T.C.
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
SEPSİSTE İNTRAVENÖZ İMMÜNOGLOBULİN DENEYİMİMİZ
UZMANLIK TEZİ
Dr. Farid İsmayilov
TEZ DANIŞMANI
Doç. Dr. Devrim Bozkurt
T.C.
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
SEPSİSTE İNTRAVENÖZ İMMÜNOGLOBULİN DENEYİMİMİZ
UZMANLIK TEZİ
Dr. Farid İsmayilov
TEZ DANIŞMANI
Doç. Dr. Devrim Bozkurt
ÖZET
Sepsis, enfeksiyona düzensiz bir konakçı tepkisinden kaynaklanan hayatı tehdit eden organ fonksiyon bozukluğudur. Sepsis ve septik şok, her yıl dünyada milyonlarca insanı etkileyen ve dörtte birini (genellikle daha fazlasını) öldüren önemli sağlık sorunlarıdır.
İntravenöz İmmunoglobulin tedavisi alan her hastada bakılan laboratuvar verilerinden albumin, c-reaktif protein (CRP), main platelet volume (MPV), trombosit sayısı (PLT) değişimlerini hesaplamak ve bu değişimlerin sepsisli olgularda sağkalım ve mortalite açısından değerlendirilmesini amaçlamaktadır.
Çalışmamıza Ocak 2010- Aralık 2018 tarihleri arasında Ege Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Yoğun Bakım Ünitesinde İntravenöz İmmünoglobulin tedavisi alan 130 sepsis tanılı hasta dahil edildi. Hastalar IVIG başlanma zamanına göre; Grup 1 (IVIG<24 saat) (n=75) ve Grup 2 (IVIG>24 saat) (n=55) olarak sınıflandırıldı.
Hastaların %53.1’i erkek ve yaş ortalaması 54.16 ± 17.28 olup gruplar arasında istatiksel anlamlı fark saptanmadı. Çalışmada toplam mortalite oranı %51.5’tir. Grup 1 ile grup 2 arasında mortalite açısından istatiksel anlamlı fark saptanmadı. İnotrop kullanan grupta mortalite oranı kullanmayan gruba göre istatiksel olarak daha anlamlı yüksek saptandı (%81.6 ve %9.3, p<0.001). Başvuru anında hastaların sistolik kan basıncı (SKB) ortalaması 106.5 ± 28.4 mmHg, diyastolik kan basıncı (DKB) ortalaması 66.3 ± 17.06 mmHg, serum albumin değeri 2.9 ± 0.63 g/L idi. Bu verilerden SKB, DKB ve serum albumin değerleri ölen grupta yaşayan gruba göre istatiksel olarak daha anlamlı düşük saptandı (p=0.017, p=0.019 ve p<0.001). Yaşayan grupta CRP (Δ CRP), MPV (Δ MPV) değişimlerinde ölen gruba göre istatiksel olarak daha anlamlı azalma saptandı (p<0.001 ve p<0.001). Albumin (ΔAlbumin) ve PLT (Δ PLT) değişimlerinde ise ölen gruba göre istatiksel olarak daha anlamlı artış saptandı (p=0.002 ve p=<0.001). Grup 1’de (IVIG<24 saat) Δ Albumin değişimi istatiksel olarak anlamlı daha iyi saptandı (p=0.040).
Bu tez, sepsis hastalarında IVIG verme zamanı ile ilgili devam eden gözlemsel çalışmanın ilk sonuçlarının paylaşıldığı veriler içermektedir. Literatürde bu konuda yayınlanmış sadece iki çalışma vardır. İnotrop kullanan hasta grubunda mortalite oranı
(ΔMPV) değişimlerinde istatiksel anlamlı düşme, albumin (Δ Albumin) ve PLT (Δ PLT) değişimlerinde ise artma saptandı. Grup 1 (IVIG<24 saat) ve Grup 2 (IVIG>24 saat) arasında mortalite açısından anlamlı farklılık saptanmadı.. Grup 1’de (IVIG<24 saat), albumin değişiminde (Δ Albumin), Grup 2’ye oranla istatiksel olarak daha anlamlı artış saptandı. Aynı şekilde PLT değişimi (Δ PLT) ve CRP değişimleri (Δ CRP) grup 1’de grup 2’ye göre sırasıyla daha fazla artış ve daha fazla düşüş olarak gerçekleşti ancak fark istatistiksel anlama ulaşmadı. Bunun nedeni hasta sayısının az olması olabilir. Her ne kadar az hasta popülasyonunda elde ettiğimiz veriler sunulmuş olsa da, Sepsis ve septik şokta erken IVIG tedavisi ile mortalitenin azalacağını düşünmekteyiz. Mortalite ön görücüsü olarak saptadığımız albumin değişiminin, erken grupta anlamlı daha iyi çıkması da bu olasılığı desteklemektedir. Süregelen dönemde, artan hasta sayısı ile daha sağlıklı veriler elde edeceğimizi düşünmekteyiz.
ÖN SÖZ
Hekimlik mesleğinin öğrenilmesinde önemli kademelerden biri olan asistanlık eğitiminin sonuna gelmiş bulunuyorum. İç Hastalıkları uzmanlık eğitimi boyunca bana emek veren, bilgi, deneyim ve manevi desteklerini benden esirgemeyen başta Anabilim Dalı Başkanımız Prof. Dr. Fehmi Akçiçek olmak üzere her biri çok değerli olan tüm Ege Üniversitesi İç Hastalıkları Ana bilim hocalarıma; Tez çalışmamda bilgi birikim ve görüşleriyle beni yönlendiren tez danışman hocam Doç. Dr. Devrim Bozkurt’a; Asistanlık sürecinde birlikte çalıştığım saygıdeğer tüm asistan arkadaşlarıma; Eğitimim süresince birlikte çalıştığımız ve tezim süresince yardımlarını eksik etmeyen tüm hemşire ve personel arkadaşlara teşekkür ederim. Hayatımın her döneminde yanımda olan anne, babam ve kardeşime,
Son olarak; sevgili eşim ve oğluma,
Sonsuz sevgi, saygı ve teşekkürlerimi sunarım.
Dr. Farid İsmayilov İZMİR-2019
İÇİNDEKİLER
ÖZET ... I ÖN SÖZ ... III İÇİNDEKİLER ... IV TABLO LİSTESİ ... VI ŞEKİL LİSTESİ ... VII KISALTMALAR ... VIII 1. GİRİŞ VE AMAÇ ... 1 2. GENEL BİLGİLER ... 3 2.1. Sepsis Tanımları ... 3 2.1.1. Enfeksiyon ... 3 2.1.2. Bakteriyemi ... 4
2.1.3. Sistemik İnflamatuar Yanıt Sendromu ... 4
2.1.4. Sepsis ... 4
2.1.5. Ciddi sepsis ... 5
2.1.6. Septik şok ... 6
2.1.7. Çoğul Organ İşlev Bozukluğu sendromu ( MODS) ... 6
2.2. Sepsis epidemiyolojisi ve insidansı ... 7
2.3. Sepsis etyolojisi ve patofizyolojisi ... 8
2.4.1. Sepsiste intravenöz immünoglobulin tedavisi ... 12
3. MATERYAL METOD ... 15
3.1. Çalışma tasarımı ve hastalar ... 15
3.2. Hesaplamalar ... 15
3.3. Verilerin değerlendirilmesi ve İstatiksel Analiz ... 15
4. BULGULAR ... 17
4.1. Demografik ve Laboratuvar Verileri ... 17
5. TARTIŞMA ... 21
6. SONUÇ ... 24
KAYNAKLAR ... 25
TABLO LİSTESİ
Tablo 1- SIRS tanısında kullanılan kriterler ... 4
Tablo 2: İmmün modülasyon fonksiyonunda IVIG’in ana etki mekanizmaları ... 13
Tablo 3: Hastaların başvuru anındaki bazal laboratuvar ve demografik verileri ... 17
Tablo 4: Cinsiyet grupları arasında sağkalım ve mortalite ilişkisi ... 18
Tablo 5: Bazal laboratuvar verileri mortalite ilişkisi ... 18
Tablo 6: Laboratuvar verilerinin zamansal değişimi ile mortalite ilişkisi ... 19
Tablo 7: IVIG verilme zamanına göre grupların bazal laboratuvar verilerinin karşılaştırılması ... 20
ŞEKİL LİSTESİ
Şekil 1: Sepsis, enfeksiyon ve SIRS (systemic inflammatory response syndrome) arasında
ilişki ... 3
Şekil 2: Sepsis için tanı kriterleri ... 5
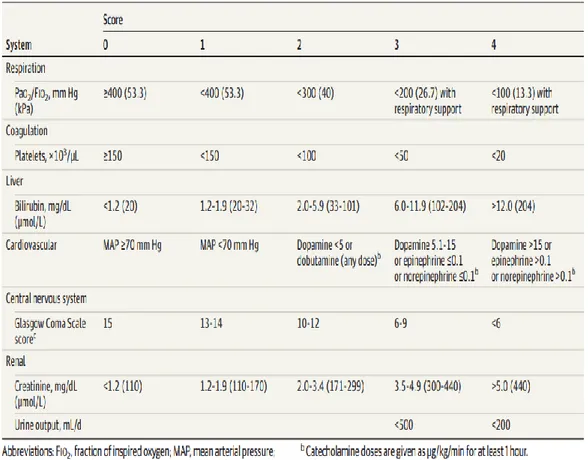
Şekil 3: SOFA score ... 6
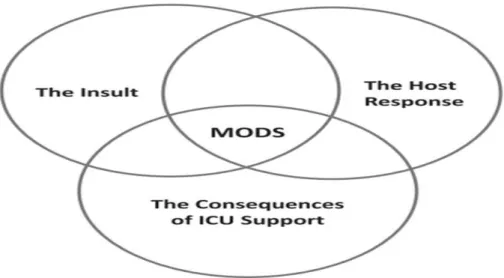
Şekil 4: MODS’ta 3 değişken faktör arasında dinamik etkileşim ... 7
KISALTMALAR
IVIG : İntravenöz İmmünoglobulin CRP : C-reaktif protein
MPV : Mean platelet volüme NLR : Nötrofil/lenfosit oranı PLT : Platelet count
ACCP/SCCM : American College of Chest Physicans/Society of Critical Care Medicine SIRS : Systemic inflammatory response syndrome
TNF : Tümör necrosis factor
SOFA : Sequential Organ Failure Assessment MODS : Çoğul Organ İşlev Bozukluğu Sendromu NK : Natural killer
PRRs : Patern tanıma reseptörleri
PAMPs : Patojen ilişkili moleküler paternler
DAMPs : Hasar ilişkili moleküler yapılar TLR : Toll like resöptör
NLR : Nod like resöptör RLR : Rig like resöptör
CLR : C-tip lektin resöptör LPS : Lipopolisakkarit İL : İnterlökinler
COX-2 : Siklooksijenaz-2
MCP-1 : Monocyte chemoattractant protein-1 MKP-1 : Mitogen activated protein-1
BSF-2 : B hücresi uyarıcı faktör 2 INF γ : İnterferon γ
TH : T hücre
GM-CSF : Granülosit makrofaj koloni stimüle edici faktör TGFβ : Tümör büyüme faktörü β
Treg : Düzenleyici T hücre
CKs : Kemokinlerin
M-CSF : Makrofaj koloni uyarıcı faktör G-CSF : Granülosit koloni uyarıcı faktör Ig : İmmünoglobulin
SPSS : Statistical Package for Social Sciences SKB : Sistolik kan basıncı
DKB : Diyastolik kan basıncı MAP : Ortalama arter basıncı
1. GİRİŞ VE AMAÇ
Sepsis, yoğun bakım ünitelerinde yatan hastalarda morbidite ve mortalitenin önde gelen nedenidir.(1) Sepsis, enfeksiyona düzensiz bir konakçı tepkisinden kaynaklanan hayatı tehdit eden organ fonksiyon bozukluğudur. Sepsis ve septik şok, her yıl dünyada milyonlarca insanı etkileyen ve dörtte birini (genellikle daha fazlasını) öldüren önemli sağlık sorunlarıdır.(2) Sepsis 2011’de ABD’deki toplam hastane maliyetlerinin 20 milyar dolardan daha fazlasını oluşturan önemli bir sağlık sorunudur.(3)
Sepsis, özellikle yaşlı, bağışıklığı baskılanmış ve kritik hastalığı olanlarda yaygın bir morbidite ve mortalite nedenidir.(4) Koroner yoğun bakım dışındaki diğer yoğun bakım ünitelerinde en sık ölüm nedeninin sepsis olduğu bildirilmiştir.(5) Sepsisin görülme sıklığı enflamatuar, enfeksiyöz ve neoplastik hastalıkların tedavisinde daha güçlü ve geniş spektrumlu antibiyotiklerin, immünosupresif ajanların ve invaziv girişimlerin artan kullanımı ile ilgili artmıştır.
Son yıllarda şiddetli sepsis ve septik şok tedavisinde sayısız gelişmeler olmasına rağmen, ölüm oranı hala kabul edilemez şekilde %30 ila %50 arasında yüksek bulunmaktadır.(6) Hızlı enfeksiyon kontrolü, ampirik geniş spektrumlu antibiyotiklerle tedavi ve hemodinamik stabilitenin sürdürülmesi de dahil olmak üzere erken tanı ve resüsitasyon sepsis ve septik şokun erken faz yönetiminin temelidir.(7)
Sepsis ve ya septik şok nedeniyle bozulmuş konakçı bağışıklık sistemini güçlendirmek için immünoadjuvan tedavi sepsis tedavisinde bir sonraki ana basamak tedavi olarak tanımlanmıştır.(8) Hem bakteriyel ürünlere hem de konakçı sitokinlere karşı geniş ve güçlü aktivitesi nedeniyle, poliklonal intravenöz immünoglobulin (IVIG), ciddi enfeksiyonların tedavisi için yardımcı bir tedavi olarak kullanılmaktadır.(9) Sepsis ve septik şok tedavisinde IVIG’in ek kullanımı ile ilgili yapılan araştırmalarda mortalitede çarpıcı bir azalma olduğu gösterilmiştir.(10, 11)
Yaptığımız çalışmadaki amacımız, Ocak 2010 – Aralık 2018 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Hastanesi İç Hastalıkları Anabilim Dalı yoğun bakım biriminde İntravenöz İmmünoglobulin tedavisi alan sepsis tanılı hastalarının dosyalarından bakılan demografik özellikleri, laboratuvar verileri, tedaviye başlanma zamanı, inotrop kullanımı ve sepsis etyolojileri incelenerek sepsis olguları arasında olası kötü sonlanıma neden olabilecek risk faktörlerini belirlemek ve bu risk faktörlerinin karşılaştırılırak ortak yönlerini ve
farklılıklarını ortaya çıkarmaktır. Öncelikli amacımız her hastada bakılan laboratuvar verilerinden albumin, c-reaktif protein (CRP), main platelet volume (MPV), trombosit sayısı (PLT) değişimlerini hesaplamak ve bu değişimlerin sepsisli olgularda sağkalım ve mortalite açısından değerlendirilmesini amaçlamaktadır.
2. GENEL BİLGİLER
2.1. Sepsis Tanımları
1992 yılında gerçekleştirilen ACCP/SCCM (American College of Chest Physicans/Society of Critical Care Medicine) Konsensüs Toplantısında sepsis enfeksiyona enflamatuar yanıt olarak tanımlanmıştır. Bu toplantıda sepsisin yeni tanımlamaları yapılmıştır. (Şekil-1) (12)
Şekil 1: Sepsis, enfeksiyon ve SIRS (systemic inflammatory response syndrome) arasında ilişki
2.1.1. Enfeksiyon
Normalde steril olan konakçı dokusunun mikroorganizmalara ya da mikroorganizma invazyonuna karşı vücudun geliştirdiği inflamatuar cevapla karakterize mikrobiyal oluşumdur.(12)
2.1.2. Bakteriyemi
Kanda canlı bakteri varlığıdır ve kültürle doğrulanabilir. İki klinik bakteriyemi örneği vardır: Aralıklı ve devamlı bakteriyemi. Aralıklı bakteriyemide bakteriler kanda belirli sürelerde bulunur. En yaygın bakteriyemi örneğidir. Devamlı bakteriyemi ise genellikle endokardit ve ya endarterit, süpüratif tromboflebit, enfekte bir anevrizma ve ya vasküler greft gibi kalıcı bir endovasküler enfeksiyonu yansıtır.
2.1.3. Sistemik İnflamatuar Yanıt Sendromu
Konsensüs toplantısında SIRS, enfeksiyöz ve nonenfeksiyöz bir mekanizmayla tetiklenen sistemik inflamatuar yanıtı tanımlamak için kullanılmıştır. Nonenfeksiyöz mekanizmalar arasında pankreatit, iskemi, travma, hemorajik şok, yanık, ekzojen TNF (tümör necrosis factor) kullanımı ve diğer sitokinler gibi etkenler yer almaktadır. SIRS tanısının konulmasında aşağıdaki kriterlerden en az ikisinin bulunması gerekmektedir.(12) SIRS kriterleri Tablo 1’de verilmiştir.
Tablo 1- SIRS tanısında kullanılan kriterler 1-Vücut ısısının < 36°C ve ya > 38°C olması 2-Kalp hızının > 90/dk olması
3-Solunum hızının>20/dk olması ve ya PaCO2<32 mmHg olması
4-Lökosit sayısının <4000/mm³ ve ya >12000/mm³ olması, ve ya genç hücre formunun >%10 bulunması
2.1.4. Sepsis
Enfeksiyonlara karşı sistemik enflamatuar cevab olarak tanımlanmaktadır. 2001 yılında ‘‘Uluslararası Sepsis Tanımlanmaları Toplantısı’’ yapılmıştır. Toplantıda SIRS kriterlerinin sepsis tanısında artık yararsız kaldığı ve ileride biyokimyasal ve/ve ya immünolojik kriterlerinin kullanılacağı belirtilmiştir.(13) Sepsis için tanı kriterleri Şekil 2’de verilmiştir.(14)
Şekil 2: Sepsis için tanı kriterleri
2.1.5. Ciddi sepsis
Ciddi sepsis organ işlev bozukluğu ile komplike olan sepsistir. Ciddi sepsisin yoğun bakım ünitelerinde en yaygın ölüm nedeni olduğu düşünülmektedir. Avrupa’da yılda yaklaşık 150.000 ve ABD’de 200.000’den fazla kişi ölmektedir.(15)
Organ işlev bozukluğunu tanımlamak için Sequential Organ Failure Assessment (SOFA) score kullanılıyor (Şekil 3).(14)
Şekil 3: SOFA score
2.1.6. Septik şok
Diğer nedenlerle açıklanamayan kalıcı arteriyel hipotansiyon ile karakterize akut dolaşım yetersizliğidir. Hipotansiyon, başka arteriyel hipotansiyon nedenleri olmadığında, yeterli sıvı replasmanına rağmen sistolik arteryel kan basıncının 90 mmHg’nin altında, ortalama arter basıncının 60 mmHg’nin altında veya bazal sistolik arteryel kan basıncında 40 mmHg’den fazla azalma olması olarak tanımlanmaktadır.(16)
2.1.7. Çoğul Organ İşlev Bozukluğu sendromu ( MODS)
Sepsisin klinik ekspresyonu olan MODS, enfeksiyon, konağın bu enfeksiyona karşı doğal tepkisi ve yaşamı sürdürmek için kullanılan yoğun bakım desteğinin hem yararlı hem de zararlı etkileşimini yansıtır. (Şekil 4) (17)
Şekil 4: MODS’ta 3 değişken faktör arasında dinamik etkileşim
MODS’ta görülen organ yetersizlikleri dolaşım, böbrek, pulmoner, gastrointestinal ve hepatik, hematolojik ve merkezi sinir sistemlerini içerir. Bunların arasında en sık etkilen dolaşım ve pulmoner sistem, en az etkilen hepatik ve merkezi sinir sistemleridir.(18)
2.2. Sepsis epidemiyolojisi ve insidansı
Ciddi sepsisin sistemik enflamasyon ve çoklu organ yetmezliği özelliklerini anlamak, potansiyel tedavileri geliştirmek ve değerlendirmek için büyük kaynak ve çabalar harcanmıştır. Bununla birlikte, sepsisin insidansı, maliyeti ve sonucu hakkında bilgi az ve eksik kalmaktadır.(19) Son 40 yılda nüfus yaşının artması nedeniyle ciddi sepsis görülme sıklığı artmıştır. En son tahminlere göre ABD ve Avrupada sepsisin görülme sıklığı popülasyonun 0,4/1000- 1/1000’i arasında değişmektedir.(20) Ciddi sepsis, ABD’de hastane ölümünün en sık nedeni ve yoğun bakım ünitesi kaynaklarının neredeyse yarısını tüketen toplum üzerinde önemli bir yük olmaya devam etmektedir.(21) ABD’de her yıl yaklaşık 300.000-500.000 sepsis vakası olduğunu gösteren raporlar mevcut. Ciddi sepsis insidansında kalıcı artış devam etmekte ve hastane içi mortalitesi %20-45 olarak tahmin edilmektedir.(22) Kadınlarda ciddi sepsis insidansı erkeklere göre daha düşüktür. Bu cinsiyyet farkının nedenleri açıklanmamıştır, ancak seks hormonlarının doğuştan ve adaptif bağışıklık ve sitokin sinyallemesine kardiyovasküler cevap üzerindeki etkisini içerebilir.(23) Yaşlı hastalarda sepsis gelişme riski daha yüksektir. ABD’deki 500 hastanenin taburcu veri incelemesi, 65 yaş
ve üstü hastaların popülasyonun %12’sini, ancak sepsis vakalarının yaklaşık %65’ni oluşturduğunu bildirmiştir.(24)
Ciddi sepsisin önemini geniş bir düzeyde anlamak için geriye dönük veritabanlarını kullanarak bir dizi epidemiyolojik çalışma yapılmıştır. Yapılan çalışmalarda multiorgan yetmezliğinin sepsisin ciddiyetini artıran önemli bir konu olduğu belirtilmektedir.
2.3. Sepsis etyolojisi ve patofizyolojisi
Mikroorganizmalar vücuda penetre olduğu zaman doğal bağışıklık sistemi tarafından tespit ediliyor. Doğal bağışıklık sistemi humoral ve hücresel mekanizmaların bir araya gelmesidir. (25) Monositler,makrofajlar,nötrofiller,eozinofiller, bazofiller ve natural killerler (NK’ler) doğal bağışıklık sisteminin önemli elemanlarıdır. Doğal bağışıklık sistemi patern tanıma reseptörleri (PRRs) sayesinde aktive oluyor. PRRs’ler tarafından lökosit aktivasyonu, enfeksiyöz mikroorganizma, patojen ilişkili moleküler paternlerin (PAMPs) ve ya hasar ilişkili moleküler yapıların (DAMPs) bağlanmasından sonra gerçekleşiyor.
Bu güne kadar omurgalılarda 4 tip PRRs tanımlanmıştır: Toll like resöptörü (TLR), Nod like resöptörü (NLR), Rig like resöptörü (RLR) ve C-tip lektin resöptörü (CLR). Sepsis patogenezinde en çok çalışılan PRRs Toll like resöptörüdür. (26)
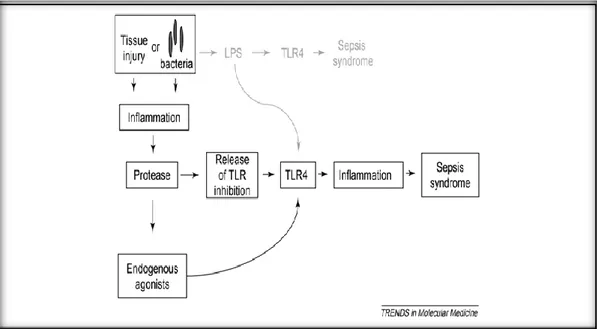
Sepsis etyolojisinde mikrobiyal ürünlerin sırayla organ yetmezliği, şok ve ölüme neden olan yaygın enflamasyonu uyaran Toll like reseptörleri (TLR) aktif hale getirdiği düşünülmektedir. Son zamanlarda yapılan araştırmalarda mikrobiyal ürünler dışında endojen moleküllerin de endotoksin reseptörü olan Toll like reseptör-4’ü (TLR-4) tetiklediği belirtilmektedir. (Şekil 5)(27)
Şekil 5: Sepsisin yeni modeli
Lipopolisakkarit (LPS) üretmeyen Gram (+) ve mantar enfeksiyonları sepsis etyolojisinde Gram (-) bakterilerden daha sık rol almaktadır.(28) Bunun nedeni TLR-2 ve TLR-6’yı uyarabilen ve TLR-4 ile aynı hücreiçi sinyalleri üreten Gram-pozitif bakterilerin peptidoglikan ve lipoteikoik asit, mantarların ise zymosan üretmesidir.(29)
Sepsisin patogenezinde sitokinlerin de önemli rolü vardır. İnterlökinler (İL) enfeksiyöz süreçte önemli sitokin grubudur. İnterlökinler Pro-inflamatuar ve Anti-inflamatuar olmak üzere iki grupa ayrılır. Pro-inflamatuar interlökinler hücre aktivasyonundan,doku hasarından ve nekrozundan, Anti-inflamatuar interlökinler ise enflamatuar süreci hafifletmek ve sonlandırmaktan sorumludur. Sepsis patogenezinde önemli rol oynayan Pro-inflamatuar interlökinler: İL-1β,İL-6,İL-12 ve İL-17’dir.
Katabolin olarak da adlandırılan İL-1β İL-6,İL-8,COX-2,MCP-1,IBa,MKP1 ve IL-1α gibi çeşitli enflamatuar genlerin sentezini indükler.(30) Sepsis sırasında, İL-1β düzeylerinin sağ kalanlara göre ölen hastalarda daha yüksek olduğu gösterilmiştir. Bu da yüksek düzeylerde İL-1β ile sepsis sonucu arasında bir ilişki olduğunu göstermektedir.(31)
İL-6 ayrıca interferon β2, B hücresi uyarıcı faktör 2 (BSF-2) olarak da bilinen pleiotropik interlökindir. İL-6’nın sitokin fırtınası sırasında rolü karmaşık ve
tartışmalıdır.İL-6 aslında tek bir protein değildir, ama İL-11, onkostatin M, siliyer nötrofilik faktör ve ya kardiyotrofin benzeri sitokin içerir. İL-6’nın CD126 ve CD130 olmak üzere iki subünit reseptörü mevcuttur.(32) İL-6’nın ana kaynağı doku makrofajlarıdır. Kardiyovasküler hastalık, otoimmün hastalıklar ve ya kanser gibi enflamatuar hastalıkta İL-6 düzeyleri artıyor. İL-1’e benzer şekilde, yüksek seviyelerde İL-6’nın sepsisin ciddiyeti ve daha kötü sonuçlarla ilişkili olduğu gösterilmiştir. (33-35) İL-6’nın sepsise kesin katkısı halen araştırılmaktadır ve muhtemelen tamamlayıcı yolun aktivasyonu ve kapilyar kaçak ile bağlantılıdır.(36, 37)
İL-12 de sepsis sırasında yükselir. Dentritik hücreler, makrofajlar ve lenfoblastoid hücreler tarafından üretilen İL-12 naif T hücrelerinin Tip 1 yardımcı T hücrelerine (TH-1) farklılaşmasına ve NK hücrelerinin aktivasyonuna neden oluyor. Sonuç olarak bu hücreler yüksek miktarda İnterferon γ (INF γ) üretiyor.(38)
17, 23 tarafından uyarıldıktan sonra TH-17 hücreleri tarafından üretiliyor. İL-17 makrofajlar, fibroblastlar, endotel hücreleri ve epitel hücrelerinden çok çeşitli sitokinlerin (İL-1β, İL-6, GM-CSF (granülosit makrofaj koloni stimüle edici faktör), TNF-α (tümör nekrozis faktör α),İL-8) sentezini indükler.(39, 40) İL-17 üreten TH17 hücrelerinin üretilmesi ince ayarlanmıştır. Tümör büyüme faktörü β (TGFβ),İL-1,İL-6,İL-21 ve İL-23’ün naif CD4+ hücrelerinden TH17 hücrelerini uyarması için yeterli olduğu gösterilmiştir. TGFβ hem düzenleyici T hücrelerini (Treg) hem de TH17’yi indükleyebilir. İL-6 Treg’lerin gelişimini sınırlar. (41) İL-6, İL-17’nin ekspresyonunu kısıtlayan İL-10’un üretimini de indükleyebilir.(42) Bu nedenle TH17 jenerasyonunu destekleyecek pro-inflamatuar mediatörlerin bir dengesi vardır. İL-6’nın kritik rolünün bir kanıtı olarak, İL-6’dan yoksun fareler TH17 hücreleri geliştiremez. İL-6 -/- farelerde Treg’lerin silinmesi ve İL-21’in salgılanması İL-17 üretimini eski haline getirebilir.(43)
İnterferonlar reseptör özelliklerine göre üç ana tipte sınıflandırılır. İFNAR1/İFNAR2 tip 1 interferon (İFN-α ve İFN-γ) için heterodimerik reseptördür. İFN-γR1/İFN-γR2 tip 2 İFN (İFN-γ) için reseptördür. İnterferon λ esas olarak viral enfeksiyonlar sırasında incelenen üçüncü İFN tipidir. İFN-γ temel olarak CD4 ve CD8 hücreleri tarafından üretilir.(44, 45) İFN-γ sepsis sırasında enflamatuar yanıtı teşvik etse de, muhtemelen immun baskılanmış durumdaki lenfositlerin aşırı duyarlılığı nedeniyle İFN-γ üretimi sepsis sırasında azalır.(46, 47)
Kemokinlerin (CKs) sepsis patofizyolojisindeki rolü derinlemesine incelenmiş ve enfeksiyona konakçının cevabında önemli rol oynadıkları saptanmıştır.Kemokinler sadece enfeksiyon bölgesine lökosit alımını sağlamakla kalmaz, aynı zamanda immun hücrelerin kemik iliğinden ve ya dalaktan salınımı sağlar. Kemokin ve reseptörlerinin eksikliği yarı-bağışıklık bastırılmış bir duruma neden olur ve organizmayı enfeksiyon kaynaklı ölümcüllüğe karşı daha duyarlı hale getirir.(48-51)
Büyüme faktörleri de sepsis patogenezinde önemli rol alır. Sepsis sırasında salgılanan farklı büyüme faktörleri arasında sitokin fırtınasının oluşumunda en fazla rol oynayan hematopoetik hedefli koloni uyarıcı faktörler (CSFs): GM-CSF, makrofaj koloni uyarıcı faktör (M-CSF) ve granülosit koloni uyarıcı faktörleridir (G-CSF). İL-3 gibi diğer faktörlerle birlikte CSF’ler miyeloid hücre farklılaşmasını ve çoğalmasını uyarır, böylece daha fazla sayıda aktive edilmiş hücre harekete geçirilir ve daha fazla sitokinlerin sentezine katkıda bulnur. Bu nedenle de sitokin fırtınasını teşvik eder. CSF İL-1 ya da TNF-α gibi erken faz moleküllere tepkisini artırarak sadece sayısal rol oynamakla kalmaz, aynı zamanda işlevsel bir rol oynar.(52)
En çok araştırılan anti-enflamatuar interlökinler, İL-1RA, İL-4 ve İL-10’dur. İL-1RA immun hücreler ve ya epitel hücreleri tarafından salgılanır ve 1R’ye bağlanır, böylece İL-1α ve İL-1β enflamatuar sinyallerin etkisini bloke eder.(53, 54) İL-1RA ile tedavi polimikrobiyal peritonit ve ya gram-negatif pnömoni tarafından indüklenen sepsisi iyileştirmiştir.(55, 56) İL-4 esas olarak T hücreleri tarafından üretilir ve hem B hem de T hücrelerinin çoğalmasını ve T hücrelerinin bir TH2 profiline kaymasını destekler.(57, 58) İL-4’ün sepsisteki rolü tartışılmaktadır ve sepsis patofizyolojisinde mühtemel bir rolü tutarlı bir şekilde bildirilmemiştir. İL-10 sepsiste önemli bir anti-enflamatuar sitokindir.(59) İL-10 myeloid hücreler, NK hücreleri ve T hücreleri tarafından enflamatuar sitokinlerin üretimini engelleme yeteneğine sahiptir.(60) Anti-enflamasyon belirteci olan İL-10’un seviyeleri enflamasyon derecesi ile doğrudan ilişkilidir. Bu da pro ve anti-enflamatuar proseslerin yakından ilişkili olduğunu göstermektedir. Yüksek İL-10 seviyeleri de sepsis kaynaklı immünosupresyonun daha önemli özellikleri ile ilişkilidir.(61)
Multi-CSF olan İL-3 sepsis sırasında gelişen sitokin fırtınasının esas düzenleyicisidir.(62) İL-3, IRA B hücreleri tarafından üretilir ve acil miyelopoezi teşvik ederek enflamatuar kaskadı besler. İL-3 enjeksiyonu miyeloid hücrelerin çoğalması yoluyla pro-enflamatuar sitokinlerin yüksek düzeylerini destekler, fakat aktivasyonlarına katkıda
bulunmaz. Son zamanlarda yapılan bir çalışma, İL-3’ün immün düzenlemedeki rolünü ve sepsis sırasında kortikosteroidlere olası yanıtı doğrulamaktadır.(63)
2.4. Sepsis tedavisi
Sepsiste tedavinin başarısı erken tanıya, uygun antibiyotik tedavisine hemen başlanmasına ve altta yatan hastalığın tedavisine bağlıdır. Koruma, morbidite ve ölüm oranlarını azaltmanın en önemli yoludur.(64)
Sepsis tedavisi uygun antimikrobiyal tedavi ve çok amaçlı destek tedavisi olmak üzere iki ana başlık altında inceleniyor. Sepsis tablosundaki her hasta kaynaklar açısından kesinlikle değerlendirilmelidir.(65) Antibiyotikler çoğunlukla aktif mikroorganizmanın belirlenmesine kadar geçen sürede ampirik olarak kullanılıyor. Şok insidansının gram negatif bakterilerden kaynaklanan sepsiste uygun antibiyotik tedavisi ile yarı yarıya azaldığı bilinmektedir. Septik şok tedavisinde temel hedef kan hacmini düzenlemek ve yeterli doku perfüzyonu sağlamaktır. Bu amaçla yapılacak ilk şey yeterli sıvı resüsitasyonu sağlamaktır. Sıvı resüsitasyonuna rağmen hipotansiyon devam ederse tedaviye vazopressör ilaçlar ekleniyor.(66)
Kortikosteroidler sepsis tedavisinde ölüm riskini azalttığı gösterilen önemli ajanlardır. Sepsis tedavisinde yüksek dozlarda uygulandığında sağkalımı artırmadığı ve immünosüpresif etkileri nedeniyle sekonder enfeksiyonlara yol açtığı ve sepsisteki klinik ilerlemeyi olumsuz etkilediği bilinmektedir.(67) Bununla birlikte uzun vadede düşük ve yüksek dozlarda uygulandığında mortalite oranlarını düşürdükleri ve vazopressör gerektiren şok süresini azaltdıkları gösterilmiştir.(68)
2.4.1. Sepsiste intravenöz immünoglobulin tedavisi
Yetişkinlerde sepsiste yardımcı tedavi olarak immünoglobulinler ilk kez 1980 tarihinde kullanılmıştır.(69) Gram negatif sepsiste mortalite üzerinde belirgin bir etki olduğunu ve Lipopolisakkarit (LPS;ayrıca endotoksin olarak da adlandırılan) ile bağışıklanan bir donör havuzundan antiserum uygulamasıyla rapor edilmiştir. İmmünoglobulin A (IgA), IgM ve IgG içeren bu preparatın abdominal cerrahi hastalarında septik şok gelişimine karşı koruyucu bir etkiye sahip olduğu gösterilmiştir.(70) Sepsis sırasında enflamatuar kaskadın modülasyonu kavramına dayanarak İntravenöz İmmunglobulin (İVİG) yararlı bir adjuvan
bir antijen-antikor reaksiyonunu aşıyor.(71) Konsensüs kılavuzları şiddetli sepsis ve ya septik şoku olan hastalarda İVİG’in yaygın şekilde kullanılmasını önermemektedir.(65, 72) Bunun yerine İVİG kullanımı A grup Streptokok toksik şok sendromunda bir tedavi olarak önerilmektedir.(73)
İVİG çeşitli mikrobiyal antijenlere karşı opsonik ve nötralize edici antikor içeriyor. Bu antijenlerin doğrudan nötralizasyonuna ek olarak İVİG için sistemik enflamatuar hastalıklarda faydalı etkiye katkıda bulunabilicek muhtemel başka birkaç hareket modu tanımlanmıştır. Bunlar fagositik hücreler üzerinde Fc reseptörlerinin blokajı, Fc reseptörü ekspresyonunun modülasyonu, aktive edilmiş kompleman ile etkileşim, sitokin tepkilerinin modülasyonu ve immün hücre fonksiyonlarının modülasyonudur (Tablo 2).(74-76)
Tablo 2: İmmün modülasyon fonksiyonunda IVIG’in ana etki mekanizmaları
F(ab)2: fragment antigen binding; Fc: fragment crystallizable ; FcRn: neonatal Fc reseptor for IgG; FcγR: receptor for Fc-IgG; FcγRIIB: receptor for Fc-IgG with inhibitory activity.
F(ab)2 aracılı etkinlikler Fc bağımlı ektinlikler
-Sitokilerin baskılanması ve ya nötralizasyonu -FcRn’nin blokajı
-Aktif kompleman bileşenlerinin -FcγR’lerin aktivasyonunun modülasyonu
nötralizasyonu
-Lökosit adezyon mölekülünün bağlanma -FcγRIIB inhibisyonunun up-regülasyonu
blokajı
-Spesifik immün hücre reseptörlerinin -T regülatör hücrelerin immünosupresif etkisini ve
hedeflenmesi proliferasyonunu arttırmak
-Dentritik hücrelerin fonksiyon ve olgunlaşmasının
modülasyonu
Bu güne kadar sepsis tedavisinde farklı ticari İVİG preparatları test edilmiştir. Bunlar standart İVİG (tamamen IgG) ve IgM ile zenginleştirilmiş preparatlardır. IgM ile zenginleştirilmiş preparat IgM, IgG ve IgA, buna karşın standart İVİG preparatları genellikle >%96 IgG içerir. İnsan plazması üç immünoglobulin sınıfının tümünü içerdiğinden, IgM/A ile zenginleştirilmiş IVIG’in daha fizyolojik olduğu ileri sürülmüştür. Bakteriyel etyoloji ile ilgili olarak yapılan bir çok çalışma, İgM ile zenginleştirilmiş IVIG preparatlarının Gram negatif şok hastalarında daha faydalı olduğunu göstermektedir.(77, 78) IVIG preparatında IgA varlığı ayrıca IgA eksikliği olan bireylerde potansiyel ciddi advers reaksiyon ile de ilişkilidir. Primer antikor yanıtının ana bileşeni olduğu için İgM’nin IVIG preparatında önemli bir bileşen olduğu iddia edilmiştir. Pentamerik formu toksin nötralizasyonunda ve bakteriyel aglütinasyonda, İgG antikorları ile karşılaştırıldığında üstün bir etkinliğe katkıda bulunur. Bu üstün aktivite Anti-LPS içeriği ve opsonizasyon aktivitesi için IgM ile zenginleştirilmiş IVIG ve standart IVIG preparatları değerlendirildiğinde doğrulanmıştır.(79-81)
Sepsis ve septik şokta, tüm immünoglobulin sınıflarının plazma konsantrasyonu azalıyor. Endojen immünoglobülindeki bu azalmanın nedenleri; daha yüksek immünoglobulin tüketimi, ekstravasküler sızıntı ve ya immünoglobulin sekestrasyonu, düşük immünoglobulin üretimi ve önceden mevcut immün baskılama dahil olmak üzere kesinlikle çok faktörlüdür.(82) Sepsis ve septik şokun seyri sırasındaki düşük immünoglobulin seviyeleri kötü hasta prognozu ile ilişkilidir. Bu da endojen immünoglobulin replasmanının sonuçları iyileştirebileceğini ortaya koymaktadır.(83, 84)
3. MATERYAL METOD 3.1. Çalışma tasarımı ve hastalar
Bu çalışma ; Ocak 2010- Aralık 2018 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Hastanesi İç Hastalıkları Anabilim Dalı yoğun bakım birimine sepsis tanısı ile yatırılan ve/veya takipte sepsis tablosu gelişip intravenöz immünoglobulin tedavisi alan hastaların (n=130) dosyaları retrospektif incelenerek yapıldı. Çalışmaya; 18 yaş ve üstü, yoğun bakımda 3 günden fazla yatan sepsis tanılı hastalar alındı. 18 yaş altı ve 3 günden az yatış süresi olan hastalar çalışmaya alınmadı. Hastaların adı, soyadı, protokol numaraları, cinsiyyeti, tanı anındaki yaşları, sepsis etyolojisi, tanı anındaki sistolik ve diyastolik arteriyel kan basınçları, diyaliz ve inotrop ihtiyaçları, intravenöz immünoglobulin başlanma zamanı, yatış süreleri ile laboratuvar verileri; albumin, üre, kreatinin, CRP, MPV, PLT, NLR verileri ile sonlanım verileri her bir hasta için hazırlanan olgu formuna kaydedildi. Hastaların başvuru anında ve sonlanım (ölüm veya taburculuk) anındaki laboratuvar değerleri kaydedildi.
Sepsis tanısı 2016 yılında yayınlanan Üçüncü Uluslararası Sepsis ve Septik Şok Tanımlama Konsensüsünde (The third international consensus definitions for sepsis and septic shock, 2016) belirtilen tanı kriterlerine göre belirlendi.
3.2. Hesaplamalar
Δ NLR: sonlanım NLR- başvuru NLR Δ CRP: sonlanım CRP- başvuru CRP
Δ Albumin: sonlanım Albumin- başvuru Albumin Δ MPV: sonlanım MPV- başvuru MPV
Δ PLT: sonlanım PLT- başvuru PLT
3.3. Verilerin değerlendirilmesi ve İstatiksel Analiz
İstatiksel analizi için Statistical Package for Social Sciences (SPSS 22.0 Inc, Chichago, IL, USA) programı kullanıldı. Normal dağılım gösteren kantitatif değişkenlerin
ortanca değerleri, minimun, maksimum değerleri ortalama ve standart sapmaları hesaplanmış, sonuçlar ortalama ± standart sapma (SS), ortanca (min-maks) olarak belirtilmiştir. Kalitatif değişkenler frekans ve yüzde olarak tanımlanmıştır. Kategorik değişkenlerin karşılaştırılması için ‘‘Ki-kare testi’’, sürekli değişkenlerin karşılaştırılması için ‘‘independent samples t-test’’ kullanılmış; p <0.05 değeri istatiksel olarak anlamlı kabul edilmiştir.
4. BULGULAR
4.1. Demografik ve Laboratuvar Verileri
Çalışmamıza Ocak 2010 – Aralık 2018 tarihleri arasında Ege Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Yoğun Bakım Ünitesinde sepsis nedeniyle İntravenöz İmmünoglobulin tedavisi alan 130 hasta dahil edildi. Etyolojide malignite ve/veya kemoterapi altında sepsis gelişen hasta sayısı 62 (%47.7) ve malignitesi olmayan hasta sayısı 68 (%52.3) saptandı. Çalışma hastaları demografik özellikleri, başvuru anındaki sistolik ve diyastolik kan basınçları, inotrop ve hemodiyaliz gerekliliği, laboratuvar değerleri ve tüm bu verilerinin sonlanım noktası olarak kabul edilen taburculuk ve mortalite üzerine etkileri her grupta ve gruplar arasında karşılaştırılarak değerlendirildi. Çalışma hastalarının başvuru anındaki bazal laboratuvar ve demografik verileri Tablo 3’te verilmiştir.
Tablo 3: Hastaların başvuru anındaki bazal laboratuvar ve demografik verileri Mean ± SD Yaş 54.16 ± 17.28 SKB (mmHg) 106.5 ± 28.4 DKB (mmHg) 66.3 ± 17.06 NLR 11.56 ± 19.3 CRP (mg/L) 17.6 ± 11.6 Albumin (g/L) 2.9 ± 0.63 Serum kreatinin (mg/dL) 3.0 ± 7.7 Yatış süresi (gün) 13.0 ± 17.10
1.SKB: Sistolik kan basıncı ; 2.DKB:Diyastolik kan basıncı; 3.NLR: Neutrophil/lymphocyte ratio; 4.CRP: C-reaktif protein
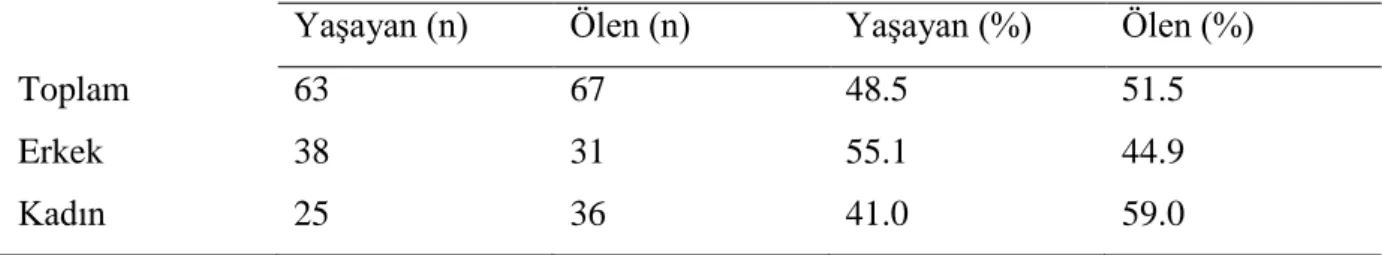
Çalışmaya 69 erkek (%53.1) ve 61 kadın (%46.9) hasta dahil edildi. Mortalite açısından cinsiyyet grupları arasında anlamlı farklılık saptanmadı. Mortalite oranı sırasıyla %44.9 ve %59.0, p=NS saptandı. Cinsiyet grupları arasında sağkalım ve mortalite ilişkisi Tablo 4’da verilmiştir.
Tablo 4: Cinsiyet grupları arasında sağkalım ve mortalite ilişkisi
Yaşayan (n) Ölen (n) Yaşayan (%) Ölen (%)
Toplam 63 67 48.5 51.5
Erkek 38 31 55.1 44.9
Kadın 25 36 41.0 59.0
Başlangıç anında inotrop kullanan 76 hasta (%58.5) ve kullanmayan 54 hasta (%41.5) vardı. Gruplar mortalite açısından karşılaştırıldığında mortalite yüzdeleri sırasıyla %81.6 ve %9.3, p<0.001 olarak saptandı. İnotrop kullanan grupta mortalite oranı kullanmayan gruba göre istatiksel olarak daha anlamlı yüksek saptandı.
Hastaların 32’si (%24.6) hemodiyalize alındı. 98 hastada (%75.4) hemodiyaliz gerekliliği olmadı. Gruplar arasında mortalite oranı sırasıyla %53.1 ve %51.1, p=NS. Gruplar arasında mortalite açısından istatiksel anlamlı fark saptanmadı.
Başvuru anında hastaların sistolik kan basıncı (SKB) ortalaması 106.5 ± 28.4 mmHg, diyastolik kan basıncı (DKB) ortalaması 66.3 ± 17.06 mmHg, serum albumin değeri 2.9 ± 0.63 g/L idi. Bu verilerden SKB, DKB ve serum albumin değerleri ölen grupta yaşayan gruba göre istatiksel olarak daha anlamlı düşük saptandı (p=0.017, p=0.019 ve p<0.001) (Tablo 5).
Tablo 5: Bazal laboratuvar verileri mortalite ilişkisi
Yaşayan Ölen p
Serum Albumin (g/L) 3.15±0.54 2.74±0.64 <0.001
SKB (mmHg) 112.68±28.30 100.82±27.48 =0.017
DKB (mmHg) 70.0±15.17 63.0±18.13 =0.019
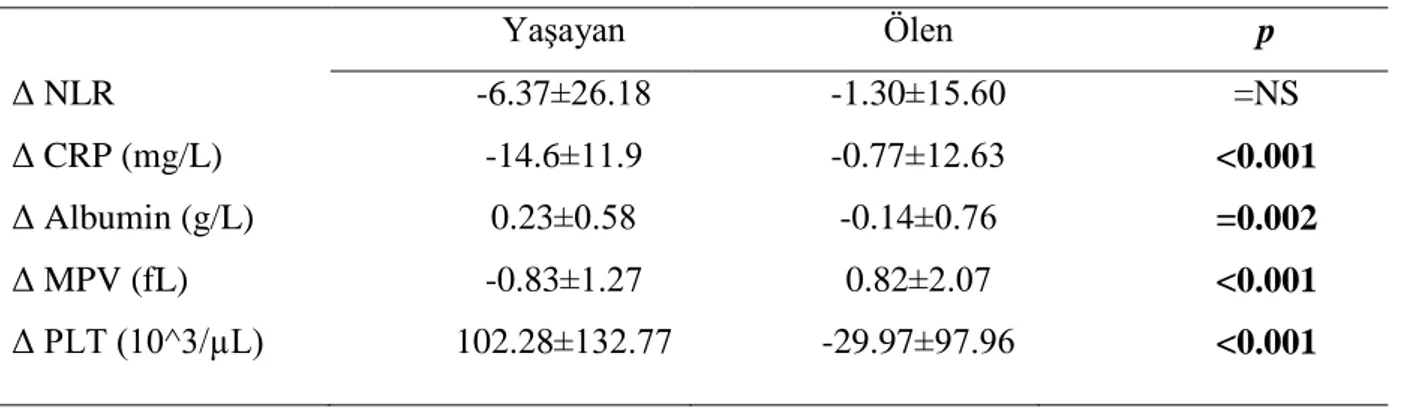
edildi. NLR değişimleri (Δ NLR) yaşayan ve ölen hasta grupları arasında istatiksel olarak anlamlı saptanmadı (p=NS). Yaşayan grupta CRP (Δ CRP), MPV (ΔMPV) değişimlerinde ölen gruba göre istatiksel olarak daha anlamlı azalma saptandı (p<0.001 ve p<0.001). Albumin (Δ Albumin) ve PLT (Δ PLT) değişimlerinde ise ölen gruba göre istatiksel olarak daha anlamlı artış saptandı (p=0.002 ve p=<0.001) (Tablo 6).
Tablo 6: Laboratuvar verilerinin zamansal değişimi ile mortalite ilişkisi
Yaşayan Ölen p Δ NLR -6.37±26.18 -1.30±15.60 =NS Δ CRP (mg/L) -14.6±11.9 -0.77±12.63 <0.001 Δ Albumin (g/L) 0.23±0.58 -0.14±0.76 =0.002 Δ MPV (fL) -0.83±1.27 0.82±2.07 <0.001 Δ PLT (10^3/µL) 102.28±132.77 -29.97±97.96 <0.001
1. NLR: Neutrophil/lymphocyte ratio; 2. CRP:C-reaktif protein; 3.MPV-Mean platelet volüme; 4.PLT:Platelet count; Δ: Sonlanım- başvuru değeri
Hastaları IVIG başlanma zamanına göre ikiye ayırdığımızda; Grup 1’de 75 hasta (%58.1) ilk 24 saatte ve Grup 2’de 55 hasta (%41.9) yatışından 24 saat sonrasında tedavi almıştı. Bu iki grubu inotrop kullanımı, SKB, DKB, yaş, etyoloji ve bazal laboratuvar verileri açısından karşılaştırdığımızda her iki grup benzerdi (Tablo 7).
Tablo 7: IVIG verilme zamanına göre grupların bazal laboratuvar verilerinin karşılaştırılması IVIG<24 saat IVIG>24 saat p Yaş 52.37±18.046 57.00±15.904 =0.134 SKB (mmHg) 106.83±28.488 105.69±28.544 =0.823 DKB (mmHg) 67.12±16.171 65.20±18.430 =0.532 NLR 11.517±23.022 11.762±12.967 =0.944 PLT (10^3/µL) 105.266±122.022 110.857±109.935 =0.790 MPV (fL) 10.977±1.522 10.851±1.371 =0.672 Albumin (g/L) 2.955±0.628 2.946±0.651 =0.937 CRP (mg/L) 17.236±11.252 18.171±12.417 =0.658
1.SKB: Sistolik kan basıncı ; 2.DKB: Diyastolik kan basıncı; 3. Neutrophil/lymphocyte ratio; 4. PLT:Platelet count; 5. MPV-Mean platelet volüme; 6. CRP:C-reaktif protein
Bu iki grupta laboratuvar verilerinin zamansal değişimine baktığımızda (Tablo 8), IVIG<24 saat grubunda Δ Albumin değişimi istatiksel olarak anlamlı daha iyi saptandı (p=0.040). Δ CRP ve Δ PLT değişimleri IVIG<24 saat grubunda daha iyi olsa da istatiksel anlamlı saptanmadı (p=NS ve p=NS).
Tablo 8: IVIG verilme zamanına göre laboratuvar verilerinin zamansal değişimi
IVIG<24 saat IVIG>24 saat p
Δ CRP (mg/L) 8.55±12.7 6.14±15.82 =NS
Δ Albumin (g/L) 0.14±0.63 0.11±0.76 =0.040
Δ PLT (10^3/µL) 44.02±126.80 17.54±141.36 =NS
5. TARTIŞMA
Sepsis ve septik şok, tüm dünyada yoğun bakım ünitelerinde yatan hastalarda mortalitenin en sık nedenidir. Septik şokta mortalite oranı %50’den fazladır.(85) Sepsis, enfeksiyona düzensiz bir konakçı tepkisinden kaynaklanan hayatı tehdit eden organ fonksiyon bozukluğudur. Organ işlev bozukluğunu tanımlamak için SOFA skoru kullanılıyor. Septik şok, yeterli sıvı resüsitasyonuna rağmen devam eden hipotansiyon ve doku perfüzyon bozukluğu olarak tanımlanmaktadır. Sepsis ve septik şokta erken tanı, hızlı enfeksiyon kontrolü, ampirik geniş spektrumlu antibiyotik tedavisi ve hemodinamik stabilizasyon sağlanması hastalarda mortalitenin azalmasına neden olmaktadır.(7) Bununla birlikte, bu önlemler ve tedaviler, sepsis ve septik şokun neden olduğu enflamatuar dengesizlik, immünolojik düzensizlik ve uzun süreli immünsüpresyonda faydalı olmamaktadır.(86) Sepsis ve septik şokta bozulmuş konakçı bağışıklık sistemini güçlendirmek için İmmünoadjuvan tedavi bir sonraki ana basamak tedavi olarak tanımlanmıştır.(8)
Sepsis ve septik şokun seyri sırasındaki düşük immünoglobulin seviyeleri kötü hasta prognozu ile ilişkilidir. Bu da endojen immünoglobulin replasmanının sonuçları iyileştirebileceğini düşündürmektedir.(83, 84)
IVIG preparatlarının sepsis ve septik şoktaki etkileri son on yıldaki klinik çalışmalarda araştırılmıştır. Sepsis ve septik şok tanılı hastalarda erken dönemde IVIG tedavisi uygulanmasının mortalite ve morbidite üzerinde olumlu etkisi olduğunu gösteren çalışmalar vardır.
Literatürde aynı araştırmacıların yaptığı iki retrospektif tek merkezli çalışmada IVIG tedavisinin septik şoklu olan hastalarda erken dönemde başlanmasının, bu hastalarda mortalite riskini bağımsız olarak azalttığı bildirmişlerdir.
Berlot ve ark. Temmuz 2004 – Ekim 2009 tarihleri arasında yoğun bakım ünitesinde yatan 129 septik şok tanılı hastada yaptıkları retrospektif, tek merkezli çalışmada hastalar IVIG başlama zamanına göre mortalite riski açısından araştırılmıştır. Yaşayan gruptaki hastalarda ölen gruba göre IVIG tedavisinin daha erken başlandığı saptanmıştır (23 ve 63 saat, p<0.05).(87)
Berlot ve ark. 1999 – 2016 tarihleri arasında yoğun bakım ünitesinde yatan 355 septik şok tanılı hastada yaptıkları retrospektif, tek merkezli çalışmada IVIG uygulamasındaki
gecikme ile mortalite arasında bağımsız bir ilişki olduğunu bildirmişlerdir (her 24 saatlik artış için, düzeltilmiş OR, 1.15; %95 CI, 1.05-1.27; p=0.0005) (88) Çalışmamızda hastaları IVIG başlanma zamanına göre değerlendirdiğimizde iki grup arasında istatiksel anlamlı farklılık saptanmadı. Bu iki tedavi grupu arasında istatiksel anlamlılığa ulaşmama nedenimiz çalışmamızdaki hasta sayısının az olması olabilir.
Sepsis tanısında kullanımının yanı sıra, CRP prognostik bir belirteç olarak da değerlendiriliyor. Lee C-C ve ark. sepsis ve septik şok tanılı 525 hastanın dahil edildiği bir çalışmasında ölen hastaları mortalite açısından iki gruba ayırmışlar. Erken mortalite (<5 gün) ve Geç mortalite (5-30 gün) saptanan grup. Bu iki gruptaki CRP değerleri yaşayan hastalara göre istatiksel olarak daha anlamlı yüksek saptanmıştır (p=0.002 ve p=0.011).(89) Bizim çalışmamızda ise ölen ve yaşayan hastalar arasında bazal CRP değerlerinde istatiksel olarak anlamlı farklılık saptanmasa da, CRP değişiminde (Δ CRP) yaşayan hastalarda istatiksel olarak daha anlamlı düşüş saptandı (p<0.001). Grup 1 (IVIG<24 saat) hastalarda CRP değişimde (Δ CRP) Grup 2’ye (IVIG>24 saat) göre daha iyi düşüş olsa da istatiksel olarak anlamlı bulunmadı.
Albuminin, negatif akut faz reaktanı olarak, sepsis ve septik şok seyrindeki azalması, bu hastalarda mortalitenin güçlü bir göstergesidir. Kim MH ve ark. sepsis ve septik şok tanılı 670 hastanın dâhil edildiği çalışmalarında, bazal albumin düşüklüğü ile mortalite arasında istatiksel anlamlı ilişki saptanmışlardır (p<0.001) (90). Bizim çalışmada da, bazal albumin düşüklüğü ile mortalite arasında istatiksel anlamlı ilişki saptandı (p<0.001). Ayrıca yaptığımız bu çalışmada albumin değişimde (Δ Albumin) yaşayan hastalarda istatiksel olarak daha anlamlı artış saptandı (p=0.002). Grup 1 (IVIG<24 saat) hastalarda albumin değişimde (Δ Albumin) istatiksel olarak daha anlamlı artış saptandı (p=0.040).
MPV (mean platelet volume) kronik enflamatuar hastalıklarda enflamasyon, hastalık aktivitesi ve anti-enflamatuar tedavi etkinliği indeksi olarak önerilmektedir. Kim CH ve ark. sepsis ve septik şok tanılı 345 hastanın dahil edildiği bir çalışmasında MPV değişiminin (Δ MPV: 72.saat MPV-başvuru MPV) mortalite ile ilişkisi araştırılmıştır. Ölen grupta MPV değişiminde (Δ MPV) istatiksel olarak daha anlamlı artış saptanmıştır (p=0.021).(91) Bizim çalışmada da MPV (Δ MPV) değişimde ölen grupta istatiksel olarak daha anlamlı artış saptandı (p<0.001).
Sepsis ve septik şok tanılı hastalarda başlangıçta trombositopeni olması, takipte trombositopeni süresinin uzun sürmesi ve trombosit değerlerinde artış olmaması kötü prognostik belirteçdir. Lee K ve ark. 107 hastanın değerlendirildiği bir çalışmasında 53 hastada sepsis görülmüş ve bu septik hastalarda PLT sayısı ölen grupta yaşayan gruba göre istatiksel olarak daha anlamlı düşük saptanmıştır (p=0.004).(92) Bizim yaptığımız çalışmada da PLT değişiminde (Δ PLT) yaşayan grupta ölen gruba göre istatiksel olarak daha anlamlı artış saptandı (p<0.001). Grup 1 (IVIG<24 saat) hastalarda PLT değişimde (Δ PLT) Grup 2’ye (IVIG>24 saat) göre daha iyi artış olsa da istatiksel olarak anlamlı bulunmadı.
Septik şokta yeterli sıvı replasmanına rağmen dirençli hipotansiyon söz konusudur. Ortalama arteryel basıncı (MAP) sağlamak için inotropik ve vazopressör ajan kullanımı önerilmektedir. Mayaud ve ark. 2113 sepsis ve septik şok tanılı hastanın dahil edildiği bir çalışmasında MAP’in ölen grupta istatiksel olarak daha anlamlı düşük olduğu saptandı (p<0.001). İnotrop kullanımı açısından ölen grup ile yaşayan grup arasında istatiksel olarak anlamlı fark saptanmıştır (%63.1 ve %48.1, p<0.001).(93) Bizim yaptığımız çalışmada hastaların ortalama SKB 106.5 ± 28.4 mmHg, DKB 66.3 ± 17.06 mmHg’dir. Ölen grupta SKB ve DKB değerleri istatiksel olarak daha anlamlı düşük saptanmıştır (p=0.017 ve
p=0.019). İnotrop kullanan grupta mortalite oranı kullanmayan gruba göre istatiksel olarak
6. SONUÇ
Bu tez, sepsis hastalarında IVIG verme zamanı ile ilgili devam eden gözlemsel çalışmanın ilk sonuçlarının paylaşıldığı veriler içermektedir. Literatürde bu konuda yayınlanmış sadece iki çalışma vardır.
Çalışmaya 130 hasta alındı. İnotrop kullanan hasta grubunda mortalite oranı istatiksel olarak daha yüksek saptandı. Ölen grupta SKB, DKB ve albumin değerleri yaşayan grupa göre istatiksel anlamlı düşük saptandı. Yaşayan grupta CRP (Δ CRP) ve MPV (Δ MPV) değişimlerinde istatiksel anlamlı düşme, albumin (Δ Albumin) ve PLT (Δ PLT) değişimlerinde ise artma saptandı. Grup 1 (IVIG<24 saat) ve Grup 2 (IVIG>24 saat) arasında mortalite açısından anlamlı faklılık saptanmadı. Bunun nedeni hasta sayısının az olması olabilir. Grup 1’de (IVIG<24 saat) albumin değişiminde (Δ Albumin) istatiksel anlamlı artış saptandı.
Her ne kadar az hasta popülasyonunda elde ettiğimiz veriler sunulmuş olsa da, Sepsis ve septik şokta erken IVIG tedavisi ile mortalitenin azalacağını düşünmekteyiz. Mortalite ön görücüsü olarak saptadığımız albumin değişiminin, erken grupta anlamlı daha iyi çıkması da bu olasılığı desteklemektedir. Süregelen dönemde, artan hasta sayısı ile daha sağlıklı veriler elde edeceğimizi düşünmekteyiz.
Sepsis ve septik şok tüm dünyada önemli sağlık sorunu ve ciddi mortalite nedenleridir. Bu yüzden hastalara erken dönemde tanı konulması ve erken tedavi başlanması hayat kurtarıcıdır.
KAYNAKLAR
1. van Vught LA, Klouwenberg PMK, Spitoni C, Scicluna BP, Wiewel MA, Horn J, et al. Incidence, risk factors, and attributable mortality of secondary infections in the intensive care unit after admission for sepsis. 2016;315(14):1469-79.
2. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. 2017;43(3):304-77.
3. Torio CM, Andrews RM. National inpatient hospital costs: the most expensive conditions by payer, 2011: statistical brief# 160. 2006.
4. Manship L, McMillin R, Brown JJTAS. The influence of sepsis and multisystem and organ failure on mortality in the surgical intensive care unit. 1984;50(2):94-101.
5. Niederman M, Fein AJCicm. Sepsis syndrome, the adult respiratory distress syndrome, and nosocomial pneumonia. A common clinical sequence. 1990;11(4):633-56. 6. Harrison DA, Welch CA, Eddleston JM. The epidemiology of severe sepsis in England, Wales and Northern Ireland, 1996 to 2004: secondary analysis of a high quality clinical database, the ICNARC Case Mix Programme Database. Critical care.
2006;10(2):R42.
7. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive care medicine. 2017;43(3):304-77.
8. Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel
understanding of the disorder and a new therapeutic approach. The Lancet infectious diseases. 2013;13(3):260-8.
9. Laupland KB. Polyclonal intravenous immunoglobulin for the prophylaxis and treatment of infection in critically ill adults. Canadian Journal of Infectious Diseases and Medical Microbiology. 2002;13(2):100-6.
10. Neilson AR, Burchardi H, Schneider H. Cost-effectiveness of immunoglobulin M– enriched immunoglobulin (Pentaglobin) in the treatment of severe sepsis and septic shock. Journal of critical care. 2005;20(3):239-49.
11. Alejandria M, Lansang M, Dans L, Mantaring J. Intravenous immunoglobulin for treating sepsis and septic shock. Cochrane Review. 1999.
12. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. 1992;101(6):1644-55.
14. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). Jama. 2016;315(8):801-10.
15. Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MRJCcm. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. 2001;29(7):1303-10.
16. Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, et al. 2001 sccm/esicm/accp/ats/sis international sepsis definitions conference. 2003;29(4):530-8.
17. Ziesmann MT, Marshall JCJSi. Multiple organ dysfunction: the defining syndrome of sepsis. 2018;19(2):184-90.
18. Blanco J, Muriel-Bombín A, Sagredo V, Taboada F, Gandía F, Tamayo L, et al. Incidence, organ dysfunction and mortality in severe sepsis: a Spanish multicentre study. 2008;12(6):R158.
19. Wheeler AP, Bernard GR. Treating patients with severe sepsis. New England Journal of Medicine. 1999;340(3):207-14.
20. Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management. Bmj. 2016;353:i1585.
21. Dombrovskiy VY, Martin AA, Sunderram J, Paz HL. Rapid increase in hospitalization and mortality rates for severe sepsis in the United States: a trend analysis from 1993 to 2003. Critical care medicine. 2007;35(5):1244-50.
22. Lagu T, Rothberg MB, Shieh M-S, Pekow PS, Steingrub JS, Lindenauer PK. What is the best method for estimating the burden of severe sepsis in the United States? Journal of critical care. 2012;27(4):414. e1-. e9.
23. Angele MK, Pratschke S, Hubbard WJ, Chaudry IH. Gender differences in sepsis: cardiovascular and immunological aspects. Virulence. 2014;5(1):12-9.
24. Martin GS, Mannino DM, Moss M. The effect of age on the development and outcome of adult sepsis. Critical care medicine. 2006;34(1):15-21.
25. Janeway Jr C. Medzhitov R.(2002) Annu. Rev Immunol.20:197-216.
26. Lemaitre B, Nicolas E, Michaut L, Reichhart J-M, Hoffmann JA. The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell. 1996;86(6):973-83.
27. Brunn GJ, Platt JL. The etiology of sepsis: turned inside out. Trends in molecular medicine. 2006;12(1):10-6.
29. Akira S, Takeda K. Toll-like receptor signalling. Nature reviews immunology. 2004;4(7):499.
30. Weber A, Wasiliew P, Kracht M. Interleukin-1 (IL-1) pathway. Sci Signal. 2010;3(105):cm1-cm.
31. Mera S, Tatulescu D, Cismaru C, Bondor C, Slavcovici A, Zanc V, et al. Multiplex cytokine profiling in patients with sepsis. Apmis. 2011;119(2):155-63.
32. Jones SA, Scheller J, Rose-John S. Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling. The Journal of clinical investigation. 2011;121(9):3375-83.
33. Gouel-Chéron A, Allaouchiche B, Guignant C, Davin F, Floccard B, Monneret G, et al. Early interleukin-6 and slope of monocyte human leukocyte antigen-DR: a powerful association to predict the development of sepsis after major trauma. PloS one.
2012;7(3):e33095.
34. Chousterman BG, Swirski FK, Weber GF, editors. Cytokine storm and sepsis disease pathogenesis. Seminars in immunopathology; 2017: Springer.
35. Kellum JA, Kong L, Fink MP, Weissfeld LA, Yealy DM, Pinsky MR, et al.
Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Markers of Sepsis (GenIMS) Study. Archives of internal medicine. 2007;167(15):1655-63.
36. Riedemann NC, Guo R-F, Hollmann TJ, Gao H, Neff TA, Reuben JS, et al. Regulatory role of C5a in LPS-induced IL-6 production by neutrophils during sepsis. The FASEB journal. 2004;18(2):370-2.
37. Riedemann NC, Neff TA, Guo R-F, Bernacki KD, Laudes IJ, Sarma JV, et al. Protective effects of IL-6 blockade in sepsis are linked to reduced C5a receptor expression. The Journal of Immunology. 2003;170(1):503-7.
38. Hsieh C-S, Macatonia SE, Tripp CS, Wolf SF, O'garra A, Murphy KM. Development of TH1 CD4+ T cells through IL-12 produced by Listeria-induced macrophages. Science. 1993;260(5107):547-9.
39. Costa VS, Mattana TCC, da Silva MER. Unregulated IL-23/IL-17 immune response in autoimmune diseases. Diabetes research and clinical practice. 2010;88(3):222-6.
40. Reynolds JM, Angkasekwinai P, Dong C. IL-17 family member cytokines: regulation and function in innate immunity. Cytokine & growth factor reviews. 2010;21(6):413-23. 41. Veldhoen M, Hocking RJ, Atkins CJ, Locksley RM, Stockinger B. TGFβ in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity. 2006;24(2):179-89.
42. McGeachy MJ, Bak-Jensen KS, Chen Y, Tato CM, Blumenschein W, McClanahan T, et al. TGF-β and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain T H-17 cell–mediated pathology. Nature immunology. 2007;8(12):1390.
43. Korn T, Bettelli E, Gao W, Awasthi A, Jäger A, Strom TB, et al. IL-21 initiates an alternative pathway to induce proinflammatory T H 17 cells. Nature. 2007;448(7152):484. 44. Schroder K, Hertzog PJ, Ravasi T, Hume DA. Interferon‐γ: an overview of signals, mechanisms and functions. Journal of leukocyte biology. 2004;75(2):163-89.
45. Schoenborn JR, Wilson CB. Regulation of interferon‐γ during innate and adaptive immune responses. Advances in immunology. 2007;96:41-101.
46. Romero CR, Herzig DS, Etogo A, Nunez J, Mahmoudizad R, Fang G, et al. The role of interferon‐γ in the pathogenesis of acute intra‐abdominal sepsis. Journal of leukocyte biology. 2010;88(4):725-35.
47. Ono S, Ueno C, Aosasa S, Tsujimoto H, Seki S, Mochizuki H. Severe sepsis induces deficient interferon-gamma and interleukin-12 production, but interleukin-12 therapy improves survival in peritonitis. The American journal of surgery. 2001;182(5):491-7. 48. Cai S, Batra S, Lira SA, Kolls JK, Jeyaseelan S. CXCL1 regulates pulmonary host defense to Klebsiella infection via CXCL2, CXCL5, NF-κB, and MAPKs. The Journal of Immunology. 2010;185(10):6214-25.
49. Robben PM, LaRegina M, Kuziel WA, Sibley LD. Recruitment of Gr-1+ monocytes is essential for control of acute toxoplasmosis. Journal of Experimental Medicine.
2005;201(11):1761-9.
50. Lionakis MS, Swamydas M, Fischer BG, Plantinga TS, Johnson MD, Jaeger M, et al. CX 3 CR1-dependent renal macrophage survival promotes Candida control and host survival. The Journal of clinical investigation. 2013;123(12):5035-51.
51. Chousterman BG, Boissonnas A, Poupel L, de Chanville CB, Adam J, Tabibzadeh N, et al. Ly6Chigh monocytes protect against kidney damage during sepsis via a CX3CR1-dependent adhesion mechanism. Journal of the American Society of Nephrology. 2016;27(3):792-803.
52. Hamilton JA. Colony-stimulating factors in inflammation and autoimmunity. Nature Reviews Immunology. 2008;8(7):533.
53. Schreuder H, Tardif C, Trump-Kallmeyer S, Soffientini A, Sarubbi E, Akeson A, et al. A new cytokine-receptor binding mode revealed by the crystal structure of the IL-1 receptor with an antagonist. Nature. 1997;386(6621):194.
54. Dinarello CA, editor Induction of interleukin-1 and interleukin-1 receptor antagonist. Seminars in oncology; 1997.
55. Alexander HR, Doherty GM, Venzon DJ, Merino MJ, Fraker DL, Norton JA. Recombinant interleukin-1 receptor antagonist (IL-1ra): effective therapy against gram-negative sepsis in rats. Surgery. 1992;112(2):188-94.
negative pneumonia. American journal of respiratory and critical care medicine. 2011;183(10):1380-90.
57. Wynn TA. Type 2 cytokines: mechanisms and therapeutic strategies. Nature Reviews Immunology. 2015;15(5):271.
58. Luzina IG, Keegan AD, Heller NM, Rook GA, Shea‐Donohue T, Atamas SP.
Regulation of inflammation by interleukin‐4: a review of “alternatives”. Journal of leukocyte biology. 2012;92(4):753-64.
59. Couper KN, Blount DG, Riley EM. IL-10: the master regulator of immunity to infection. The Journal of Immunology. 2008;180(9):5771-7.
60. Opal SM, Depalo VA. Anti-inflammatory cytokines. Chest. 2000;117(4):1162-72. 61. Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy. Nature Reviews Immunology. 2013;13(12):862. 62. Weber GF, Chousterman BG, He S, Fenn AM, Nairz M, Anzai A, et al. Interleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis. Science.
2015;347(6227):1260-5.
63. Bentzer P, Fjell C, Walley KR, Boyd J, Russell JA. Plasma cytokine levels predict response to corticosteroids in septic shock. Intensive care medicine. 2016;42(12):1970-9. 64. Rivers EP, McIntyre L, Morro DC, Rivers KK. Early and innovative interventions for severe sepsis and septic shock: taking advantage of a window of opportunity. Cmaj.
2005;173(9):1054-65.
65. Dellinger RP, Carlet JM, Masur H, Gerlach H, Calandra T, Cohen J, et al. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock. Intensive care medicine. 2004;30(4):536-55.
66. Polat G, Ugan RA, Cadirci E, Halici Z. Sepsis and septic shock: current treatment strategies and new approaches. The Eurasian journal of medicine. 2017;49(1):53.
67. Cronin L, Cook DJ, Carlet J, Heyland DK, King DBM, Lansang MAD, et al. Corticosteroid treatment for sepsis: a critical appraisal and meta-analysis of the literature. Critical care medicine. 1995;23(8):1430-9.
68. Polderman KH, Girbes AR. Drug intervention trials in sepsis: divergent results. The Lancet. 2004;363(9422):1721-3.
69. Ziegler EJ, McCutchan JA, Fierer J, Glauser MP, Sadoff JC, Douglas H, et al. Treatment of gram-negative bacteremia and shock with human antiserum to a mutant Escherichia coli. New England Journal of Medicine. 1982;307(20):1225-30.
70. Baumgartner J-D, Mccutchan JA, Van Melle G, Vogt M, Luethy R, Glauser M, et al. Prevention of gram-negative shock and death in surgical patients by antibody to endotoxin core glycolipid. The Lancet. 1985;326(8446):59-63.
71. Werdan K. Supplemental immune globulins in sepsis. Clinical chemistry and laboratory medicine. 1999;37(3):341-9.
72. Confference NC. Intravenous immunoglobulin: Prevention and treatment of disease. J Am Med Assoc. 1990;264:3189-93.
73. Norrby-teglund A, Ihendyane N, Darenberg J. Intravenous immunoglobulin adjunctive therapy in sepsis, with special emphasis on severe invasive group A streptococcal infections. Scandinavian journal of infectious diseases. 2003;35(9):683-9.
74. Mouthon L, Kaveri S, Spalter S, Lacroix-Desmazes S, Lefranc C, Desai R, et al. Mechanisms of action of intravenous immune globulin in immune‐mediated diseases. Clinical & Experimental Immunology. 1996;104:3-9.
75. Ballow M. Mechanisms of action of intravenous immune serum globulin in autoimmune and inflammatory diseases. Journal of Allergy and Clinical Immunology. 1997;100(2):151-7.
76. Di Rosa R, Pietrosanti M, Luzi G, Salemi S, D'Amelio R. Polyclonal intravenous immunoglobulin: an important additional strategy in sepsis? European Journal of Internal Medicine. 2014;25(6):511-6.
77. Haque KN, Zaidi MH, Bahakim H. IgM-enriched intravenous immunoglobulin therapy in neonatal sepsis. American journal of diseases of children. 1988;142(12):1293-6. 78. Haque K, Remo C, Bahakim H. Comparison of two types of intravenous
immunoglobulins in the treatment of neonatal sepsis. Clinical & Experimental Immunology. 1995;101(2):328-33.
79. Garbett N, Munro C, Cole P. Opsonic activity of a new intravenous immunoglobulin preparation: Pentaglobin compared with sandoglobulin. Clinical and experimental
immunology. 1989;76(1):8.
80. McCabe WR, DeMaria Jr A, Berberich H, Johns MA. Immunization with rough mutants of Salmonella minnesota: protective activity of IgM and IgG antibody to the R595 (Re chemotype) mutant. Journal of Infectious Diseases. 1988;158(2):291-300.
81. Trautmann M, Held T, Susa M, Karajan M, Wulf A, Cross A, et al. Bacterial lipopolysaccharide (LPS)-specific antibodies in commercial human immunoglobulin preparations: superior antibody content of an IgM-enriched product. Clinical and experimental immunology. 1998;111(1):81.
82. Bermejo-Martin JF, Andaluz-Ojeda D, Almansa R, Gandia F, Gómez-Herreras JI, Gomez-Sanchez E, et al. Defining immunological dysfunction in sepsis: A requisite tool for precision medicine. Journal of Infection. 2016;72(5):525-36.
83. Giamarellos-Bourboulis EJ, Tziolos N, Routsi C, Katsenos C, Tsangaris I, Pneumatikos I, et al. Improving outcomes of severe infections by multidrug-resistant
84. de la Torre MC, Torán P, Serra-Prat M, Palomera E, Güell E, Vendrell E, et al. Serum levels of immunoglobulins and severity of community-acquired pneumonia. BMJ open respiratory research. 2016;3(1):e000152.
85. Sakr Y, Jaschinski U, Wittebole X, Szakmany T, Lipman J, Ñamendys-Silva SA, et al., editors. Sepsis in intensive care unit patients: worldwide data from the intensive care over nations audit. Open forum infectious diseases; 2018: Oxford University Press US.
86. Venet F, Rimmele T, Monneret G. Management of sepsis-induced immunosuppression. Critical care clinics. 2018;34(1):97-106.
87. Berlot G, Vassallo MC, Busetto N, Bianchi M, Zornada F, Rosato I, et al. Relationship between the timing of administration of IgM and IgA enriched immunoglobulins in patients with severe sepsis and septic shock and the outcome: a retrospective analysis. Journal of critical care. 2012;27(2):167-71.
88. Berlot G, Vassallo MC, Busetto N, Yabar MN, Istrati T, Baronio S, et al. Effects of the timing of administration of IgM-and IgA-enriched intravenous polyclonal
immunoglobulins on the outcome of septic shock patients. Annals of intensive care. 2018;8(1):122.
89. Lee C-C, Chen S-Y, Tsai C-L, Wu S-C, Chiang W-C, Wang J-L, et al. Prognostic value of mortality in emergency department sepsis score, procalcitonin, and C-reactive protein in patients with sepsis at the emergency department. Shock. 2008;29(3):322-7.
90. Kim MH, Ahn JY, Song JE, Choi H, Ann HW, Kim JK, et al. The C-reactive
protein/albumin ratio as an independent predictor of mortality in patients with severe sepsis or septic shock treated with early goal-directed therapy. PLoS One. 2015;10(7):e0132109. 91. Kim CH, Kim SJ, Lee MJ, Kwon YE, Kim YL, Park KS, et al. An increase in mean platelet volume from baseline is associated with mortality in patients with severe sepsis or septic shock. PLoS One. 2015;10(3):e0119437.
92. Lee K, Hui K, Tan W. Thrombocytopenia in sepsis: a predictor of mortality in the intensive care unit. Singapore medical journal. 1993;34:245-.
93. Mayaud L, Lai PS, Clifford GD, Tarassenko L, Celi LAG, Annane D. Dynamic data during hypotensive episode improves mortality predictions among patients with sepsis and hypotension. Critical care medicine. 2013;41(4):954.