1. GİRİŞ
1.1. Oksimler ve Özellikleri
Oksimler aldehit ve ketonların hidroksilamin ile verdikleri kondensasyon ürünü olarak tanımlanabilir. Genel formülleri RCH=NOH veya R1R2C=NOH olarak gösterilirler. Oksim kelimesi oksi-imin kelimelerinden gelmektedir. Oksimler türetildikleri aldehit ve ketonların sonlarına, oksim kelimesi eklenerek isimlendirilebildiği gibi, ana grup keton ve aldehit olmak şartıyla hidroksimino eki ile de isimlendirilmektedir. Bu oksimler kısaca mono oksimler olarak bilinir. Bir molekülde bir tane oksim grubu (C=N-OH) olabildiği gibi, birden fazlada olabilir. Özellikle komşu karbonda bulunmaları önemlidir. İki oksim grubu içeren bu bileşiklere dioksimler (glioksimler) denir ve 1,2-, α-, vic- ön ekleri ile belirtilir. İlk oksim çalışması Meyer tarafından 1882 yılında yapılmıştır. Aşağıda bazı oksimlerin isimlendirilmeleri verilmiştir. CH3-CH=N-OH C N OH H3C C=N C H3 OH
a) Asetaldoksim b) Benzofenon c) Asetonoksim C C N N H H OH OH C C N N C H3 OH OH H3C C C N N H OH OH d) Glioksim e) Dimetil glioksim f) β-Naftil glioksim
Oksimlerin N veya O üzerinde bazı gruplar bulunabilir. Bu tür oksim türevlerine örnekler aşağıda verilmiştir.
C
H3 CH N O R CH N OC2H5
O-alkil asetaldoksim (oksim eteri)
O-etil benzaldoksim
N-metil benzofenon oksim (N-metil difenil nitron)
N O CH3
C +
-Oksimler genellikle renksiz, orta derece sıcaklıklarda eriyen organik maddelerdir. Çözünürlüğü suda çok azdır. Molekül ağırlığı düşük olan oksimler uçucudurlar. Amfoterik karakterde olan oksimler taşıdıkları hidroksil protonundan dolayı asidik özellik gösterirken, azot atomu nedeniyle de zayıf bazik özelliğe sahiptirler; çok kuvvetli asit ve bazlarla tuz oluştururlar(Manav 2006). Alifatik
oksimlerin asitliği genellikle molekül ağırlığının artması ile azalırken, oksim grubuna
komşu karbonil grubunun varlığı asitliği arttırmaktadır. Aromatik oksimlerde asitlik derecesi, aromatik halkanın sübstitüentlerine bağlı olarak değişir(Migrdichian, 1957). Oksimlerin hidrojen bağı yapmaları da asitliklerini ve erime derecelerini etkileyen diğer bir faktördür(Alıcı, 2006). Oksimler katı fazda genellikle intermoleküler
hidrojen bağı yaparlar(Manav, 2006). Hidrojen bağı genellikle O─H....N arasında
olmakla birlikte, N─O....H arasında da mümkündür (Alıcı, 2006).
Basit oksimlerin pKa’ları 10 ile 12 arasındadır. vic-Dioksimler ise mono oksimlerden daha kuvvetli asidik özellik gösterir. α-Keto grubu, oksimlerde asitlik gücünü artırmaktadır ve bu tip oksimlerin pKa’ları 7-10 arasında değişmektedir(Hüseyinzade ve İrez, 1990).
Oksimler ve türevlerinin geometrik özellikleri ile izomerleri syn ve anti ön
ekleriyle belirtilir(Smith, 1966). Syn ön eki, oksim grubunun çift bağı etrafındaki hidrojen ve hidroksil ile aynı tarafta, anti ön eki ise, zıt tarafta olması halinde
kullanılır. C H N OH C H N HO
Asimetrik ketonlardan meydana gelen oksimlerde ise izomerlik referans alınan gruba göre isimlendirme yapılır. Örneğin etil metil ketoksimi iki şekilde
isimlendirebiliriz(Moller 1966). C N OH CH3 C2H5 C N O H C H3 C2H5
syn- Metil etil ketoksim veya syn- Metil etil ketoksim veya anti- Etil metil ketoksim anti- Etil metil ketoksim
vic-Dioksimlerin izomerleri ise, OH gruplarının, birbirlerinin pozisyonlarına bağlı olarak kullanılmaktadır. OH’ın aynı tarafa yönlendiği yapılar syn-, zıt tarafa yönlendiği yapılar anti- ve birbirine paralel yönlendiği yapılar amphi- olarak adlandırılır(Nesmeyanov 1974). C C H N O H N OH C C H N N OH OH C C H N N O H OH
syn-Fenilglioksim amphi-Fenilglioksim anti-Fenilglioksim e.n.:212-214 0C e.n.: 164-166 0C e.n.: 243-244 0C
Syn-, anti- ve amphi- formlarında olan oksimler birbirlerinden farklı özellik taşırlar. Örneğin bazı istisnalar hariç syn- ve amphi formlarının erime noktaları anti- formlarına göre daha düşüktür(Smith 1966). Anti- formu daha kararlı bir yapıya sahiptir. Dolayısıyla oksimlerin anti-izomeri amphi ve syn izomere göre daha düşük enerjilidir(Nesmeyanov 1974). Aynı zamanda oksimlerin anti- formu organik ve anorganik reaksiyonlar için daha uygundur. Birçok katılma-ayrılma ve kompleks reaksiyonları bu formda oluşur(Burakevich ve ark. 1971). Yine bazı aldoksim ve
ketoksimlerin değişik reaksiyon şartlarında, farklı olarak ve değişik şekillerde ele geçmeleri, bunların izomer olmalarıyla açıklanabilir. Böyle farklılıklar daha çok aromatik aldoksim ve ketoksimlerde gözlenmektedir.
1.1.2. Oksimlerin Eldesi
Bugüne kadar mono ve dioksimlerin sentezine ait çeşitli metotlar geliştirilmiştir. Aşağıda laboratuar şartlarında kolayca uygulanabilen bazı metotlar verilmiştir.
a) Aldehit ve ketonların hidroksilamin ile reaksiyonundan: Oksimler eskiden beri aldehit ve ketonların hidroksilamin ile olan reaksiyonundan elde edilmektedir. Reaksiyon sulu alkollü ortamda, kaynama sıcaklığında ve optimum pH’ larda gerçekleştirilir(Bierlein ve Lingafelter 1951).
AcONa R-CH=N-OH NaCl AcOH
R-CHO + NH2OH.HCl + +
b)Nitrosolama metodu: Özellikle α-keto oksimlerin hazırlanmasında oldukça kullanışlı bir yoldur ve aktif metilen gruplu bileşiklerden yararlanılır.
α-Keto oksimlerin (izonitroso oksimler) karbonil grubunun önceki metot da
olduğu gibi, hidroksilamin ile reaksiyonundan 1,2-(α,vic)dioksimler elde edilir
(Burakevich ve ark.1971, Uçan ve Mirzaoğlu 1990).
Ar C O CH3 C4H9ONO Ar C O CH=N-OH NH2OH.HCl Ar-C-C-H N N O H OH
İsonitroso oksimler hidroksilamin ile olduğu gibi hidrazin, amin vb. bileşikler
ile de çeşitli oksim türevlerini verirler(Chakravorty 1974, Deveci 1994).
C - C H= N O H O
N H2-Z C - C H= N O H
N -Z +
+ 2 N H2O H H Cl . C N O H C N O H Cl H CCl3 CH (O H )2 N aO H
c) Kloralhidrat ile hidroksilamin reaksiyonundan: vic-Dioksimlerin
önemli bir üyesi olan kloroglioksim, kloralhidrat ile hidroksilaminin reaksiyonundan elde edilir(Hesse ve Krehbiel 1955, Gök 1981, Deveci 1994).
1.1.3. Oksimlerin Reaksiyonları
Oksimlerin kimyasal ve fiziksel olarak birçok reaksiyonu vardır. Bazı önemli reaksiyonlar aşağıda verilmiştir.
a) Asitlerin etkisi: Oksimler kuvvetli mineral asitlerle, tuzlarına dönüşürler.
Aynı zamanda izomerik olarak dönüşüme uğrarlar. syn- ve amfi- izomerleri HCl ile
kolayca anti- izomerlerine dönüşür(Gök 1981).
H C6H5 C N HO OH H C C6H5 HCl N Cl C C H C C H N N N OH OH HO OH der. HCl Cl N
syn-benzaldoksim anti-benzaldoksim
am fi-kloroglioksim anti-kloroglioksim
b) Isı ve ışık etkisi: Oksimler oldukça kararlı maddeler olmalarına rağmen,
uzun süre ışık ve hava oksijenine maruz kaldıklarında bazı bozunmalar olur.
Bozunmalar sonucunda genellikle ana karbonil bileşiği ile bazı azotlu maddeler meydana gelir. Örneğin benzofenon oksim ısı etkisiyle bozunduğunda azot, amonyak, benzofenon ve imine ayrışır(Smith 1966).
(C6H5)2C=NOH (C
6H5)2C=O (C6H5)2C=NH N2 .H2O 160-1850C
+ + +
C I S I 5 6 5 6 5 6 N H + C H C O O H . O C C H H O N H C H 2
Oksimin yapısında α- hidrojenleri varlığında ise bozunma alkol ve nitrile ayrışma şeklinde olur.
C6H5 CH2 C C6H5
N OH
C6H5 CN + C6H5 CH2 OH ısı
c) Oksimlerin indirgenmesi: Oksimler, çeşitli reaktiflerle imin
basama-ğından geçerek, primer aminlere kadar indirgenebilirler. vic- Dioksimler de kolayca
diaminlere indirgenebilirler(Chakravorty 1974).
Ar CH NOH Ar CH
2NH
2HCl
.
SnCl2 / HCl Na / C2H5OH Ar C NOH Ar CH NH2 Ar C NOH Ar CH NH2d) Oksimlerin yükseltgenmesi: Aldoksimlerde, C-H bağının oksitlenme kararsızlığından dolayı değişik ürünler oluşur. Aldoksimler -78 °C de oksitlendiğinde
nitril oksitleri, vic-dioksimler ise furoksanları verir(Chakravorty 1974).
Pb (Ac)4
(O) + -O O R C NOH R C N R C NOH R C N
e) Açilleme reaktifleri ile reaksiyonları: Oksimler açilleme reaktifleri ile reaksiyona girerek O-açil türevlerini oluşturur. Oksimlerin bu açil türevleri kararsız
bileşikler olup, bazik ortamda hidrolize uğrayarak oksimleri oluştururlar(Freeman 1979). R CH N OH R' C O Cl ISI C R' O R CH N O +
f) Beckmann çevrilmesi: Oksimlerin katalizlenmiş izomerizasyonundan
amidlere dönüşümüdür. Özellikle keto oksimler, sülfürik asit, hidroklorik asit,
polifosforik asit gibi kuvvetli asitlerle veya fosfor pentaklorür, fosfor pentaoksit varlığında bir çevrilmeye uğrarlar. Alkil veya aril grubu azot atomu üzerine göç ederek, N-sübstitüe amidler meydana gelir. Örneğin asetofenonoksim derişik sülfürik
asit beraberinde Beckmann çevrilmesine uğrayarak aset anilidi verir(Tüzün 1999).
C C H3 N OH der. H2SO4 N H C O CH3
g) Oksimlerin klorlanması: Oksimler bir çözücü içerisinde UV, ışık veya ısı etkisiyle klorlandığında hidroksamoil klorürleri verirler. Örneğin asetaldoksimin
klorlanmasıyla asethidroksamoil klorür elde edilir(Weiland 1907).
, h
ν
Cl2 çözücü Cl CH3 CH NOH CH3 C NOHElektrofilik reaktiflerin çoğu oksimlerin O veya N atomlarına etki ettikleri
Bu reaksiyonda ilk etkinin oksijene mi, yoksa azot atomuna mı olduğu bilinmemektedir. Aldoksimlerin normal klorlanmasından, klor nitrozo bileşiği
üzerinden yürüyen reaksiyon sonunda, hidroksamik asit klorürleri meydana gelir. Eğer, klorlama ileriye gidecek olursa, sararma ile kendini gösteren bir bozunma
ürünü olan 1,1-diklor nitrozo bileşikleri oluşur(Rheinboldt und Schmitz-Dumont 1925, Karataş ve Tüzün 1989, Uçan ve Mirzaoğlu 1990).
R-CH=NOH Cl2 0 0C R-C-NO Cl H hv eter R-C=NOH Cl Cl2 R-C-NO Cl Cl
Hidroksamil klorürler çeşitli nükleofillerle reaksiyona girerek kolayca kendi
bünyelerinde bulunan klorun yerine başka gruplar geçebilir. Örneğin, amonyak ile
amidoksimleri, aminler ile N-sübstitue amidoksimleri, hidroksilamin ile de hidroksilamidoksimleri verirler. NOH NH2
Cl
NOH
R C + 2 NH
3R C + NH
4Cl
amidoksim N-Alkil amidoksim R C + 2 R' NH2 R C + R' NH2 HCl NOH Cl NH R' NOH.
R-C=N-OH Cl NH2OH R-C N-OH NH-OH NH2OH.HCl + +Hidroksamoil klorürlerin, Grignard bileşiği ile olan reaksiyonundan ketoksimler oluşur. R-C=NOH Cl R'-MgX R-C=N-OH R' +
Son yıllarda, vic-dioksim klorürleri ile mono ve diaminler arasındaki reaksiyonlardan birçok dioksim ve tetra oksim türevi sentezlenmiştir(Grundmann ve Grunanger 1971, Chakravorty 1974, İrez ve Bekaroğlu 1983, Deveci ve ark. 1991, Karataş ve ark.1991). R' NH2 H2N R' NH2 HO N C HN R' NH C NOH HO N C C NOH H (R) (R) H C N OH C N OH (R) H R' NH (R) H C NOH C NOH Cl
Yine diklorglioksim ve tereftalohidroksamoil klorür gibi oksimler ile diaminlerin reaksiyonundan organik polimerler elde edilmiştir(Grundmann ve ark. 1965, Karataş, 1993). N H2 R NH2 C C Cl Cl N N O H OH NH R NH C C N N O H OH n + C HON Cl C NOH Cl N H2 R' NH2 C C NH R' NOH NOH n N H +
1.1.4. Oksimlerin Kullanım Alanları
Oksimler analitik, organik, anorganik, endüstriyel ve biyokimyanın birçok alanında değişik amaçlarla kullanılmaktadır. Bazı oksim ve onların çeşitli alkil, oksialkil ve amino türevleri fizyolojik ve biyolojik aktif özelliklere sahip oldukları, ayrıca motor yağlarının, boyaların, epoksit reçinelerinin, lastiklerin v.b. bazı
özelliklerinin iyileştirilmesi için katkı maddesi olarak kullanıldıkları bilinmektedir (Carlos ve David 1972, Lecterc ve ark. 1977, Lecterc ve ark. 1980).
Sanayide kullanılan birçok polimer madde yüksek sıcaklığa, ışığa, darbeye, gerilmeye ve benzeri etkilere dayanıksızdır. Polimerik materyallerin bu eksik özelliklerini iyileştirmek için çeşitli aktif katkı maddeleri kullanılmaktadır, bu amaçla oksimlerin bazıları da aktif katkı maddesi olarak kullanılır. Yine doymamış oksimlerin, polimerlerin ışığa karşı özelliklerini iyileştirdiği ve epoksi reçinelerinin yapışma özelliğini artırdığı bilinmektedir(Carlos,1972). Bir oksim türü olan amidoksimler; teknolojide oldukça geniş uygulama alanına sahiptirler. Örnek verecek olursak, birkaç aromatik amidoksim yağ devir sistemlerinde korozyonu önleyici olarak kullanılmaktadır(Kara 1995). Benzamidoksimin ve süksinik diamidoksimin gümüş tuzları fototermografik özelliklere sahiptir. Bazı diamidoksimler termoplastik maddeler için uygun yayıcılar olarak yine bir amidoksim grubu içeren katyonik nişasta kağıt kuvvetlendirici olarak önerilmiştir. Kısmen amidoksimlenmiş poliakrilonitril liflerinin boya tutma kapasitesi artar (Kara 1995). Poliakrilamidoksim türevlerinin deniz suyundan uranyum elde edilmesinde en iyi absorban olduğu belirlenmiştir.
Yine; α- karbonunda arilsülfonil, sülfamid veya bir sülfon grubu içeren amidoksimler antibakteriyel maddeler olarak düşünülürler. Örneğin; 4- sülfamil – benzamid dioksim raşitizme karşı aktiflik gösterir. Triazolil halkalı amidoksimler analjesikler olarak kullanılırlar ve tümüyle sübstitüe alifatik olanlar antihistaminik aktifliği artırırlar. Yine, 2- metoksi-9- aminoakridin-6- amidoksim ve 9- anilakridin-3- amidoksim tedavi edici olup farmakolojik özelliklere sahiptir. Bir amidoksim grubuna sahip bazı halojenlenmiş fenoller Mycobacterium tuberculosis’e karşı etkindirler(Kara 1995).
Amidoksimler potansiyel pestisitler olarak test edilmişler ve O- alkil, aril, tiyenil veya arilkarbamoil, N-alkilformamidoksimlerin herbisit özelliğine sahip oldukları belirlenmiştir. Kısaca oksimlerin sağlık alanında promnezik, analjezik ve anestetik, antimikrobik ve antifungal, antiparaziter, radyoaktif işaretli, antitümöral, kardiyovasküler sistemler üzerine etkileri bulunmuştur(Bromidge ve ark. 1994). (Şimşek 1997). Ayrıca oksimlerin bir kısmı ilaçların imalatında hammadde olarak kullanılır iken bir kısmı da ilaçların yapımında etkinliği artırıcı katkı maddesi olarak
kullanılmaktadır. Oksimler daha çok antidepresan ve antibiyotik gibi ilaçların imalatında kullanılmaktadır.
Koordinasyon bileşiklerinin biyolojik yapılardaki önemi, sanayideki kullanım oranının ve alanının günden güne artması, son zamanlarda kanser araştırmalarında antitümör etkilerinin bulunması, vic-dioksim kompleksleri üzerindeki araştırmaların yoğunlaşmasına sebep olmuştur. vic-Dioksim komplekslerinin vitamin B12 ve bitkilerin klorofil renk maddesine benzerliğinden dolayı biyolojik yapıların aydınlatılmasında kullanılması, önemini arttırmıştır(Tan, 1983).
1.2. POLİMERLER
1.2.1. Polimerler Hakkında Genel Bilgi
Polimerler tekrarlanan küçük ve basit birimlerden oluşmuş yüksek moleküllü maddelerdir. Aynı yapıya sahip organik moleküllerin birbiri ile kovalent bağlar ile birleşmesinden bir makromolekül meydana gelir (Hazar 1993). Böylece polimerlerin molekül ağırlığı basit maddelerin molekül ağırlığından yüz binlerce daha fazla olur. Kimyasal anlamda ise; polimerler çok sayıda aynı veya farklı grupların kimyasal bağlarla bağlanan, uzun zincirli bir yapıda olan, yüksek molekül ağırlıklı bileşikler olarak tanımlanır.
Polimerlerin endüstriyel uygulamasında ilk basamak doğal kauçuk, selüloz, nişasta v.s gibi doğal polimerik maddelerin kullanılmasıdır. Doğal polimerik maddelerin endüstriyel kullanımında ortaya çıkan sorunların başında hammaddenin işlenmesindeki zorluklar ve ürünlerin mekaniksel ve fiziksel özelliklerinin yetersiz olması sayılabilir. 1770’de Priestly’in kâğıt üzerindeki işaretleri sildiği için silgi (rubber) dediği doğal kauçuk, ancak 1939 yılında, İngiltere’de Macintosh ve Hanrack, Amerika’da Goodyear tarafından S ile vulkanize edilerek kullanışlı hale getirilebilir. Böylece, su geçirmez botlar, yağmurluklar, dayanıklı taşıma aracı lastikleri, vb. üretimine başlandı.
Amerikalı bilim adamı Leo Hendrick Buekeland, 1907’de tamamen sentetik ilk polimer olan fenol-formaldehit reçinelerin üretimini başarmıştır. Herman Staudinger’in 1924’de Makromolekül Hipotezi ileri sürmesiyle, polimer teknolojisi önemli bir ufuk kazandı. 1927’de selüloz asetat ve polivinil klorür, 1928’de polimetilmetaakrilat, 1929’da ilk defa üretilen polistiren ve sonraki yıllarda, özellikle II. Dünya Savaşında önem kazanan SBR sentetik kauçuğu (stiren-bütadien kopolimeri) polimer teknolojisinde önemli ürünler oluşturmuşlardır.
Günümüzde polimerler hayatımızın hemen her aşamasında sıkça kullanılmaktadır. Önceleri gündelik eşya yapımında ya da endüstride çok temel uygulamalarında kullanılan polimerler, bugün uzay teknolojisindeki araştırma-larından, biyotıp alanındaki yapay organ yapımına tarımsal alanda gübrelerin denetimli salınımlarında kullanımlarından, kontakt lens yapımına kadar değişen çok geniş bir aralıkta kullanılmaktadır.
Polimerler dünyada milyonlarca ton, ülkemizde ise iki milyon ton civarındaki üretimiyle önemli malzemeler arasında yer almaktadır. Üretilen çeşit ve günlük hayatımızın hemen her aşamasında karşılaştığımız ürünleriyle, ulaştıkları teknik ve ekonomik düzey gibi nedenler ile polimer işleme sektörü ülkemizde önemli sektörlerden biri haline gelmiştir.
Yapılan çalışmalarda daha çok yeni polimer türlerinin geliştirilmesi yerine, endüstri alanında kullanım alanları geniş olan polimerlerin fiziksel ve kimyasal yöntemlerle iyileştirilmesi, üretim maliyetini düşürülmesi ve işleme tekniklerin geliştirilmesi, kullanım alanlarının genişletilmesi yönünde hız kazandığı da gözlenmektedir.
Polimerler bir çok maddeler gibi moleküllerden ibarettir. Polimer maddeler kendilerini teşkil eden moleküllerin büyüklüğü ve molekül ağırlığı ile basit maddelerden farklanırlar. Mesela, polistiren olarak adlandırılan polimer, binlerce karbon ve hidrojen atomlarından ibarettir. Bu sebeple polimerin molekülüne makromolekül denir. Polimerlere, makromoleküller veya yüksek moleküllü birleşmeler; polimeri meydana getiren maddelere ise monomerler denir. Monomer maddeler genel olarak yapılarında çift bağ, üçlü bağ, iki veya daha fazla fonksiyonel grup bulundururlar. Bir maddenin polimer olabilmesi için binlerce monomerin birleşip, büyük molekül meydana getirmesi gerekir. O halde, polimer, tarif olarak, tekrarlanan küçük ve basit birimlerden oluşmuş büyük bir moleküldür. Bilindiği gibi poli ‘‘çok’’, makromolekül içerisinde tekrarlanan küçük birime ‘‘mer’’ denir. Polimer içinde tekrarlanan birim sayısına ‘‘Polimerleşme Derecesi’’ (Pn) adı verilir. Yani, polimerleşme derecesi ile kaç tane monomerin birleştiği belirtilir. Polimerin molekül ağırlığı; tekrarlanan birimin molekül ağılığı ile polimerleşme derecesinin çarpımından bulunabilir(Bağda1976). Polimerlerin adı, makromolekül-deki tekrarlanan birimleri meydana getiren monomerlerin başına ‘‘poli’’ sözü ilave etmekle okunur. Eğer makromolekül zinciri aynı birimlerden, yani aynı monomer birimlerinden teşkil olursa, böyle polimerlere ‘homopolimer’ denir. Mesela, polipropilen, polistiren birer homopolimerdir. Eğer makromolekül zinciri iki veya daha fazla monomer biriminden teşkil olursa, böyle polimerlere ‘kopolimer’ denir. Mesala, butadien-stiren kopolimeri, butadien-akrilonitril kopolimeri gibi.
CH2=CH CH3 CH2-CH n CH3 n propilen polipropilen (monomer) (polimer) 1.2.2Polistiren ve Özellikleri
Polistiren; yapısında benzen halkası bulunduran aromatik bir polimerdir. Polistirenin monomeri olan stiren, petrol rafinelerinde bazı ürünlerin krankinden ayrılan fraksiyonlardan veya sanayide etilbenzenin katalizör ortamında dehidrojenasyonu ile elde edilir. 1930 yılında monomeri olan stirenin sentezi ile beraber polistirende sanayide üretilmeye başlanmıştır. 1970’de polistiren ve onun kopolimerlerinden elde edilen plastikler, dünyada üretimi yapılan tüm plastiklerin %13’ü kadardır (3,3milyon ton). Isıya dayanıklılığına göre termoplastik bir polimer olan polistirenin üretiminin oldukça ucuz olması, bir çok metallerin ve diğerlerinin yerine polistiren plastiklerinin kullanılması ekonomik açıdan çok önemlidir. Bu sebeble plastiki polistirenin çeşitlerinin artırılması ve bu polimerlerin özelliklerinin iyileştirilmesi gerekmektedir. Polistiren, radikalik veya iyonik olmak üzere stirenin polimerleşmesinden elde edilir. Katyonik metotla stirenin polimerleşmesinden yalnız düşük molekül ağırlıklı polistirenler elde edilirken, radikalik metotla sentez edilen polistirenler amorf ve büyük molekül ağırlıklı olurlar. Stiren; kütle polimerizasyonu, çözelti polimerizasyonu, emülsiyon polimerizasyonu ve süspansiyon polimerizasyonu olmak üzere dört şekilde polimerleştirilebilir(Memmedov ve Zeynelova 1981). C H2-C H n n=5 00_5000 H C=C H2 n
Polistiren, stirenin polimerleşmesiyle elde edilen lineer bir polimerdir. Polistirenin monomeri olan stiren, etil benzenin katalizör ortamında
dehidrojenasyonu ile elde edilebilmektedir. Bunun için önce etil benzen, AlCl3 katalizörü ortamında benzenin etilen ile (2:1, 3:1 oranında benzen:etilen) 90-95°C’de alkilleşmesinden elde edilir.
CH2=CH2 AlCl3 CH
2CH3
+
90-95 C
Etil benzen daha sonra ZnO veya Fe2O3 katalizörleri ile 600-630°C’da stirene dönüştürülür. CH2CH3 Fe2O3 CH=CH2 .H2 600-630 O C +
Elde edilen stiren, sentezi esnasında oluşan divinilbenzenden vakum kolonlarında fraksiyonla ayrılır.
Stiren, 145 °C’de kaynayan bir sıvıdır. Depolanması sırasında kendi kendine polimerleşir. Bunu önlemek için az miktarda hidrokinon karıştırılarak depolanır (Kurbanova ve ark. 1996).
Polistiren, stirenin hem iyonik hem de radikalik polimerleşmesinden elde edilebilir. Katyonik metotla düşük molekül ağırlıklı polistirenler elde edilirken, radikalik metotla yüksek molekül ağırlıklı ve amorf polistirenler sentezlenir (Mehmedov ve Zeynolava 1981).
Stiren; kütle, çözelti, süspansiyon ve emülsiyon polimerleşmesi olarak dört farklı şekilde polimerleşebilir.
Kütle polimerizasyon metoduyla elde edilen polistirenin diğer metotlarla elde edilen polistirenlere göre nispeten daha temiz olur. Ancak reaksiyon sonucu temperatürün değişmesi (azalması ve artması) ile elde edilen üründe orta molekül ağırlığı az olur. Süspansiyon polimerizasyon metodunda kullanılan çözücüde, hem monomer hemde elde edilen polimer çözünmemelidir. Bu metotla elde edilen polistirenin özellikleri blok polimerleşme metodunda elde edilen polistirenin özelliklerine yakındır. Çözücüde polimerizasyon metodunda kullanılan çözücü hem
monomeri hemde polimeri iyi çözmelidir. Sonuçta elde edilen polistirenin, sıcaklığın her yerde aynı olmasından ve stirenin çözücü ile etkileşmesinin kolay olmasından bu metotla her elde edilen polistirenin orta molekül ağırlığı yüksek olur. Ancak meydana gelen polimeri çözücüden ayırmak oldukça zordur. Emülsiyon polimerizasyon metodunda; polistiren elde etmek için stiren, su, emülgatör ve başlatıcı (K2S2O8 veya H2O2) kullanılır. Emülsiyon polimerleşme metodunda elde edilen polistirenin molekül ağırlığı diğer metotlarla elde edilen polimerlerinkinden yüksek olur. Bahsedilen metotlarla elde edilen polistirenin ortalama molekül ağırlıkları 50.000-500.000 arasında değişmektedir.
Polistiren renksiz, şeffaf, suya dayanıklı olup, yüksek dielektrik özelliğine sahip olan inert, lineer bir polimerdir. Ticari polistiren, ataktik ve amorftur. Polistiren, yoğunluğu 1,05- 1,08 g/cm3 olan beyaz, amorf bir maddedir. Polistirene kolayca şekil verilebilir ve 80 -150 °C’de elastiki olur, 200 - 250 °C’de stirene ve diğer maddelere parçalanır. Polistiren, aromatik bileşiklerde, halojenli (en çok klorlu) hidrokarbonlarda, ketonlarda ve esterlerde kolay çözünür. Ancak alifatik hidrokarbonlarda, eterlerde, düşük molekül ağırlıklı hidrokarbonlarda çözünmez. Polistiren asit ve bazlara karşı dayanıklıdırlar. Polistirenin yüksek dielektrik özelliğine sahip olduğu için optik camlar ve optik cihazlar yapımında kullanılır. Polistirenin elektrik yalıtımının kuvvetli oluşu, üretim ucuzluğu, nem tutmaması, rutubetli ortamda elektriki özelliğini kaybetmemesi, şeffaflığı, kalıplanabilme özelliğinin iyi olması gibi artılarından dolayı kullanım alanı geniş bir plastik maddedir. Termoplastik olduğu için ısı ile kolay şekil verilebilir.
Polistirenin bu iyi özelliklerinin yanı sıra mekaniki dayanıklılığının az olması yani gevrek olması, sıcaklığa, atmosfere ve darbeye karşı dayanıklılığının az olması ve muhtelif substratlara adezyon kabiliyetinin olmaması gibi önemli eksiklikleri de vardır.
Polistirenin eksiklerinin giderilebilmesi için son yıllarda bazı özelliklerini geliştirmek maksadıyla onun aşı ve blok kopolimeri sentezlenmektedir. Ayrıca modifikasyon metoduyla polifonksiyonel polistiren plastiklerin elde edilmesi yönünde çalışmalara hız verilmiştir.
1.2.3 Polistirenin modifikasyonu
Polimerlerin özelliklerini iyileştirebilmek için kimyasal reaksiyonlar ile polimer moleküllerinde bazı değişiklikler yapılmaktadır. Bu tür değişikliklere modifikasyon adı verilir.
Polistirenin fiziksel ve kimyasal olmak üzere iki tür modifikasyonu vardır. Fiziksel modifikasyonda; polimer mekanik olarak karıştırılarak fiziki özellikleri artırılabilir. Fiziksel modifikasyon metodunda; polistirenin bazı kauçukları (reçinelerle); polibütadien, polibütadienstiren, polikloropren v.s mekanik olarak karıştırılır. Bu metotla elde edilen polistirenin elastikliği yüksek olup darbeye karşı dayanıklıdır.
Ancak polistirenle karıştırılmış kauçukta bulunan çift bağın varlığı dolayısıyla elde edilen ürünün atmosfere karşı dayanıklılığı azdır. Çift bağ atmosferik ortamda oksidasyona uğradığı için materyalin bozunması ve darbeye karşı dayanıklılığının azalmasına sebep olur. Ayrıca polistirenin fiziksel modifikasyon metodunda birbirine karışmayan iki fazlı sistem meydana gelir. Kauçuk çok küçük parçacıklar halinde polistiren fazına yayılmıştır. Bu fazlar arasında hiçbir kimyasal bağ olmadığı için fazlar arasında ilişki zayıf olur ve zamanla ortamdan ayrılarak materyalin özelliklerinin kötüleşmesine sebep olur. Polistirenin plastiklerinin yüksek fizikomekanik özelliklere sahip olması için bu fazlar arasında kimyasal bağlar olmalıdır(Braun 1970).
Kimyasal modifikasyon son yıllarda polifonksiyonel polimer materyallerinde olan ihtiyaç ile ilgili olarak sürekli gelişme göstermektedir(Losev 1971; Strepihiyev 1976; Phillip 1972; Kurbanova ve ark. 1974).
Polistiren, düşük molekül ağırlıklı bileşiklere göre çok daha az aktif bir bileşiktir ve reaksiyon kabiliyeti daha zayıftır. Ancak muayyen reaksiyon şartlarında polistiren, hem düz zincirinden yani alifatik karbon zincirinden hem de aromatik halkasından yer değiştirme reaksiyonu verir(Tonimoto, 1968). Fonksiyonel grup, katyonik katalizörler kullanıldığında polistirenin, aromatik halkasına, radikalik katalizör kullanıldığında ise polistirenin alifatik zincirine bağlanır.
Polistirenin aromatik halkasındaki reaksiyonlar, gün geçtikçe alifatik düz zincirdeki reaksiyonlara göre daha da artış göstermektedir. Polistirenin aromatik halkasının alifatik zincirine göre, daha fazla reaksiyona girmesinin sebebi polistirenin aromatik halkasındaki aktif fenil grubundan ileri gelmektedir. Polistirenin aromatik halkası birçok kimyasal reaksiyonlara mesela; sülfolama, sülfoklorlaşma, klorlaşma, nitrolaşma ve sonra aminleşme, açilleşme, alkilleşme, klorometilleşme, metalleşme, vs. girebilir.
Polistirenin kimyasal modifikasyon reaksiyonları; yani halojenleşme, nitrolama, metalleşme, sülfolama, açilleşme, alkilleşme reaksiyonları vs oldukça fazla incelenmiştir(Mets ve ark. 1971; Mackal 1963, Gonney ve ark. 1967; Mogna 1977; Gibson 1980; Swiger 1974; Kurbanova ve ark. 1983; Medaliz 1959, Beffor 1979).
Kurbanova ve arkadaşları (1983) polistirenin kimyasal modifikasyonu için araştırmalar yapmış ve katyonik katalizörlü ortamda molekül ağırlığı 500.000 olan emülsiyon olan polistirenlerin; alkilleşme, açilleşme, alkenilleşme reaksiyonlarını incelemiştir. Kurbanova ve arkadaşları emülsiyon polimerizasyonla elde ettikleri polistireni çeşitli monomerlerle etkileştirmişler ve değişik fonksiyonel gruplu polistirenler sentezlemişlerdir. Oluşan üründeki fonksiyonel grupların polistirene; muhtelif substratlara karşı adhezyon kabiliyeti, darbeye karşı dayanıklılık, ışığa hassaslık gibi yeni özellikler kazandırdıklarını tespit etmişlerdir.
(CH2 CH) (CH2 CH) (CH2 CH) (CH2 CH) (CH2 CH) (CH2 CH) (CH2 CH) (CH2 CH) CH CH2 R=H; CH3 CH2 CH CH2 (III) C C CH3 CH3 CO CH3 O O O Ib Ia (I) R = = CH2 C CH CH2 O ClCH2 CH CH2 NaOH O OH CH2 CH CH2Cl m n m n m n ) ( R k CH2 C CH CH2 n m (II)
Polimerlerin, organik anhidritlerle radikalik ve katyonik katalizörler ortamında kimyasal modifikasyonu ile adhezyon kabiliyeti kazandıkları görülmektedir. Polimerlerin kimyasal modifikasyonu ile elde edilen alkilleme ve açilleme ürünleri ışığa hassaslık özelliği kazanmışlardır. Ayrıca fonksiyonel grupların bağlanması ile polimerlerin sıcaklığa ve korozyona karşı dayanıklılıklarının artması da kullanım alanlarını genişletmektedir. Yapılan birçok çalışmada, kimyasal modifikasyonla elde edilmiş modifiye polistirenin, polistirenden farklı olarak yüksek fizikomekanik özelliklere, darbeye karşı dayanıklılığa, nisbi uzamaya, ayrıca termik özelliklere sahip olduğu tespit edilmiştir(Venwo ve ark. 1977, Swiger1975).
Polistirenin aromatik halkasında yapılan kimyasal modifikasyon reaksiyonlarından nitrolama, sülfolama, halojenleme gibi reaksiyonları aşağıda görülmektedir.
C H C H2 -H N O3 S O3 S O3H C H C H2 C H C H2 C lC H2O C H3 Z n C l2 C H2C l C H C H2 R C O C l A lC l3 C H C H2 C O R C l2 C H C H2 C l H N O3; I2 H2S O4 C H C H2 I C 4H 9Li C H C H2 L i N O2 (CH CH2) C NOH NH2OHHCI R
Yukarıdaki reaksiyonlarda görüldüğü gibi polistirenden iyot ve iyodat asidi ile H2SO4 katalizörlüğünde iyotstiren sentezlenir ve ondan da poli-p-lityumstiren sentezlenmektedir. Polistirenin birçok türevleri poli-p-poli-p-lityumstirenden sentezlenmektedir. Zira, poli-p-lityumstiren büyük molekül ağırlıklı metal organik bir bileşiktir ve reaksiyon kabiliyetine göre düşük molekül ağırlıklı metal organik bileşiklere benzer özellikler göstermektedir(Braun 1959).
Yukarıdaki reaksiyonlardan görüldüğü gibi, poli-p-lityumstirenin hidrolizinden polistiren, dimetilformamit ile reaksiyonundan poli-p-formalstiren, nitrillerle reaksiyonundan ise polimer ketonlar elde edilir ki, bunları aynı zamanda Friedel-Crafts reaksiyonu ile polistirenden sentezlemek mümkündür. Elementel kükürtle, poli-p-lityumstirenin etkileşmesinden poli-p-merkaptostiren elde edilir ki, bu polimer elektron değiştirici reçine olarak kullanılabilir. Karbonil grubu ihtiva eden bileşiklerle etkileştirildiğinde sekonder ve tersiyer alkolleri meydana getirir. Poli-p-lityumstiren’in bazı reaksiyonları yukarıda gösterilmektedir(Frect ve ark. 1979, Braun 1959, George 1972, Hartmon 1977).
C H -C H 2 Li C H 2=C -C H =C H 2 C H 3 C H - C H 2 ( C H 2- C =C H - C H 3 )x C H 3 C H - C H 2 C H 2- C H -C H 2 O Cl-CH - C H -C H 2 2 O C H -C H 2 C =O R C H -C H 2 C H O C H -C H 2 S ( C H 3) 2N C H O R - C O C I C H - C H2 SH C H -C H 2 P H 5C 6 C 6H 5 (C 6 H 5)2P C I C H -C H 2 C O -N H -R R N C O C H - C H2 C - O H R R ' R R ' C O . H 2O x=3-5
2. KAYNAK ARAŞTIRMASI
2.1. Literatür Özetleri
Uçan ve Mirzaoğlu (1990), asetofenondan çıkarak önce izonitroso-asetofenonu, sonra bu bileşiğin hidroksilaminhidroklorür ile reaksiyonundan anti-fenilglioksimi sentezlemişlerdir. Bu bileşiği klorlayarak anti-kloroanti-fenilglioksimi ve bunun çeşitli aminler ile reaksiyonlarından da sübstitüe amin türevlerini sentezlemişlerdir. Ayrıca elde edilen ligandların bazı geçiş metalleri ile olan kompleksleri izole edilerek, maddelerin özelliklerini incelemişlerdir.
Chakravorty (1974), yapmış olduğu çalışmada dioksimler, keto oksimler, aminooksimler ve bunların türevleri ile çeşitli metal kompleksleri hakkında geniş ve kapsamlı bilgi verilmiştir.
Mahmut Ali Deveci (1994), “İminooksim Eldesi ve Onları Bazı Geçiş Elementleri ile Metal Kompleks Yapılarının İncelenmesi” isimli doktora tezinde yedi adet ligand sentezlemiş ve ligandların metal komplekslerini izole etmiştir. Ayrıca bu tezde oksim bileşiklerinin eldesi, reaksiyonları ve kompleksleri ile azometin bileşikleri hakkında geniş bir bilgi mevcuttur.
Memmedov ve Zeynelova (1981), polistiren, radikalik veya iyonik olmak üzere stirenin polimerleşmesinden elde edilmiştir. Polimerleşme prosesi: kütle,
çözelti, emülsiyon veya süspansiyon polimerleşme metodlarıyla yapılmıştır. Braun (1959) polistirenden iyot ve iyodat asidi ile H2SO4 katalizörlüğünde
poli-p-iyotstiren sentezlenir ve ondan da poli-p-lityumstiren sentezlenmektedir. Polistirenin birçok türevleri lityumstirenden sentezlenmektedir. Zira, poli-p-lityumstiren büyük molekül ağırlıklı metal organik bir bileşiktir ve reaksiyon kabiliyetine göre düşük molekül ağırlıklı metal organik bileşiklere benzer özellikler göstermektedir.
Poli-p-lityumstirenin birçok reaktif ile reaksiyonundan (sayfa 21’de gösterilmiştir) çeşitli bileşikler elde edilmektedir(Frect ve ark. 1979, Braun 1959, George 1972, Hartmon 1977).
2.2. Çalışmanın Amacı
Çalışmamızda ilk olarak mono- oksimleri elde ettik. Elde ettiğimiz bu mono- oksimden vic- oksimleri elde ettik. Elde edilen bu mono- ve vic- oksim bileşiklerini klorladık ve p-brompolistiren ile olan reaksiyonunu gerçekleştirdik. Reaksiyon sonucunda ketooksimpolistirenler ve vic- oksimpolistiren ürünleri oluştu.
Bu çalışma, oksimlerin eldesi ve elde edilen oksimlerin p-brompolistiren ile reaksiyonu sonucu oluşan polimerler olmak üzere iki bölüm olarak değerlendirebiliriz. Elde edilen polimerlerin adhezyon kuvveti ve korozyon kuvvetleri incelenmiştir. Elde edilen polimerlerin mono- oksimpolistiren ve vic- oksimpolistiren arasındaki fark incelenmiştir.
3. MATERYAL VE METOT
3.1 Kullanılan Kimyasal Maddeler
Deneylerde; İsopentilnitrit, butillityumheptan ve brompolistiren Fluka firmasından temin edildi.
Na metali, asetofenon, hidroksilamin hidrojenklorür, potasyum permanganat, kloroform, tetrahidrofuran, etanol, dimetilformamit, hegzan ve hidroklorik asit Merck firmasından temin edildi.
Bu malzemelerin yanı sıra kullanılan diğer reaktifler, çözücü, çöktürücü ve cam malzemeler Selçuk Üniversitesi Fen-Edebiyat Fakültesi Organik Kimya Araştırma Laboratuar’ından temin edilmiştir.
3.2 Deneylerde Kullanılan Cihaz ve Aletler
FT-IR Spektrofotometresi: Perkin Elmer Model 1605; S.Ü. Fen Edebiyat Fakültesi Kimya Bölümü-KONYA
Elementel Analiz: LECO CHNS 932 cihazında (TÜBİTAK-Enstrumental Analiz Laboratuarı-Beşevler/ANKARA )
1
H-NMR Spektrometresi: Bruker 400 MHz (TÜBİTAK-Enstrumental Analiz Laboratuarı-Beşevler/ANKARA)
4. DENEYSEL KISIM 4.1. İsonitrosoasetofenon sentezi C O CH3 n-C4H9ONO/C2H5ONa C O C NOH H -5 Co
Bu madde literatüre göre asetofenondan çıkılarak bazik ortamda bütilnitrit ile sentezlenmiştir(Burakevich 1971, Uçan, 1990).
2.03 g (88 mmol) sodyum metali 100 ml mutlak etanolde çözülür. Üzerine sıcaklık -5 OC ’yi geçmeyecek şekilde dışarıdan soğutulup karıştırılarak 9 mL (88
mmol) bütilnitrit damla damla 20-30 dakikada ilave edilir. Karıştırmaya 15-20
dakika daha devam ettikten sonra üzerine aynı sıcaklıkta karıştırılarak 12 mL (77
mmol) asetofenon 20-30 dakikada damlatılır. Bu karışım oda sıcaklığına gelinceye kadar karıştırmaya devam edilir. Bir gün dinlenmeye bırakılarak oluşan sarı-kırmızı kristaller süzülür, eterle birkaç defa yıkanır, asgari miktarda su ile çözülür. Çözelti asetik asitten asitlendirilir, oluşan çökelti süzülüp su ile birkaç defa yıkanarak etanol-
su (1/2) karışımından kristallendirilir.
Verim: 7.5 g ( % 65), e.n:129 OC (bozunma) (Lit: 128 oC).
4.1.a İsonitrosoasetofenon Klorlanması
Cl Cl2/hv C C O H C C O 40-45 C0 NOH + NOH
Bu madde literatüre göre sentezlenmiştir(H. Rheinboldt und O.Schmitz-Dumont, 1925). 4 gram isonitrosoasetofenon kloroform içinde süspansiyon haline getirilerek yarım saat güneş ışığı altında kuru Cl2 gazı geçirilir. Yavaş yavaş
isonitrosoasetofenon kirli beyaz renge döner, sonra UV ışığı (254nm) altında Cl2 gazı
karışım tamamen beyazlaşarak çökelti halinde kabın dibinde toplanır. Klorlama tamamlanınca karışım soğutulur, çeker ocakta 1 saat bekletilerek klorun fazlası
uzaklaştırılır. Çökelti süzülüp birkaç defa kloroform ve su ile yıkanır ve etanol-su
karışımından kristallendirilir.
Verim: 6,60 gr. (%60), e.n: 130-132 0C (Lit:132–133 0C)
4.2. anti- Fenilglioksim’in Sentezi
C C O N H C N C H NH2OH.HCl CH3COONa NOH + OH OH
anti-Fenilglioksim, literatürlerde belirtildiği gibi sentezlenmiştir(Burakevich ve ark.1971, Uçan ve Mirzaoğlu 1990).
4 g isonitrosoasetofenon etil alkolde çözülür ve stokiyometrik orandan % 20 fazla NH2OH.HCl ve sodyum asetat 50 ml etanol-su (2/1) karışımında çözülmüş olan
karışıma ilave edilir ve 4,5 saat geri soğutucu altında kaynatılır. Sonra sıcak karışım
bir behere dökülerek bekletilir. Oluşan kristaller süzülerek su ile kristallendirilir.
Verim: 3,3 gram (%75), e.n. 166-168 0C (bozunma) (Lit. 166-168 0C)
4.2.a. anti-Klorofenilglioksim’in Sentezi
N C N C Cl N C N C H Cl2/hv OH OH OH OH 40-45 C0
Bu madde literatüre göre sentezlenmiştir(Uçan and Karataş, 1993). 4 gram fenilglioksim kloroform içinde süspansiyon haline getirilerek yarım saat güneş ışığı
altında kuru Cl2 gazı geçirilir. Yavaş yavaş fenilglioksim kirli beyaz renge döner,
sonra UV ışığı (254nm) altında Cl2 gazı geçirilmeye 1 saat daha devam edilir.
Karışımın sıcaklığı 40–50 0C civarına gelir ve karışım tamamen beyazlaşarak çökelti halinde kabın dibinde toplanır. Klorlama tamamlanınca karışım soğutulur, çeker ocakta 1 saat bekletilerek klorun fazlası uzaklaştırılır. Çökelti süzülüp birkaç defa
kloroform ve su ile yıkanır ve etanol-su karışımından kristallendirilir.
Verim: 3,60 gr. (%70), e.n. 193–195 0C (bozunma) (Lit:195–196 0C)
4.3. İzonitroso-1-asetilnaftalin sentezi: C O CH3 n-C4H9ONO/C2H5ONa C O C NOH H -5 oC
Bu madde literatüre uyarlanarak, 1-asetilnaftalinden çıkarak bazik ortamda bütilnitrit ile sentezlenmiştir(Uçan and Karataş, 1993).
2.03 g (88 mmol) sodyum metali 100 ml mutlak etanolde çözülür. Üzerine sıcaklık -5 OC ’yi geçmeyecek şekilde dışarıdan soğutulup karıştırılarak 9 mL (88
mmol) bütilnitrit damla damla 20-30 dakikada ilave edilir ve 15-20 dakika daha karıştırıldıktan sonra üzerine aynı sıcaklıkta karıştırılarak 12 mL (77 mmol)
1-asetilnaftalin 20-30 dakikada damlatılır. Bu karışım oda sıcaklığına gelinceye kadar
karıştırmaya devam edilir. Bir gün dinlenmeye bırakılarak oluşan sarı-kırmızı kristaller süzülür, eterle birkaç defa yıkanır, asgari miktarda su ile çözülür. Çözelti asetik asitten asitlendirilir, oluşan çökelti süzülüp su ile birkaç defa yıkanarak etanol- su (1/2) karışımından kristallendirilir.
4.3.a. İzonitroso-1-asetilnaftalin’in Klorlanması O C C NOH H Cl 0 Cl2/hv O C C NOH 40-45 C
Bu madde literatüre uyarlanarak sentezlenmiştir(Pekacar A.İ. 2003). 4 gram
izonitroso-1-asetilnaftalin kloroform içinde süspansiyon haline getirilerek yarım saat güneş ışığı altında kuru Cl2 gazı geçirilir. Yavaş yavaş izonitroso-1-asetilnaftalin kirli
beyaz renge döner, sonra UV (254 nm) ışığı altında Cl2 gazı geçirilmeye 1 saat daha
devam edilir. Karışımın sıcaklığı 40–50 0C civarına gelir ve karışım tamamen beyazlaşarak çökelti halinde kabın dibinde toplanır. Klorlama tamamlanınca karışım soğutulur, çeker ocakta 1 saat bekletilerek klorun fazlası uzaklaştırılır. Çökelti
süzülüp birkaç defa kloroform ve su ile yıkanır ve etanol-su karışımından
kristallendirilir. Verim: 3,75 ( % 80); e.n: 127-128 0C 4.4. l-Naftilglioksim Sentezi N N OH C H O C C NOH H C OH CH3COONa NH2OH.HCl +
(Pekacar A.İ. 2003) l-Naftilglioksimin sentezi, anti-fenilglioksimin sentezine
stokiyometrik orandan %20 fazla NH2OH.HCl ve sodyum asetat 50 ml etanol-su
(2/1) karışımında çözülerek ilave edilir ve 4,5 saat geri soğutucu altında kaynatılır.
Sıcak karışım bir behere dökülerek bekletilir. Oluşan kristaller süzülerek, su ile
kristallendirilir. Verim: 2,42 (%52), e.n: 135–136 0C
4.4.a. l-NaftilglioksiminKlorlanması
N N OH C H C O H N N OH C C O H Cl 0 Cl2/hv 40-45 C
Bu madde literatüre göre sentezlenmiştir(Uçan and Karataş, 1993). 4 gram
l-naftilglioksim kloroform içinde süspansiyon haline getirilerek yarım saat güneş ışığı altında kuru Cl2 gazı geçirilir. Yavaş yavaş l-naftilglioksim kirli beyaz renge döner,
sonra UV (254nm) ışığı altında Cl2 gazı geçirilmeye 1 saat daha devam edilir.
Karışımın sıcaklığı 40–50 0C civarına gelir ve karışım tamamen beyazlaşarak çökelti
halinde kabın dibinde toplanır. Klorlama tamamlanınca karışım soğutulur, çeker
ocakta 1 saat bekletilerek klorun fazlası uzaklaştırılır. Çökelti süzülüp birkaç defa kloroform ve su ile yıkanır ve etanol-su karışımından kristallendirilir.
Verim: % 73 e.n: 198-200 0C 4.5. Metilglioksimin Sentezi C C O N H N C H C CH3 CH3 CH3COONa NH2OH.HCl NOH OH OH +
Metilglioksimin sentezi mevcut literatüre sentezlenmiştir(Uçan, 1993). 4 gram püriviraldehit–1-oksim ve stokiyometrik orandan %20 fazla NH2OH.HCl ve
sodyum asetat alınıp, 50 ml etanol-su (2/1) karışımında çözülerek ilave edilir ve 4,5
saat geri soğutucu altında kaynatılır. Sıcak karışım bir behere dökülerek bekletilir.
Oluşan kristaller süzülerek su ile yıkanır. Verim: % 65 e.n: 154-155 0C
4.5.a. Metilglioksimin Klorlanması
N N C C CH3 N H N C C CH3 Cl Cl2/hv OH OH OH OH 40-45 C0
Bu madde literatüre göre sentezlenmiştir(G. Hesse und G. Krehbiel, 1955). Bunun için 4 g metilglioksimin kloroform içinde süspansiyon haline getirilerek yarım saat güneş ışığı altında kuru Cl2 gazı geçirilir. Yavaş yavaş metilglioksimin kirli beyaz renge döner, sonra UV ışığı (254nm) altında Cl2 gazı geçirilmeye 1 saat daha devam edilir. Karışımın sıcaklığı 40-50 0C civarına gelir ve karışım tamamen beyazlaşarak çökelti halinde kabın dibinde toplanır. Klorlama tamamlanınca karışım soğutulur, çeker ocakta 1 saat bekletilerek klorun fazlası uzaklaştırılır. Çökelti süzülüp birkaç defa kloroform ve su ile yıkanır ve etanol-su karışımından kristallendirilir. Verim: % 68 e.n: 181-182 0C 4.6. amphi-Kloroglioksim’in Sentezi
CCl
3HC(OH)
2NH
2OH
C
Cl-C=N
H-C=N
OH
OH
+
05
3
Bu bileşiğin sentezi literatürde verilen şekilde yapılmıştır (Britzinger ve Titzmann 1952, Grundmann 1965). 0,3 mol kloralhidrat, 0,45 mol Na2CO3 ve 0,9 mol NH2OH.HCl’in 70 ml sudaki çözeltisine ilave edilerek, bir gece kendi halinde bekletilir. Derişik çözeltide tabakalar halinde oluşan kristalimsi madde -10 0C’ye soğutularak, 54 gr NaOH’ın 100 ml sudaki çözeltisi, soğutulan karışıma temperatür -5 0C’yi geçmeyecek şekilde damla damla ilave edilir. Soğuk karışıma 32 ml % 98’lik H2SO4 damla damla ilave edildiğinde pH 3,5 civarında renksiz bir lapa oluşur. Lapa nuçeden soğukken süzülerek kurutulur, eter ile ekstrakte edilerek amphi kloroglioksim eter fazına alınır. Eter buharlaştırıldığında
iğnecikler halinde renksiz kristaller oluşur. 60 0C civarında sudan kristallendirilir. Verim: 25 gr (% 68), e.n. 150 0C (bozunma) (Lit: 150oC)
4.7. Oksim Gruplu Polistiren Sentezi (Genel Metot)
1 g p-brompolistiren (% 20,8 Br) 100 ml susuz tetrahidrofuranda çözülerek üzerine 2,5 N butillityumhegzan çözeltisi - 40 0C’de ilave edildi. Sonra yarım saat karıştırıldı. Daha sonra üzerine yavaş yavaş klorlu oksim bileşiği (kloroisonitrosoasetofenon, klorofenilglioksim, kloroisonitroso-α-asetilnaftalin, kloro-α-naftilglioksim, klorometilglioksim ve anti-kloroglioksim) ilave edildi (bağlanan butillityum miktarına göre 1/1 oranında) ve 10 dakika daha karıştırıldı. Karıştırma işleminden sonra yavaş yavaş oda sıcaklığına getirildi. Reaksiyon karışımına hegzan ilave edilerek çöktürme işlemi gerçekleştirildi. Çöken kısım süzülerek alındı ve vakumda kurutuldu.
Verimleri % 75–85 arasında olup, erime noktaları genel olarak 310 0C’ nin üzerindedir(USA patent no: 3234196; Yıl:1966).
Elde edilen oksim gruplu polistirenlerin oluşumu ve formülleri aşağıda gösterilmiştir.
CH-CH2 Br n CH CH2 m C4H9Li/THF CH-CH2 n CH CH2 m Li ( I )
Bu reaksiyona göre oluşan p-lityumpolistiren bileşiği ile klorlu oksim bileşikleri reaksiyona sokularak aşağıdaki oksim gruplu polistirenler elde edilmiştir. C O C Cl NOH CH-CH2 C=N n C=O OH CH CH2 m I + (PS-PKO) C N C N OH OH Cl CH-CH2 C=N n C=N OH CH CH2 m I OH + (PS-PGO)
Cl C O CH-CH2 n CH CH2 m C NOH I O NOH C C + (PS-NKO) N N OH C C OH Cl CH CH2 m CH-CH2 C=N n C=N OH OH I + (PS-NGO) CH CH2 m CH-CH2 C=N n C=N OH OH C H3 N N C C CH3 Cl I + OH OH (PS-MGO)
CH CH2 m CH-CH2 C=N n C=N OH OH H Cl-C=N H-C=N OH OH I + (PS-GO)
4.8. Oksim Gruplu Polistirenlerin Adhezyon Kabiliyetleri
Elde edilen altı adet oksim gruplu polimerlerin, metaller üzerine adhezyon kabiliyeti incelenmiştir. Bu amaçla polimerlerin susuz DMSO’da % 50’lik çözeltileri hazırlandı. Bu çözeltilerin her birinden metallerin yüzeyi ince tabakalar halinde kaplandı. Metal yüzeyi oda sıcaklığında kuruduktan sonra 60 0C’de 1-2 saat süreyle etüvde kurutuldu. Kurutulan metal üzerindeki tabakaların adhezyon kabiliyeti karelere bölünme metodu ile tayin edildi. Metal yüzeyini ince tabakalar halinde kaplamış olan oksim polimerleri jiletle küçük karelere (0,5 cm2) bölündü. Bu işlemden sonra yapışkanlığı kuvvetli bir bant, metal üzerindeki karelere bölünmüş polimer maddelerin üzerine yapıştırıldı ve birkaç dakika sonra kuvvetle çekildi. Bant çekildikten sonra metal yüzeyinde kalan ve bant üzerine yapışan maddeden % adhezyon kabiliyeti bulundu. Elde edilen sonuçlar Tartışma ve Sonuçlar kısmında Tablo 3 olarak verilmiştir.
4.9. Oksim Gruplu Polistirenlerin Korozyon Özellikleri
Elde edilen oksim gruplu polimerlerin kaplama özelliklerinden korozyona karşı dayanıklılıkları değişik şartlarda (%3 NaCl, %10 NaOH, % 10 H2SO4, H2O) incelendi. Kaplanan metal plakalar, hazırlanan %3 NaCl, %30 NaOH, % 10 H2SO4,
H2O çözeltilerine daldırıldı. Gözlenen bozulmalar, yani sonuçlar Tartışma ve Sonuçlar kısmında tablo 3’te verilmiştir.
4.10. Oksim Gruplu Polistirenlerin TGA Analizleri
Termogravimetrik analiz metodu ile ağırlık kaybı TGA’da N2 gazı ortamında, 30-800 0C sıcaklık aralığında, 10 0C/dakika ısıtma hızında ölçülerek belirlenmiştir. Fakat ilk iki örnek 30-600 0C ve 5 0C/dakika olarak analizi yapılmıştır. Analizlerde genel olarak; 30-150 0C arası nemden kaynaklanan kayıptır. 150-350 0C arası O2, N2, C=NOH gibi maddelerden kaynaklan kayıptır. 350–450 0C arası ise CO ve (-CH-CH2-)‘den kaynaklan kayıptır. 450 0C’den sonraki sıcaklarda ise benzen, naftalin ve reaksiyon kabında kalan diğer maddeler ayrılır.
5. TARTIŞMA VE SONUÇ
Bu çalışmada ilk olarak p-lityumpolistiren ile reaksiyona girecek olan oksim bileşikleri sentezlendi. Bu amaçla ilk olarak asetofenondan çıkılarak literatür bilgileri ışığında sırasıyla isonitrosoasetofenon, fenilglioksim, kloroisonitrosoasetofenon ve klorofenilglioksim elde edildi(Burakevich 1971, Uçan 1990, Uçan 1993). Yine benzer şekilde 1-asetilnaftalinden, α-isonitroso-asetilnaftalin, α-naftilglioksim (Pekacar, 2003) ile isonitrosopuriviraldehitten metilglioksim(Uçan, 1993) ve bunların klorlanmasıyla oksim klorürleri elde edildi. Ayrıca kloralhidrat ve hidroksilamin hidroklorürlerden anti-kloroglioksim sentezlendi. Yapılan bu çalışmalarda elde edilen maddelerin erime noktaları literatür bilgileri ile uyum halindedir.
Elde edilen oksim klorürleri, p-brompolistiren ve n-butillityum ile tetrahidrofuran çözücülüğünde reaksiyona sokuldu ve oksim gruplu polistirenler elde edildi. Bu reaksiyonda önce p-brompolistirendeki brom ile n-butillityumun lityumu yer değiştirir ve p-lityum polistiren oluşur ki, buda klorlu oksimler ile daha kolay reaksiyona girer.
Sentezlenen bileşiklerin element analizleri yapılarak reaksiyonların ilerleyişi takip edildi. Özellikle p-brompolistirende % 20 olarak bulunan brom miktarı, oksim gruplu polistirenlerde brom (elektrot yardımı ile ölçüldü) % 70–75 oranında azalmış olduğu tespit edildi ki, bu da klorlu oksimlerin p-brompolistiren ile reaksiyon verdiğini gösterir. Yapılan ölçümlerde p-brompolistirende bağlanmadan kalan brom miktarı % 5-6 olarak bulunmuştur.
Elde edilen oksim gruplu polistirenlerin çözünürlüklerinin çok az olması dolayısıyla H-NMR pikleri alınamadı.
Tablo 1: Sentezlenen Bileşiklerin Elementel Analiz Sonuçları % Hesaplanan (%Bulunan) Bileşikler C H N PS-PKO 86.00 (84.56) 6.74 (6.20) 2.09 (2.32) PS-PGO 84.46 (83.80) 6.75 (6.90) 4.11 (3.95) PS-NKO 86.78 (86.91) 6.54 (5.81) 1.95 (2.00) PS-NGO 85.01 (86.07) 6.54 (6.33) 3.82 (3.79) PS-MGO 83.23 (82.28) 7.09 (6.82) 4.51 (4.72) PS-GO 83.17 (81.46) 6.93 (6.54) 4.62 (4.23)
Elde edilen oksim gruplu polistirenler ile p-brompolistirenin FT-IR değerleri karşılaştırıldığında; C-Br bağı p-brompolistiren 520 cm-1 de gözükürken, sentezlenen oksimpolimerlerde ise azaldığı veya tamamen ortadan kalkması reaksiyonun gerçekleştiğini göstermektedir. Ayrıca p-brompolistirende gözükmeyen veya yayvan olarak gözüken OH piki (nemden dolayı), elde edilen oksim gruplu polimerde bulunan OH piklerinin 3200-3370 cm-1 civarında keskin bir şekilde ortaya çıkması yine reaksiyonun olduğunu gösterir. Yine p-brompolistiren 1445-1485 cm-1 civarındaki aromatik C=C bağı pikinin elde edilen ürünlerde değişikliğe uğraması (1550 cm-1) ve 1595 cm-1 civarında pikin ortaya çıkması, oksim grubundaki C=N varlığını göstermektedir.
Tablo 2: Sentezlenen Bileşiklerin IR Değerleri (cm-1)
Sentezlenen
Bileşikler ν (OH) ν (C=O) ν (C=N) ν (C=C)arm ν (NO)
PS-PKO 3191 1740 1597 1554 860 PS-PGO 3334 - 1597 1554 860 PS-NKO 3366 1740 1597 1553 860 PS-NGO 3365 - 1597 1554 859 PS-MGO 3366 - 1598 1552 860 PS-GO 3365 - 1597 1552 860
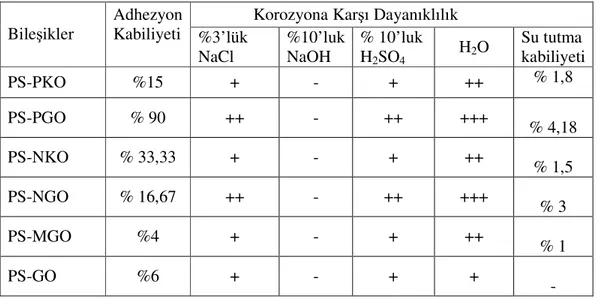
Elde edilen polimerlerin adhezyon ve korozyon kabiliyetleri incelendi. Yapılan gözlemlerde adhezyon kabiliyeti en yüksek olan bileşik PS-PGO bulundu. Bunun sebebi muhtemelen iki oksim grubu ile beraber fenil halkasının л elektronları vasıtasıyla olduğu düşünülmektedir. Aynı özellikte PS-NGO’da da beklenirken onun düşük olmasının sebebi muhtemelen yapının büyük olmasından dolayı metal yüzeyi ile etkileşimi engellemektedir. Bu polimerlerin korozyon özellikleri ise %3 NaCl, % 10 NaOH, % 10 H2SO4 ve saf su içerisinde incelendi. Bu bileşikler genel olarak % 3’lük NaCl ve %10’luk H2SO4 çözeltilerine karşı dayanıklıdırlar. Özellikle PS-PGO ve PS-NGO 300 saat civarında dayanıklılık göstermişlerdir. % 10’luk NaOH çözeltisine karşı hiçbir bileşik dayanıklılık göstermemiştir. Çünkü bu bileşiklerdeki oksim bileşikleri ile baz arasında kolaylıkla asit-baz reaksiyonu gerçekleşerek oksim tuzu oluşmaktadır. Elde edilen polimer levhalarının saf su içerisindeki şişme özellikleri incelendiğinde suya karşı en dayanıklı olan PS-PGO’dur ( 950 saat ). Diğer polimerlerden ise PS-NGO yine yüksek bir dayanma gücüne sahiptir (300 saat civarı). Diğer polimerlerde ise en fazla 20 saate kadar bir dayanma gözlendi. Bunlardaki dayanıksızlık şişme, polimer yüzeyindeki delinme gibi nedenler kendini gösterdi. Elde edilen polimerlerin adhezyon kabiliyetleri incelendi.
Tablo 3: Sentezlenen Bileşiklerin Adhezyon ve Korozyona Karşı dayanıklılıkları
TGA Analiz Sonuçlarının Değerlendirilmesi
Elde edilen oksim gruplu polimerlerin TGA (termal gravimetrik analiz) analizleri yapılarak, sonuçlarının değerlendirilmesi aşağıda verilmiştir.
Polimer: PS-PKO
30-115 0C arası (teorik olarak % 7,17) deneysel olarak % 7,10’luk kütle kaybı muhtemelen maddenin adsorblamış olduğu nemden kaynaklanmaktadır. 115-325 0C arası deneysel olarak % 11,00 (teorik olarak % 11,16’ya) tekabül eden gaz bozunma ürünü olan N2 gazı reaksiyon kabından ayrılmıştır. 325-448 0C aralığında gaz bozunma ürünlerinden CO ve –(-CH-CH2-)- grupları reaksiyon kabında (teorik olarak % 43,82) deneysel olarak % 42,68’lik kütle kaybı gerçekleşmiştir. Reaksiyon kabında kalan diğer maddeler de sıcaklıkla orantılı olarak reaksiyon kabından uzaklaşmaya devam etmektedir. 448 0C’ye kadar maddenin teorik olarak % 62,15’i deneysel olarak ise % 60,78’i reaksiyon kabından uzaklaşmıştır
Korozyona Karşı Dayanıklılık Bileşikler Adhezyon Kabiliyeti %3’lük NaCl %10’luk NaOH % 10’luk H2SO4 H2O Su tutma kabiliyeti PS-PKO %15 + - + ++ % 1,8 PS-PGO % 90 ++ - ++ +++ % 4,18 PS-NKO % 33,33 + - + ++ % 1,5 PS-NGO % 16,67 ++ - ++ +++ % 3 PS-MGO %4 + - + ++ % 1 PS-GO %6 + - + + -
Polimer: PS-PGO
30-116 0C arası (teorik olarak % 20,00) deneysel olarak % 18,75’lik kütle kaybı muhtemelen nemden kaynaklanmaktadır. 116-200 0C arası deneysel olarak % 12,50 (teorik olarak % 12,03’e) tekabül eden gaz bozunma ürünü olan O2 gazı reaksiyon kabından ayrılmıştır. 200-314 0C arası (teorik olarak % 10,53) deneysel olarak % 10,64’lük kütle kaybı muhtemelen N2 gazından kaynaklanmaktadır. Reaksiyon kabında kalan –(-CH-CH2-)- vedifenil etan da sıcaklıkla orantılı olarak reaksiyon kabından uzaklaşmaya devam etmektedir. 314 0C’ye kadar maddenin teorik olarak % 42,56’sı deneysel olarak ise % 41,89’u reaksiyon kabından uzaklaşmıştır.
Polimer: PS-NKO
30-120 0C arası (teorik olarak % 23,92’lik) deneysel olarak % 23,75’lik kütle kaybı muhtemelen nemden kaynaklanmaktadır. 120-244 0C arası deneysel olarak % 8,83 (teorik olarak % 9,30’a) tekabül eden gaz bozunma ürünü olan N2 gazı reaksiyon kabından ayrılmıştır. 244-450 0C arası (teorik olarak % 16,00) deneysel olarak % 16,60‘luk kütle kaybı muhtemelen O2 gazından kaynaklanmaktadır. Reaksiyon kabında –(-CH-CH2-)- ve fenilnaftil etan kalmış ve 800 0C'ye kadar kütle kaybı devam etmektedir. 450 0C’ye kadar maddenin teorik olarak % 52’si deneysel olarak ise % 49,18’i reaksiyon kabından uzaklaşmıştır.
Polimer: PS-NGO
30-150 0C arası (teorik olarak % 22,78’lik) deneysel olarak %21,55’lik kütle kaybı muhtemelen nemden kaynaklanmaktadır. 150-390 0C arası deneysel olarak % 28,45’e (teorik olarak % 27,00) tekabül eden gaz bozunma ürünü olan (-C=NOH) madde reaksiyon kabından ayrılmıştır. Reaksiyon kabında son olarak naftalin ve benzen kalmıştır. 390 0C’ye kadar maddenin teorik olarak % 49,78’i deneysel olarak ise % 50,00’ı reaksiyon kabından uzaklaşmıştır.
Polimer:PS-MGO
30-120 0C arası (teorik olarak % 17,65) deneysel olarak % 19,11’lik kütle kaybı muhtemelen nemden kaynaklanmaktadır. 120-283 0C arası deneysel olarak % 13,20’ye (teorik olarak %13,72’ye) tekabül eden gaz bozunma ürünü olan N2 gazı reaksiyon kabından ayrılmıştır. 283-583 0C aralığında gaz bozunma ürünlerinden CH3 ve –(-CH-CH2-)- grupları reaksiyon kabında (teorik olarak % 20,59) deneysel olarak % 19,60’lık kütle kaybı gerçekleşmiştir. Reaksiyon kabında kalan CO ve benzen de sıcaklıkla orantılı olarak reaksiyon kabından uzaklaşmaya devam etmektedir. 583 0C’ye kadar maddenin teorik olarak % 51,96’sı deneysel olarak ise % 51,91’i reaksiyon kabından uzaklaşmıştır.
Polimer: PS-GO
30-100 0C arası (teorik olarak % 28,42) deneysel olarak % 29,99’luk kütle kaybı muhtemelen nemden kaynaklanmaktadır. 100-361 0C arası deneysel olarak % 13,59’luk (teorik olarak % 14,73’e) tekabül eden gaz bozunma ürünü olan N2 gazı reaksiyon kabından ayrılmıştır. 361-439 0C arası (teorik olarak % 33,68’e) deneysel olarak % 32,45’lik kütle kaybı muhtemelen O2 gazından kaynaklanmaktadır. Reaksiyon kabında kalan –(-CH-CH2-)-, benzen ve diğer maddeler de sıcaklıkla orantılı olarak reaksiyon kabından uzaklaşmaya devam etmektedir. 439 0C’ye kadar maddenin teorik olarak % 76,83’ü uzaklaşmıştır. Deneysel olarak ise % 76,03’ü reaksiyon kabından uzaklaşmıştır.
6. KAYNAKLAR
Ahsen, V., Gürek, A., Gül, A., and Bekaroğlu, Ö., 1990, “Synthesis of a 13-Membered Macrocyclic Tetrathiadioxime and its Mono- and Trinuclear Complexes with Tetrahedrally Coordinated Palladium(II), J. Chem. Soc. Dalton Trans., 5.
Alıcı, Ö., 2006. Bazı Keto Oksimlerin Tereftalohidrazon ile Kondensasyon Reaksiyonları Yüksek Lisans Tezi Selçuk Üniversitesi. Konya,
Bekaroğlu, Ö., 1972. “Koordinasyon Kimyası” İ.Ü. yayınları, İstanbul.
Bekaroğlu, Ö., 1974, “Reactions and Mechanism of Complex Formation and Rearrangement from “Cobaltoxime” with New ligands”, Chem. Acta, Turc.,
2, 17.
Bekaroğlu, Ö., Sarısaban, S., Koray, A.R. und Ziegler, M.L., 1977, "Die Molekül und Kristallstructr von Bis(diaminoglyoximato)kobalt(II) diaminoglyoxim", Z. Naturforsch., 32b, 387.
Bekaroğlu, Ö., Sarısaban, S., Koray, A.R., Nuber, B., Weidenhmmer, K., Weiss, J. and Ziegler, M.L., 1978, "The Crystal Structure of Tris(oxamide oxime) cobalt (III) trichloride", Acta Cryst., 34, 3591.
Bierlein, T.K., Lingafelter, E.C., 1951, "The Crystal Structure of Acetoxime", Acta Cryst., 4, 450.
Britzinger, H. and Titzmann, R., 1952, “Notiz über einige halogenierte aliphatische Oxime”, Ber., 85, 345.
Bromidge, S.M., Classidy, F., M.S.G. et al., 1994, “1,2,5,6- tetrahydro-pyridine Esters and Oxime Ethers Related to Arecoline are Novel and Potent Muscarinic Agnists”, Bro. Med. Chem. Lett.,4,1185.
Burakevich, J.V., Lore, A.M., and Volpp, G.P., 1971. “Phenylglyoxime Separation, Characterization, and Structure of Three Isomers”, J. Org. Chem., 29, 482. Carlos, D.D., David. A., 1972, "Oximes as Accelators for the Amine Curing of
Epoxy Resins", Amer. Pat. N: 370 34 97 [Chem. Abs. 78, 30843e, 1973]. Chakravorty, A., 1974, “Structure Chemistry of Transition Metal Complexes of
Deveci, M.A., 1994, "İminooksim Türevlerinin Eldesi ve Onların Bazı Geçiş Elementleri ile Metal Kompleks Yapılarının İncelenmesi", Doktora Tezi, S.Ü. Fen Bilimleri Enstitüsü, Konya.
Deveci, M.A., Hosseinzadeh, A., and İrez, G., 1991, "Synthesis of Four New Subtituted Bis(diaminogloximes) and Their Complexes with Some Transition Metals", Synth. Reat. Inorg. Met.-Org. Chem., 21, 1073.
Ertaş, M., Ahsen, V., Gül, A., and Bekaroğlu, Ö., 1987, “Synthesis of novel [10]ferrocenophanedioxime with Bridge Heteroatoms and of Nickel(II) Complexes”, J. Organomet. Chem., 335, 105.
Fessenden, R. J. And Fessenden, J. S., Logue, M. M., 1998, “Organic Chemistry” 6th Ed. , Tercüme, Güneş Kitabevi Ltd. Şti, Ankara.
Freeman, P.J., 1979, “ Less Known Reactions of Oximes ”,Chem. Rev., 93, 4.
Gök, Y., 1981, “Yeni α-Dioksim Sentezleri, Geometrik İzomerleri ve Bazı Metallerle Kompleks Formasyonlarının incelenmesi”, Doktora Tezi, Karadeniz Teknik Üniversitesi, Trabzon.
Grundmann, C. and Grunanger, P., 1971, "The Nitrile Oxides", p. 160, Springer Verlag, New York.
Grundmann, C., Mini, V., Dean, J. M. and Frommeld, H. D., 1965, "Dicyan-di-N-oxyd", Ann. Chem., 687, 191.
Hesse, G., und Krehbiel, G. 1955 “Die Nitrosierung Einiger Chlorketone, ein neuer Weg Zu Hydroxamsäurechloriden” 88, 131-133
Hüsseyinzade, A., İrez, G., 1990, “Bazı Aminoglioksimlerin Ka Sabitlerinin Tayini”, S.Ü. Fen Edebiyat Fakültesi, Fen Dergisi, 10, 16.
İrez, G., and Bekaroğlu, Ö., 1983, “The Synthesis and Complex Formation Some New Substituted Amino-, Diamino Glyoximes”, Synth. React., Inorg. Met.-Org. Chem., 13, 781.
Kara, A., 1995, “Çeşitli Oksimlerin Sentezi ve Özelliklerinin İncelenmesi”, Yüksek Lisans Tezi, Uludağ Üniversitesi, Bursa.
Karataş, İ., and Uçan, H.İ. 1998, "The Synthesis of Biphenylglyoxime and Bis (phenylglyoxime) and Their Complexes with Cu(II), Ni(II), and Co(II)", Synth. React. Inorg. Met.-Org. Chem., 28, 383.
Karataş, İ., İrez, G., Sezgin, M., Uçan, H.İ., and Bedük, A.D., 1991, "The Synthesis of Some New Bis(1,2-dioximes) and Their Some Polymeric Metal Complexes", Synth. React. Inorg. Met.-Org. Chem., 21, 1031.
Karataş, İ., Tüzün, C., 1989, "Terephthalohydroximoyl Chloride", Org. Prep. Proced. Int., 21, 517.
Karataş, İ., Uçan, H. İ. and İrez, G., 1992, “Synthesis of Some Substiteted Bis(vic-dioximes) and Their Polymeric Metal Complexes”, Chim. Acta Turcica, 20, 167.
Lecterc, G., Mann, A. and Schwartz, J., 1980, "Synthesis and -adrenergic Bloking Activity of New Aliphatic Oxime Ethers", J. Med. Chem., 23, 620.
Lecterc, G., Mann, A., Wermuth, C.G., Bieth, N. and Schwartz, J., 1977, "Synthesis and -adrenergic Bloking Activity of a Novel Class Aromatic Oxime Ethers", J. Med. Chem., 20, 1657.
Manav, G., 2006. Yüksek Lisans Tezi, Selçuk Üniversitesi, Konya
Nesmeyanov, A.N. and Nesmeyanov, N.A., 1974, “Fundamentals of Org. Chem.”,3, 166., Mir. Published. Moscow.
Pekacar A.İ., Yıldırım S. and Uçan M., “Synthesis and Complex Formation of Su napthyglyoximes of Unsmmetrical vic-Dioximes”, Synth. React. İnorg. Met. –Org. Chen (2003).
Rheinboldt, H. und Schmitz-Dumont, O., 1925, "Über die Reaktionsweisen des Nitrosylchlorids", Ann. Chem., 444, 113.
Singh, A.P., Bhattacharya S., Sharma S., J. Mol. Catal, A: Chem, 102, 139, 1995. Smith, P. A. S., 1966, “The Chemistry of open Chain Organic Nitrogen
Compounds”, Vol. 2, 29-68, New York.
Şimşek, S., 1997, “ Oksimlerin Sağlık Alanında Kullanımları ”, P.A.Ü. Tıp Fakültesi Dergisi, 3(1), 59.
Tan, N. and Bekaroğlu, Ö., 1983, “Synthesis of Some Organometallic Compounds of 1,2-Acetonaphthylene Dione Dioxime and Comparison with B12 Model Compounds”, Synth. React. Inorg. Met.-Org. Chem., 13, 667.
Tüzün, C., 1996, “Organik Kimya”, 7.Baskı, s. 563, Palme Yayıncılık, Ankara. Tüzün, C., 1999, "Organik Reaksiyon Mekanizmaları", 3. Baskı, s. 331, Palme