T.C
SELÇUK ÜNĐVERSĐTESĐ SAĞLIK BĐLĐMLERĐ ENSTĐTÜSÜ
BESĐN HĐJYENĐ VE TEKNOLOJĐSĐ ANA BĐLĐM DALI
KONYA GARNĐZON BĐRLĐKLERĐNDEKĐ KUYU SULARI ĐLE ŞEHĐR ŞEBEKE SULARININ SU KALĐTESĐ VE AĞIR METALLER YÖNÜNDEN
KARŞILAŞTIRILMASI
YÜKSEK LĐSANS TEZĐ
Ümit Cenk KAHRAMAN
DANIŞMAN
Yrd. Doç. Dr. Gürkan UÇAR
i ĐÇĐNDEKĐLER Sayfa No 1. GĐRĐŞ 1 2. LĐTERATÜR BĐLGĐ 3 2.1. Su Kaynakları 3
2.2. Đçme Suyu Özellikleri 5 2.3. Sularda Kirlenme Nedenleri 5 2.4. Türkiye Su Kaynakları 6 2.5. Su Kalitesi 7 2.5.1. Alüminyum 11 2.5.2. Arsenik 13 2.5.3. Bakır 15 2.5.4. Demir 18 2. 5.5. Kadmiyum 20 2.5.6. Kurşun 22 2.5.7. Mangan 24 2.5.8. Sertlik 26 2.5.9. Đletkenlik 28 2.5.10. pH 29 2.5.11. Bulanıklık 29 3. MATERYAL VE METOT 31 3.1. Bölgenin Özellikleri 31 3.2. Mevcut Su Temin Durmu 31 3.3. Materyallerin Toplanması 32 3.4. Cihazlar ve Metot 33 3.4.1. Cihazlar 33
3.4.2. Metot 33
3.4.2.1. Alüminyum Analizi Test Prosedürü 33
3.4.2.2. Arsenik Analizi Test Prosedürü 33
3.4.2.3. Bakır Analizi Test Prosedürü 34
3.4.2.4. Demir Analizi Test Prosedürü 34
3.4.2.5. Kadmiyum Analizi Test Prosedürü 34
ii
3.4.2.7. Mangan Analizi Test Prosedürü 35
3.4.2.8. Sertlik Tayini 35 3.4.2.9. Đletkenlik Tayini 36 3.4.2.10. pH Tayini 36 3.4.2.11. Bulanıklık Tayini 36 3.5. Đstatistiksel Analiz 36 4. BULGULAR 37 5. TARTIŞMA VE SONUÇ 41 6. ÖZET 48 7. SUMMARY 49 8. KAYNAKLAR 50 9. ÖZGEÇMĐŞ 58 10. TEŞEKKÜR 59
iii
TABLO LĐSTESĐ
SayfaNo TABLO 2.1. BM Verilerine Göre Su Kaynaklarının Yeryüzünde Dağılımı 3 TABLO 2.2. Yer altı ve Yüzeysel Suların Karakteristik Özellikleri 4 TABLO 2.3. TSE ve Sağlık Bakanlığı Đçme Suyu Standartları 8
TABLO 2.4. TSE ve Sağlık Bakanlığı Đçme Suyu Gösterge Parametreleri 9
TABLO 2.5. WHO ve USEPA Đçme Suyu Standartları 9
TABLO 2.6. Avrupa Birliği (AB) Đçme Suyu Standartları 10
TABLO 2.7. Sertlik Derecesine Göre Suların Sınıflandırılması 27 TABLO 3.1. Su Numuneleri Toplanan Birlik ve Çeşme Đsimleri 32
TABLO 4.1. Kuyu Suları Đle Şehir Şebeke Sularının Karşılaştırılması 38
TABLO 4.2. Kuyu Sularının Aylara Göre Karşılaştırılması 39
iv
ÇĐZELGE LĐSTESĐ
SayfaNo
ÇĐZELGE 2.1. Kanser Risk Tahminleri 15 ÇĐZELGE 2.2. Sulara Ait Tipik Đletkenlik Değerleri 28
v
KAYNAK DĐZĐNĐ
Al : Alüminyum
As : Arsenik
BM : Birleşmiş Milletler
Bq : Becqerel, Radyoaktivite Ölçü Birimi. 1 Becqerel = Saniyedeki Parçalanma
Cd : Kadmiyum
Cu : Bakır
EC : Elektiriksel Đletkenlik
Fe : Demir
Fr : Fransız Sertlik Derecesi
Mn : Mangan
MSv : MikroSievert, Vücutta Toplanan Enerjinin Đfadesi mmho/cm : Mikrohom / Santimetre
µS : Mikro Simens, Đletkenlik Ölçü Birimi
µg : Mikro gram
NTU : Neftelometrik Bulanıklık Birimi
Pb : Kurşun
SI : Simens/Metre
USEPA : Amerikan Çevre Koruma Ajansı WHO : Dünya Sağlık Örgütü
1. GĐRĐŞ:
Yeryüzünün % 70’ini kaplayan ve bu sebeple dünyamıza “ Mavi Küre” adının verilmesine neden olan su, yeryüzünde en çok bulunan ögedir. Dünyada toplam su miktarı 1.400 milyon km3’tür. Bu suyun % 97’sini denizler ve okyanuslardaki tuzlu sular oluşturmaktadır. Geriye kalan % 3’lük bölüm ise tatlı su kaynağı olup bunun sadece % 1’i kullanılmaktadır (Açıkalın 2006).
Su, doğada katı, sıvı ve gaz olmak üzere üç fazda bulunur (buz, sıvı haldeki su ve su buharı). Bilinen tüm sıvılar içinde en yüksek yüzey gerilimine sahiptir. Bu özelliği, yağmur damlacıklarının oluşumu açısından önem taşımaktadır. Yine tüm sıvılar içerisinde suyun buharlaşma ısısı en yüksektir. Su, amonyaktan sonra en yüksek erime ısısına sahip olan bileşiktir.Yüksek özgül ısısı ile birlikte bu özellikler, suyu yeryüzündeki iklimsel farklılıkların belirleyici unsuru haline getirir (Bilgin 2003).
Su, hayatın varlığı ve devamlılığı için vazgeçilmez bir kaynaktır. Su; içmede, temizlikte, yıkanmada, tarla ve bahçe sulamada, sanayide, elektrik üretiminde, ulaşımda, taşımada, su ürünleri üretiminde ve sağlık hizmetlerinde (kaplıca) kullanılmaktadır. Canlılar üremeleri, büyümeleri, gelişmeleri ve hastalıklardan korunmaları için suya ihtiyaç duyarlar. Đnsan vücudunun % 65-75’inin su olması nedeniyle sağlıklı bir insanın, günde 2-3 litre su içmesi gerekmektedir (Akpınar 2005, Öztürk 2006). Đnsan besinsiz olarak 50 gün kadar yaşamını sürdürebilir ama susuz kaldığında birkaç gün içinde ölüm kaçınılmazdır. Günlük su gereksinimi başta cinsiyet ve yaş olmak üzere birçok etkene göre değişkenlik gösterir. Bu etkenler arasında fiziksel aktivite ve egzersiz, yüksek hava sıcaklığı, düşük nem, lifli besin tüketimi, kafeinli ve alkollü içeceklere bağlı idrar miktarının artışı yer alır (Karagülle 2004).
Dünya nüfusunun artması ve su tüketiminin fazlalaşmasının yanı sıra iklim değişiklikleri nedeni ile de temiz suya ulaşma, dünya için en önemli sorunlardan biri durumundadır ve böyle olmaya da devam edecektir. Sağlığın korunması için içme sularının kullanımına çok dikkat edilmelidir. Bir litre atık su, sekiz litre temiz suyu kirletir. Yeryüzünde kirletilmiş su miktarı 12.000 km3’tür. Bu miktar, dünyanın en büyük on nehrinde bulunan tatlı su miktarından daha fazladır. Su kirliliğinin nüfus artış hızıyla birlikte artması durumunda 2050 yılına kadar dünya çapında 18.000 km3’lük tatlı su kaybedilmiş olacaktır.
Su kaynaklarının endüstriyel atıklarla veya kanalizasyonla kirletilmesi sadece çevre sorunu yaratmakla kalmayıp aynı zamanda bazı su kaynaklarının çok uzun vadeli kaybına ve çok büyük temizleme yatırımlarına ihtiyaç doğurmaktadır. Doğal olarak
dengede olan ve bazı kirlenmeleri kendi kendine temizleyen su bazı kirlenme durumlarında ise bu özelliğini kaybederek salgın hastalık yayan ve zehirlenmeler yaparak ölümlere de neden olabilen bir kaynak haline dönüşmektedir (Akpınar 2005, Öztürk 2006).
En iyi sular kaynak sularıdır. Ancak bunlar miktar bakımından yeterli değildir. Kuyu suları da genellikle iyidir. Fakat bunlar da miktar bakımından azdır. Her iki kaynaktan alınan sular hiçbir işleme tabi tutulmadan içilebilir. Ancak bunlar büyük şehirlerin su ihtiyacını karşılamaya yetmez. Bundan dolayı, büyük şehirlerin su ihtiyacını karşılamak için nehir, göl ve dere sularından faydalanılır. Böyle sular miktar bakımından yeterli olmakla beraber kalite bakımından yeterli değildir (Bilgin 2003).
Đnsanlar, içme ve kullanma sularını büyük ölçüde tatlı su kaynaklarından sağlamaktadır. Su, hidrolojik çevrim gereğince atmosfer, yeryüzü ve yeraltında sürekli dolaşmaktadır. Nüfusun hızlı bir şekilde artması ve sanayileşmeye bağlı olarak kirleticilerin miktarı da her geçen gün artmakta ve çeşitleri fazlalaşmaktadır (Akar 2000). Bu nedenle sularda kirlenmeye yol açabilecek etkenlerin tespiti için suların periyodik olarak kontrol edilerek, kirleticilerin meydana getirebileceği sağlık sorunlarının zamanında tespit edilerek önlemlerin alınması gerekmektedir.
2. LĐTERATÜR BĐLGĐ 2.1. Su Kaynakları
Canlı yaşamının temel kaynağını oluşturan su; okyanuslar, akarsu ve göller, kar ve buzullar ve yeraltında olmak üzere yeryüzünün yaklaşık 4’te 3’ünü oluşturmaktadır. Birleşmiş Milletler (BM) verilerine göre su kaynaklarının yeryüzünde dağılımları Tablo 2.1.’de verilmiştir (Açıkalın 2006). Birleşmiş Milletler Eğitim, Bilim ve Kültür Teşkilatı (UNESCO) tarafından Paris’te açıklanan Dünya Su Gelişme Raporuna göre en kaliteli suyun Finlandiya’da olduğu bildirilmiştir. Tatlı su kaynakları ve özellikle yeraltı sularının miktarı ve temizliği, atık suyun nasıl arıtıldığı kriterleri değerlendirilerek oluşturulan listede 2 nci sırada Kanada, 3 üncü sırada Yeni Zelanda yer alırken, Türkiye 45 nci sırada yer almaktadır (Öztürk 2006).
Tablo 2.1. BM Verilerine Göre Su Kaynaklarının Yeryüzünde Dağılımı
KITALAR NÜFUS ( % ) SU KAYNAĞI (% )
Kuzey Amerika 8 15 Güney Amerika 6 26 Avrupa 13 8 Afrika 13 11 Asya 60 36 Avustralya ve Adalar 1 5
Yeryüzünde içme ve kullanma suyu olarak yararlanılabilecek sular üç ana başlık altında toplanabilir (Demirer 1995, Yalçın ve Gürü 2002).
1. Meteor Suları (Yağış Suları) 2. Yeryüzü Suları
a. Akan Sular b. Durgun Sular
1. Doğada bulunan durgun sular (deniz, göl, bataklık suları)
2. Đnsanlar tarafından hazırlanan durgun sular (baraj, havuz, depo suları) 3. Yeraltı Suları
a. Kuyu ve artezyen suları b. Kaynak suları
1. Soğuk kaynak suları Đçme suları
2. Sıcak kaynak suları
Hipotermal sular: 34 0C’ den az sıcak olan sular Homiotermal sular: 34-37 0C’ ler arasında olan sular Hipertermal sular: 40 0C’den yüksek olan sular
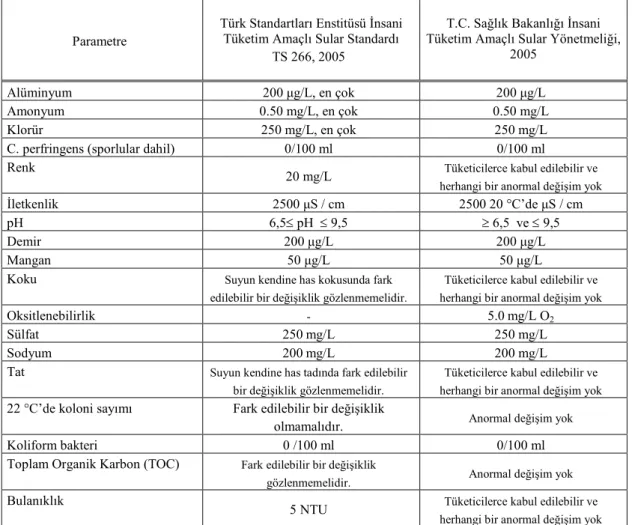
Yeraltı ve yerüstü sularının bazı karakteristik özelliklerinin karşılaştırılması Tablo 2.2.’de verilmiştir (Yalçın ve Gürü 2002).
Ülkemiz için ise toplam kullanılabilir su miktarı 112 milyar m3 olarak hesaplanmıştır. Ülkemizde sanayi sektöründe birim başına su tüketimi gelişmiş ülkelerin 3-4 katıdır. Ülkemizde su tüketiminin %12’sini içme ve kullanma suyu tüketimi oluşturmaktadır (Akpınar 2005, Açıkalın 2006).
Tablo 2.2. Yeraltı ve Yüzeysel Suların Karakteristik Özellikleri
Karakteristikler Yüzeysel Sular Yeraltı Suları
Sıcaklık Mevsimlere göre değişir Yaklaşık olarak sabit kalır Bulanıklık Zamanla değişir, bazen sabit kalır Çok az veya yok
Çözünmüş Tuzlar
Yağışlara veya sellere göre değişebilir
Yüzeysel sulardan daha yüksektir
Demir ve
Mangan Göllerin dibi hariç genellikle yoktur Daima bir miktar bulunur Serbest CO2 Genellikle yoktur Büyük ölçüde içerir
Çözünmüş
Oksijen Doygundur Genellikle azdır
Amonyak Kirlenmiş sularda bulunur Yüzeysel kirlenmeyi gösterir
Hidrojen Sülfür Bulunmaz Bazı sıcak sularda rastlanır
Silikat Az miktarda bulunur
Yüzey sularından daha yüksektir
Nitrat Genellikle çok az Bazı sularda rastlanır
Mikroorganizma
Patojen bakteriler ve viruslar bulunabilir
Sıklıkla demir bakterileri bulunur (Örn. E.coli)
Đçme ve kullanma suyu olarak kullanılan suların ana kaynağı yağışlardır. Son yıllarda yeterli su temininde sıkıntı çeken bazı ülkelerde deniz suyu, tatlı suya çevrilmek sureti ile deniz suyu da kaynak olarak kullanılmaktadır. Fakat ana kaynak yerüstü (akarsular, göller) ve yeraltı (artezyenler, kuyular, pınarlar) sularıdır (Öztürk 2006).
Dünya su tüketimi incelendiğinde kentsel alanlarda günde ortalama 150 L/sn su tüketilirken, sanayileşmiş ülkelerde bu rakam 266 L/sn ye çıkmaktadır. Afrika’da 67 L/sn, Asya’da 143 L/sn, Arap ülkelerinde 158 L/sn, Türkiye’de 111 L/sn, Đstanbul’da 125 L/sn, Ankara’da 141 L/sn su tüketilmektedir (Akpınar 2005).
2.2. Đçme Suyu Özellikleri
Günlük fizyolojik su gereksiniminin karşılanmasında yeterli ve güvenli içme suyunun sağlanması tüm ülkelerde sağlıklı bir toplum için temel ihtiyaçlar arasındadır. Bu yüzden Dünya Sağlık Örgütü (WHO) ve üye ülkeler “Tüm insanlar gelişme düzeyleri ve sosyal ve ekonomik koşulları ne olursa olsun güvenli içme suyuna yeterli miktarda ulaşma hakkına sahiptir” ortak amacını saptamışlardır. Burada güvenli su kavramı beş kategoride tanımlanmaktadır; (Karagülle 2004).
- Kalite: Ciddi bir sağlık riski taşımaması
- Kantite : Tüm gereksinimleri karşılayacak miktarda olması - Süreklilik: Sürekli ulaşılabilir olması
- Kapsayıcılık: Tüm toplum kesimleri için elde edilebilir olması - Uygun fiyat: Satın alınabilir olması
Tüketime sunulan içme ve kullanma suları belirli niteliklere sahip olmalıdır. Đyi bir içme ve kullanma suyu aşağıdaki özelliklere sahip olmalıdır; (Açıkalın 2006).
- Su kokusuz, renksiz, berrak, içimi hoş, tercihen 15 0C’den aşağı sıcaklıkta olmalı
- Hastalık yapıcı mikroorganizmalar ihtiva etmemeli - Suda sağlığa zararlı kimyasal maddeler bulunmamalı - Sular, aşındırıcı olmamalı, yeterli derecede yumuşak olmalı - Sular, kullanma maksatlarına uygun olmalıdır.
2.3. Sularda Kirlenme Nedenleri
Doğada serbest halde akan sulara (kaynak, çeşme) kirleticilerin bulaşabileceği unutulmamalıdır. Sızma yoluyla toprağa giren kirleticiler ve mikroorganizmalar sulara karışabilir ve bu sular kilometrelerce uzaklara ulaşarak bir kaynak ya da çeşmeden yeryüzüne ulaşabilir (Akpınar 2005, Öztürk 2006, Atasoylu ve ark. 2006). Su kalitesini etkileyen kirleticiler genellikle 5 başlık altında toplanmaktadır; (Öztürk 2006).
a- Potansiyel Kirleticiler: Yeraltı ve yerüstü sularına çeşitli nedenlerle karışan ve risk faktörü yüksek olan kirleticilerdir (Örn. amonyak, arsenik, kadmiyum vb. inorganik
kimyasal kirleticiler ile karbon kloroform ekstratı, yağ, gres gibi inorganik kimyasal kirleticiler).
b- Biyolojik Kirleticiler: Canlı organizmaların yaptığı kirliliktir. Bu da iki gruba ayrılmaktadır.
1- Başlıca kirleticiler; Đnsan faaliyetlerinden doğrudan suya ilave edilen canlı organizmalardan ileri gelen kirlenmedir (Örn. kanalizasyon suyundan karışan bakteri ve viruslar).
2- Dolaylı kirleticiler; Đnsan faaliyetlerinin bazı neticelerinin etkisi ile sularda kirletici olmaktadırlar (Örn. nitratlı, fosfatlı ve azotlu gübrelerin suya karışması).
c- Radyoaktif Kirleticiler: Radyoaktif maddelerin ürettiği radyasyondan ileri gelen kirlenmedir.
d- Pestisitler: Tarımda kullanılan pestisitlerin suya karışması sonucu meydana gelen kirlenmedir.
e- Yüzey Etkili Kirleticiler: Genellikle sentetik deterjanların su da yarattığı köpük tabakasından ileri gelen kirlenmedir.
Değişik amaçlarla kullanılan her suda olması gereken özellikler ya da bu özellikler suların kalitesini ifade etmektedir ve su kalitesini belirleyen kriterler iki başlık altında toplanır:
a) Müsaade Edilen Kriterler: WHO tarafından uygun görülen değerlerdir.Kullanım alanına göre su kalitesini etkileyen azami limitleri belirtir.
b) Arzu Edilen Kriterler: Kullanım alanına göre en sağlıklı değerlere sahip olan suları belirtir.
2.4. Türkiye Su Kaynakları
Türkiye’de; belediyelerin % 60’ı kuyu, % 35’i kaynak olmak üzere % 95’i ve nüfusunun % 70’i içme suyu ihtiyacını yeraltı sularından, % 5’i yüzey sularından arıtarak karşılamaktadır. Köylerin % 98’i içme suyu ihtiyacını yeraltı sularından karşılamaktadır. Bunun % 85’i kaynak, % 13’ü kuyu, % 2’si akarsu, baraj, göl ve göletlerden sağlanmaktadır (Akpınar 2005).
Ülkemizde, dünyadaki gelişmiş ülkelere paralel olarak yeraltı suyu yoğun olarak kullanılmaktadır. Yeraltı suyu dünyanın birçok yerinde iyi kalitede içme suyunun ana kaynağını oluşturur. Yeraltı suyunun geçtiği kayaçlar ve topraklar birçok istenmeyen
faydalı olmaktadır. Bununla birlikte, bu yararlarına karşın, yeraltı suyu kalitesi; yeraltı suyunu depolayan kayaçların kimyasal ve mineralojik yapılarından dolayı jeokimyasal tepkimeler neticesinde suya geçebilen iz elementler nedeniyle garanti edilemez. Bu iz elementler yüksek miktarda toksik olabilir (Akpınar 2005). Yerüstü suları ise; dere, çay, göl ve baraj sularından oluşmaktadır. Bunlar genellikle kirlidir. Kirlilik dereceleri, daha çok geçtikleri ve üzerinde bulundukları topraklara, yakınlarında bulunan fabrikalara ve yerleşim birimlerine bağlıdır. Dünyada olduğu gibi Türkiye’de yerüstü suları kirlilik derecelerine göre çeşitli arıtma işlemlerine tabi tutulduktan sonra kullanılmaktadır (Bilgin 2003, Öztürk 2006).
2.5. Su Kalitesi
Đnsan ihtiyaçlarını karşılamak için gerekli olan suyun kullanılması, suyun hastalık ve zararlı psikolojik etkiler yapabilecek mikroorganizmalar ile mineral ve organik maddelerden arındırılmış olmasına bağlıdır. Ayrıca su estetik açıdan kabul edilebilir olmalıdır; yani bulanıklık, renk, koku ve istenmeyen tatlar giderilmiş olmalıdır. Son zamanlarda nüfusun artmasıyla beraber endüstri ve kimya sanayinde çok hızlı bir gelişme olmuştur. Bununla birlikte içme suyunun güvenliği ve içilebilmesi konusundaki sorularda da bir artış görülmüştür (Akar 2000).
Su kalitesinin belirlenmesinde; çözünmüş oksijen, biyokimyasal oksijen ihtiyacı, kimyasal oksijen ihtiyacı, katı madde, azot, fosfat, bulanıklık, renk, koku, pH, iletkenlik, sertlik ve ağır metal tayinleri yapılabilir.
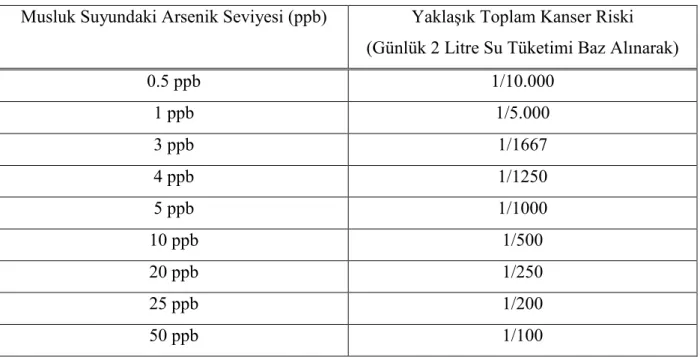
Su kalitesinin belirlenmesinde çeşitli parametrelerden yararlanılmaktadır. Bu değerler genellikle aynı olmakla beraber bazen ülkelere göre değişiklik göstermektedir. Su kalitesinin tespitinde ülkemizde T.C. Sağlık Bakanlığı’nın Đnsani Tüketim Amaçlı Sular Yönetmeliği ile Türk Standartları Enstitüsü’nün (TSE) TS 266 Đnsani Tüketim Amaçlı Sular Standartlarından yararlanılmaktadır. T.C. Sağlık Bakanlığının Đnsani Tüketim Amaçlı Sular Yönetmeliği ile TS 266 Đnsani Tüketim Amaçlı Sular Standardında yer alan su kalite parametreleri Tablo 2.3.’te (TSE 2005, Yönetmelik 2005), yine bu standart ve yönetmelikte yer alan ve suların daha sonra yapılacak kontrollerinde kullanılan gösterge parametreleri Tablo 2.4.’te (TSE 2005, Yönetmelik 2005), WHO ve USEPA’nın incelenen parametreler ile ilgili değerleri Tablo 2.5.’te (EPA 2006, WHO 2006 b), Avrupa Birliği içme suyu standartları Tablo 2.6.’da (Berktay 2004) verilmiştir.
Tablo 2.3. Türk Standartları Enstitüsü ve Sağlık Bakanlığı Đçme Suyu Standartları
Parametre Türk Standartları Enstitüsü Đnsani Tüketim Amaçlı Sular Standardı TS 266, 2005
T.C. Sağlık Bakanlığı Đnsani Tüketim Amaçlı Sular Yönetmeliği, 2005
MĐKROBĐYOLOJĐK ÖZELLĐKLER Parametre
Escherichia coli ( E. coli ) 0/100 ml 0/100 ml
Enterococci 0/100 ml 0/100 ml Koliform bakteri - 0/100 ml KĐMYASAL ÖZELLĐKLER Parametre Akrilamid - 0.1 µg/L Antimon 5.0 µg/L 5.0 µg/L Arsenik 10 µg/L 10 µg/L Benzen 1.0 µg/L 1.0 µg/L
Benzo (a) piren - 0.010 µg/L
Bor 1.0 mg/L 1 µg/L
Bromat 10 µg/L 10 µg/L (içme-kullanma suları için 31 Aralık 2007 yılına kadar 25 µg/L olarak uygulanır)
Kadmiyum 5.0 µg/L 5,0 µg/L Krom 50 µg/L 50 µg/L Bakır 2000 µg/L 2 mg/L Siyanür 50 µg/L 50 µg/L 1,2-dikloretan - 3.0 µg/L Epikloridin - 0.10 µg/L Florür 1.5 mg/L 1.5 mg/L Kurşun 10 µg/L 10 µg/l
(içme-kullanma suları için 31 Aralık 2012 tarihine kadar 25 µg/l olarak uygulanır)
Cıva 1.0 µg/L 1.0 µg/L Nikel 20 µg/L 20 µg/L Nitrat 50 mg/L 50 mg/L Nitrit 0.50 mg/L 0.50 mg/L Pestisitler 0.10 µg/L 0.10 µg/L Toplam pestisitler 0.50 µg/L 0.50 µg/L
Polisiklik aromatik hidrokarbonlar 0.10 µg/L 0.10 µg/L
Selenyum 10 µg/L 10 µg/L
Tetrakloreten ve trikloreten - 10 µg/L
Trihalometanlar-toplam -
100 µg/L
(içme-kullanma suları için 31 Aralık 2012 tarihine kadar 150 µg/L olarak uygulanır)
Vinil Klorür - 0,50 µg/L
RADYOAKTĐFLĐK
Trityum 100 Bq/L 100 Bq/L
Toplam Gösterge Dozu 0.10 mSv/yıl 0.10 mSv/yıl
Alfa Aktivitesi 0.1 Bq/L 0.1 Bq/L
Tablo 2.4. Türk Standartları Enstitüsü ve Sağlık Bakanlığı Đçme Suları Gösterge Parametreleri
Tablo 2.5. Dünya Sağlık Örgütü (WHO) ve Amerika Çevre Koruma Ajansı (USEPA) Đçme Suyu Standartları
Parametre
Türk Standartları Enstitüsü Đnsani Tüketim Amaçlı Sular Standardı
TS 266, 2005
T.C. Sağlık Bakanlığı Đnsani Tüketim Amaçlı Sular Yönetmeliği,
2005
Alüminyum 200 µg/L, en çok 200 µg/L
Amonyum 0.50 mg/L, en çok 0.50 mg/L
Klorür 250 mg/L, en çok 250 mg/L
C. perfringens (sporlular dahil) 0/100 ml 0/100 ml
Renk
20 mg/L Tüketicilerce kabul edilebilir ve herhangi bir anormal değişim yok
Đletkenlik 2500 µS / cm 2500 20 °C’de µS / cm
pH 6,5≤ pH ≤ 9,5 ≥ 6,5 ve ≤ 9,5
Demir 200 µg/L 200 µg/L
Mangan 50 µg/L 50 µg/L
Koku Suyun kendine has kokusunda fark
edilebilir bir değişiklik gözlenmemelidir.
Tüketicilerce kabul edilebilir ve herhangi bir anormal değişim yok
Oksitlenebilirlik - 5.0mg/L O2
Sülfat 250mg/L 250 mg/L
Sodyum 200mg/L 200 mg/L
Tat Suyun kendine has tadında fark edilebilir
bir değişiklik gözlenmemelidir.
Tüketicilerce kabul edilebilir ve herhangi bir anormal değişim yok 22 °C’de koloni sayımı Fark edilebilir bir değişiklik
olmamalıdır. Anormal değişim yok
Koliform bakteri 0 /100 ml 0/100 ml
Toplam Organik Karbon (TOC) Fark edilebilir bir değişiklik
gözlenmemelidir. Anormal değişim yok
Bulanıklık
5 NTU Tüketicilerce kabul edilebilir ve herhangi bir anormal değişim yok
Parametre Dünya Sağlık Teşkilatı WHO 2006
ABD Çevre Koruma Ajansı USEPA 2006 Alüminyum 0.2 mg/L 0.2 mg/L Arsenik 0.01 mg/L 0.01 mg/L Bakır 2 mg/L 1.3 mg/L Demir 0.3 mg/L 0.3 mg/L Kadmiyum 0.003 mg/L 0.005 mg/L Kurşun 0.01 mg/L 0.015 mg/L Mangan 0.4 mg/L 0.05 mg/L pH 6.5-8.5 6.5-8.5 Đletkenlik - - Sertlik 200 mg/L - Bulanıklık - -
Tablo 2.6. Avrupa Birliği (AB) Đçme Suyu Standartları
Özellikler Avrupa Birliği (AB), 1998 Önerilen Değer
Avrupa Birliği (AB), 1998 Maksimum Değer Sıcaklık °C 12 25 pH 6.5 – 8.5 6.5 – 8.5 Renk (Pt – Co Skalası) 1 20 Bulanıklık (mg/L SiO2) 1 10 Đletkenlik µS/cm 400 - Klorürler mg/L 25 - Serbest Klor mg/L 0.1 0.5 Sülfatlar mg/L 25 250 Kalsiyum mg/L 100 - Magnezyum mg/L 30 50 Sodyum mg/L 20 175 T.Çözünmüş tuz. mg/L - 1500 Nitrat mg/L 25 50 Amonyum mg/L 0.05 0.5 Fenoller µg/L - 0.5 Bor µg/L 1000 - Demir µg/L 50 200 Mangan µg/L 20 50
Fosfor P2O5 olarakµg/L 400 5000
Flor µg/L - 700 Arsenik µg/L - 50 Kadmiyum µg/L - 5 Siyanür µg/L - 50 Civa µg/L - 1 Kurşun µg/L - 50 Pestisitler µg/L - 0.5 PAHµg/L - 0.2 T.Koliform MPN/100 ml - <1 Fekal Koliform MPN/100ml - <1
2.5.1. Alüminyum
Alüminyum yer kabuğunda en çok bulunan elementlerden birisidir ve yer kabuğunun yaklaşık % 8’ini oluşturmaktadır. Doğada silikatlar, oksitler ve hidroksitler şeklinde diğer elementlerle kombine (örnek: sodyum ve florid) ve organik maddelerle kompleksler oluşturmuş halde bulunmaktadır (Güler ve Çobanoğlu 1997, WHO 1998, Singh ve ark. 2006).
Alüminyum birçok endüstriyel ve evsel kullanım biçimine sahiptir. Yapı malzemesi olarak, otomotiv ve uçak endüstrisinde, yemek kaplarının yapımında, gıda paketlemede, gıda katkı maddesi olarak, antasit ve terleme önleyici olarak kullanılmaktadır (Güler ve Çobanoğlu 1997, WHO 1998). Ayrıca alüminyum tuzları, organik maddeler, renk, bulanıklık ve mikroorganizma seviyesinin düşürülmesinde kaogulant olarak su işlemede kullanılmaktadır (WHO 1998).
Alüminyum canlılara çeşitli yollardan, genel olarak da gıda, su ve hava ile geçer. Alüminyum’un insanlara bulaşma kaynakları; solunum (özellikle endüstriyel bölgelerde), yıkanmamış meyve ve sebzelerin üstünde kalan toprak, işlenmiş gıdalar, pişirilmiş gıdalar, antasit preparatlar, terlemeyi önleyiciler, pişirme kapları ve mutfak malzemeleri’dir (Anonim 2007 a). Doğal toprak erozyonu, madencilik, volkanik püskürme, tarımsal aktiviteler ve kömür yanması havada bulunan alüminyum’un başlıca kaynaklarıdır. Havadaki alüminyum seviyeleri 0.0005 µg/m3 ile 1 µg/m3 arasında değişebilmektedir (WHO 1998).
Alüminyum suda çok sayıda değişik formda bulunabilir. Alüminyum monomerik ve polimerik hidroksi türleri, koloidal polimerik solüsyonlar ve jeller ile presipitatlar oluşturabilir. Ayrıca çeşitli organik (humik ve fulvik asit) ve inorganik (florid, klorid ve sülfat) asitlerle kompleksler oluşturabilir ve bunların bir çoğu suda çözünür (WHO 1998). Doğal sulardaki alüminyum konsantrasyonu çeşitli fizikokimyasal ve mineralojik faktörlere bağlı olarak önemli düzeylerde değişebilir. Nötral pH değerine yakın sulardaki çözünmüş alüminyum konsantrasyonu genellikle 0.001-0.05 mg/L arasında değişmektedir. Fakat daha asidik sularda ya da organik madde açısından zengin sularda bu değer 0.5-1 mg/L’ye kadar çıkabilir. Yüksek düzeyde asitli sularda alüminyum konsantrasyonunun 90 mg/L’ye çıktığı belirlenmiştir (WHO 1998). Đçme sularındaki alüminyum konsantrasyonu su kaynağındaki alüminyum seviyesine bağlı olarak değişebilmektedir. Almanya, ABD, Kanada ve Đngiltere’de yapılan çeşitli çalışmalarda su kaynaklarındaki alüminyum seviyelerinin 0.01 mg/L ile 2.7 mg/L arasında değiştiği görülmüştür (WHO 1998).
Su işlemede koagulant olarak alüminyum tuzlarının kullanılması son üründe alüminyum konsantrasyonunun artmasına neden olabilmektedir. Đşlenmiş sulardaki yüksek konsantrasyonlardaki alüminyum (3.6-6 mg/L) sudaki bulanıklığı arttırmakta ve dezenfeksiyon etkinliğini azaltmaktadır (Srinivasan ve ark. 1999).
Alüminyum gıdalarda doğal olarak ve alüminyum içeren katı maddelerin kullanılması sonucu bulunmaktadır. Gıdalardaki alüminyum konsantrasyonunu pişirme kapları ve ambalaj malzemeleri artırabilir. Patates, ıspanak ve çay alüminyumca zengin gıdalardır (WHO 1998, Srinivasan ve ark. 1999, Basrur 2001, Singh ve ark. 2006).
Alüminyum USEPA’ya göre sularda ikinci derece kontaminanttır ve maksimum kontaminasyon düzeyi 0.05- 0.2 mg/L olarak belirlenmiştir (Srinivasan ve ark. 1999). Günlük ortalama su ile 0.1 mg/L alüminyum alınmaktadır. Đnsanların gıdalar ile birlikte sulardan günde 88 mg alüminyum aldığı tahmin edilmektedir. Bu durumda toplam alüminyum alımına içme suyunun katkısı % 4 kadardır (WHO 1998). Alüminyum insanlar için temel besin maddelerinden değildir. Uzun süre fazla miktarda alüminyum hidroksit’in alınması vücutta fosfatların kaybına neden olur. Dokularda bulunan kalsiyum ve potasyum gibi mineraller ile alüminyum arasında bir korelasyonun bulunduğu ve beyin dokusunda alüminyum artması ile bu minerallerin azaldığı bildirilmiştir (WHO 1998).
Alüminyum’un gıda, su ve antasit tabletlerde yoğun olarak bulunmasına rağmen ağız yolu ile alımı sonucu toksik etkisi az görülür. Đngiltere’de 1988 yılında 20.000 kişi içme suyuna yanlışlıkla ya da kaza sonucu karışan alüminyumu 5 günden daha uzun bir süre ile almış ve ardından bu kişilerde bulantı, kusma, ishal, ağız ve deri ülserleri, deri döküntüleri semptomları görülmüş ve bu semptomlar kısa sürede ve çoğunlukla hafif geçmiştir (WHO 1998).
Alüminyum’un insanlardaki etkisi akut etkiden daha çok kronik olarak görülmektedir. Böbrek yetmezliği olan hastaların uzun süre alüminyumca zengin sulara maruz kalmasının ensefalopati ve/veya kemiklerde mineralizasyon zararlarına sebep olabildiği bildirilmiştir (Srinivasan ve ark. 1999, Gourier ve Frery 2004, Anonim 2007 a).
Alüminyum ile Alzheimer hastalığı arasında ilişki olduğuna dair görüşler bulunmaktadır. Bazı bilim adamları vücutta alüminyum birikiminin Alzheimer’in bir yan etkisi olduğuna inanmakta iken artan sayıda araştırıcı hastalığın oluşumunda alüminyum’un merkezi bir rol oynayabileceğini söylemektedir (WHO 1998, Srinivasan ve ark. 1999, Flaten 2001).
2.5. 2. Arsenik
Arsenik yerkabuğunda en sık bulunan 20 nci elementtir. Arsenik çevrede uzun süre bozulmadan kalabilir ve yüksek konsantrasyonları birçok canlı için toksik olabilir. Arseniğin çok düşük miktarları ise birçok hayvan türleri için esansiyel bir besin ögesidir. Her yıl dünyada 50.000 tonun üzerinde üretilen arsenik türevleri yaygın kullanım alanı bulmaktadır. Arsenik trioksit (beyaz arsenik), sodyum arsenit ile birlikte mono-sodyum metenarsonat, disodyum metenarsonat gibi organik bileşikler, potasyum ve kurşun arsenit gibi alkali tuzları herbisit olarak sıkça kullanılır. Bu bileşikler, yabani bitki, tohum ve filiz öldürücü özelliklerinin yanında pamuk ve meyve ağaçlarında yaprak döktürücü olarak da kullanılmaktadır. Bakır asetoarsenit (paris yeşili) ve kurşun arsenat kuvvetli insektisitlerdir. Arsenik bileşikleri ayrıca bazı deterjanların yapısında, boya pigmentlerinde (emerald yeşili), deri ve kağıt endüstrisinde (potasyum asit arsenat), seramik, cam ve lastik imalatında da kullanılmaktadır (WHO 2001, Yağmur ve Hancı 2002, Karataş 2004, Yılmaz ve Ekici 2004).
Arseniğin başlıca çevreye yayılma ve taşınma yolu sulardır. Arsenik özellikle, arsenikçe zengin kaya parçaları yoluyla sulara bulaşabilmektedir. Başlıca arsenik kaynakları ve çevreye yayılma yolları şunlardır;
- Arsenik , yerkabuğu yoluyla çevreye yaygın olarak dağılmaktadır.
- Arsenik , mineraller ve cevherlerin çözünmesi sonucu suya bulaşabilmektedir. - Arsenik, alaşımlama ajanları ve ahşap koruyucularda ticari olarak kullanılmaktadır. - Arsenik, fosil yakıtların yanması sonucu atmosfere yayılmaktadır.
- Đnorganik arsenik doğal sularda da bulunabilmektedir. Çoğunlukla doğal sularda üç değerlikli arsenit As (III) ya da beş değerlikli arsenat As (V) olarak bulunmaktadır (WHO 2001).
Đçme suları halk sağlığı açısından en önemli sorunu oluşturmaktadır. Bunun yanı sıra çalışma ortamında, madencilikte ve endüstriyel emisyonlar yoluyla arseniğe maruz kalmak lokal olarak önem taşımaktadır (WHO 2001).
Doğal dengeyi bozan kirleticiler arasında yer alan arsenik, gerek doğada serbest olarak bulunabilmesi ve gerekse canlı yapıda oluşturduğu değişik toksik etkileri nedeniyle insan ve hayvan sağlığı açısından önem taşımaktadır. Bu nedenle içilebilir sularda bulunan arsenik düzeylerine belirli sınırlamalar getirilmiştir. WHO, içme ve kullanma sularında 10 mg/L (ppb)’ ye kadar arsenik bulunabileceğini, 50 ppb’den daha yüksek miktarda arsenik içeren suların ise kesinlikle kullanılmaması gerektiğini bildirmiştir (WHO 2001, Yılmaz ve Ekici 2004).
Arsenik ile ilgili WHO standartları 1958’li yıllara kadar uzanmaktadır. Bulunmasına müsaade edilen değer 1958’de 0.20 mg/L iken, 1963’te 0.05 mg/L’ye düşürülmüş, WHO’ nun 1993 yılında çıkardığı rehberde ise, inorganik arsenik insanlarda kanserojen olarak belgelenmiş ve 0.01 mg/L değeri arsenik için kılavuz değer olarak benimsenmiştir (WHO 2000, WHO 2001, WHO 2006 a).
Đçme sularında arsenik üzerine ilk ABD politikası ise, 1943 yılında ortaya konmuştur ki, o yıl ABD Halk Sağlığı Servisi ülke içindeki sularda bulunmasına müsaade edilen arsenik limitini 50 ppb olarak standartlaştırmıştır. Aynı kuruluş tarafından 1962 yılında bu değerin 10 ppb’ye düşürülmesi önerilmiştir. 2001 yılında Amerikan Bilimler Akademisinin bir çalışmasına göre içme sularında müsaade edilen değer olan 50 ppb’nin, mesane ve akciğer kanseri riskini artırdığı belirlenmiş ve bu değerin yeniden gözden geçirilerek değiştirilmesi önerilmiştir (Sylvia 2001).
Çoğu arsenik bileşiğinin özel bir tadı ve kokusu yoktur. Đnorganik arsenik (su kaynaklarında bulunabilen bir formdur) insanlar için zehirli olup, organik arsenik (bitki ve hayvanlarda bulunur) daha az zararlıdır. Arsenik gastrointestinal sistem, solunum sistemi ve paranteral yollardan absorbe olur. Đnorganik arseniğin gastrointestinal absorbsiyon hızı çok yüksektir. Akut alımda en fazla dağılım karaciğer ve böbrekte olur, daha sonra beyindedir. Ağızdan alınan akut arsenikle zehirlenmenin başlıca belirtisi mide bulantısı, kusma, ağız ve boğazda yanma ve şiddetli karın ağrısıdır. Bunu izleyen dolaşım ve kalp yetmezliği birkaç saat içinde ölüme neden olabilmektedir. Kronik arsenik zehirlenmesi ise yavaş yavaş güçten düşme, ishal ya da kabızlık, ciltte tümör gelişimi gösterebilen pullanma ve renk değişikliği, felç ve bilinç bulanıklığı ile ortaya çıkan sinir sistemi bozukluğu, yağ dokusunda bozulma, kansızlık ve tırnaklarda tipik çizgiler belirmesiyle tanınabilir. Kronik arsenik zehirlenmesi, uzun süre içme suyu yoluyla arseniğe maruz kalma sonucu ortaya çıkmaktadır. Arseniğin sebep olduğu semptomlar ve etkiler farklı bireylerde, populasyon gruplarında ve coğrafi bölgelerde ortaya çıkmaktadır. Bunun sonucunda arsenikten kaynaklanan hastalığın uluslararası bir tanımı yapılamamaktadır (Smith ve ark. 1992, Calderon 2000, WHO 2000, WHO 2001, Tchounwou ve ark. 2003, Karataş 2004, Yılmaz ve Ekici 2004, WHO 2006 a).
Arseniğin deri yoluyla alımı oldukça düşüktür. Bu nedenle arsenik içeren sularda el yıkama, banyo yapma, çamaşır yıkama gibi aktiviteler sağlık risklerine neden olmamaktadır (Petrusewski ve ark. 2007).
ASYA : Bangladeş, Kamboçya, Tayvan’ın bazı şehirleri, Hindistan, Đran, Japonya, Nepal, Pakistan, Tayland, Vietnam
AMERĐKA : Alaska, Arjantin, Şili, Dominik Cumhuriyeti, El Salvador, Honduras, Meksika, Nikaragua, Peru, ABD
AVRUPA : Avusturya, Hırvatistan, Fransa, Almanya, Yunanistan, Macaristan, Đtalya, Romanya, Rusya, Sırbistan, Đngiltere
AFRĐKA : Gana, Güney Afrika, Zimbabwe PASĐFĐK : Avustralya, Yeni Zelanda
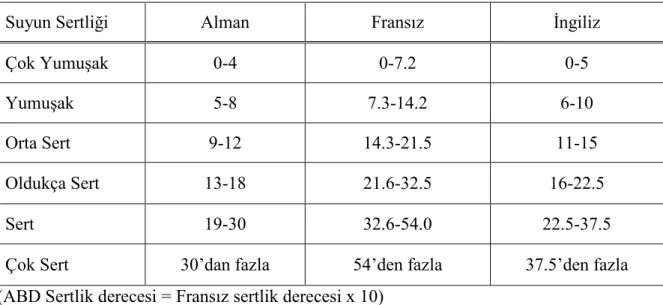
Amerikan Ulusal Bilimler Akademisi tarafından 1998 yılında yapılan bir çalışma sonucunda musluk sularındaki arsenikten kaynaklanan kanserler için risk tahminleri Çizelge 2.1.’de verilmiştir (Anonim 2000).
Çizelge 2.1. Kanser Risk Tahminleri
Musluk Suyundaki Arsenik Seviyesi (ppb) Yaklaşık Toplam Kanser Riski (Günlük 2 Litre Su Tüketimi Baz Alınarak)
0.5 ppb 1/10.000 1 ppb 1/5.000 3 ppb 1/1667 4 ppb 1/1250 5 ppb 1/1000 10 ppb 1/500 20 ppb 1/250 25 ppb 1/200 50 ppb 1/100 2.5.3. Bakır
Atmosfer koşullarında metalik gri tonunda bulunmayan iki metalden biri olan bakır metalik durumda stabildir. Tek değerlikli ve çift değerlikli katyonlar oluşturur. Başlıca bulunan bakır bileşikleri bakır (II) asetat monohidrat, bakır (II) klorit, bakır (II) nitrat trihidrat, bakır (II) oksit ve bakır (II) sülfat pentahidrat’tır. Bu bileşiklerin sırasıyla yoğunlukları (gr/cm3) 1.88 , 3.39, 2.32, 6.32 ve 2.28 dir. Suda çözünürlükleri ise (g/L); 72, 706, 1378, çözünmüyor ve 316 dır (WHO 2004 a).
Bakır toprağın doğal bir bileşenidir. Đnsanlar, hayvanlar ve bitkiler için esansiyel bir besin ögesidir. Endüstride bakırın önemli rol oynamasının ve çeşitli alanlarda kullanılmasının nedeni çok farklı özelliklere sahip olmasıdır. Metalik bakır iyi bir termal ve elektrik iletkenidir. Boruların, valflerin bağlantı elemanlarının, yemek kaplarının ve yapı malzemelerinin yapılmasında kullanılır. Bronz alaşımlarda ve kaplama materyallerinin yapısında bulunmaktadır. Yine fungusitlerin, insektisitlerin, algisitlerin ve ahşap koruyucuların yapısında yer alır. Azo boyaların yapımında kullanılmaktadır. Bakır bileşikleri hayvan yemlerine de ilave edilmektedir. Bakır ayrıca gıda katkı maddesi olarak da kullanılır (Besin öğesi ve renk maddesi olarak). Bakır sülfat pentahidrat bazı durumlarda alglerin kontrolü için yüzey sularına ilave edilmektedir. Bakır sülfat önceleri kusturucu olarak kullanılmış ancak daha sonra bunun sağlık üzerine olumsuz etkileri nedeniyle kullanımından vazgeçilmiştir (Güler ve Çobanoğlu 1997, Karataş 2004, WHO 2004 a, Skipton ve ark. 2007).
Atmosferdeki bakır, toz halindeki jeolojik materyallerin yayılması sonucu bulunur. Bu kaynaklar çevrede açığa çıkan bakırın yalnızca % 4’ünü oluşturur. USEPA’nın 1977-1983 yılları arasında yaptığı ve 23814 hava örneğinin incelenmesi sonucu havadaki bakır konsantrasyonunun 0.003-7.3 µg/m3 arasında olduğu belirlenmiştir. Atmosfere yayılan bakırın ancak %1’i biyolojik kullanılabilir iyon halinde kalırken diğer kısmı sedimente olarak çökelir (WHO 2004 a, WHO 2006 a).
Gıdalar, insanlara bakır bulaşması için temel bir kaynaktır. Karaciğer ve diğer organ etleri, su ürünleri, fındık ve tohumlar gıdalarla alınan bakırın temel kaynaklarıdır. Bakır doğada pek çok meyve ve sebzede bulunur. Örneğin elmada ortalama 0.1-2.3 mg/kg, kuru erikte 3.7-5.0 mg/kg, ay çekirdeğinde 14.3-19 mg/kg bakır bulunur. Bakırın yetişkin insanlar için günlük alım limiti ABD ve Kanada’da 900 µg/gün’dür. 3 yaşına kadar olan çocuklarda bu değer 300 µg/gün, 4-8 yaş arası çocuklarda 440 µg/gün, 9-13 yaş arası çocuklarda 700 µg/gün, 14-18 yaş arasında 890 µg/gün, hamilelikte 1000 µg/gün ve laktasyon döneminde 1300 µg/gün’dür (WHO 2004 a).
Gıda ve sular gelişmiş ülkelerde bakır alımı için başlıca kaynaklardır. Genel olarak yetişkinler için diyetle günlük bakır alımı 1-3 mg’dır. Vitamin, mineral destekleri kullanıldığı zaman bakır alımı yaklaşık 2 mg/gün artmaktadır. Đçme suyu bir çok durumda günlük bakır alımına 0.1-1 mg/gün katkı yapmaktadır (WHO 2004 a).
Bakır yeraltı sularında, deniz suyunda, yüzey sularında ve içme sularında bulunur. Buralarda bulunma şekli kompleksler halinde veya partikül halindedir. Đçme suyunun
kontaminasyonu su dağıtım sistemlerindeki bazı noktalarda ortaya çıkmaktadır. Evlerdeki su tesisatlarında kullanılan bakır borular ve bağlantı ekipmanlarının mikro korozyonu sonucu kontaminasyon gerçekleşmektedir. Korozyona neden olan faktörler ; düşük pH (< 8), yüksek sıcaklık, düşük toplam çözünmüş katı madde içeriği, yüksek miktarda çözünmüş O2 ve CO2 ’dir. Genel olarak yumuşak sular, sert sulardan daha koroziftir. Đyon
değişimi yoluyla yumuşatılmış sularda bakır seviyesinin arttığı görülmüştür (WHO 2004 a, Skipton ve ark. 2007).
Bakır, içme sularında çözündüğü zaman bazı durumlarda açık mavi ya da mavi-yeşil bir renk, istenmeyen metalik acı bir tat ile tesisat üzerinde mavi-mavi-yeşil lekeler oluşturabilir (WHO 2004 a, Skipton ve ark. 2007).
Yüzey ve yeraltı sularında bakırın başlıca kaynakları; endüstriyel kirlilik, evsel atıklar ve madencilik atıklarıdır. ABD’de yapılan çok sayıda çalışmada yüzey sularındaki bakır konsantrasyonunun 0.0005-1 mg/L arasında değiştiği tespit edilmiştir. Bakır konsantrasyonu pH, sertlik ve su dağıtım sisteminde bakır bulunması gibi su karakteristiğindeki farklılıkların bir sonucu olarak oldukça geniş bir aralıkta olabilmektedir. Avrupa, Kanada ve ABD’deki çok sayıda çalışmanın sonucu içme sularındaki bakır seviyelerinin ≤ 0.005 ile > 30 mg/L arasında değiştiğini ve sudaki bakırın temel kaynağının içme suyu şebekesinin bakır aksamın korozyonu olduğunu göstermiştir. Asidik ya da alkali pH’ya sahip yüksek karbonatlı sularda suyun dağıtımı sırasında sudaki bakır konsantrasyonu çoğunlukla artmaktadır (WHO 2004 a, WHO 2006 a).
USEPA halk su sağlayıcıları için bakır seviyesini 1.3 ppm olarak belirlemiştir. Đçme sularında WHO tarafından belirlenen sınır değer 2 mg/L’dir (WHO 2004 a, WHO 2006 a, Skipton ve ark. 2007).
Bakır zehirlenmesi akut ve kronik olarak iki şekilde görülür. Akut bakır zehirlenmesi seyrek olarak gözlenir. Genelde yiyecek ve içeceklere kazayla bakır ihtiva eden maddelerin karışması ile veya kasten bakır tuzlarının yutulması sonucu zehirlenme oluşur. Akut bakır zehirlenmesinde gözlenen belirtiler tükürük salgılamanın artması, mide ağrıları, bulantı ve ishal’dir. Ayrıca alınan doza bağlı olarak koma ve ölümde görülebilir (Güler ve Çobanoğlu 1997, Akar 2000, Karataş 2004, WHO 2004 a).
Kronik bakır zehirlenmesi ise ender rastlanan bir durum olup genellikle uzun süre bakır ile temas halinde olan yiyecek ve içeceklerin ağız yolu ile alınması sonucu ortaya çıkabilir. Bakır zehirlenmesi sonucu karaciğerde leke oluşması ve siroz, sinir sisteminde
bozukluk, böbrek fonksiyonlarında zayıflama görülür (Güler ve Çobanoğlu 1997, Akar 2000, Karataş 2004, WHO 2004 a).
2.5.4. Demir
Demir yer kabuğunda en çok bulunan ikinci metaldir. Miktarı yaklaşık % 5 kadardır. Buna karşın doğal sularda az miktarda bulunmaktadır. Element halindeki demir doğada çok nadir bulunmaktır. Đyon halindeki Fe2+ ve Fe3+ oksijen ve sülfür içeren bileşiklerde kompleks oluşturma aktiviteleri yükseltir ve reaksiyon sonunda oksitler, hidroksitler, karbonatlar, sülfitler oluşabilmektedir. Demir doğada en çok oksitleri halinde bulunur. Demirin erime noktası 1535 0C, özgül ağırlığı 25 0C’de 7.86’dır (WHO 1996 a, Güler ve Çobanoğlu 1997, Anonim 2007 b).
Demir başlıca, içme suyu borularının yapı malzemesi olarak kullanılır. Demir oksitler, boya ve plastiklerde pigment olarak kullanılmaktadır. Diğer demir bileşikleri gıda boyaları ve insanlarda demir eksikliğinin tedavisinde kullanılmaktadır. Çok sayıda demir tuzu suyun işlenmesinde koagulant olarak kullanılmaktadır (WHO 1996 a, Güler ve Çobanoğlu 1997).
Demir’in çevrede bulunma oranları farklılık göstermektedir. Şehirlerde havada 1.3 µg/m3 seviyelerinde bulunurken, şehir merkezlerinden uzak bölgelerde 50-90 ng/m3 seviyelerinde, demir çelik üreten tesislerin bulunduğu bölgelerde ise 12 µg/m3’ün üzerinde bulunabilmektedir. Demir bitki ve hayvanlarda doğal olarak bulunan bir unsurdur. Karaciğer, böbrek, balık ve yeşil sebzeler 20-150 µg/kg demir içermekte iken kırmızı etler ve yumurta sarısı 10-20 µg/kg, pirinç 1-10 µg/kg demir içerir (WHO 1996 a).
Nehirlerde ortalama demir konsantrasyonu 0.7 mg/L olarak bildirilmiştir. Anaerobik yeraltı sularında bulunan demir, Fe (II) formundadır ve konsantrasyonu normal olarak 0.3 µg/L’den azdır. Fakat su işleme tesislerinde koagulant olarak çeşitli demir tuzları kullanılan ülkelerde bu değer daha yüksek olabilmektedir. Bunun yanında su dağıtım şebekelerinde galvanize demir borular ve çelik kullanımı durumunda da içme suyundaki demir konsantrasyonu yüksek olabilmektedir (WHO 1996 a).
USEPA tarafından demir, içme suları için ikinci derece kontaminant olarak değerlendirilmektedir. Sudaki mevcut tavsiye edilen limit 0.3 mg/L (ppm)’dir. Bu değer suyun duyusal özelliklerindeki kalite değişimleri baz alınarak değerlendirilmiştir (Güler ve Çobanoğlu 1997).
suyunda tat eşik değeri 0.12 mg/L’dir. Kuyu sularında 0.3 mg/L’nin altındaki demir konsantrasyonları duyusal olarak hissedilememektedir. 0.3-3 mg/L demir konsantrasyonlarının ise duyusal olarak hissedilebildiği bildirilmiştir (WHO 1996 a).
Đçme suyu kaynaklarında demir (II) tuzları stabil değildir ve demir (III) hidroksit olarak çökmektedir. Demir (III) hidroksit suda pas rengi olarak kendini göstermektedir Anaerobik yeraltı suları herhangi bir kuyudan direkt olarak pompalandığında renk değişikliği ya da bulanıklık olmaksızın litrede birkaç miligramın üzerinde demir (II) konsantrasyonu içerebilmektedir. Buna karşın su borularında 0.05-0.1 mg/L’nin üzerindeki demir konsantrasyonu bulanıklık ve renk değişimi meydana getirebilmektedir (WHO 1996 a). Demir konsantrasyonu 0.3 mg/L’nin üzerinde olduğunda sıhhi tesisat, çamaşırlar, cam kaplar ve tabaklar gibi malzemelerde kırmızı, kahverengi ya da sarı lekeler oluşturabilmekte ve suda metalik bir tat ile demir kokusu hissedilmektedir. Demirce zengin sular çay, kahve ve alkollü içeceklerle karıştırıldığında siyah, mürekkebimsi bir görünüş ve tat oluşturabileceği bildirilmektedir. Demirce zengin sularla pişirilen sebzeler siyahlaşmakta ve renkleri bozulmaktadır (WHO 1996 a, Anonim 2007 b).
Ayrıca demir, su pompa istasyonunda ve dağıtım sisteminde istenmeyen bakteriyel gelişimi (demir bakterileri) teşvik edebilir. Bu demir korozyon ürünlerinin içme suyu dağıtım şebekelerinde bakteriyel aktiviteyi teşvik ettiği bildirilmiştir. Söz konusu durum suda süspanse olmuş bakteriler ve koliform bakterilerin bulunmasını arttırmaktadır. Çevresel demir minerali üzerinde ve paslanmış metalik yüzeylerde bakteriyel hücrelerin yüksek oranda birikmesinin demir oksitlerin yüzey özelliklerinden olabileceği bildirilmektedir. Demir aynı zamanda karbon, azot ve fosfor elementleri gibi bakteriyel gelişme için gerekli bir besin ögesi olarak değerlendirilmektedir. Demirin hem besin ögesi hem de elektron alıcısı olarak kullanılmasının içme sularındaki E.coli’nin gelişmesi için bir avantaj sağladığı görülmüştür. Düşük konsantrasyonlarda demir içeren suya az miktarda demir sülfat ilavesinin E.coli sayısının önemli derecede artmasına neden olduğu bildirilmiştir (Appenzeller ve ark. 2005).
Demir’in insanlara bulaşmasındaki başlıca kaynak gıdalardır. Gıdalarla günlük olarak 10-14 mg demir alındığı bildirilmektedir. 0.3 mg/L demir içeren içme suyu günlük demir alımına yaklaşık 0.6 mg katkıda bulunmaktadır. Şehirlerde havadan demir alımı yaklaşık 25 µg/gün’dür (WHO 1996 a).
Demir insan beslenmesinde esansiyel bir elementtir. Demir için minimum gereksinim yaş, cinsiyet, fizyolojik durum ve demirin biyoyararlılığına bağlı olarak 10-15 mg/gün aralığında değişmektedir. Demirin ortalama öldürücü dozu 200-250 mg/kg vücut
ağırlığıdır. Fakat 40 mg/kg vücut ağırlığı gibi dozların ağızdan doğrudan vücuda alımını takibende ölüm gerçekleşmektedir. Demir zehirlenmesi sonucu; kusma, karnın üst bölgesinde ağrı, solukluk, siyanoz, ishal, uyku hali ve şok gözlenir. Ayrıca bazı alerjik rahatsızlıklar ve siroz gibi hastalıklarda görülebilir (WHO 1996 a).
Demirin kronik olarak vücuda alınmasının genetik bozukluklara neden olabildiği bildirilmiştir (WHO 1996 a).
2.5.5. Kadmiyum
Kadmiyum, yer kabuğu üzerinde geniş bir yayılıma sahip olup ortalama konsantrasyonu 0.1 mg/kg’dir. Kimyasal olarak çinko ile benzer özelliklere sahip olup sülfat cevherlerinde çinko, bakır ve kurşun ile birlikte doğal olarak bulunmaktadır. Kadmiyum tuzlarının çözünürlük dereceleri önemli ölçüde farklılıklar gösterir. Halojen, sülfat ve nitrat tuzları nispeten suda çözünürken; oksit, hidroksit ve karbonat bileşikleri aynı ortamda çözünmezler. Kadmiyumun yoğunluğu 8.64 g/cm3, erime noktası 320.9
0
C’dir (Güler ve Çobanoğlu 1997, WHO 2004 b, Brigano ve ark. 2004).
Kadmiyum’un başlıca kullanım alanları; metalurjik alaşımlar, seramikler, elektro kaplama, kumaş boya çalışmaları, tekstil boyama, kimyasal endüstri, nikel-kadmiyum batarya sanayi, PVC stabilizatörü olarak ve antikorozif olarak kullanılmaktadır (Güler ve Çobanoğlu 1997, Karataş 2004, WHO 2004 b).
Kadmiyum fosfatlı gübrelerde, deterjanlarda ve rafine petrol türevlerinde bulunur ve bunların çok yaygın kullanımı sonucunda da önemli miktarda kadmiyum kirliliği ortaya çıkar. Đnsan yaşamını etkileyen önemli kadmiyum kaynakları; sigara dumanı, rafine edilmiş yiyecek maddeleri, su boruları, kahve, çay, kömür yakılması, kabuklu deniz ürünleri, tohum aşamasında kullanılan gübreler ve endüstriyel üretim aşamalarında oluşan baca gazlarıdır (Karataş 2004, WHO 2004 b).
Kadmiyum organizmaya çoğunlukla solunum ve gıda yolu ile girer. Gıda yolu ile alınan kadmiyum oranı daha azdır (Karataş 2004).
Kadmiyum havada partiküller halinde bulunmaktadır. Yerleşim alanlarındaki atmosferin ortalama 0.001 g/m3 düzeyinde kadmiyum ile kirlendiği ve bunun sonucunda insanların solunum yolu ile günlük 0.02-1 mg kadmiyum aldıkları hesaplanmıştır. Almanya’da 1981-1982 yılları arasında 4 şehirde yapılan bir çalışmada yıllık ortalama kadmiyum konsantrasyonu 1-3 ng/m3 olarak bulunmuştur. Hollanda’da 1980-1983 yılları arasındaki yıllık ortalama konsantrasyonu 0.7-2 ng/m3 olarak bulunmuştur. Havadaki
1985-1986 yıllarında yapılan bir çalışmada endüstriyel alanlarda yıllık seviye 10-60 ng/m3 olarak belirlenmiştir. Sigara içme, evlerin içindeki kadmiyum konsantrasyonunu yükseltmektedir (WHO 2004 b).
Kirlenmiş toprakta yetişen mahsuller ile kirlenmiş su ile muamele edilmiş toprakta yetişen mahsuller yüksek konsantrasyonda kadmiyum içerebilir. Kontamine olmuş meralarda otlayan hayvan etleri de yüksek konsantrasyonda kadmiyum içerebilir. Hayvansal gıdalardan karaciğer ve böbrekler kadmiyumca zengindir. Meyve, et ve sebzelerdeki kadmiyum seviyesi genellikle 10 µg/kg’ın altındadır. Karaciğerde 10-100 µg/kg ve böbreklerde 100-1000 µg/kg’dır. Tahıllarda yaklaşık 25 µg/kg (nemli ağırlık)’dır. Kadmiyumun günlük diyetle alım miktarı 10-35 µg olarak tahmin edilmektedir. Gıdalar ile alınan kadmiyum miktarı ortalama 10-25 µg/kg kadardır (WHO 2004 b).
Kadmiyum suda çözünebilme özelliğinden dolayı Cd2+ halinde bitki ve deniz canlıları tarafından biyolojik sistemlere alınır. Kirlenmemiş doğal sulardaki kadmiyum konsantrasyonu genellikle 1µg/L’nin altındadır. Đçme sularındaki kontaminasyonuna; borularda çinko kirliliğinden dolayı kadmiyum bulunmasının bir sonucu olarak ya da bağlantı ekipmanları, su ısıtıcıları, soğutucuları ve musluklardaki kadmiyum içeren lehimler neden olmaktadır. Volkanik hareketlerle de kadmiyum yeraltı ve yerüstü sularına bulaşabilir (WHO 2004 b).
Kadmiyum seviyesi, düşük pH’lı yumuşak suların sağlandığı bölgelerde daha yüksek olabilir. Bu durum aynı zamanda koroziviteyi de artırmaktadır (WHO 2004 b, Brigano ve ark. 2004).
Sudaki kadmiyumun çözünürlüğü çok önemli oranda suyun asitliğine bağlıdır. Süspanse olmuş ya da sedimentlere bağlanmış durumdaki kadmiyum, asitliğin artması ile tekrar çözünür duruma geçebilir. Doğal sulardaki kadmiyum çoğunlukla dipteki sedimentlerde ve süspanse olmuş partiküllerde bulunmaktadır (Brigano ve ark. 2004).
Kadmiyumun içme sularıyla alımı genellikle 2 µg/gün’den daha düşüktür. USEPA içme sularındaki kadmiyum seviyesini maksimum kontaminant olarak 0.005 mg/litre olarak belirlemiştir (Brigano ve ark. 2004).
Đçme sularında güvenli olarak değerlendirilen seviyeler (kısa süreli maruz kalmalarda); 1-10 gün süre ile günlük 1 litre su içen 10 kg’lık bir çocuk için 0.04 mg/L, 7 yaşından büyük çocuklar için daha uzun süreli kadmiyuma maruz kalma seviyesi 0.005 mg/L’dir. 0.005 mg/L’ den yüksek konsantrasyonlarda uzun süre kadmiyuma maruz kalma böbrek, karaciğer, kemik ve kanda bozukluklara neden olur (Brigano ve ark. 2004).
Kadmiyum’a akut olarak oral yolla maruz kalma sonucu başlıca; kusma, ishal, kas krampları, bulantı, ağız sulanması ve duyusal algı bozuklukları, karaciğer ve böbrek hasarı görülebilir (WHO 2004 b, Brigano ve ark. 2004, Godt ve ark. 2006).
Solunumla maruz kalma sonucu; akut pnömoni ve pulmoner ödeme bağlı olarak akut solunum yetmezliği gözlenir. Ayrıca plasentaya toksik etkisi olup fetus’un büyümesinde gerilik ve düşük doğum ağırlığına sebep olur (Brzoska ve Monıuszko 1998, Koçak 2004).
Kronik kadmiyum zehirlenmesinde; iştahsızlık, kilo kaybı, yorgunluk, anemi, kemiklerde hasarlar (osteomalazi, osteoporoz), hipertansiyon, kardiyovasküler hastalıklar, sinir sistemi semptomları (baş ağrısı, baş dönmesi, uyku bozuklukları, tremor, parestezi ve kramplar) görülür (Brzoska ve ark. 1998). Kronik alım sonucunda en hassas organ böbrektir. Kronik zehirlenmede görülen en önemli etki özellikle akciğer ve prostat kanseridir (Brzoska ve ark. 1998, Akar 2000, WHO 2004 b, Godt ve ark. 2006).
2.5.6. Kurşun
Kurşun yerkabuğunda ve biyosferin hemen her yerinde doğal olarak bulunan bir elementtir. Yer kabuğunda 13 mg/kg düzeyinde bulunmaktadır. Kurşun çoğunlukla gümüş, bakır, çinko, antimon ve demir metalleri ile birleşmiş halde bulunur. Yumuşak bir metaldir ve erime noktası 327 0C’dir (WHO 1996 b, Güler ve Çobanoğlu 1997). Kurşun ve bileşikleri 8000 yılı aşkın bir süredir kullanılmaktadır. Kurşun; alaşımların, bataryaların, lehimlerin, pigmentlerin, kablo kılıflarının, pas önleyicilerin, mühimmatın sırlı porselenlerin, konservelerdeki lehimlerin, levhaların, yapı kaplamalarının yapımında, tel ve kablo imalatında kullanılmaktadır. Tetra etil ve tetra metil kurşun, petrolde detonasyon kesici madde olarak yaygın şekilde kullanımından dolayı önemlidir. Fakat bu bileşiklerin söz konusu amaçla kullanımları Kuzey Amerika ve Batı Avrupa’da neredeyse tamamen bırakılmıştır. Ancak Doğu Avrupa ve birçok gelişmekte olan ülkede devam etmektedir. Kurşunun su dağıtım sistemlerindeki lehimlerde ve bağlantı ekipmanlarında kullanımı önem taşımaktadır (WHO 1996 b, Güler ve Çobanoğlu 1997, Kitman 2000, Karataş 2004, Dündar ve Aslan 2005).
Kurşun su, toprak ve hava arasında doğal, kimyasal ve fiziksel yollarla çevrilmektedir. Tozda veya akarsularda birikerek yayılabilmektedir. Toplumlar için en önemli kurşun kaynakları ülkelere göre değişmektedir. ABD’de en önemli kurşun kaynağı
eski boyalı evlerken ülkemizde kurşunlu benzin kullanımından çıkan egzoz gazlarıdır (Güler ve Çobanoğlu 1997, Hızel ve Şanlı 2006).
Havada kurşun konsantrasyonu çok sayıda faktöre bağlıdır. Bu faktörler; otoyollara ve muhtemel kurşun kaynağına yakınlık, endüstriyel öğütme işlemleri sırasında oluşan tozlar ve kurşun içeren yakıt dumanlarıdır. Atmosferde başlıca parçacıklar halinde bulunur (WHO 1996 b, Güler ve Çobanoğlu 1997, Hızel ve Şanlı 2006). Kurşunun havadaki ortalama konsantrasyonu 0.2 µg/m3 olarak varsayılırsa havadan kurşun alımı yetişkinler için 4 µg/gün, çocuklar için ise 0.5 µg/gün olarak hesaplanabilir (WHO 1996 b).
Lehimli ambalajlardaki konserve, mama, diğer gıda ve içecekler, kurşunla kontamine olmuş su ve arazilerden elde edilen sebze ve meyveler, tütün mamulleri, ortamdan etkilenen balık, beyaz ve kırmızı et, sakatat türleri, süt ve süt ürünleri kurşunun başlıca bulaştığı gıdalardır. Günlük kurşun alımının yaklaşık % 16’sı yiyeceklerden, % 40’ı yemek hazırlarken yüzeylerde bulunan tozun bulaşmasından, % 75’i ise toz şeklinde alınmaktadır. Kurşun içeren suyu içmek veya bu suyu kullanarak yemek pişirmek de kurşun alımına neden olmaktadır (Güler ve Çobanoğlu 1997, Bellinger 2004, Karataş 2004, Dündar ve Aslan 2005, Hızel ve Şanlı 2006).
Onlarca yıl önce kullanılan kurşun borulardan akan içme suyu şebekelerindeki sular, WHO tarafından belirlenen ve önerilen 0.01 mg/L düzeyinin çok üzerinde kurşun içermekteydi. 1960’lı yıllardan sonra terk edilen bu borular yerine kullanılan bakır alaşımlı borularda ise, bağlantı noktalarındaki kurşun lehimler ve metal korozyonu nedeniyle, içme sularına kurşun bulaşması engellenememiştir (WHO 1996 b, Dündar ve Aslan 2005, Skipton ve ark. 2006). Bu borulardaki kurşun içme suyuna geçerek sudaki kurşun miktarını artırabilir. Đçme suyu dağıtım sisteminden kurşunun ayrışması; ortamda klorid ve çözünmüş oksijenin varlığı, pH, sıcaklık, suyla temas süresi ile suyun yumuşak veya sert su oluşuna bağlıdır. Özellikle lehimle bağlantı yapılan bakır borularda lehimden kurşun ayrılarak suya geçebilir (WHO 1996 b, Clair ve Zaslow 1996, Skipton ve ark. 2006). Yumuşak sular, sert sulara göre daha koroziftir. Çünkü bunlar daha asidiktir ve toplam çözünmüş katı madde oranı daha düşüktür (WHO 1996 b, Dietrich ve ark. 2004, Skipton ve ark. 2006). Birçok ülkede çeşme suyunda kurşun seviyesi ortalama 10-20 µg’dır. ABD’de sularda bulunmasına izin verilen kurşun miktarı ilk olarak 50 ppb ile sınırlandırılmıştır. Yeni sağlık ve yayılma verilerinin ışığında USEPA bu değeri 15 ppb’ye düşürmüştür. Đçme sularında kurşun seviyesi en fazla 0.05 mg/L olmalıdır ( Dietrich ve ark. 2004). WHO musluk sularında izin verilebilen kurşun miktarını 10 µg/L olarak belirlemiştir (Hızel ve Şanlı 2006).
Đçme sularındaki kurşun konsantrasyonunun 5 µg/L olduğu varsayılırsa içme suyu yoluyla toplam kurşun alımı yetişkinler için 10 µg/L, bebekler için 3.8 µg/L olarak hesaplanabilir (WHO 1996 b).
ABD’de içme suyundaki kurşunun minimalize edilmesi için kanunlarla uygulanan bir program bulunmaktadır. Bu program aşağıdaki maddeleri kapsamaktadır (Clair ve Zaslow 1996).
- Suyun pH’sı ayarlanarak ekipmanlardan korozyon sonucu kurşunun suya geçişinin engellenmesi
- Đçme suyunun işlenmesi - Halkın eğitimi
Kurşunun toksik etkileri akut ve kronik olarak ayrılsa da bu iki kategori arasında keskin bir sınır yoktur. Kurşun zehirlenmesinin belirtileri erişkinlerde birkaç hafta, çocuklarda ise birkaç gün içinde ortaya çıkar. Düşük dozlarda kurşun alımında akut etkiler çoğunlukla hissedilmez. Bebekler, fetus, hamile kadınlar kurşunun etkilerinin görülmesi için hassas gruplardır. Akut kurşun zehirlenmesinde yorgunluk, halsizlik, karın ağrısı, hassasiyet, kansızlık ve çocuklarda davranış bozuklukları, böbrekte hasar, hafıza kaybı, ensefalopati gözlenebilir (WHO 1996 b, Bellinger 2004, Dietrich ve ark. 2004, Dündar ve Aslan 2005, Hızel ve Şanlı 2006).
Kronik kurşun zehirlenmesinde; yorgunluk, uykusuzluk, baş ağrısı, eklem ağrısı, ve mide-bağırsak semptomları gözlenebilir (WHO 1996 b, Dietrich ve ark. 2004, Dündar ve Aslan 2005, Hızel ve Şanlı 2006).
Kurşun zehirlenmesi çocuklarda psikomotor gelişim ve zihinsel işlevleri etkileyen bir faktördür. Kurşun zehirlenmelerinde demir eksikliği anemileri de gözlenebilir. Kurşunun mutajenik ve kanserojenik etkisi de söz konusudur (WHO 1996 b, Güler ve Çobanoğlu 1997, Akar 2000, Bellinger 2004, Karataş 2004, Dietrich ve ark. 2004, Dündar ve Aslan 2005, Hızel ve Şanlı 2006).
2.5.7.Mangan
Mangan, yerkabuğunda en yüksek oranda bulunan metallerden birisidir ve genellikle demirle birlikte bulunmaktadır. 100’ün üzerinde mineralin bileşenidir fakat elemental halde doğal olarak bulunmaz. Birçok hücre enziminin fonksiyonunu yerine getirebilmesi için gerekli bir elementtir. Çevrede en çok bulunan ve biyolojik olarak önemli mangan bileşikleri Mn+2, Mn+4 yada Mn+7 içermektedir (Güler ve Çobanoğlu 2001,
Mangan; demir ve çelik alaşımlarının ve mangan bileşiklerinin üretiminde ve çeşitli ürünlerde katkı maddesi olarak kullanılmaktadır. Mangan dioksit ve bazı mangan bileşikleri; pillerin ve cam gibi ürünlerin yapımında, potasyum permanganat; temizleme, ağartma ve dezenfeksiyon amacıyla bir oksidant olarak, diğer bazı mangan bileşikleri; gübrelerde, fungusitlerde ve hayvan yemlerinde katkı maddesi olarak kullanılmaktadır (WHO 2004 c, WHO 2006 a).
Mangan bileşikleri endüstriyel emisyonlar, toprak erozyonu, volkanik emisyonlar ve metilsiklopentadienil mangan trikarbonil (MMT) içeren petrolün yanması sonucu atmosferde bulunabilir (WHO 2004 c).
Demir alaşım üretim yerleri ve kok fırınları gibi nokta kaynakları bulunmasına bağlı olarak havadaki mangan seviyesi de değişmektedir. Endüstriyel kaynaklara yakın yerlerdeki ortam havasındaki ortalama mangan seviyesi 220-300 ng/m3 iken nokta kaynakların olmadığı kent bölgelerindeki seviye 10-70 ng/m3 olarak rapor edilmiştir (WHO 2004 c).
Mangan birçok gıda kaynağında doğal olarak bulunur. Bu kaynaklar; sebzeler, tahıl taneleri ve hayvansal ürünlerdir. Gıdalar genel populasyonda mangan alımı için en önemli kaynaktır (WHO 2004 c). Vejetaryen diyetlerde bu oran daha da yüksek olabilir. Yetişkinler diyetle günlük 0.7-10.9 mg mangan almaktadır. Yiyeceklerdeki mangan miktarı önemli derecede değişiklik gösterir. Süt ürünlerinde düşük konsantrasyonlarda, etlerde 0-0.8 mg/kg , balıkta 0-0.1 mg/kg düzeyinde bulunmaktadır (Güler ve Çobanoğlu 2001, WHO 2004 c).
Mangan; doğal olarak bir çok yüzey suyunda ve yeraltı suyunda da bulunabilir. Yeraltı suları yüzey sularına göre daha sıklıkla mangan içermektedir. Deniz suyundaki mangan konsantrasyonu 0.4-10 µg/L olarak bildirilmiş olup ortalama 2 µg/L’dir. Taze sulardaki seviyeler ise 1-200 µg/L’dir. Đçme suları ile mangan alımı gıdalarla alıma oranla oldukça düşük seviyededir. ABD’de yapılan bir çalışmada günlük 2 litre su içen bir kişinin günlük 20 mg mangan alabileceği bildirilmiştir. Mineral içme suları mangan miktarını önemli derecede artırabilir (WHO 2004 c).
Demiri fazla olan sularda, çok defa mangana rastlanır. Fakat miktarı çok az olup litrede 0.3 mg’ı geçmez. Yeraltı sularında bulunan mangan ortamda oksijen bulunmayışı nedeniyle iki değerliklidir. Yüzeysel sularda, özellikle göl ve baraj gibi rezervuarların dip çökeltisi çamurları içerisinde bulunur ve indirgeyici ortamda çamurdan suya geçer (Güler ve Çobanoğlu 2001). Yüzey sularında pH, anyonların varlığı ve oksidasyon redüksiyon
potansiyeline bağlı olarak mangan hem çözünmüş hem de süspanse olmuş halde bulunur (WHO 2004 c).
ABD’deki yeraltı sularındaki mangan’ın belirlenme sıklığının yüksek olduğu bildirilmiştir. Bunun nedeni toprak ve kayalardaki manganın çokluğudur. Ancak yeraltı sularında belirlenen seviyeler halk sağlığı açısından önemli olan seviyelerin altındadır. Benzer şekilde yüzey sularının büyük çoğunluğunda mangan bulunmakta ve bulunan mangan seviyeleri halk sağlığını olumsuz etkilememektedir. ABD’de 1984-1986 yılları arasında yapılan bir çalışmada 49 bölgede yeraltı suları incelenmiş ve % 68’inde mangan tespit edilmiştir (Güler ve Çobanoğlu 2001).
Manganın suda bulunmasının zararı, endüstri sularında hemen hemen demirin etkisinin aynısıdır. Bu da suda bazı bakterilerin çoğalmasına yardım ettiği gibi, boruların tıkanmasına neden olmaktadır (Güler ve Çobanoğlu 2001).
Mangan konsantrasyonunun 0.1 mg/L’nin üzerine çıkması sularda istenmeyen tat ile çamaşırlarda ve tesisat ekipmanlarında lekelere sebep olmaktadır. 0.02 mg/L kadar düşük konsantrasyonlardaki mangan bakır borular üzerinde bir tabaka oluşturabilir, daha sonra bu siyah çöküntü olarak dökülür. Birçok ülkede mangan için standart değer 0.05 mg/L olarak belirlenmiştir (WHO 2004 c).
Đnsanlar da dahil olmak üzere birçok organizma için mangan esansiyel bir elementtir. Sağlık üzerine zararlı etkileri çok yüksek düzeylerde alındığı zaman ortaya çıkmaktadır. Mangan’ın çok yüksek seviyelerde çıkması sonucu ortaya çıkan sendrom manganism olarak bilinmektedir ve parkinson benzeri bir sendrom olarak karakterize edilmektedir (WHO 2004 c, WHO 2006 a).
1941 yılında Japonya’da beyinle ilgili hastalığın nedeni 14 mg/L manganla kirlenmiş kuyu suyuna bağlanmıştır. Bununla birlikte yalnız mangan konsantrasyonunun bu hastalığın nedeni olabileceğinin iddia edilemeyeceği bildirilmektedir (Güler ve Çobanoğlu 2001).
2.5.8. Sertlik
Sertlik suyun sabunu köpürtmesinin bir ölçüsüdür. Büyük oranda su içinde çözünmüş (+2) değerlikli katyonların (Ca++,Mn++, Sr++, Fe++, Mg++) bir sonucudur. Sertlik; suda bulunan polivalan iyonlar sayısını, özellikle kalsiyum ve magnezyum miktarını belirlemek için kullanılır. Sularda sertlik iki türlüdür. Bikarbonatların oluşturduğu “geçici sertlik” ile kalsiyum ve magnezyum sülfatların oluşturduğu “kalıcı sertlik” tir. Ayrıca
alüminyum, demir, mangan, stronsiyum ve çinko da sertliğe sebep olmaktadır (Greenberg ve ark. 1998, Örgen ve Đnanç 2004, Tekbaş ve Güleç 2004).
Đçinde fazla miktarda kalsiyum ve magnezyum tuzu bulunan sular sert sulardır. Đçinde 0-75 mg/L CaCO3 bulunan sular “yumuşak”, 75-150 mg/L CaCO3 bulunan sular
“orta derecede sert”, 150-300 mg/L CaCO3 bulunan sular “sert” ve 300 mg/L CaCO3’ün
üzerinde ise “çok sert” sular olarak kabul edilmektedir (Örgen ve Đnanç 2004). Suların sertliklerini belirtmekte kullanılan birimler değişiktir. Ülkemizde Fransız sertlik derecesi kullanılır. Bu ölçüme göre ; bir sertlik derecesi litrede 10 mg kalsiyum karbonata eşittir. Çok yumuşak sular 0-7.2 sertlik derecesinde, çok sert sular 54 ve daha fazla sertlik derecesindedir. Suların sertlik derecelerine göre sınıflandırılması Tablo 2.7.’de verilmiştir (Tekbaş ve Güleç 2004).
Tablo 2.7. Sertlik Derecesine Göre Suların Sınıflandırılması
Suyun Sertliği Alman Fransız Đngiliz
Çok Yumuşak 0-4 0-7.2 0-5
Yumuşak 5-8 7.3-14.2 6-10
Orta Sert 9-12 14.3-21.5 11-15
Oldukça Sert 13-18 21.6-32.5 16-22.5
Sert 19-30 32.6-54.0 22.5-37.5
Çok Sert 30’dan fazla 54’den fazla 37.5’den fazla
(ABD Sertlik derecesi = Fransız sertlik derecesi x 10) (1 Fransız SD = 0.56 Alman SD = 0.70 Đngiliz SD)
Çeşitli ülkeler farklı sertlik dereceleri kullanmaktadır. Bunlar arasında en sık kullanılanlar ve karşılığı olan kalsiyum oksit veya bikarbonat miktarları şu şekildedir.
1 Alman sertlik derecesi = 100 ml suda 1 mg Ca0 1 Fransız sertlik derecesi = 100 ml suda 1 mg CaCO3
1 Đngiliz sertlik derecesi = 700 ml suda 10 mg CaC03
1 USA sertlik derecesi = 100 ml suda 0.1 mg CaC03
Sert sular, sağlık açısından doğrudan zararlı olmasa bile yemek pişirmeye ve içmeye elverişli değildir. Ayrıca bu nitelikteki sular, çamaşır yıkamada ya da sanayide kullanılırsa çok sabun sarfiyatına neden olacağı gibi kazan ve boruların içine kireç tabakasının yığılmasına da yol açmaktadır (Bilgin 2003, Tekbaş ve Güleç 2004).
Yumuşak sular, aşındırıcı olduğu için iletim hatlarında korozyona neden olurlar. Bu sular yüksek geçirgenlikleri nedeniyle temas ettikleri kurşun, bakır, çinko, kadmiyum ve buna benzer toksik metalleri daha yüksek yoğunluklarda içerebilirler (Bilgin 2003, Tekbaş ve Güleç 2004).
Suyun sertliğinin sağlık üzerine herhangi bir etkisi olmasa da içimi hoş olan sular daha çok orta sertlikteki sulardır (Bilgin 2003, Tekbaş ve Güleç 2004).
2.5.9. Đletkenlik
Đletkenlik; ısı, elektrik ve sesi iletme veya aktarma gücü ya da kabiliyeti olarak tanımlanan bir kelimedir. Birimleri SI birim sisteminde Siemens/metre, Amerika’da ise mikrohom/cm (mmho/cm)’dir. Sembolü κ’dır. 1 S=1/Ohm=Ohm-1=1mho olduğuna göre, öz iletkenlik = mho.cm-1 veya S/cm’dir. Doğal suların iletkenliği çok küçük olduğundan, suların öz iletkenliği genellikle µmhos/cm (µS/cm) cinsinden ifade edilir (Anonim 2007 c). Elektriksel iletkenlik (EC) ise; sudaki toplam çözünmüş tuzların (TDS) ya da çözünmüş iyonların toplam miktarlarının tahminidir. Bir cm3 suyun 25°C’de iletkenliği olarak tanımlanır ve sıcaklıktaki 1°C’lik artış elektriksel iletkenliği yaklaşık % 2 artırır (Örgen ve Đnanç 2004). Suların elektriksel iletkenliği ölçülerek su içinde çözünmüş tuz miktarı hakkında fikir edinilebilir. Sudaki birçok kirletici elektrik iletkenliğinin yükselmesine neden olarak sinyal verir (Berktay 2004).
Kaliteli bir kaynaktan gelen su, elektrik akımına karşı sabit bir direnç gösterir. Kaynağın debisine ve suyun toprak tabakalarından yavaş olarak süzülmesine bağlı olarak su genellikle aynı miktarda mineral madde yüklenir. Kalitesiz kaynaklarda ise; yağmurlar sonucu fazla su, çatlaklar arasından geçerek geldiği zaman hem suyun debisi hem de iletkenliği değişir (Bilgin 2003).
Saf su iyi bir iletken değildir. Sudaki iyon konsantrasyonunun artması suyun iletkenliğini de artırır. Bundan dolayı suda çözünen iyon konsantrasyonu arttıkça iletkenlik de artar. Sulara ait tipik iletkenlik değerleri Çizelge 2.2.’de verilmiştir (Anonim 2007 c).
Çizelge 2.2. Sulara Ait Tipik Đletkenlik Değerleri. Ultra Saf Su 5.5x10-6 S/m
Đçme Suyu 0.005-0.05 S/m