T.C.
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI
PANKREAS KANSERİNDE
SERİN PROTEAZ İNHİBİTÖRÜ, KAZAL TİP1 (SPINK1) DÜZEYİ
UZMANLIK TEZİ
Dr. ALİDA ALİYEVA
TEZ DANIŞMANI
Prof. Dr. NEVİN ORUÇ
İZMİR 2018
T.C.
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI
PANKREAS KANSERİNDE
SERİN PROTEAZ İNHİBİTÖRÜ, KAZAL TİP1 (SPINK1) DÜZEYİ
UZMANLIK TEZİ
Dr. ALİDA ALİYEVA
TEZ DANIŞMANI
Prof. Dr. NEVİN ORUÇ
İZMİR 2018
I
ÖNSÖZ
Ege Üniversitesi Tıp Fakültesi Hastanesi İç Hastalıkları Anabilim Dalı’nda sürdürdüğüm uzmanlık eğitimim süresince bilgi ve deneyimlerinden yararlandığım,
her türlü konuda desteğini esirgemeyen İç Hastalıkları Anabilim Dalı Başkanı Sayın Prof. Dr. Fehmi Akçiçek’e,
Tez çalışmalarım sırasında bana danışmanlık yapan, engin tecrübe ve bilgilerini benden esirgemeyen, çalışmalarımın her aşamasında bana yardımcı olan tez danışmanım Gastroenteroloji Bilim Dalı öğretim üyesi Sayın Prof. Dr. Nevin Oruç’a,
Tezin hazırlanmasında laboratuvar çalışmalarını özveriyle yürüten Klinik Biyokimya Anabilim Dalı öğretim üyesi Doç. Dr. Burcu Barutcuoğlu ve Tıbbi Biyolog
Cansu Çalışkan Kurt’a,
Emeği geçen tüm hocalarıma, tez çalışmalarım sürecinde her zaman desteğini hissettiğim Dr. Aysel Şihaliyeva, Dr. Elvan Seher Taşöz, Dr. Anar Sadıgov,
Dr. Tuğba Çelebi, Dr. Eltan Maharramova ve Uzm. Dr. Narimana İmanova başta olmakla çalışmaktan her zaman mutluluk duyduğum tüm doktor arkadaşlarıma, İç Hastalıkları ve Gastroenteroloji Bilim Dalı’nda çalışan tüm hemşire ve klinik çalışanlarına,
Bu günlere gelmemde maddi ve manevi emeği geçen, üzerimde sonsuz emekleri olan kıymetli anne ve babama, desteklerini hiçbir zaman esirgemeyen kız kardeşlerime teşekkür ederim.
Dr. Alida Aliyeva
ARALIK– 2018 İZMİR
II
İÇİNDEKİLER
ÖNSÖZ...I TABLO LİSTESİ ... III ŞEKİL LİSTESİ ... VI KISALTMALAR LİSTESİ ... VII ÖZET ... IX ABSTRACT ... X 1.GİRİŞ VE AMAÇ ... 1 2. GENEL BİLGİLER ... 2 2.1. Pankreas kanseri. ... 2 2.1.1. Epidemiyoloji ... 2 2.1.2. Risk faktörleri ... 2 2.1.3. Patoloji... 5
2.1.4. Moleküler patogenez ve genetik ... 8
2.1.5. Klinik ... 10 2.1.6.Tanı ... 12 2.1.6.1. Görüntüleme yöntemleri ... 12 2.1.6.2.Serum tümör belirteçleri... 16 2.1.6.3. CA 19-9 ... 17 2.1.7. Evreleme ... 19
2.1.8. Yüksek riskli kişilerde Tarama ... 21
2.1.9. Tedavi ... 22
2.1.9.1. Rezektabl pankreas kanseri tedavisi ... 22
2.1.9.2. Borderline rezektabl PK tedavisi ... 23
2.1.9.3. Lokal ileri(unrezektabl) PK tedavisi ... 23
2.1.9.4.Metastatik PK tedavisi ... 25
III
2.1.9.4.2. Radyoterapi ... 25
2.1.9.4.3. Palyatif tedavi ... 25
2.1.9.5.İmmunoterapi ... 26
2.1.10. Prognoz ... 26
2.2. Serin protez inhibitörü, Kazal tip (SPINK) ailesi ... 26
2.2.1. SPINK1 ... 27
2.2.1.3. SPINK1 ve pankreatit ... 28
2.2.1.1. Kanserde tanı belirteci olarak serum SPINK1 ... 29
2.2.1.4. SPINK1 ve pankreas kanseri ... 29
3.MATERYAL METOD ... 30
3.1.Pankreas kanseri ve kontrol grubu ... 30
3.2. ELISA PROTOKOLÜ İLE SERUMDAN SPINK1 ÇALIŞMA AŞAMASI ... 31
3.2.1. SPINK1 ölçümünde kullanılan cihazlar, kimyasal ve sarf Maddeler ... 31
3.2.2. Kit prosedürü... 33
3.3. İSTATİSTİKSEL ANALİZ METODLARI ... 34
4.Bulgular ... 34
5.Tartışma ... 47
6.Sonuçlar ... 55
7.Kaynaklar ... 57
IV
TABLOLAR LİSTESİ
Tablo 1: Artmış kanser riski ile ilişkili kanser sendromları……….3
Tablo 2: Pankreas kanseri için değiştirilebilir risk faktörleri………...4
Tablo 3: Ekzokrin pankreas tümörlerinin histolojik tipleri………..5
Tablo 4: Pankreas kanserinde sık görülen semptom/bulgular ve görülme sıklığı………..11
Tablo 5: Pankreas kanseri tanısında kullanılan görüntüleme yöntemleri………...15
Tablo 6: Pankreas kanseri tanı algoritması……….16
Tablo 7: CA 19-9 serum değerlerinin artışı ile ilgili durumlar………...18
Tablo 8: Tümör markırlarının pankreas kanseri evresine göre tanıdaki yerleri………….18
Tablo 9: Pankreas kanseri TNM evrelemesi AJCC 2017………...20
Tablo 10: AJCC evreleme………...21
Tablo 11: Metastatik olmayan ekzokrin pankreas kanseri tedavi algoritması………24
Tablo 12: Pankreas kanseri ortalama yaşam süresi………26
Tablo 13: Human SPINK1 (Serine Peptidase Inhibitor Kazal Type 1) ELISA Kit içerik ve saklama koşulları………...32
Tablo 14: Demografik Bulgular ...35
Tablo 15: Sigara içenlerin cinsiyete göre dağılımı ...37
Tablo 16: Pankreas kanseri ve kontrol gruplarında cinsiyetlere göre yaş ortalamaları….37 Tablo 17: Pankreas kanseri hastalarında araştırılan risk faktörleri………...38
Tablo 18: Pankreas kanserinde semptom ve bulguların sıklığı ...39
Tablo 19: Grupların laboratuvar değerlerine göre karşılaştırılması...40
Tablo 20: Pankreas kanserli olguların tümör boyutuna göre dağılımı...41
Tablo 21: Pankreas kanserli olguların lenf nodu metastazına göre dağılımı ...41
Tablo 22: Pankreas kanserli olguların uzak metastaz varlığına göre dağlımı ...41
Tablo 23: Pankreas kanserli olguların evrelere göre dağılımı...41
Tablo 24: Pankreas kanserli olgularda tümörün pankreasta yerleşimine göre dağılımı....42
Tablo 25: Grupların SPINK1 Sonuçları ...42
Tablo 26: Pankreas kanseri ve kontrol grubunda demografik verilere göre SPINK1 değerleri………...43
Tablo 27: Semptomlar ve bulguların serum SPINK1 seviyeleri ile ilişkisi...44
Tablo 28: Pankreas kanserinde tümör boyutuna (T) göre SPINK1 değerleri ...45
Tablo 29: Pankreas kanserinde Lenf nodu metastazına (N) göre SPINK1 değerleri ...45
V Tablo 31: Pankreas kanserinde evrelere göre SPINK1 değerleri...46 Tablo 32: Pankreas kanserli olgularda tümörün pankreasta yerleşimine göre
VI
ŞEKİLLER LİSTESİ
Şekil 1: Normal pankreatik kanal yapısının, pankreas kansere ilerlemesi sürecinde
gelişen olaylar……….6
Şekil 2: PanIN grubunda saptanan genetik mutasyonlar………...7
Şekil 3: Pankreas kanserine ilerleme ve genomik instabilite………...8
Şekil 4: Rekombinant SPINK1 varyantının bant diagramı………...27
Şekil 5: SPINK1 molekülü ile EGFR yolağının etkileşimi………...29
VII
KISALTMALAR LİSTESİ
ABD: Amerika Birleşik Devletleri
AJCC: American Joint Committee onCancer APC : Adenomatöz Polipozis Coli
ATM: Ataxia-Telangiesctasia mutated BRCA1 : Breastcancer gene, type-1 BRCA2 : Breastcancer gene, type-2 BT: Bilgisayarlı tomografi CA 19-9: Carbohydrate antigen 19-9 CA 242: Carbohydrate antigen 242 CA 50: Carbohydrate antigen 50 CA 72-4: Carbohydrate antigen 494 CA125: Carbohydrate antigen 125
CDKN2A: Cyclin-dependent Kinase Inhibitor 2A CEA: Carcinoembryonic antigen
CEACAM1: Carcinoembryonic antigen-related cell adhesion molecule 1 DPC4: Deleted in Pancreatic Cancer, locus 4
DPP-4: Dipeptidyl Peptidase-4
ECOG: Eastern Cooperative Oncology Group EGFR: Epidermal growth factor
ERCP: Endoskopik retrograd kolanjiyopankreatografi ERK: Extracellular signal-regulated kinase
EUS: Endoskopik ultrasonografi
EUS-FNA: EUS eşliğinde ince iğne aspirasyon biyopsisi
FAMMM: Familial Atypical Multiple Mole Melanoma Syndrome FAP: Familiyal Adenomatöz Polipozis
FU: FLUOROURACIL
GLP: Glucagon like peptid GSTT1: Glutatyon S-transferaz T1 HCC: Hepatosellüler karsinom
HNPKK Herediter Nonpolipozis Kolorektal Kanser IPMN: İntraduktal papiller musinöz neoplazi
VIII KF: Kistik fibrozis
MAPK: Mitogen-activated protein kinase MCN: Müsinöz kistik neoplazi
MIC1: Macrophage inhibitory cytokine-1 MMR: Mismatch repair
MRCP: Manyetik Rezonans Kolanjiyopankreatografi MRI: Manyetik Rezonans Görüntüleme
NCCN: National Comprehensive Cancer Network NSAİİ: Non-steroidal anti-inflamatuar ilaç
PALB2: Partner and localizer of BRCA2 PanIN: Pankreatik intraepitelyal neoplaziler
PET: Pozitron Emisyon Tomografi PPI : Proton Pompa Inhibitor PRSS1 : Protease Serine 1
PSTI: Pankreas Sekretuar Tripsin İnhibitörü RCC: Renal cell carcinoma
SMAD4: Mothers against decapentaplegic homolog SPINK1: Serin Protez İnhibitörü, Kazal Tip1 STK 11: Serine/ThreonineKinase 11
TATI: Tumor-associated trypsin inhibitör TGF: Tumor growth factor
TGFb: Tumor growth factor beta TP53: Tumor protein53
IX
ÖZET
GİRİŞ: Pankreas kanseri, yüksek mortal hastalıktır. Pankreas kanserli hastaların çoğu, hastalık ileri evreye ulaşana kadar asemptomatik kalır. Pankreas kanseri taranması için standart bir program bulunmamaktadır. Pankreas kanseri tanısı için spesifik serum belirteçleri gerekmektedir. SPINK1 doku yıkımı üzerinde potansiyel inhibitör etkilere sahip proteaz inhibitörüdür. Serumda artmış seviyeleri, çeşitli kanserlerde olumsuz prognoz ile ilişkilendirilmiştir. Pankreas kanseri hastalarında serum SPINK1 düzeylerinin klinik-patolojik ilişkisini ve önemini inceledik.
AMAÇ-YÖNTEM: Pankreas kanserinde serum SPINK1 seviyelerinin tanısal ve tedavideki önemini araştırmayı amaçladık. Çalışmaya 62 pankreas adenokarsinomlu ve 76 sağlıklı kontrol olgu dahil edilmiştir. Hastaların yaş, cinsiyet, aile öyküsü, tanı yaşı, hastalık evresi, klinik semptomları, biyokimyasal parametreleri değerlendirilmiştir. Serum SPINK1 seviyeleri ELISA ile ölçülmüştür.
BULGULAR: Pankreas kanserli hastalarda serum SPINK1 seviyeleri kontrol grubuna göre anlamlı olarak daha yüksek bulunmuştur (48.3±29.3 vs 25.3±15.4ng/ml, p<0.001). Serum SPINK1 seviyesinin cut off değeri 25ng/ml olarak alındığında sensitivitesi %71 ve spesifitesi %61 saptanmıştır (p<0.001, AUC 0.71). Serum SPINK1 ile CA 19-9 ve diğer biyokimyasal parametreler arasında korelasyon saptanmamıştır. Diabetes mellitus hastalarında serum SPINK1 seviyeleri düşük saptanmıştır. Serum SPINK1 seviyeleri hastalığın evresinden etkilenmezken erken evrelerde bile yüksekti. Tümör boyutu arttıkça serum SPINK1 seviyesinin arttığı görülmüşdür. Metastazı olan ve olmayan hastalarda SPINK1 düzeyinde anlamlı farklılık saptanmamıştır.
SONUÇ: Serum SPINK1 seviyesi pankreas duktal adenokarsinomunun tanısında yüksek sensivite ve spesifiteye sahiptir. Ancak hastalığın prognozunun tayininde kullanılabilecek bir gösterge değildir.
X
ABSTRACT
INTRODUCTION: Pancreatic cancer is a highly lethal disease. Most patients with pancreatic cancer remain asymptomatic until the disease reaches an advanced stage. There is no standard programme for screening of pancreatic cancer. There is need for spesific serum markers for diagnosis of pancreatic cancer. SPINK is a protease inhibitor with potential inhibitory effects on tissue degradation. In serum, increased levels have been associated with adverse prognosis in different forms of cancer. We studied the clinical-pathologic association and significance of serum levels of SPINK1 in pancreatic cancer patients.
AİMS&METHODS: We aimed to investigate the importance of serum SPINK1 levels in the diagnosis and treatment of pancreatic cancer. Sixty two patients with pancreatic adenocarcinoma and 76 healthy controls were included in the study. Age, gender, family history, age of diagnosis, disease stage, clinical symptoms and biochemical parameters of the patients were evaluated. Serum SPINK1 levels were measured by ELISA.
RESULTS: Pancreatic cancer patients has significantly higher levels of serum SPINK1 levels then controls(48.3±29.3 vs25.3±15.4ng/ml, p<0.001). The cut off value of serum SPINK1 levels over 25 ng/ml has 71% sensitivity and 61% specificity for diagnosis of pancreatic cancer(p<0.001, AUC 0.71). Serum SPINK1 levels was not correlated with serum Ca19-9 levels and other biochemical paremeters. Serum SPINK1 levels were found to be low in patients with diabetes mellitus. Serum SPINK1 levels were not affected by the stage of the disease, but were even higher in the early stages. As the tumor size increased, serum SPINK1 level increased. There was no significant difference in SPINK1 levels in patients with and without metastasis.
CONCLUSION: Serum SPINK1 level has high sensitivity and specificity in the diagnosis of pancreatic ductal adenocarcinoma. However, it is not an indicator that can be used to determine the prognosis of the disease.
1
1. GİRİŞ VE AMAÇ
Pankreas kanseri(PK) daha ziyade erkeklerde görülen, ileri yaşlarda (40-85 yaş) daha sık ortaya çıkan, agresif seyirli, ölümcül malign kanserlerden biridir (1). Türkiye’de 100.000 kişide 1,6-2 arasında görülmektedir. PK’in nedenleri tam olarak bilinmemektedir; ancak bazı risk faktörleri belirlenmiştir. İleri yaş, obezite, sigara içilmesi, yoğun alkol kullanımı, özgeçmişinde kronik pankreatit ve diyabet bulunması, aile öyküsü önemli risk faktörlerindendir. Kronik pankreatitli hastalarda pankreas kanseri gelişme riski yüksek bulunmuştur. Pankreas kanseri olgularında en sık görülen semptomlar; kilo kaybı, sarılık ve ağrıdır. Pankreas kanserinde tanısal görüntüleme yöntemlerinden abdominal ultrasonografi, bilgisayarlı tomografi, manyetik rezonans görüntüleme, pozitron emisyon tomografi, endoskopik ultrasonografi kullanılmaktadır. Pankreas kanserli hastaların %80’inden fazlası tanı anında hematojen veya peritoneal yolla metastaz yapması veya çevre dokulara invazyon yapmış olması nedeniyle teknik olarak cerrahi tedavi mümkün değildir. Ameliyat edilemeyen bu grup hastalara genellikle palyatif cerrahiler ve uygun durumlarda sistemik ve lokal tedaviler uygulanır. Tedavisinde operasyon, kemoterapi, radyoterapi ve kemoradyoterapi tedavi kombinasyonları uygulanır. Ancak tüm tedavi yaklaşımlarına rağmen pankreas kanserinde sağkalım sonuçları yeterli değildir. PK’de moleküler değişiklikler en sık K-RAS, P16, SMAD4 ve TP53 genlerini etkiler. Pankreas kanseri tanısında; CA 19-9, CEA, CA 72-4, CA 50, CA 242 gibi tümör markırları kullanılması önerilmiştir. Bunlardan en yaygın olarak kullanılanı CA 19-9’dur, ancak duyarlılık ve özgüllüğü %90’ın altındadır. Pankreas kanserinde daha spesifik ve sensitif, hastalığın tanınması, progresyon ve regresyonunun takibinde faydalı olabilecek biyobelirteç gerekmektedir. PK’in erken tespiti, hastalığın mortalitesini azaltmanın en etkili yolu olabilir (2).
SPINK1 pankreas hücrelerinde sentez edilir ve bir çok tümörlerde yüksek ekspresyonu saptanmıştır. Bu nedenle serin proteaz inhibitörü, Kazal tip 1(SPINK1) ölçümünün hem tanıda hem hastalık prognozunu değerlendirmede kullanılabileceği düşünülmektedir.
Çalışmanın amacı pankreas kanserinde SPINK1’in bir tümör belirteci olarak kullanıp kullanılamayacağını belirlemektir.
2
2. GENEL BİLGİLER
2.1. Pankreas kanseri
2.1.1. EpidemiyolojiPankreas kanseri, dünya genelinde, erkeklerde kanser ölümlerinin 8.(yılda 138.100 ölüm) ve kadınlarda 9.(yılda 127.900 ölüm) önde gelen nedenidir (3).Genellikle, dünyanın sanayileşmiş bölgelerinde yaşayan kişileri etkiler, Hindistan ve Nijerya'da yaşayan insanlar arasında bildirilen en düşük insidansa sahipken, en yüksek insidans yerli Hawaililer, Yeni Zelandanın Maoris ve Amerikanın zenci popülasyonlarında rapor edilmiştir (4). Pankreas kanseri, Amerika Birleşik Devletlerinde(ABD) hem erkekler, hem de kadınlar arasında kanserle ilişkili en yaygın dördüncü ölüm nedenidir. ABD’de, yılda yaklaşık 55.440 hastaya ekzokrin pankreas kanseri teşhisi konmaktadır ve hemen hemen hepsinin hastalıktan öleceği tahmin edilmektedir (5). Türkiyede ise Türkiye Cumhuriyeti Sağlık Bakanlığı Halk Sağlığı Kurumu’nun yayınlamış olduğu Ocak 2014 tarihli Türkiye Kanser İstatistikleri 2009 yılı verilerine göre, erkeklerde kanserler arasında pankreas kanserinin görülme sıklığı tüm yaş grupları içinde %2 ile 10.sıradadır, kadınlarda ise ilk 10 da yer almamaktadır. 70 yaş üzeri popülasyonda erkeklerde %3.2 ile 7.sırada, kadınlarda ise %2 ile 8.sıradadır. Pankreas kanserli hastaların ortalama sağ kalım süreleri 11.2 ay bulunmuştur (6). İnsidans ve ölüm oranları cinsiyet ve ırka göre değişir. İnsidans erkeklerde kadınlara (erkek/kadın oranı 1.3/1) ve siyahlarda beyazlara göre daha yüksektir (genel nüfusta 100.000'de 8.8 iken, siyah erkeklerde 100.000 başına 14.8) (7). Ancak, daha yeni veriler bu ırk farklılıklarının azalabileceğini bildirmektedir (8).
2.1.2. Risk faktörleri
PK gelişiminde katkıda bulunan risk faktörleri, konak ve çevresel faktörleri veya değiştirilemeyen ve değiştirilebilir risk faktörleri olarak gruplanır. Konak veya değiştirilemeyen risk faktörleri yaş, cinsiyet, kan grubu, etnik köken ve genetik risk faktörleri olarak tanımlanır. PK ağırlıklı olarak yaşlı grubun hastalığıdır ve yaşamın ilk 30 yılında nadirdir. Hastalık insidansı 45 yaşından sonra artmaktadır ve 7-8.dekatta pik yapar. ABO kan grubu, pankreas kanseri de dahil olmak üzere birçok gastrointestinal malignite riskiyle ilişkili kalıtsal bir özelliktir. O-kan grubu ile karşılaştırıldığında, O-kan grubu olmayan (A, AB veya
3 B) bireylerin PK geliştirme olasılığı daha yüksek saptanmıştır (PK için düzeltilmiş risk oranı sırasıyla 1.32, 1.51ve 1.72’di) (9). Genetik risk faktörleri tüm pankreas kanserli hastaların yaklaşık % 10-15'inde tespit edilmiştir, bu olguların % 20’sini spesifik germline mutasyonları oluşturur. Pankreas kanseri için iki geniş kategoride kalıtsal risk vardır:
1. Pankreas kanseri ve diğer maligniteler için artmış risk taşıyan tanımlanmış genetik predispozan sendromları (Tablo 1)
2. Familiyal PK ,bilinen bir genetik yatkınlık olmadan en az iki birinci derece akrabasında pankreas duktal adenokarsinom bulunan bireylerde pankreas kanserine yatkınlık olarak tanımlanır. Familiyal PK’den sorumlu spesifik bir gen defekti tanımlanmamıştır.
Tablo1: Artmış kanser riski ile ilişkili kanser sendromları (10)
Sendrom
Gen
Risk oranı
Kromozom
Herediter meme/over kanser sendromu
BRCA2, BRCA1 3-5 13q
PALB2 Bilinmiyor 16p
FAMMM sendromu CDKN2A 10-19 9p
Peutz-Jeghers sendromu
STK 11 11-36 19p
FAP APC Bilinmiyor 5q
Lynch sendromu DNA mismatch repair gen
4 2p, 3p, 7p
Herediter pankreatit PRSS1, SPINK1 25-40 7q, 5q
Ataksi telenjiektazi ATM Bilinmiyor 11q
Li-Fraumeni sendromu
P53 Bilinmiyor 17p
FAMMM: Ailesel Atipik Mol-Malign Melanom; Lynch: Herediter nonpolipozis kolorektal kanser
Çevresel veya değiştirilebilir risk faktörleri olarak sigara kullanımı, diyet, alkol alımı ve obezite PK riskiyle ilişkilendirilmiştir. Sigara içme pankreas kanseri riskini artırır ve tek başına tüm vakaların yaklaşık % 25'ini oluşturur (11). Risk, karsinojen metabolize edici enzim glutatyon S-transferaz T1 homozigot gen mutasyonları olan ağır sigara içenlerde özellikle yüksek olabilir ve tüketilen sigara miktarı ile artar (12).Vücut kitle indeksi, yüksek ve düşük fiziksel aktivite ile PK riski arasında bir bağlantı olduğunu düşünülmektedir (13). Fazla kilolu ve obez bireylerin daha genç yaşlarda PK geliştirdikleri, pankreas kanseri tanısı ile normal kilolu hastalara göre hayatta kalma sürelerinin daha düşük olduğu ileri sürülmüştür (14). "Batı" diyet modeli(yağ veya işlenmiş et miktarı fazla olan beslenme düzeni), birçok hastada pankreas
4 kanserin gelişimine neden olabileceği düşünülmüştür, ancak tüm çalışmalarda onaylanmamıştır (15). Birkaç vaka kontrol çalışması, taze meyve ve sebzelerin tüketiminin koruyucu etki gösterdiğini bildirmektedir, ancak ileriye dönük çalışmalar böyle bir ilişkiyi gözlemlememiştir (16). Kahve tüketimi, aşırı alkol kullanımı bazı çalışmalarda artmış PK riski ile ilişkilendirilmiştir. Aspirin ve diğer NSAİİ'lerin pankreasta tümörogenez üzerindeki olası inhibitör etkisini gösteren laboratuvar verileri mevcut, ancak insanlar arasında yapılan epidemiyolojik veriler çelişkilidir (17). Helicobacter pylori infeksiyonu ve pankreas kanseri arasında zayıf fakat istatistiksel olarak anlamlı bir ilişki olduğu bildirilmiştir (18). Birkaç raporda hepatit B virüsü (HBV) ve hepatit C virüsü (HCV) ile pankreas kanseri arasında hepatosellüler kanserden daha az riske sahip bir ilişki olduğu gösterilmiştir (19). PK için değiştirilebilir risk faktörleri ve rölatif riskleri tablo 2’de özetlenmiştir.
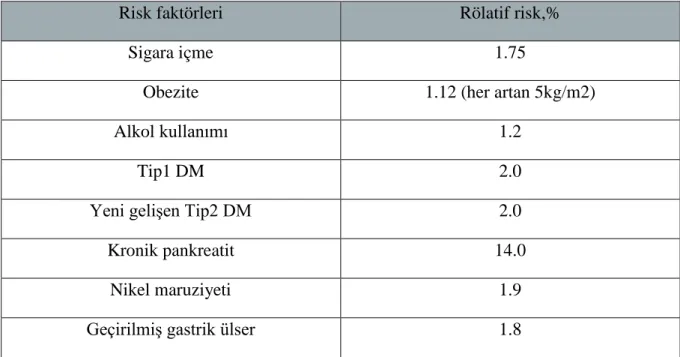
Tablo 2: Pankreas kanseri için değiştirilebilir risk faktörleri
Risk faktörleri Rölatif risk,%
Sigara içme 1.75
Obezite 1.12 (her artan 5kg/m2)
Alkol kullanımı 1.2
Tip1 DM 2.0
Yeni gelişen Tip2 DM 2.0
Kronik pankreatit 14.0
Nikel maruziyeti 1.9
Geçirilmiş gastrik ülser 1.8
Diğer risk faktörleri kistik fibrozis(KF), herediter olmayan kronik pankreatit, diyabet, pankreatik kistler ve kimyasal maruziyetitir. Kistik fibrozlu hastalarda risk organ transplantasyonu yapılmış KF'li kişilerde artmıştır (20). Kronik pankreatitli hastalar pankreasta kronik iltihaba bağlı olarak artmış PK riski altındadır. Çok sayıda epidemiyolojik çalışma, diyabet ve pankreas kanseri arasındaki ilişkiyi tanımlamaktadır (21).
5 2.1.3. Patoloji
Pankreas malign tümörlerinin %95'inden fazlası ekzokrin elementlerden kaynaklanmaktadır. Endokrin pankreasdan kaynaklanan neoplazmlar (yani pankreas adacık tümörleri) pankreatik neoplazmların %5'ini oluşturur. Yaygın olarak kullanılan terimler "pankreatik karsinom" veya “pankreas kanseri”, tüm pankreatik neoplazilerin yaklaşık olarak %85'ini temsil eden “duktal adenokarsinom”u kastetmektedir. Ekzokrin pankreasta ortaya çıkan malign tümörlerin histolojik tipleri ve bu alt tiplerin prevalansı tablo 3’de gösterilmiştir. Tablo 3: Ekzokrin pankreas tümörlerinin histolojik tipleri
Ekzokrin pankreas neoplazmları Görülme sıklığı, %
Duktal adenokarsinom 85
İnvaziv karsinom ilişkili IPMN 2-3
İnvaziv karsinom ilişkili MCN 1
Solid pseudopapiller neoplazm <1
Asiner hücreli karsinom <1
Pankreatoblastoma <1
Seroz kistadenokarsinom <1
Ekzokrin pankreas kanserlerin yaklaşık %60-%70'i pankreasın başına lokalize olurken, %20-%25'i gövde ve kuyruk yerleşimlidir ve geri kalanı tüm organı tutar. Pankreas kanserinin histolojik evrelemesi diferansiasyon derecesine dayanır ve 3 grubu içerir: iyi diferansiye, orta derecede diferansiye ve kötü diferansiye. Pankreas kanseri duodenum, portal ven veya superior mezenterik ven gibi komşu yapılara lokal yayılım gösterir. Dalak, adrenal bezler, omurga, tranvers kolon ve mideyi invaze olabilir. Regional peripankreatik lenf nodlarına metastatik yayılım daha sık, perigastrik, mezenterik, omental ve portahepatik lenf nodlarına ise seyrek görülür. Uzak metastazlar genelde, karaciğer, akciğer ve kemiklere olur. Pankreatik duktal adenokarsinomlar, retroperitona ise perinöral invazyon yapmaktadır (22).
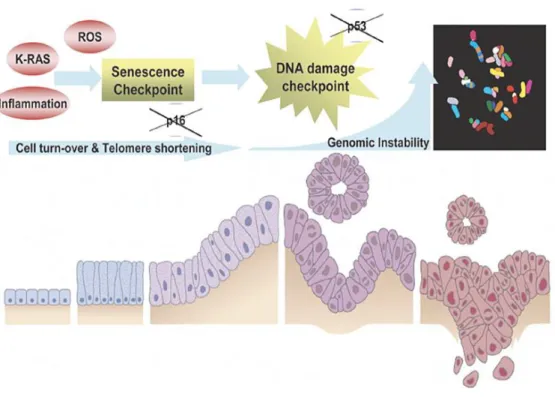
Premalign lezyonlar, maligniteye ilerleme potansiyeli olan neoplazilerdir. PK’ne en önemli ve iyi bilinen öncü lezyonlar Pankreatik intraepitelyal neoplaziler(PanIN), İntraduktal papiller musinöz neoplaziler(IPMN) ve Müsinöz kistik neoplaziler(MCN)’dir. PanIN’ler, küçük pankreatik kanallarda duktal epitel proliferasyonu ve metaplazi ile oluşan mikroskobik(genellikle <5 mm), intraduktal, non-invaziv düz veya papiller lezyonlardır (23). Bu lezyonlar mutasyonlarla ilişkili olup karakteristik olarak asemptomatiktir. Bunlar üç sınıfa
6 ayrılırlar: PanIN-1A(flat) ve PanIN-1B(papiller) minimal, PanIN-2 lezyonları ise hafif-orta sitolojik ve mimari atipi gösterir. PanIN-1 ve PanIN-2 düşük dereceli lezyonlardır. PanIN-3 şiddetli sitolojik ve mimari atipi ile karakterizedir, genellikle papiller morfolojiye sahiptir ve yüksek dereceli lezyonlardır. PanIN-3 ayrıca “in situ karsinoma” olarak da adlandırılır. PanIN’lerin insidansı yaşla birlikte artmakta ve 50 yaşın üstünde yaygındır. PanIN’lerin düşük dereceden yüksek dereceye ilerlediği ve daha sonra invaziv olduğu düşünülmektedir(Şekil 2) ve bu histolojik ilerleme, genetik mutasyonların birikmesiyle paraleldir(şekil 3) (24).
Şekil 1: Normal pankreatik kanal yapısının ve pankreas kansere ilerlemesi sürecinde gelişen olaylar (25)
7 Şekil 2: PanIN grubunda saptanan genetik mutasyonlar (26)
IPMN, pankreas kanallarında oluşan neoplazilerdir. Tüm pankreas ekzokrin tümörlerinin %1-3’nü, pankreasın tüm kistik tümörlerinin %20-50’sini oluşturur (27). Yaşlı erişkinlerde (ortalama 65 yaş), her iki cinsiyette eşit olmakla görülür. IPMN’ler müsin salgılayan kolumnar epitel ile kaplıdır, pankreas başında daha sık görülür. Düşük veya yüksek dereceli displazili, invaziv veya non-invaziv IPMN olarak sınıflandırılırlar. Ayrıca displazi veya malignite gelişme olasılığı ile ilişkili 4 histolojik alt tipi tanımlanmıştır: gastrik, intestinal, pankreatobiliyer ve onkositik. İntestinal tip, en sık görülen tiptir. Gastrik tip düşük dereceli displazi gösterirken, diğerlerinde yüksek dereceli displazi görülür. Pankreatik kanalın anatomik tutulumuna dayanan ana kanal(IPMN-MD) tipi veyan dal kanalı(IPMN-BD) tipi olarak sınıflandırılmıştır. IPMN-MD ana pankreas kanalını diffüz veya segmental olarak tutar, pankreasın başında ortaya çıkar. IPMN-BD daha genç hastalarda ortaya çıkar ve genellikle pankreasın gövde ve kuyruğunda yerleşir. Ana pankreatik kanalla ilişkili IPMN’in IPMN-BD ile kıyasla pankreas malignitesi gelişme riski daha yüksek bulunmuştur. IPMN-MD'de in situ veya invaziv karsinom riski yaklaşık %70’inde görülür. IPMN-BD olan hastaların çoğunun kanser gelişimi olmaksızın uzun süreli bir seyri vardır (28). Ana kanal tip IPMN’de cerrahi tedavi önerilir. Yan dallardan gelişen IPMN’de tümör 10 mm’den küçükse, yıllık kontrol, büyüklük 10-20 mm arasında 6-12 ay ara ile kontrol, 20 mm’den büyükse veya kuşku uyandıran bulguları varsa cerrahi olarak tümör çıkarılır.
8 MCN’ler genellikle pankreasın gövdesinde veya kuyruğunda kalın-fibrotik duvarlı, keskin sınırlı olup, içinde musin, hemorajik sıvı veya nekrotik materyal bulunabilir. IPMN’den daha az görülmekte, kadın/erkek oranı 20/1’dir, ortalama görülme yaşı 40-50 yaş civarıdır. IPMN’den farkı pankreatik kanalla bağlantısı olmadığı düşünülmektedir. Genelde tesadüfen saptanır ve asemptomatiktir. Epitelyal displazi derecesine göre düşük ve yüksek dereceli olarak sınıflandırmışlar. Makroskopik olarak, soliter, multiloküler ve uniloküler olmak üzere 3 gruba ayrılır. İnvaziv MCN’de 5 yıllık yaşam oranı, %20-60 oranındadır (29).
2.1.4. Moleküler patogenez ve genetik
Pankreas kanseri, kanser ile ilişkili genlerde (onkogenler, tümör süpresör genler, hücre siklus genleri, apoptoz ve genom onarım genleri) herediter germline veya akkiz somatik mutasyonlar ile oluşmaktadır. Mutasyonlar aynı zamanda kanser progresyonuna ve metastaza neden olmaktadır (29). Hücre döngüsü, telomerazda kısalma ve genomik instabilite, pankreas epitel hücrelerinin pankreas kanserine ilerlemesinde önemli rol oynamaktadır(Şekil 1).
9 Pankreas kanserinde genetik mutasyonların çoklu kombinasyonları bulunur. Bunlar üç geniş kategoriye ayrılabilir (31).
● KRAS gibi onkogenlerin aktivasyon mutasyonları
● TP53, p16 / CDKN2A ve SMAD4 gibi tümör supresör genlerin inaktivasyonu
● DNA hasarı onarımını kontrol eden MLH1 ve MSH2 gibi genom onarım genlerinin inaktivasyonu
Genel olarak, PK’de dört temel yönetici gen bulunmaktadır, biri onkogen olan KRAS ve diğer üçü CDKN2A, TP53 ve SMAD4 gibi tümör baskılayıcı genlerdir. Onkogenler, mutasyona uğrayıp aktive olduklarında kanser gelişiminde rol oynarlar ve değişik mekanizmalarla (nokta mutasyon, amplifikasyon) aktive olurlar. Kromozom 12p üzerinde bulunan KRAS onkogeni, pankreas kanserinde en sık ve en erken mutasyona uğramış genlerden biridir (32). PK’in %90'ından fazlasında KRAS gen mutasyonu bulunur. KRAS geni, hücre yaşamı, hücre farklılaşması, hücre proliferasyonu gibi hücre fonksiyonlarını olumsuz etkiler. KRAS gen mutasyonları IPMN, PanIN ve MCN’lerde de tanımlanmıştır ve bu non-invaziv öncü lezyonlarda artan displazi dereceleri ile mutasyon prevalansı artmaktadır. KRAS, ayrıca birçok sinyal yolunu da aktive eder. P13K-AKT yolunu (hücre yaşamı ve hücre sirkülasyonunu etkiler), MEK ve ERK1/2 yolunu aktive eder (anjiogenez, hücre proliferasyonu, apoptozu, kanserli hücre migrasyonu ve hücre siklus regülasyonunu etkiler). Ayrıca NOTCH yolunu (hücre proliferasyonu, hücre farklılaşması ve hücre apoptozu etkiler) ve Hedgehog yolunu etkiler (metastazlara neden olur). STAT3 aktivasyonu da pankreas kanserli hastalarda saptanmaktadır (STAT3 inhibitörleri, pankreas kanseri tedavisinde kullanılır).
Tümör supresör genler tümörogenezden hücre siklusunu veya apoptozu korur. Kromozom 9p üzerindeki CDKN2A geni ve onun protein ürünü p16 hemen hemen tüm pankreas kanserlerinde, yaklaşık olarak % 95’inde bir miktar etkisiz hale getirilmiştir. P16/CDKN2A genindeki herediter mutasyonlar FAMMM(Ailesel Atipik Mol Malign Melanom) sendromunun nedenlerinden biridir. Kromozom 17p üzerindeki TP53 geni, pankreas kanserli hastalarının %75-%85'inde etkisiz hale getirilir. Kromozom 18q'da bulunan SMAD4 geni(eski adı DPC4 olarak bilinir), pankreatik kanserlerin yaklaşık % 50'sinde inaktive edilir (33). SMAD4 geninin protein ürünü hücre içi sinyallerin hücre zarındakı transforme edici büyüme faktörü beta(TGFb) reseptörlerinden nukleusa iletilmesinde işlev görür. SMAD4 ekspresyon kaybı olan PK daha yüksek metastaz oranlarına ve daha kötü prognoza sahiptir (34). Daha ileri çalışmalara ihtiyaç olsa da, bu veriler SMAD4 gen durumunun bir gün prognostik tabakalaşma ve tedaviye karar verme için yararlı olabileceğini düşündürmektedir.
10 MLH1 ve MSH2 gibi DNA mismatch repair genleri, özellikle Lynch(Herediter nonpolipozis kolorektal kanser) sendromunda önemli rolleri ile bilinmektedirler. DNA mismatch repair genleri pankreas kanserlerinin yaklaşık %2-%3’ünde mutasyona uğrar (35). MikroRNA'lar, diğer genlerin ekspresyonunu düzenleyen RNA'nın kısa, kodlanmamış bölümleridir, onkojenik fonksiyonları vardır. PK ve pankreas kansere yol açan prekürsör lezyonlarda bir dizi mikroRNA'nın farklı şekilde eksprese olduğu görülmektedir (36).
Mutasyonlar çoğunlukla nükleer DNA'yı hedef alır, ancak mitokondriyal DNA da pankreas kanserinde somatik mutasyona uğrayabilir. Mitokondriyal mutasyonlar erken teşhis için çekici bir hedeftir, çünkü hücreler binlerce mitokondri içerir ve mitokondride bir klonal mutasyon nükleer DNA'daki bir klonal mutasyondan daha kolay tespit edilebilir (37).
Sadece pankreatik kanserde nadiren mutasyona uğrayan başka genler de tanımlanmıştır ve bunlar KRAS, p16/CDKN2A, TP53 ve SMAD4'ten genel olarak daha az önem taşırlar. Düşük prevalansta mutasyona uğramış veya genetik olarak değiştirilmişler arasında EP300, SMARCA4, CDH1, EPHA3, AKT2, ALK4, ARID1A, BRAF, CTNNB1, EP300, FBXW7, FGFR1, GATA6, MKK4, MLL3, MYB, MYC, PBRM1, PIK3CA, ROBO2, SMARCAA2, SMARCAA4 ve TGFbetaR2 genleri tanımlanmıştır.
2.1.5. Klinik
Pankreas kanseri hastalarında en sık görülen semptomlar ağrı, sarılık ve kilo kaybıdır. Pankreas kanserinin klinik bulguları tümörün yerine göre değişir. Gövde ve kuyruk yerleşimli pankreas tümörleri ile karşılaştırıldığında, pankreas başı tümörleri daha çok sarılık, steatore ve kilo kaybı ile karşımıza çıkar (38).
Tablo 4: Pankreas kanserinde sık görülen semptom/bulgular ve görülme sıklığı (38).
11
Halsizlik 86 Sarılık 55
Kilo kaybı 85 Hepatomegali 39
Anoreksi 83 Sağ üst kadranda ele gelen kitle 15
Karın ağrısı 79 Kaşeksi 13
Koyu idrar 59 Ele gelen ağrısız safra kesesi (Courvoisier bulgusu)
13
Sarılık 56 Epigastrik kitle 9
Bulantı 51 Assit 5 Sırt ağrısı 49 İshal 44 Kusma 33 Steatore 25 Tromboflebit 3
Karın ağrısı 2 cm’den küçük tümörlerde bile en sık bildirilen semptomlardan biridir (39). Pankreas kanserine bağlı ağrı başlangıçta sinsidir. Ağrı genellikle epigastrikdir, sırta yayılır. Şiddetli sırt ağrısı, pankreas korpus ve kuyruğunda ortaya çıkan bir tümör için şüphe uyandırmalıdır. İntermittan olabilir, geceler artar ve yemeklerle veya sırt üstü uzanırken kötüleşebilir. Ana pankreas kanalının tümör nedeniyle tıkanmasına bağlı gelişen akut pankreatit sonucu oluşan ağrı ise şiddetli olur (40).
Sarılık, genellikle ilerleyicidir, pankreas kanserine bağlı malign biliyer obstrüksiyon nedeniyle gelişir ve konjuge hiperbilirubinemi ile karşımıza çıkar. Sarılık, pankreas başı tümörlerinde nispeten erken bulgudur, ağrı ve tıkanma sarılığı kliniği ile karşımıza çıkan pankreatik tümörlerin, ağrısız sarılık ile gelenlere kıyasla daha kötü prognoza sahip olduğu bildirilmiştir. Gövde ve kuyruk yerleşimli tümörlere sekonder sarılık genellikle karaciğer metastazlarına bağlı olmaktadır. Pankreas kanalının tıkanması ekzokrin yetmezliğe neden olabilir ve bunun da sonucu olarak gelişen steatore, yağ malabsorbsiyonu, pankreas başı tümörleri olan hastaların %28'inde, gövde tümörlerinin %11'inde görülür. Kuyrukta lokalize tümörler ise, genelde, steatore yapmaz. Kilo kaybı görece sıktır. Kilo kaybı ağrı, abdominal distansiyon, malign obstrüksiyona bağlı iştahsızlık, bulantı, kusma ve malabsorbsiyon sonucu gelişir.
Ani başlayan diabetes mellitus (DM) pankreas kanserinin habercisi olabilir (41). Açıklanamayan yüzeysel gezici tromboflebit(klasik Trousseau sendromu) pankreas kanserinde
12 bazen görülebilir ve mevcut hiperkoagülopati ile ilgilidir. Tromboembolik komplikasyonlar, pankreasın gövdesinde veya kuyruğunda ortaya çıkan tümörlerde daha sık görülür (42).
2.1.6.Tanı
Semptomların özgün olmaması nedeniyle tek başına semptom ve bulgulara dayanarak güvenilir şekilde pankreas kanseri tanısı koymak mümkün değildir. Risk faktörleri(genetik yatkınlık, yaş, sigara, diyabet) hakkında farkındalık, hastalıktan şüphelenilen semptomları olan hastalarda pankreas kanser için daha erken değerlendirmeye yol açabilir. Pankreas kanseri şüphesi olan bir hastanın tanısal değerlendirmesi abdominal görüntüleme ve serolojik değerlendirmeyi içerir.
2.1.6.1. Görüntüleme yöntemleri
Pankreas kanserinin tanısı ve evrelemesi için çeşitli görüntüleme yöntemleri mevcuttur: • Transabdominal ultrasonografi(USG)
• Abdominal bilgisayarlı tomografi(BT) • Endoskopik ultrasonografi(EUS)
• Endoskopik retrograd kolanjiyopankreatografi(ERCP) • Manyetik rezonans görüntüleme(MRI)
• Pozitron emisyon tomografisi(PET) • Anjiyografi
• Laparoskopi
Pratikte, transabdominal USG, düşük maliyetli, non-invaziv olması ve geniş kullanılabilirliği nedeniyle, pankreatobiliyer hastalıklar için ilk tarama tekniği olarak kullanılmaktadır. Bununla birlikte, transabdominal USG 3 cm’den büyük tümörleri tespit etmek için yüksek duyarlılığa sahip iken, daha küçük tümörler için duyarlılığı düşüktür (43).
Kısıtlayıcı özellikleri barsak gazlarından etkilenmesi ve yapan kişinin deneyimine bağlı olmasıdır. USG'de pankreasta kitle görülürse, kitlenin varlığını doğrulamak ve hastalık derecesini değerlendirmek için abdominal BT taraması yapılır.
13 PK için BT'nin duyarlılığı %89-97 arasındadır. Beklendiği gibi, büyük tümörler için duyarlılık daha yüksektir, yapılan çalışmalardan birinde duyarlılık 2 cm’den büyük tümörler için %100 iken, 2cm’den küçük tümörler için sadece %77 idi (44). Batın Radyoloji Derneği ve Amerikan Pankreas Derneği konsensüs bildirimi pankreas kanseri şüphesi olan hastalarda ilk tercih edilen yöntem olarak kontrastlı BT tetkikini önerir. Preoperatif görüntülemede evreleme amaçlı kullanılır.
EUS transabdominal ultrasondan çok daha yüksek bir çözünürlük sağlar. Pankreas kanserinin teşhisi ve evrelemesi için EUS'u diğer görüntüleme yöntemleriyle karşılaştıran çok sayıda çalışmada EUS'un küçük tümörlerde, lenf nodu evrelemesi ve vasküler invazyon değerlendirilmesi için daha üstün olabileceği sonucuna varılmıştır. Ancak, EUS peritoneal veya mediastinal lenf nodlarına metastaz gibi uzak metastazların değerlendirilmesi için BT'den daha düşük değerlidir ve EUS'un spesifikliği kronik pankreatit gibi inflamatuvar değişiklikler mevcut olduğunda sınırlıdır. Sedasyon gerektirmesi, EUS uygulayan kişinin deneyimine bağımlılığı ve pahalı olması gibi birçok faktör EUS'un dezavantajları olarak kabuledilebilir. EUS’un avantajı ince iğne aspirasyon biyopsisi (İİAB) yapılabilmesidir. Endoskopik ultrason kılavuzluğunda ince iğne aspirasyonu(EUS-FNA), PK teşhisinde ve evrelemesinde çeşitli şekillerde yardımcı olabilir. EUS-FNA aşağıdaki durumlar için kullanılabilir:
• BT veya MRI ile karakterize edilemeyecek küçük lezyonları değerlendirme ve biyopsi için (45),
• Vasküler yapılar tarafından çevrelenmiş lezyonlara güvenli biyopsi yapmak için, • Çölyak, paraaortik, retroduodenal ve superior mezenterik lenf nodlarına malign invazyonu kanıtlamak için,
• Karaciğerin sol lobundaki şüpheli küçük metastazlara biyopsi amaçlı, • Assit sıvısının örneklenmesi yoluyla karsinomatoz tanısı için.
Pankreas kanserli EUS-FNA endikasyonları tartışmalıdır. Genel olarak, zayıf cerrahi aday olan veya lokal ileri hastalıklara sahip olan uzak metastazları olan hastalarda kemoterapi veya radyoterapiyi planlamak için histolojik doğrulamanın yararlı olduğu kabul edilir.
Ayrıca, EUS-FNA lenfoma, küçük hücreli karsinom, metastatik hastalık ve gastrointestinal nöroendokrin tümörleri gibi pankreas adenokarsinomu taklit eden pankreas ile ilgili diğer malignitelerin yanı sıra otoimmün veya kronik pankreatit gibi malign olmayan hastalıklarında ayırıcı tanısı için de kullanılır. Cerrahi planlamaya yardımcı olmak (örneğin, nöroendokrin tümörlü hastalarda daha sınırlı bir rezeksiyon mümkün olabilir) ve ameliyattan önce doğrulama istenen hastalarda tanının doğrulanması için endikasyonu mevcuttu (46) .
14 Bununla birlikte, negatif sonuç, maligniteyi dışlamaz. Eğer hasta makul bir cerrahi adaysa ve klinik tablo ve görüntüleme rezektabl adenokarsinom için tipikse, doku tanısı olmadan ameliyat yapmak mantıklıdır.
ERCP pankreas ve biliyer kanallarının görüntülenmesi için oldukça hassas bir tetkikdir. Histolojik tanı için doku örneklemesi (forseps biyopsi, fırça sitoloji) için de fırsat sağlar. ERCP, ekstrahepatik biliyer tıkanıklığın saptanması için transabdominal USG ve BT'den üstündür ve koledokolitiazis şüphesi olduğunda tercih edilen prosedürdür. Ancak, USG veya BT'den daha pahalıdır ve invaziv olmasının yanı sıra pankreatit, kanama ve kolanjit gibi komplikasyonlara neden olabilir. Sonuç olarak, pankreas kanserinden şüphelenilen hastalarda ERCP'nin rolü, tümör obstrüksiyonuna bağlı kolestaz ile başvuran ve biliyer stent yerleştirilmesini gerektiren hastalar için temel bir tedavi modalitesine dönüşmektedir. ERCP'nin dezavantajları unsinat proses ve pankreas kuyruğunda olan tümörleri gözden kaçırabilmesi ve kontrast madde uygulama ihtiyacı olmasıdır.
Diyagnostik ERCP'ye bir alternatif Manyetik Rezonans Kolanjiopankreatografi (MRCP)’dir. MRCP’de pankreatobiliyer sistem, karaciğer parankimi ve vasküler yapıların üç boyutlu görüntüsü oluşturulur, striktürün proksimal ve distalinde bulunan safra yollarını değerlendirme yeteneğine sahiptir ve ayrıca intrahepatik kitle lezyonlarını da belirleyebilir, ERCP'den farklı olarak non-invaziv girişimdir ve kontrast madde gerektirmez.
Pozitron Emisyon Tomografisi(PET) pankreas kanserinin ayırıcı tanısı ve ekstrapankreatik tutulum hakkında bilgi verir. Damar yoluyla verilen radyoaktif maddenin (F-2fluoro-2-deoxy-D-glucose-FDG) tümör dokusu tarafından tutulmasıyla tümörün görüntülenmesi esasına dayanan bir testtir. PET taraması, pankreas kanserini saptamak için yüksek bir sensitiviteye(% 90) sahipken, orta derecede spesifiteye (yaklaşık %70) sahiptir. Yeni geliştirilen PET cihazları 7mm çapındaki küçük pankreas kanserlerini ve metastazları gösterebilmektedir. Bir cm’den küçük pankreas tümörlerinin ve kemik metastazlarının gösterilmesindeki duyarlılığı BT’den üstündür. Bununla birlikte, vasküler invazyonun, paraaortik lenf nodu tutulumunun, peritoneal yayılımın ve karaciğer metastazlarınının gösterilmesinde duyarlılığı BT’ye göre daha düşüktür. PET cerrahi uygulanacak lokalize hastalığı olanlarda gizli metastazları dışlamada faydalı olabilir. PET, tümörün teşhisi yanında tedaviye alınan cevabın değerlendirilmesinde de kullanılır. Hiperglisemik hastalarda yanlış negatif, pankreatit, enfekte psödokist ve biliyer stentin yerleştirilmesinin neden olduğu lokal inflamasyon gibi çeşitli inflamatuvar durumlarda yanlış pozitif sonuçlar görülebilir.
Evreleme laparoskopide amaç unrezektabl hastalıkta gereksiz laparotomiden kaçınmaktır. İleri evre vasküler tutulumu olan (ancak henüz damar tıkanması olmayan), sarılığı
15 olmayan gövde ve kuyruk yerleşimli PK, 3cm’den büyük olan pankreas tümörlerinde, CA 19-9 değeri yüksek olan(>100MIU/L), görüntülemede gizli metastatik hastalığı düşündüren bulgular olduğunda ve neoadjuvan tedavi önerilecekse laparoskopi tercih edilmektedir (47).
Anjiografi çölyak veya superior mezenterik arter anjiografisi şeklinde yapılır; bunun özellikle venöz fazı bilgi verir.
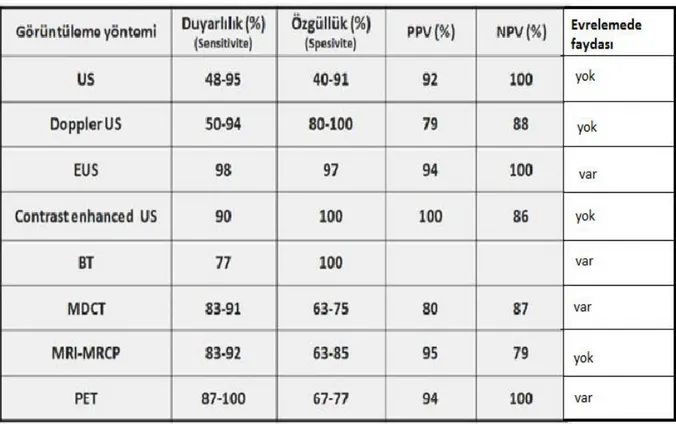
PK tanısında kullanılan yöntemler, duyarlılık, özgüllük, pozitif ve negatif prediktif değerleri ve evrelemede faydası tablo 5’de gösterilmiştir.
Tablo 5: Pankreas kanseri tanısında kullanılan görüntüleme yöntemleri
Pankreas kanserinin tanı yöntemleri özet halinde tablo 6’da gösterilmiştir Tablo 6: Pankreas kanserin tanı algoritması
16
2.1.6.2.Serum tümör belirteçleri
Tümör belirteçleri potansiyel olarak malignitelerin taranmasında, evre belirlemede, tedavi seçimi, prognoz tayini ve hastalığın takibinde yararlı olabilen maddelerdir. PK hastaları
17 erken dönemde belirgin semptomları olmadığından, tanı anında orta veya ileri evredeler ve optimal tedavi şansını kaybederler. Günümüzde, PK tanısı için görüntüleme, endoskopik ve patolojik inceleme, serum tümör markırları gibi yöntemler olmasına rağmen, erken tanı ve prognoz değerlendirmesi için etkili tümör belirteçleri yoktur. Pankreas kanseri için çeşitli serum belirteçleri değerlendirilmiş, CA19-9, CA50, CA242, CA125 ve CEA gibi tümör markırları karbonhidrat antijen sınıfını oluşturur, bunların en yararlı olanı CA 19-9 (karbohidrat antijeni 19-9) olduğu düşünülüyor.
2.1.6.3. CA 19-9
PK’da tanı, evreleme, rezektabilitenin belirlenmesinde, rezeksiyon sonrası prognostik markır olarak ve kemoterapiye yanıt için bir prediktif belirteç olarak kullanım potansiyeli vardır. Pankreas kanseri için CA 19-9'un bildirilen duyarlılık oranı %70-92, özgüllük oranı %68-92 arasındadır (48). Bununla birlikte, duyarlılık tümör büyüklüğü ile yakından ilişkilidir. CA 19-9 seviyeleri küçük boyutlu kanserler için sınırlı duyarlılığa sahiptir. CA 19-9’un 130 U/ml’den büyük değerleri multivarite analizlerde unrezektabl hastalığın belirleyicisi olarak gösterilmiştir (49). Adjuvan kemoterapi alan ve CA 19-9 seviyeleri 90 U/ml’den düşük olan hastalar daha uzun sağkalıma sahiptirler (50). Çok sayıda çalışmada, artmış CA 19-9 seviyelerinin kötü sağkalım ve nüks ile ilişkili olduğunu belirtilmiştir. Ancak CA 19-9’un eksprese olması için Lewis kan grubu antijeninin (glikoziltransferaz) varlığı gerektirir. O nedenle Lewis negatif bireyler arasında (popülasyonun tahmini % 5-10'u), CA 19-9 yararlı bir tümör belirteci değildir. CA 19-9, PK dışında malignitelerde ve bazı benign durumlarda da artmaktadır(Tablo 7).
Tablo 7: CA 19-9 serum değerlerinin artışı ile ilgili durumlar Maligniteler
18 Ampuller ve periampuller tümörler,kolanjiosellüler karsinomlar, safra kesesi kanserleri Hepatosellüler karsinomlar
Mide, kolorektal, over kanserleri (daha az sıklıkta) Akciğer, meme, endometrium kanserleri (nadir)
Benign durumlar Akut kolanjitler
Karaciğer sirozu ve diğer kolestatik hastalıklar(safra kesesi taşları dahil)
CA242, CA72-4, CA125 ve karsinoembriyonik antijen (CEA) gibi diğer konvansiyonel biyobelirteçler, PK'in erken tespiti için sınırlı diagnostik etkililik göstermiştir.
Karsinoembriyonik antijen (CEA), PK'ini saptamak için klinik olarak şu anda kullanılan ikinci en yaygın serum belirtecidir. Ortalama sensivitesi % 54, spesifitesi % 79 olduğu bildirilmişdir. Bununla birlikte, sigara içenler ve nonspesifik kolitli kişilerde de pozitif olabilir.
CA 125, MUC16 geni tarafından kodlanan, over kanserinde aşırı eksprese edilen ve diğer kanser hücreleri tarafından salgılanan, musin benzeri bir transmembran glikoproteindir. CA 19-9'un kullanımı, biliyer tıkanıklık olan hastalarda da seviyeleri yükseldiği için sınırlıdır. Bu açıdan CA 125 faydalı olabilir. CA 125, CA 19-9 ve diğer test edilen biyobelirteçlerle karşılaştırıldığında, rezektabiliteyi tahmin etmede üstün olabileceği bildirilmiştir (51).
Plazma IL-11 konsantrasyonları da %97,7 duyarlılık ve %70 özgüllüğü ile PK için tanısal, öngörücü ve prognostik biyobelirteç olarak önerilmiştir (52).
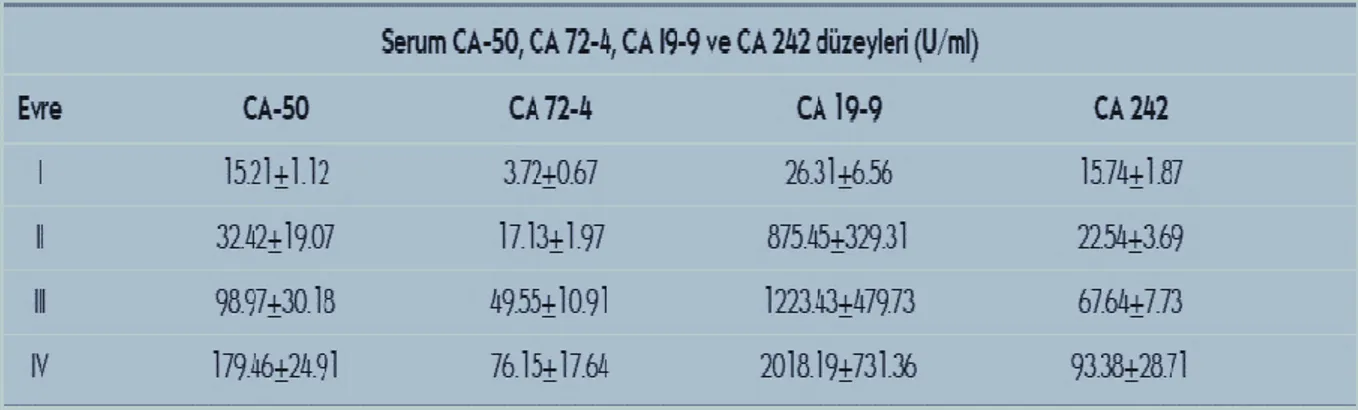
Tablo 8: Tümör markırların pankreas kanserinde evrelemeye göre tanıdaki yerleri
Genomik, epigenetik ve proteomik tekniklerle yeni markırlar belki de yakın gelecekte kullanıma girecektir. Bunlar; CEACAM1, MIC1, Fibrinogen gama, Sialylated plazma proteaz C1, N83 glycolsylation of antitripsyn, N83 glycolysylation of 1-antitripsin, Apolipoprotein A1,
19 transithretin, apolipoprotein E, gelsolin, lumican, metalloproteinaz 1 doku inhibitörü, HSP27, HSP70, PGK1, HMGB1, DJ-1 v.s gibi değişik markırlar mevcuttur.
Her ne kadar preklinik ve klinik çalışmalarda CA 19-9'dan daha iyi duyarlılığa sahip olabilecek birkaç markır adayı ortaya çıkmış olsa da, bugüne kadar CA 19-9'un yerini alamamış ya da desteklenmemiştir.
2.1.7. Evreleme
PK evrelemesi, tümör büyüklüğüne, tümörün pankreastaki yerine, vasküler invazyon ve metastatik hastalık varlığına dayanır. ABD’de yaygın olarak kullanılan evreleme sistemleri, Amerika Kanser Komitesi(AJCC) ve NCCN’den alınmıştır. AJCC TNM evreleme sistemine dayanmaktadır. T evresi tümörün büyüklüğüne,N ve M evresi bölgesel lenf nodlarına ve uzak metastaz varlığına dayanır(Tablo 9,10) (53).
Tablo 9: Pankreas kanseri TNM evrelemesi AJCC 2017 (54) Primer tümör (T)
20
T kategorisi T kriterleri
Tx Primer tümör değerlendirilemiyor T0 Primer tümör kanıtı yok
Tis Karsinoma in situ(PanIN-3, yüksek dereceli IPMN ve MCN içerir) T1 Tümör boyu 2cm’den küçük
T2 Tümör boyu 2cm’den büyük ve 4cm’den küçük T3 Tümör boyu 4cm’den büyük
T4 Boyutuna bakılmaksızın çölyak aks,süperior mezenterik arter ve/veya arteria hepatika kommunise invaze tümör (unrezektabl tümör)
Bölgesel lenf nodları (N)
N kategorisi N kriterleri
Nx Bölgesel lenf nodları değerlendirilemiyor N0 Bölgesel lenf nodu metastazı yok
N1 1-3 bölgesel lenf nodu metastazı var N2 4-6 bölgesel lenf nodu metastazı var
Metastaz (M)
M kategorisi M kriterleri
M0 Uzak metastaz yok M1 Uzak metastaz var
21
Prognostik evreleme grupları
T N M Evre Tis N0 M0 0 T1 N0 M0 IA T1 N1 M0 IIB T1 N2 M0 III T2 N0 M0 IB T2 N1 M0 IIB T2 N2 M0 III T3 N0 M0 IIA T3 N1 M0 IIB T3 N2 M0 III T4 Herhangi N M0 III HerhangiT Herhangi N M1 IV
2.1.8. Yüksek riskli kişilerde Tarama
Asemptomatik bireylerde pankreas kanseri için rutin tarama genellikle önerilmemektedir. PK için tarama, multidisipliner ekiple tecrübeli merkezlerde araştırma protokolüne göre yapılmalıdır. PK tarama programları bulunmaktadır, fakat göreceli olarak düşük insidansından dolayı, mevcut çabalar, yalnızca hastalığın gelişmesi açısından yüksek risk altında bulunan hastalardaki erken tespite odaklanmıştır.
Aşağıdaki kişilerde PK için tarama yapıyoruz (55).
• En az iki 1.derece akrabasında pankreas tanısı olan familiyal pankreas kanserli hastalar • Peutz-Jeghers (PJ) sendromlu hastalar
• Bir veya daha fazla 1.derece akrabasında p16/CDKN2A, BRCA1, BRCA2, PALB2, ATM ve Lynch sendromu mutasyon taşıyıcıları olanlar
• Herediter pankreatitli hastalar
PK için beklenen ortalama gelişme yaşı ve ailede PK'nin en küçük başlangıç yaşı taramaya başlamak için temel alınmıştır. PK ile 45-50 yaşlarında veya en genç pankreas kanseri tanılı 1.derece akrabasının tanı yaşından 10-15 sene önceden taramaya başlanır. PJ sendromlu hastalarda PK için taramaya 30 yaşında başlanır. Herediter pankreatitli hastalarda 40 yaşında
22 tarama yapmaya başlanır. Familiyal pankreas kanseri tanılı ailelerde sigara içenlerin, sigara içmeyenlere göre on yıl öncesinde kanser geliştirdikleri göz önüne alındığında, tarama sigara içen kişilerde daha erken başlamalıdır. Yüksek riskli bireyleri taramak için en iyi görüntüleme yöntemine dair bir fikir birliği yoktur. Bununla birlikte, EUS ve /veya MRI/MRCP en yüksek verime sahip gibi görünmektedir (55). EUS'un ümit verici bir role sahip olabileceği düşünülmektedir. PK için riskli bireylerde görüntüleme sırasında normal pankreas olduğunda tekrarlayan görüntüleme (EUS ve /veya MRI / MRCP) her yıl, tipik olarak EUS ve MRCP'de bir lezyon tespit edilene kadar gerçekleştirilebilir. Taramayı durdurma yaşı, her hastanın tıbbi durumuna ,tespit edilen lezyonların cerrahi tedavisi için uygunluğuna, yaşam beklentisine ve tercihlerine göre bireyselleştirilmelidir. Pankreas kanseri tanısından 2 yıl öncesinden hastalarda CA19-9 seviyeleri yükselebilir, bu da CA 19-9'un yüksek riskli hastaları taramak için biyobelirteç olarak kullanılma potansiyeline sahip olduğunu gösterir (56).
2.1.9. Tedavi
Pankreas kanseri tedavisinde cerrahi, lokal ablasyon tedavileri, kemoterapi, radyoterapi ve palyatif tedavi yöntemleri yer alır. PK hastaları klinik evrelemeye göre 4 ana gruba kategorize edilir: rezektabl, borderline rezektabl, lokal ileri ve metastatik hastalık.
2.1.9.1. Rezektabl pankreas kanseri tedavisi
Radikal cerrahi rezeksiyon bugün de tek potansiyel küratif tedavi seçeneği olmaya devam etmektedir. Ne yazık ki, geç tanıdan dolayı, hastaların sadece %15-20'si pankreatektomi için aday olmaktadır (57). Preoperatif evrelemede ve cerrahi rezeksiyon kararında tümör boyutu, vasküler tutulum, yaş ve komorbidite düşünülmelidir (58). Primer cerrahi rezeksiyon, uzak metastatik hastalığı bulunmayan, arter ve venöz yapılara teması olmayan yada 180 derecenin altında teması olan, abdominal cerrahi için uygun performans durumu olan, komorbidite profili olmayan, T1N0 evresinde olan hastalar için uygundur. Pankreatoduodenektomi(Whipple), distal pankreatektomi veya total pankreatektomi tümör konumuna göre gerçekleştirilir. Whipple ameliyatı pankreas başı,duodenum, jejunumun ilk 15 cm'si, safra kesesi ve gastrektomi yapılmasını içerir. Komplikasyonlar arasında gecikmiş mide boşalması, yara infeksiyonları, abdominal apse ve fistüllerdir. Sonuçları iyileştirmek veya operasyonla ilişkili morbiditeyi azaltmak amacıyla bu ameliyatın pilor koruyucu pankreatoduodenektomi ve subtotal mide koruyucu pankreatoduodenektomi gibi modifikasyonları geliştirilmiştir. Pankreasın gövde ve kuyruk yerleşimli kanserleri için
23 splenektomi ile kombine distal pankreatektomi uygulanır. Bölgesel pankreatektomi veya geniş lenfadenektomi ek bir fayda sağlamayacağından önerilmiyor.
2.1.9.2. Borderline rezektabl PK tedavisi
Borderline rezektabl neoadjuvan tedavi için potansiyel adaydırlar. Neoadjuvan kemoterapiden sonra cerrahi yapılan hastaları, neoadjuvan kemoterapi verilmeden ameliyat yapılan hastalarla karşılaştırıldığında lenf nodu pozitifliği, perinöral invazyon, pozitif sınır oranlarının daha düşük olduğu ve sağkalım oranının daha yüksek olduğu bildirilmiştir. Neoadjuvan tedavinin, PK için adjuvan tedaviden üstün olup olmadığı ise tartışmalıdır.
TNM sınıflamasına göre T1N0M0 evresinde neoadjuvan tedavi olmaksızın tümör rezeksiyonu yapılan tüm hastalara postoperatif adjuvan kemoterapi önerilir. Adjuvan tedavi mümkünse cerrahiden 8 hafta sonra başlatılmalıdır.
Rezeksiyona mutlak kontrendikasyonlar arasında periton, omentum veya herhangi bir ekstra abdominal bölgede metastaz varlığıdır.
2.1.9.3. Lokal ileri(unrezektabl) PK tedavisi
Lokal ileri PK için RT ve kemoradyoterapiden daha çox kemoterapi önerilmektedir. Rezektabl, borderline ve lokal ileri PK tedavi şeması tablo11'de gösterilmiştir.
24
PK: pankreas kanseri; KT: kemoterapi; PS: performans skoru; met: metastaz;T.bil: total bilirubin; NÜS: normalin üst sınırı.
25
2.1.9.4.Metastatik PK tedavisi
Metastatik hastalık varlığında kemoterapi, radyoterapi, palyatif tedaviler uygulanır. 2.1.9.4.1. Kemoterapi
Gemsitabin rezeke edilen pankreatik kanser için halen tercih edilen adjuvan tedavi olarak kullanılırken, 2011'den beri metastatik hastalık için iki kombinasyon rejimi altın standart haline gelmiştir: irinotekan ve oksaliplatin ile 5-fluorourasil (5-FU)/leucovorin (FOLFIRINOX) ve gemsitabin/nab-paklitaksel (59). Gemsitabin bazlı kemoterapinin lokal olarak ilerlemiş hastalıkları olan hastalarda sağkalım üzerindeki etkisinin, kemoradyoterapi ile yaklaşık olarak aynı etkinlikte olabileceği düşünülmüştür. ECOG(Eastern Cooperative Oncology Group) performans durumu 3 ve üzerinde olan veya kötü kontrol edilen komorbid durumları olan hastalara, duruma göre bireyselleştirilmiş sistemik kemoterapi önerilmeli ve destek tedavi ön planda düşünülmelidir.
2.1.9.4.2. Radyoterapi
Tek bir modalite olarak RT, medikal komorbiditelere bağlı kombine kemoradyoterapi için aday kabul edilmeyen veya ağrıları narkotik analjeziklerle yeterli düzeyde kontrol edilemeyen hastalarda ağrı palyasyonunda düşünülebilir. Lokal ileri hastalıkta eksternal RT kullanılabilir, ancak tek başına optimal tümör kontrolü sağlamaz. Bu belirsiz sonuçlar nedeniyle, sonuçları iyileştirmek adına FU, gemsitabin ve paklitaksel gibi radyasyon duyarlılaştırıcıları gibi davranan ilaçların RT ile eşzamanlı uygulanması gerekebilir. Kemoradyoterapi tedavisinin potansiyel yararları, lokal olarak ilerlemiş pankreas kanseri olan hastalarda çalışılmıştır.
2.1.9.4.3. Palyatif tedavi
Palyatif bakım diğer tedaviler kadar önemlidir, çünkü pankreas kanseri olan hastalar bir noktada palyasyon gerektirir. Obstrüktif sarılıkla gelen pankreas kanseri hastalarında cerrahi biliyer by-pass, endoskopik veya perkütan biliyer stentleme gerekir (60). Mide çıkış
obstruksiyonu için hem cerrahi gastrojejunostomi, hem de endoskopik duodenal stentler kullanılır. Unrezektabl ve metastatik pankreas kanseri palyatif tedavi olarak ağrı palyasyonu, pankreatik ekzokrin yetmezliğinin giderilmesi, venöz trombemboli tedavisi, kilo kaybı ve anoreksiya ile gelen hastalarda enteral/parenteral nütrisyon desteğinin sağlanması, peritoneal metastaz veya portal ven trombozuna bağlı gelişmiş assit tedavisi uygulanır.
26 2.1.9.5.İmmunoterapi
PK'de immünoterapi beş ana kategoriye ayrılabilir: kontrol noktası inhibitörleri/immün modülatörler, terapötik aşılar, adoptif T hücre transferi antikorları, monoklonal antikorlar ve sitokinler.
2.1.10. Prognoz
Hastanın prognozu tümörün histolojik derecesine ve yayılma derecesine bağlıdır. Tamamlanmış rezeksiyon uygulanmış lenf nodu negatif pankreas kanseri hastaların çoğu hala hastalıkdan ölmektedir (61). Unrezektabl pankreas adenokarsinomu olan hastalarda evreden bağımsız prognoz kötüdür. Sağkalım, epidemiyoloji ve sonuç veri tabanına göre pankreas kanseri evresi, görülme sıklığı ve evresine göre ortalama yaşam süresi tablo 12’de belirtilmiştir. Tablo 12: Pankreas kanseri ortalama yaşam süresi (62)
Evre Görülme sıklığı,% Ortalama yaşam süresi,ay
I 16 5.7
II 35 4.4
III 42.5 2.8
IV 6.6 2.2
2.2. Serin protez inhibitörü, Kazal tip (SPINK) ailesi
SPINK aile üyelerinin, disülfid bağı paterni oluşturan ve Kazal alan içeren karakteristik özelliği vardır. SPINK'ler böcekler, kuşlarda ve memelilerde bulunurlar. Tüm SPINK üyeleri, kontrolsüz proteolizi önleyen serin proteaz aktivitelerinin düzenlenmesinden sorumludur (63). Bugüne kadar insan genomunda SPINK1, SPINK2, SPINK4, SPINK5, SPINK6, SPINK7, SPINK8, SPINK9, SPINK13 ve SPINK14 olarak bildirilen en az 10 gen üyesi vardır. SPINK proteinleri ve proteazları arasındaki dengesizlik, pankreatit, çölyak hastalığı, Netherton sendromu ve kanser gibi ciddi hastalıklara neden olabilir. SPINK1 pankreas ve gastrointestinal sistemde; SPINK2 testis, epididim ve seminal vezikülde eksprese edilir. SPINK2 antimikrobiyal etki ile fertilitenin korunmasında rol oynar. SPINK4 ince barsak kriptlerinde, monosit ve merkezi sinir sisteminde; SPINK5, timus, vajinal epitel, Bartolin
27 bezleri, oral mukoza, bademcikler ve paratiroid bezlerinde bulunur. SPINK üyelerinin ana görevi epitelyal ve mukozal dokularını proteolitik degradasyona karşı korumadır (64).
2.2.1. SPINK1
SPINK1 pankreas sekretuar tripsin inhibitörü (PSTI) veya tümör ilişkili tripsin inhibitörü (TATI) olarak da bilinir. PSTI ilk kez 1948 yılında Kazal ve ark. tarafından sığır pankreasından izole edildi, bu yüzden Kazal inhibitörü de denir ve daha sonra 1967’de Fritz ve ark. tarafından insan pankreatik kanal sıvısında tespit edildi. Tümör ilişkili tripsin inhibitörü (TATI) olarak bilinen protein ise 1982 yılında over kanserli hastanın idrarında tanımlandı (65), daha sonra PSTI ile aynı özellikte olduğu anlaşıldı. TATI veya PSTI serin peptidaz inhibitörleri ailesine aittir, 5q32 kromozomal bölgede bulunan serin peptidaz(proteaz) inhibitörü, Kazal tip 1 (SPINK1) geni tarafından kodlanır, gen ismiyle son yayınlarda artık SPINK1 olarak isimlendirilmiştir. SPINK1 56 aminoasitten oluşur, üç disülfit bağı mevcuttur ve moleküler ağırlığı 6242 Da’dır(dalton) (66).
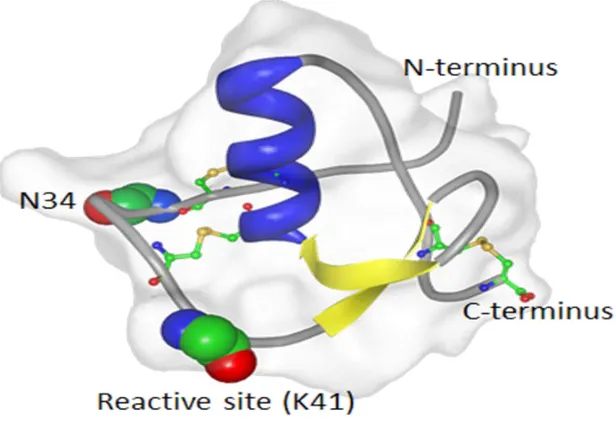
Şekil 4: Rekombinant SPINK1 varyantının bant diyagramı (üç disülfid bağı oluşturan sisteinler, toplar ve çubuklar olarak, Asparajin-34(N34) atomları ve reaktif bölge lisin(K41) yan zincirler olmayan toplar,
28 Sağlıklı popülasyonda SPINK1 serum konsantrasyonu 3-16 μg/l veya ng/ml (0.5-2.6 nmol/l), dolaşımdaki yarı ömrü 6-8dk’dır (69). Serum SPINK1 konsantrasyonu 70 yaş üstü erkek ve kadınlarda daha yüksek saptanmıştır. SPINK1 glomerüler filtrasyon ile elimine edildiğinden, diyaliz hastalarında serum konsantrasyonlarında artış beklenmektedir. SPINK1 proteini ekzokrin pankreas asiner hücrelerinde sentezlenir, tripsine bağlanır ve tripsinojenin erken aktivasyonunu önler (70). Bu nedenle, SPINK1’in normal pankreas gelişimi ve diferensasyonu için gerekli olduğu düşünülmektedir. SPINK1 normal konsantrasyonlarda plazmin, ürokinaz, doku plazminojen aktivatörünün inhibitörüdür. SPINK1, hem de midenin mukus salgılayan hücrelerinde eksprese edilir ve reflüde pankreatik proteazlara karşı mide epitelini korumaktadır (71). Ayrıca, SPINK1 serin proteaz ve kaspaz bağımlı apoptozu inhibe etmektedir (72). Son zamanlarda, SPINK1’in overekspresyonunun hepatit B ve C ile enfekte karaciğer hücrelerinde hücre apoptozunu önlediği bildirilmiştir (73). Bir proteaz inhibitörü olmasının yanı sıra, SPINK1 akut faz reaktanı ve büyüme faktörü olarak da davranmaktadır. Ogawa ve ark. tarafından şiddetli sistemik inflamasyonda serum SPINK1 konsantrasyonu yüksek bulunmuştur (74). Akut pankreatitli hastalarda SPINK1’in serum konsantrasyonu belirgin olarak artmıştır (75).
2.2.1.3. SPINK1 ve pankreatit
SPINK1 gen mutasyonları genel popülasyonda oldukça yaygındır, sağlıklı bireylerin %2'si bu mutasyonu taşırlar, fakat taşıyıcıların %1'inden azı pankreatit geliştirir (76). 2000 yılında Witt ve ark. SPINK1 genindeki mutasyonların kronik pankreatit ile ilişkili olduğunu göstermiştir (77). SPINK1'deki mutasyonlar, genel popülasyona göre yaklaşık 12 kat kronik pankreatit riskini artırmaktadır. Pankreatitli hastalarda N34S alleli sıklığı %9.1-%28,6 arasında bulunmuştur. SPINK1 mutasyon varyantları idiopatik pankreatit, alkole bağlı pankreatit, familiyal pankreatit ve tropikal pankreatit ile ilişkilendirilmiştir (78). Heterozigot SPINK1 mutasyonları ve pankreatitli hastalar, kompleks genetik mutasyonlara sahiptirler. Dolayısıyla, SPINK1 mutasyonu muhtemelen başka bir genetik veya çevresel faktörlerden pankreatit geliştirme eşiğini düşürerek hastalık modifiye edici olarak görev yapar. SPINK1’in bilinen mutasyonlarından ikisi N34S ve c.194 + 2T> C'dir. Birincisi enzim fonksiyonunu değiştirmez, c.194 + 2T> C ise fonksiyon fenotip kaybına yol açar. SPINK1 mutasyonları önemli ölçüde pankreas kanseri için risk faktörü olan kronik pankreatit ile de ilişkili bulunmuştur (79). Eşzamanlı pankreatit olmaksızın SPINK1 mutasyonları ve DM arasındaki ilişki nedeni açıklanamamış ve genetik bir bağlantının olup olmadığı hala aydınlatılmamıştır.
29 2.2.1.1. Kanserde tanı belirteci olarak serum SPINK1
SPINK1 yüksek ekspresyonu insan pankreas asinar hücrelerinde olduğu gibi kanserlerde de araştırılmış ve serum, idrar ve tümör dokularında mevcut olduğu bulunmuştur. Gastrointestinal tümörlerde, karaciğer, pankreas, mesane, böbrek, prostat, testis, over, serviks, meme kanserlerinde de SPINK1'in overekspresyonu gözlemlenmiştir. SPINK1'in aşırı ekspresyonu, bazılarında kötü prognoz göstergesidir ve serumda SPINK1'in belirlenmesi, agresif hastalık riskini tanımlamak için kullanılabilir.
2.2.1.4. SPINK1 ve pankreas kanseri
Erken evre prekanseröz PanIN’lerde ve pankreatik duktal adenokarsinom hücrelerinde SPINK1 ve EGFR birlikte eksprese edilir. EGFR ve EGF ailesi ligandları pankreas adenokarsinomu ve displazide aşırı eksprese edilir. Ozaki ve ark. tarafından hem EGFR, hem de MAPK/ERK kinaz inhibitörlerinin, pankreas kanser hücrelerinde SPINK1 tarafından indüklenen hücre proliferasyonu inhibe ettiği gösterilmiştir (72). Bu nedenle, SPINK1'in EGF reseptörlerine bağlanarak mitojenle aktive olan protein kinaz (MAPK) kaskadı yoluyla hücre proliferasyonuna neden olarak büyüme faktörü olarak rol oynadığı düşünülmüşdür. (Şekil 5).
30
3.MATERYAL METOD
3.1.Pankreas kanseri ve kontrol grubu
Pankreas kanseri çalışma grubu; Ege Üniversitesi Tıp Fakültesi Gastroenteroloji klinik ve polikliniklerine 2017-2018 yılları arasında başvuran, en az bir görüntüleme yöntemi ile pankreas kanseri tanısı alan hastalardan oluşturulmuştur. Sağlıklı kontrol grubu, Ege Üniversitesi Tıp Fakültesi Hastanesi Gastroenteroloji polikliniklerine herhangi şikayetle başvurmuş, 18 yaş üstü, kronik hastalığı olmayan, ve incelemeler sırasında anlamlı patoloji bulgu saptanmamış, rutin işlemleri sırasında hemogram, biyokimyasal parametreler, CA19-9 tetkikleri istenmiş sağlıklı bireylerden oluşturulmuştur.
Çalışmaya katılan pankreas kanseri tanılı hastalardan ve sağlıklı gönüllülerden “Gönüllü Olur Formu” alınmıştır.
Çalışma grubundan her hasta ile tek tek görüşülerek dışlama kriterlerinin varlığı da araştırılmıştır. Temel hasta özelliklerine (cinsiyet, yaş, yaşam tarzı faktörleri, beslenme biçimleri, komorbiditeler, kullandığı ilaçlar, aile öyküsü, tanı yaşı ve tanı süresi ) ilişkin veriler; klinik-patolojik özellikler (semptomlar, tümör yeri, tümör çapı ve evresi); laboratuvar parametreler (hemogram, biyokimyasal parametreler ve tümör belirteçleri) kaydedilmiş ve değerlendirilmiştir. SPINK1 değerini etkileyebilecek ek maligniteleri olan olgular çalışmaya alınmamıştır.
Kilo ve boy bilgileri sorgulanarak vücut kitle indeksleri (VKİ) tek tek hesaplanmıştır. VKİ hesabı için kilo/ boy2 formülü kullanılmıştır
Çalışma grubuna alınan hastaların pankreas kanseri tanısına yönelik yapılmış USG, BT, MRG, PET’BT, EUS raporları incelenerek tümörün çapı, vasküler invazyonu, lenf nodu ve uzak metastazı kaydedilmiştir. Mevcut görüntüleme yöntemleri kullanılarak (AJCC) TNM evreleme sistemi ile hastalığın evresi belirlenmiştir.
EUS-FNA veya perkutan işlemle alınan biyopsi örneklerinin patoloji sonuçları incelenmiştir. Pankreas adenokarsinomu ile uyumlu sonuçları bulunan hastalar çalışmaya dahil edilmiştir. Patolojik tanısı olmayan ancak görüntülemelerle pankreas kanseri tanısı alan hastalar da çalışmaya katılmıştır.
Hastaların başvuru anındaki laboratuvar değerlerinden; hemoglobin, hematokrit, lökosit, trombosit değerleri, CRP, Aspartat Amino Transferaz (AST), Alanin Amino Transferaz (ALT), Alkalen Fosfataz (ALP), Gama Glutamil Transferaz (GGT), üre, kreatinin, kalsiyum, glukoz, albümin, globülin, total bilirubin, direk bilirubin, indirekt bilirubin, amilaz, lipaz,