i
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
KARDİYOLOJİ ANABİLİM DALI
HİPERKOLESTEROLEMİLİ OLGULARDA SERUM
LİPOPROTEİN (a) DÜZEYLERİ İLE AORT KAPAK
KALSİFİKASYONU İLİŞKİSİNİN DEĞERLENDİRİLMESİ
UZMANLIK TEZİ
Dr. Rashad HUSEYNOV
TEZ DANIŞMANI
Prof. Dr. Serdar PAYZIN
ii
TEŞEKKÜR
Kardiyoloji ihtisas eğitimim boyunca engin bilgi ve deneyimlerini benden
esirgemeyen başta anabilim dalı başkanımız sayın Prof.Dr.Cemil GÜRGÜN ve tez
danışman hocam Prof.Dr.Serdar PAYZIN olmak üzere tüm değerli hocalarıma,
Tez çalışmamın ortaya çıkmasında konu belirlenmesinden istatistik yöntemlere
kadar tüm aşamalarında en az benim kadar emek sarf eden değerli hocam
Prof.Dr.Meral KAYIKÇIOĞLU'na,
Tez çalışmamda tomografi görüntülerinin yorumlanmasında yardımlarını
esirgemeyen sayın Doç.Dr.Selen BAYRAKTAROĞLU'na
Tez çalışmamda bilgi birikim ve yardımlarını esirgemeyen
Uzm.Dr.Evrim ŞİMŞEK'e,
Asistanlık süremi birlikte geçirdiğim tüm değerli doktor arkadaşlarıma,
İhtisas sürem boyunca yardım ve güler yüzlerini esirgemeyen kliniğimizin
bünyesinde çalışan tüm servis, yoğun bakım, poliklinik hemşire ve yardımcı sağlık
çalışanlarına,
Desteğini her zaman yanımda hissettiğim, yaptığı işlerle beni ve ailemizi her
zaman gurulandıran abim Halit HUSEYNOV'a,
Bugünlere gelmemdeki emeklerini unutmayacağım, desteklerini hayatımın her
anında hissettiğim ve her zaman yanımda olan babam Zöhrab HUSEYNOV,
annem Samara HUSEYNOV ve ablalarıma teşekkürlerimi sunarım.
Dr.Rashad HUSEYNOV İZMİR 2016
iii
İÇİNDEKİLER Sayfa
1. Giriş ve Amaç ... 8-9 2. Genel Bilgiler ... 9-422.1. Aort Kapak Hastalıkları... 9-17
2.2. Kolesterol Metabolizması ve Hiperkolesterolemi... 17-27
2.3. Lipoprotein (a)...……… 28-33
2.4. Elektron Beam Tomografi... 34-39
2.5. Aort Elastik Özellikleri... 39-42
3. Gereç ve Yöntem ... 43-49 4. Bulgular ... 50-63 5. Tartışma ... 64-71 6. Kısıtlılıklar ………... 71 7. Sonuç ………... 72 8. Özet ... 73 9. Summary ... 74 10. Kaynaklar ... 75-89
iv
TABLO VE ŞEKİL DİZİNİ
Şekil 1. Aort kapağının ve aort kökünün normal anatomisi.Şekil 2. Aort kapak histolojik tabakaları. (F-fibroza, S-Spongioza, V-Ventrikülaris(endotel)). Şekil 3. TEE ile elde edilmiş farklı tiplerdeki Aort Kapak Kalsifikasyonu görüntüleri.(3) Şekil 4. Aterosklerotik plak gelişimi.
Şekil 5. LDL ve Lp-(a)' nın bileşenleri.
Şekil 6. A-Windkessel fonkiyonu; Aortanın sistolde gevşeyerek kan depolaması,B-Diyasyolde elastik geri çekilme ile depolanan kanın sisteme gönderilmesi.
Şekil 7. Aort Elastik Özelliklerinin TTE ile değerlendirilmesi. Şekil 8. İnen Aortaya Yayılım Hızı.
Tablo 1. Aort kapak kalsifikasyonunun sınıflandırılması.(2)
Tablo 2. Aort kapak kalsifikasyonunun transözofajiyal ekokardiyografik görüntüler ile yapılan sınıflandırması.
Tablo 3. NCEP ATP III kılavuzuna göre serum lipid düzeylerinin sınıflandırılması.(43) Tablo 4. Sekonder dislipidemi nedenleri.
Tablo 5. Hiperkolesterolemi için ESC Dislipidemi Kılavuzu (2016) tedavi önerileri.(43) Tablo 6. Kadınlar için yaşa göre Koroner Arter Kalsiyum skoru persentil tablosu. (85) Tablo 7. Ekekler için yaşa göre Koroner Arter Kalsiyum skoru persentil tablosu. (85) Tablo 8. Klinik verileri.
Tablo 9. Aile öyküleri verileri. Tablo 10. Laboratuvar veriler.
Tablo 11. Karotis intima media kalınlığı ve aşil tendon kalınlığı verileri. Tablo 12. Ekokardiyografi verileri.
Tablo 13. Aort elastik özellikleri verileri. Tablo 14. Tedavi verileri.
Tablo 15. EBT verileri ile Lp(a) kolerasyonu. Tablo 16. Eko parametreleri ile Lp(a) kolerasyonu. Tablo 17. USG verileri ile Lp(a) kolerasyonu.
v
Tablo 18. Lp(a) gruplarına göre aort kapak kalsifikasyonu verileri karşılaştırılması.
Tablo 19. Lp(a) gruplarına göre arkus aorta kalsifikasyonu ve koroner arter kalsifikasyonu verileri karşılaştırılması.
Tablo 20. Lp(a) gruplarına göre USG verileri karşılaştırılması. Tablo 21. Lp(a) gruplarına göre EKO verileri karşılaştırılması.
Tablo 22. Lp(a) gruplarına göre klinik ve laboratuvar verileri karşılaştırılması.
Tablo 23. Aort elastik özellikleri ile arkus aorta kalsifikasyon verilerinin karşılaştırılması. Tablo 24. aort elastik özellikleri ile koroner arter kalsiyum skoru verileri karşılaştırılması. Tablo 25. Aort kapak kalsifikasyon skoru ile klinik ve laboratuvar verilerin karşılaştırılması. Tablo 26. Arkus aorta kalsifikasyon skoru ile klinik ve laboratuvar verilerin karşılaştırılması. Tablo 27. Koroner arter kalsiyum skoru ile klinik ve laboratuvar verilerin karşılaştırılması.
vi
KISALTMALAR
AoDÇ : Aortik diyastolik çap AoSÇ : Aortik sistolik çap
Apo : Apolipoprotein
DKB : Diyastolik kan basıncı
DM : Diyabetes Mellitus
DNA : Deoksiribonüleik asit E(p) : Elastik Modulus
EAS : Avrupa Ateroskleroz Derneği (European Atherosclerosis Society) EKG : Elektrokardiyografi
ESC : Avrupa Kardiyoloji Derneği (European Society of Cardiology)
AH : Ailesel hiperkolesterolemi
GİA : Geçici iskemik atak HbA1C : Glukozile hemoglobin HDL : Yüksek dansiteli lipoprotein
HDL-K : Yüksek dansiteli lipoprotein kolesterol
HT : Hipertansiyon
ICD : Uluslararası Hastalık Sınıflaması (International Classification of Diseases)
İAYH : İnen aorta yayılım hızı KAH : Koroner arter hastalığı KBY : Kronik böbrek yetmezliği KİMK : Karotis intima media kalınlığı KKH : Koroner kalp hastalığı
KVH : Kardiyovasküler hastalık LDL : Düşük dansiteli lipoprotein
LDL-K : Düşük dansiteli lipoprotein kolesterol
vii Lp (a) : Lipoprotein a
Mİ : Miyokard infarktüsü
NCEP ATP III : Amerikan Ulusal Kolesterol Eğitim Programı- Erişkin Tedavi Paneli
(National Cholesterol Education Program Adult Treatment Panel)
NICE : İngiltere Ulusal Sağlık ve Klinik Mükemmelik Enstitüsü (National Institude for Health and Clinical Excellence)
NLA : Amerikan Ulusal Lipid Derneği (National Lipid Association) SKB : Sistolik kan basıncı
SNP : Tek nükleotid dizilim hatası (Single Nucleotide Polymorphism) SREBP2 : Sterole yanıt veren element bağlayıcı protein 2 (Sterol-responsive
element binding protein 2)
TAPSE : Triküspit Anüler Plan Sistolik Bozulma (Trikuspit Anular Plane Systolic Excursion )
TG : Trigliserid
THS : Turkish Heart Study (Türk Kalp Çalışması) VLDL : Çok düşük dansiteli lipoprotein kolesterol VYA : Vücut yüzey alanı
WHO : Dünya Sağlık Örgütü (World Health Organisation) KAKS : Koroner Arter Kalsiyum Skoru
EBT : Elektron Beam Tomografi
AKK : Aort Kapak Kalsifikasyonu AAK : Arkus Aorta Kalsifikasyonu SolV EF : Sol ventrikül ejeksiyon fraksiyonu SolVED : Sol ventrikül diyastol sonu çap SolVES : Sol ventrikül sistol sonu çap SağVsm : Sağ ventrikül sistolik haraketi
8
GİRİŞ VE AMAÇ
Aort kapak kalsifikasyonu lipit depolanması, enflamasyon ve kalsifikasyon aşamalarının oluşturduğu ateroskleroza çok benzer fizyopatolojiye sahip aktif bir hastalık sürecidir ve bu süreç hafif derece aort kapak kalsifikasyonundan ciddi aort kapak darlığına kadar değişken evreler içermektedir.
Aort darlığının farklı derecelerine sahip hastalar üzerinde yapılan immünohistokimyasal analizler erken evre aort darlığı ile ateroskleroz arasında birçok benzer nokta olduğunu ortaya koymuştur. Bunların başında enflamatuvar hücre infiltrasyonu, lipoproteinler ve kalsiyum depolanması gelmektedir. Koroner arter hastalığı (KAH) ile aort darlığında da ileri yaş, erkek cinsiyet, hipertansiyon öyküsü ya da düşük yoğunluklu lipoprotein kolesterol (LDL-K) yüksekliği gibi aterosklerotik risk faktörlerinin ortak oluşu da bu patofizyolojik benzerliği desteklemektedir.
Aort sklerozu, kalsifik aort darlığının erken aşaması olarak kabul edilmekte olup kapağın kan akımını engellemeyecek ölçüde kalınlaşması ile karakterizedir. Aort sklerozu 65 yaş üzerindeki erişkinlerin yaklaşık %25’inde görülen bir tablodur ve sıklığı yaş, cinsiyet, hipertansiyon, sigara içimi, serum LDL-K düzeyi, lipoprotein(a) [La(a)] düzeyi ve diabetes mellitus gibi aterosklerotik risk faktörlerinin varlığında artmaktadır. Ayrıca bilinen KAH olmayanlarda ekokardiyografik olarak aort sklerozunun saptanmasının miyokart enfarktüsü ve kardiyovasküler (KV) ölüm riskini kapağı normal olanlara göre %50 oranında artırdığı
gösterilmiştir.
1963 yılında Berg tarafından tanımlanan Lp (a), LDL benzer yapıda ancak farklı olarak LDL'deki apolipoprotein B-100'e disülfit köprüsü ile bağlı spesifik bir glikoprotein,
Apolipoprotein (a) içeren kolesterolce zengin bir plazma partikülüdür . Apolipoprotein (Apo) (a) plazminojende yer alan proteaza benzer bir bölge, “Kringle” 4 homoloğu çok sayıda kopya ve bir adet kringle 5 homoloğu bölge içererek plazminojen ile de önemli yapısal özellikleri
paylaşmaktadır . LDL'ye benzer yönüyle aterojenik özelliklere sahip olan Lp (a), Apo (a) nın plazminojenle olan yapısal homolojisi ile trombojenik ve antifibrinolitik potansiyele sahip
9
olabilmektedir. Çok sayıda çalışmada KAH , miyokart enfarktüsü, ve koroner arter bypass operasyonu sonrası ven graft stenozu ile ilişkisi gösterilen plazma Lp(a) konsantrasyonları, aterosklerotik hastalıklar için bağımsız bir risk faktörü olarak kabul edilmekte ve 30 mg/dl den daha yüksek plazma konsantrasyonları 2-5 kat daha yüksek risk taşımaktadır.
Aort kapak kalsifikasyonun tıpkı KAH gibi aktif bir aterosklerotik süreç olduğu ve Lp(a)’nın, LDL gibi aterojenik molekül olduğu göz önüne alındığında, bu çalışmada serum Lp(a) düzeyi ile aort kapak kalsifikasyonu ilişkisini saptamayı amaçladık. Bu amaçla Ege Üniversitesi Tıp Fakültesi (EÜTF) Kardiyoloji AD lipid polikliniğinden takipli koroner arter kalsiyum (KAK) skorlama tetkiki yapılmış, serum Lp(a) düzeyi belirlenmiş olguların tomografi görüntüleri aort kapak kalsifikasyonu açısından tekrar değerlendirdik.
Çalışmamızın hipotezi;
1. Serum Lp (a) aterosklerozda aktif rol almaktadır ve bu nedenle aterosklerotik bir süreç olan aort kapak kalsifikasyonu (AoKK), arkus aorta kalsifikasyonu (AAK) ve KAK ile ilişkilidir.
2. Arkus aorta kalsifikasyonu ekokardiyografik olarak değerlendirilen aort elastik özelliklerini bozmaktadır.
2. GENEL BİLGİLER
2.1. Aort Kapak Hastalığı
Aort kapak hastalığı geleneksel olarak kapak disfonksiyonu baz alınarak sınıflandırılır. Günümüzde, sınıflama altta yatan patolojiye göre değerlendirilmektedir; çünkü progresyon ve yönetim en azından kısmen hastalık etiyolojisi tarafından belirlenmektedir, kapak hemodinamisi açısından değil.
Önemli aort kapak hastalığının prevalansı (orta ve ciddi kapak hastalığı) yaşla artar; 18 ve 44 yaşları arasında aort kapak hastalığı %0.7 de iken, 75 yaş ve üzerinde bu oran %13.3’dür(1).
10
Ekokardiyografide görülen klinik olarak önemli diğer nativ kapak hastalıkları ile kıyaslandığında aort kapak hastalıkları Avrupa Kalp Araştırmasında en sık olarak belirtilmiştir(%34)(1).
2.1.1. Normal Kapak Anatomisi.
Normal aort kapak anatomisi Aortik Valsalva sinüslerinde uzanan üç yaprakçıktan oluşmaktadır. Anatomik olarak, normal aort kapakğı kompleks üç boyutlu şekle sahiptir ayrıca her bir kuspis komissürlerin süperiyorunda ve sol ventriküler (SolV) çıkış yolunun inferioruna yerleşimli semi-silindirik aort sinüslerinden oluşmaktadır. (Şekil 1)
Herbir sinüsteki koroner ostiumlar Aortik yaprakçıklara göre isimlendirilirler: sağ
koroner kuspis, sol koroner kuspis ve nonkoroner kuspis. Diyastolde yaprakçıklar birbiri üzerine örtüşürler ve her bir yaprakçıkta santral kalınlaşma bölgesi mevcuttur (Arantius nodülü) öyle ki kapağın tam kapanmasını sağlamaktadır. Sistolde yaprakçıklar pasif olarak dairesel açıklığın içine doğru açılır ve ventriküler kontraksiyon kanın kapaklar boyunca aorta içine geçişine yol açar.
Şekil 1. Aort kapağının ve aort kökünün normal anatomisi.
11
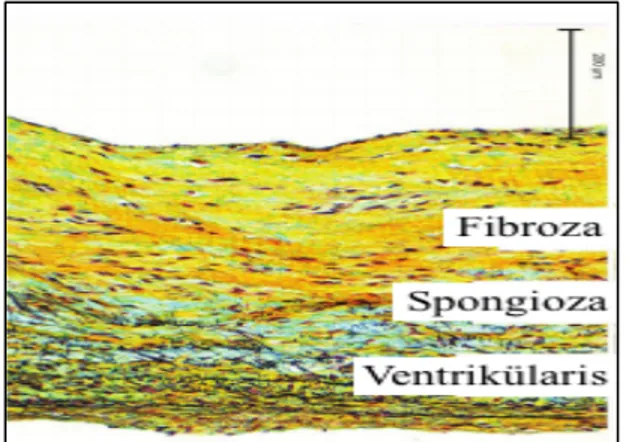
1. Fibroza; Daha güçlü bir yapı oluşturan yoğun kollajen tabaka. 2. Spongiyoza; Yaprakçıkların tabanındaki zayıf doku.
3. Endotel; Yaprakçığın hem aortik hem de ventriküler tarafları üzerindeki dış tabaka.
Şekil 2. Aort kapak histolojik tabakaları.
(F-fibroza, S-Spongioza, V-Ventrikülaris (endotel))
Çoğunlukla, yaşlanma ile oluşan kapaktaki makroskopik değişiklikler yaprakçık kalınlığında diffüz artış ve santral nödüllerin kalınlığındaki artışı içermektedir. Aort kapağın fonksiyonel sistolik açılması yaş ile genel olarak etkilenmez ancak yaş ile birlikte fibroza tabakasında disorganizasyon ve spongiyoza tabakasında artmış adiposit hücreleri
izlenmektektedir.
2.1.2. Kalsifik Aort Kapak Hastalığı
Kalsifik aort kapak hastalığı (KAKH) yaprakçık tabanlarının tutulumu, yaprakçık kenarlarının göreceli olarak atlanması ve komissüral füzyonun yokluğu ile karakterize kapak yaprakçıklarının anormal kalsifikasyonudur. KAKH aortik skleroz olarak adlandırılan yaprakçık haraketi bozukluğu olmaksızın hafif fokal kapak kalınlaşmasından, kalsifik aort stenozu olarak adlandırılan SolV çıkışının önemli obstrüksiyonuna kadar değişen aralıktadır.
12
Aort kapak kalsifikasyonunun standart bir morfolojik sınıflandırması mevcut değildir. Shively ve arkadaşlarının yaptığı bir çalışmada, kalsifik kapağın değerlendirilmesinde
kalsifikasyonun derecesi, dağılımı ve lokalizasyonunu içeren 3 özellik kullanılmıştır(Tablo1).(2) Tolstrup ve arkadaşları tarafından transözofajiyal ekokardiyografi ile yaptıkları bir çalışmada ise farklı bir sınıflandırma yapılmıştır.(Tablo 2, Şekil 3).(3)
Tablo 1. Aort kapak kalsifikasyonunun sınıflandırılması(2) Derece Ekokardiyografi değerlendirme
1 Normal
2 Yansımada hafif artış 3 Yansımada orta derece artış
4 Yansımada yaygın, belirgin artış, kapakçıklarda 2-4mm’lik kalınlık artışı 5 Yansımada yaygın, belirgin artış, kapakakçıklarda ≥4mm’lik kalınlık artışı
Tablo 2. Aort kapak kalsifikasyonunun transözofajiyal
ekokardiyografik (TÖE) görüntüler ile yapılan sınıflandırması. Tip TÖE görüntüsü
I Lokalize ve nodüller olmayan II Lokalize ve nodüller
III Yaygın IV Karışık
13
Şekil 3. TÖE ile elde edilmiş farklı tiplerdeki Aort Kapak Kalsifikasyonu görüntüleri(3) A: Tip I, B: Tip II, C: Tip III ve D: Tip IV.
5621 kişiyi içeren Amerika popülasyon tabanlı Kardiyovasküler Sağlık Çalışmasına göre, aort kapak sklerozu 65 yaşın üzerindeki yetişkinlerde %26 ve 85 yaşın üzerindekilerde %48 olarak saptanmıştır(4). Benzer olarak, Finlandiya Helsinki Yaşlanma Çalışmasında, 55 ile 71 yaşların arasındaki kişilerin %21’i ekokardiyografide aort stenozuna sahipti(5). Aort sklerozu zamanla stenoza ilerleyebilir. Ciddi kalsifik aort stenozunun yaşla artmakla birlikte 65 yaşın üzerindeki kişilerde yaklaşık olarak %2 ile %4’tür. Birleşik Devletlerde yıllık 50000 aort kapak replasmanın çoğunun nedeni aort stenozudur ve bu hastaların yaklaşık %50’sinde stenoz nedeni kalsifik aort hastalığıdır.
2.1.3. Patofizyoloji
Uzun yıllar boyunca dejeneratif aort kapak hastalıklarının (aort kapak sklerozu ve stenozu) kalsiyumun pasif olarak kapakta birikimi sonucunda ortaya çıktığı düşünülmekteydi.
14
Günümüzde ise aort kapağı hastalıklarının aktif bir süreç içeren, değişkenlik gösteren bir durum olduğu bilinmekte ve bunun ilerlemesini önleyecek yaklaşımlar üzerinde durulmaktadır.
Doku düzeğinde, KAKH’nın erken lezyonu yaprakçığın Aortik tarafdaki fokal
subendotelyal lezyonlar ile karakterizedir ayrıca komşu fibrozaya doğru hastalık uzanmaktadır. Bu erken lezyonlar okside LDL-K içeren ekstraselüler lipid, makrofaj ve T lenfositler ile infiltre durumda inflamatuvar hücre kümesi ve mikroskobik doku kalsifikasyonu içermektedir.(6-10)
Makrojaflar tarafından anjiyotensin dönüştürücü enzim (ACE) üretimi kanıtı mevcuttur ayrıca doku kalsifikasyonu ile ilişkili proteinler mevcuttur. Cerrahi olarak eksize edilmiş kapak çalışmaları ve KAKH hayvan modelleri araştırmalarında hastalık progresyonunda osteogenezis ile kapak intersitisyel hücrelerin transformasyonu olduğu gösterilmiştir.
Aort kapak lezyonlarının hiperlipidemi ile ilişkili olabileceğini gösteren bir çok çalışma vardır. Aort kapağı lezyonlarının patolojik incelemesinde, lipid yüklü köpük hücreleriyle ekstraselüler alanda serbest olarak lipid depolanması, aterosklerotik süreç ile olan benzerliğin göstergesi olarak değerlendirilmektedir. LDL-K haricinde aterojenik lipoproteinlerden olan Apo (B), Apo (a) ve Apo E aort kapak sklerozu ile ciddi aort kapak lezyonlarında gösterilmiştir. Bu bilgiler aort kapak lezyonlarının dejeneratif bir süreçten ziyade aktif bir inflamasyon sonucunda oluştuğunu düşündürmektedir.(11)
2.1.4. Genetik ve Klinik Risk Faktörleri
KAKH gelişimi çeşitli anatomik, genetik ve klinik faktörler ile ilişkilidir. KAKH gelişimi için en güçlü öngörü sağlayan durum konjenetal biküspit aort kapak hastalığıdır. Bununla yanaşı genetik faktörler triküspit yapıdaki aort kapakların kalsifikasyonu hastalığında da etkili
olmaktadır. Stabil popülasyon tabanlı Fransa’dan bir çalışma göstermektedir ki çeşitli jenerasyonlar boyunca birden çok kişinin etkilenmiş durumda olduğu ailelerde aort stenozu vakalarının coğrafi kümelenmesi söz konusudur.(12) Ayrıca spesifik aday genleri gösteren vaka kontol çalışmaları KAKH ile ilişkili genetik polmorfizmleri göstermektedir ve bunlar vitamin D reseptör, östrojen reseptör, apolipoprotein ve interlökin alellerini içermektedir.(9, 13-15)
KAKH ile ilişkili klinik faktörler KAKH’nın ekokardiyografi ile saptanmasına dayalı prospektüf Kardiyovasküler Sağlık Çalışmasını (CHS) ve yaprakçık kalsifikasyonunun BT’de
15
saptanması üzerine dayalı Aterosklerozun Çoklu Etnik Çalışmasını (MESA) içermektedir. CHS’de çoklu değişkenli analiz tarafından tanımlanan KAKH ile ilişkili klinik faktörler; ileri yaş, erkek cinsiyet, artmış serum Lpa düzeyi, hipertansiyon, sigara kullanımı ve kısa boyu içermektedir. MONİCA-KORA çalışması bu klinik faktörleri desteklemekle birlikte yaş, sigara kullanımı ve total kolesterol düzeğinin de KAKH ile ilişkili olduğu saptamıştır(16) MESA verileri diyabet ve metabolik sendromla olan ek ilişkileri göstermiştir.(17)
KAKH’nın yapılan çalışmalarla birlikte progresif aterosklerotik sürecin bir parçası olduğu ispatlanmışdır. Aterosklerotik risk faktörleri ile KAKH’nın ilişkisini destekleğen diğer veriler Aortik sinüslerde ve kökte yaşamın erken evrelerinde homozigot tip II hiperlipoproteinemili hastalarda hızlanmış KAKH’nın varlığıdır.(18)
2.1.5. Klinik Sonuçlar
Erken KAKH (aort sklerozu) bazen ciddi kapak obstrüksiyonuna(aort stenozu) progrese olabilir fakat tüm kişilerde değil. 5 yıllık bir süreç içerisinde sklerozdan progresyon CHS popülasyonunun yaklaşık %9’unda gözlenmiştir.(19) Aort stenozu olan 2000 hastadan daha fazla kişinin katıldığı bir çalışmada, aort sklerozu tanısından ciddi aort stenozu gelişimine kadar geçen süre 8 yıldır, %10 hafif stenoz ve %3 hastada orta dereceli stenoza ilerleme gözlemlenmiştir.
Önemli çıkış yolu obstrüksiyonu yokluğunda bile, aort sklerozunun varlığı advers klinik sonuçlarla ilişkilidir ve aort stenozuna progrese olmayanlarda bile risk sürmektedir.
Katılımcılarının tamamının KAH’a sahip olmadıkları bilinen CHS çalışmasında, 5 yıl boyunca KV ölüm için rölatif risk normal aort kapaklı olanlarla kıyasla 1.52 idi (%95GA, 1.12-2.05). Riskte benzer bir artış miyokard enfarktüsü için de gösterilmiştir (rölatif risk 1.4).(19) Ayrıca artmış anjina, kalp yetersizliği ve inme riski ile ilişkilidir.(20)
LIFE (Losartan Intervention for Endpoint Reduction in Hypertension) araştırmasının aort kapak sklerozunun KV olaylarla ilişkisini inceleyen ekokardiyografik alt çalışmasında, diyabet, KAH, periferik arter hastalığı ve inme gibi geleneksel risk faktörlerine sahip bireylerde aort kapak sklerozunun daha fazla izlendiği tespit edilmiştir. Beş yıllık izlemde aort kapak sklerozu varlığının inme, miyokard enfarktüsü ve birleşik sonlanım noktalarında (KV ölüm, inme veya miyokard enfarktüsü) artış ile birlikteliği ortaya konmuştur. (HR 1.52, 95% GA, 1.01-2.30)(21)
16
2279 tane daha önce bilinen KAH olmayan bireyin incelendiği epidemiyolojik bir çalışmada aort kapak sklerozu varlığının KV olaylarda 4 kat artış ile birlite olduğu tespit edilmiştir.(22)
Tüm bu çalışmalar incelendiğinde aort kapak sklerozu varlığının klinik sonlanım noktaları açısından bağımsız bir risk faktörü olduğuna dair kesin bir yargıya varmak oldukça güç
görünmektedir. Büyük gözlemsel çalışmalarda aort kapak sklerozunun klinik sonlanımlarla ilişkisi gösterilememiştir. Bunda büyük ihtimalle aort kapak sklerozunun kabul edilmiş evrensel bir tanımlamasının olmayışı ve görüntüleme yöntemi olarak oldukça yaygın kullanılan
ultrasonografi tekniğindeki tanısal anlamdaki güçlükler rol oynamaktadır. Görüntüleme yöntemi olarak kolay erişebilen ve sık kullanılan ekokardiyagrafik incelemelerde kardiyak yapıların görüntülerinin iyileştirilmesi amacıyla kazanım (gain) ve frekans ayarlarını değiştirmek sistematik hatalara yol açabilir.
Aort sklerozu ile ilişkili artmış risk mekanizması belirsizdir fakat aort sklerozu artmış aterosklerotik hastalık riski belirleyicisidir ayrıca tanımlanmamış klinik bir risk faktörünü(23, 24) veya generalize inflamatuvar süreci yansıtmaktadır.(24-27)
2.1.6. Aort Kapak Kalsifikasyonu Varlığında Risk Azaltılmasına
Yönelik Yaklaşımlar
Günümüzde izole aort kapak sklerozu varlığında klinik sonlanımları önlemek noktasında kabul edilen bir öneri bulunmamaktadır. Ancak aort kapak sklerozuna eşlik eden geleneksel risk faktörlerinin varlığı birincil ve ikincil önleme stratejilerini gündeme getirmektedir.
3-hidroksi-3-metilglutaril koenzim A (HMG CoA) reduktaz inhibitörü olan rosuvastatin ile yapılan bir çalışmada, orta ve ciddi aort darlığı olan hastaların rosuvastatin tedavisi ile kapak patolojilerinin ilerlemesi karşılaştırılmıştır. 121 hastanın dahil edildiği çalışmada, 74 haftalık takip sonucunda rosuvastatin tedavisi verilen grup ile plasebo grubu karşılaştırıldığında
ekokardiyografik ölçümlerde statin tedavisinin etkisi saptanmıştır (aort kapak alanında plasebo vs statin -0.10 +/- 0.09 cm2/yıl vs -0.05 +/- 0.12 cm2/yıl p=0,041; aortik jet velositede plasebo vs statin 0.24 +/- 0.30 m/s/yıl vs 0.04 +/-0.38 m/s/yıl (p = 0.007)(28). Ancak daha sonra yapılan çalışmalarda bu bulgular desteklenememiştir.(29, 30) Bu bulgular ışığında, yalnızca aort kapak
17
patolojilerinin ilerlememesine yönelik statin tedavisi önerilmemektedir. Ancak potansiyel farmakoteropatiklerin faydasının aort kapak sklerozu gibi hastalığının erken aşamalarında başlanılması hastalığın ilerlemesini önleyebilir. Ancak bu konuda yapılan büyük çalışmalar henüz mevcut değildir.
Otuz üç, aort kapak sklerozu ve hafif derece aort darlığı olan hastanın dahil edildiği bir çalışmada hastalara 20 mg atorvastatin verildikten sonra, hastalığın ilerlemesinde önemli rol oynayan doku kalsifikasyonunun plazma belirteçlerinde (osteoprotegerin (OPG), osteopontin (OPN), ve “soluble receptor activator of nuclear factor (NF)-kappa B ligand (sRANKL)” anlamlı düzeyde düşüşler saptanmıştır.(31) Ancak moleküler düzeyde sağlanan faydaların klinik
sonlanımlara etkisini değerlendirmek için henüz yeterli veri yoktur.
2.2. Kolesterol Metabolizması ve Hiperkolesterolemi
Kolesterol organizmada eritrositler dışında her hücrede sentezlenen, hücre zarlarının oluşumunda ve stabilizasyonunda, seks hormonlarının, steroidlerin ve D vitmainin sentezinde rol alır. Özellikle merkezi sinir sisteminde ve beynin miyelin içeren yapılarında fazla miktarda bulunmaktadır. İnsan vücudunda ağırlığın %0.32’si kolesterol oluşturmaktadır.
Kolesterol başlıca iki kaynaktan sağlanır. Bunlardan birincisi diyetle alınan kolesterol (eksojen kolesterol), diğeri de öncelikle karaciğerde ve ince bağırsaklarda üretilen kolesteroldür (endojen kolesterol). Karaciğer, adrenal korteks, deri, ince bağırsak, testis ve aort gibi dokularda kolesterol sentezi yapıldığı ispatlanmıştır.(3)
Yiyeceklerle alınan kolesterol miktarı, vücutta sentezlenen miktarın %20’si kadarını oluşturmaktadır. Vücutta sentezlenen kolesterol ile gıdayla alınan kolesterol arasında bir denge vardır. Bu denge organizma tarafından ayarlanır. Eğer gıda ile alınan kolesterol miktarı artarsa vücutta sentezlenen kolesterol miktarı azalır, denge korunur. Hasta kişilerde ise karaciğerin kontrol sistemi bozulmuştur.(33)
18
2.2.1. Lipoprotein Sınıfları
Lipoproteinleri fiziksel ve kimyasal özelliklerine göre elektroforez ve ultrasantrifügasyon gibi yöntemlerle ayırmak mümkündür.(34) Major plazma lipoproteinlerinin yoğunluğuna göre dizilim sıraları şöyledir:
Ş
ilomikronlar, VLDL, LDL-K, IDL, HDL-K ve Lp (a)Şilomikronlar:
Lipoproteinlerin en büyük olan grubudur. Başlıca apolipoproteinleri A-I, A-II ve B–48’ dir. ApoB-48, ince barsak epitel hücreleri tarafınca üretilen tekapolipoproteindir. ApoA-I ve A-II, HDL’de bulunan C ve E apoproteinleriyle değişime uğrar. ApoC-II tarafından aktifleştirilen ekstrasellüler lipoprotein lipaz (LPL) enziminin şilomikron ve VLDL’deki TRG’lerin hidrolizi sonucu serbest yağ asitleri açığa çıkar. Dolaşımdaki
şilomikronlar LPL etkisiyle TRG’den fakir, kolesterolden zengin şilomikron artıklarına
dönüşürler. Serbest yağ asitleri TRG olarak depolanmak, enerji kaynağı olarak oksitlenmek veya yeniden TRG yapımında kullanılmak üzere çeşitli dokular tarafından hepatik lipaz (HL) başlıca fosfolipaz gibi ve ikincil olarak da bir gliserid hidrolaz gibi hareket ederek şilomikron
artıklarının hepatositler tarafından alınmasının son aşamasında da rol oynarlar. Şilomikron artıkları, kısa sürede apoB–48 ve apoE’yi tanıyan karaciğer parankim hücreleri tarafından plazmadan temizlenir.(35) Diyetle yüksek düzeyde yağ alımı şilomikron yapımını arttırır. Absorbsiyon sonrası (12–15 saat açlıkta) şilomikron dolaşımda bulunmaz. Ayrıca yüksek karbonhidrat, düşük yağ alımı yapımını azaltır. Bu gibi durumlarda ince barsak vene VLDL sekrete eder ve TRG transportu bu yolla yapılır. Bu partiküller dolaşımdaki VLDL’nin %10–20 kadarını oluşturur ve şilomikronlar gibi metabolize edilirler.
VLDL;
Yağ asidi hepatositlere geldiğinde karaciğerde VLDL üretimi uyarılır.Karaciğere yağ asidi girişinin artması yüksek yağlı diyet veya çeşitli metabolik bozukluklarda ya da açlık nedeniyle yağ dokusundan yağ asidi salınımını takiben ortaya çıkar. VLDL yapımında kullanılacak TRG ve fosfolipidlerin yapımı kaba ve düz endoplazmik retikulumda olur. VLDL kolesterol de novo sentez ya da lipoprotein yıkımından elde edilmektedir. VLDL’ler karaciğer parankim hücreleriyle sinüzoidleri arasındaki alana salınır, oradan da dolaşıma geçerler. VLDL plazmada HDL’den apoC-I, C-II, C-III ve apoE proteinlerini alır. VLDL TRG’leri LPL ve daha az oranda HL etkisiyle hidrolize edilir. VLDL, TRG’lerin kaybı ve apoC’nin HDL’ye transferi sonucu giderek küçülen partiküllere dönüşür ve kolesterolden zengin IDL’yi oluşturur.
19
LDL;
Total plazma kolesterolünün yaklaşık %70’ini taşırmaktadır.(35) LDL yaklaşık %75 lipid (%35 kolesterol esteri, %10 serbest kolesterol, %10 trigliserid, %20 fosfolipid) ve % 25 proteinden oluşur. Eser miktardaki apoE ve C dışında, çok miktarda apoB–100 içerir. Total plazmadaki apoB–100’ün %90–95’i LDL yapısındadır.(36) Sağlıklı kişilerde LDL kolesterolü total plazma kolesterolünün 2/3 sini oluşturmaktadır. LDL’nin yaklaşık 2/3 sinin hücre içine alımı reseptör aracılı endositoz ile gerçekleşir. LDL subendoteliyal bölgeye geçerek okside olabilir ve köpük hücre oluşumunu uyarabilir. LDL’nin plazmadan temizlenmesi apoB-100’e spesifik LDL reseptörleri aracılığıyladır.HDL;
En küçük lipoprotein partiküllerdir. HDL’nin %50’si lipid (%25 fosfolipid, %15 kolesterol esteri, %5 serbest kolesterol, %5 TRG) ve %50’si proteinden oluşur. Başlıcaapoproteinleri apoA-I (%65), apoA-II (%25)’dir.(34) HDL karaciğer ve barsak hücreleri tarafından sentezlenir. VLDL’de olduğu gibi HDL’de de bir olgunlaşma süreci bulunur. Yeni sentezlenmiş HDL plazmada apoA-I, A-II ve fosfolipid içeren disk halinde bulunur. Yeni sentezlenmiş HDL’ler, diğer lipoproteinlerden veya aşırı kolesterol içeren hücre zarlarından sınırlı olarak serbest kolesterol alırlar. Serbest kolesterol HDL’de lesitin kolesterol açil transferaz enzimi ile kolesterol esterine dönüştürülür ve biriktirilmeye başlanır.(35) HDL reseptör aracılı endositoz ile hepatosit tarafından alınır. Kolesterol esterlerinin hidrolizi ile açığa çıkan serbest kolesterol lipoproteinlerin sentezinde kullanılır, safra asitlerinin yapısına katılır veya safraya sekrete edilerek vücuttan uzaklaştırılır.(35, 36)
Trigliserid;
Epidemiyolojik çalışmalar, yüksek plazma TRG düzeylerinin KAH riskini artırdığını göstermiştir. Artmış TRG düzeyleri, serumda HDL kolesterol düzeyinde azalmaya, kalıntı lipoproteinlerde artışa ve LDL kolesterol düzeylerinde artışa yol açarak ateroskleroz gelişimine katkıda bulunmaktadır. TRG’ler normalde damar duvarında birikemez; ancak TRG düzeyleri yükseldikçe, esas olarak aterojenik olan ve TRG içeriği zengin olan lipoproteinler kanda artar. Bunların yoğunluğu yüksek ve boyutları küçük olduğundan, kolayca damar duvarını geçip aterom plağı gelişiminde rol oynarlar. TRG düzeyleri ile KAH gelişimi arasında doğrusal ilişki gösterilmiştir ve özellikle TRG düzeyi >200 mg/dl olduğunda riskin arttığı saptanmıştır.(37)Lipoprotein (a):
Lipoprotein (a), LDL (apolipoprotein B-100) ve genetik boyut polimorfizmi gösteren, düşük molekül ağırlıklı glikoprotein olan apolipoprotein a’nınbileşiminden oluşmaktadır. Bu bağlanma disulfit bağıyla olmaktadır. Apolipoprotein a’nın 32 formu tanımlanmıştır ve çalışmalar göstermektedir ki apolipoprotein a’nın boyutu ile Lp(a)’nın serum düzeği arasında ters bir ilişki vardır. Çalışmalarda Lp(a) lipoproteinin prematür KAH için bağımsız bir risk faktörü olduğu görülmüştür. Serum Lp(a) lipoprotein seviyesinin; koroner anjiyografi ile görülen lezyonların varlığı, ciddiyeti, lezyon skoru ile beraber miyokard
20
enfarktüsü ve kardiyak ölümün sıklığı ve rekürrensi ile oldukça aşikar korelansı vardır. Gebelik, ilerlemiş malignite ve terminal safha renal hastalıkta Lp(a) lipoproteini seviyeleri artmaktadır. Apolipoprotein a, plazminojen ile belirgin homoloji gösterir, fibrinoliz ile etkileşebilir ve tromboz için predispozisyon gösterebilir. Serum Lp(a) düzeği çevresel faktörlerden etkilenmez, maksimal düzeyine infantlarda ulaşır. Ayrıca Lp(a) lipoprotein LDL klirensini inhibe edebildiği için statin terapisine rağmen LDL-K düzeyi hedef düzeye getirilemeyen hastalarda Lp(a), lipoprotein düzeyinin yüksekliği gözden geçirilmelidir.
2.2.2 Hiperkolesterolemi
Kolesterol hücre membranlarının yapısal komponentidir. Kolesterolün büyük bölümü LDL, endojen trigliseridler ve VLDL ile taşınır. Kolesterol metabolizması bozukluğuna bağlı hiperkolesterolemi tablosu gelişir. Bunun sonucu olarak plazma lipoprotein ve trigliserid düzeyinde yükselme gözlenir. Hiperkolesterolemi, ateroskleroz gelişimine önemli katkıda bulunmakta ve KAH’a zemin hazırlamaktadır.
Anormal kolesterol ve lipoprotein metabolizması ile beraber endoteliyal hasar
aterosklerozun major uyaranıdır ve yeryüzünde obstrüktif koroner arter ve vasküler hastalıkların önde gelen sebebidir. Sigara, hipertansiyon, diyabet ve hiperlipidemi aterosklerotik KV
hastalıkların major risk faktörleridir. Aterosklerotik plaklar büyük oranda kolesterolden meydana geldiği için hiperkolesterolemi önemli bir faktör olarak görülmektedir.
Ortalama total kolesterol seviyesi bir populasyonda tüm KV olay insidansının iyi bir prediktörüdür. Fakat hastalar bireysel olarak değerlendirilirken LDL-K, HDL-K ve trigliserit gibi lipid subfraksiyonları ölçülmelidir. National Cholesterol Education Program (NCEP) önerilerine göre genç yaşta ateroskleroz geliştiren hastalar, normal standart lipid seviyelerinde ateroskleroz geliştiren hastalar ve NCEP kılavuzuna göre lipid seviyeleri kontrol altında tutulmasına rağmen rekürren koroner hadise geçiren hastalarda ileri düzey lipid testleri faydalı olabilir. Lp(a)’nın aterosklerozda rol oynadığı bilinmektedir ve özellikle prematür KAH aile öyküsü olan hastalar gibi seçili grupların taranmasındaki rolü de National Lipid Association (NLA) ve European Atherosclerosis Society (EAS) gibi gruplar tarafından önerilmektedir.
21
Tüm dünyada önde gelen mortalite ve morbidite sebeplerinden olan KV hastalıkların patogenezinde ateroskleroz önemli rol oynar. Ateroskleroz, etkilenen organın kan akımının azalmasına, oksijen ve diğer besin maddelerinden yoksun kalmasına neden olarak dokuda iskemi ya da infarktüse yol açar. Damar duvarında lipid depolanması ve ardından gelişen hücre
proliferasyonu, aterosklerozdaki kan akımı azalmasının esas nedenidir. Plazmada yüksek oranda kolesterol, özellikle de LDL ve trigliserit (TG) bulunması yanı sıra, HDL’nin düşük olması, tütün kullanımı, hipertansiyon, diyabet, erkek cinsiyet, egzersiz eksikliği, obezite ve stres,
aterosklerotik KV hastalık için önemli risk faktörleridir.(33)
Ateroskleroz gelişmiş toplumlarda görülen morbidite ve mortalitenin ana nedeni olarak önemini korumaktadır. Yüksek plazma total kolesterol ve LDL-K seviyeleri ve düşük plazma HDL-K seviyeleri aterotrombotik vasküler hastalıklar açısından önemli fakat değiştirilebilir risk faktörleridir. Özellikle satüre olmak üzere diyette yüksek miktarda kolesterol bulunması plazma kolesterol seviyelerini yükseltmekte; yüksek plazma kolesterol konsantrasyonları da koroner kalp hastalığı (KKH) riskini artırmaktadır. Plazma kolesterol seviyelerinin düşürülmesi ise KKH riskinin azalması ile sonuçlanmaktadır.
Aterosklerotik damar hastalığı tespit edilmesi, pankreatit, ksantom veya ksantalezma görülmesi ya da yüksek plazma lipid seviyelerinin fark edilmesi üzerine başvuran her hastada öykü ve fizik muayeneyi takiben KKH açısından bireysel risk faktörlerinin değerlendirilmesi ve plazma lipidlerinin ölçülmesi gereklidir. Yüksek plazma lipidlerinin (kolesterol ya da
trigliseritler) deri, tendonlar, göz, karaciğer ve dalak gibi çeşitli dokularda makrofajlar içerisinde birikerek depolanmaları fizik muayenede kolayca fark edilebilirler ve bu birikimler, lipid
düşürücü tedavi ile neredeyse tamamen düzelirler.(34, 35)
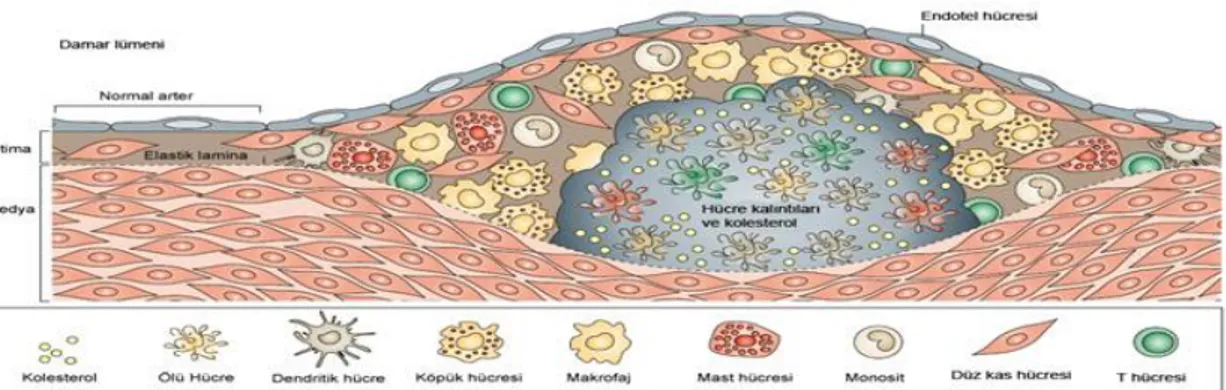
Endotel disfonksiyonu ile başlayan aterosklerotik süreç, yağlı çizgi oluşumunu izleyen aterosklerotik plak oluşumu ile devam eder (Şekil 4). Plak rüptürü ile de miyokard enfarktüsü ve serebrovasküler olaylar gibi aterosklerozun ciddi sonuçlarını doğurur. Ateroskleroz gelişiminde hiperkolesteroleminin önemi çok iyi bilinmektedir. LDL-K damar duvar içinde uğradığı
değişiklikler sonucu proinflamatuar etki gösterir, özellikle oksidasyona uğraması sonucu oluşan okside LDL köpük hücresi oluşumuna ve lezyonların gelişimine önemli katkı sağlamaktadır.(36) LDL kolesterolün düşürülmesi ile koroner olaylarda azalma sağlandığı birçok çalışmada
22
gösterilmiştir.(36, 38) Bunun yanı sıra trigliserid düzeylerinin artması ile KAH riskinin arttığı ve HDL-K düzeyleri ile KV riskin ters orantılı bir ilişki gösterdiği bilinmektedir.
Şekil 4. Aterosklerotik plak gelişimi
Lipid metabolizmasını ikincil olarak etkileyecek obezite, diyabet, hipotiroidizm, gebelik, kolestatik karaciğer hastalığı ve nefrotik sendrom gibi durumlar ve hiperlipidemiye neden olabilecek alkol, östrojenler, progestinler, beta blokerler, oral kontraseptifler, HIV proteaz inhibitörleri ve tiazid diüretikler gibi ajanların kullanımı tüm hastalarda araştırılmalıdır. Ayrıca eksojen androjenler de HDL-K’de düşüşe neden olabilirler.(39)
Amerika Birleşik Devletleri’nde 2001 yılında yayınlanan “Yetişkinlerde Yüksek Kan Kolesterolünün Tespiti, Değerlendirilmesi ve Tedavisi Üzerine Ulusal Kolesterol Eğitim Programı Uzman Paneli’nin Üçüncü Raporu” (NCEP ATP III), 20 yaş ve üzeri kişilerde en azından her 5 yılda bir tam plazma lipid profilinin ölçülmesini önermektedir.(40) Kolesterol ölçümleri öğünlerden etkilenmez, ancak miyokard enfarktüsü, ciddi travma gibi durumlarda akut faz yanıtı ile ilk günden 1 ay sonrasına kadar ölçümlerde yanıltıcı şekilde düşük değerler görülebilir. Yemek sonrasında şilomikronların artışına bağlı olarak TG düzeyleri de artar, bu nedenle TG ölçümleri 10 – 12 saatlik açlık sonrasında yapılmalıdır.
23
Çoğu laboratuarda total kolesterol, HDL ve trigliseritler ölçülmekte, bundan sonra Friedewald formülü ile LDL-K hesaplanmaktadır.
Friedewald formülü: LDL kolesterol = Total Kolesterol – [HDL kolesterol +(TG / 5)].
Plazma TG seviyesinin 400 mg/dl’nin üzerinde olduğu durumlarda LDL-K düzeyi bu formülle doğru şekilde hesaplanamaz. Bu durumda ardışık ultrasantrifüj gibi yöntemlerle ayrı ayrı ölçüm yapmak gerekir. Primer lipid metabolizması bozukluklarının tanısı için plazma Lp(a) seviyesini, apolipoproteinleri ve DNA mutasyonlarını belirleyen özel testler de mevcuttur.(35, 41)
Total ve HDL kolesterol arasındaki fark olarak tanımlanabilen HDL-dışı kolesterol düzeyi de açlık faktörü dikkate alınmaksızın elde edilebilen ve KKH içinTG kadar iyi bir belirteç olarak önerilmektedir.
Ailesinde prematür kalp hastalığı öyküsü ya da hiperlipidemi öyküsü olan çocuklarla, kendisinde diğer KV risk faktörleri bulunan çocuklarda ve ebeveynlerin tıbbi geçmişi
bilinmiyorsa hiperlipidemi açısından tarama yapılması önerilmektedir. Çocuklarda yapılan ölçümlerde açlık faktörü aranmaz.(35)
Türk Kalp Çalışması ve “TEKHARF” (Türk Erişkinlerinde Kalp Hastalığı ve Risk Faktörleri) Çalışması Türk toplumunun dünyada en düşük HDL-K düzeyine sahip toplumlardan biri olduğunu saptamış, ortalama HDL-K düzeyinin Batı Avrupa ülkeleri ve Amerika’ da yaşayanlardan 10-15 mg/dl daha düşük olduğu belirtilmiştir. Türk toplumunda erkeklerin %74'ünde, kadınların %53'ünde HDL-K düzeyi <40 mg/dl olarak belirlenmiştir, kadınlarda ortalama HDL-K düzeyi 42 mg/dl, erkeklerde ise 37 mg/dl olarak saptanmıştır. HDL-K düzeyi Avrupa ülkelerine benzer iken ergenlik sonrası dönemde azalmış fiziksel aktivite, obezite ve sigara içimi gibi faktörlere bağlı olarak ortalama 10-15 mg/dl düşer. TEKHARF çalışmasının 10 yıllık takibinde Türk toplumunda TK/HDL-K oranının KAH (KAH) riskini belirleyen en iyi belirleyici olduğu saptanmıştır. Türk kadınlarında TK/HDL-K oranının >5.5 oluşu, <4 oluşuna göre koroner riski 1.73 kat arttırmaktadır. Bu nedenle etkileyici koruyucu stratejiler
tasarlanmalı, lipid bozukluklarının tedavisi ve KAH riskini azaltmaya yönelik uygulamalar yapılmalıdır. Bir bireyin KAH riskini ve tedaviye olan ihtiyacını belirlemede ilk yapılması gereken serum kolesterol düzeylerinin değerlendirilmesi ve sınıflandırılmasıdır (Tablo 3).
24
Ulusal Kolesterol Eğitim Programı Erişkin Tedavi Paneli (NCEP ATP) III ve Türk Kardiyoloji Derneği Koroner Kalp Hastalığı Korunma Kılavuzu (TKD-KKHK) KV risk durumuna bakılmaksızın her 5 yılda bir 20 yaş ve üzerindeki tüm hastalar için açlık lipid profiline (TK, HDL-K, LDL-K ve TG) bakılmasını önermektedir.(32) LDL-K düzeyi ile KAH riski arasındaki ilişki devamlılık gösterdiğinden NCEP ATP III tarafından tedavinin ana hedefi LDL-K gösterilmektedir. ATP III’e göre herhangi bir hastada lipid bozukluğu tespit edilirse anormal lipid bozukluğunun ikincil nedenlerinin araştırılması gerekmektedir (Tablo 4).(42)
Tablo 3. NCEP ATP III kılavuzuna göre serum lipid düzeylerinin sınıflandırılması.(43) Serum konsantrasyonu Sınflandırma
LDL-
Düşük dansiteli lipoprotein
<100 Normal
100-129 Normale yakın/hafif yüksek
130-159 Sınırda yüksek 160-189 Yüksek ≥190 Çok yüksek Total kolesterol <200 Normal 200-239 Sınırda yüksek ≥240 Yüksek HDL-
Yüksek dansiteli lipoprotein
<40 Düşük ≥60 Yüksek Trigliserid <150 Normal 150-199 Sınırda yüksek 200-499 Yüksek ≥500 Çok yüksek
25 Tablo 4. Sekonder dislipidemi nedenleri
Hipertrigliseridemi Hiperkolesterolemi
Aşırı alkol ve basit şeker tüketimi Aşırı doymuş yağ veya kolesterol diyeti
Kontraseptifler, östrojenler, gebelik Hipotiroidizm
Tip 2 diyabet Obstrüktif karaciğer hastalığı
Kronik böbrek yetmeziği Nefrotik sendrom
Obezite Multipl myelom veya disglobulinemi
Cushing hastalığı, kortikosteroid tedavisi Progestasyonel ajanlar ve anabolik steroidler
2.2.3. Risk Değerlendirmesi ve Risk Kategorileri
NCEP ATP III’ e göre LDL-K’nin dışında KAH için major risk faktörleri şunlardır:(43) 1. Yaş (erkeklerde 45 yaş ve üzeri, kadınlarda 55 yaş ve üzeri veya erken menapoz) 2. Aile öyküsü: Birinci derece erkek akrabalarda 55, birinci derece kadın akrabalarda
65 yaşından önce miyokard infarktüsü veya ani ölüm bulunması 3. Sigara kullanımı
4. Hipertansiyon (kan basıncının > 140/90 mmHg olması veya antihipertansif tedavi alıyor olmak)
5. Hiperkolesterolemi ( Total kolesterol >200 mg/dL, LDL-K >130 mg/dL) 6. Düşük HDL kolesterol düzeyi ( <40 mg/dL)
7. HDL >60 mg/dL olduğunda 1 risk faktörü azaltılır.
NCEP ATP III’te diyabetes mellitusun bir risk faktörü olmayıp KAH ile eşdeğer olduğu belirtilmiştir.(32) NCEP ATP III’e göre bir adet risk faktörüne sahip hastalar için uygun tedaviyi belirlemede daha fazla risk değerlendirilmesine gerek yoktur. Bu hastaların 10 yıllık KAH riski %10’un altındadır. ATP III iki veya daha fazla risk faktörüne sahip hastalarda Framingham skorlama sistemini kullanarak 10 yıllık KAH riskinin hesaplanmasını önermektedir.(43)
26
Framingham risk skorlaması yaş, total kolesterol, sistolik kan basıncı, HDL-K ve sigara içimi durumlarına dayanılarak yapılır.
2.2.4. Hiperlipidemi İçin Tedavi Önerileri
Düşük risk grubu:
10 yıllık KKH riski % 10’ nun altında olan, <1 risk faktörüne sahip gruptur. ESC Dislipidemi Kılavuz (2016) önerisine göre, bu risk grubunda LDL-K hedefi <190 mg/dl’ dir. ≥190 mg/dl olduğunda yaşam tarzı değişikliği ve yaşam tarzı değişikliği sonucunda LDL-K düzeyi kontrolü sağlanamaz ise ilaç tedavisi önerilmektedir. (43)Orta risk grubu:
≥1-5 risk faktörüne sahiptir ve ESC Dislipidemi Kılavuzna (2016) göre, LDL-K hedefi <100 mg/dl’ dir. ≥100 mg/dl olduğunda yaşam tarzı değişikliği ve yaşam tarzı değişikliği sonucunda LDL-K düzeyi kontrolü sağlanamaz ise ilaç tedavisi önerilmektedir. (43)Yüksek risk grubu:
≥5-<10 risk faktörüne sahiptir ve ESC Dislipidemi Kılavuzna (2016) göre, LDL-K hedefi <70 mg/dl’ dir. ≥70 mg/dl olduğunda yaşam tarzı değişikliği ve klinik takip önerilir. Yaşam tarzı değişikliğine rağmen ≥70 mg/dl LDL-K olan hastalarda ilaç tedavisi uygulanması hekimin kararına bağlıdır.(43) ≥100mg/dl LDL-K düzeyine sahip olgulara yaşam tarzı değişikliği ile eş zamanlı ilaç tedavisi başlanması ESC Dislipidemi Kılavuzuna (2016) göre önerilmektedir.(43)Yüksek risk grubu:
≥10 risk faktörüne sahiptir ve ESC Dislipidemi Kılavuzna (2016) göre, LDL-K hedefi <70 mg/dl’ dir. <70 mg/dl olduğunda da yaşam tarzı değişikliği ve ilaç tedavisi uygulanması hekimin kararına bağlıdır.(43) ≥70 mg/dl LDL-K düzeyine sahip olgulara yaşam tarzı değişikliği ile eş zamanlı ilaç tedavisi başlanması ESC Dislipidemi Kılavuzuna (2016) göre önerilmektedir.(43)27
Tablo 5. Hiperkolesterolemi için ESC Dislipidemi Kılavuzu (2016) tedavi önerileri.(43
Toplam KV Risk LDL kolesterol düzeyi <70mg/dl 70-99mg/dl 100-154mg/dl 155-189mg/dl ≥190mg/dl Düşük Risk (<1) Tedavi Önerilmez Tedavi Önerilmez Tedavi Önerilmez Tedavi Önerilmez YTD veya ilaç
Tedavi Önerisi IC IC IC IC IIa/A
Orta Risk (≥1-<5) Tedavi Önerilmez Tedavi Önerilmez
YTD veya ilaç YTD veya ilaç YTD veya ilaç
Tedavi Önerisi IC IC IIa/A IIa/A IIa/A
Yüksek Risk (≥5-<10)
Tedavi Önerilmez
YTD veya ilaç YTD ve Eşzamanlı İlaç YTD ve Eşzamanlı İlaç YTD ve Eşzamanlı İlaç
Tedavi Önerisi IIa/A IIa/A IIa/A I/A I/A
Çok Yüksek Risk (≥10)
YTD veya ilaç YTD ve Eşzamanlı İlaç YTD ve Eşzamanlı İlaç YTD ve Eşzamanlı İlaç YTD ve Eşzamanlı İlaç
28
2.3. Lipoprotein (a)
Kare Berg ve arkadaşları tarafından LDL’nin farklı bir çeşidi olarak tanımlanan ve 1987’de yapısı belirlenen Lipoprotein(a) [Lp(a)] son zamanlarda, özellikle KV sistemdeki etkileri de ortaya çıktıktan sonra, yoğun araştırmaların hedefi haline gelmiştir.(44) Ateroskleroz için güçlü, bağımsız ve genetik bir risk faktörü olarak kabul edilen Lp(a) vücutta iki önemli fonksiyon ile ilişkilendirilmiştir:
1. Lipid transport sistemi,
2. Pıhtılaşma sistemi.
Bu yüzden, Lp(a)’nın ateroskleroz ve tromboz alanları arasında potansiyel bir köprü kurduğu ve lipid hastalıkları ile KAH arasındaki anahtar bağlantıyı oluşturduğu düşünülmüş(45) ve aterosklerotik ve trombotik hastalıklarla ilişkisi geniş olarak ele alınmaya başlanmıştır.(46, 47)
Lp(a), plazma lipoprotein ailesindeki heterojenitenin en iyi örneklerinden biridir. Agaroz jelde VLDL gibi pre-beta bandında yer alır, hidrate edilmiş dansitesinin 1.063 gr/ml’den yüksek (1.050-1.120 gr/ml) olması dolayısıyla HDL gibi yüksek yoğunluklu lipoproteinler arasında sayılır. Büyüklük ve lipid içeriği açısından LDL’ye benzemekle beraber, LDL’den daha
büyüktür (çapı 230 Ao), daha fazla protein molekülüne sahiptir ve daha yüksek oranda glikozile olmuştur. Lp(a) Apo-B100’e bir disülfid bağıyla bağlanan ve apo-(a) olarak isimlendirilen ayrı bir ek antijene sahip olması nedeniyle diğer lipoproteinlerden ayrılır. Yine plazma
konsantrasyonları <0.1 ile >180 nmol/lt gibi geniş bir aralıkta değiştiğinden, diğer lipid risk faktörlerinden plazma konsantrasyonu açısından da ayrılmaktadır.
Lp(a)’nın toplam kütlesinin % 40’ını serbest veya esterleşmemiş kolesterol oluştururken, % 17-24’ünü fosfolipidler, % 17-29’unu proteinler, ancak % 9’dan daha az bir kısmını
trigliseridler oluşturur. 300- 800 kD kadar olan apo-(a) kütlesinin % 23’ünü, Lp(a)’nın elektronegatif potansiyelinden sorumlu olan O- ve N- glikozidler kaplar.
Lp(a), merkezde LDL, çevrede oldukça polimorfik karakterli, glikoprotein yapıda ve yapısında hiç amfipatik heliks taşımayan apolipoprotein-(a) içermektedir. Aynen LDL’de olduğu
29
gibi, her bir Lp(a) partikülü tek bir molekül apolipoprotein B-100 (apo B-100) içermektedir. Hem apo-B hem de lipid-merkez proaterojeniktir (Şekil 5).
Şekil 5: LDL ve Lp-(a)' nın bileşenleri.
Apo-(a) glikoproteininin, plazminojenle çok çarpıcı bir aminoasit sıralanma homolojisine sahip olduğu ve Lp(a)’nın plazminojen gen süperailesinin bir üyesi olduğu(48) bilinmektedir. Plazminojen ve apo-(a) genleri, zincir içi disülfid bağlarla stabilize edilen kıvrımlı yapıları kodlayan dizelere sahiptirler ve bu dizeler ‘kringle (K) domain’ olarak adlandırılır.
Plazminojen geni 5 farklı K domainini (K1’den K5’e kadar) kodlayan sıralamaya sahipken, bunlardan ikisi (K4 ve K5) apo-(a) geninde de bulunmaktadır. Apo-(a) geni 10 farklı plazminojen benzeri K4 domainine sahiptir ve bunlar K4 tip 1-10 olarak adlandırılır. Her bir kringle ortalama 80-85 aminoasitten oluşur ve ortalama 10 kD ağırlığındadır. K4 tip 1 ve 3-10 birer kopya halinde bulunurken, apo-(a) alt biriminin, plazminojenin kringle 4 tip 2 domainine homolog bir domainden 40’tan fazla kopyaya kadar sahip olduğu bilinmekte ve bu nedenle hem moleküler ağırlığı hem de molekül büyüklüğü ciddi değişkenlikler göstermektedir.
Lp(a)’nın plazminojene olan bu yapısal benzerliğinden dolayı, fibrine ve endotelyal hücre yüzeyine bağlanan plazminojenle yarıştığı ve fibrin yıkımını engellediği öne sürülmektedir. Lp-(a), vasküler yüzeylere bağlanan plazminojen aktivatörleri ile de yarışarak plazminojen
aktivasyonunu engellediği gibi, PAI-1 gibi plazminojen aktivasyonunun geri dönüşümsüz
30
inhibitörleri ile yarışarak plazminojen aktivasyon süresinin daha da uzamasına yol açabilir. Ancak yüksek konsantrasyonlarda fibrinolitik aktiviteyi engelleyici etkisi ağır basmaktadır.(49)
Lp(a)’nın aterosklerozdaki rolü değişik mekanizmalarla açıklanmaktadır. Lp(a)’nın aterojenik ve trombojenik özelliklerinin altında yatan olası mekanizmalar şu şekilde sıralanabilir.(50)
1- Plazminojenin yarışmalı inhibisyonu sonucu fibrinolizin engellenmesi: Fibrin ve hücre yüzeyine bağlanmada plazminojenle yarışarak plazminojen aktivasyonunu azaltır (Ancak fibrin ve fibrinojene bağlanma özelliği apo(a) polimorfizmine bağlı olarak önemli ölçüde
değişmektedir.).
2- Transforming growth factor-beta (TGF-β) ’yı inhibe eder ve düz kas hücre büyümesi ve gelişimini arttırır.
3- Köpük hücreleri içine girer.
4- Plazminojen aktivatörünün bağlanma noktalarına bağlanır ve endotel hücrelerinden PAI-1 salınımını arttırır.
5- Fibrin, monosit, endotel hücreleri ve çeşitli doku faktörlerine bağlanarak bunları aktive eder.
6- LDL oksidasyonunu arttırır.
7- Endotelyal ICAM–1 (intersellüler adhezyon molekülü–1) ekspresyonunu arttırır.
8- TFPI( Doku faktörü yolu inhibitörü) inaktivasyonuna yol açar.
Apo-(a), kan damarlarına kolayca bağlanmasını sağlayan yapışkan bir yapıya sahiptir. Apo-(a)’ nın yapışkanlığı LDL, VLDL ve kalsiyum gibi diğer kan akımı infiltratları için ideal bir kapan işlevi görür. Dolaşımdaki bu maddeler, debrisin üzerine tabakalar halinde yığılarak
ateromatöz kitlenin daha da büyümesine yol açar. Plak biriktikçe, daralma alanına daha fazla Lp(a) oturur.
31
Apo-(a)’nın kringle IV tip 5-8 domaininin kendine has bir hücre yüzeyine bağlanıcı özelliği olup, yapısında doğal olarak bu domaini taşıyan apo-(a) fragmanlarının insanlarda aterojenik olduğu düşünülmektedir.(51)
Lp(a) partikülünün KAH’da ilk evrelerden biri olan lipid oksidasyonuna ileri derecede yatkın olduğu ve makrofajlarca fagosite edilerek aterosklerotik plağın gelişimini hızlandırdığı bilinmektedir.(52) Aynı zamanda Lp-(a)’nın aortanın aterosklerotik lezyonlarında biriktiği ve köpük hücresi oluşumunu kolaylaştırdığı gösterilmiştir.(53)
Her ne kadar aterojenik olsa da, Lp-(a)’ya damarsal lezyonların ve doku hasarının
tamirinde, yara iyileşmesinin sağlanması ve hızlandırılmasında etkili, evrimsel bir avantaj olarak bakılabilir. C. Pauling ve M. Rath’e Nobel ödülü kazandıran klasik “birleşik teori”ye göre, insanlardaki tıkayıcı KV kronik askorbat (vitamin C) eksikliğinden kaynaklanan dejeneratif bir sonuçtur ve Lp(a)’nın ekstrasellüler alanda fazla miktarda birikimi aslında güçlü biyolojik savunma mekanizmalarından biridir. Lp(a)’nın büyüme faktörü benzeri özellikleri, damarsal hasarın tamirine ve lipoproteince taşınan çok miktardaki kolesterolün de yardımıyla hücre rejenerasyonuna neden olur. Herkes tarafından kabul görmese de, Lp(a)’nın bir akut faz reaktanı olarak davrandığı düşünülmektedir. Apo-(a) gen dizisi, genin transkripsiyonunu hızlandırmakla görevli bir çok interlökin-6 (IL-6 )-cevaplı elementler içerir. IL-6, apo-(a) mRNA sentezinde ciddi düzeyde, doza bağlı artışa yol açtığından in vivo oluşturulan akut faz reaksiyonlarına plazma Lp(a) düzeyindeki ciddi artışlarla karşılık verilir. İşte bu yüzden, Lp(a) düzeylerinin akut miyokard enfarktüsü sırasında, gebelikte, son dönem böbrek yetersizliğinde ve onkolojik
hastalarda yükselebileceği de akılda tutulmalıdır.
Lp(a)’nın vasküler hasar olan alanlarda biriktiği saptanmış olup(54, 55, 56) Lp(a)’nın ateroskleroza katkısının apo-(a)’nın plak içeriğini oluşturan maddelerle girdiği etkileşime bağlı olduğu düşünülmektedir.
Yapılan çok sayıda çalışmada normal kontrol gruplarında ortalama Lp(a) düzeylerinin 5-20 mg/dl aralığında olduğu gösterilmiştir. Lp(a) plazma düzeylerinin, büyük ölçüde apo-(a) geni ile belirlendiği ve kalıtsal bir geçiş olduğu düşünülmektedir.
32
Lp(a) konsantrasyonunun neredeyse % 90’ı genetik regülasyon altındadır.(57) Lp(a) seviyelerindeki değişkenliğin büyük kısmından (% 40) LPA isimli apo-(a) geninin internal sekansındaki kantitatif polimorfizmler sorumlu iken, promoter sekansındaki kalitatif
polimorfizmler sadece küçük bir rol oynar (% 10-14). Bu genetik düzenlemeye rağmen, bazı metabolik anormallikler plazma Lp(a) düzeylerini etkiler. Lp(a) seviyelerini düzenleyici
mekanizmalar tam açıklığa kavuşmamışsa da, akut faz cevabı, hormonal homeostasis, kontrolsüz diyabet, karaciğer ve böbrek yetersizliği ve LDL reseptör genindeki defektlerin halen karanlık noktaları bulunan bu lipoprotein metabolizmasını etkilediği bilinmektedir. Hipotiroidi,
akromegali, troglitazon kullanımı ve inflamasyon Lp(a) düzeylerini arttırırken, hipertiroidi, karaciğer hastalığı ve aşırı alkol alımı Lp(a) düzeylerini azaltmaktadır. Yine aynı şekilde,
özellikle proteinürik olan diyabetik nefropati, nefrotik sendrom, böbrek yetmezliği, böbrek nakli ve diyaliz hastalarının, özellikle de sürekli ayaktan periton diyalizi tedavisi gören hastaların(58) Lp(a) seviyelerinin kontrollerden daha yüksek olduğu bilinmektedir.(59, 60, 61, 62) Renal
hastalıklarda hem diyabetik hem de diyabetik olmayanlarda Lp(a) düzeyleri proteinüri ile doğru olarak artmaktadır.(63)
İzoform büyüklüğü genetik olarak belirlenen, yani apo-(a) gen lokusundaki boyut polimorfizminin (özellikle de promoter alandaki pentanüklid tekrarı ve kodlanma bölgesindeki kringle IV tekrarındaki polimorfizmler belirleyicidir!), heterojenitesinden sorumlu olduğu Lp(a)’nın serum seviyeleri, düşük veya yüksek moleküler ağırlıklı izoformlarının oranından da etkilenmektedir. Yüksek moleküler ağırlıklı izoformlu sağlıklı bireylerde Lp(a) seviyeleri daha düşükken, düşük moleküler ağırlıklı izoformlu sağlıklı bireylerde Lp(a) seviyeleri daha
yüksektir. Hepatositler tarafından (a) sekresyonunun, kringle-IV tekrarının belirlediği apo-(a) izoform moleküler ağırlığından etkilendiği zaten bilinen bir gerçektir.(64) Yüksek moleküler ağırlıklı apo-(a) izoform prekürsörlerinin, endoplazmik retikulumda glikozilasyonu ve katlanma işlemleri daha uzun süre aldığından, matürasyon işlemleri sırasında apo-(a) izoformlarının kesilmesi de zaman almakta ve bu sekresyon hızını yavaşlatmaktadır. Tersine küçük apo-(a) izoform proteinleri hücre içi matürasyon safhalarını daha hızlı geçmekte ve bu yüzden sekresyonları da daha hızlı olmaktadır. İşte bu mekanizmaların apo-(a) izoform moleküler ağırlığı ve serum Lp(a) konsantrasyonları arasındaki ters ilişkinin altında yatan neden olduğu düşünülmektedir.(65, 66)
33
Sonuçlar, apo-(a) molekülünde tek bir kopya kringle-V bulunduğundan, okside fosfolipid bağlama potansiyelinin apo-(a) boyutundan bağımsız olacağını öngörmekle beraber; apo-(a) boyutunun, şekil değişikliğine neden olma yoluyla, okside fosfolipid bağlanma bölgesini etkileyebileceği ihtimali de göz önünde tutulmalıdır.
Plazmadaki Lp(a) konsantrasyonu yaşla birlikte hafifçe artar ve ırklara göre değişir. Örneğin siyah ırkta Lp(a) konsantrasyonu, beyaz ırka göre daha yüksektir.(67) Lp(a) düzeyi diğer lipoproteinlerden farklı olarak sigara kullanımı, diyet, kilo, yaş ve cinsiyetten daha az etkilenir. Menopoz sonrası değerler yüksek olmasına karşın, yaş ve cinsiyetle kesin bir ilişki
gösterilememiştir. WHO-MONİCA projesinde hem kadın hem de erkeklerde yaşla zayıf bir korelasyon bildirilmiştir.(68) Lp(a) seviyeleri ile LDL-K , HDL-K ve total kolesterol seviyeleri arasında anlamlı bir ilişki saptanamamıştır. Ancak KV riski değerlendirmede Lp-(a) ve LDL-K karşılaştırırken dikkat edilmesi gereken bir nokta da, LDL konsantrasyonları ölçümlerinde sadece kolesterol seviyeleri belirtilirken, Lp(a) seviyesi ölçümlerinde tüm partikülün konsantrasyonunun yani hem lipid hem de protein içeriğinin hesaba katılmakta olduğudur. Ayrıca Lp(a)’nın miyokard enfarktüsü ve inme sonrasında da kan düzeylerinin arttığı bildirilmiştir.(69, 70)
34
2.4. Elektron Beam Tomografi
Mönckeberg’in kalsifik medial sklerozu koroner arterlerde izlenmez. Koroner arter kalsifikasyonu (KAK) ile ilişkili tek hastalık aterosklerozdur.(71, 72, 73) Dolayısıyla KAK aterosklerozun patognomonik bulgusudur.(74) Kalsifikasyon aterosklerotik plak gelişiminin herhangi bir evresinde izlenebilir. Küçük kalsifiye fokuslar 10-20. dekadda, hemen yağlı çizgilenmelerin oluşumunu takiben gelişmektedir.(75) Histolojik olarak hem stabil, hem de unstabil plakta bulunabildiği gösterilmiştir.(76) Koroner arter kalsifikasyonu kemiğin majör inorganik komponenti olan hidroksiapatit formunda kalsiyum fosfattır. Koroner arterlerde kalsifikasyon dejeneratif bir olay değildir, damar duvarındaki enflamasyon nedeniyle lipit birikimi ve osteoblast benzeri hücrelerin migrasyonu sonucu sellüler kontrol altında gerçekleşen aktif bir olaydır.(77)
İntravasküler Ultrason (IVUS) ve histopatolojik çalışmalar KAK düzeyi ile toplam aterosklerotik plak yükü arasında güçlü bir korelasyon olduğunu göstermektedir.(76, 78, 79) Rumberger ve ark.(78) yaptığı çalışmada Elektron Beam Tomografi (EBT) ile kantifiye edilen kalsiyumun histopatolojik total plak alanıyla lineer korelasyon gösterdiği ve korelasyon kat sayısının yüksek olduğu belirtilmiştir (r=0,9). Toplam kalsiyum alanı,toplam aterosklerotik plak alanının %20’sini oluşturmaktadır.(76) Dolayısıyla, KAK düzeyinin belirlenmesi sadece kalsifik plak yükünün değil, mevcut aterosklerotik hastalığın yaygınlığının ve nonkalsifiye plak yükünün de bir ölçüsüdür. Çalışmalar EBT ile kantifiye edilen koroner kalsifikasyon düzeyinin lüminal daralma düzeyi ile non-lineer korelasyon gösterdiğini işaret etmektedir.(76, 80)
KAK, Elektron Beam Tomografi (EBT) ve Çok kesitli BT ile belirlene bilmektedir. Çekim yapılacak hastada koroner anjiyogram görüntülerinin alınması gerekmemekteyse EBT protokolünde çekim yapılması yeterli olmaktadır. EBT yüksek temporal ve kontrast rezolüsyonu olan, mekanik hareket gerektiren parça bulundurmayan ve bu nedenle 50-100msn/kesit gibi çok hızlı görüntüleme hızına ulaşabilen, ayrıca imajları elektrokardiyografi (EKG) tetiklemesi eşliğinde alabilen kesitsel bir görüntüleme tekniğidir.
35
EBT, Boyd ve arkadaşları tarafından 1979'da özellikle kalp gibi hareketli organların değerlendirilmesi amacıyla geliştirilmiştir. "Ultrafast" BT, "Cine" BT veya 5. jenerasyon BT olarak da adlandırılmaktadır. EBT'nin diğer BT cihazlarından en önemli farklılığı, dizaynında mekanik olarak hareket eden hiç bir parçanın bulunmayışıdır.(81)
Koroner arter kalsifikasyon alanı lüminal daralma düzeyiyle ilişkili olmakla birlikte, stenoz ciddiyetinin direkt kantifikasyonu amacıyla kullanılamaz. Hem tıkayıcı olan (>%50 darlığa yol açan), hem de tıkayıcı olmayan plaklarda kalsifikasyon olabileceği için KAK düzeyi tıkayıcı koroner arter hastalığı varlığını belirleme anlamında spesifisitesi düşük (yaklaşık %40) bir yöntemdir.(82) Bununla birlikte, koroner arterlerde kalsiyum yokluğu (sıfır skor) ≥%50 darlığı dışlama anlamında %98-100 gibi oldukça yüksek negatif öngörü değerine sahiptir.(76, 82)
2.4.1. Teknik Özellikler.
Koroner arterlerde kalsifikasyonu görüntülemeye yönelik olarak Elektron Beam Tomografi (EBT) veya Çok Kesitli Bilgisayarlı Tomografi (ÇKBT) kullanılabilir.
EBT ile koroner arter kalsifikasyonu tespitinde aksiyel veya konvansiyonel mod kullanılır. Bu teknik EBT’de kullanılan tekniğin analoğudur. Devamlı masa hareketi olmadan, şutla dur yöntemi ile çekim yapılır. Kalbi en hareketsiz fazında, erken diyastolde görüntelemek esastır. Bu amaçla prospektif EKG gating yöntemi kullanılır. Elektrokardiyogra ’de R dalgasına göre erken diyastolün zamanı belirlenir ve sadece bu dönemde şutlama yapılır. Ayrıca prospektif gating kullanılması radyasyon maruziyetini de azaltmaktır. İntravenöz (İV) kontrast madde enjeksiyonu yapılmadan, trakeal bifurkasyon düzeyinden kalp tabanına kadar olan inceleme alanına dahil edilir.
Koroner kalsiyumu kantifiye etmek için Agatston skorlama sistemi kullanılmaktadır.(83) Agatston skorlamasında ≥3 pikselde (en az 1 mm2) 130 HU’dan yüksek dansite değerine sahip lezyon kalsifikasyon olarak tanımlanır. Kalsiyum alanı BT dansitesine göre belirlenen bir kat sayıyla çarpılır. Bu hesaplama her 3 mm’de bir yapılır. Agatston yöntemi 3 mm kesit kalınlığına göre tasarlanmış olduğu için, en doğru kullanımı bu kesit kalınlığında olmaktadır.(75) KAK skoru tek bir koroner arter için belirlenebileceği gibi, bunların toplamı ile tüm koroner arteriyal ağaca ait skor hesaplanabilir. Bu yöntemde, küçük kalsifik lezyonlarda parsiyel volüm etkisi nedeniyle
36
hatalı ölçüm yapılabilmektedir. Çekim tekniğine bağlı olarak sonuçları değişkenlik gösteren, kesit kalınlığındaki minör değişikliklerden etkilenen bir yöntemdir.(75) Agatston yöntemi ile kalsifikasyonun hesaplanması son yıllarda aort kapağı kalsifikasyonlarının belirlenmesinde de çalışmalarda kullanılmaktadır.(84) Bizim çalışmamızda da aort kapak kalsifikasyonu
belirlenmesinde Agatston yöntemi kullanılmıştır.
2.4.2. Asemptomatik hastaların taranması
Janowitz ve arkadaşları asemptomatik kişilerde yaş ve cinsiyet gruplarına göre KAK skoru normogram değerleri belirlediler. Bireyin KAK skoru değeri yaşına ve cinsiyetine göre belirlenen ortalama kalsiyum skorları ile karşılaştırılarak belirli persentil aralıklarında
değerlendirilir (Tablo 6-7). (85) NCEP kılavuzları 75 persentil ve üzeri hastalarda daha agresif risk redüksiyonu öneriyor.
YAŞ ARALIKLARI (KADIN)
40-45 46-50 51-55 56-60 61-65 66-70 >70 Pe rs an ti l 10 0 0 0 0 0 0 0 25 0,1 0,1 0,1 0,2 0,5 1 4 50 0,1 0,1 1 1 3 25 51 75 1 2 6 22 68 148 231 90 3 121 61 127 208 327 698
Tablo 6. Kadınlar için yaşa göre Koroner Arter Kalsiyum skoru persentil tablosu. (85)
YAŞ ARALIKLARI (ERKEK)
40-45 46-50 51-55 56-60 61-65 66-70 >70 Pe rs an ti l 10 0 0 0 1 1 3 3 25 0,5 1 2 5 12 30 65 50 2 3 15 54 117 166 350 75 11 36 110 229 386 538 844 90 69 151 346 588 933 1151 1650
37
Akut MI nadiren tıkayıcı (≥%50 stenoz yapan) plak zemininde gelişir. Sebep sıklıkla MI’dan önce tıkayıcı olmayan, hafif-orta düzeyde daralma yapan, hassas plakta ince fibröz başlığın yırtılması ve plak rüptürü sonucu gelişen ani oklüzyondur. (86) Total plak yükü ne kadar fazla olursa hem stabil hem de unstabil plak bulunma olasılığı o oranda artacaktır. (76)
Dolayısıyla, koroner olay riskinde belirleyici olan stenoz düzeyi değil, total aterosklerotik plak yükü ve hastalığın yaygınlığıdır. Total plak yükü koroner olayı ön görme gücü ve prognostik değeri en yüksek olan faktördür. (86)
KAHı araştırmaya yönelik noninvazif testler (egzersiz testi, stres ekokardiyogra ve nükleer testler) anlamlı darlık ve miyokardiyal iskemi mevcut, ileri aterosklerotik hastalığı belirler. Aterosklerozu, henüz anlamlı darlığın mevcut olmadığı, preklinik aşamada tespit edemez. (87) Ayrıca asemptomatik hastalarda tıkayıcı plak prevalansı düşüktür, dolayısıyla iskemi araştırmaya yönelik testler için, test öncesi hastalık olasılığı (pretest probability) düşük olacaktır. Bu durum asemptomatik grupta stres testlerin yalancı pozitiflik oranını yükseltir ve birçok hastanın gereksiz yere invazif anjiyografiye yönlendirilmesine yol açar.(88) Ek olarak, bu testler akut MI açısından risk taşıyan hassas ancak tıkayıcı olmayan plaklara sahip hastayı gözden kaçırır. Koroner kalsiyum skorlama ise subklinik aterosklerozun direkt göstergesidir. Koroner arterlerde hem kalsifik hem de non-kalsifik yani total plak yükünün ölçütüdür. Asemptomatik bireylerde koroner olay riskini belirlemede önemli bir yer almaktadır.(74)
Literatürde koroner kalsiyum skorlamanın prognostik değeri ile ilgili birçok çalışma mevcut olup, varılan ortak sonuç KAK skorlamanın koroner olay riskini belirlemede geleneksel risk faktörlerinden bağımsız ve onların etkinliğini artıran bir prediktif değer taşıdığını
göstermektedir. (75)
Raggi ve ark.(89) 2003 yılında 632 asemptomatik bireyi 32 ay süreyle takip ettikleri çalışmalarında, kardiyak ölüm gelişen hastalarda KAK skorunun yaşa ve cinsiyete göre 75 persentil üzerinde olma oranı %70 bulunurken, koroner olay geçirmeyenlerde bu oran %25 bulunmuştur (p<0,001).
38
Shaw ve ark.(90) 2003 yılında yaptıkları, 10377 asemptomatik hastanın 5 yıl takip edildiği çalışmada, hem kadın hem de erkek hastalarda koroner olay riskinin bazal KAK skoru ile doğru orantılı olarak arttığı ve KAK’ın ani kardiyak ölümün bağımsız bir prediktörü olduğu sonucuna varmışlardır.
Bu çalışmalar ışığında son yıllarda yayınlanmış uluslararası 14 kılavuzun 10’unda KAK skorlamanın geleneksel risk analiz yöntemlerinin etkinliğini arttırdığı ve risk analizini
iyileştirdiği söylenmektedir.(88) American Heart Association ve Screening for Heart Attack Prevention and Education (SHAPE)’ın desteklediği yaklaşım, orta risk grubunda bulunan bireylerde (10 yıllık olay riski %10-20 arası) KAK skorlama yapılmasıdır.(75, 91, 92) Agatston skoru >100 olan hastalarda yıllık koroner olay riski %2’ye çıkmaktadır ki bu durum hastayı yüksek riskli gruba sokar. Dolayısıyla >100 KAK skoru varlığında statin, aspirin, ACE
inhibitörü ve yaşam tarzı değişiklikleri yapılmalıdır. Yine aynı raporda “negatif skor”un unstabil-vulnerable plak da dahil aterosklerotik plak varlığı olasılığını düşürdüğü ve yıllık koroner olay geçirme olasılığını %0,1’e indirdiği, dolayısıyla bu hastaların düşük riskli gruba alınması gerektiği söylenmektedir.(75, 91)
2.4.3. Semptomatik hastaların değerlendirilmesi.
Koroner kalsiyum skorlama KAH yönünden yüksek sensitivite ve negatif öngörü değerine sahiptir. Ancak obstrüktif hastalığı tespit etme anlamında spesifitesi düşüktür.(82) Semptomatik hastada, anjiyogramda anlamlı düzeyde darlık varlığını dışlama anlamında başarılıdır. Budoff ve ark.(82) negatif (sıfır) skor ile anjiyografik olarak anlamlı darlık yokluğu arasında yüksek korelasyon tespit etmişler ve negatif öngörü değerini %98 olarak bulmuşlardır. Dolayısıyla KAK skorlama semptomatik hastada invazif anjiyografiden önce filtre olarak kullanılabilir. Sıfır skor, invazif anjiyogra ye yönlendirme gerekliliğini ortadan kaldırır. Ayrıca, daha önce bahsedildiği üzere stenoz düzeyi değil, hastalığın yaygınlığı daha önemli prognostik değer taşımaktadır. Dolayısıyla, KAK skorlama semptomatik hastada da ileride koroner olay meydana gelme olasılığını belirlemede faydalıdır. Bu hasta grubunda da bağımsız prognostik değere sahiptir.(74)