TC.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
Prof. Dr. Fehmi AKÇİÇEK
PALBOSİKLİB VE RİBOSİKLİBİN HORMON RESEPTÖRÜ POZİTİF MEME KANSERİ HÜCRE HATLARINDA MOLEKÜLER ETKİNLİK VE
HÜCRE İÇİ YOLAKLAR AÇISINDAN KARŞILAŞTIRILMASI
UZMANLIK TEZİ Dr. Ahmet Anıl ÖZLÜK
TEZ DANIŞMANI
Doç. Dr. Ş. Burçak KARACA
TC.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
Prof. Dr. Fehmi AKÇİÇEK
PALBOSİKLİB VE RİBOSİKLİBİN HORMON RESEPTÖRÜ POZİTİF MEME KANSERİ HÜCRE HATLARINDA MOLEKÜLER ETKİNLİK VE
HÜCRE İÇİ YOLAKLAR AÇISINDAN KARŞILAŞTIRILMASI
UZMANLIK TEZİ Dr. Ahmet Anıl ÖZLÜK
TEZ DANIŞMANI
Doç. Dr. Ş. Burçak KARACA
I İÇİNDEKİLER
ŞEKİL, TABLO VE GRAFİK LİSTESİ ………III
KISALTMALAR LİSTESİ ………..V TEŞEKKÜR ……….VII ÖZET ………1 ABSTRACT ………2 1. GİRİŞ VE AMAÇ ………...3 2. GENEL BİLGİLER ………...5 2.1. Epidemiyoloji ………..5
2.2. Meme Kanseri Risk Faktörleri ……….5
2.3. Tarama ………6 2.4. Klinik Bulgular ………7 2.5. Tanı ……….7 2.6. Patolojik Tipler ………...7 2.7. Prognostik Faktörler ……….8 2.8. Evreleme ………...10 2.8.1. Primer Tümör ………...10
2.8.2. Bölgesel Lenf Nodu ……….11
2.8.3. Uzak Metastaz ……….11
2.9. Tedavi ………...12
2.9.1. Primer- Lokal Bölgesel Tedavi ……….13
2.9.2. Adjuvan Hormonoterapi ………...13
2.9.3. Adjuvan Kemoterapi ………...14
2.9.4. Metastatik Meme Kanseri Tedavisi ………...14
2.10. Siklin Bağımlı Kinaz (CDK) 4/6 İnhibitörleri ………...15
2.10.1. Hücre Siklusu ………...15
2.10.2. Hücre Siklusunda Siklin Bağımlı Kinazların Rolü …….16
2.10.3. Kanser Hücresinde Hücre Siklus Disregülasyonu ……16
2.10.4. Kanserde CDK4/6 İnhibisyonu ……….17
2.10.4.1. Palbosiklib ………19
II 2.10.5. Hücre Ölüm Yolakları ……….22 2.10.5.1. Apoptoz ………22 2.10.5.2. Nekroz ………..23 2.10.5.3. Otofaji ………...24 3. GEREÇ VE YÖNTEM ………26
3.1. Hücre Hatlarının Temini, Çoğaltımı Ve İdamesi ………26
3.2. Hücrelerin Sayımı ve Deney Planına Göre Ekimi ……….26
3.3. Palbosiklib ve Ribosiklib’ in Temini Ve Solüsyonlarının Hazırlanması ………...27
3.4. Hücre Canlılığının Belirlenmesi ………28
3.5. Apoptozis Belirteçlerinden Histon-DNA Fragmantasyonunun Belirlenmesi ……….28
3.6. Apoptozis ile İlişkili Proteinlerin Antikor Array Yöntemi ile Belirlenmesi ……….29
3.7. İstatistiksel Analiz ………...30
4. BULGULAR ………...32
4.1. MCF-7 ve BT474 Hücre Hatlarında Palbosiklib Ve Ribosiklib’in Zamana Ve Doza Bağımlı Anti-Tümöral Etkilerinin Gösterilmesi Ve IC50 (%50 İnhibitör Konsantrasyon) Saptanması ………32
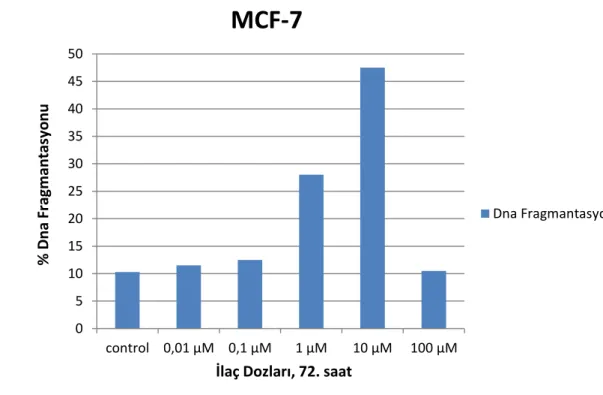
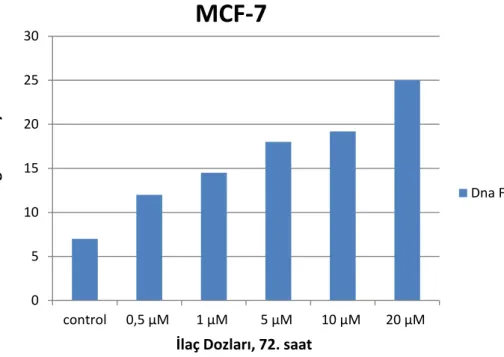
4.2. Palbosiklib Ve Ribosiklib’in MCF-7 ve BT474 Hücre Hatlarında Olası Apoptotik Etkilerinin DNA Fragmantasyonu İle Gösterilmesi ..37
4.3. Apoptozis ile İlişkili Proteinlerin Antikor Array Yöntemi ile Belirlenmesi ……….41
5. TARTIŞMA VE SONUÇ ………42
6. KAYNAKÇA ………46
III ŞEKİL, TABLO VE GRAFİKLER
Tablo 1. NCCN TNM Evrelemesi (NCCN 2016)
Tablo 2. Palbosiklib’in MCF-7 hücre hattında zamana ve doza bağlı sitotoksisite oranları
Tablo 3. Palbosiklib’in BT474 hücre hattında zamana ve doza bağlı sitotoksisite oranları
Tablo 4. Ribosiklib’in BT474 hücre hattında zamana ve doza bağlı sitotoksisite oranları
Tablo 5. Ribosiklib’in MCF-7 hücre hattında zamana ve doza bağlı sitotoksisite oranları
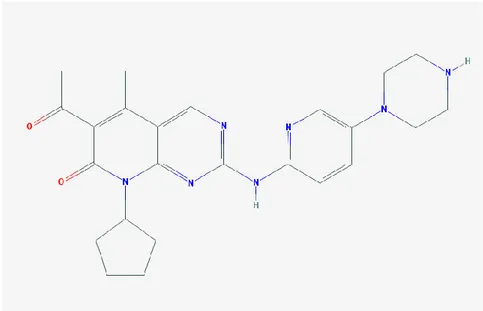
Şekil 1. Siklin D-CDK4/6-INK-Rb yolağı Şekil 2. Palbosiklib moleküler yapısı Şekil 3. Ribosiklib moleküler yapısı
Çizelge 1. : Protein Antikor Yöntemiyle Araştırılan Apoptozisle ilişkili 35 protein (R&D Systems)
Grafik 1. Palbosiklib’in MCF-7 hücre hattında 24, 48 ve 72.saatlerde değişen konstantrasyonlarda canlılık yüzdeleri
Grafik 2. Palbosiklib’in BT474 hücre hattında 24, 48 ve 72.saatlerde değişen konstantrasyonlarda canlılık yüzdeleri
Grafik 3. Ribosiklib’in MCF-7 hücre hattında 24, 48 ve 72.saatlerde değişen konstantrasyonlarda canlılık yüzdeleri
Grafik 4. Ribosiklib’in BT474 hücre hattında 24, 48 ve 72.saatlerde değişen konstantrasyonlarda canlılık yüzdeleri
IV Grafik 5. Palbosiklib’in MCF-7 hücre hattında gözlenen %DNA fragmantasyonu oranları
Grafik 6. Palbosiklib’in BT474 hücre hattında gözlenen %DNA fragmantasyonu oranları
Grafik 7. Ribosiklib’in MCF-7 hücre hattında gözlenen %DNA fragmantasyonu oranları
Grafik 8. Ribosiklib’in BT474 hücre hattında gözlenen %DNA fragmantasyonu oranları
V KISALTMALAR
ABD: Amerika Birleşik Devleti
BRCA-1, BRCA-2: Breast Cancer 1-2
CDK: Cyclin dependent kinase; Siklin Bağımlı Kinaz CYP: Sitokrom
CDKN2A: Cyclin Dependent Kynase İnhibitor 2A; Siklin Bağımlı Kinaz İnhibitör 2A
DMSO: Dimethyl sulfoxide
EDTA: Ethylenediaminetetraacetic acid ER: Estrogen Receptor; Östrojen Reseptör
EGFR: Epidermal Growth Factör Receptör; Epidermal Büyüme Faktörü Reseptörü
FDA: Food and Drug Administration; Amerikan Gıda ve İlaç Dairesi HR: Hormon Reseptör
Her-2: Human Epidermal Growth Factor Receptor 2; İnsan Epidermal Büyüme Faktör Reseptör 2
HT: Hormonoterapi HCQ: Hidroksiklorokin
IC50: Half maximal inhibitory concentration KT: Kemoterapi
MG: Mamografi
MRG: Magnetik Rezonans Görüntüleme MKC: Meme Koruyucu Cerrahi
MKT: Meme Koruycu Terapi
mTor: Rapamisin Mekanik Hedef İnhibitörü NADP: Nikotinamid Adenin Dinükleotit Fosfat
PFS: Progression Free Survival; Progresyonsuz Sağ Kalım PI3K: Fosfotidilinozitol3-kinaz
VI PTEN: Phosphatase and tensin homolog
RIP: Receptor interacting proteinler; Reseptör Etkileşim Rb: Retinoblastom
RT: Radyoterapi
SERM: Selective Estrogen Receptor Modulator; Selektif Östrojen Reseptör Modülatörü
TNF: Tümör Nekrozis Faktör
VII TEŞEKKÜR
İç hastalıkları eğitimim boyunca bana her zaman destek olan İç Hastalıkları Anabilim Dalı Başkanı Sn. Prof. Dr. Fehmi Akçiçek’e,
Tezim süresince eşşiz bilgi birikimi ve deneyimi ile her zaman yol gösterici olan tez danışmanım Sn. Doç. Dr. Ş. Burçak Karaca’ya,
İç hastalıkları eğitimim boyunca eğitimime katkıları ile beni mesleğime hazırlayan tüm İç hastalıkları öğretim üyelerine ve her zaman varlığı ile güç bulduğumuz, bilgisi ile aydınlandığımız Sn. Doç. Dr. Devrim Bozkurt’a,
Tezin hazırlanma süresince laboratuvar çalışmalarını titizlikle yürüten moleküler biyoloji uzmanı Sn. Dr. Harika Atmaca’ya,
Büyük bir özveri ile bugünlere gelmemde büyük emekleri olan ve hayatın her alanında desteklerini esirgemeyen babama, babaanneme, büyükbabama ve kardeşime çok teşekkür ederim.
Bu çalışmadan elde edilecek verilerin meme kanserli hastaların tedavisine bir nebzede olsa katkı sağlamasını diliyoruz.
1 ÖZET
Meme kanseri kadınlarda en sık görülen kanserdir. Kadın kanserleri içinde mortalite ile sonuçlanan ikinci sıklıktaki kanserdir. Meme kanserinde mevcut kemoterapi, hormonoterapi, radyoterapi, monoklonal antikorlarla tedavilerin yanında yeni yolaklara yönelik etkin tedavi yöntemleri de geliştirilmektedir. Mevcut kemoteropatik ajanların en önemli etki mekanizması apoptozis olmasına rağmen yeni geliştirilen ilaçlarda bu etki mekanizmaları yönünden farklılık göstermektedir.
Palbosiklib ve ribosiklib hücre döngüsünde önemli bir yeri olan siklin bağımlı kinaz 4/6 (CDK 4/6) inhibitörleri olarak meme kanserinde güncel kullanıma girmiş yeni ajanlardır. Bu iki ilaç aynı yolak üzerinden etki ediyor olsalarda moleküler etkinlik ve hücre ölüm mekanizmaları açısından farklılık göstermektedirler.
Bu çalışmada, iki farklı CDK4/6 inhibitörünün, meme kanserinin en sık görülen iki moleküler alt tipleri olan luminal-A ve luminal-B özellikleri içeren HR+ hücre kültürlerinde (MCF-7 ve BT474) aynı yolakta CDK4/6 inhibisyonu yapmalarına rağmen moleküler anlamdaki farklılıkların ortaya çıkarılması, bu hücre kültürlerindeki sitotoksitelerinin karşılaştırılması, yeni kombinasyonlara yol açabilecek direnç mekanizmalarının, hücre ölüm mekanizmalarının saptanması planlanmaktadır.
Anahtar Kelimeler: CDK 4/6, Palbosiklib, Ribosiklib, Meme Kanseri, MCF-7 hücre hattı, BT474 hücre hattı, hücre ölüm mekanizması
2 ABSTRACT
Breast cancer is the most common cancer in women. It is the second most common cancer that results in mortality in female cancers. Chemotherapy, hormonotherapy, radiotherapy, monoclonal antibodies in breast cancer as well as effective treatments for new pathways are being developed. Despite the fact that apoptosis is the most important mechanism of action of existing chemotherapeutic agents, these mechanisms of action differ in newly developed drugs.
Palbociclib and ribociclib are new agents that have been recently used in breast cancer as cyclin-dependent kinase 4/6 (CDK 4/6) inhibitors, which have an important role in the cell cycle. These two drugs differ in terms of molecular activity and cell death mechanisms as they affect the same pathway.
In this study, although two different CDK 4/6 inhibitors inhibited CDK 4/6 in the same pathway in HR + cell cultures (MCF-7 and BT474) containing two of the most common molecular subtypes of breast cancer, luminal-A and luminal- the comparison of cytotoxicity in these cell cultures, the resistance mechanisms that may lead to new combinations, and the detection of cell death mechanisms are planned.
Key World: CDK 4/6, Palbociclib, Ribociclib, Breast Cancer, MCF-7 cell line, BT474 cell line, cell death mechanism
3 1.GİRİŞ ve AMAÇ
Meme kanseri, tüm dünyada kadınları en fazla etkileyen kanser tipidir ve kansere bağlı ölümlerde kadınlarda akciğer kanserini takiben 2. sırada yer almaktadır (1). Olguların yaklaşık %5-10’u tanı anında ileri evre ve metastatik meme kanseri olarak bulunmaktadır (2). Meme kanserli olguların yaklaşık %60-75’inde hormon reseptörü (HR) + olarak bulunmaktadır (3). Östrojen reseptörü (ER) iki ayrı, fakat birbiriyle bağlantılı yolaklarla çalışır. Bunlar nükleer (genomik) ve nükleer olmayan (nongenomik) yolaklardır. Nükleer yol, ER'nin genomik aktivite üzerindeki etkilerine aracılık eder. Böylece fizyolojik hücre fonksiyonunda ve anormal hücre çoğalmasında rol alan birçok genin ekspresyonunu değiştirir ve tümörogeneze neden olur (4). Hücre siklusunun tamamlanması ve hücre çoğalması, kinazlar ve çeşitli proteinler aracılığıyla olmaktadır.
Siklin bağımlı kinazlar (CDK), hücre döngü ilerlemesinin düzenlenmesinde anahtar bir rol oynayan serin/treonin kinazların bir alt grubudur. Hücre döngüsü G1 ila S fazı geçişi, D-tipi siklinlere bağlandığında aktive olan ve S fazı girişi için gerekli genlerin ekspresyonuna yol açan CDK4 ve CDK6 ile kontrol edilir (5). Siklin D1, ER'nin direkt bir transkripsiyonel hedefidir. Anti-östrojen tedavi HR+ meme kanseri hücrelerinin büyümesini durdurur ve siklin D1’in etkinliğini azaltır. Diğer meme kanseri alt türleri ile karşılaştırıldığında, HR+ meme kanseri sıklıkla siklin D1-CDK4/6'nın hiperaktivasyonu ile ilişkilidir (6). CDK4/6 selektif inhibitörleri olan palbosiklib ve ribosiklib ile ilgili klinik ve preklinik birçok çalışma bulunmaktadır.
Palbosiklib, 2015 yılında postmenapozal kadınlarda HR+, insan epidermal büyüme faktör reseptörü-2 (HER-2) negatif metastatik meme kanserinde letrozol ile kombinasyonu Amerikan Gıda ve İlaç Dairesi (FDA) tarafından onay almıştır (7). Preklinik faz 2 çalışması olan PALOMA-1 çalışmasında palbosiklibin, HR+ meme kanseri hücrelerinin gelişimini engellediği ve progresyonsuz sağkalımda (PFS) 10.2 aydan 20.2 aya çıkardığı saptanmıştır (8). Faz 3 çalışma olan PALOMA-3 çalışmasında, ileri evre meme kanserinde önceki endokrin tedaviye dirençli ya da nüks gelişen
4 meme kanseri olgularında palbosiklibin fulvestrant ile kombinasyonunda PFS da 4.6 aydan 9.5 aya çıkarması ile FDA tarafından onay almıştır (9).
Bir diğer selektif CDK4/6 inhibitörü ribosiklibtir. Ribosiklib yine bir faz 3 çalışma olan MONALEESA-2 çalışmasında ER+, HER-2 negatif ileri ya da metastatik meme kanserinde letrozol ile ribosiklib kombinasyonun etkili olduğu gösterilmiştir ve 2017 yılında FDA tarafından onay almıştır. Ribosiklib hücre döngüsünde retinoblastom (Rb) proteininin fosforilasyonunu engelleyen ve hücre döngüsünü G1 fazında durduran CDK4/6 inhibitörüdür. Ribosiklib’in anti-tümör aktivitesi ER+ meme kanseri olan xenograft modellerde tek ajan olarak, letrozol ve fosfotidilinozitol3-kinaz (PI3K) inhibitörleri ile kombinasyonunda gösterilmiştir (10).
Bu çalışmada, iki farklı CDK4/6 inhibitörünün, meme kanserinin en sık görülen iki moleküler alt tipleri olan luminal-A ve luminal-B içeren HR+ hücre kültürlerinde (MCF-7 ve BT474), potens farklılıklarının olup olmadığının gösterilmesi, aynı yolakta CDK4/6 inhibisyonu yapmasına rağmen moleküler anlamdaki farklılıkların ortaya çıkarılması, bu hücre kültürlerindeki sitotoksitelerinin karşılaştırılması, yeni kombinasyonlara yol açabilecek direnç mekanizmalarının, hücre ölüm yolaklarının saptanması amaçlanmıştır. Literatüre bakıldığında bu amaçla yapılan bir çalışmaya rastlanmamıştır.
5 2.GENEL BİLGİLER
2.1. Epidemiyoloji:
Meme kanseri, kadınlarda tanısı konulan en sık malignitedir ve kansere bağlı ölümlerde akciğer kanserinden sonra en sık ölüm nedenidir. Amerika Birleşik Devletleri' nde (ABD) her yıl 250.000'den fazla yeni meme kanseri vakası görülürken, her yıl ABD’de 40.000'in üzerinde kadın hayatını kaybetmektedir (11). Yıllar içerisinde meme kanseri görülme sıklığında artış olmakla birlikte erken tanı ve tedavi modalitelerindeki gelişmeler sayesinde mortalite oranlarında düşüş görülmektedir. Daha az endüstrileşmiş ülkelerde yaşayan kadınlarda meme kanseri insidansı endüstrileşmiş ülkelerde yaşayanlara göre daha düşük olma eğilimindedir (12). Erken tanı ve sistemik tedavi sayesinde meme kanseri mortalitesi azalmaktadır (11).
2.2. Meme Kanseri Risk Faktörleri
Meme kanseri gelişiminde risk faktörlerini 5 kategoride toplamak mümkündür. Bu bağlamda;
1. Demografik özellikler (cinsiyet, yaş, ırk/etnisite gibi)
2. Reprodüktif öykü (menarş yaşı, doğum yapma, doğum sayısı, ilk gebelik yaşı, menapoz yaşı, laktasyon, infertilite, düşük yapma)
3. Ailesel/genetik faktörlerin bulunması (aile öyküsü olması, BRCA1/2, p53, PTEN veya meme kanseri riski ile ilişkili diğer gen mutasyonlarının olması)
4. Çevresel faktörler (30 yaşından önce toraks bölgesine radyoterapi, hormon replasman tedavisi, alkol kullanımı, sosyoekonomik düzey, vb.)
5. Diğer faktörler (Kişinin kendisinde meme kanseri öyküsü olması, meme yapısından dens olması vb)
Demografik özellikler de kadın cinsiyet en büyük risk faktörüdür ve 100 kat risk artışı ifade etmektedir. Beyaz kadınlarda görülme oranı zenci kadınlara göre risk %20 oranında fazladır ancak mortalite zenci kadınlarda daha fazladır.
6 Reprodüktif öykü de, bu risk faktörlerinin çoğu östrojene maruziyet süresi ve miktarı ile ilişkilidir. Östrojene maruziyet süresi arttıkça meme kanseri görülme riski artmaktadır (erken menarş-12 yaşından önce, geç menapoz- 55 yaşından sonra).
Yine laktasyon meme kanseri görülme riskini azaltmaktadır. Bu etki premenapozal kadınlarda daha belirgindir.
Ailesel/genetik risk faktörlerinde, meme kanserli hastaların %20-30’unda ailesinde en azından bir kadında meme kanseri öyküsü vardır. Bir adet birinci derece akrabada meme kanseri olması, meme kanseri riskini 1.80 kat artırır. İki tane birinci derece akraba varlığında ise bu risk 2.9 kat artar (13). Ancak %10’unda herediter predispozisyon vardır. Bu predispozisyonun en önemlileri BReast CAncer (BRCA) 1 ve 2 gen mutasyonlarıdır. Kalıtsal meme kanseri ile ilişki diğer genler ise Li-Fraumeni sendromundan sorumlu TP53 ve Cowden sendromundan sorumlu PTEN genleridir (14).
Çevresel faktörler de, sosyoekonomik düzeydeki yüksekliğin meme kanseri gelişiminde 2 kata yakın bir artışı ifade eder, bu reprodüktif alışkanlıklardaki değişikliklerle ilişkilidir (15). 10-14 yaşları arasında meme gelişiminin aktif olduğu dönemlerde radyasyona maruz kalmak, yine hayatın özellikle ilk 3 dekatında toraks bölgesine alınan terapötik radyoterapi (RT) işlemide meme kanseri gelişime katkıda bulunmaktadır (16).
Meme kanseri açısından yüksek riskli kadınlar düzenli takip edilmeli ve bu yüksek riskli hastaların bazılarında profilaktik mastektomi, ooferoktomi veya tamoksifen gibi seçenekler düşünülmelidir (17).
2.3.Tarama
Meme kanserinin erken tanı aldığında tedavi edilebilir olması ve özellikle kadınlarda sık görülüyor olması sebebi ile tarama önerilmektedir (17). Mamografinin (MG) tarama aracı olarak 50 yaş ve üzeri kadınlarda kullanılması, bu kansere bağlı mortaliteyi %20-30 oranında azalttığı gösterilmiştir (14). Bu tarama ile lenf nodu tutulumu olmadan meme kanseri %80 oranında tanınabilmektedir. Mamografi ve fizik muayene taramada
7 birlikte kullanılmalıdır. Erken meme kanserlerinin %35-50’si sadece mamografi ile saptanırken, sadece fizik muayene ile %40’ı saptanmaktadır. Meme muayenesi 40 yaşının üstünde yıllık yapılmalıdır (14).
Meme kanserinde yavaş büyüyen tümörler fizik muayene ile palpe edilmeden 2 yıl önce mamografi ile tespit edilebilmektedir. Bu açıdan MG kitle palpe edilmeden önce meme kanserini tanımlamada kullanılan en güvenilir testtir. Ancak MG’nin normal olması meme kanserini ekarte ettirmez. Eğer şüphe duyulan bir lezyon var ise fizik muayene ve ultrasonografi ile değerlendirilmesi gerekmektedir (17).
Magnetik rezonans görüntüleme (MRG) yüksek riskli meme kanserlerinde kullanılabilir. Ancak MRG’nin duyarlılığı MG’den yüksek olsa da özgüllüğü daha düşüktür.
2.4. Klinik Bulgular
Meme kanseri genellikle mamografik bir bozukluk veya memede kitle, asimetrik kalınlaşma, meme ucu akıntısı, deri veya meme ucu değişiklikleri gibi fiziksel değişiklikler ile prezente olur. En sık üst dış kadranda (%60) lezyon görülürken, %15’i üst iç kadranda, %15’i alt dış kadranda, %5’i alt iç kadranda %5’i ise areola etrafında görülür (17).
2.5. Tanı
Tanısal değerlendirme mamografi veya fizik muayene ile ele gelen kitle tespit edilmesi sonrası o kitleden biyopsi alınması ile tanıya gidilir. Tanı histopatolojik olarak konur (17).
2.6. Patolojik Tipler
Meme kanserlerinin %15-25’ini karsinoma in-situ oluştururken, geri kalan bölümünü ise invaziv meme kanserleri oluşturmaktadır ve memenin köken aldıkları bölgelerine göre duktal ve lobüler olarak ayrılırlar.
A-Karsinoma in-situ Duktal Karsinoma in-situ
8 Lobuler Karsinoma in-situ
B-İnvaziv Meme Kanseri İnvaziv duktal karsinom- %76
İnvaziv lobüler karsinom- %8
Duktal/lobüler karsinom- %7
Müsizöz (kolloid) karsinom- %2,4
Tübüler karsinom- %1,5
Medüller karsinom- %1,2
Papiller karsinom- %1
Metaplastik meme kanseri ve mikropapiller meme kanserinin de içinde bulunduğu diğer alt tiplerin oranı %5’ ten az bulunmuştur (14).
2.7. Prognostik Faktörler
Meme kanserinde en önemli prognostik faktör aksillar lenf nodu tutulumu ve sayısıdır. Buna göre negatif lenf nodu olan hastalarda 5 yıllık sağkalım %82.8, 1-3 pozitif lenf nodu tutulumu olanlarda %73, 4-12 lenf nodu tutulumu olanlarda %45.7, 13 ve daha fazla lenf nodu tutulumu olanlarda bu oran %28.4 olarak bulunmuştur (18,19). Lenf nodu durumundan sonra en önemli prognostik faktör tümör çapıdır. Bir diğer prognostik faktör lenfatik ve vasküler invazyondur. Peritümöral lenfatik damar ve vasküler invazyon lokal ve uzak rekürrens riski açısından prognostik öneme sahiptir (18, 19). Tümör
tipi ve derecesi yine bir diğer prognostik faktördür. Meme kanseri her hasta için farklı farklı değerlendirilmelidir. Aynı histolojik özelliklere sahip tümörler moleküler anlamdaki farklılıklarından dolayı klinik olarak farklı davranış sergilemektedirler. Bu farklılıklar nedeniyle meme kanserinin moleküler anlamda 6 farklı alt tipi ortaya çıkarıldı (19).
· Luminal A hastalık; ER(+), PR(+), Her-2 (-), CK 5/6 ve EGFR (-)
9 EGFR (-)
· Bazal- like hastalık; Triple negatif, CK 5/6 ve EGFR (+)
· Her-2 pozitif hastalık; ER, PR(-), Her-2(+), CK 5/6 ve EGFR (-)
· Normal meme benzeri; ER (-)/(+), Her-2 (-), CK 5/6 ve EGFR (+)
· Claudin- low hastalık; Triple negatif, CK 5/6 ve EGFR (+)/(-)
1-Luminal A: Meme kanserinin yaklaşık %40’ını oluşturmaktadır. ER’nin en yüksek oranda eksprese edildiği alt tiptir. HER-2 ve proliferasyon ile ilişkili genlerin (örn; Ki-67) ekspresyonu çok düşüktür. Tüm meme kanseri alt tiplerinden en iyi prognozlu olanıdır ve hormonoterapiye iyi yanıt verir (20).
2-Luminal B: Yaklaşık %20 oranında görülmektedir. ER’nin nispeten daha az eksprese edildiği alt tiptir. Bazı tümörlerde HER-2 pozitifliği olduğu saptanmıştır. Proliferasyonla ilişkili genlerin (Ki-67) ekspresyonunun luminal-A ya göre daha fazla olduğu bilinmektedir. Luminal-luminal-A’ya göre daha kötü prognozludur. Ki-67’nin prognostik önemi 2009 yılında yayınlanan St. Gallen meme konsensusunda belirtilmiştir. Ki-67 için immünohistokimyasal (IHC) olarak <%14 düşük risk, %15-30 orta risk ve > %30 yüksek risk grubu olarak kabul edilmiştir (20).
3-Bazal Like: Bu tümörlerin %90 ila %95’inde ER, PR ve HER-2 negatiftir. ER negatif olan bu grubun çoğu yüksek gradeli tümörlerdir. CK 5/6, CK17, p-kadherin, caveolin 1-2, nestin, CD-44 ve epidermal büyüme faktörü reseptörü(EGFR) (+)’liği gibi birçok miyoepitelyal hücre belirteçleri bu grupta bulunmaktadır (21). Yine bu meme kanseri grubunda BRCA-1 gen mutasyonu daha sık görülmektedir. Triple negatif meme kanseri ile klinik olarak aynı anlamda kullanılsada moleküler anlamda farklılıkları mevcuttur.
4-Her-2 Pozitif: Bu grup meme kanserlerinin %10 ila %15’ini kapsamaktadır. HER-2 ve proliferasyon gen kümelerinin yüksek ekspresyonu ile karakterizedir. Bu yüzden sıklıkla ER, PR negatif, HER-2 pozitiftir (22).
5-Claudin-low tipi hastalık: İlk kez 2007’de tanımlanmıştır. İntersellüler adezyon molkeüllerinin düşük ekspresyonu ile karakterizedir (claudin 3,4,7,
10 cingulin, e–kadherin gibi). Bazal-like hastalığa benzer bir moleküler yapılanması vardır (23).
2.8. Evreleme
Meme kanseri için tümör çapı, lenf nodu sayısı ve metastaz durumuna göre yapılan TNM sınıflaması hastalık aşamasını belirlemek için kullanılan uluslararası kabul görmüş bir sistemdir. Bu hastalık evresi prognozu ve hastalık yönetimini belirtlemek için kullanılır. Evreleme T primer tümörün boyutunu, N bölgesel lenf nodu metastatzını, M uzak metastazı gösterir. Evre 1, 2A ya da evre 2B’nin alt kolu (T2N1) erken evreyi gösterir. Evre 2B’nin alt kolu (T3N0), evre 3A ile 3C hastalık lokal ileri hastalıktır (24).
2.8.1. Primer Tümör (T)
Tx: Primer tümör değerlendirilemiyor. T0: Primer tümör bulgusu yok.
Tis: Karinoma in situ.
Tis (DCIS): Duktal karsinoma in situ
Tis (Paget): Tümör kitlesi olmayan memenin paget hastalığı T1: Tümör çapı ≤20 mm
T1mi: Tümör çapı 1 mm veya daha küçük
T1a: Tümör çapı 1 mm’den büyük ancak 5 mm’yi geçmeyen boyutlarda
T1b: Tümör çapı 5 mm’den büyük ancak 10 mm’yi geçmeyen boyutlarda
T1c: Tümör çapı 10 mm üzerinde ancak 20 mm’yi geçmeyen boyutlarda
T2: Tümör çapı 20 mm’den büyük ancak 50 mm’yi geçmeyen boyutlarda
T3: Tümör çapı 50 mm’den büyük boyutlarda
T4: Tümör çapı ne olursa olsun, göğüs duvarı veya cilde direk yayılım gösteren tümör
11 T4b: Meme derisinin ülserasyonu veya ödem (portakal kabuğu
görünüm dahil) yada aynı memede uydu nodüller T4c: T4a ve T4b’deki bulguların birlikte olması T4d: İnflamatuar karsinoma
2.8.2. Bölgesel Lenf Nodu (N)
NX: Bölgesel lenf nodları değerlendirilemiyor N0: Bölgesel lenf nodu metastazı yok
N1: Aynı tarafta mobil aksiller lenf bezi metastaz varlığı
N1mi: Mikrometastaz (Yaklaşık 200 hücre, 0.2 mm'den büyük, ancak hiçbiri 2.0 mm'den büyük değil)
N2: Birbirlerine veya çevre yapılara fikse aynı taraftaki aksiller lenf bezleri veya aynı taraf internal mammaryal lenf bezlerine metastaz varlığı
N2a: Birbirlerine veya çevre yapılara fikse aynı tarafta aksiller lenf nodu metastazı varlığı
N2b: Klinik olarak belirgin aksiller lenf nodu metastazı olmaksızın aynı taraftaki internal mammaryal lenf nodlarına metastaz varlığı
N3: Aynı taraftaki infraklaviküler lenf nodlarına metastaz veya hem aynı taraftaki internal mammaryal lenf nodlarına hem de aksiller lenf nodlarına metastaz ya da aynı taraftaki supraklaviküler lenf nodlarına metastaz varlığı
N3a: Aynı taraflı infraklaviküler lenf nodlarına metastaz varlığı
N3b: Hem aynı taraftaki internal mammaryal lenf nodlarına hem de aksiller lenf nodlarına metastaz varlığı
N3c: Aynı taraftaki supraklaviküler lenf nodlarına metastaz varlığı
2.8.3. Uzak Metastaz
12 M0: Uzak metastaz yok
M1: Uzak metastaz var Tablo 1: NCCN TNM Evrelemesi Evre 0 Tis N0 M0 Evre IA T1* N0 M0 EvreIB T0 N1mi M0 T1 N1mi M0 Evre IIA T0 N1** M0 T1 N1** M0 T2 N0 M0 Evre IIB T2 N1 M0 T3 N0 M0 Evre IIIA T0 N2 M0 T1* N2 M0 T2 N2 M0 T3 N1 M0 T3 N2 M0 Evre IIIB T4 N0 M0 T4 N1 M0 T4 N2 M0
Evre IIIC Herhangi bir T
N3 M0
Evre IV Herhangi bir T Herhangi bir N M1 *T1 Tmic’ i içerir. 2.9.Tedavi
Meme kanserinde tedavi şeklini belirleyen birçok parametre bulunmaktadır. Bunlardan en önemlileri aksillar lenf nodu tutulumu varlığı, tümörün boyutu, tümörün moleküler sınıfı, hastanın yaşı, menapoz durumu ve hastanın performansı olarak sıralanabilir.
Şu anda evre 1,2,3 hastalarda standart tedavi cerrahi tedaviyi takiben radyoterapi ya da sistemik tedavidir. Sistemik tedavi tümörün boyutu, derecesi, ilgili lenf düğümleri sayısı, ER ve PR reseptörlerinin durumu ve HER-2 ekspresyonuna göre seçilmektedir. Neoadjuvan tedavi ise tümör
13 çapını küçültmeye yönelik, cerrahi tedavi öncesi uygulanan tedavidir. Bu sayede mastektomili uygulanacak hastalara lumpektomi yani meme koruyucu cerrahi (MKC) uygulanabilir (17). Primer tedaviden sonra uygulanan adjuvan sistemik tedavinin rekürrens riskini azalttığı ve genel sağkalım üzerine olumlu etki yaptığı bilinmektedir. Adjuvan tedavi kemoterapi (KT) ve hormonoterapiden (HT) oluşmaktadır (14).
2.9.1. Primer- Lokal Bölgesel Tedavi
Meme koruyucu terapi (MKT), MKC sonrası radyoterapi işlemidir. MKT’nin hedefleri kosmetik olarak kabul edilebilir bir meme dokusu ve düşük nüks oranı ile sağkalım eşdeğerlerini sağlamaktır. Başarılı bir MKT negatif cerrahi ile tümörün tamamen çıkarılması ve ardından RT almayı gerektirir. Meme kanseri olan kadınlar arasında yapılan çalışmada mastektomi ile meme koruyucu terapi arasında genel sağkalımda bir farklılık gösterilememiştir (25).
MKT’nin yapılıp yapılamayacağını belirleyen en önemli faktör tümörün çapıdır. Bu bağlamda MKT’yi engelleyen kriterler, tümörün çapı, multisentrik hastalık, toraks bölgesine alınmış RT öyküsü, gebelik, göğüs duvarı, deri, meme başı ve etrafındaki deriye fiske olmuş tümörler sayılabilmektedir. Aksillar bölge diseksiyonu, aksillar rekürrensi önlemede, aynı zamanda tümörün önlenmesinde ve tedavi planlanmasında önemlidir (26).
2.9.2. Adjuvan Hormonoterapi
Meme kanserinde hormon reseptörü pozitifliği (ER ve/veya PR) en yaygın meme kanseri alt tiplerini oluşturmaktadır ve tüm vakaların %75’ini oluşturur. Bu açıdan ER ve/veya PR pozitifliğinin saptanması tedavi yönetimi açısından önemlidir. Reseptör pozitif olan hastalar HT alabilmektedir. Başlıca anti-östrojen tedaviler; selektif östrojen reseptör modülatörü (SERM) tamoksifen, aromataz inhibitörleri (periferde androjenin östrojene dönüşümünü baskılarlar, örn; anastrozol, letrozol, exemestan) ve ovaryan süpresyon ya da ablasyondur. Aromataz inhibitörleri fonksiyon gören overi olan hastalarda overyan fonksiyonlar bloke edilmeden kullanılmamalıdır. Son menstürel siklustan bir yıldan daha az zaman geçmiş hastalar premenopozal
14 kabul edilirler. Potent selektif östrojen modülatörü olan tamoksifen premenopozal hastalarda en sık kullanılan hormonal tedavidir (17).
2.9.3. Adjuvan Kemoterapi
Adjuvan sistemik tedavi orta ve yüksek risk grubundaki kadınlara önerilmektedir. Ancak HT’den daha toksiktir. Genel sağkalımı iyileştirir ve rekürrens riskini azaltmaktadır. Bu etkisini lenf nodu tutulumundan bağımsız olarak gerçekleştirir. Adjuvan tedavi 10 yıllık relaps riski yüksek olan kadınlara önerilmektedir. Bu grup patolojik tümör çapı 1 cm ve üzerinde olan İnvaziv duktal, lobüler karsinomları ve tümör çapı ile histolojik bulgularına bakılmaksızın aksiller lenf nodu pozitif olan tüm hastaları içerir (14). Lenf nodu negatif olsada %25 oranında mikroskobik metastatik hastalık görülebilmektedir. Bu yüzden lenf nodu negatif yüksek riskli hastalara da adjuvan tedavi önerilmektedir.
2.9.4. Metastatik Meme Kanseri Tedavisi
Meme kanserli olguların yaklaşık %10-15’inde tanı anında metastatik hastalık mevcuttur. Erken evre veya lokal ileri hastalığı olan meme kanserli olgularda gelişen nüksler lokal olmaktan daha çok metastatik hastalık şeklinde kendini göstermektedir. Uzak metastazlar en sık kemik, karaciğer ve akciğere olmaktadır. Metastaz görülme olasılığı en sık tanı sonrası 2-3. yıllardadır (27).
Meme kanseri yukarıda saydığımız birçok organlara metastaz yapabildiği, lokal meme dokusunda ya da göğüs duvarında da tekrar ortaya çıkabilir. Bu durumdaki meme kanseri hastalarında küratif bir tedavi seçeneği yoktur. Metastaz sonrası ortalama sağkalım 2-3 yıldır. Bu yüzden tedavi planlanması uzun sağkalım, progresyonsuz sağkalım, stabil hastalık ve yaşam kalitesini artırmaya yönelik olmalıdır (27). Bununla birlikte metastatik meme kanseri olan hastalar için medyan sağkalım taksanlar, aromataz inhibitörleri ve trastuzumab da dahil olmak üzere yeni ve daha etkili ajanlarla daha da gelişmiştir (28).
Metastatik meme kanserli hastalar da tedavi planlanması prognostik ve prediktif faktörlere göre yapılmalıdır. Hormon reseptör durumu, HER-2 aşırı
15 ekspresyonu ve tümör yükü gibi biyolojik belirteçler hem prognostik hem de prediktif değere sahiptir ve tedavi seçiminde önemlidir.
Metastaz bölgesi nedeniyle riskli olan veya tek izole metastaz odağı olan hastalarda öncelikle lokal tedaviler seçilmelidir. Sistemik tedavi endikasyonu varsa ve hormon reseptörleri pozitif ise, birinci basamak sistemik tedavi olarak HT tercih edilmelidir. Hızlı progresyonu olan, visseral organ tutulumu bulunan ve hormonoterapiye yanıtsız hastalarda kemoterapi ve trastuzumab (HER-2 pozitif tümörlerde) verilmelidir. HER-2 pozitif tümörlerde trastuzumab ilk tercih edilecek ajan olmalıdır. Hafif seyirli hastalığı olanlarda başlangıçta trastuzumab+hormonoterapi denenebilir. Hızlı progrese visseral metastazı olan semptomatik hastalarda ise trastuzumab+kemoterapi kombinasyonu verilebilir. Kemoterapiler, hormonoterapiler, anti-HER-2 tedavilerin yanında metastatik meme kanserli hastalarda etkinliği kanıtlanmış moleküler hedefli ajanlar da (örn; siklin bağımlı kinaz 4/6 inhibitörleri (CDK 4/6), rapamisin mekanik hedef inhibitörü (mTOR)) bulunmaktadır. HER-2 negatif, hormon reseptörü pozitif metastatik meme kanserli hastalarda CDK 4/6 inhibitörleri ile progresyonsuz sağkalımda önemli artış saptanmıştır (9,10).
2.10. Siklin Bağımlı Kinaz (CDK) 4/6 İnhibitörleri 2.10.1. Hücre Siklusu
Hücre siklusu birçok malignitenin tümörogenesisi için kilit bir hedeftir. Hücre bölünmesi ve hücre ölümü, doku homeostazını düzenleyen iki baskın fizyolojik süreçtir ve burdaki herhangi bir değişiklik ölümsüz kanser hücrelerinin oluşumuna neden olmaktadır. Hücre siklusu dört fazda gerçekleşir. Hücre büyümesi ve olgunlaşmasının büyük bölümünün gerçekleştiği G1 fazı ile başlar. G0 fazı ile hücre siklustan çıkar ya da DNA sentez fazı olan S fazına geçer. Bu fazı G2 fazı izler ve hücre mitoza giderek yeni iki hücre ortaya çıkar. G1 ve G2 fazları kritik öneme sahip düzenleyici kontrol noktaları içerir. Spesifik olarak, G1 ve S fazı arasındaki bir sınırlama noktası hücrenin başka bir bölünme döngüsüne devam edip etmeyeceğini veya hücre döngüsünden çıkıp çıkmayacağını belirler (29).
16 2.10.2. Hücre Siklusunda Siklin Bağımlı Kinazların Rolü
CDK'lar, ilişkili siklinleri ile birlikte kompleksler oluşturan bir serin/ treonin kinaz grubudur. Siklinler düzenleyici altbirimdir ve CDK'lar aktive edilmiş bir heterodimer kompleksinin katalitik altbirimidir. CDK’lardan birkaçı hücre döngüsünün düzenlenmesinde doğrudan rol oynarken (CDK1, CDK2, CDK3, CDK4 ve CDK6) birkaçı ise DNA sentezi ve transkripsiyon düzenleme yoluyla hücre döngüsünde daha dolaylı bir role sahiptir (CDK7, CDK8, CDK9, CDK10 ve CDK11). Spesifik siklin ve CDK kompleksleri, hücre döngüsü boyunca fazlar arası geçişin yönetilmesini ve hücre siklusunun ilerlemesini düzenler. CDK4 ve CDK6, D tipi siklinler (D1, D2, D3) ile ilişkilidir ve hücre siklusunun G1’den S fazına ilerlemesini uyarırlar. G1’den S fazına geçmeden önce normal koşullar altında fosforile edilmemiş tümör supresör gen olan retinoblastom (Rb), E2F transkripsiyon faktör gen ailesinin üyelerine bağlanır. Siklinler ve CDK kompleksleri tümör supresör gen olan Rb’u fosforile ederek E2F transkripsiyon faktörünün salınmasını ve hücre döngüsünün ilerlemesini sağlarlar. Diğer siklin-CDK kompleksleri de (CDK2/siklin E ya da siklin A, CDK1/ siklin A ya da siklin B) bu fosforilasyon sürecini çoğaltarak devam ederler. E2F, siklinler ve CDK'lar dahil olmak üzere hücre döngüsü genlerinin, G1 fazından S fazına ve mitoza ilerlemeyi sağlayan replikasyon ve mitozda (M fazı) rol oynayan genlerin ekspresyonunu uyarır. M-G1 fazına geçişte Rb defosforile edilir ve böylece yeniden fosfatazlar tarafından aktive edilir (29,30).
Hücre döngüsü intrinsik CDK inhibitörleri tarafından negatif olarak düzenlenir. CDK4/6, Rb (retinoblastoma) proteininin fosforilasyonunda siklin-D aracılı olarak rol oynamaktadır ve bu şekilde G1-S fazını yönetmektedir. CDK4/6 bu özelliğiyle ileri evre kanser tedavisinde hedef molekül haline gelmiştir (29,30) (Şekil 1).
2.10.3. Kanser Hücresinde Hücre Siklus Disregülasyonu
Kanser hücrelerinde, hücre bölünmesi işlemi düzensiz hale gelir ve kontrolsüz bir büyüme ile sonuçlanır. Bu da bir tümörün gelişimine neden olur. Malign hücrelerde CDK 4/6 hiperaktivitesi ve amplifikasyonu, genomik insitabilite gibi birtakım mekanizmalar hücre siklusunda disregülasyona
17 sebep olmaktadır. Siklin D1 (CCND1), CDK4 veya CDK6 proteinlerini kodlayan genlerin amplifikasyonu ya da p16ink4A (CDKN2A-cyclin dependent kynase inhibitor 2A) kodlayan gen lokusundaki delesyon Siklin D-CDK4/6-INK-Rb yolağında aktivasyona neden olan major mekanizmadır. Bu mekanizmaları kullanan kanser hücreleri, G1'den S fazına geçişi tetikleyerek çoğalmaya devam ederler. Bu süreç G1 fazının kısalmasıyla kolaylaşır. Meme kanserinde yapılan bir çalışmada; çalışmada değerlendirilen hastaların %16’sında CDK4 amplifikasyonu, %17’sinde CDK6 amplifikasyonu ve %21 p16ink4A kaybı saptanmıştır (31). Bir kanser hücresinde CDK 4/6, tümörün büyümesini daha da artıran, hücre yaşlanmasını ve apoptozu içeren intrensek tümör supresyon mekanizmalarını antagonize eder. Kanser hücreleri aynı zamanda diğer CDK'ları ve siklinleri upregüle eder ve intrinsik CDK inhibitörleri ve tümör süpresör proteinleri gibi baskılayıcı mekanizmaları azaltır. Bu tip hücre döngüsü bozuklukları maligniteye sebep olmaktadır (32).
2.10.4. Kanserde CDK4/6 İnhibisyonu
CDK 4/6 aktivitesinin hücre çoğalmasındaki öneminin ve rolünün bilinmesi, sinyal yolakları ile kanser gelişimi arasındaki ilişkinin gün geçtikçe yapılan çalışmalar ile ortaya çıkarılması, CDK 4/6 inhibisyonunu kanser tedavisi için ilgi çekici hale getirmiştir. Etkilerinin sınırlı alanda gözlenmesi CDK’lara karşı geliştirilen inhibitörlerin toksisite profillerinin belirlenmesini kolaylaştırarak, klinikte kullanılabilir hale gelmelerini sağlamaktadır. Bu bağlamda üzerinde en çok çalışılan tüm CDK’ları inhibe etmesi, geniş yelpazede yan etki oluşturmasına neden olduğundan yapılan çalışmalarda klinik fayda sağlanamamış olup, tedavideki önemi sınırlı kalan flavopiridoldür. Flavapiridol bir pan-CDK inhibitörüdür. Bu nedenle yapılan çalışmalarda yüksek selektif özelliği olan, dar terapötik çevrede etki oluşturabilen ve bu nedenle yan etki profili daha az olan yeni nesil ajanlar ortaya çıkarılmıştır (31).
CDK inhibitörlerinden şu ana kadar 3 adet geliştirilmiştir. Bunlar Palbosiklib (PD-0332991), Ribosiklib (LEE011) ve Abemasiklib (LY2835219)’dir. Üçü de CDK inhibitörü olsada yan etki profilleri ve etki ettikleri tedavi dozları ve potensleri arasında farklılıklar bulunmaktadır. Bu üç
18 ajanın da Rb+ tümör hücrelerinde etkinliği gösterilmiş olup, içlerinden sadece palbosiklib ayrı olarak CDKN4A mutasyonu ya da kaybı olan ve p16ink4a proteinin ekspresyon kaybının olduğu tümörlerde etkili bulunmuştur (31).
.
Şekil 1. Siklin D-CDK4/6-INK-Rb yolağı. CDK 4/6 inhibisyonu ile Rb fosforillenemez ve E2F transkripsiyon faktörünün aktivitesi engellenir.
19 2.10.4.1. Palbosiklib
Palbosiklib oral yoldan uygulanan, potent, selektif, Rb+ hücrelerde hücre proliferasyonunu engelleyen bir CDK 4/6 inhibitörüdür.
Şekil 2. Palbosiklib moleküler yapısı
İleri evre Rb+ solid tümörlerde palbosiklib ile yapılan ilk faz 1 çalışması 41 hasta ile yapılmıştır. Tek ajan olarak palbosiklib için maksimum tolere edilebilir ve faz 2 çalışmaları için önerilen doz 21 gün tedavi 7 gün ara 28 günlük periyotlar halinde 125 mg/gün olarak belirlenmiştir. Palbosiklib’in emiliminin yaklaşık 5,5 saat olduğu ve ortalama yarılanma ömrünün 26 gün olduğu bulunmuştur. 5 hastada yani %12’sinde doz bağımlı toksisite ve nötropeni gelişmiştir. Diğer en sık görülen yan et etki anemidir. Hematolojik olmayan yan etkilerde halsizlik, diyare, bulantı, artralji ve dispnedir. Nötrofil ve trombosit sayısındaki düşüş, Palbosiklib’in artan uygulamalarıyla artmaktadır. Bu etki geri dönüşümlü olup tedavinin ilk siklusu bittikten 7 gün sonra trombosit ve nötrofil sayısı normale dönmektedir. İzlenen hastaların takipte %27’si 4 siklus boyunca, %16’sı en az 10 siklus boyunca hastalıkları stabil seyretmiştir. Yine bir faz 2 çalışma olan ve Rb+ iyi diferansiye
20 liposarkom ve dediferansiye liposarkomlu hastalarda 12 haftalık progresyonsuz sağkalım oranı %66 olarak bulunmuştur (31).
Palbosiklib adına yapılan en büyük çalışmalardan olan PALOMA-1 çalışmasında HR+, HER 2- meme kanserli hastalarda Letrozol+Palbosiklib kombinasyonu ile progresyonsuz sağkalımın (PFS) 10.2 aydan 20.2 aya çıktığı bulunmuştur. Bu çalışma sonrasında Palbosiklib ER pozitif, HER2 negatif postmenopozal ileri evre meme kanserinde kullanım için 2015 yılında FDA tarafından onay almıştır (33).
Palbosiklib, postmenopozal HR pozitif meme kanseri hastalarında kullanılan östrojen reseptör blokeri fulvestrant ile kombine olarak kullanılmaktadır. Endokrin tedavi sonrası progrese hastalıkta Fulvestrant ve Palbosiklib kombinasyon tedavisinin etkinliği faz 3 PALOMA-3 çalışması ile araştırılmıştır. Kombinasyon tedavisinde sağkalım yalnızca fulvestrant alan gruba göre anlamlı olarak yüksek bulunmuştur (sırasıyla 9.5 ay ve 4.6 ay). 2016 yılında FDA tarafından Fulvestrant ve Palbosiklib kombinasyon tedavisi kullanım onayı almıştır (9).
PALOMA-1 den daha büyük olan ve PALOMA-1 bulgularını teyit etmek için 666 ER+, HER2- postmenapozal meme kanseri hastasında palbosiklib+letrozol ve placebo+letrozol karşılaştırılmış. Primer sonlanım noktası PFS olan çalışmada palbosiklib+letrozol alan grupta PFS 24.8 ay bulunurken, placebo+letrozol alan grupta 14.5 ay olarak bulunmuştur (34).
21 2.10.4.2. Ribosiklib
Ribosiklib oral yoldan uygulanan, selektif, küçük, Rb+ hücrelerde hücre proliferasyonunu engelleyen bir CDK 4/6 inhibitörüdür.
Şekil 3. Ribosiklib moleküler yapısı
İleri evre Rb+ solid tümörlerde ribosiklib ile yapılan ilk faz 1 çalışması 128 hasta ile yapılmıştır. Maksimum tolere edilebilir ve faz 2 dozu sırasıyla 900 ve 600 mg/gün 28 günlük periyotlar ile 21 gün tedavi 7 gün ara olarak belirlenmiştir. Doz bağımlı toksisitede nötropeni, trombositopeni, mukozit, pulmoner emboli, hiponatremi, kreatinin yükselmesi ve asemptomatik QTc uzaması saptanmıştır. Tedavi ile ilişki en sık görülen yan etkiler %45 oranında nötropeni, %44 lökopeni, %43 bulantı ve %42 yorgunluk bulunmuştur. Yarı ömrü yaklaşık 36 saattir ve 40 hastadan alınan eşleştirilmiş deri biyopsilerinde sırasıyla %55 ve %42’sinde ki-67 de ve fosforile Rb de başlangıça oranla en az %50 azalma gözlenmiştir. Ribosiklib’in metabolizması hepatik yoldandır ve çoğunlukla sitokrom P450 (CYP) 3A4 aracılığıyla metabolize olması ve monooksigenaz 3 içeren flavinle metabolize edilen küçük bir bölümünün olması nedeniyle CYP3A4 inhibitörlerinin birlikte kullanımı ile toksitesi artabilir (29).
Endokrin tedavi postmenapozal ileri evre HR+, HER 2-, meme kanseri hastalarında aromataz inhbitörleri ile birlikte ilk hat seçilen tedavi seçeneğidir. Bununla birlikte hastaların çoğunda bu tedavilere direnç gelişmektedir. Bu da
22 alternatif tedavi rejimlerine gereklilik duyurmaktadır. CDK4/6 aşırı ekspresyonu ve CCND1 amplifikasyonu HR+ meme kanserlerinde sıklıkla görülmektedir ve bu endokrin tedaviye direnç gelişmesinde anahtar rol oynamaktadır. Ribosiklib’in tek ajan, letrozol ile kombinasyon formu ve fosfotidilinozitol-3-kinaz (PI3K) inhibitörleri ile birlikte xenograf modellerde anti tümör aktivitesi kanıtlanmıştır. ER+, HER-2-, ileri evre meme kanseri hastalarında yapılan faz 1 çalışmasında daha önce sistemik tedavi almayan hastaların ribosiklib+letrozol kombinasyonu ile sağlanan genel cevap oranı %46, klinik yarar oranı %79 olarak bulunmuştur (35).
Bir faz 3 çalışma olan MONALEESA-2 çalışmasında ER+, HER-2 negatif ileri ya da metastatik meme kanserinde letrozol ile ribosiklib kombinasyonun etkili olduğu gösterilmiştir ve 2017 yılında FDA tarafından onay almıştır (35).
2.10.5. Hücre Ölüm Yolakları
Canlıda yeni hücreler oluşurken, varolan hücrelerin bir kısmı da hücre ölümü ile ortadan kaldırılmakta, böylelikle sabit denge korunmaktadır. Varolan bu hücreler fizyolojik, programlanmış hücre ölümü olan apoptoz, patolojik hücre ölümü nekroz ve otofaji gibi çeşitli hücre ölüm tipleriyle yok olmaktadır (36).
2.10.5.1. Apoptoz
Apoptoz genel olarak hücrelerin kendi kendilerini yok ettikleri, genlerle düzenlenen, programlı, RNA, protein sentezi ve enerjiye gereksinim duyan, organizmada homeostazı koruyan bir olaydır. Apoptoz hücrenin kendini yok etmek için bir takım metabolik ve fizyolojik işlemleri devreye soktuğu bir olaydır. Apoptoz uyarısı alan hücre bulunduğu ortamdan uzaklaşır, komşu hücrelerle bağlantısını koparır ve büzüşür (36). Apoptozun düzenlenmesinde kalsiyum, seramid, Bcl-2 ailesi gibi moleküller, p53, kaspazlar, sitokrom-c gibi proteinler ve mitokondriyonlar rol oynar.
Bcl-2 ailesi proapototik ve antiapoptotik olmak üzere birbirine zıt iki gruptan oluşmaktadır. Proapoptotik üyeler Bad, Bax, Bid, BclXs, Bak, Bim, Puma ve Noxa’dır. Bu proteinler sitozolde yer alırlar. Sitokrom-c ve AIF
23 (Apoptoz indükleyici faktör) salınımını artırarak apoptozu indüklerler. Antiapoptotik üyeler ise Bcl-2, Bcl-xL ve Mcl-1’dir. Bu proteinler de mitokondriyon dış membranında, endoplazmik retikulumda ve çekirdek zarında yer alırlar ve kaspazların öncü formlarıyla AIF ve sitokrom-c salınımını bloke ederek apoptozu inhibe ederler (37).
P53 hücrede DNA hasarı oluştuğunda hücre siklusunu G1 fazında durdurup hücreye DNA tamiri için zaman veren bir transkripsiyon faktörüdür. Hasar tamir edilemeyecek durumda ise Bax, Apaf-1 ve Fas yapımını artırıp Bcl-2 ve Bcl-xL’yi baskılar ve apoptozu indükler (24).
FAS (APO-1 veya CD95) 24 üyeli tümör nekrozis faktör (TNF) reseptör ailesinin en iyi tanımlanmış üyesidir. Bağışıklık sisteminde hücre ölümünü kontrol eden Fas hücre reseptörü sitotoksik T hücreleri ve naturel killer hücreleri üzerinde bulunur. Fas proteini hücre yüzeyinde kendi reseptörüne bağlanır ve reseptör trimerizasyonunu sağlar. Aktive olmuş reseptörler FADD reseptör molekülü ile birleşir ve prokaspazlar aktive olur ve apoptoz başlar (37).
Kaspazlar, sistein proteazlardır ve aspartik asitten sonraki peptid bağını kırarlar. Hücrede inaktiftirler, ancak proteolitik olarak birbirlerini aktifleştirirler. 100 farklı hedef proteini keserek apoptoza neden olurlar. Başlatıcı kaspazlar; (Kaspaz 2,8,9,10), Efektör kaspazlar (Kaspaz 3,6,7), İnflamatuar kaspazlar (Kaspaz 1,4,5,11,12,13,14) dır. DNA tamiri ve replikasyonu için gerekli enzimleri inaktive ederler ve apoptozu indüklerler (37).
2.10.5.2. Nekroz
Rastgele gelişen, genler tarafından kontrol edilemeyen düzensiz bir süreçtir. En yaygın nedeni hipoksidir. Arsenik, siyanid, insektisitler gibi toksik maddeler ve ağır metaller nekroza neden olur. Nekroz sırasında mitokondriyal ROS üretimi artar, nonapoptotik proteazlar aktive olur, ATP üretimi azalır ve Ca++ kanalları açılır.
24 Nekroz Tipleri; Koagülasyon nekrozu Likefaksiyon nekrozu Kazeöz nekroz Yağ nekrozu Kangrenöz nekroz Fibrinoid nekroz
Fas, TNF reseptörlerinin aktivasyonu veya hücresel stres sonucu RIP1 ve RIP3 (Receptor interacting proteinler) aktive olur. RIP1 ve RIP3 mitokondriyonu ya direkt aktive eder ya da nikotinamid adenin dinükleotit fosfat (NADPH) oksidazın oluşturduğu ROS ile indirekt olarak etkileyip nekrozu indükler. Nekrotik uyarı ayrıca PARP’i aktive eder. PARP1 de kalpain aktivasyonu, RIP kinazların aktivasyonu ya da PAR polimerazlar yoluyla nekroza neden olur. PAR polimeraz ve kalpain, AIF salınımını sağlayarak nekrotik hücreleri indüklerler (38).
2.10.5.3. Otofaji
Bir vakuol içine alınan hücre içi makro moleküllerin ve organellerin primer lizozomlarla kaynaşıp parçalanması ile gerçekleşen bir mekanizmadır. Bu yolla anabolik ve katabolik hücre fonksiyonları dengelenir, istenmeyen gereksiz organeller ortadan kaldırılır. Sindirilen organel komponentleri geri dönüştürülerek, hücre büyümesi ve gelişmesi için kullanılır. Sitoplazmanın bir kısmı ya da bir organel ilk önce endoplazmik retikulumun ekstrasellüler membranı ile sarılır. Primer lizozomlar bu yapıyla birleşir ve sekonder lizozom yani otofajik vakuol (otozom=otofagozom) meydana gelir ve hidrolitik enzimlerle parçalanır. Apoptozdan farklı olarak çekirdek yoğunlaşması çok daha sonra gerçekleşir. DNA kırıkları ve apoptotik cisimcik oluşumu gözlenmez. Günümüzde mikrootofaji, makrootofaji ve şaperonlar ile düzenlenen otofaji olmak üzere otofajinin 3 farklı tipi tanımlanmıştır. Makrootofaji, sitosolik bileşenlerin ve organellerin lizozomlarda yıkıldığı asıl tiptir ve genellikle “otofaji” kullanıldığında makrootofajiden bahsedilir. Otofajik süreçte ilk basamak, yeniden düzenlenebilen izole edilmiş membranların
25 (isolated membranes veya phagophores - fagoforlar) görülmesidir. Bunun ardından otofagozom olarak tanımlanan ve sitoplazmanın bir kısmını içerebilen çift zarlı yapılar oluşur. Otofagozomal zarın, endoplazmik retikulumun katlanmasıyla meydana geldiği düşünülmektedir. Bu işlemin sonunda otofagozom lizozomla kaynaşarak, izole edilen materyalin lizozomal asit hidrolazlarca yıkıldığı “otofagolizozom”lar oluşturulur. Bu işlemin ardından zarın permeazlar tarafından yıkılmasıyla metabolik öncü moleküllerin sitosole salınması gerçekleşir. Otofaji sırasındaki moleküler makine “otofaji ile ilişkili genler (autophagy-related genes - ATG)” ve bu genlerden sentezlenen proteinler ile organize edilir. Bilinen 30’dan fazla proteinin bu süreçte görev almaktadır. Bu proteinler 3 başlık altında toplayabiliriz. (1) ATG1/ULK1 (Unc51-like autophagy-activating kinase 1) kompleksi ve düzenleyicileri, (2) Beclin-1/fosfatidil-inositol-3 kinaz sınıf III compleksi ve (3) Atg5-Atg12 ve LC3 konjugasyon sistemi. Bu proteinlerin hücre içi başka proteinlerle etkileşime girerek otofajinin hücresel strese bağlı olarak, adaptif cevap oluşturarak hücrenin hayatta kalmasına katkı sağlayabildiği veya hücre ölümüne neden olabildiği gösterilmiştir (39).
26 3. GEREÇ VE YÖNTEM
3.1. Hücre Hatlarının Temini, Çoğaltımı Ve İdamesi
İnsan meme kanseri hücre hatları MCF-7 ve BT474 sağlıklı meme hücre hattı Tülay Aktaş Onkoloji Hastanesi Tıbbi Onkoloji Araştırma Laboratuvarı’nın ICLC (Interlab Cell Line Collection, İtalya) ve HPA (Health Protection Agency, İngiltere)’den temin ettiği ve çoğaltarak -80 °C’de stokladığı kanser hücre hatları panelinden temin edildi. MCF-7 hücre hattı, 37°C ve %5 CO2’li, nemli inkübatörde, stabil L-glutamin içeren RPMI-1640 besiyerine %1 nonesansiyel aminoasitler, %10 ısı ile inaktive edilmiş fetal sığır serumu, 10 000 unite/ml penisilin ve 10 mg/ml streptomisin eklenerek çoğaltıldı. BT474 hücre hattı, DMEM/F12 (Dulbecco’s modified Eagle’s minimal essential medium) besiyerine %20 fetal sığır serumu, 10.000 ünite/ml penisilin ve 10 mg/ml streptomisin eklenerek, 37°C sıcaklıkta, %5 CO2 ve nem içeren inkübatörlerde çoğaltıldı. Hücre kültür işlemleri steril laminar hava akımlı çalışma kabininde gerçekleştirildi. -80°C’de saklanan MCF-7, BT474 hücreleri 37°C su banyosunda çözüldü ve 75 cm2’lik hücre kültür flasklarına aktarıldı. Kültür flasklarına 10 ml besiyeri eklendi ve inkübatöre koyulmadan önce kapakları hafifçe gevşetilerek, CO2 girişi sağlandı. Hücreler, 37°C, %5 CO2 içeren nemli inkübatörde (NuAire, ABD) çoğaltıldı. Kültür flasklarının tabanına tutunarak çoğalan hücreler, inverted mikroskop yardımıyla, günlük olarak canlılık, çoğalma ve enfeksiyon yönünden izlendi. MCF-7 ve BT474 hücrelerinin ikilenme süreleri sırasıyla 30 ve 28 saat olarak tespit edildi ve pasajlar ikilenme sürelerine uygun olarak gerçekleştirildi.
3.2. Hücrelerin Sayımı ve Deney Planına Göre Ekimi
Hücre sayısı; besiyerinin mililitresi başına veya tutunulan yüzeyin santimetreküpü başına düşen hücre sayısı olarak belirtilebilir. Flasklar içinde inkübe edilmiş olan MCF-7 ve BT474 hücreleri yapıştıkları yüzeyden kalkması için tripsin EDTA(Ethylenediaminetetraacetic acid) ile muamele
27 edildi. Hücreler kalkınca besiyeri ile nötralize edilip, tüpte santrifüje edildi. Altta kalan hücre çökeltisi besiyeri ile dilüe edilip homojenize edildi.
Hücre sayımı için trypan blue dye exclusion test uygulandı. Hücre içeren süspansiyon ve trypan blue solüsyonu 1:1 oranında karıştırıldı ve otomatik sayım cihazının (Cellometer) lamına mikropipet yardımıyla aktarıldı. Hücre sayımı otomatik olarak yapıldı. Canlı hücreler, trypan blue boyasına geçirgen olmadıkları için parlak, ölü hücreler ise bu boyayı hücre içine çektikleri için mavi renkte görünürler.
Canlı hücre sayımından sonra, deneyi yapacağımız 96 kuyucuklu hücre kültür plaklarında her bir kuyucuk içine 10.000 hücre gelecek şekilde MCF-7-BT474 hücrelerinin ekimi yapıldı. Deneyde her bir ilaç konsantrasyonu ve kombinasyonları üçlü kontrolle çalışılacağı ve 24-48-72. saatlerde de tek ajan değerlendirmeleri yapılacağı için, aynı zamanda pozitif kontrol (sadece hücre içeren) ve negatif kontrol (sadece besiyeri içeren) kuyucuklar da hazırlanacağı için, deney planına göre uygun sayıda kuyucuk içine hücre ekim işlemleri tamamlandı. Hücre ekilen 96 kuyucuklu hücre kültür plakları, hücrelerin tabana yapışması için 37°C ısı, %95 nem ve %5 CO2 içeren inkübatörde 24 saat inkübe edildi.
3.3. Palbosiklib ve Ribosiklib’in Temini Ve Solüsyonlarının Hazırlanması
Palbosiklib (PD0332991) liyofilize halde Selleckchem (Almanya)’den temin edildi. 5 mg toz Palbosiklib 1.7432 ml DMSO (dimetilsülfoksit) içinde çözülerek Palbosiklib’in 5 mM’lık stok solüsyonu hazırlandı.
Ribosiklib (LEE011) liyofilize halde, Selleckchem (Almanya)’den temin edildi. 5 mg toz Ribosiklib, 2.0411 ml DMSO (dimetilsülfoksit) içinde çözülerek Ribosiklib’in 5 mM’lık stok solüsyonu hazırlandı.
Hazırlanan stok solüsyonlar 0.22 μm’lik filtreden geçirilerek sterilize edildi ve 100 μl’lik parçalar halinde -80°C ‘de saklandı. Her deney için taze stok kullanıldı.
28 3.4. Hücre Canlılığının Belirlenmesi
Palbosiklib ve Ribosiklib’in ayrı ayrı sitotoksik etkilerinin gösterilmesi ve hücre canlılığının belirlenmesi için XTT testi kullanıldı.
XTT: Hücre proliferasyonu ve sitotoksisite tayini için XTT Hücre Canlılık Kiti (Roche, Almanya) kullanıldı. XTT metodu ilk kez 1988 yılında Scudiero tarafından tanımlanmıştır. Tetrazolium tuzuna dayanan kolorimertrik bir metoddur. Tetrazolium tuzlarından biri olan XTT [ 2,3-Bis( 2-methoxy-4-nitro-5- sulfophenyl)-2H-tetrazolium-2-methoxy-4-nitro-5-carboxanilide] hücre canlılığı ölçümünde sıklıkla kullanılan bir yöntemdir. Ribosiklib ve Palbosiklibin farklı konsantrasyonlarda (5-10-25-50-75-100 ϻM) 24 ve 48 saat inkübasyonları sonucu hücrelerdeki sitotoksik etkilerini belirlemek üzere XTT testi (Roche, Almanya) kullanıldı. XTT solüsyonu sodyum 3’- [1-(fenil-aminokarbonil)- 3, 4-tetrazolyum]- bis (4-methoksi-6-nitro) benzen sülfonik asit hidrat ile N-metil dibenzopirazin metil sülfat’ ın 50:1 oranında karıştırılması ile hazırlandı. Her bir kuyucuğa toplam hacmin (200 μl) yarısı kadar (100 μl) XTT solüsyonu eklendikten sonra 96 kuyucuklu hücre kültür plakaları 37°C’de ve %5 CO2 ihtiva eden inkübatörde 4 saat inkübe edildi. Dört saat sonunda her kuyucuğun absorbans değeri 450-490 nm referans dalga boyu aralığında mikro plaka okuyucuda (DTX 880 Multimode Reader, Beckman Coulter, ABD) ölçüldü.
% Sitotoksisite = 1 – [(İlaçlı Kuyucukların Absorbans Ortalaması / Pozitif Kontrol Kuyucuklarının Absorbans Ortalaması ) x100] formülü ile hesaplandı. Absorbans değerlerinden yukarıdaki formül kullanılarak hesaplanan sitotoksisite yüzdeleri CalcuSyn 2.0 (Biosoft, İngiltere) programına girildi. Her ilacın doz etki tablosu ve eğrisi çizilerek hücrelerin %50’ sini (IC50) öldüren konsantrasyonlar hesaplandı.
3.5. Apoptozis Belirteçlerinden Histon-DNA Fragmantasyonunun Belirlenmesi
Palbosiklib ve Ribosiklib’in tek başlarına sitotoksik oldukları konsantrasyonlarda bu etkinin apoptoza bağlı olup olmadığını belirlemek üzere Cell Death Detection ELISA Plus Kit (Roche Applied Science,
29 Germany) kullanıldı. Bu kit hücrelerdeki DNA fragmantasyon miktarının ölçülmesi için tasarlanmıştır ve apoptotik hücrelerin sitoplazmasındaki histonlarla paketlenmiş olan DNA fragmanlarını ölçmektedir. İlaçlarla tek ve kombine olarak muamele edilen hücrelerden ve ilaç eklenmeyen kontrol hücrelerinden elde edilen hücre lizatları kitin içerdiği streptavidin kaplı plakalara eklendi. Histon proteinleri ve DNA fragmanlarına karşı (Anti-histon biotin ve Anti-DNA-Peroksidaz) antikorları içeren reaktiften 80 μl eklenen plaka, oda sıcaklığında 2 saat inkübe edildi. İnkübasyon sırasında anti-histon antikoru bir taraftan nükleozomlardaki histonlara tutunurken bir taraftan da oluşan immunkompleksler, streptavidin kaplı plakalara tutunmaktadır. Anti-DNA-Peroksidaz antikoru ise nükleozomlar arasındaki DNA’ lara bağlanır. Bağlanmayan bileşenlerin yıkama basamaklarıyla uzaklaştırılmasından sonra nükleozomların miktarının kalitatif olarak belirlenmesi immunokomplekslere tutunmuş olan peroksidazların ölçülmesiyle gerçekleştirilir. POD, ABTS substratı ile 405 nm ve 490 nm referans dalga boyunda çok modlu plaka okuyucuda ölçüldü (DTX 880 Multimode Reader, Beckman Coulter, ABD). Kitin ihtiva ettiği ve %100 apoptotik hücre lizatlarında histon ve DNA fragmanları miktarındaki artış, apoptoz miktarındaki artışla doğru orantılı olarak değerlendirildi.
3.6. Apoptozis ile İlişkili Proteinlerin Antikor Array Yöntemi ile Belirlenmesi
Çeşitli ilaçların ve kimyasalların hücre kültürlerindeki sitotoksik etkilerinin hangi apoptotik proteinler üzerinden gerçekleştiğini anlamada protein antikor yöntemi (çoklu western) güncel bir yaklaşımdır. Çok sayıda western blot yapmaya gerek kalmaksızın 35 adet apoptotik proteinin göreceli ekspresyon miktarları eşzamanlı olarak ve motif temelli olarak ölçülebilmektedir. Palbosiklib ve Ribosiklib’ in ardışık kombinasyonu ile inkübe edilen her iki hücre hattında, apoptozisle ilişkili proteinlerin ekspresyon düzeyleri, Human Apoptosis Protein Array (R&D Systems, Ġngiltere) ile ölçüldü. Öncelikle ilaçlarla 72 saat boyunca muamele edilen ve ilaçla muamele edilmeyen kontrol hücrelerinin lizatları elde edildi. Her bir monoklonal antikora spesifik olarak nitroselülöz membrana tutundurulmuş olan spesifik antikorları içeren membran bloke edilerek, örnekler eklendi ve
30 bir gece boyunca +4 0C’ de inkübasyona bırakıldı. Bağlanamayan proteinler, yıkama basamakları ile uzaklaştırıldı. Proteinlerin kemilüminesans yöntemiyle dedeksiyonunda, biotinlenmiş antikor ve streptavidin-HRP kullanıldı. Membranın tanımlanmış ve spesifik monoklonal antikor içeren alanlarında oluşan antikor antijen kompleksinden (spot) antijen miktarıyla doğru orantılı sinyal alındı. Spotların sayısal olarak analizi Koadarray 2.6 (Koada Tech, İngiltere) yazılımı ile yapıldı. Her bir spottan lokal arka zemin piksel ölçümü çıkarılarak ve ortalama yoğunlukları baz alınarak sayısal veriler elde edildi. İkişer spottan oluşan ilgili proteinlerin ekspresyonları ortalama ± standart sapmaları ve güven aralılığı verilerek Koadarray algoritmasına göre sayısallaştırıldı. Protein ekspresyon seviyelerinin belirlenmesinde limit olarak 1.5 kat baz alındı.
Çizelge 1. Protein Antikor Yöntemiyle Araştırılan Apoptozisle İlişkili 35 Protein (R&D Systems)
3.7. İstatistiksel Analiz
Bu çalışmada MCF-7 ve BT474 meme kanseri hücre hatlarında palbosiklib ve ribosiklibin farklı dozlarının tek başına ve ardışık uygulamasındaki olası sitotoksik, apoptotik etkilerine ait ölçüm değerlerinin her biri istatiksel işlemlerle analiz edildi.
Deneylerde, her bir ilacın tekli ve ardışık konsantrasyonları üçer kuyucukta test edildi ve her bir deney üç kere tekrarlandı. Her kuyucuğa ait absorbans değerleri, mikroplaka okuyucu tarafından ortalama absorbans ve
Bad TRAIL R1/DR4 PON2
Bax TRAIL R2/DR5 p21/CIP1/CDNK1A Bcl-2 FADD p27/Kip1
Bcl-x Fas/TNFSF6 Phospho-p53 (S15) Pro-Caspase-3 HIF-1 alpha Phospho-p53 (S46) Cleaved Caspase-3 HO-1/HMOX1/HSP32 Phospho-p53 (S392) Catalase HSP 32 PhosphoRad17(S635 cIAP-1 HSP27 SMAC/Diablo cIAP-2 HSP60 Survivin
Claspin HSP70 TNF RI/TNFRSF1A Clusterin HTRA2/Omi XIAP
31 ± SD değerleri olarak hesaplandı. Yüzde canlılığı gösteren bu absorbans değerleri, Excel programında sitotoksik yüzdeyi dolaylı olarak hesaplama şablonuna aktarıldı. Hesaplanan sitotoksik yüzde değerleri, CalcuSyn (Biosoft, Version 2.1) programına girildi. Sinerjistik, additif ya da antagonistik etkinin olup olmadığı CalcuSyn ile değerlendirildi. Her iki ilacın çeşitli konsantrasyonlarına ait doz cevap eğrileri, Graphpad Prism 5.0 istatistik yazılımında oluşturuldu. Sitotoksisitenin doz ve zamana bağlı artışı istatistiksel olarak linear regression ile değerlendirildi. Sitotoksik etki yüzdesi açısından tekli ilaç konsantrasyonları ile pozitif kontroller arasında anlamlı bir farklılığın olup olmadığı Bonferroni testi ile araştırıldı.
32
4. BULGULAR
4.1. MCF-7 ve BT474 Hücre Hatlarında Palbosiklib Ve Ribosiklib’in
Zamana Ve Doza Bağımlı Anti-Tümöral Etkilerinin Gösterilmesi Ve IC50
(%50 İnhibitör Konsantrasyon) Saptanması
Palbosiklib:
MCF-7 ve BT474 hücreleri 96 kuyucuktan oluşan (microtiter well plate) deney ortamına her kuyucukta 10.000 hücre bulunacak şekilde ekildi. Palbosiklib’ in beş farklı konsantrasyonunun (0,01 μM, 0,1 μM, 1 μM, 10 μM ve 100 μM) 24. saat, 48. saat ve 72. saatteki sitotoksisitesi belirlenecek şekilde deney planlandı. Deneye sadece besiyeri ve besiyeri ile birlikte hücre bulunacak şekilde iki adet pozitif kontrol eklendi. Pozitif kontroller ve farklı ilaç konsantrasyonlarının bulunduğu her deney iki defa tekrarlandı. Belirlenen konsantrasyonlarda Palbosiklib; MCF-7 ve BT474 hücrelerinin bulunduğu deney ortamına eklendi. 24. saat, 48. saat ve 72. saatlerde yukarıda bahsedildiği şekilde XTT metodu kullanılarak hücre canlılığı spektrofotometrik yöntemle yapıldı. 24, 48 ve 72. saatte gözlenen sitotoksisite ayrıca hesaplandı (Tablo 2-3).MCF-7 hücre hattında 24. saatte; 0,01 ϻM konsantrasyonda sırasıyla %100, 0,1 ϻM’ da %96, 1 ϻM’ da %94, 10 ϻM’ da %90, 100 ϻM’ da %55 oranında canlılık gözlendi (Grafik 1).
MCF-7 hücre hattında 48. saatte; 0,01 ϻM konsantrasyonda sırasıyla %97, 0,1 ϻM’ da %94, 1 ϻM’ da %90, 10 ϻM’ da %82, 100 ϻM’ da %50 oranında canlılık gözlendi (Grafik 1).
MCF-7 hücre hattında 72. saatte; 0,01 ϻM konsantrasyonda sırasıyla %95, 0,1 ϻM’da %90.2, 1 ϻM’ da %76, 10 ϻM’ da %42, 100 ϻM’ da %28 oranında canlılık gözlendi (Grafik 1).
33 Tablo 2: Palbosiklib’in MCF-7 Hücre Hattında Zamana Ve Doza Bağlı Sitotoksisite Oranları
Tablo 3: Palbosiklib’in BT474 Hücre Hattında Zamana Ve Doza Bağlı Sitotoksisite Oranları
Grafik 1: Palbosiklib’in MCF-7 Hücre Hattında 24, 48 ve 72.Saatlerde Değişen Konstantrasyonlarda Canlılık Yüzdeleri
BT474 hücre hattında 24. saatte; 0,01 ϻM konsantrasyonda sırasıyla %100, 0,1 ϻM’ da %98, 1 ϻM’ da %95, 10 ϻM’ da %90, 100 ϻM’ da %48 oranında canlılık gözlendi (Grafik 2).
0 20 40 60 80 100 120 0,01 μM 0,1 μM 1 μM 10 μM 100 μM % Canl ıl ık
MCF-7
24.saat 48.Saat 72.saat %canlılık Pozitif 0,01μM 0,1 μM 1 μM 10 μM 100 μM 24.saat 0 100 96 94 90 55 48.saat 0 97 94 90 82 50 72.saat 0 95 90,2 76 42 28 %canlılık Pozitif 0,01μM 0,1 μM 1 μM 10 μM 100 μM 24.saat 0 100 98 95 90 48 48.saat 0 98 94 92 85 45 72.saat 0 95 88,4 77 65 43,534 BT474 hücre hattında 48. saatte; 0,01 ϻM konsantrasyonda sırasıyla %98, 0,1 ϻM’ da %94, 1 ϻM’ da %92, 10 ϻM’ da %85, 100 ϻM’ da %45 oranında canlılık gözlendi (Grafik 2).
BT474 hücre hattında 72. saatte; 0,01 ϻM konsantrasyonda sırasıyla %95, 0,1 ϻM’ da %88.4, 1 ϻM’ da %77, 10 ϻM’ da %65, 100 ϻM’ da %43.5 oranında canlılık gözlendi (Grafik 2).
Grafik 2: Palbosiklib’in BT474 Hücre Hattında 24, 48 Ve 72.Saatlerde Değişen Konstantrasyonlarda Canlılık Yüzdeleri
Sonuç olarak Palbosiklib’in MCF-7 ve BT474 hücre hattında sitotoksik etkisinin; doza ve zamana bağımlı olarak arttığı ve bu artışın istatistiksel olarak anlamlı olduğu görüldü (Tablo 2,3) (p <0,005)
72. saatte tespit edilen sitotoksisite yüzdeleri Calcusyn programına girilerek Palbosiklib’in IC50 değeri hesaplandı. Bu programa göre Palbosiklib’in 72. saatte; MCF-7 ve BT474 hücre hatlarındaki IC50 değerleri sırasıyla 10,6 μM ve 33,5 μM olarak belirlendi.
Ribosiklib: MCF-7 ve BT474 hücreleri 96 kuyucuktan oluşan (microtiter well plate) deney ortamına her kuyucukta 10.000 hücre bulunacak şekilde ekildi. Ribosiklib’in beş farklı konsantrasyonunun (0,5 μM, 1 μM, 5 μM, 10 μM ve 20 μM) 24. saat, 48. saat ve 72.saatteki sitotoksisitesi belirlenecek şekilde
0 20 40 60 80 100 120 0,01 μM 0,1 μM 1 μM 10 μM 100 μM % C anlı lık