T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ORTOPEDİ VE TRAVMATOLOJİ ANABİLİM DALI
Epidermal Büyüme Faktörü, Hiperbarik oksijen
ve Tetanoz toksini uygulamasının ratlarda spinal
kord yaralanma modelinde iyileşmeye etkisi
UZMANLIK TEZİ
Dr. Murat Celal SÖZBİLEN
Tez Danışmanı Prof. Dr. Halit ÖZYALÇIN İZMİR- 2016
TEŞEKKÜR
Bu çalışma, Türk Ortopedi ve Travmatoloji Birliği Derneği’ nin alt kuruluşu olan Türk Ortopedik Araştırma Konseyi (TOAK) tarafından değerlendirilmiş ve desteğe layık görülmüştür.
Çalışmanın hazırlanmasında ve devamında desteğini esirgemeyen değerli tez danışmanım Prof. Dr. Halit ÖZYALÇIN’a ve Op. Dr. Murat ÖZTÜRK’e teşekkür ederim. Proje ekibinde yer alan ve bu çalışma sırasında bilgilerini ve desteklerini esirgemeyen Fizyoloji ABD öğretim üyesi Prof. Dr. Taner DAĞCI’ya, Eczacılık Fakültesi öğretim üyesi Doç. Dr. Güliz ARMAĞAN’a ve Uzm. Dr. Figen AYDIN’a teşekkür ederim.
Çalışma süresince, asistanlık ve tüm eğitim hayatım boyunca beni hep destekleyen sevgili eşim Gözde Seval SÖZBİLEN ve aileme teşekkür ederim.
İÇİNDEKİLER
TABLOLAR DİZİNİ ... vii ŞEKİLLER DİZİNİ ... viii RESİMLER DİZİNİ ... x KISALTMALAR DİZİNİ ... xi BÖLÜM 1. GİRİŞ VE AMAÇ ... 1 BÖLÜM 2.GENEL BİLGİLER ... 3 2.1. Omurilik Embriyolojisi ... 3 2.2. Omurilik Anatomisi ... 4 2.2.1. Makroskopik Görünümü ... 42.2.2. Medulla Spinalis İç Yapısı ... 5
2.2.3. Omuriliğin Vasküler Yapısı ... 6
2.3. Omurilik Travmasının Tarihçesi ... 8
2.4. Fizyopatoloji ... 9
2.4.1. Birincil (Primer) Hasar Mekanizmaları ... 9
2.4.2. İkincil (Sekonder) Hasar Mekanizmaları ... 10
2.4.2.1 Vasküler Mekanizmalar ve Endotel Hasarı ... 12
2.4.2.2. Eksitotoksite ... 13
2.4.2.3. Serbest Radikal Oluşumu ve Lipid Peroksidasyonu ... 14
2.4.2.4. Nitrik Oksit ... 16
2.4.2.5. Araşidonik Asit Metabolizması ... 18
2.4.2.6. İnflamatuar Cevap ... 19
2.4.2.7. Sekonder Hasarda Elektrolit İlişkisi ... 19
2.4.2.8. Apoptoz ... 22
2.4.2.9. Azalmış ATP Üretimi ... 26
2.5. Omurilik Travmasında Patolojik Değişiklikler ... 26
2.5.1. Makroskopik Görünüm ... 26
2.6. Spinal Kord Yaralanmasında Tanı ve Sistemik Komplikasyonlar ... 29
2.6.1. Tanı ... 29
2.6.2. Komplikasyonlar ... 33
2.6.2.1. Otonomik Disrefleksi ... 33
2.6.2.2. Derin ven trombozu ve solunum problemleri ... 33
2.6.2.3. Nörojenik mesane ... 34
2.6.2.4. Spastisite ... 34
2.6.2.5. Bası yaraları ... 34
2.6.2.6 Heterotopik Ossifikasyon ... 34
2.7. Omurilik Travmasında Patolojik Değişiklikler ... 34
2.7.1. Metilprednizolon ... 35
2.7.2. Trilazadlar ... 36
2.7.3. Opioid Reseptör Antagonistleri ... 36
2.7.4. Eksitatör Aminoasit Antagonistleri ... 36
2.7.5. Kalsiyum Kanal Blokerleri ... 37
2.7.6. Sodyum Kanal Blokerleri ... 37
2.7.7. Potasyum Kanal Blokerleri ... 37
2.7.8. Magnezyum ... 38
2.7.9. Antioksidanlar ... 38
2.7.10. Tirotropin Salıcı Hormon (TRH) ve TRH Analogları ... 38
2.7.11. Eritropoetin ... 39
2.7.12. Hipotermi – Epidural Soğutma ... 39
2.8. Hiperbarik Oksijen Tedavisi (HBO)... 40
2.8.1. Tedavinin Uygulanması ... 40
2.8.2. Etki Mekanizması ve Teknik ... 41
2.8.3. Sinir Hücresi İyileşmesine Etkisi ... 42
2.8.4. Kan Akımı ve Oksijenizasyonuna Etkisi ... 42
2.8.5. Serbest Oksijen Radikal Oluşumuna Etkisi ... 43
2.8.6. Kan Hücreleri Üzerine Etkisi ... 43
2.8.7. İskemi ve Reperfüzyon Hasarında Doku Yaşayabilirliğine Etkisi ... 43
2.8.8. HBO Tedavisinin Endikasyonları ... 44
2.8.9. HBO Tedavisinin Kontrendikasyonları ... 44
2.9. Epidermal Büyüme Faktörü (EGF) ... 45
BÖLÜM 3. GEREÇ VE YÖNTEM ... 49
3.1. Materyal ... 49
3.2. Yöntem ... 51
3.2.1. Cerrahi Yöntem ve Klip Kompresyon Modeli ile OİH ... 51
3.2.2. Tetanoz ve EGF’in Hasar Sonrası Uygulanması ... 52
3.2.3. Metilprednizolon Uygulanması ... 53
3.2.4. Paraplejik Sıçanların Bakımı ... 53
3.2.5. Hiperbarik Oksijen Tedavisi ... 53
3.2.5.1. Omurilik Hasarı Sonrası HBO ... 55
3.2.6. Motor Performansı Değerlendirme ... 55
3.2.7. Ratların Sakrifiye Edilmesi ... 57
3.2.8. Kullanılan Biyokimyasal Yöntemler ... 57
3.2.8.1. Dokuların Homojenizasyonu ... 57
3.2.8.2. Protein Miktar Tayini ... 58
3.2.8.3 Protein Miktar Tayini Belirlenmesinde Kullanılan Standart Çözeltilerin Hazırlanması ... 59
3.2.8.4. SOD Enzim Aktivitesi Tayini ... 59
3.2.8.5. SOD Tayininde Kullanılan Standart Çözeltilerin Hazırlanması ve Örneklerin SOD Aktivitesinin Hesaplanması ... 60
3.2.8.6. Katalaz Enzim Aktivitesi Tayini ... 61
3.2.8.7. GPx Enzim Aktivitesi Tayini ... 62
3.2.8.8. Western Blot Yöntemi ... 62
3.2.9. İstatistiksel Değerlendirme Yöntemi ... 63
3.3. Etik Kurul Onayı ... 63
BÖLÜM 4. BULGULAR ... 64
4.1. Antioksidan Enzim Aktiviteleri ... 64
4.1.1. SOD Enzim Aktivitesi ... 64
4.1.2. Katalaz (CAT) Enzim Aktivitesi ... 65
4.1.3. GPx Enzim Aktivitesi ... 65
4.2. Apoptoz İle İlişkili Protein Düzeyleri ... 68
4.2.1. Bax ve Bcl-2 Protein Düzeyleri ... 68
4.2.2. Kaspaz-3 Protein Düzeyleri ... 68
BÖLÜM 5. TARTIŞMA ... 75
5.1. HBO Tedavisinin Spinal Kord Yaralanması Üzerine Etkisi ... 77
5.2. Tetanoz Toksininin Spinal Kord Yaralanması Üzerine Etkisi ... 81
5.3. EGF’in Spinal Kord Yaralanması Üzerine Etkileri ... 83
BÖLÜM 6. SONUÇ ... 86
KAYNAKLAR ... 87
TABLOLAR DİZİNİ
Tablo Sayfa
Tablo 1. Deneysel spinal kord yaralanması modelleri ... 9
Tablo 2. İkincil Yaralanma Mekanizmaları ... 11
Tablo 3. Omurilik hasarında yol gösteren klinik veriler ... 30
Tablo 4. ASIA /IMSOP hasar skalası ... 32
Tablo 5. UHMS tarafından belirlenen HBO endikasyon listesi ... 44
Tablo 6. BBB (Basso-Beattie-Bresnahan) lokomotor skalası... 56
Tablo 7. Omurilik hasarı (OİH) sonrası farklı tedavi gruplarının ve sham grubunun SOD enzim aktiviteleri (%İnhibisyon) ... 64
Tablo 8. OİH sonrası farklı tedavi gruplarının ve sham grubunun katalaz enzim aktiviteleri (mU/mL) ... 66
Tablo 9. OİH sonrası farklı tedavi gruplarının ve sham grubunun GPx enzim aktiviteleri U/mL) ... 67
Tablo 10. OİH sonrası farklı tedavi gruplarının ve sham grubunun Bax ve Bcl-2 protein düzeyleri ... 68
Tablo 11. OİH sonrası farklı tedavi gruplarının ve sham grubunun kaspaz-3 protein düzeyleri ... 69
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 1. İntrauterin 5½ haftada omuriliğin transvers kesiti ... 3
Şekil 2. Omuriliğin farklı seviyelerdeki transvers kesitleri ... 5
Şekil 3. Başlıca lif ve traktlar ... 6
Şekil 4. Anterior spinal arter, posterior spinal arter ve radiküler arter arasındaki anastomoz ... 7
Şekil 5. Omuriliğin venleri ... 7
Şekil 6. Akut SKY patogenezi ... 12
Şekil 7. Süperoksit dismutaz enziminin katalizlediği reaksiyon ... 15
Şekil 8. Serbest radikal oluşum kaynakları ... 16
Şekil 9. NO ve/veya peroksinitrit ilişkili nörotoksisite ... 18
Şekil 10. . Hücre içi Ca+2 artışı ve enzimlerin aktivasyonuna bağlı olarak gelişen biyomolekül hasarları ve hücre ölümü ... 21
Şekil 11. Apoptozda rol oynayan intrinsik ve ekstrinsik yolaklar ... 23
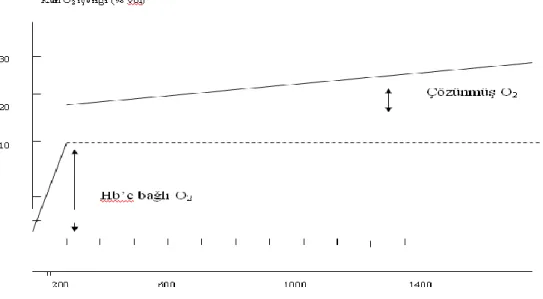
Şekil 12. PO2 ile kanın O2 ‘i arasındaki ilişki. ... 41
Şekil 13. EGF’nin yapısı. ... 46
Şekil 14. EGF Sinyalizasyon yolu. ... 46
Şekil 15. Tetanoz toksini c-terminal fragmanın tirozin kinaz reseptör aracılı sinyal mekanizması. ... 48
Şekil 16. Hiperbarik oksijen tedavisinin uygulanışı. ... 54
Şekil 17. SOD aktivite tayininde temel reaksiyon denklemi ... 60
Şekil 18. Katalaz aktivite tayininde temel reaksiyon denklemi. ... 61
Şekil 19. GPx aktivite tayininde temel reaksiyon denklemi ... 62
Şekil 20. Tedavi grupları, sham ve travma grubunun SOD enzim aktivitesi düzeyinin gösterilmesi ... 65
Şekil 21. Tedavi grupları, sham ve travma grubunun katalaz enzim
aktivitesi düzeyinin gösterilmesi. ... 66
Şekil 22. Tedavi grupları, sham ve travma grubunun GPx enzim aktivitesi düzeyinin (U/mL) gösterilmesi ... 67
Şekil 23. Bax protein düzeylerinin gösterimi ... 69
Şekil 24. Bcl-2 proteini düzeylerinin gösterimi ... 70
Şekil 25. Kaspaz-3 proteini düzeyleirnin gösterimi ... 71
Şekil 26. Denek gruplarının medulla spinalis bölgesindeki Bax, Bcl-2 ve Kaspaz-3 protein düzeylerinin western blot yöntemiyle gösterilmesi ... 72
Şekil 27. Tedavi gruplarının BBB lökomotor skalasına göre fonksiyonel skorlamalarının günler arasındaki değişimi ... 73
RESİMLER DİZİNİ
Resim Sayfa
Resim 1. Argefar hayvan bakım odası ve kafesleri ve operasyon odası ... 50
Resim 2. Sıçanların ağırlıklarının tartımı ve anestezi uygulaması ... 50
Resim 3. Cilt insizyonu, spinöz çıkıntılar ve paravertebral kasların gösterimi ... 51
Resim 4. Laminektomi safhası, spinal kordun ortaya konması, hasar sonrası kordun görüntüsü ... 52
Resim 5. EGF ve Tetanoz uygulaması ... 52
Resim 6. Hamilton enjektörü ... 52
Resim 7. Kafeslerdeki sıçanların görüntüsü... 53
Resim 8. Paraplejik sıçanlar beslenmesi ... 53
Resim 9. Mesane masajı uygulaması ... 54
Resim 10. Sıçanların perine temizliği batikonlu tampon ile yapıldı. ... 54
Resim 11. Çalışmada kullanılan Barotech DB1 AR-GE basınç odası ... 55
Resim 12. Sıçanlara BBB skorlaması yapılması ... 57
KISALTMALAR DİZİNİ
ADP --- Adenozin difosfatATA --- Absolute atmosfer ATP --- Adenozin trifosfat BBB--- Basso-Beattie-Breshnan BSA --- Sığır serum albumini BOS --- Beyin omurilik sıvısı CAT--- Katalaz
CPP --- 3-(2-karboksipiperazin-4-yl) propil-1-fosforik asit COX --- Siklooksijenaz
EAA --- Eksitotoksik aminoasit EGF--- Epidermal growth faktör EPO --- Eritropoietin
FGF--- Fibroblast growth faktör GABA --- Gama amino butirik asit GM-1 --- Monosialotetraheksosil GPx --- Glutatyon peroksidaz GR --- Glutatyon redüktaz HBO --- Hiperbarik oksijen HNE --- Hidroksinonenal H2O2 --- Hidrojen peroksit IL --- İnterlökin
LDH --- Laktat dehidrogenaz LPO --- Lipid peroksidasyonu MDA --- Malondialdehit MgCl2 --- Magnezyum klorür MgSO4 --- Magnezyum sülfat
NASCIS--- National Acute Spinal Injury Study NGF--- Nöral growth faktör
NMDA --- N-metil-D-aspartat NO --- Nitrik oksit
nNOS --- Nöronal nitrik oksit sentaz eNOS --- Endotelial nitrik oksit sentaz NR --- Nitrat redüktaz
O2ˉ --- Süperoksit radikali OHˉ --- Hidroksil radikali OİH --- Omurilik hasarı
pO2 --- Parsiyel oksijen basıncı PSS --- Periferik sinir sistemi SKY --- Spinal kord yaralanması SOD --- Süperoksit dismutaz SSS --- Santral sinir sistemi TT --- Tetanoz toksini TNF --- Tümör nekrozis faktör TRH --- Tirotropin salıverici hormon TXA2 --- Tromboksan A2
XOD --- Ksantin oksidaz
ÖZET
Spinal kord yaralanması, kordun major fonksiyonlarında yitime neden olmakla birlikte, sonuçları açısından da büyük bir sosyal problemdir. Omurilik yaralanmalarında en etkin tedavi, kaçınılmaz olan çarpma etkisiyle başlayan ikincil hasarın önlenmesidir. Bu hasarda en önemli tedavi hedefleri ise apoptotik hücre ölümünün engellenmesi ve rejenerasyon mekanizmalarıdır. Bu çalışmada, hiperbarik oksijen (HBO) uygulaması, tetanoz toksini (TT) ve epidermal büyüme faktörünün (EGF), apoptotik kaskadların önlenmesindeki ve antioksidan mekanizmaları ile motor nöron koruyucu etkilerinin değerlendirilmesi amaçlanmıştır.
Bu çalışmada, üç tedaviyi karşılaştırma amacıyla altı grup Sprague Dawley tür ratlar (HBO, TT, EGF, metilprednizolon-pozitif kontrol, travma ve sham) üstünde çalışılmıştır. Sham grubu hariç tüm gruplara T4-T10 vertebra seviyesinden anevrizma klibi ile ekstradural olarak kompresyon uygulanarak spinal kord yaralanması yaratılmıştır. Tetanoz ve EGF tedavileri travmadan hemen sonra, HBO ise ilk birinci saat içinde olmak üzere yedi gün boyunca aynı saatte uygulanmıştır. Fonksiyonel değerlendirme için BBB (Basso-Beattie-Bresnahan) skorları günlük olarak kaydedilmiştir. Akut ve subakut dönemin sonunda (8. gün) sakrifiye edilen ratların spinal kord örneklerinde, SOD, GPx ve katalaz anti-oksidan enzim aktiviteleri ölçülmüştür. Apoptoz değerlendirmesi amacıyla ise bax, bcl-2 ve kaspaz-3 protein miktarı western blot yöntemiyle saptanmıştır.
HBO uygulamasının SOD ve GPx enzim aktiviteleri ile fonksiyonel skorları anlamlı şekilde yükselttiği görüldü (p<0.05). Western blot analizinde ise kaspaz-3 ve bax proteinlerini yükselterek mitokondri aracılı apoptozu arttırdığı tespit edildi (p<0.05). EGF uygulamasında antioksidan enzim aktivitelerinin anlamlı artışına karşın (p<0.05), apoptoz ve fonksiyonel açıdan diğer gruplarla karşılaştırıldığında etkisiz olduğu görüldü (p<0.05). Tetanoz toksini uygulamasının fonksiyonel skorları ve antioksidan enzim aktivitelerini anlamlı düzeyde arttırdığı tespit edilmiştir (p<0.05). HBO uygulanan gruptan farklı olarak ise, anti-apoptotik bcl-2 düzeyini arttırıp, apoptotik bax ve kaspaz-3 protein düzeyini ise anlamlı şekilde azalttığı; böylece apoptozu engellediği görülmüştür (p<0.05).
HBO tedavisi serbest oksijen radikalerini uzaklaştırması ve fonksiyonel iyileşmeyi arttırması nedeniyle iyi bir tedavi seçeneği olarak görülmüştür; ancak apoptozu arttırdığı mekanizmanın gelecek çalışmalarla açıklanması gerekmektedir. Tetanoz toksininin motor nöron koruyucu ve iyileştirici etkisi ortaya konmuş olup, her üç değerlendirmedeki sonuçlarıyla tedavide etkin bir ajan olarak kullanılması beklenmektedir
ABSTRACT
Spinal cord injury, is a major social problems in terms of its consequences, causes the loss of many functions of cord. The most effective treatment in spinal cord injuries is the prevention of secondary injury that commences with the crush The regeneration mechanisms and the prevention of apoptotic cell death are the most important aims of treatment in this injury.
In this study, the effects of hyperbaric oxygen therapy (HBO), tetanus toxin (TT) and epidermal growth factor (EGF) on the prevention of apoptotic cascades and motor neuron protective effects of these treatments through their antioxidant mechanisms were evaluated. For the purpose of the comparison of three treatments, Sprague Dawley rats were divided into six groups (HBO, TT, EGF, Metilprednizolon as positive control, trauma and sham). Spinal cord injury was examined in all rats except for sham group, after the extradural compression was performed at T4-T10 vertebra by Yasargil aneurysm clip. TT and EGF treatment were applied just after the trauma, while HBO therapy was given in the first hour of trauma and it continued during 7 days. Functional evaluation of rats were assessed daily by using Basso-Beattie-Bresnahan (BBB) locomotor scale. Superoxide dismutase (SOD), glutathione peroxidase (GPx) and catalase enzymes activities were measured in the spinal cord samples of rats that were sacrified at the end of acute and subacute period which was the 8th day of trauma. The measurement of bax, bcl-2 and caspase-3 were conducted by western blot method in order to reveal apoptosis.
The increase in the activities of SOD, GPx and scores of functional evaluation by HBO was significant (p<0.05). Besides, HBO led to upregulate the level of caspase-3 and bax; therefore it increased apoptosis through mitochondrial pathway (p<0.05). EGF caused significant increase in antioxidant enzyme levels (p<0.05), while it is not sufficiently effective with regard to apoptosis and functional evaluation compared to other treatment groups (p>0.05). TT also significantly increased both the level of enzyme activities and functional scores (p< 0.05). In contrast to HBO, TT significantly increased the level of bcl-2, but it decreased apoptotic proteins of bax and caspase-3 (p<0.05).
As a conclusion, HBO treatment was found to be beneficial in the removal of reactive oxygen species and neurologic recovery. However, HBO-induced apoptosis mechanism needs to be revealed by future studies. Neuro-protective and healing effects of TT have been demonstrated by all evaluations and TT is expected to be an effective agent in the treatment of spinal cord injury.
BÖLÜM 1
GİRİŞ ve AMAÇ
Spinal kord yaralanması, kordun major fonksiyonlarında (motor, duyu, otonomik ve refleks) yitime neden olmakla birlikte, aynı zamanda sonuçları açısından da büyük bir sosyal problemdir. Spinal kord travmalı hastaların yaklaşık yarısı komplet yaralanmaya sahiptir ve lezyon altında istemli motor ya da duysal fonksiyon korunmamıştır. Medulla spinalis yaralanmaları yüksek oranda morbidite ve mortalite oluşturan, sosyoekonomik sorunları da beraberinde getiren travma grubunu oluşturur. Günümüzde teknolojinin gelişmesi ve motorlu taşıtların çoğalması ile artan trafik kazaları medulla spinalis yaralanmalarının daha fazla görülmesine neden olmuştur. Medulla spinalis yaralanmaları en çok genç erişkinleri etkilemekte ve 16-30 yaşları arasında daha sık görülmektedir. Vakaların yaklaşık yarısında komplet nörolojik defisit bulunurken; bunların % 54’ü kuadriplejik, % 46’sı ise paraplejiktir (1).
Akut omurilik yaralanmasının tedavisi için harcanan çabalar, çağdaş yaklaşıma olumlu katkılarda bulunmaktadır; ancak kalıcı ve anlamlı derecede etkili ve aynı zamanda evrensel bir tedavi protokolü geliştirilememiştir (2, 3). Bu hastaların yaşam boyu süren tedavi ve bakım masrafları, işgücü ve gelir kayıpları ile yaşadıkları sosyal ve psikolojik sorunlar, ne kadar ciddi bir sağlık problemi ile karşı karşıya olduğumuzu göstermektedir (4).
Omurilik yaralanması, omurilikteki yaralanma bölgesinde sınırlı kalan bir patoloji oluşturmakla kalmayıp, pek çok organı ve sonuçta tüm organizmayı etkileyen patolojik olaylar zincirini başlatır. Dolaşım sistemi, solunum sistemi, sindirim sistemi, ürogenital sistem ve hatta endokrin ve immünolojik sistemler üzerine oluşturduğu etkiler nedeni ile ağır patolojik durumlara ve hatta ölüme neden olabilir. Bu nedenle omurilik yaralanmalarında acil müdahale, nöroprotektif tedavi ve cerrahi tedavi kadar diğer sistemlerin korunmasına yönelik, destek tedavilerinin de önemi büyüktür (1).
Erişkinlerde omurilik yaralanmasından sonra aksonal rejenerasyon ve fonksiyonel iyileşme genellikle çok sınırlıdır. Otopsi çalışmaları, omurilik yaralanmalarının çoğunda klinik olarak tam yaralanma olsa dahi omuriliğin anatomik olarak sağlam kaldığını göstermiştir. Ayrıca, deneysel çalışmalar, spinal aksonların %12 kadar az bir oranının korunmasının, nörolojik iyileşmeyi destekleyeceğini göstermektedir (1,3). Hasarlı bölgeyi geçebilen fonksiyonel akson oranını arttıran ya da bu aksonlardan gelen zayıf uyarılara alt
motor nöronların yanıtını arttırıcı her türlü müdahale, nörolojik iyileşmede belirgin etki gösterebilir (5).
Travmatik omurilik yaralanmasında birincil zedelenme travma anında olan zedelenmedir. İkincil zedelenme ise oluşan birincil zedelenmenin başlattığı saatler içerisinde gelişen, metabolik ve biyokimyasal nedenlerle oluşan hasarlardır. İkincil zedelenme mekanizmaları arasında yer alan iki faktör serbest radikaller ve iskemi-reperfüzyon hasarıdır.
Literatürde deneysel olarak rekombinant epidermal büyüme faktörü, hiperbarik oksijen tedavisinin omurilik travma modeliyle oluşturulan omurilik yaralanmasında etkilerinin araştırıldığı çalışma sayısı çok kısıtlıdır. Günümüzde hücre apopitozisin ve akut enflamasyonunun engellenmesinde birçok alanda yaygın olarak kullanılan hiperbarik oksijenin tedavi seçeneklerinin son derece kısıtlı olduğu spinal kord iyileşmesine olumlu katkıda bulunabilir. (6,7).
Tetanoz toksinin yaralanmış sinir rejenerasyonu üzerine olan olumlu etkisi (özellikle siyatik sinir) son dönemde yapılan çok az sayıda yayında gösterilmiştir (8, 9, 10). Ancak spinal kord yaralanma modelinde rejenerasyona olan etkisiyle ilgili literatürde yayına rastlanmamıştır. Çalışmamızda; antioksidan, antiinflamatuar, etkileri olduğu bilinen bu üç tedavi yönteminin ratlarda deneysel omurilik travma modeli ile oluşturulan omurilik yaralanmasında koruyucu ve rejeneratif etkilerinin incelenmesi amaçlanmıştır.
BÖLÜM 2
GENEL BİLGİLER
2.1. Omurilik EmbriyolojisiSinir sistemi ektoderm katmanından meydana gelirken, gelişmesi embriyonik diskin oluşması ile başlar. Embriyonik gelişmenin 18. günlük evresinde nöral plak, tüp ve tepe oluşur. İlk olarak, orta hat notokord dokusu (blastoporun önünde yer alan) üzerinde yer alan baş uzantısının kalınlaşmasını ve bir nöral plak halini almasını indükler. Daha sonra plak üzerinde mid-sagital bir nöral çukur belirir. Bunun her iki yanında yer alan ektodermal doku, nöral tepenin nöral katlar halinde yüksek bir yapı haline dönüşmesine katkıda bulunmak üzere programlanmıştır (Şekil 1)(11).
Sinir sisteminin alar ve bazal plaklara bölünmesiyle oluşan kalıbı izleyerek gri cevherin arka sütun nöral hücreleri (alar) duysal işlevler ile ilgilenirken, yan-ön gri sütunlardaki hücreler (bazal) motor işleve sahiptir. (11).
Şekil 1: İntrauterin 5½ haftada omuriliğin transvers kesiti (Netter FH: Embriyoloji, The Netter Collection of Medical illustration Nervous System, Volume 1: Part I: Anatomy and Physiology, Ed: Brass A, Elsevier Saunders, 2007, pp: 130-147.’den Türkçeye çevrilerek alınmıştır).
2.2. Omurilik Anatomisi
2.2.1. Makroskopik Görünümü
Medulla spinalis atlasın üst kenarından başlar ve L2’ nin üst kenar sınırına kadar intervertebral disk düzeyinde yer alan konus medüllaris denilen yassılaşmış bir uçta sonlanır. Medulla oblongatanın uzantısı olup, yaklaşık 46 cm kadardır. Duramater ve araknoid (dolayısıyla subaraknoid boşluk) ikinci sakral omura kadar uzanır. Konustan çıkan silindirik ve fibröz filum terminale ise koksiksin arkasına kadar uzanır (12).
Medulla spinalis, silindir şeklinde, ön-arka yönünde hafifçe yassıdır. Ekstremitelere giden sinirlerle ilgili segmentlere karşılık gelen servikal ve lomber genişlemeler gösterir. Üst ekstremiteyi inerve eden sinirler dördüncü servikalden ikinci torakal segmente kadar, alt ekstremite ise üçüncü lomberden üçüncü sakrale kadar olan segmentlerle ilişkilidir (12). Meninksler: Medulla spinalis dura, araknoid ve piamater ile sarılıdır. Bu zarlar foramen magnumda karşılık gelen serebral meninks tabakaları ile devam etmektedir. Dışarıda yer alan katı fibröz zar olan duramater omurga kanalı duvarından bir epidural boşlukla ayrılmış olup, boşlukta yağlı gözenekli doku ve bir ven pleksusu bulunmaktadır. Duramater ile araknoid arasında potansiyel bir subdural boşluk bulunmakta ve burada son derece sığ, lenfe benzer bir sıvı bulunmaktadır (12). Spinal araknoid, ince bir membrandır. Bu zar piamaterden subaraknoid boşluk ile ayrılmış olup mezotelial septalar bulunmakta ve BOS yer almaktadır. Piamater ince bir vasküler bağ doku olup omurilik ve sinir köklerini sıkıca sarmalamıştır. Bu zar silindirik filum terminale ile devam eder. Pia, ligamentum denticulatum adı verilen, her iki yanda duraya 22 tane uzantı ile bağlanmıştır (12).
Spinal sinirler: Simetrik olarak düzenlenmiş omurilikten 31 çift (8 servikal, 12 torasik, 5 lomber, 5 sakral ve 1 koksigeal) spinal sinir bulunmakta olup bunlar omuriliğe sinir köklerini yapmak üzere kümelenmiş ventral ve dorsal sinir kökçükler veya filamentlerin yaptığı lineer bir dizi halinde bağlanmıştır. Her dorsal spinal sinir kökü üzerinde oval bir genişleme olan spinal (duysal) ganglion bulunur. Omuriliğin alt kısmına bağlanmış sinir kökleri dışarı çıkış noktalarına kadar kauda ekina olarak aşağı inmektedir (12).
2.2.2. Medulla Spinalis İç Yapısı
Medulla spinalis bir dış lif katmanı olan beyaz cevher ile sarılmış nöropil bir nüve olan gri cevherden yapılmıştır. Gri cevher spinal nöronların hücre gövdeleri ve dendritleri ile bunlardan çıkan veya bunların üzerinde sonlanan aksonlar ve akson sonlanmalarından kuruludur (12). Gri ve beyaz cevher sınırları farklı omurilik seviyelerinde farklı şekildedir. Beyaz cevher servikal bölgede görece kalın olup aşağı indikçe giderek azalır. Gri cevher ise servikal ve lomber genişlemelerde daha fazla gelişmiş olup ekstremitelerin motor ve duysal işlevlerine katılan nöronlardan yapılmıştır. Bu genişlemeler, intumescentia servikalis ve intumescentia lumbosakralis adı verilen fuziform genişlemelerdir (Şekil 2) (12).
Şekil 2: Omuriliğin farklı seviyelerdeki transvers kesitleri (Netter FH: Beyin ve omurliğin anatomisi, The Netter Collection of Medical illustration Nervous System, Volume 1: Part I: Anatomy and Physiology, Ed: Brass A, Elsevier Saunders, 2007, pp: 36-66 ‘den Türkçeye çevrilerek alınmıştır.)
Enine kesitte gri madde, kanalis sentralisi içeren komissura grisea ile birbirine bağlanmış kolumna anterior ve kolumna posteriorlardan oluşan bir “H” harfi şeklinde görülür. Torasik ve üst lomber segmentlerinde küçük bir kolumna lateralis bulunur (13). Kolumna anteriorda sinir hücrelerinin çoğu büyük ve multipolardır. Aksonları spinal sinirlerin ön köklerinden iskelet kaslarını innerve eden alfa afferentler olarak çıkarlar. Daha küçük olanlar nöromuskuler iğciklerin intrafusal kas liflerini innerve eden gamma efferentler olarak çıkarlar. Medial grup, çoğu segmentte bulunur, boyun ve gövdenin iskelet kaslarının innervasyonundan sorumludur; santral grup bazı servikal ve lumbosakral segmentlerde bulunur (nucleus nevri phrenici, n.nervi accesorii, n.lumbosacralis); lateral grup, servikal ve lumbosakral segmentlerde bulunur ve iskelet kası innervasyonundan sorumludur (Şekil 3) (13).
2.2.3. Omuriliğin Vasküler Yapısı
Medulla spinalis bir ön ve iki tane arka spinal arter oluşturan çok sayıda radiküler arter tarafından beslenir. Radiküler arterler her vertebral segment hizasında komşu arterlerden doğar. Birçok ince radiküler arter vertebral foraminadan sinir köklerine eşlik ederek mediale doğru seyreder. Esas olarak radiks beslenmesi ile ilişkilidir. Daha kalın arterlerden bazıları dura mater’e erişerek ince meningial dalları verir sonra spinal arterleri oluşturmak üzere yukarı tırmanan ve aşağı inen dallara ayrılır (12). Ön spinal arter orta hat hizasında tüm medulla spinalis boyunca seyreder.
Şekil 3: Başlıca lif ve traktlar (Netter FH: Beyin ve omurliğin anatomisi, The Netter Collection of Medical illustration Nervous System, Volume 1: Part I: Anatomy and Physiology, Ed: Brass A, Elsevier Saunders, 2007, pp: 36-66 ‘den Türkçeye çevrilerek alınmıştır.)
Genel olarak her vertebral arterin dördüncü segmentinden doğan iki ön spinal dalın birleşmesinden oluşur. Ön spinal arterden gelen kan merkezi dallar ve pial pleksuslardan gelen penetre dallar yoluyla omuriliğin ön üçte ikisine dağılır. Omuriliğin dorsolumbosakral kısmı (Torakal 8’ den konus medullarise kadar) ana beslenme desteğini % 80 sol taraf interkostal (lomber) arterden doğan Adamkiewicz arterinden alır (Şekil 4) (12).
Arka spinal arterler radiküler arterlerin posterior dalları ile anastomoz yaparak omuriliğin tüm uzunluğu boyunca posterolateral yüzde seyreder. Kanı omuriliğin kendilerine karşılık gelen tarafında arka üçte bir kısmına dağıtır (12).
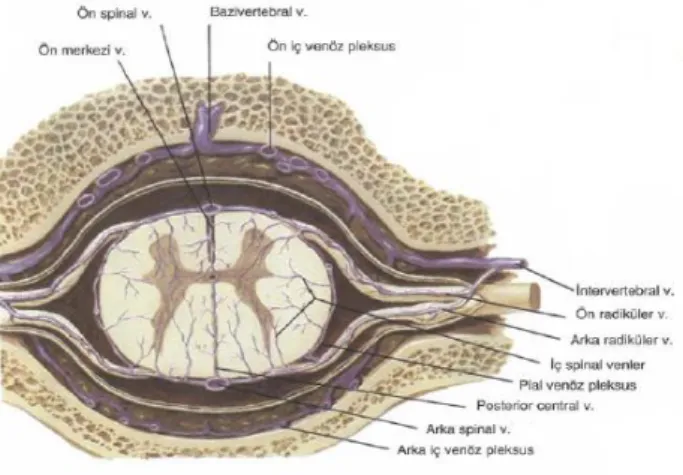
Omuriliğin venleri (Şekil 5), yerleşim yönünden arterlere benzer ve pia materde kıvrımlı bir pleksus oluştururlar. Venüller, ventral ve dorsal sinir köklerine bitişik olarak uzanan iki çift ön-yan, arka-yan longitudinal venlere ve iki median longitudinal vene boşalan ön ve arka ana vene açılır. Yukarıda foramen magnum aracılığı ile medulla oblongatayı ve serebellumun alt yüzünü boşaltan venlerle bağlantı halindedir. Sinir kökleri ve radiküler arterlere eşlik eden ön ve arka radiküler venler intervertebral venleri yapmak üzere ön ve arka iç vertebral pleksuslardan gelen dallarla birleşir (12).
Şekil 4: Anterior spinal arter, posterior spinal arter ve radiküler arter arasındaki anostomoz (Netter FH: Beyin ve omurliğin anatomisi, The Netter Collection of Medical illustration Nervous System, Volume 1: Part I: Anatomy and Physiology, Ed: Brass A, Elsevier Saunders, 2007, pp: 36-66 ‘den Türkçeye çevrilerek alınmıştır.)
Şekil 5. Omuriliğin venleri (Netter FH: Beyin ve omurliğin anatomisi, The Netter Collection of Medical illustration Nervous System, Volume 1: Part I: Anatomy and Physiology, Ed: Brass A, Elsevier Saunders, 2007, pp: 36-66 ‘den Türkçeye çevrilerek alınmıştır.)
2.3. Omurilik Travmasının Tarihçesi
Omurilik travmasının tanı ve tedavisi hakkında çalışmalar antik döneme kadar uzanmaktadır. Yaklaşık 3000 yıl önce yazılmış olan Edwin Smith’in Surgical Papirus’unda muhtelif olgular değerlendirilmekte ve hastalar tedavi edilebilecek olgular, tedavi edilmeye çaba gösterilmesi gerekenler ve umutsuz olgular olarak sınıflandırılmaktadır. (4). Hipokrat, M.Ö. 400 yıllarında paraplejiyi ilk kez tarif etmiştir Kolumna vertebralisin kırık ve çıkıkları ile ortaya çıkan paraliziler arasındaki ilişkiye dikkat çekmiş, ancak medulla spinalisin fonksiyonu hakkında net bir fikir belirtememiştir (4). Aulus Cornelius ise tedavi amacıyla bir traksiyon cihazı geliştirmiştir (4). Galen (M.S. 2.y.y) hayvanların spinal kordlarını kestikten sonra ortaya çıkan nörolojik defisitleri inceliyerek, farklı lezyonlara bağlı klinik tablolar hakkında veriler elde etmiştir (4).
İlk kez dekompresif laminektomi cerrahi fikrini ortaya koyan Egeli Paulus (625-690) traksiyon ile omurilik hasarının önlenemeyeceğini düşünmüştür. 19. yüzyıla kadar omurilik yaralanmalarında yaygın olarak konservatif yaklaşım tercih edilmesine karşın, Paulus’un dekompresif cerrahi fikrine dayanarak uygulanan cerrahi girişimlerde gelişimini devam ettirmiştir (14). Omurilik travması ile ilgili ilk fizyopatolojik çalışma 1890’da Schamus tarafından tavşan omuriliğinde travma sonucu gelişen patolojik değişiklikleri inceleyerek yapılmıştır (15).
Deneysel medülla spinalis travma çalışmaları ise, 1911 yılında Allen ile başlamıştır. Allen, köpeklerde laminektomi sonrası omurilik üzerine ağırlık düşürerek kontüzyon tipi omurilik hasarı oluşturmuş ve uygulanan myelotominin ve posttravmatik hematomyelinin kaldırılmasının nörolojik fonksiyonlarda iyileşme sağladığını ortaya koymuştur (16). Bu çalışma daha önce yapılmış olan deneysel çalışmaların belirli kriterlere bağlanmasını sağlamış ayrıca sekonder hasar konseptininde öncülüğünü yapmıştır.
1978 yılında Tator ve Rivlin tarafından geliştirilen klip kompresyon modelinde omurilik çeşitli zaman aralıklarında anevrizma klipleri ile klibe edilmekte ve bu sayede değişik miktarlarda travma oluşturulabilmektedir. Bu modelde klip kapanma gücü ve kompresyon süresi değiştirilerek istenen şiddette yaralanma oluşturulabilmektedir. Bu modelin avantajı omuriliğin tamamının travmaya maruz bırakılarak, aynı zamanda iskemiye yol açmasıdır ki bu da insanlarda meydana gelen travma sonrası omurilik yaralanmasına benzer bir model olmaktadır (17). Bu modellerle birlikte birçok deneysel omurilik hasar modeli geliştirilmiştir (Tablo 1) (18).
Tablo 1. Deneysel spinal kord yaralanması modelleri (18). A.Travmatik Yaralanma
1.Akut kinetik kompresyon: Klip Kaf, , Balon kompresyon, Vertebral dislokasyon 2.Akut statik kompresyon: Ağırlık uygulama
3.Çarpma veya ağırlık düşürme 4.Akselerasyon-Deselerasyon 5.Distraksiyon
6.Transseksiyon: Parsiyel veya komplet B. Non-travmatik Yaralanma
1.İskemi: Aort oklüzyonu, selektif arteryel yada venöz oklüzyon 2.Tümör kompresyonu: Ekstradural
3.Kimyasal ve fotokimyasal 4.Lazer indüksiyonu
2.4. Fizyopatoloji
Yapılan deneysel çalışmalar, yaralanma sonrası oluşan spinal kord hasarının karmaşık olduğunu; birincil hasar ve ikincil hasar olarak iki aşamada geliştiğini ortaya koymuştur.
2.4.1. Birincil (Primer) Hasar Mekanizmaları
Birincil mekanik hasar, travma esnasında olan zedelenmedir. Fleksiyon, ekstansiyon, dislokasyon veya rotasyonla ilgili distraksiyonel kuvvetlerin hepsi ve penetran yaralanmalar nöral elemanlarda ve spinal kord damarlarında gerilme veya yırtılmaya neden olur. Diğer olası mekanik etkiler, kemik kısımlardan, ligamanlardan veya spinal kanal içindeki hematomlardan kaynaklanan kompresyonu içermektedir (19).
Bu kuvvetler sadece yaralanma esnasında akut olarak değil kronik olarak da omuriliği tahrip edebilir. Post-travmatik kifoz gibi daha ileri yapısal deformasyonlar nörolojik defisitte artışa neden olabilir. Yaralanmanın yaygınlığı ayrıca kuvvet uygulanan düzeyde spinal kanalın göreceli boyutlarına da dayanmaktadır. Geniş kanallar her hangi bir mekanik strese bir tampon sağlayabilse de, stenotik kanallarda böyle bir tampon mekanizması yoktur (20)
Birincil yaralanmanın dört karakteristik mekanizması vardır; 1. Persistan kompresyon ile darbe,
2. Transient kompresyon ile darbe, 3. Distraksiyon,
4. Laserasyon ve transeksiyon.
İlk ve en yaygın mekanizma dirençli kompresyon ve travmadır. Burst (Patlama) kırıklarında kemik fragmanların kordu sıkıştırması, dislokasyon ve akut disk rüptürlerinde bu kanıtlanmıştır (21).
İkinci mekanizma olan transient kompresyon ile yalnız darbe, altta yatan dejeneratif servikal omurga hastalığı olan kişilerde hiperekstansiyon yaralanmalarında görülür (21). Distraksiyon, aksiyel planda gerici kuvvetlerin spinal kolonda oluşturduğu travma mekanizmasıdır.
Distraksiyon, fleksiyon, ekstansiyon, rotasyon ya da dislokasyondan kaynaklanan distraksiyonel kuvvetlerin spinal kordu ve/veya onun vasküler yapısını gerip yırtmasından kaynaklanır. Radyolojik anormallik olmaksızın spinal kord yaralanmasının altında bu tip bir yaralanma yatabilir. Özellikle kartilajenöz vertebra cismi, gelişmemiş adale yapısı ve ligaman gevşekliği çocuklarda bu tip yaralanma için predispozan faktörlerdir. Aynı zamanda bu tip yaralanma travmanın radyolojik kanıtı olmadan yetişkinlerde altta yatan dejeneratif spinal hastalık durumunda SKY’na yol açan bir sendromdur (21).
Son mekanizma laserasyon ve transeksiyondur. Spinal kord laserasyonu ateşli silah yaralanması, keskin kemik fragman dislokasyonu ya da ileri derecede distraksiyondan kaynaklanır (21).
2.4.2. İkincil (Sekonder) Hasar Mekanizmaları
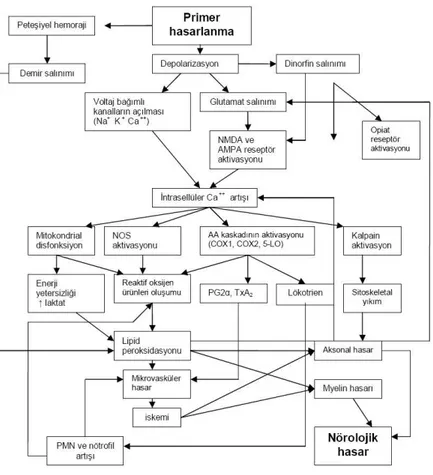
Omurilik yaralanmasında iki basamaklı mekanizma kavramı Allen'in 1900' lerin başlarında, omurilikleri yaralanmış hayvanlarda ilerleyici hasar oluştuğunu göstermesi ile ortaya atılmıştır (16). Spinal kord travmalarının seyri ve yaralanma sonrasında oluşan patolojik bulgular sadece primer yaralanmaya ait değildir. Devamında ortaya çıkan fizyopatolojik mekanizmalar (Tablo 2) sonucunda oluşan yaralanmalar, sekonder yaralanmayı oluşturur. Omurilik yaralanması sonrasında, omurilikte hemoraji, ödem, demiyelinizasyon, aksonal ve nöronal nekroz ile kavite oluşumu ve infarkt ile sonlanan bir seri patolojik değişiklikler oluşur. Ducker, bu patolojik değişikliklerin zamana bağlı olarak artarak, hasardan sonraki altı güne kadar kötüleştiğini göstermiştir (22).
Akut yaralamadan sonra kordda kanama, ödem, aksonal ve nöronal nekroz kist formasyonu ve enfarktın takip ettiği demiyelinizasyon gibi patolojik değişikilkler oluşur (Şekil 6) (19, 23). Spinal şok, vasküler değişiklikler, hücre içi Ca+2
artışı, serbest radikal teorisi, endojen opioidler, enflamasyon ve apopitoz teorileri üzerinde en fazla durulanlan ikincil hasar mekanizmalarıdır (19, 23).
Tablo 2. İkincil Yaralanma Mekanizmaları (19). Sistemik etkiler (Nörojenik şok)
Kalp hızında kısa süreli artış, daha sonra uzun süreli bradikardi
Kalp basıncı kısa süreli hipertansiyon, daha sonra uzun süreli hipotansiyon Periferik dirençte azalma
Kalp debisinde azalma
Omurilik mikrodolaşımında lokal vasküler hasar Kapiller ve venüllerde mekanik bozulma Hemoraji: özellikle gri cevherde
Mikrodolaşımda kayıp: mekanik, tromboz, vazospazm Biyokimyasal değişiklikler
Serbest radikal üretimi Lipid peroksidasyon Eksitotoksisite: glutamat Nörotransmitter birikimi Araşidonik asit salınımı Eikozanoid üretimi Prostaglandinler Sitokinler
Endojen opioidler Katekolaminler: noradrenalin, dopamin Elektrolit kaymaları
İntraselüler kalsiyumda artış Sodyum geçirgenliğinin yükselmesi Ekstraselüler potasyumda artış
Enflamatuar cevap
Serbest radikal üretimi Akson yıkımı
Wallerian dejenerasyon Myelin artıklarının uzaklaştırılması Oligodentrositlerde sitotoksik etkiler Glial hücre aktivasyonu
Sitokinlerin salınımı Ödem
Apopitozis
Enerji metabolizmasında kayıp Azalmış ATP üretimi
Şekil 6: Akut SKY patogenezi (24)
2.4.2.1. Vasküler Mekanizmalar ve Endotel Hasarı
Akut omurilik yaralanması sistemik vasküler etkiler ile birlikte ikincil hasara uzanan ani mikrovasküler değişiklikler oluşturur. Bu değişikliklerin ilerleyici karakteri omurilik iskemisini travmadan sonra gittikçe artırır (19).
Sistemik vasküler etkiler: Akut omurilik yaralanması yaralanma şiddeti ve yaralanmanın seviyesi ile orantılı olarak birçok kardiovasküler ve hemodinamik etki yapar. Birçok çalışma posttravmatik hipotansiyon ve nörojenik şok gelişimini göstermiştir. Travmayı takiben sistolik arterial basınçta hafif ve kısa süreli bir artışı takiben, ortalama arter basıncında ve kardiyak outputta kalıcı bir düşüş olur. Hipertansif fazda plazma norepinefrin ve epinefrin düzeylerinin arttığı gösterilmiştir (19).
Lokal vasküler etkiler: Omuriliğin çok farklı arteriyel kan basınçlarında omurilik kan akımını sabit tutma özelliğine otoregülasyon denir. Omurilik vasküler yatağında otoregülasyonun bozulması, perfüzyon basıncının düşmesi ile dokulara gereksinim duyduğu kadar metabolit ve oksijen ulaşmasını engelleyen nedenlerden biri de spinal şoktur (13). Tator ve arkadaşlarının klip kompresyon modeline göre yaptıkları omurilik
yaralanmasında, hem yaralanma bölgesinde hem de sefalad ve kaudal komşu bölgelerde arterioller, kapiller ve venüllerde kanlanma durur (25).
Beyaz cevher perfüzyonu travmadan sonraki 5. dakikada hızla azalır, 15. dakikadan sonra normale dönmeye başlar. Gri cevherde ise travmadan sonraki ilk 5 dakika içinde birçok hemorajik alan belirir. Perfüzyon travmadan saatler sonra bile yoktur. Lezyon bölgesinde, özellikle gri cevherde, omurilik kan akımının ileri derecede azalması iskemi gelişmesi ile sonuçlanır (25). Posttravmatik iskeminin travmadan sonra saatler içinde kötüleşmesi, erken tedavi edilmesi halinde iskeminin önlenebileceğini düşündürmektedir. Posttravmatik omurilik iskemisi travma şiddeti ile lineer korelasyon göstermektedir. Omurilik yaralanma derecesi ve posttravmatik iskemi derecesi ile motor ve somatosensorial uyarılmış potansiyaller arasında lineer ilişkinin olduğunun bildirilmesi, posttravmatik iskeminin akson fonksiyonunun bozulması ile doğrudan ilişkili olduğunu göstermektedir. Sonuçlar göstermektedir ki, beyaz cevherdeki iskemik lezyonlar anatomik olarak gri cevherdeki hemorajik lezyonlarla ilişkilidir (26).
Endotel hasari: Yaralanmayı oluşturan mekanik travma, vazoaktif aminlerin salınımı, hemoraji, trombozis, platelet agregasyonu, endotel hasarı ve şişme vazospazmı tetikleyebilir. Direkt travmaya veya diğer tetikleyici ajanlara bağlı oluşan vazospazmın da iskemide önemli rol oynadığı gösterilmiştir. Ayrıca TXA2 gibi bazı maddelerin salınması sonucu oluşan tromboz da posttravmatik iskeminin şiddetlenmesine neden olmaktadır. Eksitotoksik aminoasitler de iskemi yapabilir.Nöronların iskemiye dayanıksızlığının sebebi bilinmemekle beraber glutamat sorumlu tutulmaktadır (27).
Carlos ve Harlan endotel hasarının aktive olmuş nötrofıller tarafından olduğunu öne sürmüşlerdir (19). Endotel hasarına platelet yapışması, intravasküler platelet agregasyonu, mikrovasküler oklüzyon, emboli ve vazojenik ödemin eşlik etmesi nedeni ile endotel hasarını azaltmak için antiplatelet ajanlar kullanılmıştır. Posttravmatik omurilik kan akımını arttırmak için pek çok ajan denenmiştir. SSS'de hücre içine kalsiyum girişinin hücre ölümünde son basamaklardan birinin olduğunun gösterilmesi, kalsiyum kanal blokerlerinin serebral vazospazmda kullanılmasını gündeme getirmiştir. Bir kalsiyum kanal blokeri olan nimodipinde omurilik yaralanma modellerinde denenmiştir (19).
2.4.2.2. Eksitotoksite
Omurilik yaralanması sonrası eksitator amino asitlerden (EAA) glutamat ve aspartat dakikalar içinde hızla yükselir (27). İn vitro çalışmalar EAA' nın neden olduğu geç doku hasarında glutamat reseptörlerinin önemini vurgulamışlardır. EAA hasarında, hücre
içinde Na+
ve Ca++ artışı hücre şişmesi ile proteazlar, kinazlar ve fosfolipazlar gibi kalsiyum bağımlı olayların başlamasına neden olur. Glutamatın toksik özelliklerini açıklamak amacı ile glutamat, SSS'ne enjekte edilmiş ve glutamatın eksitotoksik olduğu, bunun reseptör blokörleri ve serbest radikal tutucular ile önlendiği gösterilmiştir (27).
Bu sonuçlar bize glutamat toksisitesinde serbest radikallerin de olaya katıldığını göstermiştir. Glutamat ve aspartat salınımının omurilik yaralanmasının şiddeti ile ilişkili olduğu gösterilmiştir. Orta şiddetli yaralanmalarda 2-4 kat yükselme olurken, şiddetli yaralanmalarda 10 kata kadar yükselme olabilir. Glutamat, yaralanmadan sonra 15 dakikada pik değerine ulaşırken, 120 dakika kadar yüksek kalabilir (24).
Travmatik beyin ve omurilik yaralanmasından sonra glutamat reseptörlerinin hızla azalması, hücrenin kendisini eksitotoksisiteden koruma çabası olabilir. Omurilik yaralanmasında glutamat antagonistleri ile çok çalışma yapılmıştır. N-methyl D-Aspartate (NMDA) reseptör antagonisti olan 3-propyl-l-phosphonic acid (CPP) ve dizocilopine (MK-801) ile yapılan çalışmalar travmatik ve iskemik omurilik hasarında histolojik ve klinik iyileşmeye neden olduklarını göstermiştir (28). NMDA reseptörleri fizyolojik koşullarda ağırlıklı olarak öğrenme ve bellek fonksiyonunda rol alırken non-NMDA reseptörleri yaygın olarak hızlı eksitatör sinapslarda bulunurlar . Bir çok çalışma intraselüler Ca+
akışı için ana hedefin NMDA reseptörleri olduğunu göstermiştir (29).
2.4.2.3. Serbest Radikal Oluşumu ve Lipid Peroksidasyonu
İlk kez 1970'lerde Demopoulos tarafından ortaya atılan hipoteze göre oksijen serbest radikalleri ve ürünleri ilerleyici doku hasarına neden olurlar (30). Hücre yaşamı için serbest radikal oluşumunun önlenmesi önemli bir hayati adımdır. Çünkü normal hücresel solunum işlemlerinde devamlı olarak potansiyel oksijen toksik metabolitleri oluşturulur. Serbest radikaller dış yörüngelerinde fazladan (çiftlenmemiş) bir elektron bulunduran kuvvetli reaktif moleküllerdir. Biyolojik dokularda serbest radikallerin en sık kaynağı moleküler oksijen radikalleridir. İnsan vücudunda en yaygın bulunan serbest radikaller oksijen kaynaklı olanlardır. Fakat pek çok serbest radikalin varlığı da gösterilmiştir. Tanımlama olarak günümüzde serbest oksijen radikalleri (SOR) yerine daha kapsamlı olarak, reaktif oksijen türevleri (ROT) tanımı kullanılmaktadır. Reaktif oksijen türevleri arasında süperoksit radikal (O2), hidrojen peroksit (H2O2), hidroksil radikal (OH
-), perhidroksi radikali (HO2) ve organik peroksi radikal (ROO) sayılabilir. Mitokondrideki yetersiz elektron transferi neticesinde süperoksit radikali oluşur. Süperoksit dismutaz
enzimi (SOD) süperoksiti, hidrojen peroksite (Şekil 7), katalaz enzimi de hidrojen peroksiti H2O ve O2 ye dönüştürür (31).
Şekil 7: Süperoksit dismutaz enziminin katalizlediği reaksiyon 66(32)
Fizyolojik koşullarda oluşan serbest radikaller enzimatik antioksidan mekanizmalar (katalazlar, sitokrom oksidaz sistemi, SOD’ler, glutatyon peroksidazlar) ya da nonenzimatik antioksidanlar (tokoferol, karoten, glutatyon, askorbik asit, ürat, sistein, bilirubin, albumin), veya metal bağlayıcılar (seruloplazmin, transferrin, laktoferrin) ile inaktive edilerek doku hasardan korunur. SOD canlılarda oluştuğu ilk gösterilen serbest radikal süperoksitdir. Aerobik canlılarda süperoksitlerin H2O2’e çevrilmesi katalitik aktivitesi çok yüksek bir enzim olan SOD tarafından katalizlenir ve bu tepkime “dismutasyon tepkimesi” diye adlandırılır (33).
SSS, askorbat, glutatyon ve tokoferol gibi antioksidan mekanizmalara yüksek oranda sahiptir. Ancak travma sonrası dokuda bu antioksidan mekanizmalar hızla azalır. Oluşan serbest radikaller lipidler, proteinler, nükleik asitler ile reaksiyona girerek sıklıkla lipid peroksitler oluştururlar ve bunun sonucunda daha fazla serbest radikal oluşur. Omurilik yaralanmasından sonra kanamayı takiben hemoglobin, ferritin ya da transferinden demir açığa çıkar. Serbest demir veya demir şelatları iki seviyede serbest radikal oluşumunda etkili olur. Bunlardan birincisi süperoksit iyonu oluşumunda Fe+2
‘nin oto-oksidasyonu olup, ikincisi ise Fe+2’nin H202 varlığında okside olup hidroksil iyonu oluşumuna sebep olmasıdır (Şekil 8) (34).
Fe+ ve Cu+ gibi transisyonel metal iyonları, oksidan kaynaklı doku hasarı üzerinde major rol oynarlar. Süperoksit dismutaz, süperoksit radikalini, katalaz ve glutatyon peroksidaz ise hidrojen peroksiti metabolize ederler. Katalaz, SOD ve glutatyon redoks siklusundaki enzimler artmış oksidan stresiyle başa çıkacak primer antioksidan defans mekanizmasıdır. Bu enzimlerin aktif oluşu daha zararlı olan hidroksil radikali oluşumunun engellendiğini gösterir (35).
Katalaz tetramerik hemoproteindir. H2O2 varlığında, 2H2O2 → 2H2O + O2 reaksiyonunu katalizler. Redoks siklusunun hidroperoksitlerin redüksiyonundan sorumlu ana enzimi glutatyon peroksidazdır. 4 selenyum atomu bağlı tetramerik bir proteindir (32).
Süperoksit dismutaz, iki değerli bakır içermekte olup, süperoksit radikalini (O 2-) bu özelliğinden dolayı H2O2’ye dönüştürebilmektedir.
Serbest yağ asitlerinin serbest radikal ile oksidasyonu lipid peroksidasyonu olarak adlandırılır. Oluşan lipid peroksidasyonu ile birlikte mikrovasküler endotel hasarı oluşarak kan beyin bariyerinin bozulduğu deneysel çalışmalarda gösterilmiştir (36). Akrolein (2-propenal) ve 4-hidroksinonenal (HNE) farklı hücrelerdeki zararlı etkileriyle LPO’nun en toksik yan ürünleridir. Akrolein ve HNE’in travma sonrası 4.saatte yükselmeye başlayarak, 24 saat sonra pik değerine ulaştığı ve 7 gün boyunca yüksek seviyesini koruduğu görülmüştür. Bu sonuçlara göre bir lipit peroksidasyon ürünü olan akroleinin, mekanik stimulusu takiben oluşan sekonder nöronal dejenerasyonda kritik bir rolü olabilir. (36).
Şekil 8: Serbest radikal oluşum kaynakları (34)
2.4.2.4. Nitrik Oksit
Nitrik oksit sentaz (NOS) tarafından L-Arginin’den sentezlenen güçlü serbest radikal yapıda bir moleküldür. NO ikincil hasarda önemli bir rol oynar (37). NO’in en küçük endojen biyolojik mediyatörlerden biridir ve diğer dokularda olduğu gibi SSS’de bir
takım fizyolojik ve patolojik olaylar içinde yer aldığı bilinmektedir. Vasküler tonusun düzenlenmesi, platelet fonksiyonların düzenlenmesi, inflamasyona immünolojik cevap, otonomik tonus ve duysal iletinin regülasyonu gibi birçok fizyolojik olayda rol oynarken aynı zamanda önemli bir nörotransmitter ve nöromodülatördür (37).
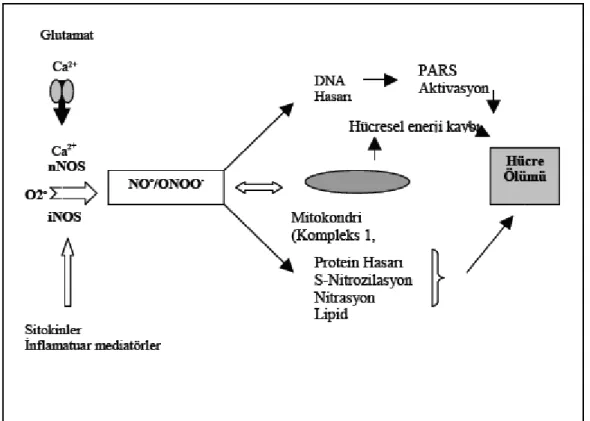
NO, spinal kord hasarına cevap olarak artış göstermekte ve NOS’ın farklı kaynaklardan oluşumuna bağlı olarak travma sonrası değişik zamanlarda yükselmektedir (38). NO, NOS un bilinen 3 izoformu tarafından sentezlenmektedir. Nöronal NOS(kalsiyum bağımlı) (nNOS), endotelial (eNOS) ve üçüncü izoformu inducible NOS(Kalsiyum bağımsız) (iNOS) ki bu enflamatuar uyaranlarla sentezlenir (38). Patolojik koşullarda özellikle iNOS’a bağlı NO aşırı üretimi ve peroksinitrit oluşumu; protein hasarı, lipit peroksidasyonunun artışı, DNA hasarıyla birlikte mitokondrial elektron transport zinciri enzimleri olan kompleks 1-2 ve akonitaz’ın inhibisyonu sonucu mitokondrial respirasyonun durması ve dolayısıyla DNA replikasyonunun inhibisyonu ile hücre ölümüne neden olur (38).
Spinal kord yaralanması olan sıçan modellerinde immünhistokimyasal çalışmalarda yaralanma sonrası nötrofil, makrofaj, epandimal, endotelial ve glial hücreleri içeren iNOS immünreaktivitesi gösterilmiştir . İNOS sağlıklı dokularda bulunmazken patolojik süreçlerde makrofajlar, glial hücreler, endotelial hücreler, fibroblastlar, nöronlar ve vasküler düz kas hücreleri tarafından inflamatuar mediatörler ve sitokinler tarafından stimülasyonu sonucu üretilir (37).
Deneysel SKY’nda NOS inhibitörlerinin sonuçları iyileştirdiğini, kötüleştirdiğini ya da etkisi olmadığını bildiren çalışmalar vardır. Tekrarlayan yaralanma sonrası non-spesifik NOS inhibitörü olan L-NAME enjeksiyonlarının sıçanda SKY sonrası motor kayıpları azalttığı gösterilmiştir. Başka bir sıçan çalışması ise rölatif spesifik iNOS inhibitörü olan aminoguanidinin uzun dönem fonksiyonel sonuçları iyileştirdiği ve posttravmatik kavitenin volümünü azalttığını gösterdi (38). NOS’ın selektif uzun dönem inhibitörleri SKY’da nöroproteksiyonu indükleyebilir. NOS hasarlı nöronlarda NOS upregülasyonu gerçekleşir. Bu NO’in nörotoksik olduğunu gösterir. Torasik spinal kordda NOS (+) hücreler dorsal boynuzda, dorsolateral funikulusta, lateral spinal nöronlarda ve santral kanal çevresinde bulunurlar. Dorsal boynuzun spinal kord lamina 1 ve 3 de NOS nöronları GABA, glisin ve asetilkolin içerirler. Bu NO ve diğer nörotransmitterlerin etkileşiminin SSS regülasyonunda önemli rol oynadığını gösterir.NOS nöronları spinal kord kan akımına etki eder ve kan spinal kord bariyeri fonksiyonunu regüle ediyor görülmektedir. Dorsal hornda spinal kord iskemisi veya perifer sinir yaralanmasını takiben
NOS ekspresyonu görülür. Kord hemiseksiyonu ya da darbe yaralanması NOS(+) internöronlarda özellikle lezyon rostralinde upregülasyonla sonuçlanır (Şekil 9) (39).
NOS ekspresyonunun selektif inhibitörlerle blokajı SKY’nın indüklediği kan – spinal kord bariyer tahribatı, ödem formasyonu, hücre reaksiyonlarının azaltılması düzelmiş motor fonksiyonlarla ilişkilidir (39).
Şekil 9: NO ve/veya peroksinitrit ilişkili nörotoksitite (38)
2.4.2.5. Araşidonik Asit Metabolizması
Travmanın direkt etkisi ile ya da kalsiyumun anormal hareketi, membran fosfolipidlerinden, fosfolipaz aktivitesi ile araşidonik asit salıverilmesini artırmakta, o da siklooksijenaz tarafından hızla metabolize edilerek, prostanoidler ve prostasiklin haline dönüştürülmektedir. Lipaz, lipoksijenaz ve siklooksijenaz aktivasyonu, araşidonik asidin tromboksan, lökotrien ve prostaglandinlere dönüşmesini sağlar (21). Bu dakikalar içerisinde olur. 24 saat sonra ortaya çıkan gecikmiş araşidonik asit yüksekliğinin sebebi; Na+/K+ ATPaz pompasının inhibisyonu ve doku ödemine bağlıdır. Bunun sonucunda COX 1’ in persistan birikimi görülür. COX 1’ den sonra ortaya çıkan ürünler lokal kan akımı yavaşlaması, platelet agregasyonu ve vazokonstrüksiyona yol açar. Bu inflamatuar cevap lipid peroksidasyonuna neden olur. Hasar görmüş membranlarda lipid
peroksidasyonu sonucunda serbest radikaller üretilir. Bu serbest radikaller membran hasarına devam eder ve bu döngü endojen antioksidanlar olan SOD, alfa tokoferol (vitamin E) tarafından kırılana kadar devam eder (21).
Artmış ekstrasellüler eksitatör nörotransmitterler nöronal aktivasyonu uyarırlar. Bu da kortikal nöronlardan COX 2’nin salınımına yol açar. COX 2’nin selektif inhibisyonunun çeşitli hayvan deneylerinde SKY sonrasında düzelmeyi kolaylaştırdığı görülmüştür (21). 2.4.2.6. İnflamatuar Cevap
Omuriliğin travmatik yaralanması sonrası yangısal cevabı saatler içinde başlar ve birkaç gün içinde tepe değerine ulaşır. Bu cevap endotel hasarı, yangı mediatörlerinin salınımı, vasküler permeabilite artışı, ödem gelişimi, periferal yangısal hücrelerin göçü ve mikroglianın aktivasyonu olarak gözlemlenir. Lezyon bölgesine yangısal hücre infiltrasyonu iki dalga halindedir. Birinci dalgada polimorfonuklear granulosit infiltrasyonu varken, ikinci dalga monosit ve makrofajlar tarafından gerçekleştirilir. Polimorfonuklear granulositler lezyon bölgesini ilk birkaç saat içinde infitre etmeye başlar, birinci günde pik değerine ulaşır ve üçüncü günde kaybolurlar. Polimorfonuklear granulosit infiltrasyonu miktarı ile oluşan hemoraji miktarının korelasyon göstermesi, kan içindeki kemoatraktan maddelerin bu infiltrasyonun miktarını belirlemede önemini göstermiştir (40).
İkinci dalgada yaralanma bölgesine monosit/makrofaj ve mikroglial grup migrasyon gösterir. Burada asıl fonksiyonun hücre debrisinin fagositozu olduğu düşünülmektedir (40). Makrofajlar ve nötrofiller doku harabiyeti ve lezyonun büyümesinde rol alırlar. Makrofaj ve mikroglialar sitokinlerin salınımıyla (TNF, İL-1, IL-6, İL-10) sekonder patolojik ve yangısal yanıtta rol alırlar. İnflamasyonun yaralanma sonrası hem nörokonstrüktif hem de nörodestriktif işlemlere yardımcı olduğuna inanılır (41).
2.4.2.7. Sekonder Hasarda Elektrolit İlişkisi
SSS’nde yaralanmayı takiben nöronal dejenerasyonun patogenezinde Ca+’a karşı oluşan membran geçirgenliğindeki değişiklikler önemli yer tutar. Örneğin; nöronal kültürlerde glutamat sitotoksisitesi çalışmaları, beyaz cevher yaralanmasında hipoksi çalışmaları, SKY sonrası aksonlarda Ca+
akümülasyonu ultrastürüktürel çalışmaları, optik sinir ve spinal korda aksonal ve glial Ca+ seviye değişikliklerini görüntüleme çalışmaları ve posttravmatik spinal kord kan akımı çalışmaları nöronal yaralanmanın Ca+
hipotezini kuvvetle desteklemektedir (42). Voltaj bağımlı Ca+ kanalları, eksitabl hücrelerde Ca+ girişi
için önemli bir yolak oluştururlar Kalsiyum iyon konsantrasyonu ekstrasellüler aralıkta hücre içine göre 1000 kat daha fazladır. Omurilik yaralanmasında hücre hasarı ile membranların parçalanması, hücrede enerji yetmezliği ve bunun neticesinde Na+
- Ca++ değiştirici gibi elektrolit pompalarının iyi çalışmaması sonucunda, bu büyük gradient farkı ile hücre içine Ca++
iyon girişi olur. Ca++ iyonları hücre içinde fosfolipazları, proteazları ve fosfatazları aktifleştirerek hücre hasarının ilerlemesine neden olur. Fosfolipazlar hücre membranlarının yıkılmasını sağlayarak araşidonat gibi yağ asitlerinin ortaya çıkmasına neden olur. Siklooksijenaz ve lipooksijenaz araşidonik asiti prostaglandinler ve lökotrienlere dönüştürür. Bundan başka, kuvvetli vazojenik ve inflamatuar özellikleri olan bu ürünler kan akımını azaltır, membranın iyonlara geçirgenliğini artırır ve sonuçta daha fazla Ca++ girişine neden olurlar (43).
Voltaj bağımlı Ca+
kanalları, eksitabil hücrelerde Ca+ girişi için önemli bir yolak oluştururlar. Fizyolojik özelliklerinin temelinde ve farmakolojik profillerine göre bu kanallar düşük voltaj aktivasyonlu ya da T tip kanallar ve birkaç yüksek voltaj aktivasyonlu kanal olarak L, N, P, Q ve R tipleri şeklinde klasifiye edilirler (42). İntraselüler Ca+
artışı proteazların, endonükleazların aktivasyonuna apopitoz, nekroz, mitokondrial hasar ve asidoza öncülük eder ve artmış serbest radikal üretimi aksonal yaralanma ile sonuçlanır (44). Voltaj bağımlı Ca++
kanallarının bloke edilmesinin (nimodipin, nikardipin) omurilik yaralanmasında klinik sonuçları iyileştirmezken kan akımını artırdığı gösterilmiştir (Şekil 10)(45).
Şekil 10. Hücre içi Ca+2
artışı ve enzimlerin aktivasyonuna bağlı olarak gelişen biyomolekül hasarları ve hücre ölümü (46).
SSS beyaz cevher yaralanmasındaki anoksi, ATP ve membran depolarizasyonunun kaybına neden olur. Na+ kanallarından hücre içine Na+ akar. İntrasellüler Na+ konsantrasyonundaki bu artış, membran depolarizasyonu ile birlikte olunca, Na+
- Ca+ değiştiricinin ters çalışması ile hücre içine zararlı miktarda Ca++
girişine neden olur (47) Sodyuma bağlı hücre yaralanmasının potansiyel mekanizmaları;
1. Sitotoksik ödem indüksiyonu,
2. İntraselüler fosfolipaz aktivitesinin stimülasyonu 3. Na+/H+ kapısı yolu ile intraselüler asidoz
4. Na+/Ca+ değiştiricisinin ters çalışması ile intraselüler Ca+ artışı.
Travmatik aksonal yaralanma voltaj bağımlı kanallar yolu ile Na+ girişi sonrası sodyumda bir yükselme ile ilişkilidir ve membran bağımlı Na+
/K+ ATPaz disfonksiyonu ile sodyum çıkışı azalır. Na+
artışı Na+/H+ değişimi yoluyla intraselüler asidoza neden olur. Na+/H+ değişimi intraselüler pH’nın regülasyonunda primer role sahiptir (47).
Omurilik yaralanmasından sonra subpial bölgede kalan aksonlarda fonksiyonel ileti bozulur. Bu aksonlarda refraktör periyot uzar, yüksek frekanslı ileti bozulur, aktivasyon eşiği yükselir, ısı bağımlı ileti bloğu olur ve ileti hızı azalır. Hızlı aktive olan K+ kanalları
miyelin tarafından sarılmış olarak paranodal ya da internodal bölgelerde yerleşmiştir. Miyelin yaralandığında hızlı K+ kanallarının aktivitesi artar, membran potansiyeli K+ denge potansiyeline yaklaşır ve aksonal ileti bloğu oluşur (43).
2.4.2.8. Apoptoz
Apoptoz hücrelerin kendi kendilerini yok ettikleri programlı, aktif olarak RNA/protein sentezine ve enerjiye gereksinim gösteren fizyolojik ölüm biçimidir. Bu terim ilk kez 1972 yılında Kerr, Willie ve Currie tarafından kullanılmıştır. Apoptoz fizyolojik koşullarda barsak hücreleri, derideki epitelyal hücreler gibi birçok hücrede gerçekleşmektedir. Nöronlar ve kalp kası hücrelerinde ise sürekli bir apoptoz durumundan bahsedilmez. Nöronlarda apoptoz olayı doğumdan sonra sinapsların tam olarak oluşmadığı dönemde görülmektedir. Doğumdan sonra uygun sinaptik ağın sağlanabilmesi için nöron sayısının azaltılması gerekir. Hücre homeostazının sağlanabilmesi için apoptoz ve mitoz olaylarının dengede olması gerekmektedir (48). Özellikle DNA’da oluşan bir hasar sonucunda ortamdan uzaklaştırılmayan hücreler kontrolsüz çoğalma sonucunda kanser hücrelerine dönüşebilmektedir. Apoptoz her zaman fizyolojik şartlarda karşımıza çıkmaz. Nörodejeneratif hastalıklar, AIDS, insüline bağımlı diyabet, viral infeksiyonlar gibi patolojik şartlarda apoptozun bozulduğu saptanmıştır. Son yıllarda yapılan çalışmalarda Alzheimer, Parkinson gibi kronik nörodejeneratif hastalıklarda apoptozun indüklenerek hücrelerin öldüğü gösterilmiştir. Nörodejeneratif hastalıklarda gözlenen apoptoz; olmaması gerekirken gerçekleşen veya olması gerekenden daha hızlı gerçekleşen apoptoz olarak kabul edilmektedir. Kanser ve otoimmun hastalıklardaki apoptoz şekli ise yavaşlamış apoptozdur.
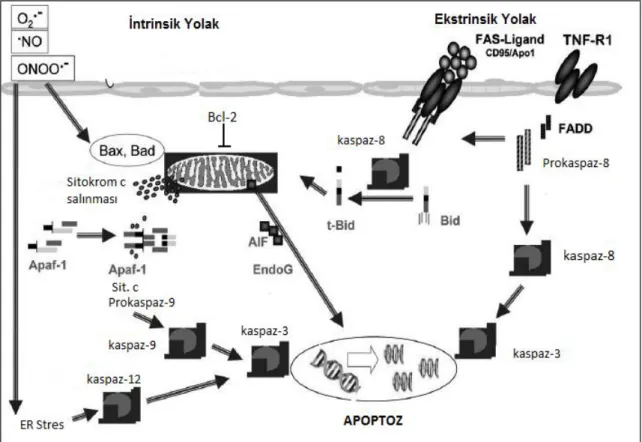
Apoptozun başlamasını tetikleyen iki yolak vardır (Şekil 11). Bunlar ekstrinsik ve intrinsik yolaklardır. Ekstrinsik yolak hücre ölüm reseptörlerinin aktivasyonu sonucunda başlarken intrinsik yolak mitokondrinin uyarılmasıyla başlamaktadır. Ekstrinsik yolakta hücre ölüm reseptörlerine ligandlar bağlanmakta ve apoptotik süreç başlamaktadır. İntrinsik yolağı başlatan faktör DNA hasarı gibi stres sonucu oluşan sinyallerdir. Apoptozun düzenlenmesinde mitokondri, Ca2+, çeşitli genler ve proteinler, enzimler, seramid gibi moleküller rol oynamaktadır. Bir hücreyi apoptoza götüren süreç şu şekilde özetlenebilir:
Şekil 11. Apoptozda rol oynayan intrinsik ve ekstrinsik yolaklar (49).
Apoptozun tetiklenmesi: Apoptozu tetikleyen fizyolojik veya patolojik birçok durum vardır. Bunların arasında hücre yaşlanması, radyasyon, sitotoksik T lenfositler, oksidatif stres, HIV, kanser, nörolojik hastalıklar, DNA hasarına yanıt olarak p53’ün indüksiyonu, büyüme faktörlerinin eksikliği (kültür ortamında), UV ışınlar, hücre içine Ca2+ girişi sayılabilir.
Hücre yüzey ölüm reseptörlerinin uyarılması: Hücre yüzey ölüm reseptörleri ekstrinsik yolağın bir parçasıdır. Fas ve TNFR-1 reseptörleri hücre ölüm reseptörleridir. Bu reseptörlerin, ligandları aracılığıyla uyarılması sonucunda hücre içi apoptotik süreçler tetiklenmektedir. Fas reseptörleri lenfoid hücrelerde, hepatositlerde, bazı kanser hücrelerinde, akciğerlerde ve miyokartta bulunmaktadır. Ligandı, Fas ligandı adını alır. Bu ligand TNF ailesinin bir üyesidir ve sitotoksik T lenfositlerde ve doğal öldürücü hücrelerde bulunmaktadır. Reseptörlere ligandların bağlanmasıyla ölüm uyarısı verilmiş olur ve membranın iç yüzeyinde bulunan bir dizi proteinler kendi aralarında etkileşime girer. Reseptörler öncelikle kendilerine doğal olarak bağlı bulunan ve ölüm bölgeleri adı verilen TRADD ve Fas ile ilişkili ölüm bölgesi (FADD) ile etkileşmektedir. Bu ölüm bölgeleri prokaspaz 8’i aktifleştirerek kaspaz kaskadının aktivasyonunu başlatmaktadır. Aktif kaspaz 8, hücre içindeki proapoptotik proteinlerden bid’i aktif hale getirir (tbid). Oluşan bid
fragmanı diğer proapoptotik Bcl-2 ailesi üyelerle etkileşime girerek bu üyelerin sitoplazmadan mitokondriye göç etmelerine neden olur. Böylece bu üyeler mitokondri membranından por oluşumuna neden olarak mitokondri içindeki sitokrom c’nin sitoplazmaya salıverilmesini sağlar.
Mitokondriden sitokrom c’nin salınması: Apoptozda rol oynayan temel organel mitokondridir. Intrinsik yolağın başlangıcından beri rol almakla birlikte ekstrinsik yolağın da devamında rol oynamaktadır. Mitokondrinin aktivasyonu denilen olay sitokrom c’nin sitoplazmaya salıverilmesidir ve bu olay apoptozun irreversibl sürece girdiğini göstermektedir. Mitokondrinin aktivasyonunu sağlayan en önemli faktör Bcl-2 ailesidir. Bcl-2 ailesi hem proapoptotik (Bax, Bcl-Xs, Bad, Bim, Bid, Bak) hem de antiapoptotik (Bcl-2, Bcl-X1, Mcl-1) üyelere sahiptir. Proapoptotik proteinler mitokondri üzerinde porlar açarak sitokrom c’nin mitokondriden sitoplazmaya salıverilmesini sağlamaktadır. Salıverilmenin mekanizması tam olarak bilinmese de başta Bax olmak üzere proapoptotik üyelerin mitokondri membranında voltaja bağımlı anyon kanallarını etkileyerek sitokrom c geçişini sağladığı düşünülmektedir. Antiapoptotik üyeler sitokrom c‘nin salıverilmesini baskılamaktadır. Mitokondri apoptoz sırasında sitoplazmaya sitokrom c’den başka apoptoz indükleyici faktör (AIF), endonükleaz G, Smac/DIABLO gibi diğer apoptotik faktörleri de salıvermektedir.
Apoptozda rol oynayan bir diğer Bcl-2 ailesi üyesi proapoptotik özellikteki bad’tır. Normal koşullarda bu protein fosforile halde tutularak antiapoptotik üyelerle kompleks yapması engellenmektedir. Defosforile durumdayken bad, bcl-xl gibi antiapoptotik üyelerle birleşerek onları etkisizleştirmektedir. Böylece sitokrom c’nin antiapoptotik üyelerce mitokondriden salınması engellenememekte apoptoz devam etmektedir. Hücre içine Ca2+ girişi bad’ın defosforilasyonu sağlayan mekanizmalardan biridir. NMDA reseptörlerinin uyarılmasına bağlı olarak hücre içine Ca2+ girişi gerçekleşmektedir. Artan Ca2+ hücre içinde kalsineurin (kalsiyumla aktive olan protein fosfataz) adlı proteini uyarmakta ve bu protein de bad’ın defosforilasyonunu sağlayarak apoptozda rol oynamaktadır. Ayrıca hücre içinde Ca2+ artışı apoptozda etkili endonükleaz, transglutaminaz gibi enzimleri de aktive eder. Bu enzimler kromatinde parçalanmaya, hücre iskeletinde ve sitoplazmik proteinlerde değişikliklere neden olmaktadır.
Apoptozom oluşumu: Mitokondriden salıverilen sitokrom c sitoplazmada Apaf’la birleşerek apoptozomu oluşturmaktadır. Oluşan apoptozom kaspaz 9 monomerlerinin bir araya getirilmesini sağlayarak kaspaz 9’u aktifleştirir. Aktif kaspaz 9 da kaspaz 3’ü aktifleştirmektedir.