T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
İKİNCİ KUŞAK TİROZİN KİNAZ İNHİBİTÖRÜ TEDAVİSİ
ALAN
KRONİK MYELOİD LÖSEMİ HASTALARININ
DEMOGRAFİK, KLİNİK ve TEDAVİYE YANIT
ÖZELLİKLERİNİN GERİYE DÖNÜK TEK MERKEZ
OLARAKDEĞERLENDİRİLMESİ
UZMANLIK TEZİ Dr. Narimana İMANOVA
TEZ DANIŞMANI Prof. Dr. Güray SAYDAM
İZMİR (2017)
ÖNSÖZ
Tüm bilgilerini bizimle paylaşmaktan imtina etmeyen başta Ana Bilim Dalı Başkanı Prof. Dr. Fehmi AKÇİÇEK olmak üzere uzmanlık eğitimim süresince çalışmaktan onur duyduğum tüm EÜTF İç Hastalıkları Ana Bilim Dalı öğretim üyelerine,
Bu çalışmanın yapılmasında en büyük destekçim olan tez danışman hocam Prof. Dr. Güray SAYDAM, Hematoloji Bilim Dalı’nın hocaları Prof. Dr. Mahmut Töbü, Prof. Dr. Filiz Vural, Prof. Dr. Fahri Şahin, Tıbbi Biyoloji Ana Bilim Dalı Başkanı Prof. Dr. Cumhur Gündüz ve çalışmanın her aşamasında yanımda olan ve büyük sabırla sorularımı yanıtlayan Uzm. Dr. Nur Akad Soyer’e,
Tezimin istatistiksel analizini yapan Yrd. Doç. Aslı Suner ve Ar. Gör. Semiha Özgül’e, Beraber çalıştığım değerli uzmanlarıma, asistan doktor arkadaşlarıma, İç Hastalıkları kliniğinin vefakar hemşire ve çalışkan personeline,
En büyük manevi desteğim saygıdeğer babam Rafil İmanov ve aileme eğitimim süresince göstermiş oldukları büyük destek ve katkılarından ötürü teşekkürü bir borç bilirim.
Dr. Narimana İMANOVA İZMİR-2017
ÖZET
İKİNCİ KUŞAK TİROZİN KİNAZ İNHİBİTÖRÜ TEDAVİSİ ALAN KRONİK MYELOİD LÖSEMİ HASTALARININ DEMOGRAFİK, KLİNİK
ve TEDAVİYE YANIT ÖZELLİKLERİNİN GERİYE DÖNÜK TEK
MERKEZ OLARAKDEĞERLENDİRİLMESİ
KML klonal kök hücre hastalığı olup, miyeloid elemanların aşırı çoğalması ile karakterizedir. Hastalığın patogenezinde 22.kromozomun Bcr geni ile 9.kromozomun Abl geni arasında resiprokal translokasyon sonucu oluşan Bcr-Abl füzyon geni rol oynamaktadır. Ph kromozomunda yerleşen bu gen, tirozin kinaz aktivitesi sayesinde lökositoza neden olur. 2001 yılında KML tedavisinde 1.kuşak TKİ: imatinibin kullanıma girmesi ile sağkalım oranları arttı. Buna rağmen hastaların bir kısmı imatinibe yanıtsız veya intolerandır. Bu hastalarda tercih 2.kuşak TKİ olan dasatinib ve nilotinibdir. Biz bu çalışmada 2.kuşak TKİ alan KML hastalarının demografik, klinik ve tedaviye yanıt özelliklerini değerlendirdik.
Gereç ve Yöntem: Kliniğimizde imatinib yanıtsız veya intoleran olan ve 2.kuşak TKİ: dasatinib veya nilotinibden herhangi birini alan 69 hasta çalışmaya dahil edildi. Hastaların klinik ve demografik verileri, 2.kuşak TKİ başladıktan sonra 3. 6. ve 12.ayda MMY elde etme, 12-24 ay arası ve 24 aydan sonra MMY kaybetme sıklığı, TSY ve THY elde etme oranları değerlendirildi.
Bulgular: Hastaların 34’ü erkek, 35’i kadındı, ortalama yaş 53,7 idi. Sokal risk skoruna göre hastaların %36,2’si (17 hasta) düşük riskli, % 40,4’ü (19 hasta) orta riskli, %23,4’ü (11 hasta) yüksek riskli grupta yer almaktaydı. Hasford risk skoruna göre hastaların %53,2’si düşük (25 hasta), %31,9’u orta (15 hasta), %14,9’u (7 hasta) yüksek riskli gruplardaydı. Hastaların tümü kronik fazdaydı. Altmış dokuz hastanın 37’si (%53,6) nilotinib, 59’u (%85,5) dasatinib kullanmıştır. Her iki 2.kuşak TKİ alan 27 hasta mevcuttu.
Nilotinib alan hastaların 3. 6. ve 12.ay MMY elde etme oranları sırasıyla %76, %73,7 ve %85,7 iken 12-24 ay arası ve 24. aydan sonra MMY devam etme oranı sırasıyla, %70,6 ve %71,4’dü. THY ve TSY elde etme oranı %91,9’du. Dasatinib alan hastalarda 3. 6. ve 12.ay MMY elde etme oranları sırasıyla %62,2, %71,4 ve %71,4 iken 12-24 ay arası ve 24.aydan sonra MMY devam etme oranı sırasıyla, %66 ve %62,3’dü. TSY ve THY elde etme oranı %93,1’di.
Nilotinib alanların %29,7’de, dasatinib alanların %30,5’de yan etki gelişti. Bu oranların tümünü kıyasladığımızda istatistiksel olarak anlamlı fark yoktu.
Toplam ortanca sağkalım süresi 2.kuşak TKİ ortak değerlendirmesinde 93 ay, dasatinibde 66 ay, nilotinibde 72 ay bulundu. Ortanca olaysız sağkalım 2.kuşak TKİ ortak 73 ay, dasatinib 55 ay, nilotinib 32 ay bulundu. Toplam sağkalım ve olaysız sağkalım kıyaslamasında anlamlı fark yoktu.
Toplam 3 hastada akselere faza geçiş izlendi. Bu hastalarda her iki 2.kuşak TKİ ile yanıt elde edilememiştir. On ex olan hastanın yarısının ölüm nedeni KML ile ilişkiliydi.
Tartışma: TKİ’lar KML tedavisinde dramatik gelişme sağladılar. Yaygın kullanılan TKİ’lar imatinib, nilotinib ve dasatinibdir. İmatinib dirençli veya intoleran hastalarda 2.kuşak TKİ etkinliklerini değerlendiren çalışma sayısı oldukça kısıtlıdır.
Çalışmamızdaki hastaların hepsi kronik fazda iken 2.basamak tedavisi olarak nilotinib ve dasatinibe geçmişlerdir. Sokal ve Hasford risk oranları, cinsiyet dışındaki demografik veriler ve laboratuar değerleri literatürle benzer idi. Yakın dönem MMY oranlarımız daha düşük olsa da uzun dönem sonuçlar yine literatürdeki çalışmalarla uyumluydu. Toplam sağkalım ve olaysız sağkalım oranımız daha düşüktü. Bu çalışmamızda 2.kuşak TKİ’ların 2.basamak tedavide, mevcut çalışmalarda 1.basamak tedavide verilmesine bağlı olabilir.
İmatinib halen KML tedavisinde güncelliğini korusa da hastalarda direnç ve intolerans durumunda gecikmeden 2.kuşak TKİ’lara geçilmelidir. Farklı yan etki profili fakat benzer yanıt gösteren bu ilaçların seçiminde hastaya özgü davranılmalıdır. KML hastalarının tedavi ve izlemi kılavuzlara uygun şekilde yapılmalıdır.
Anahtar Sözcükler: KML, Nilotinib, Dasatinib
ABSTRACT
EVALUATION OF OUTCOMES OF RESULTS IN PATIENTS WITH CML TREATED WITH SECOND GENERATİON TKIs: EGE HEMATOLOGY
EXPERIENCE
Although chronic myeloid leukemia (CML) has been known for long time, the fate of the disease and the survival plots of patients have been dramatically changed after discovery of Imatinib, the first TKI, and other TKIs. We hereby retrospectively evaluated demographic, clinical and treatment characteristics as response in patients with CML treated with 2ndgeneration TKIs in our center.
Material and method: Sixty nine Imatinib-resistant or intolerant patients who were treated with dasatinib or nilotinib were included in our study. Patient’s clinical and demographic parameters, rates of 3rd, 6th, and 12th months MMR achievement, loss of MMR over 12-24 month and after 24 month, rate of CCyR and CHR after taking 2nd generation TKİs were considered for evaluation.
Results: All patients were in chronic phase:thirty four patients were men, 35 were women. The mean age was 53,7. Rate of low sokal risk score was 36,2% (17 patients), intermediate risk was 40,4% (19 patients) and high risk group was 23,4% (11 patients). As for the HASFORD risk score; groups were 53,2 low% (25 patients), 31,9 % intermediate (15 patients), 14,9 %high (7 patients).
Out of sixty nine patients, thirty seven used nilotinib, fifty nine patient used dasatinib. There were 27 patient who used both of 2nd generation TKIs. For patients treated with nilotinib; the third, 6th and 12th months MMR achievement rates were 76%, 73,7% and 85,7% respectively. While these were 70,6% and 71,4%over 12-24 months and after 24 months respectively. CHR and CCyR rates were 91,9% . For patients treated with dasatinib; the third, 6th and 12th months MMR achievement rates were 62,2%; 71,4% and 71,4% respectively, while it was 66% and 62,3% over 12-24 month and after 24 months respectively. CCR and CHR rates were 93,1%. The rate of side effects in patients treated with nilotinib was 29,7% and 30,5% for dasatinib with no differences. We have evaluated the overall survival (OS) for all patients and it was found 93 months for all patients and; 66 and 72 months for dasatinib and nilotinib respectively. Event free survival (EFS) rate for 2nd generation TKIs were 73 months, for dasatinib 55 months, for nilotinib 32 months.
Transformation to accelerated phase was observed only in 3 patients. Those patients are non-responsive to both nilotinib and dasatinib. Out of ten deaths 50% was found to be related to CML. There were no statistically differences in OS and EFS in terms of treatment with dasatinib or nilotinib.
Discussion: In our CML population, there were no apparent differences in treatment with either nilotinib or dasatinib of patients with CML in terms of efficacy, side effect profile, long term safety and OS, and EFS. Treatment selection for patients with CML resistant or intolerant to imatinib should be personalized based on patients characteristics.
Key Words: CML, Nilotinib, Dasatinib
İÇİNDEKİLER ÖZET... I ABSTRACT ... III İÇİNDEKİLER ... V ŞEKİLLER DİZİNİ ... VII TABLOLAR DİZİNİ ... VII KISALTMALAR ... IX 1. GİRİŞ ve AMAÇ ... 1 2. GENEL BİLGİLER ... 2
2.1. Tarihçe, Tanım Etiyoloji ve Epidemiyoloji ... 2
2.2. Patogenez ... 3
2.2.1. KML Moleküler Genetiği ... 3
2.2.1.1. ABL Onkogeni ... 3
2.2.1.2. BCR Geni ve Proteini ... 4
2.2.1.3. Bcr-Abl Füzyon Geni, Füzyon Proteini ... 4
2.2.1.4. Ph(-) KML ve Varyant Ph Patogenezi ... 6
2.2.2. Bcr/Abl Geni Tarafından Kontrol Edilen Malign Dönüşüm Mekanizmaları ... 6
2.2.2.1. Bcr/Abl-pozitif Hücrelerin Biyolojik Özellikleri ve Aktif Sinyal İleti Yolakları ... 7
2.2.2.2. Sinyal Yolaklarının Aktivasyonu ... 7
2.3. KML Tanısı ve Klinik Bulgular ... 8
2.4. KML Ayırıcı Tanısı ... 11
2.5. KML’de Prognoz ... 11
2.6. KML‘de Tedavi ... 12
2.6.1. Tarihçe ... 12
2.6.2. Genel Bakış ... 13
2.6.2.1. İmatinib Direnci ve İntolerans ... 15
2.6.3. Dasatinib ... 17
2.6.4. Nilotinib ... 19
2.6.5. Diğer Tedavi Seçenekleri ... 22 V
2.6.5.1. Bosutinib ... 22
2.6.5.2. Ponatinib ... 23
2.6.5.3. Omecexatine ... 24
2.6.5.4. Allojenik Hematopoetik Kök Hücre Nakli ... 24
2.7. Tedaviye Yanıtın Değerlendirilmesi ... 25
2.8. İzlem ... 26
3. GEREÇ ve YÖNTEM ... 39
3.1. Hastalar ... 29
3.2. Yanıt Değerlendirilmesi ... 29
3.2.1. Hematolojik Yanıt Kriterleri... 29
3.2.2. Sitogenetik Yanıt Kriterleri ... 30
3.2.3. Moleküler Yanıt Kriterleri ... 30
3.3. Başlangıç Tedavi Durumu ... 30
3.4. Yan Etki Durumu ... 31
3.5. Son Durum ... 31
3.6. İstatistiksel Analizler ... 31
4. BULGULAR ... 34
4.1. Hastaların Demografik ve Klinik Özellikleri ... 34
4.2. Moleküler Yanıt ... 36
4.3. Sitogenetik Yanıt ... 37
4.4. Hematolojik Yanıt ... 37
4.5. Yan Etki ve Doz Reduksiyonu ... 38
4.6. İzlem ve Son Durum ... 39
4.7. Yanıt Oranları Kıyaslaması ... 40
4.7.1. Sağkalım Üzerine Etkinlik... 42
5. TARTIŞMA ... 45
6. SONUÇLAR ... 52
KAYNAKLAR ... 54
ŞEKİLLER DİZİNİ
Şekil 1 : KML’ de t(9;22) translokasyonu ... 5
Şekil 2 : Lösemik proliferasyon ... 6
Şekil 3 : Bcr-Abl pozitif hücrelerde aktive olmuș sinyal yolakları ... 8
Şekil 4 : İmatinib aracılı Bcr/Abl inhibisyon mekanizması ... 14
Şekil 5 : Dasatinib etki mekanizması ... 18
Şekil 6 : Nilotinib ve dasatinibin kıyaslamalı toplam sağkalım eğrisi ... 42
Şekil 7 : İkinci kuşak TKİ toplam sağkalım eğrisi ... 42
Şekil 8 : Nilotinib ve dasatinib kıyaslamalı olaysız sağkalım eğrisi ... 43
Şekil 9 : İkinci kuşak TKİ olaysız sağkalım eğrisi ... 43
TABLOLAR DİZİNİ
Tablo 1 : Dünya sağlık örgütü kronik miyeloid lösemi evre tanımlamaları .... 10
Tablo 2 : Sokal ve Euro risk skorlamaları ... 12
Tablo 3 : Eşlik eden hastalığa ve mutasyona göre 2.kuşak TKİ seçimi ... 21
Tablo 4 : TKI’lerine direnç ile ilişkili mutasyonlar ... 22
Tablo 5 : KML’de Allojeneik Hematopoetik Kök Hücre nakli EBMT risk skoru ... 24
Tablo 6 : İkinci kuşak tirozin kinaz inhibitörlerine yanıt değerlendirmesi ... 27
Tablo 7 : KML’de AHKHN endikasyonları ... 28
Tablo 8 : Değerlendirmeye alınan tüm hastaların cinsiyet dağılımı ... 33
Tablo 9 : Değerlendirmeye alınan tüm hastaların yaş dağılımı... 33
Tablo 10 : Sokal risk grubuna göre hasta dağılımı ... 33
Tablo 11 : Hasford risk grubuna göre hasta dağılımı ... 34
Tablo 12 : Hastaların demografik ve klinik özellikleri ... 36
Tablo 13 : Nilotinib ve dasatinib kıyaslaması ... 40
Tablo 14 : 3. ve 6. ay yanıtlarının 2.kuşak TKİ alanlarda ortak kıyaslaması .... 40
Tablo 15 : 3. ve 12. ay yanıtlarının 2.kuşak TKİ alanlarda ortak kıyaslaması... 41
Tablo 16 : 3. ve 6. ay yanıtlarının nilotinib alanlarda kıyaslaması... 41
Tablo 17 : 3. ve 12. ay yanıtlarının nilotinib alanlarda kıyaslaması ... 41
Tablo 18 : 3. ve 6. ay yanıtlarının dasatinib alanlarda kıyaslaması ... 42
Tablo 19 : 3. ve 12. ay yanıtlarının dasatinib alanlarda kıyaslaması ... 42
Tablo 20 : 2.kuşak TKİ ortak, dasatinib ve nilotinib ayrı-ayrı şekilde sağkalım üzerine etkileri ... 48
Tablo 21 : Farklı çalışmalarda genel sağkalım ve olaysız sağkalım oranları .... 49
KISALTMALAR
Abl : Abelson geni
AHKHN : Allojeneik Hematopoetik Kök Hücre Transplantasyonu ALL : Akut Lenfoblastik Lösemili
AML : Akut Myeloid Llösemi ARA-C : Sitarabin arabinozid ARG : Abl ile ilişkili gen ATP : Adenosin trifosfat
Bcr : Breakpoint Cluster Region
BELA : Bosutinib Efficacy and safety in chronic myeloid Leukemia
DASISION : Dasatinib versus imatinib study in treatment naive CML-CP patients
EBMT : European Group for Bone Marrow Transplantation ELN : European Leukemia Net
ENESTnd : Evaluating Nilotinib Efficacy and Safety in Clinical Trials of Newly Diagnosed Ph+ CML Patients
EPİC : The Evaluation of Ponatinib versus Imatinib in Chronic Myeloid Leukemia
ET : Esansiyel Trombositemi FAK : Fokal Adezyon Kinaz
FDA : Food and Drug Administration FGFR : Fibroblast Growth Factor Receptor FISH : Fluoresans in situ hibridizasyon GAP : GTP-az aktive edici protein
G-CSF : Granulocyte colony-stimulating factor GDP : Guanidin difosfat
GM-CSF : Granulocyte Macrophage colony-stimulating factor GRB-2 : Growth factor receptor bound protein 2
GTP : Guanidin trifosfat
HLA : Human leucocite antigen
IRIS : International Randomized Study of İnterferon and STI571 IFN : Interferon
İS : International Scale
JAK : Janus Kinaz
KML : Kronik Myeloid Lösemi KNL : Kronik Nötrofilik Lösemi KSY : Kısmı sitogenetik yanıt KVS : Kardiyovasküler
LAP : Lökosit Alkalen Fosfataz aktivitesi LDH : Laktat dehidrogenaz
M-Bcr : Major Breakpoint Cluster Region m-Bcr : Minor Breakpoint Cluster Region MDS : Myelodisplastik sendromlar MPN : Myeloproliferatif neoplaziler MSY : Major sitogenetik yanıt NF-KB : Nükleer Faktör-Kappa Beta PCM : Plasma Cell Myeloma
PDGFR : Platelet-derived Growth Factor Receptor Ph : Philadelphia kromozomu
PV : Polisitemi Vera
RT/PCR : Real Time/Polymerase Chain Reaction RTK : Reseptör Tirozin Kinaz
Star-C : Src/Abl Tirozin Kinaz Inhibition Activity Research Trial C STAT : Signal transducers and activators of transcription
THD : Türk Hematoloji Derneği THY : Tam Hematolojik yanıt TKİ : Tirozin Kinaz İnhibitörü TMY : Tam Moleküler yanıt TSY : Tam Sitogenetik yanıt WHO : World Health Organization μ-Bcr : Mikro Breakpoint Cluster Region
1. GİRİŞ ve AMAÇ
Kronik myelositerlösemi (KML) myeloproliferatif kök hücre hastalığı olup myeloid hücre elemanlarının proliferasyonunda artış ve kemik iliğinde hipersellülarite ile karakterizedir (1). İnsidansı 1-2/100.000’dir ve erişkin lösemilerinin %15’ini oluşturur. Sıklıkla 40-60 yaşları arasında ortaya çıkar. Erkeklerde kadınlara göre 1,3/1 oranında görünür (2-4).İyonize radyasyona maruz kalmabilinen tek risk faktörüdür (5). KML’de ailesel yatkınlık saptanmamıştır (6, 7, 8). 1960 yılında Nowell ve Hungeford KML hastalığınpatogenezinde G kromozomu anormalliğini bularak hastalığın tedavisinde dönüşüm yaratmışlardır (9). İsmini bulundukları şehir olan Philadelphiaşehrinden alan Philadelphia(Ph) kromozomu, KML hücrelerinde bulunan kazanılmış sitogenetik anormalliktir. 9 ve 22. kromozomlar arası resiprokaltranslokasyon sonucu şimerik Bcr-Abl füzyon genini ortaya çıkarmaktadır (10). 1998 yılından yani imatinib kullanıma girmeden önce KML tedavisindebusulfan, hidroksiüre, interferon ve allojeneik kök hücre nakli yer alıyordu. Hastalık tedavi edilmediği sürece yaklaşık 4-5 yılda blastik faza transforme olarak hastalar hayatlarını kaybediyorlardı. Tirozinkinaz inhibitörlerinin (TKİ) kullanıma girmesiyle gelişmiş ülkelerde KML prevalansı artış göstermiştir ve 2050 yılında 180.000’den fazla KML hastası olacağı tahmin edilmektedir (11). Her geçen gün hastalığın tedavisinde yeni moleküller bulunmasına rağmen hastaların 1/3 bu tedavilere yanıt vermemektedir.
Biz bu çalışmamızda 2. Kuşak TKİ olan dasatinib ve nilotinibinEge Üniversitesi Tıp fakültesi Hastanesi Hematoloji bölümünde takip edilen imatinib dirençli veya intoleran KML hastalarındaki etkinliklerini değerlendirmeyi ve aldığımız sonuçları diğer literatür sonuçlarıyla karşılaştırmayı amaçladık.
2. GENEL BİLGİLER
KML myeloid öncül hücrelerinin aşırı klonal çoğalması ile karakterize kök hücre hastalığıdır. Hastalığın patogenezinde22. Kromozomun 11q bandındaki Bcr geni ile 9.kromozomun q34 bandına yerleşik Abl geninin 22. Kromozom (Ph kromozomu) üzerinde birleşmesi sonucu oluşan Bcr-Abl1füzyon geni başlıca rol oynamaktadır. Phkromozomumyeloid öncül hücrelerin çoğalmasına ve lökositoza neden olur. Bu genin ürünü P 210 peptidi (bcr-abl füzyon proteini)tirozinkinaz aktivitesine sahiptir (12, 13).
2.1. Tarihçe, Tanım Etiyoloji ve Epidemiyoloji
KML ilk defa 1845 yılında JohnHughesBennet tarafından tanımlanmıştır (9). İzleyen dönemlerde Robert Virchow periferik yayma ile leukemia-lösemi olabileceğini ön görmüştür (14). 1891 yılında Paul Erlich lösemi gruplandırmalarını yaparak KML hastalığını “splenomiyelojenik lösemi” adı altında myeloproliferatif hastalıklar grubuna dahil etmiştir (16). 1960 yılında Nowel ve Hungerford tarafından KML hastalarında kromozomalanormallik tespit edilerek, bu anormalliği yaşadıkları şehrin ismi ile Philadelphia (Ph) kromozomu olarak isimlendirmişlerdir. KML, kromozomalanormalliğin eşlik ettiği ilk malign hastalık olarak tanımlanmıştır (17). 1973 yılında JanetRowley translokasyonun 9.kromozom ile 22.kromozom arasında olduğunu göstermiştir (18).
KML, Bcr/Abl füzyon geni oluşumuna bağlı olgun ve olgunlaşmakta olan myeloid seri elemanlarının differansiyasyonlarının normal kaldığı, aşırı ve kontrolsüz çoğalma ile giden myeloproliferatif kök hücre hastalığıdır. KML 2008 WHO sınıflamasının 2016 revizyonunagöre myeloproliferatifneoplaziler arasında yer almaktadır.
Miyeloid neoplaziler 2008 WHO sınıflaması 2016 revizyonu (19) 1. Akut miyeloid lösemiler ve ilişkili neoplazmlar
2. Miyeloproliferatif hastalıklar
• KML-Kronik Miyeloid Lösemi, Bcr-Abl pozitif • KNL-Kronik Nötrofilik Lösemi
• PV-Polisitemi Vera
• ET-Esansiyel Trombositemi • Primer Miyelofibroz
• Kronik Eozinofilik Lösemi
• Sınıflandırılamayan myeloproliferatif neoplazm 3. Miyelodisplastik sendromlar
4. Mastositoz
5. MDS/MPN sendromları
• Kronik miyelomonositik lösemi
• Atipik Kronik Miyeloid Lösemi, Bcr-Abl1 negative • Juvenil Miyelomonositik lösemi
• MDS/MPN, ring sideroblast ve trombositozla • MDS/MPN, sınıflandırılamayan
6. Miyeloid/lenfoid neoplazmlar
• eozinofili vePDGFRA, PDGFRB veyaFGFR1’in yeniden düzenlenmesi veya PCM1-JAK2 ile KML erişkin lösemilerinin %15-20’ni oluşturmaktadır. Yıllık insidansı yaklaşık 1,6/100.000’dir. Erkeklerde daha sık görülmektedir (1,3/1 oranında). Ortalama görülme yaşı 50 olmasına rağmen hastalar yaklaşık 10 yıl sonra tanı alıyorlar (3,4). Yaşla beraber insidansı artış göstermektedir. KML hastalarının %30’u 60 yaş üzerindedir (20).
2.2. Patogenez
2.2.1. KML Moleküler Genetiği 2.2.1.1. ABL Onkogeni
Abl geni 9. Kromozomda yer alan abelson murin lösemi virüsünün Abl geninin insandaki eşdeğeridir. Tüm normal insan hücrelerinde bulunup 145 kDa non-reseptör kinaz proteinini kodlar.Non-non-reseptör kinaz proteini farklı alanlar taşımaktadır: SH1, SH2, SH3. SH1 tirozin kinaz aktivitesini taşır, SH1, SH2 Abl’in diğer proteinlerle etkileşimini sağlar. Bu alanlar protein uçta yerleşir (21,22).Normal
Abl proteini, hücre döngüsünü, bağlanmasını, büyümesini ve çoğalmasını aynı zamanda stres ortamında verdiği yanıtı kontrol eder.
2.2.1.2. BCR Geni ve Proteini
Bcr 22.kromozomun 11bölgesindeki 5,8 kDa kırık alanıdır. Birçok kırılma içermesi sebebiyle ’’breakpoint cluster region’’ adını almıştır. Yüz otuz kb alan kaplayan, 23 ekzon barındıran bir gendir. Bcr geni5-3 yönünde olup, 5 ucu sentromere yakındır (23). Bcr ilişkili 1 ve kendisini hedefleyen serin protein-kinazı kodlar. Bir sinyal proteini işlevi görür. Merkezinde Dbl–like ve pleksitrin alanları bulunur, bu alanlar Rho-guanidin değişim faktörü üzerindeki guanidin trifosfatı guanidin difosfata çevirerek nükleer faktör-kappa beta (NF-ĸB) gibi transkripsiyon faktörlerini tirozin kinazı aktif hale getirir (21). Rac ve Cdc42 proteinleri için GTPaz-aktive edici protein (GAP) fonksiyonu olan bir bölgesi Bcr’nin c terminal ucunda yer alır. GAP bölgesi GTP hidrolizini uyararak, merkezi Rho-GEF bölgesinin aksine, tirozin kinaz aktivitesinin inhibisyonuna neden olur (24).
2.2.1.3. Bcr-Abl Füzyon Geni, Füzyon Proteini
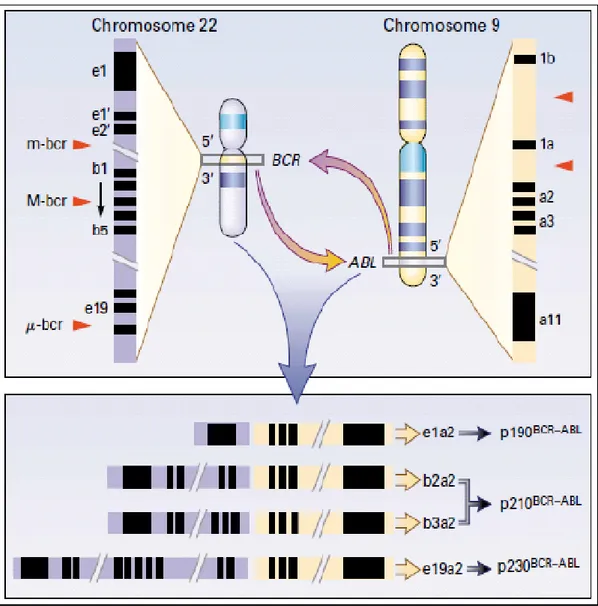
22.kromozom ve 9.kromozom arasında resiprokal translokasyon sonucu oluşur. 9q34 kromozomunda yer alan Abl geninde kırılma noktası, 300 kD’luk bir bölgenin 5’ ucundaki herhangi bir kısmında meydana gelebilir.Abl geninde kırılma noktası sabitdir fakat Bcr geni üzerindeki kırılmalar farklı noktalarda oluşur. Kırılma noktasının Abl’de sabit, Bcr’de ise değişken olması Abl geninin sağlıklı hücreleri değişime uğratarak kanser hücresine dönüşmesini sağlarken, Bcr geni hastalığın fenotipini etkilemektedir.Füzyon sırasında Abl’in 3’ ucu Bcr’ın 5’ ucuna eklenir. Füzyon geni Bcr promotorü kontrolündedir (25). Birçok KML hastasında ve akut lenfoblastik lösemili (ALL) hastaların 1/3’ünde, kırılma noktası 5,8 kb uzunluğunda olan 12. Ve 16.ekzonlar arasında meydana gelmektedir. Bu bölge majör-Bcr (M-Bcr) olarak adlandırılmaktadır. Kırılmanın bu bölgede meydana gelmesi ile b2a2 veya b3a2 genleri oluşur ve bu genler 210 kD moleküler ağırlığında Bcr/Abl füzyon proteini kodlar (Şekil 1).
Şekil 1: KML’ de t(9;22) translokasyonu-Faderl ve ark. (10)’ dan alınmıştır.
ALL hastalarının 2/3’ünde ve nadiren KML hastalarında kırılma noktası e2 ekzonunda oluşmakta ve 190 kD moleküler ağırlığında Bcr/Abl proteini kodlayan e2a2 geni oluşur. E2 ekzon bölgesinde oluşan kırılma noktası minör-Bcr (m-Bcr) olarak isimlendirilir. Son dönemlerde üçüncü bir kırılma noktası, e19 ekzonu üzerinde tespit edilmiş ve 230 kD moleküler ağırlığında Bcr/Abl proteinini kodladığı belirlenmiştir.Mikro-Bcr (μ-Bcr) olarak adlandırılan bu kırılma kronik nötrofilik lösemi hastalarında tespit edilmiştir.
2.2.1.4. Ph(-) KML ve Varyant Ph Patogenezi
KML’nin klinik özelliklerini gösteren bazı hastaların sitogenetik analizlerde Ph kromozomu saptanmaz. Medical Research Council tarafından yapılan büyük bir prospektif çalışmada bu duruma hastaların yaklaşık %15’inde rastlanmaktadır. Buna rağmen bu hastaların yarısında t(9,22) translokasyonunu maskeleyen kompleks kromozomal düzenlenmeler bulunmakta ve başka bir alt grupta ise karyotipik olarak Ph(-) iken metafaz/interfaz FISH (Fluoresans in situ hibridizasyon) analizleri ve RT/PCR (Real Time/Polymerase Chain Reaction) ile Bcr/Abl füzyon geninin kanıtı saptanabilmektedir. Bu grupta yer alan Ph(-) hastaların klinik bulgular bakımından Ph(+) hastalardan belirgin bir farkı bulunmamaktadır (26).
2.2.2. Bcr/Abl Geni Tarafından Kontrol Edilen Malign Dönüşüm Mekanizmaları
Şekil 2. Lösemik proliferasyon. (www.bloddjournal.hematologylibrary.org)
Abl tirozin kinazı sıkı kontrol edilmektedir ve SH1 alanı tarafından aktivitesi taşınır. SH3 alanı Abl proteinini inhibie eder, bu alanın delesyonu tirozin kinazı aktif hale getirir. Hücrelerin iyonize radyasyon gibi bir oksidatif stres altında kalması da, küçük proteinlerin oksitlenmesine ve Abl’den kopmasına yol açarak kinazı aktif hale çevirir (22). KML’de Ph(+) myeloid progenitörler, artmış proliferasyona da bağlı olarak, kemik iliği ve kanda geniş bir alana yayılmışlardır. KML’deki anormal füzyon proteini olan Bcr/Abl primer mitojenik aktiviteye sahiptir ve büyüme faktörlerinin yokluğunda bile hematopoetik hücre hatlarında, hücre siklusuna girişi stimüle edebilir (27,28).
2.2.2.1. Bcr/Abl-pozitif Hücrelerin Biyolojik Özellikleri ve Aktif Sinyal İleti Yolakları
Bcr/Abl füzyon proteini tarafından oluşturulan malign transformasyonun dört temel mekanizması mevcuttur.
1. Hücrelerin stromal hücreler ve hücre dışı matrikse olan bağlanma özelliğinin değişimi,
2. Mitotik bölünmeyi sağlayan sinyal ileti yolaklarının sürekli aktif tutulması, 3. Apoptozun engellenmesi,
4. Proteazomlarca Abl gen aktivitesini engelleyen proteinlerin parçalanması. KML öncül hücreleri hücredışı matrikse ve kemik iliği stroma hücrelerine düşük bağlanma özelliği gösterir.Çoğalma için stromal hücrelerle temas gerekli değildir fakat diffüze olabilen faktörler çoğalmayı sitimule eder (29).
2.2.2.2. Sinyal Yolaklarının Aktivasyonu
Bcr-Abl birçok sitoplazmik substratıfosforile eder, büyümeyi, farklılașmayı ve hematopoetik hücrelerinadezyonunu kontrol eden sinyal yollarını aktive eder. STAT (signal transducers andactivators of transcription) moleküllerini, GRB-2 ve Crkl gibi Ras aktive edici adaptörmoleküller aracılığıyla da mitojenik sinyal yolaklarını aktive etmektedir. Aktivasyon ile hücreproliferasyonu artar ve kontrolsüz büyümeye neden olur. Ayrıca aktin moleküllerinebağlanarak paxillin, talin gibi sitoiskelet düzenleyicierini, FAK gibi fokal adezyonkomplekslerini fosforilleyerek hücre adezyonunu değiștirir. Bcr-Abl hücreye sürekli biryașam sinyali sağlar,
STAT/Akt/PI63K molekülleri üzerindeki etkisiyle mitokondriüzerinden hücrelere anti-apoptotik özellik kazandırır ve proliferasyonu artırır (30). (Șekil 3)
Şekil: 3. Bcr-Abl pozitif hücrelerde aktive olmuș sinyal yolakları (30,31)
P16 ve p14 gibi tümör süpresör genlerindeki mutasyon/delesyonlar p53’ünifadesinde azalmaya ve G1/S fazı siklin D-cdk4/cdk6’nın inhibisyonuna yol açar. P16homozigot delesyonu ve p53 mutasyonları çoğu blastik krizdeki hastada gözlenmektedir (32).
2.3. KML Tanısı ve Klinik Bulgular
KML tanısı periferik kan yayması, karyotip analizi, polimeraz zincir veya southern blot reaksiyonları, kemik iliği biyopsisi incelemeleri ile konur (33). Tanı anında hastaların %30 asemptomatik olup, rutin muayenelerinde lökosit yüksekliği saptanması ile yapılan ileri tetkiklerle tanı alır. Kromozomal anormalik oluşumundan KML kliniğinin gelişmesine kadar 7-8 yıl geçmektedir (34).
Hastalığın 3 klinik evresi mevcuttur: kronik, hızlanmış ve blastik evre. Eğer hastalar tanı sonrasında tedavi edilmezler ise, kronik evreden sonra genellikle 3-5 yıl içerisinde önce hızlanmış ardından da blastik evre gelişir. Blastik evre birkaç ay sürer ve ölümle sonuçlanır. Hastaların büyük bölümü (yaklaşık %85), tanı anında kronik evrede, %10’u hızlanmış evrede ve %5’i blastik evrede saptanmaktadır (10). Hastalığın seyrinde anemiye bağlı halsizlik, çabuk yorulma, efor intoleransı, 8
fonksiyonel kapasitede azalma; splenomegaliye bağlı karında şişlik, ağrı, erken doyma, hipermetabolik duruma bağlı ateş, iştahsızlık, kilo kaybı, gut, trombosit fonksiyon bozukluğuna bağlı hemoraji, ekimoz, hematom, tromboembolik olaylar, retinal hemoraji, hiperlökositoz ve hipervizkoziteye bağlı tinnitus, stupor, görme bozukluğu, nefes darlığı, priapizm, serebrovasküler olaylar gibi semptomlar ortaya çıkar. Lökositoz hastalığın tipik bulgusudur. Lökosit sayısı 15.000–500.000/μl arasında değişir. Tedavi edilmeyen olgularda total lökosit sayısı progresif olarak artış gösterir. Hastalığın seyrinde myeloid serinin değişik aşamalarındaki tüm immatür hücreler görülsede genellikle normal görünümlü lökositler izlenir. Bazofil, eozinofil ve monositler de artmıştır. Bazofili prognostik önem taşır. Ortalama blast prevelansı %3 civarındadır ve %10’a kadar çıkabilir. Trombosit sayısı da genel olarak artmıştır, görünümleri değişkenlik gösterebilir. Trombosit sayısının 1.000.000/μl’nin üzerinde bulunması nadir değildir ve 5.000.000-7.000.000/μl kadar yüksek olabilir. Trombositopeni nadir olarak görülür ve blastik faza geçiş öncesi prezente olur. Hematokrit çoğu hastada tanı anında düşüktür. Eritrositler, boyut ve şekil değişkenliğinde artışla beraber sadece hafif değişiklikler gösterme eğilimindedir. Az sayıda çekirdekli eritrosit ve hafif retikülositoz görülebilir. Periferik yaymada iri trombositler gözyaşı şeklinde eritrosit hücreleri görülür. Bazen çoğalarak myelofibroza benzeyebilir. Yaymada lökoeritroblastik tablo görürüz. Nötrofillerdeki alkalen fosfataz aktivitesi (LAP) %90 KML hastasında azalmıştır. Normali 20-100 arasıdır. Kronik evrede lökosit sayısı azaldığında, araya enfeksiyongirdiğinde LAP aktivitesinde artış görülür (20). Biyokimyasal olarak ensık LDH yüksekliği ile karşılaşırız. Aynı zamanda hiperürisemi, hiperürikozüri de görülür. Kemik iliği sitolojik incelemesinde sellülarite artışı gösterir, myeloid/eritroid serinin oranı 10/1 bile üzerinde olur. Eozinofil ve bazofillerin sayısında artış, megakaryositler normal veya sayıca artmış olup displastik izlenir. Eritropoezis azalmıştır. Eritroid maturasyon ve yağ hücrelerinde azalma görülür. Kronik dönemde blast+promyelosit oranı %30’un altındadır. Retikulin fibrozis artışı hastalık süresi ile beraber artmaktadır. Fibrozisdeki artış büyük dalak boyutu, ciddi anemi, kemik iliği ve periferde yüksek blast sayısı ile de korelasyon gösterir.Sitogenetik incelemlerde t(9;22)(q34;q11) ve Ph kromozomu %90’dan fazla hastada izlenirken, %5’inde kromozom 9 ve 22’ye ek olarak gelişen varyant gen rearanjmanları saptanabilir (35). RT/PCR ile Bcr-Abl ürünleri tespit edilir. Oldukça yüksek özgüllüğüye ve duyarlılığa sahiptir ve sonuçları hızlı elde edilir. Bu yöntemle kırılma noktalarının 9
tesbiti ALL, KML, AML (akut myeloid lösemi), kronik nötrofilik lösemiyi birbirinden ayırmada kullanılır. Kronik faz KML hastalarını değerlendirirken detaylı öykü ve fizik muayene alınmalı, periferik kan yayması ve biyokimyasal belirteçler değerlendirilmelidir. Moleküler yanıtın izlemi için Bcr-Abl1 takibi yapılmalıdır. Kemik iliği aspirasyon ve biyopsisi (blast ve bazofillerin yüzdesi, konvansiyonel sitogenetik inceleme, gerektiğinde FISH incelenmelidir (36). Kronik faz KML’de dalak ve karaciğerde infiltrasyon olur, lenfadenopati genellikle görülmese de saptandığında terminal döneme geçiş açısından uyarıcıdır.
Tablo 1: Dünya sağlık örgütü kronik miyeloid lösemi evre tanımlamaları
Kronik Evre-Yüksek Risk Hızlanmış Evre Blastik Evre
Tedavi öncesi trombosit sayısının >1.000.000/mm3
Çevresel kan lökositlerin ve/veya çekirdekli kemik iliği hücrelerinin %10-19’unun blast olması
Çevresel kan lökositlerin ve/veya çekirdekli kemik iliği hücrelerinin
%20’sinin blast olması
Kronik Evre-Düşük Risk Çevresel kandaki
bazofillerin >%20 olması Kemik iliği dışı blastik proliferasyon
Çevresel kan lökositlerin ve/veya çekirdekli kemik iliği hücrelerinin
<%10’unun blast olması
Tedavi ile ilişkisiz kalıcı trombositopeni
(<100.000/mm3) veya tedaviye yanıtsız kalıcı trombositoz
(>1.000.000/mm3)
Kemik iliği biyopsisinde gruplar halinde blastların olması
Çevresel kandaki
bazofillerin <%20 olması
Tedaviye yanıtsız ve giderek artan dalak
büyüklüğü ve lökosit sayısı Sitogenetik olarak klonal dönüşüm
Tedavi almayan hastalarda ortalama 3-4 yıl içinde öncelikle akselere ardından blastik faz gelişir. Blastik faz KML 2 formda karşımıza çıkar: miyeloid ve lenfoid. Miyeloid form %70, lenfoid form %30 gelişir. Blastik faz KML hastalarında kemoterapi ile tek başına yanıt alınmaz, TKİ ile beraber verilmesi önerilir (37, 38, 39).
2.4. KML Ayırıcı Tanısı
-Atipik KML: Yüksek nötrofil sayısı, hem miyeloid seride proliferasyon, hem de displazi ile karakterize bir tablodur. Anemi veya trombositopeni de bulunabilir. Kemik iliğinde blast artışı izlenmez, monositoz yoktur. Granülositik serinin proliferasyonuna bağlı hipersellülarite izlenir. KML’den nötrofillerle beraber megakaryositik ve eritroid seride de displazi olması ile farklanır.
-Kronik Myelomonositik Lösemi (KMML): Olgun monosit hücrelerinin proliferasyonu ile karakterize tablodur. Ph kromozu saptanmaz ve kemik iliğinde iki veya üç myeloid seride displazi gözlenir.
-Kronik Eozinofilik Lösemi: Eozinofilik serinin proliferasyonu ve end organlara infiltrasyonu ile patognomoniktir. Bcr/Abl gen füzyonu ve Ph kromozomu saptanmaz.
-Kronik Nötrofilik Lösemi: Kanda ve kemik iliğinde artmış olgun granülositik proliferasyon ve hepatosplenomegali izlenir. Sıklıkla nötrofillerde toksik granülasyon, nükleer hipersegmentasyon ve artmış LAP skoru gözlenir. Bcr/Abl gen füzyonu veya Ph kromozomu bulunmaz.
-Diğer Ph(+) Maligniteler: Ph+ akut lösemilerin özellikle KML-blastik krizden ayırt edilmesi zor olabilir. KML’de Ph kromozomu nötrofillerde ve lenfoblastlarda saptanır. Ph(+) ALL’de ise söz konusu anormallik lenfoid hücrelerle sınırlıdır (40,41).
-Lökomoid Reaksiyon: Genellikle enfeksiyonlara cevap olarak gelişir. Periferik kanda nötrofili ve sola kayma, yüksek lökosit sayımı (50.000/μl’ye ulaşabilir) oluşur. Bu yönüyle KML ile karıştırılabilir. Fakat açık bir infeksiyon kanıtının bulunması, daha çok olgun hücrelerin (band ve segment) görülmesi, bazofillerin artmaması, nötrofillerdeki toksik granülasyon, yüksek LAP skoru ve sitogenetik analizin normal olmasıyla KML’den ayırt edilebilir.
2.5. KML’de Prognoz
Tanı anındaki hastalık evresi hastalığın prognozu açısından en önemli göstergedir. Tanı anında kronik fazda olan hastalarda tedavi ile hastalığın kontrolü uzun yıllar sağlanabilirken, akselere faz ya da blastik krizdeki hastalarda kötü 11
prognoz beklenir. Bununla beraber tirozin kinaz inhibitörlerine direnç ile ilişkili Bcr/Abl T315I mutasyonu varlığı da kötü prognozla ilişkili bulunmuştur (42).
KML Risk Skorlaması
Tanı anında Sokal, Hasford (Euro) skorlamaları yapılmalıdır. Sokal skoruna göre düşük risk grubunda (<0,8) olan hastalarda ortalama yaşam beklentisi 4,5 yıl, orta risk grubunda (0,8-1,2) 3,5 yıl ve yüksek risk grubunda (>1,2) ise <2,5 yıl olarak saptanmıştır (43). Hasford skorlama sistemine göre düşük risk gruplu hastaların (<780) ortalama sağ kalım 96 ay, 5 yıllık sağkalım oranı %75, yüksek risk grubunda (>1480) ise ortalama sağkalım 42 ay, 5 yıllık sağkalım %28 saptanmıştır (44).
Tablo 2: Sokal ve Euro risk skorlamaları (KML tanı/tedavi kılavuzu 2016,THD)
I-Sokal risk skoru Hesaplanması Risk Sınıflandırması
0.0116 x [yaş (yıl) - 43.4)] + 0.0345 x (dalak -7.51)
+ 0.188 x [(trombosit sayısı/700)2 - 0.563] +0.0887 x (blast - 2.10)
Düşük risk <0.8 Orta risk 0.8-1.2 Yüksek risk >1.2
II-Euro, Hasford risk skorlaması (modifiye Sokal) Risk Sınıflandırması
Yaş≥ 50 ise 0.666 + (0.042xdalak boyutu) + trombosit sayısı> 1500 x109/L ise 1.0956 + (0.0584 x blast
+bazofil sayısı > %3 ise 0.20399 + (0.0413 x eozinofiller)x100
Düşük risk ≤780 Orta risk 781-1480 Yüksek risk >1480 Not: Dalak büyüklüğü kot kavsinden en uzak nokta (cm) olarak alınır, blast, bazofil ve eozinofiller periferik kandaki yüzdelerdir. Tüm bu faktörler herhangi bir tedavi başlanmasından önceki değerlerdir (45).
IRIS (International Randomized Study of Interferon and STI571) çalışmasında karşılaştırmalı imatinib ve interferonun kullanan hastaların 5 yıllık verilerinin değerlendirmelerinde; imatinib kullanan hastalarda, Sokal sınıflamasına göre düşük risk grubundaki hastalarda tam sitogenetik yanıt (TSY) %89, orta risk grubunda %82, yüksek risk grubunda %69 saptanmıştır (46).
2.6. KML‘de Tedavi
2.6.1. Tarihçe
KML’de 1985 yılında Dr. Rudolf Virchow ve Dr. John Hughes Bennett tarafından ampirik tedavi olarak fowler solusyonu denenmiştir. Bu hastalara
1950 yıllarında splenomegali açısından radyoterapi yapılmıştır Rasyonel tedavi hastalığın patogenezi öğrenilmeye başladıktan sonra geliştirilmiştir. Altmışlı yıllarda alkilleyici ajanlar kullanılmaya başlanmış, KML ve Hodgkin lenfomalarda denenmiştir. KML’de bu ajanlar, lökosit sayısında hızlı azalma ve dalak boyutunda küçülmeye neden olmuştur. Fakat çalışmalar bu tedavilerin sağkalıma etkisi olmadığını göstermiştir. Benzer etki gösteren hidroksiürede sağkalıma fayda sağlamamasına rağmen, yan etkisinin daha az olması sebebiyle KML tedavisinde bir süre yer almıştır. 1970-80 yıllarında kök hücre nakli yapılarak uzun süreli sağkalım sağlanmış faka tküratif bir tedavi seçeneği olmasına rağmen komplikasyonları ile sık karşılaşılmıştır. 1960 yılında hastalığın patogenezinde kormozomal anormalik olduğu bilinmesine rağmen tirozin kinaz inibitörlerinin KML tedavisinde etkili olacağı 2001 yılında Druker ve ark. tarafından gösterilmiştir (37). Bunun ardından 2001 yılında yapılan IRIS çalışmasında imatinib mesilat kullanan hastalar, interferon alfa-sitozin arabinozid kombinasyonu kullanılan hastalar ile karşılaştırıldı. İmatinib kullanan hastalarda TSY oranın interferon-alfa/sitozin arabinozid koluna göre anlamlı fark elde etmesi üzerine imatinib mesilat KML hastalığının tedavisinde ilk önce tedaviye yanıtsız hastalarda ve ardından da birinci basamak tedavi olarak yerini aldı (47). 2007 yılında imatinib direnci nedeniyle ikinci kuşak tirozin kinaz inhibitörleri olan Dasatinib ve Nilotinib, FDA’nın onayı ile kullanıma girmiştir. Yeni tedavi seçenekleri olan bosutinib, ponatinib, danusertib, omecexatine 2010 yılından sonra geliştirilmeye başlanmıştır.
2.6.2. Genel Bakış
Tirozin kinaz enzimi adenozin trifosfattan hedef proteinine fosfor grubunu taşır, fosforilasyonu katalize eder. Bu enzim hücrenin normal bölünmesinde önemli rol alarak, sinyal iletimi, hücrelerin çoğalması, apoptozisi gibi fonksiyonlarını da kontrol eder. Bu yolaklarda meydana gelen bazı değişimler de kanser oluşmasına sebep olur. Tirozin kinazlar reseptör ve non-reseptör olarak iki sınıfa ayrılır. RTK (reseptör tirozin kinaz) membran yerleşimli, non-reseptör TK sitoplazma yerleşimlidir (48). RTK sinyal transdüksiyon yolağının temel bileşeni olarak hücre-hücre iletişimine yardımcı olur. RTK ailesine 58 transmembran proteini dahildir. İnsülin reseptörü, büyüme faktörleri reseptörleri ve efrin reseptörleri bu aile içerisinde yer alır. Transmembran proteinler, polipeptid ligandları da bağlayarak
hücresel büyüme, farklılaşma ve metabolizasyon gibi süreçlerde önemli rol oynarlar (49,50). Non-reseptör tirozin kinaz ise ATP’den fosfat grubunu tirozin aminoasitine transfer eder. Bu grup içerisinde Src, Abl, fokal adezyon kinazı (FAK) ve janus kinaz (JAK) proteinleri yer almaktadır (50). Bu enzimlerin aktivasyonu tumörgenez ve transformasyon gibi malignite oluşumuna yardımcı hücresel olayları provoke eder. Tirozin kinaz inhibitörleri bu enzimlerin fosforilasyonunu durdurarak hücre bölünmesini engeller, kanser hücresinin apopitozunu sağlar.Hedef kinaz spektrumu açısından farklı etki gösteren TKİ’lar mevcuttur. İmatinib ilk üretilen tirozin kinaz inhibitörüdür.2001 yılında IRIS çalışmasında imatinible tedavi edilen hastalarda %83, interferon/sitozin arabinozid alanlarda ise %20 major sitogenetik yanıt (MSY) alındı. 2002 yılında KML tedavisinde birinci basamakta yerini aldı (46, 47). İmatinib mesilat Bcr-Abl’ye bağlanır, hücre içinde cKit, PDGF-R (plateletderived growth factor receptor) ve ARG (Abl ile ilişkili gen) kinazları da inhibe eder.ATP defosforile olamadığı için Bcr-Abl içeren malign hücreler bölünemez, normal sağlıklı hücreler diğer yolaklarla döngüsünü tamamlar (şekil 4) (51). İmatinib oral yolla alınır ve günlük dozu 400 mg olup yarılanma ömrü 18 saatdir (52).
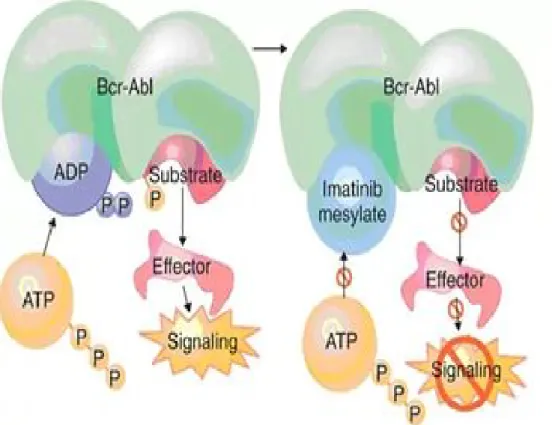
Şekil 4: İmatinib aracılı Bcr/Abl inhibisyon mekanizması
Sol tarafta Bcr-Abl kinaz alanına substrat proteinin bağlandığını gösterir. Kinazın enzimatik aktivitesi ile protein fosfatlanır. Sağ tarafta İmatinib kinaz alanına bağlanmak için substratla yarıșır. İmatinib kinaz alanına bağlandığında substrat protein fosforillenemez ve tümör hücresi çoğalma sinyallerini alamaz (53).
İmatinib tedavisi ile uzun süreli remisyonlar sağlanmasına rağmen hastaların bir kısmında imatinibe direnç gelişmektedir. İmatinib direnci primer ve sekonder olmaktadır. Primer direnç tedaviye başlandığından itibaren yanıt elde edememe, sekonder yanıtsızlık yanıt alınmasından birsüre sonra yanıt kaybıdır. İmatinib direnci Bcr-Abl’in ATP bağlayan bölgesindeki nokta mutasyonları sonucu oluşmaktadır. Yapılan araştırmalarda 18 farklı nokta mutasyonu bulunmuştur. Özelikle T315I mutasyonu imatinib doz artımı ile aşılamaz ve dirençli klonlarda görülür (54). İmatinib ile hastaların yaklaşık %15’de sitogenetik yanıt alınamaz, aynı zamanda %1 hasta ilacı tolere edemez. Bu grup hastalarda ikinci basamak tedavi 2.kuşak TKİ olan nilotinib ve dasatinibdir (55).
2.6.2.1. İmatinib Direnci ve İntolerans
İmatinib, 400 mg/gün dozunda özellikle kronik fazda hematolojik, sitogenetik, hatta moleküler remisyon (Bcr/Abl füzyon transkriptinin kaybolması) sağlayabilmektedir ve oral olarak çok iyi tolere edilir. Fakat ilaca bağlı yan etki gelişme, ilacı alamama ve yanıtsızlık geliştiği durumlarda tedavi değişikliğine gidilmektedir.
İmatinib direnci oluştuğu zamana göre primer ve sekonder olarak iki grupta ayırt edilir.
Primer (interensek) direnç:imatinib ile tedaviye başlandığında etkin yanıtın yani 3.ayda THY (tam hematolojik yanıt) ve 6. ayda MSY veya 12. ayda TSY (tam sitogenetik yanıt) elde edilememesi olarak tanımlanır.
Sekonder (edinsel) direnç ise imatinib tedavisi sonrası ilk yanıtı takiben daha sonra her hangi zaman diliminde gelişen yanıt kaybı olarak tanımlanır (56). Primer ve sekonder direnç dışında direnç hematolojik, sitogenetik vemoleküler direnç olarak alt gruplara ayrılabilir.
Hematolojik direnç; kronik faz hastada tam hematolojik yanıtın olmaması, akut fazdaki hastaların kronik faza geçememesi veya blastik krizde ve ALL’de kısmi yanıt olarak tanımlanır.
Sitogenetik direnç major sitogenetik ya da tam sitogenetik yanıt eksikliği veya kaybıdır.
Moleküler direnç ise tam moleküler yanıt kaybı veya eksikliği olarak tanımlanır. Major moleküler yanıt kantitatif olarak Bcr/Abl transkriptlerinin ≥3 log azalması veya bir Bcr-Abl /Abl oranında <%0.1 olarak tanımlanır (57).
Primer direnç, imatinib alan kronik faz KML hastalarının %25’de görülebilir. Sekonder direnç ise yaklaşık iki yıl içinde hastalığın tanı anındaki evresine göre sırasıyla blastik faz, akselere faz ve kronik faz hastalarda %80, %50 ve %15 oranlarında gelişir.Primer direnç imatinib dozunun arttırılması ile büyük oranda giderilebilir. Sekonder imatinib direncinin gelişmesinde iki farklı mekanizma mevcuttur: Bcr/Abl’ye bağımlı ve Bcr/Abl’den bağımsız mekanizma
Bcr/Abl bağımlı direnç mekanizmaları başlıca olarak ATP bağlayan domainde (P-loop) veya Bcr/Abl onkoproteinin aktivasyon loopda noktasal mutasyonlar, Bcr/Abl füzyon geninde genomik amplifikasyon, Bcr/Abl yazımında düzensizlik, çoklu direnç proteinlerinin düzensizliği nedeni ile imatinibin hücre dışına atılması ve imatinib’in hücresel biyo-kullanılabilirliğinin azalmasına dayanmaktadır. Bcr/Abl’de kinaz bölgesi mutasyonları, kazanılmış imatinib direnci olan hastaların %50-60’ını oluşturur. Hem primer, hem de sekonder direnç ile ilgili saptanmış olan 50’den fazla mutasyon mevcut olup, bulundukları bölgeye göre dört gruba ayrılabilirler (58).
1. P-loop= fosfat (ATP) bağlamadan sorumlu bölge mutasyonları – V289, G250E, E255K, Q252H
2. Aktif bölgedeki mutasyonlar
– IM bağlanma bölgesinde= V289A, T315I, F317L – Doğrudan H bağı ile etkileşen= T315I
– Van der Waals etkileşimleri= V289, T315I, F317
3. IM bağlanma bölgesinden uzakta aminoasitleri içeren mutasyonlar – M315, E355, F486S
– Enzimin C terminal lobunda E, F ve I heliksleri arasında bir hidrofobik yama oluşturur ve tirozin kinaz ailesi arasında yüksek oranda korunur
4. Aktivasyon bölgesi mutasyonları:
--Esnek sekansın bağlanma bölgesine yakındır
En sık gözlenen ve en yüksek derecede in vitro ve klinik direnç ile ilişkili olan mutasyonlar; imatinib bağlanma bölgesinde bulunan Y253H, F317L, T315I ve ATP bağlama bölgesinde bulunan E255K’dir. T315I mutasyonunda 2.kuşak TKİ olan dasatinib ve nilotinib de tedavide etkili değildir. Bu mutasyonda allojeneik hematopoetik kök hücre transplantasyonu (AHKHN) önerilmekte ve yeni TKİ’leri üzerinde çalışılmaktadır. Y253H, E255K mutasyonlarında ise dasatinib nilotinib'den daha etkili, F317L mutasyonunda ise nilotinib dasatinib'den daha etkili olduğu bildirilmektedir. Genel olarak P-loop mutasyonları azalmış sağkalım ile birliktedir.
Bcr/Abl’den bağımsız mekanizmalar ise taşıyıcı proteinlerde (OCT1, MDR1) ve farmakolojik bariyerlerde (CYP3A 4/5 indükleyiciler) olan değişiklikler, NF-kappa B, SHP-1, p53, RB, p16 mutasyonları, EVI ve myc aşırı ekspresyonu, kromozomal değişiklikler, ek Ph kromozomu kazanımı, Src ilişkili Lyn/Hck kinazların aşırı ekspresyonu gibi bazı sekonder genetik değişikliklere bağlıdır (59, 60).
2.6.3. Dasatinib
Dasatinib, T315I ve F317V mutasyonları dışında imatinib rezistan birçok Bcr-Abl gen mutasyonlarını hedef alır. Aynı zamanda SRC ailesi ( SRC, LKC, YES, FYNdahildir); c-KIT, EPHA2 vePDGFRβ’yıda inhibe eder. Dasatinib 2006 yılında kullanıma girmiştir. İmatinible kıyaslamada 325 kat daha potent olduğu saptanmıştır. Dasatinibin bu potentliği Abl kinazın aktif ve inaktif her iki formuna bağlanabilmesi ile ilişkilidir. İmatinibe karşı dirençli olan Src kinaz ailesi ve çoklu ilaç direnci-1 gen aşırı üretimi gibi birçok alternatif sinyal yolaklarını da inhibe etmektedir (61).
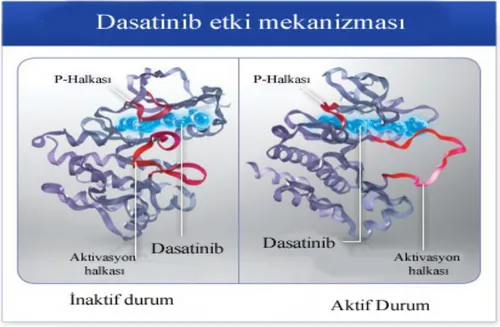
Şekil 5: Dasatinib etki mekanizması
Dasatinibin in vitro 19 Bcr-Abl mutasyonunun 18’ine inhibitör etkisi çalışmalarla gösterilmiştir. T3151 mutasyonu imatinib, dasatinib ve nilotinibe karşı dirençli olup KML hastalarında kemik iliği nakli yapılması endikasyonudur. Kantarjian ve ark. tarafından yapılan dasatinib versus imatinib study in treatment naive CML-CP patients (DASISION) çalışması 26 ülkeden 108 merkezi içermektedir. Çalışmaya 519 yeni tanı kronik faz KML hastası alınmış ve 259 hastaya dasatinib 100 mg, 260 hastaya imatinib 400 mg verilmiştir. Beş yıl takip sonunda majör moleküler yanıt ve 4-4.5 log moleküler yanıt oranları arasındaki fark dasatinib kolu lehine anlamlı daha yüksek bulunmuştur. Progresyonsuz sağkalım ve toplam sağkalımda oranları her 2 ilaç grubu için benzer saptanmıştır. Faz 3 çalışmasının sonunda dasatinib kolunda tedavi devamlılığı %61, imatinib kolunda ise %63’tür. Beş yıllık progresyonsuz ve genel sağkalım oranları her 2 kolda yüksek olup bir-birine benzerdi (dasatinib %91, imatinib %90). Üçüncü ayda Bcr-Abl ≤%10 olan hasta oranı dasatinib kolunda %84, imatinib kolunda %64 idi. Beş yıllık MMY (major moleküler yanıt) ve MY4,5 oranları dasatinib kolunda %76 ve %42 iken
imatinib kolunda %64 ve %33 olarak dasatinib lehine anlamlı farklı bulundu (62). Akselere veya blastik faza dönüşüm, sırasıyla dasatinib ve imatinib kollarında %5 ve %7 oranında gerçekleşti.Tedavi sonlandırıldığında dasatinib alan 15 hastada, imatinib alan 19 hastada Bcr-Abl mutasyonu görüldü. İlaç ilişkili en sık görülen non-hematolojik olay plevral efüzyon idi. Dasatinib alan kolda %28 iken imatinib alan kolda %0,8 idi. Daha potent olması nedeniyle dasatinibde hematolojik yan etkiler ve 18
plevral efüzyon sık görülmektedir (62). Yapılan çalışmalarda dasatinib dozu 70 mg iken plevral efüzyon ve hematolojik yan etkiler anlamlı derecede daha az görülmüştür. Star-C (Src/Abl Tirozin Kinaz Inhibition Activity Research Trial C) çalışması dasatinib ile ilgili yapılan en geniş ve kapsamlı çalışmalardandır. Toplam 387 hasta ile yapılmış ve bu hastaların 288’i imatinib dirençli ve 99’u imatinib intolerandı. Hastalara günde 2 kez 70 mg dasatinib verilmiş ve medyan 15,2 aylık izlem süresinin sonunda THY %91, MSY %59 ve TSY %49 saptanmıştır. MSY gelişenlerin %97’sinde 18.ayda da yanıt durumu korunmuş ve hastalıksız sağkalım oranı %90, genel sağkalım %96 bulunmuştur. Grade 3/4 hematolojik yan etkiler; trombositopeni (%48), anemi (%22), nötropeni (%49) ve lökopeni (%27) iken en önemli grade 3/4 non-hematolojik yan etki plevral effüzyon (%6) olmuştur (63). Doz bağımlı yan etki profili değerlendirilmesi açısından faz 3 çalışmasında dasatinibin doz optimizasyonu yapılmıştır. Altı yüz yetmiş kronik faz KML hastasına günlük 1x100 mg, 2x50 mg, 1x140 mg, 2x70 mg şeklinde 4 farklı dozda dasatinib verilmiştir. Günlük 1x100 mg dasatinib verilen hasta grubuyla, 2x70 mg alan grubu kıyaslandığında MSY oranları benzer bulunurken, plevral effüzyonu da içeren grade 3/4 hematolojik ve non-hematolojik yan etki oranlarında azalma gözlenmiştir (64). FDA tarafından 2006 yılında dasatinib için önerilen doz 100 mg günde tek doz olarak belirlendi. Akselere ve blastik fazda doz yükseltilmesi daha etkin bulunmuştur. Günlük 2x70 mg veya 1x140 mg kullanılması halinde çift doz kullanımı daha avantajlı saptanmış, yan etkiler daha az görülmüştür (65, 66). Y253H, E255KN veya F359N/C/I mutasyonları dasatinib ve bosutinibe daha duyarlıdır (Şekil 6).
2.6.4. Nilotinib
Nilotinib 2007 yılında onaylanan 2.kuşak TKİ’dır. İmatinibin analoğu olupBcr/Abl, ARG, KIT, PDGFR ve efrin reseptörlerini inhibe etmektedir. Etki mekanizması imatinibe benzer olmasına rağmen imatinib direnci olmayan hücre dizilerinde 43 ila 60 kat daha fazla, imatinib direnci olan hücre dizilerinde 20 kat daha fazla potenttir.V299L, T315AyadaF317LN/I/C mutasyonlarına daha sensitiftir. Y253H, E255V/K ve F359V/C mutasyonları ise nilotinibe daha az duyarlıdır (55,67). Nilotinib de imatinib ve dasatinib gibi T315I mutasyonuna karşı etkisizdir. İmatinib direnci olan 33 mutasyondan 32’sine karşı direnç mevcut değildir. Yüz on dokuz 19
imatinib dirençli hastada yapılan faz 1 çalışmada 50 mg ile 600 mg arasında nilotinib verilen hastalarda KML’nin tüm fazlarında etkin olduğu görülmüş ve günde 2 kez 400 mg verilmesi uygun doz olarak bulunmuştur. Kronik fazdaki 12 hastanın 11’inde (%92) THY, akselere fazdaki 46 hastanın 33’ünde (%72) hematolojik yanıt, 22’sinde (%48) sitogenetik yanıt(%39) ve blastik fazdaki 33 hastanın 13’ünde (%39) hematolojik ve 9’unda (%27) sitogenetik yanıt saptanmıştır (67). Faz 2 çalışması % 71’i imatinib dirençli, %29’u imatinib intoleran 321 kronik faz KML hastasında yapılmıştır. İlk basamak tedavi ile THY elde edilemeyen 206 hastanın 158’inde (%77) nilotinib tedavisiyle THY sağlanabilmiş, 186 hastada (%59) MSY ve %46’sında TSY elde edilmiştir. On sekiz aydan uzun majör sitogenetik yanıta sahip hasta oranı %84, majör sitogenetik yanıta ulaşma süresi ortalama 2.8 ay ve 18 aylık ortanca sağkalım %95 bulunmuştur (68). Nilotinib KML’nin ilk basamak tedavisindeENESTnd(Evaluating Nilotinib Efficacy and Safety in Clinical Trials of Newly Diagnosed Ph+ CML Patients) çalışması sonrası yer almıştır. Bu çalışma nilotinib 2x300 mg veya 2x400 mg ve imatinib’in 1x400 mg alan toplam 846kronik faz farklı sokal skoruna sahip KML hastasında yapıldı. Farklı sokal skoruna sahip 846 kronik faz KML hastasında nilotinibin 2 farklı dozu (2x300 mg, 2x400 mg) ve imatinib (1x400 mg) karşılaştırılmıştır (69). Beş yıllık çalışma sonunda nilotinib alan hastaların %54’ünde ve imatinib alan hastaların %31’inde MY4,5
(IS’e göre Bcr-Abl≤ 0.0032) saptanmıştır (70). Nilotinib alan hastalarda tüm sokal risk gruplarında 3.ayda erken MY (Bcr-Abl< %1) görülmüştür. Yüksek sokal skoru olan ve erken MY alınamayan hastalarda bu bulgular progresif hastalık açısından önemli bulunmuştur. Kardiyovasküler (KVS) yan etki, kan kolesterolü ve glikoz düzeylerinde yükselme çalışmanın nilotinib kolunda daha sık saptanmıştır. Bulantı, kusma, kramp, başağrısı, diyare, nötropeni ise nilotinib alan hastalarda imatinib alanlardan daha az görüldü. Uzun vadeli sonuçlar günde 2 kez 300 mg nilotinib tedavisinin fayda-risk profilinidesteklemiştir (71,72). Toplam sağkalım açısından nilotinib ve imatinib kolları arasında anlamlı fark saptanmamıştır. Nilotinib 400 mg günde 2 kez, 300 mg günde 2 kez ve imatinib 400 mg günlük doz alan hasta gruplarında 4 yıllık toplam sağkalım oranları sırasıyla %97, %93 ve %94 bulunmuştur (73).
Nilotinib iyi tolere edilir. Nilotinib tedavisi ile en sık görülen yan etki trombositopeni (%20-33), nötropeni (%13-31), bilirubin yüksekliği (%7) ve serum lipaz yüksekliğidir (%5-15). Bununla beraber bulantı, kusma, kaşıntı, döküntü de
görülebilir. Nilotinibin en önemli yan etkisi kardiyak repolarizyonu uzatması ve QT mesafesini uzatmasıdır. Tedavi başlanmadan önce mutlaka EKG, serum magnezyum ve potasyum düzeyleri görülmelidir. Dasatinibde de aynı yan etki mevcuttur.
Tablo: 3 Eşlik eden hastalığa ve mutasyona göre 2.kuşak TKİ seçimi (74, 75, 76)
Eslik Eden Hastalıklara Göre:
Hipertansiyon, akciğer hastalıkları Nilotinib düsün Ağır diyabetes mellitus, pankreatit öyküsü Dasatinib düsün
QT uzaması olan hastalarda hem nilotinib hem de dasatinib kullanımı özel dikkat gerektirir.
Mutasyon Durumuna Göre:
Nilotinibe duyarlılığı az olan mutasyonlar Y253H, E255K/V, F359V/C Dasatinibe duyarlılığı az olan mutasyonlar F317L, F317I/V/C, T315A, V299L Nilotinib ve dasatinibe dirençli mutasyon T315I
Her üç TKİ: imatinib, dasatinib ve nilotinib KML’nin birinci basamak tedavisinde onay almıştır. Literatürlerde önerilen; hastanın öyküsü ve komorbid riskleri (diyabetes mellitus, pankreatit, kardiyovasküler hastalıklar, pulmoner hipertansiyon gibi) ile beraber TKİ ilişkili mutasyonlarında değerlendirilmesidir. Tablo 3’de imatinib, dasatinib, nilotinib duyarlı ve dirençli mutasyonlar gösterilmiştir.
Tablo 4: TKI’lerine direnç ile ilişkili mutasyonlar (www.bloodjournal.hematologylibrary.org)
2.6.5. Diğer Tedavi Seçenekleri 2.6.5.1. Bosutinib
Dual kinaz inhibitörü olup Abl ve Src yolaklarını inhibe eder. Bu özelliği dasatinibe benzerdir. PDGF ve KİT üzerine etkisi yoktur (77). İmatinibden 30-200 kat daha fazla potenttir. Faz 3 BELA (Bosutinib Efficacy and safety in chronic myeloid Leukemia) çalışmasında 502 yeni tanı KML hastasına 500 mg bosutinib ve 400 mg imatinib verilerek 24 aylık izlem yapılmıştır. TSY oranları, bosutinib ve imatinib kollarında 12.ayda (sırasıyla %70 ve %68) ve 24.ayda (sırasıyla %79 ve
%80) benzer bulunmuştur. Bosutinib ile ortanca TSY'a ulaşma süresi daha kısa (13'e
karşı 25 hafta), 12.ay MMY yanıt oranı daha yüksek ve 24.ay yanıt oranı benzer
saptanmış olup, transformasyonizlenmemiştir. Bosutinib kolunda imatinib koluna göre diyare (%68 ve %21), kusma (%32 ve %13) ve karın ağrısı (%11 ve %5) daha
fazla görülsede ödem (%11 ve %38), kemik ağrısı (%4 ve %10) ve kas spazmları
(%2 ve %20) daha az sıklıkta izlenmiştir. Yan etkileri daha fazla olsada bosutinib
imatinibe kıyasla yeni tanı KML hastalarında daha erken ve derin yanıt oluşturmuştur. Bosutinib tedavisi ile grade 4 diyare (%8), döküntü (%9) ve trombositopeni (%4-10) izlenmiştir. Çalışma halen devam etmekte olup uzun dönem sonuçları beklemektedir (78,79).
2.6.5.2. Ponatinib
Üçüncü kuşak tirozin kinaz inhibitörü olup T315I mutasyonuna etki edebilen tek Bcr-Abl inhibitörüdür (80). Ponatinibin en büyük dezavantajı vasküler komplikasyonlar, tromboz ve embolinin ponatinib alanlarda sıklığının artmasıdır. İlaç kullanan hastaların %27’sinde bu komplikasyonlar gelişmiştir. Bu sebeple bir süre satışı durdurulmasına rağmen vasküler komplikasyonların aydınlatılması ile Ocak 2014’den sonra T315I mutasyonu olan ve diğer TKİ ile yanıt alınamayan hastalarda ponatinib kullanımı onaylanmıştır. Faz1 çalışmasına kronik faz tedaviye dirençli ve nüks eden 43 KML hastası alınmıştır. Hastaların %98’i iki, %63’ü üç TKİ kullanmış ve %29’unda T315I mutasyonu mevcut idi. Hastaların %98’inde hematolojik, %72’sinde MSY, %63’ünde TSY alınmıştır. T315I mutasyonu olan 12 hastada hematolojik yanıta, 9 hastada MSY, 9 hastada TSY ve 8 hastada MMY ulaşılmıştır (81).Faz 2 çalışmasında MSY’a 2.8 ayda ulaşılmış ve ortanca 12 ay devam etmiştir. En sık görülen yan etkiler trombositopeni, döküntü, cilt kuruluğu, karın ağrısı ve baş ağrısı olmuştur. KVS olaylar hastaların %7’sinde izlenmiştir. Bu hastaların büyük kısmında önceden KVS risk faktörleri bulunmuştur. KVS olay geçiren ve ponatinib tedavisine devam edilen %36 hastada KVS olaylarda tekrarlama yaşandı. Hastaların yaklaşık %8'inde ciddi arteryal tromboz bildirilmiştir (82). EPİC (The Evaluation of Ponatinib versus Imatinib in Chronic Myeloid Leukemia) faz 3 çalışması toksik etkiler nedeniyle sonlandırılmıştır (83).
2.6.5.3. Omecexatine
T315I mutasyonuna etki edebilen diğer protein sentez inhibitörüdür. Önerilen dozu 1,25 mg/m214 günde bir subkutan şeklindedir. T315I mutasyonu olan 62 kronik faz KML hastası ile yapılan faz 2 çalışmasında THY, MSY ve TSY oranları sırasıyla %77, %23 ve %16 saptanmıştır. Hastaların büyük kısmında grade3/4 trombositopeni, nötropeni ve anemi görülmüştür. Akselere fazda omecexatine kullanımı tartışmalıdır. FDA 2 TKİ tedavisine yanıt vermeyen progresif hastaların tedavisinde omecexatini onaylamıştır (84, 85).
2.6.5.4. Allojenik Hematopoetik Kök Hücre Nakli
Diğer hematolojik malignitelerde olduğu gibi KML’ninde tek küratif tedavisi AHKHN’dir. İmatinib tedavisinden sonra KML’de AHKHN’nin yeri değişmiştir. TKİ öncesinde yüksek sokal skoruna sahip, genç, uyumlu donörü olan hastalarda önerilmekteydi. Günümüzde ise genç olgularda, yeni tanı blastik veya akselere evrede olan ve TKİ dirençli olan hastalarda kronik fazda AHKHN düşünülmesi öneriliyor (86). KML’de en sık kullanılan hazırlama rejimleri yüksek doz siklofosfamid ve tüm beden ışınlaması (CY/TBI) veya yüksek doz siklofosfamid ve yüksek doz busulfan (BU/CY)’dır. Bu hazırlama rejimleri sonrası uyumlu donörden GM-CSF veya G-CSF ile indukde edilerek toplanan CD34 hücreleri hastaya infuze edilir.KML hastalarında nakil öncesi risk skorlaması olarak EBMT (European Group for Bone Marrow Transplantation) skorlama sistemi kullanılır. İmatinib öncesi AHKHN kararı verilmesinde de bu skorlama sistemi sık kullanılmıştır. Bu skorlama bize hastanın AHKHN sonrası hastalıksız sağkalımı, nüks olasılığını, mortalite ve morbiditeyi tahmin etmede yardımcı olmaktdır (87).
Tablo 5: KML’de allojeneik hematopoetik kök hücre nakli EBMT risk skoru (87)
Risk faktörü 0 1 2
Hastalık evresi Kronik Hızlanmış Blastik Yaş <20 yaş 20-40 yaş >40 yaş Tanıdan sonraki süre 1 yıl ve altı 1 yıl üstü
Verici tipi HLA uygun verici Diğerleri
Alıcı-verici cinsiyet uyumu Diğer durumlar Alıcı erkek, verici kadın
2.7. Tedaviye Yanıtın Değerlendirilmesi
KML’de tedavi yanıtı değerlendirilmesinde hematolojik, sitogenetik ve moleküler tetkikler incelenmelidir.
Tam Hematolojik Yanıt Kriterleri: (THY) • Lökosit sayısı <10,000/μL,
• Çevresel kanda bazofil yüzdesi <%5,
• Çevresel kanda myeloblast, promyelosit, myelosit görülmemesi, • Trombosit sayısı <450,000/μL,
• Dalağın ele gelmemesi Sitogenetik Yanıt (SY)
• Tam sitogenetik yanıt (TSY): Ph + metafazın olmaması, • Parsiyel (kısmi) sitogenetik yanıt (KSY): Ph + metafaz %1-35, • Minör sitogenetik yanıt: Ph + metafaz %36-65,
• Minimal sitogenetik yanıt: Ph + metafaz %66-95, • Sitogenetik yanıtsızlık: >%95 Ph + metafaz
Konvansiyonel sitogenetik inceleme için en az 20 metafaz değerlendirilmelidir. Konvansiyonel sitogenetik inceleme; Ph kormozomu dışında diğer kromozom anormalikleri de saptanabilir. Majör sitogenetik yanıt, tam ve parsiyel sitogenetik yanıtı içerir (Ph + metafaz %0-35).FİSH ile sitogenetik yanıt değerlendirmesinde yanlış pozitiflik oranı göz önünde bulundurulmalıdır.
Moleküler yanıt
• Majör moleküler yanıt (MMY, MY3.0 veya daha derin yanıt): Bcr-Abl1/Abl1 oranının uluslararası ölçeğe (international scale IS) göre ≤%0,1 olması,
• MY 4.0 aşağıdakilerden biridir;
(i) Saptanabilen moleküler hastalık, Bcr-Abl1 uluslararası ölçeğe göre <%0,01,
(ii) Saptanamayan moleküler hastalık, cDNA >10,000 Abl1 kopya, • MY 4.5 aşağıdakilerden biridir;
(i) Saptanabilen moleküler hastalık, Bcr-Abl1 uluslararası ölçeğe göre <%0,0032,
(ii) Saptanamayan moleküler hastalık, cDNA >32,000 Abl1 kopya,
• Tam moleküler yanıt (TMY) kavramı “moleküler olarak tespit edilemeyen lösemi” ile değiştirilmiştir ve RT-PCR veya “nested” PCR yöntemi kullanıldığında Bcr-Abl1 saptanmamasıdır (88, 89).
2.8. İzlem
Daha önce belirttiğimiz gibi KML hastasının tedavi yanıtını hematolojik, sitogenetik ve moleküler yanıt olarak değerlendirmekteyiz. İzlemde de bu 3 yönden takip etmek geremektedir.Hematolojik değerlendirme yanıt sağlanana kadar 15 günde bir, sağlandıktan sonra 3 ayda bir veya lüzum halindeyapılmalıdır.
Tanı anında, 3. ve 6.aylarda, TSY yanıt elde edilene kadar 6 ayda bir, TSY elde edildikten sonra 12 ayda bir SY takibi yapılmalıdır. Bunun dışında; tedaviye yanıtsızlık (primer veya sekonder direnç) durumunda her zaman, açıklanamayan anemi, lökopeni, trombositopeni gelişiminde her zaman yapılmalıdır.
RT-QPCR ile moleküler izlem: MMY (MY 3.0 veya daha derin yanıt) elde edilmesi ve doğrulanmasına kadar 3 ayda bir, daha sonra 3-6 ayda bir yapılmalıdır. Bunun dışında uyarı durumunda, hasta daha yakından izlenmeli ve eğer gerekirse moleküler ve sitogenetik testler daha sık (<3 ay) yapılmalıdır.
Moleküler mutasyon analizi: Yanıtsızlık durumunda ve diğer TKİ veya başka tedavilere geçmeden önce daima bakılmalıdır. Hızlanmış ve blastik evrede başvuran hastalarda mutasyon analizi çalışılması önerilir (89).Yanıtsızlık durumunu değerlendirmek için tek Bcr-Abl değeri yeterli kabul edilmemektedir. İki kez bcr-abl ölçümü şüphe durumunda kromozom, mutasyon analizleri yapılması önerilir (90). Günümüzde TKİ tedavisinin kesilmesi açısından yapılan çalışmalarda MY4,5sağlanan
hastaların %40’ında yanıtın devam ettiği saptanmıştır. Buna rağmen TKİ tedavisi kesilmesi güncel klavuzlarda önerilmemektedir. Pratikte sadece TKİ tedavisi alamayan gebelik gibi durumlarda, hastanın en az 2 yıl devam eden MMY’ıvarsa TKİ tedavisine ara verilebilir. Bu hastalarda sık takip (<3ay) önerilmektedir.
Tablo 6: İkinci kuşak tirozin kinaz inhibitörlerine yanıt değerlendirmesi (88)
Optimal Uyarı Yanıtsız
Başlangıç
THY yok veya imatinib tedavisi altında THY kaybı
Birinci kuşak TKİ SY alınamaması veya yüksek
risk 3 ay BCR/ABL1 ≤%10 ve/veya Ph + <%65 BCR/ABL1 > %10 ve/veya Ph + %65-95 THY yok ve/veya Ph+>%95 veya yeni mutasyonlar 6 ay BCR/ABL1 ≤ %10 ve/veya Ph + < %35 Ph + %35-65 BCR/ABL1>%10 ve/veyaPh+ >%65 ve/veya yeni mutasyonlar 12 ay BCR/ABL1 < %1 ve/veya Ph+ 0 BCR/ABL1 %1-10 ve/veya Ph+ %1-35 BCR/ABL1 >%10 ve/veya Ph+ >%35 ve/veya yeni mutasyonlar Özet olarak: KML hastalığının tedavisinde
Birici basamak tedavi: imatinib, nilotinib, dasatinib.
Sadece yüksek riskli, Klonal kromozomal anomali/Ph pozitif olanlarda hasta ve kardeşlerinde HLA doku tiplendirmesi çalışılması önerilir;
İkinci basamak tedavi: intolerans durumunda ilk tedavi basamağında kullanılmayan TKİ
İmatinibe yanıtsız hastalarda dasatinib, nilotinib, ponatinib; Hasta ve kardeşlerinde HLA doku uygunluğuna bakılması önerilir Nilotinibe yanıtsız hastalarda dasatinib, bosutinib, ponatinib
Hasta ve kardeşlerinde HLA doku tiplendirmesi yapılması eş zamanlı akraba dışı kök hücre vericisi aranması, AHKHN düşünülmesi önerilir.
Dasatinibe yanıtsız hastalarda nilotinib, bosutinib, ponatinib;
Hasta ve kardeşlerinde HLA doku tiplendirmesi yapılması eş zamanlı akraba dışı kök hücre vericisi aranması, AHKHN düşünülmesi önerilir (88, 89).