T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI
ANABİLİM DALI
PROSTAT KANSERLİ HASTALARIMIZ
VE SAĞ KALIMI ETKİLEYEN
PROGNOSTİK FAKTÖRLER
Dr.Beşir KAYA
TIPTA UZMANLIK TEZİ
Prof.Dr. Abdurrahman IŞIKDOĞAN
TEZ DANIŞMANI
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI
ANABİLİM DALI
PROSTAT KANSERLİ HASTALARIMIZ
VE SAĞ KALIMI ETKİLEYEN
PROGNOSTİK FAKTÖRLER
Dr.Beşir KAYA
TIPTA UZMANLIK TEZİ
Prof.Dr. Abdurrahman IŞIKDOĞAN
TEZ DANIŞMANI
TEŞEKKÜR
İç Hastalıkları İhtisas Eğitimim süresince üzerimde büyük emekleri olan, engin bilgi ve tecrübelerinden faydalandığım, kendileriyle çalışmaktan gurur duyduğum, her zaman örnek aldığım, başta Sayın Prof.Dr.Ekrem MÜFTÜOĞLU olmak üzere, İç Hastalıkları Anabilim Dalı Başkanımız Sayın Prof.Dr.M.Emin YILMAZ’a teşekkür eder, saygılarımı sunarım.
İhtisasım süresince beraber çalıştığım ve kendilerinden çok şey öğrendiğim saygıdeğer hocalarım, Prof.Dr.Orhan AYYILDIZ’a, Prof.Dr.Vedat GÖRAL, Prof.Dr.Kendal YALÇIN’a, Prof.Dr.Alpaslan Kemal TUZCU’ya, Prof.Dr.Muhsin KAYA’ya, Prof.Dr.Ali Kemal KADİROĞLU’na, Doç.Dr.Ebubekir ŞENATEŞ’e, Yrd.Doç.Dr.Yaşar YILDIRIM’a, Yrd.Doç.Dr.Zülfikar YILMAZ’a, Yrd.Doç.Dr.M.Sinan DAL’a, Yrd.Doç.Dr Faruk KILINÇ’a, Uz.Dr.Nazım EKİN’e, Uz.Dr.Zeynep ORUÇ’a ve Uz.Dr.Zafer PEKKOLAY’a teşekkür ederim.
Tezimin hazırlanmasında büyük katkıları olan ve ihtisasım süresince desteklerini esirgemeyen değerli hocam Prof.Dr.Abdurrahman IŞIKDOĞAN’a, Doç.Dr.M.Ali KAPLAN’a, Doç.Dr.Mehmet KÜÇÜKÖNER’e, Doç.Dr.Ali İNAL’a ve Yrd.Doç.Dr. Zuhat URAKÇI’ya çok teşekkür eder ve saygılarımı sunarım.
Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen, Göğüs Hastalıkları ve Tüberküloz Anabilim Dalından Sayın Pof.Dr.Abdurrahman ŞENYİĞİT’ e, Kardiyoloji Anabilim Dalından Prof.Dr.M.Sıddık ÜLGEN’ e, Enfeksiyon Hastalıkları Anabilim Dalından Prof.Dr.Salih HOŞOĞLU’ na teşekkürlerimi sunarım.
Birlikte çalışmaktan onur ve zevk duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları Anabilim Dalı çalışanlarına teşekkürlerimi sunarım. Tezimin hazırlanmasında yardımcı olan asistan arkadaşlarım Dr.M.Emin BÜYÜKBAYRAM’a, Dr.M.Elif ÇELİK'e ve öğretmen arkadaşım Ferit DÖNEN'e teşekkür ederim.
Ayrıca bugünlere gelmemde büyük pay sahibi olan ve desteklerini hiçbir zaman benden esirgemeyen anneme, babama ve kardeşlerime gösterdikleri sabır ve hoşgörüden dolayı teşekkürlerimi sunarım.
İÇİNDEKİLER
TEŞEKKÜR---ii İÇİNDEKİLER---iii KISALTMALAR---iv TABLO LİSTESİ---v ŞEKİL LİSTESİ---xi ÖZET ---vii SUMMARY ---ix 1. GİRİŞ VE AMAÇ---1 2. GENEL BİLGİLER---3 3. GEREÇ VE YÖNTEM---25 4. BULGULAR---26 5. TARTIŞMA---40 6. SONUÇLAR---44 7. KAYNAKLAR---45KISALTMALAR
MRI : Magnetic Rezonans Imaging (manyetik rezonans görüntüleme) TNM : Tümör, lenf nodu, metastaz
BT : Compotorize tomography (bilgisayarlı tomografi) PET-CT : Pozitron emisyon tomografi- Compotorize tomography
ECOG : Eastern Cooperative Oncology Group (Performans skorlama sistemi)
RT : Radyoterapi
EBRT : Bir radyoterapi tekniği (External beam radiation therapy)
AJCC : Amerikan kanser komitesi birliği (American Joint Committee on Cancer)
US : Utrasonografi
TRUS : Transrektal ultrasonografi
UICC : Ulusal kanser kontrol merkezi (Union for international cancer control) SPSS : İstatiksel veri analizi terimi (Statistical Package for the Social Sciences) CI : Confidence İnterval
OR : Odds Ratio
GFR : Glomeruler filtrasyon hızı
HRPC :Hormon replasman prostate karsinom PSA :Prostat spesifik antijen
CMV :Sitomegalovirüs
LHRH :Luteinizing-hormone-releasing hormone PRM :Parmakla rektal muayene
LDH :Laktat dehidrogenaz ALP :Alkalen fosfataz
TABLO LİSTESİ
TABLO 1 Prostat Kanserinin TNM evrelemesi TABLO 2 Prostat CA evrelendirilmesi
TABLO 3 Prostat kanserinde prognostik gruplama
TABLO 4 Prostat kanserli hastaların klinikopatolojik ve demografik özellikleri TABLO 5 Tek değişkenli analize göre sağkalımı etkileyen prognostik faktörler TABLO 6 Sağkalıma etkili faktörlerin multivariant analizi
ŞEKİL LİSTESİ
ŞEKİL 1 Derin pelvise yerlesmis prostat glandı ŞEKİL 2 Ailede kanser öyküsü dağılım
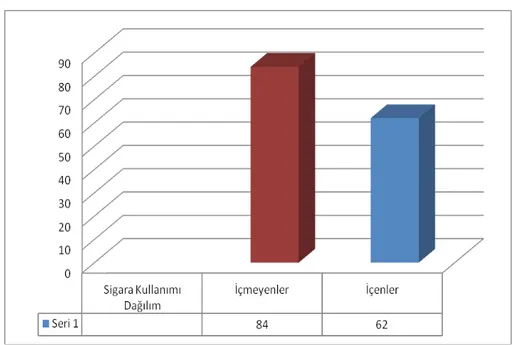
ŞEKİL 3 Sigara kullanımı dağılı
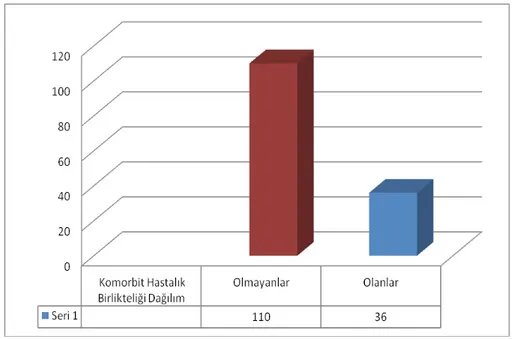
ŞEKİL 4 Komorbit hastalık birlikteliği dağılım ŞEKİL 5 ECOG skoru dağılım
ŞEKİL 6 Başvuru anında şikayet ŞEKİL 7 Tanı yöntemi dağılımı ŞEKİL 8 Tümör histolojik tip dağılım ŞEKİL 9 Tümör yaygınlık dağılımı ŞEKİL 10 Metastaz bölgeleri dağılım ŞEKİL 11 Hormon direnci dağılım ŞEKİL 12 Yaş ve sağkalım ilişkisi grafiği
ŞEKİL 13 Performans statüsü sağkalım ilişkisi grafiği ŞEKİL 14 PSA sağkalım ilişkisi grafiği
ŞEKİL 15 Tümör yaygınlığı ve sağkalım ilişkisi grafiği ŞEKİL 16 ALP değerleri ve sağkalım ilişkisi grafiği ŞEKİL 17 LDH değerleri ve sağkalım ilişkisi grafiği ŞEKİL 18 Albümin değerleri ve sağkalım ilişkisi
ŞEKİL 19 Kalsiyum değerleri ve sağkalım ilişkisi grafiği ŞEKİL 20 Gleason skoru ve sağkalım ilişkisi grafiği
ŞEKİL 21 Hormon tedavisine direnç ve sağkalım ilişkisi grafiği ŞEKİL 22 Komorbit hastalık birlikteliği ve sağkalım ilişkisi grafiği
ÖZET
Amaç: Prostat kanserinde sağkalıma etki eden prognostik faktörler genel olarak yaş, performans statüsü, gleason skoru, tümör yaygınlığı, PSA değeri ve diğer biyokimyasal( albumin, ALP, LDH) değerlerdir. Bu çalışmada merkezimizde takip ve tedavi edilen prostat kanserli olguların klinikopatolojik özellikleri, biyokimyasal verileri ve sağkalımı etkileyen prognostik faktörlerin incelenmesi amaçlanmıştır.
Gereç-Yöntem: Dicle Üniversitesi Tıp Fakültesi Tıbbi Onkoloji kliniğinde Mart
2003- Ekim 2012 tarihleri arasında izlenen 147 prostat kanserli hastaya ait demografik, klinik, histopatolojik ve biyokimyasal veriler dosya ve hastane kayıtları incelenerek elde edildi. Sağkalıma etkileri olan parametreler; yaş, tümörün evresi, hastanın performans durumu(ECOG performans skalası), komorbid hastalık birlikteliği, gleason skoru, hormon tedavisine direnç varlığı, başvuru anındaki biyokimyasal değerler (PSA, ALP, LDH, kalsiyum, albumin, kreatinin) incelendi ve prostat kanseri gelişimi riski açısından aile öyküsü ve sigara içimi değerlendirildi.
Bulgular: Toplam 147 hastaya ait veriler analiz edildi. Hastalarımızda ortanca yaş
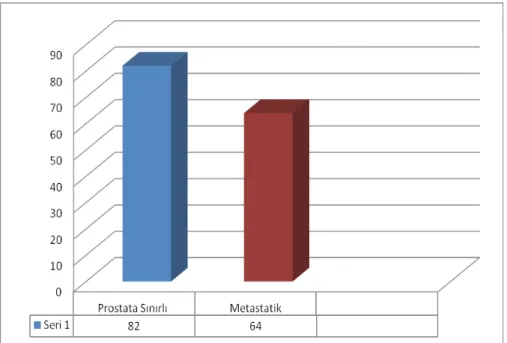
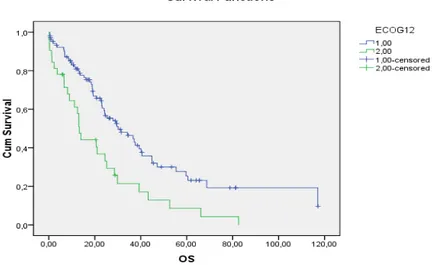
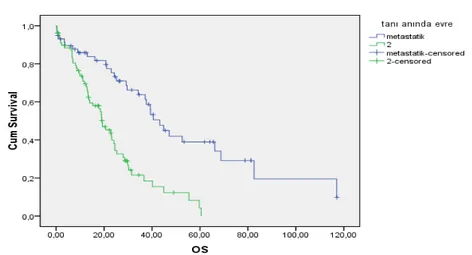
68 (50-86) idi. Hastaların %46.9’u 68 yaşından büyük iken ve %53.1’i 68 yaşından küçüktü. Tüm hastalarımızda ortanca sağkalım 25.3 ay idi. 68 yaş ve 68 yaşından küçük olanlarda ortanca sağkalım 25.3 ay iken, 68 yaşından büyük olanlarda ortanca sağkalım 25.1 ay idi. İstatistiksel olarak yaş sağkalım açısından anlamlı bulunmadı (p=0.707). Başvuru şikayeti olarak %50’si ürolojik şikayetler(idrarda kanama, idrarda zorlanma vb.), %42’si sırt ve bel ağrısı ve %8 diğer şikayetlerle başvurdu. Yüz on üç hasta (%59) ECOG 0-1-2 iken, 34 (%41) hastamız ECOG 3-4 olarak başvurdu. ECOG skoru 0-1-2 olanlarda ortanca sağkalım 54.4 ay, ECOG skoru 3-4 olanlarda ortanca sağkalım 29.8 ay idi. Başvurudaki performans durumu, sağkalıma etkili faktör olarak bulundu (p=0.001). Histopatolojik dağılım olarak %97.2’si adenokanser histopatolosine sahipken, %2.8’inde diğer histopatolojik paternler mevcuttu. Ailede birinci derecede yakınlarında kanser öyküsü bulunan hasta sayısı 25 hasta(%17) idi. 52 hasta (%32) sigara tüketicisi idi. En çok eşlik eden hastalık kardiyovsküler hastalıklar olmak üzere, 36 hastamızda (%24.4) eşlik eden komorbid hastalık mevcuttu. Prostat kanserine ek olarak komorbid hastalığı olanlarda ortanca sağkalım 24.2 ay iken komorbid hastalığı olmayanlarda ortanca sağkalım 29.8 ay idi. Komorbid hastalık birlikteliği sağkalıma etki eden faktör olarak anlamlı bulunmadı (p=0.544). Tanı anında hastalarımızın 82 (%56.2) si prostata sınırlı, 64 (%43.8)'ü
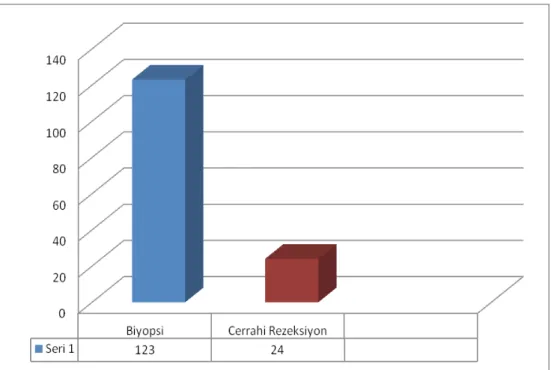
metastatik olarak tespit edildi. Prostatla sınırlı olanlarda ortanca sağkalım 66.5 ay iken, prostat dışında metastazı olanlarda ise ortanca sağkalım 27.4 ay idi. Prostatla sınırlı veya metastatik kanser olması sağkalıma etkili faktör olarak bulundu (p<0.001). Tanı yöntemi olarak 123 hastada (%84.8) biyopsi yapılırken, 24 hastada (%15.2) cerrahi rezeksiyon yapıldı. Toplamda 113 hastamıza hormon tedavisi verildi. Hormon tedavisi verdiğimiz hastalarımızdan 41’inde hormon tedavisine direnç gelişirken, 72’sinde hormon tedavisine direnç gelişmedi. Hormon tedavisine dirençli olmayanlarda ortanca sağkalım 58.1 ay iken, hormon tedavisine dirençli olanlarda ortanca sağkalım 52.5 idi. Hormon tedavisine direnç gelişimi sağkalıma etkili faktör olarak bulunmadı (p=0.316). Tanı anında PSA<50 olanlarda ortanca sağkalım 59.3 ay PSA>50 olanlarda ortanca sağkalım 43.4 ay idi. Başvuru anındaki PSA değeri sağkalıma etkili faktör olarak bulunmadı (p=0.088). ALP değerleri normal sınırlarda olanlarda ortanca sağkalım 54.9 ay iken, ALP değerleri yüksek tespit edilenlerde ortanca sağkalım 49.1 ay olarak tespit edildi. Başvuru anındaki ALP değerleri sağkalıma etkili faktör olarak anlamlı bulunmadı (p=0.107). LDH değerleri normal sınırlarda olanlarda ortanca sağkalım 62.5 ay iken, LDH değerleri yüksek tespit edilenlerde ortanca sağkalım 34.8 ay olarak tespit edildi. Başvuru anındaki LDH değerleri sağkalıma etkili faktör olarak bulundu (p=0.020). Albümin değerleri >2.5 mg/dl olanlarda ortanca sağkalım 30.1 ay iken, Albümin değerleri <2.5 mg/dl olanlarda ortanca sağkalım 8.5 ay olarak tespit edildi. Tanı anındaki Albümin değerleri sağkalıma etkili prognostik faktör olarak bulundu(p<0.001). Hastalarımızdan Gleason skoru<6 olanlarda ortanca sağkalım 27.9 ay iken, gleason skoru>6 olanlarda ortanca sağkalım 25.1 ay idi. Gleason skoru sağkalıma etkili prognostik faktör olarak bulunmadı (p=0.688). Kalsiyum değerleri yüksek olanlarda ortanca sağkalım 25.1 ay iken kalsiyum değerleri normal sınırlarda olan hastalarda ortanca sağkalım 27.9 ay olarak bulundu. Hastalarımızda başvuru anındaki kalsiyum değerleri ve sağkalım arasında anlama yakın ilişki bulundu (p=0.053).
Sonuç. Başvuru anında kanser yaygınlığı, performans durumu, LDH, Kalsiyum düzeyi ve albumin düzeyi prostat kanserli hastalarda sağkalımı etkileyen prognostik faktörler olarak belirlendi.
SUMMARY
Purposes: Prognostic factors for survival in prostate cancer defined as age
,performance status ,gleason score, extension of tumor, PSA level and other biochemical parameters (calcıum, albumin, ALP, LDH ) İn this study we aimed to investigate the clinicopathologic biochemical features and prognostic factors for survival in patients diagnosed with prostat cancer in our cancer center .
Materials –Methode: Clinical data records and follow up cards were analysed of
147 patients diagnosed with prostate cancer between March 2003 and October 2012 in the Dicle University faculty of Medicine Medical Oncology departmen. Demographic parameters clinical histopathological and biochemical data were gathered. Parameters that affect survival such as age stage of tumor performans status gleason score resistance to the hormonal therapy biochemical values( PSA, ALP, LDH, calcium, albumin and kreatinin) during the admission were observed and family history and smoking is evaluated by the risk of prostat cancer development
Result: Clinical data /information of 147 patients were analysed . Median age is 68
(50-86 ) %46.9 of patients are older than 68 and %53.1 are under the 68 years. Overall survival was estimated 25.3 months and 25.1 months among patients older than 68 years old. Age was found non significant statistically for survival(P=0.707 ). 50 % of patients has urological complaints ( hematuria urgency etc.) at admission %42 of patients have back pain and %8 of patients were admitted with other problems . 59 (%113)of patients have ECOG performance scale 0-1-2. 34(%41) patients have ECOG score of 3-4 . Median survival time was estimated 54.4 months for patients with ECOG 0-1-2 whereas 29.8 months for patients with ECOG 3-4. Performance status at admission was found statistically significant on survival (p=0.001). Histopathology in %97.2 of patients with prostate cancer demonstereted adenocarcinoma subtype and in %2.8 of patients shows other histopathological patterns . 17of patients(%25 ) have positive family history of one degree relative had been diagnosed with cancer before. 32 (%52) of patients are smoker. 24 of patients(%36) has comorbid diseases. The most frequent co morbid condition among our patient population is cardiovascular disease . Median survival for patients with comorbid diseases was estimated 24,2 mo vs 29,8 mo for patients with no comorbid factor . Comorbid factors was not found significant for survival (p=0,544). Median survival was estimated 59.3 months for patients with PSA level under 50 at admission vs 43.4 months
for those PSA level>50 .PSA level at admission was not found to be a significant factor for survival (p=0.088) . 56.2 (%82 ) of patients diagnosed with organ confined prostate cancer and 43.8 (% 64)of patients have metastatic cancer at the time of diagnosis .Median survival was estimated 66.5 mo for patients with organ confined prostate cancer compared with 27.4 mo for patients with metastatic cancer .Stage of prostat cancer at admission was considered a significant factor for survival (p<0.001). A fine needle bisopsy was used for %84.8(123) of patients as diagnostic methode and surgical resection was chosen for (24) 15% of patients. 113 patients was treated with hormonal therapy. 41 of 113 patients who treated with hormonal therapy developed resistance to the therapy while 72 patients didn’t develop resistance to hormonal therapy Median survival for patients who are sensitive to hormonal therapy was 58,1 mo whereas in patients who developed resistance to hormonal therapy was 52,5 mo Resistance to hormonal therapy was found non-significant for survival(p=0.316). Median survival for patients with normal ALP values at admission was estimated 54.9 mo vs 49.1 mo for patients with elevated ALP levels. ALP level at admission was found non significant value for survival (p=0.107). Median survival for patients with normal LDH values was 62.5 mo vs 34.8 mo for patients with elevated LDH levels ALP level at admission was defined as a significant factor for survival (p=0.020). Median survival for patients with albumin levels >2.5 mg/dl was 30,1 mo whereas for patients with albumin levels under 2.5 mg/dl was 8,5 mo .Albumin level at admission was determined significantly associated with survival (p<0.001). 27 patients have gleason score under 6 and 120 patients have gleason score >120 Median survival for patients with gleason score under 6 was 27,9 month vs 25.1 month for patients with gleason score >120.Gleason score has no significance for survival (p=0.688).Median survival for patients with normal calcium values at admission was estimated 27,9 month vs 25.1 mo for patients with elevated calcium levels Calcium level at admission was associated with significance for survival (p=0.053)
Conclusion: Widespread of tumor at admission LDH level Calcium level Albumin
level and performace status at admission were identified as prognostic factors for survival for prostate cancer.
1. GİRİŞ ve AMAÇ
Bugün dünyada yaklaşık 25.000.000 kanser hastası vardır. Her yıl yaklaşık 11.000.000 kişi kansere yakalanmaktadır. 2020 yılında bu rakamın yıllık 16 milyon vakaya ulaşacağı tahmin edilmektedir. Bunların da üçte ikisinin gelişmekte olan ülkelerde olması beklenmektedir. Dünyada her yıl 7.000.000 kişi kanserden ölmektedir. 2020 yılında bu sayının 10.000.000’u geçeceği rapor edilmektedir(1) . Türkiye’de ise her yıl yaklaşık 150.000 kişi kansere yakalanmaktadır.(2) Günümüzde prostat kanseri gelişmiş batı ülkelerinde erkeklerde birinci sırada, Türkiye’de ise 6. sırada yer almaktadır. Ülkeler arasında büyük ölçüde değişmekle birlikte, tüm dünyadaki sıklığı 100 binde 25.3 tür. 2009 yılında açıklanan verilere göre ülkemizde görülme sıklığı 100.000 erkekte 19 olarak bildirilmektedir (3). İzmir Kanser İzlem Denetim Merkezi araştırmasının sonucuna göre 1993 – 2000 yılları arasında en sık görülen 5. kanser türü olduğu bildirilmiş, ancak 2009’da kanser sıklığı açısından 2. sıraya yükselmiştir. Son yıllardaki bu artışta erken tanı ve taramaların rolü büyüktür (3).
Prostat kanserinin erken tanı ve tedavisindeki gelişmelere rağmen, klinik lokalize prostat kanserinde de %10 - %30 progresyon görülmektedir (4,5). Ayrıca olgu başına ortalama dokuz yıllık kaliteli yaşam süresi kaybına neden olur (6). Erken evre prostat kanseri için sağkalım oranı yüksek olmakla birlikte nükseden tümörler için yeterli bir kurtarma tedavisi bulunmamaktadır. Prostat kanseri ileri evrede uygulanan hormonal tedaviler sonrasında hemen daima hormon refrakter hale geçer. Hormon dirençli prostat kanserli hastalar için şu anda uygulanmakta olan tedaviler altında progresyon ve ölüm kaçınılmazdır. Hormon dirençli metastatik prostat kanserli (HRPC) hastaların tedavisinde en etkili ilaç dosetakseldir. Dosetaksel ve prednizon tedavi şeması ile ortalama 18,9 aylık bir sağkalım süresine ulaşılabilmiştir(7). Hormon rezistans prostat kanserinin tedavisinde sağlanan ilerlemelere rağmen mortalitesi hala çok yüksektir. Tedavideki temel amaç sağkalım süresini artırmak ve palyatif tedavi ile semptomatik düzelme sağlamaktır.
Metastatik prostat kanseri için uygulanmakta olan tedaviler şu an için yeterli değildir. Bu nedenle prostat kanserinin tedavisi için daha etkili moleküllerin keşfedilmesine yönelik çalışmalara büyük ihtiyaç vardır. Bu amaca yönelik olarak yapılacak in-vitro çalışmaların sonucunda kliniğe uygulanabilir yeni tedavi yöntemlerin geliştirilmesi büyük önem taşımaktadır.
Prostat kanserinde sağkalıma etki eden prognostik faktörler genel olarak yaş, hormon tedavisine direnç, performans statüsü, gleason skoru, tümör yaygınlığı, PSA değeri ve diğer biyokimyasal(kalsiyum, albumin, ALP, LDH) değerlerdir.
Bu çalışmanın amacı Dicle Üniversitesi Tıbbi Onkoloji Bilim Dalı tarafından Mart 2003-Ekim 2012 yılları arasında merkezimize başvuran prostat kanseri olgularının epidemiyolojik, klinik ve laboratuar özellikleri, uygulanan tedavi ve sonuçları, hastalara ait geç komplikasyonların saptanması, sağkalıma etkili prognostik faktörlerin saptanması ve bu verilerin ülkemiz ve yurt dışındaki çalışmalar ile karşılaştırılmasıdır.
2. GENEL BİLGİLER
PROSTAT KANSERİ Prostat Anatomisi
Prostat, tabanı mesane tarafında, apeksi membranöz üretrayla birlesen ters kestane şekilli, 18 gram ağırlığında, 3 cm uzunluğunda ve 4 cm genişliğinde bir organdır. Asiner, stromal ve müsküler elemanlardan oluşan kompleks bir yapıya sahiptir. Posterior yüzeyi düzgün ve ortası hafifçe girintilidir. Bu yüzeyi ampulla rekti üzerinde yer alır. Rektumla arasında iki lamellası ile Denonvilliers fasiası bulunur. Prostata cerrahi olarak erisim kolay değildir. Çünkü gland symphisis pubis arkasında, levator ani kasları arasında, derin pelviste yerlesmistir(Sekil-1).
Prostat oldukça zengin bir damarlanmaya sahiptir. Prostatovezikal arter çoğunlukla hipogastrik arterin guluteopudendal trunkusundan ayrılır. Ancak bazen vezikülodeferensiyal arterle birlikte superior vezikal arterden, hatta internal pudendal ya da obturator arterden de çıkabilir. Ayrıca a.hemorrhoidalis mediadan gelen küçük aksesuar arterlerden de beslenir. Prostatın inferior kısımları a.pudenda internanın prostatoveziküler dalından da beslenir. Arterler, karsı taraf damarlarla birlesebilirler. A.mesenterica inferiorun dalı olan A.rektalis superior sıklıkla prostatın üst lateral kısmına besler. A. rektalis media da prostatı besleyebilir. Müsküloglandüler bir yapıya sahip olan prostatın, yaklasık % 30’u müsküler geri kalanı ise glandülerdir. Prostatın baslıca posterior ve lateral kısmında bulunan glandüler yapıların duktus ve asinileri kolumnar epitel ile döselidir. Organın anterior kesimi fibromüsküler yapıya sahiptir. Mc Neal 1968 yılında yapmıs olduğu ayrıntılı anatomik ve histolojik çalışmalar sonucunda erişkin prostatı glandüler yapılarını; santral zon, periferik zon ve transizyonel zon olmak üzere üç, non-glandüler yapıları ise anterior fibromüsküler stroma ve preprostatik sfinkter olmak üzere iki bölgeye ayırmıstır (8)
Anterior fibromüsküler stroma
Özellikle prostatın anteriorda yer alan bir dokudur. Fibröz ve müsküler dokudan olusur. Glandüler yapılar içermez. Detrüsör kasından köken alır ve prostatın ön yüzünü tümüyle kaplar.
Preprostatik Sfinkter
Prostatik üretrayı tümüyle saran düz kas sfinkteridir. Glandüler yapılariçermez. Retrograd ejekülasyonu önlemekle görevlidir.
Santral Zon
Glandüler yapılardan olusur, verumontanumun arkasında üretrayı saracak biçimde yerleşmiştir. Birbirlerine bitişik oldukları için santral zon ile transizyonel zon arasın da ayrım yapmak zordur.
Transizyonel Zon
Distal ve proksimal üretranın birlesim yerinde üretranın hemen çevresinde yer alan küçük bir grup glandüler elemandan olusmustur. Tüm prostatın % 5 ‘inde azını olusturmasına rağmen fonksiyonel önemi çok fazladır. Benign prostat hiperplazisinin köken aldığı zon olarak tanımlanmıstır.
Periferik Zon
Glandüler yapıları içeren prostatın en büyük bölümüdür. Prostat kanserinin sıklıkla periferik zondan gelistiği bilinmektedir. Prostat glandının dısı, prostatik asinüsler arasındaki dokunun devamı olan aglandüler fibromüsküler dokudan olusan anatomik kapsül ile sarılıdır. Ayrı bir anatomik yapı olmayıp, 2-3 mm kalınlığındadır. Parankimi çevre bağ dokulardan ayırıyor gibi görünmekle birlikte mikroskobik olarak prostat glandının bir parçasıdır ve ondan ayrılamaz. Üstelik bu kapsülün dıs yüzeyi peri prostatik bağ dokusu ile karısan lifler verdiğinden, belirgin bir sınıra sahip değildir. İlerleyen yasla birlikte içteki transizyonel zona ait glandüler hücreler hiperplaziye uğrar ve iç kısım hacimce genişlemeye baslar ve çevre yapıları sıkıştırır. Prostatın dış kısmındaki sıkışmış gland yapısına cerrahi kapsül denmektedir. Transizyonel zondaki fibroadenomyomanın rezeksiyonu (TURP) yada enükleasyonundan (Açık Prostektomi) sonra kalan kısım olduğu için cerrahi kapsül denilmiştir.
Sekil 1. Derin pelvise yerlesmis prostat glandı (Sobotta insan anatomi atlasından) İnsidans ve epidemiyoloji
Prostat kanseri son 25 yıl istatistiklerine göre, Amerika birleşik devletlerinde erkeklerde görülen en sık viseral malignite ve 2008 yılında yaklaşık olarak 28.660 kişinin ölümüne yol açmıştır. Hayat boyu hastalığın görülme riski beyaz erkeklerde %17.6, siyah ırkta %20.6 iken bu hastalıktan ölüm riski ise sırasıyla %2.8 ve %4.7‘dir. Prostat kanseri insidansı 1995’den beri yıllık yaklaşık %1.7 artış gösterirken, motalite oranı 1994’den bu yana her yıl için yaklaşık % 4 azalmaya devam etmektedir (9). Prostat kanserinin dünya çapındaki insidansı ülkeler ve etnik pupulasyonlar arasında farklılıklar göstermekte, populasyondan populasyana 100 kattan fazla değişebilmektedir. Hastalığın yıllık görülme oranı en düşük olarak asyada (1.9 kisi/100.000 kişi, Tianjin, çin ) iken en yüksek oran Kuzey Amerika ve İskandinavya’da, özellikle Afrikalı Amerikalarda görülmektedir (272 kisi /100.000 kisi ). Çevresel faktörlerde prostat kanserinin olusunda rol alabilmektedir. Amerika’da yasayan Japon ve çin asıllıların prostat kanserine yakalanma ve ölüm oranları,
Japonya ve Çin’de yasayan akrabalarına oranla daha yüksektir. Ülkemizde epidemiyolojik anlamda ilk ve tek olan insidans çalışması, İzmir ilinde yapılmıştır. Bu çalışmada prostat kanseri, akciğer, mesane, malign melanom dışı deri kanserleri, larinks kanserinden sonra en sık görülen 5. kanserdir ve 1995-1996 yılları arasında insidans 9.1/100000 bulunmuştur (10). Prostat kanseri, 50 yasının altındaki erkeklerde nadiren teşhis edilmektedir ve bu oran yaklaşık olarak tüm hastaların % 0.1’ini oluşturmaktadır. İnsidansın pik yaptığı yaşlar 70-74 yaşları arasındadır ve hastaların yaklaşık %85’i 65 yasından sonra teşhis edilmektedir. Prostat Spesifik Antijen (PSA) testinin rutin kullanıma girmesinden sonra lokalize prostat kanserinin insidansı artmış ve metastatik hastalığın ise insidansı azalmıstır. Günümüzde yeni teşhis konan prostat kanserlerinin %75’ini nonpalpabl kanserler(AJCC klinik evre T1c) oluşturmaktadır.
Risk faktörleri a. Yaş
Prostat kanserinin gelişme riski 50 yaşından sonra artmaya başlar. Erkek kardeşinde ya da babasında prostat kanser öyküsü olanlarda ise risk 40 yaşından sonra artmaya başlar. Prostat kanseri riski yaşın ilerlemesi ile doğru orantılı olarak artış gösterir ve ortalama tanı konma yaşı 60 yaş civarındadır. Prostat kanserinin sebebi tam olarak bilinmemektedir. Bazı faktörler risk artışından sorumlu tutulmaktadır(11).
b. Irk
Dünyada prostat kanseri insidansı en yüksek Amerikalı zencilerde görülür. Bu insanlarda yaşam boyu prostat kanseri gelişme oranı %9.8 civarındadır. Amerikalı beyaz erkeklerde bu oran hafifçe düşük olup %8’dir. Çin ve Japonyada prostat kanseri insidansı dünya geneline göre en düşük orandadır. Etnisiteye göre ortaya çıkan prostat kanser insidansındaki farkın nedeni açıklanamamıştır. Ancak beslenme, hormonal durum ve genetik faktörler etnisiteden kaynaklanan farkı açıklayabilir(12).
c. Coğrafik Konum
Prostat kanseri insidansı 22/100.000 oranıyla en yüksek İskandinav ülkelerinde görülmektedir. Asyada bu oran 5/100.000’dir. Bu coğrafik farklılığın güneş ışığındaki ultraviyole ışınlarına maruz kalma ile ters bir korelasyon gösterdiği ileri sürülmüştür. Ancak bazı Afrika ülkelerinde yüksek prostat kanseri insidansının bildirilmesi bu hipotezi desteklememektedir(13).
Risk faktörleri ve etiyoloji:
Prostat kanseri başlangıcının ve progresyonunun kesin nedenleri henüz tam olarak bilinmemektedir. Birçok kanıt hem çevresel hem de genetik faktörlerin bu hastalığın gelişiminde rolü oldugunu göstermektedir.
Prostat kanseri risk faktörleri arasında diyet ve içeriği giderek önem kazanmaktadır. Son çalışmalar göstermiştir ki diyetle birlikte likopen, vitamin D, vitamin E, hint safranı, fito östrojenler, resvatrol, uzun zincirli omega-3 yağ asitlerinden ve selenyumdan zengin besin maddelerinin, fruktoz içeren meyvelerin yüksek oranda tüketimi, et, hayvansal yağlar ve kalsiyumdan zengin yiyeceklerin düşük oranda tüketimi prostat kanseri insidansını veya progresyonunu azaltmaktadır.14)
Obezite ve prostat kanseri arasındaki ilişkiyi ortaya koymak için birçok çalışma yapılmış ve bu çalışmalardan bazıları obezitenin prostat kanseri riskini arttırdığını(15) bazıları ise azalttığını ortaya koymuştur(16). Obez hastalar diyabet, koroner kalp hastalığı, hipertansiyon ve aterosklerozis gibi ek hastalıkları nedeniyle daha sık sağlık kuruluşlarında izlem altında olduklarından daha genç yaşta prostat kanseri tanısı almaktadırlar. Bu yüzden bu hastalar tanı anında, düşük PSA düzeylerine ve erken evre hastalığa sahip olmaktadırlar(17). Ayrıca literatürde, prostat kanserli obez hastalarda radikal prostatektomi sonrası biyokimyasal nüks riskinin yüksek olduğunu gösteren çalışmalar da bulunmaktadır (18)
Diyabet ve prostat kanseri arasındaki ilişkiyi araştıran birçok çalışma yapılmış ve prostat kanseri riskinin diyabet tanısından birkaç yıl sonra arttığı, uzun süredir diyabet olanlarda ise prostat kanseri riskinin azaldığı gösterilmiştir .(19) Literatürde bu sonucun nedenlerini ortaya koyan birçok çalışma yapılmıştır. Diyabette, insülin rezistansının sonucu olarak hastalığın ilk evrelerinde insülin düzeyi yükselmekte ve diyabetin ilerlemesiyle ortaya çıkan pankreastaki beta hücrelerinin hasarı sonrasında insülin düzeyi normalin altına düşmektedir. İnsülinin prostat kanseri hücre kültürlerine etkisini araştıran invitro çalışmalarda, insülinin bu hücre kültürlerinin çoğalmasını pozitif yönde etkilediği ortaya çıkarılmıştır .(20) Ayrıca artmış serum insülin düzeyinin prostat kanseri riskini ve prostat kanseri rekürrens riskini arttırdığı da gösterilmiştir . (21)
Birinci dereceden yakınlarından birinde prostat kanseri öyküsü olanlarda risk 2 kat, ikiden fazla prostat kanseri öyküsü olanlarda ise risk 9 kat artış göstermektedir.(22) Yemeklerle alınan yağ oranının prostat kanseri riskini arttırabileceği ileri sürülmüştür.(23) Prostat kanserinden korunmaya yönelik kemopreventif etkili ajanların saptanması için çalışmalar sürmektedir. Finasterid ile yapılan prostat kanserini önleme çalışmasında
%24,8’lik bir risk azalması bildirilmiştir .(24) Ancak finasterid kullanan deneklerde yüksek dereceli prostat kanserinin görülme oranının plaseboya göre fazla olması finasteridin bir kemopreventif ajan olarak kabul görmemesine neden olmuştur. Bununla birlikte Finasterid kullanan hastaların devam eden takiplerinde yüksek dereceli prostat kanserinin bu erkeklerde daha yüksek bir oranda görüldüğüne dair bir bulguya rastlanmamıştır. Preklinik verilerde nonsteroid antiinflamatuar ilaçların (NSAİİ) prostat kanserinin oluşumunu engelleyebileceğine dair gözlemler nedeniyle yapılan bir çalışmada beş yıl boyunca ayda 30 tablet ve üzerinde NSAİİ kulananlarda prostat kanseri riskinin anlamlı olarak azaldığı gösterilmiştir.(25)
Enfeksiyöz ajanların kanser etyolojisindeki rolünü araştıran epidemiyolojik, virolojik, immünolojik çalışmalarda herpes simpleks tip 2, CMV ile prostat karsinomu birlikteliği elektron mikroskobik incelemelerde saptanmıştır.
Belirti ve Semptomlar
Prostat kanseri sıklıkla ileri yaş hastalarda görülmekle birlike nadiren genç erişkinlerde de ortaya çıkabilmektedir. Kanserin prostat dokusuna sınırlı olduğu erken evredeki hastalar tamamen asemptomatiktir. Hastalığın sessiz seyri nedeni ile 50 yaş üzeri erkekler yüksek rölatif riskli kabul edilerek, prostat kanseri için tarama programlarına alınmaları öngörülmektedir. Bu amaçla dijital rektal muayene ve prostat spesifik antijen (PSA) ölçümlerinin yıllık olarak tekrarı tarama için yeterli görülmektedir . Hastalık ilerledikçe idrar projeksiyonunda azalma, pollaküri, dizüri ve idrar retansiyonu gibi prostatizm semptomlarıyla beraber kemik ağrıları ortaya çıkabilir. Fakat bu bulgular prostat kanseri için spesifik değillerdir. Mesane boynunun fonksiyone ya da mekanik obstrüksiyonuna bağlı acil olarak idrar yapma, idrarı tam boşaltamama hissi ve nokturi görülebilir. Kanserin prostatik üretra ve trigona invazyonu sonucu hastaların %15’inden azında hematüri gelişir ve hemospermi nadir olarak görülebilir. İleri evrede rektumun invazyonu ile konstipasyon, abdominal ağrı, rektal kanama, diyare ve rektal ağrı görülebilir. Korpus kavernozuma invazyon ile priapismus gelişebilir. Tümörün trigon ve daha yukarı yayılımı ile üreter alt uçlarına invazyonu sonucunda oligüri, anüri, üremi, ödem, sıvı retansiyonu ve elektrolit imbalansı gibi böbrek yetmezliği semptomları verebilir. Sırtta ve kalçada devamlı kemik ağrıları veya siyataljik ağrılar kemik metastazlarına bağlı olabilir. Nadiren pelvik lenfadenopatiler, supraklavikular veya aksiler lenfadenopatiler (genellikle sol taraflı) bazen semptom sebebi olabilir. Asit ve plevral efüzyonlar prostat kanserinin nadiren başlangıç bulgularıdır.
Tanı
Prostat kanserinin tarama ve tanısına yönelik olarak dijital rektal muayene ve serum PSA düzeyi önemli katkılar sağlar ve ayrıca prostat kanserinin evrelendirilmesi için de yol gösterici olabilir. Rektal tuşede prostatın nodüler bir şekilde palpe edilmesi, endurasyon göstermesi malignite lehine değerlendirilmekle beraber bu vakaların ancak %15 -25 kadarında gerçekten prostat kanseri tanısı konulur. Bu nedenle prostat kanserinin tanısında rektal tuşenin duyarlılığı oldukça düşüktür.(26) Bir serin proteaz olan PSA, prostat epitel hücrelerinde sentezlenerek bol miktarda seminal sıvıya salgılanır. Serum PSA düzeyleri prostat kanserinde artabileceği gibi prostatitte, idrar retansiyonunda ve rektal tuşe ile prostat muayenesi sonrasında da artabilir.(27)
Prostat biyopsisinin endikasyonunu koymak için hangi PSA düzeyinin kriter alınacağına dair çalışmalar devam ediyor. Serum PSA düzeyinin toplam duyarlılık oranı yaklaşık %70 olmakla birlikte spesifik değildir ve sessiz ve agresif hastalığı saptamada yetersizdir. Örneğin PSA’nın kritik eşik değeri 4.1 ng/mL olarak kabul edilirse 60 yaş altı erkeklerde hata yapma oranı önemli ölçüde artar. Bununla birlikte 4.1 ng/mL cut off değerinin %30’luk bir prediktif değeri olduğu dikkate alınırsa her 3 erkekten ikisinin prostat kanseri olmadığı halde biyopsi yapılacağı anlamına gelir. (28)
Sık olarak kullanılan diğer bir test de PSA değerinin 10 ng/mL altında olan hastalarda serbest PSA oranına bakılmasıdır. Serbest PSA düzeyleri ile kanser tanısı arasında ters bir ilişki mevcuttur. Ürologların çoğu %10’luk bir serbest PSA düzeyinin olması durumunda prostat biyopsisini önermektedir. Serum PSA düzeyleri 4 ng/mL üzerinde olan ve daha önce biyopsi yapılmayan erkeklerde serbest PSA düzeyi %25’in altında olması %50-60 prostat kanseri riskini gösterebilir. Önceden yapılan biyopsi sonucu benign olmasına rağmen erkeklerde PSA’nın 4,0 ng /ml’nin üzerinde ısrarla seyretmesi ve serbest PSA’nın %10’un altında olması biyopsinin hemen tekrarlanmasını gerektirir (29, 30).
Amerikan Kanser Cemiyeti ve Amerikan Ürologlar Birliği, sağkalım süresinin 10 yıldan fazla olabileceği düşünülen erkeklerde 50 yaş sonrasında yıllık rektal tuşe muayenesi ve serum PSA düzeyinin ölçülmesini tavsiye etmiştir. Yüksek risk taşıyan erkeklerde ise peryodik takibin 40-45 yaş sonrasında başlanması tavsiye edilmiştir.
Parmakla Rektal Muayene
Parmakla rektal muayenede prostat patolojileri, prostat asimetrisi, nodül, seminal vezikül ve rektum patolojileri anlaşılabilir. PRM prostat kanser tarama ve tanısında uygulanan en basit yötemdir. PRM ile belirlenen prostat nodüllerinin sadece 1/3’ü aslında prostat kanseri iken geriye kalanlar ise BPH, prostatit, seminal vezikül anomalileri, prostat tası ve rektal patolojilerdir. Parmakla rektal muayene yöntemi prostat kanserlerinin lokal yayılımlarının değerlendirilmesinde ilk kullanılan yöntemdir. Ancak, prostat kanserlerinin az bir kısmının palpabl olması ve palpabl kanserlerin de bu asamada prostat kapsülünü asmıs durumda olması, bu yönteminönemli dezavantajlarını olusturmaktadır (31). Populasyonun taranmasıyla yapılan bir çalışmada PRM’nin pozitif öngörü değeri PSA değerinin 0 ile 2,9 ng/ml olduğuaralıkta %4 ie %11 arasında iken, PSA değerinin 3 ile 9,9 ng/ml olduğu aralıkta iken bu değer %33 ile %83 olarak hesaplanmıstır. Aynı çalısmada, PRM olmadan tümkanserlerin %17,3’nü atlanacağı belirtilmistir (32). Parmakla Rektal Muayene (PRM) tek basına kullanıldığı zaman kanserlerin %23-%45’ini atlamaktadır (31). Üstelik PRM ile yakalanan kanserler genellikle ileri evre kanserler olmaktadır. PSA değerine bakılmaksızın PRM’de anormallik saptanan her hastaya biyopsi yapılmalıdır. Çünkü prostat kanserlerinin %25’inde PSA değeri normal kabul edilen 4 ng/ml’nin altındadır.
Prostatın Transrektal Ultrasonografisi ve Biyopsisi
Transrektal ultrasonografinin prostat kanser tanısındaki yeri, TRUS esliğinde yapılan prostat biyopsisidir. TRUS esliğinde prostat biyopsisi, parmakla muayene ve serum PSA değerleri de göz önüne alınarak yapıldığında kanser tanısı koymakta kullanılan önemli bir yöntem olarak karsımıza çıkmaktadır. Yasam beklentisi 10 yılın üzerinde olan ve PSA yükselmesi ile birlikte ya da olmaksızın PRM’si anomalliği bulunan hastalara TRUS esliğinde prostat biyopsisi yapılması gereklidir. PRM’si normal fakat PSA yüksekliği bulunan tüm hastalara biyopsi yapılması endikedir. Aynı zamanda TRUS brakiterapinin planlanmasında ve tedavisi sırasında kullanılmaktadır. Önceleri, TRUS’un prostat kanser taramasında kullanılması önerilmesine rağmen günümüzde sınırlı sensitivite ve spesifitesinin olması ve yüksek maliyeti nedeniyle bu düsünceden uzaklasılmıstır (33). Prostat kanser tanısındaki en önemli engel, TRUS’ta tespit edilen hipoekoik lezyonların çoğunun kanser olmayısı ve palpabl olmayan kanserlerin %50’sinin 1 cm’nin altında olması ve bu kanserlerin TRUS’ta tespit edilememesidir (34). Sadece TRUS’ta görülen hipoekoik alanlardan biyopsi alınırsa kanserlerin %25 ile %50’si atlanmaktadır. Çünkü
hipoekeoik alanlar isoekeoik alanlara göre iki misli kanser olma olasılığı tasımaktadır (35). Buradan yola çıkarak PRM’si anormal olan ya da PSA yüksekliği bulunan tüm hastalara TRUS bulgularına bakılmaksızın biyopsi yapılmalıdır. TRUS’un en önemli avantajı prostat biyopsisi sırasında genis alanların örneklenmesini sağlamasıdır (31). Prostat biyopisinde klasik yöntem sistematik sekstant biyopsi tekniğidir. Biyopsiler her iki prostat lobunun taban, orta kesim ve apeksinden, parasagital hattan, özellikle periferik zonlara denk gelecek sekilde alınır (36). Stamey ise biyopsi sayısını değistirmeden, iğneyi daha laterale kaydırarak daha iyi örnekleme yapılabileceğini ileri sürmüstür. Klasik sekstant biyopsiye prostatın orta ve taban kısımlarında periferal zonun lateralinden biyopsiler eklenerek gelistirilen 10 kadran biyopsi tekniğinin kanser yakalamada daha duyarlı olduğu ve bu yöntemin düsük hacimli tümörleri daha basarılı bir sekilde tespit ettiği savunulmaktadır (37).
Biyopsi
Prostat biyopsi endikasyonu konduktan sonra transrektal US eşliğinde 18 G biyopsi iğne ucu olan bir tabanca ile lokal anestezi altında yapılır. Biyopsi işleminde 8-12 adet kor biyopsi alınır. Biyopsi sonucu negatif gelen erkekler yıllık peryodik izleme alınır; eğer yıllık 0,8 ng/mL’den fazla bir artış varsa ve rektal muayenede yeni geişen nodüllerin ya da endurasyonun saptanması halinde prostat biyopsisi yeniden önerilir. Yüksek dereceli intraepitelial neoplazi saptananlarda 1/3-1/2 oranında prostat kanseri olma olasılığı nedeniyle prostat biyopsisi tekrarlanmalıdır.(38,39,40)
Patoloji
Prostat kanserinin büyük bir çoğunluğunu adenokarsinomlar oluşturur ve bunların %70’i prostatın periferik zonundan, %20’si transizyonel zondan, %10’u da santral zondan köken alır. Prostat kanseri %85 vakada multifokaldir. 40 yaşındaki her 100 erkeğin 30’unda mikroskobik latent prostat kanseri vardır. Çok yavaş geliştikleri için birçoğu klinik önemli hale gelmezler. Çok nadir görülebilen diğer kanserler; duktal adenokarsinom, müsinöz adenokarsinom, transizyonel karsinom ve nöroendokrin (küçük hücreli) tümörlerdir. Prostat adenokarsinomunun değerlendirilmesinde birçok derecelendirme sistemi mevcut olmasına rağmen en çok kabul gören Gleason derecelendirmesidir.(41)
Gleason Skoru:
İğne biyopsine kanser teşhisi konulduktan ve patoloji raporundan sonra, kanser hücrelerinin görünümü, içindeki çekirdeklerin büyüklüğü ve şekline göre üreme ve yayılım hızı hakkında bilgi sahibi olmamızı sağlayan bir derecelendirme metoduna Gleasonn skoru denir. Gleason sistemi; tümörün, küçük büyütmede tespit edilen glandüler diferansiyasyon, büyüme paterni ve stroma ile ilişkisine dayanır. Sitolojik özellikler tümör derecelendirmesinde rol oynamaz. Primer ve sekonder yapısal paternler belirlenip, 1’den 5’e kadar derecelendirilir. 1 en iyi diferansiyasyonu, 5 en kötü diferansiyasyonu gösterir. Bulunan iki sayı toplanarak Gleason skor elde edilir. Tümör tek bir histolojik paternden oluşuyorsa primer ve sekonder paternlere aynı derece verilir. Gleason skoru, 2’den (1+1=2), 10’a kadar (5+5=10) değişir. “2” yavaş ilerleme potansiyeline sahip kanser hücrelerini ifade ederken, “10” aşırı hızlı ilerleme ve çoğalma kapasitesine sahip tümör anlamını taşır. Gleason dereceleme sisteminde skor gruplandırılması; 2-4 (düşük derece), 5-7 (orta derece) ve 8-10 (yüksek derece) olarak üçlü grup şeklinde yapılmıştır.(42,43)
Gleason Skor 2-4: İyi differansiye (iyi nitelikte farklışama gösteren) kanser
hücreleri.
Gleason Skor 5-6: Orta differansiye kanser hücreleri Gleason Skor 7-10: Kötü differansiye kanser hücreleri Prostatta görülen tümör tipleri:
Benign: Benign büyüme(nodüler hiperplazi) Malign: -Adenokarsinom >%95
-Transizyonel karsinom, -Küçük hücreli karinom, -Skuamöz cell carsinom Araştırma ve evreleme:
Genellikle transrektal USG yardımı ile periferal zondan örnekleme yapılır. Prostatın midlobar periferal zonundan 3 biyopsi ve lateral periferal zonundan bir biyopsi yapılır.
Görüntüleme olarak MRG ve BT çekilmeli. Hastada rutin kemik görünülemesi amacıyla kemik sintigrafisi çekilmelidir. Prostat kanserli hastalarda PET-CT görüntülemesinin rolü tam olarak değerlendirilememiştir.
Evrelendirme
Prostat kanserinin tanısı histolojik olarak konduktan sonra yapılacak ilk is Evrelemenin yapılmasıdır. Prostat kanserinin evrelemesinde iki amaç vardır. Prognozu belirlemek ve tahmin edilen hastalık yaygınlığına göre uygun tedaviyiseçmektir. Prostat kanserinin evrelemesi PRM, PSA ölçümü ve kemik taraması ile yapılmaktadır. Bazı durumlarda bilgisayarlı tomografi(BT) veya manyetik rezonans görüntüleme ve akciğer grafisi gerekmektedir. Tedavi seçeneklerini tamamen etkilediği için intrakapsüler (T1-T2) ve ekstrakapsüler(T3-T4) hastalık ayrımının yapılarak lokal tümör evresinin belirlenmesi gereklidir. Genellikle PRM T evresini düsük belirler ve yapılan bir çalısmada PRM ve patolojik tümör evre uyumunun <%50 olduğu bulunmustur (44). Serum PSA seviyesi arttıkça hastalığın yayılma ihtimali artar. Serum PSA seviyesi, prostat biyopsisindeki gleason skoru ve klinik T evresinin birlikte kullanımı patolojik evreyi öngörmede belirteçlerin tek basana kullanımlarından daha yararlıdır (45). Tedavi öncesi evreleme; klinik olarak lokalize, lokal ilerlemis ve metastatik hastalık arasında ayırım yapma sansını getirmektedir. Günümüzde kullanılan klinik evreleme yöntemi 1997 yılında son sekli verilen TNM (Tümör, Lenf nodu, Metastaz) klinik evreleme klasifikasyonudur (Tablo 1) (46). Patolojik evreleme, klinik evreleme yönteminden prognozu belirleme açısından daha değerlidir. Çünkü patolojik evreleme yönteminde tümör hacmi, cerrahi sınır durumu, ekstrakapsüler yayılım, seminal vezikül ve lenf nodu yayılımı gibi parametreler kullanılmaktadır ve somut bilgi verici niteliktedirler.
Tablo 1. Prostat Kanserinin TNM evrelemesi T-Primer tümör
Tx; Pirimer tümör değerlendirilemez To; Primer Tümöre iliskin kanıtı yok
T1 Palpe edilemeyen yada görüntülemede fark edilemeyen klinik olarak görünmez tümör T1a; Çıkarılan dokunun % 5’inde yada daha azında tümöre iliskin insidental histolojik bulgu
T1b; Çıkarılan dokunun % 5’inden çoğunda tümöre iliskin insidental histolojik bulgu T1c; iğne biyopsisiyle tespit edilen tümör
T2 Tümör prostat içinde sınırlıdır
T2a;Tümör bir lobun bir yarısını yada daha azını tutar
T2b;Tümör bir lobun bir yarısından çoğunu tutar, ama her iki lobu tutmaz T2c;Tümör her iki lobuda tutar
T3 Tümör prostatik kapsülden dısarıya uzanır T3a;Kapsül dısı uzanım (tek veya iki taraflı) T3b;Tümör seminal vezikülleri istila eder
T4 Tümör sabittir yada seminal veziküllerden baska komsu yapıları istila eder: Mesane boynu, eksternal sfinkter, rektum, levator ani ve/veya pelvik duvar
N –Bölgesel lenf nodları
Nx Bölgesel lenf nodları değerlendirilemez N1 Bölgesel lenf nodu metastazı yok N2 Bölgesel lenf nodu metastazı var
M- Uzak metastazlar
Mx Uzak metastazlar değerlendirilemez M0 Uzak metastaz yok
M1 Uzak metastaz var
M1a Bölgesel olmayan lenf nodu(nodları) M1b Kemik(kemikler) metastazı
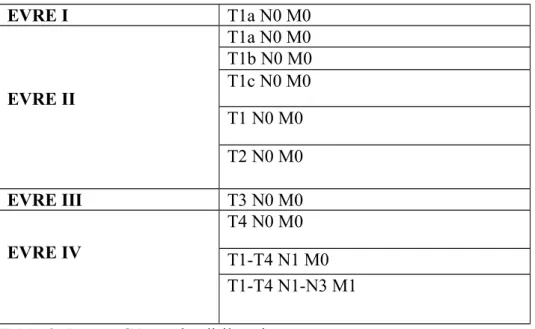
T, N, M kategorileri belirlendikten sonra aşağıdaki tablodan evrelendirme yapılır: EVRE I T1a N0 M0 EVRE II T1a N0 M0 T1b N0 M0 T1c N0 M0 T1 N0 M0 T2 N0 M0 EVRE III T3 N0 M0 EVRE IV T4 N0 M0 T1-T4 N1 M0 T1-T4 N1-N3 M1
Tablo 2: Prostat CA evrelendirilmesi Tedavi:
Sınırlı Prostat Kanserinin Tedavisi
Radikal prostatektomi, radyoterapi (RT) ve brakiterapi gibi birçok tedavi seçeneği vardır. Radikal tedavi sonrası prostat kanserli hastaların nüks oranı, düşük riskli hastalarda %10-15, orta riskli hastalarda %25, yüksek riskli hastalarda %50-65’tir (47).
Yakın Izlem:
Lokalize prostat kanserinin doğal seyri üzerine yapılan çalışmalar 10 sene içinde kanserin genellikle lokal olarak büyüdüğünü ancak çok az sayıda hastanın prostat kanseri sebebiyle öldüğünü gösterir. Bu konuda yapılan non-randomize çalışmaların meta-analizinde Grade 1, 2 ve 3 hastalar için 10 yıllık kanser spesifik sağkalım sırasıyla %87, %87 ve %34 olarak; 10 yıllık metastazsız yaşam ise yine sırasıyla %81, %58 ve %26 olarak belirlenmiştir. Bu meta-analizin sonuçlarına göre yaşam beklentileri 10 yıl veya daha az olan hastalar için yakın izlem uygun bir seçenek olabilir.
Radikal Radyoterapi:
Lokalize prostat kanserinin tedavisinde radyoterapinin çeşitli avantajları vardır. Teknik olarak radikal radyoterapide hastalara genellikle toplam 6800-7000 rad radyoterapi uygulanır.
Pelvik lenf nodları ise 4500-5000 rad ile ışınlanır. Tedavi yaklaşık 6-7 gün sürer. Modern yüksek enerjili lineer akseleratörler ve 3 boyutlu konformal tedavinin kullanılmasıyla morbidite oldukça düşmektedir. Yapılan çalışmalarda radikal radyoterapi ile cerrahide elde edilen sonuçlara yakın sonuçlar elde edildiği ancak hastalıksız yaşamın cerrahi tedavi alan hastalarda daha iyi olduğuna dair kanıtlar vardır. Ancak cerrahi tedavi ile radyoterapinin sonuçlarını doğru bir şekilde karşılaştırmak hemen hemen olanaksızdır. Bunun temel sebebi cerrahi tedavi uygulanan hastaların patolojik evrelendirmeleri yapılmışken, radyoterapi uygulanan hastaların gerçek patolojik evrelerinin bilinmeyişidir. Ayrıca bu iki tedavi alternatifini karşılaştıran büyük prospektif çalışmalar henüz yapılmamıştır. Lokalize prostat kanserinde hastalığa spesifik sağkalım oranları retrospektif çalışmalarda 5 yıl için %76–89, 10 yıl için ise %56-85 arasında bildirilmiştir. Yapılan prospektif çalışmalarda ise genel sağkalım oranları 5 yıl için%74–87, 10 yıl için ise %43–63 arasında bildirilmektedir.
Brakiterapi:
Brakiterapi veya radyoaktif izotop implantasyonu teorik olarak konvansiyonel radyoterapiye oranla prostat dokusuna daha fazla ışın verilirken komşu organların daha az ışına maruz kalmalarına olanak verir. Yüksek intraprostatik doz da daha az komplikasyon ile daha etkili tümör sterilizasyonunu sağlar. Açık cerrahi ile pelvik lenf nod disseksiyonunu takiben kalıcı radyoaktif iodin (I125) implantı yerleştirilmesi 1970’li yıllarda yaygın olarak 15 kullanılıyordu. Bu uygulamanın 5 yıllık sonuçları umut verici iken 10 yıllık sonuçlar oldukça başarısız idi. Bunun muhtemel sebepleri heterojen ışın dağılımı ve yüksek gradeli tümörlerin tedavisindeki olumsuz radyobiyolojik etkiler olarak düşünülmüştür. Brakiterapide görüntüleme ve uygulamadaki teknolojik gelişmeler bu tedavi yönteminin günümüzde tekrar gündeme gelmesini sağlamıştır.
Radikal prostatektomi: Radikal prostatektomide cerrahın amacı ilk olarak
kanserin kontrolü ancak bunun yanısıra idrar kontinansının ve cinsel fonksiyonun korunmasıdır.
Radikal prostatektomi, bu operasyon ile kür sağlanabilecek ve bu kürden yararlanabilecek kadar uzun yaşam beklentisi olan hastalar için uygulanmalıdır. Radikal prostatektomi ile tedavi edilen T1-T2 prostat kanserli hastalarda 5 yıl için yaklaşık %80, 10 yıl için ise yaklaşık %70 oranında biyokimyasal nükssüz takip oranları bildirilmektedir. Operasyon alt midline karın insizyonu ile girilerek retropubik olarak uygulanabilir. Beraberinde pelvik lenf nodu diseksiyonu yapılabilir. Operasyona bağlı mortalite %0,05’ten azdır. Radikal prostatektomiden sonra hastanede ortalama kalış süresi 1-3 gündür (47,48). Yeni çalışmalar, T1c prostat tümörlerinde eğer Gleason skoru < 7, PSA düzeyi < 10,0 ng/mL ise pelvik lenf nodu diseksiyonunun gerekli olmadığını göstermektedir. Bazı orta riskli vakalar için de bu evrelendirme prosedürünün yapılmasının gerekmeyebileceği ancak yüksek riskli olgular için hala yapılması gereken bir işlem olduğu kabul edilmektedir (49, 50).
Adjuvant tedavi: Radikal prostatektomi sonrasında T1, T2 veya patolojik olarak
T3 prostat kanseri olan, pozitif lenf nodu, PSA’da yükselme saptanan ve cerrahi sınırları pozitif olan hastalar için potansiyel olarak adjuvant tedavi endikasyonu vardır. Adjuvant tedavi, RT veya antiandrojen tedavi ile tek başına ya da kombine edilerek uygulanır. Adjuvant hormonal tedavinin ne zaman başlaması gerektiği konusunda akademik çevrelerde ciddi tartışmalar ve kuşkular vardır. Yalnızca nod pozitif hastaların adjuvant hormonal tedaviden yarar görebileceği bildirilmektedir.
Prostatektomi sonrası nüks olan hastaların tedavisi: Radikal prostatektomi
sonrası PSA düzeylerinin ölçülemeyecek kadar düşük seyretmesi beklenir. Cerrahi sonrası takipte PSA’nın 0,2 ng/ml’nin üzerine çıkması nüks olasılığını kuvvetlendirir. Bu durumda hastanın yeniden evrelendirilmesi ve yeni bir kurtarma tedavisi yönünden değerlendirilmesi gerekir. Nüks prostat kanserinde verilecek tedavi seçenekleri; RT, hormonal tedavi, klinik çalışma protokolleri veya palyatif destek tedavilerinden oluşur. Bazı vakalarda prostatektomi sonrası küçük bir benign prostat dokusunun geride kalması nedeniyle kanda ölçülebilir düzeyde PSA saptanabilir. Bu durumda her ne kadar PSA’nın 0,2 ng/ml’nin üzerinde olması nüksü gösterse de gerçek nüksten emin olmak için PSA’nın 0,4 ng/ml’nin üzerine çıkması beklenir. PSA artışını yorumlamak için kullanılan bir diğer yöntem PSA velositesi veya daha spesifik olarak PSA ikilenme zamanıdır. Birçok yeni çalışmada eğer biyokimyasal bir nüks tedavi edilmezse PSA ikilenme zamanının 10-12 aydan daha kısa olması erken klinik nüksü gösterdiği bulunmuştur. Nüks prostat kanserinin küratif RT’si ile ilgili şu ana kadar biriken veriler konvansiyonel konformal RT dozundan (70,2 Gy) daha yüksek bir dozda (79,2 Gy) tedavi gerektirdiğini desteklemektedir (51).
RT sonrası nüks saptanan olgular için tedavi önerileri: Küratif RT sonrası 2
yıldan sonra nüks eden prostat kanserleri için hormonal tedavi, kurtarma cerrahisi, gözlem veya klinik bir çalışmaya alınma bir tedavi seçeneği olarak önerilmektedir. Eğer hastalarda minimal yandaş hastalık, iyi bir yaşam beklentisi ve nüks prostat kanserinin lokal olduğuna dair kanıt varsa kurtarma cerrahisi bir opsiyon tedavi yaklaşımıdır. Ancak işlem öncesinde kemik sintigrafisi, BT, sistoskopi ve detaylı bilgilendirme yapılmalıdır.
Lokal İleri Prostat Kanserinin (T3-T4) Tedavisi
Lokal ileri prostat kanserli hastaların tedavisi, EBRT, androjen ablasyon tedavisi ile
birlikte RT veya androjen deprivasyon tedavisi ile birlikte olan ya da olmayan radikal prostatektomiyi içeren multidisipliner ve multimodal bir yaklaşım çerçevesinde yapılır.
Yeni yapılan iki çalışmanın kanıtları (RTOG 85-10 ve EORTC); tek başına RT ile karşılaştırıldığında lokal ileri veya yüksek riskli (Gleason skoru ≥ 8) prostat kanserli hastalarda EBRT ile antiandrojen tedavinin kombine verilmesinin sonuçları olumlu yönde etkilediğini göstermektedir. Tek başına cerrahi tedavi lokal ileri prostat kanserinde mantıklı bir seçenek olabilir. Yamada ve arkadaşları evre III prostat kanserinin düşük morbidite ve lokal nüks riskinde anlamlı bir azalma ile başarılı bir şekilde tedavi edilebileceğini bildirmişlerdir. T3 hastalar için yapılan radikal prostatektomi serilerinin en büyüklerinden biri olan Mayo Clinic serisinde 1000’den fazla olgu mevcuttur. Bu seride hastaların %34’üne adjuvant tedavi verilmiş; kansere özgü 15 yıllık sağkalım %77 ve lokal nüks oranı %21 olarak bildirilmiştir. Radikal prostatektomi ve pelvik lenfadenektomiyi takiben nodal metastaz saptanan 98 hasta, antiandrojen ve gözlem koluna randomize edilmiştir. Ortalama 7 yıllık bir takip sonrasında gözlem kolundaki 51 hastanın 18’inin, tedavi kolundaki 47 hastanın ise yalnızca 4’ünün öldüğü bildirilmiştir (52).
Nod pozitif prostat kanserli hastalarda lokal tedavinin total sağkalıma bir katkı sağlayıp sağlamadığı hakkında tartışmalar devam etmektedir. Yakın zamana kadar radikal prostatektomi yapılmadan önce pelvik lenf nodlarından yapılan örneklemenin frozen patolojik incelenmesi standart bir yaklaşımdı. Frozen incelemede mikrometastaz saptanan olgularda radikal prostatektominin kontrendike olduğu kabul edilirdi. Retrospektif olsa da, büyük ölçekli Mayo Clinic verilerinin de dâhil edildiği Amerikan merkezli birçok çalışmadanelde edilen verilerde, bölgesel pelvik lenf nodlarında mikrometastazlar olmasına rağmen radikal prostatektomi yapılan hastalarda sağkalım avantajı bildirilmiştir. Bu hastalaraerkenden başlanacak hormonal tedavi ile daha iyi ve daha uzun bir sağkalım sağlanabilir.
Metastatik Prostat Kanserinin Tedavisi
Sadece PSA düzeyi yükselen hastaların tedavisinde erken tedavinin herhangi bir yararı olduğuna dair prospektif bir kanıt yoktur. Bununla birlikte metastaz gelişme riski yüksek olan ve PSA düzeyi yükselen hastalar için ayrıca radyolojik olarak metastatik hastalığı kanıtlanmış olan hastalarda erken hormon tedavisinin faydalı olabileceğini ileri süren hekimler mevcuttur (53).
Metastatik hastalıkta birinci hat hormon tedavisi: İlerlemiş prostat kanserinin
birinci hat hormon tedavisi, cerrahi veya medikal olarak androjenlerin etkisinin yok edilmesidir. Böylece hastaların çoğunda PSA düzeylerinde azalma, hastalık semptomlarında düzelme ve radyolojik iyileşme sağlanabilir. Bilateral orşiektomi testosteron düzeylerini çok hızlı ve etkili bir şekilde düşürür. Medikal olarak androjenlerin etkisini yok etmek için sıklıkla lüteinizan hormon relazing hormon (LHRH) analogları (goserelin, leuprolide), LHRH antagonistleri (abarelix), nonsteroidal antiandrojenler (flutamid, bikalutamid, nilutamid) ve steroidal antiandrojenler (siproteron asetat, megestrol asetat) kullanılır. Tek başına antiandrojen kullanımının hastalık progresyonu veya sağkalım bakımından kombine tedaviye göre daha başarısız olduğu gösterilmiştir. Bu nedenle antiandrojen ilaçlar cerrahi veya medikal kastrasyon ile kombine olarak kullanılır. Kombine androjen blokajı, bir LHRH analoğu ile bir antiandrojen ilacın birlikte kullanılması ile yapılan tedaviyi ifade eder. Bu tedavide hem testiküler ve hem de sürrenal kaynaklı androjen üretimi baskılanır.
Dietilstilbesterol (DES): Östrojen kullanımı kimyasal bir kastrasyondur. DES,
hipotalamo-hipofizer-gonadal aksı inhibe ederek prostat büyümesini önler. Bunun sonucundatestiküler testosteron sentezi engellenir ve plazma testosteron düzeyleri düşer. DES 3 mg/gün 18 den fazla alınırsa kardiyovasküler mortalitede anlamlı bir artışa neden olduğu için kastrasyon dozlarında kullanılabilir (54).
Tedavi önerileri: Metastatik prostat kanserinin başlangıç tedavisi
bireyselleştirilmelidir. Lokal tedavi sonrası izleme alınan prostat kanser vakalarında serum PSA ikilenme zamanı ve PSA nüksüne kadar geçen sürenin uzun olması, düşük Gleason skoru ve önemli komorbiditelerin eşlik etmesi durumlarında tedavi geciktirilebilir. Bununla birlikte birçok yerde metastaz ortaya çıkan hastalara derhal tedavi başlanmaktadır. Genellikle orşiektomi veya kombine antiandrojen tedavi metastatik hastalıktan kaynaklanabilecek patolojik kırık, spinal kord basısı, üreter obstruksiyonu ve iskelet dışı metastaslar gibi komplikasyonları önlemek için tercih edilmektedir. İlk aşamada orşiektomi
veya kombine antiandrojen tedaviyi genellikle bir LHRH analoğu ile monoterapi takip eder.
İkinci hat hormon tedavileri: Androjen ablasyon tedavisine ilk kez başladıktan
sonra elde edilen yanıtların süresi aylardan yıllara kadar değişen zamanlarda karşımıza çıkabilir. Gözlenen bu farklı yanıt sürelerinin nedeni Gleason skoru, tedavi öncesi PSA velositesi ve hastalığın yaygınlığından kaynaklanabilir. Androjen ablasyon tedavisi altında PSA düzeylerinin artmaya başlaması, hormon direnci olarak tanımlanır. Bu aşamadaki birçok hasta, yapılacak birtakım hormon tedavi maniplasyonları ile tekrar hormon duyarlı hale gelebilir. Hormon direnci başladığı zaman yapılabilecek tedavi seçenekleri; ikinci hat antiandrojen ajanlar, steroidler veya ketakonazolün kullanılmasıdır. Çeşitli hormonal tedavi yöntemleri ile hormon duyarlılığının artırılmasına örnek olarak antiandrojen kesilmesine karşı ortaya çıkan yanıt gösterilebilir. Antiandrojen bir ilaçla yapılan tedavi sırasında PSA düzeylerinin yükselmeye başlaması nedeniyle antiandrojen ilaçları kesilen hastaların 1/3’ünde PSA düzeylerinde bir azalma ya da klinik bir iyileşme gözlenir. Bu yanıtın nedeni tam olarak bilinmemesine rağmen progresif hastalıkta androjen reseptörlerinin öneminin hala devam ediyor olması bu hipotezi desteklemektedir (55, 56). İkinci hat hormon tedavilerinin PSA düzeyinin düşürülmesinde ve klinik yanıt bakımından faydalı olduğu saptanmış olsa da 2. hat hormonoterapilerin herhangi bir sağkalım avantajı gösterdiğine dairbir veri yoktur.
Androjen Refrakter Hastalıkta Tedavi Dosetaksel:
Dosetaksel Avrupa porsuk ağacı Taxus Baccata’nın yapraklarından elde edilen taxan ailesine ait yarı sentetik bir ilaçtır. Molekül ağırlığı 807.879 g/mol dür. Etki mekanizması, hücre içindeki mikrotubulleri stabilize eder ve tubulin dimerlerden mikrotubulus oluşumunu artırır. Hücrede tubulin / mikrotubul dengesi bozulur ve nonfonksiyone tübuller lehine denge oranı değişir. Hücre içinde biriken polimerize mikrotubuller DNA, RNA ve protein sentezini bozarak G2/M fazında maksimum sitotoksik etkisini gösterir. Bcl–2 ve Bcl-x gen ekspresyonunun etkilerini tersine çevirdiği saptanmıştır. Dosetakselin hücre içinde birikimiyle polimerize mikrotubullerin ayrılamadığına inanılmaktadır. Proliferasyon aşamasındaki kanser hücresi, siklusun G2/M fazında arrest olur ve apoptoza yönelir (57). İn-vitro çalışmalar çeşitli fare ve insan kanser hücre hatlarında 4-35 ng/mL gibi oldukça düşük konsantrasyonlarda sitotoksik etki gösterir. Bir çok antitumoral ajanla kombine edilerek antitumoral etkilerinde oluşabilecek
sinerjistik etkiler araştırılmış; cisplatin veya adriamycin ile herhangi bir sinerjistik etki saptanmamıştır. Vinkristin ile kombinasyonunda additif etki elde edilmiştir. Siklofosfamid ve 5-FU ile sinerjistik etki gösterdiği tespit edilmiştir. Docetakselin in-vivo etkileri, deneysel olarak hayvanlarda oluşturulan tümör ksenogreftleri üzerinde komplet remisyon oluşturmasıyla gösterilmiştir. İnsan over, meme ve melanom hücre paneli ile deneysel olarak hayvanlarda oluşturulan kanser depozitleri üzerinde küratif antineoplastik etki gösterdiği saptanmıştır (58, 59).
Dosetaksel temel kemoterapi şemaları ile androjen refrakter prostat kanserli hastaların tedavisinde bir sağkalım avantajı sağladığını gösteren iki büyük randomize çalışmanın sonuçları kemoterapinin rolünü son birkaç yıldır önemli olarak değiştirmiştir. Southwest Oncology Group (SWOG)’dan bir grup araştırıcı tarafından hastalar Mitoksantron, Prednizon ile Dosetaksel, Estramustin, Deksametazon kollarına randomize edilmiş. Dosetaksel kolundaki hastalarda sağkalımda anlamlı bir artış (2 ay) saptanmıştır (60). Tennock ve arkadaşlarının yaptığı ikinci bir çalışmada 75 mg/m² dosetaksel + prednizon verilen hastalar ile mitoksantron + prednizon verilen hasta kolu karşılaştırıldığında benzer bir sağkalım avantajı (2 ay) bildirilmiştir. Bu çalışmalarda metastatik prostat kanserinde ilk kez kemoterapi ile sağkalımda bir artış olduğu saptanmıştır. Bu artış nedeniyle dosetakselin yeni ajanlarla kombinasyonunu içeren birçok çalışma yapılmıştır. Dosetakselin doz sınırlayıcı olabilen toksik etkileri miyelosupresyon, nöropati veya her ikisinin bir arada bulunduğu bir klinik tablo ile karşımıza çıkabilir.
Mitoksantron ve prednizon: 12 mg / m² mitoksantron + prednizon şeması tek
başına prednizona göre refrakter metastatik prostat kanserinde ağrıyı azaltması, hayat kalitesinde iyileşme sağlaması nedeniyle onay almıştır. Ancak bu şemanın genel sağkalıma herhangi bir katkısı saptanmamıştır (61).
Estramustin: Östrodiol molekülüne bağlı bir alkilleyici ajan olan estramustinin tek
başına etkinliği düşük olduğu için prostat kanserinde diğer stotoksik ilaçlarla birlikte kullanılmıştır. Faz 3 çalışmalarda, estramustinin dosetaksel ile kombinasyonu, mitoksantron ile kombinasyonundan üstün bulunmasına karşılık dosetaksel prednizon kombinasyonuna üstünlüğü gösterilememiştir (62). Estramustinin diğer sitotoksik ajanlarla (vinorelbin, paklitaksel, ixabeplone ve etoposit) kombinasyonlarının değerlendirildiği çalışmaların metaanalizinde istatistiksel anlamlı genel sağkalım artışı elde edilmesine rağmen grade 3 tromboembolik olayların sıklığında da anlamlı artışlar saptanmıştır (63-64-65).
Kabazitaksel: Diğer taksanlara dirençli prostat kanserinde ikinci hat tedavi olarak
değerlendirilmiştir. American Society of Clinical Oncology (ASCO) 2010’da sunulan Tropik faz 3 çalışmasının sonucuna göre Food and Drug Administration (FDA) tarafından dosetaksel tedavisi ile progresyon gösteren hormona refrakter prostat kanserinin tedavisinde kullanımı onaylanmıştır. Bu çalışmada tümü dosetaksel tedavisi altında progresyon gösteren 755 prostat kanserli hasta 10mg/gün prednizon ile birlikte 21 günde bir 25mg/m2 kabazitaksel ve 12mg/m2 mitoksantrona randomize edilmiştir. Kabazitaksel kolunda hem hastalıksız sağkalımda hem de genel sağkalımda anlamlı bir artış saptanmıştır (66).
Zoledronik Asit: Prostat kaynaklı kemik metastazları, tümör depozitlerinin
çevresinde kemik yapımında artış ve karakteristik olarak osteoblastik metastazlarla kendini gösterir. Bununla birlikte osteoblastik aktiviteye kemik rezorbsiyonunda ve osteoliziste bir artış eşlik eder. Bu klinik tablo bisfosfonatlarla engellenebilir.
Bifosfonatların doğrudan antitümöral etkilerinin olup olmadığını belirlemeye ve sitotoksik, apoptotik, immünmodülatör ve antianjiojenik etkilerinin mekanizmalarını açıklamaya yönelik çok sayıda araştırma yapılmış olmasına karşın kanser hücreleri üzerindeki etkisi tam olarak açıklanabilmiş değildir. Bununla birlikte kaspazların aktivasyonu ve mevalonat yolağının anahtar enzimi olan farnesil pirofosfat sentazın inhibisyonu ileri sürülen mekanizmalardır (67-68). Daha yüksek konsantrasyonlarda antiproliferatif ve proapoptotik etkileri bildirilmiştir. Bazı in vitro çalışmalarda myeloma hücre hatlarında (69), meme kanseri hücre hatlarında (70) ve prostat kanseri hücre hatlarında (71) antiproliferatif ve sitostatik etkileri gösterilmiştir. Flow sitometri yöntemini kullanarak Lee ve arkadaşları (72) pamidronat tedavisinin (100 μM) üç prostat kanseri hücre hattında (PC-3, DU 145 ve LNCaP) hücre ölümünü indüklerken, zoledronik asit tedavisinin hücre proliferasyonu üzerinde dramatik etkileri olduğunu göstermiştir. Corey ve arkadaşları ise (71) bu antitümöral etkileri teyit etmenin yanında zoledronik asit tedavisini takiben SCID farelerde osteolitik ve osteoblastik lezyonları in vivo inhibe edici etkilerini de göstermiştir. Bunun da ötesinde Dumon ve arkadaşları (73) antitümöral etkilerin doz ve maruz kalma süresi ile ilişkili olduğunu ve bu etkilerin bifosfonatlar arasında değişmekle birlikte aminobifosfonatlarda en fazla olduğunu göstermiştir. Meme kanser hücrelerinde paklitaksel (74), dosetaksel ve doksorubisin ile prostat kanseri hücre hatlarında dosetaksel ile (75) ve aynı zamanda myeloma hücrelerinde deksametazonla (76) zoledronik asit kombine edildiğinde sinerjistik sitotoksik etkileri gösterilmiştir.Prostat kanserinde bisfosfonatlarla yapılan çalışmalar, karmaşık sonuçlar ortaya koymuştur.
Pamidronat ile plaseboyu karşılaştıran çok merkezli kontrollü randomize iki çalışmanın kombine analizinde hormon refrakter progresif prostat kanserli olgularda iskelet sistemi ile ilgili olaylar veya semptomatik iyileşme yönünden iki grup arasında anlamlı bir fark saptanmamıştır (77). Oral bisfosfonat klodronat ile yapılan bir faz III çalışmada, gerek semptomatik kemik metastazları ve gerekse prostat kanseri ile ilişkili ölümlerde plaseboya göre anlamlı bir fark saptanmamıştır (78). Başka bir faz III çalışmada, potent bir bisfosfonat olan zoledronik asitin hormon refrakter prostat kanserli hastaların iskelet sistemi ile ilgili olaylar üzerinde koruyucu bir etkisi olduğu görülmüştür. Bununla birlikte bu çalışmada zoledronik asit ile hayat kalitesinde önemli bir artışın olmadığı ve yeni metastazlarınmeydana gelmesinde anlamlı bir azalmaya neden olmadığı dezavantajlar olarak belirtilmiştir(79).
Güncel Tedaviler
Prostat kanserli olgular için bazıları tek ajandan oluşan, bazıları ise kemoterapi ile kombine edilen araştırma aşamasında bir çok tedavi şeması vardır. Bunları aşağıdaki şekilde özetleyebiliriz.
1) Dosetakselin konvansiyonel kemoterapotiklerle ve değişik biyolojik ajanlarla kombinasyonu.
2) Oral aktif platin bileşikleri (satraplatin) ve epotilonlar (ixebeplon).
3) Diferansiyasyon sağlayan ajanlar veya antiproliferatif kromatin remodeling terapiler (vitamin D, fenilbutirat, suberoylanilid hidroksamik asid, histon deasetilaz inhibitörleri ve nonsteroid antiinflamatuar ilaçlar).
4) Tümör ilişkili antijenlere karşı geliştirilen monoklonal antikorlar, otolog dendritik hücre aşıları, tümör hücresi iminojenisitesini arttırmak için gen transferi yaklaşımları ve T hücresi inhibitör molekülerin antikor ilişkili blokajinı kapsayan immün bazlı terapiler.
5) Apoptozisi aktive etmek için adenovirüs ilişkili BAX overexpresyonunu kapsayan gen terapi yaklaşımları.
6) Sinyal ileti yolakları ve büyüme faktörlerine karşı geliştirilen yeni hedefe yönelik tedaviler (endotelin reseptör antogonistleri, epidermal growth faktör reseptörüne karşı geliştirilen monoklonal antikorlar, antisens oligonükleotitler, reseptör trozin kinaz inhibitörleri).
7) Matriks metalloproteinaz inhibitörleri ve integrin inhibitörleri. 8) Yeni hormonal terapiler.