T.C
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ ACİL TIP AD
SERUM FERRİTİN, PRO -BNP, HOMOSİSTEİN
DÜZEYLERİNİN ACİL SERVİSE BAŞVURAN
SEREBROVASKÜLER TROMBOEMBOLİLİ HASTALARDA
İNME TİPİ, İNME ŞİDDETİ VE PROGNOZ ÜZERİNE
ETKİLERİ
(Klinik Çalışma)
Dr. Engin ÖZTÜRK
(UZMANLIK TEZİ)
Tez yöneticisi
Yrd. Doç. Dr. Mehmet ÜSTÜNDAĞ
ÖNSÖZ
Acil Tıp uzmanlık eğitimim boyunca mesleki bilgi, beceri ve
deneyimlerinden
yararlandığım
Anabilim
Dalı
Başkanımız
Sayın Doç. Dr. Cahfer GÜLOĞLU’na, Sayın Doç. Dr. Mustafa ALDEMİR,
Sayın Prof. Dr. Yusuf YAĞMUR, Sayın Yrd. Doç. Dr. Murat ORAK,
Sayın Yrd. Doç. Dr. Mehmet ÜSTÜNDAĞ, tez çalışmalarımda sonsuz
desteğini esirgemeyen Uzm. Dr. Mustafa Burak SAYHAN ve Uzm. Dr. M.
Özgür ERDOĞAN’A,
Acil kliniğinde birlikte çalıştığımız tüm asistan arkadaşlarıma,
hemşire ve sağlık memuru arkadaşlarıma ve diğer bütün klinik
çalışanlarına,
Ayrıca beni bugünlere getiren aileme, her za man desteğini gördüğüm
ve her zaman yanımda olan sevgili eşim Özlem’e, biricik oğlum Deniz
Erçin’e
Rotasyonlarım süresince bilgi ve tecrübelerini bizimle paylaşan değerli
Hocalarıma, diğer asistan arkadaşlarıma ve özellikle eğitimimde önemli
katkılarda bulunan hastalarıma teşekkür ederim.
Dr. Engin ÖZTÜRK
DİYARBAKIR – 2009
İÇİNDEKİLER ONAY SAYFASI 1 ÖNSÖZ 2 İÇİNDEKİLER 3 1. GİRİŞ VE AMAÇ 4 2. GENEL BİLGİLER 6 2.1. İNMENİN TANIMLANMASI 6 2.2. EPİDEMİYOLOJİ 6 2.3. RİSK FAKTÖRLERİ 7 2.3.1 DEĞİŞTİRİLEMEZ RİSK FAKTÖRLERİ 7 2.3.2 DEĞİŞTİRİLEBİLİR RİSK FAKTÖRLERİ 8 2.3.3 YENİ(POTANSİYEL)RİSK FAKTÖRLERİ 9
2.4 SEREBROVASKÜLER HASTALIKLARIN VASKÜLER ANATOMİSİ 10
2.5 SEREBROVASKÜLER HASTALIKLARIN FİZYOLOJİ 11
2.6 SEREBROVASKÜLER HASTALIKLARIN PATOGENEZ VE SINIFLANDIRILMASI 13 2.6.1 PATOGENEZ 13 2.6.2 SINIFLANDIRMA 14 2.6.3 İNME SKALALARI 18 2.7 TEDAVİ 18
2.7.1 İSKEMİK İNMEDE AKUT TEDAVİ 18
2.7.2 AKUT İSKEMİK İNMEDE ACİL DESTEK TEDAVİSİ 19
2.8 İNMENİN SONUÇLARI, ETKİLERİ, PROGNOZ 20
2.9 İSKEMİK İNMEDE NÖROLOJİK HASARLANMANIN BİYOKİMYASAL GÖSTERGESİ
21 2.10 İSKEMİK İNMEDE NÖROLOJİK HASARLANMANIN
GÖSTERİLMESİNDE YENİ NESİL BİYOKİMYASAL BELİRTEÇLER 22 2.10.1 PRO-BNP 22 2.10.2 HOMOSİSTEİN 24 2.10.3 FERRİTİN 26 3. MATERYAL VE METOD 29 4. BULGULAR 33 5. TARTIŞMA 52 6. SONUÇ 61 7. ÖZET 62 8. SUMMARY 64 9. KAYNAKLAR 66 10. EKLER 79
1.GİRİŞ VE AMAÇ
İnme (stroke) sadece gelişmiş ülke lerde değil, tüm dünyada da koroner kalp hastalığı ve kanserlerin ardından üçüncü sıklıkta gelen ölüm nedenidir. Dünyada 1990 yılında 4.4 milyon kişinin inme nedeniyle öldüğü hesaplanmıştır. İnme insidansı güvenilir çalışmaların yapılabildiği beyaz popülas yonların çoğunda birbirine yakındır ve ortalama olarak bir yılda, her 1000 kişide 2 yeni inmenin ortaya ç ıktığı hesaplanmıştır. 45 -84 yaşları arası bu oran 4/1000 çıkmaktadır. İnme prevalansı bir toplumda yaşayan ve inme geçirmiş olan insanların oranı olarak tanımlanır ve 6/1000 civarındadır. İnme mortalitesinde batı ülkelerinin çoğunda ve Japonya’da son elli yıldır süregelen bir azalma izlenmektedir. Buna rağmen, gene yıllar içinde toplumdaki yaşlı insan oranındaki artışa bağlı olarak inme ve inmeye bağlı ölümlerin mutlak sayısı artmaktadır. İnmenin toplumsal yükü çok ağırdır. İnmeli hastaların %20’si erken dönemde olmak üzere %30’u bir yıl içinde ölmekte, yaşayanların üçte biri de günlük işlerinde başkalarına muhtaç olarak yaşamlarını sürdürebilmektedirler . Böylece inme, toplumda üçüncü en sık ölüm nedeni olmasının yanı sıra, erişkinlerde ilk sırada gelen maluliyet nedenidir. Nörolojik hastalıklar nedeniyle hastaneye yatan olguların yarısından fazlasını inmeli hastalar oluşturmaktadır (1,2).
Amerika Birleşik Devletleri (ABD)’de halen yıllık yaklaşık 700,000 stroke hastası tespit edilmekte, bunların sadece üçte ikisi sağ kalabilmekte ve stroke ölüm sebepleri arasında üçüncü sırada yer almaktadır. Hastaların akut tedavisi, uzun dönem bakımı ve hastala rın üretimden düşmeleri bireye ve topluma ağır maliyetler getirmektedir (3). Stroke sonrası oluşan bilinçsel ve motor sekeller, bireyleri fizyolojik, psikolojik ve sosyal açıdan bakıma muhtaç hale getirmektedir. Bunun ekonomik açıdan anlamı ABD’de yıllık 3 0 milyar dolar, hasta başına ise yaklaşık 50,000 dolar maliyettir (4).
çeşitli moleküller ve immün hücreler arasında komplike ilişkiler izlenmektedir. Akut iskemik inmenin fizyopatolojisinde iyon değişiklikleri, eksitotoksisite, serbest radikaller ve nitrik oksit hasarı, postiskemik inflamatuar reaksiyonlar rol almaktadır. İskemik in me araştırmalarında son yıllarda moleküler, genetik, klinik ve biyokimyasal olarak önemli gelişmeler izlenmektedir. Beyin hasarı sonrasında nörobiokimyasal markerlardaki artışlar dikkat çekmektedir.
İskemik inme tanısı; risk faktörlerinin değerlendirilmes i, dikkatli ve hızlı nörolojik muayenenin yapılması ve uygun görüntüleme tekniklerinin uygulanması temelindedir. Dolaşımdaki biyomarkerlerin ölçülmesi, iskemik inmede tanı ve prognozu değerlendirmeyi kolaylaştırmıştır.
Bilgisayarlı Beyin Tomografi si ve Magnetik Rezonans Görüntüleme gibi modern nöroradyolojik görüntüleme teknikleri iskemik ve hemorajik inme yerini ve hacmini belirlemede yardımcı olur. Ancak tekrarlanan nöroradyolojik görüntülemeler pratik değildir. Bu nedenle iskemik stroke hastalar ında tanı, stroke tipi ve mortaliteyi belirlemede yeni nesil biyokimyasal göstergelere ihtiyaç vardır.
Bu çalışmanın amacı Pro -BNP, homosistein, ferritin plazma seviyeleri ile iskemik inmenin lateralizasyonu, lokalizasyonu, iskemik inmenin boyutla rı, inme alt tipleri, klinik seyir ve prognozu karşılaştırmak, ayrıca Glaskow Koma, National Institute of Health Stroke (NIHSS), TOAST, Glaskow Outcome skorları ile yeni nesil biyomarker düzeylerinin tanıdaki rolünü belirlemektir.
2. GENEL BİLGİLER 2.1 İNME TANIMI
Beyin damar hastalıkları; beyinde bir bölgenin, geçici ya da kalıcı bir sürede erçekleşen, beyni besleyen damarlardaki patolojik süreçler sonucunda oluşan hastalıklarını içerir (5,6). Dünya Sağlık Organizasyonu (WHO) inmeyi ‘’hızla ge lişen serebral işlevlerin fokal (veya global) bozuklu ğuna bağlı klinik bulgular olup, 24 saat veya daha uzun sürme veya ölüm gelişmesi’’ olarak tanımlamaktadır (7).
2.2 EPİDEMİYOLOJİ
İnme, dünya toplumlarında üçüncü ölüm nedeni, sakatlık/özürlülük yapm ada birinci neden olup, endüstrile şmiş toplumlarda hastane ba şvurularında ve sağlık harcamalarında önemli bir yer tutan hastalık grubudur (7). Batı toplumlarında inmenin yakla şık %85’i iskemi, %15’i hemoraji nedeniyle meydana gelmektedir (8). Amerika Birleşik Devletleri’nde yılda yaklaşık 6.000.000 iskemik, 100.000 hemorajik serebrovasküler olgu görülmekte ve bunlarında 175.000’i ölümle sonuçlanmaktadır (6). Türkiye’de inmenin prevalansı veya insidansına ait sağlıklı veriler yoktur (7). Ülkemizde inme hast alarının genel özellik ve risk faktörlerinin araştırıldığı hastane tabanlı, çok merkezli bir çalı şmada; iskemik inme %72, hemorajik inme %28 oranında bulunmu ştur (8). Hemorajik inme oranının batı toplumu oranlarından daha yüksek olmasının en önemli nedeni, majör risk faktörü hipertansiyonun iyi tanınmaması ve tedaviye katılımdaki kesintiler olabilir (9).
İnme prevalansı yaşla birlikte artar. Daha önceden yapılan çalışmalara göre; 55 -64 yaşları arasında yıllık inme insidansı 1,7 -3,6/1000 kişi, 65-74 yaş arası 4,9-8,9/1000 kişi, 75 yaşından sonra 13,5-17,9/1000 kişidir (10).
Kadınlarda 55–64 yaş arası inme insidansı erkeklere göre 2 –3 kat daha azdır. 85 yaşa doğru bu fark azalmaktadır. Kış aylarında inmenin arttığı görülmektedir (10).
Avrupa ülkelerinde ve Japonya’da bu oranlar daha yüksektir. Kuzey İskandinav ülkeleri, Hollanda, Amerika Birleşi k Devletleri, Kanada ve İsviçre’de oranlar 100/100.000’ in altında olup, düşüktür (1).
2.3. RİSK FAKTÖRLERİ
Bireysel ya da çevresel bazı özellik ve koşullar, iskemik inme riskini arttırır. Risk faktörleri farklı yollarla inme oluşumunu hazır layabilir. Bu nedenle, birden fazla risk faktörü olan kişilerde inme riski daha yüksektir (1 1). İleri yaş ya da genetik yatkınlık gibi önlenemez durumlar bir yana bırakılırsa, bu risklerin tanınması, inme için öneminin belirlenmesi ve giderilmesi, akut inme sonucu gelişen beyin hasarını minimale indirme giri şimlerinden doğal olarak daha kolay ve etkilidir (1 2). Risk faktörleri değiştirilemez, değiştirilebilir ve yeni (potansiyel) risk faktörleri olmak üzere üç gruba ayrılır.
2.3.1. Değiştirilemez Risk Faktörleri
Yaş: Elli beş yaştan sonra inme riski, her 10 yılda iki kat artar. Cinsiyet: Erkeklerde daha fazla görülür.
Irk: Siyah ırkta inme insidansı daha yüksektir (%38). Populasyonda hipertansiyon, obesite ve diyabetin fazla olması, bu durumd an sorumlu tutulmuştur.
Genetik: Klinik gözlem ve hayvan çalı şmalarından elde edilen bilgiler, genetik yapı ve inme arasındaki bağlantıyı henüz tam aydınlatacak ve tedaviye ı şık tutacak düzeyde de ğildir. Benzer riskli koşullara sahip bir topluluk üyel erinin ancak bazılarında hastalı ğın ortaya çıkması ya da aynı hastalıktaki ki şilerin tedaviye verdikleri yanıtların çok de ğişik olması, genetik özellik farkları nedeniyle olabilir (1 2). İskemik inme alt tiplerinin genetik komponentlerini ara ştıran bir çalışmaya göre aile öyküsü; büyük damar aterosklerozu ve küçük damar hastalı ğı için anlamlı bir risk faktörüdür. Kardiyoembolik ve nedeni belirlenemeyen inme gruplarında böyle bir korelasyon gözlenmemi ştir (13).
2.3.2 Değiştirilebilir Risk Faktörleri
Hipertansiyon: İskemik ve hemorajik inme için en önemli risk faktörüdür. Büyük damar aterosklerozu, küçük damar oklüzyonu ve intraserebral hematoma yol açar. Uzun süreli antihipertansif tedaviyle, hem aterosklerozun yava şlatıldığı hem de araya giren di ğer tetikleyici faktörlerin kontrol edildi ği düşünülmektedir. On dört randomize çalı şmanın meta-analizine göre diastolik kan basıncında 5,8 mm Hg’lık bir dü şme, inme riskini %42 oranında azaltmaktadır (14). İnme insidansı; hem sistolik hem diastolik hipertansiyonla a rtar. Diastolik basınç artışının eşlik etmediği izole sistolik hipertansiyon ya şlılarda önemli inme risklerinden biridir (12).
Sigara: Sigara inme riski açısından ba ğımsız bir risk faktörüdür. Miktarına göre değişmekle birlikte, inme riski içmeyenlerle kar şılaştırıldığında 6 kat daha fazladır
Diabetes Mellitus: Diabetes Mellitus iskemik inme için ba ğımsız bir risk faktörüdür. İnme hastalarında olgu -kontrol çalışmaları ya da prospektif epidemiyolojik ara ştırmalarla rölatif riskin 1,8-6 kat arttığı görülmüştür. Büyük damar aterosklerozunu hızlandırdı ğı, düşük ve yüksek dansiteli lipoprotein kolesterolleri üzerine olumsuz etkide bulundu ğu ve hiperinsülinemi yoluyla aterosklerotik pla ğı büyüttüğü bilinmektedir.
Hiperlipidemi: Serum lipid bozukluklarının koroner arter hastalığıyla olan ilişkisi iyi bilindiği halde, inmeyle olan ili şkisi yakın zamana dek belirsiz kalmı ştır. Mortaliteyi primer son nokta alan ve fatal olmayan inme olgularını hesaba katmayan çalı şmalar, kolesterol düzeyiyle inme arasında anlamlı bir i lişki kurmakta yetersiz kalmı şlardır. Üstelik bazı çalışmalarda inme alt tipleri belirlenemedi ğinden; yüksek kolesterol düzeyinin tıkayıcı tip büyük arter hastalığıyla olan pozitif ilişkisi, hemorajik inmeyle olan negatif ili şkisi yüzünden dengelenmiş olabilir. Çalışmaların meta-analizine göre, statin grubu ilaçlarla (HMG -CoA redüktaz inhibitörleri) inme riskinde %31’lik bir azalma meydana gelmektedir (1 5).
Atrial Fibrilasyon: Atrial Fibrilasyon (AF), iskemik inme için önemli bir risk faktörüdür. Hem valvül er hem de %70 oranında görülen valvüler olmayan AF için bu geçerlidir. AF’de yıllık inme riski %3 -5’tir. Tromboembolik inmelerin %50’sinden sorumludur. AF’li olgularda ya şla birlikte inme insidansı artar (50 –59 yaş için %1,5; 80- 89 yaş için %23,5).
Alkol: Fazla miktarda alkol tüketenlerin hemorajik inme geçirme riski, içmeyenlere göre üç kat daha fazladır. İskemik inmeyle ilişkili olarak ılımlı alkol alanlarda risk azalırken, fazla miktarda içenlerde risk artar.
Fiziksel inaktivite: Fiziksel aktivite doğrudan inme riskini azaltmaz. Vücut a ğırlığı, kan basıncı, serum kolesterolü, glukoz toleransı üzerine olumlu etkileriyle yarar sa ğlayabilir.
Obezite: Obezite genellikle hipertansiyon, diabet ve hiperlipidemi ile birlikte olduğundan, inme için risk faktörü ka bul edilir.
Asemptomatik Karotis Stenozu: ACAS (Asyptomatic Carotis Atherosclerosis Study, 1995) çalınmasına göre; asemptomatik karotis stenozu olan hastalarda e ğer darlık derecesi %60’tan daha ileriyse, endarterektomi uygulanması halinde be ş yıllık ipsilateral inme riskinde %53 oranında rölatif risk azalması sa ğlanmaktadır (16).
2.3.3 Yeni (Potansiyel) Risk Faktörleri
Hiperhomosisteinemi: Artmış kan homosistein düzeyi, ateroskleroz ve tromboz için risk olabilir. Çalışmalarda inmeyle olan ili şkisi gösterilmiştir.
İnflamasyon/İnfeksiyon: İskemik inmenin en önemli nedeni aterosklerozdur. Aterosklerozun kronik bir inflamatuar hastalık oldu ğu düşünülmektedir. İnflamasyon süreciyle iskemik olaylar arasında ili şki vardır. Ayrıca düşük serum folat düzeyi, yüksek antikardiolipin antikor düzeyi, oral kontraseptif kullanımı da yeni (Potansiyel) risk faktörleri arasında sayılmaktadırlar (10) .
2.4. Serebrovasküler Hastalıkların Vasküler Anatomisi
Beyin; iki serebral hemisferden ve derindeki büyük yapıları (bazal ganglion ve talamusu, kortekse çıkan ve korteksten inen beyaz madde yollar ve sıvı ile dolu ventriküler sistemi) saran serebral korteksten oluşur. Serebral korteks frontal, pariyetal, temporal ve oksipital loplara ayrılır. Serebrumun orta beyin, pons ve m edullayı içeren derin yapıları beyin köküne bağlanır.
Serebral hemisferler kanını internal karotis arterden alır. Sağ arteria karotis komminis brakiyosefalik gövdeden köken alır ve sol arteria karotis komminis arkus aortadan köken alır. Her iki arteria karotis komminis boyunda mandibula açısının hemen altında ikiye ayrılır ve beyine giden arteria karotis interna ile yüze giden arteria karotis eksternayı oluşturur. İnternal karotis arter petroz kemik ve kavernöz sinüsü geçerek oftalmik arteri oluşturup dallara ayrılarak göze doğru yol alır. Anterior koroidal arter dalı orta serebral ve anterior serebral arterlere ayrıldığı yerden hemen önce inter nal karotis arterden köken alır. Anterior koroidal arter mediyal temporal loba kan sağlar. Orta serebral art er frontal, pariyetal ve temporal lobları içeren serebral hemisferlerin lateral yüzeyinin dolaşımını sağlar. Orta serebral arterin horizontal bölümünden gelen küçük dallar -lentikülostriat arterler - bazal ganglionun derindeki yapılarını ve internal kapsül e kan sağlar; bu yapı korteks ve alttaki yapılar arasındaki beyaz maddeden oluşan ana bağlantı yoludur. Anterior serebral arter frontal, pariyetal ve temporal lopları içeren serebral hemisferlerin mediyal yüzeyine kan sağlar.
Beyin kökünün kanını ik i vertebral arter sağlar; bu arterler her iki tarafta da subklavyen arterlerden köken alır ve birleşerek baziller arteri oluştururlar. Posterior inferior serebellar arter proksimal intrakranyal vertebral arterden köken alarak inferior serebellum ve lateral medullanın kan dolaşımını sağlar. Anterior serebellar arter ve süperior serebellar arter baziller arterden köken alır ve baziller arterden çıkan küçük arterlerle beyin kökü ve serebellumun geri kalan bölümüne kan sağlar. Baziller arterin uç dalları poster ior serebral
arterleri oluşturur ve bu arterler talamus ile birlikte pariyetal ve temporal lobların posterior bölümlerine ve oksipital loba kan sağlar.
Majör bir damar tıkandığı zaman kollateral anastomozlardan oluşan yoğun bir ağ beyinin primer kan desteğinden yoksun alanlarını besler. Ana kollateral kanal beyinin tabanındaki Willis halkasından oluşur İki karotis arter anterior komminis arterler boyunca birbirleri ile bağlantılar oluşturur. Posterior serebral arterle birlikte iki karotis arter poste rior komminis arterin de katılımıyla serebral ve vertebrobaziller dolaşımlar arasında kollateral bir yol oluşturur. İnternal karotis arter tıkandığı zaman eksternal karotis arter ve internal karotis arter arasında kollateral kanallarda oluşabilir. Eksterna l karotis arterin supraorbital dalından gelen kan internal karotis arteri doldurmak için oftalmik arter boyunca geriye doğru akabilir ve eksternal karotis arterin meningeal dalları serebral arterlerin distal dalları ile anastomozlar yapabilir. Beyin dolaş ımında hemisferlerin orta bölümündeki orta ve anterior serebral arter alanlarının birleşim yerinde serebral arterlerin distal dallarının ortak akım alanlarında ve posterior pariyetal lobta orta ve posterior serebral arterlerin birleşim alanında boşalma havzaları oluşur. Perfüzyon basıncındaki ani düşüşlerde, bu alanlar iskemiye daha açık alanlardır (17).
2.5. Serebrovasküler Hastalıkların Fizyolojisi
Metabolik olarak vücuttaki en aktif organlardan biri olan beynin bu aktiviteyi sağlayabilmek için zen gin bir kan akımına gereksinimi vardır. Normalde total kan volümünün %20’sini, glukozun %17’sini kullanan beyin akciğerler tarafından absorbe edilen oksijeninde %20 kadarını kullanmaktadır. Beyin total olarak dakikada 750 –800 ml kan kullanıp 46 ml kadar oksijen tüketimi yapmaktadır. Serebral kan akımı (SKA) 100 gr beyin dokusu için ifade edilir ve normalde ortalama 50ml/dak‘dır. Gri cevherde SKA ortalama 70 -80ml/100gr/dak iken beyaz cevherde 30ml/100gr/dak’dır (1 8). Her iki karotis arter dakikada 350 cc, vertebrobaziler sistem ise 150 -200cc kanı beyine taşır. Birkaç dakikalık işlev bozukluğu
sonucunda bile oksijen ve glikoz azalıp kritik seviyelere inebilir. Beyin dokusu bu maddeleri depolayamadığından ve metabolizması çok yüksek olduğundan serebral dolaşımd a 6–10 saniyelik kritik düzeyde bir duraklama geriye dönüşümlü nöronal metabolik bozukluğa ve bilinç yitimine neden olur. Serebral dolaşımda 30 saniyelik bir kesilme beyin metabolizmasında değişikliğe yol açarken, 5 dakika sonra irreversibl beyin dokusu y ıkımı ve serebral enfarktla sonlanabilecek anoksi başlar ( 19,20). Arterioller, oksijen ve karbondioksit kısmi basınçlarının değişikliklerine aşırı duyarlıdır. PaO2' nin ileri düzeyde düştüğünde ve PaCO2 arttığında arterioller genişler ve serebral kan akım ı artar. PaCO2 azaldığında ve ekstrasellüler Ph arttığında arterioller kasılır ve kan akımı azalır. PaO2 değişiklikleri karşıt etkilidir. Fokal serebral aktivite, ekstremite hareketi oluştuğu zaman meydana gelmekte ve uygun bölgede metabolizma hızlanmaktad ır, buna uygun olarak lokal kan akımı da artmaktadır. Serebrovasküler patolojilerde bu kompansatuvar mekanizmalar ortadan kalkar.
Kemoregülatuar faktörlerin dışında ateş, intrakranial basınç değişiklikleri, anestezik ajanlar ve vazoaktif ilaçlar beyin kan akımını etkileyebilmektedir. Vücut ısısındaki her 1 derecelik düşüş serebral metabolizma hızında %6 –7' lik bir azalma ortaya çıkartmaktadır. Hipotermi hem beynin elektrofizyolojik fonksiyonları için, hem de hücrelerin yapısal olarak bütünlüğünü devam ettir ebilmeleri için gerekli olan enerji ihtiyacını azaltmaktadır. Vücut ısısının yaklaşık 20 dereceye yaklaştığı hipotermide EEG'de tam bir baskılanım görülmektedir. Hiperterminin serebral fizyoloji üzerine etkisi hipoterminin tam tersidir. Vücut ısısının 42 dereceye kadar olan artmalarında, hem serebral metabolizma, hem de serebral kan akımını arttırmaktadır. Hiperterminin toksik etkisi için eşik değer kabul edilir. 42 dereceden sonra enzimlerin fonksiyonlarında bozulma ve protein yıkımı görülebilmektedir. İnt rakranial basınç, serebral perfüzyon basıncını etkileyerek serebral kan akımında değişikliğe neden olur. İntrakranial basıncın yükselmesi serebral perfüzyon basıncını düşürmektedir. Barbitüratlarda, serebral metabolizma ve nöronal aktiviteyi azaltarak beyn in enerji gereksinimini düşürürler ve
sonra da serebral kan akımını azaltırlar (2 1).
2.6. Serebrovasküler Hastalıkların Patojenez ve Sınıflandırması 2.6.1. Patogenez
Nöronal disfonksiyon serebral kan akımı 22ml/100gr/dak düzeylerinde oluşmaya başlar. 12ml/100gr/dak’nın altına düşmesi durumunda ise nöronal ölüm meydana gelir. Beyin enerji depolama kapasitesi düşük olan bir organdır. Komplet bir iskemide depolanmış enerji hücreyi ancak 3 dakikada koruyabilir. İskemik inmelerin çoğunda komplet iskemi alanı k üçük olup çevresindeki inkomplet iskemi alanı ise büyüktür. Bu alanlarda kollateral akım sayesinde hücrelerde morfolojik değişiklikler oluşmamıştır. Ancak irreversibl harabiyet açısından riskli bir alandır. Bu alana penumbra denir. Penumbra belli bir terap otik zaman aralığında uygun tedavi yaklaşımları ile kurtarılabilir bir beyin dokusudur. Penumbra alanı dinamiktir. Bu alanda iskeminin şiddet ve süresine bağlı olarak dokuyu infarkta götüren çok karmaşık nöronal, glial ve vasküler olaylar rol almaktadır. P rotein sentezi süprese olmuş ancak ATP azalmamıştır. Elektrofizyolojik olarak da aktif bir alandır.
İskemik dokuda biyokimyasal kaskadın birçok kademeleri vardır. Yapılan çalışmalar nöron ölümüne yol açan başlıca 4 fazın oluştuğunu göstermektedir
1- Eksitotoksisite (dakikalar içinde).
2- Perinfarkt depolarizasyon (dakikalar, saatler içinde). 3- İnflamasyon (saatler günler içinde).
4- Apopitoz, nekroz (günler içinde).
Bu fazlarda rol oynayan majör mediyatörler intrasellüler sitozolik kalsiyumun kontrolsüz yükselişi, serbest radikallerin artışı ve asidozdur.
2.6.2. Sınıflandırma
İskemik inmeli hasta grubunu alt tiplere ayırma konusunda halen bir fikir birliğine varılmamıştır. Yaygın olarak kullanılan sınıflandırmalar da hastaların değerlendirilmesi ve tedavi yöntemi için yol gösterse de her yönü ile yeterli olmaktan uzaktırlar. Bugün için en sık kullanılan etyolojiyi temel alan sınıflamadır. Etyolojiyi temel alan sınıflandırmalardan en yaygın kullanılanı, klinik bulguların yanı sıra etyolojiye de yer vere n 1993 yılında yayınlanan Trial of Org 10172 in Acute Stroke Treatment (TOAST) çalışmasında kullanılan sınıflandırmadır (22). TOAST sınıflandırılmasında adı geçen hastalıklar şunlardır;
a. Aterosklerotik İnfarkt (Büyük Damar Hastalığı)
Tüm iskemik inme hastalarının %14 –40 kadarından sorumludur ( 23,24). NINDS (National Institute of Neurological Disorders and Stroke ) kriterlerine göre major intrakranyal veya ekstrakraniyal serebral arterleri tutan aterosklerotik lezyonlara bağlı olarak ortaya çıkan serebral enfarkt olarak tanımlanır. Geniş damarların birindeki aterosklerotik plak sonucunda progresif stenoz ile geniş arteryel oklüzyon oluşabilir. Aterosklerotik plaklar karotis arter ve vertebrobaziler sistemin herhangi bir noktasında oluşabilir. Fakat en sık ana karotis arter bifurkasyonu ile eksternal ve internal karotis arterlerde görülür. Ayrıca orta ve ön serebral arterlerden ve vertebral arterlerden orijin alabilir (2 5).
Major damarların oklüzyonu ya da şiddetli stenozu distal kısımda perfü zyon yetersizliği ve enfarkt oluşturur. Enfarktın oluşumu kollateral akımla da ilgilidir. Stenozun derecesi ve perfüzyonun azalması multiple faktörlere bağlıdır. Aterosklerotik stenoz ya da oklüzyon, embolik mekanizma üzerinden de serebral enfarkta neden o labilir. Bu durumda proksimalde yerleşmiş atheromatöz lezyondan çıkan emboli, diğer sağlıklı dalları oklüze ederek arterial ağacın daha distalinde lokalize olur. Embolik fragman, stenoze ya da ülsere, etkilenmiş ekstrakraniyal arterlerden çıkabilir. Herhan gi bir majör serebral arterin kökünde stenoz olabilir ayrıca oklüzyon internal karotid arterin gövdesinde de görülebilir ve bu
durumlarda embolik fragman oluşturabilir. Hatta oklüze karotisin üstünde anterograd olarak trombüs gelişebilir.
b. Kardiyoembolik Enfarkt
Kardiyak kaynaklı trombüsden köken alan kardiyoembolizm önemli bir inme nedenidir. İskemik serebrovasküler hastalık nedenleri arasında, aterotrombotik mekanizmalardan sonra ikinci sırada yer alır, %15 ile %30 kadarından sorumludur ( 23,25). Trombüsten küçük bir partikül kopup kan dolaşımına geçerek küçük bir artere, genelde distal intrakraniyal dallara gidebilir. Trombüsten embolizasyonun yanı sıra diğer tip partiküller de (neoplazm, yağ, hava ve diğer yabancı madde partikülleri) embolize o labilir. Kardiyak embolizmin en sık nedenleri; valvüler kalp hastalıkları (mitral stenoz, mitral regurjitasyon, romatik kalp hastalıkları), intrakardiyak trombüs (anterior MI sonrası, sol ventrikül duvarını etkileyen trombüs, atriyal fibrilasyonlu (AF) has talarda sol atriyal apendikste trombüs), ventriküler ya da septal anevrizma ve kardiyomyopatilerdir.
Kardiyak kan akımının yavaşlaması da intrakardiyak trombüs formasyonu için artmış eğilim yaratır. Diğer serebral embolizm kaynakları; atrial miksoma, marantik endokardit ve şiddetli mitral kapak prolapsusudur. Embolizm, majör serebral arterlerin farklı bölümlerini veya serebral yüzeyel dalları etkileyebilir. Arteriyel lümenin embolik obstrüksiyonu rekanalizasyon ve fibrinolizis ile temizlenmektedir. Bu oluşum sırasında damar lümeni stenotik görülebilir. Son zamanlarda kardiyak ve serebral görüntülemenin daha duyarlı olmasıyla trombüs kaynağının daha iyi tanımlaması yapılmıştır.
c. Laküner Enfarktlar (Küçük Damar Hastalığı)
Tüm inme olgularının %1 5 ile 30 kadarını oluşturur ( 23,25). Bu enfarktlar tek bir damar alanında tanımlanan küçük iskemik bölgelerde oluşan lezyonlardır. Lakünün patolojik tanmlaması; ortalama 5mm çapta (3 –15 mm) ufak serebral enfarktlardır.
beyin sapında görülebilir. Temel patoloji damar duvarı yıkımı, damarın fokal ekspansiyonu, trombotik tıkanma, hemorajik ekstravazasyon ve fibrinoid depolanmadır (2 6). Derin penetran arterlerde stenoz, lipohyalinoz ya da mikroateromla oluşan ufak fokuslar gösterilmiştir ( 5). Laküner infarktlar büyük serebral arterlerin (özellikle arteria serebri media, arteria bazillaris, arteria serebri posterior, arteria serebri anterior ve arteria vertebralis) de rin delici dallarının tıkanması sonucu beyinin derin bölümlerinde ve beyin sapında oluşurlar. Bu arterlerin çapları 40–500 mikron arasındadır ve tümü delici arterler olarak bilinir. Kollateral dolaşımları yoktur. Delici arterlerin kanlandırdığı alanlar değ işik olduğundan farklı büyüklükte enfarktlar oluşur. Küçük damar hastalığı (lipohyalinozis) daha çok beyinin derin penetran arterlerini tutar ve arteryel hipertansiyon ile birliktedir ancak emboli kaynaklı kalp hastalığı ve büyük damar hastalıkları ile birlikte de görülebilir (2 6). Küçük derin enfarktlara neden olabilir. Genellikle çoğuldur. Putamen, kaudat nükleus, globus pallidus, talamus, pons, internal kapsül ve periventriküler ak maddede yerleşir.
Lakünlerin gelişiminde HT, diabetes mellitus (DM), kardiyomyopatiler, kan basıncında ani düşmeler, polisitemi, arterden artere emboliler de nedenler arasındadır (2 6). Küçük lakünler (2–4 mm) genelde asemptomatiktir. Kaudat nükleus ve putamende pek çok lakün asemptomatik olabilir. Nekropsi ç alışmalarında lakünlerin %30'u asemptomatik bulunmuştur. Bununla birlikte lakünler küçük olsa bile, duyusal ve motor yollarda geliştiklerinde klinik bulgular verirler. Anjiyografik incelemelerde arter tıkanmaları olağan değildir. Vakaların %20 -25'inde önceden GİA görülebilir. Lakünler semptomatik olduğunda lakünün konum ve büyüklüğüne bağlı olarak değişik klinik tablolar ortaya çıkar. Semptomatik lakünlerin altta yatan en önemli mekanizması mikroateromdur. Kronik HT'a bağlı penetran arterlerin lipohyalinozi si de önemli rol oynar. Lipohyalinozis sessiz lakünlerde de sık görülür. Ayrıca damar duvarındaki, kronik HT'a bağlı fibrinoid nekroz da önemlidir. Fibrinoid nekroz sonucu serebral otoregülasyon bozulabilir. Artmış kan basıncı ile damar duvarı kalınlaşır. Bu
durum hidrostatik kapiller basıncı arttırır ve kapiller zararla vasküler nekroz küçük damar hastalığı oluşturur (27). Mikroembolizm de laküner enfarkt oluşturabilir. Laküner enfarktlarda hemodinamik temelde intra veya ekstrakraniyal karotis stenozu önem li rol oynar. Derin enfarktlarda perfüzyon yetmezliği de önemlidir ( 28). Genel olarak laküner enfarkt risk faktörleri geniş arter hastalığı ile aynıdır. Bilateral kapsüler lezyonlarda afoni, anartri, apraksi ve mutizm görülebilir. Multipl lakünlere bağlı f rontal lob disfonksiyonu ve demans bildirilmiştir (27). Laküner infarktların tanısında bilgisayarlı beyin tomografisi (BBT)/ Magnetik Rezonans Görüntüleme ( MRG) kullanılabilir. MRG tanımlamaları, BBT'ye göre daha üstündür (27,29). BBT'de 10 mm dolayındakil er kolayca tanınabilir ama 4 mm'den küçük ve beyin sapındaki lezyonları görülemeyebilir ( 30).
d. Diğer belirlenen etyolojiler
Daha az sıklıkla görülmekle birlikte serebral perfüzyonu azaltıp enfarkt oluşturan diğer durumlar iskemik inmenin etyolojis inin yaklaşık %5’ini oluşturur. Bu nedenler; vazospazm ve sistemik hipotansiyon, primer ya da sekonder vaskülit, hiperkoagulabl durumlar hiperviskozite (polistemi, disproteinemi ya da trombositozis), arteryal disseksiyon, beyin drenajını sağlayan venlerin oklüzyonu, fibromusküler displazi, moya moya hastalığı, tümör ile majör arterlerin ekstrinsik kompresyonu şeklinde sıralanabilirler ( 23,25).
Serebral enfarkt subtiplerinin ayırt edilmesinde inme oluşumunun klinik özellikleri yardımcı olabilir. İnme etyolo jisine yönelik ilk sınıflandırmalar genellikle patolojisine göre yapılmış ve tüm inmeler iskemik ve hemorajik olarak iki ana gruba ayrılmıştır. Daha sonraki çalışmalarda ileri nöroradyolojik, kardiyolojik, hematolojik ve biyokimyasal tetkiklerin kullanılması ile lezyonun patolojisi ile birlikte lezyon lokalizasyonu ve oluş mekanizması göz önüne alınarak sınıflandırmalar yapılmıştır (3 1). Bamford ve arkadaşları (32) 1991 yılında klinik bulguları ön planda tutara k bir sınıflandırma yapmışlardı. Bu sınıflandırmada etyolojiye yer verilmemiştir. Bamford ve arkadaşlarının yaptığı Oxfordshire sınıflandırması: a. Total
anterior sirkülasyon infarktları(TACI), b. Parsiyel anterior sirkülasyon infarktları(PACI), c. Laküner enfarktlar(LACI), d.Posterior sirkülasy on infarktları(POCI) şeklinde belirlenmiştir .
2.6.3. İnme Skalaları
Klinik bulgular inme prognozunun önemli göstergesidir. İnme sonrası prognozun erken tahmin edilmesi için yöntemler hekimler tarafından araştırılmaktadır. Tahminen inme sonrası 6. ayda hastaların %20-30’u ölmekte, %20-30’u sakat kalmakta, %20 -25’inde hafif sakatlık gelişmekte ve kalan kısmında nörolojik defisit oluşmamaktadır. Hastaların bir kısmında riskli tedaviler verilmesi gerekebileceğinden nispi riske göre karar verilmesi için riskin iyi belirlenmesinde fayda vardır. Sonucu doğru olarak tahmin ettiren birkaç inme skalası geliştirilmiştir. Bu skalalar orta şiddette daha doğru, şiddetli veya hafif inmede ise daha az doğru olmaktadır (3 3).
Canadian Neurologic Scale (CNS): Güçlü olara k prognozla ilişkilidir. Başlangıçta CNS skoru 4,5’tan düşük 70 ya şından büyük inmeli hastalarda 4 ayda ölüm veya sakatlık şansı %90 olmaktadır (34).
The National Institutes of Health Stroke Scalae (NIHSS): 36 puanlık muayene skalasıdır. NİH inme skal asında; NIHSS 0: Normal muayeneyi, NIHSS 1 –7: Hafif nörolojik defisiti, NIHSS 8–14: Orta derecede defisiti, NIHSS ≥15 olması şiddetli defisiti göstermektedir. İnmeli hastalarda NIH inme skalası prognozu belirlemek amacıyla hastaneye başvuru anında yapılmaktadır. NIH inme skalası birçok klinik denemede standart klinik şiddet skalası olmuştur (33).
2.7. TEDAVİ
2.7.1.İskemik İnmede Akut Tedavi
Akut iskemik inmede, hasar gören beyin dokusunu en aza indirmek, iskemik olayın tekrarını önlemek ve fonksiyonel i yileşmeyi sağlamak için dört değişik yaklaşım yolu mevcuttur.
a. Komplikasyonları önlemek ve tedavi etmek, b. Arteryel rekanalizasyonu sağlamak,
c. Hücresel ve metabolik durumu korumak için sitoprotektif stratejiler, d. Serebral iskemiyle ilişkili olarak oluşan inflamatuar proçesi inhibe etmek.
Bu hedeflerin sağlanabilmesi için akut dönemde hasta için en uygun tedavi seçenekleri oluşturulur ve komplikasyonların önüne geçilir. Akut tedavide trombolitik tedavi, antiagregan tedavi ve antikoagülan tedavi veril ir (35).
2.7.2.Akut İskemik İnmede Acil Destek Tedavisi
Hastalara uygulanacak destek tedavileri şu şekildedir:
a. Aritmi öyküsü, kalp hastalığı öyküsü veya stabil olmayan kan basıncı varsa inmeyi takiben ilk 48 saatte hastalara kardiyak monitorizasyon ya pılmalıdır.
b.Oksijenizasyon pulse oksimetre ile takip edilmelidir. c.Hipoksi durumunda oksijenizasyon önerilmektedir.
d. Hipotansiyon durumunda IV mayi tedavisiyle desteklenmelidir. e.Hiperglisemi önlenmeli ve kan şekeri takibe alınmalıdır.
f. Hipoglisemi varsa % 10–20 glukoz infüzyonu ile düzeltilmelidir. g.Vücut ısısı 37,5 derecenin altında tutulmalıdır.
h. Enfeksiyon tedavi edilmeli ve sıvı -elektrolit dengesi takip edilmelidir. i.Beyin ödemi hiperozmolar ajanlar ile tedavi edilmelidir.
Akut dönemde kan basıncını düşürmeye yönelik tedaviler tartışmalıdır. Araştırmalar akut inmeden sonra kan basıncının arttığını, 24 –48 saat sonra düşme eğiliminde olduğunu göstermektedir. Akut inmeden sonra kan basıncı çok yükselmedikçe düşürülmemelidir. Kan basıncı 220/120 mm Hg’nin üzerinde ise tedavi edilmelidir(3 6).
2.8. İnmenin Sonuçları, Etkileri, Prognoz
İskemik inmede ölüm riski yüksektir. Ölüm oranı ilk 30 günde %8 –20 arasında değişmektedir. Ölüm, transtentoriyal herniasyon ve beyin ölümünden ziyade kardiyopulmon er komplikasyonlar sonucunda olmaktadır.
Hasta-ölüm oranları gerek intersellüler adezyon kuvvet moleküllerinin aterosklerozlu bölgede endotel tarafından eksprese edilmesi, gerekse endarterektomi preparatlarında aktive T lenfositleri ve makrofajların bulun ması, akut inflamatuar cevabın, plak destabilizasyonu ve semptomların ortaya çıkışını kolaylaştırdığını düşündürmektedir. Aterosklerotik karotis plaklarında Chlamydia pneumoniae isimli bakterinin bulunması yine plak destabilizasyonunda enfeksiyonun rolünü göstermektedir. İskemik inme geçirenlerde akut faz reaktanı olan C-reaktif protein (CRP) ve serum amiloid A yüksek olarak bu lunmaktadır.
Ayrıca bir çalışmada, yüksek CRP düzeyi ile kardiyovasküler olaylar arasında anlamlı bir ilişki bulunmuştur. Bu bulgu lar infeksiyonun, aterosklerozu hızlan dırdığını veya uygun bir çevre hazırladığını desteklemektedir ( 37–39). Bilinç seviyesinde bozulma, başlangıç klinik semptomların şiddeti, hiperglisemi ve yaş erken mortalite ile ilişkilidir. Yıllık tahmin edilen ölüm oranı minör inme için %5, majör inme için %8 bulunmuştur (4 0). Mortalite ve morbidite; yaş, HT, kardiyak hastalık (Mİ, AF, KKY) ve DM gibi eşlik eden hastalıklara da bağlıdır. Laküner infarktlı hastalarda diğer stroke alt tiplerine göre daha iyi bir progno z vardır. Majör inmede rekürrens; morbitide ve mortaliteyi arttırır. İnmeden sonraki periyod erken rekürrens riskinin en büyük olduğu dönemdir ve ilk 30 günde %3 –10 arasıdır (40).
Erken inme rekürrensi nörolojik defisitleri arttırır ayrıca mortalite ve hastanede kalma süresini artırır. İlk 30 gündeki rekürrens riski enfarkt subtiplerine göre farklılık gösterebilir, en büyük oran aterosklerotik enfarktta, en düşük oran laküner enfarktta bulunmuştur (4 1). Uzun dönem inme rekürrens oranları her yıl için yapılan farklı çalışmalarda % 4 –14 arasında bulunmuştur. Bu oranlar minör inme için %6, majör inme için %9 bulunmuştur ( 25,40).
İnme rekürrensi için en önemli belirleyici yaştır. Yaşlı hastalarda benzer boyuttaki iskemide daha genç yaştaki hastalara gör e iyileşme daha az gerçekleşir. Kötü sonuç yaşlı hastalarda sekonder komplikasyonların daha sık görülmesi ile açıklanabilir. Şiddetli nörolojik defisitli 75 yaş üzerindeki hastalarda prognozun genellikle kötü olduğu gösterilmiştir (4 2). Sonucu etkileyen majör risk faktörlerinden birisi de daha önceden inme geçirilmesidir. Öyküde inme geçirilmiş olmasının daha yüksek oranda ölüm olasılığı ile ilişkili bulunduğu belirtilmektedir (42). HT, valvüler kalp hastalıkları, AF, KKY inme rekürrensi ile ilgili faktörlerdir. Ayrıca hiperglisemi ve alkol alımı da ilgili olabilir ( 25,43).
İnme prognozunun saptanmasında spesifik klinik muayene bulgularından faydalanılabilmektedir. Başlangıçtaki şuur düzeyi önemli bir göstergedir ve bilinç düzeyinde azalma kötü prognozu göst ermektedir. Bakış deviasyonu varlığı genellikle kötü prognozla ilişkili bulunmaktadır. Bakış deviasyonu nispeten küçük sağ hemisfer enfarktüslerinde mevcut olabilmekte ancak, genellikle sol hemisfer lezyonlarında (bütün fronto -temporal bölgeyle ilişkili) daha büyük enfarkt alanları ile ilişkili bulunmaktadır. Baş ağrısı, bulantı, kusma klinik olarak şiddetli inme sonucunu gösterebilir ve ilk 24 saatte bu klinik bulguların varlığı fatal beyin ödeminin varlığını gösterebilmektedir (4 2).
Anormal kan basıncı pr ognozu etkileyebilir. Hayvan modellerinde enfarktüs boyutu ile kan basıncı arasında ilişki gösterilmiş, kan basıncı düştükçe enfarktüs boyutunda artış saptanmıştır. Kan basıncının düşürüldüğü klinik çalışmalarda lezyonlu alanda serebral kan akımında azalma gösterilmiştir (34,42).
2.9. İskemik inmede nörolojik hasarlanmanın biyokimyasal göstergeleri
Serebral hipoksi ve iskemiden sonra nörobilişsel testlere ek olarak nöronlar, glialar, endotel, platelet ve lökositlerden salıverilen bazı protein ve madd elerin kan düzeylerinin ölçülmesi de beyin hasarlanmasının saptanması için kullanılmıştır (4 4). Glial hücreler için: S-100 protein, Myelin Bazik protein (MBP),Glial fibriler asidik protein (GFAP), nöronlar için:
Nöron spesifik enolaz (NSE), Adenilat kinaz (AK), Kreatin kinaz beyin formu (CPK -BB),Guanin nükleotid bağlayan protein, Laktat dehidrogenaz, Glutamat, enflamatuar hücreler için: IL6, Transforming büyüme faktörü -b, Adezyon molekülleri(ICAM -1),E-selektin, nöral hücre adezyon molekülleri( NCAM) klinisy enlere yardımcı iken , metabolik durumlarda ise; Laktat , Cu-Zn süperoksit dismutaz (CuZn -SOD) düzeyleri kullanılmaktadır.
Bu maddelerin saptanması, hızlı tanı konmasına ve erken tedaviye olanak sağlamaktadır. Erken dönemde nörolojik hasarın gösterg esi olan markırların ölçümü, nörolojik ve nöropsikolojik testlerin neden olacağı zaman ve para kaybının önlenmesine olanak sağlamaktadır. Bu tür biyokimyasal markırların serebral hasarın ciddiyetini göstermesi mümkün olabilmekle birlikte, hasarlanmanın ana tomik lokalizasyonu ve klinik önemi hakkında fikir vermesi mümkün değildir (4 5).
2.10. İskemik inmede nörolojik hasarlanmanın gösterilmesinde yeni nesil biyokimyasal belirteçler
2.10.1. PRO-BNP
Myokard tarafından ANP, BNP ve CNP olmak üzere üç çeşit natr iüretik peptid salgılanmaktadır. ANP’nin yarı ömrü ve preload ve afterloada etkileri BNP’den daha azdır. CNP’nin ise kardiak fonksiyonlar üzerine etkisi minimaldir ( 46,47). BNP bütün natriüretik peptidlerde ortak olan ve 17 aa’den oluşan halka yapısını içe ren 32 aminoasitlik bir polipeptiddir (48). Temel depolanma yeri atriyum olan ANP’nin aksine temel kaynağı kalp ventrikülleridir. Bu nedenle diğer natriüretik peptidlerden farklı olarak ventriküler hastalıkların tanısında daha duyarlı ve özgül bir gösterge dir. Sol ventrikül duvarındaki gerilme ve hacim yükü ile BNP sekresyonu uyarılır. Bu peptid de dolaşımdan ANP’ye benzer şekilde uzaklaştırılmaktadır. Natriüretik klirens reseptörü olarak bilinen C -tip reseptörler BNP ile kompleks oluşturur ve hücre içine r eseptör-peptid kompleksi fagosite edilir. İkinci bir mekanizma olarak içerisinde çinko ihtiva eden ve daha çok böbrek tubüllerinde ve damar
endotel hücrelerinde bulunan endopeptidazlar aracılığıyla parçalanırlar (48). Ayrıca BNP’nin plazma seviyesi ANP’den daha fazla ve yarılanma ömrü daha uzundur (20 dk). Tıpkı NT -ANP de olduğu gibi BNP sentez yan ürünü olan NT pro -BNP, BNP’den daha kararlı ve uzun yarı ömürlüdür (60–120 dk) (49). C-tip natriüretik peptid natriüretik peptid ailesinin üçüncü üyesi olup, orijinal olarak domuz beyninden izole edilmekle beraber esas olarak endotel hücreleri ile ilişkilidir (50). Vasodilatör özelliği gösterilmiş olmakla beraber esas etkisinin ne olduğu net olarak bilinmemektedir. Yapılan çalışmalarda hipertansif ve normotansif hastalarda serum düzeylerinde belirgin fark saptanmamıştır (48).
Dolaşımdaki BNP’nin temel kaynağı kalp kası hücreleridir. Son zamanlarda kalpteki fibroblastların da BNP üretebildikleri gösterilmiştir (48). Ancak fibroblastların ürettiği bu BNP’nin dolaşımdaki BNP düzeyine ne oranda katkıda bulunduğu bilinmemektedir. Hem ANP hem de BNP salgılanması için asıl uyarıcı duvar gerilimidir (51). Artmış duvar gerilimi pek çok kalp hastalığının ortak paydası olması nedeni ile dolaşımdaki BNP düzeyleri bu hastalıkların klinik göstergesi olarak kabul edilebilir. BNP’nin kan düzeyinin ventrikül ejeksiyon fraksiyonu ile ters orantılı olduğu gösterilmiştir (52). ANP ile BNP depolanması ve salgılanması arasında açık farklılıklar mevcuttur. ANP atriyal granüllerde depolan ır ve atriyal gerilme ANP granüllerinin hızla boşalmasına yol acar. Peptidin de novo sentezi dikkate alındığında ise ANP geni göreceli olarak yavaş aktive olur (48). Bunun tersine BNP hücrelerde granüllerde sadece az miktarda depolanır ve peptid salgılanma sının artışı BNP geninin aktivasyonuna bağımlıdır. Bununla beraber ANP ile karşılaştırıldığında BNP gen aktivasyonu daha hızlı oluşur (48). İnsan BNP’si kalpte 108 aminoasit içeren öncü BNP “pro -BNP” şeklinde patlamalar -ani salınışlar şeklinde üretilir. Da ha ileri işlemler ile biyolojik olarak aktif, olgun 32 -aminoasitten oluşan BNP molekülü salınır. Sonuç olarak biyolojik etkileri diürez, vasodilatasyon, renin ve aldosteron üretimi ile kalp ve vasküler kas hücre büyümesinin inhibisyonu şeklinde gerçekleşme ktedir. Santral sinir sistemindeki ve periferik
dokulardaki aktivitesi aracılığı ile sıvı elektrolit dengesini sağlar. Özellikle volüm fazlalığı durumunda BNP’nin damar gevşetici etkisi belirgindir ve kan basıncında belirgin düşme sağlar. BNP sempatik tonu su, RAA(renin anjiotensin aldesteron) sistemini, katekolamin ve endotelin gibi vasokonstriktor moleküllerin sentezini inhibe eder. Renal etkileri arasında glomerul filtrasyon hızı ve sodyum atılımını artırması sayılabilir ( 53,54).
Pro-BNP akut inmede sıklıkla yükselir (55–57). Stroke hastalarında mortalitenin ve miyokardial enfarktın bağımsız prediktoru olduğu gösterilmiştir (58) . Akut strokta Pro-BNP artışının nedeni belirsizdir. 3 ana hipotez vardır. İlk açıklamaya göre stroke hastalarında sıklıkla kronik ya da akut bir kalp yetmezliği olduğu ve Pro -BNP salınımın ventriküler disfonksiyonu reflekte ettiği yönündedir. İkinci açıklamaya göre Pro -BNP artışının nedenlerinden birisi olan ve strokunda önemli nedenlerinden olan atrial fibrilasyon varlığıdır (59). Son açıklama ise ProBNP’nin beyinden salınımı nedeniyledir. Beyin her ne kadar Pro -BNP fraksiyonunun az bir kısmını üretiyor olsa da akut parankimal hasarda kanda ölçülebilir oranda Pro-BNP saptanması kabul edilebilirdir (60).
2.10.2.HOMOSİSTEİN
Son dönemde inme, Alzheimer hastalı ğı ve depresyonun da içinde bulundu ğu değişik nörolojik sorunlarla serum Homosistein (Hms) düzeyleri arasında kar şılıklı ilişkiler bildirilmektedir. Yüksek serum Hms düzeyleri ile periferik vasküler hastalıklar, iskemik kalp hastalığı ve inme gelişimi arasında bir ilişkinin bulunduğu gösterilmiştir (61,62).
Plazma homosistein düzeyi standardize edilememi ş olmakla birlikte, genellikle 5 -15 Umol/L düzeyi normal olarak kabul edilmekte ve 16 Umol/L üzerindeki de ğerler hiperhomosisteinemi olarak kabul edilmektedir (63). Plazmada, total homosisteinin %70’i proteinlere bağlanarak, %25’i disülfid ba ğı ile birbirlerine bağlanarak (disülfid homosistein) ve %5’i de homosistein tiolacton halinde bulunur.
Kang ve arkadaşları; aç olarak alınan kandaki total plazma homosistein seviyelerini, normal (5–15 mmol/L), orta yüksek (15 –30 mmol/L), ara yüksek (30 –100 mmol/L) ve ağır yüksek (100 mmol/L ve üzeri) olarak 4 gruba ayırmı şlardır.
Yaşa bağlı olarak homosistein plazma seviyesi hafif artma e ğilimi gösterir. Östrojen, total homosistein konsantrasyonunu beslenme ve kas kitlesinden ba ğımsız olarak düşürdüğü için, erkeklerde homosistein kadınlara göre 1 mmol/L daha yüksek olabilir. Bu durum erkek ve kadınlar arasındaki total homosistein konsantrasyon farklılı ğını açıklamaktadır. Menopozda olmayan 17–54 yaş arası kadınlarda, homosistein konsantrasyonu aynı ya ş grubu erkeklere göre daha düşüktür. Hormon replasman tedavisi verilen menapozdaki sa ğlıklı kadınlarda plazma homosistein düzeyi tedavi almayanlardan %10 –15 daha düşük bulunmuştur (64).
Hiperhomosisteinemi inme olu şumunda önemli bir risk faktörü olarak görülmektedir (65,66,67,68). Homosisteinin plazma seviyesinin önemli derecede yükseldi ği durumlar, arteriyal ve venöz trombozis, inme, miyokardiyal infarkt ve kronik renal yetersizli ği için önemli bir risk oluşturmaktadır (69–71). Yapılan çalışmalarda plazma homosisteinin orta derecede artışlarının, serebral, koroner ve periferal damar hastalıkları ile ili şkişi olduğu açıklanmıştır (72). Ciddi hiperhomosisteinemi (100 mmol/L’den daha yüksek düzeyler), inme oluşumuna neden olan tromboembolik ve aterosklerotik olayların erken ortaya çıkmasına neden olur (73,74).
İnmeli hastalarda plazma homosistein konsantras yonu ile yaş, kreatinin ve folat konsantrasyonları arasında bir ili şki vardır. Yapılan çalı şmalarda plazma homosistein de ğeri, total anterior sirkülasyon infarktlı hasta grubunda, di ğer gruplara göre daha yüksek bulunmuştur (75,76).
2.10.3.FERRİTİN
Ferritin, demiri depolama ve işlev dışı demiri toksik olmayan halde tutma görevi olan ß bir proteindir. Ortasında depo halinde demir atomları olan bir kor içeren ve etrafı protein kabuğu ile çevrili demirin geçişini sağlayan miçel çözelti ile dolu kanallardan oluşur.
Ferritin vücuttaki bütün hücrelerde bulunabilir. Özellikle karaciğer, dalak ve kemik iliğinde bol miktarda bulunur. Bir ferritin molekülü 4500 demir atomu içeren ferrik hidroksifosfat yapısında bir çekirdek ve onun etrafını saran apoprotein kabuktan oluşur, suda eriyebilir (77–79). Apoferritin kabuğun molekül ağırlığı 450 000’dir ve her birinin molekül ağırlığı 18 500 olan, 24 subunitten oluşmuştur ( 79–81).
Ferritin demir depo proteini olmak için bütün özellikle re sahiptir. Öncelikle apoferritin Fe+2’yi alır ve oksitler. Böylece Fe+3 çekirdekte depolanır. İkinci olarak Fe+3’ün Fe+2’ye indirgenmesi ile demir salınır. Üçüncü olarak demir apoferritin sentezini stimüle eder (79). Demir ferritin mRNA’sının translasyon a uğramamış 5’ bölümüne bağlanarak mRNA’yı daha aktif hale getirir ve böylece apoferritin sentezini stimüle eder. Bu olay translasyon düzeyinde gözlenen düzenlemelerin az sayıdaki örneklerinden birini gösterir (78).
Ferritinin H ve L alt tip leri vardır. H (ağır) alt tipi başlıca demir metabolizması aktif dokularda bulunur (kalp, beyin, plasenta, eritrositler, lenfositler, monositler vs). L (hafif) alt tipi daha stabil olduğundan demirin uzun süreli depolanmasında görevli bir moleküldür. Başlıca karaciğer ve dalakta bulunur (82).
Ferritin elektron mikroskobunda kolayca görülebilir. Fagositoz ve bununla ilgili olaylarda izlenici (tracer) olarak kullanılır (78). Ferritin tüm hücrelerde ve ayrıca tüm doku sıvılarında bulunur. En faz la bulunduğu yer demir içeren bileşiklerin sentezinin olduğu eritroid ana hücreler ile demir metabolizması ve depolanmasında rol oynayan makrofaj ve hepatositlerdir. İntrasellüler ferritin, düz endoplazmik retikulumda intrasellüler demir azlığı veya yüksekliği durumlarına göre sentez edilir.
Normalde plazmadaki ferritin düzeyi sellüler ferritin miktarı ile orantılıdır. Yani plazma ferritin konsantrasyonu vücut demir depolarını yansıtmaktadır ( 79,80,83,84). Ancak ferritin aynı zamanda bir akut faz reaktanıdır ve demirden bağımsız olarak enflamatuar sitokin ve oksidatif stres ile de sentezi ilişkilidir.
Hücre içi ferritinin aksine plazma ferritini glikozillenmiştir. Ferritin suda erir. Askorbik asit lizozomal otofajiyi geciktirerek fe rritinin yıkılmasını önler (82). Ferritin yıkılınca ya protein ve demir açığa çıkar ya da hemosiderin oluşur (8 2). Lizozomal zarlarda ferritin molekülleri %50 oranında demir içeren agregatlar şeklinde bir araya gelebilirler, bunlara hemosiderin adı verilir (78). Hemosiderin suda erimez, normalde monosit ve makrofajlar içerisinde oluşturulur. Ama patolojik durumlarda her dokuda fazla miktarda birikir. Hemosiderinin içerdiği demir ferritinden daha fazladır (8 2). Genellikle apoferritin sentezinin ve demir tara fından tutulmasının maksimal olduğu aşırı demir yüklenmesi durumlarında görülür. Hemosiderinin içindeki demir hemoglobin yapımı için kullanılabilirse de demirin hemosiderinden mobilizasyonu ferritindekine göre çok daha yavaştır (84).
İskemik stroke da ferritinin etkisini oksidatif stress esnasında ferritinden ayrılan demirin stoplazmada süperoksit radikallerini arttırması sonucu gösterdiği düşünülmektedir (85). Ferrous demir aracılığı ile olan serbest radikal oluşumu mekanizmasının akut strok ta en önemli rolü oynadığı düşünülmektedir (86).
Demir lipit peroksidayonunu hem başlatır hem de ilerlemesine neden olur. Membran akışkanlığını değiştirmede başrolü oynar. Membran bağımlı enzim kompleksini inaktive eder ve tüm bunların sonucunda ödem formasyonu, membran parçalanması olur ve hücre ölümü gerçekleşir (87).
Strokta demir metabolizmasının etkisini değerlendirmek için geçtiğimiz yıllarda birkaç çalışma yapılmıştır. Bu çalışmalar demir statusu ile strok insidansı ve mortaliteyi inceleyenler olarak ya da demirin strok ciddiyeti ve prognoz ile ilişkisini inceleyen çalışmalar olarak
kategorize edilebilirler (88–90). Tek prospektif olan ve demir statusu ile strok arasındaki ilişkiyi inceleyen çalışma Busselton Health Study dir (9 1). Bu çalışmanın sonuçları strok iç in önemsizdir. Diğer çalışmalarda ise mortalite ve nörolojik dezoryantasyonun serum ferritini bir prediktörü olarak bulunmuştur (88–90). Bu çalışmalar ferritini olaydan 24 –48 saat sonrasında ölçmüşlerdir. Bu nedenle bu çalışmalardaki plazma ferritin düzeyi nin olaya bağlı akut faz reaktanı olarak mı arttığı ya da yüksek serum demirinin göstergesi mi olduğunu ayırt etmek zordur (92) .
3.MATERYAL METOD
Bu prospektif çalışma Dicle Üniversitesi Tıp Fakültesi Etik Kurul Başkanlığından onay alındıktan sonra Aralık 2007 – Nisan 2008 tarihleri arasında gelen ve çalışmaya alınma kriterlerine uyan, klinik ve radyolojik olarak iskemik inme tanısı kesinleşen ardışık 92 hasta ile yapıldı (hasta grubu ). Çalışmaya cinsiyet ve yaşça uyumlu 15 sağlıklı bir ey kontrol grubu olarak dahil edildi.
3.1.Çalışmaya alınma kriterleri:
1- Stroke semptomların başlangıcından itibaren ilk 24 saatte başvuran hastalar 2- İskemik inme tanısı klinik, BBT ya da MRI ile kesinleştirilmiş hastalar 3- Çalışmaya girmeyi kabul eden hastal ar.
3.2.Çalışmadan dışlanma kriterleri:
1- Anevrizma rüptürü, AVM, vasküler malformasyon, moya moya hastalığı, kafa travması gibi nedenlere bağlı intraserebral kanama geçirenler
2- Akut veya kronik kan kaybı bulunan hastalar 3- Demir eksikliği tanısı olan hastala r
4- Kollajen doku hastalığı olanlar 5- Kanser ve karaciğer hastalığı olanlar 6- Ateş 38 derece üstü olan hastalar 7- 15 yaşından küçük hastalar
8- Oxfordshire Community Stroke Project (OCSP)’e göre klinik sınıflandırılması yapılamayan hastalar
9- TOAST kriterlerine göre alt tiplere ayrılamayan hastalar 10- İlk geliş anında NIHS Skalası hesaplanamayan hastalar
11- Hastaneye yatırılmadan 2 hafta öncesine kadar olan sürede enfeksiyon öyküsü bulunan hastalar
12- Çalışmaya katılmak istemeyen hastalar
13-İskemik stroke geçirdi kten 24 saat sonra başvuran hastalar.
Serebrovasküler hastalık şüphesi ile acil servise kabul edilen hastalar monitörlü acil gözlem odasına alındı. Acil serviste hastaların solunum sayısı, vücut sıcaklığı, kan basıncı, nabız sayısı ve oksijen saturasyonu k aydedildi. Hastaların sistemik ve nörolojik değerlendirmesi yapıldı. 12 derivasyonlu EKG çekilerek ritmi kaydedildi. Hastalardan tam kan sayımı ve biyokimyasal testler için 2 ayrı tüpe 3’er cc kan alındı. Klinik ve laboratuvar olarak iskemik stroke tanısı alan hastalar için daha önceden hazırlamış olduğumuz Ek -1’de gösterilen standart çalışma formu ve Ek -2’de gösterilen hasta rıza onam formları dolduruldu. Bu forma hastanın yaşı, cinsi, acil servis protokol numarası, şikayetleri, şikayetlerin başlangıcı sonrası ile acil servise kabul arası geçen süre, hastanın özgeçmisi (DM, HT, iskemik kalp hastalığı, aritmiler, hiperlipidemi) kaydedildi. Hastanın nörolojik muayene bulgusu olarak, şuur durumu, taraf veren lezyon (parezi, pleji), konuşma özelliği (afazi, dizartri), pupil çapı, ışık reaksiyonu, patolojik refleksleri kaydedildi. Hastalara yapılan ilk müdahaleden sonra geliş BBT ve kranial MRI’ları çekildi. Geliş BBT’ leri ve kranial MRI ’ ları bir nörolog ile birlikte değerlendirildi.
Hastaların acil servise baş vuru anındaki bilinç durumları Ek -3’de gösterilen Glasgow Koma Skalası (GKS) ile Strok ciddiyeti ve prognozu ise Ek –4 ‘de gösterilen The National Institutes of Health Stroke Scalae (NIHSS) ile değerlendirildi. GKS puanı 8 ve altı olanlar kötü, 9–12 aralığında olanlar orta, 13–15 aralığında olanlar iyi olmak üzere hastalar bilinç durumlarına ayrıldı. NIHS skalası 36 puan üzerinden hesaplandı. 0 -1:normal (grup 1), 2–7: hafif nörolojik defisit (grup 2), 8–14: orta derecede nörolojik defisit (grup 3), ≥15 olması şiddetli nörolojik defisit (grup 4) olarak değerlendirildi.
3.3. İnme tipinin Belirlenmesi
Serebral iskemik inmeli hastalar anamnez, özgeçmiş, muayene bulguları ve yapılan tetkikler (ekokardiyografi, karotis -vertebral arter doppler ultraso nografi, BBT, MRG gibi) doğrultusunda Oxfordshıre Communıty Stroke Scale’sına göre total anterior sirkülasyon infarktları(TACI), parsiyel anterior sirkülasyon infarktları (PACI), laküner enfarktlar (LACI), posterior sirkülasyon infarktları (POCI) olmak üzere 4’e (32), TOAST (Trial of Org. 10172 in Acute Stroke Treatment) sınıflamasına göre de; aterosklerotik enfarkt, kardiyoembolik enfarkt, laküner enfarkt, transient iskemik inme olmak üzere 4 ayrı alt gruba ayrıldı (31). 3.4. Radyolojik tetkikler:
Kranial MRI çekimleri 1 Tesla gücündeki Magneton -Expert Siemens marka, Bilgisayarlı Beyin Tomografileri çekimleri Toshiba X Vision cihazı ile yapıldı.
Ekokardiografi hewlett packard sonos 4500 ekokardiografi cihazı ile yapıldı.
3.5.Biyokimyasal Ölçümler:
Hasta ve kontrol grubundan alınan kan örneklerinde rutin biyokimyasal testler, tam kan sayımı ve kardiyak belirteçlerden Pro -BNP (immulite 2500 siemens Usa Los Angeles, referans aralığı 20–110 pg/l, chemiluminescent immun assay metoduyla), Homosistein (immulite 2500 siemens Usa Los Angeles, referans aralığı 5–12 pg /ml, chemiluminescent immunassay metoduyla), Ferritin (modular analytics e 170 Roche Usa Kanada referans aralığı 13–150 ng/ml elektro chemiluminescent immunassay metoduyla) tetkikle ri acil laboratuarında çalışıldı.
3.6.İstatistiksel Analiz
Sonuçlar mean+SD olarak verildi. Univarite istatistiksel analizler kategorik değişkenler için ki-kare testi ve sürekli değişkenler için student -t testi kullanılarak yapıldı. Grup içi karşılaştırmalarda gruplar normal dağılım göstermediği ve gruplarda ki denek sayısı eşit olmadığından dolayı Kruskal Wallis tek yönlü varyans analizi ve çoklu karşılaştırma
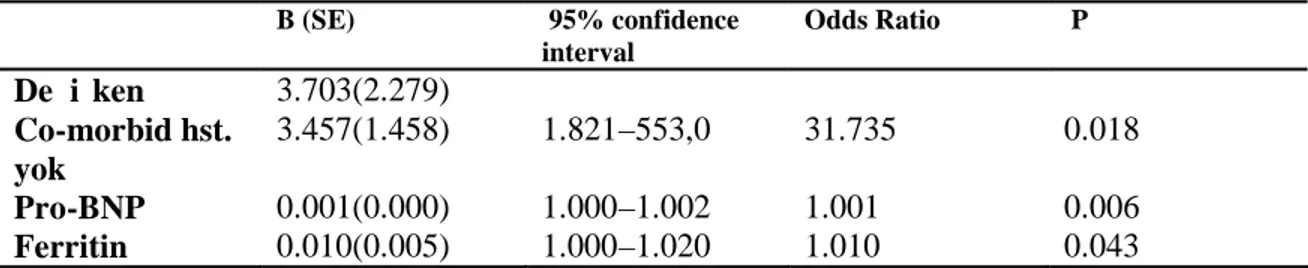
yöntemi olarak Mann -Whitney U testi kullanıldı. Grupların kendi aralarındaki karşılaştırmalarda p<0.01, diğer karşılaştırmalarda ise p<0,05 değeri istatistiksel olarak anlamlı kabul edildi. Mortalite üzerine etkili bağımsız risk faktörlerini belirlemek için univariete analizlerde anlamlı çıkan değişkenler için multivarite analizlerde Step -Wise Logistik regresyon analizi kullanıldı.
4.BULGULAR
4.1.Klinik ve demografik özellikleri
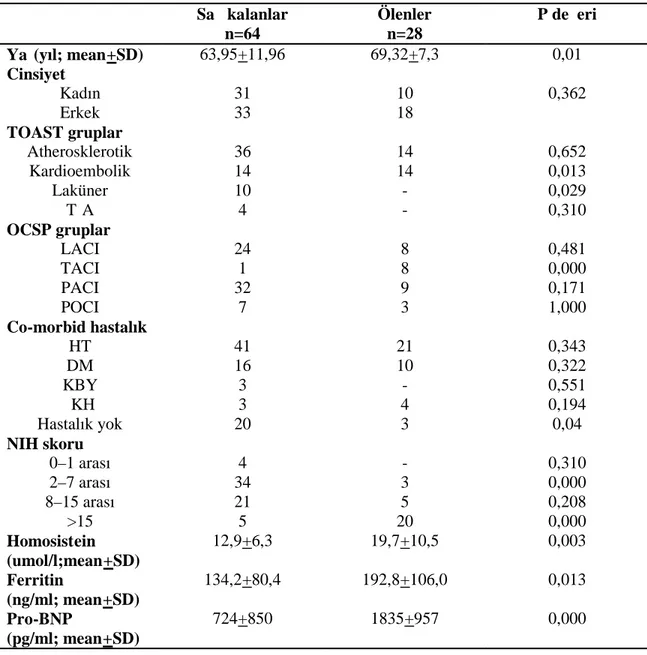
Çalışmaya alınma kriterlerine uyan toplam 92 hasta alındı. Bunların 41’i (%44,6) erkek, 51’i (%55,4) kadın idi. Ortalama yaş 65,59 +11,00 idi. Kontrol grubunu oluşturan olguların ise 9’u (%60,0) erkek, 6’sı (%40,0) kadın ve ortalama yaşları 62,80+2,90 idi.
Kontrol grubu ile hasta grubu arasında cinsiyet ve yaş açısından istatistiksel olarak anlamlı fark saptanmadı (Tablo 1).
Tablo 1: Gruplarının yaş ve cinsiyete göre dağılımı Kontrol grup
n=15
Hasta grup
n=92
P değeri
Yaş (yıl; mean+SD) 62,80+2,90 65,59+11,00 0.333
Cinsiyet Erkek Kadın 9 6 41 51 0.787
Hastalar öykülerinde eşlik eden co -morbid hastalıklara göre analiz edildiğinde; 62’sinde (%67,3) hipertansiyon, 26’sında (%28,2) diyabetes mellitus, 3’ünde (%3,2) kronik böbrek yetmezliği, 7’sinde (%7,6) iskemik kalp hastalığı tespit edilirken 23’ünde (%25,0) ise herhangi bir co-morbid hastalık öyküsü yoktu. Ayrıca hastalardan 59’u (%64,2) ilk iskemik strok atağı ile başvururken; 33 (%35,8) hastanın daha önce iskemik strok atağı geçirme öyküsü vardı.
Transtorasik ekokardiografi sonuçlarına göre ; Hastaların 12’sinde (%13,0) sol ventrikül hipertrofisi, 14’ünde (%15,2) sol atriyal tro mbüs, 4’ünde (%4,3) diyastolik disfonksiyon, 18’inde (%19,5) kalp kapak yetmezliği görülürken, 49 (% 53,2) hastada patoloji saptanmadı.
İlk geliş anındaki GKS Puanlarına göre; 17 hastanın GKS puanı 8 ve altı, 10 hastanın GKS puanı 9–12 aralığında, 65 hasta nın ise GKS puanı 13–15 aralığında tespit edildi.
TOAST sınıflandırmasına göre strok subtiplerinin ayırımı yapıldığında; hastaların 50’si (%54,3) aterosklerotik enfarkt grubunda, 28’i (%30,4) kardioembolic enfarkt grubunda, 10’u (% 10,9) laküner enfarkt grubunda ve 4’ü (% 4,4) ise TİA grubunda idi.
OCSP klasifikasyonuna göre sınıflandırıldığında; 9’u (%9,7) TACI, 41’i (%44,5) PACI, 32’si (%34,7) LACI ve 10’u (%10,8) POCI idi.
Hastaların ortalama NIH Skoru 10,91 + 8,02 olarak hesaplandı. Hastaların 4’ünün (%4,3) NİH skoru 0–1 arası, 37’sinin (%40,2) NİH skoru 2 –7 arası, 27’sinin (%29,4) 7 –14 arası ve 24’ünün de (%26,1) 15’den büyüktü.
4.2.Biyokimyasal parametreler
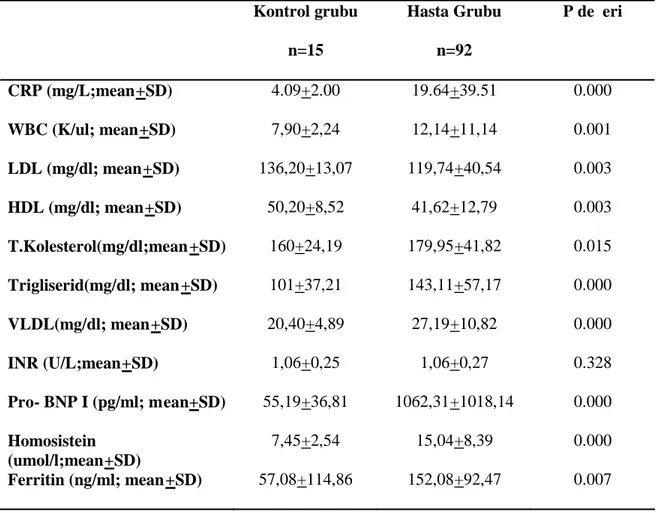
Hasta ve kontrol gruplarımız arasında CRP, LDL, VLDL, HDL, Total Kolestrol, Trigliserit, WBC, Pro-BNP, Homosistein, Ferritin, serum düzeyleri arasında istatistiksel olarak anlamlı fark varken, PTZ -INR için anlamlı fark saptanmadı. Gruplara göre serum biyokimyasal parametrelerin ortalamaları tablo 2 de gösterilmiştir.
Tablo 2: Gruplara göre biyokimyasal parametreler Kontrol grubu n=15 Hasta Grubu n=92 P değeri CRP (mg/L;mean+SD) 4.09+2.00 19.64+39.51 0.000 WBC (K/ul; mean+SD) 7,90+2,24 12,14+11,14 0.001 LDL (mg/dl; mean+SD) 136,20+13,07 119,74+40,54 0.003 HDL (mg/dl; mean+SD) 50,20+8,52 41,62+12,79 0.003 T.Kolesterol(mg/dl;mean +SD) 160+24,19 179,95+41,82 0.015 Trigliserid(mg/dl; mean +SD) 101+37,21 143,11+57,17 0.000 VLDL(mg/dl; mean+SD) 20,40+4,89 27,19+10,82 0.000 INR (U/L;mean+SD) 1,06+0,25 1,06+0,27 0.328 Pro- BNP I (pg/ml; mean+SD) 55,19+36,81 1062,31+1018,14 0.000 Homosistein (umol/l;mean+SD) 7,45+2,54 15,04+8,39 0.000 Ferritin (ng/ml; mean+SD) 57,08+114,86 152,08+92,47 0.007
TOAST sınıflandırmasına göre hasta grubunun strok subtipleri ile kontrol grubu serum Pro- BNP, Homosistein ve Ferritin düzeyleri açısından ayrı ayrı karşılaştırıldı (Tablo3).
Kontrol grup ile aterosklerotik enfarkt grubu arasında Pro-BNP (p=0,000), Homosistein (p=0,000) ve Ferritin (p=0,000) düzeyleri açısından istatistiksel olarak anlamlı fark saptandı.
Kontrol grup ile kardioembolik enfarkt grubu arasında Pro- BNP (p=0,000), Homosistein (p=0,000) ve Ferritin (p=0,000) düzeyleri açısından istatistiksel ol arak anlamlı fark saptandı.
Kontrol grup ile laküner enfarkt grubu arasında Pro- BNP (p=0,002), Homosistein (p=0,016) ve Ferritin (p=0,001) düzeyleri açısından istatistiksel olarak anlamlı fark saptandı.
Kontrol grup ile TİA grubu arasında Pro- BNP (p=0,037), Homosistein (p=0,124) ve Ferritin (p=0,221) düzeyleri açısından istatistiksel olarak anlamlı fark saptanmadı.
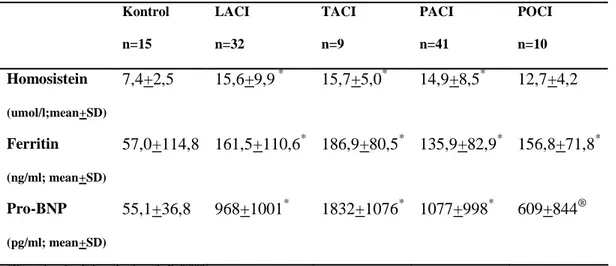
Tablo 3. Kontrol grubu ve stroke subtiplerine göre hasta grubunun serum Pro- BNP, Homosistein ve Ferritin düzeylerinin karşılaştırılması.
Kontrol n=15 Atherosklerotik n=50 Kardioembolik n=28 Laküner n=10 TİA n=4 Homosistein (umol/l;mean+SD) 7,4+2,5 16,5+10,1* 14,0+5,4* 11,1+4,7® 12,9+5,7 Ferritin (ng/ml; mean+SD) 57,0+114,8 155,3+106,3* 147,5+61,9* 169,7+95,5* 98,1+86,0 Pro-BNP (pg/ml; mean+SD) 55,1+36,8 938+992* 1555+1017* 384+524α 851+1055 *Kontrol grubuyla kıyaslandığında P=0.000.
® Kontrol grubuyla kıyaslandığında P=0.016. α Kontrol grubuyla kıyaslandığında P=0.002.
Aterosklerotik enfarkt grubu ile kardioembolik enfarkt grubu arasında Pro- BNP (p=0,003) düzeyi açısından istatistiksel olarak anlamlı fark saptanırken, Homosistein (p=0,859) ve Ferritin (p=0,731) düzeyleri açısından istatistiksel olarak anlamlı fark saptanmadı.
Aterosklerotik enfarkt grubu ile laküner enfarkt grubu arasında Pro- BNP (p=0,242), Homosistein (p=0,145) ve Ferritin (p=0,372) düzeyleri açısından istatistiksel olarak anlamlı fark saptanmadı.
Aterosklerotik enfarkt grubu ile TİA grubu arasında Pro- BNP (p=0,714), Homosistein (p=0,937) ve Ferritin (p=0,311) düzeyleri açısından istatistiksel olarak anlamlı fark saptanmadı.
Kardioembolik enfarkt grubu ile laküner enfarkt grubu arasında Pro- BNP (p=0,001) düzeyleri açısından istatistiksel olarak anlamlı fark saptanırken, Homosistein (p=0,172) ve Ferritin (p=0,351) düzeyi açısından istatistiksel olarak anlamlı fark saptanmadı.
Kardioembolik enfarkt grubu ile TİA grubu arasında Pro- BNP (p=0,135), Homosistein (p=0,891) ve Ferritin (p=0,209) düzeyleri açısından istatistiksel olarak anlamlı fark saptanmadı.
Laküner enfarkt grubu ile TİA grubu arasında Pro- BNP (p=0,635), Homosistein (p=0,539) ve Ferritin (p=0,240) düzeyleri açısından istatistiksel olarak anlamlı fark saptanmadı.
TOAST sınıflandırmasına göre strok subtiplerinin Pro - BNP, Homosistein, Ferritin düzeyleri grafik 1,2 ve 3’de ayrıntılı bir biçimde gösterilmiştir.
4 10 28 50 15 N =
TOAST GRUPLAR
4
3
2
1
0
PROBNP
4000
3000
2000
1000
0
-1000
39 0=kontrol grubu1=atherosklerotik enfarkt grubu 2=kardioembolik enfarkt grubu 3=laküner enfarkt grubu 4=TİA grubu
Grafik 1: TOAST sınıflandırmasına göre strok subtip leriyle Pro-BNP düzeyinin karşılaştırılması
4 10 28 50 15 N =
TOAST GRUPLAR
4
3
2
1
0
HOMOSIST
50
40
30
20
10
0
-10
25 22 21 85 20 19 9 94 95 0=kontrol grubu1=atherosklerotik enfarkt grubu 2=kardioembolik enfarkt grubu 3=laküner enfarkt grubu 4=TİA grubu
Grafik 2: TOAST sınıflandırmasına göre strok subtipleriyle Homosistein düzeyinin
4 10 28 50 15 N =
TOAST GRUPLAR
4
3
2
1
0
FERRITIN
600
500
400
300
200
100
0
-100
70 87 75 66 20 9 17 103 96 99 0=kontrol grubu1=atherosklerotik enfarkt grubu 2=kardioembolik enfarkt grubu 3=laküner enfarkt grubu 4=TİA grubu
Grafik 3: TOAST sınıflandırmasına göre strok subtipleriyle Ferritin düzeyinin karşılaştırılması
OCSP klasifikasyonuna göre ha sta grubunun subtipleri ile kontrol grubu serum Pro -BNP, Homosistein ve Ferritin düzeyleri açısından ayrı ayrı karşılaştırıldığında:
Kontrol grup ile laküner infarkt grubu (LACI) arasında Pro - BNP (p=0,000), Homosistein (p=0,000) ve Ferritin (p=0,000) düzeyleri açısından istatistiksel olarak anlamlı fark saptandı.
Kontrol grup ile total anterior sirkülasyon infarktı (TACI) arasında Pro - BNP (p=0,000), Homosistein (p=0,000) ve Ferritin (p=0,000) düzeyleri açısından istatistiksel olarak anlamlı fark saptandı.
Kontrol grup ile parsiyel anterior sirkülasyon infarktı (PACI) arasında Pro - BNP (p=0,000), Homosistein (p=0,000) ve Ferritin (p=0,000) düzeyleri açısından istatistiksel olarak anlamlı fark saptandı.
Kontrol grup ile posterior sirkülasyon inf arktı (POCI) arasında Pro - BNP (p=0,002), Homosistein (p=0,001) ve Ferritin (p=0,000) düzeyleri açısından istatistiksel olarak anlamlı fark saptandı.
OCSP klasifikasyonuna göre hasta grubunun subtipleri ile kontrol grubu serum Pro -BNP, Homosistein ve Ferr itin düzeyleri karşılaştırıl dı (Tablo 4).