T.C
İNÖNÜ ÜNİVERİTESİ
FEN BİLİMLERİ ENSTİTÜSÜ
METAL ALKOKSİT TEMELLİ KOMPOZİT MATERYAL
SENTEZİ VE BOYA ADSORPSİYONUNDA KULLANIMI
Meltem ASİLTÜRK
DOKTORA TEZİ
KİMYA ANABİLİM DALI
MALATYA
Haziran 2007
Tezin Başlığı : Metal Alkoksit Temelli Kompozit Materyal Sentezi ve Boya Adsorpsiyonunda Kullanımı
Tezi Hazırlayan : Meltem ASİLTÜRK
Sınav Tarihi : 13 Temmuz 2007
Yukarıda adı geçen tez jürimizce değerlendirilerek Kimya Anabilim Dalında Doktora Tezi olarak kabul edilmiştir.
Sınav Jürisi Üyeleri
Prof. Dr. Çetin GÜLER Ege Üniversitesi
Prof. Dr. Kadim CEYLAN İnönü Üniversitesi
Prof. Dr. Ergün EKİNCİ İnönü Üniversitesi
Prof. Dr. Engin ŞENER İnönü Üniversitesi
Yrd. Doç. Dr. Yunus ÖNAL İnönü Üniversitesi
İkinci Danışman
Doç. Dr. Hikmet SAYILKAN İnönü Üniversitesi
İnönü Üniversitesi Fen Bilimleri Enstitüsü Onayı
Prof. Dr. Ali ŞAHİN Enstitü Müdürü
ONUR SÖZÜ
Doktora Tezi olarak sunduğum “Metal Alkoksit Temelli Kompozit Materyal Sentezi ve Boya
Adsorpsiyonunda Kullanımı” başlıklı bu çalışmanın bilimsel ahlak ve geleneklere aykırı düşecek bir yardıma başvurmaksızın tarafımdan yazıldığını ve yararlandığım bütün kaynakların, hem metin içinde hem de kaynaklar bölümünde yöntemine uygun biçimde gösterilenlerden oluştuğunu belirtir, bunu onurumla doğrularım.
Ç NDEK LER
Ç NDEK LER ... ÖZET ... V ABSTRACT... V TE EKKÜR ... V TABLOLAR D Z N ... X EK LLER D Z N ... X 1. G R ...1 1.1. AMAÇ...4 1.2. KAPSAM...42. KURAMSAL TEMELLER VE UYGULAMALAR ...6
2.1.KATI-SIVI ARAYÜZ YAPISI...6
2.1.1. Elektriksel Çift Tabaka Teorisi...6
2.1.2. Elektrokinetik Potansiyel...8
2.2.ADSORPS&YON TEOR&S&...10
2.2.1. Adsorpsiyon Tipleri ...12
2.2.2. Adsorpsiyon &zotermleri ...15
2.2.2.1. Adsorpsiyon &zoterm Tipleri...15
2.2.2.2. S.v. Fazdan Adsorpsiyon &zoterm Tipleri...18
2.2.3. Adsorpsiyon &zoterm Denklemleri...20
2.2.3.1. Langmuir Denklemi...20 2.2.3.2. BET Denklemi ...22 2.2.3.3. Polanyi Denklemi ...23 2.2.3.4. Freundlich Denklemi ...24 2.2.3.5. Redlich-Peterson Denklemi ...24 2.2.3.6. Temkin Denklemi ...25 2.2.3.7. Dubinin-Radushkevich Denklemi...25 2.2.3.8. Frumkin Denklemi...26 2.2.4. Adsorpsiyon Enerjileri...27
2.2.4.1. Adsorpsiyon Molar Enerjisi...27
2.2.4.2. Adsorpsiyon Molar &ntegral Entalpisi...28
2.2.4.3. Adsorpsiyon Molar &ntegral Entropisi ...28
2.2.4.4. Adsorpsiyon Is.s. ...29
2.2.4.5. Adsorpsiyon &zosterik Is.s. ...30
2.2.5. Adsorpsiyon Kineti;i...32
2.2.5.1. Adsorpsiyon Kinetik E<itlikleri ...33
2.2.5.1.1. Elovich Kinetik Modeli ...33
2.2.5.1.2. Yalanc. Birinci Dereceden H.z E<itli;i ...34
2.2.5.1.3. Yalanc. &kinci Dereceden H.z E<itli;i ...34
2.2.5.1.4. Bangham’s E<itli;i...35
2.2.5.1.5. Molekül &çi Difüzyon Modeli ...36
2.2.5.1.6. Modifiye Freundlich Modeli...36
2.3.1. Aktif Karbon ...38 2.3.2. Zeolitler...42 2.3.2. Killer ...42 2.3.3. Silisyumlu Materyaller ...44 2.3.4. Kompozit Materyaller...45 2.4.SOL- JEL PROSES&...48
2.4.1. Sol-Prosesinin ve Ürünlerinin Uygulama Alanlar...50
2.4.2. Sol-jel Prosesinde Kullan.lan Ç.k.< Maddeleri...51
2.4.2.1. Metal Alkoksitler ...52
2.4.2.2. Metal Alkoksitlerin Tepkimeleri ...54
2.4.2.2.1. Hidroliz Tepkimeleri...54
2.4.2.2.2. Hidroksi Bile<ikler ile Tepkimeler ...58
2.5. Boyar Maddeler ...59
2.5.1. Bazik Boyalar ...59
2.5.2. Reaktif Boyalar ...60
2.5.3. Azo Boyalar ...61
3. MATERYAL VE YÖNTEM...62
3.1.DENEYSEL ÇALICMADA KULLANILAN ARAÇLAR VE K&MYASAL MADDELER...62
3.1.1. Deneysel Çal.<mada Kullan.lan Kimyasal Maddeler ...62
3.1.2. Deneysel Çal.<mada Kullan.lan Cihazlar ve Di;er Yard.mc. Gereçler ...63
3.2.ADSORBAN SENTEZ&...64
3.2.1. Metal alkoksit/ Çam Tala<. Kompozit Materyalinin Sentezi...64
3.2.2. Çam Tala<.ndan Aktif Karbon Sentezi ...66
3.3.ADSORPS&YON DENEYLER&...67
3.4ADSORPS&YON TERMOD&NAM&K&NCELEMELER&...67
3.5.ADSORPS&YON K&NET&K&NCELEMELER&...68
3.6.ZETA-POTANS&YEL ÖLÇÜMLER&...68
4. ARA TIRMA BULGULARI VE DE!ERLEND RME...69
4.1.YAPI VE YÜZEY ANAL&ZLER&...69
4.1.1. Element Analizi Sonuçlar. ...69
4.1.2. FT-IR Analizi Sonuçlar. ...70
4.1.3. XRD Analizi ...75
4.1.4. SEM Analizi Sonuçlar. ...78
4.1.5. Termal Analiz Sonuçlar...82
4.1.6. BET Analiz Sonuçlar...86
4.1.7. BOEHM Titrasyonu Sonuçlar. ...91
4.2.ADSORPS&YON PARAMETRE ÇALICMALARI...92
4.2.1. TAC1 Kompozitine Ait Adsorpsiyon Sonuçlar...92
4.2.1.1. Adsorban Miktar.n.n Belirlenmesi ...92
4.2.1.2. Adsorbat Deri<iminin Etkisi ...94
4.2.1.3. Kar.<t.rma Süresinin Etkisi...97
4.2.1.4. Kar.<t.rma H.z.n.n Etkisi ...100
4.2.1.5. Çözelti pH Etkisi...102
4.1.2.6. S.cakl.k Etkisi ...104
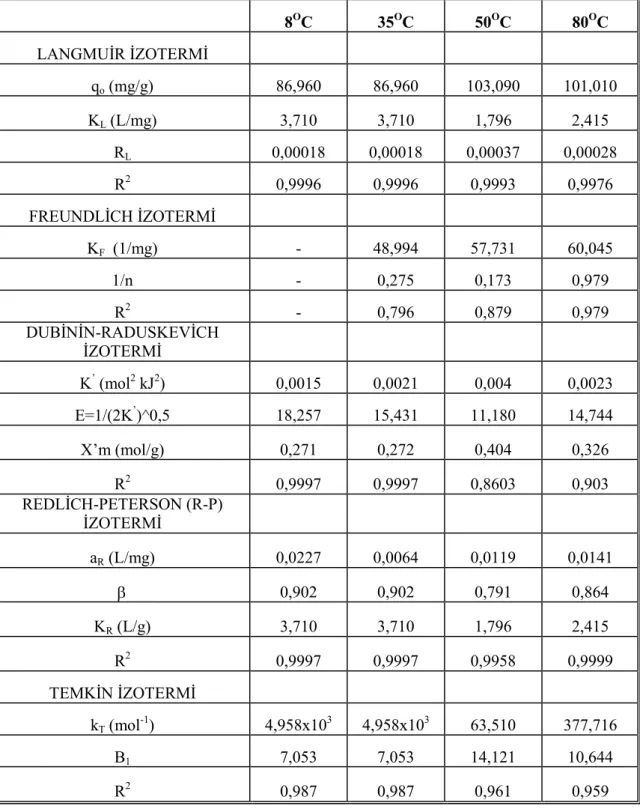
4.3.ADSORPS&YON DENGE &ZOTERM ÇALICMALARI...111
4.3.1. TAC1 Kompozit Adsorban. Adsorpsiyon Denge izotermleri ...111
4.3.1.1. TAC1/Metilen Mavisi Adsorpsiyon Denge &zotermleri ...111
4.3.1.3. TAC1/Remazol Mavisi Adsorpsiyon Denge &zotermleri ...120
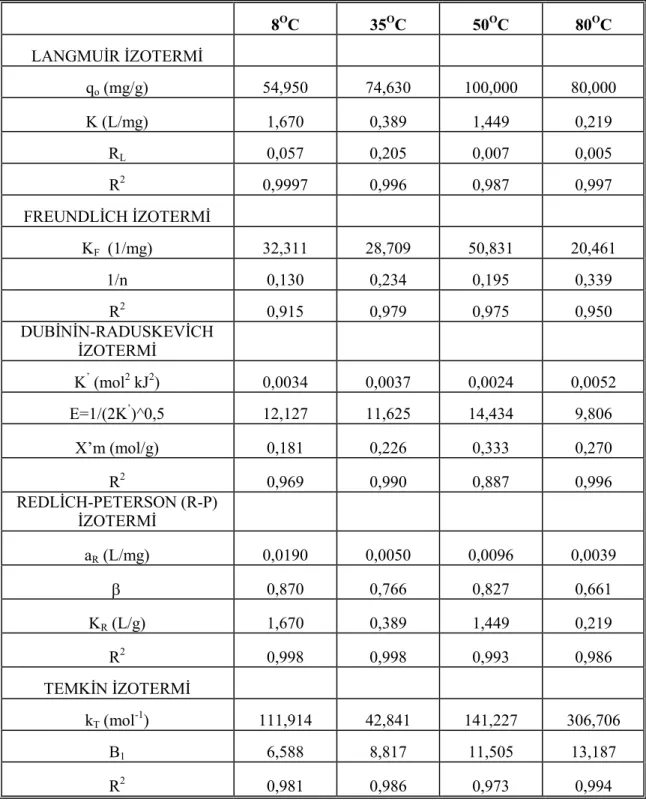
4.3.2. TAC2 Adsorpsiyon Denge &zotermleri...125
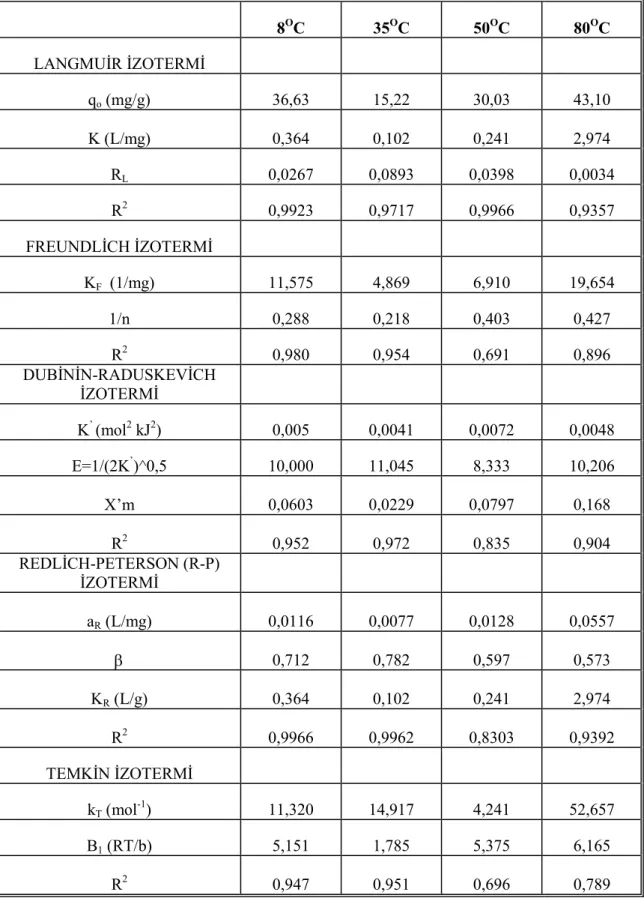
4.3.3. ALAC1 Adsorpsiyon Denge &zotermleri ...130
4.3.4. Aktif Karbon Adsorpsiyon Denge &zotermleri ...135
4.4.ADSORPS&YON K&NET&J&...139
4.4.1. TAC1 Kompoziti Adsorpsiyon Kineti;i...139
4.5.1.1. TAC1/Metilen Mavisi Adsorpsiyon Kineti;i ...139
4.5.1.2. TAC1 Kompoziti Oranj II Adsorpsiyon Kineti;i ...146
4.5.1.3. TAC1/Remazol Mavisi Adsorpsiyon Kineti;i ...151
4.4.2. TAC2 Kompoziti Adsorpsiyon Kineti;i...156
4.4.3. ALAC1 Kompoziti Adsorpsiyon Kineti;i...161
4.4.4.AKT&FKARBON ADSORPS&YON K&NET&J&...166
4.5.ADSORPS&YON TERMOD&NAM&J&...171
4.6.ZETA POTANS&YEL&ÖLÇÜM SONUÇLARI...180
4.6.1. TAC1 Zeta Potansiyeli Ölçümleri ...180
4.6.1.1. TAC1/Metilen Mavisi Sistemi Zeta Potansiyeli Ölçümleri...180
4.6.1.2. TAC1/Oranj II Sistemi Zeta Potansiyeli Ölçümleri ...182
4.6.1.3. TAC1/Remazol Mavisi Sistemi Zeta Potansiyeli Ölçümleri ...184
4.6.2. TAC2 Zeta Potansiyeli Ölçümleri ...185
4.6.2.1. TAC2/Metilen Mavisi Sistemi Zeta Potansiyeli Ölçümleri...186
4.6.2.2. TAC2/Oranj II Sistemi Zeta Potansiyeli Ölçümleri ...187
4.6.2.3. TAC2/Remazol Mavisi Sistemi Zeta Potansiyeli Ölçümleri ...188
4.6.3. ALAC1 Zeta Potansiyeli Ölçümleri ...190
4.6.3.1. ALAC1/Metilen Mavisi Sistemi Zeta Potansiyeli Ölçümleri...190
4.6.3.2. ALAC1/Oranj II Sistemi Zeta Potansiyeli Ölçümleri...192
4.6.3.3. ALAC1/Remazol Mavisi Sistemi Zeta Potansiyeli Ölçümleri ...193
4.6.4. Aktif Karbon Zeta Potansiyeli Ölçümleri...194
4.6.4.1. AC/Metilen Mavisi Sistemi Zeta Potansiyeli Ölçümleri ...196
4.6.4.2. AC/Oranj II Zeta Potansiyel Ölçümleri ...198
4.6.4.3. AC/Remazol Mavisi Sistemi Zeta Potansiyeli Ölçümleri ...199
5.SONUÇ VE ÖNER&LER...201
REFERANSLAR ...206
ÖZET
Doktora TeziMETAL ALKOKS&T TEMELL& KOMPOZ&T MATERYAL SENTEZ& VE BOYA ADSORPS&YONUNDA KULLANIMI
Meltem AS<ÜRK &nönü Üniversitesi Fen Bilimleri Enstitüsü
Kimya Anabilim Dal. 219+xiv
2007
Dan.<man: Prof. Dr. Engin CENER Yrd. Dan.<man: Doç. Dr. Hikmet SAYILKAN
Bu tezde bilinen önemli endüstriyel kirliliklerden olup, farkl. özelliklerdeki Metilen mavisi, Oranj II ve Reaktif Remazol Brillant mavisi boyar maddelerinin at.k sulardan uzakla<t.r.lmas. amac.yla kullan.lmak üzere kompozit adsorban materyaller ve aktif karbon üretilmi<tir.
Kompozit adsorbanlar, tar.msal bir at.k olan ham çam tala<. ile Ti(OPrn)4, Ti(OBun)4 ve Al(OBus)3 metal alkoksit bile<iklerinin sol-jel yöntemiyle elde edilen hidroliz ürünlerinin birle<tirilmesiyle haz.rlanm.<t.r. Aktif karbon ise, kompozit olu<umunda kullan.lan ham çam tala<.n.n kimyasal aktivasyonuyla elde edilmi<tir. Sentezlenen adsorbanlar.n yap. ve yüzey özellikleri FTIR, XRD, BET, TGA/DTA, SEM, Boehm metodu ve Zeta potansiyeli ölçümleri ile incelenmi<tir.
Çal.<mada, sentezlenen kompozit materyallerle aktif karbonun üç boyar madde için de adsorpsiyon özellikleri incelenmi<tir. Boyar madde adsorpsiyonu üzerine; adsorban miktar., adsorbat deri<imi, kar.<t.rma süresi, kar.<t.rma h.z., pH ve s.cakl.k parametrelerinin etkisi ara<t.r.lm.< ve yüksek adsorpsiyon verimi için en uygun ko<ullar tespit edilmi<tir.
Adsorpsiyon sistemleri için, s.cakl.k ve deri<ime ba;l. olarak adsorpsiyon denge incelemeleri yap.lm.<t.r. Adsorpsiyon denge deneysel verilerinin Langmuir, Freundlich, Dubinin-Raduskevich, Redlich-Peterson ve Temkin izoterm denklemlerine uyumlar.
incelenerek adsorpsiyon denge sabiti, tek tabaka kapasitesi, adsorpsiyon enerjisi ve adsorpsiyon .s.s., adsorpsiyon <iddeti ve ba;lanma enerjisi ile ad. geçen özelliklerin s.cakl.kla de;i<imi ara<t.r.lm.<t.r. Kompozit adsorbanlar ve aktif karbon yüzeylerinde her bir boyar madde adsorpsiyonunun tek tabakal. olarak gerçekle<ti;i, tüm s.cakl.k ve deri<imlerde Langmuir izoterminin uygulanabilece;i tespit edilmi<tir.
Adsorpsiyon sistemleri için farkl. s.cakl.klarda adsorpsiyon kineti;i incelemi<tir. Kinetik verilerin yalanc. I. ve II. dereceden, Elovich ve Bangham’s, Molekül &çi Difüzyon ve Modifiye Freundlich kinetik modellerine uygulanmas.yla; adsorpsiyon h.z sabiti, adsorpsiyonun h.z s.n.rlay.c. basama;., yüzeyin kaplanma kesri, kuramsal adsorpsiyon kapasitesi gibi parametreler ve bunlar.n s.cakl.kla de;i<imleri belirlenmi<tir. Tüm adsorban/adsorbat sistemlerinin yalanc. II. dereceden kinetik modeline uydu;u tespit edilmi<tir.
Adsorpsiyon sistemleri için, s.cakl.;a ba;l. olarak adsorpsiyon termodinami;i ve adsorpsiyon aktivasyon termodinami;i incelenerek, adsorpsiyon prosesinin .s.sal karakteri ara<t.r.lm.<t.r. Tezde kullan.lan kompozit adsorban materyaller ve aktif karbonun, boyar madde adsorpsiyonu öncesi ve sonras. pH’a ba;l. olarak zeta potansiyeli de;i<imleri incelenmi<tir.
ANAHTAR KEL&MELER: Kompozit materyal, aktif karbon, boyar madde adsorpsiyonu, adsorpsiyon izotermi, adsorpsiyon kineti;i, zeta potansiyeli
ABSTRACT
Ph. D. ThesisMETAL ALKOXIDE BASED COMPOSITE MATERIALS SYNTHESIS AND USE IN DYE ADSORPTION
Meltem AS<ÜRK
Inonu University
Graduate School of Natural and Applied Sciences Department of Chemistry
219+xiv 2007
Supervisor: Prof. Dr. Engin CENER
Co-supervisor: Assoc. Prof. Dr. Hikmet SAYILKAN
In this thesis, composite adsorbent materials and an activated carbon have been prepared to be used in removal of Methylene Blue, Orange II and Reactive Remazol Brillant Blue dyes, which are important industrial pollutants, from waste water.
Composite adsorbents have been prepared by combining raw pine sawdust, an agricultural waste, with hydrolysis products of Ti(OPrn)4, Ti(OBun)4 ve Al(OBus)3 prepared by sol-gel method. Activated carbon samples have been prepared from the same pine sawdust, using a chemical activation method. The structural and surface properties of prepared adsorbents have been investigated by FTIR, XRD, BET, TGA/DTA, SEM, Boehm techniques and Zeta potential measurements.
In this study, adsorption properties of the prepared composite materials and activated carbon samples have been studied for three dyes. Effects of adsorbent amount, adsorbate concentration, pH, temperature, mixing time and speed have been investigated and optimum levels for the adsorption parameters have been determined.
Equilibrium investigation of adsorption systems has been carried out for varying concentration of dyes and temperature. Agreement of adsorption equilibrium data with Langmuir, Freundlich, Dubinin-Raduskevich, Redlich-Peterson and Temkin isotherm equations has been investigated. The adsorption equilibrium constant, mono layer
capacity, adsorption energy, adsorption heat, adsorption power and binding energy values and their temperature dependence have been investigated. It was found that dye adsorption on composite adsorbents and activated carbon takes place on a mono layer and Langmuir isotherm can be applied for any temperature and concentration.
Adsorption kinetics has also been investigated at several temperatures for adsorption systems. Parameters such as adsorption rate constant, surface coverage fraction and theoretical adsorption capacity and their temperature dependance have been determined by employing Pseudo first and second order, Elovich and Bangham’s, Intra-particle Diffusion and Modified Freundlich kinetic models. It was determined that all adsorbent/adsorbate systems obey the Pseudo second order kinetic model.
Overall and activation thermodynamics of the adsorption systems have been investigated as a function of temperature and thermal nature of adsorption process has been studied.
Zeta potential changes of adsorbent materials used in this thesis have been examined before and after adsorption as a function of pH.
KEYWORDS: Composite Materials, Activated Carbon, Dye adsorption, adsorption isotherm, adsorption kinetics, zeta potential.
TE EKKÜR
Tez çal.<mas.n.n her a<amas.nda yard.m, öneri ve destekleriyle beni yönlendiren
dan.<man hocalar.m Prof. Dr. Engin CENER ve Doç. Dr. Hikmet SAYILKAN’ a
Tezin deneysel ve yaz.m a<amas.nda her türlü yard.m.n. gördü;üm Mühendislik
Fakültesi Kimya Mühendisli;i Anabilim Dal. ö;retim üyesi Yrd. Doç. Dr. Yunus
ÖNAL’a
Zeta Potansiyeli ölçümlerinde yard.m ve önerilerini gördü;üm Mühendislik
Fakültesi Maden Mühendisli;i Anabilim Dal. ö;retim üyesi Doç. Dr. Murat
ERDEMOJLU ve tez çal.<mas.n.n her a<amas.nda bana .<.k tutan Doç. Dr. Sema
ERDEMOJLU’ na
Termal Analizleri yapan bölümümüz Fizikokimya Anabilim Dal.nda görevli
arkada<.m Ar<. Grv. Süleyman KÖYTEPE’ ye
Çal.<malar.m boyunca bana destek olan arkada<lar.m Ar<. Grv. Funda
SAYILKAN, Hülya&Kadir BEYC&OJLU’na
Her zaman oldu;u gibi, tez çal.<mas. s.ras.nda da bana destek olan A&LEM”e
TABLOLAR D Z N
Tablo 2.1. Temel tip endüstriyel adsorbanlar 37
Tablo 3.1. Deneysel çal.<mada kullan.lan kimyasal maddeler ve özellikleri 62 Tablo 3.2. Kullan.lan alkoksitlerin hidroliz oranlar. 65
Tablo 4.1. Element Analiz Sonuçlar. 69
Tablo 4.2. Aktif karbonun FT-IR spektrumunda gözlenen pikler 70 Tablo 4.3. Adsorban maddelere ait BET analizi ve DFT sonuçlar. 86 Tablo 4.4. Kompozit materyaller ve aktif karbonun Boehm titrasyonu
sonuçlar.
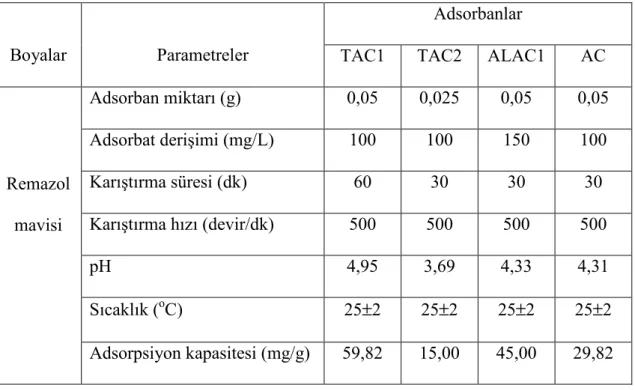
91 Tablo 4.5. TAC1, TAC2, ALAC1 kompozitleri ve aktif karbon yüzeyinde
Metilen mavisi adsorpsiyonu parametre çal.<mas. sonuçlar. 109 Tablo 4.6. TAC1, TAC2, ALAC1 kompozitleri ve aktif karbon yüzeyinde
Oranj II adsorpsiyonu parametre çal.<mas. sonuçlar.
109 Tablo 4.7. TAC1, TAC2, ALAC1 kompozitleri ve aktif karbon yüzeyinde
Remazol mavisi adsorpsiyonu parametre çal.<mas. sonuçlar.
110 Tablo 4.8. Farkl. s.cakl.klarda TAC1/Metilen mavisi adsorpsiyon denge
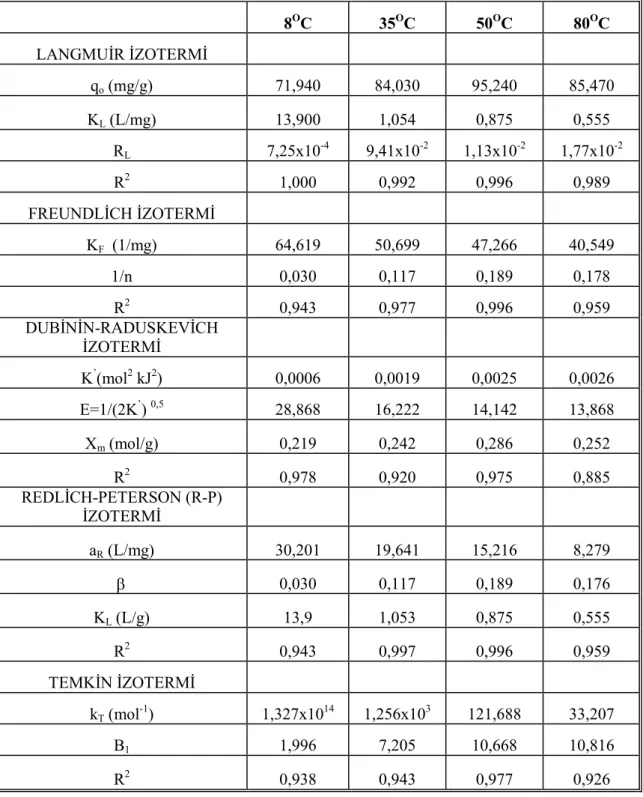
izoterm sonuçlar. 115
Tablo 4.9. Farkl. s.cakl.klarda TAC1/Oranj II &zoterm adsorpsiyon denge izoterm sonuçlar.
119 Tablo 4.10. Farkl. s.cakl.klarda TAC1/Remazol mavisi adsorpsiyon denge
izoterm sonuçlar. 123
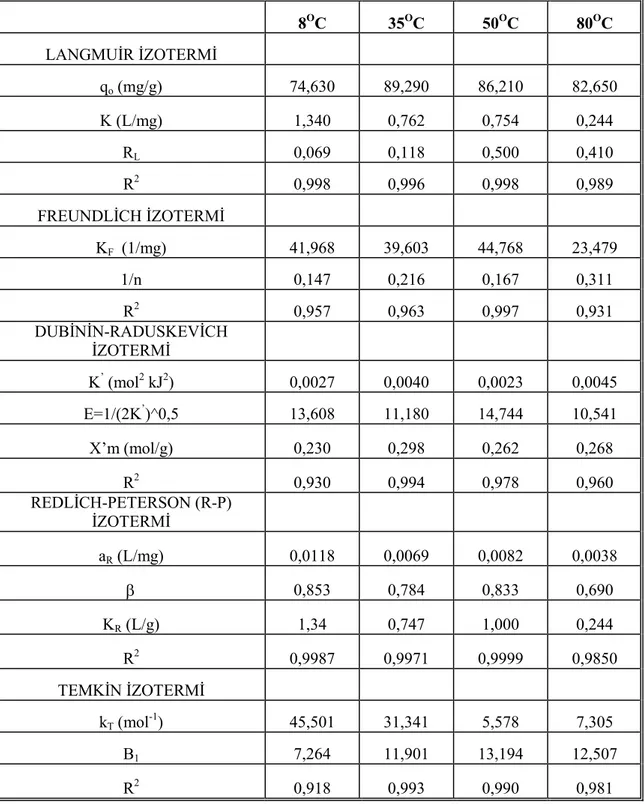
Tablo 4.11. Farkl. s.cakl.klarda TAC2/Metilen mavisi adsorpsiyon denge izoterm sonuçlar.
127 Tablo 4.12. Farkl. s.cakl.klarda TAC2/Oranj II adsorpsiyon denge izoterm
sonuçlar.
128 Tablo 4.13. Farkl. s.cakl.klarda TAC2/Remazol mavisi adsorpsiyon denge
izoterm sonuçlar. 129
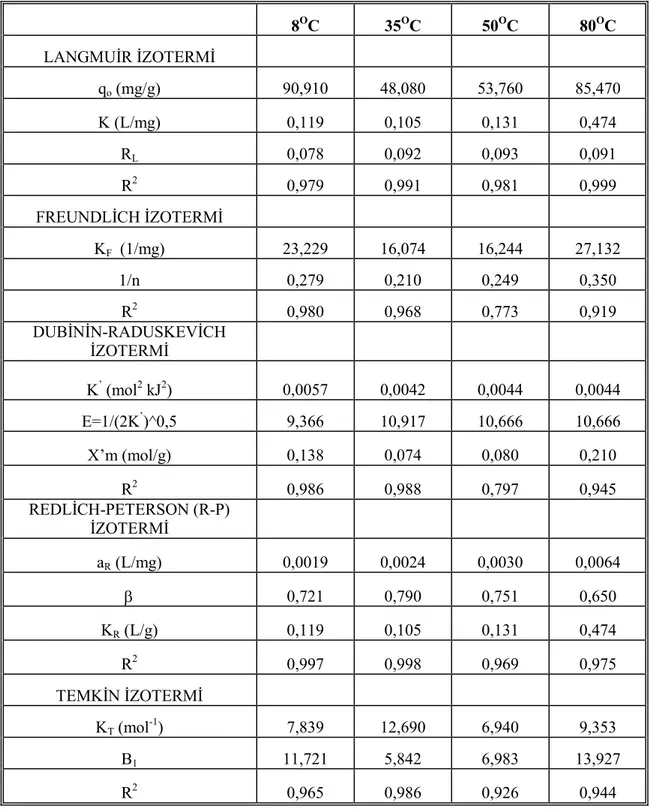
Tablo 4.14. Farkl. s.cakl.klarda ALAC1/Metilen mavisi adsorpsiyon denge izoterm sonuçlar.
131 Tablo 4.16. Farkl. s.cakl.klarda ALAC1/Remazol mavisi adsorpsiyon denge
izoterm sonuçlar. 132
Tablo 4.17. Farkl. s.cakl.klarda Aktif Karbon/Metilen mavisi adsorpsiyon denge izoterm sonuçlar.
133 Tablo 4.18. Farkl. s.cakl.klarda Aktif Karbon/Oranj II adsorpsiyon denge
izoterm sonuçlar.
136 Tablo 4.19. Farkl. s.cakl.klarda Aktif Karbon/Remazol mavisi denge izoterm
sonuçlar. 137
Tablo 4.20. TAC1/Metilen mavisi sistemi için çe<itli s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri
143 Tablo 4.21. TAC1/Oranj II adsorpsiyon sistemi için çe<itli s.cakl.klardaki farkl.
adsorpsiyon kinetik parametreleri 150
Tablo 4.22. TAC1/Remazol mavisi adsorpsiyon sistemi için çe<itli s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri
154 Tablo 4.23. TAC2/Metilen mavisi adsorpsiyon sistemi için çe<itli
s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri
158 Tablo 4.24. TAC2/Oranj II adsorpsiyon sistemi için çe<itli s.cakl.klardaki farkl.
Tablo 4.25. TAC2/Remazol mavisi adsorpsiyon sistemi için çe<itli s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri
160 Tablo 4.26. ALAC1/Metilen mavisi adsorpsiyon sistemi için çe<itli
s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri 162 Tablo 4.27. ALAC1/Oranj II adsorpsiyon sistemi için çe<itli s.cakl.klardaki
farkl.
adsorpsiyon kinetik parametreleri
163
Tablo 4.28. ALAC1/Remazol mavisi adsorpsiyon sistemi için çe<itli s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri
165 Tablo 4.29. Aktif karbon/Metilen mavisi adsorpsiyon sistemi için çe<itli
s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri 167 Tablo 4.30. Aktif karbon/Oranj II adsorpsiyon sistemi için çe<itli s.cakl.klardaki
farkl. adsorpsiyon kinetik parametreleri
168 Tablo 4.31. Aktif karbon/Remazol mavisi adsorpsiyon sistemi için çe<itli
s.cakl.klardaki farkl. adsorpsiyon kinetik parametreleri 170 Tablo 4.32. TAC1/boyar madde adsorpsiyon sistemlerine ait termodinamik
verileri
172 Tablo 4.33. TAC2/boyar madde adsorpsiyon sistemlerine ait termodinamik
verileri
174 Tablo 4.34. ALAC1/boyar madde adsorpsiyon sistemlerine ait termodinamik
verileri 176
Tablo 4.35. Aktif karbon/boyar madde adsorpsiyon sistemlerine ait termodinamik verileri
EK LLER D Z N
Cekil 2.1. Elektriksel çift tabaka 7
Cekil 2.2. Adsorpsiyon potansiyel e;rileri 14
Cekil 2.3. BET adsorpsiyon izoterm tipleri 18
Cekil 2.4. S.v. fazdan adsorpsiyon izoterm tipleri 19
Cekil 2.5. Sol-jel prosesinin <ematik prosesi 49
Cekil 2.6. Metal alkoksitler için genel hidroliz reaksiyonu 55 Cekil 2.7. Kondenzasyon tepkimelerinin alkoksilasyon, oksolasyon ve
olasyon mekanizmalar.
56 Cekil 2.8. Silisyum alkoksitlerin asidik ortamda hidroliz-kondenzasyon
tepkime mekanizmas.
57
Cekil 2.9. Metilen mavisi’nin kimyasal yap.s. 60
Cekil 2.10. Remazol Brillant mavisi’nin kimyasal yap.s. 60
Cekil 2.11. Oranj II’ nin kimyasal yap.s. 61
Cekil 4.1. Aktif karbona ait FT-IR spektrumu 71
Cekil 4.2. Al(OBus)3’ in hidroliz ürünleri (100oC ve 500oC sonras.) ve ALAC1 kompozitine ait FT-IR spektrumu
72 Cekil 4.3. TAC2 kompozitine ait FT-IR spektrumu 73 Cekil 4.4. Ti(OBun)4’ in hidroliz ürününün 100oC, 500oC’deki FT-IR
spektrumlar.
74 Cekil 4.5. TAC1 kompozitine ait FT-IR spektrumu 74
Cekil 4.6. TAC1 kompozitine ait XRD spektrumu 75
Cekil 4.7. TAC2 kompozitine ait XRD spektrumu 76
Cekil 4.8. ALAC1 kompozitine ait XRD spektrumu 76
Cekil 4.9. Aktif karbona ait XRD spektrumu 77
Cekil 4.10. 100oC’ye .s.t.lm.< Ti(OBun)4’in hidroliz ürününün SEM görüntüsü 78
Cekil 4.11. TAC1 kompozitine ait SEM görüntüsü 79
Cekil 4.12. TAC2 kompozitine ait SEM görüntüsü 79
Cekil 4.13. 100oC’de .s.l i<leme tabi tutulmu< Al(OBun)3’ in hidroliz ürününün SEM görüntüsü
80
Cekil 4.14. ALAC1kompozitine ait SEM görüntüsü 80
Cekil 4.15. Aktif karbona ait SEM görüntüsü 81
Cekil 4.16. 500oC’ de .s.l i<leme tabi tutulmu< Ti(OBun)4’in hidroliz ürününe ait DTA ve TGA e;rileri
82
Cekil 4.17. TAC1 kompozitinin DTA ve TGA e;rileri 83
Cekil 4.18. TAC2 kompozitinin DTA ve TGA e;rileri 83
Cekil 4.19. ALAC1 kompozitinin DTA ve TGA e;rileri 84
Cekil 4.20. Aktif karbona ait DTA ve TGA e;rileri 85
Cekil 4.21. TAC1 ve TAC2 kompozitlerinin gözenek boyut da;.l.m. 87 Cekil 4.22. Aktif karbona ait gözenek boyut da;.l.m. 88 Cekil 4.23. TAC1 kompozitine ait N2adsorpsiyon-desorpsiyon izotermi 89 Cekil 4.24. TAC2 kompozitine ait N2adsorpsiyon-desorpsiyon izotermi 89 Cekil 4.25. ALAC1 kompozitine ait N2adsorpsiyon-desorpsiyon izotermi 90 Cekil 4.26. Aktif karbona ait N2adsorpsiyon-desorpsiyon izotermi 90 Cekil 4.27. TAC1/Metilen mavisi adsorpsiyonu üzerine adsorban miktar.n.n
etkisi
93
Cekil 4.28. TAC1/Oranj II adsorpsiyonu üzerine adsorban miktar.n.n etkisi 93 Cekil 4.29. TAC1/Remazol mavisi adsorpsiyonu üzerine adsorban miktar.n.n
etkisi
Cekil 4.30. Metilen mavisi’nin TAC1 kompozit adsorban. yüzeyinde adsorpsiyonu üzerine adsorbat deri<imi etkisi
95 Cekil 4.31. Oranj II’nin TAC1 kompozit adsorban. yüzeyinde adsorpsiyonu
üzerine adsorbat deri<imi etkisi
96 Cekil 4.32. Remazol mavisi’nin TAC1 kompozit adsorban. yüzeyinde
adsorpsiyonu üzerine adsorbat deri<imi etkisi
96 Cekil 4.33. Metilen mavisi’nin TAC1 kompozit adsorban. yüzeyinde
adsorpsiyonu üzerine kar.<t.rma süresinin etkisi
97 Cekil 4.34. Oranj II’ nin TAC1 kompozit adsorban. yüzeyinde adsorpsiyonu
üzerine kar.<t.rma süresinin etkisi 98
Cekil 4.35. Remazol mavisi’nin TAC1 kompozit adsorban. yüzeyinde adsorpsiyonu üzerine kar.<t.rma süresinin etkisi
99 Cekil 4.36. TAC1kompozti yüzeyinde Metilen mavisi adsorpsiyonu üzerine
kar.<t.rma h.z.n.n etkisi
100 Cekil 4.37. TAC1kompozti yüzeyinde Oranj II adsorpsiyonu üzerine
kar.<t.rma h.z.n.n etkisi 101
Cekil 4.38. TAC1kompoziti yüzeyinde Remazol mavisi adsorpsiyonu üzerine kar.<t.rma h.z.n.n etkisi
101 Cekil 4.39. TAC1kompoziti yüzeyinde Metilen mavisi adsorpsiyonu üzerine
pH etkisi 103
Cekil 4.40. TAC1kompoziti yüzeyinde Oranj II adsorpsiyonu üzerine pH etkisi 103 Cekil 4.41. TAC1kompoziti yüzeyinde Remazol mavisi adsorpsiyonu üzerine
pH etkisi 104
Cekil 4.42. TAC1kompoziti yüzeyinde Metilen mavisi adsorpsiyonu üzerine s.cakl.k etkisi
105 Cekil 4.43. TAC1kompoziti yüzeyinde Oranj II adsorpsiyonu üzerine s.cakl.k
etkisi
106 Cekil 4.44. TAC1kompoziti yüzeyinde Remazol mavisi adsorpsiyonu üzerine
s.cakl.k etkisi
106
Cekil 4.45. TAC1/ Metilen mavisi adsorpsiyon sistemi Langmuir &zotermi 112 Cekil 4.46. TAC1/ Metilen mavisi adsorpsiyon sistemi Freundlich &zotermi 112 Cekil 4.47. TAC1/ Metilen mavisi adsorpsiyon sistemi Dubinin-Raduskevich
&zotermi 113
Cekil 4.48. TAC1/ Metilen mavisi adsorpsiyon sistemi Redlich-Peterson &zotermi
113
Cekil 4.49. TAC1/ Metilen mavisi adsorpsiyon sistemi Temkin &zotermi 114 Cekil 4.50. TAC1/ Oranj II adsorpsiyon sistemi Langmuir &zotermi 116 Cekil 4.51. TAC1/ Oranj II adsorpsiyon sistemi Freundlich &zotermi 116 Cekil 4.52. TAC1/ Oranj II adsorpsiyon sistemi Dubinin-Raduskevich &zotermi 117
Cekil 4.53. TAC1 / Oranj II adsorpsiyon sistemi Redlich-Peterson &zotermi 117
Cekil 4.54. TAC1/Oranj II adsorpsiyon sistemi Temkin &zotermi 118 Cekil 4.55. TAC1/ Remazol mavisi adsorpsiyon sistemi Langmuir &zotermi 120
Cekil 4.56. TAC1/ Remazol mavisi adsorpsiyon sistemi Freundlich &zotermi 120 Cekil 4.57. TAC1/ Remazol mavisi adsorpsiyon sistemi Dubinin-Raduskevich
&zotermi
121 Cekil 4.58. TAC1/Remazol mavisi adsorpsiyon sistemi Redlich-Peterson
&zotermi
121
Cekil 4.59. TAC1/Remazol mavisi adsorpsiyon sistemi Temkin &zotermi 122 Cekil 4.60. TAC1 kompozit adsorban. yüzeyinde Metilen mavisi adsorpsiyonu 140
için yalanc. II. derece kineti;i
Cekil 4.61. TAC1 kompozit adsorban. yüzeyinde Metilen mavisi adsorpsiyonu için “Elovich Kinetik Modeli”
140 Cekil 4.62. TAC1 kompozit adsorban. yüzeyinde Metilen mavisi adsorpsiyonu
için “Molekül &çi Difüzyon Kinetik Modeli” 141 Cekil 4.63. TAC1 kompozit adsorban. yüzeyinde Metilen mavisi adsorpsiyonu
için “Molekül &çi Difüzyon Kinetik Modeli” (Do;rusal k.s.m) 141 Cekil 4.64. TAC1 kompozit adsorban. yüzeyinde Metilen mavisi adsorpsiyonu
için “Bangham’s Kinetik Modeli”
142 Cekil 4.65. TAC1 kompozit adsorban. yüzeyinde Metilen mavisi adsorpsiyonu
için “Modifiye Freundlich Kinetik Modeli” 142 Cekil 4.66. TAC1 kompozit adsorban. yüzeyinde Oranj II adsorpsiyonu için
yalanc. II. derece kineti;i
146 Cekil 4.67. TAC1 kompozit adsorban. yüzeyinde Oranj II adsorpsiyonu için
“Elovich Kinetik Modeli” 147
Cekil 4.68. TAC1 kompozit adsorban. yüzeyinde Oranj II adsorpsiyonu için “Molekül &çi Difüzyon Kinetik Modeli”
147 Cekil 4.69. TAC1 kompozit adsorban. yüzeyinde Oranj II adsorpsiyonu için
“Bangham’s Kinetik Modeli ”
148 Cekil 4.70. TAC1 kompozit adsorban. yüzeyinde Oranj II adsorpsiyonu için
“Modifiye Freundlich Kinetik Modeli” 148
Cekil 4.71. TAC1kompozit adsorban. yüzeyinde Remazol mavisi adsorpsiyonu yalanc. II. dereceden kineti;i
151 Cekil 4.72. TAC1kompozit adsorban. yüzeyinde Remazol mavisi adsorpsiyonu
için “Elovich Kinetik Modeli” 151
Cekil 4.73. TAC1kompozit adsorban. yüzeyinde Remazol mavisi adsorpsiyonu için “Molekül &çi Difüzyon Kinetik Modeli
152 Cekil 4.74. TAC1kompozit adsorban. yüzeyinde Remazol mavisi adsorpsiyonu
için “Bangham’s Kinetik Modeli ”
152 Cekil 4.75. TAC1kompozit adsorbanu yüzeyinde Remazol mavisi
adsorpsiyonu için “Modifiye Freundlich Kinetik Modeli” 153 Cekil 4.76. TAC1 kompozitine ait pH-Zeta potansiyeli grafi;i 181 Cekil 4.77. TAC1/Metilen mavisi sistemine ait pH-Zeta potansiyeli grafi;i 181 Cekil 4.78. TAC1/Metilen mavisi sistemi adsorpsiyon öncesi ve sonras.
pH-Zeta potansiyeli grafi;i 182
Cekil 4.79. TAC1/Oranj II sistemine ait pH-Zeta potansiyeli grafi;i 183 Cekil 4.80. TAC1/ Oranj II sistemine ait adsorpsiyon öncesi ve sonras.
pH-Zeta potansiyeli grafi;i 183
Cekil 4.81. TAC1/ Remazol mavisi sistemine ait pH-Zeta potansiyeli grafi;i 184 Cekil 4.82. TAC1/Remazol mavisi sistemine ait adsorpsiyon öncesi ve sonras.
pH-Zeta potansiyeli grafi;i 184
Cekil 4.83. TAC2 kompozitine ait pH-Zeta potansiyeli de;i<imi 185 Cekil 4.84. TAC2/ Metilen mavisi sistemime ait pH-Zeta potansiyeli grafi;i 186
Cekil 4.85. TAC2/ Metilen mavisi sistemine ait adsorpsiyon öncesi ve sonras. pH-Zeta potansiyeli de;i<im grafi;i
187 Cekil 4.86. TAC2/ Oranj II sistemine ait pH-Zeta potansiyeli grafi;i 187 Cekil 4.87. TAC2/ Oranj II sistemine ait adsorpsiyon öncesi ve sonras.
pH-Zeta potansiyeli de;i<im grafi;i 188
Cekil 4.88. TAC2/ Remazol mavisi sistemine ait pH-Zeta potansiyeli grafi;i 188 189
Cekil 4.89. TAC2/ Remazol mavisi sistemine ait adsorpsiyon öncesi ve sonras. pH-Zeta potansiyeli de;i<im grafi;i
Cekil 4.90. ALAC1 kompozitine ait pH-Zeta potansiyeli de;i<im grafi;i 190 Cekil 4.91. ALAC1/ Metilen mavisi sistemine ait pH-Zeta potansiyeli grafi;i 191 Cekil 4.92. ALAC1/ Metilen mavisi sistemine ait adsorpsiyon öncesi ve
sonras. pH-Zeta potansiyeli de;i<im grafi;i
192 Cekil 4.93. ALAC1/ Oranj II sistemine ait pH- Zeta potansiyeli grafi;i 192 Cekil 4.94. ALAC1/ Oranj II sistemine ait adsorpsiyon öncesi ve sonras.
pH-Zeta potansiyeli de;i<im grafi;i
193 Cekil 4.95. ALAC1/ Remazol Mavisi sistemine ait pH-Zeta potansiyeli grafi;i 194 Cekil 4.96. ALAC1/ Remazol mavisi sistemine ait adsorpsiyon öncesi ve
sonras. pH-Zeta potansiyeli de;i<im grafi;i
194 Cekil 4.97. Aktif karbona ait pH-Zeta potansiyeli grafi;i 196 Cekil 4.98. Aktif karbon/Metilen mavisi sistemine ait pH-Zeta potansiyeli
grafi;i 197
Cekil 4.99. Aktif karbon/Metilen mavisi sistemine ait adsorpsiyon öncesi ve sonras. pH-Zeta potansiyeli de;i<im grafi;i
198 Cekil 4.100. Aktif Karbon/Oranj II sistemine ait pH-zeta potansiyeli grafi;i 198 Cekil 4.101. Aktif karbon/Oranj II sistemine ait adsorpsiyon öncesi ve sonras.
pH-Zeta potansiyeli de;i<im grafi;i
199 Cekil 4.102. Aktif karbon/Remazol mavisi sistemine ait pH-Zeta potansiyeli
grafi;i
200 Cekil 4.103. Aktif karbon/Remazol mavisi sistemine ait adsorpsiyonu öncesi ve
sonras. pH-zeta potansiyeli de;i<im grafi;i
1. G R
Bugün ve gelecekte; zararl at klar n giderilmesi ve kirlenmi çevrelerin temizlenerek tekrar eski haline dönü türülmesiyle ilgili ara t rmalar, bilimsel ve teknolojik olarak büyük bir önem ta maktad r.
Boyarmaddeler; boya, ilaç, tekstil, kâ" t ve plastik gibi pek çok endüstri alan nda oldukça yayg n olarak kullan lmaktad r. Bu proseslerde bol miktarda su kullan ld " için uygulamalar n sonras nda önemli miktarda renkli at k su olu maktad r. Bu nedenle, su kalitesinin söz konusu at k sulardan büyük ölçüde etkilendi"i kabul edilmektedir [2]. Sulardaki boyarmaddelerin miktar çok az dahi olsa (baz boyalar için 1 ppm’ den daha az) ortamda bulunmalar yasaklanm t r [1,2].
Günümüz endüstrisinde yakla k 100.000’den fazla ticari boya kullan lmakta ve y ll k boya üretiminin 7x105tondan daha fazla oldu"u belirtilmektedir [3,4]. Bu boyalar aras nda, yüksek çözünürlü"e sahip olmas ndan dolay , sentetik boyarmaddeler a" rl kta olup; yayg n su kirleticileridir. Sulu at klardaki boya miktar n n, üretilen boyalar n %2’ sini olu turmas problemin boyutunu göstermesi aç s ndan önemlidir [1,3]. Ancak endüstriyel at klar n içerdikleri boyarmaddelerin çevreye ve sa"l "a verdikleri zarardan dolay artan zorunlu ve s n rlay c kurallar, at " n d ar ya verilmeden önce mutlaka bu maddelerden uzakla t rmas n zorunlu hale getirmi tir. Özellikle organik boyarmaddelerin ço"u toksik ve karsinojenik olup, sulu ortamda ya ayan organizmalar için ciddi bir tehlike olu turmaktad r [5,6]. Ancak boya içeren at k sular temizlemek için uygun tek bir temizleme i leminden geçirmek çok zordur. Çünkü genellikle boyarmaddeler aerobik sindirim için dirençli olup, "a, s ve yükseltgen maddelere kar kararl d r [7,8].
Son otuz y lda bu tür maddelerin olu turdu"u renklerin giderimi için baz metotlar önerilmi olmas na ra"men, ancak bunlardan bir kaç n n endüstriyel uygulamalarda kullan labilece"i kabul edilmi tir [9]. At klar n uzakla t r lmas için önerilen metotlar ve teknikler biyolojik, kimyasal ve fiziksel olmak üzere üç kategoride toplanabilir [1]. Bu metotlar n ço"u yüksek maliyet gerektirdi"inden ve genellikle tek kullan ml k olmalar ndan dolay birçok endüstride boyal at k su temizleme i lemleri için geni ölçüde uygulanmamaktad r [9].
Biyolojik metotlar, fiziksel ve kimyasal tekniklerle kar la t r ld " nda genellikle en ekonomik olanlar d r. Funguslar ile renk giderimi, mikrobiyal parçalama, mikrobiyal
biyokütle arac l " yla adsorpsiyon ve biyoremidasyon gibi biyobozunma sistemleri, endüstriyel at klar n temizlenmesinde yayg n olarak kullan lmaktad r. Çünkü bakteri, maya, alg ve funguslar gibi ço"u mikroorganizmalar bulunduklar ortamda ço"alabilmekte ve farkl kirlilikleri parçalayabilmektedirler [2,4]. Bu metotlar n uygulanabilmesi için büyük bir kara alan gerektirmesi, günlük de"i melere kar duyarl l klar , düzenleme ve uygulamadaki esnekliklerinin daha az olmas , uygulanabilirliklerini s n rlamaktad r. Bu nedenle, biyolojik metotlar geleneksel biyobozunma teknikleri ile elde edilen tatmin edici renk gideriminde yetersiz kalmaktad r [1]. Biyolojik metotlar, ço"u organik molekülü parçalamas na ra"men, pek çok boyan n karma k yap l ve sentetik organik merkezli olmas nedeniyle bu türlerde yetersiz kalmaktad r. Bu metotla, özellikle ksenobiyotik yap lar nedeniyle azo boyalar tamamen uzakla t r lamamakta veya parçalanamamaktad r.
Kimyasal metotlar; flotasyon (yüzdürme) ve filtrasyon ile birle tirilmi flokülasyon (p ht la ma) ve koagülasyon, Fe(II)/Ca(OH)2 ile çöktürme-flokülasyon, elektroflotasyon, elektrokinetik koagülasyon, yükseltgen (ozon) ile gerçekle tirilen yükseltgeme metotlar olup, nland rma ya da elektrokimyasal teknikleri de içermektedir. Bu metotlar, genellikle boyalar ortamdan uzakla t rmas na ra"men, pahal olduklar ndan az tercih edilmektedir. Ayr ca a r kimyasal kullan m ndan dolay ikincil bir çevre problemini de ortaya ç karabilmektedirler. Son y llarda ortaya ç kar lan tekniklerden bir di"eri olan ve hidroksil, peroksit radikalleri gibi çok güçlü yükseltgenlerin elde edildi"i ileri oksidasyon prosesi de kirlilik giderilmesinde kullan lmaktad r. Bu metotlar, at klar taraf ndan kirletilmi sular n temizlenmesinde etkili olmas na ra"men, çok maliyetli olduklar ndan dolay ticari aç dan ilgi çekici de"ildir. Çünkü bu metotta, yüksek elektrik enerjisi gerekmekte ve fazla miktarda kimyasal belirteçler tüketilmektedir.
Membran filtrasyon (nanofiltrasyon, ters ozmos, elektrodiyaliz gibi) ve desorpsiyon teknikleri gibi farkl fiziksel metotlar da at k su temizleme i lemlerinde yayg n olarak kullan lmaktad r. Membran filtrasyon yönteminin en büyük dezavantaj n n, membran n kullan m ömrünün s n rl ve periyodik olarak membran de"i tirilmesinin yüksek bir maliyete sahip oldu"u ifade edilmektedir. Yap lan birçok çal mada, s v faz adsorpsiyonunun at k sulardan kirliliklerin uzakla t r lmas nda uygulanan en etkin metotlardan biri oldu"u ileri sürülmü tür. Bu metot, özellikle adsorban n ucuz olmas ve uygulamadan önce ilave bir ön basamak gerektirmemesi nedeniyle at k sular n temizlenmesinde ilgi çeken alternatif bir metottur.
Boya giderimi teknikleri aras nda adsorpsiyon iyi sonuçlar veren etkin bir yöntem olup, farkl molekül yap s ndaki boyarmaddeleri uzakla t rmada kullan lmaktad r [10–12]. Adsorpsiyon sistemleriyle ortamda bulunan zararl moleküller büyük oranda uzakla t r larak at k sular tekrar kullan l r hale getirilebilmektedir. Endüstriyel kurulu lar n pek ço"u at k sulardaki boyarmaddeleri adsorpsiyon yöntemiyle uzakla t rmak için adsorban olarak üstün adsorpsiyon özelli"ine sahip olmas nedeniyle aktif karbonu tercih etmektedir. Amerika Birle ik Devletleri Çevre Koruma Ajans , aktif karbon adsorpsiyon yöntemini piyasada kullan lan en iyi kontrol teknolojilerinden biri olarak kabul etmektedir [12]. Aktif karbon tercih edilen bir adsorban olmas na ra"men elde edilmesindeki maliyetinin yüksek olmas ve seçimli adsorpsiyon özelli"ine sahip olmamas kullan m n önemli ölçüde s n rlamaktad r.
Adsorpsiyon, iyi bilinen bir denge ay rma yöntemi olup, kirli sular n temizlenmesinde yayg n olarak kullan lan etkin bir metottur. Suyun yeniden kullan m ndaki ba lang ç maliyeti, tasar m basitli"i ve esnekli"i, uygulama kolayl " ve zehirli kirlilikleri uzakla t r lmas bak m ndan adsorpsiyon di"er tekniklere göre üstünlük sa"lamaktad r.
Adsorpsiyon metodu, at k sulardan önemli miktarda toksik özelli"e sahip kimyasal kirliliklerin uzakla t r lmas için son derece yayg n olarak kullan lmaktad r. Ancak, tüm adsorbanlar aras nda yüksek adsorpsiyon özelli"inden dolay , aktif karbon at k sulardan zararl kirliliklerin uzakla t r lmas nda en fazla kullan lan d r [12–15]. Yüksek adsorpsiyon kapasitesi, esas olarak aktif karbonun yap sal özelliklerinden, büyük bir yüzey alan na sahip olmas n sa"layan gözenekli yap s ndan ve kimyasal i lemler arac l " yla bunlar n kolayl kla modifiye edilebilir olmas ndan kaynaklanmaktad r. Ancak oldukça pahal ve yüksek maliyetli olmas , seçici olmamas , disperse ve f ç boyalar na kar iyi bir adsorban özelli"ine sahip olmamas önemli dezavantajlar d r [14]. Ayr ca rejenerasyonu oldukça pahal d r ve rejenerasyon s ras nda önemli oranda kütle kayb da olmaktad r.
Son y llarda adsorpsiyon konusunda yap lan çal malar n pek ço"unda adsorban olarak endüstriyel ve tar msal at k ürünlerin kullan m önerilmektedir [16–37]. Tar msal ve odun temelli ürünler, bol, ucuz ve yenilenir olmas ndan dolay aktif karbon kayna" olarak tercih edilmektedir. Bu tar msal at k ürünler, ekonomik de"eri olmad " gibi düzenlenme problemlerine de sahiptirler. Bunlar n aktif karbona dönü türülmesinin ekonomik de"eri, at k üzerindeki maliyeti azaltmaya yard m etmesinin yan s ra mevcut
ticari aktif karbonlar için potansiyel ucuz alternatif ba lang ç malzemesi olmas da çok önemlidir.
1.1. Amaç
Aktif karbon, atmosferik kirliliklerin ve at k sular n adsorpsiyon metodu ile temizlenmesinde en çok kullan lan adsorban madde olmas na ra"men; disperse ve f ç boyalar na kar etkisiz olmas , rejenerasyonunun pahal ve adsorban kayb na neden olmas ve seçici olmamas gibi dezavantajlara sahiptir. Karbon yüzeyi organik ve inorganik ajanlar ile modifiye edilerek, adsorpsiyon özelikleri, yüzey davran lar , kimyasal adsorpsiyon ve katalitik parçalanma arac l " yla toksik gaz ve buharlar n uzakla t r lmas nda daha da yararl hale getirilebilmektedir. Metaller ve metal oksitler ile aktif karbon impregnasyonu, belirli endüstriyel proseslerde aktif karbonun iyi bir katalizör olmas n sa"lam t r. Metaller ile impregnasyon ve ayn zamanda gazla t rma özelliklerinin modifiye edilmesiyle sonuç ürünün gözenek yap s de"i tirilebilmektedir.
Kat taneciklerin yüzeylerini kaplamada kullan lan materyaller genel olarak MOx veya MxOy formundaki metal oksitlerdir. Bu oksitler, sol-jel yöntemiyle kolayca sentezlenebilen ve at k sulardaki organik ve/veya anorganik kirliliklerin adsorpsiyonunda kullan lmaya ba lanan, de"i ik formdaki metal alkoksitlerin hidroliz-kondansasyon tepkimeleri sonucunda da elde edilebilmektedir.
Hki ayr maddenin iyi olan özelliklerinin kompozit ad verilen tek bir materyalde toplanmas sonucu elde edilen adsorbanlar n, adsorpsiyon çal malar nda kullan m literatüre yeni girmektedir. Bu çal mada; do"al at k malzemelerden olan çam tala ile farkl metal oksitleri içeren kompozit materyallerin sentezlenmesi, karakterizasyonu ve at k sularda bol miktarda bulunan farkl organik boyalar adsorplama özelliklerinin incelenmesi amaçlanm t r. Kompozit materyaller ile homojen gözenek da" l m na sahip, adsorpsiyon kapasitesi yüksek, hem anyonik hem de katyonik türlere kar etkili adsorbanlar n sentezlenmesi hedeflenmi tir. Çal mada, tüm adsorbanlar n boyarmadde adsorpsiyon mekanizmalar , adsorpsiyon termodinami"i ve kineti"inin aç klanmas amaçlanm t r.
1.2. Kapsam
Doktora tez çal mas üç bölümden olu maktad r. Hlk bölüm, fakl metal alkoksit bile iklerinden metal oksit bile iklerinin sentezini içermektedir. Bu kapsamda;
• Sol-jel yöntemi arac l " yla Ti(OPrn)4, Ti(OBun)4 ve Al(OBus)3 metal alkoksit bile iklerinin hidroliz-kondansasyon reaksiyonu sonucu metal oksit ve/veya metaloksihidroksit bile iklerinin sentezi,
• Sol-jel ürünlerinin FTIR, XRD, BET, TGA/DTA, SEM teknikleri arac l " yla karakterizasyonunun yap lmas ,
• Sol-jel ürünlerinin adsorpsiyon özeliklerinin incelenmesi hedeflenmi tir. Hkinci bölümde,
• Ham at k materyal ile metal oksit ve/veya metaloksihidroksit bile iklerinin birle tirilmesi ve kimyasal aktivasyon i lemiyle kompozit materyallerin sentezi,
• Do"al at k materyalden aktif karbon üretimi,
• Kompozit materyaller ile aktif karbonun yap ve yüzey özelliklerinin FTIR, XRD, BET, TGA/DTA, SEM, Boehm titrasyon metodu ve Zeta potansiyeli ölçümleri arac l " yla karakterize edilmesi amaçlanm t r. Son bölümde ise;
• Kompozit materyallerin Metilen Mavisi, Oranj II ve Reaktif Remazol Brillant Mavisi boyarmaddelerine kar adsorpsiyon özelliklerinin incelenmesi
• Optimum adsorpsiyon ko ullar n n belirlenmesi,
• Adsorpsiyon dengesi, adsorpsiyon termodinami"i ve kineti"ine yönelik çal malar n yap lmas hedeflenmi tir.
2. KURAMSAL TEMELLER VE UYGULAMALAR
2.1. Kat -s v Arayüz Yap s
Biri iyon di"eri elektron içeren iki faz n birbirine temas etmesiyle olu an ve her iki faza da temas eden iki boyutlu kuramsal yüzeye, arayüz ad verilmektedir. Arayüzlerde meydana gelen fiziksel ve kimyasal olaylar, arayüzü olu turan kitle fazlardakinden oldukça farkl d r. Kuvvet dengesizli"i nedeniyle; arayüzlerdeki atom, iyon ya da moleküller kitle fazda bulunanlardan çok daha etkindirler. Atom, iyon ve molekül gibi taneciklerin bir kat yüzünde tutunmas olan adsorpsiyon olgusu bu nedenle ortaya ç km t r.
Kat taneciklerin bir s v içinde da" lmas yla olu an ve süspansiyon ad verilen bir sistemde tanecikler, yüzeye genellikle elektrostatik adsorpsiyon arac l " yla geçerler. Bu ilk adsorpsiyon tabakas gerçek bir yüzey yükü olu umuna neden olur. Süspansiyondaki pek çok tanecik, çözücü-tanecik fazlar aras ndaki elektriksel potansiyelin bir sonucu olarak yüklüdür. Bu yük, tanecik yüzeyi ve onu çevreleyen çözeltideki iyonlar n e it da" lmamas n n sonucu olu maktad r.
Kolloidal tanecik üzerindeki yük, çözeltideki iyonik türlerin ve çözücünün pH’sinin de"i imiyle ve yüzey aktif ajanlar n kullan lmas ile kontrol edilebilmektedir.
2.1.1. Elektriksel Çift Tabaka Teorisi
Elektriksel çift tabaka modeli, Stern taraf ndan Helmholtz ve Gouy-Chapman modellerinin birle tirilmesiyle ortaya konmu tur. Stern’e göre bu tabaka, yüklü bir kolloit ile onu saran iyonik çevre aras ndaki uzakl " ifade eder ve itici güçlerin bir kolloidin etraf nda nas l olu tu"unu aç klar. Bu yüzeydeki z t yüklü iyonlar n yüzey potansiyeli do"rusal olarak azal r. Elektriksel çift tabakan n d nda, yüzeyde saç lm iyonlardan olu an di"er bir tabaka vard r. Bu tabakada potansiyel azalmas do"rusal de"ildir fakat s f ra do"ru yakla maktad r [38]. Çözeltideki z t yüklü iyonlardan baz lar elektrostatik olarak adsorplanarak kolloit yüzeyinde bir tabaka olu tururlar ki, bu tabaka “Stern tabakas ” olarak bilinir. Hlave edilen iyonlar, z t yüklü iyonlar taraf ndan ba"lan rlar. Fakat yüklenmi kolloide yakla an z t yüklü di"er iyonlar, Stern tabakas arac l " yla itilirler. Stern tabakas ndaki söz konusu sabit çekme ve itmeler bir difüz tabaka olu umuna neden olur.
Difüz tabaka, kolloidi çevreleyen yük atmosferi olarak dü ünülebilir. Stern tabakas ndaki yüklenmi iyonlar ile difüz tabakadaki yük atmosferi “çift tabaka” olarak ifade edilir. Yük, tanecik yüzeyinde maksimumdur ve yüzeyden uzakla t kça azal r. Bu tabakan n kal nl " çözeltideki iyonlar n deri imine ve iyon tipine ba"l d r.
Oekil 2.1. Elektriksel çift tabaka
DLVO (Derjaguin, Landau, Verwey ve Overbeek) teorisi, yüklü kolloidal tanecikler aras ndaki kuvvet dengesini aç klayan klasik bir modeldir. Amirtharajah ve O’Melia (1990) DLVO modeli ve di"er çal malar yla kolloit kararl " üzerine elektrostatik teorinin tart lmas n sa"lam lard r.
Hki benzer yüklü kolloidal tanecikten biri di"erine yakla t " nda, difüz tabakalar etkile meye ba lar. Benzer yüklü kolloitler itme kuvvetlerinin olu umuna neden olur ve yakla m artt kça itici güç de o kadar fazla olur. Partiküllerin birle mesini engelleyen itici güç, van der Waals çekme kuvvetleri arac l " yla biraz zay flat l r. Van der Waals kuvvetleri ba" l olarak zay f çekimler olmas nedeniyle, tanecikler aras ndaki mesafenin artmas yla h zl bir ekilde azal r.
Elektrostatik itme ve van der Waals çekme kuvvetleri aras ndaki denge, baz kolloidal sistemlerdeki parçac klar n niçin birle ti"ini aç klamaktad r. Benzer yüklü taneciklerden biri di"erine yakla t " nda onlar ayr tutmak için, itici elektrostatik kuvvetler artar. Bununla birlikte, e"er bu enerji bariyerini geçmek için yeterince yak n olabilirlerse van de Waals çekme kuvveti daha bask n olur ve tanecikler birlikte kal rlar. “Brown hareketi” ad verilen, su molekülleri ile kolloidlerin sabit çarp malar n n neden oldu"u rastgele hareketler tanecikleri yak n olmaya zorlar ve birle me meydana gelebilir. Ancak, koagülan ve polimer ilavesi, tipik olarak tanecikler aras nda küçük enerji bariyerlerini azaltmak amac yla kullan l r.
2.1.2. Elektrokinetik Potansiyel
Difüz tabaka yüklü taneciklerin dinamik oldu"u, Stern tabakas ise kolloide s k bir ekilde ba"lanm bir tabaka olarak dü ünülür. Difüz tabakadaki gerilimin ölçümü Nerst potansiyeli olarak bilinir. Potansiyel, Stern tabakas nda maksimumdur ve difüz tabaka boyunca üstel olarak azal r. Zeta potansiyeli, kitle çözelti ile difüz tabaka aras ndaki gerilim fark n ifade eden ve kolloit yüzeyi için ölçülebilir elelektriksel potansiyeldir. Ayn zamanda elektrokinetik potansiyel olarak da adland r l r ve büyüklü"ünün bilinmesi önemlidir [39]. Zeta potansiyeli, kolloidal tanecikler aras ndaki itme kuvvetlerini ve taneciklerin bir araya gelmesini engelleyen uzakl " ifade eder.
Zeta potansiyeli, , a a" daki e itlik ile ifade edilir [39].
D q
4
= (2.1.1)
q: Stern tabakas n n elektriksel yükü : elektriksel çift tabakan n kal nl " D: s v n n dielektrik sabiti
Bir kolloidin zeta potansiyelinin uygunlu"u sistemin kararl l " n n da ba" l ölçüsüdür. DLVO teorisi, e"er kolloit içindeki taneciklerin yüzeyinde net yükten dolay ortaya ç kan elektrostatik itmeler, ayn tanecikler aras ndaki van der Waals etkile imlerinden çok daha büyükse, koloidal sistemin kararl kalabilece"ini vurgular. Tersi do"ru oldu"unda, sterik etki varl " nda/yoklu"unda ve van der Waals etkile imlerinin gücüne ba"l olarak, kolloidal tanecikler birlikte küme olu turur ve topaklan rlar. Mutlak zeta potansiyeli çok yüksek oldu"unda, tanecikler aras nda güçlü elektrostatik itmeler olur ve bu yüzden kolloit üzerinde van der Waals etkisi daha az olur.
Hlk olarak Marian Smoluchowski [39] elektrokinetik hareketlilikten, zeta potansiyelini hesaplamak için düzenli bir e itlik türetmi tir.
/
D
×
= (2.1.2)
Burada , elektroforetik hareketlilik D, s v n n dielektrik sabiti ve , s v n n viskozitesidir
Smoluchowski e itli"i hâlâ en çok kullan lan e itliktir. Bu e itlik, büyük kolloidal tanecikler ve yüksek iyonik iddet ile çok yüksek zeta potansiyeli olmad " durumlarda iyi sonuçlar verir.
2.2. Adsorpsiyon Teorisi
Say s z fiziksel, kimyasal ve biyolojik i lemler iki faz aras ndaki tabakada meydana gelmektedir. Biti ik fazlar ile kar la t r ld " nda, arayüzey ad verilen bu tabakada bir ak kan n deri imindeki de"i im adsorpsiyon olarak tan mlanmaktad r. Ak kan terimi yayg n olarak kat lar n s n r yüzeyi ile temas halindeki s v ya da gaz ifade etmek için kullan lmaktad r.
Adsorpsiyon ile ilgili ilk deneysel gözlemler 1773’te Scheele ve 1777’de Fontana taraf ndan, kömür ve killer arac l " yla baca gazlar üzerinde yap lan baz deneyler ile ortaya konmu tur [40].
Gerçek bir adsorpsiyon sistemi, kitle faz ve arayüz tabakas ile temas halindeki adsorplanacak maddeyi kapsayan bir denge olarak tan mlanabilir. Bu tabaka, kat yüzey tabakas ile kat yüzeyinin kuvvet alan nda mevcut olan ak kan k s m olmak üzere iki bölgeden olu ur. Adsorpsiyon terimi arayüz tabakas nda moleküllerin birikmesini ifade ederken, desorpsiyon bu i lemin tersidir. Adsorpsiyon histerisisi; adsorpsiyon ve desorpsiyon e"rilerinin birinin di"erinden ayr ld " olaylar için ifade edilir. Böyle bir durumda, izoterm bir histerisis halkas na sahip olur ve adsorpsiyon sisteminin ekli de"i ir. Histerisis döngüsü, ço"unlukla kapiler kondansasyonun meydana geldi"i mezogözenekli kat larla ilgilidir. Adsorplanan madde “adsorbat”, adsorplanma olmadan önceki kitle ak kan faz “adsorptif” olarak tan mlan r. Kitle kat faz içine adsorbat moleküllerinin girmesi “absorpsiyon” olarak belirtilir. “Sorbent”, “sorbat” ve “sorptif” terimleri ile birlikte “sorpsiyon” terimi e zamanl meydana gelen ya da seçiçi olmayan hem adsorpsiyon hem de absorpsiyonu anlatmada kullan lmaktad r.
Adsorpsiyon terimi Du Bois-Reymond taraf ndan önerilmi olmas na ra"men ilk kez Kayser taraf ndan literatüre geçmi tir [41]. Daha sonra yap lan birçok çal ma sonucunda, sabit s cakl kta adsorpsiyon ölçüm sonuçlar n aç klamak için “izoterm” ve “izoterm e"risi” terimlerinin kullan lmas gerekti"i ortaya ç km t r.
Adsorpsiyon, van der Waals etkile imleri (fiziksel adsorpsiyon veya fizisorpsiyon) ya da kimyasal bir i lem özelli"ine sahip (kimyasal adsorpsiyon veya kemisorpsiyon) iki farkl mekanizma arac l " yla gerçekle ebilir. Fiziksel adsorpsiyonun aksine kimyasal adsorpsiyon, yaln zca tek tabakal olarak meydana gelir [41]. Fiziksel adsorpsiyon, kondansasyon ile adsorplama i lemine benzetilebilir ve adsorplanan moleküllerin kritik s cakl " na yak n ya da dü ük bir s cakl kta meydana gelen tersinir bir i lemdir.
Gerçek bir adsorpsiyon sisteminde, ortamda nötral ya da iyonik türlerin varl " na ra"men kitle faz ile yüzey tabakas aras nda denge kurulabilmektedir. E"er bir veya birkaç türün adsorpsiyonu, e de"er miktarda iyonik türlerin e zamanl desorpsiyonu ile birlikte gerçekle iyorsa bu olaya “iyon de"i imi” ad verilmektedir [40].
Büyük endüstriyel uygulamalarda kullan lan kat adsorbanlar n pek ço"u, farkl boyut ve ekle sahip gözeneklerden olu mu karma k yap ya sahiptir. Gözenekler yar k
ekle sahip ise “geni lik”, silindirik ekle sahip ise “yar çap” terimi daha s k kullan l r. Adsorpsiyon biliminde s kça kullan lan toplam gözeneklilik terimi genellikle üç grupta s n fland r l r. IUPAC tavsiye karar na göre [42]; 2 nm ve alt ndaki geni likteki gözenekler mikrogözenek, 2 ve 50 nm aras nda geni li"e sahip gözeneklere mezogözenek ve 50 nm’ den daha büyük geni li"e sahip gözenekler ise makrogözenekler olarak tan mlanm t r. Son y llarda “nanogözenek” deyimi hem mikro- hem de mezo- gözene"i içine alacak ekilde kullan lmaktad r.
Adsorpsiyon olay nda, gözeneklerin önemi büyük ölçüde boyutlar na ba"l d r. Mikrogözeneklerin boyutu adsorbat molekülleri ile kar la t r labilir oldu"undan, adsorban n tüm atom ya da molekülleri adsorbat türleri ile etkile ebilir. Bu durum, mikrogözeneklerdeki adsorpsiyon ile mezo- veya makro- gözenek gibi daha büyük gözeneklerdeki adsorpsiyon aras ndaki temel farkt r. Ayr ca, mikrogözeneklerdeki adsorpsiyon gözenek dolgu i lemidir ve gözeneklerin hacmi adsorpsiyon olay n kontrol eden temel faktörüdür [41]. Böylece mikrogözenekleri karakterize eden esas parametre, gözeneklerin karakteristik boyutlar ve genellikle birim adsorban kütlesine dayanan hacimleridir. Bu özellik, mikrogözenek da" l m fonksiyonu arac l " yla dü ük deri imlerdeki adsorpsiyon verilerinin büyük ölçüde de"erlendirilmesini ifade etmektedir [42]. Genel olarak kabul edilen adsorpsiyon e itli"inden mikrogözenekli adsorban n özgül yüzey alan n n hesaplanmas yaln zca biçimsel bir özelliktir.
Çok say da atom ya da moleküller arac l " yla meydana gelmi duvarlara sahip mezogözenekli adsorbanlarda, fazlararas s n r yani adsorpsiyon yüzey alan , farkl fiziksel bir anlama sahiptir. Makrogözeneklerde adsorpsiyon güçlerinin etkisi her yerde bulunmamakla birlikte gözenek duvarlar aras ndaki mesafe yak nd r. Bu nedenle tek ve çok tabakal adsorpsiyon, mezogözenekli yüzeylerde ba ar l bir ekilde meydana gelir ve adsorpsiyon adsorbat moleküllerinin kapiler kondansasyonu mekanizmas na göre ilerler [40]. Bu yüzden, mezogözenekleri karakterize eden temel parametreler; özgül yüzey alan , gözenek hacmi ve gözenek-boyut ya da gözenek-hacim da" l m d r.
Mezogözenekler makrogözenekler gibi, adsorbat moleküllerinin mikrogözenek hacimden içeri transferinde önemli bir rol de oynar.
Özgül yüzey alan oldukça küçük olan makrogözenekli yüzeydeki adsorpsiyon mekanizmas gözeneksiz yüzeylerdekinden farkl de"ildir. Makrogözeneklerde kapiler kondansasyon meydana gelmedi"i için bu yüzeydeki adsorpsiyon genellikle ihmal edilebilmektedir.
Adsorpsiyon ve mekanizmas hakk ndaki temel kaynak adsorpsiyon s s [43] ve adsorpsiyon izotermidir. Gerçekte bir adsorpsiyon sisteminin integral özelli"i olan adsorpsiyon izoterminden türetilen tüm bilgiler yaln zca adsorban ve adsorbat ile ilgilidir.
Adsorpsiyon biliminde temel kavram, “adsorpsiyon izotermi”dir. Adsorpsiyon izotermi, sabit s cakl kta kitle ak kan faz ndaki adsorban miktar ile bas nç ve/veya deri im aras ndaki denge e itli"idir. Adsorpsiyon izoterminin, adsorpsiyon olay ndaki öncelikli bilgi kayna" oldu"u söylenebilir.
Gaz ya da buharlar n fiziksel adsorpsiyonu temeline dayanan izoterm e itlikleri; endüstriyel adsorbanlar n özgül yüzey alan , gözenek boyut ve enerji da" l m , gözenek hacmi gibi çok önemli adsorban özelliklerinin belirlenmesini sa"lar. Böyle çok spesifik e"riler, adsorban ve adsorbat molekülleri aras ndaki etkile imlere ba"l olan adsorpsiyon mekanizmas hakk nda bilgi edinilmesini sa"lar. Ayr ca endüstriyel adsorbanlar n, kullan m alanlar ndan olan ay rma ve safla t rma yöntemlerinde veriminin hesaplanmas n sa"lamaktad r.
2.2.1. Adsorpsiyon Tipleri
Adsorpsiyon iki farkl mekanizmayla gerçekle ebilmektedir. Yüzey ile adsorbat molekülleri aras ndaki etkile imler, molekülleraras van der Waals etkile imleri türünden olabilir. Genellikle s v larda bulunan bu kuvvetler, molekül dipolleri aras ndaki elektrostatik etkile imleri ve hidrojen ba"lar n içerir. Bu durumda etkile im tamamen fizikseldir ve hiçbir kimyasal de"i im söz konusu olmad " için fiziksel adsorpsiyon ya da “fizisorpsiyon” olarak adland r l r. Adsorpsiyon, adsorban n yüzey atomlar nda bulunan serbest valens bandlar ile adsorbat moleküllerinin etkile imleri vas tas yla, kimyasal ba"lar n ayr lmas ve olu umu eklinde gerçekle ebilir. Bu tür bir prosese ise “kimyasal adsorpsiyon” ya da “Kemisorpsiyon” ad verilmektedir [40].
Fiziksel ve kimyasal adsorpsiyonun ay rt edici en önemli özellikleri a a" daki gibi özetlenebilir:
• Kimyasal adsorpsiyon adsorban ve adsorbat n reaktifli"ine ba"l iken, fiziksel adsorpsiyon dü ük derecede seçiçili"e sahip genel bir olayd r.
• Kimyasal adsorpsiyonda moleküller yüzeyin reaktif k s mlar na ba"lan r ve tek tabakal d r. Yüksek ba" l bas nçlarda, fiziksel adsorpsiyon genellikle çok tabakal olarak meydana gelir.
• Fiziksel olarak adsorplanan molekül kimli"ini korur ve desorpsiyonla orijinal formlar na ve s v faza geri döner. Kimyasal adsorplanan molekül tepkimeye veya ayr maya u"ruyor ise yap s de"i ir ve desorpsiyon ile geri kazan lamaz.
• Kimyasal adsorpsiyonun enerjisi kimyasal tepkimeler ile kar la t r ld " nda ayn derecede enerji de"i imine sahiptir. Fiziksel adsorpsiyon daima eksotermiktir, fakat içerdi"i enerji genellikle adsorbat n kondansasyon enerjisinden büyük de"ildir. Bununla birlikte, fiziksel adsorpsiyon çok dar gözeneklerde meydana geldi"inden aç "a ç kan enerji de yüksektir.
• Aktivasyon enerjisi kimyasal adsorpsiyon için ço"u kez gereklidir. Dü ük s cakl kta sistem, termodinamik dengeye eri mek için yeterli enerjiye sahip olmayabilir. Fiziksel adsorpsiyonda ise sistemler genellikle h zl bir ekilde dengeye ula r. Fakat h z belirleyen basamak dengeye yava ula labilir.
Oekil 2.2. Adsorpsiyon potansiyel e"rileri [47]
( Hk: kimyasal adsorpsiyondaki entalpi de"i imini ve Hf: fiziksel adsorpsiyondaki) entalpi de"i imi
Hem fiziksel adsorpsiyon hem de kimyasal adsorpsiyon için adsorban yüzeyinden uzakl k ile adsorbat n potansiyel enerji da" l m n Oekil 2.2’de görülmektedir. Adsorbat n yüzeyden uzakla mas yla potansiyel enerji s f ra yakla maktad r. Kimyasal adsorpsiyonda, adsorbat adsorban n yüzeyine fiziksel adsorpsiyondakinden daha yak nd r. Kimyasal adsorpsiyondan geçi hali, fiziksel ve kimyasal adsorpsiyon e"rilerinin kesi ti"i nokta (Ec) olup, bu kimyasal adsorpsiyon için aktivasyon enerjisidir. Kimyasal adsorpsiyon fiziksel adsorpsiyon gibi ba lar, bu yüzden adsorbat minimum enerji ile yüzeye yakla abilir [43].
2.2.2. Adsorpsiyon zotermleri
Kat yüzeyi bir ak kan ile kar kar ya geldi"inde, kat n n yüzeyine çarpan ak kan moleküllerinin baz lar yap arak adsorplan rken baz lar çarp p geri dönerler. Ba lang ç olarak yüzey tamamen aç k oldu"undan adsorpsiyon h z çok yüksektir. Adsorbat molekülleri kat yüzeyini gittikçe artan oranda kaplayaca" ndan, adsorpsiyon h z azalarak devam eder. Bununla birlikte, desorpsiyon h z artar. Dengeye ula ana kadar desorpsiyon h z artarken, adsorpsiyon h z azalmaya devam eder ve dengede, adsorpsiyon h z desorpsiyon h z na e it olur. Bu dinamik bir dengedir çünkü yüzeye yap an moleküllerin say s yüzeyden ayr lan moleküllerin say s na e ittir.
Bir adsorban-adsorbat sisteminde dengede adsorplanan miktar, adsorpsiyon s cakl " ve gaz bas nc na ba"l iken adsorpsiyon dengesi sabit s cakl kta adsorpsiyon izotermi olarak ve sabit bas nçta adsorpsiyon izosteri"i olarak ifade edilmektedir. Gerçek bir uygulamada sabit s cakl kta adsorpsiyonun belirlenmesi oldukça kolayd r. Adsorpsiyon izotermi, adsorpsiyon sisteminin denge halini ifade etmek için kullan lan yayg n bir metottur. Adsorpsiyon izotermleri adsorbat, adsorban ve adsorpsiyon prosesi hakk nda yararl bilgiler verir. Adsorban n yüzey alan n n, gözenek hacminin ve gözenek boyut da" l m n n belirlenmesine yard mc olur. Adsorpsiyon entalpisinin büyüklü"ü ve seçilen standartlara göre bir adsorbanda buhar ya da gaz n ba" l adsorplanabilirli"i hakk nda önemli bilgiler sa"lar [44,45].
2.2.2.1. Adsorpsiyon zoterm Tipleri
Gaz-kat dengesi için adsorpsiyon yorumlamal adsorpsiyon izotermleri için ilk sistematik s n fland rma 1940’ta Brunauer, Deming, Deming ve Teller[47] taraf ndan ortaya konulmu tur. Bu izotermler adsorban tipi, adsorbat tipi, gaz ve kat yüzeyi aras ndaki molekülleraras etkile imlere ba"l olarak çok farkl ekillere sahip olabilir.
Hzotermleri be tipe ay ran BDDT s n fland rmas modern IUPAC adsorpsiyon izotermleri s n fland rmas n n da çekirde"ini olu turmaktad r [46]. Ayr ca IUPAC s n fland rmas yaln zca kritik s cakl " n alt ndaki s cakl klarda adsorpsiyonu dikkate almaktad r. BDDT izotermleri ve ilave izoterm tipi Sing taraf ndan daha sonra olu turulmu tur. IUPAC s n fland rmas n tamamlayan bu izoterm Oekil 2.3’te gösterilmektedir. Tip I izotermleri, mikrogözenekli adsorbanlar karakterize eder. Tip II ve tip III adsorban-adsorbat güçlü ve zay f etkile imler ile makrogözenekli adsorbanlarda adsorpsiyonu aç klar. Tip IV ve Tip V histerisize sahip adsorpsiyon
izotermlerini aç klar. Tip VI izotermi ise basamaklara sahiptir. Ancak BDDT ve IUPAC s n fland rmas nda adsorpsiyon izotermleri daima bas nc n monotonik fonksiyonu olarak verilmektedir [45].
Deneysel yoldan belirlenen adsorpsiyon izotermleri ekilde ematik olarak gösterilen 6 tip izoterm e"risinden birine daha çok benzemektedir. Daha çok buhar faz ndan adsorpsiyon uygulamalar için çizilen bu izotermlerin baz lar çözeltiden adsorpsiyon için de geçerlidir. Oekildeki p/po ba" l denge bas nc n , c/coise ba" l denge deri imini göstermektedir. Buradaki podoygun buhar bas nc n coise doygun çözeltinin deri imini göstermektedir. Ayn izotermler p/po yerine p denge bas nc n ve c/co yerine de c denge deri imi al narak da çizilebilir. Oekildeki p/po=1 ya da c/co=1 de"erlerinde adsorplanan madde y " n olarak ayr ld " ndan izoterm e"rileri dikey olarak yükselmeye ba lamaktad r. Bu dikey yükselme noktas na gelindi"inde adsorpsiyon tamamlanm demektir [47].
Tip I zotermi: Monomoleküler yani tek tabakal olan kimyasal adsorpsiyon
izotermi k ve n e"rilerine benzemektedir. Di"er taraftan, mikrogözenekli kat lardaki adsorpsiyon izotermi k e"risine, makrogözenekli kat lardaki adsorpsiyon izotermi ise n e"risine yak nd r. Adsorplama gücü yüksek olan mikrogözeneklerin yüzeyleri monomoleküler olarak kapland " nda, gözenekler tümüyle doldu"undan adsorpsiyon tamamlanm olacakt r. Di"er taraftan, adsorplama gücü dü ük olan makrogözeneklerin gözenekleri monomoleküler olarak kapland " nda adsorpsiyon yine tamamlanm olacakt r. Bu nedenle, mikro- ve makro- gözenekli kat lardaki adsorpsiyon izotermleri, aralar ndaki yükseklik fark d nda eklen birbirine benzemektedir. Çözeltiden adsorpsiyon izotermleri k, n ve m e"rilerinden birine yak n olarak ortaya ç kmaktad r.
Tip II zotermi: Birinci tabakan n adsorpsiyon s s yo"unla ma s s ndan daha
büyük olan ve k lcal yo"unla man n az oldu"u adsorpsiyon izotermleri tip II izoterm e"rilerine benzemektedir. Hzotermin “ab” parças boyunca tek tabakal adsorpsiyon, “bc” parças boyunca ise çok tabal adsorpsiyon ve k lcal yo"unla ma gerçekle mektedir. Hzotermin b noktas ndan sonraki do"rusal k sm n n uzant s ndan “nm” tek tabaka kapasitesi grafikten yakla k olarak okunabilir. Doygunluk noktas na gelindi"inden dolay “ef” boyunca adsorplanan madde s v ya da kat olarak y " n halde ayr l r.
Tip III zotermi: Birinci tabakan n adsorpsiyon s s yo"unla ma s s ndan daha
küçük olan ve k lcal yo"unla man n az oldu"u adsorpsiyon izotermleri bu e"riye benzemektedir. Adsorplama gücü en dü ük olan kat lardaki adsorpsiyon izotermleri bu tipe uymaktad r. E"rinin gidi inden tek tabaka kapasitesini bulmak mümkün de"ildir.
Tip IV zotermi: Birinci tabakan n adsorpsiyon s s yo"unla ma s s ndan daha
büyük olan ve k lcal yo"unla man n çok oldu"u adsorpsiyon izotermleri bu e"riye benzemektedir. Oekilde görüldü"ü gibi adsorpsiyon ve desorpsiyon izotermlerinin farkl yollar izlemesine adsorpsiyon histerisizi denir. Bu durum dar a" zlardan dolan gözeneklerin geni a" zlardan bo almas yla aç klanabilir. Hzotermin “ab” parças boyunca tek tabakal adsorpsiyon, “bc” parças boyunca çok tabakal adsorpsiyon, “cd” parças boyunca ise k lcal yo"unla ma olmaktad r. K lcal yo"unla ma tamamland ktan sonra gözeneklerin a" zlar ndaki çukur yüzeyler “de” parças boyunca dolmakta ve “ef” boyunca adsorplanan madde y " n olarak ayr lmaktad r. Genellikle mikro- ve mezo- gözenek içeren kat lardaki adsorpsiyon izotermleri bu tipe uymaktad r. Bu izotermden de “nm” tek tabaka kapasitesi yakla k olarak bulunmaktad r.
Tip V zotermi: Birinci tabakan n adsorpsiyon s s yo"unla ma s s ndan daha
küçük olan ve k lcal yo"unla man n çok oldu"u adsorpsiyon izotermleri bu e"riye benzemektedir. Hzotermin “ac” parças boyunca yüzey tek tabakal ya da çok tabakal kapland ktan sonra “cd” boyunca k lcal yo"unla ma olmaktad r. Adsorplanma gücü dü ük olan mezogözenekli kat lardaki adsorpsiyon izotermleri bu tipe benzemektedir.
Tip VI zotermi: Basamakl olan bu izoterm tipine çok az rastlanmaktad r.
Mikrogözenekler yan nda farkl boyutlarda mezogözenek gruplar içeren kat lardaki adsorpsiyon izotermleri bu tipe benzemektedir.
Oekil 2.3. BET adsorpsiyon izoterm tipleri [47]
2.2.2.2. S v Fazdan Adsorpsiyon zoterm Tipleri
1960–1962 y llar nda Giles ve arkada lar taraf ndan, s v faz adsorpsiyon izoterm tipleri; izoterm e"rilerinin ba lang çtaki bükülmelerini esas alarak S, L, H, C ve alt bölümleri olmak üzere dört farkl kategoride s n fland r lm t r. Bu s n fland rmada, S tipi izotermler konveks, L tipi izotermler ise konkav yap da olup, BET gaz adsorpsiyon izoterm s n fland rmas ndaki tip III ve tip I izotermlerine kar l k gelmektedir. H ve C tipi izotermlerde, adsorban tercihli bir adsorpsiyon göstermekte olup, H-tipi izotermler dü ük deri imlerde basamakl iken, C tipi izotermler dar bir adsorpsiyon aral " nda do"rusall k göstermektedir [48].
Gaz faz ndan adsorpsiyon izotermleri bas nç yerine deri im kullan lmas yla s v faz adsorpsiyon izotermleri olarak da uygulanabilmektedir.
Gaz faz ndaki adsorpsiyonun aksine, s v fazdaki adsorbat n yo"unlu"u sabittir. Çözelti deri imi sabit olmak üzere, s v fazdan tek bile en adsorpsiyon sistemlerinin deneysel verileri Oekil 2.4’ deki e"rilerden birine uymaktad r [48].
2.2.3. Adsorpsiyon zoterm Denklemleri 2.2.3.1. Langmuir Denklemi
Irving Langmuir 1916’ da, kat üzerinde adsorplanan gazlar için kendi ismi ile an lan yeni bir adsorpsiyon izotermini ileri sürmü tür [49]. Bu denklem kinetik yakla mlardan türetilmi olup, dört hipoteze dayanan deneysel bir izotermdir. Langmuir denklemi,
• Adsorban yüzeyi ayn tiptedir yani, tüm adsorpsiyon aktif merkezleri enerjisel olarak e ittir
• Adsorplanan moleküller birbirleri ile etkile mezler
• Tüm adsorpsiyon ayn mekanizma arac l " yla meydana gelir
• Maksimum adsorpsiyonda, yaln zca tek tabaka olu ur ve adsorbat molekülleri di"erlerinin üzerinde birikmeyerek sadece adsorban n serbest yüzeyinde adsorplan rlar.
eklinde tan mlanan dört hipoteze dayal deneysel bir izotermdir. Bu dört hipotez nadiren do"rudur. Çünkü yüzeyde daima birtak m kusurlar vard r ve adsorplanan moleküller inert de"ildir. Adsorpsiyon mekanizman n çok h zl moleküller için de ayn oldu"u aç k de"ildir. Dördüncü ko ul en s k nt l olan d r, çünkü pek çok molekül ço"u zaman tek tabakada adsorplanmaktad r. Ancak daha sonra bu problem, BET izotermi arac l " yla çözülmü tür.
Langmuir, “A” gaz molekülü ve “S” adsorpsiyon merkezi olmak üzere, adsorpsiyonun a a" da gösterilen mekanizma arac l " yla meydana geldi"ini önermektedir.
A(g) + S AS
Bu mekanizmaya göre ileri ve geri reaksiyon h z sabitleri k1ve k-1 olup, dengede kaplanan adsorpsiyon sitelerinin oran olan örtülü yüzey kesri ( ) e itlik 2.2.1’deki gibi tan mlanmaktad r.
(
)
P k k K = = 1 1 1 ya da KP KP + = 1 (2.2.1)Çok dü ük bas nçlar için KP ve yüksek bas nçlar için 1 dir. de"erinin deneysel olarak belirlenmesi zordur. Çünkü adsorbat genellikle bir gazd r ve
adsorplanan madde miktar , standart s cakl k ve bas nçta (STP) birim gram adsorban hacmi ile ifade edilmektedir. Bu yüzden, tek tabaka olu umu için gerekli adsorbat, STP hacmine göre Vm eklinde kullan l rsa,
m
V v
= (2.2.2)
denklemi ile ifade edilir. 2.2.2 e ili"inin e itlik 2.2.1’de kullan l p do"rusalla t r lmas yla, e itlik 2.2.3 elde edilir.
m m P V KV V 1 1 1 1 = + (2.2.3) Sabit s cakl kta her bir adsorban/adsorbat çifti için, 1/P–1/V grafi"i e"im ve kaymas ndan Vm ve K elde edilir. Vm, adsorpsiyon aktif merkez say s yla ba"lant l d r. E"er, adsorpsiyon aktif merkez say s , kat n n tüm yüzeyinin adsorbat moleküllerinin kesitine bölünmesi olarak kabul edilirse adsorban n yüzey alan kolayl kla hesaplanabilir. Adsorban n yüzey alan , adsorban n yap s na ba"l olup, daha fazla gözene"e sahip adsorbanlar daha büyük yüzey alan na sahiptir. Büyük yüzey alan , yüzey reaksiyonlar nda büyük bir etkiye neden olmaktad r.
“i” adsorplanan gazlardan her biri olmak üzere, yüzeyde birden fazla gaz adsorplan rsa bo aktif merkezlerinin kesri olup,
= + = n i i i E P K 1 1 1 (2.2.4) ve = + = n i i i i i J P K P K 1 1 (2.2.5)
e itlikleri ile ifade edilir.
Çözeltiden adsorpsiyon sistemleri için Langmuir e itli"i;
e L e L e C a C K q + = 1 (2.2.6)
ile ifade edilmektedir. Denklemin do"rusalla t r lm hali;
e L L L e e C K a K q C = 1 + (2.2.7)
eklini al r. Maksimum adsorpsiyon kapasitesi qe ve denge adsorbat deri imi Ce olmak üzere; Ce/qe-Ce grafi"inin e"im ve kaymas ndan KL ve aL Langmuir sabitleri hesaplanabilmektedir. Kuramsal tek tabaka kapasitesi qo, say sal olarak “KL/aL” de"erine e it kabul edilmektedir.
2.2.3.2. BET Denklemi
BET teorisi 1938’ de Stephen Brunauer, Paul Hugh Emmett ve Edward Teller taraf ndan kat yüzeyinde gaz moleküllerinin fiziksel adsorpsiyonu için türetilmi bir denklemdir [40,50].
Moleküllerin genellikle çok tabakal eklinde adsorpland " bilinmektedir. Yani gaz molekülerinin ço"u, adsorplanm moleküller üzerine adsorplan r ve bu durumda Langmuir izotermi geçerli de"ildir. BET teorisinde, fiziksel adsorpsiyon için önerilen mekanizma:
A(g) + S AS A(g) +AS A2S A(g) + A2S A3S …..
eklindedir. Teori, tek tabakal adsorpsiyon için geçerli olan Langmuir teorisinin geni letilmi bir halidir. Çok tabakal adsorpsiyon için öne sürülen hipotezler;
• Gaz molekülleri bir kat da tabakalar içine fiziksel olarak adsorplan r,
• Her bir adsorpsiyon tabakas aras nda hiçbir etkile im yoktur,
• Langmuir teorisi her bir tabakaya uygulanabilir, eklindedir. Bu hipotezlere dayanarak BET e itli"i,
(
)
[
]
P V c P c V c P P V o m o m 1 1 1 / 1 = + (2.2.8)P ve Po, adsorpsiyon s cakl " nda, adsorbat n denge ve doygunluk bas nc n , V adsorplanan gaz miktar n ve Vm tek tabakada adsorplanan gaz hacmini ifade etmektedir. C sabiti, = RT E E L e c 1 (2.2.9)
![Tablo 4.2. Aktif karbonun FTIR spektrumunda gözlenen pikler [76]](https://thumb-eu.123doks.com/thumbv2/9libnet/2799762.911/88.892.136.797.853.1109/tablo-aktif-karbonun-ftir-spektrumunda-gozlenen-pikler.webp)