T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ RADYASYON ONKOLOJİSİ ANABİLİM DALI
TÜM BEYİN RADYOTERAPİSİ ALAN HASTALARIN VMAT TEKNİĞİ İLE HİPOKAMPUS KORUMALI VE KORUMASIZ OLARAK YENİDEN
PLANLANARAK DOZ VOLÜM DAĞILIMLARININ KARŞILAŞTIRILMASI
Tıpta Uzmanlık Tezi
Dr. Özge DURAN
DANIŞMAN
Prof. Dr. Yavuz ANACAK
İZMİR 2017
Önsöz
Bu tezi hazırlarken fiziken ve kalben her zaman yanımda olan hayat arkadaşım Umut Hoşkan’a, uzakta olsalar dahi varlıklarını hep en derinde hissettiren en kıymetlilerim canım aileme sonsuz sevgi ve minnetlerimle.
Bir parçası olmaktan her zaman gurur duyduğum ve duyacağım Ege Üniversitesi Tıp Fakültesi Radyasyon Onkolojisi ailesinde geçen asistanlık hayatım boyunca, bilgi ve tecrübelerinin yanında sevgilerini de hiç esirgemeyen saygıdeğer hocalarıma, tez danışmanım olan ve bu süreçte her zaman yardım eden Prof. Dr. Yavuz ANACAK’a, tezimin fizik planlama kısmında yanımda olan Öğr. Gör. Sinan HOCA’ya, beraber çalıştığımız tüm uzmanlarıma ve asistan arkadaşlarıma sonsuz teşekkürler.
Özet
TÜM BEYİN RADYOTERAPİSİ ALAN HASTALARIN
VMAT TEKNİĞİ İLE HİPOKAMPUS KORUMALI VE KORUMASIZ OLARAK YENİDEN PLANLANARAK DOZ VOLÜM DAĞILIMLARININ
KARŞILAŞTIRILMASI
Amaç
Tüm beyin radyoterapisi endikasyonu olan hastalarda hipokampus korunarak yapılan VMAT tedavi planlarının, hedef organ ve riskli organ dozları açısından uygulanabilir olup olmadığının araştırılmasıdır.
Gereç ve Yöntem
Ege Üniversitesi Tıp Fakültesi (EÜTF) Radyasyon Onkolojisi Anabilim Dalı’ nda Ocak - Mart 2017 tarihleri aralığında çeşitli tanılarla kranyal RT uygulanan 10 olgu çalışmamız için incelenmiştir. Hastaların kranyal simülasyon BT’leri kullanılarak, hipokampus korumalı ve hipokampus korumasız olarak 2 farklı tedavi tekniği ile tüm beyin radyoterapisi planı yapılmıştır. Hastaların simülasyon BT’leri MR’ları ile füzyon edilmiştir. Tüm beyin hedef hacim olarak; sağ ve sol optik sinir, kiazma, sağ ve sol lens, sağ ve sol orbita ve hipokampus riskli organlar olarak konturlanmıştır. Hipokampus konturlaması T1 ağırlıklı kontrastlı MR sekanslarında ‘’Hippocampal Contouring: A Contouring Atlas for RTOG 0933’’ rehberliğinde yapılmıştır. Hipokampus’e 5 mm marj verilerek ‘’Hippocampal Avoidance Zone’’ (HA zone) oluşturulmuştur. Hipokampus korumasız TBRT planından farklı olarak, HK TBRT planında, hedef beyin hacmi, tüm beyin hacminden HA zone hacmi çıkarılarak hesaplanmıştır. HK TBRT planı için “Volumetric modulated Ark Therapy (VMAT)” tekniği, hipokampus koruması olmayan TBRT için karşılıklı 2 yan saha konformal teknik kullanılmıştır. Her iki yöntemde de 10 x 3 Gy (30 Gy) RT dozu hedef beyin hacmine planlanmıştır. Hedef ve orbita ve lens dışı kritik organlar için, RTOG 0933 çalışmasının hipokampus korumalı TBRT için belirlediği kabul edilebilir doz
sınırlamaları, orbita ve lens dozları için ise RTOG 0615 ve RTOG 0539 çalışmaları kriter olarak alınmıştır. Ayrıca homojenite indeks (HI) de her iki planlama da hesaplanmıştır. Ölçümler sonucunda elde edilen verilerin analizi SPSS 18.0 istatistik programı kullanılarak paired sample t test signed rank testi kullanılarak yapılmıştır. İstatistiksel değerlendirmede p< 0.05 anlamlı kabul edilmiştir.
Bulgular
Her iki planın verileri incelendiğinde, sağ ve sol optik sinir, kiazma, sağ ve sol orbita dozlarının kritik doz sınırlarını aşmadığı görülmüştür. Lens dozları ise HK TBRT’ de ortalama 8 Gy ile sınırlamanın biraz üstündedir. Hipokampus korumasız planda lens ve kiazma dozları HK TBRT planına göre anlamlı olarak düşükken, orbita dozları için bu durum HK TBRT planı lehinedir (p<0.01). Hipokampus korumalı planda hesaplanan ortalama hipokampus Dmaks ve Dmin dozları, 14.2 Gy ve 8.7 Gy
olarak bulunmuştur ve sırasıyla hedefimiz olan 17 Gy ve 10 Gy’ in altındadır. Hipokampus Dort ise 10.4 Gy bulunmuştur. Hipokampus BEDgeç etki ve EQD2 dozları,
korumasız plana göre %80 azaltılmıştır. Hipokampus koruması yapılmayan planda ortalama homojenite indeksi (HI) 0,08; hipokampus korumalı planda ise 0,21 olarak hesaplanmıştır. Fark hipokampus korumasız plan lehine anlamlı bulunmuştur (p<0.01). PTV Beyin D2%, D98% ve V30Gy, hipokampus korumasız planda anlamlı
olarak daha iyi olmakla birlikte, V30Gy dışındaki hedef hacim doz parametreleri HK
TBRT ile sağlanabilmiştir. Ortalama hipokampus hacmi 3.1 cm3’ tür.
Sonuç
Çalışmamızda, hipokampus dozlarımızın, hipokampus korumalı TBRT için kabul edilen doz parametrelerini sağladığı görülmüştür. Bunun yanında lens dışında kritik organ doz hedeflerimizin hepsine sadık kalınmış, hedef hacim doz ve homojenitesinden büyük ölçüde ödün verilmemiştir. Sonuç olarak mevcut durumda, HK TBRT’ nin günlük pratikte uygulanabilirliği teyit edilmiştir.
Abstract
REPLANNING OF THE PATIENTS WHO RECEIVED WHOLE BRAIN RADIOTHERAPY WITH HIPPOCAMPAL SPARING USING VMAT
TECHNIQUE OR WITHOUT HIPPOCAMPAL SPARING AND COMPARISON OF THE DOSE VOLUME DISTRIBUTIONS
Purpose
To evaluate the feasibility of hippocampal sparing whole brain radiotherapy using VMAT technique in terms of target volume and organ at risk doses.
Materials and Method:
10 anonymous patients received whole brain radiotherapy at Ege University Faculty of Medicine Department of Radiation Oncology from January to March 2017 were replanned. Using the CT simulation scan images, two treatment plans with or without hippocampal sparing were generated. All patients had their CT simulation images fused with axial MRI scans. While whole brain was contoured as target organ, optic nerves, chiasm, lenses, orbits and hippocampus were contoured as organ at risk.The hippocampus was contoured on T1-weighted MRI axial sequences following the ‘’Hippocampal Contouring: A Contouring Atlas for RTOG 0933’’. The ‘’Hippocampal Avoidance Zone’’ was generated by expanding the hippocampal contour by 5mm. Differently from without hippocampal sparing plan, whole brain planning target volume defined as the whole brain volume excluding the hippocampal avoidance region volume. VMAT technique was used for HA-WBRT plans and two lateral parallel opposed fields with conformal technique for non HA-WBRT. For both modalities 30 Gy in 10 fractions RT dose was prescribed for whole brain PTV. For treatment plans qualifying we used RTOG 0933 HA WBRT acceptable compliance criteria for target organ and organs at risk excepting orbit and lens and RTOG 0615 and RTOG 0539 for orbit and lens. In addition, the homogeneity index (HI) was calculated in both plans. Statistical comparisons between the two modalities treatment
plans were performed using in SPSS software, version 18.0 using paired sample t test signed rank and an upper bound of p< 0.05.
Results
When analyzing the data, for both two modalities plans, we detected that optic nerves, chiasm and orbits’ doses didn’t exceed dose constraints. In HA-WBRT plans, lens dose is slightly above the limit with 8 Gy. While non HA-WBRT plan was adventageous regarding chiasm and lens doses, HA-WBRT was more adventageous regarding orbit dose (p<0.01). In HA-WBRT plans, hippocampus Dmax and Dmin are
14.2 Gy and 8.7 Gy, respectively and these doses are within the protocol criteria of 17 Gy and 10 Gy. Hippocampus Dmean is 10.4 Gy in HA-WBRT plans. Among two
modalities, Hipokampus BEDlate effects and EQD2 is reduced by %80 with VMAT
technique. In non HA-WBRT plans, mean HI of 0.08 compared to 0.21 for HA-WBRT was found and the difference was statistically significant (p<0.001). In terms of PTV whole brain D2%, D98% and V30Gy among two modalities, non HA-WBRT was superior
for all of the parameters and the difference was statistically significant. However with HA-WBRT modality, target volume parameters’ results were still within the protocol’s criteria except V30Gy. Average hippocampus volume was 3.1 cm3.
Conclusion
In our study, hippocampus doses seem to provide the dose compliance criteria for HA-WBRT. Besides, all of the organs at risk doses excepting lens, are within the dose constraints, with no significant compromise from the target volume dose and homogenity. As a result, the feasibility of HA-WBRT technique in daily routine has been confirmed.
Key words: radiotherapy, hippocampus, VMAT, neurocognitive side effects, WBRT
İçindekiler
Özet………..Ⅰ Abstract……….………….Ⅲ İçindekiler……….……….Ⅴ Tablolar ve Şekiller Dizini ………..Ⅶ Kısaltmalar………Ⅸ
1. Giriş ………1
2. Genel Bilgiler ……….2
2.1. Beyin Anatomisi………...2
2.1.1. Beynin Derin Yapıları ………3
2.1.2. Meninksler .………...4
2.1.3. Ventriküller ve Beyin Omurilik Sıvısı………...……...5
2.1.4. Beslenme………..…………..5
2.2. Hipokampus………..……...5
2.2.1. Hipokampus Anatomisi Ve Embriyolojisi ……….6
2.2.2. Hipokampüsün Dolaşımı ………...…………..8 2.2.3. Hipokampüsün Histolojisi ………...…9 2.2.4. Hipokampusun Bağlantıları ……….10 2.2.5. Hipokampusun Fizyolojisi……….12 2.2.6. Hipokampusun Fonksiyonları………...12 2.3. Nörogenez ve Nöroplastisite ………15
2.3.2. Nörogenez Araştırmalarında Kullanılan Belirteçler ….……….19
2.4. Kranyal Radyoterapi ……….…19
2.4.1. Kranyal RT Yan Etkileri ……….…….…….21
2.4.1.1. Akut Yan Etkiler ……….…………21
2.4.1.2. Subakut Yan Etkiler ……….………..22
2.4.1.3. Geç Yan Etkiler ……….…………..22
2.5. Nörokognitif Toksisite ……….………….24
2.6. Hipokampus Korumalı TBRT’ nin Preklinik ve Klinik Dayanağı…...25
2.7. Hipokampus Korumalı TBRT Fizibilite Çalışmaları……….…27
3. Gereç ve Yöntem ……….……….29
3.1. Olgu Seçim Kriterleri ……….…………..29
3.2. Çalışma Tasarımı ………..……30
3.2.1. Üç Boyutlu Bilgisayar Tomografi Simülasyon ………30
3.2.2. Konturlama ………30 3.2.3. Tedavi Planlama……….………….31 3.3. İstatistiki Analiz……….35 4. Bulgular………...35 5. Tartışma……….…………42 6. Sonuç ve Öneriler……….……….51 7. Kaynaklar ………...53 Ekler……….. 72
Ek-1: Etik Kurul Onayı………... 72
Tablolar ve Şekiller Dizini
Şekil 1-1: Beyin Kanserlerinin Yaşa Standardize İnsidans Hızlarının Cinsiyete Göre
2009-2013 Yılları Arasındaki Dağılımı………...……….1
Şekil 2-1: Beyin loblarının görünümü………..…………3
Şekil 2-2: Beynin derin yapıları ………...……4
Şekil 2-3: Hipokampus görünümü ………...……6
Şekil 2-4: Hipokampusun bölümleri……….8
Şekil 2-5: Hipokampus histolojik tabakaları………..10
Şekil 2-6: Hipokampus SGZ’ daki nörogenezin şematik gösterimi…….………..16
Şekil 2-7: Hipokampusde prolifere olan nöral kök/progenitör hücrelerinin FABP7 (Fatty acid-binding protein-7) ekspresyonu ve BrDU ile boyanması………….…19
Şekil 3-1: Hipokampus korumalı TBRT’ de örnek hasta konturlaması…………. 31
Şekil 3-2: Hipokampus korumalı (VMAT) TBRT örnek hasta tedavi planlaması 32 Şekil 3-3: Hipokampus korumasız (3D) TBRT örnek hasta tedavi planlaması…..32
Şekil 4-1: Hipokampus korumalı TBRT planlaması DVH örneği………..39
Şekil 4-2: Hipokampus korumasız TBRT planlaması DVH örneği………....39
Şekil 4-3: Hedef hacim değerlendirme parametre verilerinin her iki plan için karşılaştırılması………...40
Şekil 4-4: Riskli organ değerlendirme parametre verilerinin her iki plan için karşılaştırılması………...40
Şekil 4-5: Hipokampus değerlendirme parametre verilerinin her iki plan için karşılaştırılması………...41
Tablo 2-1: Nörogenezi etkileyen iç ve dış uyaranlar………..18
Tablo 2-2: Beyin metastazlı hastalarda RTOG RPA sınıflandırması………….…20
Tablo 2-3: Nörokognitif fonksiyon değerlendirme testleri……….24
Tablo 2-4: Hipokampus Korumalı TBRT fizibilite çalışmaları……….28
Tablo 3-1: HK TBRT için doz sınırlamaları………..34
Tablo 4-1: Sağ ve sol lens maksimum dozları………....35
Tablo 4-2: Sağ ve sol orbita maksimum dozları……….…36
Tablo 4-3: Sağ ve sol optik sinir maksimum dozları………..36
Tablo 4-4: Kiazma maksimum dozları………...37
Tablo 4-5: Hipokampus minimum, maksimum, ortalama(Gy), BEDgeç etki ve EQD2 (Gy2) dozları ………..37
Kısaltmalar ve Semboller
3D: 3 Boyutlu
ABD: Amerika Birleşik Devletleri ACTH: Adrenokortikotropik Hormon ALL: Akut Lenfoblastik/Lenfositer Lösemi
AMPA: α-amino-3-hydroxyl-5-methyl-4-isoxazole-propionate
BDNF: Brain Derived Neurotrophic Factor, Beyin Derive Büyüme Faktörü BED: Biyolojik Etkin Doz
BOS: Beyin Omurilik Sıvısı BrdU: Bromodeoksiüridin BT: Bilgisayarlı Tomografi C1: Birinci Servikal Vertebra C2: Ikinci Servikal Vertebra
CA: Cornu Amnonis CCK: Kolesistokinin cm3: Santimetreküp
COWA: Controlled Oral Word Association Test CRH: Kortikotropin Salgılatıcı Hormon
d: Fraksiyon başı verilen doz D: Verilen total doz
D2: En yoğun doz alan %2’ lik kısmının aldığı doz
Dmaks:: Organın Aldığı Maksimum Doz
Dmedian : Organın aldığı median doz
Dmin / D100% : Organ hacmimin %100’ nün aldığı doz
Dort : Organın aldığı ortalama doz
EEG: Elektroensefalografi
EORTC: European Organisation for Research and Treatment of Cancer
EQD2: Fraksiyon başı 2 Gy verilmesi halinde verilen total dozun biyolojik eşdeğeri
FABP-7: Fatty Acid-Binding Protein-7 fx: Fraksiyon
GABA: Gamma-Aminobutyric Acid GAD: Glutamat Dekarboksilaz GD: Gyrus Dentatus
GFAP: Glial Fibrillary Acidic Protein
GS: Genel Sağkalım Gy: Gray
HA: Hippocampal Avoidance HI: Homogenity Index
HK TBRT: Hipokampus Korumalı Tüm Beyin Radyoterapisi HT: Helical Tomoterapy
HVLT-R: The Hopkins Verbal Learning Test – Revised
IMRT: Intensity Modulated Radiotherapy IQ: Intelligence Quotient
KHDAK: Küçük Hücreli Dışı Akciğer Kanseri KPS: Karnofsky Performans Skalası
KS: Kranyal Sinir KT: Kemoterapi
LENT-SOMA: Late Effects Normal Tissue Task Force-Subjective, Objective, Management, Analytic
LGG: Low Grade Glioma
LINAC: Lineer Akseleratör
LTP: Long Term Potentiation, Uzun Süreli Potansiyasyon mGluR: Metabotropic Glutamate Receptor
MLC: Multikolimatör Lif
MMSE: Mini-Mental State Examination MR: Manyetik Rezonans Görüntüleme n: Fraksiyon Sayısı
NCAM-H: Neural Cell Adhesion Molecule NCI: National Cancer Institute
NeuN: Neuronal Nuclear Antigen
NGF: Neuron Growth Factor, Nöron Büyüme Faktörü NKF: Nörokognitif Fonksiyon
NKH: Nöral Kok Hücre NMDA: N-methyl-d-aspartate NSE: Neuron Spesific Enolase
NTF: Neurotrophic Factor, Nörotrofik Faktör PKRT: Profilaktik Kranyal Radyoterapi PTV: Plannig Target Volume
QUANTEC: Quantitative Analysis of Normal Tissue Effects in the Clinic
RE: Rölatif Etkinlik
REM: Rapid Eye Movement
RPA: Recursive Partitioning Analysis
RT: Radyoterapi
RTOG: The Radiation Therapy Oncology Group
SGZ: Subgranüler Zon
SIB: Simültane Entegre Boost SRC: Stereotaktik Radyocerrahi SVZ: Subventriküler zon
TBRT: Tüm Beyin Radyoterapisi TC: Target Coverage
TD5/5: 5 yılda toplumun %5’ nde yan etki oluşturacak RT dozu TD50/5: 5 yılda toplumun %50’ nde yan etki oluşturacak RT dozu TH: Temporal Horn
TMT: Trail Making Test
TOAD-64: Turned On After Division, 64 kDa
TUNEL: Terminal Deoxynucleotidyl Transferase dUTP Nick End Labeling V30Gy: 30 Gy alan hedef hacim yüzdesi
VMAT: Volumetric Modulated Arc Therpy
1. Giriş
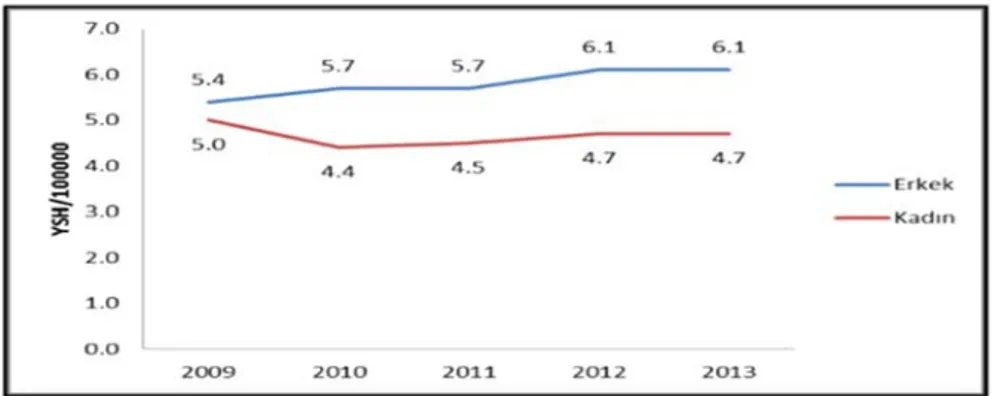
Hem primer hem sekonder beyin tümörleri toplumda önemli bir sağlık sorunu teşkil etmektedir. Son yıllarda primer beyin tümörleri ve beyin metastazlarının insidansında bir artış söz konusudur (35). 2014 yılında Amerika Birleşik Devletleri (ABD)’nde 24.000 civarında yeni tanılı primer beyin tümörü hastası olduğu saptanmıştır (36). Ülkemizde ise 2010 yılından sonra hem kadın hem erkek cinsiyette primer beyin tümör insidansında artış vardır (Şekil 1-1) (37). Bunun yanında yine ABD’de her yıl yeni tanı alan 1.4 milyon solid tümörlü kanser hastasının yaklaşık %30’u beyin metastazı geliştirmektedir (36). Bu nedenle beynin primer ve sekonder tümörlerinin tedavisinin yönetilmesi kanser tedavisinde gittikçe artan bir öneme sahiptir.
Radyoterapi beyin tümörlerinde önemli bir tedavi modalitesidir. Gerek profilaktik gerek küratif veya palyatif amaçla yapılmış olsun, bu hastalarda artan sağkalım beklentisi radyoterapiye bağlı gelişen yan etkileri daha önemli bir konuma getirmektedir (38). Bu nedenle tedaviye bağlı yan etkileri azaltmak tedavinin önemli bir komponenti haline gelmektedir.
Bu çalışmada amacımız, ‘’Volumetric modulated arc therapy’’ (VMAT) tekniği kullanılarak yapılan hipokampus korumalı tüm beyin radyoterapisi (HK TBRT) planının hedef ve riskli organ dozları açısından hipokampus koruması olmadan yapılan klasik 3 boyutlu (3D) konformal tüm beyin radyoterapisi planı ile karşılaştırmak ve günlük pratikte uygulanabilir olup olmadığının araştırmaktır.
Şekil 1-1: Beyin Kanserlerinin Yaşa Standardize İnsidans Hızlarının Cinsiyete Göre 2009-2013 Yılları Arasındaki Dağılımı (37)
2.Genel Bilgiler
2.1. Beyin anatomisi
İnsan beyni serebrum, serebellum ve beyin sapı tarafından oluşturulur (1). Serebrum beynin en büyük parçasıdır ve sağ ve sol hemisferlerden oluşur. Görme, duyma, dokunmayı yorumlama, konuşma, muhakeme, öğrenme, duygular, hareketlerin ince kontrolü gibi beynin yüksek fonksiyonlarını yönetir (2).
Serebellum serebrumun alt kısmında yerleşir. Kas koordinasyonunun, postür ve dengenin sağlanmasından sorumludur (2).
Beyin sapı, orta beyin, pons ve medulla oblangata’yı içerir. Nefes alıp verme, kalbin çalışması, vücut ısısının düzenlenmesi, uyku-uyanıklık siklusları, sindirim, hapşırma, öksürme, kusma, çiğneme gibi otomatik fonsiyonların düzenlendiği merkezdir. 12 kranyal sinirin (KS) 10 tanesi bu bölgeden orijin alır (2).
Serebrumun yüzeyi kıvrımlı bir yapıdadır ve korteks olarak adlandırılır. Korteks 100 milyar sinir hücresinin %70’ni içerir. Sinir hücrelerinin gövdesi kortekse gri-kahve rengini verir (gri madde). Nöronların arasındaki bağlantıyı sağlayan lifler, akson adını alır ve beyaz maddeyi oluşturur (3).
Beyin kıvrımları arttıkça yüzey alanı artar ve bu da daha fazla nöron aktivitesi anlamına gelir. Her kıvrım ‘’gyrus’’ adını alır, kıvrımlar arasındaki yarıklara ise ‘’sulcus’’ adı verilir. Her kıvrım ve yarığın kendine özel ismi vardır ve bu beynin spesifik bölgelerini adlandırmada kullanılır (4).
Beynin sağ ve sol hemisferleri ‘’corpus callosum’’ adı verilen liflerle birleştirilir. Bu lifler iki hemisfer arasındaki iletişimi sağlar. Her bir hemisfer karşı taraf vücut yarımını kontrol eder. Sol hemisfer genellikle konuşmayı, yazmayı, aritmetiği, anlamayı kontrol ederken sağ hemisfer yaratıcılığı, uzaysal konumu, artistik ve müzikal beceriyi kontrol eder. Sol hemisfer el kullanımında ve dilde insanların %92’sinde dominanttır (4).
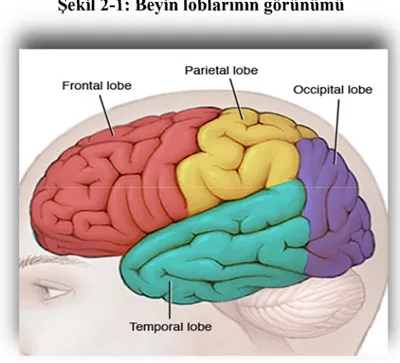
Beyin hemisferleri belirgin fissürler tarafından loblara ayrılır. Her bir hemisfer 4 lobdan oluşur: frontal, paryetal, oksipital ve temporal lob (Şekil 2-1). Her bir lob da kendi içinde özel fonksiyon birimlerine göre farklı bölgelere ayrılır (5):
✓ Frontal lob; kişilik, yargılama, planlama, problem çözme, zeka, konsantrasyon, farkındalık, motor merkez ve konuşmanın motor merkezi’ni (Broca’s area) içerir
✓ Paryetal lob; dokunma, ağrı, sıcak-soğuk hissetme, duyu merkezini içerir. Duyu organlarından gelen sinyalleri yorumlar. Mekansal ve görsel algıyı sağlar.
✓ Oksipital lob; görüntüyü yorumlar (renk, ışık, hareket).
✓ Temporal lob; hafıza, duyma, konuşulanı anlama (Wernicke’s area), sıralama ve organizasyon yapmayı sağlar.
Şekil 2-1: Beyin loblarının görünümü
2.1.1. Beynin Derin yapıları
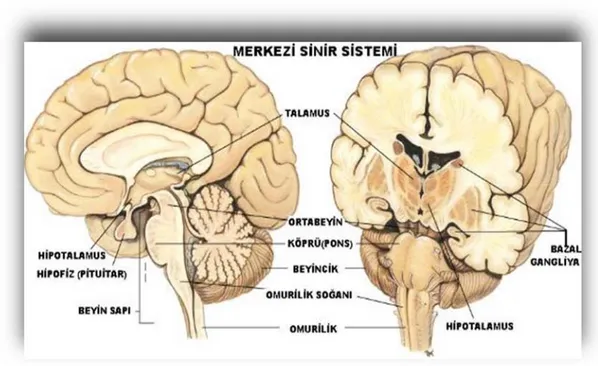
Hipotalamus, 3. ventrikül tabanında yer alır ve otonom sinir sisteminin şefidir. Açlık, susama, uyku, seksüel davranışların kontrolünde, vücut ısısı, kan basıncı, hormon sekresyonu ile duygusal tepkilerin düzenlenmesinde rol alır (6).
Hipofiz bezi, kafa tabanında, sella turcica adlı yapının üzerinde uzanır. Hipotalamus ile bağlantılıdır. ‘’Master Gland’’ olarak bilinir ve vücudun diğer endokrin bezlerini kontrol eder. Seksüel gelişimi kontrol eden hormonları salgılar. Kas ve kemik gelişimine katkı sağlar. Stres yanıtında ve hastalık ile mücadelede önemlidir (6).
Talamus, kortekse girip çıkan hemen hemen tüm veriler için aracı istasyon görevi görür. Ağrı hissi, dikkat, uyanıklık ve hafıza oluşumunda rol oynar (6).
Basal ganglion, caudate, putamen ve globes pallidus’u içerir. Bu çekirdekler, beyincik ile birlikte, ince hareketlerin koordinasyonunda rol alır (6).
Limbik sistem, duyguların, öğrenme ve hafızanın merkezidir. Singulat girus, amigdala, hipotalamus, ve hipokampus bu siteme dahil yapılardır (6) (Şekil 2-2).
Şekil 2-2: Beynin derin yapıları
2.1.2. Meninksler
Beyin ve spinal kord 3 tabakadan oluşan ve meninks adı verilen yapı tarafından çevrelenip korunur. Dıştan içe doğru, dura mater, araknoid mater ve piamater olarak sıralanır. Dura mater, kafatasının içinde uzanan kalın ve güçlü bir membrandır. Periosteal ve meningeal dura isimli tabakalardan oluşur ve venöz sinüsü oluşturur. Dura mater kıvrımlı bir hal alarak iki özel yapı oluşturur. Bunlar falks serebri ve tentoryum olarak bilinir. Falks beyin hemisferlerini birbirinden ayırırken, tentoryum ise serebrumu serebellumdan ayırır (2).
Araknoid mater ile dura mater arasında subdural boşluk bulunur. Araknoid mater ile pia mater arasında ise subaraknoid boşluk vardır. Beyin omurilik sıvısı (BOS) burda bulunur ve beynin yükünü azaltır (2).
2.1.3. Ventriküller ve beyin omurilik sıvısı
Beyin içinde bulunan sıvı dolu boşluklara ventrikül adı verilir. Ventrikül içinde bulunan koroid pleksus adlı yapı beyin omurilik sıvısı (BOS) üretiminden sorumludur. BOS beyin ve spinal kordu darbelere karşı korur. Serebral hemisferlerin derininde lateral ventriküller bulunur ve foramen Monro aracılığıyla 3. ventriküle bağlanır. 3. ventrikül ise akuaduktus silvius aracılığıyla 4. ventriküle bağlanır. BOS burdan subaraknoid aralığa geçer. Superior sagittal sinus’ta bulunan araknoid villi tarafından absorbe edilir (2).
2.1.4. Beslenme
Beyin temel olarak 2 arterden beslenir. Bunlar internal karotid arter ve vertebral arterdir. İnternal karotid arter beynin büyük kısmını beslerken, vertebral arter serebellum, beyin sapı, serebrumun alt kısmını besler. Kafatasından geçtikten sonra, sağ ve sol vertebral arterler birleşerek basiller arteri oluşturur. Basiller arter ile internal karotid arter ‘’willis poligonu’’nu oluştururlar (7). Beynin venöz drenajı ise venöz sinüsler aracılığıyla internal juguler vene olur (7).
2.2. Hipokampus
Hipokampus temporal lobun medial kısmında bulunur ve lateral ventrikülün temporal hornu ile yakın komşuluk içindedir (8,9). Hipokampus, üzerinde en fazla klinik ve laboratuvar çalışma yapılan beyin bölümüdür. Temel olarak hafıza, duygulanım, konumlama ve yön bulmada önemli rolü vardır (12). Hipokampus bir gri cevher tabakasıdır ve lateral ventrikülün temporal hornu boyunca uzanır (24). Yaklaşık 5-8 cm uzunluğundadır. Arşikorteks olarak da adlandırılır. Filogenetik olarak en eski beyin kısımlarından birisidir (24). Hipokampusta nöral plastisite hayat boyunca devam etmektedir. Hipokampus, singulat girus, hipotalamus ve amigdala birlikte limbik
sistemi oluşturur. Erişkin bir insan beyninde hipokampusun hacmi yaklaşık 3-3,5 cm3 olup, hipokampusun tüm insan neokorteksine oranı yaklaşık 0,009’dur (25).
2.2.1. Hipokampus Anatomisi ve Embriyolojisi
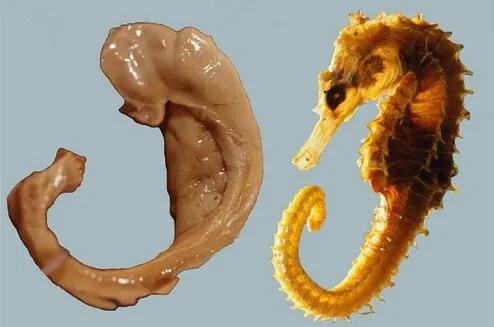
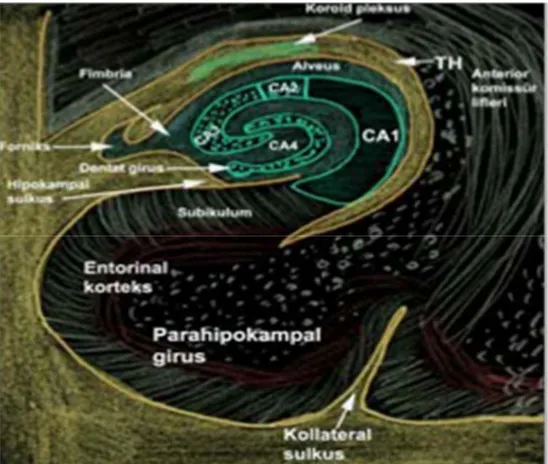
Hipokampus koronal beyin kesitlerinde C harfi şeklinde görülür. Denizatına benzerliğinden dolayı “hipokampus” ismi verilen bu yapı (Yunanca: hippos = at, kampos = deniz), dış yüzü koç boynuzuna benzediğinden dolayı “cornu ammonis” (CA) olarak da anılmıştır (Şekil 2-3). Bundan dolayı hipokampusun bölümleri CA1, CA2, CA3 ve CA4 olarak kısaltılarak adlandırılmıştır (8).
Şekil 2-3: Hipokampus görünümü
Hipokampus koroid fissür kavsinin dış parçasından gelişir (24). Embriyonel dönemde gelişim süreci bölgede bulunan öncü nöronların (nöral progenitör hücreler) çoğalması ve göç etmesi ile başlar (10, 19). Gestasyonel hayatın 13-14. haftaları civarında temporal lobun medial yüzeyinde hipokampal fissür ile çevrili katlanmamış bir hipokampus yapısı vardır. 15 ve 16. haftalarda dentat girus ve kornu ammonis içe doğru katlanmaya başlar, ancak hipokampal sulkus halen açıktır. CA1, CA2 ve CA3 bölümleri çizgisel bir şekildedir (24). Dentat girus dar ve U şeklinde bir anatomik
yapıdır. 18 ile 20.haftalarda ise fötal hipokampus giderek erişkin hipokampusuna benzemeye başlar (19). Embriyonel hayatta hemisfer duvarı bir yandan kalınlaşırken, diğer yandan da ventrikülün medial kenarına doğru bir çıkıntı yapar. Bu çıkıntı hipokampusu meydana getirir (10, 24).
Anatomik olarak hipokampusun ventriküle bakan yüzü konveks, hemisferin alt kısmına bakan yüzü ise konkavdır (9). Ön tarafı geniş ve düz olup “pes hippocampi” adı verilir. Ön bölümde pençeye benzeyen iki veya üç adet yüzeysel çıkıntı bulunur. Bu çıkıntılara “digitationes hippocampi” adı verilir (24). Hipokampusun bütün ventriküler yüzeyi kendi hücrelerinden gelen aksonların oluşturduğu “alveus” tabakası ile örtülüdür. Alveus lifleri medialde yassı bir bant şeklinde birbirine yaklaşarak “fimbria hippocampi” yi meydana getirir (24). Fimbria hippocampinin ön ucu uncus, gyri hippocampinin beyaz cevherinde sonlanır. Arka ucu ise alveus ile birlikte ‘’Crus fornicis’’ i oluşturur. Alveustan gelip fimbriaya dahil olan lifler forniksin başlangıcını meydana getirir. Forniks myelinli liflerden oluşur. Duyu lifleri hipokampusu forniksten terkeder. Cornu Ammonis’in İngilizce baş harflerini temsilen “CA” olarak da ifade edilebilen hipokampus, hücre yapısındaki değişikliklerden dolayı CA1, CA2, CA3 ve CA4 gibi farklı alanlara bölünmüştür (8, 9, 24). Bunlardan CA1 subikuluma, CA4 ise dentat girusa en yakın olan alandır (Şekil 2-4). Hipokampus CA1 bölgesi nöronları spasyal (uzaysal) öğrenme ve bellek için gereklidir. CA1 bölge nöronları entorinal korteksten veya CA3 bölgesinden bilgileri alır ve işler. Sağlam bir CA3 ve CA1- CA3 bağlantısı referans hafıza için mutlaka gereklidir. CA3 bölgesi Schaffer kollateral lifleri aracılığı ile CA1 bölgesiyle bağlantılıdır. CA1 çıktıları (output) subikulum, entorinal korteks ve prefrontal kortekse uzanır. CA1 ise iki yerden girdi (input) alır; birincisi (büyük kısmı) CA3’den gelir, çok az kısmı ise entorinal korteksden gelir. CA1 bölgesi kortikal bilgiler ile CA3 ve entorinal korteksden gelen bilgiler arasında uyumsuzluk olup olmadığına bakar. CA1 ve CA3’deki hücre sayıları adölesan dönemden önce daha az iken bu dönemden sonra giderek artmaktadır (25). Bu da adölesan dönemde uzaysal öğrenme ve belleğin geliştiğini gösterir (24, 25, 27).
Şekil 2-4: Hipokampusun bölümleri
2.2.2. Hipokampus dolaşımı
Hipokampus arteryel yönden oldukça zengindir. Hipokampusu temel olarak posterior serebral arter ve bundan çıkan dallar besler (11, 30). Bunun dışında anterior koroidal arter ve dalları da hipokampusu besler (11). Her iki arterin hipokampal dalları unkal sulkusda yaygın anastomozlar yaparlar (26). Bu anas tomozlardan süperfisyel hipokampal arterler oluşur ve bunlar hipokampus içine doğru derin hipokampal arterleri verirler (26). CA3 ve CA4 bölgesi özellikle küçük ventral intrahipokampal arterler tarafından beslenir. CA1 ve CA2 bölgeleri ise geniş ventral intrahipokampal arterler tarafından beslenir (11, 26). Aynı arterin dalları dentat girusun distal bölümünü de besler. Hipokampusun venöz drenajı ise sulkal ve subepandimal intrahipokampal venler yoluyla önce süperfisyel hipokampal venlere olur. Ardından bu venler de 2 adet
venöz ark oluşturur. Bu arklar da önde inferior ventriküler ven yoluyla arkada ise medial atrial ven yoluyla bazal vene drene olurlar (26).
2.2.3. Hipokampus Histolojisi
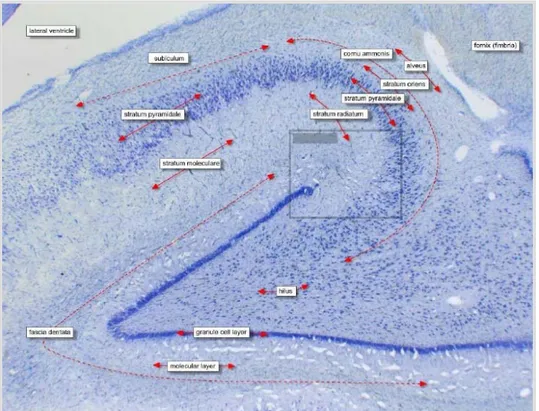
Hipokampus histolojik olarak ince ve birbiriyle bağlantılı pek çok tabakadan oluşur. Literatürde yazardan yazara değişmekle birlikte, genel olarak üzerinde anlaşılan 7 tabaka vardır (Şekil 2-5). Histolojik olarak ventriküler yüzeyden başlayarak dışa doğru şu şekilde sıralanır (24):
1- Alveus: En derindeki tabakadır. Ventrikül yüzeyine komşudur. Subikulum ve hipokampusa ait piramidal hücre aksonlarını içerir. Hipokampusun en önemli çıktısı (output) olan fimbria/fornikse uzanan aksonlar alveusdan geçerler.
2- Stratum oriens: Esas olarak piramidal hücrelerin bazal dendritleri ile internöronların yerleştiği tabakadır. Buradaki çoğu nöron aksonları alveus liflerine katılır. Diğer hücre aksonları ise, en derinde yer alan stratum molekülareye dek uzanır. 3- Stratum piramidalis: Karakteristik olarak bu tabakada büyük piramidal ve Golgi tip II hücreleri çoğunluktadır. Piramidal hücrelerin esas olarak gövdeleri bu tabakada bulunur. Çıplak gözle bile görülebilen bir tabakadır. Piramidal hüc relerin tabanı hipokampusun ventriküler yüzeyine dönüktür ve bazal-apikal dendritleri komşu tabakalara (stratum lusidum) kadar uzanır. Aksonları ise stratum oriens’ten geçerek alveus liflerine katılırlar. Bu tabakada yosunsu (mossy) lifler ile yapılan sinapslar vardır. Ayrıca pek çok internöronun hücre gövdesi burada bulunur. Hipokampusa asıl şeklini veren buradaki piramidal hücrelerin dizilimidir.
4- Stratum lusidum: Hipokampusun en ince tabakalarından birisidir. Sadece CA3 bölgesinde bulunur. Hücresel yönden yoğundur ve çoğunlukla motor tip piramidal hücrelerden oluşur. CA3 alanındaki piramidal hücreler ile dentat girusun granüler hücreleri arasında bağlantı sağlayan yosunsu (mossy) lifler de içerir. Bu lif şebekesi beyindeki en yaygın ve gelişmiş ağdır. Diğer primatlara göre insanlarda daha belirgin olup CA1 ile CA2 alanlarında bulunmaz.
5- Stratum radiatum: Stratum oriens gibidir. Septal ve komissural lifleri içerir. Ayrıca Schaffer kollateral lifleri içerir ki bunlar CA3’den CA1’e projeksiyon lifleridir. Bu bölgede yüzeyde bulunan bazı internöronlar da bulunur. (basket hücreleri, radial trilaminar hücreler vb.).
6- Stratum lakünozum: İnce bir tabakadır ve bu da Schaffer kollateral lifleri içerir. Ancak süperfisyal tabakadan entorinal kortekse uzanan bazı perforan lifler de içerirler. Çok ince olduğu için çoğu zaman stratum molekülare ile birlikte anılırlar ve “stratum lakünozum-molekülare” adıyla tek tabaka olarak da adlandırılırlar.
7- Stratum molekülare: En yüzeyel (dış) tabakadır. Burada da perforan lifler ve piramidal hücrelerin apikal dentritleri bulunur. Burası bazı yazarlar tarafından“stratum molekülare”adı altında tek bir tabaka olarak kabul edilirken, bazı kaynaklarda ise bir üst maddede belirtildiği gibi 6. ve 7. tabakaları birleştirerek “stratum lakünozum–molekülare” ismiyle tek tabaka olarak da incelenmektedir.
Şekil 2-5: Hipokampus histolojik tabakaları
2.2.4. Hipokampusun bağlantıları
Histolojik tabakalardan farklı olarak hipokampusa gelen (afferent) ve hipokampusten çıkan (efferent) yollar vardır (24):
A- Afferent yollar:
Hipokampus; dolaylı da olsa tüm duyusal uyarıları içeren afferent yollara sahiptir. Entorinal korteksden gelen duyular temel olarak dört yolla hipokampusa iletilir:
1. Perforan yollar: Entorinal korteksten gelen aksonlar subikulum boyunca dentat girusa ilerler ve bu aksonlar CA4 alanı hariç tüm hipokampusa dağılır.
2. Yosunsu (Mossy) lifler: Dentat girustan CA3 alanına giderler.
3. Schaffer kollateral lifleri: CA3 ve CA2’den CA1 alanına uzanan piramidal hücre uzantılarıdır.
4. Alvear lifler: Bu lifler subkortikal alanlardan gelirler ve alveustan hipokampusa geçerek hipokampusun CA1 kısmı ile subikulumun iç tabakasına dağılırlar.
Hipokampus, parahipokampal girus korteksinden de uyarılar alır ve bu uyarıları forniks yolu ile corpus mamillare, area septalis ve bazı hipotalamik nukleuslara nakleder. Ayrıca hipokampus forniks aracılığı ile anterior talamik nükleus, area hypothalamica posterior, corpus mamillare, area septalis, substantia innominata, ventral tegmental area, raphe nükleusu ve parabrakial nükleusdan da lifler alır (24).
B- Efferent yollar:
Forniks, hipokampusun en büyük efferent yoludur (8). Hipokampus ve subikulumdan başlayan ve yaklaşık 1,2 milyon kadar olan myelinli lifler, alveustan fimbria hippocampiye geçer (18). Bu lifler, korpus kallozumun splenium bölümünün altında crus fornicis, talamusun arkasında da corpus fornicis olarak devam eder. İki crus arasında çapraz yapan liflere “commissura hippocampi” adı verilir ve bu lifler ‘’psalterium’’ (Lyra) isimli üçgen şeklinde bir laminada bulunurlar (24). Corpus fornicisten sonra, “columna fornicis” ismiyle uzanan aksonlar, interventriküler foramenin önünde kavis yaparak anterior talamik nükleus ve dorsal lateral talamik nükleusa lifler (postkomissural lifler) verir (18, 24).
Buradan hipotalamusa uzanan liflerin çoğu corpus mamillarede ve hipotalamusun ventromedial nukleusunda sonlanır. Columna fornicisten commissura anteriora ayrılan az sayıdaki forniks lifleri (prekomissural lifler) ise area septalis, substantia innominata ve area hypothalamica rostralis’e geçerler (24).
2.2.5. Hipokampusun Fizyolojisi
Hipokampuste monoaminerjik, kolinerjik ve gabamainobütirik asit-erjik (GABAerjik) afferentler bulunur (23, 24). Glutamat ve aspartat, hipokampusten en çok salgılanan eksitatör transmitter olarak bilinir (20). Somatostatin-immünoreaktif lifler, stratum lakünozum ve stratum orienste; glutamat dekarboksilaz (GAD) -immünoreaktif lifler, stratum piramidalis, stratum radiatum ve stratum orienste; kolesistokinin (CCK) -immünoreaktif lifler ise özellikle stratum piramidaliste gösterilmiştir (24,41). Bunun yanında; CA3’e giden yosunsu (mossy) liflerde bir opioid peptid olan dinorfin, pek çok hipokampal alanlarda ise vazoaktif intestinal polipeptid (VIP) yaygın olarak bulunur (12, 20, 24).
Yakın hafıza olarak tutulan bilgilerin sağlamlaştırılması uykunun rapid eye movement (REM) safhasında meydana gelir (24). Bu safhada, hipokampuse işaret eden seratonerjik raphe nukleusları aktiftir. Derin uykuda neokorteksteki elektroensefalografi (EEG) kayıtları düzenli ve senkronize ritm gösterir iken, hipokampal EEG kayıtları desenkronizedir. Uyanıklık durumunda ise neokortikal kayıtlar desenkronize olmasına rağmen; hipokampus yavaş ve düzenli bir ritm gösterir (40). Hipokampusun EEG dalgaları ritmik sinüzoidal tipteki “teta” dalgalarıdır (14, 40). Bu durum yapının spontan aktivitesini ve bilincin değişik devrelerle ilişkili olduğunu göstermektedir (24).
Hipokampus; uzun süreli bir sinaptik ilişki türü olan ’’long term potentiation’’ (LTP) ve iskemiye seçici duyarlılık gibi konularda oldukça dikkat çeken bir yapıdır. Ayrıca hipokampusun bir diğer özelliği ise hipereksitabilitesidir (13,39,40,42). Örneğin hafif elektriksel uyarılar, hipokampus bölgelerinde uyarı kesildikten sonra saniyeler süren lokal epileptik nöbetlere sebep olur (40). Bu da hipokampusun normal koşullarda bile uzun süren sinyaller yaydığını gösterir.
2.2.6. Hipokampusun Fonksiyonları
1948 yılına kadar hipokampusun yalnızca koku alma ile ilgili bir merkez olduğu düşünülmekteydi (24). Bunun nedeni olfaktor bulbustan direkt sinir lifleri aldığına dair yaygın inanış idi. Fakat daha sonra koku yollarının gelişmediği bazı insanlarda, hipokampusun normal geliştiği gözlendi. Ayrıca hipokampusun gelişiminin olfaktor
bulbusa paralel olmadığı da gösterilmiştir. Ama kokunun özellikle formatio reticularis ve hipokampus ile olan anatomik bağlantıları daha sonra net olarak ortaya konmuş ve bundan dolayı zihinsel uyanıklık, hafıza ve dikkati etkilediği düşünülmüştür (33). Entorinal korteks ve olfaktor korteksten başlayan bir takım lifler hipokampuse gelirler. Bu bağlantı bize kokunun belleği etkileyebileceği fikrini verir. Bugün ise hemen her türlü duyusal uyarının (görme, işitme, koku, dokunma, iç organ duyuları vs.) hipokampusu aktive ettiği bilinmektedir (33).
Hipokampusun fonksiyonları üzerine ilk modern bilimsel çalışmalar 1957 yılında Scoville ve Milner’in hipokampusun insan hafızasında önemli rol oynadığını bulması ile başlar (22). Özellikle 2000’li yıllardan itibaren çalışmalar daha çok hipokampusun kendi içindeki ve çevre dokular ile bağlantılarına doğru kaymıştır (21, 31).
Hipokampus ventral talamus, hipotalamus ve limbik sistemin diğer bölgelerine sinyaller gönderir (18, 23). Böylece, hareketlerin davranış biçimine dönmesinden önce, limbik sistemi etkileyen hipokampus, davranışların şekillenmesine katkıda bulunmuş olur. Bu sebepten dolayı hipokampusun, gelen duyusal sinyalleri içerisinden geçiren ek bir kanal rolü oynadığı düşünülebilir.
Hipokampusun hafıza, özellikle de kısa süreli hafıza ile ilgili olduğu bilinmektedir (32). Kısa süreli hafıza, yeni bilgilerin depolanma kapasitesini ifade etmektedir. Bu nedenle mekanizma ne olursa olsun sağ ve sol hipokampus olmadan verbal veya sembolik uzun süreli anıların kalıcı olması mümkün değildir. Diğer yandan, sağ hipokampus görsel, sol hipokampus ise sözel hafıza ile ilgili fonksiyonlarda daha fazla aktivite göstermekte ve bu bölgelerin lezyonlarında da ilgili hafızalarda kayıp gelişmektedir (24).
Hipokampusun endokrin fonksiyonu üzerinde de durulmaktadır (29). Kortizol adrenal korteksden üretilen ve kan yoluyla bütün vücuda yayılan bir hormondur. Kortizol beyinde, özellikle de hipokampusteki reseptörlere bağlanır. Hipokampusteki reseptörler, yeterli miktarda kortizol ile bağlandığında, hipotalamus üzerinde negatif feedback etkisi yaparak, kortikotropin salgılatıcı hormon (CRH) salınımını inhibe eder. Bu yolla hipokampus, kortizolü belli seviyede tutarak, amigdalanın tetiklediği stres cevabını regüle eder. Hipokampus yeterli oranda işlev görebiliyorsa, stres reaksiyonu durdurulabilir. Ancak bununla birlikte uzamış stres, hipokampusun işlevlerini bozabilir. Uzamış stresin hipokampusteki dendritleri büzdüğü ve bunun
büzüşmesi daha çok hipokampusun CA3 bölgesinde görülürken, bu sırada dentat girusta nörogenesis durur. Hipokampus ve septumun birlikte beynin davranışsal inhibitör şebekesi olduğu düşünülmektedir. Hipokampusun stres oluşturan durumlarda aktif hale geldiği düşünülmektedir. Ancak bu teori günümüzde tartışmalıdır (20). Bunun dışında hipokampusun ön bölgesinde östradiol konsantre eden nöronlar saptanmıştır. Sıçan deneylerinde ise hipokampusun uyarılması ile ovülasyonda inhibisyon meydana geldiği gösterilmiştir. Ayrıca forniksin kesilmesi ile adrenokortikotropik hormon (ACTH) salınımında bozukluk saptanmıştır. Bunlar dışında hipokampusun şu fonksiyonlara da katıldığı kabul edilmektedir (24):
- Heyecan uyandıran reaksiyonlar veya heyecanın kontrolü, - İç organlara ait aktivitenin düzenlenmesi,
- Serebral korteks üzerine olan retiküler aktivitenin ayarlanması.
Hipokampus, hareketlerin davranış biçimine dönüşmesinde önemli role sahip olan limbik sistemde yer alır. Ayrıca hafıza ve özellikle de daha önce bahsedildiği gibi “kısa süreli hafıza” üzerinde rolü vardır. Uzaysal yön bulmada da etkilidir. Alzheimer hastalığında hipokampus beyinde ilk etkilenen yerlerden biri olur (17). Bu nedenle Alzheimer’da hafıza bozuklukları ve dez oryantasyon erken belirtilerdir. Oksijen yetmezliği, medial temporal lob epilepsisi ve ensefalit de hipokampus hasarına yol açabilir (13).
Deney hayvanlarında hipokampusun hafıza ve uzaysal (spasyal) yön bulmadaki rolüyle ilgili çok sayıda çalışma yapılmıştır (14-16). Hayvanlar yaşam çevrelerindeki bildik yerlerden geçerken hipokampus nöronlarının aktif hale geçerek aksiyon potansiyelleri oluşturdukları gözlenmiştir (16).
Hipokampuste değişik nöron tipleri çok düzgün biçimde yerleştiğinden bu organ sıklıkla nörofizyoloji çalışmalarında bir model olarak kullanılmıştır. Uzun süreli potansiyasyon (LTP) olarak bilinen “nöral (sinirsel) plastisite” ilk olarak bu yapıda saptanmış ve incelenmiştir. Bu olgunun hafıza oluşumundaki temel nöral mekanizma olduğuna inanılmaktadır (22, 23).
2.3. Nörogenez ve nöroplasitisite
Nörogenez sinir kök ve progenitör hücrelerinden nöronların üretildiği bir süreçtir (44). En fazla doğum öncesi dönemde aktif olan nörogenez, gelişmekte olan beynin nöronlarla doldurulmasından sorumludur. İnsanda nörogenez gebeliğin ilk haftalarında başlar ve ikinci trimesterin sonunda nöronların büyük kısmı oluşur. Doğum sonrasında altı yaş civarına kadar sinaps oluşumu oldukça hızlıdır. Ondört yaşından sonra sinaps oluşumu, nöronal yenilenme ve onarım hızı azalmaya başlar (45).
Eskiden beyinde nöronların kendilerini onarabilme ve yeni nöron oluşturabilme yeteneklerinin olmadığına inanıldığı için, doğum sonrası belli bir sayıya ulaştıktan sonra yaşlanma ile birlikte sayılarının giderek azaldığı kabul ediliyordu. Bugün ise nöronların kendilerini onarabildikleri ve yenileyebildikleri, yeni nöron oluşumunun azalmış hızda da olsa devam ettiği kanıtlanmıştır. Erişkin hipokampal nörogenezisi insanlar da dahil olmak üzere birçok canlı türünde gösterilmiştir (43).
Plastisite terimi Yunanca’da “plaistikos” kelimesinden kaynaklanır, biçimlendirmek, şekil vermek anlamına gelir ve merkezi sinir sisteminin çevresel değişimlere uyum gösterebilme yeteneğidir. Beyindeki nöronlar ve oluşturdukları sinapsların vücudun içinden ve dışından gelen uyaranlara bağlı olarak gösterdikleri yapısal ve işlevsel değişiklikleri kapsar. Nöroplastisite, beynin öğrenme, hatırlama ve unutma yeteneklerine işaret eder (43-45).
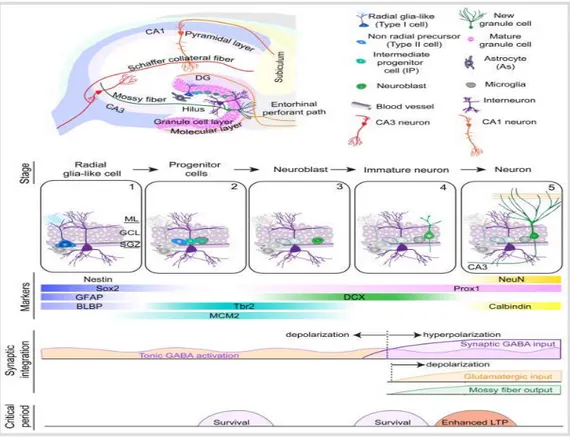
Hipokampusde yeni oluşan nöronların saptanması bromodeoksiüridin (BrdU) gibi işaretleyicilerin bulunması ile büyük hız kazanmıştır. Hipokampus öğrenme ve bellek gibi bilişsel işlevler için sürekli olarak yeni nöronlar üretir. Sıçanlar üzerinde yapılan bir çalışmada hipokampusde her gün 9000 yeni hücre oluştuğu, bir ayda bu hücrelerin yaklaşık %3.3’ünün nörona dönüştüğü bildirilmiştir. Hipokampusdeki subgranüler zon (SGZ) ve subventriküler zon (SVZ) nöral kök hücrelerin oluştuğu en etkin alanlardır (Şekil 2-6). Bunun yanı sıra amigdala, frontal korteks, olfaktör bulbus bölgelerinde de etkin olarak yeni nöronların oluşturulduğu ve plastisite yetilerinin diğer bölgelere karşın daha yüksek olduğu bilinmektedir (45,46).
Şekil 2-6: Hipokampus SGZ’daki nörogenezin şematik gösterimi (46)
Dendritler nöronların değişime en açık yapılarıdır. Bu nedenle onların yapısındaki değişikliklerin nöroplastisiteyi yansıttığı düşünülmektedir. Dendritlerin yapısındaki değişimler artan sinaptik iletişimle bağıntılıdır. Sinaptik alanların artışı ise çevresel uyaranlardaki artışla kendini gösterir. Çevresel uyaranlar nöron büyüme faktörü (NGF), beyin derive nörotrofik faktör (BDNF), nörotrofin-3 (NF-3) ve nörotrofin-4 (NF-4) gibi nörotrofik faktörlerin salınımını tetikler (47). İlk nörotrofik faktör olan NGF nöronların morfolojik yapılarını korumaları ve büyümelerini araştıran çalışmalarının sonucunda bulunmuştur (48). Bu faktörler hücrenin uyarana karşı uyumunu sağlarken bir yandan da apoptoza engel olarak hücrenin atrofiye gitmesini engeller (49,50). Nöroplastisitenin bir diğer önemli başrol oyuncusu nöral kök hücrelerdir. Kök hücreler oluştuktan sonra olgun nöron yapısına ulaşmak için uygun ortam ve uyaranlar varsa seri değişimler geçirirler. İlk önce hücresel uzantıları şekillenir. Bunu kutuplaşma izler. Diğer nöronlar ile afferent ve efferent bağlantılar kurar. Dentritlerin üzerinde spinler oluşur. Bu adımlar türe özgü olarak değişik sürelerde gerçekleşir. Bu sürede olgunlaşmakta olan nöronlarda yüzey reseptörleri de
şekillenir. Yüzey reseptörlerinin oluşumuna katılan ve plastik sinapslarda en çok işlev gördüğü bilinen nörotransmitter glutamattır. Glutamat vücudumuzdaki diğer proteinlerin yapısına da katılan bir aminoasittir. Glutamat reseptörleri dört çeşittir. Bunlardan ‘’α-amino-3-hydroxyl-5-methyl-4-isoxazole-propionate’’ (AMPA), ‘’ N-methyl-d-aspartate’’ (NMDA) ve kainat adları verilen üç tanesi iyonotropik reseptörlerdir. Dördüncü tip metabotropik reseptör olup ‘’metabotropic glutamate receptor’’ (mGluR) olarak adlandırılır. Glutamat reseptörlerinin bütün tipleri aynı nörotransmitere yanıt vermelerine karşın, hepsi çok farklı işlevleri yerine getirir. İyonotropik glutamat reseptörleri, eksitatör postsinaptik potansiyelleri oluşturmak için kendi iyon kanallarını kullanırken, metabotropik glutamat reseptörleri bu yanıtın doğasını ve boyutlarını nöromodülatör etkilere benzer şekilde değiştirirler. Bütün tipler sinaptik plastisite için önemli olmakla birlikte, AMPA ve NMDA reseptörleri en iyi bildiğimiz ve çoğunlukla bellek molekülleri olarak düşünülen reseptörlerdir. (51-56).
2.3.1. Nörogenezi etkileyen faktörler
Doğum sonrasında ilk kez Altman ve arkadaşları 1965’de yetişkin sıçan hipokampüsünde yeni oluşan nöronların varlığını kanıtlamıştır (57). Yetişkinlerde nörogenez dinamik olarak fizyolojik uyarılarla tetiklenmektedir. Nöroplastisiteyi olumlu etkileyen en önemli etken ise alışılagelen hayatın ya da davranışların dışına çıkmaktır. Daha önce yapılmamış aktiviteler ya da rutinin dışına çıkmak nöronlarda yeniden yapılanmayı tetikleyen en önemli unsurlardan biridir. Nöroplastisite gelişimsel plastisite (öğrenme ve bellek), tepkisel plastisite (kısa süreli uygulama sonrası), uyumsal, dejeneratif plastisite (uzun süreli uygulama sonrası) ve onarım plastisitesi (hasarlanmış nöronun iyileşmesi) şeklinde sınıflandırılabilir. Son yıllarda en çok üzerinde durulan plastisite türü gelişimsel plastisitedir. Van Prag ve arkadaşları fiziksel egzersizin SGZ’da hücre proliferasyonunu artırdığı vurgularken,1997 yılında yayınlanan bir çalışmada uyaranlardan zengin çevrenin yeni nöronların canlılığını korumasında önemli bir etken olduğu gösterilmiştir (58-60).
Hipokampusde fiziksel egzersiz deneyim çeşitliliği, uyaran zenginliği nöronların farklanmasında ve canlılığını korumasında etkili olsa da nöral kök hücre oluşumunu ve sinaptik plastisiteyi olumsuz etkileyen en önemli etken stresdir. Bunu
ve SVZ’de hücre proliferasyonunun azalmasına neden olan en önemli etkendir (61). Hipokampus, fazla sayıda adrenal steroid reseptörü içerir ve stres hormonlarının etkilerine oldukça duyarlıdır. Stresle yükseldiği bilinen glukokortikoidlerin hipokampusun CA3 bölgesinde aşırı miktarda hasara yol açtığı bildirilmiştir. Kronik stresin beyinde sinyal ileti yolaklarında bozulmaya neden olarak nöroplastisiteyi etkilediği, hipokampüste nöronal atrofi ve hücre ölümüne yol açtığı gösterilmiştir. Stresin hipokampal nörogenezisi azalttığı ve dendrit yapısında bozulmaya neden olduğu da gözlenmiştir. Ayrıca stres, hipokampuste nöronların hayatta kalabilmelerini ve çoğalmalarını baskılayabilir. Stresin neden olduğu bu etkiler yaşlanma sürecinde ve nörodejeneratif hastalıklarda da kendini gösterir (62-66). Nörogenezi etkileyen iç ve dış faktörler Tablo 2-1’de özetlenmiştir.
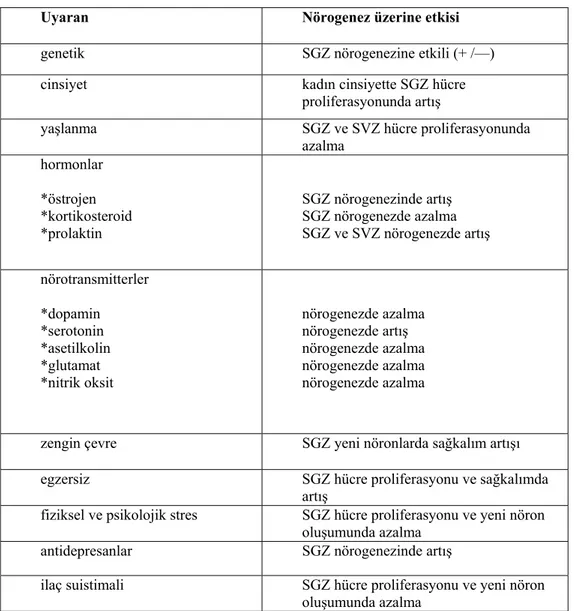
Tablo 2-1: Nörogenezi etkileyen iç ve dış uyaranlar (62)
Uyaran Nörogenez üzerine etkisi
genetik SGZ nörogenezine etkili (+ /—)
cinsiyet kadın cinsiyette SGZ hücre proliferasyonunda artış
yaşlanma SGZ ve SVZ hücre proliferasyonunda
azalma hormonlar *östrojen *kortikosteroid *prolaktin SGZ nörogenezinde artış SGZ nörogenezde azalma SGZ ve SVZ nörogenezde artış nörotransmitterler *dopamin *serotonin *asetilkolin *glutamat *nitrik oksit nörogenezde azalma nörogenezde artış nörogenezde azalma nörogenezde azalma nörogenezde azalma
zengin çevre SGZ yeni nöronlarda sağkalım artışı
egzersiz SGZ hücre proliferasyonu ve sağkalımda
artış
fiziksel ve psikolojik stres SGZ hücre proliferasyonu ve yeni nöron oluşumunda azalma
antidepresanlar SGZ nörogenezinde artış
ilaç suistimali SGZ hücre proliferasyonu ve yeni nöron oluşumunda azalma
2.3.2. Nörogenez Araştırmalarında Kullanılan Belirteçler
Bromodeoksiuridin (BrdU) yetişkin nörogenezini ispatlayan, yaygın kullanılan bir S-fazı belirteci ve timidin analoğudur (69,70) (Şekil 2-7). Sıçanda ‘’neural cell adhesion molecule’’ (NCAM-H) yeni üretilmiş granüler hücrelerinde geçici olarak üretilir (67). Calbindin-D28k tüm granüler hücrelerinde ve CA1 ve CA2’nin piramidal hücrelerinde üretilen bir kalsiyum bağlayan proteindir (71). ‘’Terminal deoxynucleotidyl transferase dUTP nick end labeling’’ (TUNEL) apoptotik hücreleri yakalayan bir yöntemdir (72). ‘’Glial fibrillary acidic protein’’ (GFAP) ise astroglia belirteci olarak kullanılır (73). Ayrıca ‘’neuronal nuclear antigen’’ (NeuN), ‘’neuron spesific enolase’’ (NSE) ve calbindin-D matür nöron belirteçleridir (68). İmmatür nöronlar ise ‘’Turned On After Division, 64 kDa’’ (TOAD-64) ile boyanır (74). Şekil 2-7: Hipokampusde prolifere olan nöral kök/progenitör hücrelerinin FABP7 (Fatty acid-binding protein-7) ekspresyonu ve BrDU ile boyanması (73)
2.4. Kranyal Radyoterapi
Kranyal radyoterapi (RT), bir çok onkolojik tabloda etkin bir tedavi modalitesidir (81). Küratif amaçla uygulanabildiği gibi profilaktik amaçla da uygulananabilir (82). Parsiyel kranyal radyoterapi veya tüm beyin radyoterapisi şeklinde uygulanabilir (83,84). Yetişkin hasta grubunun yanı sıra pediatrik
popülasyonda da sıklıkla kullanılmaktadır (82). Kranyal radyoterapinin bu etkinliği; makroskobik hastalığın yanında mikroskobik hastalığı da hedeflemesi ile açıklanabilir (77,78).
Tüm beyin radyoterapisi (TBRT), beyin metastazlarında ana tedavidir (79). Yapılan prospektif randomize çalışmalarda, beyin metastazı tanısı alıp TBRT almayan hastalarda, tanı anında TBRT alan hastalara göre yeni beyin metastazı geliştirme rölatif riskinin %70-300 daha fazla olduğu saptanmıştır (96-99). TBRT için tedavi sahası, beyin ve beyin sapı dahil tüm intrakranyal kompartmanı, foramen magnumun alt sınırına kadar veya birinci (C1) veya ikinci servikal vertebranın (C2) alt sınırına kadar olan alanı içerir. Tipik olarak karşılıklı lateral sahalardan verilen tedavide uniform bir doz dağılımı sağlanırken, kurşun bloklar veya multikolimatör lifler (MLC) ile lensler korunur (85).
İntrakranyal metastazların tedavisinde, ‘’The Radiation Therapy Oncology Group recursive partitioning analysis’’ (RTOG RPA) sınıflandırması, tedavi seçenekleri için yol gösterici olabilir. Sınıflandırma, hastanın Karnofsky performans skalasına (KPS), yaşına, primer ve ekstrakranyal hastalık durumuna göre yapılır ve hasta için beklenen ortalama sağkalım süresini belirtir. RTOG RPA sınıf III hastalar, sağkalım beklentisi düşük olduğu için yalnız TBRT ile tedavi edilirken sınıf I ve II hastalar için farklı tedavi kombinasyonları uygulanabilir (86). Bunlar; tek başına TBRT, cerrahi rezeksiyon sonrası TBRT, tek başına stereotaktik radyocerrahi (SRC) (özellikle sınıf I hastalar için), TBRT ile kombine SRC olarak sayılabilir (80,87,88). RTOG RPA sınıflandırılması Tablo 2-2’de özetlenmiştir:
Tablo 2-2: Beyin metastazlı hastalarda RTOG RPA sınıflandırması (86)
RPA sınıfı tanım median sağkalım
sınıf I KPS > 70
yaş < 65
primer kontrol altında ekstrakanial metastaz yok
7.1 ay
sınıf II KPS > 70 (+) alttakilerden en az biri
yaş > 65
primer kontrol altında değil ekstrakranial metastaz var
4.2 ay
Profilaktik kranyal radyoterapinin (PKRT) temeli, mikroskobik metastatik hastalığı beyin veya beyin sapında klinik olarak manifeste olmadan elimine etmektir (89). Tedavi sahası TBRT ile benzerdir ve beyin ve beyin sapı dahil tüm intrakranyal kompartmanı, foramen magnumun alt sınırına kadar veya birinci veya ikinci servikal vertebranın alt sınırına kadar olan alanı içerir. Karşılıklı lateral sahalardan verilen tedavide uniform bir doz dağılımı sağlanırken, bloklar veya multikolimatör lifler ile lensler korunur (91). PKRT yapılmayan küçük hücreli akciğer kanseri (KHAK) hastalarının %60’dan fazlasının klinik olarak saptanabilir veya semptomatik beyin metastazı geliştirdiği, PKRT ile bu oranın %20 dolaylarına indiği saptanmıştır (94). Hem sınırlı evre hem yaygın evre KHAK’de, PKRT’nin genel sağkalımı arttırdığı gösterilmiştir (95). PKRT, sistemik tedaviye iyi yanıt veren sınırlı/yaygın evre KHAK’de standart hale gelmiştir (92,93). Küçük hücreli dışı akciğer kanserinde (KHDAK) de çalışmalar mevcut olup, beyin metastazında azalma sağlanmasına rağmen, sağkalım artışına dair bir veri elde edilememiştir (76,90). Pediatrik popülasyonda, yüksek riskli akut lenfoblastik lösemi (ALL)’de PKRT standart olarak yapılmaktadır (75). Tedavi sahası; kranyal meninksleri, kribriform plate’i, retina ve göz glob posteriorunu, 3.-4.-5.-6. kraniyal sinir çıkışlarını içermeli ve C1-C2 vertebra aralığına dek uzanmalıdır (85).
2.4.1 Kranyal RT Yan Etkileri
Kranyal RT, iyi tolere edilebilen bir tedavi şekli olsa da erken ve geç dönem bir çok yan etkisi bulunur (100). Yaş (>60, <12), metastaz boyutu, tümöre bağlı ödemin büyüklüğü gibi faktörler yan etki geliştirme riskini arttırır (100). Yan etkiler ortaya çıkma zamanına göre akut, subakut ve geç dönem yan etkiler olarak sınıflandırılır (102). Bu yan etkileri değerlendirmek için çeşitli skorlama sistemleri tanımlanmıştır. En sık kullanılan sistemler National Cancer Institute (NCI) Common Toxicity Criteria ve RTOG/European Organisation for Research and Treatment of Cancer (EORTC) Late Effects Normal Tissue Task Force (LENT)-Subjective, Objective, Management, Analytic (SOMA) sistemleridir (101,115). Ancak hafif nörokognitif defisitler ve nöroendokrinolojik sekeller, bu sistemlerde skorlanmamıştır.
Yorgunluk, en sık rastlanan akut yan etkilerden olup tedavinin ilk günlerinden ilk haftalarına kadar görülebilir (100). RT’ye bağlı alopesi, dermatit, bulantı-kusma, iştahsızlık da akut yan etkiler içindedir ve alopesi dışındakiler genelllikle kendiliğinden veya medikal tedavi ile iyileşir (104). Beyin ödemi de rölatif olarak sık görülür ancak genelde kortikosteroidlere yanıtlıdır (103).
Akut ensefolapati, nadir de olsa görülebilen, ciddi başağrısı, nörolojik defisit, bilinç kapanması ve ciddi vakalarda intrakranyal basınç artışına bağlı serebral herniasyon sonucu ölümle sonuçlanabilen bir komplikasyondur (107). Bu ağır klinik, en çok fraksiyon (fx) başına 3 Gray (Gy) üzeri TBRT alan hastalarda saptanmıştır (105). 45 hastaya tek fraksiyonda 10 Gy TBRT yapılan bir çalışmada, 3 hasta (%6,7) tedaviden sonraki birkaç saat içinde ölmüştür (106).
2.4.1.2. Subakut Yan Etkiler
TBRT’nin başladığı ilk haftalardan tedavi bitiminden sonraki 3 aya kadar olan süre içinde ortaya çıkar (100). Hafızada bozulma gibi nörokognitif defisitler, fokal veya genel nörolojik semptomlar, yorgunluk ve somnolans görülebilir (101). Tedavi sonrası 1-4 ay içinde klinik yan etkilerden başka, radyolojik değişiklikler de saptanabilir. Tedavi sonrası çekilen kontrastlı manyetik rezonans görüntülemede (MR) diffüz kontrast tutulumu ile seyredip hastalık progresyonu ile karışabilir (108). Bu durum psödoprogresyon olarak adlandırılır ve daha yüksek doz tedavi ile ilişkilidir (109).
Somnolans sendromu, TBRT sonrası ilk olarak pediatrik popülasyonda tanımlanmıştır (110,111), ancak erişkin hastalarda da rastlanmıştır (113). Somnolansın yanında, yorgunluk, ateş, bulantı, kusma, disfazi, disartri ve irritabilite tabloya eklenebilir (111-113). Genellikle 1-3 hafta içinde kendiliğinden iyileşir. Bazı vakalarda, özellikle ALL tanısı ile PKRT alan çocuklarda, uzun dönem nörolojik disfonksiyonlara yol açabilir (114). Kortikosteroid kullanımı bu grupta somnolans sendromunu önlemek için idealdir (111).
2.4.1.3. Geç Yan Etkiler
RTOG tarafından, tedavinin başlangıcından itibaren 90 gün sonrasında ortaya çıkan yan etkiler olarak tanımlanmıştır (115). Geç yan etkiler en çok korkulan yan
etkilerdir. Akut ve subakut yan etkilerin aksine, kendiliğinden iyileşmez ve ciddi sonuçları olabilir (102).
Nörokognitif defisit sık görülür. RT’ye bağlı nörokognitif dejenerasyon, bifazik bir pattern izler. Tedavi sonrası 4. ayda mental fonksiyonlarda geçici bir azalma olur, bunu takip eden süreçte nörokognitif fonksiyonlarda artış görülür; tedavi bitiminden aylar-yıllar sonra ise nihai olarak geri dönüşümsüz bir düşüş yaşanır (116,117).
TBRT alan hastalarda bu yan etkilerin sıklığını ölçmek zordur. Çünkü, beyin metastazlarının varlığı, paraneoplastik nörokognitif disfonksiyon, kemoterapiye bağlı nörokognitif bozukluk gibi değişkenlerin varlığı kafa karıştırıcı olabilir (118). Tallet ve ark. tarafından yapılan metaanalizde, değişik şemalarda yapılan TBRT sonrası nörokognitif defisitler, 3. ayda %31-57, 1. yılda ise %48-89 olarak saptanmıştır (119). Her ne kadar TBRT’nin nörokognitif disfonksiyona yol açtığı düşünülse de, Li ve arkadaşaları tarafından beyin metastazlı hastalarla yapılan çalışmada, nörokognitif fonksiyonda bozulmaya TBRT’den daha çok intrakranyal hastalık progresyonunun neden olduğu görülmüştür (120). TBRT sonrası ise, tedaviye iyi yanıtlı hastalarda tümör regresyonuna bağlı olarak, nörokognitif fonksiyonlarda iyileşme saptanmıştır (120).
Lökoensefalopati, yüksek doz tedavilerde daha sık saptanır. Klinik tablo; nöbet, letarji, nörokognitif disfonksiyon ve disartri ile karakterizedir ve tedaviden aylar bazen yıllar sonra görülebilir (121,122). Tanı radyolojik olarak desteklenebilir. En fazla periventriküler bölgede olmak üzere ak maddede diffüz hasar görülür. Bu bulgu T2 baskılı MR’da, hiperintensite, bilgisayarlı tomografide (BT) ise hipodensite olarak karşımıza çıkar. Her iki görüntülemede de sulkal ve ventriküler büyüme saptanabilir (123-125).
Lökoensefalopatinin, ALL tanısıyla PKRT alan pediatrik popülasyonda sık görülmesi, PKRT’nin bu grupta daha seçici kullanımını göz önünde bulundurmayı gerektirmektedir (122).
Radyasyon nekrozu, TBRT sonrası görülen en ağır lokal toksisitedir. Etkilenen bölgede nekroz vardır ve geri dönüşsüzdür. Patolojik olarak, küçük arter ve arteriollerdeki fibrinoid nekroz ile karakterizedir ve vasküler endotelindeki hasara bağlı ortaya çıktığı sanılmaktadır (129,130). Küçük damarlardaki hasarın yanı sıra, büyük serebrovasküler damarlar da (özellikle Willis halkasının ön yarısını içeren damarlar) RT’nin etkilerine karşı hassastır (126-128). Çok nadir görülse de, RT’nin
hemoraji ve tromboza eğilimli sklerotik arterler ve bu arterlerin etrafında zayıf kollateral yapısı ile karakterize Moyamoya sendromu gelişebilir. Bu sendrom sonucu ağır demans ve ölüm görülebilir (129,130). Radyolojik bulgusu tipik olarak, anjiografide saptanan ‘’puff of smoke’’ görünümüdür. Bu işaret, küçük kollateral damar dansitelerini illüstre eder (131).
2.5. Nörokognitif toksisite
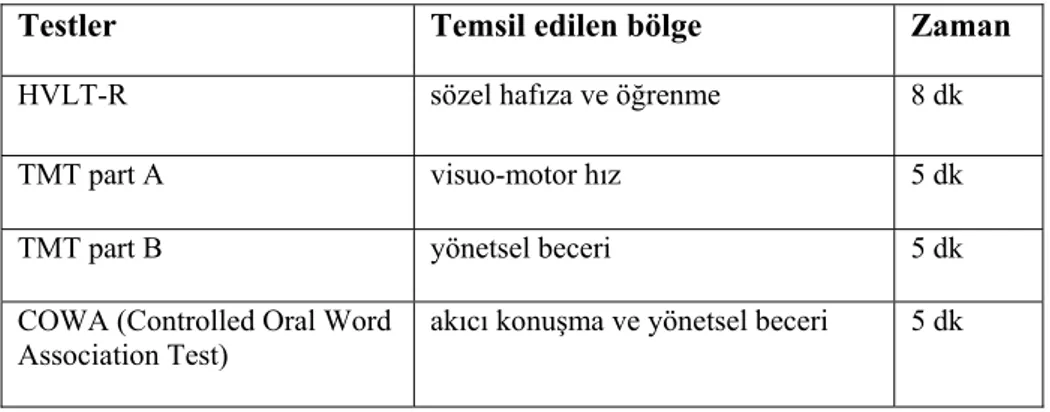
Nörokognitif disfonksiyon, hafıza ve öğrenmede, dikkatte, işlem yapabilme-yönetsel fonksiyonlarda ve motor fonksiyonlarda azalma olarak tariflenir (100). Beyin tümörlü hastalarda nörokognitif fonksiyonları (NKF) etkileyen, tedavi ve hastaya bağlı birçok faktör vardır (132). Bu hastaların genel sağkalımları birkaç ayla sınırlı olabildiğinden, geç yan etki değerlendirmesi her zaman efektif yapılamamaktadır (133). Nörokognitif toksisiteyi ölçmek için geliştirilen çok sayıda test vardır (133-135). Hasta uyumunu kolaylaştırmak için bu testlerin toplamda 30 dakika içinde tamamlanması önerilmektedir (135). Ancak çalışmalarda yapılan testler ve testlerin zamanlaması standart olmadığından defisit insidansını saptamak güçleşmektedir. Örneğin eski çalışmalarda, kranyal RT sonrası NKF’yi ölçmek için kullanılan ‘’Mini-Mental State Examination’’ (MMSE) testi, sadece demansı saptamada faydalı olurken, diğer nörokognitif değişiklikleri göstermede yetersiz kalmıştır (135,136) Kranyal RT sonrası birçok çalışmada hastaların ‘’The Hopkins Verbal Learning Test – Revised’’ (HVLT-R) ve ‘’Trail Making Test’’ (TMT) skorlarına göre NKF’da azalma saptanırken, MMSE skorlamasında bu azalma saptanamamıştır (137,138). Birçok çalışma grubu tarafından önerilen, geçerliliği kabul edilmiş, sensitif ve sık kullanılan ölçüm testleri Tablo 2-3’te gösterilmiştir (135).
Tablo 2-3: Nörokognitif fonksiyon değerlendirme testleri (135)
Testler Temsil edilen bölge Zaman
HVLT-R sözel hafıza ve öğrenme 8 dk
TMT part A visuo-motor hız 5 dk
TMT part B yönetsel beceri 5 dk
COWA (Controlled Oral Word
2.6. Hipokampus korumalı TBRT’nin Preklinik ve Klinik Dayanağı
Hipokampusun temel fonksiyonları; yeni bilgileri öğrenme, önceden kazanılmış bilgiyi kuvvetlendirme ve gerektiğinde bunlara erişimi sağlama ile yeni hafıza oluşumunda rol almaktır (139). Hipokampusun radyasyona bağlı bilateral veya unilateral harabiyetinde öğrenme ve yeni hafıza oluşturmada zorluk yaşandığı bilinmektedir (140). Bu sürecin patofizyolojisi tamamen açıklanamamakla birlikte, üzerinde en çok durulan nörogenez üzerindeki etkilerdir (141).
Nöral kök hücreler beynin farklı bölgelerinde konumlanmakta ancak özellikle SVZ ve hipokampüse ait bir yapı olan SGZ’da bulunmaktadır (142). Hipokampal SGZ, öğrenme ve hafıza oluşumunda önemli bir merkezdir (143). Nöral kök hücreler, kök hücrelerin tipik özelliklerini taşırlar; çoğalabilme ve başka hücrelere diferansiye olabilme yetenekleri vardır (144). Nörogenez, astrosit veya endotel hücreleri gibi regülatör hücrelerin katkıda bulunduğu, ‘’niş’’ adı verilen özel bir nörojenik mikroçevrede gelişen ve nöral kök hücrelerin değişimini koordine eden kompleks bir işlemdir (145,146).
Yapılan birçok preklinik çalışmada hipokampus aracılı nörokognitif disfonksiyon hipotezi desteklenmiştir (147-154). İn vivo çalışmalar nöral kök hücrelerin (NKH) iyonizan radyasyona hassasiyetini göstermektedir. İyonizan radyasyon sonrası NKH’deki apoptoz, ilk olarak genç erişkin ratlardaki subependimal zonda gösterilmiştir. Tek fx 5 Gy veya 30 Gy RT sonrasındaki 6. saatte apoptozun pik yaptığı saptanmıştır (147). Birkaç yıl sonra, yine ratlarda, tek fx 10 Gy RT sonrasında dentat girusta apoptoz gösterilmiştir (148). Gerek tek fx gerek fraksiyone beyin RT sonrası kemirgenlerde görülen kognitif bozulma, nörogenezde meydana gelen azalma ile ilişkilendirilmiştir (149). Muzimatsu ve ark., deney farelerinde, çeşitli dozlarda tek fx tüm beyin RT’si yapmış ve hipokampal dentat girus SGZ’da bulunan immatür nöronları, prolifere olan hücreleri ve apoptozu saptayabilmek için immünohistokimyasal boyama metodunu kullanmıştır. RT sonrası 12. saatte doz bağımlı apoptozda pik saptanmış ve bunu takiben SGZ’da prolifere olan hücre miktarında azalma gözlenmiştir (150). Nörogenezde görülen değişiklikler, inflamatuar yanıt ile ilişkilendirilmektedir. RT sonrasında saptanan mikroglia hücrelerinin aktivasyonu, inflamatuar yanıt teorisini doğrulmaktadır (151). Buna ek olarak, kemirgenlerde ramipril ve indometazin gibi antiinflamatuar ajanların uygulanmasını
takiben RT’ye bağlı kognitif bozulmada azalma saptanması, inflamatuar yanıtın RT’nin etkileri için önemli bir mediatör olduğunu göstermektedir (152).
Ancak, radyasyonun nörogenez üzerindeki etkilerini inceleyen bu mekanizmalar, hipokampusun radyobiyolojisini tam olarak açıklayamamıştır (155). Daha güncel olan in vivo ve in vitro çalışmalar, kognitif değişikliklerde, RT sonrası hipokampuste ortaya çıkan daha farklı mekanizmaların rol alabileceğini belirmektedir (156). Kalifoniya Üniversitesi’nde yapılan bir araştırmada, SYBR green boyası kullanılarak, düşük doz RT’nin etkileri, radyolojik değişiklikler ortaya çıkmadan önce saptanmaya çalışılmıştır. Sonuç olarak, 2 Gy RT sonrasında bile, diferansiasyona uğrayan NKH sayısında azalma saptanmıştır (157). Aynı gruptaki araştırmacıların yaptıkları başka bir çalışmanın sonuçlarına göre, RT’ye bağlı görülen nörogenez inhibisyonunun, oksidatif strese bağlı olabileceği ileri sürülmektedir (158). Parihar ve Limoli’nin, RT sonrası NKH sayı ve fonksiyonunda azalma ile birlikte, nöronal yapıdaki değişimi göstermesi, bu mekanizmanın da RT etkilerine aracılık edebileceğini düşündürmektedir. Bu çalışmada RT sonrası dendritik dallanmada, boyut ve alanında azalma gözlenmiştir (159).
Güncel çalışmalar, kranyal RT sonrasında NKH’nin doz-cevap ve klonojenik sağkalım eğrisi ile ilgili veriler sağlamıştır. Bu veriler, radyasyon onkoloğunun önerilen doz sınırları içinde, uygun tedavi planı yapmasında önemlidir (160)
Quantitative Analysis of Normal Tissue Effects in the Clinic (QUANTEC) analizinde, normal beyin dokusunun değeri 2.9 olarak belirlenmiştir (160). Hipokampal bölge için ise, değeri genellikle 2-3 arası bir değer olarak alınır (170). Ancak bir kısım araştırmacı, NKH kompartmanlarının değerini 10 olarak alır (180), ki bu değer kök hücreler için belirlenen genel değerdir (160). Bazı yazarlar ise gerçek hipokampus için bu değeri 10, tüm hipokampus için ise 2 olarak alır (174). Bütün bu farklılıklar, hipokampusun radyasyon sensitivitesi için konsensus eksikliği olduğunu göstermektedir. Ancak preklinik çalışmalarda, 2 Gy RT sonrasında bile NKH apoptozu görülmesi, hipokampusun ‘’no-shoulder dose response’’ olduğunu düşündürmektedir (157). Tüm bu preklinik verilerden yola çıkarak, nörokognitif disfonksiyonun çok düşük dozlarda dahi (<10 Gy) ortaya çıkabileceği iddia edilebilir (158).
Preklinik verilere ek olarak, retrospektif klinik veriler de, hipokampal bölgenin, RT sonrası görülen nörokognitif disfonksiyonda rol alabileceğini desteklemektedir.
Beyin tümörü tanılı, prospektif klinik çalışma protokolü içerisinde RT alan çocuk hastalarda yapılan nörokognitif ölçümlerde, sol temporal lob ortalama dozu 45 Gy ve üzeri olanlarda, longitudinal Intelligence Quotient (IQ)’ da anlamlı düşüklük saptanmıştır (162,163). Low grade glioma (LGG) tanılı yetişkin hasta grubunda, RT öncesi ve RT sonrası 18. ayda NKF değerlendirmesi yapılmış. Sonuç olarak, hipokampus volümünün %40’ nın 7,3 Gy biyolojik eşdeğer dozundan fazla aldığı hastalarda uzun dönem nörokognitif fonksiyonlarda, özellikle ‘’list-learning delayed recall’’ da bozulma saptanmıştır (164). MD Anderson’da yapılan bir çalışmada, LGG veya anaplastik beyin tümörü tanılı hastaların sol hipokampus maksimum dozları, öğrenmede ve delayed recall’da azalma ile ilişkili bulunmuştur (165). Jalali ve ark., LGG tanılı hastalara prospektif olarak IQ ölçümü yapmış ve sol temporal lob ile IQ düşüşü arasında önemli bir korelasyon saptamış (166).
RTOG 0933, bu konuda yapılan ilk prospektif faz II çalışmadır. Bu çalışmada, beyin metastazı tanılı hastalara HK TBRT yapılmış, 4. ayda HVLT-R ile ‘’delayed recall’’ değerlendirmesi yapılarak (primer sonlanım noktası) daha önce klasik TBRT alan kontrol grubunun sonuçları ile karşılaştırılmıştır. Sonuç olarak, HK TBRT yapılan hastaların sadece %7’sinde hafızada azalma saptanırken, kontrol grubunda bu oran %30 olarak bulunmuştur (167).
2.7. Hipokampus korumalı TBRT fizibilite çalışmaları
Yapılan çok sayıda çalışma HK TBRT’nin dozimetrik fizibilitesini göstermiştir. Lineer akseleratör (LINAC) Intensity modulated radiotherapy (IMRT), Helikal Tomoterapi (HT), VMAT gibi tekniklerin yanısıra, step & shoot IMRT tekniği ile de HK TBRT mümkün olabilmektedir (168-170). Farklı tekniklerle yapılan, Hipokampus korumalı TBRT temel fizibilite çalışmaları Tablo 2-4’te verilmiştir.
HK TBRT için öncü çalışma 2007’de Gutierrez ve ark. tarafından yapılmıştır. HT tekniği ile HK TBRT ve metastazlara yönelik simültane entegre boost (SIB) yapılmıştır. Sonuç olarak, tüm beyinde konvansiyonel RT eşdeğeri homojen doz dağılımı sağlanmış, metastazlara yönelik yapılan SIB tekniği ile radyocerrahi eşdeğeri dozlara çıkılabilmiş ve hipokampal koruma konformal bir şekilde başarılabilmiştir (169).