T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
KADIN HASTALIKLARI VE DOĞUM ANABİLİM DALI
BAŞKAN: PROF. DR. İSMAİL METE İTİL
İNSAN YUMURTALIK KANSERİ HÜCRE
HATLARINDA (MDAH 2774 VE OVCAR 3)
LEPTİNİN APOPTOZA OLAN ETKİLERİ
UZMANLIK TEZİ
DR. AYTAN NAJAFALİYEVA
DANIŞMAN
PROF. DR. M. COŞAN TEREK
ii
ÖNSÖZ
Uzmanlık eğitimim boyunca iyi yetişmem için bana her konuda destek veren, bilgi ve deneyimlerini aktaran ana bilim dalı başkanımız Sayın Prof. Dr. İsmail Mete İtil’e teşekkür ederim.
Uzmanlık eğitimim ve tezimin her aşamasında desteğini gördüğüm, bu tezin gerek fikir gerekse sürdürülme aşamasında çok büyük pay sahibi olan, tezimin her aşamasında bana yol gösteren, yardım ve desteğini esirgemeyen, bilgi ve tecrübesinden yararlandığım danışman hocam Sayın Prof. Dr. M. Coşan TEREK’e teşekkür ederim.
Kadın Hastalıkları ve Doğum Anabilim Dalı’nda uzmanlık eğitimim boyunca bilgi, deneyim ve yardımlarıyla bu alanda yetişmemde katkısı olan tüm değerli hocalarıma, başta Sayın Prof. Dr. Teksin ÇIRPAN, Doç. Dr. Mete ERGENOĞLU, Doç. Dr. Özgür YENİEREN, Doç. Dr. Ali AKDEMİR, Doç. Dr. Levent AKMAN, Uzm. Dr. Çağdaş ŞAHİN’e ve Uzm. Dr.Fırat ÖKMEN’e ayrıca birlikte çalışmaktan mutluluk duyduğum tüm araştırma görevlisi arkadaşlarıma ve servis, doğumhane, poliklinik, ameliyathane hemşire ve personeline teşekkür ederim.
Çalışmanın yürütülmesi sırasındaki katkılarından dolayı Tıbbi Onkoloji Bilim Dalından, Doç. Dr. Şaziye Burçak Karaca’ya, Harika Atmaca ve Latife Merve Oktay’a teşekkür ederim.
Beni yetiştiren, bugünlere getiren eğitimimde maddi ve manevi destek sağlayan, babam Dr. Seferali NAJAFALİYEV‘e ve annem Dr. Çimnaz NAGİYEVA’ya, assistanlığım boyunca desteğini esirgemeyen eşim Reşat’a, varlığı ile hayatımı şenlendiren kızıma ve kardeşlerime teşekkür ederim.
iii
İÇİNDEKİLER
ÖNSÖZ... ... ii
İÇİNDEKİLER ... iii
ŞEKİLLER VE TABLOLAR LİSTESİ ... iv
ÖZET……… ... v ABSTRACT ... vi KISALTMALAR ... vii 1.GİRİŞ ... ... 1 2.GENEL BİLGİLER... ... 2 3.GEREÇ ve YÖNTEM ……... ... 21 4. BULGULAR... ... 30 TARTIŞMA... ... 33 SONUÇ... ... 40 KAYNAKLAR……… ... 41 .
iv
ŞEKİLLER LİSTESİ
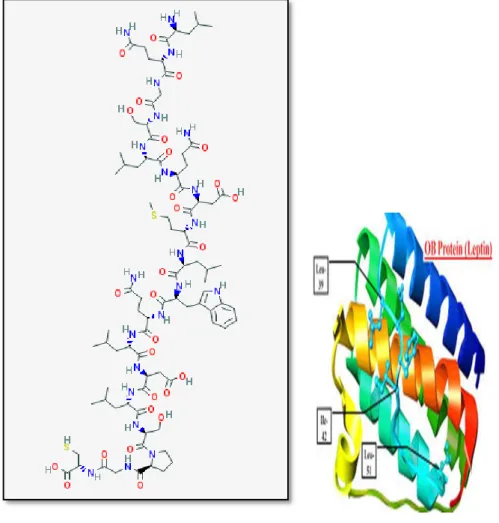
Şekil 1: Leptin hormonunun kimyasal yapısı (a) ve 3 boyutlu protein yapısı (b). 3
Şekil 2: Leptin sinyal yolakları 5
Şekil 3: Apoptoz mekanizması 15
Şekil 4: MDAH-2774 (a) ve OVCAR-3 (b) hücre hatlarının inverted
mikroskop görüntüleri 22
Şekil 5: MDAH-2774 hücre hattında 24 saat serum açlığı sonrası 72. saatte
ve OVCAR-3 hücre hattında 48 saat serum açlığı sonrası 24. saatte vehücre
v
TABLOLAR LİSTESİ
Tablo 1: Over kanserlerinin histolojik özellikleri, öncüleri ve ayırıcı
moleküler özellikleri 10
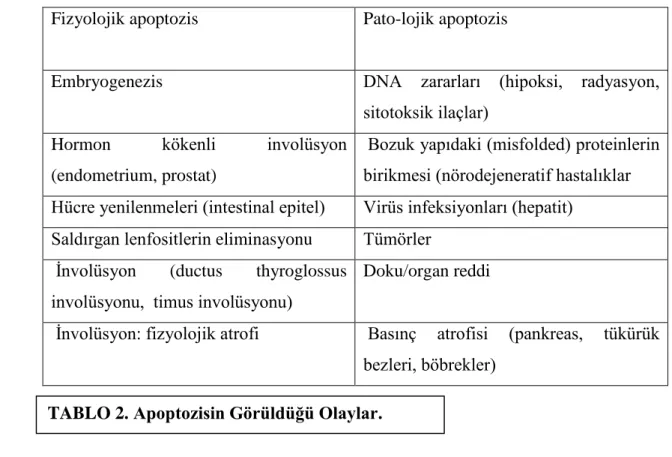
Tablo 2. Apoptozisin Görüldüğü Olaylar 18
Tablo 3: Leptin düzeyleri 28
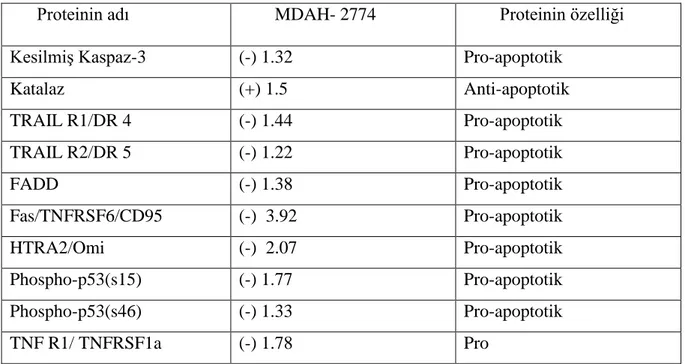
Tablo 4: MDAH-2774 hücre hattında 24 saat serum açlığının ardından 72 saatlik
25 ng/ml leptin uygulanmış hücrelerde, leptin uygulanmamış hücrelere göre proapoptoz ve antiapoptoz protein miktarlarındaki değişimler (kat olarak, pozitif
değerler proetin değişimlerindeki artışı, negatif değerler azalmayı göstermektedir). 31
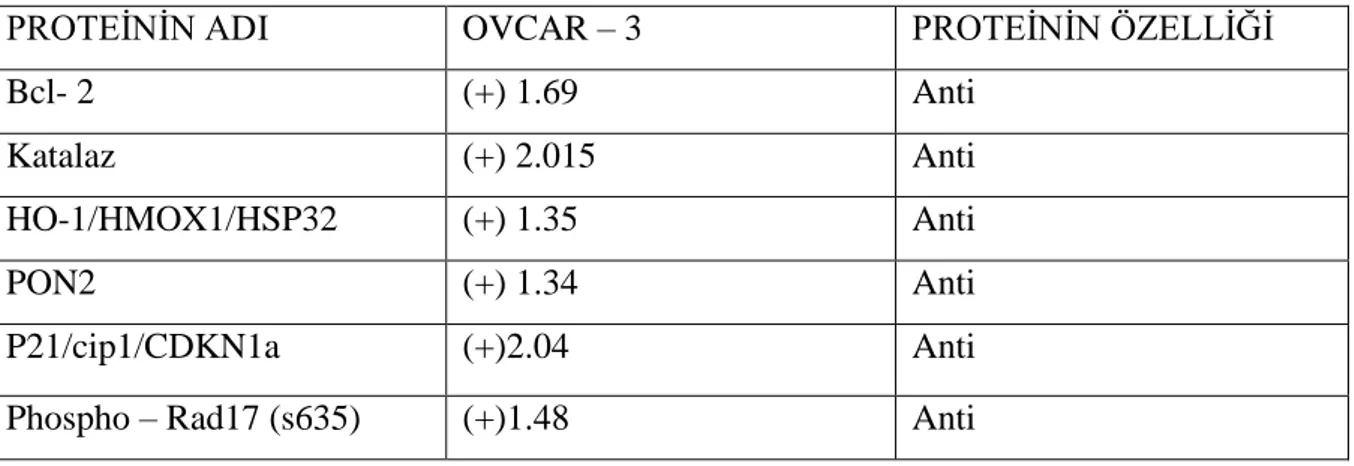
Tablo 5: OVCAR-3 hücre hattında 48 saat serum açlığının ardından 24 saatlik
50 ng/ml leptin uygulanmış hücrelerde, leptin uygulanmamış hücrelere göre proapoptoz ve antiapoptoz protein miktarındakı değişimler (kat olarak, pozitif
vi
ÖZET
Obezite çeşitli kanser tiplerinin gelişimiyle sıkı bağlantılı bir hastalıktır. Obezitenin, kanser riskini hangi biyolojik mekanizmalarla ve nasıl etkilediğine dair yapılan çalışmalar; farklı kanser türleri için farklı mekanizmaların söz konusu olabileceğini göstermektedir. Leptin seviyesi obez hastalarda normal populasyona göre daha yüksek olduğu bilinmektedir. Bu çalışmada leptinin over kanseri hücrelerinde (MDAH-2774 ve OVCAR-3) apoptoza olan etkilerini ortaya koymak amaçlanmıştır. 24 ve 48 saat serum açlığına bırakılan MDAH-2774 ve OVCAR-3 hücre hatlarında artan konsantrasyonlarda leptin uygulamasının (0.5-400 ng/ml) 24, 48 ve 72 saat sonunda hücre çoğalması üzerindeki etkilerini belirlemek amacıyla XTT testi, proapoptoz ve antiapoptoz protein miktarlarındaki değişimleri belirlemek amacıyla apoptoz array (Human Apoptoz Array C5, RayBiotech) yöntemi kullanılmıştır. Elde edilen bulgular ANOVA ve ardından Dunnett’s istatistiksel analizleriyle değerlendirilmiştir.
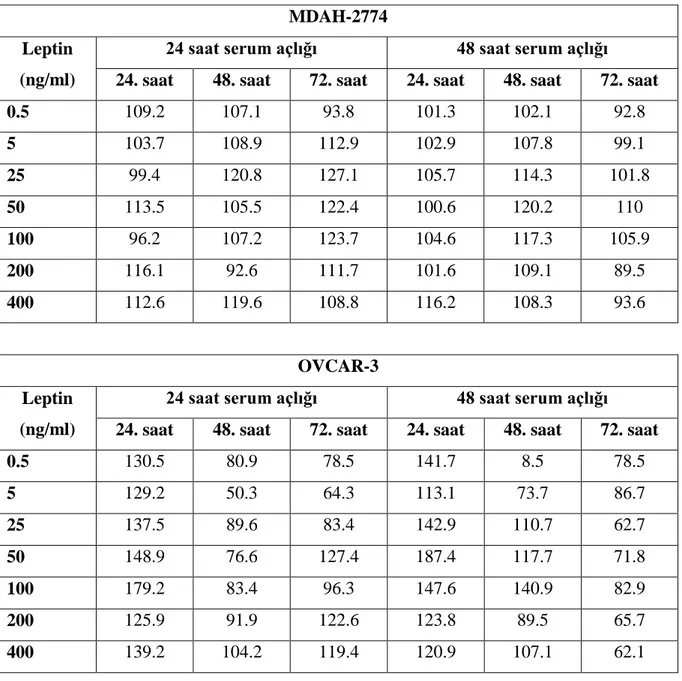
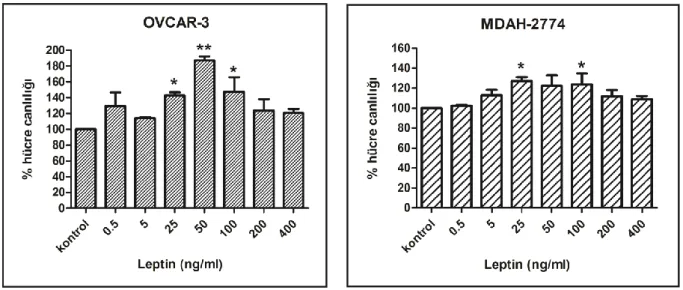
Çalışmamızda 24 ve 48 saat serum açlığına bırakılan hücre hatlarında leptin uygulamasının hücre çoğalmasını artırdığı gözlenmiştir. 24. saat serum açlığına bırakılan MDAH-2774 hücre hattında 25 ng/ml leptin uygulaması ile 72. saatte hücrelerin kontrol hücrelerine göre %127.1 oranında çoğalması ile maksimum etki gözlenmiştir. 48. saat serum açlığına bırakılan OVCAR-3 hücre hattında ise 50 ng/ml leptin uygulaması ile 24. saatte hücrelerin kontrol hücrelerine göre %187.4 oranında çoğalması ile maksimum etki görülmüştür.
Leptin uygulaması sonucu her iki hücre hattında da antiapoptotik protein olan katalaz seviyelerinde artış izlenmiştir. MDAH-2774 hücre hattında proapoptotik proteinler olan TRAİL R1/DR4, TRAİL R2/DR5, FADD, HTRA 2/Omi, PHOSPHO-53 (S15), Fas TNFRSF6/CD 95 seviyelerinde azalma görülmüştür. OVCAR-3 hücre hattında leptin uygulaması ile antiapoptotik etkiye sahip Bcl-2, PON2, p21/cip1/CDNK1a, phospho-Rad17(s635), HO-1/HMOX1/HSP32, katalaz seviyesinde artış belirlenmiştir
Epidemiyolojik araştırmalar, obezitenin over kanseri insidansını arttırdığını, yaşam süresini ve nüks riskini arttırdığını göstermektedir. Bu çalışma klinik gözlemlerin altında yatan ve henüz tam olarak aydınlatılmamış olan moleküler mekanizmalar açısından bir kaynak oluşturmaktadır.
vii
ABSTRACT
Obesity is closely linked to the development of various cancer types. Studies on which biological mechanisms and how obesity affects the cancer risk showed that there may be different mechanisms for different types of cancer. It is known that leptin levels in obese patients are higher than in normal population. The objective of the present study is to reveal the effects of leptin on cell proliferation and proapoptotik, antiapoptotik protein levels in human ovarian cancer cell lines MDAH-2774 and OVCAR-3.
XTT test was used to evaluate the effect of increasing concentrations of leptin treatment (0.5 – 400 ng/ml) on cell proliferation in OVCAR-3 and MDAH-2774 cell lines at 24, 48 and 72 hours after 24h and 48h serum starvation, respectively. Human Apoptosis Array was used to determine the changes in proapoptotik and antiapoptotik protein levels. The findings were evaluated by ANOVA followed by Dunnett’s statistical analyzes.
In our study it was observed that leptin treatment increased the cell proliferation after 24h and 48h serum starvation.
The maximum effect was observed with a proliferation of 127.1% compared to control cells in MDAH-2774 cell line with 25 ng/ml leptin treatment at 72h after 24h serum starvation The maximum effect was observed with a proliferation of 187.4% compared to control cells in OVCAR-3 cell line with 50 ng/ml leptin treatment at 24h after 48h serum starvation
As a result of leptin treatment, there is an increase in proapoptotik protein catalase in both of cell lines. There is an increase in antiapototic proteins Bcl-2, PON2, p21/cip1/CDNK1a, phospho-Rad17 (s635), HO-1/HMOX1/HSP32 levels in-OVCAR-3 cell line by leptin administration. There is a decrease in proapoptotic proteins TRAİL R1/DR4, TRAİL R2/DR5, FADD, HTRA 2/Omi, PHOSPHO-53 (S15), Fas TNFRSF6/ CD 95 levels in MDAH-2774 cell line by leptin administration.
Epidemiological studies have shown that obesity increased the ovarian cancer incidince, life span and risk of relapse. This study is a reference for the molecular mechanisms, which are not fully identified, underlying clinical observations.
viii
KISALTMALAR
AKT protein kinaz B
AMPK AMP ile aktive olan protein kinaz
BRCA1/2 meme kanseri geni 1/2
CA125 kanser antijeni 125
EGF epidermal büyüme faktörü ER östrojen reseptörü
GSK3A/B glikojen sentaz kinaz3 A/B
IGFR insülin benzeri büyüme faktörü reseptörü
IGFRBP insülin benzeri büyüme faktörü reseptörü bağlanma proteini
IL interlökin
JAK/STAT janus kinaz / transkripsiyonun sinyal ileticileri ve aktivatörleri
KRAS Kirsten fare sarkoma virüsü geni LPA lizofosfotidik asit
MAPK mitojenle aktive olan protein kinaz
MCP monosit kemoatraktan proteini
NF-kB nüklear faktör kappa-B NK doğal öldürücü
ng/ml nanogram / mililitre
Ob obezite geni
Ob-R obezite geni reseptörü PI3K fosfotidilinozitol- 3 kinaz
PLC fosfolipaz C
PTEN fosfataz ve tensin homoloğu RB retinoblastoma geni
1
1.GİRİŞ
Erken dönemde herhangi bir yakınma vermemesi ve erken tanı için etkili bir tarama yönteminin olmamasından dolayı günümüzde over kanseri, jinekolojik kanserler arasında en ölümcül olanıdır (1,2). Over kanseri farklı jinekolojik dokulardan gelişen, farklı klinik tablo çizen, genetik farklılıklara sahip olan ve tedavi şekillerine farklı yanıtlar veren alt tiplere ayrılan heterojen bir hastalıktır. Başladıkları hücre tiplerine göre over kanserleri epitelial, germ hücreli ve stromal tümörler olarak ayrılmaktadır (3). Over kanseri olgularının %90’ını epitelial over tümörleri oluşturmaktadır ve en sık görülenden en az görülene doğru sırasıyla; yüksek dereceli seröz karsinom, berrak hücreli, endometrioid, müsinöz ve düşük dereceli seröz over kanseridir (4).
Hastaların küçük bir kısmında yakınma olmadan jinekolojik muayene ve ultrasonografik inceleme sırasında overde değişik büyüklükte kitle saptanabilir. Hastaların büyük bir bölümünde tümör karın içerisine yayılmıştır ve ileri evre olgularından oluşur. Bu hastalarda yapılan muayene, ultrasonografik inceleme veya diğer görüntüleme yöntemlerinde, batın içerisinde kitle ve assit saptanabilir. Serum CA 125 düzeyi çoğu ileri evre olguda yüksek saptanır. Serum tümör belirteç düzeyinin düşük olması, olgunun malign olmadığını göstermez ve tanıdan çok hastalığın izlemi için kullanılır.
Başarılı sitoredüktif cerrahi ve kombine kemoterapi uygulamaları sayesinde over kanseri olan hastalarda 5 yıllık sağkalım oranı son otuz yılda %37’den %45’e yükselmiştir (3). Hastalarının %60-70’inde cerrahi girişim ve kemoterapi sonrasında hastalık tekrarlamakta ve platin bazlı kemoterapiye direnç geliştiğinden over kanseri tedavisinde etkili yeni ilaçların belirlenmesine ve yeni tedavi yaklaşımlarına gereksinim vardır (5).
Literatüre göre over kanseri ile leptin hormonu arasında anlamlı bağlantılar bulunmaktadır. Leptin’in hücre çoğalmasını tetikleyen ve tümör oluşumuna katkıda bulunan yolakların ortaya konulması ve bu yolların baskılanması alternatif bir tedavi yaklaşımı olarak düşünülebilir.
Bu amaçla bu tez çalışmasında, leptinin farklı konsantrasyonlarının, insan over kanserinin endometrioid karsinom alt tipi olan MDAH-2774 ve yüksek dereceli seröz karsinom alt tipi olan OVCAR-3 kültürlerinde hücre çoğalmasına etkileri ve ilgili olduğu apoptoz yolağı araştırılmıştır.
2
2. GENEL BİLGİLER
2.1. Leptin, yakın zamanda keşfedilen ve halen araştırılmakta olan, metabolizmayı ve
tüm vücut sistemlerini düzenleyici bir hormondur. Leptin kelimesi Yunanca ince, zayıf anlamına gelen leptos kelimesinden türetilmiştir. Leptin hormonu, Zhang ve ekibi tarafından 1994 yılında keşfedildikten sonra üzerinde geniş incelemeler yapılmış ve obezite geninin 167 aminoasitli hormonal protein ürünü olduğu bulunmuştur. Hormon aşırı gıda alan ve az enerji tüketen obez farelerde genetik defekt olarak tanımlanmış, gene “ob” ve mutasyonlu obez farelere “ob/ob” denmiştir. İnsanlarda 7. kromozomun uzun kolunda bulunan (7q31) ob/ob geninde kodlanmıştır (23).
Yağ dokusu enerji depolamanın yanısıra endokrin doku olarak da çalışmaktadır. Yağ dokusundan östrojen, progesteron ve androjenler gibi seks hormonları salınmaktadır. Seks hormonları dışında yağ dokusundan salınan majör hormon leptindir. Vücutta enerji homeostazının sağlanmasında leptin anahtar bir rol oynamaktadır. Adiposit kaynaklı bir hormon olan leptin, beslenme ve enerji homeostazında önemli bir rol oynamaktadır. Leptin, yapısal olarak sitokinlere olan benzerlikleri nedeniyle, sitokin sınıfında da yer alabilmektedir. Leptin eksikliği veya leptine direnç durumları; insanlarda obezite, diyabet ve infertilite ile sonuçlanmaktadır (21).
Vücuttaki leptin düzeyi vücut ağırlığıyla bağlantılı olarak değişkendir (6,7). Kandaki leptin düzeyleri gece yarısı ve sabahın erken saatleri arasında daha yüksektir (9). Kandaki leptin düzeyi kısa süreli açlık-diyet (24-72 saat) durumunda düşer (10, 11, 12). Açlığa adaptif yanıtın gelişmesinde leptin kritik bir rol oynamaktadır (8).
Leptinin merkezi görevi hipotalamus üzerinden enerji metabolizmasını düzenlemek olsa da bunun yanı sıra periferal etkileri de vardır. Leptin fetal ve maternal metabolizma arasında bir modülatör, ergenlik döneminde seçimsel faktör, immün hücre ve beta adacık hücreleri aktivatörü ve büyüme faktörü olarak da işlev görür. Ayrıca insülin, glukagon, büyüme hormonu, insülin-benzeri büyüme faktörü, glukokortikoidler, sitokinler ve metabolitler gibi çeşitli hormonlar ve enerji düzenleyicilerle de etkileşir (16).
Kadınlarda ve erkeklerde fertilite için leptin gereklidir. Kadınlardaki ovulasyon döngüsü enerji dengesiyle bağlantılıdır ve enerji dengesi yüksek derecede negatif olduğunda (yani açlık durumunda) veya enerji akışı çok yüksek olduğunda (aşırı egzersiz yapıldığında) over döngüsü ve menstruasyon durur. Leptin düzeyleri normal aralığın dışında olduğunda yumurta kalitesini
3
ve in vitro fertilizasyon sonucunu negatif olarak etkileyebilir (16). Ayrıca leptin hipotalamustan gonadotropin-salgılatıcı hormonu tetikleyerek üremede de rol alır (17).
Plasenta leptin üretir ve gebelik boyunca leptin seviyeleri fetusun kilosuyla orantılı olarak yükselir ve doğumdan sonra düşer (18). Leptin aynı zamanda fetal membranlardan da eksprese olur. Uterin kontraksiyonlar leptin tarafından engellenir (19). Bunun dışında leptin hiperemezis gravidarum ve polikistik over sendromunda rol oynar (20-21).
Leptin öncelikli olarak beyaz adipoz dokudaki adipositler tarafndan üretilir. Bununla birlikte kahverengi adipoz doku, plasenta (sinsitiyotrofoblast), overler, iskelet kasları, mide gastrik hücrelerde, meme epitel hücrelerinde, kemik iliğinde (15) ve P/D1 hücrelerinde de üretilir (22).
Leptin obesite geni (OB) tarafından kodlanan 16-kDA ve 167 aminoasitlik bir adipokin’dir ve Ob (leptin) geni insanlarda 7. kromozom üzerinde yerleşiktir (23). Moleküler formülü C87H138N22O28S2’dir. Leptin’in kimyasal yapısı şekil 1a’da ve 3 boyutlu protein yapısı
şekil 1b’degösterilmiştir (Şekil 2.1) ( 24).
a.Leptin hormonunun kimyasal yapısı b.üç boyutlu protein yapısı
4
Leptin kanda plazma proteinlerine bağlanarak veya serbest formda dolaşarak etkisini membran reseptörü olan obesite reseptörü (OB-R) üzerinden göstermektedir. Leptin reseptörünün alternatif kesim (alternative splicing) ile oluşan tek bir gen (Ob-R) tarafından kodlanan altı tip izoformu mevcuttur (Ob-Ra, Ob-Rb, Ob-Rc, Ob-Rd, Ob-Re ve Ob-Rf) (25). Ob-Rb hücre içi sinyalizasyonu ilete bilen tek izoformdur ve bu sinyalizasyon hipotalamik çekirdekte (26) Jak-Stat ve MAPK yolakları üzerinden olur (27). Leptin reseptörü sınıf 1 sitokin reseptörleri ailesine aittir. Bu resöptörler tipik olarak membranın hücre dışındaki bölgesinde ‘sitokin reseptör homolog domain’i içerirler ve ligand bu bölgeye bağlanır. Leptin sinyalizasyonunun diğer sınıf 1 sitokin reseptörleri gibi başlıca olarak JAK/STAT, MAPK ve PI3K yolakları üzerinden gerçekleştirmektedir (28). Sharma ve arkadaşlarının çalışmasında leptinin etki mekanizmasında JAK/STAT ve AKT yolaklarının anahtar rol oynadıkları bildirilmiştir (29).
2.1.1. Leptin Sinyal Yolağı
Ob-Rb (LEPRb) homodimer form oluşturur ve leptinle 1:1 sitokiometri ile bağlanır. Bu tetramerik reseptör/ligand kompleksi sinyal iletimi için temeldir. Leptin reseptörü hücre içi kinaz aktivitesinden yoksun olduğundan Janus Kinaz 2 (JAK2) gibi sitoplazmik kinazlara bağlanarak çoklu sinyal yolaklarına aracılık eder. Leptin tarafından JAK2’nin aktivasyonu Ob-Rb’nin tirozin fosforilasyonunu tetikleyerek leptin reseptörünün aktive olmasını sağlar ve bu aktivasyon da JAK/STAT, RAS/RAF/MAPK, IRS1/PI-3K, PLCγ ve AMPK/ACC gibi sinyal modüllerini aktive eder.
Aktive olmuş STAT’lar nukleusa geçerek sitokin sinyal supresörü 3 (SOC3) ve TIMP metalopeptidaz inhibitör 1 (TIMP 1) gibi genlerin ekspresyonlarını indükler ve SOC3, Ob-R’nin tirozin rezidüsüne bağlanarak geri bildirim yoluyla leptin yolağının inhibisyonuna aracılık eder. Sitozolik PTP1B, STAT3’ ve JAK2’yi defosforilleyerek leptin yolağını negatif yönde düzenler.
Leptinin reseptörüne bağlanması PTPN1’in fosforilasyonuyla sonuçlanır ve bu GRB2 için bir bağlanma bölgesi sunar. Bu bağlanmadan dolayı RAS-RAF-MEK sinyalizasyonuyla ERK modülü aktive olur.
5
Leptin SH2B/JAK2/IRS kompleksinin etkileşimi ve oluşumunu tetikleyerek PI-3K aktivasyonunu indükler. PI-3K aktivasyonu da protein kinaz B (AKT1) ve bunun downstream sinyal kaskadındaki memeli rapamisin hedefi (mTOR), nitrik oksit sentaz 3 (NOS3) ve fosfodiesteraz 3A (PDE3A)’nın aktivasyonuna aracılık eder. Aktive olmuş AKT ayrıca glikojen sentaz kinaz 3 alfa/beta (GSK3A/B) proteinlerini düzenler. İnhibitör Kappa-B kinazlar (IKK’lar) AKT aktivasyonuna yanıt olarak aktive olurlar ve ardından IKK’lar NF-kappa-B’nin nuklear translokasyonunu indükler.
Leptin 5’-AMP-ile aktive olan enerji sensörü gibi işlev gören protein kinaz (AMPK) sinyalizasyonunu düzenler. Aktive olmuş AMPK, yağ asidi biyosentez-asetil-CoA karboksilaz (ACC) enziminin aktive ederek yağ asidi biyosentezini düzenler.
Hücre içi kalsiyum seviyesini ve protein kinaz C aktivasyonunu düzenleyen PLC gamma da leptin sinyalizasyonu sonucu aktive olur. Bu bilgiler Şekil 2.2’de gösterilmiştir (Şekil 2.2) (30).
6
2.2 Over Kanseri
Adneksiyal kitle tanısı ile ilk akla gelen, overyan kitleler ve sıklıkla da neoplazilerdir. Ancak funksional kistler, endometriozis ya da dış gebelik olasılığı daima akılda tutulmalıdır. Fizik muayene esnasında pelviste palpe edilen kitle uterusa, overlere, tubalara, barsaklara ait olabilir.
Pelvik muayenede kitlenin lokalizasyonu, büyüklüğü, kistik ya da solid kıvamda oluşu, hareketli ya da fikse oluşu, hassasiyetin tek ya da iki taraflı oluşu ve birlikte assit varlığı gibi özellikler belirlenmelidir. Kitlenin boyutu 5 cm’den küçük ya da büyük olması, benign veya malign olma olasılığı açısından önemlidir. Malign lezyonlar daha çok fikse olma eğilimindedir ve çevre dokuyla yapışıktır. Tek taraflı ve kistik lezyonların benign, çift taraflı ve solid komponent içeren lezyonların ise malign olma olasılığı yüksektir. Overin malign patolojilerinde batında assit varlığına rastlanır.
Over kanseri tüm jinekolojik kanserler arasında ölüm oranı en yüksek olan jinekolojik malignitedir. Hastaların yaklaşık %45’inden azı tanı aldıklarında erken evrelerdedir (47). Genellikle postmenopozal dönemdeki kadınlarda görülür ve 50-60 yaş arasında pik yapar, 70’li yaşlara kadar yaşla birlikte artar. İnsidansı 40/100.000’dir. Her yıl dünyada, 225.500 yeni olgu saptanır (3). Hastalığın ileri evrelerine kadar belirti vermediği için over kanseri “silent killer” (sessiz katil) diye adlandırılmıştır. İlerlemiş epitelyal over kanseri pelvik ağrı bulantı, abdominal distansiyon zayıflama, çabuk doyma hissi, nefes darlığı gibi yakınmalarla kendini göstermektedir. Ancak bu belirtilerin daha çok gastrointestinal ve üriner sistem kaynaklı olduğu düşünülerek hastalık atlanmaktadır.
Over kanserinde sağkalım kanserin evresine bağlıdır ve 5 yıllık sağkalım oranı evre I ve II de %70-90’larda iken, evre III ve IV de %20-40’lara düşmektedir. Teknolojik gelişmelere karşın son 30 yılda over kanserinin mortalitesindeki azalma yüz güldürücü değildir (47).
Olguların erken evrelerde (Evre I/II) yakalanması ve uygun tedavinin (cerrahi ve /veya kemoterapi) verilmesi over kanserinin mortalitenin azaltılabilmesi için çok önemlidir. Günümüzde over karsinomu tanısında ve taramasında görüntüleme teknikleri, fizik muayene ve tümör belirteçleri kullanılmaktadır. Derin pelvik anatomik lokalizasyonundan dolayı, pelvik muayene ile over kanserinin erken tanısı çok nadirdir. Bundan dolayı pelvik muayene ile tanı konulan hastaların çoğunluğu ileri evrededir ve kötü prognozludur. Pelvik kitlenin ultrasonografide tespit edilebilmesi önemlidir ancak benign–malign ayırımı kişiden kişiye değişiklik gösterebilir. CA-125 over kanseri tansında en yaygın kullanılan tümör belirteci
7
olmasına rağmen erken evredeki over kanserlerinin tanınmasında yetersiz kalmaktadır, ayrıca endometriyozis, gebelik ve bazı inflamatuvar hastalıklarda da yükselmektedir.
2.2.1.Over Kanseri Risk Faktörleri
Over kanseri gelişiminde; aile öyküsü (anne, kız, kız-kardeş), erken menarş, geç menopoz, ileri yaş, beyaz ırk, PID, postmenopozal hormon tedavisi, nulliparite, yüksek yumurtlama döngüsü sayısı, ovulyasyon induksiyonu (klomifen sitrat riski 2-3 kat arttırır) genetik faktorlar sorumludur. Menopoz, infertilite, beslenme alışkanlığı, obezite, sigara kullanımı, virüsler, coğrafi alanlar ve ırksal varyasyonlar etkili olan faktörlerdir.
Multiparite, kombine oral kontraseptif kullanımı, tüp ligasyonu ve histerektomi, emzirme over kanseri riskini azaltan durumlardır. Gebelik ve oral kontraseptif kullanımının over kanserini ovulasyonu erteleyerek over kanserini azalttığı kabul edilmektedir (38) .Hankinson ve arkadaşlarının yaklaşık 121.700 kadın üzerinde yaptığı araştırmada, her doğumun over kanseri riskini azalttığı tespit edilmiştir. Whittemore, tek doğumun over kanseri riskini 0.47 oranında azalttığını, doğum sayısı artdıkca bu riski daha da azalttığını, altıncı doğumda ise risk oranının oldukça düştüğünü tespit etmiştir (39).
Obezitenin, meme ve endometrium gibi hormon ile ilişkili kanserlerde anlamlı risk faktörü olduğu ortaya konulmuştur. Son zamanlarda yapılan epidemiyolojik çalışmalarda obezite, artmış over kanseririski ile ilişkili bulunmuştur ve yüksek vücut kitle indeksi (VKİ) over kanseri oluşumu ile anlamlı ilişki göstermektedir (41,42). Olsen ve arkadaşlarının çalışmasında obez kadınlarda normal vücut kitle indeksi olan kadınlar ile karşılaştırıldığında epitelial over kanser riski %30 artmaktadır (43). Obesite ayrıca over kanserinde sağkalım üzerine olumsuz etkide bulunmaktadır (44).
2.2.2. Tarama ve Klinik Bulgular
Over kanseri için etkin bir tarama yöntemi yoktur. Pelvik muayene, CA-125, USG ve renkli doppler ultrasonun birlikde kullanımı faydalıdır. Yapılan çalışmalarda BRCA gen mutasyonu olan kadınlarda bile transvaginal ultrasonografi ve CA-125 ile tarama yapılmasının çok sınırlı bir faydası olmuştur ve umut vaad etmemiştir. CA-125 normal over dokusunda üretilemeyen glikoprotein yapısında bir belirteçtir. Ancak hem benign hem de malign over tümörlerinde üretile bilir.
8
Günümüzde over kanseri için yeterince etkili bir tarama yöntemi olmadığından 40 yaşından itibaren, menapoz sonrası ve genetik olarak yatkınlığı bulunan ailesel meme ve over kanseri öyküsü olan kadınların düzenli olarak kontrol yaptırmaları önerilir.
Over kanseri erken evrelerde spesifik belirti vermemektedir. Over kanseri olan hastalarda birçok hastalıkta rastlanan bulgular: abdomenin alt ya da yan kısmında ağrı, karında doygunluk/şişlik hissi, iştahsızlık, bulantı/kusma, kabızlık, yorgunluk, sık idrara çıkma gibi yakınmalar görülebilmektedir (45).
2.2.3. Tanı
Tanıda en çok kullanılan biomarker Cancer-antigen 125 (CA125)’tir. CA125, 3 ya da 4. evre epitelial over kanserlerinde %80 duyarlılık ve %97 spesifiteye sahiptir. Ancak evre 1’deki duyarlılığı %30 oranındadır ve artışı başka fizyolojik durumlarla ve benign olgularla ilişkilendirilebilir (2). Bu nedenle etkili tanı için farklı biomarker araştırmaları devam etmektedir.
2.2.4. Over Kanseri Alt Tipleri ve Moleküler Hücre Biyolojisi
Normal over dokusu gonadal sırttan gelişir ve farklı hücre tiplerinden meydana gelmiştir. Temelde 3 tip hücre içerir;
1) Germ hücreler - endodermden türer, yumurtalığın iç kısmını örter ve çoğalıp oositlere farklılaşır.
2) Stromal hücreler - östrojen ve progesteron hormonlarının büyük kısmını üretir. 3) Epitelial hücreler - Müller kanalından türer, yumurtalığın dış kısmını örter ve over yüzeyinin hemen altındaki inklüzyon kistleri sınırını çizer (3,46).
Bu 3 hücre tipininin her birinden benign ya da malign tümörler gelişebilir. Tüm over kanseri olgularının %90 gibi büyük bir kısmından epitelial over kanseri sorumludur. Epitelyal over kanseri genellikle ileri yaşta menapoz sonrası görülür. Over kanserinin geri kalan %10 kısmını germ hücreli tümörler (genellikle 20-30’lu yaşlarda) ve seks-kord stromal tümörler oluşturur. Germ hücreli tümörler bu hastaların %3-5’inden sorumluyken, seks-kord-stromal tümörler %7’lik bir kısmı oluşturur (3).
Dünya Sağlık Örgütü (WHO) over tümörlerini histolojik farklılaşmalarına göre epitelyal, seks-kord stromal ve germ hücreli tümörler olarak sınıflara ayırmaktadır. En büyük grup olan epitelial over tümörleri; seröz, müsinöz, endometrioid, berrak hücreli, transisyonel ve brenner tümörler olmak üzere alt gruplara bölünmüştür (47).
Over kanserleri histolojik düzeye, moleküler fenotipe ve genotipe göre tip 1 ve tip 2 olmak üzere iki ana gruba ayrılır. Düşük dereceli seröz, müsinöz, berrak hücreli, endometrioid karsinomlar tip 1 over kanserlerirdir. Bu kanser türleri genellikle yavaş büyüyen, erken evrede
9
(I ya da II) tanı konulan tiplerdir ve konvansiyonel kemoterapiye dirençlidirler ancak hormonal tedaviye yanıt verebilirler. Daha yaygın olarak görülen yüksek dereceli seröz, yüksek dereceli endometrioid ve farklılaşmamış olarak adlandırılan histotipler tip 2 grupunu oluşturmaktadır. Bu kanserler geç evrede (III-IV) ortaya çıkar, agresif olarak büyür ve konvansiyonel kemoterapiye, daha az olarak da hormonal tedaviye yanıt verir (3).
Over kanseri ile ilişkili olan birçok sinyal ileti yolakları vardır. Bunlar; nükleer faktör kappa-B (NF-kB) yolağı, Janus protein kinaz/sinyal iletici ve transkripsiyon aktive edici protein 3 (Jak-STAT 3) yolağı, mitojen-aktive protein kinaz (MAPK) yolağı, proto-onkogen tirozin protein kinaz Src yolağı, ErbB aktivasyon yolağı, lizofosfotidik asit (LPA) yolağı, fosfatidilinositol 3 kinaz (PI3K) yolağı, Müllerian inhibitör madde reseptör yolağı, epidermal büyüme faktörü (EGF) yolağı, vasküler endotelyal büyüme faktörü (VGEF) yolağı ve östrojen reseptör (ER) beta yolağıdır (2).
Tip 1 kanserlerde IGFR ekspresyonu ve PI3K yolağının aktivasyonu ile birlikte Ras ve Raf’ta sık mutasyonlar görülmesine rağmen p53 ve BRCA1/2 genleri yabanıl tiptedir. Ancak tip 2 kanserlerin hemen hemen hepsinde p53 mutasyonu vardır, neredeyse yarısında BRCA1/2 mutasyonu ya da fonksiyon bozukluğu mevcuttur. Bunlarda onkogenezin, Ras/MAPK ve PI3K yolaklarını aktive eden birçok çoğalma düzenleyici genin amplifikasyonu tarafından tetiklendiği izlenmektedir (3).
Tip 2 yüksek dereceli seröz over karsinomları tüm over karsinomlarının %70’ni oluşturur ve over karsinomu sebebi ile ölümlerin %90’ınından sorumludur. Tedavi için klasik yaklaşım cerrahinin ardından taksan ve platin bileşenleri ile kombine kemoterapidir. Ancak tedaviden yaklaşık 6 ay sonra hastaların ortalama %25’inde platine dirençli kanser tekrarlamakta ve genel olarak 5 yıllık sağkalım oranı %31’dir (4).
Over kanserinin belirli alt tipleri farklı jinekolojik dokular gibi göründüğünden, farklı genetik yapıya sahip olduğundan ve farklı klinik tablo çizdiğinden çalışmamızda iki farklı alt sınıfa ait hücre hatları kullanıldı. Tercih ettiğimiz model hücre hatlarımızdan MDAH-2774, tip 1 endometrioid karsinom sınıfına, diğer hücre hattı OVCAR-3, tip 2 yüksek dereceli seröz over karsinomu sınıfına dahildir.
Over kanserinin alt tiplerine göre histolojik yapıları ve moleküler özellikleri Tablo 2. 1’ de gösterilmiştir.
10
Tablo 1: Over kanserlerinin histolojik özellikleri, öncüleri ve ayırıcı moleküler özellikleri (3). Moleküler
tip Histoloji Öncü Moleküler özellikler
I Düşük dereceli seröz karsinom
Border-line
karsinoma sekans KRAS ve BRAF mutasyonları
I Düşük dereceli endometrioid karsinom Endometriozis CTNNB1, PTEN mutasyonları ve mikrosatellit instabilitesi I Müsinöz karsinom
Cystadenoma-borderline sekans KRAS mutasyonları
I Berrak hücreli karsinom
Endometriozis olabilir
PTEN mutasyonları ve LOH*, PIK3CA mutasyonları II Yüksek dereceli seröz karsinom İnklüzyon kistlerinden yeniden oluşum p53 mutasyonları, BRCA 1/2 mutasyonları ve BRCA1 metilasyonu II İleri dereceli endometrioid karsinom Epitelial inklüzyon kistleri p53 mutasyonları, BRCA 1/2 mutasyonları ve BRCA 1 metilasyonu II Farklılaşmamış karsinosarkom - -
*LOH: heterozigosite kaybı
2.2.4.1. Endometrioid Karsinom Moleküler Biyolojisi.
Endometrioid karsinom over kanserlerinin yaklaşık %10’nunu oluşturur ve genellikle erken evrede düşük dereceli olarak ortaya çıkar. Overdeki endometrioid karsinom endometriumdaki endometrioid karsinomda gözlemlenen benzer morfolojik özelliktedir. Glandüler görünümü skuamoz farklılaşma ile karşılaşılan en yaygın modeldir (4).
AT’ce zengin etkileşim domaini içeren protein 1A (ARID1A) ve protein fosfataz 2’nin yapısal ve düzenleyici alfa altünitesi (PPP2R1A) mutasyonları hem de endometrioid karsinoma hemde berrak hücreli karsinoma da görülür. Over endometrioid karsinomlarının %30’unda ARID1A mutasyonu ve %12’sinde PPP2R1A mutasyonu vardır (4,51).
Endometrioid Karsinom’un %38-50’sinde somatik mutasyonlar beta-katenin 1 (CTNNB1) geninin 3. ekzonunda meydana gelir ve olguların %80’ninden fazlasında nüklear beta-katenin proteini saptanmıştır. Olguların %20 sinde PTEN geninin 3. ve 8. ekzonları arasında oluşan mutasyonlar tespit edilmiştir (4).
11
Endometrioid karsinomda görülen bir diger mutasyon da PIK3CA mutasyonudur, ancak berrah hücreli karsinomda görüldüğünden daha az rastlanır (52).
Endometrioid karsinomlu olguların yaklaşık %10’u yanlış eşleşme tamir proteinlerinin (MLS1, MSH2, MSH6 ve PMS2) ekspresyonunun kaybı ile ilişkilidir (4).
Endometrioid Karsinom’un oluşumunda rol oynayan bu mutasyon ve değişimler şunlardır:
PTEN, CTNNB1, ARID1A, PPP2R1A mutasyonları
Mikrosatellit instabilite (MSI) / yanlış eşleşme tamir proteini ekpresyonu kaybı (4).
2.2.4.2. Yüksek Dereceli Seröz Karsinom Moleküler Biyolojisi.
Yüksek dereceli seröz karsinomlarda %97 oranında hücre döngüsünün düzenlenmesinde ve DNA tamirinde anahtar bir rol oynayan p53 geninde olan mutasyonlar görülür (38). P53 hücresel replikasyon meydana gelmeden önce hücre döngüsünün G2 kontrol noktasında etki ederek hücre büyümesini durdurup DNA hasarının onarılması için hücreyi teşvik eder. Ancak Hasar onarılamayacak ise apoptozisi başlatır. Bu nedenle p53 mutasyonları DNA hasarının yayılmasına ve kromozomol instabiliteye neden olur (4).
BRCA1 ve BRCA2 genleri her ikisi de DNA tamir proteinlerini kodlar ve kalıtsal BRCA1 ve BRCA2 mutasyonları yüksek dereceli seröz karsinomların %15’inden daha fazlasında görülürken, somatik BRCA1/2 mutasyonları ya da BRCA1 promotor metilasyonu %14-22’sinde görülür (39). Bu proteinlerin eksikliği homolog rekombinasyon sırasında DNA çift zincir kırıklarının onarımında kusura ve böylece kromozomal instabiliteye neden olur. Normal durumda BRCA1/2 işlev kaybı hücreler için ölümcüldür, ancak bu hücrelerde p53 mutasyonlarının varlığı hücrelerin hayatta kalmasını sağlar (4).
Yüksek dereceli seröz karsinomların %50 ya da daha fazlasında bulunan homolog rekombinasyon kusurları; PTEN delesyonu (%7), EMSY amplifikasyonu (olguların %8’inde), RAD51C hipermetilasyonu (%2) ya da diğer az rastlanan mekanizmalar sonucu da meydana gelebilir (4,19).
Kanser Genom Atlası (TCGA)’nda 400’den fazla yüksek dereceli seröz karsinom ile yapılan derinlemesine moleküler araştırmalar, yüksek dereceli seröz karsinomlarda p53 ve BRCA1/2 hariç tek gen mutasyonlarının nadir olduğunu, istatistiksel olarak anlamlı düzeyde sadece altı gende tekrarlayan mutasyonların bulunduğunu ve bunların tümünün %10’dan daha az bir oranda görülen düşük frekanslı olaylar olduğunu göstermiştir (4).
12
Tekrarlayan mutasyonlar yüksek dereceli seröz karsinomların tek ayırıcı özelliği değil aynı zamanda 100’den daha fazla sayıda tekrarlayan amplifikasyonlar ve delesyonların teşhis edilmesiyle ortaya konan çok sayıdaki somatik kopya sayı değişiklikleridir (4).
TCGA çalışmalarından elde edilen bilgiler retinoblastoma (RB), PI3K/RAS, NOTCHve FoxM1 yolaklarının yüksek dereceli seröz karsinom oluşumuna katkıda bulunduğunu göstermektedir ve bu yolaklar hastalığın tedavisi için yeni stratejiler geliştirilmesine adaydırlar (4).
HGSC oluşumunda rol oynayan bu mutasyon ve değişimler şunlardır:
Kromozomal instabilite / anöploidi (%100)
P53 mutasyonları (> %90), BRCA kaybı (%30-45)
Birkaç mutasyon, çok sayıda somatik kopya sayısı değişiklikleri
Homolog rekombinasyon defektleri
FoxM1 (olguların %84’ü), RB (%67), PI3K/RAS (%45), NOTCH (%22) sinyal ileti değişiklikleri
2.2.2. Leptin ve Over Kanseri İlişkisi
Gelişmiş ülkelerde over kanseri en sık görülen jinekolojik kanser tipidir. Obezitenin en önemli sağlık sorunlarından biri olduğu İngiltere’de her yıl yaklaşık 40.000 yeni over kanseri insidansı görülmektedir. Sonuç olarak obezitenin over kanseri üzerindeki etkileri bu iki önemli sağlık sorunu arasındaki kritik bir kesişmeyi temsil eder (29).
Leptin multi-fonksiyonel bir peptid hormonudur ve iştah düzenlenmesi, kemik oluşumu, üreme fonksiyonu ve anjiyogenez gibi çok çeşitli biyolojik aktivitelere sahipdir. Leptinin bu biyolojik aktiviteleri kanserde proliferasyon, invazyon ve metastazda önemli rol oynadığını göstermektedir (28,29). Leptin over karsinomu ile obezite arasındaki ilişkiyi oluşturan hormon olabilir.
Uddin ve ark çalışmasında over kanserlerinin %59’unda OB-R overekspresyonu over görülmüş ve kötü hastalıksız sağkalım ile ilişkili bulunmuştur. Leptin etkisi ile birçok büyüme faktörleri ve sitokinlerin düzeyleri etkilenmektedir. Yine bu çalışmada endometriyal over kanseri hücre hatlarında leptinin hücre çoğalmasını tetiklediği ve PI3K/AKT yolağını aktive ederek apoptozu inhibe ettiği gösterilmiştir (28).
Sharma ve arkadaşları (29) leptin’in insan endometrium kanser hücrelerinde proliferatif yanıtı ve invazyon yatkınlığını yükseltdiğini göstermişlerdir.
13
Yunanistan’da yapılan bir olgu kontrol çalışmasında leptinin endometriyal kanser insidansı ile güçlü pozitif ilişkisinin olduğu belirlenmiştir (29).
Chen ve arkadaşlarının çalışmasında meme kanseri hücre hattında leptinin doza ve zamana bağlı olarak hücre çoğalmasını etkilediğini göstermişlerdir. Bu indüklemenin hücre döngüsü kritik moleküllerinden siklin D1’in ve proto-onkogen c-Myc‘i upregülasyonu ile ve tümör süpresör p53 ile p21WAF1/CIP1’in downregülasyonu yoluyla gerçekleştiği gösterilmiştir
(31).
Somasundar ve arkadaşlarının çalışmasında ise, leptinin meme, prostat ve özofagus kanseri hücre hatlarında hücre büyümesini ındüklediğini, ancak pankreas kanseri hücre hattında büyümeyi inhibe ettiğini göstermişlerdir. Bu sonuçlara dayanarak leptinin çoğalma üzerindeki etkisinin organ türevine göre değiştiyi kanaatına varabiliriz (32).
2.3. Apoptozis
Organizmada sürekli yeni hücreler sentez edilirken, varolan hücrelerin bir kısmı hücre ölümü ile ortadan kaldırılmakta ve böylece denge korunmaktadır. Apoptozis, hücrenin intihar şeklidir ve hücre kendi kendini aktif olarak yok eder. Bu olay nükleer büzülme ve DNA fragmantasyonu ile karakterizedir. Elbette bu mekanizma organizmada doğru bir şekilde işlemelidir. Ölmesi gereken hücrelerimiz zamanında ve gerekli sayıda ölmelidir. Bir şekilde (mutasyonlar, çevresel etmenler, vs. sebebiyle) hızlanmış ya da yavaşlamış bir apoptozis patalojiktir. Apoptosis çok hızlı gerçekleşiyorsa, gerekenden fazla hücre ölerek atrofi, olması gerekenden yavaş gerçekleşiyorsa istenmeyen hücreler bazı bölgelerde birikerek kanser oluşumuna sebep olur (52).
2.3.1. Apoptoz’un Aşamaları.
Apoptoz hücrenin kendini yok etmek için bir takım metabolik ve fizyolojik işlemleri devreye soktuğu bir olaydır. Apoptoz uyarısı alan hücre bulunduğu ortamdan uzaklaşır, komşu hücrelerle bağlantısını koparır ve büzüşür, kromatini yoğunlaşır piknotik bir görünüm alır. DNA’sı nukleozomlarından kesilir jel elektroforezinde tipik merdiven bant görünümü alır. Ancak hücre organelleri yapısal bütünlüklerini korur. Hücre zarı yapısında bulunan fosfotidilserin hücre zarının iç yüzünden dış yüzüne transloke olur. Çekirdek küçülür, parçalara ayrılır. Hücre zarla sarılı tomurcuklar halinde kopar, apoptotik cisimciklere ayrılır. Apoptotik cisimcikler makrofajlar tarafından tanınır ve fagosite edilir, ancak enflamasyon görülmez (53,56).
14
2.3.2 Apoptoz’un Düzenlenmesi.
Genel olarak apoptozun düzenlenmesinde kalsiyum, seramid, Bcl-2 ailesi gibi moleküller, p53, kaspazlar, sitokrom-c gibi proteinler ve mitokondriyonlar rol oynar. Apoptotik süreç boyunca hücre içine sürekli kalsiyum girişi olur. Kalsiyum iyonları; endonükleaz, proteaz ve transglutaminaz aktivasyonunda, gen regulasyonunda ve hücre iskeleti organizasyonunda rol alır.
2.3.2.1 Bcl-2 Ailesi.
Bir hücrenin apoptoza eğilimli olup olmaması Bcl-2 ailesi genlerinin heterodimer ya da homodimer formuna bağlıdır. Bcl-2 ailesi birbirine zıt 2 gruptan oluşur;
Hücrede proapoptotik proteinler fazla ise hücre apoptoza eğilimlidir. Antiapoptotik proteinler fazla ise hücre apoptoza daha az eğilimlidir. Proapoptotik üyeler Bad, Bax, Bid, BclXs, Bak, Bim, Puma ve Noxa’dır. Bu proteinler sitozolde yer alırlar. Sitokrom-c ve AIF (Apoptoz indükleyici faktör )salınımını artırarak apoptozu indüklerler. Antiapoptotik üyeler ise Bcl-2, Bcl-xL ve Mcl-1’dir. Bu proteinler de mitokondriyon dış membranında, endoplazmikretikülümde ve çekirdek zarında yer alırlar. Por oluşumunu sağlayıp iyontransportunu düzenlerler. Özellikle hücredeki Ca++ oranını kontrol ederler. Ayrıca kaspazların öncü formlarıyla AIF ve sitokrom-c salınımını bloke edereka poptozu inhibe ederler (59,60).
2.3.2.2 P53
Hücrede DNA hasarı oluştuğunda hücre siklusunu G1 fazında durdurup hücreye DNA tamiri için zaman veren bir transkripsiyon faktörüdür. Hasar tamir edilemeyecek durumda ise Bax, Apaf-1 ve Fas yapımını artırıp Bcl-2 ve Bcl-xL’yi baskılar ve apoptozu indükler.
2.3.2.3 FAS (APO-1 veya CD95)
24 üyeli TNF reseptör ailesinin en iyi tanımlanmış üyesidir. Bağışıklık sisteminde hücre ölümünü kontrol eden Fas hücre reseptörü sitotoksik T hücreleri ve naturel killer hücreleri üzerinde bulunur. 43 kDa molekül ağırlığındaki Fas proteini hücre yüzeyinde kendi reseptörüne bağlanır vereseptör trimerizasyonunu sağlar. Aktive olmuş reseptörler FADD reseptör rmolekülü ile birleşir. Bu şekilde; Fas reseptörünün karboksil ucuna (C) yakın 80 aminoasitlik bölgenin uyarılmasıyla prokaspazlar aktive olur ve apoptoz başlar. Fas ve TNF alfa dışında TRAİL ve TRAİL reseptörleri de benzer yolla apoptozu uyarabilir (61).
15
2.3.2.4.KASPAZLAR
Kaspazlar, sistein proteaz oldukları için aspartik asitten sonraki peptid bağını kırarlar. Hücrede inaktiftirler, ancak proteolitik olarak birbirlerini aktifleştirirler. Apoptoza 100 farklı hedef proteini keserek neden olurlar. Üç tiptirler:
I- Başlatıcı kaspazlar; (Kaspaz 2,8,9,10), II- Efektör kaspazlar (Kaspaz 3,6,7),
III- İnflamatuar kaspazlar (Kaspaz 1,4,5,11,12,13,14).
DNA tamiri ve replikasyonu için gerekli enzimleri inaktive ederler. Hücre iskeleti proteinlerini keserek hücre zarının tomurcuklanmasına neden olurlar (61,62). Apoptoz aktive edildikten 1 saat ya da daha uzun bir süre sonra DNA da tek iplikte bir çentikle başlayan çok karakteristik ve geri dönüşsüz bir parçalanma görülür.
2.3.3. Apoptoz Mekanizması.
ŞEKİL 3.Apoptoz Mekanizması
Apoptoz iki yolla gerçekleşir; I- İnstrinsik (mitokondriyal) yol II- Ekstrinsik yol
16 A- Direkt mekanizma
B- Dolaylı mekanizma
Apoptozu tetikleyen hücre içi sinyaller; DNA hasarı, hücre içi Ca++ düzeyi artışı, pH azalışı, metabolik ve/veya hücre siklus bozuklukları ve hipoksidir. Hücre dışı sinyaller ise büyüme ve üreme faktörlerinin yetersizliği, ölümreseptörlerinin aktivasyonu (FAS – FAS ligand aracılığı ile apoptoz, TNF aracılığı ile apoptoz), sitotoksik T lenfosit ve dış etkenler (İskemi, toksinler, UV, kemoterapötik ilaçlar, radyasyon)’dir. Her 2 sinyal yolunda da kaspazlar görev almaktadır. Hücre içi sinyaller instrinsik apoptoz yolunu devreye sokarken, hücre dışı sinyaller ekstrinsik yol ile apoptozu indükler (60,61,62).
2.3.3.1 İnstrinsik Yol.
Hücre içi sinyallerle apoptotik uyarı alınmasından sonra proapoptotik proteinlerden Bid; bir antiapoptotik protein olan Bcl-2‘yi inaktive eder, Bax veBak’ı aktifleştirir. Aktifleşen Bax ve Bak mitokondriyon membranında por oluşumunu indükleyip zar potansiyelini değiştirir. Böylelikle mitokondriyon membranındaki porlardan sitokrom-c, Smac (Second mitochondria-derivedActivator of Caspase), Endo-G (Endonukleaz-G), Ca++ ve AIF (Apoptoz indükleyici faktör) salınımını uyarır. Sitokrom-C, oksidatif fosforilasyon içinelektron taşır. SMAC, IAF (İnhibitör apoptotik faktör)’ü inhibe eder ve apoptozu hızlandırır. IAF’nin ortamda bulunması ise kaspaz-3 ve kaspaz-8 aktivasyonunu engeller. AIF, çekirdeğe transloke olur ve parçalara ayırır. ENDO-G de DNA’yı parçalar. Mitokondriyal porlardan salınan sitokrom-c, Apaf-1 (Apoptotik proteaz aktive eden faktör) ve ATP’nin katılmasıylasitozolde Apoptozom denen bir kompleks oluşturur (61). Apoptozom kaspaz-9’ukeserek aktifleştirir. Kaspaz-9 da prokaspaz-3’ü aktif kaspaz-3 halinegetirir. Aktif kaspaz-3 de ICAD (İnaktif kaspaz aktive edici DNaz)‘ı inaktifleştirerek CAD (Kaspaz aktive edici DNaz)’ı serbestleştirir. CAD ise çekirdekte kromatin yoğunlaşmasına ve DNA’nın nukleozomal alt birimler halinde fragmante olmasına neden olur (62).
2.3.3.2. Ekstrinsik Yol
Hücre yüzeyindeki ölüm reseptörlerine (Fas, TNFR, DR5) ölüm sinyallerinin (FasL, TNF-alfa, TRAİL) bağlanmasıyla reseptörler trimerik yapıkazanır. Bu şekilde trimerik yapı kazanan reseptör; adaptör molekülleri ve prokaspazla birleşerek DISC (Death inducing signaling complex) adı verilen yapıyı oluşturur. Bu birleşmeden sonra inaktif durumdaki pro8’in uzun ve kısa kolları kesilerek aktif 8’in oluşması sağlanır. Aktif 8 doğrudan ve dolaylı olmak üzere 2 yolla 3’ü aktive eder. Ya direkt kapsaz-8 kaspaz-3’ü aktive eder ya da Bid’i keserek dolaylı olarak instrinsik mekanizmada kaspaz-9’u aktive ettikten sonra kaspaz-3’ü aktive eder. Her 2 yolla da aktive olan kaspaz-3 yine CAD
17
aktivasyonu ile DNA fragmantasyonuna neden olur (62). Ekstrinsik yollardan biriside sfingolipid yoludur. Sfingomyelin, hücre zarıyapı taşlarından biridir. Radyasyon, kemoterapi, ölüm reseptörleri ile aktiveolan sfingomyelinaz, sfingomyelini seramid’e dönüştürür. Seramid ise seramidaz ile sfingozine dönüşür. Sfingozin de Bid yapımını artırarak apoptozu tetikler. Ayrıca patojenle enfekte hücreler ve tümör hücrelerinin ortadan kaldırılmasında etkili bir diğer yol ise Granzim-Perforin sistemidir. Perforinler ve Granzim B birer serin proteaz’dır. Sitotoksik T lenfositler ve Natural Killer hücrelerinin sitoplazmik salgı granülleri içinde bulunurlar. Sitotoksik T lenfositler hedef hücreye bağlandığında perforinler salınır. Perforinler hedef hücre üzerinde dairesel bir por oluştururlar. Bu perforin poru hücre içine Ca++girişini artırır. Vezikülden Granzim B’nin serbest kalmasını sağlar. Granzim B’de kaspaz aktivasyonunun ardından DNA fragmantasyonu sonucu apoptoza neden olur.
2.3.5. Apoptoz’un Belirlenmesinde Kullanılan Yöntemler.
1.5.1 Morfolojik görüntüleme yöntemleri 1. Işık Mikroskobu
a. Hematoksilen Boyama b. Giemsa Boyama
2. Floresan Mikroskobu / Lazerli Konfokal Mikroskop a. Propidium İyodür (PI)
b. Hoechst Dye
3. Elektron Mikroskobu 4. Faz Kontrast Mikroskobu
1.5.2. İmmunohistokimyasal yöntemler 1. Anneksin V Yöntemi 2. TUNEL Yöntemi 3. M30 Yöntemi 4. Kaspaz-3 Yöntemi 1.5.3. Biyokimyasal yöntemler 1. Agaroz Jel Elektroforezi - DNA fragmentasyonu 2. “Western Blotting”
18
2.3. 6. Apoptozisin Görüldüğü Olaylar
Fizyolojik apoptozis Pato-lojik apoptozis
Embryogenezis DNA zararları (hipoksi, radyasyon, sitotoksik ilaçlar)
Hormon kökenli involüsyon (endometrium, prostat)
Bozuk yapıdaki (misfolded) proteinlerin birikmesi (nörodejeneratif hastalıklar Hücre yenilenmeleri (intestinal epitel) Virüs infeksiyonları (hepatit)
Saldırgan lenfositlerin eliminasyonu Tümörler İnvolüsyon (ductus thyroglossus
involüsyonu, timus involüsyonu)
Doku/organ reddi
İnvolüsyon: fizyolojik atrofi Basınç atrofisi (pankreas, tükürük bezleri, böbrekler)
.
2. 3. 7 Apoptozis ve Kanser
Organların fonksiyonlarının devamlılığı açısından hücre proliferasyonu ve hücre ölümü arasındaki homeostaz kritik bir rol oynar. Bu denge; immunotolerans, onarım ve yaşlanma prosesleri sırasında fizyolojik olarak değişmektedir. Hücre proliferasyonu ve ölümü arasındaki dengesizlik hücrelerin apoptoza karşı direnç oluşturmasına ve prolifere olarak klonal genişleme sonucu malign oluşumlara yol açmaktadır. Karsinogenezde öncelikle hücre ölümü hücre proliferasyonuna paralel olarak artmaktadır. Hücre ölüm mekanizmaları bozulduğunda tümör büyümeye başlayarak etrafındaki lokal yapıları invaze eder. Malign tümörlü olgularda uygulanan terapötik stratejilerin amacı proliferasyon ve dejenerasyon arasındaki dengenin tekrar sağlanmasıdır. Kemoterapötik ilaçların yol açtığı hücre hasarı, normal hücre siklüsünün durması, onarım mekanizmalarının yetersiz olması ve aktif apoptotik hücre ölümünün indüklenmesidir. Hücre ölümü ve proliferasyonu ile ilgili markerlerin tayini karsinogenez prosesi ve antitümör tedavisine karşı verilen cevabın etkinliği ile ilgili bilgi verir. Normal fizyolojik koşullar altında gelişen apoptozis sonrası oluşan hücre ölümü ile ortamdaki hücre
19
artıkları makrofajlar ve komşu hücreler tarafından uzaklaştırılır. Malign durumlarda bu denge bozulur ve hücre artıkları dolaşımda birikmeye başlar (55).
2.4. Over Kanserin Araştırmak İçin Kullandığımız Model Hücre Hatları
Çalışmamızda insan over kanserinin farklı özelliklere sahip ve farklı alt tiplerini modelleyen iki hücre hattı kullanıldı. Tip 1’e dahil olan adenokarsinomayı modelleyen MDAH-2774 ve tip 2 sınıfından yüksek dereceli seröz karsinom’u modelleyen OVCAR-3. Bu hücre hatlarının özellikleri aşağıda detaylı olarak açıklanmıştır.
2.4.1 MDAH-2774 İnsan Over Kanseri Hücre Hattı
İnsan over kanseri hücre hattı MDAH-2774; Kafkasya kökenli, endometrioid over adenokarsinomlu hastadan elde edilmiştir. Bu hücre hattının büyüme karakteristikleri ve tümörijenik potansiyeli, endometrioid over adenokarsinomunun klinik özellikleri ile paralellik göstermekle birlikte tümörün derecesi ve evresi ile ilgili bir bilgi bulunmamaktadır (63).
MDAH-2774 hücre hattında yüksek derecede Wnt sinyal iletisi düzensizliği olduğu izlenmişdir. Mutasyon analizlerinde hücre hattının mutant p53 genine sahip olduğu ve bunun yanı sıra axis inhibitör 1 (AXIN1) geninde missense mutasyon sonucu sekans değişimi olduğu ve PI3K/Akt sinyal ileti yolağında bulunan K-ras geninin mutasyona uğradığı tespit edilmiştir (63).
2.4.2. OVCAR-3 İnsan Over Kanseri Hücre Hattı
OVCAR-3 hücre hattı; Kafkasya kökenli, 60 yaşında, ilerlemiş over adenokarsinomu olan hastanın asit sıvısından elde edilmiştir. Bu hücreler epitelial morfolojidedirler ve hem atimik farede tümör hem de agarozda klonlar oluştura bilmektedirler. Kültüre edilen bu hücreler kendilerine has steroid hormon reseptörleri olan sitoplazmik androjen, östrojen ve progesteron bağlama makromolekülleri içermektedir.
Anöploid bir dişiden elde edilen bu hücre hattı homojen boyanma bölgesi ve double-minute kromozomu içeren anormal bir karyotipe sahiptir. Karyotip analizinde kromozom sayılarının triploidiye yakın değerlerde olduğu izlenmiştir. Hücrelerde sitogenetik analizlerde marker olarak kullanılan N11, N13, N14, N15, N16, N17 ve N22 kromozomları bulunmamaktadır. Bunun yanı sıra marker olarak bilinmeyen kromozomların büyük çoğunluğunda yapısal anormallikler, hücreler arasında kromozom sayısı ve yapılarının değişkenlik gösterdiği bulunmuştur.
Dizi analizleri sonucu OVCAR-3 hücre hattında p53 geninin mutant (248, Arg → Gln) olduğu belirlenmiştir. 743. nükleotidte Guanin’in Adenin’e değişimi nokta mutasyonu, 248. kodondaglutaminin arjinin aminoasidinin yerine gelmesine sebep olmuştur (47).
20
2.5. Over Kanserinde Tedavi Yaklaşımları
Sitoredüktif cerrahi ile birlikde uygun kemoterapik ajanlarla - platinyum ve taksan kombinasyonları sayesinde over kanseri hastalarının 5 yıllık sağkalım oranları %37’lerden %45’lere yükselmiştir.
Over kanserinin tüm evrelerinde cerrahi girişim mühim bir yer tutar. Teşhis sırasında sitoredüktif cerrahinin uygulanabilir olmadığı durumlarda neoadjuvan kemoterapiden sonra cerrahi uygulanabilir. Optimal sitoredüktif cerrahinin amacı Uluslararası Jinekoloji Obstetri Federasyonu’nun (FIGO) standartlarına uygun evreleme ve sağaltım sağlamaktır. Nükseden hastalığın tedavisinde uygulanan sitoredüktif cerrahide, gözle görünen, makroskobik tümörün tamamı alındığında sağ kalımın arttığı bilinmektedir.
Yeni teşhis edilen over kanseri hastalarında standart adjuvan tedavi olarak sitoredüktif cerrahi sonrası 6 kür karboplatin ve paklitaksel kombinasyonu standart olarak uygulanmalıdır. Alkilleyici ilaç karboplatin DNA’ya kovalent bağlanarak zincir içi ve zincirler arası çapraz bağlar meydana getirir. Paklitaksel mikrotübüllere nonkovalent olarak bağlanır ve mitotik iğ oluşumunu engelleyerek mikrotübüllerin stabilitesini artırır. Her iki ilaçda apoptozu indükler (3). Kemoterapi genellikle intravenöz uygulanır ancak sitoredüktif cerrahi uygulanmış hastalarda yapılan çalışmalar intraperitoneal uygulanan terapinin mortalite riskini %20-25 azalttığını göstermiştir.
Primer kemoterapiden altı aydan sonra nükseden over kanserlerinde tekrar uygulanan karboplatin ve paklitaksel ile %20-50 olumlu cevap alınmaktadır. Nükseden hastalıkta antikanser ilaçların karboplatin, paklitaksel ve cisplatin ile kombine edilmesi hastaların yaşam süresini artırmaktadır. Platinyum duyarlı hastalıkta ise, karboplatinin paklitaksel, gemsitabin ve liposomal doksorubisinle kombinasyonunun tekli karboplatin uygulamasına göre daha etkin olduğu bilinmektedir. Altı aydan önce nükseden hastalarda liposomal doksorubisin, paklitaksel ve totptekan gibi çeşitli kemoterapötiklerin cevap oranları %10-30 arası değişmektedir ve hastaların yaşam sürelerini arttırmaktadır.
21
3. GEREÇ VE YÖNTEM
Çalışmamızda tip 1 endometrioid over kanserini modelleyen MDAH-2774 ve tip 2 yüksek dereceli seröz over kanserini modelleyen OVCAR-3 hücre hatlarında leptinin proapoptotik ve antiapoptotik protein düzeyinde anlamlı deyişiklikler yaparak apoptozu azaltıp bu hücrelerin artmasına dayanmıştır
-Tümör hücre hattı:
MDAH-2774 ve OVCAR-3 hücre hatları Tülay Aktaş Onkoloji Hastanesi Tıbbi Onkoloji Araştırma Laboratuvarı’nın ICLC (Interlab Cell Line Collection, İtalya) ‘den temin ettiği ve çoğaltarak -80°C’de stokladığı kanser hücre hatları panelinden temin edildi.
-Leptin:
Human Recombinant Leptin PeproTech, USA’dan temin edildi.
3.1.OVCAR-3 ve MDAH-2774 Hücre Hatlarının Çoğaltılması ve Kültür İşlemleri:
-80 °C’de dondurucuda kriyotüpler içinde dondurma solüsyonunda muhafaza edilen hücreler 37°C sıcaklıkta su banyosunda çözüldü ardından 10 ml besiyeri eklenerek 1000 devir/dk’da 10 dakika santrifüj edildi. Santrifüj işleminin ardından üstteki kısım atılıp, dipte kalan hücre çökeltisi taze besiyeri ile homojenize edilerek steril hücre kültür flasklarına aktarıldı.
OVCAR-3 hücre hattı, Roswell Park Memorial Institute (RPMI) 1640 besiyeri, MDAH-2774 hücre hattı ise Dulbecco’s Modified Eagle Medium/Ham’s F12 (DMEM/Ham’s-F12) besiyeri kullanılarak idame ettirildi. Besiyerlerine ısı ile inaktive edilmiş fetal sığır serumu (FBS) %10 oranında eklenerek hücreler için uygun besiyeri ortamı yaratıldı. Mikrobiyal ve fungal enfeksiyonu önlemek için besiyerine %1 oranında penisilin-streptomisin ve Amphothericin-B ilave edilerek mikrobiyal ve fungal enfeksiyonu önlemeye çalışıldı. Ardından hücreler 37 °C’de %5’lik CO2’li inkübatörlerde çoğaltıldı. Çalışma sürecinde hücreler -80°C’de dondurularak saklandı.
Hücre kültür işlemleri steril ortamda ultraviyole ile sterilize edilen laminar hava akımlı kabinlerde (NuAire, USA) gerçekleştirildi.
22
Çoğaltılan hücreler inverted mikroskopta canlılık, çoğalma ve enfeksiyon açısından her gün kontroldan geçildi ve hücre yoğunluğunun %80’nin üzerine ulaştığı belirlendiğinde pasajlanarak çoğaltıldı.
3.1.1.Hücre hattının pasajlanması:
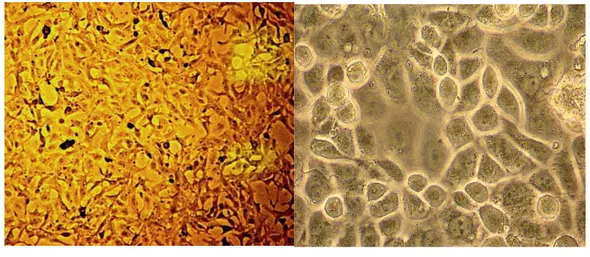
Hücrelerin çoğalma durumları inverted mikroskopta incelendi ve bu esnada flask tabanını monolayer olarak kaplayıp kaplamadıkları kontrol edildi. Pasajlama işlemi için önce flaskların içindeki besiyeri dökülüp, hücrelerin üzerine 4 ml Tripsin–EDTA (Biological Industries, Indianapolis) eklendi ardından inkübatörde yaklaşık 5 dakika bekletildikten sonra mikroskopta flask tabanından kalkıp kalkmadıkları kontrol edildi. Tabandan ayrışan hücrelerin üzerine, 4 ml besiyeri eklenerek, Tripsin-EDTA nötralize edildi. Daha sonra bu karışım, tüplere alınıp santirfüj edildi üzerindeki süpernatant atılıp, tabandaki hücre çökeltisi 10 ml besiyeri ile homojenize edildi ve flasklara tekrar ekildi. Her pasaj sırasında yaklaşık 2 milyon hücre/10 ml besiyerinde olacak şekilde pasajlama yapıldı. MDAH-2774 (Şekil-3a) ve OVCAR-3 (Şekil-3b) hücrelerinin inverted ışık mikroskobu görüntüleri Şekil 3’te gösterilmiştir.
a ) MDAH-2774 b) OVCAR-3
Şekil 3: MDAH-2774 (a) ve OVCAR-3 (b) hücre hatlarının inverted mikroskop
23
3.1.2. Hücrelerin Sayımı
Deneylerde kullanılacak miktarlarda hazırlana bilmesi için hücreler sayım işlemine tabii tutuldu. Bunun için canlı hücrelerin sayımında en çok tercih edilen yöntemlerden biri olan negatif yüklü tripan mavisi ile boyama yapıldı. Membranı zarar görmeyen canlı hücrelerin boya hücre içine girmez ve hücreler mikroskopta parlak renkte görünürler. Canlı olmayan hücreler ise membranı hasar gördüğünden boyayı absorbe ederler ve mikroskopta mavi renkli görünürler.
Hücre sayım işlemleri için Flasklardaki hücrelerin üzerlerindeki besiyerleri dökülerek 4 ml Tripsin EDTA eklendi ardından hücreler flask tabanından ayrılınca 4 ml besiyeri eklenerek steril santrifüj tüplerine alında ve 1000 devir/dk’da 10 dk santrifüj edildi. Üzerinde biriken süpernatant atıldı. Dipteki hücre pelleti taze besiyerinde homojenize edildikden sonra süspansiyondan 50 μl alınıp50 μl Tripan mavisi ile 1:1 oranında karıştırıldı. Ardından hücre sayım cihazının (Invitrogen / Countess, ABD) lamına aktarıldı ve mililitredeki canlı hücre sayısı hesaplandı.
Her deney düzeneği için bu işlemler tekrarlandı ve uygun sayıda hücre ekimi yapıldı.
3.2. Leptin’in Çözülmesi ve Stok Solüsyonlarının Hazırlanması
Leptin USA’ dan liyofilize halde PeproTech, temin edildi. 1 mg toz leptin üzerine 1 ml steril moleküler grade su eklenerek 1 mg/ml’lik ana stok hazırlandı. Hazırlanan stok solüsyon 20 ve 50 μl’lik küçük stoklara bölündü. Her stok -20°C’de saklandı. Her deney için bu stoklar kullanıldı.
3.3. Leptin’in MDAH-2774 ve OVCAR-3 Hücre Çoğalmasına Etkilerinin Belirlenmesi.
Hücre canlılığının belirlenmesinde deoksiribonükleik asit sentez hızının ölçülmesine dayalı yöntemler, metabolik aktivitenin ölçümüne dayalı testler, proliferasyon işaretleyicilerinin (marker) ölçümüne dayalı testler ve hücrelerdeki ATP miktarının ölçümüne dayalı yöntemler kullanılır (75).
24
XTT testi metabolik aktivitenin ölçümüne dayalı olarak çalışan yöntemdir ve 2,3-Bis (2-metoksi-4-nitro-5-sulfofenil)-2H-tetrazolyum (XTT) suda çözünen bir tetrazolyum tuzudur. XTT canlı hücre mitokondrilerindeki dehidrojenaz enzimi ile parçalandığında çözülebilir formazana dönüşür ve turuncu renk meydana gelir. Metabolik olarak aktif hücrelerin sayısıne kadar çok olursa turuncu rengin yoğunluğu o kadar fazla olur. Renk değişimi için absorbans olarak ELISA okuyucu ya da spektrofotometre kullanılır (75,76).
Hücre canlılığının saptanmasında kullanılan bir diğer yöntem ise Tripan mavisi ile boyama yöntemidir. Canlı hücrelerde membran bütünlüğü bozulmadığından negatif yüklü tripan boyası hücreiçine giremez. Bunun aksine ölü hücrelerde membran bütünlüğü bozulduğu için boya hücre içine geçdiğinden mavi renkte görünürler (77).
Çalışmamızda leptinin over kanseri hücre hatlarında hücre çoğalmasına etkilerini belirlemek amacıyla Tripan mavisiyle boyama yöntemi veXTT testi (Roche, Almanya) kullanıldı.
3.3.1. Tripan Mavisi ile Boyama Yöntemi.
MDAH-2774 ve OVCAR-3 hücre hatlarında Leptin’in 0.5, 25,50 ve 100 ng/ml dozları için her deneyde 2’şer kuyucuk kullanıldı ve her deney iki kez tekrar edildi.
Hücrelerin bulunduğu flasklardaki besiyerleri döküldü ve üzerlerine 4 ml Tripsin EDTA eklenerek yaklaşık 5 dk 37˚C’de inkübatörde bekletildi. İnverted mikroskop ile flask zemininden hücrelerin ayrılıp ayrılmadığı kontrol edildi. Hücreler flask zemininden kalkınca 1:1 oranında besiyeri ile nötralize edilip, 15 ml’lik steril santrifüj tüplerine alındı ardından 1000 devir/dk, 10 dakikia santrifüj edildikten sonra üst fazda biriken süpernatantları atıldı. Dibe çöken hücre pelleti ise 10 ml besiyeri içinde tekrar homojenize edildi.
Her bir kuyucukta 2 ml besiyeri solüsyonü içerisinde 2 x 106 hücre olacak şekilde 6
kuyucuklu plakalara ekildi. Ayrı ayrı 24 ve 48 saat serum açlığına bırakılan hücrelere 0.5, 25, 50 ve 100 ng/ml leptin eklendi ve ardından 24, 48, 72 saat muamale edildi (her 48 saatte bir besiyeri yenilendi).
24, 48 ve 72. Saat beklemenin sonunda kuyucuklardaki besiyerleri çekildi ve üzerlerine 500 µl Tripsin EDTA eklenerek yaklaşık 10 dakika inkübatörde bekletildi. Hücreler flask zemininden ayrılınca 1:1 oranında besiyeri ile nötralize edildi. 2 ml’lik steril mikro santrifüj tüplerine alındıkdan sonra tüplerdeki süpernatantlar atılarak dipte kalan hücre pelleti 2 ml besiyeri içerisinde homojenize edildi.
25
Oluşan hücre süspansiyonundan 50 µM alınarak 50 µM tripan mavisi ile 1:1 oranında karıştırıldı ve otomatik hücre sayım cihazının (Invitrogen / Countess, ABD) lamına aktarıldı ve mililitredeki canlı hücre sayısı (hücre sayısı/ml) hesaplandı.
Otomatik sayım cihazı ile eş zamanlı olarak Thoma lamı ile ışık mikroskobunda hücre sayımı yapıldı. Canlı hücre sayısının belirlenmesi için tüm sayımların ortalamaları hesaplandı. Leptin eklenen kuyucuklardaki canlı hücre sayısı ve leptin eklenmenmeyen kontrol kuyucuklarındaki canlı hücre sayılarının ortalamaları hesaplanıp karşılaştırıldı.
3.3.2. XTT Yöntemi.
Hücre canlılığı ölçümünde sıklıkla kullanılan bir yöntem olan XTT 2,3-Bis (2-methoxy-4-nitro-5- sulfophenyl)-2H-tetrazolium-5-carboxanilide] metabolik olarak aktif hücreler tarafından tetrazolyum tuzu olan XTT‘nin suda çözünebilen turuncu renkli formazan tuzuna çevrilmesine dayanır. Bu yöntem uygulaması gerçekleştirildikten sonra örnekler çok modlu plaka okuyucu tarafından analiz edilerek meydana gelen renk değişimine göre çoğalan hücre miktarları hesaplanmaktadır.
Leptin’nin tüm dozları için deneyler her iki hücre hattında da 3 kez tekrar edildi ve her deneyde bir doz için 3’er kuyucuk kullanıldı.
MDAH-2774 ve OVCAR-3 hücreleri her bir kuyucukta 100 μl besiyeri içerisinde 104
hücre olacak şekilde 96 kuyucuklu plakalara ekildi.
MDAH-2774 ve OVCAR-3 hücre hatları ayrı ayrı 24 saat ve 48saat serum açlığına bırakıldı. Her saat diliminde ve her doz için 3’er kuyucuk kullanılarak Leptin’in 0.5, 5, 25, 50, 100, 125, 200 ve 400 ng/ml’lik dozları ile 24, 48 ve 72 saat muamele edildi
Leptin’in hücre çoğalması üzerine her saat dilimindeki etkilerini belirlemek için sodyum 3’-[1-(fenil-aminokarbonil)-3,4-tetrazolyum]-bis (4-methoksi-6-nitro) benzen sülfonik asit hidrat ile N-metil dibenzopirazin metil sülfat’ın (işaretleme ajanı/aktivasyon ajanı) 50:1 oranında karıştırılması ile hazırlanan XTT solüsyonu kullanıldı.
Daha önce 96 kuyucuklu plakaya ekilen ve Leptin’in artan konsantrasyonları ile muamele edilen hücrelerin bulunduğu her bir kuyucuğun üzerine 100 µl XTT solüsyonu eklenerek toplam hacim 200 µl’ye çıkarıldı.
Bu işlemin ardından hücre kültür plakaları 37˚C’de ve %5 CO2 içeren inkübatörde 4 saat bekletildi.
26
İnkübasyonun ardından her kuyucuğun absorbans değeri çok modlu plaka okuyucuda (Beckman Coulter, multimode detector, ABD), 450-690 nm referans dalga boyu aralığında ölçüldü.
3.4.Apoptoz Array İle Pro/Anti Apoptotik Proteinlerin Miktarlarındaki Değişimlerin Belirlenmesi.
MDAH-2774 ve OVCAR-3 hücre hatlarında leptin uygulamasının apoptoz üzerindeki etkisini belirlemek için Human Apoptoz Antibody Array (Raybiotech, GA, USA) kullanıldı. Kitin içerdiği protokole göre kademeli şekilde bu basamaklar uygulandı:
MDAH-2774 ve OVCAR-3 hücreleri her flaskta 2 x 106 hücre olacak şekilde 25 cm2’lik
flasklara ekildi.
MDAH-2774 hücreleri 24 saat serum açlığına bırakılmanın ardından 50 ng/ml leptin ile 72 saat muamele edildi. OVCAR-3 hücreleri de önce 48 saat serum açlığına bırakıldı ardından 50 ng/ml leptin ile 48 saat muamele edildi.
Sadece serumsuz besiyeri uygulanan kontrol hücreleri ve serum açlığına bırakıldıktan sonra leptin ile muamele edilen hücrelerin üzerlerindeki besiyerleri dökülerek kitti bulunan lizis solüsyonu ile muamele edildi ve hücre lizatları elde edildi.
Kontrol ve her bir pro/anti apoptotik proteinespesifik olan antikorlar kitte bulunan nitroselüloz membranlarda (array) ikişer spot şeklinde tutunmuş halde bulunmaktadır.
İlk olarak bu membranlar blok solüsyonuyla 30 dakika çalkalayıcıda tutularak bloke edildi.
Ardından her hücre hattı için leptin eklenmemiş ve leptin ile muamele edilmiş hücrelerden elde edilen protein örnekleri ayrı ayrı membranlara eklendi ve +4˚C’de bir gece boyunca inkübasyona bırakıldı.
Gece inkübasyonundan sonra her array 3 defa 5’er dakika yıkama solüsyonlarıyla yıkanarak bağlanmayan proteinler kenarlaştırıldı.
Yıkama işlemlerinden sonra arraylar hazırlanan biotinlenmiş antikor kokteyli ile oda sıcaklığında 2 saat inkübasyona bırakıldı.
Yıkama basamakları tekrarlandı.
Ardından arrayler streptavidin bağlı horseradish peroksidaz (HRP-streptavidin) ile oda sıcaklığında 2 saat inkübe edilerek pro/anti apopitotik proteinlerin belirlenmesi tamamlandı.
27
Arrayler plastik sheetlere alındı daha sonra üzerlerine hazırlanan deteksiyon buffer karışımı eklendi, oda sıcaklığında ve karanlıkta 2 dakika bekletildi.
Sinyallerin kemilüminesans olarak belirlenmesi için Kodak®Gel Logic 1500
görüntüleme sistemi kullanıldı.
Görüntülemeden elde edilen spotlar Koadaarray® 2.6 bilgisayar yazılım programı ile kantitatif olarak hesaplandı ve analiz edildi.
3.5. İstatistiksel Analiz
Leptinin 0.5, 5, 25, 50, 100, 125, 200 ve 400 ng/ml dozlarının her biri tripan ve XTT uygulamaları için üçer kuyucukta test edildi. Her bir doz denemesi üç kez tekrarlandı ve her bir doz için üçer kuyucuktaki mikroplaka okuyucudan elde edilen absorbans değerlerinin ortalaması alındı ve ± SD değerleri hesaplandı. Artan dozların her birine ait hesaplanan değerler pozitif kontrol değerleriyle karşılaştırılarak hücre çoğalmasındaki artış miktarı açısından anlamlı bir farklılığın olup olmadığı tek yönlü ANOVA ve ardından Dunnett’s t-test kullanılarak araştırıldı. Elde edilen değerler Graphpad Prism 5.0 istatistik yazılımına aktarılarak leptinin artan dozlarına ait doz ve zamana bağlı cevap eğrileri ve grafikleri çizildi. Apoptoz arrayden görüntülemesinden elde edilen spotlar Koadaarray® 2.6 bilgisayar yazılım programı ile kantitatif olarak hesaplandı ve analiz edildi.