T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
KADIN HASTALIKLARI ve DOĞUM ANA BİLİM DALI BAŞKAN: PROF. DR. NİYAZİ AŞKAR
GLİKASYONUN SON METABOLİT ÜRÜNÜ- AGE VE
GLİKASYONUN SON METABOLİT ÜRÜNÜ ÇÖZÜNEBİLİR
RESEPTÖRÜ- sRAGE’NİN YARDIMCI ÜREME TEKNİKLERİ
UYGULANACAK İNFERTİL HASTALARDA OOSİT SAYISI,
MATURASYONU VE EMBRİYO KALİTESİ İLE İLİŞKİSİ
UZMANLIK TEZİ
DR. PARVANA SEYIDOVA
DANIŞMAN
PROF. DR. EROL TAVMERGEN
ii
ÖNSÖZ
Teşekkürler….
Uzmanlık eğitimim süresince bilgi ve tecrübelerinden yararlandığım, başta ana bilim dalı başkanımız Sayın Prof. Dr. Niyazi AŞKAR olmak üzere tüm değerli hocalarıma destek ve yardımlarını hiçbir zaman esirgemedikleri için en içten saygı ve teşekkürlerimi sunarım. Uzmanlık eğitimim ve tezimin her aşamasında desteğini gördüğüm, bu tezin gerek fikir gerekse sürdürülme aşamasında çok büyük pay sahibi olan, her konuda içtenlik ve samimiyetle yardımlarını esirgemeyen değerli hocam ve tez danışmanım Sayın Prof. Dr. Erol TAVMERGEN’e teşekkür ederim.
Tez çalışmamın her aşamasında yardımlarını esirgemeyen Sayın Prof. Dr. Ege Nazan Tavmergen GÖKER’e, Sayın Uzm. Dr. Gülnaz ŞAHİN ve Sayın Uzm. Dr. Ayşin AKDOĞAN’a, başta Sayın Nilüfer ÇALIMLIOĞLU olmak üzere çalışmanın yürütülmesinde emeği geçen tüm Ege Üniversitesi Rektörlüğü Aile Planlaması İnfertilite Uygulama ve Araştırma Merkezi çalışanlarına teşekkür ederim.
Kadın Hastalıkları ve Doğum Anabilim Dalı’nda uzmanlık eğitimim boyunca bilgi, deneyim ve yardımlarıyla bu alanda yetişmemde katkısı olan tüm değerli hocalarıma teşekkür ederim. Birlikte çalıştığımız süre boyunca her konuda desteklerini esirgemeyen sadece hocam olarak değil aynı zamanda birer ağabeyim olarak gördüğüm Sayın Prof. Dr. Mustafa Coşan TEREK’e, Sayın Doç. Dr. Ahmet Mete ERGENOĞLU’na, Sayın Doç. Dr. Ahmet Özgür Yeniel’e, Sayın Uzm. Dr. Levent AKMAN’a, Sayın Uzm. Dr. Çağdaş ŞAHİN’e, ve Sayın Uzm. Dr. Nuri YILDIRIM’a ayrıca birlikte çalışmaktan mutluluk duyduğum tüm araştırma görevlisi arkadaşlarıma, klinik hemşire ve personeline teşekkür ederim.
Çalışmanın yürütülmesi sırasındaki katkılarından dolayı Tıbbi Biyoloji Anabilim Dalı’dan Yard. Doç. Dr. Nur Selvi GÜNEL’e ve Dr. ASLI Tetik VARDARLI’ya teşekkürlerimi bir borç bilirim.
Kilometrelerce uzakta olsalarda hayatımdaki her zorlukta varlıkları ile hayatı yeniden anlamlandıran, bana güç veren, maddi, manevi hiçbir fedakarlıktan kaçınmayan, sevgi ve ilgilerini esirgemeyen ve bu günlere gelmemi sağlayan Sevgili Annem ve Babama, uzmanlık eğitimim boyuca beni hiç yalnız bırakmayan, her ihtiyacım olduğunda yanımda olan, canım kardeşim Nergiz SEYIDOVA’ya sonsuz teşekkür ederim.
Tanıdığım ilk günden beri her zaman yanımda yeralan, en büyük destekçim olan, tezimi yazmam konusunda yardımlarını esigemeyen hayat arkadaşım Sevgili Tansel VOYVODAOĞLU’na sonsuz teşekkür ederim.
iii
İÇİNDEKİLER
TABLOLAR ve ŞEKİLLERİN LİSTESİ ... iv
KISALTMALAR ... vii ÖZET ... ix GİRİŞ VE AMAÇ ... 1 GENEL BİLGİLER ... 4 YÖNTEM VE GEREÇ ... 44 BULGULAR ... 57 TARTIŞMA ... 71 SONUÇ ... 76 KAYNAKLAR ... 78
iv
TABLOLAR ve ŞEKİLLERİN LİSTESİ
Tablo 1:Erkek infertilitesi etiyolojisi ... 6
Tablo 2: Dünya Sağlık Örgütü Kriterlerine Göre Semen Analizi ... 7
Tablo 3: Sperm parametrelerinin değerlendirilmesi ... 8
Tablo 4: PKOS’ un 1990 Dünya Sağlık Örgütü Tanı Kriterleri ... 12
Tablo 5: 2003 Rotterdam PKOS Tanı Kriterleri ... 12
Tablo 6: Açıklanamayan İnfertilite de Olası Etyolojiler ... 15
Tablo 7: Over Rezervini Etkileyen Başlıca Parametreler ... 17
Tablo 8: Over Rezerv Testleri ... 18
Tablo 9: Kız Çocuk ve Adolesanlarda ortalama AMH Düzeyleri ... 24
Tablo 10: Glikasyon ... 31
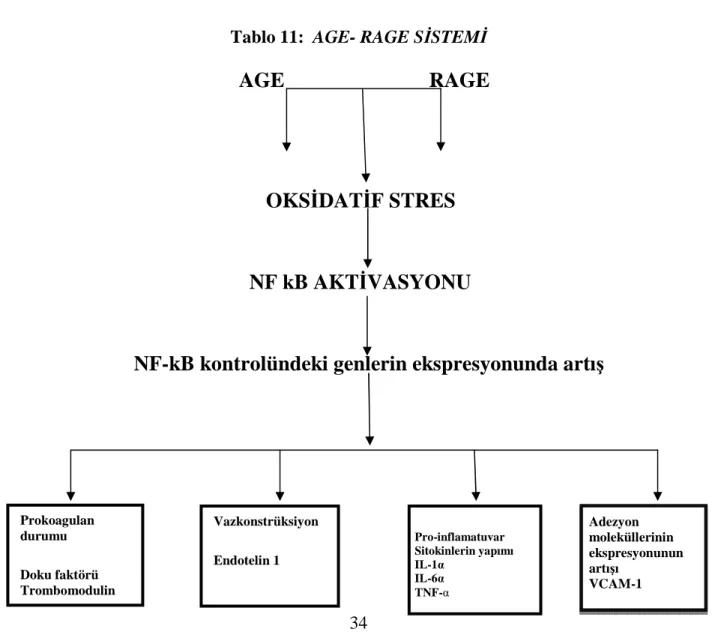
Tablo 11: AGE- RAGE SİSTEMİ ... 34
Tablo 12: Oosit Maturasyonunun Değerlendirilmesi ... 39
Tablo 13: Genel Embriyo Değerlendirilmesi ... 43
Tablo 14: Çalışmaya Dahil Edilme Kriterleri ... 44
Tablo 15: Çalışmada Kullanılan Kitler ... 46
Tablo 16: AGE Kiti ile Birlikte Sunulan Materyaller ... 48
Tablo 17: AMH Test Kitinde Bulunan Materyaller ... 51
Tablo 18: NFkB Test Kitinde Bulunan Materyaller ... 54
v
Tablo 20: Çalışma Grubundaki Hastaların Plazma AGE, sRAGE, AMH,
NFkB Arasındaki İlişkinin Değerlendirilmesi ... 59
Tablo 21: Çalışma Grubundaki Hastaların Folikül Sıvısında AGE, sRAGE, AMH, NFkB Arasındaki İlişkinin Değerlendirilmesi ... 60
Tablo 22: Çalışma Grubundaki Hastaların Folikül Sıvısında ve Plazma örneklerinde sRAGE, AMH, NFkB Arasındaki İlişkinin Değerlendirilmesi ... 61
Tablo 23: Çalışma Grubundaki Hastaların Folikül Sıvısında ve Plazma örneklerinde AGE, sRAGE, AMH, NFkB Değerlerinin Demografik Parametreler, Oosit sayısı, Oosit kalitesi, Embriyo sayısı, Embriyo kalitesi, Oosit maturasyon oranı, Fertilizasyon oranı ile Karşılaştırması ... 62
Tablo 24: Çalışma Grubundaki Hastaların Folikül Sıvısında ve Plazma Örneklerinde AGE, sRAGE, AMH, NFkB Değerleri ile Embriyo Kalitesi Arasındaki İlişki ... 64
Tablo 25: Çalışma Grubundaki Hastaların Toplam Embriyo Sayısı ve Embriyo Kalitesi ile Gebelik Oranları Arasındaki İlişki ... 65
Tablo 26: Çalışma Grubundaki Hastaların Toplam Embriyo Sayısı ve Embriyo Kalitesi ile Fetal Kardiyak Aktivitenin İzlendiği Gebelik Oranları Arasındaki İlişki ... 65
Tablo 27: Çalışma Grubundaki Hastaların Folikül Sıvısında ve Plazm Örneklerinde AGE, sRAGE, AMH, NFkB Değerleri ile Klinik Gebelik Oranları Arasındaki İlişki ... 66
Tablo 28: İnfertilite Nedenleri ile İlişkilendirme ... 67
Tablo 29: İnfertilite Nedenleri ile Anlamlı İlişki ... 69
vi
ŞEKİLLER
Şekil 1: İnfertilite nedenleri ... 5
Şekil 2: Menstrüel siklus hormonal değişiklikleri ... 9
Şekil 3: Normal ovulatuar bir siklusta bazal vücut ısısı grafiği ... 10
Şekil 4: Overde Folikül Gelişimi ... 22
Şekil 5: NFkB Aktivatörleri ve Etki Yerleri ... 37
Şekil 6: Metafaz I ve Metafaz II oositler ... 40
Şekil 7: Pronukleus aşaması ... 41
Şekil 8: Thermo Scientific® MultiscanFC spektrofotometre cihazı ... 48
Şekil 9: AGE ELISA KİT ile Çalışma Sonuçları ... 49
Şekil 10: sRAGE ELISA KİT ile Çalışma Sonuçları ... 50
Şekil 11: AMH ELISA KİT ile Çalışma Sonuçları... 53
Şekil 12: NFkB ELISA KİT ile Çalışma Sonuçları ... 55
Şekil 13: Olguların Toplam Embriyo ve Oosit Sayılarının Şematizasyonu ... 58
Şekil 14: Çalışma Grubundaki Hastaların Folikül Sıvısında ve Plazma Örneklerinde AGE, sRAGE, AMH, NFkB Değerleri ile Klinik Gebelik Oranları Arasındaki İlişki………66
vii .
KISALTMALAR
AGE : Glikasyonun Son Metabolit Ürünü
AMH : Anti Müllerian Hormon
AMHR : Anti Müllerian Hormon Reseptörü
ALK : Aktivin Reseptör Benzeri Kinaz
CML : Karboksimetil Lizin
COX : Siklooksijenaz
DM : Diabetes Mellitus
FSH : Folikül Stimulatif Hormon
GIFT : İntrafallop Gamet Transferi
E2 : Estradiol
EGF : Epidermal Büyüme Faktörü
GnRH : Gonadotropin Salgılatıcı Hormon
HPLC : Yüksek Performans Sıvı Kromatografisi
HCG : İnsan Koryonik Gonadotropin
HSG : Histerosalpingografi
IL : İnterlökin
IVF : İn Vitro Fertiizasyon
IUI : İntrauterin Inseminasyon
ICSI : İntrasitoplazmik Sperm Enjeksiyonu
IGF : İnsülin Benzeri Büyüme Faktörü
KOH : Kontrollü Ovaryan Hiperstimulasyon
LH : Luteinize Edici Hormon
MAPKs : Mitojen Aktive Protein Kinaz
NFkB : Nüklear Faktör kappa B
NADPH : Nikotinamid Adenin Dinükleotit Fosfat
NLS : Nükleer Lokalizasyon Sinyal
OHSS : Ovaryan Hiperstimülasyon Sendromu
OS : Oksidatif Stres
PKOS : Polikistik Over Sendromu
viii
POST : Peritoneal Oosit ve Sperm Transferi
RAGE : Glikasyonun Son Metabolit Ürünü Reseptörü
sRAGE : Glikasyonun Son Metabolit Ürünü Çözünebilir Reseptörü
ROS : Reaktif Oksijen Ürünleri
RHD : Rel-Homoloji Domain
SUZI : Subzonal İnseminasyon
TAGE : Toksik İlerlemiş Glikasyon Son Ürünleri
TNF : Tümör Nekroz Faktör
TET : Tubal Embriyo Transferi
TSH : Tiroid Simuleedici Hormon
TVUSG : Transvajinal Ultrasonografi
Tip2 DM : TİP 2 Diabetes Mellitus
USG : Ultrasonografi
YÜT : Yardımcı Üreme Teknikleri
VCAM : Vasküler Hücre Adezyon Molekülü
VKİ : Vücut Kitle İndeksi
VEGF : Vasküler Endotelyal Büyüme Faktörü
ix
ÖZET
Amaç
: Bu çalışmada amaç; glikasyonun ileri metabolit ürünü (Advanced Glycation EndProducts – AGE) ve glikasyonun ileri metabolit ürününün çözünebilir reseptörünün (Soluble Receptor for Advanced Glycation End Products - sRAGE), Yardımcı Üreme Teknikleri uygulanacak infertil olgularda oosit sayısı, maturasyonu ve embriyo kalitesi ile ilişkisini belirlemektir.
Yöntem
: Ege Üniversitesi Rektörlüğü Aile Planlaması İnfertilite Uygulama ve AraştırmaMerkezi Şubat 2015 - Ağustos 2015 tarihlerinde başvuran, aşağıdaki özellikleri taşıyan 40 olgu çalışmaya dahil edilmiştir. Olgular 20-42 yaş aralığında, BMI (Vücut Kitle İndeksi) <30 kg/m2, uterin anomalisi olmayan ve her iki overinin mevcut olması, düzenli adet döngüsüne sahip olması, FSH (Folikül Stimulatif Hormon) düzeyinin 15 mIU/ml’ nin, E2 düzeyinin 70 pg/ml’nin altında olması, PKOS (Polikistik Over Sendromu) ve Endometriozis tanısının olmaması, sigara kullanımının olmaması, hastanın ilk veya ikinci IVF (In Vitro Fertilizasyon) denemesinin olması, önceki IVF denemesinde OHSS (Overian Hiperstimülasyon Sendromu) gelişmemesi, diyabet, kardiyovasküler hastalıklar, otoimmun hastalıklar, bağ dokusu hastalıklarının olmaması, erkeklerde azospermi ve şiddetli oligospermi durumunun olmaması, Swim up değerinin >2.000.000/ml olması, çalışmaya dahil edilme kriterlerini oluşturmakta idi. Hastalardan folikül ponksiyonu günü kan ve folikül sıvısı örnekleri alınarak, kan örnekleri 3.000 rpm de 10 dakika, folikül sıvısı 800 rpm de 10 dakika santrifuje edildikten sonra -80 ºC’de saklanıldı. Alınan örnekler üzerinde, OxiSelect™ Advanced Glycation End Product (AGE) Competitive ELISA Kit, sRAGE (human), ELISA kit, Anti-Mullerian Hormone (AMH) ELISA Kit, NF-kBp65 (total) ELISA Kit ile çalışıldı. AGE, sRAGE, AMH, NF-kB gibi parametreler hem alınan kan örneklerinde, hem de folikül sıvısında değerlendirildi. Değerler 450 nm’ de Thermo Scientific® Multiscan FC spektrofotometre cihazı ile ölçülmüştür.
Bulgular:
Çalışma grubunda plazma ve folikül sıvısında glikasyonun ileri metabolit ürünü AGE ve onun çözünebilir reseptörü sRAGE değerleri çalışıldı. Bu parametrelerin kendi aralarında pozitif korelasyon gösterdiği görüldü. Özellikle oksidatif stresin önemli belirteci olan NFkB ile karşılaştırdığımız zaman hem plazma, hemde folikül sıvısında NFkB değeri yüksek bulunan hastalarda AGE ve sRAGE düzeyleri de yüksek saptandı. AGE ve sRAGEx
düzeylerini oosit sayısı, oosit maturasyon oranı, fertilizasyon oranı, embriyo kalitesi ve gebelik oranları ile karşılaştırdığımızda sonuç anlamlı bulunmamıştır. Özellikle azalmış over rezervi mevcut hastaların hem plazma hemde folikül sıvısında AGE ve sRAGE seviyeleri yüksek saptandı.
Sonuç:
İnfertil bayan olgularda AGE ve sRAGE’nin infertilte nedenleri ilişkili olduğuçalışmamızda da ortaya çıkmıştır. İleriye yönelik çalışmalarda daha fazla olgu sayısı ile daha farklı sonuçlar elde edilebilir.
1
GİRİŞ VE AMAÇ
İnfertilite, korunmasız cinsel ilişkiye rağmen bir yıl boyunca gebe kalınamaması olarak
tanımlanmaktadır. İnfertilite daha önce gebelik olmaması “primer infertilite” ve en az bir gebelik sonrası gebe kalamama “sekonder infertilite” olarak ikiye ayrılmaktadır. Genellikle infetilitenin 1/3 bayan, 1/3 erkek ve kalan 1/3 kısmına her ikisi katkıda bulunmaktadır.
İnfertilite tanısı üreme yaş grubundaki çiftlerin %10-15’ini etkilemektedir. 15-44 yaş
grubundaki kadınlar arasında infertilite insidansı %10,2 olarak bilinmektedir. 20-24 yaşlar arasında fertilite en yüksek seviyesindedir; 30-32 yaşlarında hafif şekilde azalmaktadır ve 40 yaşından sonra ilerleyici olarak hızla azalmaktadır.
20-25 yaşlarında fertilite oranı %4-8 iken; 40-45 yaşlarında %95 oranında daha düşük olmaktadır (11).
Artan yaşla birlikte fertilite azalırken, klinik olarak fark edilen gebelik kayıp oranı artmaktadır. Yaşla birlikte fertilitenin azalmasında birçok faktör etken olarak bilinmektedir. Yaşam tarzı seçenekleri ve çevresel faktörler fertiliteyi etkileyebilmektedir.
Ovulatuar disfonksiyon, tubal hastalıklar, uterin anormallikler ve diğer birçok faktörün fertilite üzerinde etkisi olduğu bilinmektedir.
Sigaranın fertilite üzerindeki olumsuz etkileri net olarak bilinmektedir (4). Alkol ve madde bağımlılığının da fertilite üzerinde olumsuz etkileri vardır.
Obezite, kemoterapi öyküsü, radyasyon maruziyeti, PKOS, endometriozis gibi durumlar da fertilite oranını düşürmektedir (9). Evlilik yaşının ilerlemesinin, geç anne olma isteğinin, toplumda kadınların rolünün değişmesinin ve yetersiz sosyokültürel koşullarının da infertil çiftlerin artışına katkısı olabilir.
Özellikle yardımcı üreme tekniklerinin gelişmesiyle infertilite tedavisindeki başarı oranları artmış ve daha çok infertil çiftin sağlıklı bir bebeğe sahip olabilmesi sağlanmıştır. Böylece infertil çiftlerin tedaviye yönelik umutları artmış ve bu nedenle hastaneye başvuru sayısında önemli artışlar olmuştur.
Tüm bu aşamalarda olguların bazal olarak doğru değerlendirilmesi, semen kalitesi ve over rezervinin saptanması çok önemlidir. Çünkü yardımcı üreme teknikleri tedavisi infertil çiftler için pahalı, düzenli zaman gerektiren, aynı zamanda stresli bir tedavidir ve tedavinin
2
başlangıcında hastalarla başarı oranları tartışılarak klinisyenle ortak karar vermeleri sağlanmalıdır (11).
Over rezervi, oosit sayısı ve kalitesiyle ilgilidir ve kadının reprodüktif potansiyelini gösterir. Over rezervinin gösterilmesi, klinisyenin başarı şansı konusunda hastayı realistik olarak bilgilendirmesini sağlar (11).
Böylece over rezervinin kötü olduğu hastaların başarısız bir tedavi siklusu yaşamasından kaynaklanan emosyonel stres, maddi kaynaklarının boşa harcanması ve zaman kaybı önlenmiş olur. Bunun yanı sıra tedaviden fayda görebilecek olguların da tedavi programında tutulması sağlanır. Over rezervini belirlemede birçok önemli parametreler mevcuttur.
Bu parametrelere; siklusun üçüncü günü bakılan FSH ve E2 değeri, antral folikül sayısı, siklustan bağımsız olarak bakılan AMH, inhibin B, klomifen sitrat testi ve bunların dışında over volümü, uterin arter vasküler değeri rezistansı dahildir.
Halen tüm dünyada over rezervini belirlemede kesin bir standardizasyon yapılmamıştır. En güvenilir parametrenin ne olduğu konusunda tartışmalar ve karşıt çalışmalar mevcuttur. Bu nedenle araştırmalar sürmektedir.
Son dönemde birçok hastalığın etiyopatogenezinde önemli etken olduğu düşünülen glikasyon metabolizmasının son ürünü AGE (Advanced Glycation End Products) ve onun reseptörü RAGE’nin, ovaryan ve endometrial disfonksiyona neden olarak fertilizasyon ve implantasyon üzerinde olumsuz etkilerinin olduğu düşünülmektedir. Vücutta özellikle over dokusunda biriken ve plazmada serbest halde bulunan AGE’nin fertilite oranlarını düşürdüğü bilinmektedir (2,3,6).
AGE; Tip2 DM, kardiyovaskuler hastalıklar, nörodejeneratif hastalıklar, obezite ve PKOS gibi patolojilerle bağlantılı bulunmuştur. İç kaynaklı AGE’ler vücutta kimyasal reaksiyonlar tarafından üretilirler. AGE’lerin dış kaynakları, beslenme ve sigara kullanmadır (4). AGE’ler genellikle fizyolojik koşullar altında yavaş oluşmaktadırlar. Hiperglisemi, insülin direnci, obezite, yaşlanma, oksidatif stres ve hipoksi, AGE habercilerinin oluşumunu hızlandırırlar. Sigara kullanımı sırasında tütün dumanında bulunan glukotoksin AGE oluşumunu artırmakla birlike AGE inhibitörü aminoguanidini inhibe etmektedir (4). Et, yumurta, peynir ve fazla yağlı besinler ile beslenme AGE oluşumunu anlamlı arttırmaktadır (2,3).
3
RAGE (Receptor for Advanced Glycation End Products) bir AGE reseptörüdür. RAGE bir immunoglobulindir. AGE-RAGE etkileşimi proinflamatuar durumun gelişmesine hücre toksisitesi ve hasarına sebep olan NFkB (nükleer faktör kappa B )’yi aktive etmektedir. AGE‘ler oksidatif stresle bağlantılı bulunmuştur. Over yaşlanmasında da AGE’lerin potansiyel akümülasyonunun yeri olabileceği hipotezi öne sürülmüştür. Üreme çağı boyunca AGE’lere uzun süre maruziyet, primordial foliküllerde oksidatif hasarlanma, ovaryan stromal damarlarda hasarlanma ve ovaryan mikroçevrede reaktif oksijen ürünlerinin belirgin artışı ile ilişkili olabilir. Overde AGE birikimi, oksidatif stres ve enflamasyon aktivasyonu ile over rezerv düşüklüğüne neden olabilir. Çözünebilir RAGE, (sRAGE) olarak bilinmektedir. AGE’yi bağlayarak olası olumsuz etkilerini azaltan sRAGE’nin varlığı folikül gelişiminde olumlu etkide bulunarak oosit sayısı ve kalitesini etkilemektedir (1,5). AGE- RAGE sistemi yardımcı üreme tekniklerine ihtiyaç duyulan over rezervi tükenen kadınlarda tedavi açısından çok büyük önem taşıyabilir (6).
İnfertil hastalarda fertilite üzerinde olumlu sonuçlar almak için birçok çalışma yapılmıştır.
Bu çalışmada; glikasyonun son metabolit ürünü (Advanced Glycation End Products–AGE) ve glikasyonun son metabolit ürününün çözünebilir reseptörü (soluble Receptor for Advanced Glycation End Products-sRAGE)’nün Yardımcı Üreme Teknikleri uygulanacak infertil olgularda oosit sayısı, maturasyonu ve embriyo kalitesi ile ilişkisi araştırılmıştır. Plazma ve foliküler sıvıda AGE ve sRAGE ölçümlerinin Yardımcı Üreme Teknikleri - IVF (In Vitro Fertilizasyon) sikluslarında gebelik sonuçları ile bağlantısı da araştırılmıştır.
4
GENEL BİLGİLER
İ
NFERTİLİTE
İnfertilite bir yıl süreyle korunmaksızın cinsel ilişkide bulunulmasına rağmen gebelik
olmaması olarak tanımlanır. Üreme cağındaki çiftlerin %10-15’i infertildir (11).
İnfetilite tedavisindeki bilimsel ve teknolojik gelişmeler başarı oranlarının artmasını
sağlamıştır. Böylece infertil çiftlerin beklentileri ve bu konudaki yardım arayışları artmıştır. Bu nedenle giderek daha fazla çift infertilite nedeniyle hastanelere başvurmaktadır. Sağlıklı genç çiftlerin yaklaşık % 85-90’ında ilk bir yıl içerisinde gebelik gerçekleşmektedir (26). Bir menstrüel siklusta gebe kalabilme olasılığına fekundabilite, bir siklusta canlı doğuma kadar gidebilecek gebelik oluşma olasılığına ise fekundite denir (11).
Fekundabilite, fertilite potansiyeline sayısal baz oluşturması nedeni ile değerli ve bilimsel bir kavramdır. Ayrıca çeşitli fertilite tedavilerinin yeterliliğinin sayısal olarak tahmin edilebilmesini ve optimal tedavinin planlanmasını sağlar. Siklus fekunditesi insanlarda %20 civarındadır. Gebelik oranları ise; ilk 3 ayda %57, ilk 6 ayda %72, ilk 1 yılda %85, ilk 2 yılda ise %93 tür (26).
Daha önce hiç gebelik oluşmamışsa primer infertilite; canlı doğumla sonuçlansın ya da sonuçlanmasın, en az bir gebelik oluşmuşsa sekonder infertilite denir.
Günümüzde yardımcı üreme tekniklerinin gelişmesiyle infertil çiftlerin tedavi şansları artmış, Bu yönde olumlu sonuçlar elde edilmiştir. Doğru tedavi için infertiliteye neden olan sebepler iyi belirlenmeli ve nedene yönelik tedavi yapılmalıdır.
Tedavide amaç öncelikle infertilitenin sebebini bulmak ve bunu düzeltmek olmalıdır. Ayrıca amaç sadece gebelik elde etmek değil, gebeliğin elde edilmesine kadar geçen zamanı da kısaltmaktır.
Tedavi süresince infertil çiftlere emosyonel destek sağlanmalı, çiftlerin; gerek çocuk sahibi olamamaktan, gerekse tedaviden kaynaklanan anksiyeteleri de giderilmelidir. Her aşamada çiftin bilgilendirilmesi sağlanmalı, tedavinin ne zaman kesileceği de anlatılmadılır.
İ
NFERT
Ş
EKİL 1:
(25)İnfertilitenin sıklığı ve nedenleri
Çiftlerin %30-40’ında erkek, % ise günümüzdeki mevcut standart mevcuttur.
5
İ
NFERTİLİTE NEDENLERİ
nedenleri bir toplumdan diğerine farklılık göstermektedir.
%40-50’sinde ise kadın infertiliteden sorumludur. standart tanısal testlerle izah edilemeyen (açıklanamayan
göstermektedir.
sorumludur. %10-15 çiftte (açıklanamayan infertilite)
6
ERKEK İNFERTİLİTESİ
Bir yıl içerisinde korunma olmaksızın yapılan normal cinsel ilişkiye rağmen gebe kalmayan çiftlerin oranı yaklaşık %15 kadardır. Erkeğin bu durumdaki oranı saf olarak yaklaşık %20 iken, kadın eş ile beraber ve açıklanamayan grup da içine alındığında bu oran %50’lere varmaktadır (26).
Reprodüktif yaştaki erkeklerin %6’sında infertilite problemi ortaya çıkmaktadır. Bu olguların yaklaşık % 90’ında da bozulmuş spermatogenez vardır. Normalde fertil bir erkekte günde 120 milyon adet sperm yapılmaktadır. Dünya Sağlık Örgütü tarafından 7273 evli infertil çift üzerinde, infertilite nedenine göre yapılan bir çalışmada %41 oranında kadın, %24 oranında erkek, %24 kadın ile erkek beraber ve %11’inde de bir neden gösterilememiştir (27).
Buradan da anlaşılacağı gibi evli infertil çiftlerin %48’inde mutlaka erkek faktörü işin içine girmektedir.
Dünya Sağlık Örgütünün ‘İnfertil Çiftlerin Standardize Edilmiş Araştırma ve Tanısı’ ile ilgili el kitabında erkek faktörünün etiyolojik grupları Tablo 1’de verilmiştir (26):
Tablo 1: Erkek infertilitesi etiyolojisi (26)
1) Seksüel /Ejakülatuar disfonksiyon 2) İmmünolojik nedenler
3) Neden belirlenememiş grup
4) İzole seminal plazma anormallikleri 5) İatrojenik nedenler
6) Sistemik nedenler 7) Konjenital anomaliler 8) Akkiz testiküler hasar 9) Varikosel
10) Aksesuar bezlerin enfeksiyonu 11) Endokrin nedenler 12) İdiopatik oligozoospermi 13) İdiopatik astenozoospermi 14) İdiopatik teratozoospermi 15) Obstruktif kriptozoospermi 16) Obstruktif azoospermi 17) İdiopatik azoospermi
7
Semen analizi ile erkek faktöründen şüphelenilerek ek klinik ve biyokimyasal değerlendirmeye yönlendirir. Konsantrasyon, motilite ve morfoloji özellikle önemlidir. Bu parametrelerden bir tanesi bozuksa, infertilite olasılığı 2-3 kat, iki tanesi bozuksa 5-7 kat, üçü de bozuksa 16 kat artar (27).
Erkek infertilitesinin belli başlı nedenleri genital yaralanma, semen testis enfeksiyonları genital traktus tıkanıklıkları, varikosel, yapısal genital sistem bozuklukları, endokrin ve metabolik bozukluklar, ilaç kullanımı ve psikiyatrik problemler olabilir. Erkek faktörü dışında sperm ve mukus ilişkisi de incelenmelidir.
Fizik ve ürogenital muayene sonrası noninvazif yöntemlerden başlanarak laboratuvar incelemeler semen analizi ile başlar. 2-5 günlük cinsel abstinans süresi sonunda elde edilen semen 2 saat icinde incelenmelidir (29).
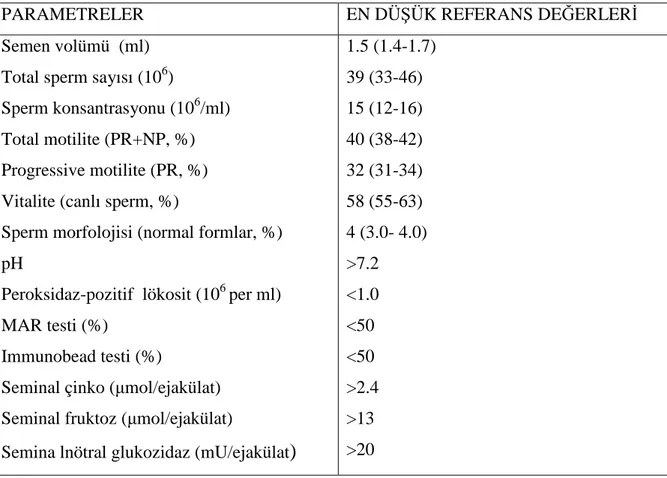
Dünya Sağlık Örgütünün 2010 da yeniden düzenlenen kriterlerine göre semen analizi bulguları Tablo 2҆ de gösterilmiştir (155).
Tablo 2: Dünya Sağlık Örgütü Kriterlerine Göre Semen Analizi (155)
PARAMETRELER EN DÜŞÜK REFERANS DEĞERLERİ
Semen volümü (ml) Total sperm sayısı (106)
Sperm konsantrasyonu (106/ml) Total motilite (PR+NP, %) Progressive motilite (PR, %) Vitalite (canlı sperm, %)
Sperm morfolojisi (normal formlar, %) pH
Peroksidaz-pozitif lökosit (106 per ml) MAR testi (%)
Immunobead testi (%)
Seminal çinko (µmol/ejakülat) Seminal fruktoz (µmol/ejakülat)
Semina lnötral glukozidaz (mU/ejakülat)
1.5 (1.4-1.7) 39 (33-46) 15 (12-16) 40 (38-42) 32 (31-34) 58 (55-63) 4 (3.0- 4.0) >7.2 <1.0 <50 <50 >2.4 >13 >20
8
Kruger’e göre normal morfoloji %4’den az, %4-14 arası ve %14’den fazla olarak sınıflandırılmaktadır. Normal morfoloji %4’den az olduğunda konvansiyonel IVF ile her oosit başına fertilizasyon oranı %7,6 iken, %14’den büyük olanlarda oran %63,9’a yükselmektedir (30).
Semen analizi sonrası sperm parametrelerinin değerlendirilmesi ile ilgili terimler Tablo 3’te verilmiştir (28).
Tablo 3: Sperm parametrelerinin değerlendirilmesi (28)
-Normozoospermi: Referans değerlerle tanımlanan normal ejakülat
-Oligozoospermi: Konsantrasyon için referans değerden daha düşük değer -Astenozoospermi: Hareketlilik için referans değerden daha düşük değer -Teratozoospermi: Morfoloji için referans değerden daha düşük değer -Oligoastenoteratozoospermi: Her üç değişkende olan bozukluğa işaret eder -Azoospermi: Ejakülatta hiç spermatozoa olmaması
-Aspermi: Hiç ejakülat elde edilememesi
KADIN İNFERTİLİTESİ
Kadına ait infertilite nedenleri ovulatuar, tuba peritoneal, servikal, immunolojik ve diğer infertilite nedenleri olarak bilinmektedir. İnfertilite nedenleri içerisinde %10 oranında açıklanamayan infertilite olgularıyla da karşılaşmaktayız.
Kadın infertilitesinin sebebini belirlemede yapılan testler; hormon profili, postkoital test (servikal mukusun değerlendirilmesi), bazal vücut ısısı takibi, endometrial biyopsi, luteal faz progesteron ölçümü (ovulasyonun değerlendirilmesi), USG, histerosalpingografi, histeroskopi ve laparaskopidir ( uterus, tuba , over anatomisinin değerlendirilmesi) (11).
Kadın infertilitesi nedenlerinden ovulasyon bozuklukları, diğer nedenlere kıyasla daha fazla görülmektedir.
Ovulatuar bozukluklar
Kadına bağlı infertilitenin %30 ile kendini gösterir. İnfertil hastalarda Ovulasyon hipotalamus, hipofiz herhangi bir aşamasındaki bozukluk koyulur ise, ayırıcı tanıda hipotalamo prematür over yetmezliği, hipotiroidizm tipine göre, tedavi protokolleri
Ovulasyonun tespitinde çeşitli - Hikaye: 21-35 günde bir
hassasiyet, dismenore gibi ovulasyonun belirtileridir.
- LH Monitorizasyonu: Ovulasyon; saat sonra gerçekleşir. Bu ortaya konabilir (31,32). Menstrüel siklustaki hormonal
ŞEKİL 2:Menstrüel
9
30-40’ını oluşturur. Anovulasyon, amenore ve hastalarda ovulasyonun olup olmadığı mutlaka hipofiz ve over aksının düzenli çalışmasıyla
bozukluk sonucu, anovulasyon oluşabilir. Anovulasyon hipotalamo-hipofizer bozukluklar, PKOS, anoreksiya hipotiroidizm gibi hastalıklar düşünülmelidir.
protokolleri değişmektedir.
şitli yöntemler kullanılabilir:
bir düzenli adet görmek ve adet öncesi göğ gibi premenstrüel ve menstrüel semptomların belirtileridir.
Ovulasyon; LH yükselmeye başladıktan 34-36,
Bu nedenle LH yükselmesinin tespiti ile ovulasyonun
hormonal değişiklikler Şekil 2҆ de gösterilmiştir.
Menstrüel siklus hormonal değişiklikleri (11)
ve adet düzensizliği mutlaka tesbit edilmelidir.
sağlanır. Bu aksın Anovulasyon tanısı anoreksiya nevroza, elidir. Anovulasyonun
göğüslerde şişkinlik, semptomların varlığı mühtemel
LH pikinden 10-12 ovulasyonun varlığı
- Bazal vücut ısısı ölçümü: kalkmadan vücut ısısının ölçülerek, Normal vücut ısısı 36,5 °C civarında Ovulasyondan sonra progesteron vücut ısısında 0,2-0,3 °C artış Yani menstrüasyonun birinci ve Eğer siklusta monofazik düzen
yükselme oldu ise kesin tanı olmamakla
ŞEKİL 3:Normal
- Midluteal serum progesteron birlikte luteinize olan granuloz progesteron düzeyinin yükselmesi
10
Siklusun ilk gününden itibaren, her sabah aynı ölçülerek, bazal vücut ısısı kartına işlenmesi
civarında olup, preovulatuar dönemde bu düzeydedir. progesteron hormonu artar. Progesteronun termojenik
artış izlenir. Luteal fazda en az 10 gün süren artı
ve ikinci dönemi arasında bifazik düzen söz konusudur. düzen varsa bu anovulasyonu, ısı artışında 10 gün
olmamakla beraber luteal faz yetersizliğini düş
Normal ovulatuar bir siklusta bazal vücut ısısı grafiğ
progesteron ölçümü: Ovulasyon sonrası korpus luteumun granuloza hücrelerinden progesteron salgılanır. yükselmesi ovulasyonun indirekt bir bulgusudur.
aynı saatte, yataktan yöntemiyle yapılır. düzeydedir.
termojenik etkisi sonucu, artış vardır (Şekil 3).
konusudur.
günden daha kısa bir üşündürür.
grafiği (11)
luteumun oluşmasıyla Bu nedenle serum
11
Progesteron ölçümü sekresyonun pik yaptığı midluteal dönemde yapılmalıdır (33). Serum progesteronunun 3 ng/ml’nin üstünde olması ovulasyonun göstergesidir. Luteal faz yetmezliği tanısında ise ovulasyondan sonraki 5-9. günleri arasında 3 kez progesteron ölçümü yapılır. 3 ölçümün toplamı 30 ng/ml ya da tek ölçümde 10 ng/ml ise luteal faz yetmezliği yoktur (34). - Endometrial biyopsi: Geç luteal dönemde, genellikle beklenilen menstrüasyondan 2-3 gün önce alınır. Proliferatif endometriumun tespit edilmesi, anovulasyonu gösterir. Siklus gününe göre 2 gün veya daha fazla gecikme, luteal faz yetmezliğini düşündürür (33).
- Ultrasonografik Monitörizasyon: Seri ultrasonografik takip ile dominant folikül gelişimi ve ovulasyondan sonra folikülün gerilemesi izlenerek ovulasyon olup olmadığı saptanabilir. Menstrüasyonun 3. günü TVUSG (Transvajinal Ultrasonografi) ile overler ve overlerde antral foliküller değerlendirilmelidir. Siklusun 5-7. günü seçilen dominant folikül ovulasyona kadar 1-4 mm/gün büyüme gösterir. Ovulasyon genelikle folikül çapı 21-23 mm olduğunda gerçekleşir (35,36).
Anovulasyon ve infertilite ile giden hastalıkların en sık görülenleri aşağıda belirtilmiştir:
WHO I: Hipogonadotropik hipogonadizm (kilo ve vücut kompozisyonunda değişiklikler,
stres, aşırı egzersiz, hipotalamusun infiltran hastalıkları, prolaktinoma, boş sella sendromu, Sheehan Sendromu, Cushing Hastalığı, Akromegali vb.)
WHO II: Östrojenik ovulatuar disfonksiyon (Polikistik Over Sendromu (PKOS) ) WHO III: Hipergonadotropik hipogonadizm (Over Yetmezliği)
Vücut kitle indeksi (VKİ), serum FSH, prolaktin, TSH ve gerektiğinde androjenlerin ölçümü anovulasyonun spesifik nedenini anlamaya yönelik tetkiklerdir. Anovulatuar hastalıkların tedavisi ile normal çiftlerin fekunditesine yakın sonuçlar alınabilir (37).
Polikistik Over Sendromu
PKOS doğurganlık çağındaki kadınlarda en sık görülen endokrin bozukluktur (38). Kronik
anovulatuar infertilitenin en sık nedeni olan PKOS, multisistemik reprodüktif, metabolik bir sendrom olarak; Tip 2 diyabet, dislipidemi, kardiyovasküler hastalık ve endometriyal karsinoma gibi uzun dönem sağlık riskleri taşır.
12
Sendromun prevalansı yaklaşık % 6- 8 olarak bildirilmektedir.
İlk kez 1935 yılında Stein Leventhal tarafından, yedi hastadan oluşan bir seride polikistik
overler ve amenore birlikteliği şeklinde rapor edilmiştir (39). Günümüzde halen sendromun etyopatogenezi ve tanı kriterleri hakkında tartışmalar sürmektedir.
En yaygın olarak kullanılan tanı kriterleri, 1990 yılında National Institute of Health (NIH) tarafından düzenlenmiş bir konferansta oluşturulmuştur (Tablo 4).
Tablo 4: PKOS’ un 1990 Dünya Sağlık Örgütü Tanı Kriterleri (40,41)
1. Kronik anovulasyon
2. Klinik ve/veya biyokimyasal hiperandrojenizm bulguları ve diğer etyolojik nedenlerin ekarte edilmesi
2003 yılında düzenlenen toplantıda NIH kriterleri yeniden gözden geçirilmiş ve “Rotterdam yeniden gözden geçirilmiş tanı kriterleri” oluşturulmuştur (Tablo 5). Sendromun tanısının, aşağıdaki üç kriterden ikisinin birlikteliği ile konulması önerilir (40,41).
Tablo 5: 2003 Rotterdam PKOS Tanı Kriterleri (40,41)
1. Oligo-anovulasyon
2.Klinik ve/veya biyokimyasal hiperandrojenizm bulguları 3.Polikistik overler ve diğer etyolojik nedenlerin ekarte edilmesi
PKOS genellikle peripubertal dönemden itibaren başlayan menstrüel düzensizlikler (oligo-amenore, disfonksiyonel uterin kanaması), hiperandrojenizm bulguları (hirsutizm, akne, ciltte yağlanma, androjenik alopesi) ve infertilite ile ortaya çıkmaktadır (42). PKOS’da obezite sıklığı %40-60 olarak bildirilmektedir (43,42). Klinik bulguların PKOS düşündürdüğü
13
olgularda tanı biyokimyasal ve ultrasonografik bulgularla desteklenmelidir. LH düzeylerinde ve LH/FSH oranında artış olabilir.
Yaklaşık %25-60 olguda hiperinsülinemi ve insülin direnci saptanabilir (44,45).
Ultrasonografik görüntülemede 2-9 mm çaplı, 12 veya daha fazla folikül olması ve/veya artmış over volümü (>10ml) polikistik over olarak tanımlanır (40,41). Bu bulguların tek overde olması yeterlidir.
PKOS’nun etyopatogenezi net olarak bilinmediği için günümüzde mevcut tedavi seçenekleri de genellikle semptomatiktir. Bu anlamda, tedavi hedefleri hiperandrojenizmin kontrol edilmesi, menstrüel disfonksiyonun düzeltilmesi ve fertilitenin sağlanması şeklinde sıralanabilir.
Tubal faktör:
İnfertil çiftlerin yaklaşık %20'sinden tubal ya da peritoneal faktör sorumludur. Pelvik
enflamatuar hastalıklar, apandisit, septik abortus, önceki tubal cerrahi, pelvik enfeksiyona neden olan intrauterin araç kullanımı, klamidya trakomatis ile subklinik pelvik enfeksiyonlar tubal hastalığa katkıda bulunurlar.
Tubal durumu değerlendirmek için en çok kullanılan testler HSG (Histerosalpingografi) ve laparoskopidir. HSG’nin avantajı uterin kavite ile ilgili bilgi sağlaması ve peritoneal ortamı değiştirmek suretiyle fekundabiliteyi arttırabilmesidir. Dezavantajı ise prosedürün ağrılı olması ve adezyonlar ya da endometriozis gibi peritoneal hastalıklar hakkında fikir vermemesidir.
HSG’de proksimal tubal oklüzyon görüldüğünde doğrulayıcı testler (selektif tubal kateterizasyonu ya da laparoskopi) yapılma gereği vardır.
Laparoskopinin HSG’ye üstünlüğü, tubal hastalıkları tespit etmede daha sensitif ve spesifik olmasıdır. Laparoskopi ayrıca endometriozisi tespit edebilir ve saptanan anormalliklerin tedavisini sağlar.
14
gebeliktir (37). Buna karşın IVF/ICSI uygulanmış hastaların ilk tedavi siklusundaki gebelik oranı %21 olarak bulunmuştur (46).
Distal tubal hastalıkta hafif hasar veya minimal peritubal yapışıklık varlığında yaşı genç hastalarda, cerrahi denense de yardımcı üreme tekniği mutlaka uygulanmalıdır (47). Cerrahiye rağmen 1 yıl içerisinde gebe kalamayan olgularda, hastalığın ciddiyetinden bağımsız olarak yaşı ileri olan kadınlarda ve tekrarlayan distal tubal tıkanıklığı olan hastalarda yardımcı üreme tekniği tercih edilmelidir. Şiddetli distal tubal hastalığı olan kadınlar da IVF öncesi uygulanacak cerrahi girişimden fayda görebilmektedir.
Uterin kavite ile bağlantısı olan hidrosalpinks varlığında (proksimal açık distal tıkalı) IVF ile elde edilen gebelik ve canlı doğum oranlarının neredeyse yarı yarıya azaldığı gösterilmiştir (48). Hidrosalpinks sıvısı enflamatuar karakterde olur, embriyo ve endometriyuma toksik etki göstermektedir. IVF öncesi laparoskopik salpenjektomi yapılmasının, IVF başarısını arttırdığı gösterilmiştir (49).
Proksimal tubal tıkanıklık tanısı konulduktan sonra olgulara cerrahi girişim uygulanabilmektedir. Tubal cerrahi başarısızlığı durumunda veya postoperatif 6-12 ay geçmesine rağmen gebelik oluşmamış ise IVF/ICSI uygulanmalıdır. Hem proksimal hem de distal tubal hasar varsa cerrahi başarısı çok düşük olacağından IVF/ICSI en uygun yöntemdir.
Açıklanamayan infertilite
Açıklanamayan infertilite: İnfertilite nedenleri için yapılan tetkikler sonucunda herhangi bir neden saptanamaması olarak tanımlanır. İnsidansı, infertil populasyondaki tanı kriterlerine bağlı olarak %10-30 arasında değişmektedir (50).
Tanı, normal semen analizi, ovulasyonun objektif kanıtları, normal uterin kavite ve bilateral tubal açıklık olduğunda konulur.
Nedeni açıklanamayan infertilitesi olan kadınlarda laparoskopinin gerekliliği tartışmalıdır. Laparoskopi tespit edilmemiş tubal faktör ve endometriozisin tanısını koyarak tedavi sağlayabilir veya nedeni açıklanamayan infertilite için yapılan ampirik tedavileri sınırlandırabilir.
15
Bununla birlikte, normal HSG ve pelvik muayenesi olup, tubal faktör için risk faktörü olmayan asemptomatik kadınlarda laparoskopi ek açıklayıcı bilgi vermeyecektir. Overleri tutan endometriomaların ve ilerlemiş endometriozisin infertiliteye etkisi kesinken orta düzeyde hastalığın etkisi kanıtlanmamıştır.
Birçok araştırıcı, infertilite değerlendirilmesinde tanısal laparoskopi yerine, foliküler fazda yapılacak transvajinal ultrasonografinin daha uygun olacağını belirtmektedir (11).
Tablo 6. Açıklanamayan İnfertilite de Olası Etyolojiler (11)
(Berek J.S. İnfertilite (In), Berek J.S: İnfertilite, Adashi E. Y, Hillard P.A Novak Jinekoloji, 14.baskı)
1) Antagonist servikal sekresyonlar
2) Erken embriyonel implantasyonda defektif endometrial reseptivite 3) Anormal tubal silier aktivite
4) Defektif ovum pick-up mekanizması 5) Luteinize unrüptüre folikül sendromu
6) Ek hormonal anormaliteler, örnek: Luteal faz defekti 7) Bozulmuş oosit ve/veya sperm fertilizasyon kapasitesi 8) Minimal veya orta düzeyde endometriozis
9) İmmünolojik faktörler
10) Bozulmuş peritoneal makrofaj aktivitesi
11) Bozulmuş pertoneal sıvı antioksidan fonksiyonu
Nedeni açıklanamayan infertilite, normal reproduktif etkinlik dağılımının alt sınırını veya standart değerlendirme metoduyla tanısı konulamayan sperm veya oosit fonksiyon anormallikleri, fertilizasyon, implantasyon veya embriyo gelişim bozukluklarını içermektedir. Tedavi edilmemiş olanlarda siklus başına gebelik oranı %2-4 kadardır (51).
Tedaviden bağımsız gebelik olasılıkları, artan kadın yaşı ve infertilite süresi ile ters orantılıdır (52,53). Her ne kadar nedeni açıklanamayan infertil çiftlerin çoğu tedavi olmadan gebe kalabileceklerse de yıllarla azalan gebe kalabilme oranları tedavi için başvurmalarını gerektirmektedir.
16
Açıklanamayan infertilitede ovulasyon induksiyonu ile kombine edilmiş IUI (İntrauterin
İnseminasyon) tedavisi 3-4 kez denenebilir.
Gebelik oluşmazsa IVF/ICSI yöntemine geçilir. İleri kadın yaşında özellikle 38 yaş üzeri IUI uygulamaksızın direkt IVF/ICSI tedavisine geçilmesi düşünülmelidir (54).
İnfertilite olgularında baş vuran hastaları değerlendirirken en önemli parametrelerden biri de,
over rezervinin belirlenmesidir.
Over Rezervi
İnfertilite tedavisi yapılacak olgularda tedavi şeklinin belirlenmesi ve elde edilecek başarı şansının tahmini için over ve testislerin değerlendirilmesi gereklidir. Bu bilgi erkeklerde
spermiogramla sağlanır. Kadınlarda ise over rezervi araştırılmalıdır. Over rezervinin tayini gebelik olasılığı hakkında bilgi verir. Tedavinin gecikmemesi, doğru planlanması ve gerekiyorsa iptal edilerek maddi ve manevi zararların önlenmesini sağlar. Ayrıca ovulasyon indüksiyonu ve kontrollü ovaryan hiperstimülasyon uygulamalarında amaçlanan sayıda folikül gelişiminin sağlanması ve ovarian hiperstimülasyon sendromu gelişmesinin önlenmesi için uygun tedavi şeklinin, ilaç dozunun belirlenmesinde kullanılır.
Oosit fonksiyonunun regülasyonu, parakrin ve endokrin faktörlerin kontrolü ile sağlanır. Oosit gelişimini sağlayan temel endokrin hormonlar FSH ve LH dır. Bunlar, sitokinler interkolin A, inhibin, aktivin, büyüme faktörleri, steroidler, oosit maturasyon inhibitorü gibi lokal faktörlerin oluşumunu da içeren çeşitli mekanizmalarla etki gösterirler. Oositler üzerinde gonadotropin reseptörü olduğu gösterilememiştir. Oositler üzerine olan etki daha büyük olasılıkla granüloza ve teka hücrelerinden kaynaklanan mediatörler ile sağlanmaktadır. EGF, VEGF, IGF2 bu mediatörler arasında sayılabilir. Over fonksiyonları steroidojenik ortamdan da ileri derecede etkilenir. İntrafoliküler androjen ve östrojen oranı özellikle önemlidir. Örneğin androjen/östrojen oranı düşük olduğundan germinal vezikül yıkımı olur, oran yüksek ise de folikül dejenerasyonu meydana gelir.
Suprafizyolojik E2 düzeyleri; oosit gelişimini, fertilizasyon ve gebelik oluşumunu olumsuz etkilemektedir, ayrıca endometriumun hızlı gelişimini sağlayarak implantasyon penceresinin kaçırılmasına neden olmaktadır. LH hipersekresyonu, artmış androjen üretimini, mayozun
17
erken tamamlanması gibi patolojik durumlar da oosit fonksiyonlarını negatif yönde etkilemektedirler (55).
Over rezervi bilindiği gibi doğumdan itibaren yaşla azalmakta, 35 yaşından sonra oosit kalitesi de bozulmaktadır.
Rezerv azalmasının mekanizması tam bilinmemektedir. Fakat çevresel faktörlerin etkisiyle oksidatif hasar ve hormonal dengesizlik, folikülü atreziye götürmektedir. Zarar gören yaşlı oositin hücre siklusu bozulmakta, mayotik ayrılmama, anöploid oositler, mozaisizm, gebelik kayıpları meydana gelmektedir. Preimplatasyon genetiği çalışmalarında 35-45 yaş arasında embriyolarda %40 oranında kromozomal anomali izlenmiş, bunların %76’sında anöploidi bulunmuştur (56).
Prematür over yetmezliği etyolojisinde birçok teori öne sürülmüştür. Granüloza hücrelerine karşı oluşan otoantikorlar, bozulmuş anjiogenezis, patolojik apoptotik aktivite, otokrin ve parakrin faktörlerin etkisi bunlardan bazılarıdır. Ayrıca ailesel yatkınlık da önemli olup ve genetik yatkınlık da faktörler arasında bulunmaktadır.
Gerçekten de prematür over yetmezliği olanlarda sayısal ve yapısal kromozomlarda anomali görülme sıklığı artmış olarak bulunmaktadır (56).
Tablo 7: Over Rezervini Etkileyen Başlıca Parametreler
1-Yaş
2-Geçirilmiş over cerrahisi 3-Şiddetli endometriozis 4-Obezite
5-Sigara kullanımı
6-Anatomik bozukluklar (adezyon gibi) 7-Latent veya prematür over yetmezliği
18
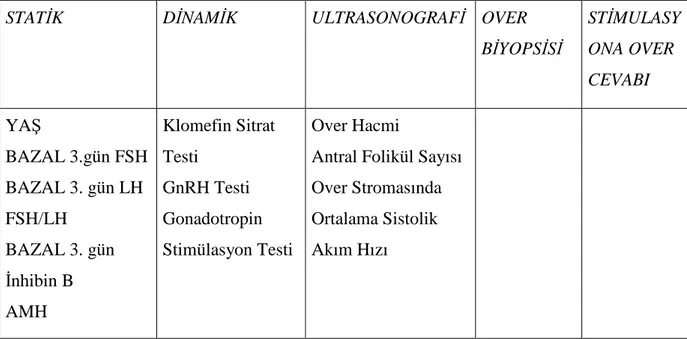
Tablo 8: Over Rezerv Testleri
STATİK DİNAMİK ULTRASONOGRAFİ OVER
BİYOPSİSİ STİMULASY ONA OVER CEVABI YAŞ BAZAL 3.gün FSH BAZAL 3. gün LH FSH/LH BAZAL 3. gün İnhibin B AMH Klomefin Sitrat Testi GnRH Testi Gonadotropin Stimülasyon Testi Over Hacmi
Antral Folikül Sayısı Over Stromasında Ortalama Sistolik Akım Hızı
Over Rezervini Etkileyen Başlıca Parametreler:
*Yaş:
Over rezervi yaşla direkt ilişkili olmasına rağmen çeşitli varyasyonlar olabilmektedir. Çalışmalar göstermiştir ki; <25 yaşta gebe kalamayan hastaların oranı %6 iken 36-40 yaşında bu oran %43’e çıkmaktadır. 40’lı yaşlara yaklaşıldığında 12 inseminasyon siklusu ile gebe kalabilme şansı %50 dir. Yaş ile reprodüktif potansiyel azalmasına rağmen sınırlı bir prediktif değeri vardır (59).
*FSH:
FSH, over foliküllerinin gelişimini uyaran gonadotropik bir hormondur. Over rezervinin azalması sonucu foliküler gelişim bozulur ve buna yanıt olarak kanda FSH düzeyi yükselir. IVF sikuslarında yaştan daha önemli bir belirleyici olduğu ortaya çıkmıştır (57). Toner ve arkadaşları 1478 IVF siklusunda yaptıkları çalışmada gebelik ve siklus iptal oranlarını belirlemede bazal FSH değerlerinin yaştan daha değerli bir prediktör olduğunu bulmuşlardır (58). Siklusun 2 veya 3. günü bakılan FSH değeri >12 mIU/ ml ve üzerinde ise overin ovulasyon induksiyonu veya kontrollü ovaryan hipertimülasyona cavabı zayıf olacaktır. FSH değeri
19
sikluslar arasında dalgalanmaktadır, bununla beraber en az bir kez yüksek bulunması zayıf over rezervi yönünden anlamlıdır (9).
*E2:
Siklusun 2. veya 3. günü bakılan E2 değerlerinin >70 pg/ml’nin üzerinde olması siklus iptali riskinin yüksek olduğunu gösterir (58). E2 düzeyi FSH ile birlikte değerlendirildiğinde anlamlıdır. <45 pg/ml değeri idealdir. Sadece bazal E2 düzeyi ile tedavi sonuçları arasında anlamlı korelasyon yoktur.
Yüksek E2, FSH üzerinde negatif feedback etkili olduğundan FSH’ın yanlış olarak düşük saptanmasına neden olur. Önceki siklustan kalan persiste kistik oluşum, E2’nin yüksek ölçülmesine neden olabilir.
Kontrollü ovarian hiperstimülasyonda HCG günü E2 değerinin 500 pg/ml’nin altında olması zayıf cevap olarak değerlendirilir (59). Yüksek östrojen değerleri over rezervinin kısıtlı olduğu yönünde uyarıcıdır.
Siklusun 3.günü estradiol düzeyinin yüksek olması (80 pg/ml'nin üzeri) düşük fekundabiliteyi gösterir (56).
*İnhibin-B:
45 pg/ml ve altında saptanan olgularda gebelik oranlarının düşük, iptal riskinin yüksek olduğu gösterilmiştir (60).
*Klomifen sitrat testi:
Bu test için siklusun 3. günü FSH ve E2 ölçümü yapılır. 5-9. günler arası 100 mg/gün klomifen sitrat uygulanır. Siklusun 3. ve 10. günlerinde FSH ölçülür. Bu ölçümlerde laboratuvar sınırlarını aşan bir değer bulunmuşsa test pozitif olarak değerlendirilir. Bu sınır genellikle 10-12 mIU/mL’dir (61,62).
*Gonadotropin stimülasyonuna cevap testi:
Siklusun 3. günü 300 IU FSH IM (intramüsküler) uygulanır. Önce ve 24 saat sonra E2, FSH değerlerine bakılır. İyi cevap olarak değerlendirmek için artış oranları sırasıyla E2 >25-30 pg/ml, FSH <9 IU/I olmalıdır (23).
20
*GnRH analoğu stimülasyon testi:
GnRH analoğu uygulanması ilk 4.-6. günü içinde FSH, LH ve bunlara bağlı olarak E2 artışı olur. Siklusun 2. günü 1 mg leuprolide asetat subkutiküler uygulanarak 3. gün E2 düzeyine bakılır (63). Buna flare etki denir. Uygulama zorluğu ve pahalı bir test olması nedeniyle pratik olarak kullanılmamaktadır.
Dört farklı E2 paterni izlenebilir. Hızlı E2 yükselmesi ve 4. günü azalma, gecikmiş E2 yükselmesi ve 6. gün azalma, devamlı E2 yükselmesi, E2 yükselmesinin olmamasıdır (29).
*Ultrasonografik ölçümler - Over volümü ve antral folikül sayısı :
Halen over rezervinin belirlenmesinde güvenirliği yüksek testler bulunmaya çalışılmaktadır. Bu konu araştırılırken overlerin ultrasonografik görünümü ile induksiyona verdikleri cevap arasında bağlantı olduğu görülmüştür. Over hacmi ve antral folikül sayısı arttıkça over rezervinin de arttığı öne sürülmektedir.
Antral folikül sayısına göre yapılan derecelendirme tedavi şeması ve ilaç dozları belirlemede yardımcıdır (61,62). Doppler USG ile over kan akımının ölçülmesi folikül ve oosit sayısını tahmin etmede belirleyici olabilir (62).
Antral folikül sayısı <6 olan hastalarda cevap kötüdür (29).
Chang ve arkadaşları 130 hastayla 149 tedavi siklusunda yaptıkları çalışmada antral folikül sayısına göre (≤3, 4-10,ve ≥ 11) hastaları 3 gruba ayırmışlar ve çalışmanın sonucunda antral folikül sayısının yaş, 3. gün FSH düzeyi, kullanılan gonadotropin dozu serum E2 konsantrasyonu, toplanan oosit sayısı ve transfer edilen embriyo sayısı ile önemli ölçüde korelasyon gösterdiğini belirlemişlerdir (64).
Kötü Over Rezervi Tanımı:
Kötü Over Rezervi tanımındaki parametreler aşağıdakilerdir (115):
• İleri hasta yaşı
• Klomifen sitrat test’e kötü yanıt
21
• En az bir IVF siklusunun iptali
• Artmış “kullanılan FSH” dozu
• Uzamış stimulasyon süresi
• Kontrollü ovaryan hiperstimülasyon (KOH) ’da uygun sayıda folikül elde edememek
• Tek dominant folikül, günlük doz > 300 IU, total doz > 3000 IU
• FSH/LH≥ 3, Bazal İnhibin B < 45 pg/ml
• Artmış FSH seviyeleri
• Az matür folikül sayısı (2-5)
• hCG günü düşük E2 seviyeleri (300-660 pg/ml) (114)
• İleri maternal yaş veya anormal ovaryan rezerv test yokluğunda, maksimal
stimülasyona rağmen iki kez kötü ovaryan yanıt oluşmuşsa bu hastalar Kötü Over Rezerv’li olarak tanımlanır (116).
Kötü over rezervi, ESHRE Konsensus, Bolonya Kriterleri bu kriterlerin özetidir ve üç özellikten en az 2‘si olmalıdır (115).
ESHRE Konsensus Bolonya Kriterleri:
* İleri kadın yaşı (≥ 40) veya kötü over rezervi için diğer risk faktörleri * Önceki bir konvansiyonel stimülasyon protokolü ile ≤ 3 oosit* Herhangi anormal ovaryan rezerv test (ör: antral folikül sayısı (AFC) < 5-7 veya Anti Müllerian Hormon (AMH) < 0.5-1.1 ng/ml
YÜT (Yardımcı Üreme Teknikleri) sikluslarının %9-26’sını kötü ovaryan rezerv sahibi olgular oluşturur. 40 yaşın üzerinde oran %50’dir.
Şekil
Anti-Müllerian Hormon
İlk defa 1940 yılında testislerden
saptandı. Bu proteine “Müllerian bu proteini izole edilerek kodlayan AMH reseptörü tanımlandı (67) ağırlığında, disulfit bağlarıyla Erkeklerde testislerde sertoli başlar ve tüm yaşam boyunca Kızlarda overlerde primordial başlayıp primer ve preantral salgılanır.
Dişi insan fetusunda 36. gestasyon menapoza kadar AMH eksprese foliküllerde AMH üretimi yoktur. dolaşımdaki düzeyleri overdeki
22
ekil 4: Overde Folikül Gelişimi (66)
testislerden salgılanan bir proteinin Müller kanalını “Müllerian Inhibiting Substance” adı verildi. Yaklaş
kodlayan geni saptandı ve proteine AMH denildi.
(67). Anti-Müllerian Hormon dimerik bir glikoproteindir. bağlanmış iki monomerden oluşur (65).
hücrelerinden 5. gestasyonel haftadan itibaren salgılanması devam eder.
foliküllerde AMH salgılanmazken primordial preantral foliküllere dönüştüğünde granüloza hücr
gestasyon haftasından (farelerde postnatal 3-4. eksprese olur (68). Atretik foliküller ve FSH bağ
yoktur. Lokal olarak üretilen bu hormon kana geçti overdeki konsantrasyonuna paraleldir.
kanalını regrese ettiği Yaklaşık 40 yıl önce ise denildi. 2006 yılında ise glikoproteindir. 72 kDa
itibaren salgılanmaya
primordial folikül gelişmeye hücrelerinden AMH
4. günden) itibaren bağımlı olan antral geçtiğinden sistemik
23
AMH geni 19. kromozomun kısa kolundadır (19p13.3) ve 2750 nükleoitid ve 5 exondan oluşur. Hedef organ erkekte müller kanalı ve her iki cinste gonadlardır (69). AMH reseptör (AMHR) geni 12. kromozomda 11 exondan oluşur (67). AMHR tip I ve tip II olarak adlandırılan 2 subüniteden oluşan transmembran heteromerik proteindir. AMHR II, müller kanallarını çevreleyen mezenkimal hücrelerde ve her iki cinste gonadlarda eksprese olur. Hayvan deneylerinde postnatal dönemde overlerde granüloza hücreleri, preantral ve küçük antral foliküllerin teka hücrelerinde AMHRII ekspresyonu olduğu gösterilmiştir (70,71). AMH sinyalizasyonunda esas olarak etkili kısım AMHII’dir ve AMHII geni olmayan farelerde müller kanalı regrese olmamaktadır (72).
Birçok farklı AMHRI (Aktivin Reseptör Like Kinazlar = ALK2, ALK3, ALK6) vardır, fakat ALK2 ve muhtemelen ALK3 müller kanal regresyonunda etkiliyken, ALK6’nın etkisi tam bilinmemektedir (73,74). ALK2 ve ALK3 fetal ve yetişkin fare overlerinde eksprese olurken (73,75), ALK6 fetus fare overinde eksprese olmaz, sadece yetişkin overlerde eksprese olur (76).
İnsan over granüloza hücrelerinde 36. gestasyon haftasından, menapoza kadar primer,
preantral ve küçük antral (≤ 4 mm) foliküllerden AMH salgılanır (68).
En yüksek düzeyde AMH ekspresyonu küçük antral foliküllerdedir (77). Primordial folikül, teka hücreleri, oosit, interstisyum ve atrezik foliküllerden AMH salgılanmaz (78).
Düzenli adet gören kadınlarda ooferektomi sonrası 3-5 gün içinde AMH’nın saptanamaması, kanda saptanan AMH’nın kaynağının overler olduğunu göstermektedir (79,80).
Primordial folikül sayısı over rezervini gösteren esas unsurdur fakat bunun ölçümü klinik olarak mümkün değildir (81). Büyümekte olan folikül sayısı, primordiyal folikül deposuyla orantılı olduğundan over rezervlerini indirekt olarak iyi yansıtmaktadır.
Normoovulatuar genç kadınlarda yapılan bir çalışmada AMH’nun yaşla birlikte düştüğü ve bu düşüşün FSH ve inhibin B’deki değişiklikten önce olduğu ve transvajinal USG’deki antral folikül sayısıyla kan ve foliküler sıvıdaki AMH arasında pozitif korelasyon olduğu gösterilmiştir (82,83).
Yaşla ilişkili antral folikül sayısındaki düşme, yaşla ilişkili primordial ve primer folikül sayısındaki düşmeye bağlıdır. Bu nedenle serum AMH düzeyi over folikül havuzunun büyüklüğü ve over yaşı için iyi bir göstergedir (84).
24
Aynı zamanda AMH düzeyi ile IVF tedavisine oosit yanıtı arasında da ilişki vardır (85). Sadece düşük AMH seviyeleri değil, yüksek AMH seviyeleri de IVF tedavisine kötü yanıtla ilişkilidir.
Yenidoğan kızlarda AMH düzeyi neredeyse saptanamayacak düzeydeyken, doğum sonrası ilk haftada yükselmeye başlar, puberteye kadar aşamalı olarak artar, geç puberte döneminde pik yapar ve üreme çağı boyunca progresif azalarak menapozda saptanamayacak düzeye inmektedir (68).
Hagen ve arkadaşlarının 2010 yılında yaptığı çalışmada sağlıklı kız çocuk ve adölesanlarda AMH düzeyinin (IB kiti ile) stabil fakat geniş bir aralıkta (0,63-8,68 ng/ml) olduğu saptanmıştır (86).
Grinspon ve arkadaşlarının çalışmasında da yaş gruplarına göre ortalama AMH düzeyleri Tablo 9‘da verilmiştir (87).
La Marca ve arkadaşları ise 18-24 yaş aralığındaki sağlıklı kadınlarda ortalama AMH düzeyini (IB kiti ile) 3,8 ±1,2 ng/ml olarak saptamışlardır (88).
Cook ve arkadaşlarının 22-35 yaş aralığındaki sağlıklı kadınlarda yaptığı çalışmada erken foliküler fazda ortalama AMH düzeyi (DSL kiti ile) 1,4 ±0,9 ng/ml olarak rapor edilmiştir (89).
Tablo 9: Kız Çocuk ve Adolesanlarda ortalama AMH Düzeyleri (ng/ml)
Yaş/Puberte AMH Kiti Ortalama SD Kaynak
İLK 1 AY IB 1,00 0,90 Grinspon ve ark (87)
1 AY -1 YAŞ IB 2,5 3,0 Grinspon ve ark (87)
5-12 YAŞ(TannerI) IB 3,2 2,70 Grinspon ve ark (87)
Tanner Evre IV-V IB 1,90 2,60 Grinspon ve ark (87)
18-24 YAŞ IB 3,8 1,2 La marca ve ark (88)
22-35 YAŞ DSL 1,4 0,9 Cook ve ark (89)
Kan ve foliküler sıvıda AMH ölçümü için yüksek sensitif ELISA metodu kullanılmaktadır ve <0,1 ng/ml konsantrasyonları ölçebilecek duyarlılıktadır.
25
PKOS ve AMH
PKOS’da primer, sekonder ve antral foliküllerin sayısı 2-6 kat artmıştır (90). PKOS’da serum AMH seviyeleri hastalığın şiddetiyle orantılı olarak artmaktadır (91,92). Polikistik overlerdeki granüloza hücrelerinde AMH düzeyi normalden yaklaşık 75 kat fazladır (77). Artmış AMH düzeyi folikül gelişimi için gerekli olan FSH uyarısına duyarlılığı düşürdüğünden foliküller çok büyüyemez, küçük antral foliküllerin (2-5 mm) sayısı artar ve dominant folikül seleksiyonu önlenir (93). PKOS hastalarında artmış 2-5 mm’lik folikül sayısı ve artmış ortalama over volümü, AMH seviyesiyle orantılıyken, 6-9 mm’lik folikül sayısıyla AMH ilişkisizdir (94).
Tümör Göstergesi Olarak AMH:
Granüloza hücreli tümörlerde alfa-inhibin ve östradiole göre AMH daha iyi bir tümör göstergesidir. Bu hastalarda tümör boyutu ile AMH iyi koreledir (95). AMH ooferektomize granüloza hücreli tümörlü hastaların takibinde rekürrenslerin erken saptanmasını sağlar. AMH’nun epitelyal kaynaklı bazı over tümörlerini ve bazı nonovarian tümörlerin büyümesini inhibe ettiği saptanmıştır (96,100) .
Oksidatif Stres
Oksidan ve antioksidan mekanizmalar arasındaki dengenin, oksidan parametreler lehine bozulması olarak tanımlanan oksidatif stres, kadınlarda infertilite etiyopatogenezinde önemli rol oynamaktadır (101). Organizmada oksijenin kısmi redüksiyonuyla, çok sayıda ve yüksek derecede reaktif oksijen ürünleri (ROS) oluşmaktadır. Reaktif oksijen ürünleri (ROS) üreme üzerinde hem fonksiyonel, hem de patolojik rol oynamaktadır. Oosit matürasyonu, folikülogenez, tubal fonksiyon, siklik endometrial değişiklikler gibi çeşitli fonksiyonların modifikasyonlarında anahtar sinyal moleküllerdir. Fagositik makrofajlar, parankimal steroidojenik hücreler (teka hücreleri, granüloza lütein hücreleri, hilus hüceleri) ve endotelyal hücreler over içinde ROS üreten hücrelerdir (148). Normal sikluslarda overlerde çeşitli oksidatif stres biyomarkerlarının ekspresyonu gösterilmiştir.
26
Yardımcı üreme teknikleri göz önüne alındığında oksidatif stres, in vitro kültürlerde embriyo üzerine etki ile gebelik sonuçlarını olumsuz etkileyebilir. IVF mediumlarında üretilen ROS’ların mitokondri, DNA, RNA, sperm oosit birleşimine zararlı etkiler gösterebileceği bildirilmiştir (148,149,150).
Polikistik over sendromu, endometriozis ve açıklanamayan infertilite gibi reprodüktif hastalıkların oksidatif stresin etiyopatogenezde rol aldığı gösterilmiştir.
Oksidatif stres, serbest radikallerin aşırı yapımıdır. Serbest radikallerin fizyolojik miktarlarının kadın üremesinde, oosit maturasyonundan fertilizasyona kadar pek çok süreçte önemli rolleri vardır. Oksidatif stresin oosit kalitesini, fertilizasyonu, implantasyonu ve erken embriyo gelişimini olumsuz yönde etkileyerek fertilite üzerinde olumsuz bir rol oynadığı bilinmektedir.
Organizmada serbest radikallerin oluşması ve bunların antioksidan sistemler tarafından kaldırılma hızı denge içindedir. Bu denge sağlandığı sürece organizma serbest radikallerden etkilenmemektedir. Oksidatif stres (OS) bu dengenin serbest radikaller lehine bozulması olarak tanımlanır (102).
Fizyolojik düzeyde, serbest radikallerin folikülogenez, oosit maturasyonu, ovulasyon, implantasyon ve embriyo gelişiminde önemli fonksiyonları bulunmaktadır. Fazla miktarda serbest radikal üretiminin ise kadın fertilitesi üzerine olumsuz etkileri vardır (102).
İnfertil hastalara antioksidan verilmesi ya da in vitro fertilizasyona (IVF) giden hastaların
kültürlerindeki mediumlara antioksidan maddelerin eklenmesi fertilite oranlarını ve IVF başarısını arttırabilir (101).
Serbest radikaller fizyolojik şartlarda hücrelerde endojen ve eksojen kaynaklı etmenlere bağlı olarak oluşabilen yüksek derecede reaktif, stabil olmayan moleküllerdir. Biyolojik sistemlerdeki en önemli serbest radikaller oksijenden oluşan reaktif oksijen türleridir (103). Serbest radikaller fazla miktarda olduğu zaman proteinlerde, nükleik asitlerde hasara yol açar. Lipidlerde peroksidasyona neden olarak hücresel fonksiyonları bozarlar (101).
Reaktif oksijen türlerinin ve antioksidanların kadın üreme sisteminde folikülogenez, oosit matürasyonu, luteal regresyon, ovulasyon, fertilizasyon, yaşa bağlı fertilitede azalma, embriyo gelişimi gibi fizyolojik süreçlerde rolü vardır (104).
27
Oksidatif stresin fertiliteyi olumsuz yönde etkilediği bilinmektedir. Oksidatif stres; fertilizasyon, implantasyon ve erken embriyo gelişimini etkileyebilir. Fertilizasyondan önce oksidatif strese maruz kalmak anormal zigot oluşumunu arttırır.
Foliküler sıvıda reaktif oksijen türlerinin fizyolojik miktarlarının sağlıklı oosit gelişimi için gerekli olduğu (105), granüloza hücrelerinde antioksidanların azalmasının kötü oosit kalitesini gösterdiği (106), folikül sıvısında serbest radikal artışının dejenere oosit sayısı ile korele olduğu ve antioksidan ilavesinin foliküler oksidatif hasarı azalttığı ve fertilizasyon ve gebelik oranlarını arttırdığı (107) bulunmuştur. Fragmente embriyolarda oksidatif parametrelerin yüksek olduğu bulunmuştur (108).
Serbest radikallerin kadın fertilitesi üzerine olan olumsuz etkilerinden yola çıkarak antioksidan ajanlar verilerek oksidatif parametrelerin düzeleceği ön görülmüştür. Selenyum, melatonin, E vitamini, antioksidan elementler bakımından zengin meyve diyetiyle beslenen kadınlarda da oksidatif stres parametrelerinin kontrol grubuna nazaran daha düşük olduğu bildirilmiştir (109,110,111,112).
Sonuçta oksidatif stres, üreme ve gelişme patolojisi ile ilişkili gibi durmaktadır.
AGE
Proteinler yüksek glukoz konsantrasyonları ile karşılaştıklarında, glukoz bir enzimin aracılığına gereksinim duymadan proteine bağlanarak kontrolsüz glikasyon reaksiyonlarına neden olur. Glikasyona uğramış protein, moleküler oksijene bir elektron vererek serbest oksijen radikali oluşumuna neden olur (143). Glukoz ve proteinlerin amino grupları arasında kendiliğinden gelişen enzimatik olmayan glikasyon reaksiyonları yoluyla önce Shiff bazları, sonrasında daha stabil olan Amadori ürünleri oluşur. Amadori ürünlerinin oluşumundan sonra ileri glikasyon son ürünleri (AGE) meydana gelir (144).
AGE(Advanced Glycation End Products) glikasyonun son ürünü olup, insan vücudunda karbonhidratların karbonil grubunun proteinlerin primer amino gruplarıyla non enzimatik reaksiyona girmesi sonucu oluşmaktadır. Mailard reaksiyonu olarak bilinen kimyasal prosedürün son ürünüdür. Protein, lipit, nükleik asitler non enzimatik reaksiyon sonucu AGE’ye dönüşmektedirler (1,2,3). İlerlemiş glikasyon, proteinlerin tersine döndürülemez
28
çapraz bağlanmasıyla protein yapısının ve fonksiyonun kaybolması ve bunu takiben apoptozis ile sonuçlanır (1). AGE-modifiye edilmiş proteinler, makrofajlar mitojenik aktivitesi ve vasküler düz kas hücrelerinde kemotaktik aktivitesi gibi çeşitli hücresel tepkileri indükleyebilir.
AGE’ler, endotelin-1 aracılığıyla vazokonstrüksiyonu arttırarak endotel hasarına yol açtığı gibi, kompleks biyokimyasal mekanizmalarla serbest radikal üretebilme kapasitesine de sahiptirler. Yine AGE’lerin toksik etkileri arasında; proteinlerin yapılarını ve fonksiyonlarını değiştirebilmeleri, kendi reseptörleri ile oksidatif stresi indükleyebilmeleri ve sonuçta nükleer faktör kappa B (NFkB) gibi redoks duyarlı transkripsiyon faktörlerini aktive etmeleri ve ilgili genlerin (prokoagülant doku faktörü endotelin-1, adhezyon molekülü, VCAM-1 gibi) ekspresyonlarının artışı bulunmaktadır (145,146).
Araştırmalar AGE’lerin, reseptör aracılı mekanizma ile serbest radikal üretimini uyarmasının yanı sıra, artmış serbest radikallerin de hücre içi AGE oluşumunu arttırdığını göstermektedir (147).
AGE oluşumunun temel mekanizması glikasyon olmasına rağmen, son çalışmalar AGE endositotik alımında insülin reseptörü ve özellikle fosfatidil inositol-3 kinaz'ın (PI-3K) rolünün olduğunu, bunların hızlı bozulmasını ve eliminasyon süreçlerini düzenleyenin, kendi reseptörünün (RAGE) olduğunu göstermiştir.
RAGE (Receptor for Advanced Glycation End Products) bir AGE reseptörüdür (1,5). RAGE bir immunoglobulindir. AGE-RAGE etkileşimi proinflamatuar durumun gelişmesine hücre toksisitesi ve hasarına sebep olan NFkB (nükleer faktör kappa b)’yi aktive etmektedir (3). Normal AGE reseptörleri dışında sitosolik ve transmembran alanlardan yoksun RAGE formu da mevuttur. Bu reseptör formu hücre dışına salgılanır ve kan dolaşımında bulunmaktadır. Çözünebilir RAGE (sRAGE) olarak bilinmektedir (5).
AGE’lerin dokularda birikmesi oksidatif stresi harekete geçirmekte ve enflamasyonu artırmaktadır. sRAGE nin inflamatuar yanıtı başarıyla azalttığı bildirilmektedir (1).
AGE, hücre yüzeyinde reseptörlerle etkileşime girerek hücre fonksiyonlarını olumsuz yönde etkilemektedir. AGE’yi 20’den fazla heterojen grup üyesi oluşturmaktadır. Buraya pentosidin, karboksimetil lizin, metilglioksal, glioksal gibi yapılar aittir. Özellikle pentosidin ve