T.C.
BALIKESĠR ÜNĠVERSĠTESĠ SAĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ TIBBĠ BĠYOKĠMYA ANABĠLĠM DALI
DEMANS HASTALARINDA SERUM AKUT FAZ
PROTEĠNLERĠNĠN ve IL-6 DÜZEYLERĠNĠN
DEĞERLENDĠRĠLMESĠ
YÜKSEK LĠSANS TEZĠ
Gökçen AVCI AYTAV
Tez DanıĢmanı Prof. Dr. Özlem YAVUZ
Bu araĢtırma; Balıkesir Üniversitesi Bilimsel AraĢtırma Projeleri Birimi tarafından 2012/78 no‟lu proje ile desteklenmiĢtir.
BALIKESĠR-2015 .
.
TEġEKKÜR
Tez çalıĢmamın her aĢamasında yakın ilgi ve desteğini gördüğüm; çalıĢmalarımın yönlendirilmesi ve sonuçlandırılmasında büyük emeği geçen tez danıĢmanım Sayın Prof.Dr.Özlem YAVUZ‟a, tezimin deney aĢamasında bilgi ve deneyimleriyle yardım ve desteklerini esirgemeyen hocam Sayın Doç.Dr.Adnan Adil HĠġMĠOĞULLARI‟na, eğitimimde bilgi ve deneyimlerini aktaran hocam Sayın Prof.Dr.Kamil SEYREK‟e müteĢekkirim.
ÇalıĢma boyunca her türlü katkı ve desteklerinden dolayı hocalarım Dr.Merve ġAHĠN CAN, Prof.Dr.Mehmet Tevfik YAVUZ, Prof.Dr.Tunay KARLIDERE, Prof.Dr.Bahar YANIK KEYĠK, Uzman Dr.Bahri KEYĠK ve Uzman Dr.Zeliha AYHAN‟a sonsuz Ģükran ve saygılarımı sunarım.
Birlikte çalıĢmaktan her zaman onur ve mutluluk duyduğum, tezin laboratuvar çalıĢmaları aĢamasında yardımcı olan tüm biyokimya laboratuvarı çalıĢanı arkadaĢlarıma, diyetisyen arkadaĢım Hayrettin KARA‟ya ve bu yolda beraber çaba harcadığımız sevgili yol arkadaĢım Ayça Derya ÇELĠKÇEKEN‟e teĢekkür ederim.
Her konuda sabırla yardımcı olan ve beni hiç yalnız bırakmayan eĢim Emre AYTAV‟a, bu aĢamada annesini hiç üzmeyen minik oğlum Kayra AYTAV‟a ve beni her zaman destekleyip yanımda olan aileme desteklerinden dolayı teĢekkür ederim.
ĠÇĠNDEKĠLER
ÖZET ………... i
ABSTRACT………... ii
SĠMGE VE KISALTMALAR DĠZĠNĠ………. iii
ġEKĠLLER DĠZĠNĠ………...v
TABLOLAR DĠZĠNĠ……….vi
1. GĠRĠġ ……… 1
2. GENEL BĠLGĠLER………. 4
2.1. Nörodejeneratif Hastalıklar 4 2.2. Nörodejeneratif Hastalıkların Sınıflandırılması 4 2.3. Demans 5 2.3.1. Demansın Sınıflandırılması 6 2.4. Alzheimer Hastalığı 7 2.4.1. Tanımı 7 2.4.2. Epidemiyoloji 7 2.4.3. Tarihçe 8 2.4.4. Etiyoloji 9 2.4.4.1. Genetik………. 9
2.4.4.2 Çevresel Risk Faktörleri 10 2.4.5.Klinik 11
2.4.6. Tanı Kriterleri 13
2.4.6.1 NINCDS-ADRDA Alzheimer Hastalığının Klinik Tanı Kriterleri 14
2.4.6.2 DSM-IV Alzheimer Tipi Demans Ġçin Tanı Kriterleri 15 2.4.7. Nöropatoloji 16
2.4.7.1. Amiloid Kaskad Hipotezi 17 2.4.7.2. Nörofibriler Yumaklar 18
2.4.7.3.Amiloid Plaklar 18 2.5. AH‟nin Ġnflamasyonla ĠliĢkisi 19
2.6. AH‟de Genetik ve Biyokimyasal Belirteçler 20
2.6.1.1. BOS Aβ42 20
2.6.1.2. BOS Tau Protein 21
2.6.1.3. BOS Total Tau Protein 21
2.6.1.4. BOS Fosfo-Tau (P-tau) 21
2.7. Ġnflamasyon Biyobelirteçleri 21
2.7.1 Aktive mikroglia ve komplemanlar 22
2.7.2.Proinflamatuar sitokinler 22
2.7.3. Akut faz proteinleri 23
2.7.3.1. C-Reaktif Protein 24 2.7.3.2. α1-Antitripsin (α1-antiproteinaz) 25 2.7.3.4. α1-Asitglikoprotein (Orosomukoid) 26 2.8.1.4. Haptoglobulin 26 2.8.1.5. Fibrinojen 26 2.8.1.6. Seruloplazmin 26 2.8.1.7. Kompleman (C3, C4) 26
2.8.1.7. Serum Amiloid A (SAA) 27
2.8.1.8. Ferritin 27
2.8.1.9. α1-Antikimotripsin 27
2.9.Akut Faz Proteinlerinin Ölçüm Yöntemleri 28
2.9.1. Spektrofotometre 28
2.9.2. Nefelometre ve Turbidimetre 29
2.9.3. Enzyme Linked ImmunoSorbent Assay (ELISA) 29
2.9.4. Elektroforez………. 30
3. GEREÇ VE YÖNTEM……… 33
3.1. Denek Seçimi 33
3.1.1.Hastalarin ÇalıĢmaya Dahil Edilme Kriterleri 33
3.1.2.Hastalarin ÇalıĢmaya Dahil Edilmeme Kriterleri 33
3.2. Kan Örneklerinin Toplanması 35
3.3. Kan Analizleri 35
3.3.1.Serum Akut Faz Protein Düzeyinin Ölçümü 35
3.3.2.Serum IL-6 Düzeyinin Ölçümü 37
3.3.3.Serum CRP Düzeyinin Ölçümü 37
3.4.Ġstatistiksel Analizler 37
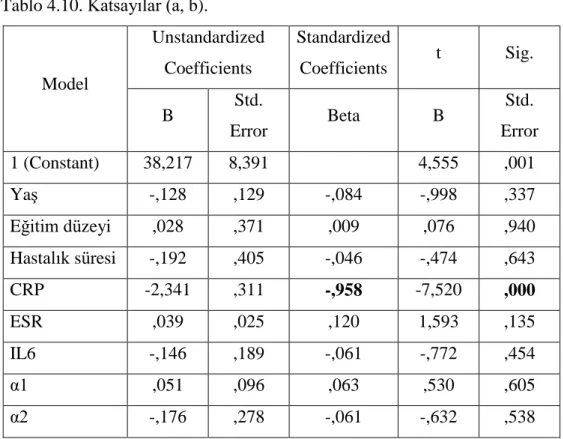
4.1.Demografik ve Klinik Bulgular 39
4.1.1. Mini Mental Test Sonuçları 40
4.1.2.Hipokampal Hacim Ölçüm Sonuçları 40
4.2. Biyokimyasal Analiz Sonuçları 41
4.2.1. Ġnflamatuar Belirteçler 41
4.2.2. Serum CRP düzeyleri 42
4.2.3. Serum IL-6 Düzeyleri 43
4.2.4. Serum α1- ve α2- Globulin Düzeyleri 44
4.2.5. Korelasyon Analizi Sonuçları 45
4.2.6. Çok DeğiĢkenli Lineer Regresyon Analiz Sonuçları 46 5. TARTIġMA……….. 49 6. SONUÇ VE ÖNERĠLER………. 55 KAYNAKLAR………. 58 EKLER
EK-1. BĠLGĠLENDĠRĠLMĠġ GÖNÜLLÜ OLUR FORMU 68
EK-2. HASTA BĠLGĠ FORMU 71
EK-3. BĠLGĠLENDĠRĠLMĠġ GÖNÜLLÜ OLUR FORMU (SAĞLIKLI GRUP) 72
EK-4. ETĠK KURUL RAPORU 75
i
ÖZET
Demans, tüm dünyada giderek yaygınlaĢan ve sağlık giderlerinde oldukça büyük yer tutan bir hastalık grubudur. Alzheimer Hastalığı (AH), yaĢlılarda en sık görülen demans nedenidir. AH‟li beyin dokularının postmortem çalıĢmalarının sonuçları, AH‟nin en önemli patolojik iĢaretleri olan senil plaklar ve nörofibriler yumaklarda, akut-faz inflamatuar reaktanlarının varlığını göstermiĢtir. Bu çalıĢmada,
AH'li hastalar ve sağlıklı kontrol olgularının serum örneklerinde ölçülen periferal inflamatuar belirteç düzeyleri ile biliĢsel fonksiyonlar ve hipokampal hacimler arasındaki iliĢkinin incelenmesi amaçlanmıĢtır.
AH tanısı alan 65 yaĢ ve üstünde 24 hasta ve kontrol grubu olarak da yaĢ grubu uyumlu 24 kiĢi, prospektif olarak çalıĢmaya dahil edildi. Kognitif bozukluğun derecesi Standardize Mini Mental Test (MMT) ile değerlendirildi. 24 ve altındaki mini mental skorlar, kognitif bozukluk olarak kabul edildi. Serum C-Reaktif Protein (CRP) konsantrasyonları, spektrofotometrik yöntem ile klinik kimya cihazında ölçüldü. -1 ve -2 globulin düzeyleri, kapiller elektroforez tekniği ile serum Ġnterlökin-6 (IL-6) düzeyleri ise ELISA ile analiz edildi. Ġncelenen inflamatuar belirteçlerden (IL-6, α1, α2-globulinler, CRP, eritrosit sedimentasyon hızı [ESR] ve lökosit sayısı [WBC]) sadece IL-6 ve CRP düzeyleri açısından, iki grup arasındaki fark, istatistiksel olarak anlamlı bulundu. AH grubunun serum CRP düzeylerinin, sağlıklı kontrollere göre anlamlı bir Ģekilde azaldığı (p<0.05); IL-6 seviyelerinin ise sağlıklı kontrollere göre anlamlı bir Ģekilde arttığı saptandı (p<0.05). Çok değiĢkenli lineer regresyon analizi sonucunda, serum CRP düzeylerinin MMT puanı için önemli bir belirleyici olduğu bulundu (β= -0.958, p<0.001).
ÇalıĢmamızın sonuçları, Alzheimer‟lı hastalarda düĢük CRP düzeyleri saptayan önceki çalıĢmaların bulgularını desteklemektedir. Sonuç olarak; serum CRP düzeylerinin biliĢsel bozulmanın tespitinde bir biyobelirteç olarak kullanılabilmesi için çok daha kapsamlı çeĢitli çalıĢmalarla desteklenmesi gerektiğini düĢünmekteyiz. Kanda ölçülebilen duyarlı ve efektif biyobelirteçlerin saptanması, erken tanının yanı sıra, hastalık progresyonunun veya tedaviye yanıtın değerlendirilmesi açısından da yararlı olacaktır.
Anahtar kelimeler: Akut faz proteinleri, Alzheimer Hastalığı, biyobelirteç, CRP, IL-6.
ii
ABSTRACT
Dementia is a group of diseases widespread all over the world and maintains a fairly large place in health care costs. Alzheimer Disease (AD) is the most common cause of dementia among older people. The results of postmortem studies of brain tissues with AD demonstrated that the presence of acute-phase inflammatory reactants in the senile plaques and neurofibrillary tangles that are the most imporant pathologic hallmarks of AD.
24 patientswith AD who are 65 years and over age and 24 age-matched healthy controls were included in this prospective study. The degree of cognitive impairment were assessed by the Mini-mental State Examination (MMSE) test. 24 and below mini menthal scores are evaluated as cognitive disorder. Serum C-Reaktive Protein (CRP) concentrations were measured by spectrophotometric method on the clinical chemistry analyzer. 1- and 2-globulin levels were analyzed by capillary electrophoresis technique. Serum Interleukin- 6 (IL-6) levels were quantified by ELISA. Only in terms of IL-6 and CRP levels of the inflammatory markers analyzed (IL-6, α1, α-2 globulins, CRP, Erythrocyte Sedimentation Rate (ESR) and White Blood Cell (WBC)), the differences between the two groups was statistically significant. Serum CRP levels of patients with AD were significatly decreased compared to healthy controls (p<0.05) whereas IL-6 values of patients with AD were significatly higher than control subjects (p<0.05). Multivariable linear regression models in AD patients showed that serum CRP was a significant predictor of MMSE score (β= -0.869, p<0.01)
The current results support previous findings that decreased serum CRP levels in patients with AD. As a result; in order to serum CRP levels as a biomarker for the detection of cognitive impairment more detailed studies are required. The detection of sensitive and effective peripheral blood biomarkers will be beneficial for early diagnosis, for evaluation of response to disease progression or the treatment.
iii
SĠMGELER VE KISALTMALAR DĠZĠNĠ
AH : Alzheimer Hastalığı
APP : Amiloid Prekürsör Protein
AFC : Akut Faz Cevabı
AFP : Akut Faz Proteini
Apo-E4 : Apolipoprotein E‟nin e4 alleli
DSM- IV : Diagnostic and Statistic Manuel of Mental Disorders, Fourth Edition
DM : Diyabetes Mellitus
ELISA : Enzyme Linked Immuno Sorbent Assay
EF : Elektroforez
HKB : Hafif Kognitif Bozukluk
HIS : Hachinski Ġskemi Skalası
IL-1 : Interlökin-1
IL-6 : Interlökin-6
IL-8 : Interlökin-8 IL-18 : Interlökin-18
KE : Kapiller Elektroforez
MAP : Mikrotubul Asosiye Proteinler
MCP-1 : Monosit Kemoatraktan Protein-1
MIP-1 α ve MIP-1β : Makrofaj Inflamasyon Protein-1α ve β
MMT : Mini Mental Test
MRG : Magnetik Rezonans Görüntüleme
NFY : NöroFibriler Yumaklar
NINCDS-ADRDA : Ulusal ve Nörolojik ve ĠletiĢim Hastalıkları Enstitüsü ve Ġnme - Alzheimer Hastalığı ve ĠliĢkili Hastalıklar Derneği (National Institute of Neurological and Communicative Disorders and Stroke-Alzheimer‟s Disease and Related Disorder Association)
OD : Otozomal Dominant
PS : Presenilin
SP : Senil amiloid Plaklar
iv
SPE : Serum Protein Elektroforezi TNF- α : Tümör Nekroz Faktör- α
VD : Vasküler Demans
v
ġEKĠLLER DĠZĠNĠ
Sayfa No
ġekil 2.1. AH‟nin Klinik Seyri……… 11
ġekil 2.2. Amiloid Beta Proteini OluĢum Mekanizması…………..……… 18
ġekil 2.3. Akut Faz Protein Düzeyleri…….. ……….. 28
ġekil 2.4. ELISA Testi……… 30
ġekil 2.5. Normal SPE Örnek Sonucu ………... 31
ġekil 2.6. SPE‟de Bantlara Ait Proteinler ……….. 32
ġekil 3.1. Örnek Kaplarının Yüklenmesi ………... 35
ġekil 3.2. Örneklerin YerleĢtirildiği Raklar ………... 35
ġekil 3.3. Kapiller Elektroforez Tekniği ………. …….. 35
ġekil 4.1. AH ve Kontrol Grup Arasındaki MMT Puanları ………... 40
ġekil 4.2. AH ve Kontrol Grup Arasındaki Hipokampal Hacimler ……… 41
ġekil 4.3. AH ve Kontrol Grup Arası CRP Düzeyleri……. ……….. 43
ġekil 4.4. AH ve Kontrol Gruplarında IL-6 Düzeyleri ………... 44
ġekil 4.5. AH ve Kontrol Gruplarında α1ve α2Globulin Düzeyleri .……… 45
ġekil 4.6. Seçilen Vakalar Grafiği ... 48
ġekil 4.7. Seçilen Vakalar Ġçin Standart Residual Alan Grafiği ……… 48
vi
TABLOLAR DĠZĠNĠ
Sayfa No
Tablo 2.1. AH‟de Genetik Faktörler ……….. 10
Tablo 2.2. AH‟de Genetik ve Biyokimyasal belirteçler ………. 20
Tablo 4.1. Demografik ve Klinik Özellikler ………... 39
Tablo 4.2. MMT Puanları (ortalama ± SD) ………... 40
Tablo 4.3. Hipokampal Ölçümler (ortalama ± SD) ……….. 41
Tablo 4.4. Ġnflamatuar Belirteçler ……….. 42
Tablo 4.5. Serum CRP Düzeyleri (ortalama ± SD) ……… 42
Tablo 4.6. Serum IL-6 Düzeyleri (ortalama ± SD) ……… 43
Tablo 4.7. α1ve α2 Globulin Düzeyleri ………. 44
Tablo 4.8. Korelasyon Analizi ……… 46
Tablo 4.9. Girilen/Kaldırılan DeğiĢkenler (b, c) ……… 46
Tablo 4.10. Katsayılar (a, b) ………... 47
1
1. GĠRĠġ
Teknolojinin geliĢmesine paralel olarak sağlık hizmetlerinin de geliĢmesi, yaĢam koĢullarını kolaylaĢtırmasının yanı sıra, yaĢlı nüfusun genel nüfusa oranının da tüm dünyada giderek artmasına sebep olmaktadır (Jarvik ve ark., 2000). YaĢlı nüfusun artması ise daha kaliteli ve daha sağlıklı yaĢam koĢullarının oluĢturulmasını gündeme getirirken, bu grupta önemli bir sağlık sorunu olan demans geliĢme riskini de arttırmıĢtır (Regier ve ark., 1993).
Bellek bozukluğundaki ilerleme, yaĢlanmanın doğal bir sonucu olarak kabul edildiğinden, demansın erken evrede teĢhis edilmesini son derece güçleĢtirmektedir. (Pinsky, 2001). Bu nedenle demans, yaĢlı popülasyonda sık görülen bir hastalık olmasına rağmen, hasta yakınları ve birinci basamak hekimleri tarafından gözden kaçırılabilmektedir (Dugu ve ark., 2003). Önümüzdeki yıllarda demans prevelansındaki artıĢ ve yapılması gerekli olacak sağlık harcamaları dikkate alındığında, demansa olan bakıĢ açısı, tanı ve tedavisi için kullanılan metotlar ve ilaçların etkinliğinin değerlendirilmesi, hastalığın teĢhisi için son derece büyük önem arz etmektedir (Wimo ve ark., 2001).
YaĢlı popülasyonda demansın en sık nedeni, AH‟dir. Dünya üzerinde 18 milyondan fazla insanı etkileyen AH; hafıza, konuĢma, yön bulma, insanları tanıma, problem çözme gibi çeĢitli zihinsel iĢlevlerin zamanla zayıflaması, günlük iĢleri yerine getirme yeteneğinde azalma ve davranıĢ bozuklukları ile karakterize olan ilerleyici bir nörodejeneratif hastalıktır (O‟Brien ve ark., 2000). AH‟nin histopatolojik incelemeleri; beyin volümünde azalma, ventriküler geniĢleme ile beraber kortikal nöronal atrofi, ekstrasellüler amiloid plaklar ve nöronal stoplazma içinde nörofibriler yumakların olduğunu göstermektedir (Burns, 2000; Yamada ve ark., 1999).
AH‟de ortaya çıkan nörodejenerasyonun, hipoksi veya iskemi gibi, beyine yönelik bir saldırıya karĢı immun veya inflamatuar bir yanıt olduğuna iliĢkin önemli
2
kanıtlar vardır (Clarkson ve ark., 2005). AH‟de, beyindeki dejenerasyona bağlı olarak akut faz cevabı oluĢmaktadır. Bu durum, sitokin adı verilen ve bedenin savunma düzeneklerini uyaran proteinlerde hızlı bir artıĢa sebep olmaktadır (Ramirez ve ark., 2003). Ġnflamasyonun farklı demans türlerinde, özellikle de AH‟de, anahtar bir rol oynadığı gösterilmiĢtir (Mrak ve Griffin, 2001) .
Epidemiyolojik veriler, inflamasyonun, sporadik geç baĢlangıçlı AH‟nin multifaktoriyal etiyolojisi ile ilgili olduğu görüĢünü desteklemektedir (Engelhart ve ark., 2004).
Ġnflamasyonun, AH‟nin patalojisinin erken dönemindeki ve özellikle Aβ protein metabolizmasındaki rolü incelendiğinde, inflamatuar mediatörlerin Aβ protein patolojisindeki fonksiyonu henüz tam olarak anlaĢılamamıĢtır. Ancak akut-faz proteinlerinin erken dönemde arttığı ve BOS ile kana, beyinden Aβ proteinlerinin taĢınmasında önemli bir role sahip olduğu bildirilmiĢtir (Eikelenboom ve ark., 2006).
Yaygın nöronal ölüm gerçekleĢmeden önce, biyobelirteçlerin kullanımı aracılığı ile nörodejeneratif hastalıkların erken tanısı için büyük çaba harcanmaktadır. Bilim insanlarının bundan sonraki hedefleri, Alzheimer‟lı beyin dokularındaki patofizyolojik değiĢiklikleri yansıtıcı çalıĢmalar yapmaktır (Blennow ve ark., 2010). Biyobelirteçler, hem normal yaĢlanmayı ve nörodejeneratif bir bozukluğu demanstan ayırt etmek, hem de demansın kesin nedeninin belirlenmesine yardımcı olmak için gereklidir (Rachakonda ve ark., 2004).
AH tanısında kullanılması önerilen biyobelirteçler için karakteristik ve spesifik kriterler, 1998 yılında belirlenmiĢtir (Consensus report of the Working Group on: "Molecular and Biochemical Markers of Alzheimer's Disease". The Ronald and Nancy Reagan Research Institute of the Alzheimer's Association and the National Institute on Aging Working Group, 1998). Ġdeal bir biyobelirteç, ilk olarak, nöropatolojinin temel yapısını tespit ederken, aynı zamanda da kesin, güvenilir ve ucuz olmalıdır. Ġkinci olarak, nöropatolojik açıdan kabul edilmiĢ vakaları doğrulamalı ve hastalığa karĢı son derece duyarlı olmalıdır (duyarlılık>%80). Son olarak, AH‟yi diğer nörodejeneratif hastalıklardan ayırma konusunda, yeterince ayırt edici olmalıdır (Mulder ve ark., 2000).
3
Kan bazlı hiçbir belirteç, tam olarak valide edilememiĢtir; ancak bu konuda yapılan çalıĢma sayısı giderek artmaktadır. Bu alandaki geliĢmelerin baĢarısı, büyük ve iyi tanımlanmıĢ örneklerin toplandığı longitudinal çalıĢmalara ve araĢtırmalarda kullanılan teknoloji çeĢitliliğine bağlıdır (Thambisetty ve Lovestone, 2010).
Son yıllarda, AH‟nin bütün aĢamalarında biyobelirteçlerin geliĢtirilmesi için çalıĢmalar devam etmektedir. BOS biyobelirteçlerinde önemli bir ilerleme kaydedilmesine rağmen nörodejeneratif hastalıklarda, potansiyel plazma biyobelirteçlerinin diyagnostik olarak geçerlilik kazanması için çok sayıda çalıĢmada tekrarlanması gerekmektedir. Ġnflamasyonun plazmadaki potansiyel biyobelirteçleri ile ilgili çalıĢmalarda, çok farklı sonuçlar alınmıĢ ve kesin bir kanıt henüz ileri sürülememiĢtir.
Bu çalıĢmada, Alzheimer'lı hastalar ve sağlıklı kontrol olgularının serum örneklerinde ölçülen periferal inflamatuar biyobelirteç düzeyleri ile biliĢsel fonksiyonlar ve hipokampal volümler arasındaki iliĢkinin incelenmesi amaçlanmıĢtır.
4
2. GENEL BĠLGĠLER
2.1. Nörodejeneratif Hastalıklar
Nörodejeneratif hastalıklar, zengin bir çeĢitliliğe sahip olan merkezi sinir sistemi hastalıkları arasında, nöral dokuların ilerleyici kaybı ile karakterizedir. Merkezi sinir sisteminin nöronları, hücre ölümü ya da yıkımından sonra kendi kendilerini yenileyemediklerinden bu hastalıkların tedavisi yoktur (Chung ve ark., 2002; Peterson, 2002).
Nörodejeneratif hastalıkların tanısında kullanılan iki majör test; a. Nöroradyolojik görüntüleme yöntemleri (CT, PET, SPECT, MRI vs.) ve b. Biyobelirteç ölçümleri
Son yıllarda, hastalığa erken evrelerde tanı konulabilmesi için nöropatolojik, biyokimyasal ve genetik biyobelirteçlerin tanımlanmasında önemli derecede çaba sarfedilmektedir. Biyobelirteçler, belirli bir bozukluğun varlığını ya da baĢlangıcını belirten, temelde biyolojik içerikli bileĢiklerdir. Nöropatolojik belirteçler, Ģu anda altın standart olmasına rağmen, postmortem dönemde analiz yapılabildiğinden, kullanıĢlı değildir. Bu yüzden, erken dönemlerde hastalığı tanımlayan spesifik biyobelirteçler, hekimler için kritik önem taĢımaktadır. Böylece hastalar, hastalığın ilerlemesini durdurabilecek erken tedavi için bir Ģansa sahip olabileceklerdir (Rachakonda ve ark., 2004).
2.2.Nörodejeneratif Hastalıkların Sınıflandırılması
Bilişsel Bozukluklar (Demans): Serebral korteksin dejenerasyonu. Demans. (örn. Alzheimer Hastalığı, Pick hastalığı)
Hareket Bozuklukları:
1.Motor nöronların dejenerasyonu. (Amiyotrofik Lateral Skleroz, Spinal Musküler Atrofi, Bulbospinal atrofi),
5
2.Serebellum ve bağlantı yollarının dejenerasyonu (spinoserebellar dejenerasyon). Spinoserebellar ataksiler (örn. Friedreich ataksi, ataksi-telanjiektazi),
3.Substansia nigra ve basal gangliyonların dejenerasyonu. Ekstrapiramidal defektler: Akinetik ve rijid. (örn. Parkinson hastalığı, Progressif supranükleer palsi),
4.Basal gangliyonların dejenerasyonu. Hareketlerin disregülasyonu: Hiperkinetik (örn. Huntington hastalığı),
5.Multiple Sistem Atrofisi: Striatonigral dejenerasyon, olivopontocerebellar atrofi veya otonomik sistem disfonksiyonu (Shy-Drager sendromu).
2.3. Demans
Dilimizdeki kullanımıyla „bunama‟ adı verilen demans kelimesi, Latince „zihin‟ anlamına gelen „mens‟ kelimesinden türemiĢtir. Demans ise zihnin yitirilmesi anlamına gelir; unutkanlığın ön planda olduğu birçok hastalığın genel adıdır ve yaĢlılarda sık görülen hastalıkların baĢında gelmektedir. Bu bilgiler ıĢığında demansın tanımı; „eriĢkin merkezi sinir sisteminin hasarlanması sonucu geliĢen zihinsel yeteneklerde (kognitif iĢlevlerde) bozulma‟ Ģeklinde olarak yapılabilir. Bu nedenle, „demans‟ zihinsel yeteneklerde bozulma Ģeklinde tanımlandığında, bozulan zihinsel yeteneklerinin sayısının, bu bozulmanın baĢlangıç tarzının, Ģiddetinin, süresinin ve doğal seyrinin diğer bozulma türlerinden ayırt edici nitelikte olduğu vurgulanmıĢ olur (Gürvit, 2004).
Demans sendromunun belirtileri, üç ana kategoride sınıflandırılabilir (Gürvit, 2004);
- Kognitif - DavranıĢsal - ĠĢlevsel
Demans tanısını koyabilmek için hastanın kognitif fonksiyonlarında, önceki durumuna göre azalma olmalı, günlük yaĢamı etkilenmeli ve hafıza bozukluğunun yanı sıra, birden fazla kognitif alanda (afazi, agnozi, apraksi, yürütücü iĢlev bozukluğu) bozukluklar eĢlik etmelidir (Cankurtaran ve ark., 2005). Bireyi demans
6
yönünden değerlendirirken en önemli kısım, hikâyesidir. Çoğu zaman aynı hikâyelerin tekrar anlatılması ve aynı soruların tekrar sorulması, demans tanısı için erken ipuçları olabilir. Bu dönem içinde hastanın hobilerine karĢı ilgisinde azalma, ev kazalarında artıĢ, günlük kullanılan ilaçların unutulması, çocuklarının, torunlarının, iyi tanınıp bilinen arkadaĢ isimlerinin veya eĢya isimlerinin unutulması gibi belirtiler saptanabilir (Cankurtaran ve ark., 2005).
65 yaĢ üstü hastalarda, demansın en önemli nedenleri (Sonnen ve ark., 2007);
- Alzheimer Hastalığı (% 45),
- Vasküler Beyin Hasarı (mikroinfarktlar) (% 33), - Ġzokortikal Lewy Body Hastalığı (LBD) (% 10),
- Frontotemporal Lobar Dejenerasyonlar veya Prion Hastalığı.
2.3.1. Demansın Sınıflandırılması - Alzheimer Hastalığı
- Vasküler Demans • Multi enfarkt demans • Stratejik konumlu enfarktlar
• Multipl subkortikal lakuner enfarktlar
• Binswanger‟in subkortikal arteriyosklerotik lokoensefalopatisi • Tip 1, 2 ve 3‟ün kombinasyonu
• Tek ya da multipl hemorajik serebral lezyonlar • Subkortikal demanslar
• Alzheimer tip demans ve vasküler demansın kombine Ģekli - Parkinson Hastalığı
- Huntington Demansı - Pick Hastalığı
- Frontotemporal Demans
- Progresif multifokal lokoensefalopati - Progresif supranukleer palsi
- Depresyon ve pseudodemans - Lewy cisimcikli Demans -Ġnfeksiyon
7 - Normal basınçlı hidrosefali
- Subdural hematom
2.4. Alzheimer Hastalığı 2.4.1. Tanımı
Alzheimer hastalığı (AH); biliĢsel iĢlevlerde bozulma, günlük yaĢam aktivitelerinde azalma, davranıĢsal ve psikolojik bozukluklarla sonuçlanan, ilerleyici bir nörodejeneratif hastalıktır (Kemper ve Murtaugh,1991).
AH‟nin baĢlıca belirtileri Ģunlardır:
- Günlük yaĢam aktivitelerini etkileyen bellek kaybı - Günlük yaĢam aktivitelerini yapmada güçlük - Kelime bulmada güçlük
- Zaman ve mekan karmaĢası - Yargı ve karara varmada güçlük
- Sık kullanılan eĢyaların yerlerini değiĢtirme - Ruh hali ya da davranıĢlarda değiĢim - KiĢilik değiĢimleri
- Sorumluluktan kaçınma
2.4.2. Epidemiyoloji
AH, demans sendromlarının en sık rastlanan formudur (O'Brien ve ark., 2000). Tüm demansların 2/3‟sinden sorumludur. AltmıĢbeĢ yaĢ üzerindeki kiĢilerdeki AH prevalansı %10 iken, yaĢ arttıkça prevalans da artmaktadır. 65-74 yaĢ arasında %30 ve 85 yaĢ üzerindekilerde %50‟ye ulaĢmaktadır (Ferri ve ark., 2005). Dünya nüfusunun her geçen gün yaĢlanmasına ve yaĢam süresinin uzamasına paralel olarak gelecek on yılda, dünyadaki yaĢlı insan sayısının bir milyarı aĢacağı beklenmektedir. Buna bağlı olarak, yakın bir gelecekte, yaĢlı nüfusun artmasıyla birlikte, AH‟nin daha yaygın görüldüğü yaĢ gruplarındaki insan sayısı da artacaktır (Alzheimer in Europa, 31 Ekim 2006).
8 2.4.3. Tarihçe
Dr.Alois Alzheimer‟ın 1907‟de ilk olgusu, 51 yaĢındaki Auguste D.‟dir. Hastalığa klinik Ģefi olan Dr.Emil Kraepelin “Alzheimer” adını vermiĢtir. Bu ilk olguda, hastanın, kocası ile ilgili aĢırı kıskançlık hezeyanları bulunmaktaydı. Sonrasında bellek baĢta olmak üzere, yüksek beyin fonksiyonlarında bozukluk saptanmıĢtı. Hastanın otopsisinde, gümüĢ boyası ile anormal boyanma örneği; senil plaklar, distrofik nöritler, nörofibriler yumaklar ve serebral kortekste belirgin yaygın atrofi ve hücre kaybı gözlenmiĢti. 1960'lara kadar çok nadir bir hastalık olduğu ve sadece presenil yaĢ grubunda görüldüğü düĢünülmekteydi (Ġçelli, 2001).
AH‟nın olası risk faktörleri olarak Ģunlar sayılabilir:
- Ġleri yaĢ -Aile hikayesi -Apolipoprotein E4 alleli -Down sendromu -DüĢük eğitim seviyesi -Sık kafa travması -Kadın cinsiyet
-Nörotoksinler, sigara, alkol -Serebrovasküler hastalık -Miyokard infarktüsü -Hipertansiyon -Homosistein -Diyabet -Vitamin B12 eksikliği -Dislipidemiler - Hipotiroidizm -Ġnfeksiyonlar
-Serum demir yüksekliği -Ferritin yüksekliği
-C-Reaktif Protein yüksekliği -Folat eksikliği
9 2.4.4. Etiyoloji
AH‟nin nedeni, henüz kesin olarak bilinmemektedir. Hastalığın etiyolojisinde genetik ve çevresel faktörler etkili olmaktadır (Selekler, 2003).
2.4.4.1 Genetik
ġimdiye kadar, otozomal dominant (OD) geçiĢten sorumlu olduğu düĢünülen üç ayrı gen bulunmuĢtur: Bunlar, amiloid prekürsör protein (APP) geni (21.kromozom), presenilin 1 geni (14.kromozom) ve presenilin 2 geni (1.kromozom)‟dir (Tablo 2.1). Bu genlerin kodladığı üç protein de normal iĢlevleri çok iyi bilinmeyen, nöronal plastisitede rol oynadıkları yönünde varsayımlar ileri sürülen transmembran proteinlerdir (Schellenberg ve ark., 1995). AH, tüm hastaların %5‟i kadarını oluĢturan daha genç bireylerde de (40–60 yaĢ arası) görülebilir. Bu bireylerin çoğunda, belirgin bir aile öyküsü vardır ve bilinen bir genetik mutasyon bulunabilir (O‟Brien ve ark., 2001). Kromozom 14‟teki presenilin 1 (PS–1), kromozom 1‟deki presenilin 2 (PS–2) ve kromozom 21‟deki amiloid-β protein prekürsörü olan üç gen defekti, ailelerde erken baĢlangıçlı AH‟ye neden olmaktadır (Schellenberg, 1995; Cruts ve ark., 1998).
Erken baĢlangıçlı tüm Alzheimer hastalarının yaklaĢık %50‟sinin nedenini açıklayan, erken baĢlangıçlı AH ile ilgili en sık mutasyon, kromozom 14‟de PS–1 geninde bulunmuĢtur. Bu mutasyonla AH, 40–50 yaĢ dolaylarında baĢlamaktadır. Kromozom 1‟deki presenilin 2 genindeki homolog proteindeki mutasyon ise birkaç ailede saptanmıĢtır (Cruts ve ark., 1998).
Geç baĢlangıçlı AH ile iliĢkili olduğu kesin olarak kanıtlanmıĢ tek gen, 19.kromozomda kodlanan, kolesterol taĢıyan bir enzim olan apolipoprotein E‟nin, e4 allelidir (Apo-E4) (Cummings ve Kaufer, 1996). Apo E‟nin AH‟deki önemi, AH‟yi karakterize eden senil plaklar ve nörofibriler yumaklarda da bulunmasıdır (Blacker ve ark., 2003).
Hastaların %95‟inden fazlasında hastalık, OD geçiĢ göstermez. Bu hastaların AH‟nin dominant olmayan, ancak ailevi bir Ģekle sahip olduğu kabul edilir. Otozomal geçiĢ göstermeyen ve genellikle 65 yaĢından sonra baĢlayan bu sporadik
10
Ģekilde, ortaya çıkan hastalığa neden olan mutasyon bulunamamıĢtır, ancak çok sayıda risk faktörü tanımlanmıĢtır (Schellenberg ve ark., 1995).
Tablo 2.1. AH‟de Genetik Faktörler.
Gen Kromozom Mekanizma Etki
APP 21 Mutasyon/Trisomi Ab üretiminde artıĢ Presenilin 1 14 Mutasyon Ab üretiminde artıĢ Presenilin 2 1 Mutasyon Ab üretiminde artıĢ
APOE 19 Polimorfizm
Ab klirensinde bozulma, tau hiperfosforilizasyonu, nöral plastisitede bozulma.
2.4.4.2 Çevresel Risk Faktörleri
Çok sayıda çevresel risk faktörü, AH patogenezinde rol oynar. Ancak hangilerinin gerçek risk etkeni olduğuna dair fikir ayrılıkları vardır:
a. Yaş: En önemli kanıt, ilerlemiĢ yaĢ için mevcuttur. Hastalığın görülme sıklığı 60 yaĢından önce nadirken, 85 yaĢ ve üzerindeki yaĢlarda, yaklaĢık %50‟ye yükselir. AH riski, her 5 yılda bir, 65 yaĢından önce 5 kat, 75 yaĢından önce 3 kat ve 85 yaĢından önce 1.5 kat artar (Gao ve ark., 1998).
b. Cinsiyet: Kadınlarda, hastalığın erkeklerden daha fazla olduğu bilinmektedir. Baltimore YaĢlanma ÇalıĢmasında kadınlardaki AH insidansının erkeklerden daha yüksek olma eğiliminde olduğu bulunmuĢtur (%1.43/yıl oranına karĢın %1.12/yıl). Genel olarak kabul gören kadın erkek oranı, 2/1‟dir (Gao ve ark., 1998).
c. Ailede demans öyküsü olması: AH olan birinin çocukları, kardeĢleri, hastalıktan etkilenmiĢ bir yakını olmayan birine göre 3 – 4 kat daha fazla etkilenir (Clark, 2005).
d. Düşük eğitim düzeyi: AH insidansı eğitim seviyesi düĢük kiĢilerde eğitim seviyesi daha yüksek kiĢilere oranla 1.5 kat fazla bulunmuĢtur (Blacker ve ark., 2003).
11 e. Uzun süreli alkol kullanımı (Tyas, 2001).
f. Kardiyovasküler hastalık ve risk faktörleri (Doll ve ark., 2004).
g. Down sendromu: EriĢkin yaĢlara kadar yaĢayabilenlerde, muhtemelen genetik bozukluğa bağlı olarak AH geliĢim riski yüksektir (Down sendromu olanların %90‟ında, 30 yaĢında iken amiloid plaklar, nörofibriler yumaklar ve kolinerjik eksiklikler vardır) (Clark, 2005).
2.4.5.Klinik
Günümüzdeki kanıtlar, AH‟ye bağlı patolojik değiĢikliklerin, klinik bulgular ortaya çıkmadan 15–20 yıl önce baĢladığına iĢaret etmektedir. AH, ġekil 2.1‟de görüldüğü gibi, klinik olarak altı gruba ayrılabilir (Alzheimer‟s Association, 2009);
- Presemptomatik dönem, - Preklinik dönem,
- Erken „Ģüpheli‟ AH, - Hafif evre AH, - Orta evre AH, - Ağır evre AH
12 AH’nin klinik evreleri;
Presemptomatik dönemde, farklı nedenlerle ölen kiĢilere yapılan otopsilerde, beyinlerinde yavaĢ ilerleyen AH‟ye ait patolojik bir sürecin varlığı gösterilmiĢtir. Bunun yanında bu dönemde mental veya davranıĢsal semptomlar, günlük yaĢam aktivitelerinde bozulma ve nöropsikolojik değerlendirmelerde bozukluk yoktur (White ve ark., 1996).
Preklinik dönemde, bellekte kolayca fark edilemeyen bozukluklar yalnız nöropsikolojik testler yapılarak ortaya çıkarılabilir. Bu dönemde de günlük aktivitelerde bir bozukluk yoktur (Morris ve ark., 1984).
Hafif evre AH: En önemli özellik bellek bozukluğudur. KonuĢulanlar tekrarlanır, eĢyalar bulunamayacak Ģekilde yanlıĢ yerlere konulur, yeni öğrenilen bilgiler kaydedilemez, yakın dönem olayları veya yeni tanıĢılan insanların isimleri hatırlanamaz. Ancak geçmiĢte edinilmiĢ bilgiler rahatlıkla hatırlanabilir. Dil bozuklukları, kelime bulma güçlüğü, duraklayarak konuĢma baĢlar. Hafif demanslı hastalar genellikle kiĢisel bakımlarını (örn; giyinme, yıkanma, kendine çekin düzen verme ve tuvalet) yardıma ihtiyaç duymadan kendileri yerine getirirler (Gonzalez ve ark., 1999).
Orta dönem AH: Hastalığın baĢlangıcından 4 ile 7 yıl sonra hasta orta evreye ilerler ve giderek artan bir Ģekilde baĢkalarına bağımlı bir hale gelir. Yeni öğrenilen bilgiler çok çabuk unutulur. DıĢarıya çıktıklarında kaybolmalar görülebilir. Muhakeme etme ve problem çözme belirgin olarak bozulmuĢtur. Dil iĢlevleri daha da kötüleĢir. Her hastada görülmese de yıkıcı davranıĢlar genellikle orta derece Alzheimer hastalarında ortaya çıkar (Terry ve ark, 1999).
Ağır (geç) dönem AH: Hasta en temel iĢlevlerde bile tamamen bakıcısına bağımlı hale gelir. EĢ ve çocuklarını duygusal olarak tanımasına rağmen akrabalık derecesini ve isimleri hatırlayamaz. KonuĢma kısa cümleler veya kelimelerin tekrarı Ģeklindedir ve sadece basit sözcüklerle anlayabilir (Tyas, 2001).
13 2.4.6. Tanı Kriterleri
AH‟nin klinik tanısı için NINCDS-ADRDA (McKhann ve ark., 1984) ve DSM-IV tanı kriterleri, günümüzde yaygın biçimde kullanılmaktadır (American Psychiatric Association, 1994).
2.4.6.1. NINCDS-ADRDA - Alzheimer Hastalığı için Klinik Tanı Kriterleri a. MUHTEMEL AH Tanı Kriterleri:
-Klinik muayene ile saptanan, Mini-Mental Test, Blessed Demans Ölçeği ya da benzer bir test ile dokümante edilen ve nöropsikolojik testlerle de doğrulanan demans tablosu;
-Ġki ya da daha fazla biliĢsel süreçte bozulma; -Bilinç bozukluğu yok.
-BaĢlangıç 40-90 yaĢları arasında, büyük sıklıkla da 65 yaĢından sonra;
-Bellek ya da diğer biliĢsel süreçlerde ilerleyici bozukluğa yol açabilecek sistemik ya da beyne ait baĢka bir hastalık yok.
Mini Mental Test (MMT)
Standardize Mini Mental Test (MMT), biliĢsel bozuklukların saptanmasında, demansiyel sendromların seyrini, tedaviye yanıtları ve yaĢlılarda yapılan epidemiyolojik araĢtırmalarda, biliĢsel performansı global olarak kantitatif bir Ģekilde değerlendirmek amacıyla kullanılan, net ve uygulanılabilirliği kolay olan bir tarama
testidir (Folstein ve ark., 1975). MMT kullanılarak bellek bozukluğunun hastalık boyutu hakkında bir öngörüde bulunulabilir. Bununla birlikte depresyon, erken evre demans veya hafif kognitif yetmezlik evrelerinde olan demans olgularında MMT yeterli olmayabilir (Devenand ve ark., 1997; Derrer ve ark., 2001).
MMT, kısa bir eğitimden geçirilmiĢ hekim, hemĢire veya psikologlar tarafından 10 dakika gibi kısa bir sürede, poliklinikte ya da yatak baĢında uygulanabilir. Yönelim, kayıt hafızası, dikkat ve hesaplama, hatırlama ve lisan olmak üzere beĢ ana baĢlık altında toplanmıĢtır. Onbir maddeden oluĢmakta ve toplam puan 30 üzerinden değerlendirilmektedir. Testin orijinalinde uygulama sırasında uyulması gereken talimatlar bulunmaktadır, ancak oldukça esnek bırakılmıĢlardır. Böylelikle
14
farklı uygulayıcılar kendilerine ait uygulama ve puan teknikleri geliĢtirebilmekte, bu da testin güvenirliğini ve yaygınlığını zedeleyebilmektedir (Molloy ve Standish,1997).
b. MUHTEMEL AH tanısını destekleyen faktörler:
-Dil (afazi), motor yetenekler (apraksi) ve algı (agnozi) gibi özgül biliĢsel iĢlevlerde ilerleyici bozulma;
-Günlük yaĢam aktivitelerinde bozulma ve davranıĢ biçiminde değiĢme; -Ailede benzer bozukluk öyküsü (özellikle patolojik olarak kanıtlanmıĢsa); -Laboratuvarda:
* Standart teknikler ile normal lumbar ponksiyon,
* EEG‟nin normal olması yada yavaĢ dalga aktivitesinde artıĢ gibi non-spesifik değiĢiklikler,
* Bilgisayarlı Tomografide (BT) serebral atrofiye iliĢkin bulgular ve seri incelemelerde bu bulguların ilerleyiĢi.
c. Diğer nedenler dışlandıktan sonra, MUHTEMEL AH tanısı ile uyumlu olabilecek diğer klinik özellikler şunlardır:
-Hastalığın seyrinde platolar;
-Depresyon, uykusuzluk, inkontinans, hezeyan, illüzyon ve halüsinasyon, verbal, emosyonel ya da fiziksel katastrofik patlamalar, cinsel bozukluklar ve kilo kaybı gibi eĢlikçi bulgular;
-Bazı hastalarda, özellikle hastalığın ileri dönemlerinde, kas tonusunda artıĢ, myoklonus ya da yürüme güçlüğü gibi diğer nörolojik bozukluklar;
-Hastalığın ileri evresinde nöbetler; -YaĢ için normal BT.
d. MUHTEMEL AH tanısını belirsizleştiren ya da ihtimal dışına çıkaran özellikler şunlardır:
- Ġnme tarzında ani baĢlangıç;
-Hemiparezi, duysal kayıp, görme alanı defektleri ve inkoordinasyon gibi fokal nörolojik bulguların hastalığın erken evrelerinde bulunması;
15
-Nöbetler ya da yürüyüĢ bozukluklarının, daha baĢlangıçta ya da hastalığın çok erken evrelerinde bulunması;
e. MÜMKÜN AH Tanı Kriterleri:
-Demansa neden olabilecek diğer nörolojik, psikiyatrik ya da sistemik bozukluklar olmaksızın, baĢlangıç, prezentasyon ya da klinik seyirde varyasyonların bulunması,
-Demansa neden olabilecek, ancak demansın nedeni gibi görünmeyen ikinci bir sistemik ya da beyin hastalığının bulunması,
-Diğer belirlenebilir nedenlerin dıĢlandığı, tek ve yavaĢ ilerleyici bir biliĢsel bozukluğun bulunması.
f. KESİN AH Tanı Kriterleri:
Biyopsi ya da otopsiyle elde edilen histopatolojik bulgular.
2.4.6.2. DSM-IV - Alzheimer Tipi Demans için Klinik Tanı Kriterleri a. Birden fazla biliĢsel alanı içeren bozukluk kendini aĢağıdaki iki maddeyi de kapsayacak Ģeklinde gösterir:
a1.Bellek bozukluğu (yeni bir bilgi öğrenme ve öğrenilmiĢ eski bir bilgiyi hatırlama yeteneğinin bozulması)
a 2.AĢağıda sıralanan biliĢsel bozuklardan en az biri: * Afazi (dil bozukluğu)
* Apraksi (motor iĢlevlerin normal olmasına karĢın belirli motor eylemlerin yerine getirilmesi yeteneğinde bozulma)
* Agnozi (duysal iĢlevlerin salim olmasına karĢın nesneleri tanımakta güçlük)
* Yürütücü iĢlevlerde bozulma (planlama, organize etme, sıralama, soyutlama)
b. a1 ve a2 kriterlerinde tanımlanan biliĢsel bozuklukların toplumsal ve mesleki iĢlevselliği ciddi biçimde bozması ve eski iĢlevsellik düzeyine göre anlamlı bir gerilemeyi temsil etmesi.
16
c. Seyrinin, sinsi baĢlangıç ve yavaĢ ilerleyici kognitif yıkım özelliklerinde olması.
d. a1 ve a2 kriterlerinde tanımlanan biliĢsel bozuklukların aĢağıda sıralanan nedenlerden herhangi birine bağlı olmaması:
- Bellek ve diğer biliĢsel iĢlevlerde ilerleyici bozulmaya neden olabilecek merkez sinir sistemine ait diğer durumlar (örn. serebrovasküler hastalık, Parkinson hastalığı, Huntington hastalığı, subdural hematom, normal basınçlı hidrosefali, beyin tümörü)
- Demansa neden olabileceği bilinen sistemik durumlar (Örn; hipotiroidizm, B12 vitamini ya da folik asit eksikliği, niasin eksikliği, hiperkalsemi, nörosifilis, HIV infeksiyonu)
- Ġlaçlar ve madde kullanımı ile ilgili durumlar
e. Bozuklukların delirium seyri dıĢında ortaya çıkması.
f. Bozuklukların baĢka bir Eksen I hastalığı ile açıklanabilir nitelikte olmaması.
2.4.7. Nöropatoloji
AH‟nin iki klasik patolojik bulgusu; senil (nörotik, amiloid) plaklar (SP) ve nörofibriller yumaklardır (NFY). Amiloid plaklar, amiloid beta (Aβ) proteininin, NFY, tau proteininin patolojik birikimi sonucu oluĢurlar.
Patolojik Aβ proteini oluĢum ve birikimi, yaygın nöron ve sinaps kaybını tetiklemektedir. Histopatolojik olarak SP, NFY oluĢumu, sinaps-nöron kaybı ve beyinde belirgin bir atrofi mevcuttur. NFY‟lerin temel bileĢeni, hiperfosforile „tau‟proteinidir. AH patogenezinde; hiperaktif kinazlar ve/veya hipoaktif fosfatazlar, tau proteininin hiperfosforilizasyonuna yol açarak mikrotübüllere bağlanma yeteneğini bozarlar. BağlanmamıĢ fosforilize tau, çözülemeyen çift sarmallı filamanlara polimerize olur. Bunlar zaman içinde, intranöronal NFY‟ler haline gelir. NFY‟ler hücre iskeletinin bütünlüğünü ve aksonal transportu bozarak hücre ölümüne
17
neden olur. AH‟deki ikinci temel nöropatolojik değiĢiklik, ana bileĢeni Aβ proteini olan amiloid plaklardır. Aβ proteini, diffüz plaklar halinde agrege olur ve bunlar yoğun nöritik plaklara dönüĢür (Braak ve Braak, 1991).
2.4.7.1. Amiloid Kaskad Hipotezi
Aβ proteini, „amiloid precursor protein‟ (APP)‟nin bazı enzimler aracılığı ile proteolizi sonucu oluĢur. Bu iĢlev, nöronal aktivite tarafından regüle edilmektedir ve proteoliz γ-sekretaz, β-sekretaz (BACE1 ya da asp2 ya da memapsin2) ya da α-sekretaz (TNFα-converting enzyme = TACE) enzim aktiviteleri tarafından sağlanmaktadır (Alzheimer A, 1911).
α-sekretaz enzimi APP‟yi transmembran bölgesinden 12 aminoasit uzaklıktaki noktadan keser. Bu kesim sonrasında, uzun, çözünebilir α-APPs fragmanı oluĢur ve fragman ekstraselüler aralığa salınır. α-sekretaz enzimine alternatif olarak ġekil 2.2.‟de görüldüğü gibi; APP, β-sekretaz enzimi ile de, bu sefer proteinin amino terminaline 16 aminoasit daha yakın bölgeden kesilebilir. Bu durumda ise β-APPs oluĢur. α-sekretaz ya da β-sekretazla kesimi takiben, ikinci kesilme iĢlemi γ-sekretaz tarafından gerçekleĢtirilir (Alzheimer A, 1911).
Ġlk kesilme α-sekretaz tarafından gerçekleĢti ise p3 fragmanı; β-sekretaz tarafından gerçekleĢti ise Aβ peptidi oluĢur. γ-sekretaz enzimi aynı zamanda oluĢan Aβ peptidinin uzunluğunu belirlemektedir. Burada özetlenen süreçler normal kiĢilerde yer almakta; Alzheimer hastalarında ise Aβ peptidini oluĢturan yol daha aktif olmaktadır (Alzheimer A, 1911; Evans ve ark., 1989).
18
ġekil 2.2. Amiloid Beta Proteini OluĢum Mekanizması.
2.4.7.2. Nörofibriler Yumaklar
NFY‟lerin temel bileĢeni, hiperfosforile „tau‟proteinidir. Tau, 17.kromozom tarafından kodlanan mikrotübül asosiye proteinler (MAP) ailesinden bir proteindir. Mikrotübülllerin stabilizasyonu, hücre iskeletinin bütünlüğü ve aksonal transportta önemli rol alır. AH patogenezinde hiperaktif kinazlar ve/veya hipoaktif fosfatazlar tau proteininin hiperfosforilizasyonuna yol açarak mikrotübüllere bağlanma yeteneğini bozarlar. BağlanmamıĢ fosforilize tau çözülemeyen çift sarmallı filamanlara polimerize olur. Bunlar zaman içinde intranöronal NFY‟ler haline gelir (Braak ve Braak, 1991; Grober ve ark., 1999; Bennett ve ark., 2004).
2.4.7.3.Amiloid plaklar
AH‟deki ikinci temel nöropatolojik değiĢiklik olan amiloid plaklar farklı morfolojik yapılarda olabilir ancak ana bileĢeni Aβ proteindir. Aβ amiloid 40-42
19
aminoasitten oluĢan bir protein olup daha büyük bir transmembran protein olan, 19. kromozomda kodlanan ve iĢlevi tam olarak anlaĢılamamıĢ bir transmembran protein olan APP‟den proteolitik yolla oluĢur (Glenner ve Wong, 1984; Masters ve ark., 1985). Bu da Aβ proteininin, APP‟nin metabolizma ürünlerinden olduğu anlamına gelir.
2.5. AH’nin Ġnflamasyonla ĠliĢkisi
Son yıllarda nöroinflamasyonun sporadik AH patolojisinin erken bir özelliği olduğu vurgulanmaktadır. Aktive mikroglia ve komplemanlar, proinflamatuar sitokinler, akut faz proteinleri gibi inflamatuar mediatörler ile amiloid plaklar arasında sıkı bir iliĢki bulunmuĢtur (Eikelenboom ve van Gool, 2004). Ġnflamasyonun farklı demans türlerinde, özellikle de AH‟de anahtar bir rol oynadığı gösterilmiĢtir (Mrak ve Griffin, 2001) .
AH‟de ortaya çıkan nörodejenerasyonun, hipoksi veya iskemi gibi, beyine yönelik bir saldırıya karĢı immün veya inflamatuar bir yanıt olduğuna iliĢkin önemli kanıtlar vardır (Clarkson ve ark, 2005). AH‟de beyindeki dejenerasyona bağlı olarak akut faz cevabı oluĢmaktadır. Bu durum, sitokin adı verilen ve bedenin savunma düzeneklerini uyaran proteinlerde hızlı bir artıĢa sebep olmaktadır (Ramirez ve ark., 2003).
Mikroglial hücreler, beyin parankiminde yer alan fagositer hücreleridir. Aktive olduklarında, diğer dokulardaki makrofajlara benzer biçimde fagositoz, antijen sunumu ve çeĢitli inflamatuar ve nörotoksik faktörlerin salınımı gibi özellikler gösterirler. İn vitro deney koĢullarında, mikroglial hücrelerden salınan nitrik oksit, oksidatif radikaller veya inflamatuar sitokinler gibi maddeler, nöronal hasara yol açmaktadır (Benveniste ve ark., 2001). Beyin dokusundaki amiloid plaklar ve nörofibriler yumaklar ile karakterize patolojik bulgulara astroglial ve mikroglial aktivasyonun eĢlik etmesi ve plakların çevresinde akut faz proteinleri, sitokinler, kompleman elemanları ve proteazlar gibi inflamasyon sürecine katılan birçok maddenin varlığının saptanmıĢ olması, AH'de inflamatuar süreçlerin ve glial aktivasyonun da patojenik sürecin bir parçası olduğunu ya da en azından hastalığın ilerlemesine katkıda bulunduğunu düĢündürmektedir (Benveniste ve ark., 2001; Akiyama ve ark., 2000).
20
2.6. AH’de Genetik ve Biyokimyasal Belirteçler
Son yıllarda, AH‟nin bütün aĢamalarında biyobelirteçlerin geliĢtirilmesi için çalıĢılmaktadır. Tablo 2.2.‟de AH‟nin erken baĢlangıç ve geç baĢlangıç formlarına iliĢkin genetik ve biyokimyasal belirteçler gösterilmiĢtir. Aβ42, Aβ40 ile birlikte ekstraselüler boĢluğa ve biyolojik sıvılara sekrete edilir. Aβ40; Beyin Omurilik Sıvısı (BOS) ve plazmada Aβ42‟ye göre daha fazla bulunmasına karĢın, Aβ42 oligomerlerde Aβ40‟dan daha hızlı birikmektedir (iki hidrofobik aminoasit kalıntısı fazla). BOS-Aβ42‟nin azalması AH için önemli bir göstergedir. Plazmadaki Aβ peptidlerin, AH ile ilgisi henüz tam olarak aydınlatılamamıĢtır (Douglas ve Thomas, 2010).
Tablo 2.2. AH‟de Genetik ve Biyokimyasal Belirteçler.
Erken-BaĢlangıç, Familyal Form Geç-BaĢlangıç, Sporadik Form Genetik Belirteçler:
- Presenilin-1 gen mutasyonları
- Amiloid prekürsör protein gen mutasyonları - Presenilin-2 gen mutasyonları
Genetik Belirteçler: - ApoE isoformları - ApoE polimorfizmi
Biyokimyasal Belirteçler: - Plasma / Bos Aβ1-42 peptid - Bos Tau protein
- Fosfo-Tau - F2 izoprostanlar
Biyokimyasal Belirteçler: - Bos Aβ1-42 peptid - Bos Tau protein
2.6.1. BOS Biyobelirteçleri 2.6.1.1. BOS Aβ42
Aβ42‟nin BOS konsantrasyonlarının azalması serebral amiloid depolanmasını yansıtır. Sensitivitesi; %80-90 civarındadır ve AH‟nin normal yaĢlanma ve depresyondan ayrılmasını sağlar. Ancak BOS-Aβ42 tek baĢına bir biyobelirteç olarak kullanılmamaktadır. Diğer biyobelirteçlerle beraber kullanıldığında sensivitesi ve spesivitesinin arttığı gösterilmiĢtir (Douglas ve Thomas, 2010).
21 2.6.1.2. BOS Tau Protein
Tau; mikrotübül stabilize edici proteindir. Aksonal transport, büyüme ve yapısal fonksiyonlara katılır. Tau regülasyonunun bozulması ve birikimi, nöronal hücre ölümüne sebebiyet verir. NFY‟de birikir. Sensitivitesi yüksek, spesivitesi ise düĢüktür (Sjögren ve ark., 2003).
2.6.1.3. BOS Total Tau Protein
Tau ile birlikte bazı fosforile tau izoformları total-tau‟yu oluĢturur. Tau izoformları, henüz periferik vücut sıvılarında saptanamamıĢtır. AH, frontotemporal demans ile parkinson hastalığı ve iskemik hasarda dramatik olarak artar (Sjögren ve ark., 2003).
2.6.1.4. BOS Fosfo-Tau (P-tau)
Tau hiperfosforilasyonu sonucu oluĢurlar. AH ve normal yaĢlanma gruplarında sensivite % 70, spesivite ise % 94 iken, AH ve kontrol gruplarında sensivite % 250 olarak saptanmıĢtır. Spesivite ile ilgili ise yeterli veri yoktur. Ġskemik hasarda, BOS‟da total Tau belirgin derecede artarken, BOS‟da fosfo-tau proteini düzeyi değiĢmez (Blennow ve Vanmechelen, 2003; Hesse ve ark., 2001).
2.7. Ġnflamasyon Biyobelirteçleri
Kemokinlerin, Aβ plak oluĢum bölgesine, mikroglia ve astrogliaların toplanmasında, önemli rol oynadıkları düĢünülmektedir. İn vitro çalıĢmalarda, Aβ proteini oluĢumu sırasında uyarılan monositlerin interlökin-8 (IL-8), monosit kemoatraktan protein-1 (MCP-1), makrofaj inflamasyon protein-1α ve β (MIP-1α ve MIP-1β) ürettikleri tespit edilmiĢtir (Lue ve ark., 2001). Postmortem incelemesi yapılan Alzheimer‟lı hastalar ve demansı olmayan kontrol olguların otopsilerinden alınan beyin dokularına ait mikroglialar, deneysel olarak Aβ proteinine maruz bırakıldıktan sonra IL-8, MCP-1 ve MIP-1 α‟nın ekspresyonlarındaki artıĢlar dikkati çekmiĢtir (Ishizuka ve ark., 1997).
22 2.7.1. Aktive mikroglia ve komplemanlar
Monosit kemoatraktan protein-1 (MCP-1): Ġnflamasyon süreci boyunca hücre göçünde görev alan bir kemokindir (Gerard ve Rollins, 2001). Nöropatolojik çalıĢmalar reaktif mikroglialarda MCP-1‟in var olduğunu ortaya koymuĢtur (Pola ve ark., 2004).
Makrofaj inflamasyon protein-1α ve β: Astrositler inflamatuar hastalık bileĢenlerine aktif olarak katkıda bulunurlar ve MIP-1β Aβ plakları civarındaki reaktif astrositlerde tespit edilmiĢtir (Choi ve ark., 1999).
2.7.2. Proinflamatuar sitokinler
Interlökin-1 1), interlökin-6 6), interlökin-8 8), interlökin-18 (IL-18) ve tümör nekroz faktörü- α (TNF-α) gibi sitokinler, proinflamatuvar sitokinler olarak bilinir ve inflamatuvar değiĢikliklerin oluĢmasında, patojen eliminasyonunu sağlayan hızlı bağıĢıklık yanıtının ortaya çıkmasında rol alırlar (Akira ve ark., 1993).
TNF-α: Ġmmuno-inflamatuar reaksiyonlarda düĢük konsantrasyonlarda lokal etki gösteren güçlü bir parakrin ve otokrin düzenleyicidir. Aynı zamanda birçok hücre tipinde büyüme ve farklılaĢmayı düzenler. ÇalıĢmalar, TNF-α‟nın akut inflamasyonda ve antitümöral immünitede en önemli sitokin olduğunu göstermektedir (Drenth ve ark., 1995).
IL-8: Yapılan in vitro çalıĢmalar sonucu, IL-8‟in, hippokampal nöronların hayatta kalmasına katkıda bulunduğu ve glial hücre çoğalmasını artırdığı tespit edilmiĢtir (Araujo ve Cotman,1993). Son yıllarda yapılan çalıĢmalarda, küçük bir grup Alzheimer‟li hastanın BOS‟undaki MCP-1 ve IL-8 düzeyleri, aynı yaĢtaki kontrollerle karĢılaĢtırıldığında, BOS MCP-1 ve IL-8 düzeyleri tüm Alzheimer‟lı hastalarda yüksek olarak bulunmuĢtur (Galimberti ve ark,, 2003). IL-8 artıĢı nöronal hayatta kalma kapasitesini geliĢtirmek için telâfi edici ve onarıcı mekanizmalar ile iliĢkili olabilir (Araujo ve Cotman,1993).
IL-1: IL-1α ve IL-1β olmak üzere, iki alt tipi vardır. Monositler, lenfositler, endotel hücreleri ve mikroglialar gibi immun sistem hücrelerinden salınır (Akira ve ark., 1993). AH‟li beyinde artan proinflamatuvar sitokinlerden biri olan IL-1'in
23
amiloid plak birikimine yanıt olarak mikroglialar tarafından sitokin üretiminde ve patoloji kısır döngüsünde rol aldığı düĢünülmektedir (Shaftel ve ark., 2007).
IL-18: IL-18, öncelikle aktive mikroglia tarafından ama aynı zamanda merkezi sinir sisteminde bulunan astrositler ve ependimal hücreler tarafından da üretilir (Sugama ve ark., 2002). IL-18, ayrıca nöronlarda da tespit edilebilir (Ojala ve ark., 2008). Alzheimer‟lı hastalarda dolaĢımdaki sitokinlerde anlamlı bir artıĢ tespit edilmemiĢ olmasına rağmen, periferik kandaki monosit-makrofajlarda IL-18 mRNA‟ları hafif dereceli Alzheimer‟lı hastalarda yüksek; orta dereceli Alzheimer‟lı hastalarda ise biraz daha düĢük bulunmuĢtur.Ancak yüksek dereceli Alzheimer‟lı hastalar ile demans olmayan yaĢları birbiriyle uyumlu kiĢiler arasında anlamlı bir fark yoktur (Malaguarnera ve ark., 2006).
IL-6: DeğiĢik dokuların büyümesini ve farklılaĢmasını düzenleyen, birçok iĢlevi olan bir sitokindir. Hedef hücreye bağlı olarak büyümeyi uyaran, büyümeyi inhibe eden ve farklılaĢmayı sağlayan etkinliğe sahiptir. IL-6‟nın baĢlıca iĢlevleri arasında, B hücrelerinin farklılaĢması (immunglobulin salınımı), değiĢik B hücrelerinde büyümeyi uyarma, hepatik akut faz yanıtına yol açma, makrofajlar ve T hücrelerinin etkinleĢmesi ve farklılaĢması ile nöronal farklılaĢma sayılabilir. Sitokinler arası zengin iletiĢim (sitokin ağı) IL-6 üretimini düzenler (Akira ve ark., 1993).
Akut faz proteinlerinin tetikleyicisi olan IL-6 ekspresyonunun senil plaklar içerisinde arttığı bildirilmiĢtir. IL-6, özellikle erken plak formasyonu döneminde etkili bir sitokindir ve AH‟nin erken evrelerinde saptanmamıĢtır. Hastalığın progresyonunda plak etrafındaki immunoreaktiviteyi düzenlediği düĢünülmektedir (Terry ve ark., 1999).
2.7.3. Akut Faz Proteinleri
Doku hasarı ve infeksiyonun her tipine cevap olarak vücudumuz bu hasarı düzeltmek için çeĢitli mekanizmaları devreye sokar. Bu mekanizmalardan en önemlisi akut faz cevabıdır (AFC). AFC‟de çeĢitli proteinler üretilir ve genelde bu üretim yeri karaciğerdir (Volanakis, 2001). Doku hasarının bulunduğu bölgeden salınan mediatörlere cevap olarak sentezlenirler. Bu mediatörler (sitokinler; 1,
IL-24
6, TNF α ve β, interferonlar) doku makrofajları, monositler ve endotel hücreleri tarafından üretilir (Sivas, 1996). Herhangi bir inflamatuar hastalık süresince plazma miktarları en az %25 kadar artan (pozitif akut faz proteini) ya da azalan (negatif akut faz proteini) proteinlere akut faz proteinleri (AFP) denir. AFP‟nin uyarılara karĢı duyarlılıkları, sentez hızları, molekül büyüklükleri, serum konsantrasyonları ve katabolizmaları büyük farklılıklar gösterir. Akut olaylarda serum düzeylerindeki artıĢlar genellikle inflamasyonun Ģiddetine ve yaygınlığına paralellik gösterirken; kronik inflamasyonlarda sentezde baskılanma veya tüketimde artıĢa bağlı olarak değiĢen dengeler oluĢur ve AFP, inflamasyonun aktivitesini ve yaygınlığını tam olarak yansıtmayabilir (Sivas, 1996).
Akut faz proteinlerinin görevleri; - Lokal doku hasarını azaltmak,
- Doku tamir ve rejenerasyonuna katkıda bulunmak, - Ġnflamatuar ajanları yok etmek,
- Kompleman sisteminin aktivasyonunu düzenlemek,
- Fagositik hücre ve proteolitik enzim aktivasyonu sonrası açığa çıkan artık ürünleri temizlemek,
- Enzim inhibisyonu yapmaktır.
2.7.3.1. C-Reaktif Protein
Bu proteinin ismi, Streptococcus pneumoniae'nın C-polisakkaridini presipite edebildiği için verilmiĢtir. Her biri 206 aminoasitten oluĢan, birbirine kovalent olmayan bağlarla bağlı beĢ alt üniteden oluĢur (Volanakis, 2001).
Oksidatif stres ve infeksiyöz ajanlar damar duvarında inflamatuar yanıt oluĢturur. Bu yanıt sonucunda makrofajlardan inflamatuar sitokinler salınır. Bu sitokinlerden olan IL-6, karaciğerdeki reseptörlerine bağlanarak CRP sentezini uyarır. Plazma yarı ömrü kısa (yaklaĢık olarak 19 saat) olmakla birlikte tüm koĢullarda aynıdır ve bu nedenle CRP‟nin plazma konsantrasyonunu belirleyen tek etken, IL-6‟nın sentez hızıdır.
Yakın zamanda CRP‟nin vasküler hücrelerdeki rolüyle ilgili yapılan çalıĢmalarda, CRP‟nin damar duvarındaki düz kas hücrelerinde de üretilebileceğine
25
dair kanıtlar bulunmuĢtur (Pasceri ve ark., 2000). Ġnfeksiyon, travma, inflamatuar romatizmal ve malign hastalıkların yol açtığı inflamasyonu en iyi gösteren testtir. Ġnflamasyondan sonra kısa sürede yükselmeye baĢlayıp, 6 saat sonra düzeyi >6mg/L olur (referans aralığı: 0-5 mg/L). 48 saatte maksimuma ulaĢır. Ġnflamatuar neden ortadan kalktığında belirgin bir Ģekilde konsantrasyonu azalır (Vigushin ve ark., 1993).
CRP‟nin kronik olarak hafif de olsa yüksek seyretmesi, koroner arter hastalığı için LDL yüksekliğinden daha önemli bir risk faktörüdür. CRP‟nin stabil olması, inflamasyonu iyi titre etmesi, ölçümünün standardize edilmiĢ olması, yaygın olarak ölçümünün yapılıyor bulunması ve koroner arter hastalığı ile gösterilmiĢ olan iliĢkisi göz önüne alındığında diğer akut faz proteini ölçümlerinden üstün olduğu söylenebilir (Ridker, 2001).
CRP değerleri hastanın yaĢı ve immunolojik durumundan bağımsız olarak değiĢmektedir. CRP‟nin serum ve plazma düzeyleri infeksiyöz ve infeksiyöz olmayan inflamatuar olaylarda (romatoid artrit, kardiyovasküler hastalık, periferal vasküler hastalık) özgül olmayarak yükselirken inflamatuar hastalıkların tümünde yükselmeyebilir (Sasaki ve ark., 2002).
2.7.3.2. α1-Antitripsin (α1-Antiproteinaz)
Ġnflamatuar bölgedeki nötrofillerden salınan öncelikle proteazlar olmak üzere nötrofil elastaz, pankreatik tripsin ve kimotripsin, nötrofil katepsin G, trombin, plazmin, kallikrein ve kollajenazları inaktive eden bir akut faz proteinidir (Harfenist ve Murray,1990).
UzamıĢ inflamasyon olmaksızın doku tamirini etkin olarak arttırmak için travmatize dokularda proteaz/antiproteaz aktivitelerinin düzenlenmesi, hassas bir Ģekilde sağlanır. Mevcut bilgiler α1-antitripsinin primer fonksiyonunun nötrofil elastaz aktivitesinin kontrolü olduğunu göstermektedir. Bu inhibitörün sentezinin kusurlu olduğu kiĢilerde, özellikle elastin gibi pulmoner ekstrasellüler matriks proteinlerinin artmıĢ dönüĢümünün bir sonucu olarak erken yaĢta pulmoner amfizem geliĢir (Gadek ve Pacht, 1990).
26
2.7.3.4. α1 Asitglikoprotein (Orosomukoid)
α1 asitglikoprotein, bir orosomukoid olarak bilinen tek bir glikoprotein zinciridir. Plazma seromukoid proteinlerinin en önemli kısmını oluĢturur. En çok sözü edilen rollerinden biri immünoregülatör olmasıdır. Ġmmün cevabın baskılanması, nötrofil fagositozunun baskılanması ve trombosit kümelenmesinin inhibisyonunu sağlar (Cheresh ve ark., 1984).
2.8.1.4. Haptoglobulin
Ġki α, iki β polipeptit zincirinin oluĢturduğu 4 alt üniteye sahip bir glikoproteindir (Haugen ve ark., 1981). Hemoliz sırasında ortaya çıkan hemoglobini α ve β zincirlerindeki farklı bağlanma yerlerine bağlar. Akut faz reaksiyonlarında sentezi uyarılır ve plazma düzeyleri 2-3 kat artar (McCormick ve Atassi, 1990).
2.8.1.5. Fibrinojen
Plazmada dolaĢan eriyebilir fibrinojen, disülfit bağlarıyla kovalent olarak bağlanmıĢ birbirinden farklı 3 çift polipeptit zincirinden oluĢmuĢtur. Her 3 zincir de karaciğerde sentezlenir (Schultz ve Arnold, 1990). Fibrin pıhtısının ön maddesidir. Plazma seviyesi, ilk 24 saatte 3-4 kat artar ve inflamatuar stimulusu takiben, üç gün sonra en yüksek değere ulaĢır (Nakano ve ark., 1998).
2.8.1.6. Seruloplazmin
Plazmada bulunan bakırın %90‟ını taĢır. Her seruloplazmin molekülü, 6 bakır atomuna sıkı bir Ģekilde bağlanır. Karaciğer hastalıklarında düzeyleri azalır. BaĢlıca karaciğerde sentezlenen seruloplazmin aynı zamanda inflamasyon ve doku hasarı gibi durumlarda ılımlı yanıt gösteren bir akut faz proteinidir (Fox ve ark., 1995).
2.8.1.7. Kompleman (C3, C4)
C3 ve C4, selüloz asetat veya agaroz jel elektroforezde, β bölgesine göç ederler. Her iki molekül de polimer yapıda olup, klasik yolun birer parçasını oluĢtururken, yalnızca C3 alternatif yola katılır. Primer olarak karaciğerde
27
sentezlenirler. Lenf nodları, dalak, akciğer, böbrek, kalp, barsaklar, kemik iliği gibi ekstrahepatik dokularda da sentezlenebilirler (Lawrence ve Robert, 1994).
2.8.1.7. Serum Amiloid A (SAA)
Kronik veya tekrarlayan inflamatuar hastalıklarda, lifli proteinlere dönüĢerek çöker. Dalak, karaciğer ve böbrekte, fonksiyon bozukluğuna neden olur. CRP gibi, inflamasyonla serumdaki seviyesi çok artar. Salgılandıktan kısa süre sonra HDL ile bağlanarak kolesterol metabolizmasında rol oynar. Kısa süreli akut faz yanıtında yararlıdır. Ġnflamasyondan sonra 8 saatte yükselir, 24 saatte maksimum olur, 48 saatten sonra azalmaya baĢlar (Lindhorst ve ark., 1997).
2.8.1.8. Ferritin
Ferritin, demiri depolama ve iĢlev dıĢı demiri toksik olmayan halde tutma görevi olan bir proteindir (Ganong, 1991). Ancak ferritin aynı zamanda bir akut faz reaktanıdır ve demirden bağımsız olarak sentezi inflamatuar sitokinler ve oksidatif stres ile de iliĢkilidir (BeĢıĢık, 2003).
2.8.1.9. α1-Antikimotripsin
Çok hızlı ortaya çıkan bir akut faz proteinidir. Normalde bronĢiyal sekresyonlarda yüksek miktarlarda bulunur (Lawrence ve Robert, 1994). pH 5.5-8.0 arasında stabildir, pH 3‟ün altına düĢerse beĢ dakika gibi kısa bir sürede hızla bozulur. Kimotripsin ve benzeri enzimler α1 antikimotripsin tarafından kuvvetlice inhibe edilirler (Berninger, 1985). ġekil 2.3.‟de inflamasyon sonrası akut faz protein düzeyleri toplu olarak gösterilmiĢtir.
28 ġekil 2.3. Akut Faz Protein Düzeyleri.
2.9. Akut Faz Proteinlerinin Ölçüm Yöntemleri 2.9.1. Spektrofotometri
Spektrofotometrik yöntemler, belli bir dalga boyunda çözeltiden geçen ıĢığın yoğunluğunun ölçülmesi ile çözünmüĢ madde konsantrasyonunun belirlenmesi prensibine dayanır. Ġçerisinde belli bir dalga boyunda ıĢığı absorbe eden renkli bir çözeltinin bulunduğu kare Ģeklindeki bir küvetten çıkan ıĢığım Ģiddeti (I), giren ıĢığın Ģiddetinden (Io) daha küçüktür. Çözeltiden çıkan ıĢık Ģiddetinin çözeltiye giren ıĢık Ģiddetine oranı (I/Io) transmittans (T) olarak tanımlanır. Absorbans ise transmittansın negatif logaritmasıdır (A=-logI/Io). Spektrofotometrede ölçüm yapabilmek için ölçümü yapılacak maddenin Beer Kanunu‟na uyması gerekir. Beer kanununa göre; bir bileĢiğin konsantrasyonu, absorbe edilen ıĢığın miktarı ile doğru, geçen ıĢığın logaritması ile ters orantılıdır (Güner, 2005).
Proteinlerin çeĢitli kimyasal reaktiflerle oluĢturduğu renkli bileĢiklerin belirli dalga boylarında verdikleri absorbans, spektrofotmetre ile ölçülerek örnekteki protein konsantrasyonu hesaplanır.
29 2.9.2. Turbidimetri ve Nefelometri
Nefelometre ve turbidimetre, ıĢık kaynağından çıkan ıĢınların, partikül yapılı maddeler tarafından saçılması prensibine dayanan cihazlardır. Katı partiküllerin dağıtıldığı berrak bir ortamdan geçen ıĢığın bir kısmı, her yönde saçılarak karıĢıma bulanık bir görünüm verir. Çözeltinin bulanık olması durumunda, ıĢık kaynağından çıkan ıĢınların tamamı, dedektöre ulaĢamaz. Dedektöre ulaĢan miktar, çözeltinin bulanıklığı ile ters orantılıdır. Turbidimetrik yöntemler, bulanıklığa sebep olan madde konsantrasyonuna bağlı olarak geçen ıĢık miktarındaki azalmanın ölçülmesi prensibine dayanır. Proteinler denatüre edilerek bulanıklık oluĢturulur. Bulanıklık, ortamdaki protein konsantrasyonu ile doğru orantılıdır.
Nefelometrik yöntemler, turbidimetri gibi, bulanıklığın ölçümü esasına dayanır. Ancak burada, çözeltideki partiküller tarafından geliĢ eksenine göre dik açıyla yerleĢtirilmiĢ olan dedektöre doğru saptırılan ıĢınlar ölçülür. Turbidimetriden bir diğer farkı, partikül sayısı arttıkça, turbidimetride geçen ıĢık (% T) azalırken, nefelometride artar (Skoog ve West, 1980).
2.9.3. Enzyme Linked ImmunoSorbent Assay (ELISA)
Çözeltideki protein konsantrasyonu çok düĢük olduğunda, yukarıda sayılan yöntemler kantitatif ölçüm için yetersiz kalır. Bu durumda ELISA, radyoimmunoassay (RIA) veya kemiluminesans yöntemleri kullanılır.
Antikor veya antijen aranmasında kullanılan serolojik testlerden biri olan ELISA, antijen-antikor bağlanmasını göstermek amacıyla enzimle iĢaretli konjugant ve enzim substratı kullanılarak renk oluĢumu esasına dayanan bir testtir. Elimizde neye özgül olduğunu bildiğimiz antijen ile örneklerdeki antikoru, tipini ve miktarını veya elimizde antikor var ise de buna özgü antijeni ve miktarını belirleyebiliriz. ELISA testinin direkt, indirekt ve sandviç ELISA gibi farklı Ģekilleri olmasına rağmen, en sık kullanılanı sandviç ELISA yöntemidir (Fung, 2006). Sandviç ELISA tekniği, daha çok bir antikorla tanınabilen, ancak en az iki farklı antijenik yapı taĢıyan maddelerin saptanmasında önem taĢır. Bu yöntemde aranılan antijen, daha önceden katı bir taĢıyıcıya tespit edilmiĢ antikora bağlanarak antijen-antikor kompleksi oluĢturur ve iĢlem sonunda da antijen-antikor kompleksinin enzimle
30
iĢaretli anti-antikor ile birleĢmesi gerçekleĢir ve renk değiĢikliği oluĢur.Reaksiyon tamamlandıktan sonra ortama bir substrat eklenerek spektrofotometrik olarak enzim aktivitesi ölçülür (Arda ve ark.,1998). (ġekil 2.4.).
ġekil 2.4. ELISA Testi.
2.9.4. Elektroforez
Elektroforez (EF); sıvı bir ortamda, yüklü solüt veya partiküllerin, elektriksel bir alanın etkisiyle, birbirinden ayrılması iĢlemidir. EF, serum proteinlerini alkali ortamda yüklerine ve molekül büyüklüklerine göre ayırmada kullanılır. Serum Protein Elektroforezinde (SPE); albumin, α1, α2, β ve -globulinler olmak üzere beĢ band elde edilir (ġekil 2.5.).
31
ġekil 2.5. SPE‟de Bantlara Ait Proteinler.
SPE, temel olarak kalitatif değerlendirme olanağı sağlayan, serum protein fraksiyonlarında referans aralığı aĢan değiĢiklikleri belirlemek amacıyla kullanılan bir tarama yöntemidir (ġekil 2.6.). Bazen spesifik bazı serum proteinlerinin miktarlarında belirgin bir artma ya da azalma gözlenmesine rağmen, elde edilecek SPE ile belirlenen fraksiyonların oranları, referans aralık sınırları içinde olabileceğinden, tek tek bantların gözden geçirilmesi, sağlıklı sonuç verebilmek için önemlidir. Akut inflamasyon durumlarında, hemen her zaman α1 ve α2 fraksiyonlarında yükselme olmasına rağmen, albumin fraksiyonu düĢük olmayabilir. Bu nedenle, değerlendirme sırasında, kiĢide bulunması muhtemel tüm hastalık durumları değerlendirilmelidir.