T.C.
EGE ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ
PATOLOJĠ ANABĠLĠM DALI
Prof. Dr. Ali VERAL
AKCĠĞER ADENOKARSĠNOMU OLGULARINDA
EZH2 VE CD10 EKSPRESYONUNUN ÖNEMĠ
UZMANLIK TEZĠ
Tez DanıĢmanı
Prof. Dr. Ali VERAL
Dr. Kenan BarıĢ BĠNGÜL
ĠZMĠR 2018
i
ÖNSÖZ
Uzmanlık eğitimim süresinde hem engin bilgilerinden
faydalandığım hem de insani değerleri, sabrı ve kişiliğiyle bana örnek
olan, hoşgörü ve sabırla desteğini benden esirgemeyen danışman hocam ve
aynı zamanda Ana Bilim Dalı başkanımız Prof. Dr. Ali VERAL’a
Bilgi ve deneyimleri ile bana yol gösteren, donanımlı bireyler olarak
yetişmemizi sağlayan, tüm hocalarıma,
Birlikte çalışmaktan büyük keyif aldığım ve hiçbir zaman
desteklerini esirgemeyen asistan arkadaşlarıma,
Tezimin
istatiksel
analiz
kısmının
hazırlanması
ve
yorumlanmasındaki katkılarından dolayı Yrd. Doç. Dr. Timur Köse’ye,
Uzmanlık eğitimim boyunca her konuda desteklerini gördüğüm ve
birlikte çalışmaktan mutluluk duyduğum tüm güler yüzlü laboratuvar,
arşiv ve idari bölüm görevlilerimize,
Yaşamımın her anında desteğini yanımda hissettiğim, bana her
zaman sevgi, huzur ve güven veren aileme,
ii
İÇİNDEKİLER
ÖNSÖZ ... i ŞEKİL DİZİNİ ... iv GRAFİK DİZİNİ ... iv TABLO DİZİNİ ... v KISALTMALAR ... vi ÖZET ... vii ABSTRACT ... ix 1. GİRİŞ ... 1 2. GENEL BİLGİLER... 4 2.1. Epidemiyoloji ... 42.2. Klinik Özellikler Ve Evreleme ... 5
2.3. Radyolojik Özellikler... 11
2.4. Histolojik Heterojenite ... 11
2.5. Makroskopik Özellikler ... 11
2.6. Mikroskobik Özellikler ... 11
2.6.1 Atipik Adenomatöz Hiperplazi (AAH) ve Adenokarsinoma İn Situ (AİS) ... 11
2.6.2. Adenokarsinomlar ... 12
2.6.2.1. Minimal İnvaziv Adenokarsinom (MİA) ... 12
2.6.2.2. İnvazyonu 5 mm’nin Üstünde Olan Baskın Lepidik Paternli Adenokarsinom ... 13
2.6.2.3. Asiner Baskın Tip Adenokarsinom ... 14
2.6.2.4. Papiller Baskın Tip Adenokarsinom ... 14
2.6.2.5. Mikropapiller Baskın Tip İnvaziv Adenokarsinom ... 15
2.6.2.6. Solid Baskın Tip İnvaziv Adenokarsinom ... 16
2.6.2.7. İnvaziv Adenokarsinom Varyantları ... 17
2.7. Moleküler Değişiklikler ... 20
2.8. Küçük Biyopsi Ve Sitoloji Materyaline Yaklaşım ... 23
2.9. Prognoz ... 25 2.9. EZH 2 İmmünbelirteç ... 28 2.10. CD10 İmmünbelirteç ... 29 3. GEREÇ VE YÖNTEM ... 30 4. BULGULAR ... 33 4.1. Demografik Veriler ... 33 4.2. Lokalizasyon ... 34
iii
4.4. Tümör Boyutu ... 38
4.5. Nekroz ... 38
4.6. Lenfovasküler İnvazyon ... 39
4.7. Hava Boşluğu Yayılımı ... 42
4.8. Desmoplazi... 43 4.9. Lenfoid İnfiltrasyon ... 46 4.10. Plevra İnvazyonu ... 47 4.11. Evre ... 48 4.12. EGFR-ALK ... 51 4.13. Sigara ... 51 4.14. EZH2 İmmünbelirteç ... 52 4.15. CD10 İmmünbelirteç ... 54 5. TARTIŞMA ... 57 6. SONUÇLAR ... 66 7. KAYNAKLAR ... 69
iv
ŞEKİL DİZİNİ
Şekil 1: Glandüler yapılar oluşturan asiner adenokarsinom örneği (H.E. x10). ... 14
Şekil 2: Fibrovasküler kor yapısı barındıran papiller morfolojinin izlendiği papiller adenokarsinom örneği (H.E. x10) ... 15
Şekil 3: Fibrovasküler kor yapısı içermeyen, boşluklar içerisinde yüzen yüzük benzeri yapıların izlendiği mikropapiller adenokarsinom örneği (H.E. x10). ... 16
Şekil 4: Belirgin bir dizilimin izlenmediği solid adenokarsinom örneği (H.E. x10). ... 17
Şekil 5: Kolumnar hücre morfolojisinde hücrelerden oluşan müsinöz adenokarsinom örneği (H.E. x10). ... 19
Şekil 6: EGFR sinyalizasyon yolağı ... 21
Şekil 7 :KHDAK’da immunhistokimyasal algoritmik yaklaşıma örnek. ... 24
Şekil 8: Pozitif kontrol olarak kullanılan tonsil dokusunda EZH2 boyanması (EZH2 x4). .. 32
Şekil 9: Pozitif kontrol olarak kullanılan tonsil dokusunda CD10 boyanması (CD10 x4)... 32
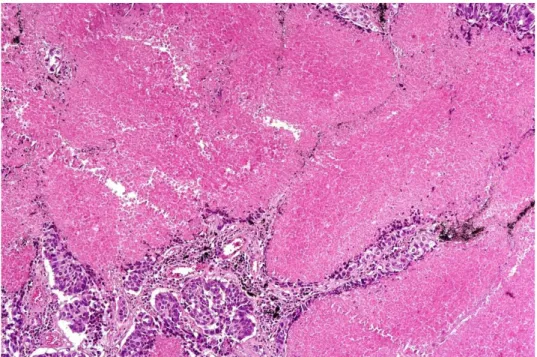
Şekil 10: Yaygın nekroz izlenen adenokarsinom olgusu örneği (H.E. x10) ... 39
Şekil 11: Çalışmada incelenen olgulara ait LVİ alanları örnekleri (H.E. x20) ... 40
Şekil 12: Hava boşluklarına yayılım: Olağan alveoller içerisinde izlenen tümör hücreleri (H.E. x20). ... 42
Şekil 13: Desmoplazi: A: “1+” Tümör hücreleri arasında ince fibröz bantların varlığı (H.E. x10), B: “2+” Tümör hücreleri arasında kalın fibröz bantlar ve düz kas liflerinin varlığı (H.E. x10). ... 43
Şekil 14: Lenfoid infiltrasyon: A: “1+” Tümör alanının %50’den azında lenfoid hücre infitrasyonu (H.E. x4), B: “2+” Tümör alanının %50’den fazlasında lenfoid hücre infitrasyonu (H.E. x10). ... 46
Şekil 15: EZH2 boyanma yoğunlukları: A-Nükleer boyanma yok (EZH2 x10), x20 büyütmede soluk nükleer boyanma “1+” (EZH2 x20), x10 büyütmede orta-soluk boyanma “2+” (EZH2 x10), kuvvetli nükleer boyanma “3+” (EZH2 x10). ... 52
Şekil 16: CD10 boyanma yoğunlukları: A-Membranöz boyanma yok (CD10 x10), kısmi membranöz soluk boyanma “1+” (CD10 x10), kısmi membranöz kuvvetli boyanma “2+” (CD10 x10), hücre membranını tam saran boyanma “3+” (CD10 x10). ... 55
GRAFİK DİZİNİ
Grafik 1: Cinsiyet dağılım grafiği. ... 34Grafik 2: Tümör yerleşim yerleri dağılım grafiği. ... 35
Grafik 3: Baskın patern dağılım grafiği. ... 36
Grafik 4: Baskın patern sağkalım grafiği. ... 36
Grafik 5: Desmoplazi sağkalım grafiği. ... 45
Grafik 6: Evrelere göre olguların dağılım grafiği. ... 48
Grafik 7: pT evresine göre olguların dağılım grafiği ... 49
Grafik 8: pN evresi sağkalım grafiği. ... 51
Grafik 9: EZH2 boyanma yoğunluğu sağkalım grafiği. ... 53
v
TABLO DİZİNİ
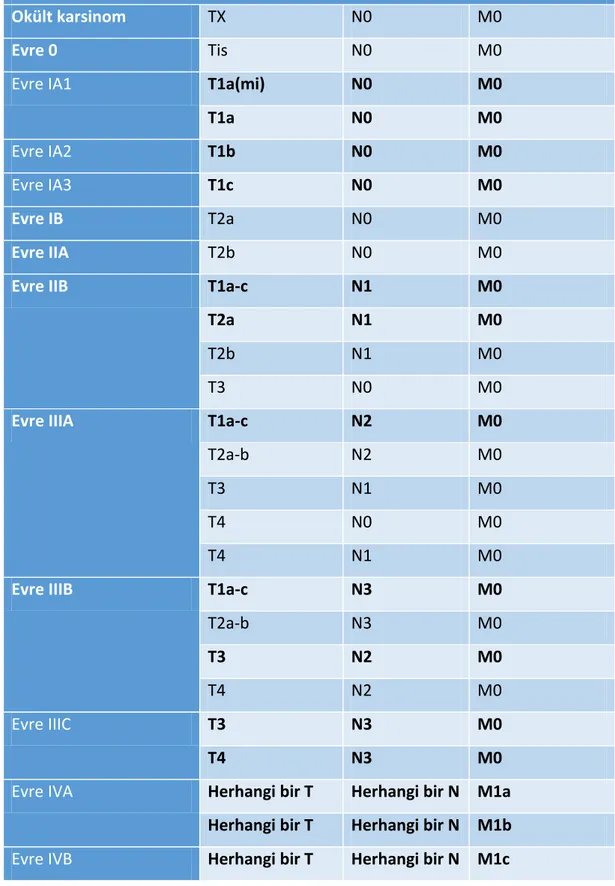
Tablo 1: DSÖ 8. versiyon akciğer karsinomları TNM sınıflaması pT evresi ... 8
Tablo 2: DSÖ 8. versiyon akciğer karsinomları TNM sınıflaması pN ve pM evresi ... 9
Tablo 3: DSÖ 8.versiyon akciğer karsinomları TNM sınıflaması evreleme ... 10
Tablo 4: Baskın patern ile cinsiyet dağılımı. ... 37
Tablo 5: Nekroz ile baskın patern ilişkisi. ... 37
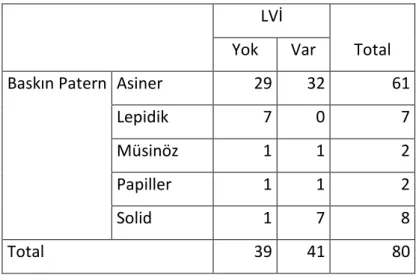
Tablo 6: LVİ ile baskın patern ilişkisi. ... 38
Tablo 7: Lenf nodu metastazı varlığı ile LVİ ilişkisi ... 39
Tablo 8: Nekroz varlığı ile LVİ ilişkisi ... 40
Tablo 9: Her histolojik patern için olgularda LVİ görülme oranları. ... 41
Tablo 10: CD10 boyanma şiddeti ile LVİ ilişkisi ... 41
Tablo 11: EZH2 boyanma şiddeti ile LVİ ilişkisi ... 41
Tablo 12: EZH2 boyanma şiddeti ile hava boşluklarına yayılım ilişkisi ... 42
Tablo 13: Desmoplazi ile hava boşluklarına yayılım ilişkisi ... 43
Tablo 14: CD10 boyanma şiddeti ile desmoplazi ilişkisi... 44
Tablo 15: EZH2 Boyanma şiddeti ile desmoplazi ilişkisi ... 44
Tablo 16: Nekroz ile desmoplazi ilişkisi... 45
Tablo 17: Hava boşluklarına yayılım ile desmoplazi ilişkisi. ... 46
Tablo 18: pM ile lenfoid infiltrasyon ilişkisi. ... 47
Tablo 19: EZH2 boyanma şiddeti ile plevra invazyonu ilişkisi ... 47
Tablo 20: pN ve pM evrelerine göre olguların dağılımı. ... 49
Tablo 21: LVİ ile evre ilişkisi. ... 50
Tablo 22: Nekroz varlığı ile pT evresi ilişkisi. ... 50
Tablo 23: EZH2 boyanma şiddeti ile LVİ ilişkisi. ... 54
vi
KISALTMALAR
KHDAK: Küçük Hücreli Dışı Akciğer Karsinomu KHAK: Küçük Hücreli Akciğer Karsinomu SHK: Skuamöz Hücreli Karsinom
EZH2: Enhancer of zeste homologue 2 DSÖ: Dünya Sağlık Örgütü
EGFR: Epidermal Growth Factor Receptor ALK: Anaplastic Lymphoma Kinase
IASLC: Uluslararası Akciğer Kanseri Araştırmaları Derneği ERS: Avrupa Solunum Derneği
ATS: Amerika Toraks Derneği BT: Bilgisayarlı tomografi MR: Manyetik rezonans
PET: Pozitron emisyon tomografisi VATS: Video eşlikli toraksokopik cerrahi AAH: Atipik Adenomatöz Hiperplazi AİS: Adenokarsinoma İn Situ
vii
ÖZET
Akciğer kanseri dünyada oldukça yaygın görülen ve en sık ölüme neden olan malign bir tümördür. Erken evrede bile metastatik lezyonların sık görülmesi ve lokal rekürrens nedeniyle mortalite yüksektir. Adenokarsinom ise, en sık görülen histolojik alt tiptir ve insidansı artmaktadır.
EZH2, histon metil transferaz etkinliğine sahip olan ve translasyon sonrası histon modifikasyonları yoluyla gen susturmasına aracılık eden, polycomb repressive complex 2'nin (PRC2) anahtar bir bileşenidir. EZH2 kanser gelişiminde önemli rol oynar ve birçok malign tümörde sıklıkla aşırı eksprese edilir. Literatürde EZH2’nin meme, prostat ve over başta olmak üzere birçok tümörde aşırı ekspresyonu kötü prognoz ile ilişkilendirilmiştir.
CD10 çeşitli normal dokularda ve çeşitli malignitelerin epitelyal, stromal veya her iki komponentinde geniş oranda eksprese edilen bir hücre yüzeyi çinko bağımlı metalopeptidazdır. Çelişkili raporlar yayınlanmış olmasına rağmen, tümör hücrelerinde CD10 ekspresyonunun kaybedilmesi veya azalmasının küçük hücreli ve küçük hücreli dışı akciğer karsinomları dahil olmak üzere pek çok malignitenin gelişimine veya ilerlemesine katkıda bulunduğu gösterilmiştir.
Seksen olgunun 27’sinde (%33,8) EZH2 boyanması saptanmamış, sekiz olguda (%10) “1+”, 18 olguda (%22,5) “2+” ve 27 olguda (%33,8) “3+” boyanma elde edilmiştir. EZH2 boyanma yoğunluğu iyi prognoz ile ilişkili bulunmuştur.
Çalışmamızda seksen olgunun 39’unda CD10 boyanmazken 10 olguda “1+”, 20 olguda “2+”, 11 olguda “3+” boyanma elde edilmiştir. CD10 boyanması ile cinsiyet dışındaki parametrelerin ilişkisi anlamlı bulunmamıştır.
Çalışmamızda 2012-2015 yılları arasında EÜTF Patoloji Anabilim Dalında “Akciğer Adenokarsinomu” tanısı almış 80 olgunun ameliyat materyalleri DSÖ 8.versiyon TNM sınıflandırmasına göre yeniden değerlendirilerek klinikopatolojik ve histopatolojik özellikleri incelenmiş, bunların EZH2 ve CD10 immünbelirteçleri ile boyanma özellikleri karşılaştırılmıştır.
viii Yapılan bu çalışmada, CD10 immünekspresyonu ile ilgili veriler anlamlı bulunmamakla birlikte literatüre katkı sağlayabileceği düşünülmüştür. EZH2 ile ilgili umut verici birçok çalışma bulunmaktadır ve çalışmamızın da literatüre farklı bir bakış açısı sunabileceği düşünülmüştür.
ix
ABSTRACT
Lung cancer is a common malignant tumor all around the world and it has the highest mortality rates. High mortality rates are the result of metastasis in early stage and local recurrences of the disease. Adenocarcinoma is the most common histological subtype of lung cancer and the incidence of this subtype has been increasing.
EZH2 is a key component of polycomb repressive complex 2 (PRC2) that has histone methyl transferase activity and gene silencing effect with post-translational histone modification. EZH2 plays an important role in tumor development and overexpression of EZH2 in many kinds of malignant tumors. Overexpression of EZH2 has been associated with poor prognosis in a group of tumors as breast, prostate and ovary in the literature.
CD10 is a zinc-dependent metalloproteinase localized on cell surface which is expressed in epithelial, stromal or both components of malignant tumors besides normal tissues. The decreased levels of CD10 expression or its total loss in tumor cells has been determined to be important in tumor development or progression including lung small cell carcinoma and non-small cell carcinoma though there are conflicting data in the literature.
In our study we applied EZH2 immunohistochemical stain to a total number of 80 cases. 27 of them were negative (22.5%). The intensity of positive staining was evaluated as “1+” in 8 cases (10%), “2+” in 18 cases (22.5%), “3+” in 27 cases (33.8%). There was negative staining in 15 of 56 male cases (26.7%), “1+” in 7 cases (12.5%), “2+” in 13 cases (23.2%), 3+ in 21 cases (37.5%). The intensity of EZH2 stain was determined to be related with good prognosis.
CD10 was also evaluated in 80 cases immunohistochemically. 39 cases were negative with CD10. The intensity of cases with positive staining was “1+” in 10 of them, “2+” in 20 and “3+” in 11. The relationship between CD10 staining and gender characteristics was not statistically significant.
x We have reevaluated surgical materials of 80 cases that had administered to department of pathology at Ege University and diagnosed as “lung adenocarcinoma” between 2012 and 2015 in the aspect of TNM classification stated in the eighth edition of the TNM staging system, clinicopathological and histological features besides EZH2 and CD10 immunohistochemical staining characteristics.
CD10 staining and the compared data did not have a statistically significant relationship although this result may contribute to the literature. EZH2 immunohistochemical staining has been intensely researched in the studies and our study can provide another perspective for the future studies about EZH2.
1
1.
GİRİŞ
Kanser, hem gelişmiş hem de gelişmekte olan ülkelerde mortalite ve morbiditenin ciddi bir sebebidir [1]. Çağımızın hastalığı olarak kabul edilen bu hastalığa karşı verilen uzun soluklu savaş, bugüne kadar hastalara daha uzun ve sağlıklı bir yaşam verme konusunda birçok zafer kazanmıştır. Erken tanı ve tedavi hastaların yaşam kalitesini ve prognozunu yükseltmede en iyi stratejidir. Bugüne kadar erken tanı ve prognoz öngörmede değerli biyobelirteçlerin keşfine yönelik yapılan birçok çalışma olmasına rağmen, bu çalışmaların başarısı sınırlıdır. Bu yüzden yeni ve etkin biyobelirteçlerin keşfi, bu alanda önemini koruyan bir konudur [2].
Akciğer kanseri, dünyada en sık görülen ve en sık ölüme neden olan kanserlerin başında gelmektedir [3]. Klinikte akciğer kanserleri küçük hücreli (KHAK) ve küçük hücreli dışı akciğer karsinomları (KHDAK) olarak iki ana gruba ayrılmaktadır.
Küçük hücreli dışı akciğer karsinomları (KHDAK), tüm akciğer kanserlerinin yaklaşık %80’ini oluşturmaktadır. KHDAK’da cerrahi rezeksiyon sonrası rekürrens riski yüksektir ve genel prognoz kötüdür [4] ve uzun yıllar benzer stratejilerle tedavi edilmişlerdir [5, 6]. Ancak son yıllarda moleküler değişikliklerin daha iyi anlaşılması ve hedefe yönelik tedavilerin geliştirilmesi nedeniyle, genellikle küçük biyopside tanı alan KHDAK’da alt tiplendirmenin önemi büyük oranda artmıştır [6]. Örneğin; yol açtığı fatal hemoptizi nedeniyle, bevacizumab skuamöz hücreli karsinomlarda kontrendike kabul edilmektedir. Pemetrekset ise skuamöz hücreli karsinomda etkisizdir [7]. Bunların yanı sıra tirozin kinaz inhibitörleri, gefitinib ve erlotinib belirli EGFR mutasyonu içeren tümörlerde etkindir ve EGFR mutasyonları büyük oranda adenokarsinomlarda saptanmaktadır. Bu nedenle hastaya uygun kemoterapötik ajanı sunabilmek ve/veya hastanın hedefe yönelik tedaviden yarar görmesini sağlayabilmek için biyopsi örneklerinde adenokarsinom ve skuamöz hücreli karsinomu tanımak ve birbirinden ayırmak gerekmektedir [6, 7].
2 Erken evre hastalığı olan ve hedefe yönelik tedavi şansı bulunmayan hastalarda olduğu gibi tümör evresi ve hastanın performans durumu gibi klasik klinikopatolojik parametreler, bugün hastalık rekürrensinin ve genel sağkalımın en güvenilir belirteçleri olarak düşünülmektedir [8]. Bu nedenle, bu hasta gruplarında, prognostik göstergelere yönelik ek araçlar ve tedavi hedefi olabilecek moleküllerin keşfi halen aktif bir kanser araştırması alanını temsil etmektedir [9].
2004 Dünya Sağlık Örgütü (DSÖ) sınıflamasına göre çoğu adenokarsinom, %80’i en az iki farklı arşitektürel patern barındırdığı için, mikst adenokarsinom olarak sınıflanmıştır [10]. 2011’de Uluslararası Akciğer Kanseri Araştırmaları Derneği (IASLC), Avrupa Solunum Derneği (ERS) ve Amerika Toraks Derneği (ATS) birlikteliğinde akciğer adenokarsinomları için yeni ve daha tatmin edici bir sınıflama önerilmiştir [11]. Ardından 2016 Dünya Sağlık Örgütü (DSÖ) sınıflaması bu öneriler ile uyumlu olarak şekillendirilmiştir. Yeni sınıflamada semikantitatif olarak ölçülen predominant histolojik alt tipin kullanılmasına karar verilmiştir. Ayrıca Bronkoalveolar Karsinom (BAK) tanımı kaldırılarak yerine lepidik baskın adenokarsinom, mikroinvaziv adenokarsinom ve minimal invaziv adenokarsinom tanımları geçmiştir [12].
EZH2, kanser gelişiminde önemli rol oynar ve birçok malign tümörde sıklıkla aşırı eksprese edilir. Literatürde EZH2’nin meme, prostat ve over başta olmak üzere birçok tümörde aşırı ekspresyonu kötü prognoz ile ilişkilendirilmiştir [13-15]. Akciğer, meme, over gibi pek çok organ karsinomu yanı sıra lenfoma, melanom ve sarkomlarda aşırı ekspresyonu gösterilmiş, [16] ve potansiyel bir terapötik hedef olarak düşünülmüştür [17]. Hedefe yönelik tedavi, radyoterapi ve kemoterapi duyarlılığının değerlendirilmesi gibi önemli konularda da EZH2 umut verici bir belirteç olarak görülmektedir.
Tümör hücrelerinde CD10 ekspresyonunun kaybedilmesi veya azalmasının, çelişkili çalışmalar yayınlanmış olmasına karşın renal kanserler, invaziv mesane karsinomları, az diferansiye mide karsinomları, prostat karsinomu, küçük hücreli ve küçük hücreli dışı akciğer karsinomları dahil olmak
3 üzere pek çok malignitenin gelişimine veya ilerlemesine katkıda bulunduğu gösterilmiştir [18]. Ayrıca CD10 ekspresyonunun tümör mikroçevresinde değerlendirilmesinin de prognostik açıdan anlamlı olacağı düşünülmektedir [19].
Bu iki protein ekspresyonunun; tümörün histolojik özellikleri ve klinik prognostik parametrelerle karşılaştırılmasının, akciğer adenokarsinomları gelişimindeki patogenetik sürece ışık tutacağından araştırılmaya değer bir konu olmuştur.
Çalışmamızda 2012-2015 yılları arasında EÜTF Tıbbi Patoloji Anabilim Dalı’nda “Akciğer Adenokarsinomu” tanısı almış olgularda, immünohistokimyasal yöntem ile EZH2 ve CD10 immünekspresyon düzeylerinin incelenmesi ve bulguların histolojik, klinik prognostik parametreler ile korelasyonunun araştırılması planlanmıştır.
4
2. GENEL BİLGİLER
2.1. Epidemiyoloji
Dünya genelinde akciğer kanseri, en sık görülen ve en sık ölüme neden olan kanserdir. Kanser nedenli ölümler arasında erkeklerde ilk sırada (1,1 milyon), kadınlarda ise ikinci sırada (491.000) yer alır [20]. 2012 yılı verilerine göre; 1,87 milyon (%13) yeni tanı ve 1,59 milyon (%19) akciğer kanseri nedenli, ölüm bildirilmiştir. Olguların büyük bir kısmı gelişmekte olan ülkelerde görülmektedir [20]. Kadınlarda görülme sıklığı hızla artmakta olup kanser, ölümlerinde ilk sırayı almaktadır [21].
40-70 yaşları arasında sık görülen bu hastalıkta, %2 vaka 40 yaşın altındadır. Ancak yıllar içerisinde genç yaştaki akciğer kanseri sıklığı da artış göstermektedir. Ülkemizde ise akciğer kanseri erkeklerde birinci sırada, kadınlarda beşinci sıradadır [22].
Tüm akciğer tümörlerinin %99’unu karsinomlar oluşturur. Akciğer karsinomları, pratik olarak KHAK (%20) ve KHDAK (%80) olarak sınıflandırılır. KHDAK grubu; skuamöz hücreli karsinom (SHK), adenokarsinom, büyük hücreli karsinom ve daha nadir alt tipleri içerir. Oldukça nadir görülen sarkomatoid karsinomlar, tüm akciğer tümörlerinin % 0,3-1,3 ünü oluşturur [3].
Tütün kullanımı: Sigara, puro ve pipo tütünü, içerdikleri karsinojenlere bağlı olarak akciğer kanseri riskini arttırır. Tütün dumanında 4000’ den fazla karsinojen madde bulunur. Bunların başında katran, nitrosamin, nikotin, benzopiren, arsenik, nikel yanısıra polonyum 210 gibi radyoaktif izotoplar bulunur. Bu karsinojen maddeler hücre içerisinde birikir, DNA’ ya kovalent bağlanır, yanlış kodlama ile DNA hasarı ve genetik mutasyonlara neden olurlar [23][24]. En önemli karsinojenler, polisiklik aromatik hidrokarbon (örneğin : benzopiren) ve 4-metilnitrosamin-1-3-piridil-1-butanondur [25].
Sigara erkeklerde %80, kadınlarda %50 oranında etiyolojide suçlanmaktadır [26, 27]. Özellikle maruziyet süresi ve kullanılan tütün cinsinin kanser riski üzerine etkisi olduğu gösterilmiştir [28]. Histolojik olarak, sigara
5 içenlerde %10 oranında bronş epitelinde atipik ve hiperplazik değişiklikler görülmektedir. Yine sigara içenlerde, %96,7 gibi bir oranla atipik hücreler görülür. Bu oran, içmeyenlerde %0,9’dur. Çevresel faktörler arasında radyasyon ve uranyum maruziyeti önemli faktörlerdir. Asbest maruziyeti de akciğer kanser riskini arttırmaktadır. Hava kirliliği yönünden en önemli etkenlerden biri ise, radondur.
Histolojik alt tiplerden skuamöz hücreli karsinom ve küçük hücreli karsinom sigara içen erkeklerde; adenokarsinom ise, sigara içmeyen kadın popülasyonda daha çok görülmektedir [29-31]. Lenfoepitelyoma benzeri karsinomda ise, EBV enfeksiyonu ile kuvvetli bir ilişki olduğu bildirilmiştir [32]. Diğer bilinen risk faktörleri arasında meslek hastalıkları, asbest, arsenik ve polisiklik aromatik hidrokarbonlar vb. çevresel etmenler akciğer kanseri gelişiminde rol oynamaktadır [3].
2.2. Klinik Özellikler Ve Evreleme
Akciğer kanserli hastalar; kliniğe sıklıkla nefes darlığı, öksürük, hemoptizi ve kilo kaybı gibi nedenlerle başvurur. Skuamöz hücreli karsinomda en sık semptom hemoptizi iken, adenokarsinomlu hastalar genellikle asemptomatiktir ve görüntüleme yöntemleriyle rastlantısal olarak saptanır [33]. Küçük hücreli akciğer kanseri, genel olarak uzak metastaz yaptığında bulgu verir ve paraneoplastik sendrom sıklıkla görülür [34].
Tanı için yıkama, torakoskopik biyopsi, rezeksiyon materyali, iğne biyopsileri ve plevra sıvı sitolojisinden yararlanılmaktadır. Uzak metastaz (kemik, karaciğer, lenf nodu vb.) varsa bu bölgelerden biyopsiler alınabilir [3]. Bunların dışında rutinde anamnez, fizik muayene, laboratuvar testleri ile akciğer grafisi, bilgisayarlı tomografi (BT), manyetik rezonans (MR) ve pozitron emisyon tomografisi (PET) gibi non-invaziv yöntemler de yer almaktadır. Periferik lezyonlarda, transtorasik BT eşliğinde ince iğne aspirasyonu ve bazen wedge rezeksiyon yararlı olabilmektedir [35]. Mediastinoskopi ve video eşlikli toraksokopik cerrahi (VATS) tanıda sık kullanılan diğer yöntemlerdir.
6 Akciğer tümörlerinde patolojik inceleme ve sınıflandırma, tümörün gerçek evresinin ortaya konması ve tedavinin yönlendirilmesi açısından büyük önem taşımaktadır. Sınıflandırmalar epidemiyolojik ve biyolojik çalışmalar sonucunda yapılmış olup, yeni bilgiler ışığında belirli aralıklarla gözden geçirilmektedir. Akciğer kanserli hastaların önemli bir kısmı tanı aldıklarında ileri evrededir. Cerrahi tedavi uzun süre sağ kalımda etkili olmakla birlikte, hastaların sadece %25 kadarı bu tedaviye aday olabilmektedir [4]. Akciğer kanserinin evrelemesi, klinik ve patolojik (cerrahi) olmak üzere iki şekilde yapılır. Klinik evrelemede görüntüleme yöntemlerinden yararlanılır. Akciğer kanseri evrelemesinde tümör çapı, lenf nodu tutulumu ve uzak metastaz (TNM) modeli prognostik prediktif değeri en fazla olan sistemdir.
1943 - 1952 yılları arasında Pierre Denoix tarafından oluşturulmuş olan TNM evreleme sistemi, 1974 yılında akciğer tümörleri için de uygulanmaya başlanmıştır [36]. TNM evreleme sisteminin 1997 yılında beşinci, 2002 yılında altıncı, 2009 yılında yedinci versiyonu yayınlanmıştır. Akciğer kanseri tanı ve tedavisindeki yenilikler nedeniyle 2011 yılında The International Association for the Study of Lung Cancer (IASLC), American Joint Committee on Cancer (AJCC) ve International Union Against Cancer (UICC) tarafından yeni bir TNM sınıflaması hazırlanmıştır [37-39]. Son olarak da 2015 yılında bu değişiklikler doğrultusunda DSÖ kılavuzunda sekizinci versiyonu yayınlanmıştır [3].
TNM evreleme sisteminde temel olarak “T” evresinde değişiklikler olmuştur. Bu değişiklikler sırasında, primer tümör ile satellit nodüllerin boyutuna, yerleşim yerine göre yeniden sınıflandırılmıştır. Bu sisteme göre 3 cm ve daha küçük tümörler T1, >3 cm ancak ≤5 cm tümörler T2, >5 cm ancak ≤7 cm olan tümörler T3 ve 7 cm üstü tümörler T4 olarak değerlendirilmektedir.
T evresi değerlendirilirken; her evresi kendi içinde alt gruplar barındırmakta ve yine tümör çapı dışında ana bronş invazyonu, plevra invazyonu, çevre doku invazyonu gibi parametreler de göz önünde bulundurulmaktadır [3].
TNM sınıflaması; geleneksel olarak küçük hücreli dışı akciğer tümörleri için kullanılmaktaydı. Küçük hücreli karsinomlar ise, lokal ve ileri evre olarak
7 değerlendirilmekteydi. Fakat yeni sınıflama her iki grup tümörler için de uygulanabilir niteliktedir [40]. Lenf nodu tutulumunu gösteren N evresi, diğer sistemlerden farklıdır. Metastatik lenf nodu sayısı değil, bölgesi önemlidir. Akciğer tümörlerine özgü bölgesel lenf nodları mediastinal, hiler, interlober, segmental, subsegmental olmak üzere; intratorasik, skalen ile supraklaviküler lenf nodlarından oluşmaktadır.
Yeni TNM sınıflamasında, N evresinde sağ kalımı etkileyecek herhangi bir değişiklik olmamıştır. Bölgesel lenf nodu sınıflaması Mountain ve Dresler tarafından 1997 yılında tanımlanmıştır [41]. Nodal, yayılımı saptamada çeşitli teknikler kullanılmaktadır. BT ve PET’in mediastinal lenf nodu tutulumunu saptamada duyarlılığı ve özgüllüğü yüksek olmakla birlikte, mediastinoskopi altın standart olarak kabul edilmektedir. Ancak invaziv bir teknik olmasının yanı sıra, posterior ve inferior mediastinal lenf nodlarını göstermede sınırlıdır [42, 43]. Ayrıca endobronşiyal ultrason eşlikli transbronşiyal iğne biyopsisi (EBUS-TBNA) yönteminin duyarlılığı %85, negatif prediktif değerinin %90 olduğu bildirilmiştir [44].
8 T – Primer Tümör
Tx Primer tümör belirlememiş. T0 Primer tümör bulgusu yok.
T1 T1 Tümör en geniş çapı 3cm/daha küçük ve çevresi akciğer veya visseral plevra ile kaplı, ana bronşlarla ilişkisi yok. T1a(mi) Minimal invaziv adenokarsinom.
T1a Tümörün en geniş çapı 1cm ya da daha küçük. T1b Tümör 1 cm’den büyük ama 2 cm’den küçük. T1c Tümör 2 cm’den büyük ama 3 cm’den küçük. T2 Tümör 3 cm’den büyük ama 5 cm’den küçük; veya
Aşağıdaki özelliklerden en az biri ile birlikte olan tümör, - Karinaya olan uzaklığına bakılmaksızın ana bronş tutulumu var ancak karina tutulumu yok.
- Visseral plevra invazyonu var.
- Hiler bölgeye uzanan atelektazi veya obstrüktif pnömoni oluşturan, akciğerin bir kısmını veya tümünü içeren tümör. T2a Tümör 1 cm’den büyük ama 4 cm’den küçük.
T2b Tümör 1 cm’den büyük ama 5 cm’den küçük.
T3 Tümör 5 cm’den büyük ama 7 cm’den küçük ya da göğüs duvarı, frenik sinir, parietal perikardın direkt invazyonu, ya da primer ile aynı lobda ayrı bir tümöral nodül bulunması. T4 Tümör 7 cm’den büyük ya da diyafragma, mediasten, kalp,
büyük damar, trakea, rekürren laringeal sinir, özefagus, vertebra korpusu, karina invazyonu; primer tümörle aynı tarafta farklı bir lobda ayrı tümöral nodül(ler).
9 N – Bölgesel Lenf Nodları
Nx Bölgesel lenf nodları belirlenemedi. N0 Bölgesel lenf noduna metastaz yok.
N1 Aynı taraf peribronşial ve/veya hilar lenf nodlarına ve intrapulmoner nodlara metastaz.
N2 Aynı taraf mediastinal ve/veya subkarinal lenf nodu(ları)na metastaz.
N3 Karşı taraf mediastinal, karşı taraf hilar, aynı/karşı taraf skalen ya da supraklavikular lenf nodu(ları)na metastaz.
M – Uzak Metastaz
M0 Uzak metastaz yok. M1 Uzak metastaz.
M1a Karşı taraf akciğerde tümöral nodül(ler); plevral/perikardial nodüller ya da malign plevral/perikardiyal efüzyon birlikteliği.
M1b Ekstratorasik tek organda tek metastaz.
M1c Ekstratorasik tek/çok sayıda organda metastaz.
Tablo 2: DSÖ 8. versiyon akciğer karsinomları TNM sınıflaması pN ve pM evresi
M evresi ise; M1a, M1b ve M1c olarak üç alt gruba ayrılmıştır. Önceden malign plevral/perikardiyal efüzyon varlığı T4 olarak kabul edilmekte iken, M1a olarak değiştirilmiştir. Tek ekstratorasik uzak metastaz varlığı M1b, multiple ekstratorasik uzak metastaz varlığı ise M1c olmuştur. Böylece hastaların prognozu daha doğru bir şekilde belirlenebilecek ve birçok hastanın da evresi değişecektir. Aynı lobda primer tümörü olan hastalar; önceleri T4 iken, şimdi T3 kabul edilerek cerrahiye ek olarak kemoterapi alabileceklerdir. Benzer şekilde ipsilateral metastatik nodülleri olup, evre IV olan hastalar ise; evre IIIA olarak kabul edilerek cerrahi tedaviden yararlanabileceklerdir [3].
10
Akciğer Karsinomlarında Evreleme
Okült karsinom TX N0 M0
Evre 0 Tis N0 M0
Evre IA1 T1a(mi) N0 M0
T1a N0 M0
Evre IA2 T1b N0 M0
Evre IA3 T1c N0 M0
Evre IB T2a N0 M0
Evre IIA T2b N0 M0
Evre IIB T1a-c N1 M0
T2a N1 M0
T2b N1 M0
T3 N0 M0
Evre IIIA T1a-c N2 M0
T2a-b N2 M0
T3 N1 M0
T4 N0 M0
T4 N1 M0
Evre IIIB T1a-c N3 M0
T2a-b N3 M0
T3 N2 M0
T4 N2 M0
Evre IIIC T3 N3 M0
T4 N3 M0
Evre IVA Herhangi bir T Herhangi bir N M1a Herhangi bir T Herhangi bir N M1b
Evre IVB Herhangi bir T Herhangi bir N M1c
11
2.3. Radyolojik Özellikler
Akciğer tümörleri, histolojik alt tiplerine göre çeşitli radyolojik bulgulara sahiptir. Örneğin: skuamöz hücreli karsinomlar, genellikle büyük çaplı, santralde lokalize olup kavitasyon sıklıkla izlenirken, adenokarsinomlar daha çok periferik yerleşimli, 4 cm’den küçüktür ve kavitasyon nadirdir [45].
2.4. Histolojik Heterojenite
Akciğer kanserleri, sıklıkla histolojik heterojenite gösterirler. Neredeyse %50 kadarı birden fazla majör histolojik alt tip sergiler. Özellikle küçük biyopsileri incelerken bu özellik akılda bulundurulmalı ve bu bilgilerin ışığında dikkatle değerlendirilmelidir. Minimum %10 oranında adenokarsinom veya skuamöz hücreli karsinom komponentine gereksinim duyan adenoskuamöz karsinom ile benzer şekilde iğsi veya dev hücreli komponent içeren pleomorfik karsinomları bronkoskopik biyopsi veya iğne biyopsilerinde değerlendirirken, bu alanların varlığından yalnızca şüphe duyabiliriz. Bu durumda kesin tanı, sadece rezeksiyon materyalinde verilebilir [3].
2.5. Makroskopik Özellikler
İnvaziv adenokarsinomların büyük bölümü, ortasında antrakozik pigment barındıran bir santral skar ve plevral çekinti barındıran gri-beyaz nodüller şeklinde karşımıza çıkar [46]. Çevredeki lepidik komponent nedeniyle sınırları belirsiz olabilir ya da içinde bağımsız normal parankim görünümünde alanlar barındırabilir. Fikse edilmemiş taze örneklerde, lepidik paterndeki alanların makroskopik olarak saptanması zor olabilir [3].
2.6. Mikroskobik Özellikler
2.6.1 Atipik Adenomatöz Hiperplazi (AAH) ve Adenokarsinoma İn Situ (AİS)
AAH; lokalize, genellikle 0,5 cm’den küçük, alveol duvarlarını veya respiratuvar bronşiolleri döşeyen hafif-orta derecede atipi gösteren, tip 2
12 pnömosit ve/veya Clara hücrelerinin proliferasyonu sonucu oluşur. Bazal membran boyunca hücreler arası boşlukların varlığı adenokarsinoma in situ ile ayırıcı tanıya yardımcı olur. Hücreler histolojik olarak yuvarlak-oval nükleuslu, kübik ya da alçak kolumnar şekillidir. Bazı otörler AAH’yi, düşük-yüksek dereceli olarak sınıflandırsa da bu derecelendirme önerilmemektedir [3]. AAH ve AİS arasında morfolojik devamlılık vardır. Hücresellik ve atipi, AİS’da AAH’ye göre daha belirgindir [47].
İmmünhistokimyasal olarak AAH’de; sürfaktan protein A (SP-A), karsinoembriyonik antijen (CEA), matriks metalloproteinaz (MMP), E-kaderin, ß-katenin, CD44v6 ve TTF-1 pozitifliği saptanır [3].
Yeni Dünya Sağlık Örgütü, TNM sınıflamasına göre; 3 cm ve altında invazyon göstermeyen pür lepidik paterne sahip proliferasyonlar, AİS başlığı altında incelenir. Çoğu olguda; nonmüsinöz tip II pnömosit veya Clara hücrelerinin tümöral proliferasyonu izlenir. Daha az olguda; abondan apikal müsin içeren, uzun kolumnar müsinöz hücrelerin proliferasyonu görülür [3, 47].
2.6.2. Adenokarsinomlar
2015 DSÖ’de; glandüler diferansiyasyon veya müsin üretimi gösteren, asiner, papiller, bronkioloalveoler veya müsin üreten solid büyüme paterni gösteren tümörler olarak tanımlanmıştır [3]. İsimlendirmenin baskın paterne göre yapılmasına ve diğer paternlerin de oranlarıyla birlikte belirtilmesi gerektiğine karar verilmiştir. Çapı, 3 cm’nin; invazyonu ise, 5 mm’nin altında olan lepidik tümörler için yeni bir adenokarsinom alt tipi tanımlanmıştır.
2.6.2.1. Minimal İnvaziv Adenokarsinom (MİA)
MİA; çapı 3 cm ve altında olan, baskın olarak lepidik paternden oluşan, radyolojik olarak solid komponent içeren buzlu cam görünümünde soliter lezyonlardır. MİA tanısı için, tümör herhangi bir odakta 5 mm ve altında invazyon içermelidir.
13 MİA olgularında invaziv komponent, lepidik paternin dışında kalan; asiner, papiller, mikropapiller tiplerin olduğu alandan ölçülmelidir. İnvazyon ölçülürken, tümör hücrelerinin infiltre ettiği myofibroblastik stroma görülmelidir. Birden fazla invaziv odak varsa, en büyük olan temel alınmalıdır. Eğer invazyon çapı ölçülemiyorsa; invaziv komponentlerin toplam yüzdesinin, tümör çapı ile çarpılması sonucu, tahmini invazyon büyüklüğü bulunarak raporlanmalıdır.
Lenfatik, kan damarı ve plevral invazyon ile tümör nekrozunun MİA tanısını dışladığı unutulmamalıdır [47].
AİS ve MİA tanıları sadece rezeksiyon materyalinde konulmalıdır. Bu yüzden raporlamadan önce kitlenin tamamı örneklenmelidir. Bu özelliği taşıyan 3 cm’den büyük soliter tümörlerde, sağ kalım konusunda yeterli bilgi mevcut olmadığı için bu olgular için “lepidik baskın adenokarsinom, AİS ya da MİA kuşkulu” terimi önerilmektedir [3, 47].
İnvaziv adenokarsinomlarda, invazyon odağı 0,5 cm’nin üzerindedir ve bu odak lepidik patern dışında; asiner, papiller, mikropapiller ve solid paternden birini içermelidir. Tümörde, invaziv tümör hücrelerini içeren miyofibroblastik stroma da izlenmelidir [47].
Yeni sınıflandırmada tümördeki baskın paternin belirlenmesi ve eşlik eden paternlerin (en az %5 olmalı) raporda belirtilmesi gerekmektedir. Baskın paternle sınıflandırma, tümörün moleküler özellikleri hakkında fikir edinmemizi de sağlayacaktır. Papiller ve lepidik paternde EGFR mutasyonları; mikropapiller paternde KRAS, EGFR, BRAF; müsinöz adenokarsinomlarda KRAS mutasyonları, solid ve asiner paternde p53 mutasyonları daha sıktır [48].
2.6.2.2. İnvazyonu 5 mm’nin Üstünde Olan Baskın Lepidik Paternli Adenokarsinom
Lepidik baskın tip invaziv adenokarsinomlar, nonmüsinöz tipte hücrelerden oluşur. 5 mm üzerinde invazyon alanı ya da lepidik patern dışındaki asiner, papiller, mikropapiller ve solid komponentleri içerir. İnvaziv tümör hücrelerini içeren, miyofibroblastik özellikte stroma dikkat çeker. Nekroz varlığı, plevral ya da lenfovasküler invazyon MİA’dan ayrımında yardımcıdır. Reaktif ve
14 benign süreçler, özellikle kor biyopsilerde ve frozen kesitlerde lepidik paterni taklit edebilir. Ayrıca kronik inflamatuar durumlarda izlenen; Tip II pnömosit hiperplazisi frozenda donma artefaktına bağlı lepidik paterni taklit edebilir. Metastatik karsinomlar da bazen lepidik patern şeklinde akciğeri infiltre edebilir [47]. Yapılan birkaç yeni çalışma, bu tümörlerde sağkalımın %86-90 arasında olduğunu göstermektedir [49, 50].
2.6.2.3. Asiner Baskın Tip Adenokarsinom
Asiner yapı, genellikle oval ya da yuvarlak tümör hücreleri ile çevrelenmiş santral lümen olarak tariflenmiştir. Tümör hücreleri ve/veya glandüler boşluklar müsin içerebilir. Ayrıca belirgin lümen oluşturmayan periferal nükleer polarizasyonlu hücre toplulukları ve kribriform yapılar da asiner patern içinde yer almaktadır [3, 47].
ġekil 1: Glandüler yapılar oluĢturan asiner adenokarsinom örneği (H.E. x10).
15 Santral, fibrovasküler koru çevreleyen atipik hücreler ile çevrili papiller yapılardan oluşur. Gerçek papiller yapılar, lepidik karsinomdaki alveoler duvarların tanjansiyel kesitlerinden ayırt edilmelidir. Alveol boşlukları içinde papiller yapı bulunduran lepidik paternli tümörler, papiller adenokarsinomdur. Myofibroblastik stroma, bu paternin tanısı için gerekli değildir [3, 47].
ġekil 2: Fibrovasküler kor yapısı barındıran papiller morfolojinin izlendiği papiller adenokarsinom örneği (H.E. x10)
2.6.2.5. Mikropapiller Baskın Tip İnvaziv Adenokarsinom
Sıklığı %1-5 oranında olan erken evrelerde dahi kötü prognozu temsil eden alt tiptir. Genellikle küçük, minimal nükleer atipi içeren küboidal hücrelerden oluşup, fibrovasküler kor içermez. Yüzük benzeri glandüler yapılar, alveol boşlukları içinde yüzebilir. Vasküler ve stromal invazyon sıktır. Psammom cisimcikleri içerebilir [47].
16 ġekil 3: Fibrovasküler kor yapısı içermeyen, boĢluklar içerisinde yüzen yüzük benzeri yapıların izlendiği mikropapiller adenokarsinom örneği (H.E. x10).
2.6.2.6. Solid Baskın Tip İnvaziv Adenokarsinom
Adenokarsinomlarda izlediğimiz asiner, papiller, mikropapiller ve lepidik paternleri belirgin olarak göstermeyen tümörlerdir. Tümör %100 solid ise; 2 büyük büyütme alanının her birinde, en az 5 tümör hücresinde histokimyasal olarak mukus boyaları ile müsin varlığının gösterilmesi gerekmektedir. SHK ve büyük hücreli karsinomdan ayırıcı tanısının yapılması gerekmektedir. Her iki karsinomda nadir intraselüler müsin pozitifliği gösterebilir.
Bazı solid adenokarsinomlar, yoğun eozinofilik sitoplazma içererek morfolojik olarak SHK’u taklit edebilir. Ayırıcı tanıda, p63 veya p40 gibi SHK belirteci olan iki belirteçten biri ve adenokarsinom belirteci olan TTF-1 kullanımı yardımcı olmaktadır [47]. Son yıllarda yapılan çalışmalar; p63’ün izomeri olan p40’ın, SHK için daha spesifik olduğu yönündedir [51].
17 ġekil 4: Belirgin bir dizilimin izlenmediği solid adenokarsinom örneği (H.E. x10).
2.6.2.7. İnvaziv Adenokarsinom Varyantları
DSÖ 2004 sınıflamasında; fetal adenokarsinom, müsinöz (kolloid) adenokarsinom, müsinöz kistadenokarsinom, taşlı yüzük hücreli ve şeffaf hücreli adenokarsinom, adenokarsinom varyantları olarak sınıflanmıştır [3]. Ancak son adenokarsinom sınıflamasında, müsinöz kistadenokarsinom, taşlı yüzük hücreli ve şeffaf hücreli adenokarsinomlar varyant listesinden çıkarılmıştır. Taşlı yüzük ve şeffaf hücreli varyantlar, diğer histolojik paternlerde, özellikle solid patern ile beraber görülen histolojik değişiklikler olarak kabul edilmektedir. Anaplastik lenfoma kinaz gen füzyonları (EML4-ALK), %56 oranında taşlı yüzük hücreli komponent içeren olgularda gözlenir. Bu olgularda, crizotinib tedavisi etkilidir [47].
Müsinöz kistadenokarsinom, ilk kez 1989’da tanımlanmış bir antitedir. Literatürde; on biri erkek, dokuzu kadın, yaşları 29-73 arasında değişen 20 olgu mevcuttur. Makroskopik olarak, kalın duvarlı kaviter lezyonlardır. Kist müsinöz epitel ile döşeli çok sayıda septa içerir. Literatürdeki üç hasta, nüks nedeniyle ex olmuştur. Son sınıflamada adenokarsinom varyantları sınıfından çıkarılmış olup,
18 kolloid adenokarsinomun uniloküler varyantı olarak kabul edilmiş ve bu gruba eklenmiştir [47].
Son adenokarsinom sınıflamasında; invaziv müsinöz adenokarsinom kolloid tip, düşük ve yüksek dereceli fetal adenokarsinom, enterik tip adenokarsinom, adenokarsinom varyantları olarak sınıflanmıştır [47].
2.6.2.7.1. İnvaziv Müsinöz Adenokarsinom
Yeni yayınlar, eski sınıflamadaki müsinöz BAK olarak sınıflanan tümörlerin; önceden nonmüsinöz BAK olarak sınıflanan tümörlerden çok farklı klinik, radyolojik, patolojik ve genetik özellikleri olduğunu göstermiştir. İnvaziv müsinöz tümörlerde KRAS mutasyonları sık görülürken, EGFR mutasyonu genellikle saptanmaz. Nonmüsinöz adenokarsinomlarda ise; EGFR mutasyonu bulunurken, KRAS mutasyonları oldukça nadirdir. Buna bağlı olarak bu iki tümör, yeni sınıflandırmada ayrı başlıklar altında incelenmektedir [47].
Morfolojik olarak, invaziv müsinöz adenokarsinomlar; nükleer atipinin belirgin olmadığı kolumnar ve goblet hücre morfolojisinde, bol intrasitoplazmik müsin içeren hücrelerden oluşur. İnterstisyel kalınlaşma, görülmez. Çok sayıda olma eğilimindedir. Her bir morfolojik komponentten en az %10 oranında görülüyorsa, raporlama “mikst müsinöz ve nonmüsinöz adenokarsinom” şeklinde olmalıdır.
19 ġekil 5: Kolumnar hücre morfolojisinde hücrelerden oluĢan müsinöz
adenokarsinom örneği (H.E. x10).
Nonmüsinöz adenokarsinomlarda olduğu gibi lepidik, asiner, papiller, mikropapiller ve solid paternleri içeren müsinöz adenokarsinomlarda; paternlerin oranlarının anlamlı olup olmadığı bilinmemektedir. Stromal invazyon alanlarındaki malign hücreler; daha az sitoplazmik müsin içeren, belirgin atipili hücrelerdir. Bu tümörlerin müsinöz AİS ve MİA’dan farklı özellikleri vardır. Çapı 3 cm’den büyük, invazyon alanı 5 mm’nin üzerinde, komşu parankime milier yayılma eğiliminde, çok sayıda nodüllerle karakterizedir [47].
İnvaziv müsinöz adenokarsinom, müsin oluşturan ancak goblet hücresi ve kolumnar diferansiyasyonu göstermeyen tümörlerden ayırt edilmelidir. Işık mikroskobunda ya da müsin boyaları ile müsin içeriği gösterilen tümörleri, müsin oluşturan ya da müsinöz özellikli olarak isimlendirmek daha uygundur [47].
2.6.2.7.2. Kolloid Adenokarsinom
Alveol duvarlarının müsin ile distansiyonuna ve yıkımına yol açan, aşırı ekstraselüler müsin üreten tümörlerdir. Goblet hücrelerinden veya müsin salgılayan hücrelerden oluşur. Bu tümörler pür olmaktan çok diğer tiplerle beraberdir. Baskın komponent olduğunda, kolloid adenokarsinom olarak sınıflanmalıdır. Eski sınıflamadaki adenokarsinom varyantları başlığı altında
20 incelenen, oldukça nadir olarak izlenen müsinöz kist adenokarsinomlar yeni sınıflamada bu gruba dahil edilmiştir [47].
2.6.2.7.3. Fetal Adenokarsinom
Fetal akciğer tübüllerine benzeyen glikojenden zengin, subnükleer vakuollü, silyalı hücreler ile döşeli tübüllerden oluşur. Skuamoid morüller içerebilir. Çoğu düşük derecelidir. Yüksek dereceli olanlar diğer histolojik subtipler ile bir arada bulunabilir. O zaman baskın komponente göre sınıflanır. Daha çok gençlerde görülür. Düşük dereceli fetal adenokarsinomlar beta katenin gen mutasyonları içerir. İmmünohistokimyasal incelemede, aberan nükleer ve sitoplazmik ekspresyon gösterilebilir. Bu özellik, yüksek dereceli fetal adenokarsinomlar ile ayırıcı tanısının yapılmasına yardımcı bir özelliktir [47].
2.6.2.7.4. Enterik Tipte Adenokarsinom
Kolorektal adenokarsinomların morfolojisini ve immünohistokimyasal özelliklerini gösteren tümörlerdir. Eğer bir tümörde bu tip özellikler %50’yi aşarsa, “enterik diferansiyasyonlu adenokarsinom” olarak isimlendirilir. Enterik belirteçlerden en az biri pozitiftir (CDX2, CK20, MUC2). CK7 ve TTF-1 pozitifliği ve lepidik paterni de içeren heterojenite ayırıcı tanıda yardımcıdır. Bu olgularda klinik olarak, kolorektal adenokarsinom olmadığı kanıtlanmalıdır. Histolojik olarak kolorektal adenokarsinomlara benzeyen, ancak kolorektal immünohistokimyasal belirteçleri negatif olan tümörler, “enterik morfolojili adenokarsinom” olarak sınıflandırılır [47].
2.7. Moleküler Değişiklikler
Son yıllarda moleküler değişikliklerin daha iyi anlaşılması ve hedefe yönelik tedavilerin geliştirilmesiyle birlikte, genellikle küçük biyopside tanı alan KHDAK’da alt tiplendirmenin önemi büyük ölçüde artmıştır. Örneğin; yol açtığı fatal hemoptizi nedeniyle, bevacizumab skuamöz hücreli karsinomlarda
21 kontrendike kabul edilirken; Pemetrekset ise, skuamöz hücreli karsinomda etkisizdir [7, 52].
Epidermal growth factor receptor (EGFR, HER-1/ErbB1), ErbB ailesine ait bir tirozin kinaz reseptörüdür. ErbB gen ailesi, 4 üyeden oluşur: ErbB1 (EGFR-HER1), ErbB2 (Neu/ HER2), ErbB3 (HER3) ve ErbB4 (HER4). Ligand (EGF, TGF-alfa), EGFR’ye bağlandığında; reseptör dimerize ve fosforile olarak aktive olur. EGFR sinyali, PI3K/AKT/mTOR ve RAS/RAF/MEK/MAPK yolağını harekete geçirir. Sonuçta bu akvitasyon sayesinde, hücre proliferasyonu ve apoptoz regüle edilir. Gefitinib ve erlotinib, kinaz bölgesini (K) bloke ederek etki gösterir. Eğer bu aşamada KRAS veya BRAF mutasyonu olursa, bu ajanlar etkisiz hale gelir [53, 54].
ġekil 6: EGFR sinyalizasyon yolağı
(Bu şekil [54] no’lu kaynaktan alıntılanmıştır.)
Tirozin kinaz inhibitörleri; EGFR mutasyonu içeren tümörlerde etkindir ve EGFR mutasyonları, genellikle adenokarsinomlarda saptanmaktadır [55]. Akciğer kanserinde KRAS mutasyonu, sigara içimi ile ilişkilidir. Literatürde adenokarsinomlarda EGFR mutasyonu beyaz ırkta %10-20 oranında Asya kökenlilerde %35-45, KRAS mutasyonu ise beyaz ırkta %15-35 oranında Asya kökenlilerde %5-10 civarında saptanmıştır [3]. Yine adenokarsinom olgularında;
22 daha çok görülen EML4-ALK gen yeniden düzenlenmesine sahip tümörlerde, crizotinib önemli bir tedavi seçeneğidir [56]. ALK gen yeniden düzenlenmesi, sıklıkla genç ve sigara içmeyen hastalarda görülen mutasyonlardır [57, 58].
ROS1 gen yeniden düzenlenmesi; adenokarsinomlarda %1-3 oranında görülen bir mutasyondur [59, 60]. Yeni çalışmalarda, ROS1 mutasyonu görülen tümörlerin crizotinibe duyarlı olabileceği bildirilmiştir [60, 61]. Skuamöz hücreli karsinomlar için de yeni moleküler değişiklikler (FGFR1 amplifikasyonu, DDR-2 ve PIK3CA mutasyonları, PTEN delesyonu) bildirilmektedir [62, 63]. Tanımlanan bu mutasyonları saptayabilmek, adenokarsinom ve skuamöz hücreli karsinom tanısı alan hastalarda hedefe yönelik tedaviler açısından çok değerlidir.
23
2.8. Küçük Biyopsi Ve Sitoloji Materyaline Yaklaşım
Akciğer kanserlerinin; klinikte, kabaca küçük hücreli ve küçük hücreli dışı karsinom olarak ayrıldığını belirtmiştik. Ancak son yıllarda yeni moleküler değişikliklerin tanımlanması ve hedefe yönelik tedavilerin geliştirilmesiyle birlikte; genellikle tanı anında olgular inoperabl olup, küçük biyopsi materyali ile tanı alan olgularda adenokarsinom ve skuamöz hücreli karsinomu birbirinden ayırmak zorunlu hale gelmiştir.
Tanımlanan hedeflenebilecek mutasyonların sayısı her gecen gün artmakta, adenokarsinomlar (EGFR, ALK mutasyonları) yanı sıra skuamöz hücreli karsinomlar için de yeni moleküler değişiklikler (FGFR1 amplifikasyonu, DDR-2 ve PIK3CA mutasyonları, PTEN delesyonu) bildirilmektedir [62, 63]. Bu durum, yalnızca hastaya uygun tedaviyi belirlememiz gerektiği anlamına gelmez. Aynı zamanda her bir tümör tipi için, farklı tanısal stratejiler izlememiz gerektiğini de göstermektedir.
Küçük dokuların; ileride yapılabilecek moleküler analizler için olabildiğince saklanması, ancak gerekli olduğu ölçüde tiplendirmeye yönelik immünohistokimyasal çalışma (genellikle bir adenokarsinom bir SHK belirteci ile) yapılması önerilmekte. 2004 DSÖ sınıflaması; rezeksiyon temelli, morfolojiye dayalı bir sınıflamadır. İmmünohistokimyasal çalışmaya daha çok nöroendokrin karakterdeki tümörlerin tanısında yer verilmiştir [64]. Bu sınıflamanın mevcut şekliyle küçük biyopsi ve sitolojik materyallerde uygulanabilirliği oldukça kısıtlıdır. Bu kısıtlılık ise, tanıda hatalara yol açmaktadır [35].
Materyallerde sıklıkla tümörlerin az diferansiye oluşu, 2004 DSÖ sınıflamasında tanımlanan kriterlere uygun olmayışı ve konvansiyonel boyaların tiplendirmede yetersiz kalması nedeniyle tiplendirilemeyen KHDAK tanısı, %40’lara çıkmaktaydı [65]. Genellikle küçük biyopsiler ya da sitolojik materyaller ile tanı alan KHDAK’larında bu kısıtlı örneklerde morfolojik olarak diferansiyasyonu belirlemek her zaman mümkün olmadığından, alt tiplendirmede immün belirteçler büyük önem kazanmıştır. Böylelikle, tiplendirilemeyen KHDAK tanısının %5’in altına çekilebileceği öngörülmektedir [65].
24 IASLC/ATS/ERS’nin birlikte çalışarak oluşturduğu uluslararası multidisipliner akciğer adenokarsinomları sınıflaması yayınlanmıştır ve yeni DSÖ sınıflamasında da adenokarsinomlar aynı şekilde ele alınmıştır [11]. Bu uluslararası multidisipliner çalışma grubu; aynı zamanda küçük biyopsilere yaklaşım prensiplerini de yayınlamış, rezeksiyon temelli DSÖ sınıflamasına eklenmesi önerilen bir küçük biyopsi/sitoloji sınıflaması oluşturmuştur [66].
Adenokarsinomlarda; TTF-1, Napsin-A, sitokeratin 7 ve müsin boyaları (d-PAS, musikarmen), skuamöz hücreli karsinomlarda ise; p63, p40, desmocollin-3 ve sitokeratin 5/6 sık kullanılan, güvenilir belirteçlerdir [67, 68]. Bunlardan özellikle; TTF-1, p63 ve müsin boyası, dokunun sınırlı olması nedeniyle tanısal algoritmik yaklaşımda ön plana çıkmış oldukça duyarlı ve özgül değeri yüksek belirteçlerdir [69].
Küçük biyopsilerde, morfolojik olarak tip belirlemek mümkün ise, immünohistokimya yapılmaması; morfolojik olarak diferansiyasyon saptanmadıysa bir adenoid ve bir skuamöz immün belirteç uygulamanın yeterli olduğu, immünohistokimyasal incelemeleri artırarak dokunun tüketilmemesi gerektiği belirtilmektedir [66].
p40 / p63
TTF1
+ -
+ KHDAK Adenokarsinom Lehine KHDAK Adenokarsinom Lehine - KHDAK SHK Lehine KHDAK Alt Tiplendirilemeyen
ġekil 7 :KHDAK’da immunhistokimyasal algoritmik yaklaşıma örnek. (Bu şekil 3 no’lu kaynaktan esinlenilmiştir.)
Hedefe yönelik tedaviyi belirlemek amacıyla, küçük biyopsilerde uygulanan immünfenotipe göre; alt tiplendirmenin, rezeksiyon materyallerinde de uygulanması gerekip gerekmediği belirsizliğini korumakta, günlük pratikte patologların farklı yaklaşımlar sergilediği görülmektedir.
25
2.9. Prognoz
Prognozu belirlemede, evreleme en önemli kriterdir. KHDAK’larında evreleme için, TNM sınıflandırması kullanılır [3]. Goya T ve ark.’nın [70] yaptığı 6644 KHDAK olgusunun incelendiği büyük bir seride, prognozu belirleyen en önemli dört faktör: Cinsiyet, yaş, histolojik tip ve evre olarak bulunmuştur.
Bu çalışmada bir yıllık bir süre içinde toplanan hastalarda, Kaplan-meier metodu ile cerrahi öncesi klinik evrelemeye göre beş yıllık sağ kalımlar şu şekilde bildirilmiştir. Evre 1A: %72,1; evre 1B: %49,9; evre 2A: %48,7; evre 2B: %40,6; evre 3A: %35,8; evre 3B: %28,0; evre 4: %20,8. Evre 1A-1B arasında, evre 2A-2B arasında, evre 2B-3A arasında ve evre 3A-3B arasında anlamlı farklılıklar saptanmış iken; evre 1B-2A ve evre 3B-4 arasında anlamlı farklılıklar saptanmamıştır. Yine aynı çalışmada cerrahi sonrası patolojik evrelemeye göre, 5 yıllık sağ kalımlar şu şekildedir; evre 1A: %79,5; evre 1B: %60,1; evre 2A: %59,9; evre 2B: %42,2; evre 3A: %29,8; evre 3B: %19,3; evre 4: %20,0. Evre 1A-1B, evre 2A-2B, evre 2B-3A ve evre 3A-3B arasında anlamlı farklılık saptanmıştır. Ancak evre 1B-2A ve evre 3B-4 arasında anlamlı farklılık saptanmamıştır.
Sonuç olarak; bu çalışmada histopatolojik tipe göre 5 yıllık sağ kalımlar, iyiden kötüye sırasıyla şöyle bildirilmiştir: Adenokarsinomlarda %56,0; SHK’da %48,6; büyük hücreli karsinomda %46,7; adenoskuamöz karsinomda %35,6.
Ichinose Y ve arkadaşlarının [71] yaptığı bir çalışmada; KHDAK olgularında ortalama sağ kalım %28,8; üç yıllık sağ kalım %44, beş yıllık sağ kalım %30 bulunmuştur. Sağ kalım için en önemli prognostik faktörler; tümör histopatolojisi, klinik evre ve patolojik evre olarak bildirilmiştir.
Hastaların sağ kalımları, plevral lavaj sitolojilerinin durumlarına göre karşılaştırıldığında; üç yıllık sağ kalım plevral sitolojisi malign olanlarda %23-39 arasında, plevral sitolojisi benign olanlarda %61-69 arasında değişmektedir. Pozitif plevral sitoloji evre 1 ve evre 2 hastalarda prognostik öneme sahip iken, evre 3A da prognostik önemi yoktur.
Sonuç olarak; bu makalede yazarlar, pozitif plevral lavaj sitolojisine sahip evre 1 ve evre 2 hastaların düşük beş yıllık sağkalım oranına sahip olduğunu bildirmişlerdir.
26 Vazquez M. ve arkadaşları [71], adenokarsinomlarda lepidik patern oranının pozitif prognostik faktör olduğunu bildirmişlerdir. Öte yandan, lenf nodu metastazı içermeyen soliter nodüller ile lenf nodu metastazı içermeyen non-soliter nodüllerin prognozlarının aynı olduğunu tespit etmişlerdir.
KHDAK’larından adenokarsinomlarda, prognoz lepidik paternin oranına göre değişir. Lepidik baskın adenokarsinomlarda, %100 oranında 10 yıllık sağ kalım oranları bildirilmiştir. Lepidik baskın adenokarsinomlar, bilgisayarlı tomografide non-solid nodüller olarak görülür ve 10 yıllık Kaplan-meier sağ kalım analizi skorları çok yüksektir [47].
Makimoto Y ve ark. [72], 2 cm veya altındaki adenokarsinomlarda mikropapiller paternin varlığının sağ kalımı %10 oranında azalttığını bildirmişlerdir.
Miyoshi T ve ark. [73] evre 1 adenokarsinomlarda; mikropapiller komponentin varlığının sağ kalımda, %14 azalma ile ilişkili olduğunu saptamışlardır.
KHDAK’larından olan sarkomatoid karsinomda, olguların çoğu tanı konulduğu sırada 6.-7. dekattadır. Bu tümör, erkeklerde dört kat daha sık görülür [3]. Prognozu tartışmalı olmakla birlikte birçok yayında, diğer KHDAK’larından daha kötü seyirli olduğu belirtilmiştir [74, 75]. Olguların %50’si evre 1’de başvurur ve 5 yıllık sağkalım %20’dir [3].
Bazaloid karsinomların çoğu, oldukça kötü prognozludur. Bunun aksine lenfoepitelyoma benzeri karsinom, diğer KHDAK’larından daha iyi bir prognoza sahiptir. Büyük hücreli nöroendokrin karsinom ve KHAK’nun prognozları arasında ise, belirgin bir fark izlenmemektedir [3].
Adenoskuamöz karsinomda, beş yıllık sağkalım; lokalize hastalık için rezeksiyondan sonra %62,5; rezeke edilebilen diğer olgular için %35’tir [3]. Karsinoid tümörlere bakıldığında ise; atipik karsinoidlerin, tipik karsinoidlerden daha kötü prognoza sahip olduğu görülür. 5 yıllık sağkalım, tipik karsinoidler için % 90-98 iken; atipik karsinoidler için % 61-73’tür [3].
KHAK’unda; hastanın genel durumunun kötü olması, yaygın hastalık varlığı, erkek cinsiyet, artmış serum laktat dehidrogenaz ve alkalen fosfataz
27 düzeyleri ile düşük plazma albümin ve sodyum düzeyleri kötü prognoz ile belirgin ilişkisi olan faktörlerdir [3].
Evre 2 KHDAK’ları için, prognostik faktörlerin araştırıldığı bir çalışmada lenf nodu metastazının en önemli prognostik faktör olduğu bildirilmiştir [76].
Cinsiyet göz önüne alındığında; beş yıllık sağkalım erkeklerde %48,6, kadınlarda %61,8 olarak tespit edilmiştir ve iki cinsiyet arasındaki fark anlamlı bulunmuştur [70]. Yaşa bakıldığında; beş yıllık sağkalım 50 yaş ve altındakilerde %56,6; 50-70 yaş arasında %55,7; 70 yaş ve üzerindekilerde %45,7’dir. 70 yaş ve üzerindeki hastalarda prognoz diğer yaşlara göre daha kötüdür [70].
Sigara içiminin prognoz üzerine etkisini araştıran, sınırlı sayıda çalışma mevcuttur ve çoğunluğunda sigara içimi ile prognoz arasında ilişki saptanmamıştır. Ancak dokuz çalışmada negatif prognostik faktör olarak belirlenmiştir. Cerrahi olarak tedavi edilen evre 1A KHDAK’larını içeren 3000 hastalık bir çalışmada prognostik faktörler araştırılmış ve ileri yaş, kötü performans durumu, erkek cinsiyet ve sigara öyküsü kötü prognostik faktörler olarak bildirilmiştir [77]. Sigara içimi ve uzun dönem sağ kalım arasında ters korelasyon saptanmıştır [77].
Sobue T ve ark. [78] akciğer adenokarsinomları için; opere olan hastalarda 50 paket/yıl ve üzeri sigara içenlerde, hiç içmeyenlere kıyasla 2,38 kez daha yüksek ölüm riski tespit etmişlerdir. Sioris T ve ark. [79] sigara içiminin akciğerin SHK’ları için prognostik önemi olduğunu ancak adenokarsinomlar için olmadığını belirtmişlerdir. Vahakangas KH ve ark [80] ise hiç içmeyenlere kıyasla sigara içenlerde ve sigarayı bırakanlarda p53 mutasyonlarına daha sık rastlandığını belirtmişlerdir.
Birçok geniş epidemiyolojik çalışma, KHDAK’unda sigaradan bağımsız olarak Asya kökeninin olumlu prognostik faktör olduğunu göstermiştir. 1991-2001 yılları arasında tedavi alan 15185 Japon hastanın ve 13332 Amerikan-Kafkas hastanın retrospektif olarak incelendiği yeni bir çalışmada; Japon kökenli olmak, hiç sigara içmemek, genç yaş, kadın cinsiyet, erken evre ve erken tedavi olumlu prognostik faktörler olarak bulunmuştur [81].
Bilindiği üzere plevral boşluğun yaygın tutulumu akciğer kanserlerinde rezeksiyon için kontrendikasyon oluşturan bir durumdur. Son yıllarda yapılan
28 çalışmalar; rezektabl akciğer kanserlerinde intraoperatif plevral lavaj sitolojisinin, etkili bir prognostik faktör olduğu yönündedir.
2.9. EZH 2 İmmünbelirteç
Histonların metilasyon yoluyla post-translasyon modifikasyonu, büyüme ve hücresel yanıt bağlamında biyolojik süreçleri etkilediği bilinen önemli ve yaygın bir kromatin modifikasyon türüdür [82].
Histonların N-terminal kuyrukları; metilasyon, asetilasyon ve fosforilasyon da dahil olmak üzere, kromatin yapılarının çeşitliliğini oluşturan post-translasyon modifikasyonlara hedef olur.
Histon lizin metilasyonu; gen ifadesinin, hücre döngüsünün, genom istikrarının ve nükleer mimarinin düzenlenmesinde kritik bir oyuncudur [83]. En yoğun olarak incelenen histon metilasyon bölgeleri; histon H3 lizin 4 (H3K4), H3K9, H3K27, H3K36, H3K79 ve H4K20’dir [82].
Gelişim, kök hücre bakımı ve farklılaşma ile ilgili birçok gen H3K27 ve H3K4 metilasyonun hedefleridir. Histon; metil değiştiricilerinin ve metil bağlayıcı proteinlerin değiştirilmesi, çeşitli kanserler insidansının artışı ile koreledir [84, 85].
Polikom baskılayıcı kompleks 2'nin (PRC2) çekirdek proteini olan Enhancer of zeste homologue (EZH2), histon h3 lizin 27 (H3K27) baskılayıcı kromatin işaretinin epigenetik bakımında hayati bir rol oynamaktadır.
Gelişen veriler, EZH2'nin meme, beyin, kolon, gastrik, karaciğer ve akciğer kanseri dahil olmak üzere çeşitli insan kanserlerinde aberan olarak eksprese edildiğini ortaya koymuştur.
Kanser hücre dizilerinde in vitro EZH2 aşırı ekspresyonunun, proliferasyon, migrasyon ve invazyon yeteneklerini aktive ettiği gösterilmiştir. Aksine, EZH2'nin siRNA veya shRNA kullanılarak baskılanması, hücre büyümesinin inhibisyonu ve onkojenik kapasitenin süpresyonu ile sonuçlanır [86].
29 Kanserde EZH2 regülasyonunun altında yatan mekanizmalar belirsizdir. EZH2'nin diğer PRC2 bileşenleri ile birlikte çalıştığı ve daha sonra H3K27'yi katalize ettiği veya DNA metil transferazlarla etkileştiği düşünülmektedir.
Hücre döngüsü, farklılaşma, yaşlanma ve kanser gibi birçok sürece dahil olduğu bildirilmiştir [86-88].
Birçok çalışma, EZH2 ekspresyonunun bazı kanserlerde anlamlı prognostik rol oynayabileceğini öne sürmektedir. Bununla birlikte, EZH2 ekspresyonunun etkisini inceleyen çoğu çalışma, küçük örneklem içeriği nedeni ile sınırlıdır.
2.10. CD10 İmmünbelirteç
CD10 / nötr endopeptidaz 24.11 (NEP) çeşitli normal dokularda, çeşitli malignitelerin epitelyal, stromal ya da her iki komponentinde, geniş oranda eksprese olan hücre yüzeyel çinko bağımlı 90-110 kDa metalopeptidazdır [89-95].
Normal dokulardaki homeostazın korunmasında, doğal olarak bulunan çok sayıda biyoaktif peptidin hidrolize edilmesi ve peptit hormonlarına verilen tepkilerin düzenlenmesini sağlayarak önemli bir rol oynar [96]. Tümör progresyonundaki rolü, eksprese edildiği hücre kompartmanına ve tümör türüne göre değişiklik göstermektedir.
Çelişkili sonuçlar yayınlanmış olmasına rağmen, tümör hücrelerinde CD10 ekspresyonunun kaybedilmesi veya azalmasının, böbrek kanseri, invaziv mesane kanseri, iyi diferansiye mide kanseri, prostat kanseri, KHAK ve KHDAK dahil olmak üzere pek çok malignitenin gelişimine veya ilerlemesine katkıda bulunduğu gösterilmiştir [97-100].
Tümör hücresi CD10 ekspresyonunun tümör davranışı üzerine önerilen etkisinin aksine birçok çalışma, melanom, kolorektal karsinom, iyi diferansiye mide kanseri, nazofarenksin skuamöz hücreli karsinomları, kutanöz bazal hücre karsinomu ve meme kanseri gibi çeşitli kanserlerdeki tümör ilerlemesiyle stromal hücre CD10 ekspresyonu arasında belirgin bir korelasyon olduğunu göstermiştir [101-106].
30
3. GEREÇ VE YÖNTEM
Ege Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı’nda 2012 ve 2015 yılları arasında akciğer adenokarsinomu tanısı almış ve Ege Üniversitesi Torasik Onkoloji Konseyi tarafından takip edilen 134 olgu retrospektif olarak yeniden değerlendirildi. Bu olgulardan konsültasyon olduğu için arşivimizde bloğu olmayan ya da sadece tru-cut biyopsi gönderilmiş, eksizyon materyali olmayan 23 olgu, tümör dokusu küçük olup ileri moleküler incelemeler için ayrılan 31 olgu çalışma dışı bırakılarak 80 olgu çalışmaya dahil edildi.
Olguların genel bilgileri, izlem süreleri ve hastalığın sonuçları ile ilişkili bilgiler, Ege Üniversitesi Tıp Fakültesi Hastanesi kayıtları yanı sıra, konsey kayıtlarından ve Kanser İzlem ve Denetim Merkezi (KİDEM) verilerinden sağlandı. Olguların makroskobik verilerine Ege Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı arşiv kayıtlarından ulaşıldı.
Tümörün histolojik tipi ve derecesi için 2015 DSÖ ve 8. versiyon TNM sınıflaması temel alındı. Histolojik tip baskın olan paterne göre adlandırıldı ve %5 üzerinde izlenen diğer paternler kaydedildi. Ana paternler olarak lepidik, asiner, solid, papiller, mikropapiller ve müsinöz adenokarsinom kullanıldı.
Lenfovasküler invazyon varlığı hematoksilen eozin kesitlerde damar veya lenfatik içi tümör trombüslerinin izlenmesi ile değerlendirildi. Nekroz izlenen vakalarda tüm tümör alanına nekrotik alanın oranı temel alındı. Hava boşlukları boyunca yayılım için tümör komşuluğunda ya da olağan parankim içerisinde çevresi olağan alveoler ya da bronşiolar yapı ile çevrelenmiş tümör hücrelerinin varlığı değerlendirildi.
Desmoplazi değerlendirmesi için tümör içerisinde ya da komşuluğunda izlenen stromal reaksiyonlar incelendi ve bulunmaması “0”, ince kollajen bantlar “1+”, kalın kollajen bantlar ya da düz kas kümelerinin varlığı “2+” olarak değerlendirildi. Yine tümör hücrelerini çevreleyen lenfoid infiltrasyonun varlığı; hiç yok “0”, tümör alanının %50’sinden azında var “1+”, %50’den fazlasında var
31 “2+” olarak değerlendirildi. Plevra invazyonu tümör hücrelerinin elastik tabakayı geçip geçmemesi ile değerlendirildi. Paryetal plevra invazyonu hiçbir vakada izlenmediği için ayrıca skorlanmadı.
Her hastaya ait ameliyat materyali 12-24 saat %10’luk nötral formalin tespiti ve rutin doku takibinden sonra 4-5 mikrometre kalınlığında kesitler alınarak hematoksilen eozin ile boyandı. Olgulara ait hematoksilen eosen boyalı preparatlar arşivden çıkarılarak yeniden değerlendirildi. Seçilen uygun preparatlara ait formalin ile tespitli parafine gömülü bloklardan hematoksilen eozin boyaması için bir adet, immünohistokimyasal yöntemle EZH2 ve CD10 çalışılmak üzere yapılan iki adet, 5 mikron kalınlığındaki seri kesitler pozitif şarjlı lam üzerine alındı. Kesitlerde İHK incelemede, EZH2 (klon 6A10, dilüsyon 1/200, Leica) ve CD10 (klon 56C6, 1/100, Novacastra) primer antikorları araştırıldı. İHK boyama sistemi olarak biyotinsiz, HRP multimer bazlı, hidrojen peroksit substrat ve 3, 3’ – diaminobenzidin tetrahidroklorit (DAB) kromojeni içeren (Bond™ Polymer Refine Detection Catalog No: DS9800, Leica Biosystems Newcastle Ltd, United Kingdom) ile tam otomatik immünohistokimya boyama cihazı (Leica BOND-III Leica Biosystems Newcastle Ltd, United Kingdom) kullanıldı.
Doku kesitleri elektrostatik yüklü lamlara (Superfrost™ Ultra Plus, Thermo Fisher Scientific, Waltham, MA USA)alındı ve 60°C’da en az iki saat kurutuldu. Deparafinizasyon ve antijen açığa çıkarma işlemleri de dahil olmak üzere tüm İHK boyama süreci BOND-III tam otomatik immünohistokimya boyama cihazında gerçekleştirildi. Cihazda zıt boyaması hematoksilen ve mavileştirici solüsyon ile tamamlanan kesitlerin dehidratasyonu, ksilen ile şeffaflandırılması ve lamel kapatılması aşamaları elde yapılarak işlem sonlandırıldı.
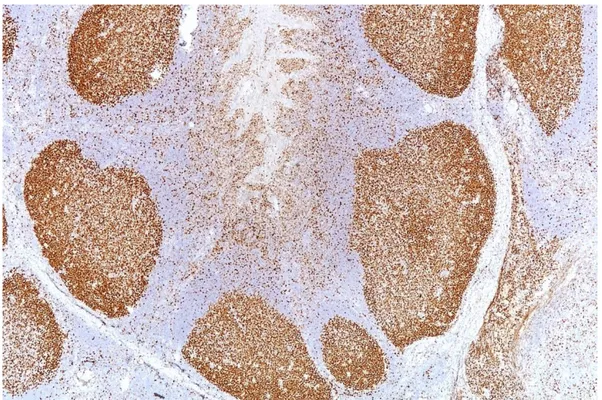
İnternal pozitif kontrol olarak EZH2 için germinal merkezli lenfoid hücre toplulukları CD10 için yangı hücreleri kullanıldı.
Pozitif kontrol örnekleri olarak hem EZH2 hem de CD10 için tonsil dokusu seçildi.
32 ġekil 8: Pozitif kontrol olarak kullanılan tonsil dokusunda EZH2 boyanması (EZH2 x4).
ġekil 9: Pozitif kontrol olarak kullanılan tonsil dokusunda CD10 boyanması (CD10 x4).
Pozitif kontrol için seçilen ancak primer antikorun damlatılmadığı örnekler ise negatif kontrol olarak kabul edildi.