T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ HASTANESİ PLASTİK CERRAHİ ANABİLİMDALI
DENEYSEL SIÇAN YANIK MODELİNDE EPİDERMAL GROWTH FAKTÖR(EGF) VE PLATELETTEN ZENGİN PLAZMA’NIN(PRP) ETKİSİ
Dr. Abdulkadir CALAVUL
UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ HASTANESİ PLASTİK CERRAHİ ANABİLİMDALI
DENEYSEL SIÇAN YANIK MODELİNDE EPİDERMAL GROWTH FAKTÖR(EGF) VE PLATELETTEN ZENGİN PLAZMA’NIN(PRP) ETKİSİ
Dr. Abdulkadir CALAVUL
UZMANLIK TEZİ
Tez Danışmanı
Yrd. Doç. Dr. Serkan ERBATUR
DİYARBAKIR, 2017
ÖNSÖZ
“DENEYSEL SIÇAN YANIK MODELİNDE EPİDERMAL GROWTH FAKTÖR(EGF) VE PLATELETTEN ZENGİN PLAZMA’NIN(PRP) ETKİSİ” adlı uzmanlık tezi Dicle Üniversitesi Tıp Fakültesi Plastik Rekonstruktif ve Estetik Cerrahi Anabilim Dalı Başkanlığı tarafından verilmiş, 10.06.2015 tarih ve 2015/21 sayı ile etik kurul onayı alınıp çalışmaya başlanmıştır.
Uzmanlık eğitimim boyunca ve bu çalışmanın gerçekleştirilmesinde destek ve yardımlarını gördüğüm ve tez danışmanım Yrd. Doç. Dr Serkan Erbatur hocama, Anabilim Dalı Başkanımız Doç. Dr. Caferi Tayyar Selçuk hocama, Yrd. Doç. Dr. Burhan Özalp hocama Yrd. Doç. Dr. Hüseyin Elbey hocama, Yrd. Doç. Dr. Mustafa Durgun hocama, çalışmamın histopatolojik değerlendirilmesinde büyük katkısı olan Prof. Dr. Engin Deveci hocama ve klinikte birlikte çalıştığım arkadaşlarıma saygı ve sevgilerimi sunarım.
ÖZET
Abdulkadir CALAVUL
DENEYSEL SIÇAN YANIK MODELİNDE EPİDERMAL GROWTH FAKTÖR(EGF) VE PLATELETTEN ZENGİN PLAZMA’NIN(PRP) ETKİSİ
Dicle Üniversitesi Tıp Fakültesi Hastanesi Plastik Cerrahi Anabilim Dalı Uzmanlık Tezi
Diyarbakır, 2017
Giriş ve amaç: Günümüzde yanık yarasının erken iyileşmesi için çeşitli yöntemlerle
ilaçlar denenmektedir. Ancak yanık iyileşmesinde halen istenen etkiyi gösteren ilaç bulunmamaktadır. Bu amaçla plateletten zengin plazma ve büyüme faktörleri yara iyileşmesini arttırıcı ve yenileyici özelliklerinden dolayı tıbbın tüm alanlarında kullanılmaktadır. Bu deneysel çalışma plateletten zengin plazma(PRP) ve epidermal büyüme faktörü( EGF) ‘nün yanık yarası üzerine olan etkilerini araştırmak amacıyla yapılmıştır.
Gereç ve yöntem: Dicle Üniversitesi Tıp Fakültesi Hastanesi Plastik Cerrahi
Anabilim Dalı’nda yapılan bu çalışmada, genel anestezi altında 350-450 gr ağırlığında 12-16 haftalık 48 adet Spraque-Dawley türü erkek rat kullanıldı. PRP elde etmek için 8 adet rat kullanıldı. Kalan 40 rat randomizasyon listesine göre her grupta 10 rat olmak üzere 4 grup oluşturulduktan sonra sırtlarında 2*1 cm boyutunda 4 adet dişi olan tarak şeklindeki metal plaka ile tam kat yanık oluşturuldu. 1. grupta yer alan ratlar kontrol grubu olup her hangi bir uygulama yapılmadı. 2. grupta yer alan ratların sırtlarında oluşturulan yanık alanına sadece EGF uygulaması, 3. grupta yer alan ratların sırtlarında oluşturulan yanık alanına EGF + PRP, 4. grupta yer alan ratların sırtlarında oluşturulan yanık alanına ise sadece PRP uygulandı. EGF 75 µg/gün ve PRP yaklaşık 1,000,000 platelet/µl olacak şekilde intralezyonel ve perilezyonel enjeksiyon ile 0, 3, 7 ve 14. günlerde uygulandı. 21. günde ratlar sakrifiye edildi. 0, 3, 7, 14 ve 21. günlerde deneysel oluşturulan yanık alanlarından alınan örnekler formalin solüsyonuna aktarıldı. Gruplardan elde edilen preparatlar histopatolojik olarak incelendikten sonra istatistiki verilerle yorumlanıp karşılaştırıldı.
Bulgular: Çalışma sonucunda plateletten zengin plazma uygulaması ile yara
iyileşmesinin epidermis rejenerasyonu, granülayon, inflamasyon ve kıl folikül rejenerasyonu fazları arasında anlamlı ilişki bulunmuştur. Epidermal büyüme faktörü uygulaması ile yara iyileşmesinin epidermis rejenerasyonu, granülayon, inflamasyon ve kıl folikül rejenerasyonu fazları arasında anlamlı ilişki bulunmuştur. epidermal büyüme faktörü + plateletten zengin plazma kombine uygulaması ile yara iyileşmesinin epidermis rejenerasyonu, granülayon, inflamasyon ve kıl folikül rejenerasyonu fazları arasında anlamlı ilişki bulunmuştur. Epidermis rejenerasyonu açısından Grup 1, 3 ve 4’ün 7. 14. ve 21. günleri arasında istatiksel olarak anlamlı fark çıkmıştır. Granülasyon açısından Grup 1, 2 ve 3’ün 7. 14. ve 21. günleri arasında istatiksel olarak anlamlı fark çıkmıştır. İnflamasyon açısından Grup 1, 2 ve 4’ün 7. 14. ve 21. Günleri arasında istatiksel olarak anlamlı fark çıkmıştır. Kıl folikül rejenerasyonu açısından Grup 2, 3 ve 4’ün 7. 14. ve 21. günleri arasında istatiksel olarak anlamlı fark çıkmıştır.
Sonuç: Üçüncü derece yanık oluşturulan ratlarda intralezyonel ve perilezyonel
enjeksiyon yöntemiyle uygulana plateletten zengin plazma ve epidermal büyüme faktörünün yara iyileşmesi üzerine olumlu etkilerinin olduğu ve yara iyileşmesini hızlandırdığı sonucuna varılmıştır.
ABSTRACT Abdulkadir CALAVUL
MedicineThesis
Introduction: Today, many drugs are being studied for faster healing of burn
wounds. However, no such drug exists with the desired rapid healing process. For this purpose, platelet rich plasma and growth factors are used in all fields of medicine due to their accelerated wound healing and renewing effects. In this experimental study platelet-rich plasma(PRP) and epidermal growth factor ( EGF) ‘s burn wounds was conducted to investigate the effects on.
Materials and methods: Dicle University Medical Faculty Hospital Department of
Plastic Surgery Department, performed in this study, weighing 350-450 g under general anesthesia 12-16 weeks 48 male Sprague-Dawley rats were used. 8 rats were used to obtain PRP. Remaining 40 rats distributed into four groups, 10 rats each and full thickness burn created on their backs with a metal plate having four ledges with 2x1 cm dimensions. Rats in Group 1 was control group and no procedure was done. EGF was applied to the burn areas on the back of the rats in Group 2. EGF + PRP applied to the burn areas on the back of the rats in Group 3. Only PRP applied to the burn areas on the back of the rats in Group 4. EGF was injected 75 µg/day and PRP with 1,000,000 platelets/mL concentration was injected intralesional and perilesional on days 0, 3, 7, and 14. On day 21 the rats were sacrificed. On days 0, 3, 7, 14 and 21 samples were obtained from experimentally created burn area and put into formol solution. After histopathologic examination of obtained samples, statistical study was made and necessary comparisons were done.
Results: Significant relation was found between platelet rich plasma application and
epidermal regeneration, granulation, inflamation, and hair follicle regeneration phases of wound healing. Significant relation was found between epidermal growth factor application and epidermal regeneration, granulation, inflamation, and hair follicle regeneration phases of wound healing. Significant relation was found between both epidermal growth factor and platelet rich plasma application and
epidermal regeneration, granulation, inflamation, and hair follicle regeneration phases of wound healing. In terms of epidermal regeneration there were statistically significant difference between days 7, 14, and 21 of Groups 1, 3, and 4. In terms of granulation there were statistically significant difference between days 7, 14, and 21 of Groups 1, 2, and 3. In terms of inflammation there were statistically significant difference between days 7, 14, and 21 of Groups 1, 2, and 4. In terms of hair follicle regeneration there were statistically significant difference between days 7, 14, and 21 of Groups 2, 3, and 4.
Conclusion: Intralesional and perilesional injection of platelet rich plasma and
epidermal growth factor in rats with third degree burn model has been concluded to have positive effects on wound healing and accelerate wound healing.
İÇİNDEKİLER ÖNSÖZ ii ÖZET iii ABSTRACT v İÇİNDEKİLER vii TABLO LİSTESİ ix
ŞEKİLLER VE RESİMLER LİSTESİ x
KISALTMALAR LİSTESİ xii
1. GİRİŞ VE AMAÇ 1
2. GENEL BİLGİLER 3
2.1.Termal Yanığın Fizyopatolojisi 3
2.1.1. Yanıkta İlk Yardım 5
2.1.1.1. Kaza bölgesinde yapılacak işlemler 5
2.1.1.2. Birinci basamak sağlık kurulusunda yapılacak işlemler 6
2.2. Yanık yarasının derinliğinin belirlenmesi 7
2.2.1. Birinci derece yanık 7
2.2.2.İkinci derece yanık 8
2.2.3.Üçüncü derece yanık 8
2.2.4.Dördüncü derece yanık 8
2.3.Yanık yüzdesinin hesaplanması 9
2.3.1. Yanık yara bakımı 11
2.3.2. Yaranın temizlenmesi 11
2.3.3. Yara pansumanı 12
2.3.4. Yanık alanının elevasyonu 14
2.3.5. Yara kapatılması 14
2.4.1. Hemostaz Evresi 17
2.4.2. İnflamasyon Evresi 18
2.4.3. Proliferasyon Evresi 18
2.4.4. Maturasyon Evresi 19
2.5. Epidermal Büyüme Faktörü (EGF) 19
2.5.1. EGF’nin Biyokimyasal Özellikleri 20
2.5.2. EGF Reseptörleri 20
2.5.3. EGF’nin Biyolojik Özellikleri 21
2.5.4. EGF’nin Yara İyileşmesindeki Yeri 22
2.6 Plateletten Zengin Plazma (PRP) 24
2.6.1. PRP Etki Mekanizması 28 2.6.2. PRP Kullanımının Avantajları 29 2.6.3. PRP Kontrendikasyonları 29 3. GEREÇ VE YÖNTEM 30 3.1. Hayvan Temini 30 3.2. Bakım 30 3.3. Cerrahi Hazırlık 30 3.4.PRP Hazırlanması 31
3.5.Epidermal Growth Faktör(EGF) Temini 35
3.6. Yanık modeli 35
3.7.Gruplar 37
3.8. Histopatolojik inceleme 38
3.9. Veri Analizi – İstatistiksel Yöntemler 54
4. BULGULAR 55
5. TARTIŞMA 69
6. SONUÇ 75
TABLOLAR LİSTESİ
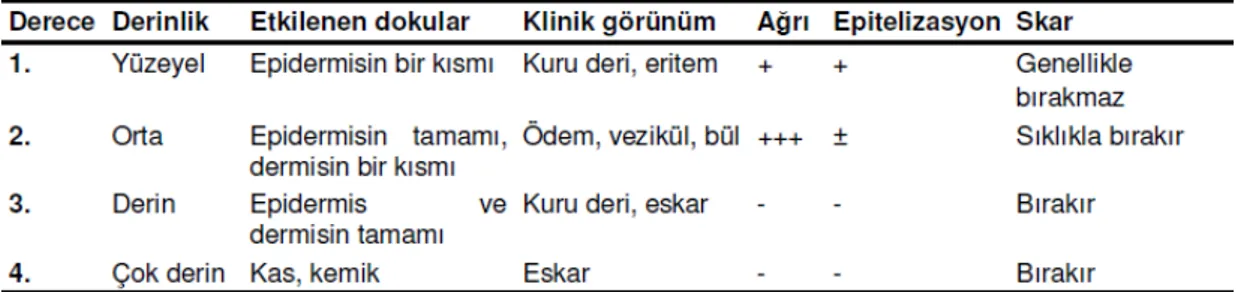
Tablo 1. Yanıkların derinliğine göre sınıflandırılması ve özellikleri
Tablo 2. Lund-Browder metoduna göre, pediatrik yaş grubundaki yanık yüzey
alanı oranları (%)
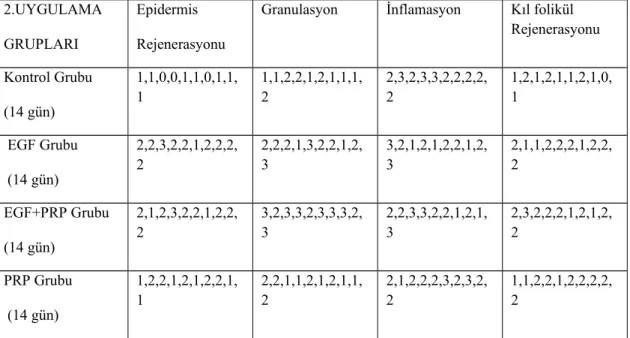
Tablo 3: 1.uygulama grupları histopatolojik skorları Tablo 4: 2.uygulama grupları histopatolojik skorları Tablo 5: 3.uygulama grupları histopatolojik skorları
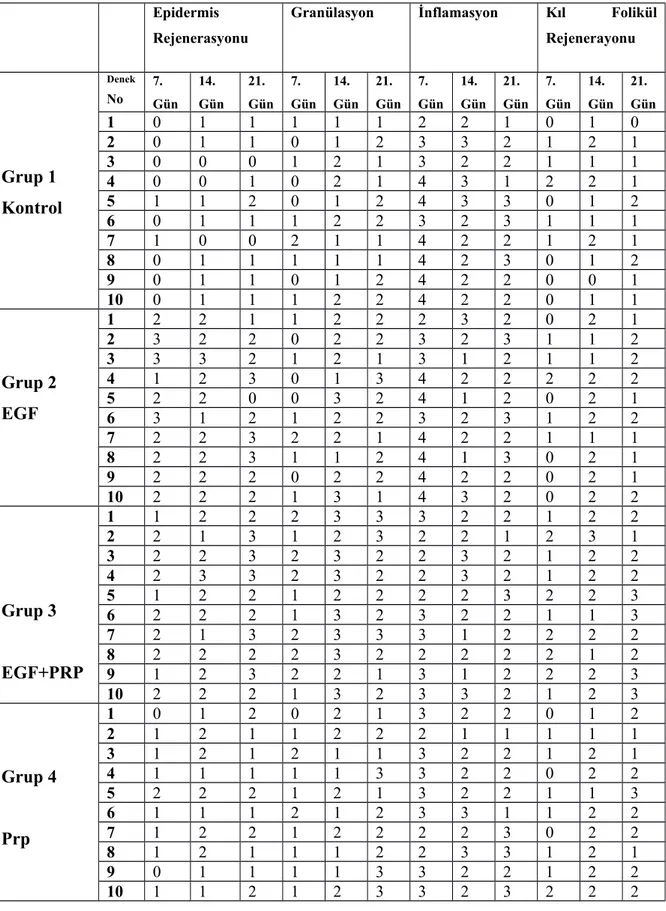
Tablo 6. Grupların Günlere Göre Histopatolojik Skorlarının Dağılımı,
Diyarbakır, 2017.
Tablo 7. Her Bir Grubun 7. 14. ve 21. Gündeki Histopatolojik Skorlarının
Aynı Anda Çoklu Karşılaştırılması, Diyarbakır, 2017.
Tablo 8. Her Bir Grup İçerisinde İzlem Zamanları Arasında Histopatolojik
Skorları Açısından Yapılan Çoklu Karşılaştırma Sonuçları (Wilcoxon işaret testi), Diyarbakır, 2017
Tablo 9. Epidermis Rejenerasyonu Açısından 7. 14. Ve 21. Günde Grupların
Çoklu Olarak Karşılaştırılması, Diyarbakır, 2017.
Tablo 10. Granülasyon Açısından 7. 14. Ve 21 Günde Grupların Çoklu Olarak
Karşılaştırılması, Diyarbakır, 2017.
Tablo 11. İnflamasyon Açısından 7. 14. Ve 21. Günde Grupların Çoklu Olarak
Karşılaştırılması Diyarbakır 2017.
Tablo 12. Kıl Folikül Rejenerasyonu Açısından 7. 14. Ve 21. Günde Grupların
ŞEKİLLER ve RESİMLER LİSTESİ
Şekil 1: Yanıklı olgularda ilk yardım tedavisi
Şekil 2: Lund-Browder metoduna göre, erişkin yaş grubundaki yanık yüzey
alanı oranları
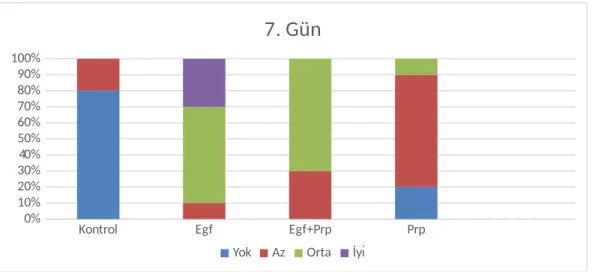
Şekil 3: 7. Günde Histopatolojik Skorlara Göre Grupların Dağılımı,
Diyarbakır, 2017.
Şekil 4: 14. Günde Histopatolojik Skorlara Göre Grupların Dağılımı,
Diyarbakır, 2017.
Şekil 5: 21. Günde Histopatolojik Skorlara Göre Grupların Dağılımı,
Diyarbakır, 2017.
Resim 1: Cerrahiye hazır sırtı tıraş edilmiş rat Resim 2: Rattan intrakardiak kan alımı
Resim 3: PRP için alınan kanın antikoagülan içeren tüpe aktarılması
Resim 4: PRP elde etmek için santrifüj edilmeye hazır yaklaşık 7 cc kan örneği Resim 5: Kanların santrifüj cihazına yerleştirilmesi
Resim 6: Santrifüj sonrası elde edilen 4,5 cc lik PRP Resim 7: Epidermal growth faktör flakonu
Resim 8: Yanık modeli oluşturma Resim 9: 3.derece yanık modeli Resim 10: EGF uygulanması
Resim 11: EGF ve PRP uygulanması Resim 12: PRP uygulanması
Resim 13: 1.Uygulama, Yanık oluşturulan kontrol grubu Resim 14: 1.Uygulama, EGF grubu
Resim 16: 1.Uygulama, PRP grubu
Resim 17: 2. Uygulama, Yanık oluşturulan kontrol grubu Resim 18: 2. Uygulama, EGF grubu
Resim 19: 2.Uygulama, EGF+PRP grubu Resim 20: 2.Uygulama, EGF+PRP grubu Resim 21: 2.Uygulama, PRP grubu
Resim 22: 3.Uygulama, Yanık oluşturulan Kontrol grubu Resim 23: 3.Uygulama, EGF grubu
Resim 24: 3.Uygulama, EGF+PRP grubu Resim 25: 3.Uygulama, PRP grubu
KISALTMA VE SİMGELER
ATP: Adenozin trifosfat
PRP: Plateletten zengin plazma (PRP)
EGF: Epidermal büyüme faktörü
FGF: Fibroblast büyüme faktörü
H-E: Hematoksilen-eozin
IL-1:İnterlökin-1
IGF: İnsülin benzeri büyüme faktörü
NO: Nitrik oksit
PDGF: Trombosit kaynaklı büyüme faktörü
PMNL: Polimorfonükleer lökosit
PTZ: Protrombin zamanı
TFP: Trombosit fakir plazma
TGF-α:Transforme edici büyüme faktörü-α
TGF-β:Transforme edici büyüme faktörü-β
TZP: Trombosit zengin plazma
1. GİRİŞ ve AMAÇ
Yanık her bireyin karşılaşabileceği en ağır travmalardan biridir. Tedavisinin uzun sürmesi ve sonradan üzerine eklenen sekonder enfeksiyonlar nedeniyle morbidite ve mortalitesi çok yüksektir. Yanık alanın erken dönemde debridmanı ve greftlenmesi gibi tedavilerle oldukça başarılı sonuçlar alınmaktadır. Fakat hastanın genel durumunun iyi olmamasından dolayı ameliyatın yapılamaması, greft elde etmek için yeterli miktarda sağlam cilt bulunmaması gibi çeşitli sebeplerle erken greftlemenin yapılamadığı durumlarda farklı tedaviler kullanılmaktadır. Özellikle geniş yanıklı hastalarda yaranın daha erken iyileşmesi için çeşitli ürünlerin kullanımı hastanın sağkalımını etkileyebilmekte ve enfeksiyöz komplikasyonları azaltabilmektedir. Bu amaçla yara bakım materyalleri ve yapay deriler üretilmekte ve kullanılmaktadır. Ancak bu ürünler çok pahalı ve ülkemizde pek bulunmamaktadır. Bu alandaki çalışmalar gelecek için umut vaad etmekte olup yeni çözümler araştırılmaktadır. Ancak yanık iyileşmesinde istenen etkiyi gösteren ilaç halen bulunmamaktadır. Bu amaçla plateletten zengin plazma ve büyüme faktörleri yara iyileşmesini arttırıcı ve yenileyici özelliklerinden dolayı tıbbın tüm alanlarında kullanılmaktadır.
Epidermal Büyüme Faktörü birçok memeli türünün değişik doku ve vücut sıvılarıda bulunan, 53 aminoasitten oluşmuş mitojenik bir polipeptitdir. Subkutan yolla enjekte edildiğinde 48 aminoasitli şekle dönüşmekte ve etken hale gelmektedir. EGF özellikle keratinosit ve fibroblast gibi hem mezodermal hem de ektodermal orijinli hücreler üzerinde proliferatif etkiye sahiptir. EGF granülasyon dokusu, kollajen ve glikozaminoglikan düzeyini arttırır, sonuçta epitelizasyon hızlanır ve yara gerilim kuvveti artar. EGF' nin içinde bol miktarda bulunduğu submandibuler tükürük bezi ekstreleri yara iyileşmesini hızlandırıcı etki göstermektedir. EGF‟nin bilinen en önemli etkisi, yara iyileşmesini hızlandırmasıdır. Yara iyileşmesini, proteinlerin üretimini ve epitel hücrelerin migrasyonunu uyararak hızlandırdığı bilinmektedir. EGF' nin yara iyileşmesindeki etkisi, inflamatuvar safha, fibroblastik safha ve remodelling safhası olmak üzere üç süreçten geçmektedir. Mitojenik bir polipeptid olan EGF, yara iyileşmesine inflamasyon fazının bitiminde etki etmeye
başlamakta ve fibroblastik oluşumunu indüklediği ve bunun yanı sıra granülasyon dokusunun oluşumu ve epitelizasyonu uyardığı bilinmektedir.
Plateletten zengin plazma (PRP) yara iyileşmesini arttırıcı ve yenileyici özelliğinden dolayı tıbbın tüm alanlarında kullanılan doğal fibrin kaynaklı bir biomateryaldir. Yerleştirildiği bölgede mikrovaskülarizasyon ve epitelyum hücre göçünü sağlar. Bu sayede açık yaralarda yara iyileştirmesini hızlandırır. Plateletten zengin plazma(PRP), tetra moleküler yapısı ile endotelyal hücreler ve fibrablastlar için matriks oluşturur. Anjiogenezisi hızlandırır ve fibrinin kolay remodelasyonunu sağlar. PRP sadece basit bir fibrin yapı değil aynı zamanda iyileşmeyi sağlayan tüm molekülleri ve hücresel elemanları içeriğinde bulunduran bir matrikstir.
Yapılan bu deneysel çalışmada plateletten zengin plazma(PRP) ve epidermal büyüme faktörü( EGF) ‘nün yanık yarası üzerine olan etkilerinin araştırılması amaçlandı.
2. GENEL BİLGİLER
2.1. Termal Yanığın Fizyopatolojisi
Deri vücudumuzun en büyük organlarından biri olup vücut ağırlığının yaklaşık %16’sını oluşturur. Yüzölçümü itibarıyla da deri yetişkin bir insanda yaklaşık 1,5-2 metrekare arasında bir sahayı kaplar. Derinin yaşamsal fonksiyonları; termal regülasyon, sıvı kaybına karşı koruma ve enfeksiyöz ajanlara karşı bariyer görevidir. Yanık yaralanması sonüçunda derinin bu üç temel fonksiyonu bozulur (1).
Yanık, dokunun kendi ısısından daha sıcak veya soğukla, kimyasal madde, elektrik akımı veya radyoaktif ışınlarla teması sonucu ortaya çıkan bir yaralanma çeşididir. Yanık, toplumun büyük bir kısmının hayatı boyunca en az bir kez karşılaşabileceği bir travmadır. Büyük ve komplike yanık şok, enfeksiyon ve bunlara bağlı çoklu organ yetmezliği sonucu hayatı tehdit eder hale gelebilirken, küçük yanıklar çeşitli derecede fonksiyon kayıpları oluşturarak yaşam kalitesini etkileyebilir.
ABD’de her yıl 1.25 milyon yanık olgusu hastaneye başvurmakta ve bu olguların 50.000 kadarı yatırılarak tedavi edilmektedir (2). Bu olguların 1 milyon kadarını da çocuk yaş grubundaki olgular oluşturmakta ve bunların % 6’sı hospitalize edilmektedir (3). Yanık yaralanmasına bağlı mortalite oranları, bu konudaki bakım ve tedavi olanaklarının gelişmesine paralel olarak azalma göstermektedir (4). Literatür verileri incelendiğinde, gelişmiş yanık merkezlerinde yatırılarak tedavi edilen major yanıklı olgularda mortalite oranlarının giderek düştüğü (ortalama %5.6) gözlenmektedir (5). Türkiye’de bu oranın % 7.5 oranında olduğu bildirilmektedir (6). Ancak yine de dünya genelinde yapılan istatistiksel çalışmalarda yanık travmasına bağlı olarak yılda 265.000 ölüm gerçekleştiği belirtilmektedir (4). ABD’de major yanıklı bir olgunun tedavi maliyeti 200.000 $ civarındadır. Tüm yanık olgularının
toplam yıllık tedavi maliyeti ise 18 milyar doları bulmaktadır (3). Fatal yanıkların % 90’ından fazlası, Güneydoğu Asya gibi gelişmekte olan gelişmemiş ülkelerde karsımıza çıkmaktadır (4).
Bugünkü bilgilerimize göre yanığın sadece deriyi etkileyen lokalize bir olay olmadığı anlaşılmıştır. Yanık, tüm organizmayı etkileyen ve oluşturduğu fizyopatoloji ile prognozu belirleyen çok kapsamlı bir travmadır. Yanıkta neden ne olursa olsun, meydana gelen doku harabiyeti; hücre proteinlerinin denatürasyonu ile karakterize olup, yanık alanının genişliği ve yanığı oluşturan etkenin devamlılığına bağlı olarak artış göstermektedir (7). Bununla birlikte, yanık tedavisinde uygulanması gereken yaklaşımlar kompleks prosedürler içermektedir (8-10).
Yanık yarasındaki fizyopatolojik değişiklikler bir alana düşen ısının neden olduğu etkiler ve bunların üzerine binen belirgin bir akut iltihabi süreç ile karakterize edilir. Termal yanığa bağlı doku hasarının esası, hücresel düzeyde sitoplâzma ve hücre zarında protein denatürasyonu ile mikrovasküler hasara bağlı iskemik zedelenmedir. Yanık sonrası ortaya çıkan doku harabiyeti lökosit ve endotel hücrelerinden salınan sitokinler aracılığıyla hem lokal hem de sistemik enflamatuar yanıta neden olur. Özellikle ağır yanık olgularında dokularda ve dolaşımdaki lökositlerin giderek artması ve sitokinler aracılığıyla lökositlerden kontrolsüz bir şekilde serbest oksijen radikallerinin salınması sistemik enflamatuar yanıt sendromuna yol açar. Bu tablo organizmanın kendi hücrelerini de tahrip eden katabolik ve immünosupresif bir süreç olup morbidite ve morbiditeyi etkileyen en önemli faktördür (1).
Isının aniden artması ile yanık bölgesinde histamin, bradikinin, tromboksan, proteolitik enzimler, serbest oksijen radikalleri ve sitokinler salgılanarak lokal olarak vazodilatasyon ve kapiller permeabilite artışı sonüçu ödem oluşur. Eğer geniş bir yanık sözkonusu ise bu etkiler sadece lokal olarak kalmaz ve tüm vücuttaki kapiller damarların geçirgenliğindeki artış sonüçu yanık şoku olarak bilinen aşırı sıvı kaybına bağlı hipovolemik şok gelişir. Bu ilk sistemik yanıt sonrası hipermetabolik yanıt ortaya çıkar ve katabolizma belirgin olarak artar. Bazal metabolizma hızında artış,
bazal vücut ısısında artış, hiperdinamik dolaşım, substrat kullanımında yetersizlik, lipoliz, vücut kas kitlesinde erime ve yara iyileşmesinde gecikme ile karakterize olan bu süreç hücresel fonksiyonları bozar ve enfeksiyon riskini artırır. Ağır yanıklardaki mortalite ve morbiditenin önemli bir kısmından bu süreç sorumludur. Yine major bir yanık sonrası hem humoral hem de hücresel savunma mekanizmalarında baskılanma sonucu enfeksiyonlara yatkınlığa sebep olan immünsupresyon tablosu ortaya çıkmaktadır (1).
Sonuçta termal hasara bağlı ölümlerin başlıca sebebi yukarıda saydığımız fizyopatolojik nedenlerden ötürü enfeksiyonlardır. Bu süreci önlemek için canlılığını kaybetmiş yanık dokusunun hızla temizlenmesi, etkin nutrisyonel destek sağlanması ve devamlılığı bozulmuş derinin hızlı bir şekilde iyileştirilmesi veya yara örtüm materyali/yapay derilerle kapatılması gerekir.
2.1.1. Yanıkta İlk Yardım
Yanıkta uygulanacak olan ilk yardım iki aşamada gerçekleştirilebilir; 1. Yanığın meydana geldiği kaza bölgesinde yapılacak işlemler.
2. Yanık travmasına uğrayan kimselerin ilgili tedavi ünitelerine ulaştırılmalarından sonra yapılacak işlemler (10).
2.1.1.1. Kaza bölgesinde yapılacak işlemler:
Yanan bir hastaya olay yerinde yapılacak ilk yardım, yanığın genişliğini hatta küçük bile olsa gelişebilecek komplikasyonları azaltması açısından çok önemlidir. Bunun için sistematik bir yaklaşım gereklidir (Şekil 1). Doğal olarak yapılması gereken ilk girişim, hastanın yakıcı etkenden uzaklaştırılması ve soğutmadır. Bunu yaparken kurtaran kişinin yanmamaya dikkat etmesi gereklidir. Elbisesi yanan kişinin koşmasına izin verilmemeli, kişi yere yatırılarak üzeri battaniyeler ile örtülmelidir. Yanan kıyafetler çıkarılırken, ödem ile birlikte turnike benzeri etkiler yapabilecek olan yüzük, saat ve bilezik gibi takılar da çıkarılmalıdır. Soğutma işlemi yakıcı ajandan uzaklaştırdıktan hemen sonra başlatılmalı ve soğuk su ile
yapılmalıdır. Bu işlem hem ödemin hem de ağrının azaltılmasında faydalıdır. Kimyasal ajanlarla oluşan yanıklarda yanık alanı bol su ile yıkanmalıdır (11).
Şekil 1. Yanıklı olgularda ilk yardım tedavisi
Yanıklı hastanın ilk saatleri hayati öneme sahiptir. Bu nedenle hastanın ilk başvuracağı sağlık kurulusunun bilinmesi gereklidir. Küçük yanıklarda herhangi bir sağlık kurulusunda hastanın tedavisi mümkünken, büyük yanıklarda hasta yanık tedavisinin yapılacağı merkeze gönderilmelidir. Hastanın gönderilmesinden önce bu merkezle irtibata geçilmeli ve hasta hakkında bilgi verilmelidir. Sevkten önce yanık oranının %20’den fazla ve yolculuğun 30 dakikadan uzun süreceği tahmin ediliyorsa mutlaka İ.V. yolla Ringer Laktat infüzyonu başlanmalıdır (12). Transport öncesinde hastanın vital bulgularının stabilize edilmesi gerekir. Transport esnasında oluşabilecek sok tablosuna ve hava yolu obstrüksiyonuna karsı hazır bulunmak gerekir (13).
2.1.1.2. Birinci basamak sağlık kurulusunda yapılacak işlemler:
Yanıklı hasta birinci basamak sağlık kurulusuna geldiğinde, burada uygulanacak ilk ve acil bakım su şekilde sıralanabilir (12):
1. Hava yolunun açıklığı sağlanmalıdır. Özellikle bas-boyun bölgesi yanıklarında ve inhalasyon yanıklarında sıklıkla ilerleyen ödemin hava yolunu tıkayabileceği akılda tutulmalıdır.
2. Kazanın kısa öyküsü alınır ve genel fizik muayene yapılır.
3. Büyük yanıklarda damar yolu açılmalı, sıvı infüzyonuna baslanmalıdır.
4. Hastanın ağrısı giderilmelidir. Yanığın büyüklüğüne göre değisik analjezikler kullanılabilir. Küçük yanık vakalarında topikal anestetikler asetaminofen ile birlikte kullanılabilir. Büyük yanıklarda 0.1-0.2 mg./kg. dozunda İ.V. morfin, veya 1-2 mg./kg. Dolantin kullanılabilir. Bu aşamada hastada olusabilecek anksiyete devam ediyorsa anksiyolitik kullanılabilir.
5. Yanık genisliği ve derinliği hesaplanır.
6. Gerekli görüldüğü durumlarda eskarotomi ve fasyotomi yapılır (13). 7. Lokal yara tedavisi uygulanır (14).
2.2. Yanık yarasının derinliğinin belirlenmesi
Yanığın derinin hangi katmanına kadar etki ettiğini gösterir. Yanık yarası derinliğinin belirlenmesi özellikle uzun dönemde morbidite ve mortalitenin belirlenmesi açısından önemlidir (Tablo 1).
Tablo 1. Yanıkların derinliğine göre sınıflandırılması ve özellikleri
2.2.1. Birinci derece yanık: Yüzeysel yanıklar olup en sık güneş etkisiyle veya ani
gaz parlamaları sonucu meydana gelir (12). Sadece epidermisin hasar gördüğü bu yanıklarda ortaya çıkan en önemli belirtiler kasıntı, kuru bir deri, eritem ve ağrıdır (3). Olay sadece bir enflamasyon olup genellikle hiçbir iz bırakmadan 3-4 gün içerisinde iyileşir (12). Tedavide güneş koruyüçu kremler, tropikal anestetikler,
antiinflamatuar ajanlar ve oral antihistaminik preparatları kullanılır (3). İyileşme esnasında deskuamasyon izlenir (15).
2.2.2.İkinci derece yanık: İkinci derece yanıklarda epidermisin tamamı hasar
görmüş olup dermisin bazı katları da yanıktan hasar görmüştür (6). Yüzeysel ya da derin olarak 2 alt grupta incelenebilir. Çok sıcak sıvılar ile temas veya yüksek ısılı metallere-aleve kısa süreli temas sonüçu ortaya çıkar. Kısa zamanda oluşan ödem, blister ve vezikül-bül ile karakterizedir (12). Bu yanıklar çok ağrılı olup 3 hafta içerisinde spontan epitelizasyon ile iyileşir (6). Eğer uygun şekilde tedavi edilmezlerse kolaylıkla üçüncü derece yanık haline gelebilirler (15).
2.2.3.Üçüncü derece yanık: Tam kalınlıkta deri kaybına neden olan yanıklardır (3).
Epidermis ve dermisin tamamı tahrip olmuştur (6). Derinin koagülasyon nekrozuna uğraması nedeni ile üçüncü derece yanıklar genellikle kuru bir görünüm sergilerler ve sinir uçlarının hasar görmesinden dolayı ağrı hissi yoktur (12). Nekroze olmuş deriye eskar adı verilir ve eskarın uzaklaşmasından sonra ortaya çıkan yaranın kendi kendine kapanması mümkün değildir (6).
2.2.4.Dördüncü derece yanık: Yanığın kas, tendon ve kemikleri de etkilediği
oldukça derin bir grubudur. Geniş ve kapsamlı bir cerrahi girişim gerektirir (12). Nekrotik dokular debride edildikten sonra sıklıkla flep cerrahisi ile defektler kapatılır. Bazı olgularda amputasyon kaçınılmazdır (3).
2.3.Yanık yüzdesinin hesaplanması:
Yanık yüzdesinin hesaplanmasında özel tablolar kullanılmaktadır, ancak pratikte en fazla kullanılan 9’lar kuralıdır. Ancak daha doğru bir hesaplama yöntemi, yas aralığı dikkate alınarak yapılan Lund-Browder yüzey hesaplama yöntemidir (Şekil 2) (Tablo 2). Ayrıca pratik olarak her kişinin avuç içi % 1 olarak kabul edilerek de hesaplama yapılabilir (16).
Tablo 2. Lund-Browder metoduna göre, pediatrik yaş grubundaki yanık yüzey alanı
Şekil 2. Lund-Browder metoduna göre, erişkin yaş grubundaki yanık yüzey alanı
oranları
Yanık yüzdesi hesaplandıktan sonra hastanın yatırılarak mı yoksa ayaktan mı tedavi edileceğine karar verilir. Hastanede yatırılarak tedavi edilme endikasyonları şunlardır:
1. Erişkinlerde % 15’den geniş ikinci derece veya % 2’den büyük üçüncü derece yanıklar.
2. Çocuklarda % 10’dan geniş ikinci derece veya herhangi miktarda üçüncü derece yanıklar.
3. Özel bölge (el, ayak, yüz ve genital bölge) yanıkları 4. İki yas altı, 65 yas üstü yanıklı hastalar
2.3.1. Yanık yara bakımı:
Yanık yarası enfeksiyonları, yanığa bağlı mortalitenin önde gelen nedenlerindendir (3). Yanık yara bakımı, hastanın ilk muayenesi ve ağrı kontrolü sonrasında sıra, yara bakımına gelir.
Son 50 yılda yanık yarası bakımında hızlı ilerlemeler kaydedilmiştir. 1950’li yıllarda yanık yaraları genelde açık pansuman yöntemleriyle takip edilmekteydi. Ancak bakteri kolonizasyonu ve sıvı elektrolit kaybı nedeniyle bu süreden sonra kapalı pansuman teknikleri geliştirilmeye başlanmıştır (3).
Büller: Büllerin tedavisi ile ilgili fikir birliğine varılmış değildir. Büllerin olduğu
gibi bırakılıp alttan epidermisin epitelizasyonunu savunanlar olduğu gibi, derisi ile birlikte uzaklaştırmak gerektiğine inananlar da vardır. Bazı araştırmacılar da büllerin içindeki sıvının aspire edilerek üzerindeki derinin pansuman olarak korunması gerektiğini savunmaktadırlar. Bül içerisindeki sıvının yara iyileşmesini bozacak çeşitli metabolitler içerdiği bilinmektedir. Büllerin patlatılmasını savunanlar bu metabolitlerin uzaklaştırılmasını amaçlamaktadır. Diğer taraftan büllerin uzaklaştırılması durumunda ortaya çıkan açık yara, bakteri kolonizasyonu ve enfeksiyon için daha uygun bir ortam haline gelmektedir. Ancak, genel kabul görmüş bir kural olarak, bül ve veziküller debride edilmelidir. Eğer bunlar patlamamış ve 6-8 cm.’den küçükse patlatılmayabilir, daha büyük olanların içi boşaltılabilir veya patlatılarak temizlenir. Avuç içi ve ayak tabanındaki büller ise genellikle patlatılmaz (17).
2.3.2. Yaranın temizlenmesi:
Yanık yarası oda ısısındaki su ile yıkanmalı, ölü dokular ve yabancı cisimler uzaklaştırılmalıdır. Chlorhexidine gluconate sabunu deri florasındaki mikroorganizmalara karsı antimikrobiyal aktiviteye sahip olması nedeni ile tercih
edilir. Asfalt ve katran yanıklarında temizlik amacı ile vazelin içeren ürünler kullanılabilir (17).
Topikal ajanlar: Yanık yarasını enfeksiyondan korumak amacıyla çeşitli topikal
ajanların kullanılması çok eski bir geçmişe sahiptir. Çok çeşitli antiseptikler, antibiyotikler ve topikal antimikrobiyal ajanların kullanılması önerilmiştir. Bu ajanların çoğunun istenmeyen lokal veya sistemik yan etkileri vardır veya yara iyileşmesi üzerine olumsuz etkileri bulunmaktadır. Ayrıca topikal ajanların kullanılmasının küçük yanıkların tedavisinde sonuçları olumlu olarak etkilediğine dair bir veri bulunmamaktadır. Buna rağmen birçok hekim, yanık yarasına topikal ajan uygulama konusunda kendilerini mecbur hissetmektedir. Bütün çalışmalarda topikal ajanların vazelin emdirilmiş gazlı bezden daha üstün olmadığını göstermiştir. Eğer topikal bir antimikrobiyal ajanın kullanılması gerektiğine inanılıyorsa, % 1’lik gümüş sülfadiyazin merhemi muhtemelen en iyi alternatiftir. Kullanılabilecek alternatif ilaçlar arasında en az yan etkiye sahip olanı bu ilaçtır. Kernikterus riskini artırması nedeni ile hamile kadınlarda, süt veren annelerde ve 2 aydan küçük bebeklerde kullanımı kontrendikedir. Epitelizasyonu bozması nedeniyle, nekrotik dokular uzaklaşıp reepitelizasyon başladığı zaman kullanımı sonlandırılmalıdır (18). İdeal antimikrobiyal ajanların istenen karakteristik özellikleri; ucuz, kolay elde edilebilir, uzun etki süreli, sistemik absorbsiyonu olmayan, sitotoksik olmayan, bakteri direnç oranı düşük, ağrısız uygulanan, alerjen olmayan, iyileşmeyi artırıcı, geniş spektrumlu, derine nüfuz edebilen ve nemlendirici olmasıdır.
2.3.3. Yara pansumanı:
Yanık yarasında pansumanın 3 amacı vardır: Drenajın absorbsiyonu, ağrının azaltılması ve yaranın çevreden izolasyonu ve korunması. Bazı durumlarda yara pansumanı gerekli değildir veya pratik olmayabilir.
Birinci derece yanıklarda topikal medikasyona veya pansumana ihtiyaç yoktur. Küçük boyuttaki yüzeyel yanıklarda topikal antibakteriyel ajanların gerekli olmadığı ortak kanıdır. Yaranın kapatılması için yaraya yapışmayan vazelinli gaz
kullanılabilir. Eğer yara derinse ve nekrotik dokular içeriyorsa topikal antimikrobiyal ajanlar kullanılabilir.
Pratik nedenlerden dolayı, yüz bölgesi yanıklarının çoğuna pansuman uygulanmaz. Bu yaraların tedavisinde topikal ajanlara da fazla gereksinim duyulmaz. Yaranın kurumasına engel olmak amacıyla yara günde iki kere temizlenir ve daha sonra nemlendirme amacıyla kremler kullanılır.
Yara pansumanının bir amacı da drenajın absorbe edilmesidir. Bu nedenle pansumanın kalınlığını belirleyen, yaradaki drenaj miktarıdır. Sızıntılı yüzeysel yanıklarda drenajın en fazla olduğu zaman yanıktan hemen sonraki dönemdir. Yara iyileşmesi başladığı zaman drenaj da azalır. Bu tarz yaralarda yara temizliği sonrasında önce nonadeziv bir tabaka daha sonra da adheziv bir takaba halinde pansuman konur. Pansuman üçüncü bir tabaka ile sabitlenir. Non-adeziv tabaka olarak vazelin emdirilmiş gazlı bez veya Chlorhexidine içeren tül seklinde pansuman malzemeleri (Bactigras® gibi) kullanılabilir. Emici tabaka olarak gazlı bez veya ped kullanılabilir. Sabitleyici olarak sargı bezi ve flaster kullanılabilir. Eklemler harekete engel olmayacak sekilde sarılırken parmaklar ayrı kapatılır.
Pansumanın sıklığı kişiden kişiye göre değişmektedir. Bu konudaki genel öneriler iki günde birden haftada bire kadar değişmektedir. Genel olarak yarayı sık görmenin bir avantajı da yaranın sık temizlenmesi ve gelişmelerin yakından takip edilmesine imkan sağlanmasıdır. Bu nedenle iki günde bir yapılan pansuman daha uygun gibi gözükmektedir (18)
Sentetik pansuman malzemeleri: Nekrotik dokunun olmadığı, temiz yüzeyli yanık
yaralarında çeşitli sentetik pansuman malzemeleri kullanılabilir. Bu malzemeler ağrıyı, pansuman sıklığını ve maliyeti azaltırken yara iyileşmesini hızlandırmaktadırlar. Omiderm®, Biobrane®, Opsite® veya Tegaderm® bu pansuman malzemeleri arasında en yaygın olanlarıdır. Bu pansuman malzemelerinin temel özellikleri film tabaka olmalarıdır. Kullanıldıkları zaman altlarında sıvı birikintisi olmasına izin verilmemelidir. Film tabakanın hasar görmesi durumunda
yara kontamine olabilir. Film tabaka altında bulanık ve yoğun sıvı birikmesi durumunda tabaka uzaklaştırılır, aksi halde tabaka yerinde bırakılır ve alttan epitelizasyonun gerçekleşmesi sağlanır (17).
2.3.4. Yanık alanının elevasyonu:
Yanık alanında enfeksiyon gelişmesini engellemenin en etkili yollarından biri de, ödem gelişmesine engel olunmasıdır. Yanık alanının hemen çevresinde doku ödemi gelişmektedir. Hastalar genellikle yanan bölgeyi hareketsiz ve sarkık pozisyonda tutma eğilimindedir. Ödem gelişimini elimine etmek için yaralı bölgeye egzersiz uygulanmalıdır. Yaralanan bölge için en uygun pozisyon kalp seviyesinden hafifçe yukarıda olmasının sağlanmasıdır (17).
2.3.5. Yara kapatılması:
Yanık bakımında yaraların 1 ay içerisinde kapatılmasına çalışılmaktadır. Ayaktan takip edilen minör yanıklı hastalarda spontan yara iyileşmesi daha kolay olmaktadır ve 3 hafta içerisinde epitelize olan yanık yaralarında çok iyi sonuçlar alınmaktadır. Bu gerçekleştiğinde deri normal elastisitede, hipertrofik skar eğilimi ve pigmentasyon problemi olmadan iyileşmektedir. Spontan iyileşme süresi ne kadar uzarsa sonuç o kadar kötü olur. Özellikle yüz bölgesi gibi estetik açıdan önemli bölgeler titizlik gerektiren alanlardır (19). Uzun sürede iyileşen yaralarda pigmentasyon problemleri ve hipertrofik skar eğilimi olmaktadır. Hekimin görevi yaranın bu süre içerisinde iyileşmesini sağlamaktır. Bu süre içerisinde spontan olarak iyileşemeyecek yaralar cerrahi olarak kapatılır. Genellikle başlangıçta yaranın 3 hafta içerisinde iyileşip iyileşmeyeceğinin anlaşılması güçtür. Bu nedenle yanık sonrası 2. haftada hasta bu açıdan değerlendirilir. Nekrotik dokunun olmadığı ve yer yer epitelizasyonun başladığı yaralar kısa süre içerisinde iyileşebilir (15).
Enfeksiyon ve antibiyotik kullanımı: Küçük yanıklarda sistemik antibiyotik
kullanımının yara enfeksiyonunu azalttığına dair kanıt yoktur. Başlangıçta yanık yarasındaki enflamasyon, enfeksiyon ile karışabilir. Ancak enflamasyonun 4 kardinal
bulgusuna ek olarak lenfanjit ve ateş varlığında enfeksiyondan şüphelenilir ve enfeksiyona yönelik tedavi uygulanır. Enfeksiyonun tedavisi istirahat, ödem kontrolü için elevasyon ve sistemik antibiyotik tedavisi ile yapılır. Eğer enfeksiyonda ilerleme varsa hasta hospitalize edilir ve parenteral antibiyotik tedavisi uygulanır.
Ayaktan hastalarda enfeksiyon sebebi genellikle deri florasından kaynaklanmaktadır. En sık karşılaşılan ajan da stafilokoklardır. Antibiyoterapinin düzenlenmesi için yara kültürü alınmalıdır. Normalde yanık yarası biyopsi kültürü alınması daha güvenli bir yöntem olmasına rağmen ayaktan hastalarda gerekli değildir. Ayaktan hastalarda sistemik sepsis oluşması yok denecek kadar azdır. Hastalar muhtemel sepsis bulguları hakkında bilgilendirilmelidir.
Minör yanıklar da dahil olmak üzere yanık yaraları tetanoz oluşumuna yatkın yaralardır. Bu nedenle son 5 yıl içerisinde tetanoz immünizasyonu almayan hastalara tetanoz profilaksisi gereklidir (7).
Kaşıntı: Kaşıntı, iyileşmekte olan ve iyileşmiş yanık yaralarında sıkıntı veren bir
şikayettir. Kasınma genellikle iyileşmekte olan yaralarda tekrarlayan yaralar oluşmasına neden olur. Sıcaklık, fiziksel aktivite ve stres gibi etkenler bu semptomu tetikler veya daha da şiddetlendirir. Kaşıntı genellikle yaralar iyileştikten hemen sonra en fazladır. Birçok vakada zamanla azalır ve biter. Ancak bazı hastalarda 12-18 ay sürebilir. Kaşınmanın etiyolojisi tam olarak bilinmemekle birlikte, yarada artan histamin, bradikinin ve diğer endopeptitler sorumlu tutulmaktadır. En iyi tedavi yöntemi ile ilgili kontrollü çalışma yoktur. Antihistaminik etkili difenhidramin ilk olarak kullanılan ilaçtır. Bu ilacın hafif sedatif etkisi de kasıntının azalmasında önemlidir. Cyproheptatine gibi diğer antihistaminikler de kullanılabilir. Ağrı kesiciler merkezi sinir sisteminde kasıntı hissinin algılanmasını değiştirerek faydalı olabilirler. Analjezik ve antihistaminik kombinasyonu denenebilir. Skar matürasyonu gerçekleştikçe kaşıntı şikayetinde azalma olur. Hastalar hipertrofik skar gelisimi açısından takip edilmelidir (7). Hipertrofik skar ve eklem fonksiyon kısıtlılığı, uzun dönemde problemlere yol açan en önemli etkenler arasındadır (8).
2.4. Yanıkta Yara İyileşmesi
Yanık yarasında iyileşmeyi sağlayan biyolojik süreçler diğer yara tiplerinden daha farklı işlemektedir. Yanık yarası ve diğer yaralar arasındaki ilk ve en aşikâr fark yanık hasarının kan damarları üzerine olan etkisidir. Yanık hasarı, hasarın olduğu bölgedeki kan damarlarına zarar vererek hasar bölgesine olan kan akımını azaltır veya durdurur ve bu bölgeyi çevreleyen bölgedeki kan akımını da değiştirir (20). Bir yanık yarası doku değişimlerine göre 3 bölgeye ayrılabilir. Ortada ısının doğrudan etkileyip protein denatürasyonu yapması ve ciltteki kan damarlarının koagülasyonuna bağlı oluşan geri dönüşümsüz cilt ölümünün gerçekleştiği koagülasyon bölgesi yer alır. Bu bölgeyi zaman içinde damarlarda oluşan trombüsler, fibrin depolanması, endotel şişmesi ve vazokonstrüksiyon sonüçunda kan akımının azaldığı staz bölgesi çevreler. Buranın da çevresinde yanmış cilt ile yanmamış cilt arasında yer alan belirgin vazodilatasyon sonucu kan akımının arttığı hiperemi bölgesi mevcuttur (20). Yanık hasarının kan damarları üzerindeki bu etkisi sonüçunda kan damarlarında ya hiç yırtılma olmaz ya da çok az olur ve diğer yaralardan farklı olarak yara bölgesinde hemoraji görülmez. Neticede yara iyileşmesinin ilk baştaki hasar sınırlayıcı safhasında oluşan hematojen dolgu yanık yarasında oluşmaz.
Cilt hasarı genellikle ciltteki hücrelerin vital aktiviteleri ile değerlendirilirse de cildin yapısal elemanlarının hasarı da değerlendirmeye alınmalıdır. Bu sebeple yanık yarasındaki iyileşme ölçütleri diğer yara tiplerinden önemli derecede farklılık gösterebilir. Yara bölgesinde yaranın sınırlarını belirleyen hemorajinin olmaması nedeniyle iyileşen bölgenin kesin olarak tanımlanması mümkün olmayabilir.
Ciltte üç ana hücre popülâsyonu bulunmaktadır. Epitelyal hücreler epidermisin yüzeyini kapamakta ancak aynı zamanda kıl follikülü, ter ve yağ bezlerinin de yapısını oluşturmaktadır. Fibroblastlar dermiste bulunurlar ve cilde gerilme kuvvetini sağlayan kollajeni oluştururlar. Endotel hücreleri ise kan damarlarında bulunmaktadırlar. Epitelyal hücre desteği iyileşme oranını artırmakla kalmayıp aynı zamanda iyileşen dokunun kalitesini de etkiler. Yüzeyel kısmi
kalınlıktaki yaralarda yaralanan bölgeye yara kenarlarından ve hasar görmemiş kıl folliküllerinden, ter ve yağ bezlerinden bol miktarda yeni epitel hücre desteği sağlanır. Bu yaralarda dermisin üst kısmında hücresel hasar görülse de yapısal matriks göreceli olarak daha az hasar görmektedir. Bu nedenle iyileşme hasar görmüş yapısal matriksin yerine konmasını içermez ve spontan olarak iyi bir neticeye ilerler. Derin kısmi kalınlıkta ve tam kat kalınlıktaki yaralarda ise yeni epitel desteği derin yapılardaki epitel kaynakları tahrip olduğu için sadece yara kenarları ile sınırlı kalmaktadır. Hasar görmüş yapısal matriksin temizlenmesi ve yenilenmesi gerekmektedir. Bu şartlar altında yara iyileşmesi sadece yara kenarlarından olacaktır ki bu durum oldukça uzun bir süre alabilir ve cerrahi girişim gerektirebilir (20).
Yara iyileşmesi hasar gören dokuların onarımı ve kaybolan dokuların yerine konması ile doku bütünlüğünün yeniden sağlanmasıdır. Bu süreç travma sonrası tetiklenen birtakım biyokimyasal ve hücresel olaylardan oluşur. Yara iyileşmesini 4 evrede inceleyebiliriz. Bunlar hemostaz, inflamasyon, proliferasyon ve maturasyon evresidir.
2.4.1. Hemostaz Evresi
Bu ilk evre geleneksel olarak pıhtılaşma ile yarada hemorajinin oluştuğu hasar sınırlama evresi olarak görülür. Doku hasarı sonüçu yırtılan damarlardan açığa çıkan trombositler subendotelyal kollajene temas ederler. Böylece faktör 12 aracılığı ile trombosit agregasyonu ve koagülasyonun intrensek dönemi aktive olur. Trombositlerden trombosit kaynaklı büyüme faktörü (PDGF), transforme edici büyüme faktörü α ve β (TGF-α, TGF-β), fibronektin ve serotonin salınır. Lokal olarak oluşan bu pıhtı sadece daha fazla kan kaybını önlemekle kalmayıp nötrofil, monosit, fibroblast ve endotelyal hücreler gibi yara bölgesine gelecek ilk dalga cevap hücrelerinin invazyonu için iskelet görevi oluşturur ki bu hücreler bir sonraki aşama olan inflamatuar evreyi başlatırlar. Hemostaz yetersizliğinde hücrelerin inflamasyon alanına tutunması azalır (21).
2.4.2. İnflamasyon Evresi
Bu süreç yaralanan bölgeye kan akımında artış, damar geçirgenliğinde artış ve yarayı mikrorganizmaların kolonizasyonuna karşı koruyan, kurtarılabilir dokuları onaran ve tamiri mümkün olmayan dokuları ortadan kaldıran çok çeşitli lökositlerin yaraya geçişi ile karakterizedir. Lokal olarak sitokinler ve büyüme faktörleri salınır, hareketli hücrelerde aktivasyon başlar. Yara bölgesine ilk olarak nötrofiller gelir. Damar geçirgenliğinin artması, prostoglandinler, kemotaktik faktörler, mikroorganizmalar ve doku artıkları ile nötrofiller aktive olurlar. İnflamasyon döneminde özellikle retiküloendotelyal sistem hücreleri (nötrofil, makrofaj ve lenfositler) görev alırlar. Ancak enfeksiyon olmadığı sürece nötrofillerin yara iyileşmesinde rolü olmaz. Makrofajlar debridman, matriks sentezi ve damarlanmadan sorumludurlar. Trombositlerden salınan faktörler makrofajlar için en önemli aktivatörlerdir (16). Makrofaj aktivasyonu ile nitrik oksit (NO) sentezi ve damarlanma artar, fibroblastlar aktive olur. Yara bölgesindeki hipoksi de NO salınımını artırır. NO salınımı makrofaj dışında endotel hücreleri, fibroblastlar, monosit ve lenfositlerce de tetiklenir (22).
Yara çevresi inflamatuar hücreler tarafından yeterince hazırlandığında yara iyileşmesi üçüncü evre olan proliferatif evreye ilerler.
2.4.3. Proliferasyon Evresi
Bu evrede esas olarak fibroblastlar aktive olur ve endotel hücreleri çoğalırlar. Fibroblastlar yara çevresindeki sağlıklı dokulardan yara içerisine ilerleyerek yara içinde fibröz bir dolgu şeklinde granülasyon dokusunu oluştururlar. Yara bölgesinde bulunan fibroblastlar sağlıklı dokulardakilere göre daha fazla kontraksiyon ve kollajen sentezleme özelliğine sahiptirler. Özellikle TGF-β ile aktive olan fibroblastlar daha fazla matriks proteini, matriks proteaz inhibitörü ve integrin reseptörü sentezlerler. Özellikle aktive olmuş makrofaj ve trombositlerden salınan sitokinler (PDGF ve EGF) fibroblast proliferasyonunu artırırlar. İnflamasyon evresinde görev alan nötrofiller ise bu evrede makrofajlar tarafından fagosite edilerek
görevlerini tamamlarlar. Yine bu evrede yaradaki hematojen dolgunun içine doğru hasarlı dokunun çevresindeki venüllerdeki endotel hücrelerinin çoğalması ve damarlanma ile kapillerleri oluşturması ile bir damarlanma artışı görülür. Aynı zamanda yaralanmadan birkaç gün sonra yara kenarlarındaki ve yara içinde sağlam kalmış cilt eklerindeki (kıl, yağ follikül epiteli gibi) epitelyal hücrelerde çoğalmanın tetiklenmesi ile yaranın kapanmasını sağlayan epitelyal hücre örtüsü (epitelizasyon) oluşmaya başlar. Epitelizasyonu tetikleyen mekanizmalar tam olarak ortaya konamamış olsa da makrofaj ve epitel hücrelerinden salınan sitokinler ile kontrol edildiklerine dair bulgular vardır. Epitelizasyonu tetikleyen epidermal büyüme faktörü (EGF) trombositlerden salgılanır, ancak kollajenin varlığı da epitelizasyonu tetikler. Epitelizasyon kontakt inhibisyon ile sona erer (22).
2.4.4. Maturasyon Evresi
Yara iyileşmesinin en uzun ve en az anlaşılmış evresidir. Yaranın kapanmasını takiben aylarca sürebilen, yaranın zeminindeki fibröz dokunun fibroblastlar tarafından modifiye edilerek yara iyileşmesinin son haline yani skar dokusuna çevrildiği evredir. Bu skar makroskopik olarak onu çevreleyen ciltten ayırt edilemez olduğu gibi (atrofik skar), çevre cillten kabarık ve orijinal yara sınırlarında (hipertrofik skar) veya çevre cillten kabarık ancak orijinal yara boyutlarını geçen büyüklükte (keloid skar) olabilir. Hipertrofik skar maalesef tedavi görmüş birçok yanık hastasında sıklıkla görülen skar çeşididir (21).
2.5. Epidermal Büyüme Faktörü (EGF)
Epidermal büyüme faktörü (EGF), ilk kez 1962 yılında Dr. Stanley Cohen tarafından erkek fare submandibuler tükürük bezinden izole edilmiştir (23). Cohen, erkek fare submandibuler tükürük bezinde, sinir büyüme faktörü (NGF) izole etmeye çalışırken, bu bezlerden elde ettiği ekstrenin yeni doğan farelere enjekte edildiğinde erken göz kapağı açılışına ve erken diş çıkarmasına neden olduğunu gözleyerek etken maddeyi izole etmiş ve epidermis gelişimini hızlandırıcı etkisi nedeni ile bu maddeye epidermal büyüme faktörü (EGF) adını vermiştir (23).
2.5.1. EGF’nin Biyokimyasal Özellikleri
EGF amino asit dizisinde lizin, fenilalanin ve alanin bulundurmayan 53 amino asitten oluşmuş, 6,000 dalton moleküler ağırlığında, tek zincirli bir polipeptittir. İzoelektrik noktası ise 4,5’tir. Su içinde çözünürlüğü çok yüksektir. Metanol ve etilen glikol içinde çözünür. Fare EGF’sinin molekül ağırlığı 6041 Da ve izoelektrik noktası ise 4,6’dır. Kaynar su içinde biyolojik aktivitesi stabildir. Fakat dilüe asit veya alkali içinde ısıtılırsa biyolojik aktivitesi zarar görür. Kimyasal özellikleri benzer olan insan ve fare EGF’leri aynı biyolojik aktiviteleri gösterirler (24). Molekülün bir üçu -NH2 grubu, diğer üçu ise -COOH grubu ile sonlanmaktadır. Polipeptit, altı sistein köküne sahiptir ve üç tane disülfit bağı içerir. Bu disülfit bağları molekülün biyolojik aktivitesi için çok gereklidir. EGF‟nin öncül molekülü ise 1217 amino asit içerir. Bu sayılar olgun EGF‟den 24 kat daha büyüktür ve prepro EGF olarak adlandırılır vermiştir (23).
2.5.2. EGF Reseptörleri
Hücrelerin çoğunda EGF’ye ait reseptörler bulunur. En çok sayıda reseptör epitelyum hücrelerinde bulunur, ancak endotel hücreleri, fibroblast ve düz kas hücrelerinde de reseptörler vardır. Anjiogenezi ve kollajenaz aktivitesini uyarıcı özelliğe sahiptir. Plazma, süt, idrar, tükrük gibi biyolojik sıvılarda bulunmaktadır. EGF, diğer tüm büyüme faktörleri gibi yüksek eğilimli ve düşük kapasiteli reseptörleri ilgili hücre yüzeyine bağlar. EGF reseptörünün içindeki aktivite, EGF bağlanmasına karşı gerçekleşen tirozin kinaz aktivitesidir. EGF reseptörünün kinaz etki alanı, EGF reseptörünün kendisini fosforile eder. Buna da otofosforilasyon denir. Bu işlem sinyal iletimi basamağındaki diğer proteinler için de geçerlidir. EGF reseptörü ile birleşip agregasyon ve fosforilasyon olayı meydana geldikten sonra EGF reseptör birlikte sitoplazmaya geçerler. Orada lizozomlar ile birleşerek reseptozomları oluştururlar ve parçalanırlar (23).
2.5.3. EGF’nin Biyolojik Özellikleri
EGF özellikle keratinosit ve fibroblast gibi hem mezodermal hem de ektodermal orijinli hücreler üzerinde proliferatif etkiye sahiptir. EGF granülasyon dokusu, kollajen ve glikozaminoglikan düzeyini arttırır, sonuçta epitelizasyon hızlanır ve yara gerilim kuvveti artar. EGF' nin içinde bol miktarda bulunduğu çenealtı tükürük bezi ekstreleri yara iyileşmesini hızlandırıcı etki göstermektedir (25). EGF erkek farede toplam bez proteinin % 0,5 i kadardır. Gregory ve arkadaşları insan idrarının köpeklerde mide asit salgısını inhibe ettiğini göstermişler ve izole ettikleri etken maddenin adını Urogastrone koymuşlardır. İzole edilen bu maddenin fare EGF’sine benzerlik göstermesi üzerine Urogastrone’a insan EGF’si denilmiştir (23). EGF, fare çenealtı tükürük bezinde sentezlenerek tübüler kanal hücrelerinde depo edilmektedir. Ancak farelerde çenealtı tükürük bezinin çıkarılması sonrasında plazma EGF düzeyinde herhangi bir değişikliğin olmaması EGF’ nin organizmada başka bir yerde de sentezlendiğini düşündürmektedir. Önce barsaklardaki Brunner bezleri önemli miktarda EGF sentezler ve salgılarlar. EGF en yüksek miktarda çenealtı tükürük bezinde bulunur. Daha sonra duodenum, Brunner bezleri, tiroid, pankreas, adrenal bez, ovaryum, parotis bezi, karaciğer, özofagus, mide, ince bağırsak, kolon, kalp, böbrek, prostat, iskelet kası, düz kas, akciğerler, timus bezi bunlar arasında sayılabilir. Bunların yanı sıra EGF idrarda, gastrik sıvıda, tükürükte, safrada, prostatik ve seminal sıvıda, terde, gözyaşında, amniyotik sıvıda ve anne sütünde, plazma ve serumda bulunur (25). EGF, pek çok mezodermal ve ektodermal kökenli hücreler için mitojenik özelliktedir. Dolayısıyla, EGF’nin neoplastik büyüme üzerinde etkisi nedeniyle kanser ile ilişkili olduğu söylenmektedir (25). EGF, etkin olduğu hücrelerde de iyon alımını, glikolizi, DNA ve RNA sentezini arttırıcı özelliğe sahiptir. EGF farklılaşma ve büyümeyi etkileyerek organizmanın gelişiminde rol oynar. Çeşitli epitel hücre kültürlerinde EGF büyümeyi, çoğalmayı ve farklılaşmayı arttırmaktadır. EGF gibi peptit büyüme faktörleri keratinositlerin ve fibroblastların mitogenezini, keratinositlerin göçünü ve doku ve granülasyon geliĢimini uyarırlar. Domuzlarda epitelyum rejenerasyonu, tavşanlarda da korneal epitelizasyonu hızlandırdığı anlaşılmıştır (23).
EGF, bir sitokindir ve doku diferansiyasyonu ve organogenezisi uyarır. Neotanal kemiricilerde diş patlamasına ve göz kapaklarının erken açılmasına neden olur, fetal sıçanlarda, koyunlarda ve tavşanlarda akciğerin olgunlaşmasını başlatır, organ kültürlerinde damak gelişimine yardımcı olur, gastrointestinal, karaciğer ve pankreatik olgunlaşmayı stimüle eder, tiroid ve adrenal bezin gelişimine yardımcı olur, meme bezi gelişimi ve yara iyileşmesini stimüle eder, gastrik asit sekresyonunu inhibe eder, büyüme hormonu (GH), prolaktin (PRL) ve adrenokortikotropik hormonu (ACTH) içeren hipofiz hormon sekresyonunu uyarır, plasenta dokusundan plasental laktojen ve koriyonik gonadotropin sekresyonunu stimüle eder. Embriyonik testis gelişiminde rol oynar. Spermatogenezin mayotik fazını uyararak erkekte reprodüktif fonksiyonda rol oynarken, sertoli ve leyding hücrelerinin aktivasyonu yoluyla spermatogenezi kontrol eder (23).
2.5.4. EGF’nin Yara İyileşmesindeki Yeri
Son zamanlarda gerek genel tıp alanında gerekse ağız cerrahisinde yapılan çalışmalarda, topikal ya da sistemik olarak uygulanan EGF’nin yara iyileşmesi üzerinde olumlu etkilerinin olduğu gösterilmiştir. EGF’nin bol miktarda bulunduğu çenealtı tükürük bezi ekstrelerinin yara iyileşmesi üzerinde hızlandırıcı etkisi olduğu birçok çalışmada deneysel olarak gösterilmiştir (25). EGF’nin bilinen en önemli etkisi, yara iyileşmesini hızlandırmasıdır. Yara iyileşmesini, proteinlerin üretimini ve epitel hücrelerin migrasyonunu uyararak hızlandırdığı bilinmektedir. EGF, fibroblastların büyümesini ve keratinositlerin göç etmesini arttırması nedeniyle yara iyileşmesinde önemli bir rol oynar (25). EGF' nin yara iyileşmesindeki etkisi, inflamatuvar safha, fibroblastik safha ve remodelling safhası olmak üzere üç süreçten geçmektedir. Mitojenik bir polipeptid olan EGF, yara iyileşmesine inflamasyon fazının bitiminde etki etmeye başlamakta ve fibroblastik oluşumunu indüklediği ve bunun yanı sıra granülasyon dokusunun oluşumu ve epitelizasyonu uyardığı bilinmektedir. Ayrıca EGF’nin DNA sentezi ve hücre üretimini başlatır ve protein sentezini aktive eder (23).
Literatürde, EGF’nin mikroemülsiyon formülasyonu geliştirilmiş ve sıçanlarda gastrik ülser yaralarındaki etkisi incelenmiş ve hazırlanan bu formülasyonunun gastrik ülser yaralarında olumlu yönde etkisi olduğu belirtilmiştir (26). EGF’nin gastrointestinal mukoza için sitoprotektif ve trofik etkili bir ajan olduğu bilinmektedir. EGF mide asit salınımın durdurur ve mide de mukozal hücrelerin çoğalmasını uyarır. Sialoadenektomi sonrası midede ülserasyon alanı ve sayısının arttığı gösterilmiştir (26).
Ayrıca gastrointestinal sistemde oluşan iskemi reperfüzyon hasarında bakteriyel translokasyonu azaltarak etki gösterir (27). Özofagus mukozasının da onarımı ve korunmasında rolü vardır (28). Çelebi ve arkadaşlarının yaptıkları çalışmada EGF içeren poliakrilik asit jel formülasyonu hazırlanmış ve fare sırtında oluşturulan 1 cm uzunluğundaki cilt kesilerinde uygulanmıştır. Poliakrilik asit, mukoza ve dokulara yapışması, irritan olmaması gibi nedenlerden dolayı tercih edilmiştir. 7. ve 15. günlerde yapılan incelemeler sonüçunda EGF-poliakrilik asit jel formulasyonunun uygulandığı yaralardaki gerilme kuvvetinin, EGF içeren serum fizyolojik uygulanan yaralara göre daha fazla olduğu görülmüştür (26). EGF‟nin kronik yaralar üzerindeki etkisinin araştırıldığı bir başka çalışmada, diabetes mellitus, romatoid artrit gibi çeşitli rahatsızlıklara bağlı olarak ortaya çıkan ülser yaralarında topikal olarak EGF içeren Silvaden uygulanmış ve iyileşme üzerinde olumlu etkilerinin olduğu bildirilmiştir (29). Farelerde korneal alkali yanıklarının iyileşmesinde EGF‟nin etkisinin araştırıldığı bir çalışmada EGF‟nin çeşitli dozaj formları içinde yara bölgesine uygulanmasıyla kontrol grubuna göre yaralı bölgenin çapında anlamlı bir azalma meydana geldiği ifade edilmiştir (30). Jimenez ve arkadaşları EGF‟nin özofagus mukozasındaki etkisini araştırmışlar ve sonuçta EGF‟nin özofagus epitelyum hücrelerinin çoğalmasında etkili olduğu sonucuna varmışlardır (31). Koltuksuz ve arkadaşları alkali yanık oluşturdukları sıçanlara EGF ve CAPE vermişler. Sonuçta EGF‟nin özofagusta iyileştirici yönde etkisinin olduğunu görmüşlerdir (32). Berthet ve arkadaşlarının sıçanlarda periton içerisine epidermal büyüme faktörü ve interferon γ vererek yaptıkları çalışmada özofagusta yanık oluşturulduktan sonra intraperitoneal epidermal büyüme faktörü ile interferon
γ’nın birlikte verildiği grupta özofagus kalınlıklarında anlamlı bir azalma izlenmiştir (33).
2.6 Plateletten Zengin Plazma (PRP)
Plateletler hemostaz ile ilgili bilinen görevinin dışında yara iyileşme surecinde etkin bir şekilde rol aldığının anlaşılmasıyla önemi daha da artmış hücrelerdir. Bu hücreler kemik iliğinde şekillenen bir çeşit beyaz kan hücresi olan megakaryositlerin sitoplazmik fragmantasyonudurlar (34). Lökosit, endotel hücreleri, dolaşan kemik iliği kökenli progenitor hücrelerle ilişki kurmak suretiyle etkilerini gösterirler (35). Otokrin ve parakrin self aktivasyonla inflamatuar cevabın, kemotaksisin, aterotrombozisin, koagulasyon ve hücresel farklılaşma regulasyonunun tetiğini çekerler (36). Ayrıca yeni oluşan ekstraseluler matriksin oluşumuna katkıda bulunurlar (37). İçeriğinde üç çeşit granül bulunmaktadır. Bunlar α, lizozomal ve yoğun kor granülleridir. Özellikle α ve kor granüllerindeki büyüme hormonları, sitokinler, kemokinler ve pıhtılaşma faktörleri ile asli görevleri olan hemostaz ve yara iyileşmesinde (inflamasyon, doku rejenerasyonu) rol alırlar (37). Plateletlerin aktivasyonuyla koagulasyon faktörleri, büyüme faktörleri, sitokin, kemokin ve integrin olarak bilinen salgısal moleküller pıhtılaşmadan sonraki yaklaşık 10 dakikalık süreçte salınırlar. Bu salgısal maddeler plateletlere transfer edilmeden ve fragmentasyona uğramadan önce megakaryositte granül halinde paketlenmiş olarak bulunur. Daha önce sentezlenmiş olan bu büyüme faktörlerinin %95’i histon ve karbonhidrat yan zincirlerinin takılması sonrası ilk bir saatte salınır (37). Devamında plateletlerin 7-10 günlük yaşam sureleri boyunca bir miktar salgılanmaya devam ederler (39). Buradaki önemli nokta ise BF’lerinin salınmadan önce aktiflenmesidir. Hasar görmüş plateletler ve PRP elde etme işlemi sırasındaki plateletlerin yaşamlarını kaybetmesi BF’lerinin aktive olamamasına ve dolayısıyla PRP uygulamasının başarısızlıkla sonuçlanmasına neden olur (38). Bütünlüklerinin korunması için asid sitrat dekstroz tip A antikoagulanı ve santrifüj sırasında düşük yerçekimi kuvvetleri gereklidir (40). En önemli ve anahtar içerikler α granüllerinde bulunur. Her platelet de 50-80 adet arasında α granül bulunur. İçeriğinde 30’dan fazla biyoaktif madde bulunur (37). PDGF, TGF-β1-2, IGF, EGF, VEGF, PDF,
PDEGF, PDAF (platelet kökenli anjiogenetik faktor) gibi mitojenik büyüme faktörleri, osteokalsin, osteonektin, fibrinojen, fibronektin, vitronektin, trombospondin, koagulasyon faktörleri ve diğer bazı adheziv proteinler, fibrinolitik faktörler, anti proteazlar, sitokin (IL-1β, SCD40L, β tromboglobulin) ve kemokinler (RANTES (CCL5), PF4, MIP1α), membran glikoproteinleri, anjiyogenez düzenleyici proteinler ve bakterisit proteinler bunlardan bazılarıdır (41-42). Lizozomal granüller ise proteolitik enzimler ve asit hidrolaz enzimleri içerirler. Yoğun kor granüllerinde ise ADP/ATP, kalsiyum, serotonin, histamin, dopamin, katekolamin gibi platelet agonistleri içerir.
Plateletler, intravaskuler olarak ve dalakta yüksek konsantarasyonda bulunur. Normal kanda yaklaşık mm3’te 140.000–400.000 platelet bulunur. Dolaşımdaki yaşam surelerini tamamladıktan sonra retikuloendotelyal sistemde makrofajlarca temizlenir. Eksikliğinde trombositopeni ve sonucunda kanama bozuklukları meydana gelir (34).
Yara iyileşmesi, evrimsel olarak korunmuş, kompleks, multiseluler bir süreçtir ve bir anlamda bariyer restorasyonunu amaçlar. İçerisinde keratinositlerin, fibroblastların, endotel hücrelerinin, makrofajların ve platelet gibi hücrelerin rol alıp, koordineli olarak çalıştığı bir surectir. Bu hücrelerin migrasyonu, infiltrasyonu, proliferasyon ve diferansiyasyonu inflamatuar bir yanıt oluşturarak, devamında yeni doku oluşumunu ve yara kapanmasını sağlar. Klasik bir bilgi olarak inflamasyon, proliferasyon ve remodelling safhalarından oluşur. İşte bu kompleks süreç içerisinde bahsettiğimiz birçok büyüme faktörü, sitokin ve kemokinlerin olduğu kompleks sinyal iletişimleri ile düzenlenir ve başarılır (43). Burada görev alan büyüme faktörleri üzerinde çok fazla araştırma yapılmaktadır. Hatta bazı büyüme faktörlerinin klinik olarak uygulaması mevcuttur. Bunun haricinde ve birkaç kozmetik içerikli krem haricinde büyüme faktörlerinin direk kullanımı yoktur. Plateletten zengin plazmanın tedavi amaçlı kullanılması fikri de plateletlerin içeriğinde işte bu yüksek miktardaki büyüme faktörleri bulunması sebebiyle ortaya çıkmıştır. Çünkü plateletler yara iyileşme surecinde temel rol oynayan büyüme faktörleri kompleksinin ana kaynağıdır. Plateletten zengin plazma; referans hattının
üzerinde platelet içeren otolog kandan elde edilen plazma fraksiyonudur. Aynı zamanda platteten zenginleştirilmiş plazma, plateletten zengin konsantre, otolog platelet jel, platelet salıverici, plazmadan zengin büyüme faktörleri olarak da tanımlanabilmektedir (44). Sonuçta içerdiği büyüme faktörleri sayesinde büyüme faktörü agonisti gibi davranır (45).
PRP yaklaşık 30 yıldır kullanılmaktadır. İlk olarak 1987’de Ferrari ve arkadaşları tarafından acık kalp ameliyatlarını takiben homolog kan ürünlerinin transfüzyonunu azaltmak amacıyla kullanılmıştır (46). Günümüz tıpta kullanım alanları daha çok cerrahi işlemlerle ilgilidir. Ortopedik girişimler, dental ve oral girişimler, travmatik cerrahi işlemler (maksillofasiyal cerrahi, spinal cerrahi, kalp by-pass ameliyatları angiyogenez gerektiren işlemler, plastik cerrahideki flep ameliyatları (47), makuler lezyon, korneal epitelyal defektler gibi… Özellikle ortopedik ve travmatik cerrahide kemik, kartilaj ve doku defektlerinde en fazla gelecek vaad eden teknik olarak görülmektedir. Dermatolojide, plastik cerrahi ile birlikte daha çok kronik yara, ülserler ve yanık bakımında kullanılır. Son yıllarda kozmetik dermatoloji alanında da kullanılmaya başlanmıştır (48-52). Dermatolojide en sık kullanım alanı kronik ülsere yaralardır. Diğer cerrahi girişimlerde olduğu gibi bu yaralarda da daha çok jel formasyonu kullanılır. Burada plateletten zengin plazmadaki yoğun büyüme faktörlerinin tropik etkisinden, plateletten zengin jelin de yapı iskelesi fonksiyonundan yararlanır (53). Burada yer alan büyüme faktörlerinin hepsi tropik olmayıp, bazı alanlarda sadece protektif özellikleriyle başarılı olur (54). Çalışma sonuçları genelde değişkendir ve PRP ile ilgili kontrollü çalışma sayısı azdır (55-56). Çalışmalardaki değişik sonuçların nedeni kullanılan ekipman, platelet jeli aktive etmek için kullanılan protokol, hasta ve lezyonun kendine özgü karakteristikleri, kullanılan platelet oranı, farklı depolama zamanları olabilir. Ayrıca PRP’ye cevapsız olguların olması kullanımını kısıtlar. Cevapsız olguların sebebi olarak yara iyileşme mekanizmasının kompleksitesi nedeniyle tam anlaşılamaması ve platelet biyoloji ve fonksiyonunun tam olarak bilinmemesinin, PRP ile yara iyileşmesi ve osteogenez arasındaki ilişkinin anlaşılmasını maskeleyebileceği şeklindeki düşünce gösterilmektedir (36).
Normal bir pıhtıda %93 kırmızı kan, %6 platelet ve %1 ise beyaz kan hücresi bulunmaktadır. PRP bu oranı platelet lehine tam tersine çevirir. Yani platelet %93, kırmızı kan %6, beyaz kan hücresi ise %1’dir (57). ELISA ve immunopresipitasyonla ölcüldüğünde içeriğinde 7 kat artmış TGF-β, 30 kat artmış PDGF ve 10 kat artmış EGF görüldüğü çalışmalar mevcuttur (58). PDGF, hem platelet hem de makrofajda bulunur. Mezenşimal hücreler için mitojen ve kemoatraktandır. Travma bölgesinde revaskularizasyona izin verir, kollagen sentezi, kok hücre ve osteoblast mitogenezinde rol alır. PRP kullanımının çoklu büyüme faktörü içermesi, otolog olması, platelet jel şeklinde verildiğinde yavaş salınıma izin vermesi ve hemen ortamdan geri çekilmemesi ile topikal olarak kullanılan rhPDGFBB’ye üstünlüğü vardır. Ayrıca PRP’nin rhPDGF-BB’den yarı ömrünün uzun olması, uzun sureli tedavide PRP’nin daha uygun fiyatı olması, yine PRP’nin ihtiyaç duyulduğunda hemen hazırlanıp tatbik edilebilmesi gibi rhPDGF-BB kullanımına karşı üstünlükleri vardır. Ayrıca kronik yaralarda PDGF’nin ekspresyonunun artmasıyla hücrelerde malin transformasyon riskinin arttığı ve rhPDGF-BB’nin 3 tüpten fazla kullanımının malinite hikayesi olan hastalarda artmış mortalite riski ile ilgili olduğuna dair yönelik 2008’de FDA tarafından bildirilmiş uyarı mevcuttur. Bu yüzden bu hastalarda kullanılması tavsiye edilmemektedir. Diğer bir büyüme faktörü de TGF-s’dır. Platelet ve makrofajda bulunur. Fibroblast, farklılaşmamış kemik iliği hücreleri, preosteoblastları uyarır. Remodelizasyon safhasında rol alır. Bunun da proosteoblast farklılaşması ve osteoblast akumulasyonu gibi görevleri vardır. VEGF ve EGF; anjiyogenez, bazal membran formasyonu, endotel farklılaşmasında rol oynar. Bu büyüme faktörleri mezenşimal hücreler üzerindeki reseptöre bağlanırlar. Hücre içine ve hücre nükleuslarına penetre olmadıklarından dolayı tümör formasyonunu indüklemezler (59). PRP içeriğindeki maddeler konsantrasyon farkı nedeniyle basit difüzyonla tatbik bölgesindeki mikroçevreye yayılır. Verildiği bölgede kalması önemlidir. Jel olarak verildiğinde zaten greft materyali tarafından oluşturulan sınırlayıcı mikroçevre ve yüksek vizkozitesi nedeni kan dolaşımına çok geçmesi zordur. Aksi takdirde istenmeyen yan etkileri olabilir (60). Doku rejenerasyonu, yeni kapiller oluşumu, epitelizasyonun artırılmasının yanında içerdiği az miktar lökosit ve salgıladığı lökosit atraktan sinyal proteinleriyle immun yanıta katkıda bulunur. Daha önceki çalışmalarda E. coli, S.