T.C.
SELÇUK ÜNĠVERSĠTESĠ SA ĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
KONYA BÖLGESĠNDE GESTASYONEL DĠABETES MELLĠTUS
HASTALARINDA PANKREATĠK β-HÜCRE ATP-BAĞIMLI
POTASYUM KANAL (K
ATP) PROTEĠNĠ KĠR6.2’YĠ ġĠFRELEYEN
KCNJ11 GENĠNĠN TARANMASI
Sevgi BOZKURT
YÜKSEK LĠSANS TEZĠ
TIBBĠ BĠYOLOJĠ ANABĠLĠM DALI
DanıĢman
Yrd. Doç. Dr. Hilal ARIKOĞLU
T.C.
SELÇUK ÜNĠVERSĠTESĠ SA ĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
KONYA BÖLGESĠNDE GESTASYONEL DĠABETES MELLĠTUS
HASTALARINDA PANKREATĠK β-HÜCRE ATP-BAĞIMLI
POTASYUM KANAL (K
ATP) PROTEĠNĠ KĠR6.2’YĠ ġĠFRELEYEN
KCNJ11 GENĠNĠN TARANMASI
Sevgi BOZKURT
YÜKSEK LĠSANS TEZĠ
TIBBĠ BĠYOLOJĠ ANABĠLĠM DALI
DanıĢman
Yrd. Doç. Dr. Hilal ARIKOĞLU
Bu araĢtırma Selçuk Üniversitesi Bilimsel AraĢtırma Projeleri Koordinatörlüğü tarafından 13202015 proje numarası ile desteklenmiĢtir.
ÖNSÖZ
DanıĢmanlığımı yapan ve çalıĢmalarım süresince gerek akademik birikimiyle gerekse manevi yönden desteğini esirgemeyen sayın Yrd. Doç. Dr. Hilal ARIKOĞLU‘na,
ÇalıĢma süresince her türlü desteği ve yardımı sağlayan sayın Öğr. Gör. Dr. Dudu ERKOÇ KAYA‘ya,
Bu süreçte beni destekleyen ve yardımlarını esirgemeyen değerli arkadaĢlarım ArĢ. Gör. Ebru AVCI ve ArĢ. Gör. Aycan AġIK‘a
ÇalıĢma gruplarının oluĢturulmasında yardımcı olan sayın Yrd. Doç. Dr. Süleyman Hilmi ĠPEKÇĠ ve Uz. Dr. Süleyman BALDANE‘ye,
Hastalarla iletiĢime geçmemde yardımcı olan Endokrinoloji Bilim Dalı çalıĢanlarına,
YaĢamımın her aĢamasında olduğu gibi tüm eğitim hayatımda ve özellikle yüksek lisans sürecimde yanımda olan, beni motive ederek güç veren ve her türlü desteği sağlayan sevgili annem, babam ve kardeĢlerime sonsuz teĢekkürlerimi sunarım.
ĠÇĠNDEKĠLER Sayfa
SĠMGELER VE KISALTMALAR ...iv
1. GĠRĠġ... 1
1.1. Diabetes Mellitus ... 1
1.2. Diabetes Mellitus‘un Etiyolojik Sınıflandırması ... 2
1.3. Tip 2 Diabetes Mellitus ... 5
1.3.1. Tip 2Diabates Mellitus‘ un Epidemiyolojisi... 5
1.4. Gestasyonel Diabetes Mellitus ... 6
1.4.1. Gestasyonel Diabetes Mellitus‘un Epidemiyolojisi... 7
1.4.2. Gestasyonel Diabetes Mellitus Ġçin Risk Faktörleri ... 8
1.4.3. Gestasyonel Diabetes Mellitus Taraması ve Tanı Kriterleri... 8
1.4.4. Gestasyonel Diabetes Mellitus‘un Anne ve Bebekte OluĢturduğu Komplikasyonlar... 10
1.4.5. Gestasyonel Diabetes Mellitus‘un Tedavisi ... 11
1.4.6. Gebelikte Glukoz Metabolizması ... 12
1.4.7. Gestasyonel Diabetes Mellitus‘un Genetiği ... 13
1.5. Pankreatik β Hücrelerinde Ġnsülin Salınım Mekanizması ... 14
1.6. ATP bağımlı Potasyum Kanalı (KATP) ve Kir6.2 Proteini... 16
1.7. KCNJ11 Geni... 17
2. GEREÇ VE YÖNTEM ... 23
2.1. Hasta ve Kontrol Gruplarının OluĢturulması... 23
2.2. DNA Ġzolasyonu, PZR ve Agaroz Jel Elektroforezi Ġçin Gerekli Olan Gereçler... 23
2.3. DNA Ġzolasyonu, PZR ve Agaroz Jel Elektroforezi Ġçin Gerekli Olan Kimyasal Maddeler... 23
2.4. DNA Ġzolasyonu ... 24
2.4.1. DNA Ġzolasyonu Ġçin Gerekli Solüsyonların Hazırlanması ... 24
2.4.2. DNA Eldesi... 25
2.5. Hedef Gen Bölgelerinin Belirlenmesi ve Primer Tasarımı... 26
2.6. Polimeraz Zincir Reaksiyonu (PZR) Uygulaması ... 28
2.6.1. Gradient PZR ... 28
2.7. Agaroz Jel Elektroforezi ... 29
2.7.1. Jelin Hazırlanması ... 29
2.7.2. Örneklerin Jele Yüklenmesi ... 29
2.7.3. Örneklerin Jelde Yürütülmesi ... 30
2.7.4. Görüntüleme ... 30
2.7.5. Agaroz Jel Elektroforezinde Kullanılan Çözeltilerin Hazırlanması ... 30
2.8. Dizi Analizi... 30
2.9. Ġstatistiki Analizler... 30
2.10. Etik Kurul Onayı ve Bilimsel AraĢtırma Projesi Desteği ... 31
3. BULGULAR ... 32
3.1. ÇalıĢma Gruplarının Klinik Özellikleri ... 32
3.2. KCNJ11 Genindeki SNP‘ lerin Belirlenmesi ... 33
3.3. ĠliĢki Analizi ... 36 3.4. Genotip-Fenotip ĠliĢkisi ... 38 4. TARTIġMA ... 39 5. SONUÇ VE ÖNERĠLER ... 43 6. KAYNAKLAR ... 44 7. EKLER ... 53
EK-A: Etik Kurul Kararı ... 53
8. ÖZGEÇMĠġ ... 54
iv
SĠMGELER VE KISALTMALAR
ABCC8: ATP-bağlanma kaset proteinleri C alt familyası elemanı 8
ACOG: Amerikan Obstetrik ve Jinekologlar Birliği
ADA: Amerikan Diyabet Cemiyeti AKġ: Açlık kan Ģekeri
APG: Açlık plazma glukozu
β: Beta
BGT: BozulmuĢ glukoz toleransı
Ca+2: Kalsiyum
DM: Diabetes Mellitus
GDM: Gestasyonel Diabetes Mellitus
GWA: Genom boyu iliĢki çalıĢması
HAPO: Hyperglycemia and Adverse Pregnancy Outcome
HOMA-IR: Ġnsülin direncinin homeostatik model değerlendirmesi
IADPSG: Uluslararası Diyabetik Gebelik Çalısma Grupları Birliği
IDF: Uluslararası Diyabet Federasyonu
IFG: Bozulmus açlık glukozu
IR: Ġnsülin direnci
K+: Potasyum
KCNJ11: Potasyum Kanalı J alt familyası içeri rektifiye elemanı 11
OAD: Oral antidiyabetik
OGTT: Oral glukoz tolerans testi
PZR: Polimeraz zincir reaksiyonu
SNP: Tek nükleotid değiĢimi
T1DM: Tip 1 Diabetes Mellitus
T2DM: Tip 2 Diabetes Mellitus
TEMD: Türkiye Endokrinoloji ve Metabolizma Derne ği
VKĠ: Vücut kitle indeksi
ÖZET
T.C.
SELÇUK ÜNĠVERSĠTESĠ SAĞLIK BĠLĠMLERĠ ENSTĠTÜSÜ
Konya Bölgesinde Gestasyonel Diabetes Mellitus Hastalarında Panreatik β-hücre ATP-bağımlı Potasyum Kanal (KA TP) Proteini Kir6.2’yi ġifreleyen
KCNJ11 Geninin Taranması
Sevgi BOZKURT Tıbbi Biyoloji Anabilim Dalı
YÜKSEK LĠSANS TEZĠ / KONYA-2015
Gestasyonel Diabetes Mellitus (GDM) değiĢik Ģiddette hiperglise mi ile sonuçlanan gebelik sırasında baĢlamıĢ veya ilk defa gebelik sırasında fark edilmiĢ olan herhangi bir düzeydeki glu koz tolerans bozukluğudur ve Tip 2 Diabetes Mellitus (T2DM) geliĢimi için yatkın lık o luĢturmaktadır. GDM genellikle doğumla birlikte kaybolur ve kan Ģekeri norma l sınırlara düĢer. Doğumdan sonra diyabetin kalıcı olma ihtimali ise %5 civarındadır. BeĢ yıl içinde T2DM geliĢ me riski %50‘d ir ve sonraki gebeliklerde %45‘lik bir frekansta tekrarlayabilme ktedir. GDM‘li bireylerin daha sonra T2DM‘ye yakalan ma riskinin yüksek olması ve yine T2DM aile öyküsü olan bireylerde de GDM geliĢ me riskin in yüksek olması her iki hastalığın aynı genetik zemine sahip olabileceğini düĢündürmektedir. Bu nedenle özellikle son yıllarda T2DM‘nin genetik mimarisi ü zerine yoğunlaĢmıĢ aday gen çalıĢmaları, bağlantı çalıĢmaları ve genom boyu iliĢki çalıĢmaları (GWA) ile ortaya konan genler ve risk varyantlarının GDM geliĢimi üzerinde etkileri araĢtırılmaktadır. Bu çalıĢmada da, T2DM‘ye geçiĢ sürecinin önemli belirleyicisi olan GDM‘nin ortaya çıkmasında genetik yatkınlık oluĢturabileceği düĢünülen Kir6.2 kanal proteinin i kodlayan KCNJ11 genin in bizim toplu mu muzdaki GDM‘li b ireylerde taran ması ve literatürde yayınlanan polimorfizmlerin ve varsa toplumu muza ö zgü yeni polimorfizmlerin frekansları tespit edilerek hastalıkla iliĢkileri bakımından d eğerlendirilmesi amaçlan mıĢtır.
ÇalıĢ mamıza Selçuk Ün iversitesi Tıp Fakü ltesi Dah iliye Anabilim Dalı Endokrinolo ji Bilim Dalına baĢvuran; ADA kriterlerine göre GDM tanısı kon muĢ 50 hasta ve kontrol grubu için 41 sağlıklı gebe dahil edildi. KCNJ11 geninin kodlanan bölgesinin tamamı Po limeraz Zincir Reaksiyonu (PZR) ile çoğaltılarak çift yönlü dizi analizi ile değerlendirild i. Biyokimyasal tetkik lerde; gluko z ve insülin düzeyleri ölçüldü. Tü m analizlerde P<0.05 istatistiksel olarak anlamlı kabul ed ild i. Çal ıĢ mamızda literatürde rapor edilen 15 SNP‘ ten sadece 5 tanesi tespit edildi. Literatürden farklı olarak toplumu muza ö zgü yeni bir varyasyon tespit edilmedi. L267L ve L270V polimorfizmlerinin görülme sıklıkların ın çok düĢük olması nedeniyle istatistik analizleri yapılamadı. Aditif, dominant ve resesif modeller kurularak yapılan iliĢki analizlerinde E23K (rs5219), A190A (rs5218), I337V (rs5215) polimorfizmle rin in GDM ile anla mlı b ir iliĢkisi saptanmadı (P>0.05).
Sonuç olarak; bugüne kadar birçok populasyonda, T2DM‘nin genetik zemininde yer ald ığı gösterilen KCNJ11 genindeki polimorfizmler ile bizim toplu mu mu zda GDM hastalığı arasında bir iliĢki tespit edilmed i. Bu çalıĢ ma ile ülkemizde ilk kez GDM‘nin genetik zeminine yönelik popülasyon temelli b ir yaklaĢımla KCNJ11 geninin etkisi araĢtırıld ı ve daha sonra yapılacak çalıĢ malar için b ir temel oluĢturuldu.
Anahtar kelimeler: Gestasyonel diabetes mellitus; KCNJ11 geni; Kir6.2 kanal proteini;
SUMMARY REPUBLIC of TURKEY SELÇUK UNIVERSITY HEALTH SCIENCES INSTITUTE
Screening of KCNJ11 Gene Encoding Kir6.2 That is Pancreatic β-cell ATP-dependent Potassium Channel (KATP) Protein at Patients With Gestational
Diabetes Mellitus in Konya Region
Sevgi BOZKURT
Department of Medical Biology
MASTER THESIS / KONYA-2015
Gestational Diabetes Mellitus (GDM) is impa ired glucose tolerance at any level, which began during pregnancy or was noticed for the first time during pregnancy resulting in varying degrees of hyperglycemia and predispose to the development of Type 2 Diabetes Mellitus (T2DM). GDM usually disappears at birth and the blood sugar decreases within normal limits. Permanent d iabetes after birth is like ly to be around 5%. The risk o f developing T2DM is 50% within five years and it can be repeated around subsequent pregnancies with 45% frequency. Because of the high risk of developing T2DM later in individuals with GDM and also the high risk of developing GDM in individuals with fa mily history of T2DM, suggests that both diseases may have the same genetic background. Therefore, especially in last years the effects of genes and risk variants determined by candidate gene studies, linkage studies and genome-wide association studies (GWA) concentrated in T2DM genetic architecture, on GDM developing have been investigated. Ġn this study, we aimed to scan the KCNJ11 gene which encodes Kir6.2 channel protein, thought to make susceptible to GDM development a mong individuals with GDM in our population and to evaluate the associations with the disease by determining the polymorphis ms reported in the literature and the new ones spe cific to our population if any.
Fifty patients diagnosed as GDM according to ADA criteria and 41 healthy pregnant wo men.for control group fro m Se lcuk Un iversity Faculty of Medicine, Depart ment of Internal Medicine, Endocrinology Depart ment were included in our study. The whole coding region of the KCNJ11 gene were a mp lified by polyme rase chain reaction (PCR) and was evaluated by two -way sequencing analysis. In biochemica l tests; glucose and insulin levels we re measured. In a ll analy zes, P<0.05 was considered statistically significant. In our study, 5 of the 15 SNPs reported in the literature (Gen Bank) were determined. We did not find any new po lymorphis m specific to our population. Statistical analysis could not be performed for L267L and L270V poly mo rphism because of their low frequency. No significant association was determined between E23K (rs5219), A190 (rs5218) , I337V (rs5215) poly morphisms with GDM under additive, dominant and ressesive models (P > 0.05).
In conclusion; no association was determined between GDM and the polymorphis ms in KCNJ11 wh ich have shown in the genetic basis of T2DM in many populations until today. With this study for the first time the effect of KCNJ11 gene on genetic basis of GDM was investigated by a population based study and presented a basic work for subsequent studies.
Ke y wor ds: Gestational diabetes mellitus; KCNJ11 gene; Kir6.2 channel protein; SNP; Type
1
1.GĠRĠġ
1.1. Diabetes Mellitus
Diabetes mellitus (DM), pankreatik β -hücrelerinden insülin salınımı ve hedef hücrelerde (baĢlıca karaciğer, kas ve yağ) insülin aktivitesi veya bu faktörlerin her ikisinde de bozulma sonucunda ortaya çıkan ve kan Ģekeri yüksekliği (hiperglisemi) ile karakterize kronik metabolik bir hastalıktır (AltuntaĢ 2001, Powers 2001, Arslan 2003, Ġmamoğlu 2005, Ulusal Diyabet Kongresi Konsensus Grubu 2013). Uzun süreli hiperglisemi sonucu karbonhidrat, yağ ve protein metabolizmasında bozukluklara sebep olur (ADA 2009).
Diyabet, dünya genelinde kentleĢme ile birlikte yaĢam tarzı değiĢiklikleri, obezitenin artması, fiziksel aktivitenin azalması, stres, sigara kullanımı gibi faktörler nedeniyle endiĢe verici bir Ģekilde artmaktadır. 2011 yılında dünya genelinde DM tanısı konmuĢ yaklaĢık 366 milyon kiĢi var olup, bu sayının 2030 yılında 552 milyona yükselmesi beklenmektedir (Gardner ve Shoback 2007).
Tüm diyabetlilerin %90-95‘ini tip 2 diabetes mellitus (T2DM) oluĢturmaktadır (ADA 2008). T2DM semptom vermeyen düzeyde hiperglisemi nedeniyle uzun yıllar tanı konmadan devam ederken, tip 1 diabetes mellitus (T1DM)‘da ketoasidozisten dolayı hastalığın erken döneminde tanı konmaktadır. Bazı durumlarda ise hipergliseminin ciddi patolojik ve fonksiyonel bozukluklara sebep olması T2DM tanısı konmadan dahi organ hasarı ile sonuçlanabilmektedir.
Pankreatik beta (β) hücrelerinde sentezlenen ve salgılanan insülin hormonunun hemen hemen tüm dokularda karbohidrat, yağ ve protein metabolizmasının düzenlenmesindeki önemli rolleri nedeniyle homeostazisindeki bozulma, baĢlıca karaciğer, yağ ve kas dokuları olmak üzere, tüm doku ve organları etkilemektedir. Genellikle diyabetin uzun süreli etkileri mikro ve makrovasküler komplikasyonları da beraberinde getirmektedir. Mikrovasküler komplikasyonlar özellikle böbrek ve retinada ince kapillerlerde kan dolaĢımının bozularak bu doku ve organların hasar görmesine yol açan temel nedenlerdir. Makrovasküler komplikasyonlar ise hipertansiyon, koroner arter hastalığı, periferal ve serebral vasküler hastalıklar ile hiperlipidemiyi içermektedir. Ayrıca diyabetik hastalarda nöropatide geliĢebilmekte ve bu durum ayak ülserleri, ampütasyonlar, seksüel disfonksiyon ve iyileĢmeyen cilt yaralarına yol açabilmektedir. Tüm bu komplikasyonlarla birlikte diyabetik bireylerde stafilokok sepsisi gibi bazı enfeksiyonlar da daha sık görülmektedir.
2 Diyabetten etkilenen doku ve organların çeĢitliliği, diyabetli bireylerin yaĢam kalitesini etkilediği gibi sağlık sistemine de artan bir maliyet getirmekte ve bu da kiĢisel maliyetlerin yanı sıra toplumsal düzeyde sağlık hizmetlerinin ve kaynaklarının en çok kullanıldığı hastalık olmasına yol açmaktadır. Türk Diyabet Cemiyeti ülkemizde diyabet hastalığına bağlı organ kayıpları, körlük, by-pas ameliyatları, diyaliz tedavileri için devletin yıllık 6-7 milyar dolar harcadığını rapor etmiĢtir (http://www.diabetcemiyeti.org).
1.2. Diabetes Mellitus’ un Etiyolojik Sınıflaması
Diabetes mellitusun sınıflandırılmasında dört klinik tip yer almaktadır. Bunlardan üçü (tip 1 diabetes mellitus, tip 2 diabetes mellitus ve gestasyonel diabetes mellitus) primer, diğeri (spesifik diyabet tipleri) ise sekonder diyabet formları olarak bilinmektedir (Satman ve ark 2013).
I. Tip 1 Diabetes Mellitus (T1DM): Bu tipte genellikle mutlak insülin noksanlığına sebep olan β -hücre yıkımı vardır. Ġki gruba ayrılır:
A. Ġmmun aracılıklı
B. Ġdiyopatik
II. Tip 2 Diabetes Mellitus (T2DM): Ġnsülin direnci zemininde ilerleyici insülin salınımı bozukluğu ile karakterizedir.
III. Gestasyonel Diabetes Mellitus (GDM): Gebelik sırasında ortaya çıkan ve genellikle doğumla birlikte düzelen diyabet tipidir.
IV. Diğer spesifik diyabet tiple ri
A. β-hücre fonksiyonlarının genetik defekti (monogenik diyabet formları)
20. Kromozom , HNF-4a (MODY1) 7. Kromozom, Glukokinaz (MODY2) 12. Kromozom, HNF-1a (MODY3) 13. Kromozom, IPF-1 (MODY4) 17. Kromozom, HNF-1b (MODY5) 2. Kromozom, NeuroD1 (MODY6)
3 2. Kromozom, KLF11 (MODY7)
9. Kromozom, CEL (MODY8) 7. Kromozom, PAX4 (MODY9) 11. Kromozom, INS (MODY10) 8. Kromozom, BLK (MODY11) Mitokondriyal DNA
11. Kromozom, Neonatal DM (ABCC8, KCNJ11 mutasyonu) Diğerleri
B. Ġnsülinin etkisindeki genetik defektler Leprechaunism
Lipoatrofik diyabet
Rabson-Mendenhall sendromu Tip A insülin direnci
Diğerleri
C. Pankreasın ekzokrin doku hastalıkları Fibrokalkulöz pankreatopati Hemokromatoz Kistik fibroz Neoplazi Pankreatit Travma/pankreatektomi Diğerleri D. Endokrinopatiler Akromegali Aldosteronoma Cushing sendromu Feokromositoma Glukagonoma Hipertiroidi Somatostatinoma Diğerleri
4
E. Ġlaç veya kimyasal ajanlara bağlı olarak görülen diyabet tiple ri Atipik anti-psikotikler
Anti- viral ilaçlar β-adrenerjik agonistler Diazoksid
Fenitoin
Glukokortikoidler α –Ġnterferon
Diğerleri (Pentamidin , Nikotinik asit, Proteaz inhibitörleri, Post transplant diyabet gibi)
F. Ġmmun aracılıklı nadir diyabet formları Anti-- insülin reseptör antikorları
―Stiff-man‖ sendromu Diğerleri
G. Diyabetle iliĢkili genetik sendromlar Alström sendromu
Down sendromu Friedreich tipi ataksi Huntington korea Klinefelter sendromu Laurence-Moon-Biedl sendromu Miyotonik distrofi Porfiria Prader-Willi sendromu Turner sendromu
Wolfram (DIDMOAD) sendromu Diğerleri
H. Ġnfeksiyonlar Konjenital rubella Sitomegalovirus Koksaki B
5
1.3. Tip 2 Diabetes Mellitus
Ġnsülin direnci ve/veya insülin salgılanmasında azalma sonucunda ortaya çıkan diyabet tipi olup tüm diyabetlilerin %90-95‘ini oluĢturmaktadır (ADA 2008). T2DM uzun yıllar insülin direnci ile seyretmekte, insulin sekresyonunda ciddi azalma ise diyabetin ileri dönemlerinde veya araya giren hastalıklar sırasında ön plana çıkmaktadır (Satman ve ark 2009).
T2DM genellikle 40 yaĢından sonra ortaya çıkan, yaĢ arttıkça görülme sıklığı artan, kronik komplikasyonların sık görüldüğü ve özellikle baĢlangıç dönemlerinde insüline ihtiyaç duyulmayan, diyet ve oral antidiyabetik ajanlarla kontrol altına alınabilen diyabet tipidir. Ġnsülin eksikliğinden çok obezite, dokularda insülinin kullanılamaması (insülin direnci) ve sonrasında geliĢen insülin sekresyon bozukluğu ve hepatik glukoz üretiminde artıĢ ile karakterizedir (ADA 2003).
1.3.1. Tip 2 Diabetes Mellitus’un Epidemiyolojisi
T2DM eriĢkin toplumda en sık görülen metabolizma hastalığıdır. T2DM görülme oranı geliĢmiĢ ülkelerde toplumun %5-10‘u kadardır (Lakso 2003). Genellikle orta- ileri yaĢ hastalığı olarak kabul edilmekle birlikte, son zamanlarda daha genç yaĢlarda da T2DM vakaları görülmektedir (Zimmet ve ark 2002, Balkau ve Eschwege 2003, International Diabetes Federation 2003). YaĢam tarzı ile alakalı olarak düzensiz ve dengesiz beslenme ile birlikte, fiziksel aktivite azlığı gibi çevresel faktörler hastalığın ortaya çıkıĢ hızını artırmaktadır (Ġmamoğlu 2009).
1997-1998 yıllarında ülke genelinde 270 köy ve 270 mahalle merkezinde gerçekleĢtirilen ve rastgele seçilmiĢ 20 yaĢın üzerinde 24 788 kiĢiyi kapsayan ‗Türkiye Diyabet Epidemiyoloji ÇalıĢması (TURDEP I)‘nın sonuçlarına göre ülkemizde diyabet prevalansı %7.2, bozulmuĢ glukoz toleransı (BGT) prevalansı ise %6.7 bulunmuĢtur. Hem diyabet hem de BGT kadınlarda erkeklere göre daha sık saptanmıĢ olup, Ģehirlerde yaĢayanlarda kırsal kesimlerde yaĢayanlara göre daha fazla olduğu belirlenmiĢtir (Satman ve ark 2002).
Ocak 2010-Haziran 2010 tarihleri arasında 15 ilden 540 merkezde rastgele seçilmiĢ 20 yaĢ ve üzeri 26 499 kiĢinin katıldığı ‗Türkiye Diyabet, Hipertansiyon, Obezite ve Endokrinolojik Hastalıklar Prevalans ÇalıĢması-II (TURDEP-II ÇalıĢması)‘nin sonuçlarına göre; Türk eriĢkin toplumunda diyabet prevalansı %13.7, BGT prevalansı ise %13.9 bulunmuĢtur. TURDEP-II sonuçları, ülkemizde 12 yılda
6 diyabet prevalansının %90, BGT prevalansının ise %106 oranında arttığını göstermektedir. TURDEP-I sonuçlarına göre kentlerde diyabet oranı biraz daha yüksek olmakla birlikte, TURDEP-II sonuçları kentsel ve kırsal alanda yaĢayanlar arasında diyabet sıklığı açısından anlamlı bir fark olmadığını göstermiĢtir. Ayrıca diyabet sıklığı erkeklerde kadınlara oranla biraz daha düĢük bulunmuĢ olup kadın ve erkekler arasında çok anlamlı bir fark görülmemiĢtir (Satman 2011). Uluslararası Diyabet Federasyonu‘nun Türkiye için yaptığı öngörüde diyabet oranın 2030 yılında %9.7‘ye ulaĢması beklenirken; TURDEP-II sonuçlarına göre bu oranın çoktan aĢıldığı görülmektedir (International Diabetes Federation 2011).
Tüm dünyada tanı konulan diyabet vakalarının %90-95‘ini tip 2 diyabet, %5-10‘unu tip 1 diyabet ve %2-3‘ünü ise diğer diyabet tipleri oluĢturmaktadır (Satman 2009). Dünya genelinde özellikle Amerika BirleĢik Devletlerinde Arizonadaki Pima yerlilerinde %50 ve Güney Pasifikte Nauru Adasında %40 ile en yüksek oranlarda görülmektedir (Buse ve ark 2008). En fazla diyabetlinin bulunduğu yaĢ aralığı 40-59 olup, bu grup tüm diyabetlilerin %46‘sını kapsamaktadır (International Diabetes Federation 2006).
1.4. Gestasyonel Diabetes Mellitus
GDM değiĢik Ģiddette hiperglisemi ile sonuçlanan gebelik sırasında baĢlamıĢ veya ilk defa gebelik sırasında fark edilmiĢ olan herhangi bir düzeydeki glukoz tolerans bozukluğudur (Proceedings of the 4th International Workshop- Conference on Gestational Diabetes Mellitus 1998, Turok ve ark 2003, Azal 2010). Gebelikten önce bilinen diyabeti olanlar bu tanım içerisine girmezler (Metzger ve Coustan 1998). Gebelikte fetüse ihtiyaç duyduğu besin ve enerji desteğini sağlamak amacıyla fizyolojik olarak insülin direnci ve hiperinsülinemi geliĢmektedir. Eğer anne pankreası bu fizyolojik insülin direncini aĢacak ölçüde insülin salgılayamazsa gestasyonel diyabet ortaya çıkmaktadır (Proceedings of the 4th International Work shop- Conference on Gestational Diabetes Mellitus 1998). GDM olgularının büyük bir kısmında glukoz tolerans bozukluğu gebelik esnasında baĢlamaktadır. Hastaların az bir kısmında ise daha önceden fark edilmemiĢ tip 2 diyabet bulunmaktadır (Sönmez ve Kutlu 2010).
Gestasyonel diabetes mellitus genellikle do ğumla birlikte kaybolur ve kan Ģekeri normal sınırlara düĢer. Doğumdan sonra diyabetin kalıcı olma ihtimali ise %5 civarındadır. 5 yıl içinde tip 2 diyabet geliĢme riski %50‘dir (Zimmet ve Shaw 2005,
7 Dinççağ 2008, Azal 2010, Powers 2012). Ayrıca gestasyonel diabetes mellitusun daha sonraki gebeliklerde % 45‘lik bir frekansta tekrarlayabileceği bildirilmiĢtir (Kwak ve ark 2008). Doğumdan sonra 6 ay içinde oral glukoz tolerans testi (OGTT) yapılarak glukoz metabolizmasının kontrol edilmesi gerekmektedir. Çünkü birçok GDM‘li kadında ilerleyen yıllarda T2DM, bozulmuĢ açlık glukozu (IFG), bozulmuĢ glukoz toleransı (BGT) ve lipid metabolizma bozuklukları geliĢmektedir. Yani GDM, T2DM geliĢimi için yatkınlık oluĢturmaktadır (Kitzmiller ve ark 2007, Ratner 2007, Bentley- Lewis ve ark 2008, Sönmez ve Kutlu 2010). Korelilerde yapılan bir çalıĢmada T2DM riskinin genel popülasyona göre GDM öyküsü olan kadınlarda 3,5 kat daha fazla olduğu gösterilmiĢtir (Lee ve ark 2008). Ayrıca GDM‗si olanlarda Tip 2 diyabet prevalansı Kafkaslarda %9, Asyalılarda %25, Ġspanyollarda %47 ve Kanadalılarda %70 olarak bulunmuĢtur (Henry ve ark 1993).
1.4.1. Gestasyonel Diabetes Mellitus’ un Epidemiyolojisi
GDM görülme sıklığı etnik ve ırksal faktörlere bağlı olarak değiĢkenlik göstermektedir. ABD‘de beyazlarda görülme sıklığı en düĢük, Afrika kökenlilerde, Güney Amerika kökenlilerde veya Yerliler‘de ise yüksektir (Centers for Disease Control 1993). Ortalama anne yaĢı ve kilosu da görülme sıklığındaki değiĢkenliği belirleyen önemli faktörlerdir (Dabelea ve ark 2005). Ayrıca aile öyküsünde tip 2 diyabet olan kadınlarda GDM geliĢme riski artmıĢtır (Williams ve ark 2003). Prevalansı kullanılan yöntem ve taranan topluluklara göre değiĢmekle birlikte kabaca tüm gebeliklerin %7‘sinde GDM bulunmaktadır (Expert Committee on the Diagnosis and Classification of Diabetes Mellitus 2003, Sönmez ve Kutlu 2010).
Türkiye‘de yapılan çalıĢmalar da GDM sıklığının arttığını göstermektedir. Ġstanbul Tıp Fakültesi‘nde 1996-1998 yılları arasında yapılan çalıĢmaya katılan gebelerde GDM prevalansı %2 iken, 2005-2010 döneminde %5,8‘e yükselmiĢtir (Dinççağ ve ark 2011). 2006-2008 yılları arasında Erciyes Üniversitesi Kadın Hastalıkları ve Doğum Kliniği‘ ne baĢvuran gebelerin değerlendirildiği çalıĢmada gestasyonel diyabet oranı %11,2 olarak tespit edilmiĢtir (Gürel ve ark 2009). TURDEP I ve II çalıĢmalarında belirtilen, Türkiye‘de diyabet prevalansında son 12 yıldaki %90 artıĢ (%7,2→%13,7) göz önünde bulundurulduğunda, GDM görülme sıklığının artması ĢaĢırtıcı değildir (Satman ve ark 2002, Satman 2011).
8
1.4.2. Gestasyonel Diabetes Mellitus Ġçin Risk Faktörleri
GDM geliĢme riskini arttırdığı bildirilen çok sayıda faktör bulunmaktadır. Bunların bazıları aĢağıda belirtilmiĢtir (Solomon ve ark 1997, Egeland ve ark 2000, Sönmez ve Kutlu 2010, Yılmaz 2010):
25 yaĢın üzerinde olmak
Obezite (vücut kitle indeksinin 30 kg/m2 veya üzerinde olması) Daha önce 4,0 kg üzeri bebek dünyaya getirmiĢ olmak
Anormal glukoz toleransı öyküsü bulunması Ailede diyabet öyküsü bulunması
Tip 2 diyabet geliĢim riskinin yüksek olduğu bir etnik gruba dahil olmak Daha önce nedeni belirlenememiĢ perinatal kayıp veya malforme çocuk doğurmuĢ olmak
Annenin doğum ağırlığının 2,7 kg‘dan düĢük yada 4 kg‘dan yüksek olması Ġlk prenatal vizitte glukozüri bulunması
Polikistik over sendromu bulunması Kortikosteroid kullanıyor olmak
Esansiyel hipertansiyon ve gebelik hipertansiyonu varlığı
1.4.3. Gestasyonel Diabetes Mellitus Taraması ve Tanı Kriterle ri
GDM açısından taranması gereken gebe bireyler ile ilgili farklı görüĢler vardır. Türkiye Endokrinoloji ve Metabolizma Derneği (TEMD) diyabet kılavuzunda ilk prenatal muayeneden itibaren risk değerlendirilmesi yapılması, yüksek risk gruplarından birine dâhil gebelerde, gebeliğin baĢlangıcında diyabet araĢtırması yapılması, test negatif ise daha sonraki trimesterlerde tekrarlanması önerilmektedir (Satman ve ark 2011). Amerikan Diyabet Birliği‘ne (ADA) göre ise düĢük risk grubundaki tüm nitelikleri taĢıyan kadınlarda tarama yapmaya gerek yoktur (Singh ve Rastogi 2008). 25000 gebe üzerinde yapılan bir çalıĢmada ADA kriterleri dikkate alındığında, bu gebeliklerin %10‘unda taramanın hiç yapılmamıĢ olacağı ve bundan dolayı gestasyonel diyabet olgularının %4‘ünün gözden kaçırılacağı gösterilmiĢtir (Williams ve ark 1999).
Amerikan Obstetrik ve Jinekoloji Uzmanları Birliği (ACOG) ise ADA‘ nın tarama ile ilgili görüĢlerini kabul etmekle birlikte, herkesi taramanın en duyarlı ve
9 pratik yöntem olduğunu bildirmektedir (ACOG 2001). Amerikan Milli Sağlık Enstitüsü (NIH) tarafından yürütülmüĢ olan HAPO (Hyperglycemia and Adverse Pregnancy Outcome) çalıĢmasında, glukoz değerlerindeki artıĢla fetal makrozomi riski arasındaki iliĢkinin sürekli olduğu ve açlık glukoz düzeyleri 75 mg/dl‘ nin üzerine çıkınca baĢladığı, herkese tarama yapmanın gebeliğin olumlu seyretmesi ve sonlanmasına etki eden önemli bir yaklaĢım olduğu bildirilmiĢtir (Metzger ve ark 2008).
GDM taraması açısından en uygun zamanlama gebeliğin 24-28. haftaları arasıdır (Jovanovic ve Peterson 1985). Ancak bu zaman aralığı, belirgin bir risk faktörü olmayan vakalar için geçerlidir, yüksek riskli gebelerde ise görüldükleri ilk ziyaret sırasında tarama yapmanın uygun olduğu belirtilmiĢtir (Metzger ve ark 2007). Ġlk trimesterde açlık glukozu en üst düzeyde olanlarda GDM geliĢme riskinin en alt düzeydeki bireylere oranla 10 kat yüksek olduğu bildirilmiĢtir (Riskin-Mashiah ve ark 2009).
TEMD kılavuzunda; fetüs ve anne adayının sağlığını korumak ve ayrıca ileride geliĢebilecek T2DM ve insülin direnci açısından riskli kadınları izleyebilmek için, Türk toplumunda risk grubunda olsun olmasın tüm gebelerde 24-28. haftalarda GDM araĢtırması yapılması gerektiğine vurgu yapılmaktadır (Satman ve ark 2011).
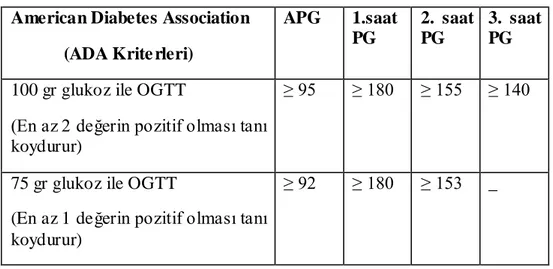
GDM taramasında; günün herhangi bir saatinde, gebeye aç veya tok halde iken 50 gr glukoz içirilir. Birinci saatteki plazma glukoz (PG) normal değeri <140 mg/dl olmalıdır. Birinci saat PG değeri 140-179 mg/dl ise GDM açısından kesin tanı koyabilmek için 100 gr glukozlu 3 saatlik OGTT yapılmalıdır (Çizelge 1.1) (ACOG 2001, ADA 2004, Satman ve ark 2011).
100 g glukoz ile yapılan 3 saatlik OGTT‘de normal değerler APG <95 mg/dl, 1.st PG <180 mg/dl, 2.st PG <155 mg/dl, 3.st PG <140 mg/dl olmalıdır ve bu değerlerden 2 tanesinin yüksek çıkması durumunda GDM tanısı konmaktadır (Çizelge 1.1) (ADA 2004, Satman ve ark 2011).
IADPSG (Uluslararası Diyabetik Gebelik Çalısma Grupları Birliği) kriterlerine göre 75 g glukoz ile yapılan 2 saatlik OGTT‘ de normal değerler APG <92 mg/dl, 1.st PG <180 mg/dl, 2.st PG <153 mg/d l olmalıdır ve bu değerlerden bir tanesinin yüksek çıkması durumunda GDM tanısı konmaktadır. ADA, önceleri klasik iki aĢamalı tarama testini (50 g tarama testi ve sonrasında 100 g glukozlu OGTT) savunurken 2010 yılından bu yana IADPSG kriterlerinin uygulanmasını önermektedir (ADA 2012).
10 50 gr glukoz ile yapılan tarama testinde 1.saat PG ≥180 mg/dl olması durumunda OGTT yapma gereği duyulmayabilir. Böyle durumlarda bu vakalar gestasyonel glukoz intoleransı olarak kabul edilir ve GDM gibi takip edilmelidir (Satman ve ark 2011). GDM Ģüphesi yüksek olan kadınlarda ön tarama testi yapılmaksızın doğrudan 100 gr glukozlu OGTT yapılabilir (Satman ve ark 2011).
Çizelge 1.1. Gestasyonel Diyabet Ġçin Tanı Kriterleri American Diabetes Association
(ADA Krite rleri)
APG 1.saat PG 2. saat PG 3. saat PG
100 gr glukoz ile OGTT
(En az 2 değerin pozitif olması tanı koydurur)
≥ 95 ≥ 180 ≥ 155 ≥ 140
75 gr glukoz ile OGTT
(En az 1 değerin pozitif olması tanı koydurur)
≥ 92 ≥ 180 ≥ 153 _
1.4.4. Gestasyonel Diabetes Mellitus’un OluĢturduğu Komplikasyonlar
GDM anne ve fetüste oluĢturduğu komplikasyonlar nedeniyle klinik açıdan çok önemlidir. GDM gebeliğin ikinci yarısından sonra ortaya çıkmakta ve fetüste intrauterin yaĢamdan doğuma, hatta eriĢkin döneme kadar uzanan süreçte çok sayıda soruna yol açabilmektedir. Bunlar arasında en çok üzerinde durulan makrozomidir. Makrozomi, bebeğin doğum ağırlığının 4000 gramın üzerinde olmasıdır. Gebeliğin son 4-8 haftasında açlık hiperglisemisi nedeniyle intrauterin ölüm riski artmaktadır. Fetüste makrozomi, perinatal mortalite, konjenital malformasyon, hiperbilirübinemi, polisitemi, hipokalsemi gibi durumların gözlenmesi bebekte ilerleyen dönemlerde hastalık görülme riskini artırabilmektedir. Fetal dönemde görülen hiperinsülineminin hepatik glukoz yapımını azaltması neonatal dönemde hipoglisemiye ve kardiyak hipertrofiye yol açarak dolaĢım bozukluğuna, akciğer geliĢiminin gecikmesine ve solunum güçlüğüne (sıkıntılı solunum sendromu) neden olmaktadır. Normoglisemi sağlanamayan GDM‘li annelerin çocuklarında geç adolesan ve eriĢkin dönemde glukoz intoleransı, obezite ve T2DM riskinin yüksek olduğu belirtilmiĢtir. Bundan dolayı GDM‘li annelerin çocuklarının doğumdan itibaren sağlıklı diyet ve yaĢam
11 tarzı alıĢkanlığı kazanmaları çok önemlidir (Brody ve ark 2003, Jolly ve ark 2003, Ahmad ve Vora 2004, Canbaz ve Dinççağ 2010).
GDM‘li kadınlarda diyabetik olmayan gebelere oranla hipertansiyon ve preeklampsi görülme riski 2-4 kat artmıĢtır (Ahmad ve Vora 2004). Fetüs makrozomisi nedeniyle doğum esnasında omuz distosisi riski ve sezaryen operasyonu ile doğum oranı artmıĢtır. Ayrıca gebelikten sonra diyabetin kalıcı olma ihtimali vardır ve ilerleyen yıllarda T2DM geliĢme riski yüksektir (Dinççağ 2008, Canbaz ve Dinççağ 2010).
1.4.5. Gestasyonel Diabetes Mellitus’un Tedavisi
GDM‘de zamanında tanı konulması ve tedavi uygulanması, yenidoğanda ölüm oranını, makrozomiyi ve oluĢabilecek diğer komplikasyonları azaltması bakımından önemlidir (Metzger ve ark 2007). Amerikan Diyabet Cemiyeti yayınladığı bir bildiride gestasyonel diabetes mellitus tanısı konan gebelerde hedeflenen anne kapiler glukoz konsantrasyonunu preprandiyal (yemek öncesi) ≤95 mg/dL, yemek sonrası 1. saat ≤140 mg/dL, yemek sonrası 2. saat ≤120 mg/dL olarak belirtmiĢtir (Standards of medical care in diabetes 2010). Hedeflenen bu değerlere ulaĢabilmek için tıbbi beslenme tedavisi (TBT), egzersiz ve insülin tedavisi uygulanmaktadır.
Tıbbi beslenme tedavisi, GDM tedavisinin en önemli kısmını oluĢturmaktadır. Beslenme planı, gebenin alması gereken minimum besin öğelerini içerecek Ģekilde, kilo kaybı veya aĢırı kilo alımı olmadan glukoz kontrolünün sağlanmasına yönelik hazırlanmaktadır. Günlük alınacak kalori miktarı, vücut kitle indeksine göre ayarlanmaktadır. Alınan kalori miktarının %33-40‘ı karbonhidratlardan, %35-40‘ı yağlardan ve %20‘si proteinlerden olacak Ģekilde ayarlanması gerekmektedir. Diyet uygulanan hastaların %75-80‘inde kan Ģekeri düzeyleri normale dönmektedir (ADA 2004). Ayrıca GDM‘si olan gebelere, öğünlerden sonra yürüyüĢ yapmaları ya da egzersiz yapmaları tavsiye edilmektedir. Egzersiz yapılması dokularda insülin duyarlılığının artmasını sağlayarak kan Ģekerinin düzenlenmesine katkıda bulunmaktadır. Düzenli olarak yapılan aerobik egzersizin açlık ve yemek sonrası (postprandiyal) glukoz değerlerini düĢürdüğü bildirilmiĢtir (Metzger ve ark 2007).
12 Diyet ve egzersizle kan Ģekerinin düzenlenmesinde hedeflenen değerlere ulaĢılamazsa insülin tedavisine geçilmektedir. Amerikan Diyabet Cemiyeti‘nin insülin tedavisine baĢlamak için belirlediği eĢik değerler açlık kan glukozu için 105 mg/dL, yemek sonrası 1. saat kan glukozu için 155 mg/dL ve yemek sonrası 2. saat kan glukozu için 130 mg/dL‘dir (ADA 2003).
1.4.6. Gebelikte Glukoz Metabolizması
Gebelik döneminde büyüyen fetüse yeterli enerji sağlamak amacıyla annede birtakım metabolik değiĢiklikler olmaktadır. Ġlk trimesterde depolanan enerji daha sonraki dönemlerde büyüyen fetüsün ihtiyaçlarını karĢılamak için kullanılmaktadır. Ġlk trimesterde açlık kan glukoz seviyesi glukozun periferik kullanımının artması sebebiyle daha düĢüktür. Tokluk glukoz düzeyleri ise daha uzun süre yüksek kalmaktadır. Bunun sebebi insüline olan periferik direncin artmasıdır. Ġlk trimester annede protein, glikojen ve yağ depolarının arttığı anabolik dönemdir. Gebeliğin ikinci yarısı ise katabolik evredir. Plasental bir hormon olan Human Plasental Laktojen (HPL) miktarı plasenta kütlesi ile doğru orantılı olarak artmaktadır. Bununla birlikte yağ dokusu yıkımı artmakta; böylece glukoz ve aminoasitler fetüsün ihtiyacı için saklanmaktadır. HPL, progesteron, kortizol ve prolaktin insülin direncine sebep olup, insüline duyarlı hücrelerin glukoz alımını bozarak etki göstermektedirler. Bunlar gebeliğin diyabete neden olmasından sorumlu ana hormonlardır. Gebelikte insülin reseptörlerinin oranında azalma yoktur. Ġnsülin direnci muhtemelen postreseptör düzeyde bir bozukluğa bağlı olarak ortaya çıkmaktadır (Moore 2004). Normal bir gebelikte üçüncü trimesterde insülin duyarlılığında %44‘lük bir azalma olduğu görülmüĢtür (The Diabetes Control an Complications Trial Research Group 1996). Diyabetik olmayan gebelerde insülin direncindeki bu artıĢ insülin üretiminin artması ile kolaylıkla dengelenmektedir. Bu dengenin sağlanamadığı hastalarda artmıĢ olan insülin direnci gebelik ilerledikçe hiperglisemiye yol açmaktadır. Normal Ģartlarda yeterli insülin salgılayabilen fakat gebelikte artan insülin direncini karĢılayamayan kadınlarda GDM oluĢur. HPL ve kortizol düzeylerinin artmasına ek olarak kandaki trigliserit, serbest yağ asitleri, HDL ve VLDL düzeylerinde de artıĢ görülmektedir (Sheffield 2002, Hadden 2003).
Son trimesterde fetüsün hızlı büyüme dönemine girmesiyle birlikte plasenta yoluyla ihtiyaç duyulan maddelerin geçiĢi de hızlanmaktadır. Anne uzayan açlık durumlarında kendisi için gerekli olan enerjiyi daha önceden depolamıĢ olduğu
13 yağların yıkımından sağlarken; glukoz, aminoasitler, laktik asit ve keton cisimleri de fetüse geçmektedir (Herrera ve ark 1991).
Ġnsülin ve glukagon plasentayı geçemediği için fetüs 9. haftadan itibaren anneden aldığı glukoza yanıt olarak kendi insülinini salgılamaya baĢlamaktadır. Fetal insülin düzeyi annenin glukoz düzeyi ile doğrudan iliĢkili olup, annede hiperglisemi varsa fetüste de hiperglisemi oluĢmakta, bu da hiperinsülinemiye neden olmaktadır. Özellikle son trimesterde ortaya çıkan hiperglisemi ve glukoz intoleransı, baĢta makrozomi olmak üzere çok sayıda soruna neden olmaktadır (Cousins 1991).
GDM ile ilgili olarak iki konuya dikkat çekmek gerekmektedir. Bunlardan birincisi, her gebelikte genelde ortalara doğru baĢlayan ilerleyici bir insülin direncinin olması ve üçüncü trimestr sonlarına doğru tip 2 diyabetli kiĢilerdekine benzeyen, annede adipoz dokunun artması ve plasentanın hormonal ürünlerinin etkilerine bağlı olarak insülin direnci geliĢmesidir. Doğumdan sonra insülin direncinin hızla düĢmesinden anlaĢılacağı üzere plasental hormonlar burada ana etken olarak görünmektedir. Ġkincisi ise pankreatik β-hücrelerinin artan insülin direncini karĢılayabilmek için daha fazla insülin salgılamasıdır. Sonuç olarak, dolaĢımda glukoz düzeyleri çok değiĢmese de insülin duyarlılığında çok büyük değiĢiklik olmaktadır. Gebelik sırasındaki normal glukoz regülasyonunun sağlanmasında en önemli etken, giderek artan insülin direnci karĢısında pankreas β-hücrelerinin gösterdiği uyumdur (Metzger ve Coustan 1998, Yogev ve ark. 2008). Özetle GDM olgularında tip 2 diyabette olduğu gibi hem insülin direnci hem de insülin salınımında bozulma vardır (Ryan ve ark 1985, Kuhl 1991, Catalano ve ark 1993).
1.4.7. Gestasyonel Diabetes Mellitus’un Genetiği
GDM‘ nin genetik zemini tam olarak bilinmemektedir. GDM‘ li kadınların annelerinde T2DM prevalansının babalarına göre anlamlı derecede yüksek olduğu ve aynı zamanda anne-büyükanne soyağacında T2DM sıklığının da baba-dede soyağacına göre daha fazla olduğu bulunmuĢtur (Harder ve ark. 2001). McLellan ve ark (1995)‘nın önceden GDM tanısı konmuĢ 100 kadından oluĢan bir grup üzerinde yaptıkları çalıĢmada, kadınlar postpartum 11. yılda tekrar sorgulanmıĢ ve % 60 ‘ında T2DM ya da BGT olduğu saptanmıĢtır. Bu kadınların ebeveynlerinin sorgulanması sonucunda önemli bir bölümünde T2DM ya da BGT saptanmamıĢ olması, poligenik
14 kalıtımın ya da çevresel faktörlerin otozomal dominant kalıtımdan daha fazla etkili olduğunu düĢündürmektedir.
Danimarkalı ikizler arasında yapılan bir çalıĢmada insülin salınımında bozulma % 75‘ten fazla ve periferik insülin duyarlılığının en az %53 oranında bulunması GDM‘nin genetik zemini olabileceğini göstermektedir (Poulsen ve ark 2005).
GDM‘li bireylerin daha sonra T2DM‘ye yakalanma riskinin yüksek olması ve yine T2DM aile öyküsü olan bireylerde de GDM geliĢme riskinin yüksek olması her iki hastalığın aynı genetik zemine sahip olabileceğini düĢündürmektedir. Bu nedenle özellikle son yıllarda T2DM‘nin genetik mimarisi üzerine yoğunlaĢmıĢ aday gen çalıĢmaları, bağlantı analizleri ve genom boyu iliĢki çalıĢmaları (GWA) ile ortaya konan genler ve risk varyantlarının GDM geliĢimi üzerinde etkileri araĢtırılmaktadır. Bu genlerin önemli bir kısmının insülin salınım mekanizmasıyla iliĢkili olduğu belirlenmiĢtir (Schäfer ve ark 2011). Ġnsülinin pankreatik β hücrelerinde sentezi, iĢlenmesi, depolanması ve salgılanması süreçlerinin herhangi birindeki bozulma insülin sentez-salınım sürecini etkileyebilmektedir.
1.5. Pankreatik β-hücrelerinde Ġnsülin Salınım Mekanizması
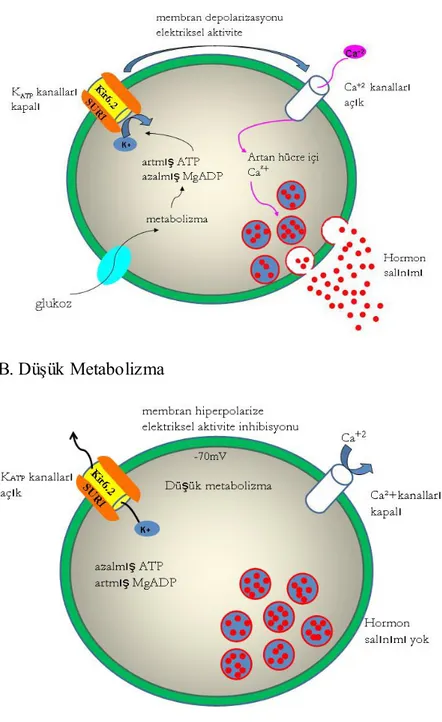
Pankreatik β-hücreler, glukozla-uyarılan insülin salınımını gerçekleĢtirmek için özelleĢmiĢ hücrelerdir. Glukoz, glukoz taĢıyıcıları (GLUT2) ile pankreatik β-hücrelerine alınarak glikolizle yıkılır. Glikoliz sonucu hücre içinde adenin nükleotid (ATP) konsantrasyonu artar ve Mg-nükleotidlerin konsantrasyonu azalır. β- hücre membranında bulunan ATP-bağımlı potasyum (KATP) kanalları ATP konsantrasyonundaki artıĢla inhibe olarkak kapanırlar. Kanalın kapanması, sırasıyla membranın depolarize olması, voltaj-bağımlı kalsiyum (Ca+2) kanallarının aktive olarak açılması ve Ca+2‘un hücre içine akması ile sonuçlanan bir dizi olayı tetikler. Ca+2‘un hücre içine alınması insülin salınımını uyarır (ġekil 1.1) (Inoue ve ark 1997, Delepine ve ark 2000). DüĢük glukoz konsantrasyonunda ise pankreatik β-hücrelerinde metabolik aktivite azalır, hücre içi ATP konsantrasyonu azalır, MgADP konsantrasyonu artar. MgADP, KATP kanalını uyararak açılmasını sağlar ve hücreden potasyum (K+) çıkıĢı olur. Bu da β-hücre membranının hiperpolarize olarak Ca+2 kanallarının kapalı durumda kalmasına neden olur. Hücre içerisine Ca+2
alınamadığı için insülin salınımı gerçekleĢmez (Inoue ve ark 1997, Delepine ve ark 2000).
15 A. Yüksek Metabolizma
B. DüĢük Metabolizma
ġekil 1.1. Pankreatik beta hücrelerinde KATP kanalı ve insülin salgılanma mekanizması. KATP kanal proteinleri Kir6.2 ve SUR1 insülin salgılanmasına aracılık etmektedir. A. Yüksek metabolizmada glukoz seviyelerinde artıĢla glukoz hücre içinde metabolize olur ve ATP konsantrasyonu artar, MgADP konsantrasyonu azalır. Bu durum potasyum iyonlarının hücreye giriĢine izin vererek KATP kanalını uyarır ve kanal kapanır. Kanalın kapanması hücre zarını depolarize eder ve hücre içi serbest Ca+2 seviyesini artırmak için kalsiyum kanallarını uyarır. Kalsiyum iyonları hücre içine akarak insülinin hücre dıĢına salınımına neden olur. B. DüĢük metabolizmada ATP konsantrasyonunun azalması ve MgADP konsantrasyonunun artması nedeniyle KATP kanalları kapalıdır. Bu durumda hücre membranı hiperpolarizedir ve hücre dıĢına insülin salınımı yoktur (Ashcroft 2005, Arıkoğlu ve ark 2012).
16
1.6. ATP Bağımlı Potasyum Kanalı (KA TP) ve Kir6.2 Proteini
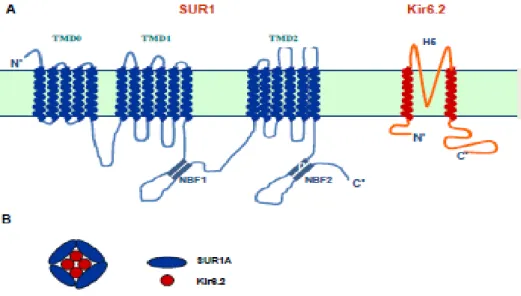
Pankreatik β hücrelerinin zarında bulunan KATP kanalları, iç kısmında poru oluĢturan Kir6.2 (içe doğru rektifiye eden) proteini, dıĢ kısmında ise poru çevreleyen SUR1 (sülfonil üre reseptör 1) proteinlerinden oluĢmuĢtur. Her iki proteinin dörder tane alt ünitesi bulunur ve birlikte endoplazmik retikulumda oktamerik KATP kanalını oluĢtururarak zara gönderilirler (ġekil 1.2) (Clement ve ark 1997, Inagaki ve ark 1997, Shyng ve Nichols 1997). Kir6.2 proteini içe doğru rektifiye eden potasyum kanal ailesinin üyelerinden biridir ve iki adet membran geçici bölgesi bulunmaktadır (ġekil 1.2) (Tusnady ve ark 1997). K+ iyon seçiciliği için kritik öneme sahip olduğu düĢünülen korunmuĢ H5 bölgesinde aminoasit dizilimi Gly-Tyr-Gly Ģeklindedir. Bu dizilim Kir6.x üyelerinde Gly-Phe-Gly‘dir (Heginbotham ve ark 1992, Jan ve Jan 1994, Kerr ve Sansom 1995). Kir6.2 proteininin sitozol kısmında kanalın kapanmasında kritik rolü olan ATP bağlanma bölgesi bulunmaktadır (Proks ve ark 2003). SUR1 proteini ise, ABC (ATP-bağlanma kaset) protein süper ailesinin üyelerinden biridir (Aguilar-Bryan ve ark 1995). ABC taĢıyıcıları oldukça büyük proteinlerdir ve transport, iyon kanalları ve kanal regülasyonu gibi geniĢ fizyolojik aktivite gösterirler (Higgins 2001). ABC proteinlerinin iki membran geçici bölgesine (TMD 1 ve 2) ilaveten SUR1 proteininde üçüncü bir membran geçici bölge (TMD 0) bulunur (Bennett ve ark 2010). Ġki adet nükleotid bağlanma bölgesi (1 ve NBF-2) bulunmaktadır. Bunlardan biri TMD 1 ve 2 arasında diğeri ise C-ucundadır (ġekil 1.2) (Higgins 1995). SUR1 proteininde NBF-1 ve NBF-2 bölgeleri tüm nükleotid bağlanma bölgelerinin özelliği olan Walker A ve Walker B adında 2 aminoasit dizi motifi içermektedir (Walker ve ark 1982, Higgins 1992). Ayrıca ABC ailesini diğer nükleotid bağlanma proteinlerinden ayıran üçüncü bir korunmuĢ dizi motifi (C) bulunmaktadır (Higgins 1992). NBF-1, ATP‘nin bağlandığı ve hidrolize edildiği bölge, 2 ise MgADP‘nin bağlandığı bölgedir (Conti ve ark 2001). SUR1, NBF-2‘ye bağlanan MgADP ile kanal aktivitesini uyarır (Conti ve ark 2001). SUR pro-teinleri (SUR1, SUR2A, SUR2B) ile Kir6.x propro-teinleri (Kir6.1, Kir6.2) farklı dokularda farklı kombinasyonlarda bir araya gelerek KATP kanallarını oluĢturmaktadır (Ashcroft 1988, Sakura ve ark 1995, Nichols ve ark 1996, Seino 1999). Çok sayıda dokuda Kir6.2 por oluĢtururken vasküler düz kaslarda Kir6.1 por oluĢturmaktadır (Inagaki ve ark 1995b, Yamada ve ark 1997). SUR alt üniteleri de pankreas ve beyinde SUR1, kalp ve iskelet kasında SUR2A, beyin ve düz kasta
17 SUR2B Ģeklinde bulunmaktadır (Chutkow ve ark 1996, Inagaki ve ark 1996, Isomoto ve ark 1996). Hücre içi membranlarda da farklı kombinasyonlarda KATP kanalları bulunmaktadır (Vivaudou ve ark 2009). Pankreatik β-hücrelerindeki insülin salgı granülleri ve pankreatik asinar hücre zimojen granüllerinde de KATP kanalları vardır (Varadi ve ark 2006, Park ve ark 2008). Ayrıca KATP kanallarının nukleus ve mitokondride de bulunması bu kanalların hücredeki metabolik olaylarda kritik önemi olduğunu göstermektedir (Terzic ve ark 2000, Quesada ve ark 2002, Ardehali ve O‘Rourke 2005, Hanley ve Daut 2005, Olson ve Terzic 2010).
ġekil 1.2. KNJ11 ve ABCC8 genlerinin kodladığı Kir6.2 ve SUR1 proteinlerinin alt ünitelerinin membran üzerindeki olası Ģematik gösterimi. A) KATP kanalının poru oluĢturan kısmı olan Kir6.2 proteininin iki membran geçici bölgesi (TMD) bulunmaktadır. Kanalın poru çevreleyen kısmı olan SUR1 proteini ise iki nükleotid bağlanma kıvrımı (NBF-1 ve NBF-2) ve membran geçici bölgelerden oluĢmaktadır. B) KATP kanalının olası oktamerik yapısı. Ġç kısımda dört adet Kir6.2 alt ünitesi ve dıĢ kısımda onu çevreleyen dört adet SUR1 alt ünitesi bulunmaktadır (Ashcroft 2005, Arıkoğlu ve ark 2012).
1.7. KCNJ11 Geni
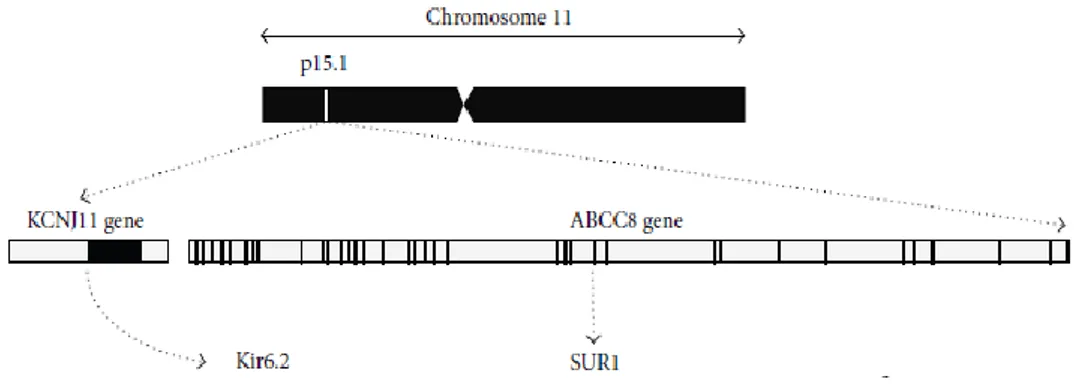
KCNJ11 geni ABCC8 geniyle birlikte 11. kromozomun p15.1 bölgesinde lokalize olup sırasıyla Kir6.2 ve SUR1 proteinlerini kodlarlar (ġekil 1.3). ABCC8 geni büyük bir gen olup 39 ekzon ve 38 introndan oluĢur ve 84,02 kilo baz (kb) uzunluğundadır. Ekzon 1‘deki 126 baz çifti (bç) ve ekzon 39‘daki 105 bç‘lik UTR (untranslated region) kısımları hariç tüm ekzonları kodlanmaktadır. 4746 bç uzunluğundaki kodlanan kısım SUR1 proteinini oluĢturmaktadır (Aguilar-Bryan ve
18 ark 1995). ABCC8 genine 4,5 kilobazlık bir mesafeyle komĢu olan KCNJ11 geni ise küçük bir gendir (ġekil 1.4). Tek bir okuma çerçevesi bulunur ve 390 aminoasitlik Kir6.2 proteinini kodlamaktadır (ġekil 1.5). Diğer rektifiye edici proteinleri kodlayan genlerde olduğu gibi bu gen de intron içermemektedir (Inagaki ve ark 1995a).
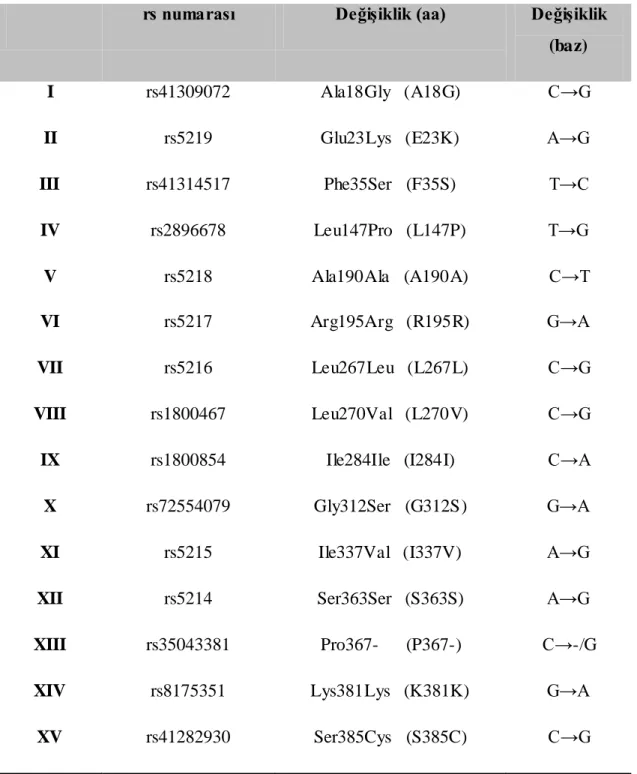
KATP kanallarının insülin salınımındaki kritik rolü, kanalı kodlayan ABCC8 ve Kir6.2 genlerindeki mutasyonların da insülin salınımını etkilemesine neden olmaktadır. KATP kanalının fonksiyon kaybetmesi (kapalı kalması) ya da fonksiyon kazanması (açık kalması) sırasıyla konjenital hiperinsülinemi ve yenidoğan diyabetinin ana nedenleri olarak gösterilmektedir. Mutasyonun yeri ve Ģiddetine göre klinik tablo değiĢmektedir. Ayrıca her iki gendeki yaygın görülen polimorfizmler de kanal fonksiyonunu etkileyerek tip 2 diyabete yatkınlığa sebep olmaktadır (Arıkoğlu ve ark 2012). Çizelge 1.2‘ de KCNJ11 genindeki yaygın görülen tek nükleotid polimorfizmleri (SNP) gösterilmiĢtir.
ġekil 1.3. Kir6.2 ve SUR1 proteinlerini kodlayan KNJ11 ve ABCC8 genlerinin kromozom üzerinde gösterimi (Haghvirdizadeh ve ark 2014).
19 TGCCTCCGATGGGGGAAGCCCCTCCCTGGGGGTCACCGGAGCCATGCTGTCCC GCAAGGGCATCATCCCCGAGGAATACGTGCTGACACGCCTGGCAGAGGAC CCTGCCAAGCCCAGGTACCGTGCCCGCCAGCGGAGGGCCCGCTTTGTGTCC AAGAAAGGCAACTGCAACGTGGCCCACAAGAACATCCGGGAGCAGGGCCG CTTCCTGCAGGACGTGTTCACCACGCTGGTGGACCTCAAGTGGCCACACAC ATTGCTCATCTTCACCATGTCCTTCCTGTGCAGCTGGCTGCTCTTCGCCATG GCCTGGTGGCTCATCGCCTTCGCCCACGGTGACCTGGCCCCCAGCGAGGGC ACTGCTGAGCCCTGTGTCACCAGCATCCACTCCTTCTCGTCTGCCTTCCTTT TCTCCATTGAGGTCCAAGTGACTATTGGCTTTGGGGGGCGCATGGTGACTG AGGAGTGCCCACTGGCCATCCTGATCCTCATCGTGCAGAACATCGTGGGGC TCATGATCAACGCCATCATGCTTGGCTGCATCTTCATGAAGACTGCCCAAG CCCACCGCAGGGCTGAGACCCTCATCTTCAGCAAGCATGCGGTGATCGCCC TGCGCCACGGCCGCCTCTGCTTCATGCTACGTGTGGGTGACCTCCGCAAGA GCATGATCATCAGCGCCACCATCCACATGCAGGTGGTACGCAAGACCACCA GCCCCGAGGGCGAGGTGGTGCCCCTCCACCAGGTGGACATCCCCATGGAG AACGGCGTGGGTGGCAACAGCATCTTCCTGGTGGCCCCGCTGATCATCTAC CATGTCATTGATGCCAACAGCCCACTCTACGACCTGGCACCCAGCGACCTG CACCACCACCAGGACCTCGAGATCATCGTCATCCTGGAAGGCGTGGTGGAA ACCACGGGCATCACCACCCAGGCCCGCACCTCCTACCTGGCCGATGAGATC CTGTGGGGCCAGCGCTTTGTGCCCATTGTAGCTGAGGAGGACGGACGTTAC TCTGTGGACTACTCCAAGTTTGGCAACACCGTCAAAGTGCCCACACCACTC TGCACGGCCCGCCAGCTTGATGAGGACCACAGCCTACTGGAAGCTCTGACC CTCGCCTCAGCCCGCGGGCCCCTGCGCAAGCGCAGCGTGCCCATGGCCAA
GGCCAAGCCCAAGTTCAGCATCTCTCCAGATTCCCTGTCCTGAGCCATGGTC
TCTCGGGCCCCCCACACGCGTGTGTACACACGGACCATGTGGTATGTAGCCCGG CCAGGGCCTGGTGTGAGGCTGGGCCAGCCTCAGCTCAGCCT
ġekil 1.4. KCNJ11 geninin nükleotid dizisi. ATG baĢlama kodonu, koyu renkle gösterilen kısım kodlanan dizi (PubMed NCBI Gen Bankası EriĢim No: NM_000525)
20 10 20 30 40 50 60 MLSRKGIIPE EYVLTRLAED PAKPRYRARQ RRARFVSKKG NCNVAHKNIR EQGRFLQDVF 70 80 90 100 110 120 TTLVDLKWPH TLLIFTMSFL CSWLLFAMAW WLIAFAHGDL APSEGTAEPC VTSIHSFSSA 130 140 150 160 170 180 FLFSIEVQVT IGFGGRMVTE ECPLAILILI VQNIVGLMIN AIMLGCIFMK TAQAHRRAET 190 200 210 220 230 240 LIFSKHAVIA LRHGRLCFML RVGDLRKSMI ISATIHMQVV RKTTSPEGEV VPLHQVDIPM 250 260 270 280 290 300
ENGVGGNSIF LVAPLIIYHV IDANSPLYDL APSDLHHHQD LEIIVILEGV VETTGITTQA 310 320 330 340 350 360
RTSYLADEIL WGQRFVPIVA EEDGRYSVDY SKFGNTVKVP TPLCTARQLD EDHSLLEALT 370 380 390
LASARGPLRK RSVPMAKAKP KFSISPDSLS
ġekil 1.5. Kir6.2 proteininin aminoasit dizisi (http://www.ncbi.nlm.nih.gov/gene)
21
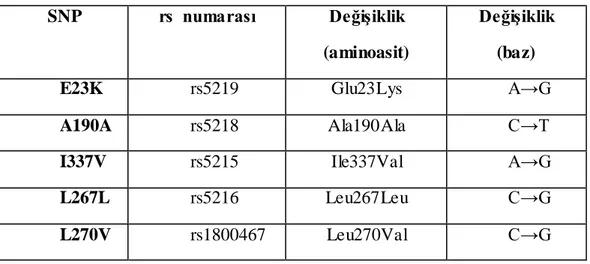
Çizelge 1.2. KCNJ11 geninde yaygın görülen SNP‘lerin listesi
rs numarası DeğiĢiklik (aa) DeğiĢiklik
(baz)
I rs41309072 Ala18Gly (A18G) C→G II rs5219 Glu23Lys (E23K) A→G III rs41314517 Phe35Ser (F35S) T→C IV rs2896678 Leu147Pro (L147P) T→G V rs5218 Ala190Ala (A190A) C→T VI rs5217 Arg195Arg (R195R) G→A VII rs5216 Leu267Leu (L267L) C→G VIII rs1800467 Leu270Val (L270V) C→G
IX rs1800854 Ile284Ile (I284I) C→A X rs72554079 Gly312Ser (G312S) G→A
XI rs5215 Ile337Val (I337V) A→G XII rs5214 Ser363Ser (S363S) A→G
XIII rs35043381 Pro367- (P367-) C→-/G
XIV rs8175351 Lys381Lys (K381K) G→A XV rs41282930 Ser385Cys (S385C) C→G
Ġnsülin salınım mekanizmasının anlaĢılması ve KATP kanalının bu mekanizmada merkezi fonksiyona sahip olması nedeni ile KATP kanalı insülin salınım bozukluklarında temel etkenlerden biri olabileceği düĢüncesiyle dikkatleri üzerine çekmiĢtir. Konjenital hiperinsülinemi ve/veya neonatal diyabet de kanalın pankreatik β-hücre zarında yokluğu ya da fonksiyonel olmaması ve bunların altında yatan sebep olarak da kanalı oluĢturan proteinleri kodlayan genlerdeki mutasyonların olduğunun
22 anlaĢılması bu düĢünceyi desteklemiĢtir. Yine özellikle son yıllarda Kir6.2 proteinini kodlayan KCNJ11 genindeki E23K polimorfizminin T2DM geliĢimiyle iliĢkisinin çok sayıda popülasyon temelli çalıĢmada gösterilmesi, sonrasında GWA çalıĢmaları ile bu iliĢkinin desteklenmesi ve polimorfizmin kanalın iĢ görmesini yavaĢlatmak suretiyle insülin salınımını azalttığının fonksiyonel çalıĢmalarla ortaya konması da KATP kanalının önemini göstermektedir. Bununla birlikte KATP kanalı T2DM tedavisinde kullanılan sülfonilüre grubu antidiyabetik ilaçların edefi olarak da klinik öneme sahiptir.
Konjenital insülin salınım bozuklukları ve T2DM ile iliĢkisi kanıtlanan KATP kanalı ve onu kodlayan genlerin GDM geliĢiminde de önemli yere sahip olabileceği düĢüncesinden yola çıkarak bu çalıĢmada Kir6.2 kanal proteinini kodlayan KCNJ11 geninin Konya bölgesindeki gestasyonel diabetes mellitus tanısı konmuĢ gebe bireylerde taranması planlanmıĢtır. Böylece literatürde yayınlanan polimorfizmlerin ve varsa toplumumuza özgü yeni polimorfizmlerin frekansı tespit edilerek hastalıkla iliĢkileri bakımından değerlendirilecektir.
23
2. GEREÇ ve YÖNTEM
2.1. Hasta ve Kontrol Gruplarının Seçilmesi
ÇalıĢmaya, Selçuk Üniversitesi Tıp Fakültesi Ġç Hastalıkları Anabilim Dalı Endokrinoloji Bilim Dalı‘na baĢvurarak; ADA kriterlerine göre gestasyonel diyabet tanısı konmuĢ 50 hasta ve kontrol grubu için 41 sağlıklı gebe dahil edildi. Hastaların seçiminde insülin ve OAD (oral antidiyabetik) kullanılmaması kriterleri dikkate alındı. Kontrol grubunun oluĢturulmasında ise, oral glukoz tolerans testi (OGTT) değerlerinin normal olması çalıĢmaya alınma kriteri idi.
ÇalıĢmamızda hasta ve kontrol gruplarındaki bireylerden serum insülin ve glukoz (AKġ) değerlerini analiz etmek üzere pıhtılaĢma engelleyici içermeyen tüplere ve DNA eldesinde kullanılmak üzere EDTA‘lı tüplere 6 ml kan alındı. EDTA‘lı tüpler çalıĢılıncaya kadar -20°C‘de saklandı.
Ġnsülin direnci HOMA-IR (Homeostasis Model Assement Of Insulin Resistance) hesaplaması; açlık kan Ģekeri (mg/dl) X açlık insülini (microU/ml): 405 formülüne göre yapıldı. Değerleri 2,5 üzerinde olan bireyler insüline dirençli kabul edildi.
2.2. DNA Ġzolasyonu, PZR ve Agaroz Jel Elektroforezi Ġçin Gerekli Olan Gereçler
Santrifüj (NF 100R, Ġstanbul, Türkiye), buzdolabı (Arçelik, Ġstanbul, Türkiye), mikrodalga fırın (Arçelik, Ġstanbul, Türkiye), su banyosu (Nüve, Ġstanbul, Türkiye), güç kaynağı (E-C Apparatus corparation, Petersburg, Florida), pH-metre (Ġnolab), manyetik karıĢtırıcı (Elektro-mag), vorteks (Nüve, Ġstanbul, Türkiye), Termal cycler (Quanta biotech, Ġngiltere), Mikropipet (Eppendorf, Hamburg, Almanya), hassas terazi (Kern, Almanya), yatay elektroforez tankı (Thermo scientific, NH, ABD), biyolojik emniyet kabini (Metisafe, Ankara, Türkiye), UV görüntüleme cihazı (Vilber-Lourmat, Ġngiltere).
2.3. DNA Ġzolasyonu, PZR ve Agaroz Jel Elektroforezi Ġçin Gerekli Olan Kimyasal Maddeler
EDTA (Merck, Darmstadt, Almanya), Tris-HCl, NaCl (Merck, Darmstadt, Almanya), KCl (Merck, Darmstadt, Almanya), Üre (Merck, Darmstadt, Almanya), SDS, Proteinaz-K (Sigma, St Louis, Amerika), Kloroform (Merck, Darmstadt,
24
Almanya), Etil alkol, Asetik asit (Sigma, St Louis, Amerika), Taq polimeraz, 100bç ve 20bç ladder, dNTP karıĢımı (Vivantis, Malezya), 10xAmonyum sülfatlı PZR tamponu, yükleme boyası (Vivantis, Malezya), 1 çift primer (Biomers, Singapur).
2.4. DNA Ġzolasyonu
2.4.1. DNA Ġzolasyonu Ġçin Gerekli Solüsyonların Hazırlanması
0,5 M EDTA (pH 8)
EDTAH2O………18,6 gr
dH2O……….80 ml
1N NaOH ile pH 8‘ e ayarlandı ve toplam hacim 100 ml‘ ye tamamlanarak otoklavlandı. 4M NaCl NaCl………..23,97 gr dH2O………..100 ml‘ ye tamamlandı. 5M NaCl NaCl………..29,22 gr dH2O………..100 ml‘ ye tamamlandı. 1M TrisHCl (pH 8) Tris….………12,11 gr dH2O………..80 ml
Tris dH2O‘da çözüldü. HCl ilave edilerek pH 8‘e ayarlandı. Toplam hacim
100 ml‘ye tamamlandı.
Parçalama Çözeltisi (5X)
NaCl………..4M EDTA………0,5M
25
TrisHCl……….1M
100 ml‘ ye tamamlanıp pH 7,5‘ e ayarlandı ve otoklavlandı. Üreli Parçalama Çözeltisi
Üre ………. 4.2 gr dH2O ………. 1 ml Parçalama çözeltisi ……… 2 ml %20 SDS SDS ………. 20 gr dH2O ………... 80 ml
SDS iyice çözününceye kadar karıĢtırıcıda tutuldu. Toplam hacim 100 ml‘ye tamamlandı.
%70 Etanol
%96 etanol ……….. 72 ml
dH2O ……….. 100 ml‘ye tamamlandı.
2.4.2. DNA Eldesi
1- EDTA‘ lı tüpler oda ısısına alındı ve üzerine hacmi kadar soğuk saf su eklendi.
2- Nazikçe altüst edildikten sonra 15 dk 4000 devir/dk da santrifüj edildi. 3- Üstteki sıvı kısım atıldı. 2 ve 3. basamak 3 kez tekrarlandı.
4- Tüplere 3 ml. üreli parçalama çözeltisi ilave edildi ve tüpler altüst edildi. 5- Üzerine 400 µl %20 SDS ve 100 µl 10 mg/ml proteinazK ilave edildi. 6- Tüpler 370C‘de 1 gece inkübasyona bırakıldı.
7- Ġkinci gün inkübasyondan çıkarılan tüplere 2 ml 5M NaCl eklendi ve 10-15 dk altüst edildi.
26 9- Santrifüj sonunda oluĢan 3 fazlık kısımdan üstteki beyaz faz temiz bir tüpe alındı ve üzerine hacmi kadar soğuk %96‘lık etilalkol eklendi.
10- Alkol ilavesiyle yumak Ģeklini alan DNA‘lar pipet yardımıyla 1.5 ml‘lik ependorf tüplere alındı ve üzerlerine 1000 µl %70‘lik alkol eklendi.
11- Tüpler 13000 devir/dk‘da10 dk santrifüj edildi.
12- Santrifüj sonrasında dibe yapıĢan DNA pelletinin üstündeki alkol dikkatlice döküldü.
13- 12. basamak 3 kez tekrarlandı.
13- DNA pelleti içeren tüpler oda sıcaklığında ağzı açık bir Ģekilde kurmaya bırakıldı.
14- Alkolün tamamen uçtuğundan emin olunduktan sonra pelletin üzerine uygun miktarda deiyonize steril su eklendi.
15. +40C‘de çözünmesi için bir gün bekletilen DNA‘lar -200C‘de saklandı.
2.5. Hedef Gen Bölgelerinin Belirlenmesi ve Primer Tasarımı
KCNJ11 geninin nükleotid dizileri Gen Bankasından NCBI (National Center for Biotechnology Information) aracılığı ile NM_000352 eriĢim numarasından temin edildi. Primerler KCNJ11 geninin kodlanan bölgesinin tamamını kapsayacak Ģekilde www.idtdna.com adresindeki online primer dizayn pro gramı ile tasarlandı (Çizelge 2.1). Tasarlanan primerler ticari olarak sipariĢ edilerek 50 pmol/µl konsantrasyonda temin edildi.
Çizelge 2.1. KCNJ11 Genininin Tamamını Kapsayan Primer Dizisi
Primer Dizisi (5’→3’) (Ġ: Ġleri / G: Geri) Ürün Büyüklüğü (Baz Çifti) Erime Sıcaklığı (˚C) Ġ: AGGAATACGTGCTGACACGCCT G:ACCATGGCTCAGGACAGGGAATCT 1153 66,4
27 TGCCTCCGATGGGGGAA GCCCCTCCCTGGGGGTCACCGGA GCCATGCTGTCCCGCAAG I II GGCATCATCCCCGAGGAATACGTGCTGACACGCCTGGCAGAGGACCCTGCCAAGCC III CAGGTACCGTGCCCGCCAGCGGAGGGCCCGCTTTGTGTCCAAGAAAGGCAACTGCA ACGTGGCCCACAAGAACATCCGGGAGCAGGGCCGCTTCCTGCAGGACGTGTTCACC ACGCTGGTGGACCTCAAGTGGCCACACACATTGCTCATCTTCACCATGTCCTTCCTG TGCAGCTGGCTGCTCTTCGCCATGGCCTGGTGGCTCATCGCCTTCGCCCACGGTGA CCTGGCCCCCAGCGAGGGCACTGCTGAGCCCTGTGTCACCAGCATCCACTCCTTCT CGTCTGCCTTCCTTTTCTCCATTGAGGTCCAAGTGACTATTGGCTTTGGGGGGCGCA IV TGGTGACTGAGGAGTGCCCACTGGCCATCC TGATCCTCATCGTGCAGAACATCGTG GGGCTCATGATCAACGCCATCATGCTTGGCTGCATCTTCATGAAGACTGCCCAAGC V CCACCGCAGGGCTGAGACCCTCATCTTCAGCAAGCATGCGGTGATCGC CCTGCGCC VI ACGGCCGCCTCTGCTTCATGCTACGTGTGGGTGACCTCCGCAAGAGCATGATCATC AGCGCCACCATCCACATGCAGGTGGTACGCAAGACCACCAGCCCCGAGGGCGAGG TGGTGCCCCTCCACCAGGTGGACATCCCCATGGAGAACGGCGTGGGTGGCAACAGC VII ATCTTCCTGGTGGCCCCGCTGATCATCTACCATGTCATTGATGCCAACAGCCCACT C VIII IX TACGACCTGGCACCCAGCGACCTGCACCACCACCAGGACCTCGAGATCATCGTCAT CCTGGAAGGCGTGGTGGAAACCACGGGCATCACCACCCAGGCCCGCACCTCCTACC X TGGCCGATGAGATCCTGTGGGGCCAGCGCTTTGTGCCCATTGTAGCTGAGGAGGAC XI GGACGTTACTCTGTGGACTACTCCAAGTTTGGCAACACC GTCAAAGTGCCCACACC ACTCTGCACGGCCCGCCAGCTTGATGAGGACCACAGCCTACTGGAAGCTCTGACCC XII XIII TCGCCTCAGCCCGCGGGCCCCTGCGCAAGCGCAGCGTGCCCATGGCCAAGGCCAA XIV XV
GCCCAAGTTCAGCATCTCTCCAGATTCCCTGTCCTGAGCCATGGT CTCTCGGGCCCCC CACA CGCGTGTGTACA CACGGA CCATGTGGTATGTA GCCCGGCCA GGGCCTGGTGTGA G
ġekil 2.1. KCNJ11 geninin nükleotid dizisi üzerinde primerlerin ve yaygın görülen SNP‘lerin gösterimi. Primer çifti altı çizili Ģekilde, yaygın görülen SNP‘ler ise vurgulu gösterilmiĢ olup üzerinde belirtilen numaralar çizelge 1.2‘deki sıralama ile aynıdır.
28
2.6. Polimeraz Zincir Reaksiyonu (PZR) Uygulaması
2.6.1. Gradient PZR
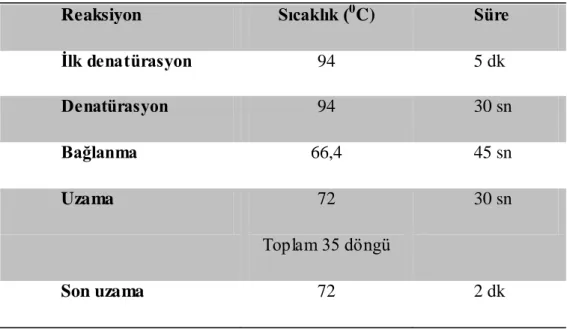
ÇalıĢmada kullanılacak primer çifti için uygun erime sıcaklığının tespit edilebilmesi amacıyla gardient PZR uygulandı. Her bir tüpte 10µl PZR karıĢımı olacak Ģekilde tüpler hazırlandı ve farklı sıcaklık aralıklarına programlanan thermal cycler cihazına yerleĢtirildi. ÇalıĢmada Biorad thermal cycler cihazı kullanıldı. PZR karıĢımının hazırlanması ve cihazın programlanması Çizelge 2.2. ve 2.3.‘ de gösterildiği gibi gerçekleĢtirildi.
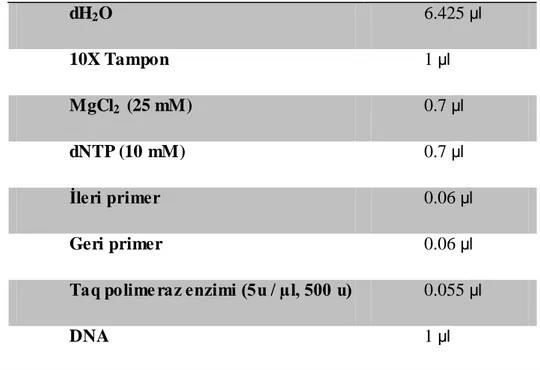
Çizelge 2.2. Gradient PZR KarıĢımının Hazırlanması
dH2O 6.425 µl 10X Tampon 1 µl MgCl2 (25 mM) 0.7 µl dNTP (10 mM) 0.7 µl Ġleri primer 0.06 µl Geri primer 0.06 µl
Taq polime raz enzimi (5u / µl, 500 u) 0.055 µl
DNA 1 µl
2.6.2. PZR Uygulamaları
Gradient PZR‘ da belirlenen sıcaklıklar dikkate alınarak örnekler ço ğaltıldı. PZR karıĢımı Çizelge 2.2‘ de verildiği gibi hazırlandı. Toplamı 20 µl olacak Ģekilde miktarlar hesaplandı. PZR koĢulları Çizelge 2.3‘ de verildiği gibi toplam 35 döngü olacak Ģekilde programlandı. Bağlanma sıcaklığı gradient PZR sonucuna göre uygulandı. PZR sonuçları agaroz jel elektroforezde değerlendirildi. Sonuç alınamayan örnekler, PZR karıĢım oranları ya da koĢulları değiĢtirilerek yeniden çoğaltıldı. Gerektiğinde farklı sıcaklık aralıkları denenerek yeniden gradient PZR yapıldı.
29
Çizelge 2.3. Gradient PZR Reaksiyon KoĢulları
Reaksiyon Sıcaklık (0C) Süre
Ġlk denatürasyon 94 5 dk Denatürasyon 94 30 sn Bağlanma 66,4 45 sn Uzama 72 Toplam 35 döngü 30 sn Son uzama 72 2 dk
2.7. Agaroz Jel Elektrofore zi
Gradient PZR ve PZR sonucunda elde edilen reaksiyon ürünleri %1‘lik agaroz jel elektroforezde yürütüldü ve görüntüleme cihazında değerlendirilerek fotoğraflandı.
2.7.1. Jelin Hazırlanması
Agaroz ……….. 1 gr 1XTAE……….. 100 ml
Mikrodalga fırında agaroz iyice eriyinceye kadar tutuldu. Daha sonra jelin sıcaklığı 600C‘ye kadar düĢünce çeker ocakta 8 µl ethidium bromür eklendi ve jel tepsisine döküldü. 30 dk donmaya bırakıldı.
2.7.2. Örneklerin Jele Yüklenmesi
6X yükleme boyası ………. 3 µl DNA ……… 5 µl
Jel donduktan kuyucuklara yükleme boyasıyla birlikte DNA (PZR ürünü) karıĢtırılarak yüklendi. Örneklerle aynı sırada ilk kuyucuğa da bant büyüklükleri bilinen bir markır yüklendi.
30
2.7.3. Örneklerin Jelde Yürütülmesi
Örnekler jelde 150 volt (V)‘da 20-30 dk süresince yürütüldü. 2.7.4. Görüntüle me
Jel, ultraviyole görüntüleme cihazında görüntülendi ve fotoğraflandı.
2.7.5. Agaroz Jel Elektrofore zinde Kullanılan Çözeltile rin Hazırlanması
50X TAE tamponu
Tris baz ………. 24.2 gr Glasiyel asetik asit ……… 5.71 ml 0.5 M EDTA ………. 10 ml
dH2O ile 100 ml‘ye tamamlandı.
1X TAE tamponu
50X TAE tamponu ……… 100 ml
dH2O ………. 900 ml
2.8. Dizi Analizi
Özel bir laboratuarda (Macrogen, Hollanda) hedeflenen DNA bölgesinin nükleik asit dizi analizi gerçekleĢtirildi. Java programı ile diziler pik Ģeklinde görüntülendi ve NCBI blast programları ile gen bankasındaki dizilerle eĢleĢtirildi. Blast sonuçları ve pik görüntüleri dikkatli bir biçimde karĢılaĢtırılarak değiĢiklikler değerlendirildi. ÇalıĢılan bölgenin büyük olması (1153 bç) nedeniyle DNA dizi analizinde oluĢabilecek olsı hatalı sonuçları önlemek için çift yönlü dizi analizi yapıldı. Böylece SNP‘ler her iki yönde de belirlenerek yüksek güvenirlilikte değerlendirildi.
2.9. Ġstatistiki Analizler
Tüm istatistik analizler SPSS 20 istatistik programı kullanılarak yapıldı. Klinik ve biyokimyasal analizler için tanımlayıcı istatistik yapıldı, veriler ± standart sapma olarak hesaplandı. Hasta ve kontrol gruplarının Hardy-Weinberg (HW)