BEYİN VE SİNİR CERRAHİSİ
ANABİLİM DALI
İZMİR
2018
DR. EMRE ÇAVUŞOĞLU
KLİVUS KORDOMALARININ ENDOSKOPİK
TRANSNAZAL CERRAHİ EKSİZYON
TEDAVİSİNİN SONUÇLARININ PETROSPEKTİF
OLARAK DEĞERLENDİRİLMESİ
DANIŞMAN
DOÇ. DR. ERKİN ÖZGİRAY
T.C.
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
DANIŞMAN
ADI SOYADI
ADI SOYADI
İZMİR
2
GİRİŞ ve AMAÇ 1.i. GİRİŞ
Kordomalar, lokal-agresif invaziv seyir gösteren notokord kökenli kemik tümörlerdir, histolojik olarak düşük grade li sayılsalarda yüksek rekurrens oranına sahiptir ve nadirende olsa metastaz yapabilirler. Bir embriyoda notokord hücreler nöral tüp boyunca dağılarak aksiyal omurga, iskelet kasları ve diğer hayati organların gelişiminde önemli rol oynar. Doğumdan itibaren notokord hücreler regrese olmaya başlarlar(6-9 yas)1,2,18,19. Ancak intervertebral diskin nükleus pulpozusunda ve klivusun sinkondrozu gibi bazı dokulada kalır. Notokord hücrelerinin bu yerleşiminden ötürü kordomanın oluşum yerleri sınırlıdır. En sık sakrokoksigeal bölge(%50-60) ve klivus (%30) ta bulunur. Ancak spinal kolon boyunca görülebilir3,4,5,21.
Klivus kordomalar tüm intrakranial tümörlerin %0,2 sini, tüm kafa tabanı tümörlerinin yüzde %6 sını oluşturmaktadır. Genel olarak 6. dekatta görülürler ancak bu klivus kordomaları çocuklar dahil daha genç yaşlarda görülmektedir. Dünyada kabul gören tedavisi agresif yaklaşımla cerrahi olarak mümkün olan en geniş tümör rezeksiyonunu sağlayıp, ek nörolojik kayıba neden olmadan hayat kalitesini korumaktır20,21. Ancak tümörun infiltratif-destruktif olması ve norovaskuler yapılara komşu olması sebebi ile ve ilk tanıda genel olarak büyük hacimlere ulaşmış olması sebebi ile genel olarak total rezeksiyon mümkün olmamaktadır.18,19,21
Radyocerrahi, proton beam ve kombine proton-foton terapileri rezidu ve rekürrens tümörlerde etkili olabilmektedir. Tanı aldıktan sonra tedavisiz yaşam süresi ortalama 28 aydır. Birçok otörün tanı konulduktan sonra agresif cerrahi ve adjuvan tedaviyi önerdiği belirtilmiştir. Ancak transfasyal, transoral, transpetrosal yaklaşımlar yüksek mortalite
3 morbiditeye sebeb olmaktadır. Daha önce seçilmiş orta hat yerleşimli-lateral uzanımı olmayan vakalarda kullanılan bir teknik olan transnazal endoskopik cerrahi, son yıllarda deneyimin artması ve cerrahi ekipmanların gelişmesi ile güvenilir minimal invaziv öncelikli cerrahi seçenek olarak karşımıza çıkmaktadır12,20,22.
1.ii. AMAÇ
Yukarıda belirtilen bilgi ve açıklamalardan yola çıkılarak planlanan, geriye dönük ve tanımlayıcı olan çalışmamızda, 1 Ocak 2014-1 Mart 2018 yılları arasında, Ege Üniversitesi Tıp Fakültesi Hastanesi Nöroşirürji Kliniği’nde, endoskopik transnazal yolla opere edilen ve kesin patoloji sonucu “klivial kordoma” olan hastaların; sosyo-demografik özellikleri, hastalığa ilişkin bulguları ve sağ kalım süreleri değerlendirilmiştir.
Verilerden elde ettiğimiz bulgularla, klivus kordomaları konusunda kısıtlı olan literatür bilgilerine katkıda bulunmayı ve cerrahi yaklaşım tekniği rezeksiyon bu hastalarda sağ-kalım üzerine olan etkisini saptamayı amaçladık.
4
I. GENEL BİLGİLER
2.1. KLİVUS ANATOMİK YAPISI
Klivus terimi ilk kez 1791 de von Sommerring tarafından eğim ya da meyil” anlamında kullanılmıştır. Klivus endokondral ossifikasyon ile gelişir. Gestasyonun üçüncü haftasında fetüsün sefalik bölgesinde oluşmaya başlayan notokord, embriyon için temel bir eksen olup aynı zamanda aksiyel iskelet (kafa kemikleri ve kolumna vertebralis) için bir temel işlev üstlenerek ileride omur cisimlerinin oluşacağı yeri belirler. Fetal üçüncü ayda parakordal kıkırdakların kafa tabanında birleşmesi ile kondrokranyum oluşur. Bu kıkırdakların bileşimi sırasında sinüs petrosus inferior her iki taraftan kemikleşen elementlerle sarılır. Bu sarılma sonucu sinusu oluşturan damarların bazıları bu kemiklerin içinde kalarak kendilerine ait bir kanal oluştururlar. Bu damarların içinde bulunduğu kanala klival kanal denir. Klivus, basiocciput ve basisphenoid parçanın arasında gelişen kısımdır. Klival kanal genellikle klivus’un 1/3’lük orta kısmındadır. Fetal yaşamın altıncı haftasında sfenoidin bazal kısmı bir ya da iki ossifikasyon merkezinden oluşur. Doğumda klivus, sfeno-okipital sinkondrozis ile ayrılmış sfenoid gövde ve basioocciputun kısmen kemikleşmiş bileşenlerinden oluşur. Oksipital kompenentin baziler ve lateral bölümleri arasındaki sinkondrozlar genellikle 1-4 yaş arasında erken evrede kapanırlar. Ancak, sfeno-okipital sinkondrozis 18 ile 25 yıl arasında kapanır. Bu kartilaginöz eklem vücuttaki son sütürlerin kaynaşması ve kafatası tabanının postnatal büyümesinde önemli bir rol oynar.1,2,11
5
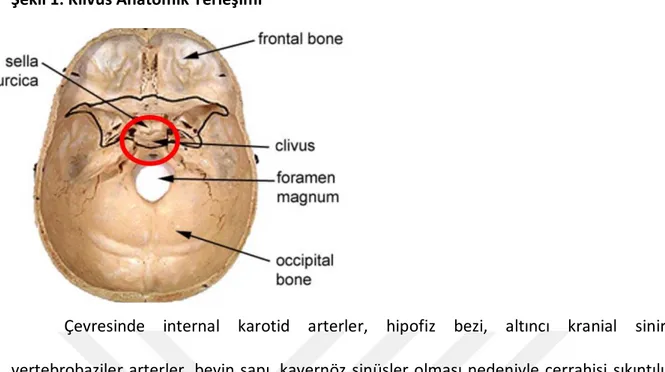
Şekil 1: Klivus Anatomik Yerleşimi
Çevresinde internal karotid arterler, hipofiz bezi, altıncı kranial sinirler, vertebrobaziler arterler, beyin sapı, kavernöz sinüsler olması nedeniyle cerrahisi sıkıntılı bir bölge olarak bilinmektedir. Klivus basio-oksiputtan sfenoid kemiğe kadar uzanır ve dorsum sellada son bulur. Klivusun uzunluğu 37 ile 52 mm arasında (ortalama 45 mm) değişir. Genişliği en dar kısımda 11 mm ve en geniş kısımda 14,3 mm dir 3.4.5 ( Şekil 2). Klivusun arka yüzünü arasında venöz pleksus olan kalın iki tabaka dura örter. Baziler dura, posteriorda beyin sapı ve vertebrobaziler arter dallarına doğru uzanır. Klivus ile her bir temporal kemiğin petroz prosesi arasında petro-oksipital fissür (sfenopetrozal veya oksipitopetrozal sütür/fissür) vardır.
6 Bu fissür aşağıya doğru olan seyrinde genişler ve juguler forameni oluşturur. Juguler foramenden internal juguler ven, kranial sinirler (IX, X, XI), inferior petrozal sinüs ve oksipital arterin meningeal dalı geçer 3,7,8,9,10 (Şekil 3).
Şekil 3: Klivus Ve Kraniyal Sinirler
Üst klivus petroz apeksin üzerinde ve orta kranial fossa posteriorunda abdusens (VI. kranial sinir) ve trigeminal sinirin çaprazlaşma noktasının üzerindedir. Dorsum sella ve posterior klinoidi içerir. Lateralinde kavernöz sinüs, intrakavernöz karotid arter, tentoryal çentik ve temporal lob, posteriorda baziler arter ve dalları ile mezensefalon, anteriorda sella tursika ve sfenoid sinüs bulunur 3,8,9,10.
Orta klivus VI. kranial sinirden IX, X, XI. sinirlerin çıkış foramenlerine kadar uzanan bölgedir. Posteriorda baziler arter ve dalları, vertebrobaziler bileşke ve ponsla komşudur. Lateralde inferior petrozal sinüs, petroz apeks, VII. ve VIII. kranial sinirler, anteriorda nazofarenks ve retrofaringeal doku ile ilişkilidir3,8,9,10.
7 Alt klivus IX, X, XI. sinirlerin altından oksipital kondil, foramen magnum ve hipoglossal kanala doğru uzanır. Posteriorda vertebral arter ve pontomedüller bileşke, medulla oblangata, spinomeduller bileşke, lateralde hipoglossal sinir, sigmoid sinüs, juguler bulbus, önde nazofarenks ve retrofarengeal doku vardır7,9. (Şekil 4)
Şekil 4: Klivusun Bölümleri
Cerrahi açıdan petroklival bölgenin intradural kompartımanları, petro- oksipital fissür hattı esas alınarak süperior petroklival aralık, orta petroklival aralık ve inferior petroklival aralık olarak üç bölgeye ayrılmıştır3,7,8.
Superior petroklival aralık orta beynin anteriorunda yer alır ve tentoriyal açıklığın anterior bölümünü oluşturur. Anterior ve anterolateral olarak sellar ve parasellar bölgeye uzanır. Bu bölgenin tavanı, üçüncü ventrikülün tabanını oluşturan diensefalik yapılardan oluşur. Posterior sınırında serebral pedinküller ve posterior perfore cisim bulunur. İnferior sınır ise trigeminal sinir ve pontomezensefalik sulkus tarafından yapılır. Tentoryumun medial kenarı superior petroklival aralığı infratentoriyal ve supratentoriyal kompartımanlara ayırır.
8 İnterpedinküler sisterna bu aralığın tam merkezinde yer alır. Her iki tarafta anterolateralde kavernoz sinüsler yer alır 3,10.
Okulomotor sinir interpedinküler fossadan çıkar, posterior klinoid procesin lateralinden ilerler ve kavernoz sinüse girer. Troklear sinir inferior kollikulusun altından çıkar, tentoryumun medial kenarının altından seyrederek kavernöz sinuse, okulomotor trigonun lateral posterior parçasından kavernöz sinüse ulaşır. Süperior petroklival aralığın (üst klivus ve petroz apeksin süperior parçasının) durasının arterleri, intrakavernoz karotid arterin meningohipofizeal trunkusunun bir dalı olan dorsal meningeal arterden ve orta meningeal arterin posterior meningeal dalından gelir.
Orta petroklival aralık pons ve serebellumun anterolateral yüzüdür. Superior sınırını pontomezensefalik sulkus; alt sınırını pons ve medulla arasındaki transvers sulkus oluşturur. Lateralinde petroz kemiğin posterior yüzeyi, serebellopontin sisterna ve içeriği bulunur. Abdusens, pontomeduller sulkus düzeyinden çıkar, öne ve yukarıya doğru ilerler, durayı geçerek ekstradural alanda baziler venöz pleksus içinde yükselip petroklinoid ligamentin altında yer alan Dorello kanalından geçerek kavernöz sinüse ulaşır.
İnferior petroklival aralık foramen magnum bölgesidir. Bu bölgedeki nörövasküler yapılar anteriorda premeduller sisterna içeriği, lateralde serebellomedüller sisterna içeriğindeki yapılardır. Bölgenin süperior sınırı pons ile medulla bileşkesidir. İnferior limit ise medulla-spinal kord bileşkesidir 3.
9 2.2. KLİVUS PATOLOJİLERİ
Klivusa ait patolojileri tümöral, vasküler ve travmatik lezyonlar olmak üzere 5 grup altında toplanabilmektedir12,13;
a. Tümöral Lezyonlar: meningiom, nörinom, kordoma, kondrosarkom, epidemoid, paragangliom, karsinom,…
b. Vasküler Lezyonlar: vertebrobaziler sistem anevrizmaları, AVM,…
c. Travmatik Lezyonlar: kranyal sinir lezyonları, dura laserasyonu, BOS fistülleri,… d. Konjenital anomaliler
e. Dejeneratif lezyonlar
Petroklival bölge tümörleri nadir görülen; tanı, tedavi ve cerrahi teknik açısından beyin cerrahisini zorlayan patolojilerdir. Uzun yıllar boyunca bu bölgeye yönelik cerrahi yaklaşımlar uygulanmış olmasına rağmen genellikle bu bölge lezyonlarının cerrahisinden kaçınılmış, opere edilen hastalarda da mortalite ve morbidite oranları oldukça yüksek olmuştur. Morbidite ve mortalitenin yüksek olmasındaki en önemli nedenler bölgenin kritik nöral ve vasküler yapıları barındırması, ulaşımın zor olması, genellikle bening natürde olan lezyonların minimal semptomlar ile dev boyutlara ulaşması, yetersiz görüntüleme teknikleri nedeniyle tümörnörovasküler yapılar arasındaki ilişkinin gereğince değerlendirilememesi olmuştur14,15,16
2.2.1. PETROKLİVAL BÖLGE TÜMÖRLERİ
Son 20 yıl içinde görüntüleme yöntemlerindeki büyük ilerlemeler bu tümörlerin anatomik genişliğinin ve çevre dokularla ilişkilerinin daha kesin çizgilerle saptanmasına imkan sağlamış, cerrahi anatomi daha iyi tanımlanmış, kafa kaidesi cerrahisindeki ilerlemeler sayesinde bu bölge lezyonlarına yönelik farklı cerrahi yaklaşımlar geliştirilmiş, cerrahi
10 rezeksiyon sırasında vasküler ve nöral yaralanma riskini azaltan, gerektiğinde rekonstrüksiyona imkan veren yeni teknikler bulunmuştur. Bu sayede kabul edilebilir mortalite ve morbidite oranları ile bu tümörlerin cerrahi olarak tedavi edilmesi mümkün hale gelmiştir. Tek bir hasta için uygun yaklaşımın seçimi söz konusu olduğunda; mevcut lezyonun natürü, lezyonun etkilediği kompartımanlar, lezyonun vaskülarizasyonu, hedeflenen rezeksiyon derecesi, nörovasküler yapılarla ilişki ve cerrahın tercihi etkili faktörler olmuştur14,15,16,17.
*İntradural lezyonlar : 1-) meningiom 2-) epidermoid kist
3-) nörilemmoma (başlıca V ve daha nadiren VII, IX, X)
*Ekstradural lezyonlar: benign, düşük gradeli ve yüksek gradeli olmak üzere sınıflanmaktadır( tablo 1).
Tablo 1: Ekstradural Lezyonların Sınıflandırılması
Benign Düşük Grade Yüksek Grade
1-) Meningiom 2-) Nörilemmoma (IX, X) 3-) Glomus Jugulare 4-) Kranyofaringioma 5-) Kolesterol Granüloma 6-) Epidermoid Kist 1-) KORDOMA 2-) Kondrosarkoma
3-) Adenoid Kistik Karsinom 4-) İnvazif Pituiter Adenoma
1-)Skuamoz Hücreli Karsinom 2-) Osteojenik Sarkoma 3-) Adenokarsinom
11
2.3.KORDOMALAR
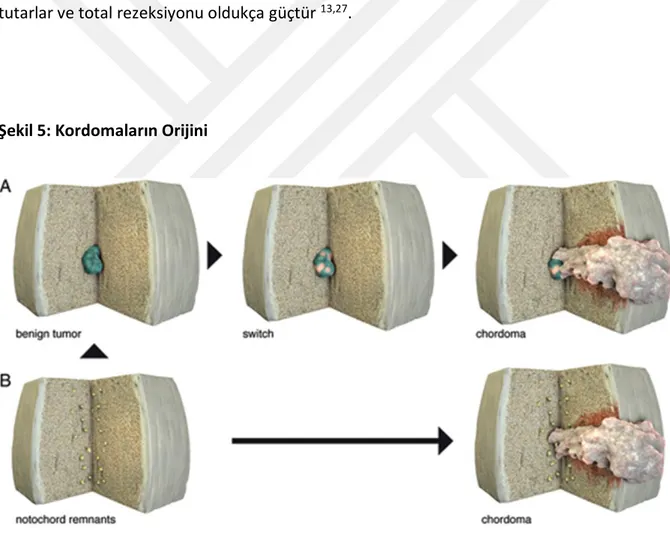
Kordomalar dorsum selladan koksikse dek uzanan orta çizgiyi tutan, embriyonal notokord kökenli olduğu düşünülen nadir, yavaş büyüyen, lokal agresif tümörlerdir18,19 (Şekil 5)74. Büyük bölümü sakrokoksigael bölge ve klivusta gelişir20,21.
Erişkinlerde notokord kalıntılar, %4-5 oranında dorsum sella içinde izlenir. Ponsun ventral bölümünde jelatinöz bir nodül biçiminde otopside rastlantısal olarak görülebilirler ve bu notokordal ektopik doku uzun zamandan beri “ ecchondrosis physaliphora” olarak adlandırılmaktadır. Başlıca yerleşim yeri sakrokoksigeal bölge( %50), ve kafatası tabanıdır(%40). Hipofizer fossada kanamalı büyük kitleler oluştuırabilir. Ekstranotokordal alanlarda gelişenler daha nadir görülürler22.
Kordoma kemik tümörleri içinde oldukça ender rastlanan bir tümördür. Malign kemik tümörlerinin %1-4’ünü oluştururlar ancak sakrumun en sık görülen primer tümörüdür. Lokal invazyon ve yavaş büyümeleri nedeniyle düşük dereceli malign olarak kabul edilirler23. Erkeklerde kadınlara göre sıklığı iki kat yüksektir ve 40 yaş altında çok nadir görülür24,25. Klinikte davranış açısından kordomalar iki grupta incelenebilir. Bunlar;
Yavaş büyüyen grup
Hızlı-agresif büyüyen ( kordoid) gruptur.
Tümörün klinik davranışı ve hasta prognozu konusunda en önemli faktör, tümörün biyolojisidir. Tedavi yaklaşımları arasında en etkin olanı cerrahi eksizyondur fakat kordomaların cerrahi tedavisinde, tümörün infiltratif-destrüktif olması ve nörovasküler yapılara yakın komşulukları ve ilk tanı anında büyük hacimlere ulaşmış olmaları nedeni ile onkolojik rezeksiyon çoğu zaman mümkün değildir. Dünyada genel kabul gören tedavi stratejisi agresif bir yaklaşımla, cerrahi olarak mümkün olan en yüksek oranda tümör
12 çıkarılmasını sağlarken, ek nörolojik kayba yol açmamak ve hayat kalitesinin korumaktır 18. Kordoid tip daha agresif seyreder. Büyük bölümü (ekstradural olanlar) klivustan çıkar ve durayı kemikten geniş bir alan boyunca ayırırlar. Nadir olgularda tümör durayı geçerek pia içersine büyür ve beynin tabanındaki arterleri ve sinirleri sarar. Pons, medulla ve 4. ventriküle basabilir. Sıklıkla kavenöz sinüs invazyonu görülür. Genellikle kranyal sinir kompresyonu 3. ve 6. sinir felciyle ortaya çıkar. Sfenopetroklival bölgeden köken alanlar oluşturdukları bulgulara göre üst yani bazisfenoidal ve alt yani bazioksipital grup olarak ikiye ayrılır. Tümör genellikle avaskülerdir. Litik kemik lezyonlarına yol açar, heterojen kontrast tutarlar ve total rezeksiyonu oldukça güçtür 13,27.
13
2.3.1. TARİHÇE
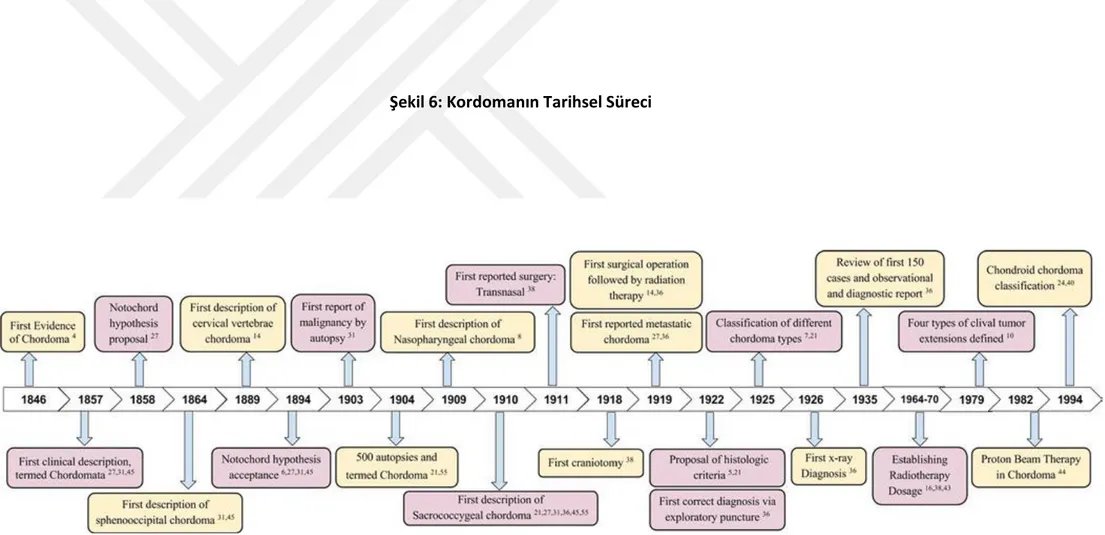
Kordoma tarihçesi ilk olarak 1946’da Alman patolog hekim olan Rudolf Virchow’un, otopside, clivus blumenbachii'nin yüzeyinde (dorsum sella) üzerinde tesadüfi, küçük, jelatimsi bir büyümenin dikkatini çekmesi ile başlamıştır28,29 (Şekil 6). 1856 yılında Alman anatomist Hubert von Luschka, rutin bir postmortem otopsi sırasında sella tursikadaki kranyal boşluğa girdiğinde, benzer şekilde yumuşak, şeffaf lobule olmuş kitlenin varlığından söz etmiştir. Çaprazlaştırılan bu bulgularla, Virchow başlattığı histolojik incelemelerle Luschka’nın gözlemlerinden sonraki bir yıl içinde, ilk kez tam olarak bunu açıklayan ve “pesuliar tümör” olarak isimlendiren kişi olmuştur. 1857’de Virchow “kordomata” terimini kullanmış ve açıklamasında tümörün ilginç embriyonik karakterli olduğunu belirterek, basioksipital ve basisfenoid arasındaki kıkırdaklı bağlantının lezyonu “ cartilaginous physaliphorous” olarak açıklamıştır. Diğer bir ifadeyle, Virchow 1857’de, bu tümörün klasik hücre tipi olan fizaliforöz hücreleri tanımlamış ve bunun kıkırdak kökenli olabileceğini düşünmüştür. Virchow, kordomatanın, kartilaj matriksin yumuşaması ve onu çevreleyen dokuların zarar görmesinin sonucunda hücrelerin vesiküler dönüşümü ve sıvı tutulumunun neden olduğu bir kartilaj neoplasmı olduğunu belirtmiştir. O mikroskobik incelemelerindeki birçok sitoplazmik vakuolleri referans göstererek “fisaliforöz” kelimesini kullanmıştır. Bu, günümüzde de bilinen kordomanın patognomik bir özelliğidir. 1958’de Virchow’un doktora danışmanı olan Alman anatomist Johannes Peter Müller, kordomatanın notokord hücrelerinden köken aldığını öne sürmüştür. Müller’in hipotezi, insanda basilar kartilaj, sakrum ve sfeno-oksipital senkrozisde notokordal doku kalıntılarının olabildildiği gerçeğine dayanmıştır. Ancak yeterli kanıt gösteremediği bu hipotezi Virchow, Luschka ve diğerleri tarafından kabul görmemiştir 28,31. Müller’in hipotezi kabul görmese de, özellikle kordomanın notokorddan gelişimi ile ilgili olarak patolojik gelişim ve özellikleri konusunda özellikle
14 Virchow, von Luschka, Kölliker, Löwe, Fric, ve Heiberg yoğun çalışmalar yapmışlardır. Virchow’un kordomanın notokorddan değil kartilajdan türediği görüşü, 1880’de Belçikalı hekim ve anatomist Hector Leboucq’un, notokordal dokunun insan embriyonik hayatında doğumdan önce yok edildiğini ve bunun yerine bağ dokusunun geçtiğini belirtmesi ile neredeyse evrensel bir görüş halini almıştır. O zamanda yanlış ve çelişkili olmasına rağmen yayınlanan birçok eser, Virchow’un görüşünden etkilenmiştir. Ancak bazı araştırmacılar şüphelerinin doğrultusunda konuya ilişkin daha fazla araştırma yapmaya devam etmişlerdir. Müller’in notokordal hipotezi üzerine olan tartışmalardan 36 yıl sonra, Alman patolog Moritz Wilhelm Hugo Ribbert tarafından kordomanın notokorddan türediği görüşü daha fazla itibar kazanmıştır28,29,30. Ribbert 1894 yılında, 5 klival kordomayı inceledikten sonra, Müller’i destekleyen, kordomanın klivusun orta hattından köken aldığını belirten bir dizi gözlemsel vaka tartışması sunmuştur. Daha sonra 1894 yılında bir grup tavşan ile yaptığı deneyde, tavşan otopsilerinin %2’sinin klivusunda notokordal doku bulmuştur28,31.
Kordomanın patolojik özelliklerine ilişkin yoğun yoğun odaklanma, gerçek bir klinik belirtecin gösterilmesini göz ardı etmiştir. 1864 yılında İsviçreli bir hekim olan Arnold C. Klebs ilk kez, sfeno-oksipital kordomalı bir hastanın klinik bulgularından söz etmiştir. Klebs 1889 yılında, tümörün malignitesine değil, medüler basınç artışına bağlı olarak öldüğünü belirttiği servikal vertebra kordoması olan ilk olguyu bildirmiştir28,29,30,31.
Alman bir hekim olan Lothar Henning 1900 yılında, 7 aylık bir yeni doğanda ilk kez sakrokoksigeal kordomata bildirmiş ancak olgunun çok genç olması nedeniyle bu doğumsal anomali olarak kabul edilmiştir. 1904 yılında Ribbert gerçekleştirdiği 500 otopsi serisinde, 10 olguda klival kordomata bidirmiş ve gözlemlediği tavşan deneyindeki insidansa benmzer
15 şekilde %2’lik bir insidans olduğunu belirtmiştir. Aynı yıl bu tümörün tanımlanmasında “kordomata” yerine “kordoma” terimi kullanılmasını önermiştir31,32.
1903 yılında Grahl, tümörün, intrakraniyal basıncı artırması ve ponsa olan bası etkisi yüzünden ölümle sonuçlanan ilk vakayı sununcaya dek, kordomalar benign, yavaş büyüyen tümörler olarak düşünülmüştür. Grahl’in otopsisinde sella tursikada kordomaya benzeyen 3 cm'lik bir tümör bulduğu hasta olan 51 yaşındaki kadın olgu, üçüncü, dördüncü ve yedinci kranial sinirlerin paralizisi nedeniyle oluşan görme bozukluğu, baş ağrısı ve sağırlık gibi nörolojik belirtilerle başvurmuş, dizartri ve disfajinin eşlik ettiği tablo sonunda medular merkezin paralizi olmasıyla kaybedilmiştir. Bundan kısa bir süre sonra, 1907 yılında, Fischer ve Steiner, ilerleyici çoklu nörolojik belirtilerle kaybedilen 16 yaşındaki bir erkek çocuk hastanın otopsisinde kordoma nedeniyle ikinci servikal vertebraya kadar uzanan yoğun bir dejenerasyona dikkat çekerek, kordomanın kliniksek olarak malign doğasını savunmuşlardır28,31,32.
1909 yılında Dr. Linck, kulakta akıntı ve otit şikâyetleriyle gelen orta yaş bir erkek hastada, farinkste güvercin yumurtası büyüklüğünde bir kitle saptamış ve 2 operasyon sonrasında; elde edilen materyalin, yağlı mukoid kordoma dokusu olduğunu kanıtlamıştır. Bu kanıt ilk nazofarengeal kordomanın sunumu olmakla birlikte, nerede meydana geldiğine bakılmaksızın kordoma ve kordomanın histolojik özelliklerini tanımlamak için kullanılmıştır28,29,30.
1910 yılında, Feldmann ve Mazzia, 46 yaşındaki kadın hastada ilk resmi sakrokoksigeal kordoma vakasını bildirmiştir. Bu hastada bir yıl önce sakro-perineal bölgede yumuşak şişlik ile başlayan ve ilerleyici özellik gösteren tümörün kordoma dokusu olduğu kanıtlan mıştır. Kısa bir süre sonra, 1919'da Pototschnig ilk gözlemlenen metastatik vakayı kaydetmiştir.
16 Sakro-koksigeal kordoma ile başvuran hastasında, ameliyattan sonra tekrarladığı ve bölgesel lenf düğümlerine metastaz yaptığı bildirilmiştir28,30.
1914'ten 1922'ye kadar bir dizi makale yayınladıktan sonra, Alezais ve Peyron kordoma gelişimi için, primitif notokordun evriminin klasik evreleri ile doğrudan ilişkili olan 3 histolojik kriteri tanımlamışlardır. Bir yıl sonra, 1923'te, çeşitli kordoma vakalarını değerlendiren Stewart ve Burrow, kordoma ve hastalığın malign büyüme potansiyeli olmayan invazif formlarını sınıflamak için “Ecchordosis physaliphora” teriminin kullanılmasını önermiştir.(Virchow’un başlangıctaki “Ekchondrosis”terimi yerine) Bu ayrım, kordomanın kırdaktan köken almasının aksine olan, neoplasm kordomadan zararsız bening forma kadar çeşitlilik gösteren notokordal orijininin kabul edilmiş olması açısından önemli bir gelişme olmuştur29,30,33.
1920'lerin sonunda ve 1930'ların başında, Coenen (1925), Corsy ve Surmont (1927) ve Stewart ve Morin (1926) tarafından oldukça değerli bilimsel incelemeler yapılmıştır. Bu incelemelerin hastalığın kliniğindeki genel anlayış üzerinde büyük etkisi olmuştur. 1925 yılında yapılan bir incelemede, Alman cerrah Coenen, farklı kordoma tanılarını içeren 68 vaka incelemiş ve verilen klinik ve embriyolojik tanımlara dayanarak, kordomanın farklı formları için ilk kez sınıflama tablosu önermiştir31,32.
1935'te Amerikalı bir doktor olan Mabrey, Massachusetts’te, bugüne kadar bildirilmiş 150 kordoma vakasını, hastalığı ve bakım standardını değerlendirmek için ayrıntılı bir gözlem raporuyla sunmuştur. Mabrey’in retrospektif çalışmasında Coenen’in sınıflandırması kullanılmış ve sakrokoksikeal ve kranial tümörlerin prevelansının, hareketli omurganın lezyonlarından daha yüksek bir prevalansı olduğunu ortaya çıkarmıştır. Ayrıca, ortalama hayatta kalma süresinin, semptomların başlangıcından itibaren 17.5 ay, erkek cinsiyette daha yüksek bir insidans, sakrokoksigeal rezeksiyon sonrası sağkalımın arttığını bildirmiştir.
17 Hastalığın farklı varyasyonları için karakteristik belirtilerin eksikliği üzerinde durmuştur. Mabrey çeşitli kordoma tiplerine özgü semptomları gözlemlemiştir. Kranial kordomada vertebral kordomanın aksine daha nadir baş ağrısı gibi nörolojik bulguların eşlik ettiğini, yaygın olarak radikülopati ile keskin ağrının varlığına dikkat çekmiştir. Sakrokoksigeal kordomada henüz belirgin ağrı bildirilmediği, Kranial kordomanın görsel rahatsızlık ve baş dönmesine yol açtığı, vertebral kordomalarda daha çok alt ekstremitelerde yaygın olarak güçsüzlük ve felç görüldüğünü bildirmiştir28,31,33.
1952'de patolog Charles Congdon, Ribbert’in orijinal tavşan deneyini tekrarlayarak, Müller'in kordomanın notokordal kökenli hipotezini doğrulamıştır. 1973'te, Heffelfinger ve meslektaşları, Minnesota'daki Mayo Kliniği'nde, neoplastik hücreli ve kliniksel olarak daha çok bening ve kıkırdak benzeri bir kondroid kordoma çeşidini tanımlamıştır26. Altı yıl sonra ilk kez, Alman çocuk radyolog Nolte, anterior, posterior, superior ve inferior olmak üzere 4 tip klival tümör uzantısını tanımlamıştır. Nolte, 5 yaşından küçük çocukların temel olarak inferior uzantıları olan klival tümörler ile başvurduğunu belirtmiştir28,29,30.
18
19
2.3.2. KORDOMA İNSİDANSI
Kordoma nadir bir tümördür. Literatürde insidansa ait bilgiler değişiklik göstermektedir. Farklı serilerde insidans %0,2 ile %6,15 arasında bildirilmiş olsa da şu ana kadar yayınlanan en geniş seride, SEER (Surveillance, Epidemiology and End Results) tarafından açıklanan bilgilere göre insidans yüzbinde 0,08 olarak rapor edilmiştir 18,34,35. Kordoma ve Kondrosarkomlar benzer anatomik lokalizasyon ve benzer histopatoloji nedeniyle birçok klinik seride birbirinden ayrılamamıştır. Bu çalışmalarda tüm intrakranial tümörlerin %0,2’sini ve tüm kafa tabanı tümörlerinin %6’sını, tüm kemik malignitelerinin ise %1-4’ünü oluşturdukları rapor edilmiştir 34,37. Kordomalarin %32’si kafa tabanında, %33 omurgada ve %29 sakrumda görülür 34,35. Kafa tabani olgularında cinsiyet dağılımı homojendir. Genellikle 50-60 yaş arası saptanır, 20 yaş altı görülme oranı %5’tir ve bu yaş grubunda daha agresif klinik seyir bildirilmiştir. Kordomalar tüm omurga tümörlerinin %17,5’ini oluşturur ve primer kemik kanserleri arasinda kordomalar 4. en sık görülen patolojidir 18,35,36. Kordomaların biyolojik özellikleri değişiklik göstermesine rağmen genellikle genç yaşlarda görülenlerin daha hızlı büyüme seyri izledikleri bildirilmiştir37. Ayrıca yaşlıların omurgalarında oluşan bu tümörün MIB-1 indeksinin düşük olduğu ve bu tümörlerde apoptoz indeksinin daha yüksek olduğu tespit edilmiştir 38,39. Bununla birlikte tekrarlayan tümörlerde ise MIB-1 indeksinin yüksek apoptoz indeksinin de yüksek olduğu gösterilmiştir 38,39. Literatürde kordomanın ailesel geçiş izleyebildiği yönünde yapılan çok az sayıda çalışma mevcuttur. Bu konuda ilk bulgular, 1998 yılında rapor edilmiş İskoçyalı bir ailenin iki kuşağında rastlanan 4 vaka 40 ve 1999 yılında ailesel kordoma olduğu söylenen 2 vaka üzerinde yapılan sitogenetik araştırmalardır 40,41. Bu çalışmaların ardından 2001 yılında linkage analizi kullanılarak yapılan bir çalışmada kordomalardaki ailesel geçiş için 7p33
20 bölgesinin önemli olabileceğini belirten bir çalışma yayınlanmıştır 42,43. Buna ilave olarak ailesel geçiş izleyen kordomalar için 7p33 ve 1p36 bölgeleri üzerinde çalışmalar yoğunlaşmıştır 42,43. Mevcut bulgular ışığında kordoma ile ilişkilendirilmiş spesifik bir kromozomal bölge tanımlanmamıştır39,44.
2.3.3. KORDOMA PATOGENEZİ
Kordomaların kokeni konusunda hala bilinmeyen cok şey olmasına rağmen tümör gelişimi konusunda bilgimiz son yıllarda önemli şekilde artmıştır. Korodomaların notokordiyal artıklardan kök aldığı konusundaki hipotez Muller tarafından 1858’de ortaya atılmıştır.
Schisano ve Raffel’in 1982 yılındaki yazılarında kafa tabanındaki lokalizasyonların
basisocciput ve basissphenoid olduğu bildirilmiştir18,44. Bu tümör lokalizasyonları notokordiyal kalıntıların yerleşimleri ile korelasyon göstermiştir 18,34,45 .
Notokord mezodermden köken alan ve bütün omurgalı canlıların embriyonal aşamasında mevcut olan fakat insan gibi yüksek organizasyonlu canlılarda yaşamsal süreç içerisinde yerini vertebralara bırakan bir yapıdır 46. Normal olarak omurların Nükleus pulposus, Annulus fibrosus ve intervertebral disk olmak üzere 3 bileşeni vardır 37,47. Notokordun nükleus pulposus hücrelerinden oluştuğu hipotezi 1950’li yıllara kadar gitmektedir 37. Fareler üzerinde 2008 yılında yapılan bir çalışmada nükleus pulposus hücrelerinin embriyonal notokord’dan köken aldığı gösterilmiştir. Bu yapılan çalışmada kordomanın da nükleus pulposus hücrelerinden köken aldığını gösteren kanıtlar ortaya konmuştur 37,48.
Kordomaların notokordiyal artıklardan kok aldığını destekleyen bu calışmaların ardından ailesel kordomalarda Brachyury geninin selektif duplikasyonu gosterilmiş ve
21 ardından sporadik kordomalarda da bu proteinin normalden fazla yapıldığı bildirilmiştir 49. Primitif notokordda eksprese edilen ve sonradan kaybolan bu proteinin in vitro ortamda maturizayonu durdurduğunu Hsu ve ark. tanımlamıştır 18,50 .
Kondrosarkomlar benzer lokalizasyonlarda görülmelerine ve benzer morfolojiye sahip olmalarına rağmen kordomalara göre daha tahmin edilebilir ve benign bir davranış sergilerler. Kordoma, pleomorfik adenom, müsinoz adenokarsinom ve kondrosarkom tanıları birbiriyle karışabilir ve bu ayrım immunohistokimyasal tekniklerle yapılabilir. Kordoma patogenezinde önemli bir rol oynadığı kanıtlanan Brachyury isimli bir transkripsyon faktörü, kordomaların tanısı konusunda güvenilir bir protein olarak yerini almıştır 59. Ayrıca radyolojik ve morfolojik olarak kodromaları takilt edebilen kondrosarkomların izositrat dehidrogenaz (IDH) mutasyonu taşımaları da ayırıcı tanı konusunda önemli bir yardımcıdır 18,45,59.
Yapılan tüm bu çalışmalar sayesinde kordomanın moleküler tanısı için yeni belirleyici proteinler ortaya konulmuş ve bu sayede literatürde kondrosarkomlar gibi kordomaların sıklıkla karıştırıldığı vakalar azalmıştır. Kordomaların tanısı için kullanılan belirteçlerin listesi Tablo 2’de verilmiştir37.
22
Tablo 2: Kordomalarda Yüksek Ekspresyon Gösteren Genler, Bulunduğu Kromozomal Bölgeler Ve Bu Genlerin Kordomalardaki Varlığını Gösteren Kaynaklar
GEN İSMİ mRNA KODU mRNA NÜKLEOTİT KODU KROMOZOMAL BÖLGE LİTERATÜR
EMA NM_002456 1q21 (Walker ve ark 1991)51
Galektin-3 NM_002306 14q22.3 (Gotz ve ark 1997)58
E-kaderin NM_004360 16q22.1 (Naka ve ark 2001)54
Vimentin NM_003380.2 10p13 (Niwa ve ark 1994)56
CD24 NM_013230 6q21 (Oakley ve ark 2008)57
CD44 NM_000610.3 11p13 (Saad ve Collins 2005)52
Sitokeratin19 NM_002276 17q21.2 (Walker ve ark 1991)51
c-met NM_001127500 7q31 (Naka ve ark 1997)55
Brachyury NM_003181 6q27 (Romeo ve Hogendoorn 2006)53
Bayrak ÖF. İnsan Kordomalarında Ekspresyon Farklılıkları Olan Mikrorna’ların Ve İlgili Transkriptlerin İncelenmesi Ve Bunların Kordomaların Patogenezindeki Öneminin Belirlenmesi. 2010, Konya.
23
2.3.4. KORDOMA PATOLOJİSİ
Kordomalar yavaş büyüyen, kapsül oluşturmayan, lokal-invaziv, nadiren de olsa metastatik olabilen tümörlerdir. Kafa tabanında bir çok anatomik lokalizasyonda görülebilir. En sık yerleşim yeri sfenooksipital sinkondroz çevresidir. Metastazlar hastaların %3-48’inde görülür; daha sıklıkla sakrokoksigeal lokalizasyonlu tümörlerdir ve bulgu vermeyebilirler 18.
Makroskopik olarak gri renkte, lobule, solid ya da jelatinöz yapıdadır. Yumuşak ve tahta sertliğine varan değişik yapı özelliği gösterebilmektedir. Odaksal kalsifikasyon içerebilirler. Çevresinde psödokapsül bulunmaktadır. Mikroskobik olarak kordomalarda musin içeren, yaygın stroma içinde, sinsiyal yapıda, gözesel kümeler yer alır. Sitoplazma geniştir, büyük intrasitoplazmik vakuol içerdiğinde “water-clear” ya da “phsaliphorus” adı alır. Bunlar, patognomoniktir22.
Kordoma patolojik olarak klasik(konvensiyonel), kondroid ve dediferansiye olarak 3 alt gruba ayrılmaktadır37,64.
Patolojik sınıflamada klasik, kondroid ya da dediferansiye tipler ayırdedilir. Işık mikroskopisi malign davranışa rağmen bening bir görünüm sergiler. Kordomaların Sitoplazma eozinofilik ve PAS (Periodik Asit Schiff) pozitiftir. Daha büyük, ekzantrik çekirdekli, vakuoller içeren retiküle sitoplazmalı fizaliforöz hücreler olarak bilinen hücreler içerirler. Bu hücreler kordomalar için spesifiktir18,37.
Klasik kordomanın varyasyonları olan ve ekstraselüler matriksin az olduğu “hücreden zengin kordomalar” ve adipositlere benzeyen hücrelerin de görüldüğü “lipoid kordomalar” tanımlanmıştır18,35. Klasik kordoma lobüler bir yapı gösterir ve etrafındaki yumuşak dokudan belirgin bir şekilde ayrılır. Tümörün büyüklüğü oldukça değişken olmakla birlikte en büyük tümörlere sakrumda rastlanılmıştır37,61,62.
24 Kondroid kordoma, klasik kordoma gibi benzer özellikler göstermesine rağmen bazı bölgelerde düşük dereceli kondrosarkom özelliklerini de taşır. Bu açıdan klasik kordomaya nazaran daha ılımlı prognozu gösterir. Kondroid kordoma daha sık olarak kafa tabanında görülür 18,37,63. Kafa tabanı kordomaları, en sık 30-40 yaşlarında görülür, genellikle yavaş büyürler ve lokal invaziv özellik gösterirler. Semptom ve bulgular, lezyonun lokalizasyon ve büyüklüğüne bağlıdır. Tümör sıklıkla, sellar, parasellar ve klival invazyon bulguları ile ortaya çıkar. 6. kraniyal sinir tutulumuna bağlı, diplopi en sık görülen semptomdur ve olguların %90’nında mevcuttur. Fronto-oksipital başağrısı, olguların en az %75’inde görülür. Görme alanı defekti ve burun tıkanıklığı sık rastlanan diğer semptomlardır. Serilerin çoğunda, klival kordomalar, nazofarengeal kitle olarak görülürler20. Kranyal Kordomalarda Schisano ve Tovi Sınıflandırması kullanılmaktadır 65; (Tablo 3)
Tablo 3: Kranyal Kordomalarda Schisano ve Tovi Sınıflandırması
A Tümör Ağırlıklı Olarak Orta Kranyal Fossada B Tümör Parasellar Bölgede
C Tümör Klivus ve Parasellar Bölgede
Nadir olarak kordomalar yuvarlak hücreli tümörlere ya da iğsi hücreli sarkomlara benzeyen alanlar içerebilir. Bu olgular dediferansiye kordomalar olarak adlandırılır; saldırgan bir davranışa ve kötü prognoza sahiptir. Pediatrik popülasyonda daha yüksek oranda görülür ve sıklıkla sakrokoksigeal bölgede yerleşir. Dediferansiye kordomalara ilk prezentasyonda %4 oranında rastlanır. Bu oran rekürren hastalarda %9’a kadar çıkabilir18,37.
25 Aksiyel iskelet kemik, kıkırdak, fibrokıkırdak, notokord, merkezi sinir sistemi yağ dokusu ve düz kas gibi birçok dokudan oluşmuştur. Aksiyel iskelet üzerinde oluşan herhangi bir tümör bu dokuların herhangi birinden kaynaklanabilir60. Kafa ve omurlarda en sık görülen bening kemik tümörü hemanjiomadır. Bununla birlikte en sık görülen maling kemik tümörü ise kordomalardır. Kordoma genellikle tüm yaş gruplarında görülmesine rağmen 50-60’lı yaşlarda daha sık görülmektedir 35,37.
2.3.5. KORDOMALARDA KLİNİK BULGULAR
Kordomalar kranial bölgeden sakrokoksigeal bölgeye kadar tüm omurga boyunca yerleşimli olabilirler. Doğal olarak klinik bulgular yerleşim yerine göre ve tümörün büyüme doğrultusuna göre değişiklik göstermektedir. Genellikle yıllar süren baş ya da boyun ağrısı gibi semptomların ardından hızlı başlayan nöropatolojik bulgular ile kliniğe başvururlar 18,66.
Kordomaların büyümesi yavaş seyirlidir, bu sebeple teşhis edildiklerinde genelde ileri evrelerde bulunurlar. Kordomaların lokalizasyonu konusunda yapılmış en kapsamlı çalışma McMaster ve ark. Tarafından yapılan çalışmadır ve %32’si kraniyal, %32,8’i spinal, % 29,2’si sakral yerleşimli olarak bulunmuştur35. İntrakraniyal kordomalar ise genellikle üst klivus (basisfenoid) yada basioksiput klivusta, sfeno-oksipital senkondrosis’ten origin olmaktadırlar (Şekil 7).35 Her ne kadar klinik bulgular lezyonların lokalizasyonuna göre değişebilse de genellikle lokalizasyondan bağımsız olarak ağrı en sık şikâyettir. Ağrı yavaş yavaş artan sinsi bir karakterdedir37,67,68. Tümör sıklıkla spinal kanala açılır ve medullanın, kauda ekuinanın ya da sinir köklerinin kompresyonuna sebep olabilir. Bu durumun sonucunda güçsüzlük, duyuda azalma, barsak ve mesane inkontinansı ve cinsel disfonksiyon gibi bulgular gelişebilir21,67,68,72.
Kafa tabanındaki kordomalar genellikle klivus içinde büyürler ve kranial sinir felçleri ile bulgu verirler. Büyük ve sella içinde yerleşmiş olanlar endokrinopatilere de sebep olabilir.
26 Kranial kordomalar sakral kordomalardan 1 dekad önce klinik bulgu verirler. En sık 6. ve daha sonra sırasıyla 3. ve 4. kafa çiftlerinin paralizileri görülürken hastaların yüzde 50’sinde pitozis saptanmaktadır18. Semptom ve bulgular, lezyonun lokalizasyon ve büyüklüğüne bağlıdır. Tümör sıklıkla, sellar, parasellar ve klival invazyon bulguları ile ortaya çıkar. 6. kraniyal sinir tutulumuna bağlı, diplopi en sık görülen semptomdur ve olguların %90’nında mevcuttur. Fronto-oksipital başağrısı, olguların en az %75’inde görülür20. Diğer nadir görülen bulgular ise epistaksis ve intrakranial kanamadır69,70.
Servikal lokalizasyonlu kordomalar kendini hava yolu obstrüksiyonu, retrofarengeal kitle, disfaji, disfoni ya da Horner sendromu şeklinde gösterebilirken, sakral bölgede lokalize kordomalar ise presakral gerginliğe sebep olarak obstipasyon, konstipasyon, tenesmus ve hemoroid gibi rektal disfonksiyon bulgularına sebep olabilir71. Bildirilmiş serilerde semptomların ortalama ortaya çıkma süresi 4 ile 40 ay arasında değişmektedir70.
Kordomalar tümörün hemen ilk başlangıcında genelde metastaz yapıyor olmasa da geç teşhis edilmesi sebebiyle teşhis anında uzak metastazla birlikte bulunabilir. Kordomaların % 5 kadarı teşhis edildiğinde akciğer, kemik, cilt veya beyine metastaz yapmış olabilir. Hastalığın ileri evrelerinde ise % 65 gibi yüksek bir oranda metastaz bulunabilir70. Fakat metastazların sağ kalımı tümörün lokal progresyonu kadar fazla etkilemediği belirtilmektedir8. Mortalite açısından en önemli faktör ise lokal nükstür, bu sebeple kür elde edilebilmesi için cerrahi rezeksiyon esnasında rezeksiyon sınırlarının uygun uzaklıkta tutulması hayati öneme sahiptirler 70,73.
Tedavi edilmemiş kordomalarda semptomların başlamasından sonra ortalama sağ kalım 6-28 aydır. Dolayısıyla tanı alan semptomatik kordoma olguları tedavi edilmelidir. Tüm kordoma olgularında uygulanabilecek optimal bir tedavi yoktur. Cerrahi, radyoterapi ya da
27 her ikisinin birlikte kullanımından sonra ortalama yaşam beklentisi 3,6 yıldan 6,6 yıla çıkar. Tümörün interensek biyolojisine bağlı olarak semptomların başlaması ve klinik tanının konması arasındaki süre ortalama 1 hafta ile 16 yıl arasındadır18,66.
28
2.3.6. KORDOMALARDA TANILAMA YÖNTEMLERİ
Kordomaların gerçek tanısı patolojik inceleme ile konulur. Fakat radyolojik görüntüleme Direkt grafi, bilgisayarlı tomografi (BT) ve Manyetik Rezonans Görüntüleme (MR) gibi incelemeler tümörün özelliklerini belirlemeye yardımcı olur. İntrakraniyal kordomaların radyolojik değerlendirmesi BT ve MR görüntülemelerinin ilerlemesiyle birlikte gelişme göstermiştir. Kafa tabanında yer alan tümörler ya da tümör uzantısı olan yapıların dâhil olduğu tanı özellikleri günümüzde daha hassaslıkla gösterilebilir hale gelmiştir. Bu gelişmeler, tümörün radikal rezeksiyonunu ve tümörün sınırlarını planlamada cerraha ve yakın kraniyal sinirler ve ileri tedaviler için vasküler yapıları değerlendiren onkoloğa gerçek veriler sunmaya başlamıştır79. MRG primer tümör lokalizasyonu ve omurga metastazlarını, lokalize olan yerdeki farklı yumuşak doku bileşenlerini ve yapıları değerlendirebilmek için başlangıç tanılama yöntemi olarak kabul edilmektedir32.
BT şüpheli tanı düşünülen vakalarda MRG ye ek görüntüleme olarak kullanılabilmektedir. BT, operasyon öncesi strateji planlaması için “bone Windows setting” ayarlı olarak gerekli görülmektedir75,76. Yüksek çözünürlüklü BT,’ de tümör içi kalsifikasyonlar düzensiz bir görünüm sergilemektedirler ve bu genellikle tümördeki distrofik kalsifikasyondan ziyade kemik harabiyetine bağlı ayrılmaların görüntüsü olarak düşünülmektedir (Şekil 8)(Şekil 9). Vertebral ya da karotis arter tutulumundan şüphelenilen durumlarda mutlaka MR-anjiografi ya da BT-anjiografi ile intrakraniyal vasküler yapılar değerlendirilmelidir. Ayrıca DSA venöz sistemin görüntülenmesi için değerlidir. İnternal karotid arterin ameliyat esnasında kapatılması düşünülüyorsa balon oklüzyon testi uygulanabilmektedir. İntraoperatif ultrasonografi, BT ve MR kafa tabanı ameliyatları sırasında rezidüel tümör hacmini azaltmakta önemlidir. MRG veya BT görüntüleme
29 yöntemleri aynı zamanda tümör rezeksiyonu sonrası durumun değerlendirilmesi için kullanılmaktadır18,75.
Şekil 8: Klivial Lezyonların Görüntülenmesi
30 Magnetik Rezonans Görüntüleme (MRG) kordomaların görüntülenmesinde altın standart olarak kabul edilmektedir. Tipik olarak kordomalar MRG incelemesinde klivustan kaynaklanan ve ekspansil kemik destriksiyonuna neden olan, homojen, hipointens lezyonlar olarak görünmektedirler. T1 ağırlıklı incelemelerde heterojen, hipointensken, T2 ağırlıklı incelemelerde heterojen, hiperintense değişken miktarlarda kontrast tutabilen lezyonlardır(Şekil 10). Metastazlar sonrasında klivusta en sık rastlanan kitle kordomalardır. Normal klivus MR incelemelerinde düşük sinyal intensitesindedir ve yaşla birlikte kemik iliğindeki yağ miktarının artışına bağlı olarak T1 sinyali daha da azalmaktadır 6,32,76.
MR incelemelerinde kordomaların lobüller oluşturarak büyüdükleri izlenebilmektedir. Kordoma ve kondrosarkomlar klivusta yerleşimli diğer tümörlerden kolaylıkla ayrılırlar. Ayırıcı tanıda yer alan patolojiler menenjiyomlar, invaziv hipofiz adenomları, plazmositomlar, metastatik tümörler, sfenoid sinüs karsinomları, nazofaringeal karsinomlar, lenfomalar, granülomatöz hastalıklar ve kıkırdak tümörleridir18. Ancak yine de günümüz teknolojisi ile yapılan radyolojik tetkiklerde, kordoma ve kondrosarkoma ameliyat öncesinde güvenilir bir şekilde birbirinden ayrılamamaktadırlar.
Kordomalar ve kondrosarkomaların ikisi de mezenkimal kökenli tümörlerdir ancak farklı biyolojik özellikler göstermektedirler. Aynı nöral aksiste görülebilmektedirler. Kranial kordomaların klasik görünümü klivusu simetrik infiltre eden bir kitle şeklindedir. Tomografide kemik dokuda destruksiyona yol açan bir yumuşak doku kitlesi görülmektedir. Özellikle kranial foramen invazyonunu göstermek konusunda BT ayrımı önemlidir18
31
Şekil 10: Kordomalarda T1 Ağırlıklı MR Görüntülemesi
Sintigrafi ise diğer kemik lezyonlarının araştırılmasında fonksiyonel bir yaklaşım sağlamaktadır. Fluorodeoxyglucose - Positron Emission Tomography/Computed Tomography (FDG-PET / CT) taraması, tümörün ve dâhil olan yapıların metabolik aktivitelerinin değerlendirilmesinde yardımcı olabilir. En etkili terapötik veya cerrahi yaklaşımı tanımlamak için klival lezyonun doğru ayırıcı tanısı önemlidir. Lezyonun kesin tanısı için, biyopsi ya da rezeksiyonu histopatolojik incelemeler izlemektedir. Bu nedenle doğru tanı, cerrah, radyolog ve patolog arasındaki multidisipliner ekip çalışması ile doğrulanabilmektedir6,78.
Kordomalarda son tanı işlemleri patolojik inceleme sonucunda elde edilmektedir. Işık mikroskobunda incelendiklerinde kordomalar içlerinde berrak görünüm veren pas pozitif glikozaminoglikanlar bulunan (fizaliferoz) hücrelerden oluşmaktadırlar. Tümör hücreleri ekstraselüler matriks içinde lobüler bir düzenlenme göstermektedirler. Lokal kıkırdak adacıklarına da rastlanmaktadır. Kordomalar ve kondrosarkomlar birbirleriyle karıştırılabilir. Bu ayrımın kesinleştirilmesi ancak immunhistokimya incelemeleri sonucunda sağlanabilmektedir. Kordomalar epitelial özellikler taşırlar ve gerek konvansiyonel boyalar ve mikroskopi, gerek elektron mikroskopisinde gerekse immünhistokimyasal olarak bu
32 özellikleri barındırmaktadırlar. Konvansiyonel mikroskopideki atipik epitelial markerler, elektron mikroskopisindeki dezmozomlar ve basit hücre junctionlarının varlığı, immünhistokimyasal olarak gösterilebilen EMA ve epitelial sitokeratinler bu özelliklerdendir. Buna karşılık kondrosarkomlar epitelial işaret taşımazlar ve S100 ekspresyonu göstermektedirler. Ayrım konusunda asıl zorluğu yaratan net bir diferensiasyon göstermeyen tümörlerdir49.
2.3.7. KORDOMALARDA TEDAVİ YÖNTEMLERİ
Kordoma düşünülen radyolojik görüntü saptandığında primer tedavi, cerrahi olarak düşünülmelidir. Tedavi edilmeyen kordomalarda semptomların başlamasından sonra ortalama sürvi 28 ay olarak bildirilmektedir. Yaşam beklentisinin uzun olmaması kordomaların doğal seyirde bırakılmaması ve daha küçük boyuttayken tedavi şansının tanınmasını gerektirmektedir. Cerrahi ve radyoterapinin eklenmesinin ortalama yaşam beklentisini uzattığı belirtilmektedir. Parsiyel, subtotal, radikal rezeksiyon ve değişik şekillerde radyoterapi uygulanmaları tanımlanmıştır. Daha yüksek oranda eksizyonun daha uzun hayatta kalım sağladığı yönündeki görüşler ağırlık kazanmaktadır18.
2.3.7. 1. CERRAHİ TEDAVİ
Kafatabanı kordomaları, cerrahi tedavi açısından, cerrahların en zorlu girişimlerinden olan kafa tabanı patolojisidir. Bu nedenle yıllar içerisinde birçok cerrahi yaklaşım denenmiştir. Bu yaklaşımlardaki temel amaç, rezeksiyon oranını artırmak, çevredeki yumuşak doku, beyin, nörovasküler yapıları korumak, morbidite ilişkili yaklaşımları azalmak ve onkokolojik sonuçları iyileştirmek olmuştur80.
33 Klivusta bulunan kordomaların en zorlayıcı cerrahiler arasında yer alması, yıllar içerisinde bu bölgeye anterior, posterior ve lateral kafa tabanı yaklaşım gibi çoklu cerrahi yaklaşımları beraberinde getirmiştir81,82.
Tüm dünyada kordoma tedavisinde kabul gören, bu tümörlerin maksimal ve emniyetli rezeksiyonların tedavinin bel kemiğini oluşturduğudur. Kordomaların kafa tabanındaki yerleşim yerleri, boyutları ve çevrelerindeki nörovasküler yapılar dolayısı ile geniş en-blok rezeksiyonlar mümkün olmadığı bilinmektedir. Cerrahi stratejiler total rezeksiyonu amaçlayan intralezyonal tümör rezeksiyonları üzerine kurulmuştur18.
Mümkün olduğunda, cerrahi rezeksiyon tedavinin ilk seçeneği olmalıdır. Ancak, kafa tabanı kordomalarının, hipofiz, hipotalamus, optik kiazma ve beyin sapına olan yakın komşulukları, güvenlik sınırı ile birlikte tümörün tam rezeksiyonuna izin vermez. Subtotal yapılan eksizyonlarda ise nüks kaçınılmazdır. Bu sebeble kafa tabanı kordomalarında olgular, cerrahi ve postoperatif radyoterapi ile tedavi edilirler20. Cerrahi sonrası ortalama yaşam süresi 7 yıldır. Ölüm çoğunlukla, intrakraniyal uzanımla birlikte olan lokal nükse bağlıdır20.
2.3.7. 2. ADJUVAN TEDAVİ
Kordomaların büyük bir çoğunluğu cerrahi sonrasında rekürrens göstermektedir, dolayısı ile adjuvan tedaviye hemen her zaman ihtiyaç duyulmaktadır. Konvansiyonel radyoterapi yöntemlerinin etkisiz kalmaları kordomaların radyorezistan oldukları düşüncesini yaratmış, fakat son yıllarda partikül ışınlaması ve radyocerrahi teknikleri kullanılarak yayınlanan ümit verici sonuçlar bu konudaki çalışmalara tekrar ivme kazandırmıştır18.
34
2.3.7.2.i Konvansiyonel Radyoterapi
Rezidüel ve rekürren tümörlerin büyük çoğunluğunda radyoterapi uygulanmaktadır 18,92. Sadece radyoterapinin sonuçları, cerrahi tedavi sonrası radyoterapiden daha kötüdür. Optik sinir ve beyin sapına olabilecek olan hasarı engellemek için, kafa kaidesi kordomalarında konvansiyonel radyoterapi de ancak orta derecede dozlar uygulanabilir. Konvansiyonel radyoterapi ile rapor edilen 5 yıllık progresyonsuz sağkalım %17-39 seviyesindedir93. Farklı çalışmalarda artan radyasyon dozları ile daha başarılı sonuçlar alınabildiği ortaya atılmıştır. Modern ekipman ve protokollerle günümüzde radyoterapi ile sağlanabilecek 5 yıllık progresyonsuz sağkalım % 50 civarındadır. Fakat olguların çoğunda uzun dönem tümör kontrolü sağlanamamaktadır. Radyoterapinin radyocerrahi ile kombinasyonu, radyosensitizan ajanların tedaviye eklenmesi gibi yaklaşımlar denenemektedir. Kordomaların çoğu cerrahi rezeksiyon sonrası tekrarlarlar ve bir çeşit adjuvan tedaviye hemen her zaman gerek duyulmaktadır. Radyasyon tedavisi dolayısıyla lokal kontrolü sağlamak amacıyla kullanılmaktadır. Radyasyon teknolojisindeki gelişmeler (Yüksek enerjili partikül radyasyon tedavileri) daha yüksek dozda radyoterapi ile daha az çevre dokuya zarar verebilmeyi başarmıştır18,92,93.
2.3.7.2.ii. Radyocerrahi
Radyocerrahi teknikleri dozimetrik planlama ile çevre dokulara minimal yan etki yaparak lezyona maksimum ışın yönlendirilmesi prensibine dayanırlar. Kordomalar konusunda günümüzde birçok kanser merkezinde kabul edilen en efektif tedavi yöntemi, geniş en-blok eksiyon sonrasında yüksek enerjili partikül radyasyon tedavileridir. Gamma-knife küçük boyutlu kordomaların primer adjuvan tedavisinde önemlidir fakat rekürren lezyonlardaki etkisi daha kısıtlıdır. Adjuvan tedaviler arasında proton radyocerrahi en etkili
35 olanıdır. Bu çok yüksek enerjili bir radyocerrahi tekniğidir. Austin-Seymour ve ark. Postop yüksek doz proton radyocerrahi alan (ort. Tümör dozu 69 Gy) 68 hastanın sonuçlarını bildirdiler 18. 17-152 ay arası izlenen bu hastalarda 5 yıllık tümör lokal kontrol oranı % 82 ve nüks olmadan yaşam oranı % 76 olarak bulundu. Erkeklerde ve küçük tümörlerde daha iyi prognoz gösterildi. Muenzenrider ve ark.nın 56,8-75,6 cGy doz radyasyon sonrası 5 yıllık nüks olmadan sağkalım oranı %76 ve total sağkalım oranı toplam 194 hasta için %90 olarak saptandı 18,92. Hug ve ark. 64,8-79,2 cGy arası dozda proton radyoterapisi alan 58 kafa tabanı kordoma ve kondrosarkoma hastası tanımladılar. Bunların 5 yıllık lokal tümör kontrol oranları kondrosarkomalar için %75, kordomalar için ise % 59 olarak saptandı. Bu yayında tümör hacmi ve beyin sapı tutulumunun kontrol oranını etkilemediği bildirilmiştir 18. Yüksek enerjili olmayan radyocerrahi tekniklerinin sonuçları ise bu kadar net değildir. Muthukumar ve ark. 15 kafa tabanı kordoma ve kondrosarkomu hastası için gamma knife cerrahisinin mikrocerrahiye alternatif olduğunu belirtmişlerdir 18. Maksimum 24-40 Gy tümör dozunda ortalama 36 Gy, ve yine tümör sınır dozu 12-20 Gy, ortalama 18 Gy ortalama 4.6 ml boyutlu tümörler için 8 hastada çalışılmış, ve bunların 3’ü stabil kalırken 4’ü eksitus olmuştur. Küçük hacimli tümörlerde, radyocerrahi güvenli bir metod olarak görülmüştür. Debus ve ark. fraksiyone stereotaktik radyoterapi alan 45 kordoma veya kondrosarkoma hastasının 5 yıllık sağkalım oranlarını % 50 ve % 82 olarak saptadılar 94. Strereotaktik radyocerrahi için küçük boyut ve yerleşim yerleri önemli kriterlerdir. Kafa tabanı kordomalarında tümör volümünü küçültmek için yapılacak cerrahi sonrası optik sinirler, kiazma ve beyin sapı gibi yapılardan belirli uzaklıklarda kalmak koşulu ile radyocerrahi uygulanması, efektif bir metod olarak saptanmıştır18.
36
2.3.7.2.iii. Protonterapi
Protonun tedavide kullanımını ilk kez 1946 yılında Robert Wilson önermiş ve 2 yıl sonra 184 inçlik “siklotron” ‘Lawrence Berkeley Laboratory’ de araştırmacıların hizmetine sokulmuştur 95. Modern tıpta ilk kullanımı ise, 1973 yılında halen günümüzde de en önemli protonterapi merkezlerinden biri olan Harvard Siklotron Laboratuvarı’dır. Loma Linda Üniversitesi (USA), Paul Scherrer Enstitüsü (İsviçre), Protontherapie d’Orsay Merkezi (Fransa), Thereoretical and Experimental Physics Enstitüsü (Rusya) en önemli ve protonterapi literatürüne en çok katkısı olan merkezlerdir. Tüm dünyada faaliyette olan yaklaşık 50 merkezde, 2014 yılı sonu itibariyle 130 bin civarında hastanın tedavi edildiği bildirilmiştir95,96. Protonun konvansiyonel foton tedavisine üstünlüğü normal dokuda daha az yan etkidir. Daha az akut yan etki sebebiyle tedaviye ara verilme ihtimalinin azalması ve radyoterapi ile eş zamanlı kemoterapi kullanımına olanak sağlaması ile artmış radyoterapi etkinliği, geç etkilerinin azalması sebebiyle ise hayat kalitesinin artması hemen söylenebilecek ilk avantajlarındandır. Yan etkilerin azalmasının dolaylı sonucu ise, doz artımına duyarlı tümörlerde daha yüksek doza çıkabilme olanağı sağlaması ile lokal kontrol ve yaşam süresinin artmasıdır96.
Günümüzde yoğunluk ayarlı radyoterapi (YART) ve stereotaksi gibi foton radyoterapi teknikleri ile tümöral doku üzerinde protondakine benzeyen doz dağılımı elde etmek çoğu zaman mümkün olmaktadır. Ancak bu tekniklerin hiçbirinde normal dokuyu protonda olduğu kadar korumak mümkün değildir96. Protonun sağladığı dozimetrik avantajın direk olarak kliniğe yansıdığı hasta gurupları göz ve kafa tabanı (kordoma ve kondrosarkoma) tümörleridir. Literatürde protonterapi ile göz tümörlerinde %85-96 lokal kontrol oranı saptanırken, %75-100 oranında görmenin korunduğu bildirilmiştir 100. Kafa tabanında görme yolu, beyin sapı gibi kritik organların çevresine yerleşmiş kordoma ve kondrosarkoma
37 tümörlerinde çevredeki riskli organları fotona göre daha iyi koruyarak yüksek dozla tedaviye olanak sağlamaktadır97,98,99. Protonun fotona kıyasla sahip olduğu tüm avantajlarına rağmen halen tartışma konusu olmasının en onemli sebebi ise şüphesiz proton akseleratorlerinin X-ray teknolojisine oranla daha pahalı olması ve bunun da daha pahalı bir tedavi yöntemi olarak kliniğe yansımasından kaynaklanmaktadır. Dünyada protonterapiye giderek artan bir ilgi gösterilmektedir ve varolan merkezlerin yanısıra faaliyete geçmesi planlanan çok sayıda merkez bulunmaktadır. Bu uygulamaları ülkemizde de geliştirmek kaçınılmaz bir gerekliliktir96,100.
2.3.7. 3. Medikal Tedavi
Kordoma tedavisinde antrasiklin, cisplatin, camptothecin analogları ve alkalin maddeler denenmiş ve bu klasik kemoterapötiklerin tedavide belirgin bir etkilerinin olmadığı gösterilmiştir 18. Kordoma onkogenezinin daha detaylı anlaşılması ile ortaya çıkan moleküler hedefler yeni potansiyel efektif tedaviler konusunda bir heyecan yaratmıştır. Rasyonel tedaviye rehberlik edecek belirgin bir terapötik hedef olmadığı için kordomalar daha çok sarkomalar için geliştirilmiş kemoterapi rejimleri ile tedavi edilmektedir ve bunların çoğunda da cevap alınmadığı veya çok az terapötik cevap alındığı bildirilmiştir. Vinblastin, actinomycin-d, siklofosfamid, metoteroksat, klorambusil kordoma tedavisinde denenmiş ve sonuçların kötü olduğu bildirilmiştir 18.
Kordoma konusunda yapılan moleküler biyolojik çalışmalar bu tümörlerin PDGFR alt tiplerini ve KIT reseptörlerini eksprese ettiklerini göstermiştir. Bu değişiklikler hedefli tedavilerin de kullanılabilmesi konusunda bir kapı açmıştır. Kısıtlı sayıda olgu raporunda kordomalarda İmatinib ve Sunitinib isimli tirozin kinaz ihibitörlerinin kullanımını ve bu ilaçlara
38 parsiyel cevapların olduğu bildirilmiştir ancak prospektif, randomize kontrollü çalışmalara dayandırılan bir hedefli ilaç endikasyonu yoktur 18.
2.4. ENDOSKOPİK CERRAHİ
İlk endoskop, 1773-1809 yılları arasında İtalyan asıllı Alman fizikçi Philip Bozzini tarafından keşfedilmiştir. Tüp içine yerleştirilmiş bir mum ışığı, yansıtıcı ayna ve oküler sisteminden oluşan bu ilk endoskop, 1806 da Viyana Tıp Akademisinde sunulmuştur. 1948 de Harold Hopkins’in zoom lens sistemini keşfetmesi, ardından gastroenterolog Basil Hirschowitz'in camla kaplı fleksibl aydınlatma kablosunu (fiberoptik kablo sistemi) geliştirmesiyle optik sistemde çığır açılmıstır. Karl Storz (1911-1996) un görüntü aktarımını ve soğuk ışık kaynağını geliştirmesiyle bugünkü anlamda modern endoskoplarin klinik kullanımı gerçekleşmiştir.
'Endoskopi' deyimi de ilk kez Fransız ürolog Antonin Jean Desormeaux (1815-1894) tarafından kullanılmıştır. 19.yüzyıl sonuna kadar endoskopun kullanımı ve gelişimi daha çok mesane, rektum ve farinks inspeksiyonuna dayanmıştır.
Endoskopi yunanca bir kelime olup “Endo” iç, “Skopein” görmek anlamındadır ve tam olarak rijit veya fleksibl tüplere ekli küçük kameralar vasıtası ile vücudun içerisine bakabilmektir 83. Medikal olarak tanılama, görüntüleme ve izlem, birçok hastalıkta cerrahi tedaviye yardımcı olmak amacıyla geniş bir kullanım alanına sahip olan Desormeaux’un icadı birçok gelişme ve yeniliğin de öncüsü olmuştur84,88. Bu dönemi Bevan’ın özefagoskopi, Pantaleoni’nin histeroskopi icatları izlemiştir. 1874’de Stein’ın “Photoendoscope” adını verdiği buluşuyla mesane patolojilerinin görüntülerini kayıt edebilmiştir 85,86. Açık tüp sistemi, içine bir teleskop sisteminin yerleştirilmesi ile devrim niteliğinde değişime uğramıştır. Alman ürolog Maximilian Carl-Friedrich Nitze 1877’de sistoskopu icat etmiştir.
39 1880’de Jan Mikulicz-Radecki Nitze’nin sistoskopuna benzer bir sistemle ilk gastroskopu yapmıştır83. 1879’da Edison’un filament ampulü keşfinden sonra Johann Mikulicz bu teknolojiyi ilk olarak kullanarak 1881’de gastroskopiye uygulamıştır. Mikulicz endoskopik olarak mide kanserini tarif etmiş ve müdahaleye imkân sağlayan ilk endoskopik prosedürü icat etmiştir 85. Ayrı bir müdahale kanalının da eklenmesi ile günümüzdeki modern endoskopi ve endoskopik cerrahi uygulamaları oluşmaya başlamıştır. Mikulicz’den sonra 1930 yılına kadar Lamm’ın fiberoptiği endoskopiye adapte etme düşüncesine kadar geçen 70 yılda anlamlı bir gelişme olmamıştır. Bu düşünce ile modern endoskopi çağının ilk adımları atılmaya başlamıştır83,88.
Henrich Lamm’ın fiberoptiği endoskopiye adapte etme düşüncesinden 25 yıl sonra İngiltere’den Harold Hopkins bir rod-lens sistemi geliştirmiş ve daha net daha keskin bir görüntü elde etmiştir. 1960’larda fiberoptik ışık kaynağının ve rod-lens sisteminin gelişimi ile modern endoskopi çağı başlamıştır. Basil Hirschowitz bu teknolojiyi klinik uygulamaya koyan ilk kişidir83,84. İlk fiberoskop Ekim 1960’da American Cystoscope Makers Şirketi tarafından yapılmıştır. Üst gastrointestinal sistem için fleksible fiberoskopların gelişimi kolonun endoskopik olarak incelenmesinin önünü açmıştır. 1963’de aynı firma tarafından ilk fleksible fiberoptik kolonoskop yapılmıştır86,87. 1973 Richter, Littman ve Levowitz tarafından ilk kez peroperatuar endoskopi, lezyonun bulunması için tarif edilmiş ve böylelikle endoskopi tanıya yardımcı araç olarak kullanılmıştır84. 1969 da Texas Medical Branch üniversitesinden cerrah Youmans ve ark. endoskopik olarak gastrik kanamayı durdurmasıyla başlayan endoskopinin terapötik araç olarak kullanımı, 1984’te Tada ve ekibi mide kanserinde ‘‘strip-off’’ soyma biopsisini, 1990’larin başında ise Japon endoskopistler erken evre özefogus kanserinde ilk endoskopik mukozal rezeksiyonu gelişmeye devam etmiştir. Endoskopi doktorların ilk çağlarda tüple ile hastaların beslenme ve lavman için kullanılmasından bu yana hastaların
40 vücudunu keşfetmek için ve şu an ise bu aletler ile tedavi etikleri birer araç halini almıştır. Endoskopi kulak-burun-boğaz hastalıklarından jinekolojiye, nöroşirürjiden ürolojiye; insan bedeninin tepesinden topuğuna kadar her ilgi alanına dağılmış sayısız işlem aracılığı ile cerrahlar arasında ortak bir anlayış, ortak bir dil oluşmasında anlamlı ve yok sayılamaz bir katalizör işlevi de görmektedir 88.
2.4.1. ENDOSKOPİK SİSTEMLERDE KULLANILAN TEMEL CİHAZLAR 1. Kamera ve Monitörler, CCD Kameraları
(Charge Coupled Device) Tüplü kameraların yerini almışlardır. Avantajları, yüksek ışık duyarlılıkları, düşük ağırlıkta olmaları ve gelişmiş elektronik stabiliteleridir. Kameraya gelen ışınlar filtre ile renklere ayrılır. Her renk için ayrı bir sinyal çıkışı vardır. Monochip kameraların çözünürlükleri 400 satır civarındadır. Monochip kameralardan daha güçlü olarak 3-chip kameralar mevcuttur.
2. Video Kayıt Sistemi
Araştırmalar ve eğitim için gereklidir. Operasyon görüntüsünün kaydedilmesini sağlar.
3. High Definition(HD) Video ve Televizyon Sistemleri
Elektrik sinyalinin görüntüye dönüştürülmesi için gereklidir.
4. Işık Kaynağı
Endoskop veya laparoskopun ucunda yer alan ampullerle aydınlatma, ısı travmasına neden olduğundan bugün fiber optik cam liflerinin kullanılması ile soğuk ışık kavramı doğmuştur.
5. Teleskop-Optik-Endoskop
Teleskop-optik-endoskop, endoskopi işleminin temel parçasıdır. Dışarıda kalan okülerinden gözle bakılarak ya da bir endokamera ile görüntü ekrana yansıtılarak kullanılır. Genel olarak 5-10 mm çapında ve farklı açılara sahiptir. Kullanıldığı alana göre değişik isimler alır.
41
6. Insuflatör Cihazı
Kavite içerisinde çalışılırken boşluğu gaz ile doldurmak için kullanılmaktadır.
7. Irigasyon/Aspirasyon Cihazı
Irigasyon/aspirasyon cihazı kadın–doğum, üroloji vb. alanlarda, vücutta boşluk oluşturmak veya saf yıkama amacıyla kullanılır. İzotonik su, salin solüsyon (iletken) ya da yalıtkan sıvı kullanılabilir.
8. Tıraşlama, Koter, Lazer Cihazları
Tıraşlama, koter, lazer cihazları ihtiyaca göre sıyırma, kesme, yakma işlemlerinin endoskopi yoluyla yapılması gerektiğinde sisteme dâhil olan cihazlardır.
9. Enstrumanlar(Cerrahi Aletleri)
Endoskopi işlemi sırasında kesme, dikme, tutma, açma gibi işlemleri yapan malzemelerden oluşur.
10. Needloscop
1.7 mm, 2 mm ve 3 mm çapında teleskoplar olup micro-invasive cerrahide sadece gözlem amacıyla kullanılır88 .
42
43
2.4.2. NÖROŞİRÜRJİDE ENDOSKOPİ
Nörosirürjide endoskopun gelişimi 20. yüzyılın başlarından itibaren tıbbın değişik alanlarındaki endoskop kullanımıyla birlikte gitmiştir. Paranasal endoskopik cerrahinin uygulayıcısı olarak bilinen Hirschmann, 1901 de maksiller sinus inspeksiyonunda sistoskopu kullanarak bir çığır açmıştır. 1910 yilinda modifiye sistoskopla endoskopik torakoskopi ve laparoskopi, ilk kez gerçekleştirilmiştir.
İlk kez 1910 yılında L'Espinasse'in hidrosefalide koroid pleksus koterizasyonu için endoskop kullanmasından itibaren modern nöroşirurjide tanı ve tedavi amaçlı çeşitli nöroendoskopi metotları geliştirilmiştir 88,91. Nöroşirurjide, mikroskopun yansıra kraniotomi sahasında, subaraknoid boşluk veya kistik yapılarda endoskopun da kullanılması ile uygulanan endoskop yardımlı cerrahi ise ilk kez 1977 de Appuzo tarafından tanımlanmıştır 89. Bu yöntemin geliştirilmesi ile ana çalışma alanı ventriküler sistem olan nöroendoskopi, mikrocerrahide yardımcı araç olarak kullanılmaya başlanmıştır. Günümüzde bu yöntem, giderek taraftar bulan “minimal invazif nöroşirürji” prensibinin değerli bir parçası olmayı başarmıştır88. Pernecsky, endoskop kullanılarak yapılan operasyonları tanımlamak için terminolojide bir sınıflama geliştirmiştir 90,91. Buna göre;
-Endoskopik Nörosirürji: Endoskop içinden çalışarak yapılan manipülasyonları,
-Endoskop Yardimli Mikronörosirürji: Mikrosirürji ve endoskopik nöroşirurjinin bağımsız olarak uygulandığı manipülasyonlar,
-Endoskop kontrollu Mikronörosirürji: Mikroskop kullanılmadan endoskopik kontrol altında yapılan mikrosirürji,
-Endoskopik Gözlem: Endoskopun sadece gözlem amaçlı kullanılması olarak tanımlanmıştır.
44 Mikroskop ve endoskopun kombinasyonu, daha az invaziv ve daha etkili mikrocerrahi uygulamalara olanak sağlamıştır.
2.4.2.i. Avantajları
Endoskopun en önemli avantaji patolojiye direkt yaklaşan ışık kaynağıyla sağlanan aktif aydınlatma ve fiberoptik - lens sistemi ve geliştirilmiş, oldukça duyarlı görüntü algılayıcı özellikleri olan geniş ve açılı görüş alanıdır. Bu sayede özellikle transsfenoidal cerrahi koridorda en önemli yol gösterici anatomik yapılar olan;
Karotid kabariklik Optik kabariklik
Optikokarotid bileske net olarak görüntülenebilmektedir91.
Bu sekilde hem orta hat yapılarından uzaklaşılmamakta, hem sella tabanı tümüyle açılabilmekte, hem de mikroskopik cerrahide orta hattı sağlamak için kullanılan C kollu Horoskopinin radyoaktif yükünden uzak kalınmaktadır. Ayrıca tümör dekompresyonu sırasında ve sonrasında intrasellar açılı endoskopun kullanımı ile kalıntı tümör dokuları görülerek temizlenebilmektedir. Perop. BOS sızıntıs olduğunda da, sızıntı yeri endoskopla görülerek daha güvenli bir tıkama yapılabilmektedir. Genel olarak normal anatomik açıklıklar kullanıldığından reoperasyonlar da endoskopik girişimde son derece kolaylıkla yapılabilmektedir.
Endoskopik transsfenoidal girişimde nasal septum ve mukozanın korunması ile; Nasal tampona bagli olarak %35 oraninda görülen yüz ve basağrısı Atrofik rinit