T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
KURAĞA TEPKĠLERĠ FARKLI ÇEREZLĠK KABAK GENOTĠPLERĠNĠN TOLERANS MEKANĠZMALARININ BELĠRLENMESĠ Canan ÜSTÜN YÜKSEK LĠSANS TOPRAK BĠLĠMĠ ve BĠTKĠ BESLEME Anabilim Dalını Aralık-2019 KONYA Her Hakkı Saklıdır
iv
ÖZET
YÜKSEK LĠSANS
KURAĞA TEPKĠLERĠ FARKLI ÇEREZLĠK KABAK GENOTĠPLERĠNĠN TOLERANS MEKANĠZMALARININ BELĠRLENMESĠ
Canan ÜSTÜN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Toprak Bilimi ve Bitki Besleme Anabilim Dalı
DanıĢman: Doç. Dr. Mehmet HAMURCU
2019, 41 Sayfa Jüri
Doç. Dr. Mehmet HAMURCU Prof. Dr. Erdoğan EĢref HAKKI Doç. Dr. Ceyda ÖZFĠDAN KONAKÇI
Kabak genotiplerinin kuraklık stresi toleranslarının araĢtırıldığı çalıĢmada, ozmotik stres oluĢturmak amacıyla Hoagland besin solüsyonu içinde %6 PEG 6000 uygulanmıĢtır. Kabak genotiplerinde temel büyüme parametreleri, prolin birikimi, iyon sızıntısı, MDA miktarı, H2O2 birikimi,
OH süpürme aktivitesi, SOD, CAT, POX ve GR antioksidan enzimler ve gövde K, Ca, Mg ve Na konsatrasyonları incelenmiĢtir.
PEG 6000-teĢvikli kuraklık stresine bağlı olarak kabak genotiplerinde yaĢ ve kuru ağırlık ile gövde boyunun azaldığı ve bu azalmaların kuraklığa duyarlı C-27 genotipinde, kuraklığa toleranslı C-26 genotipinden daha yüksek oranda olduğu belirlenmiĢtir. Prolin birikimi en fazla kuraklığa toleranslı olan C-26'da meydana geldiği belirlenmiĢtir. MDA içeriğinin kabak genotiplerinde artıĢ gösterdiği ve en fazla artıĢın C-27 genotipinde olduğu belirlenmiĢtir. Kuraklık stresine bağlı olarak elektrolit sızıntısının arttığı ve bu artıĢların kuraklık toleransı düĢük C-27 genotipinde daha yüksek oranlarda olduğu tespit edilmiĢtir. Kuraklık stresi altında kabak genotiplerinin H2O2 düzeyinin ve OH radikalini süpürme aktivitelerinin
arttığı belirlenmiĢtir. Antioksidan enzim aktivitelerinin her iki genotipte de PEG 6000-teĢvikli kuraklık stresine bağlı olarak farklılıklar gösterdiği, C-26 genotipinde SOD ve CAT enzimleri kuraklık stresi altında yüksek aktivite sergilerken, C-27 genotipinin ozmotik stres altında POX ve GR aktivitelerinin arttığı, SOD ve CAT aktivitelerinin ise azaldığı tespit edilmiĢtir. Kuraklık stresi altında kabak genotiplerinin Ca ve K içeriklerinin ise azaldığı belirlenmiĢtir.
v
ABSTRACT
MS THESIS
DETERMINATION OF THE TOLERANCE MECHANISMS OF DROUGHT REACTIONS IN DIFFERENT CONFECTIONARY PUMPKIN GENOTYPES
Canan ÜSTÜN
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE
IN DEPARTMENT OF SOIL SCIENCE AND PLANT NUTRITION
Advisor: Assoc.Prof.Dr. Mehmet HAMURCU
2019, 41 Pages
Jury
Assoc.Prof.Dr. Mehmet HAMURCU Prof. Dr. Erdoğan EĢref HAKKI Assoc.Prof.Dr. Ceyda ÖZFĠDAN KONAKÇI
In this study, in order to determine drought stress tolerance of Pumpkin genotypes, 6% PEG 6000 was applied in Hoagland's solution to develop osmotic stress. Different parameters including antioxidant enzymes like SOD, CAT, POX, GR, and shoot Ca, K, Mg and Na concentrations of pumpkin genotypes were measured.
Depending on drought strem induced by PEG-6000 in pumpkin , fresh weight, dry weight and shoot length were decreased and these decrements were much higher in C-27 genotypes as compared to C-26 genotype. That presented higher proline accumulation C-26 genotype. MDA content showed an increase that was maximum in C-27 genotype. Similarly, electrolyte leakage increased with drought stress and it was higher in susceptible C-27 genotype. H2O2 levels and OH radicals activity were increased
under drought stress. However, antioxidant enzyme activities were different in both the genotypes in accordance with the stress tolerance. SOD and CAT enzyme activities and a decrease in SOD and CAT activities under osmotic stress condition. Were determined where Ca and K contents were also decreased.
vi
ÖNSÖZ
Tezimin hazırlanması sırasında bana sabırla yol gösteren, her türlü konuda benden bilgi ve deneyimlerini esirgemeyen danıĢmanım sayın Doç. Dr. Mehmet HAMURCU hocama, bana her konuda yardımcı olan Zuhal Zeynep AVġAROĞLU, Ġsmail KAYA, A.Hümeyra OMAY’a, çalıĢma esnasında yardımlarını esirgemeyen tüm Toprak Bilimi ve Bitki Besleme Bölümü hocalarıma, tez çalıĢmamı desteklediği için TÜBĠTAK 1160704 nolu projeye, ayrıca tezimin hazırlanması sırasında destekleriyle beni motive eden dualarını ve güzel dileklerini benden esirgemeyen ve her zaman bana destek olan babam Ali ÜSTÜN, annem Oya ÜSTÜN, kardeĢlerim Neslihan, Betül, Mehmet ÜSTÜN’e ve Hidayet Öz’e sonsuz teĢekkürlerimi sunarım.
Canan ÜSTÜN KONYA-2019
vii ĠÇĠNDEKĠLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi ĠÇĠNDEKĠLER ... vii 1. GĠRĠġ ... 1 2. KAYNAK ARAġTIRMASI ... 4 3. MATERYAL VE YÖNTEM ... 13 3.1 Materyal ... 13
3.1.1 Bitki Materyallerinin Temini ... 13
3.2.1 Deneme Serilerinin Hazırlanması ... 13
3.2.2 Ön Denemeler ... 14
3.2.3 Deneme Serilerinin Hazırlanması ... 14
3.2.4 Tohum Ekimi ... 15
3.2.5 Analiz Yöntemleri ... 16
3.2.6 Biyokimyasal Parametrelerin Ölçümü ... 17
3.2.7 Prolin Analizi ... 19
3.2.8 Lipit Peroksidasyonunun Belirlenmesi ... 19
3.2.9 Hücre Zarı Geçirgenliği (Elektrolit sızıntısı) ... 19
3.2.10 Hidroksil radikali (·OH-) süpürülme aktivitesinin belirlenmesi ... 20
3.2.11 Hidrojen Peroksit (H2O2) Ġçeriğinin Ölçülmesi ... 20
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 21
4.1 Büyüme Parametreleri Bulguları ... 21
4.1.1 Gövde ve Kök YaĢ Ağırlığı ... 21
4.1.2 Gövde ve kök kuru ağırlığı ... 22
4.1.3 Gövde ve Kök Boyu ... 23 4.2 K, Mg ve Ca Konsantrasyonu Bulguları ... 25 4.2.1 Gövde ve kök K Konsantrasyonu ... 25 4.2.2 Gövde ve kök Mg Konsantrasyonu ... 25 4.2.3. Gövde ve kök Ca konsantrasyonu ... 26 4.3 Prolin Bulguları ... 27
4.4 Lipid Peroksidasyonu Bulguları ... 27
viii
4.6 Antioksidan Enzim Aktivite Sonuçları ... 29
4.6.1 Süperoksit Dismutaz Enzim Aktiviteleri (SOD; EC 1.15.1.1) ... 29
4.6.2 Peroksidaz Enzim Aktiviteleri (POX; EC 1.11.1.7) ... 30
4.6.3 Katalaz enzim aktiviteleri (CAT; EC 1.11.1.6) ... 31
4.6.4 Glutatyon Redüktaz Enzim Aktiviteleri (GR; EC 1.6.4.2) ... 31
4.7 Hidroksil Radikali (·OH-) Süpürülme Aktivitesi ... 32
4.8 Hidrojen Peroksit (H2O2) Ġçeriği ... 33
5. SONUÇLAR VE ÖNERĠLER ... 34
KAYNAKLAR ... 37
ix
TABLO LĠSTESĠ
Tablo 4. 1. C-26 ve C-27 kabak genotiplerinin gövde ve kök yaĢ ağırlık değerleri (g bitki-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 20
Tablo 4. 2. C-26 ve C-27 kabak genotiplerinin gövde ve kök kuru ağırlık değerleri (g bitki-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 21
Tablo 4. 3. C-26 ve C-27 kabak genotiplerinin gövde ve kök boyu değerleri (cm). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 22
Tablo 4. 4. C-26 ve C-27 kabak genotiplerinin gövde ve kök K değerleri (mg g-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 24
Tablo 4. 5. C-26 ve C-27 kabak genotiplerinin gövde ve kök Mg değerleri (mg g-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 25
Tablo 4. 6. C-26 ve C-27 kabak genotiplerinin gövde ve kök Ca değerleri (mg g-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 26
Tablo 4. 7. C-26 ve C-27 kabak genotiplerinin gövde prolin (nmol g-1 YA). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. ... 26
Tablo 4.8. C-26 ve C-27 kabak genotiplerinin gövde lipid peroksidasyon düzeyleri (nmol g-1 YA). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 27
Tablo 4.9. C-26 ve C-27 kabak genotiplerinin elektrolit sızıntısı değerleri (%). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. ... 27
x
Tablo 4. 10. C-26 ve C-27 kabak genotiplerinin gövde SOD aktiviteleri (Ünite mg protein). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. ... 28
Tablo 4. 11. C-26 ve C-27 kabak genotiplerinin gövde POX aktiviteleri (Ünite mg-1 protein). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 29
Tablo 4. 12. C-26 ve C-27 kabak genotiplerinin gövde CAT aktiviteleri (Ünite mg-1 protein). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. ... 29
Tablo 4. 13. C-26 ve C-27 kabak genotiplerinin gövde GR aktiviteleri (Ünite mg-1 protein). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. ………... 30
Tablo 4. 14. C-26 ve C-27 kabak genotiplerinin gövde ·OH- süpürme aktivitesi (%). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. ... 31
Tablo 4. 15. C-26 ve C-27 kabak genotiplerinin gövde · H2O2 birikimi değerleri (µg ml-1). Kontrol ve
kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir... 31
xi
RESĠM LĠSTESĠ
Resim 2. 1.Bitkilerde Stresle Ġndüklenen Fazlar (Lichtenhaler, 1998) ... 6 Resim 3. 1. Ġklim odası ve kontrollü koĢullarında yetiĢtirilen kabak genotiplerine ait resimler ... 12
Resim 3. 2. AraĢtırmada kullanılan kabak genotiplerine ait ön deneme resimleri. ... 13
Resim 3. 3. AraĢtırmada kullanılan kabak genotiplerine ait çimlendirme resimleri ... 14
Resim 3. 4. Kontrollü Ģartlarda yetiĢtirilen kabak genotiplerine ait resimler ... 15
Resim 4. 1. C-26 ve C-27 kabak genotiplerinin kontrol ve kurak koĢullarda bitkilerin tepkilerini gösteren resimler ...……….….. 23
1. GĠRĠġ
Kuraklık, tarımsal üretimi etkileyen en önemli çevresel faktörlerden biri olarak karĢımıza çıkmaktadır (Boyer, 1982; KuĢvuran ve ark., 2008). Dünya üzerindeki kullanılabilir alanlar stres faktörlerine göre sınıflandırıldığında doğal bir stres faktörü olan kuraklık stresi %26’lık payıyla en büyük dilimi oluĢturmaktadır. Bu durumda, kuraklık stresi büyümeyi ve verimi etkileyen en yaygın çevresel streslerden biri durumundadır. Yapılan son araĢtırmalara göre, küresel ısınmanın potansiyel etkileri açısından risk grubu ülkeler arasında bulunan Türkiye dahil Güney Avrupa’yı içine alan bölgenin 2030 yılında oldukça kuru ve sıcak bir iklimin etkisine gireceği bildirilmektedir. Dünyadaki doğal kaynakların nüfusu besleme kapasitelerinin azalmasına ve bunun sonucunda milyonlarca insanın açlıktan ölmesine neden olabileceği göz önüne alındığında, kuraklık, dünya üzerindeki tüm canlı yaĢamı için tehlike oluĢturmaktadır. Bu nedenle kuraklık stresine dayanıklı bitki türlerinin belirlenmesi, tolerans mekanizmalarının anlaĢılması, bitkilerin kuraklığa dayanıklılığını arttıran veya etkileyen unsurların belirlenmesi özellikle insanların neden olduğu küresel ısınma sonucunda etkisini giderek arttıran kuraklığın ileride tüm canlılar için büyük bir sorun haline gelmesini önlemede önemli rol oynayacaktır.
Kültür bitkilerinin kuraklık ve tuzluluk gibi abiyotik stres koĢullarına karĢı farklı seviyelerde dayanıklılık gösteren genotiplere sahip oldukları bilinmektedir. Bitkisel üretim aĢamasında tercih edilen genotiplerin de abiyotik stres koĢullarına karĢı tolerans seviyelerinin yetersiz olması bitkilerde birçok metabolik olayı olumsuz yönde etkilemekte ve ürün kalitesi ile verim kayıplarına sebep olmaktadır. Kabak genellikle meyvesi için üretilmesine rağmen tohumlar, çerezlik, yüksek kaliteli yemeklik yağ ve gıda üretim materyali olarak kullanılmaktadır (Paris, 2001). Son dönemlerde Türkiye’de çerezlik kabak tarımı yaygınlaĢma eğilimindedir. Çerezlik kabakta depolama ve pazarlama probleminin yaĢanmaması, alternatif ürünlerle mukayese edildiğinde karlılığın yeterli olması, sulanabilir alanların yanında sulama koĢullarının kısıtlı olduğu alanlarda da tarımının mümkün olabilmesi vb. nedenler yaygınlaĢma sebepleri arasındadır. Türkiye’de yetiĢtirilen çekirdek kabakları çoğunlukla Cucurbita pepo L., az miktarda da Cucurbita moschata L. türlerine aittir.
Türkiye baĢta olmak üzere Lübnan, Yunanistan ve Ġran gibi ülkelerde kuruyemiĢ tüketme alıĢkanlığı yaygındır. KuruyemiĢ olarak isimlendirilen baĢlıca türler ay
çekirdeği, fındık, antep fıstığı, badem, kuru kayısı, üzüm, incir akla gelmekte ise de kabak çekirdeği de kuruyemiĢ olarak tüketilen önemli bir üründür.
Son yıllarda sağlıklı beslenmede kuruyemiĢ tüketiminin önemi konu uzmanları tarafından önemle bahsedilmektedir. Bu bağlamda gün geçtikçe kuruyemiĢin hem iç tüketimde hem de ihracattaki payının artacağı öngörülmektedir. Yakın geçmiĢe kadar çekirdek kabağı, NevĢehir baĢta olmak üzere ülkemizin bazı bölgelerinde geleneksel üretim yöntemleri ile üretilen bir üründü ancak yukarıda bahsedilen gerekçeler ve çerezlik kabağın üretim koĢullarının kolaylığı, üretim maliyetlerinin alternatif ürünlere göre düĢüklüğü ve en önemlisi de karlılığının diğer ürünlere göre tatminkar olmasından dolayı üretimi gün geçtikçe artmaktadır. Önceki yıllarda Çerezlik kabak ile ilgili üretim değerleri istatistikleri verilmezken 2004 yılından itibaren tarım istatistiklerinde yer verilmeye baĢlanmıĢtır (Anonim, 2019). Ülkemizde 2004 yılında çerezlik kabak üretimi yapan il sayısı 16 iken 2018 verilerine göre bu sayı 27’ye çıkmıĢtır. Ġstatistiklerde yer verilen çerezlik kabak yetiĢtiriciliğinin her yıl üretim alanı ve miktarının arttığı, 2018 yılı verilerine göre 55 ton üretim yapıldığı görülmektedir (Anonim, 2018).
Dünyamızda su kaynaklarının yaklaĢık %70’i tarım amaçlı kullanılmaktadır. Dünyamızda sulu tarım, kuru tarıma oranla 2,8 kat daha fazladır. Bu durum gelecekte tarım alanlarımızda daha fazla su kullanımı ihtimalini gözler önüne sermektedir. Kuraklık birçok araĢtırmacı tarafından değiĢik Ģekillerde yorumlansa da genel olarak; meterolojik bir faktör olup bitki morfolojisinde gözle görülür derecede eksikliklerin meydana geldiği yağıĢsız dönemdir. Bu dönemin doğal bir sonucu olarak, toprağın su zerreciklerini tutma kuvveti artmakta ve bitkiler tarafından gerçekleĢtirilen evapotransprasyon hızında azalma meydana gelmektedir (Jones, 1992).
Türkiye’de genel olarak bir artıĢ eğiliminde olan çerezlik kabak tarımında en önemli problem farklı üretim alanlarında adaptasyon problemi yaĢamayan üretici ve tüketici taleplerine cevap verebilen çeĢitlere duyulan gereksinimdir. Yukarıda da değinildiği gibi kıraç ve/veya kısıtlı sulama olanaklarının olduğu alanlarda yetiĢtiriciliği yapılabilecek ürünlerden birisi de çerezlik kabaktır. Bu yüzdendir ki kıraç veya sulama olanaklarının kısıtlı olduğu alanlara uygun çeĢitlerin geliĢtirilmesi bir zorunluluktur. Tezimin amacı; kuraklığa karĢı farklı tepkilere sahip olduğu bilinen kabak genotiplerinin kuraklık koĢullarına maruz bırakıldıkları ortamda bitkinin geliĢtirdiği savunma mekanizması üzerine muhtemel iyileĢtirici etkileri farklı büyüme evrelerinde yapılan örneklemelerle ele alınarak temel büyüme parametreleri, gövde K, Ca ve Mg analizleri, iyon sızıntısı ve malondialdehit miktarındaki değiĢiklikler yardımıyla
hücresel membranlardaki hasar oranının belirlenmesidir. Ayrıca, süperoksit dismutaz (SOD), katalaz (CAT), peroksidaz (POX), ve glutatyon redüktaz (GR) gibi antioksidan enzim aktiviteleri ve hidrojen peroksit (H2O2) birikimi ile hidroksil (·OH
-) radikalleri belirlenmek suretiyle bitki gruplarının tepkileri ortaya konulmaya çalıĢılmıĢtır.
2. KAYNAK ARAġTIRMASI
Cucurbita pepo bitkiler aleminde meyve özellikleri bakımından çok geniĢ
varyasyona sahip olan bir türdür. En az 10.000 yıldır Kuzey Amerika kıtasında yetiĢtiriciliği yapılmaktadır. YaklaĢık 500 yıldır da Avrupa’da yetiĢtirilmektedir. Günümüzde yazlık kabaklar çok önemli sebze türleri arasında yer almakta, tropik ve subtropik bölgelerde yetiĢtirilmektedir (Paris, 1996).
Kabaklar yazlık, kıĢlık ve süs kabakları olmak üzere üç grupta incelenmektedir. Yazlık kabaklar arasında yer alan, sakız kabağı veya zucchini tipindeki ince ve uzun kabakların yanısıra, C. pepo L. botanik sınıfı içinde yer alan bir baĢka yazlık kabak grubunu da çerezlik veya çekirdek kabakları oluĢturmaktadır. Çerezlik olarak tüketilen ürünler içerisinde büyük yeri olan kabak çekirdeği, çiftçiler için iyi gelir getiren önemli bir üründür (Yanmaz, 1995).
Çerezlik kabağı bu kadar avantajlı kılan sebepler ise; ürünün pazarda genel olarak artan bir talebe sahip olması, ekim nöbeti için uygun bir tür olabilmesi, hasat kolaylığı, kültürel iĢlemlerin büyük oranda makine ile yapılabilmesi, hastalık ve zararlılar açısından fazla sıkıntıya yol açmaması gibi nedenler sıralanabilir. YetiĢtiriciliği yapılan alanlar ve yayıldığı yöreler düĢünülürse sulamanın sık yapılmasına gerek olmaması veya tamamen kıraç koĢullarda da çerezlik kabak tarımının yapılabilmesi ayrıca önemlidir. (Sakin, 1985; Yanmaz ve Düzeltir, 2003).
Ülkemizde yetiĢtirilmekte olan çerezlik kabaklar, çoğunlukla C. pepo L. türüne dahildir. Az miktarda da C. moschata türüne giren bal kabağı tohumları kullanılmaktadır. Ülkemizin değiĢik yörelerinde, değiĢik tipte kabak çekirdeklerine talep bulunmaktadır. Örneğin; Ġç Anadolu Bölgesi’nde kabak çekirdeği olarak iri ve uzun tip tohumlar tercih edilirken, Edirne ve Sakarya yörelerinde yuvarlak ve dolgun tip tohumlar, Ege Bölgesi’nde ise çoğunlukla yuvarlakça olan bal kabağı çekirdekleri tercih edilmektedir (Yanmaz ve Düzeltir, 2003).
Kabak çekirdeği, kuruyemiĢ olarak tüketiminin yanı sıra, sahip olduğu yağ, protein, mineral maddeler ve amino asitler yönünden zengin olup, insan sağlığı açısından ayrı bir öneme sahiptir. Kabağın hazmı kolay olup, mide rahatsızlığı olanlara önerilmektedir. Böbrek taĢı ve kum düĢürmede, lapa halinde kulak ağrısını gidermekte kullanılmaktadır. Halk arasında bağırsak parazitini gidermede etkili olduğu bilinen özellikle kabuksuz kabak tohumlarının %35-40 oranında yağ (Abak ve ark., 1997), karbonhidrat oranı ortalama %37 (Younis ve ark., 2000), protein içeriği %35-40
aralığında, ayrıca Ca, K, P, Mg, Fe ve Zn yönünden de zengin olduğu bilinmektedir (Lazos, 1986). Kabak tohumlan B vitamini yönünden zengin kabul edilmekte, ayrıca da tiamin ve niasin içermektedir (Mansour ve ark., 1993) . Zengin bir yağ kaynağı olması nedeniyle, kabak tohumlarından elde edilen yağ, gıda endüstrisinin yanında ilaç ve kozmetik endüstrisinde de kullanım alanı bulmaktadır (Düzeltir ve Yanmaz, 2004).
Cucurbitaceae türlerinin tohumlarının besleyici değerini araĢtırmak üzere
Kamerun da değiĢik iklim özelliklerine sahip alanlarda yapılan çalıĢmalarda; tohumların besin değerlerinin iklim farklılıklarından etkilenmediği belirlemiĢlerdir. Cucurbitaceaea tohumlarının %28-40 arasında protein içerdiği, diğer yağlı tohumlar gibi yüksek oranda lipid seviyesine sahip olduğu bundan dolayı protein ve yağ kaynağı olarak kullanılabileceği tespit edilmiĢtir (Achu ve ark., 2005).
Bir çevrede devamlı olarak ya da zaman zaman meydana gelen çok sayıdaki olumsuz, fakat hemen öldürücü olmayan koĢullar stres olarak bilinir. Bir baĢka yaklaĢımla; bitkilerde metabolizmayı, büyüme ve geliĢmeyi olumsuz etkileyen veya engelleyen, uygun olmayan herhangi bir durum veya madde stres olarak kabul edilir (Mahajan ve Tuteja, 2005).
Stresle karĢılaĢan bitkilerde normal yaĢamsal etkinlikler için gereksinim duyulan yapısal ve fonksiyonel koĢullarda değiĢiklikler meydana gelmekte ve alarm fazı baĢlamaktadır. Stresin devam etmesi durumunda, protein veya koruyucu maddelerin sentezi gibi tamir olaylarının gerçekleĢtiği dayanıklılık fazı oluĢmaktadır. Bu aĢamada, adaptasyon ve tamir olaylarının baĢlaması sağlanarak, olumsuz koĢullara “alıĢma” safhası gerçekleĢtirilmeye çalıĢılmaktadır. Stres döneminin çok uzun sürmesi durumunda, tükenim fazı ortaya çıkmaktadır. Bitkinin dayanıklılık sınırlarının aĢılması halinde bitkide kalıcı zararlar ve hatta ölüm meydana gelebilmektedir. Bitkilerdeki stres mekanizması ġekil 2.1’de verilmiĢtir (Lichtenthaler, 1998).
Resim 2. 2.Bitkilerde Stresle Ġndüklenen Fazlar (Lichtenhaler, 1998)
Stres, abiyotik faktörler ve biyotik faktörler olarak ikiye ayrılmaktadır. Tarımsal alanlarda üretimi sınırlandıran en önemli abiyotik stres faktörü su kısıtı olarak tanımlanan kuraklık stresidir. Dünya tarım alanlarının yaklaĢık olarak % 45’i sürekli olarak kuraklık stresine maruz kalır (Ashraf ve Ali, 2008) .
Ġklimsel değiĢikliklerle ortaya çıkan kuraklık olgusu bitkisel üretimi sınırlandıran faktörler arasındadır. YağıĢsız ya da yarı yağıĢlı bir süreyi ifade eden kuraklık, toprağın su tutma kapasitesi ve topraktaki su içeriğinin, bitkilerin susuzluktan sıkıntı çektiği miktara kadar ve bitkiler tarafından gerçekleĢtirilen evapotransprasyon hızına bağlı olarak meydana gelmektedir (Jones, 1992; Kozlowski ve Pallardy, 1996; Özcan ve ark., 2001)
Su bütün biyokimyasal olayların gerçekleĢmesini düzenleyen özelliğe sahip olduğundan bütün canlılar için en önemli yaĢam kaynağıdır. Kuraklık, bitkilerin en çok karĢılaĢtığı stres faktörlerinden birisidir. Kuraklıkla birlikte bitki için topraktan suyun alınması problem haline gelmekte, sonuç olarak ise bitkiler için su eksikliği oluĢmaktadır. (Handa ve ark., 1986; Wilhite ve ark., 1999).
Kuraklık, tarımsal faaliyetler üzerinde büyük bir etkiye sahiptir. Bitkilerde kuraklıkla meydana gelen stresin yoğunluğu ve süresi kadar bitkilerin farklı fenotip ya da genotipe sahip olmaları da farklı Ģekillerde tepkiler göstermelerine sebep olur. Bitkilerin gösterdikleri bu tepkiler, strese toleransın ortaya çıkmasında öneme sahiptir (GüneĢ, 2004; Reddy ve ark., 2004; Jaleel ve ark., 2007).
Smirnoff (1993), kuraklığı genel olarak su noksanlığı ve kuruma olarak iki tipe ayırmıĢtır. Buna göre; su noksanlığı, stomalarda kapanmaya ve gaz değiĢiminde kısıtlamaya neden olan orta düzeydeki su kaybıdır. Nisbi su kapsamının yaklaĢık % 70’te kaldığı hafif su noksanlığına maruz kalan bitkilerde stomaların kapanmasına bağlı olarak karbondioksit alımı kısıtlanmaktadır. Kuruma, metabolizma ve hücre yapısının tamamen bozulmasına ve sonunda enzimle katalizlenen reaksiyonların durmasına neden olabilecek potansiyele sahip olan aĢırı miktardaki su kaybı olarak tanımlanabilir.
Su stresi bitkilerde büyüme ve verim, bitkinin vejetatif ve generatif organları arasında su rekabeti, hücre içi yapılar, fotosentez ve azot metabolizması üzerine olumsuz etkilerde bulunarak bitki metabolizmasını bozmaktadır (KocaçalıĢkan, 2003).
Kuraklık stresinde bitkiler dokularındaki su kaybını tolere edebilmek ya da su kaybını azaltmak için büyümede azalma, bitki yaĢ ve kuru ağırlığı, yaprak alanı gibi parametrelerde değiĢiklikler gösterirler (Mitra, 2001; Anyia ve Herzog, 2004; Clavel ve ark., 2005; Mnasri ve ark., 2007; Anami ve ark., 2009).
Farklı PEG (Polyethylene glycol) (0, 30 ve 60 g/L) konsantrasyonlarında yetiĢtirilen pamuk bitkisinde artan PEG dozu ile sağlanan kuraklık stresinin bitki geliĢimi üzerindeki etkileri incelenmiĢtir. Bitkiler yaĢ ağırlık bakımından kontrol bitkilerine oranla % 27- 42 oranlarında kayıplar gösterirken, kuru ağırlık bakımdan % 11-20 oranında bir azalma belirlenmiĢtir. Ayrıca nispi büyüme oranı, stomal geçirgenliği ve net fotosentez oranında da kontrol bitkilerine oranla kayıplar ortaya çıkmıĢtır (Fernandez-Conde ve ark., 1998).
Buğdayda 7 gün, bezelyede ise 10 gün süresince % 10 PEG 6000 ile oluĢturulan kuraklık stresinde bitkilerde meydana gelen değiĢimler incelenmiĢtir. Her iki türde de yaĢ ve kuru ağırlıkta kontrol bitkilerine göre kayıplar gözlenirken, yaprak su içeriğinde de azalma meydana gelmiĢtir (Alexieva ve ark., 2001).
Sánchez ve ark. (2004), PEG 6000 kullanarak oluĢturdukları kuraklık stresinde bezelye epikotillerinin geliĢiminde önemli azalmalar olduğunu bildirmiĢler, geliĢim ve ozmotik düzenleme ile turgor düzenlemesi arasında bir korelasyon olduğunu ortaya koymuĢlardır.
Öztürk ve Özkan (1991), soya bitkisi üzerinde su stresinin etkisini araĢtırmıĢtır. Bitki boyunun 8- 10 cm’ye ulaĢtığı dönemi V1 (ilk geliĢme dönemi) olarak isimlendirmiĢlerdir. AraĢtırmacılar soya fasulyesinin, V1 döneminde su stresine maruz bırakıldığında, diğer dönemlerde strese uğratılan bitkilere kıyasla hasat dönemine daha erken girdiğini aynı zamanda bitkilerin cılız kaldığını ve bitki veriminde de % 50’den
fazla kayıplar ortaya çıktığını söylemiĢtir. Bunun yanı sıra bitkilerin boyunda kontrole göre % 36 düzeyinde azalma görülürken, bitkilerin terleme ile kaybettikleri suyun miktarı da, kontrole göre % 51 oranında azalmıĢtır. V1 döneminden itibaren su stresi altında kalmıĢ bitkinin kuru madde üretiminin de yine kontrole göre % 51 oranında azaldığını rapor etmiĢlerdir. AraĢtırmacılar su stresinin kuru madde üretimine etkisinin vejetatif geliĢme dönemlerinde daha Ģiddetli olduğunu V1 döneminden itibaren su stresi uygulanan bitkilerde kuru madde üretiminin azalmasında, muhtemelen bu bitkilerde fotosentez organları olan yaprakların azalması ile ilgili olduğunu belirtmiĢlerdir. Ayrıca su stresinin uygulandığı bitkilerin köklerinin ise, kontrol bitkilere kıyasla daha derinlere ulaĢtığını belirtmiĢtir.
Su stresine karĢı bitkinin hayatta kalmasını sağlayan ve vegetatif dokularda geliĢtirilen kuraklıktan kaçınma ve kurağa tolerans olarak bilinen iki ana savunma mekanizması bulunmaktadır (Levitt, 1980; Laffray ve Louguet, 1990; Cruz de Carvalho ve ark., 1998). Bu iki mekanizmadan bitkiler tarafından en çok kullanılanı kuraklıktan kaçınma mekanizmasıdır (Mitra, 2001).
Kuraklık toleransı, düĢük su potansiyeline sahip bitki dokularının su eksikliğine dayanabilme yeteneği olarak bilinir (Mitra, 2001). Kuraklık toleransı, bitkilerde uzun süreli kuraklığın neden olduğu hasarın etkisini sınırlayan ve metabolik iĢlevlerini devam ettirmelerini sağlayan mekanizmaları kapsamaktadır (Courtois ve ark., 2000).
Toprak ve bitkide ciddi su eksikliği oluĢmadan önce bitkinin hayat döngüsünü tamamlayabilme yeteneği kuraklıktan kaçınma olarak bilinmektedir. Bu mekanizma erken çiçeklenme ve erken olgunlaĢma ve su eksikliğinin derecesine bağlı olarak büyüme periyodunun süresinde değiĢiklik gibi süreçleri içermektedir (Mitra, 2001). Bu süreçler bitki morfolojisine de yansımaktadır. Yaprak alanının küçülmesi, nemli toprak tabakalarına doğru derinlemesine kök geliĢimi ve stomaların kapanması, kuraklığa karĢı savunmanın ilk adımları olarak bitkide görülen değiĢimlerdir. Su eksikliği olan koĢullarda yapraklarda meydana gelen morfolojik değiĢimler, genelde transprasyonla kaybedilen su miktarını azaltmaya, köklerde oluĢan morfolojik değiĢimler ise topraktaki suyu daha yüksek bir kuvvetle absorbe etmeye yöneliktir (Çırak ve Esendal, 2006).
Bitkilerde, kuraklık stresine karĢı yaprak büyümesinin engellendiği ve yeni yaprak oluĢumunun sınırlandırıldığı görülmektedir. Bunun nedeni, yaprak yüzey geniĢliği ne kadar büyük ise, su kaybı buna paralel olarak o kadar çok olacaktır (Mahajan ve Tuteja, 2005). Diğer taraftan, su stresine tepki olarak, bazı bitkilerde yaprak yüzeylerinin sık tüylerle kaplanması Ģeklinde morfolojik değiĢimler görülür. Bu
tüyler, alttaki hücrelerin sıcaklığını 1-2°C düĢürerek, transprasyon ve yaprak üst yüzeyi üzerinde oluĢan mumsu kutikula tabakası, güneĢ ıĢınlarını yansıtarak sıcaklığın etkisini azaltır bunun sonucunda da transprasyon hızı düĢürülür (Göksoy ve Turan, 1991).
Alexieva ve ark. (2001), % 10 PEG 6000 ile oluĢturulan kuraklık stresinin buğday ve bezelyede yaĢ, kuru ağırlıklar ve yaprak su içeriğinde kontrol bitkilerine göre azalmalar meydana getirdiğini belirlemiĢlerdir.
AvĢaroğlu (2016), karpuz genotiplerinde %15 PEG 6000 uygulanarak kuraklık stresi oluĢturmuĢlardır. Kuraklık stresi koĢullarında karpuz genotiplerinde kök, gövde yaĢ ve gövde kuru ağırlık ve gövde boyu değerlerinde azalmalar meydana geldiği bildirilmiĢtir.
PEG ile kuraklık stresi oluĢturarak kuraklığa tolerans mekanizmalarını karĢılaĢtırdıkları çalıĢmada, Phaseolus vulgaris. ve Phaseolus acutifolius türlerinde, kuraklık stresi altında, Yaprak Nisbi Su Ġçeriği (Relative Water Content) ve Stoma geçirgenliğinin (Stomatal Conductance) daha yüksek bulunduğu P. acutifolius türünün kuraklık stresine daha tolerant olduğunu bildirilmektedirler (Türkan ve ark., 2005).
Karpuz genotiplerinde PEG ile oluĢturulan kuraklık stresi çalıĢmasında artan dozlarda bor uygulanmıĢtır. AraĢtırmada kontrole göre MDA, SOD ve CAT enzim aktivitelerinde artıĢ meydana geldiği bildirilmiĢtir (Hamurcu ve ark., 2015).
Szira ve ark. (2008), arpada kuraklık stresinin farklı geliĢme dönemlerinde etkilerini araĢtırdıkları çalıĢmalarında, çimlenme ve ilk geliĢme döneminde kuraklık etkisinin çimlenme yüzdesi, sürgün uzunluğu, kök uzunluğu, toprak altı ve toprak üstü kuru ağırlıklar, oransal nem içeriği ve ozmotik potansiyel üzerine önemli düzeyde olumsuz etkilerde bulunduğunu ve bu durumun geç geliĢme döneminde tane verimi ve bin tane ağırlığını azaltarak devam ettiğini belirlemiĢlerdir. Kurağa toleranslı çeĢitlerde oransal nem içeriği ve tane veriminin daha yüksek olduğunu da vurgulamıĢlardır.
Ribas ve ark. (2001), tarafından Ġspanya’da yaptığı bir çalıĢmada, Piyonet-Piel de Sapo çeĢidi kavunlara, su ihtiyacının % 125, % 100, % 75 ve % 50’sini karĢılayacak Ģekilde su uygulamıĢlardır. Denemede yaprak gözenek dirençleri (stoma iletkenliği) ölçülmüĢtür. Sonuç olarak, değiĢik su uygulamalarının, büyüme mevsimi boyunca farklı gün ve zamanlarda ölçülen gözenek direncinde önemli farklılıklara neden olmadığı, fakat kısıtlı su uygulamalarının yaprak alan indeksi ve meyve verimini önemli düzeyde düĢürdüğü tespit edilmiĢtir.
Quisenberry ve ark. (1981), yaprak kullanımının kuraklık stresinde etkili bir parametre olabileceğini bildirirken, Basal ve ark. (2005), yaprak su kaybının belirlenerek genotip seçiminin yapılabileceğini ifade etmiĢlerdir.
Hoagland besin solüsyonu içinde yetiĢtirilen değiĢik fasulye genotiplerine ait bitkilere PEG 6000 kullanılarak kuraklık stresi meydana getirilen çalıĢmada fasulye genotiplerinin uygulanan kuraklık stresine karĢı gösterdikleri tepkilerin farklı olduğu belirlenmiĢtir. Genotipler arasındaki farklılık, özellikle MDA ile iliĢkili olarak, toplam klorofil, SOD, CAT ve APX enzimleri, oksidatif strese karĢı bitkinin savunma sistemlerinin ürünü olan antioksidant enzimlerin aktivitelerinin bu kapsamda etkin rollerinin bulunduğu gözlenmiĢtir (Özpay, 2008).
Kurak koĢullar altında bitki dokularında meydana gelen ABA miktarındaki artıĢ fizyolojik değiĢikliklerle iliĢkilendirilmektedir (Alvarez ve ark., 2008). Bitkiler stres altında birçok metabolik olaylardan etkilendiğinden düzenleyici olarak rol oynayan hormonlardan biri olan ABA stres sırasında hızlı bir birikim gösterdiği için kimyasal bir sinyal molekülü olarak rol oynamakta ve stres hormonu olarak bilinmektedir (Wilkinson ve Davies, 2002). ABA kuraklık stresi koĢullarında stomaların kapanmasını sağlayarak bitkinin suya olan ihtiyacını azaltmakta ve strese karĢı bir dayanıklılık mekanizması oluĢturmaktadır (Sauter ve ark., 2002). Kuraklık stresine cevap olarak stomaların kapanması sırasında bekçi hücrelerdeki su kaybı, yaprağın diğer kısımlarının su miktarının azalması ile baĢlatılabilir ve ABA bu olayda önemli bir rol oynamaktadır (Taiz ve Zeiger, 1998). ABA, bekçi hücrelerinin stoplazmalarının pH ve Ca+2 iyonu konsantrasyonlarında değiĢikliklere neden olarak Ca+2
, K+ iyonlarını aktive ederek plazma membranının depolarizasyonunu sağlamaktadır. Tüm bu olayların sonucunda K+ iyonları bekçi hücrelerinden dıĢarı çıkarak ve hücrelerin turgor basıncı azalarak stomalar kapanmaktadır (Kalefetoğlu, 2006).
Çoğunlukla yapraklarda erken yaĢlanmaya neden olan kuraklık genellikle protein veya klorofil konsantrasyonundaki azalma ve hücre zarı geçirgenliğindeki artıĢla ifade edilmektedir (Dhindsa ve Matowe, 1981; Sahu ve Mishra, 1987; Chen ve ark., 1991; Ten Chen ve Kao, 1991; Yeo ve ark., 1991). Su stresinin yaprak yaĢlanması üzerindeki etkisi K ve Ca iyonlarını tüketmesi biçiminde ortaya çıkmaktadır. Bununla birlikte magnezyum iyonu yaĢlanma odaklı olaylarda baĢrolde oynamaktadır (Leidi ve ark., 1991).
YapılmıĢ olan bir diğer çalıĢmada karpuzda, Ģiddetli kuraklık stresi sonucu bitki bünyesinde K konsantrasyonunda azalma meydana geldiğini göstermiĢtir. Aynı çalıĢmada potasyumun, stomaların açılıp kapanması, fotosentetik etki ve su dengesinin korunmasında etkili olduğu bildirilmiĢtir (Nasri ve ark., 2008).
Kalsiyum, bitkilerin hem geliĢimini hem de çevresel strese olan tepkilerini güçlendirdiği için fizyolojik olayların düzenlenmesinde önemli bir rol oynar. Kalsiyum, su ve suyun alınması, membran yapısı, stomatal fonksiyonlar, hücre bölünmesi, hücre duvarının sentezi gibi biyotik ya da abiyotik stres faktörlerinden zarar gören bitkilerin tamirini sağlamaktadır (McLaughlin ve Wimmer, 1999).
KuĢvuran ve ark. (2008), 20 farklı kavun genotipinde yaptıkları bir çalıĢmada, kontrol bitkilerindeki stoma yoğunluğunu belirlemiĢlerdir. ÇalıĢmada daha az stoma yoğunluğu içeren genotiplerin kuraklık stresinde daha yüksek toleranslık gösterdiği belirlenmiĢtir. AraĢtırıcılar, daha az stoma içeren genotiplerin kuraklık stresi karĢısında dayanımlarının daha yüksek olduğunu, bunun önemli bir tarama kriteri olabileceğini bildirmiĢlerdir.
González ve Ayerbe (2011), PEG 6000 ile oluĢturulan kuraklık stresinin 8 arpa çeĢidinde, koleoptil uzunluğu, büyüme, turgor ve ozmotik potansiyel üzerine etkilerini araĢtırdıkları laboratuvar çalıĢmasında, koleoptil uzunluğunun çeĢitlere göre farklılık gösterdiğini ve kuraklık stresi arttıkça koleoptil boyunun kısaldığını tespit etmiĢlerdir. Ayrıca koleoptil boyu ile ozmotik potansiyel arasında pozitif ve önemli iliĢkiler bulunduğunu ve ıslah programlarında koleoptil uzunluğunun kuraklığa dayanıklılıkta önemli bir seleksiyon kriteri olarak kullanılabileceğini bildirmiĢlerdir.
Suyun hücre içeriğinin büyük bir kısmını oluĢturması, taĢıyıcı olması, hücresel reaksiyonlar ve iĢlevler için çözücü rolde olması gibi özelliklerinden dolayı su stresi ile gelen hücre kaybı durumunda fizyolojik olaylardan en belirgini turgorun azalması ve stoma açıklığının daralmasıdır. Böyle durumlarda bitkilerde enzimatik olayların karıĢıklığı artar ve metabolik oranlar arasındaki uyum bozulur. Su kaybına bağlı olarak kutikula kalınlığı, kök yoğunluğu ve köklerden uçlara doğru uzanan dokunun değiĢmesi gibi zararlar görülür (Hale ve Orcutt, 1987; Kalefetoğlu ve Ekmekci, 2005).
Kuraklık stresi üzerinde yapılan baĢka bir çalıĢmada, oksidatif zararlanmaya neden olan SOD ve katalaz enzimlerinin aktiviteleri ile lipid peroksidasyonu düzeyinin sınırlanması arasında çok iyi bir pozitif etkileĢim olduğu belirlenmiĢtir. Eserde, kuraklığa duyarlı Cratoneuron filicinum bitkisinde olduğu gibi kontrol edilemeyen lipid peroksidasyon düzeyinin, sınırsız bir hücre zarı hasarına, hücre sıvısının kaybına ve
sonuçta ölüme neden olduğu açıklanmaktadır. Lipid peroksidasyonu, bu iĢlemin bir ürünü olan ve malondialdehid (MDA) adı verilen bir madde yardımıyla ölçülebilmektedir. Adı geçen ürün, hücre zarı hasara uğradığında açığa çıktığından yüksek miktarda bulunması hücre zarının tahrip olduğunu, düĢük miktarda bulunması ise hücre zarı yapısının bozulmadığını veya düĢük seviyede etkilendiği sonucunu göstermektedir (Dhindsa ve Matowe, 1981).
3. MATERYAL VE YÖNTEM
3.1 Materyal
3.1.1 Bitki Materyallerinin Temini
AraĢtırmada kuraklık koĢullarına tepkileri daha önce belirlenmiĢ olan toleranslı C-26 (Cucurbita pepo L.) ve hassas olan C-27 (C. pepo L.) genotipleri kullanılmıĢtır. AraĢtırmada kullanılan bitkisel materyaller Selçuk Üniversitesi Ziraat Fakültesi Bahçe Bitkileri Öğretim Üyelerinden Prof. Dr. Önder Türkmen tarafından uzun yıllar sonucu oluĢturulan kolleksiyonun kültür formları ve yabani türlerinden temin edilmiĢtir.
3.2 Metot
AraĢtırma materyali olan kabak genotipleri iklim odasında kontrollü koĢullarda su kültürü ortamında yetiĢtirilmiĢlerdir. Gerekli ısı, nem, ıĢık ve ayrıca sterilizasyon kontrolleri yapılmıĢtır.
3.2.1 Deneme Serilerinin Hazırlanması
AraĢtırmada kullanılan bitkiler iklim odasında kontrollü koĢullarda yetiĢtirilmiĢlerdir (Resim 3.1). Ġklim odası; bitkilerin tohum çimlenmesi ve çimlenme sonrası genç fidecikleri, büyüme ve geliĢme süresince % 45-55 nem, 16 saat aydınlık ve 8 saat karanlık fotoperyod, 21±1 °C sıcaklık ile 10000 Lüx/Gün ıĢık intensitesi olacak Ģekilde ayarlanmıĢtır.
Resim 3. 1. Ġklim odası ve kontrollü koĢullarında yetiĢtirilen kabak genotiplerine ait resimler
3.2.2 Ön Denemeler
Tez kapsamında PEG 6000 uygulamasıyla oluĢturulan kuraklık stres gruplarını belirlemek amacıyla ön denemeler yapılmıĢ, %6 PEG 6000 dozları en uygun seviyeler olarak belirlenmiĢtir (Resim 3.2).
Resim 3. 2. AraĢtırmada kullanılan kabak genotiplerine ait ön deneme resimleri
3.2.3 Deneme Serilerinin Hazırlanması
Tez çalıĢmasında, kontrol grubu (Hoagland solüsyon grubu) ile birlikte, kuraklık stresi grupları (%6 PEG 6000) oluĢturulmuĢtur. Kabak genotiplerinin ozmotik stres toleransı üzerine etkilerinin araĢtırıldığı bu çalıĢma, 5 tekerrürlü olarak kurulmuĢ ve toplam 20 saksı olacak Ģekilde hazırlanmıĢtır.
Deneme planı; Ko n tr o l (Ho a g la n d s o lü sy o n u ) C-26 C-26 C-26 C-26 C-26 C-27 C-27 C-27 C-27 C-27 Ku ra k lı k (Ho a g la n d s o lu s y o n u + % 6 P E G 6000 ) C-26 C-26 C-26 C-26 C-26 C-27 C-27 C-27 C-27 C-27 Ģeklinde oluĢturulmuĢtur.
3.2.4 Tohum Ekimi
Denemede kullanılan tohumlar önce %5’lik sodyum hipoklorid ile 10’ar dakika muamele edildikten sonra de-iyonize su (dI -H2O) ile 3 kez yıkanarak sterilize edilmiĢlerdir. Daha sonra her iki grup için de (C-26 ve C-27) çimlendirme düzeneği kurulmuĢtur (Resim 3.3). Kabak genotiplerine ait tohumlar 2 saat deiyonize suda ĢiĢirildikten sonra nemli filtre kağıdı içeren petrilere yerleĢtirilerek 4 °C’de gece boyunca bekletilmiĢ, çimlenen tohumlar, naylon telin üzerine alınarak 0.5 mM’lık CaCl2 solüsyonunda 25 °C’de karanlıkta inkübe edilmiĢtir. Daha sonra fideler sürekli havalandırılan 1/5’lik Hoagland solüsyonuna aktarılarak (pH 6.0) bitki büyüme odasında yetiĢtirilmiĢtir (Resim 3.4).
Resim 3. 3. AraĢtırmada kullanılan kabak genotiplerine ait çimlendirme resimleri
Bitkiler ilk üç yapraklı evreye geldiklerinde uygulamaların ilk baĢlangıç günü, yani 0. gün örneklemeleri yapıldıktan sonra kabak genotiplerine %6 PEG 6000 tatbik edilmiĢtir. Besin solüsyonları her üç günde bir yenisiyle değiĢtirilerek tazelenmiĢtir. Bitkiler kuraklık koĢullarında morfolojik değiĢimler göstermeye baĢladığında 2. örneklemeler yapılmıĢtır. Örneklemelerde saksılardaki bitkilerden eĢit sayıda kökleriyle birlikte bütün bitki alınıp, kökler ayrıldıktan sonra yeĢil aksam enzim analizlerinde kullanılmak üzere -80 °C’de derin dondurucuda saklanmıĢlardır.
3.2.5 Analiz Yöntemleri
Kuraklık koĢullarında tez çaĢılmasında belirtilen hedeflere ulaĢabilmek için hasat edilen kabak genotiplerine ait örneklerde aĢağıda belirtilen çalıĢmalar yapılmıĢtır;
• Büyüme parametrelerinin ölçülmesi • Bitkilerde K, Ca ve Mg analizi
3.2.5.1 Büyüme Parametreleri
Tez kapsamında oluĢturulan gruplardan; uygulamaların ilk baĢlangıç günü, yani 0. günde ve ilk tepkinin görüldüğü günde (14. gün) bitki örnekleri alınarak kökleri ve gövdeleri birbirinden ayrılmıĢtır. Kök ve gövdenin uzunlukları ölçülmüĢ, yaĢ ağırlıkları tartılmıĢtır. Örnekler 70 °C de 72 saat etüvde kurutulduktan sonra kuru ağırlıkları belirlenmiĢtir.
3.2.5.2 Bitkilerde K, Ca ve Mg analizi
Hasat sonrası kese kağıtları içerisinde laboratuvara getirilen bitkilerin vejetatif aksamı ve kök aksamı tamamen temizleninceye kadar musluk suyu ile yıkandıktan sonra sırasıyla bir kez saf su, 0.2 N HCl çözeltisi, iki kez saf su ve bir kez de deiyonize su ile yıkanıp, kaba filtre kağıdı üzerinde fazla suları alınmıĢtır. Daha sonra kese kâğıdına ayrı ayrı konulan bitki kısımları hava sirkülasyonlu kurutma dolabında 70 °C’ de sabit ağırlığa gelinceye kadar kurutulmuĢlardır. Kuruyan bitki örneklerinin ağırlıkları belirlendikten sonra tungsten kaplı bitki öğütme değirmeninde öğütülmüĢlerdir. Polietilen kavanozlara konulan öğütülmüĢ bitki örnekleri analizde kullanılmadan önce 70 °C’de sabit ağırlığa gelinceye kadar kurutma dolabında bırakılmıĢ ve kavanozların kapakları sıkıca kapatılmıĢtır.
Kurutulan ve öğütülen bitki örneklerinden 0.3 g tartılmıĢ 5 ml HNO3+2 ml H2O2 ile yüksek sıcaklık (210 °C) ve yüksek basınç (200 PSI) altında mikrodalga cihazında (CEM Mars 5) çözündürülmüĢtür. Daha sonra örnekler 25 ml’lik balonjoje’ye aktarılarak soğutulmuĢ, deiyonize su ile derecesine tamamlanmıĢtır. Bu süzükler hemen ince gözenekli (Whatman No:42 veya mavibant) filtre kâğıdı ile süzülerek 25 ml’lik polietilen ĢiĢelere aktarılmıĢ ve süzükte K, Ca ve Mg içerikleri ICP-AES (Inductively
Coupled Plasma Atomic Emission Spectrometer) (Varian-Vista, axiel) cihazı ile belirlenmiĢtir (Soil Survey Laboratory Methods Manual, 2004).
3.2.6 Biyokimyasal Parametrelerin Ölçümü
Tez çalıĢmasında belirtilen hedeflere ulaĢabilmek için bitkilerde aĢağıda belirtilen çalıĢmalar yapılmıĢtır.
Enzim ekstraktlarının hazırlanması, Antioksidan enzim aktivite analizleri;
Tez çalıĢmasında belirtilen hedeflere ulaĢabilmek için bitkilerde aĢağıda belirtilen çalıĢmalar yapılacaktır.
• Enzim ekstraktlarının hazırlanması,
• Süperoksit Dismutaz (SOD; EC 1.15.1.1) Enzim Aktivitesinin Belirlenmesi • Peroksidaz (POX; EC 1.11.1.7) Enzim Aktivitesinin Belirlenmesi
• Katalaz (CAT; EC 1.11.1.6) Enzim Aktivitesinin Belirlenmesi • Glutatyon Redüktaz (GR; EC 1.6.4.2) Enziminin Aktivite Tayini • Total Protein Miktarının Belirlenmesi
• Lipit Peroksidasyonunun Belirlenmesi • Prolin Analizi
• Hücre Zarı geçirgenliği (Elektrolit Sızıntısı) Tayini • H2O2 radikalinin belirlenmesi
• OH
radikali süpürülme aktivitesinin belirlenmesi
3.2.6.1 Enzim ekstraktlarının hazırlanması
Antioksidan enzimlerin ekstraksiyonu için derin dondurucuda saklanmıĢ olan yaprak örnekleri kullanılmıĢtır. SoğutulmuĢ havanda 1 gr yaprak örneği sıvı azotta %2 (w/v) polyvinylpolypyrolidone (PVPP) ve 1 mM EDTA içeren pH 7,8'de 50 mM Na-fosfat tamponuyla homojenize edilmiĢtir. Filtrasyon sonrası +4 °C'de, 14 000 rpm'de 30 dakika santrifüj edilmiĢtir. Elde edilen süpernatant, enzim aktivitesi analizlerinde kullanılmıĢtır. Ekstraksiyon prosedürünün tümü ±4 °C'de gerçekleĢtirilmiĢtir.
3.2.6.2 Antioksidan enzim aktivite analizleri
3.2.6.2.1 Süperoksit dismutaz (SOD; süperoksit: süperoksit oksidoredüktaz, EC 1.15.1.1) enziminin aktivite tayini
SOD aktivitesi, Beauchamp ve Fridovich (1971)’in metoduna göre, SOD’un fotokimyasal olarak nitro blue tetrazolium (NBT)’un indirgenmesini inhibe etme yeteneğinin ölçülmesiyle tayin edilmiĢtir. 3 ml reaksiyon karıĢımı; 50 mM fosfat tamponu (pH 7,8), 33 μM NBT, 10 mM L-metionin, 0,66 mM EDTA Na2, 0,0033 mM Riboflavin içermektedir. Süpernatant seyreltildikten sonra karıĢım 10 dk 300 μmol m-2 s-1 ıĢık Ģiddeti altında bekletilmiĢtir. Daha sonra reaksiyon karıĢımının 560 nm’de verdiği absorbans değerleri okunmuĢtur. SOD için 1 enzim birimi; fotoredüksiyonun % 50 inhibisyonuna neden olan protein miktarı (mg) olarak tanımlandığından yaprak örneklerindeki SOD aktiviteleri buna göre belirlenmiĢtir.
3.2.6.2.2 Peroksidaz (POX; EC 1.11.1.7) enzim aktivitesinin belirlenmesi
Peroksidaz (POX) enzim aktivitesi, Herzog (1973)'nin tanımladığı metoda göre yapılmıĢtır. Köre karĢı 465 nm'de H2O2 varlığında okside olan DAB (3'-3'-diaminobenzidin tetrahidroklorit) oluĢum miktarına bağlı olarak 3 dakika boyunca absorbans değiĢimleri okunmuĢtur. Spesifik enzim aktivitesi dakikada tüketilen µmol/ml H2O2 olarak ifade edilmiĢtir.
3.2.6.2.3 Katalaz (CAT; EC 1.11.1.6) enzim aktivitesinin belirlenmesi
Katalaz (CAT) enzim aktivitesi, Bergmayer (1974)'in tanımladığı metoda göre yapılmıĢtır. Analiz UV ıĢığı bölgesinde köre karĢı 240 nm'de H2O2'nin azalma oranının belirlenmesi ile yapılmıĢtır. Bu enzim aktivitesi dakikada tüketilen µmol H2O2 olarak ifade edilmiĢtir. Reaksiyon boyunca absorbansta oluĢan düĢüĢ 180 sn boyunca takip edilmiĢtir. CAT aktivitesi dakikada harcanan µmol H2O2 olarak ifade edilmiĢtir.
3.2.6.2.4 Glutasyon redüktaz (GR; EC 1.6.4.2) enziminin aktivite tayini
Glutatyon redüktaz aktivitesi, 340 nm'deki absorbans azalmasından yola çıkılarak hesaplanmıĢtır (Foyer ve Halliwell, 1976). NADPH varlığında, okside glutatyon miktarındaki azalma, kuvartz küvette köre karĢı 180 sn boyunca takip edilmiĢtir. Hesaplamalar glutatyon redüktaz enziminin ekstinksiyon katsayısı
kullanılarak yapılmıĢtır. Spesifik enzim aktivitesi, dakikada indirgenen 1 mmol/ml GSSG miktarı olarak ifade edilmiĢtir.
3.2.6.2.5 Total protein miktarının belirlenmesi
Total protein miktarı analizleri Bradford (1976)' a göre BSA (Bovine Serum Albumine) standartları kullanılarak yapılmıĢtır. Örnekler köre karĢı Shimadzu UV spektrofotometre cihazı ile 595 nm'de okunmuĢtur. Çözünebilen total protein miktarı mg yaĢ ağırlık olarak belirlenmiĢtir.
3.2.7 Prolin Analizi
Serbest prolin içeriğinin belirlenmesi Bates ve ark. (1973)'na göre yapılmıĢtır. Sıvı fazdan aspire edilen toluen fraksiyonunun 520 nm'deki absorbansı spektrofotometreden okunmuĢtur. Prolin konsantrasyonu, kalibrasyon eğrisi kullanılarak hesaplanmıĢ ve µmol prolin g-1
taze ağırlık olarak ifade edilmiĢtir.
3.2.8 Lipit Peroksidasyonunun Belirlenmesi
Lipit peroksidasyonunun belirlenmesi TBAR reaksiyonu sonucu oluĢan malondialdehit (MDA) miktarının belirlendiği Rao ve Sresty (2000) 'nin tanımladığı yönteme göre yapılmıĢtır. Aktivite için 532-600 nm aralığında absorbans değiĢimlerine bakılmıĢtır.
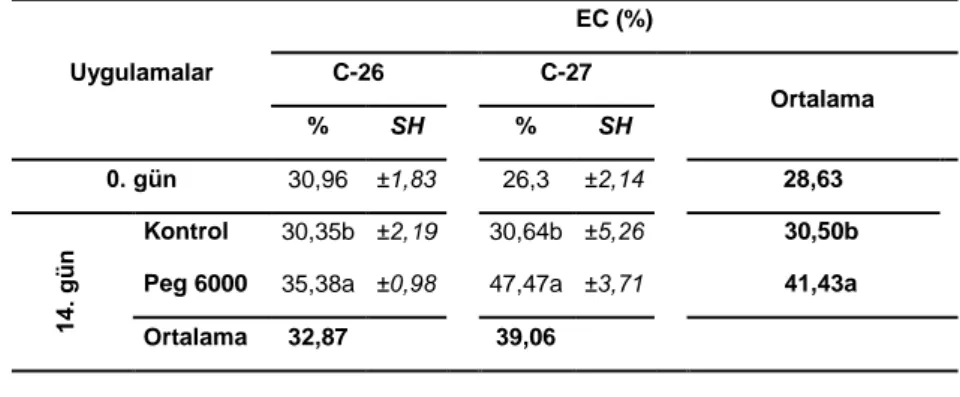
3.2.9 Hücre Zarı Geçirgenliği (Elektrolit sızıntısı)
Hücre zarı geçirgenliği elektrolit sızıntısının ölçümüyle Dionisio-Sese ve Tobita (1998)’ya göre belirlenmiĢtir. Bunun için 100 mg yaprak örnekleri 5 mm uzunluğunda kesilerek 10 mL deiyonize su içeren deney tüplerine transfer edilmiĢtir. Tüpler plastik kapaklarla kapatıldıktan sonra 32 °C’lik bir su banyosunda 2 saat sürekli olarak tutulmuĢtur. Ortamın elektrik iletkenliği EC metre ile ölçülerek (EC1) örnekler 121 °C’de 20 dk boyunca tüm dokuların ölmesi ve elektrolitlerin dıĢa çıkması için otoklavlanmıĢtır. Sonra örnekler 25 °C’ye kadar soğutularak bu ortamdaki elektrik iletkenliği ölçülmüĢtür (EC2). Elektrolit sızıntısı (ES) aĢağıdaki formüle göre hesaplanmıĢtır.
3.2.10 Hidroksil radikali (·OH-) süpürülme aktivitesinin belirlenmesi
Hidroksil radikalinin süpürülme aktivitesinin belirlenmesi Kim ve Minamikawa (1997)’ye göre gerçekleĢtirilmiĢtir. Bütün solüsyonlar analiz boyunca taze olarak hazırlanmıĢtır. Deoksiriboz ve ·OH-’nın, Fe3+
⁄ askorbat ⁄ EDTA ⁄ H2O2 sisteminden ürettiği örnek arasındaki rekabet ·OH
süpürülme aktivitesinin belirlenmesi için ölçülmüĢtür. Reaksiyon karıĢımı 0.30 ml, 20 mM sodyum-fosfat tamponu (pH7.0), 0.15 ml, 10 mM 2-deoksiriboz, 0.15 ml, 10 mM FeSO4, 0.15 ml, 10 mM EDTA, 0.15 ml, 10 mM H2O2, 0.525 ml H2O ve 0.075 ml örnek içeren karıĢım 37 °C’de 2 saat boyunca inkübe edilmiĢtir. 750 µl %2.8 triklor asetik asit ve 0.75 ml 1.0% TBA, 50 mM NaOH içinde test tüplerine eklenmiĢ ve 20 dakika boyunca tüpler kaynatılmıĢtır. Sonrasında karıĢım soğutularak 520 nm absorbansta ölçüm yapılmıĢtır.
3.2.11 Hidrojen Peroksit (H2O2) Ġçeriğinin Ölçülmesi
Hidrojen peroksit ölçümü için kullanılan örnekler, hasattan hemen sonra sıvı azotta dondurularak depolanmıĢ ve H2O2 miktarı Liu ve ark. (2010)’a göre ölçülmüĢtür.
4. ARAġTIRMA SONUÇLARI VE TARTIġMA
AraĢtırmada, kurak koĢullara toleranslı C-26 (Cucurbita pepo L.) ve kurak koĢullara hassas C-27 (C. pepo L.) kabak genotiplerinde kuraklık stresi koĢullarında meydana gelen değiĢimlerle ilgili incelenen özellikler aĢağıda alt baĢlıklar halinde verilmiĢtir.
4.1 Büyüme Parametreleri Bulguları
Kabak genotiplerinin kuraklık stresi koĢullarında bitkilerin yaĢ ve kuru ağırlık değerleri ile kök ve gövde uzunluğu değerlerine ait ortalamalar Tablo 4.1, 4.2, 4.3’ de verilmiĢtir.
4.1.1 Gövde ve Kök YaĢ Ağırlığı
PEG 6000 uygulamasının 0. ve 14. günlerinde, kabak genotiplerinin gövde ve kök yaĢ ağırlıklarına ait ölçülen ortalama değerler Tablo 4.1’de verilmiĢtir. Varyans analizi sonuçlarına göre, gövde ve kök yaĢ ağırlığı değerleri, kullanılan genotipler ve kuraklık stresi koĢullarında 0. ve 14. günlerde alınan örneklerde %1 seviyesinde önemli bulunmuĢtur (Tablo 4.1).
Tabloda görüldüğü gibi, araĢtırmada kullanılan kabak genotiplerinin gövde yaĢ ağırlık değerlerinde farklılıklar olduğu tespit edilmiĢtir. Kuraklık uygulamasına bağlı olarak 2 kabak genotipinin gövde yaĢ ağırlık değerlerinde azalma olduğu belirlenmiĢtir (Tablo 4.1). Uygulamalar mukayese edildiğinde kuraklık Ģartlarını oluĢturan PEG 6000 koĢullarında gövde yaĢ ağırlık değerleri kontrol uygulamalarına göre kurak koĢullara dayanıklı C-26 genotipinde %22 oranında azalırken, kurak koĢullara hassas C-27 genotipinde %39 oranında azalma göstermiĢtir (Tablo 4.1). Kabak genotiplerinin kök yaĢ ağırlık değerleri ile ilgili yapılan ölçümlerin C-26 genotipinde kök yaĢ ağırlığının kontrole göre %34 artıĢ ve C-27 genotipinde kök yaĢ ağırlığında kontrole göre %52 oranlarında azalma gösterdiği belirlenmiĢtir (Tablo 4.1).
Tablo 4. 1. C-26 ve C-27 kabak genotiplerinin gövde ve kök yaĢ ağırlık değerleri (g bitki-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir.
Uygulamalar
Yaş Ağırlık (g bitki-1)
C-26 C-27
Ortalama
g bitki-1 SH g bitki-1 SH
Gövde Kök Gövde Kök Gövde Kök Gövde Kök Gövde Kök
0. gün 9,98 2,19 ±0,91 ±0,50 10,74 2,37 ±0,80 ±0,44 10,36 2,28 14 . gü n Kontrol 31,50 6,61 ±9,44 ±3,11 23,67 7,12 ±5,91 ±4,62 27,58 6,87 Peg 6000 24,62 8,87 ±8,49 ±4,19 14,36 3,43 ±3,87 ±1,81 19,49 6,15 Ortalama 28,06 7,74 19,02 5,28
4.1.2 Gövde ve kök kuru ağırlığı
PEG 6000 uygulamasının 0. ve 14. günlerinde, kabak genotiplerinin gövde ve kök kuru ağırlıklarına ait ölçülen ortalama değerler Tablo 4.2’ de verilmiĢtir.
Tabloda görüldüğü gibi, araĢtırmada kullanılan kabak genotiplerinin gövde kuru ağırlık değerlerinde farklılıklar olduğu tespit edilmiĢtir. Kuraklık uygulamasına bağlı olarak 2 kabak genotipinin gövde kuru ağırlık değerlerinde azalma olduğu belirlenmiĢtir (Tablo 4.2). Uygulamalar mukayese edildiğinde kuraklık Ģartlarını oluĢturan PEG 6000 koĢullarında gövde kuru ağırlık değerleri kontrol uygulamalarına göre kurak koĢullara toleranslı C-26 genotipinde %22 oranında azalırken, kurak koĢullara hassas C-27 genotipinde %32 oranında azaldığı tespit edilmiĢtir (Tablo 4.2). Kabak genotiplerinin kök kuru ağırlık değerleri ile ilgili yapılan ölçümlerde kurak koĢullara toleranslı C-26 genotipinde kök kuru ağırlığı kontrole göre %36 artarken, kurak koĢullara hassas C-27 genotipinde kök kuru ağırlığı kontrole göre %17 oranlarında azalma gösterdiği belirlenmiĢtir (Tablo 4.2).
Tablo 4. 2. C-26 ve C-27 kabak genotiplerinin gövde ve kök kuru ağırlık değerleri (g bitki-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir.
Uygulamalar
Kuru Ağırlık (g bitki-1)
C-26 C-27
Ortalama
g bitki-1 SH g bitki-1 SH
Gövde Kök Gövde Kök Gövde Kök Gövde Kök Gövde Kök
0. gün 0,61 0,07 ±0,10 ±0,02 0,67 0,06 ±0,01 ±0,02 0,64 2,28 14 . gü n Kontrol 2,44 0,28 ±1,04 ±0,11 1,70 0,23 ±0,45 ±0,11 2,07 0,26 Peg 6000 1,90 0,38 ±0,62 ±0,19 1,16 0,19 ±0,26 ±0,08 1,53 0,29 Ortalama 2,17 0,33 1,43 0,21 4.1.3 Gövde ve Kök Boyu
PEG 6000 uygulamasının 0. ve 14. günlerinde, kabak genotiplerinin gövde ve kök boyuna ait ölçülen ortalama değerler Tablo 4.3’ de verilmiĢtir.
Tabloda görüldüğü gibi, araĢtırmada kullanılan kabak genotiplerinin gövde boyu değerlerinde farklılıklar olduğu tespit edilmiĢtir. Kuraklık uygulamasına bağlı olarak C-26 genotipinin gövde boyu değerinde artıĢ ve C-27 genotipinin gövde boyu değerinde ise azalma olduğu belirlenmiĢtir (Tablo 4.3). Uygulamalar mukayese edildiğinde kuraklık Ģartlarını oluĢturan PEG 6000 koĢullarında gövde boyu değerleri kontrol uygulamalarına göre kurak koĢullara toleranslı C-26 genotipinde %22 oranında artarken, kurak koĢullara hassas C-27 genotipinde %39 oranında azaldığı tespit edilmiĢtir (Tablo 4.3). Kabak genotiplerinin kök boyu değerleri ile ilgili yapılan ölçümlerde kurak koĢullara toleranslı C-26 genotipinde kök boyu kontrole göre %34 artarken, kurak koĢullara hassas C-27 genotipinde kök boyu kontrole göre %52 oranlarınında azalma gösterdiği belirlenmiĢtir (Tablo 4.3).
Tablo 4. 3. C-26 ve C-27 kabak genotiplerinin gövde ve kök boyu değerleri (cm). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. Uygulamalar Boy (cm) C-26 C-27 Ortalama cm SH cm SH
Gövde Kök Gövde Kök Gövde Kök Gövde Kök Gövde Kök
0. gün 21,33 48,33 ±2,72 ±6,13 21,67 50,33 ±1,89 ±7,72 21,50 49,33 14 . gü n Kontrol 30,00 58,00 ±4,52 ±2,58 26,75 44,75 ±1,11 ±28,02 28,38 51,38 Peg 6000 31,25 30,00 ±1,18 ±30,43 22,00 44,00 ±3,74 ±4,24 26,63 37,00 Ortalama 30,63 44,00 24,38 44,38
Resim 4. 1. C-26 ve C-27 kabak genotiplerinin kontrol ve kurak koĢullarda bitkilerin tepkilerini gösteren resimler. C PEG C-26 C-27 C PEG C PEG C PEG
4.2 K, Mg ve Ca Konsantrasyonu Bulguları
Kabak genotiplerinin kuraklık stresi koĢullarında bitkilerin gövde ve kök K, Mg ve Ca konsantrasyonlarına ait ortalamalar Tablo 4.4, 4.5, 4.6 ve 4.7’de verilmiĢtir.
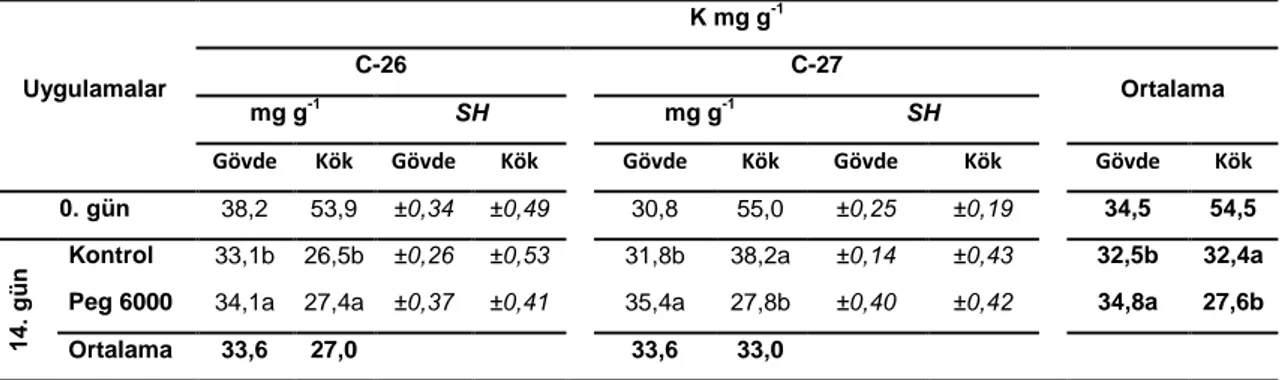
4.2.1 Gövde ve kök K Konsantrasyonu
Kabak bitkisinin gövde ve kök K konsantrasyonuna ait ortalama değerler Tablo 4.4’de verilmiĢtir.
AraĢtırmada kullanılan kabak genotiplerinin gövde K konsantrasyonlarında uygulamalara bağlı olarak farklılıklar olduğu belirlenmiĢtir. Kuraklık Ģartları oluĢturan PEG 6000 koĢullarında kontrol uygulamalarına göre kurak Ģartlara toleranslı C-26 genotipinde %3 oranında artarken, kurak koĢullara hassas C-27 genotipinde de %11 oranında artıĢ olduğu tespit edilmiĢtir (Tablo 4.4). Kabak genotiplerinin kök K değerleri ile ilgili yapılan ölçümlerde kurak koĢullara toleranslı C-26 genotipinde %3 artarken, kurak koĢullara hassas C-27 genotipinde kontrole göre %27 oranında azalma gösterdiği belirlenmiĢtir (Tablo 4.4).
Tablo 4. 4.C-26 ve C-27 kabak genotiplerinin gövde ve kök K değerleri (mg g-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. Uygulamalar K mg g-1 C-26 C-27 Ortalama mg g-1 SH mg g-1 SH
Gövde Kök Gövde Kök Gövde Kök Gövde Kök Gövde Kök
0. gün 38,2 53,9 ±0,34 ±0,49 30,8 55,0 ±0,25 ±0,19 34,5 54,5
14
.
gü
n Kontrol 33,1b 26,5b ±0,26 ±0,53 31,8b 38,2a ±0,14 ±0,43 32,5b 32,4a
Peg 6000 34,1a 27,4a ±0,37 ±0,41 35,4a 27,8b ±0,40 ±0,42 34,8a 27,6b
Ortalama 33,6 27,0 33,6 33,0
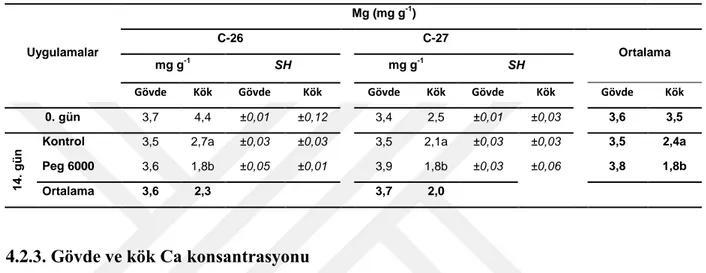
4.2.2 Gövde ve kök Mg Konsantrasyonu
AraĢtırmada kullanılan kabak genotiplerinin gövde ve kök Mg konsantrasyonuna ait ortalama değerler Tablo 4.5’ da verilmiĢtir.
AraĢtırmada kullanılan kabak genotiplerinin gövde Mg konsantrasyonlarında uygulamalara bağlı olarak artıĢlar olduğu belirlenmiĢtir. Kuraklık Ģartları oluĢturan PEG 6000 koĢullarında kontrol uygulamalarına göre kurak Ģartlara toleranslı C-26 genotipinde %3 oranında artarken, kurak koĢullara hassas C-27 genotipinde de %11
oranında artıĢ olduğu tespit edilmiĢtir (Tablo 4.5). Kabak genotiplerinin kök Mg değerleri ile ilgili yapılan ölçümlerde kurak koĢullara toleranslı C-26 genotipinde %33 azalırken, kurak koĢullara hassas C-27 genotipinde kontrole göre %14 oranında azalma gösterdiği belirlenmiĢtir (Tablo 4.5).
Tablo 4. 5. C-26 ve C-27 kabak genotiplerinin gövde ve kök Mg değerleri (mg g-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. Uygulamalar Mg (mg g-1) C-26 C-27 Ortalama mg g-1 SH mg g-1 SH
Gövde Kök Gövde Kök Gövde Kök Gövde Kök Gövde Kök
0. gün 3,7 4,4 ±0,01 ±0,12 3,4 2,5 ±0,01 ±0,03 3,6 3,5
14
.
gü
n Kontrol 3,5 2,7a ±0,03 ±0,03 3,5 2,1a ±0,03 ±0,03 3,5 2,4a
Peg 6000 3,6 1,8b ±0,05 ±0,01 3,9 1,8b ±0,03 ±0,06 3,8 1,8b
Ortalama 3,6 2,3 3,7 2,0
4.2.3. Gövde ve kök Ca konsantrasyonu
AraĢtırmada kullanılan kabak fidelerinin gövde ve kök Ca konsantrasyonlarına ait ortalama değerler Tablo 4.6’ de verilmiĢtir.
AraĢtırmada kullanılan kabak genotiplerinin gövde Ca konsantrasyonlarında uygulamalara bağlı olarak farklılıklar olduğu belirlenmiĢtir. Kuraklık Ģartları oluĢturan PEG 6000 koĢullarında kontrol uygulamalarına göre kurak Ģartlara toleranslı C-26 genotipinde %7 oranında artarken, kurak koĢullara hassas C-27 genotipinde de %25 oranında azalma olduğu tespit edilmiĢtir (Tablo 4.6). Kabak genotiplerinin kök Ca değerleri ile ilgili yapılan ölçümlerde kurak koĢullara toleranslı C-26 genotipinde %11 azalırken, kurak koĢullara hassas C-27 genotipinde kontrole göre hiçbir değiĢim göstermediği belirlenmiĢtir (Tablo 4.6).
Tablo 4. 6. C-26 ve C-27 kabak genotiplerinin gövde ve kök Ca değerleri (mg g-1). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir. Uygulamalar Ca (mg g-1) C-26 C-27 Ortalama mg g-1 SH mg g-1 SH
Gövde Kök Gövde Kök Gövde Kök Gövde Kök Gövde Kök
0. gün 27,2 9,6 ±0,47 ±0,17 32,1 12,7 ±0,32 ±0,24 29,7 11,2
14
.
gü
n Kontrol 20,5 6,5a ±0,69 ±0,07 35,2a 5,7 ±0,7 ±0,11 27,9a 6,1a
Peg 6000 21,9 5,8b ±0,92 ±0,06 26,5b 5,7 ±0,29 ±0,16 24,2b 5,8b
Ortalama 21,2 6,2 30,9 5,7
4.3 Prolin Bulguları
AraĢtırmada kullanılan kabak yaprak örneklerinde prolin değerlerine ait ortalama değerler Tablo 4.7’ da verilmiĢtir.
AraĢtırma sonucunda kabak genotiplerinde prolin değerleri, PEG 6000 uygulanan kuraklık stresi koĢulları altında kontrole göre kurak koĢullara dayanıklı C-26 genotipi %54 oranında artıĢ gösterirken, kurak koĢullara hassas C-27 genotipinin %129 oranında artıĢ gösterdiği tespit edilmiĢtir (Tablo 4.7).
Tablo 4. 7. C-26 ve C-27 kabak genotiplerinin gövde prolin (nmol g-1 YA). Kontrol ve kurak koĢullarda 0. ve 14. günlerinde örnekleme yapılmıĢtır. Sonuçlar ortalama ± standart hata olarak verilmiĢtir.
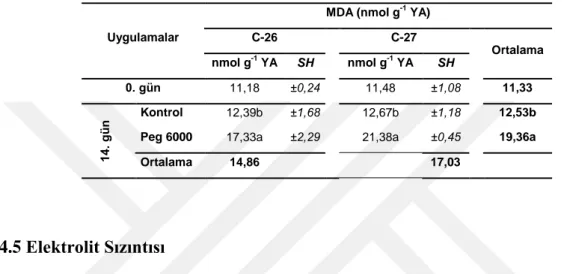
4.4 Lipid Peroksidasyonu Bulguları
AraĢtırmada kullanılan kabak genotiplerinin lipid peroksidasyon düzeyleri malondialdehit (MDA) miktarında meydana gelen değiĢimlere göre belirlenmiĢ ve elde edilen değerler Tablo 4.8’da verilmiĢtir.
Uygulamalar Prolin C-26 C-27 Ortalama nmol g-1 YA SH nmol g-1 YA SH 0. gün 0,12 ±0,09 0,05 ±0,01 0,09 14 . gü n Kontrol 0,13b ±0,03 0,07b ±0,03 0,10b
Peg 6000 0,20a ±0,01 0,16a ±0,02 0,18a