T.C.
Ege Üniversitesi Tıp Fakültesi Nükleer Tıp Anabilim Dalı
Prof. Dr. Zeynep BURAK
AKCİĞER KANSERİNİN TANI VE EVRELEMESİNDE
F-18 FDG PET/BT’NİN KATKISININ
RETROSPEKTİF DEĞERLENDİRİLMESİ
Uzmanlık Tezi
Dr. Emine TEKİN
Tez Danışmanı
Prof. Dr. Ayşegül AKGÜN
ii
İ
ÇİNDEKİLER
TABLO LİSTESİ ... iv ŞEKİL LİSTESİ ... iv GRAFİK LİSTESİ ... v RESİM LİSTESİ ... v KISALTMALAR ... vi 1.ÖZET ... viii 1.SUMMARY ... x 2.GİRİŞ ... 1 3.GENEL BİLGİLER ... 2 3.1. Akciğerlerin Anatomisi ... 2 3.1.1. Plevra ... 3 3.1.2. Pulmoner Alveoller ... 3 3.1.3. Bronş Ağacı ... 33.1.4. Akciğerlerin Lenfatik Drenajı ... 3
3.2. Akciğer Kanseri ... 4 3.2.1. Epidemiyoloji. ... 4 3.2.2. Etiyoloji ... 4 3.2.2.1. Sigara ... 4 3.2.2.2. Mesleki Maruziyet ... 4 3.2.2.3. Asbest ... 5
3.2.2.4. Diğer Etiyolojik Faktörler ... 5
3.2.3. Patoloji ... 5
3.2.3.1. Skuamöz Hücreli Karsinom ... 6
3.2.3.2. Büyük Hücreli Karsinom ... 7
3.2.3.3. Küçük Hücreli Karsinom ... 7
3.2.3.4. Adenokarsinom ... 7
3.2.4. Klinik ... 10
3.2.5. Evreleme ... 10
3.2.6. Akciğer Kanser Tanı Ve Metastaz Tarama Yöntemleri ... 19
3.2.6.1. PA ve Lateral Akciğer Grafileri ... 19
3.2.6.2. Bilgisayarlı Tomografi (BT) ... 19
3.2.6.3. Manyetik Rezonans Görüntüleme (MRG) ... 19
3.2.6.4. Bronkoskopi ... 19
3.2.6.5. Transtorasik İnce İğne Aspirasyonu ... 20
iii
3.2.6.7. Mediastinoskopi ve/veya Anterior Mediastinotomi ... 20
3.2.6.8. Endobronşiyal Ultrasonografi (EBUS) ... 20
3.2.6.9. Video Eşliğinde Torakoskopi (VATS) ... 21
3.2.6.10. Lenf Bezi Biyopsisi ... 21
3.2.6.11. Torakotomi ... 22
3.2.6.12. Tüm Vücut Kemik Sintigrafisi ... 22
3.2.6.13. F-18 FDG PET/BT ... 22
3.2.6.13.1. PET’in Tarihçesi ... 22
3.2.6.13.2. PET Görüntüleme ... 22
3.2.6.13.3. F-18 FDG PET Uygulama Ve Yorumlama ... 25
3.3. Akciğer Kanserinde F-18 FDG PET-BT ... 26
3.3.1. Soliter Pulmoner Nodüllerin Ayırıcı Tanısı ... 26
3.3.2. KHDAK’lerinde Evreleme ... 27
3.3.3. KHDAK’lerinde Nükslerin Belirlenmesi Ve Yeniden Evreleme ... 29
3.3.4. KHDAK’lerinde Tedaviye Cevabın Araştırılması ... 29
3.3.5. KHDAK’lerinde Prognoz Belirlenmesi ... 30
3.3.6. Plevral Malignite Tanısı Ve Evrelendirme ... 30
3.3.7. Küçük Hücreli Akciğer Kanserlerinin(KHAK) Evrelendirmesi ... 30
4. GEREÇ VE YÖNTEM ... 31
4.1. Hasta Grubu ... 31
4.2. BT Görüntüleme ... 31
4.3. BT Değerlendirme ... 31
4.4. Bronkoskopi ... 31
4.5. PET/BT Görüntüleme Protokolü ... 32
4.6. PET/BT Değerlendirme ... 32 4.7. Mediastinoskopi ve EBUS ... 33 4.8. Klinik Değerlendirme ... 33 4.9. Sağkalım ... 33 4.10. İstatiksel Analiz ... 33 5. BULGULAR ... 35 6. OLGU ÖRNEKLERİ ... 44 7. TARTIŞMA ... 49 8. SONUÇ ... 57 9. KAYNAKLAR ... 58
iv
TABLO LİSTESİ
Tablo Sayfa 1: Dünya Sağlık Örgütü’nün (DSÖ) 2004 Yılında Önerdiği Akciğer Kanseri
Histopatolojik Sınıflaması ... 6
2: Uluslararası Akciğer Kanseri Çalışma Derneği (IASLC), Amerikan Toraks Derneği (ATS) ve Avrupa Solunum Derneği (ERS)- Rezeke Edilen Spesmenlerde Akciğer Adenokarsinom Sınıflaması ... 9
3: Uluslar arası Akciğer Kanseri Çalışma Derneği, Amerikan Toraks Derneği ve Avrupa Solunum Derneği Çalışma Gruplarının Sunduğu Daha Önce Bronkoalveolar Karsinom Olarak Sınıflandırılan Yeni Adenokarsinom Kategorileri ... 9
4: Akciğer kanserinde görülen başvuru semptomlarının sıklığı ve nedenleri ... 10
5: Akciğer kanseri TNM sınıflaması ... 11
6: N sınıflamasında önerilen lenf bezi haritalaması ... 13
7: TNM sınıflamasına göre akciğer kanserinde evreleme ... 16
8: Adenokarsinom ve skuamöz hücreli karsinom SUVmax değerleri ... 38
9: Medyan SUVmax değerine göre iki gruba ayrılan hastalarda sağkalım ... 42
Ş
EKİL LİSTESİ
Şekil Sayfa 1: Sağ ve sol akciğer segmentleri ... 22: Lenf nodu istasyonları ... 15
3: Akciğer kanserinde evreleme ... 18
4: Adenokarsinom ile skuamöz hücreli karsinomun SUVmax değerleri ... 38
v
GRAFİK LİSTESİ
Grafik Sayfa
1: Cinsiyete göre hasta sayıları ... 35 2: Akciğer kanseri saptanan olgularda tümörlerin histopatolojik alt tipleri ... 36 3: PET/BT ile saptanan uzak metastaz bölgeleri ... 41
RESİM LİSTESİ
Resim Sayfa
1: Senkron tümörü olan olguda PET/BT’de gerçek pozitif ve yanlış negatiflik ... 37 2: PET/BT’de primer kitle atelektazi ayrımı ... 39 3: PET/BT’nin lenf nodu açısından yanlış pozitif olduğu olgu örneği ... 40 4: BT’de raporlanmayan ancak PET/BT’de hipermetabolik metastatik lenf nodu. 44 5: BT’de dansite değişikliği yaratmayan hipermetabolik kemik metastazları ... 45 6: Patolojik olarak doğrulanan PET/BT’de hipermetabolik karaciğer metastazı ... 46 7: PET/BT’de sol surrenal metastazı saptanarak tedavisi değişen olgu örneği ... 47 8: PET/BT’de beyin ve spinal kanalda metastaz saptanan olgu örneği ... 48
vi
KISALTMALAR
DSÖ : Dünya Sağlık Örgütü
IASLC : Uluslararası Akciğer Kanseri Çalışma Derneği ATS : Amerikan Toraks Derneği
ERS : Avrupa Solunum Derneği A.D : Anabilim Dalı
F-18 : Flor 18
FDG : Florodeoksiglikoz
PET : Pozitron Emisyon Tomografi BT : Bilgisayarlı Tomografi
PET/BT : Pozitron Emisyon Tomografisi/Bilgisayarlı Tomografi MRG : Manyetik Resonans Görüntüleme
USG : Ultrasonografi
TTİİAB : Transtorasik İnce İğne Aspirasyon Biyopsisi TBB : Transbronşiyal biyopsi
TBİA : Transbronşiyal iğne aspirasyonu
TBİİAB : Transbronşiyal ince iğne aspirasyon biyopsisi BAL : Bronkoalveoler lavaj
VATS : Video Eşliğinde Torakoskopi EBUS : Endobronşiyal Ultrasonografi PA : Posterior Anterior
SUVmax : Maksimum Standardize Uptake Value GLUT : Glikoz membran taşıyıcı protein γ : Gama
keV : Kilo elektron volt mCi : Milicurie dl : Desilitre ml : Mililitre g : Gram mg : Miligram dk : Dakika İV : İntravenöz KT : Kemoterapi
vii RT : Radyoterapi
NPD : Negatif prediktif değer PPD : Pozitif prediktif değer S-W : Shapiro-Wilk
KHDAK : Küçük hücre dışı akciğer kanseri KHAK : Küçük hücreli akciğer kanseri BAK : Bronkoalveoler adenokarsinom AIS : Adenokarsinoma in situ
MIA : Minimal invaziv adenokarsinom Adenoca : Adenokarsinom
SCC : Skuamöz hücreli karsinom
BHNEK : Büyük hücreli nöroendokrin karsinom AKK : Adenoid kistik karsinom
K : Karsinoid tümör Tm : Tümör
viii
1.ÖZET
Akciğer kanseri, tüm dünyada kansere bağlı gerçekleşen ölümlerin en sık nedenidir. Akciğer kanseri ancak erken dönemde tanınabilirse küratif tedavi olan operasyon şansı olabilmektedir. Erken tanı ve evrelemeye bağlı doğru tedavi seçimi sağkalımı artıran bir faktördür. Akciğer kanserinde sağkalım oranı oldukça düşük olup prognostik faktörlerin belirlenmesi hasta yönetiminde önem taşımaktadır. Çalışmamızda, akciğer kanseri tanı, evreleme ve tedavi yönetiminde FDG PET/BT’nin katkısını değerlendirmek amaçlandı. Ayrıca FDG PET/BT’deki primer lezyonun SUVmax değeri ile sağkalım arasındaki ilişki araştırıldı.
Çalışma grubumuza Şubat 2012 ile Şubat 2014 tarihleri arasında akciğer kanseri tanı ve evreleme amacıyla E.Ü.T.F. Nükleer Tıp A.D.’na başvuran ve F18 FDG PET/BT görüntüleme yapılan 50 hasta dahil edildi. Bu hastaların FDG PET/BT ve konvansiyonel görüntüleme bulguları retrospektif olarak incelendi. Tüm hastaların konvansiyonel yöntemler ve PET/BT bulguları, yöntemlere göre belirlenen evreleri ve tedavi planları ile histopatolojik bulguları kaydedildi. Ayrıca 50 hastadan ulaşılabilen 30’unun yaşam süreleri tespit edildi. İstatiksel yöntemler kullanılarak değerlendirme yapıldı.
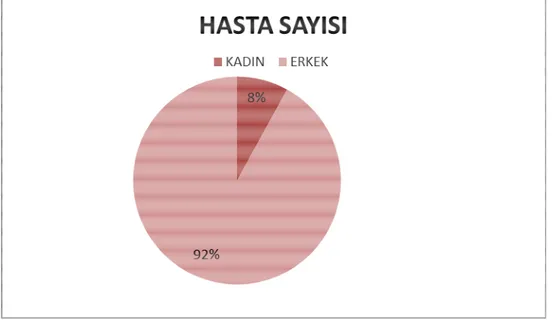
Hastaların 46(%92)’sı erkek ve 4(%8)’ü kadındı. Yaş ortalaması ise 63,0±8,6 idi. Tüm hastalarda histopatolojik tanı elde edildi ve hepsinde akciğer kanseri saptandı. 1 hastada aynı anda iki primer tümör saptanmış olup, 50 hastada toplam 51 tümör mevcuttu. FDG PET/BT’nin primer maligniteyi saptamada duyarlılık ve doğruluğu %94, pozitif prediktif değeri ise %100 olarak hesaplandı. Adenokarsinom ve skuamöz hücreli karsinom tanılı hasta gruplarında ortalama SUVmax değerleri karşılaştırıldı. Ortalama SUVmax değeri adenokarsinomlu hastalarda 16,8±13,5 ve skuamöz hücreli karsinomlu hastalarda 17,9±5,6 olarak saptandı ve aralarında istatiksel olarak anlamlı bir fark bulunmadı (p:0,2). Tüm tümörler ele alınarak tümör boyutu ile SUVmax değeri arasındaki ilişki değerlendirildi. 51 tümör için tümör boyutu ile SUVmax değeri arasında istatistiksel olarak anlamlı pozitif korelasyon (r:0,4) mevcuttu (p=0,002).
Histopatolojik olarak 21 hastada lenf nodu değerlendirilmesi yapıldı. Histopatolojik sonuçlarla birlikte değerlendirildiğinde FDG PET/BT lenf nodları açısından; 9 hastada gerçek negatif, 6 hastada yanlış pozitif, 2 hastada gerçek pozitif ve 4 hastada yanlış negatifti. Tüm hastaların %14(7/50)’ünde uzak metastaz bölgesi sadece FDG PET/BT yöntemi ile
ix
saptanabildi. PET/BT, hastaların 17/50(%34)’sinde konvansiyonel yöntemlerle belirlenen tedavi kararında değişikliğe neden oldu. Çalışmamızda 30 hastada primer kitlenin SUVmax değeri ile sağkalım arasındaki ilişki değerlendirildi. Bu 30 hastada medyan SUVmax değeri (15,6) cut off olarak kabul edildi. SUVmax değeri<15,6 olanlarda ortalama sağkalım 10,3±2,2 ay ve SUVmax değeri≥15,6 olanlarda ise 15,9±1,6 ay olarak saptandı. İki grup arasında sağkalım açısından anlamlı bir fark bulunmadı(p:0,118).
Çalışmamızda; PET/BT’nin konvansiyonel yöntemlere ek önemli bilgiler sağlayarak akciğer kanseri tanı ve evrelemesinde etkin bir yöntem olduğu sonucuna varıldı. Ayrıca PET/BT’nin evrelemeye katkısıyla hastaların önemli bir kısmında tedavi planında değişikliğe neden olduğu görüldü. Ancak primer kitlenin SUVmax değeri ile hastaların sağkalımı arasında istatistiksel olarak anlamlı ilişki saptanmadı.
x
1. SUMMARY
Lung cancer is the most common cause of cancer deaths all over the world. Chance for the surgery that is curative treatment for lung cancer is only possible if it is detected in early stages. Correct choice of treatment that depends on early diagnosis and staging increases survival. Rate of survival is quite low in the lung cancer. Determining the prognostic factors is also important in management of the patients. The present study aimed at assessing contribution of PET/CT to diagnosis, staging, and therapeutic management of lung cancer. It also investigated effects of SUVmax of the primary lesion in PET/CT scanning on the prognosis and survival.
The present study included 50 patients who were referred to Department of Nuclear Medicine of Medical School of Ege University between February 2012 and March 2014 and who underwent 18F FDG PET/CT scanning for purpose of diagnosing and staging lung cancer. FDG PET/CT scans of the patients and their findings on conventional imaging were reviewed retrospectively. Stage and therapeutic schedules of all patients based on conventional imaging and PET/CT were recorded. Histopathological findings were recorded. Furthermore, the survival of 30 out 50 patients accessed was identified. Statistical analysis was performed.
46 (92%) of the patients were men and 4 (8%) were women. Mean age of the patients was 63.0 ± 8.6 years. Histopathological diagnosis was available for all patients and lung cancer was confirmed in all of them. Two primary tumors were detected in one patient with a total of 51 tumors detected in 50 patients. FDG PET/CT has sensitivity and accuracy of 94% and positive predictivity of 100% in detecting the primary malignancy. The present study compared mean SUVmax between the patients with adenocarcinoma and squamous cell carcinoma. Mean SUVmax was 16.8 ± 13.5 in the patients with adenocarcinoma and 17.9 ± 5.6 in those with squamous cell carcinoma. Difference was not significant (P = 0.2). Relationship between SUVmax and tumor size was evaluated by taking all tumors into consideration. Statistically significant positive correlation (r = 0.4) was found for 51 tumors between tumor size and SUVmax (P = 0.002).
Histopathologically, 21 patients underwent evaluation for lymph nodes. When evaluated with histopathological results, FDG PET/CT was true negative in 9 patients, false-positive in 6, true-positive in 2, and false-negative in 4 patients. Distant metastasis could be detected only
xi
by PET/CT scanning in 14% (7/50) patients. PET/CT scanning changed therapeutic decisions detected based on conventional methods in 17/50 (34%) of all patients. In the present study, the relationship between SUVmax of the primary mass and survival was studied in 30 patients. Median SUVmax (15.6) was considered as cutoff value in these 30 patients. Survival was found as 10.3 ± 2.2 months for the patients with SUVmax < 15,6 and 15.9 ± 1.6 months in those with SUVmax ≥ 15,6. No statistically significant difference in survival was found between two groups (P = 0.118).
The present study concluded that PET/CT was an efficient method in diagnosis and staging of lung cancer by adding useful information to conventional methods. It was also observed that PET/CT scanning changed therapeutic plans in majority of the patients with the contribution it made. However, there was no statistically significant relationship between survival and SUVmax of the primary mass.
1
2.GİRİŞ
Akciğer kanseri, tüm dünyada kansere bağlı gerçekleşen ölümlerin en sık nedenidir. Hastalar genellikle geç evrelerde tanı almaktadır. Akciğer kanserinin tedavisinde hastalığın evresi, tümör tipi ve hastanın genel tıbbi durumuna göre yapılacak bir değerlendirme sonrası cerrahi müdahale, kemoterapi, radyoterapi veya bronş içi tedavi yöntemlerinden biri veya birkaçı birlikte uygulanabilmektedir. Akciğer kanseri ancak erken dönemde yakalanabilirse operasyon şansı olabilmektedir. Bu nedenle erken tanı ve evreleme büyük önem taşımaktadır. Tanı amacıyla ilk planda Toraks BT kullanılmaktadır. Toraks BT ile anatomik bilgiler elde edilirken fonksiyonel görüntülemede FDG PET/BT öne çıkmaktadır. FDG( Florodeoksiglukoz) bir glikoz analoğu olup F-18 ile işaretli FDG PET/BT ile vücut içerisindeki glikoz metabolizması görüntülenerek ölçülebilmektir. FDG PET/BT ile görüntüleme malign hücrelerin normal hücrelere oranla daha fazla glikoz kullanmaları esasına dayanmaktadır. PET/BT, akciğer kanseri tanı, evreleme, tedaviye yanıt değerlendirme, takipte nüks araştırılması ve yeniden evrelemede etkin bir yöntemdir. PET/BT’nin tüm vücut tarama özelliği sayesinde aynı anda hem T ve N, hem de M evreleme yapabilmektedir. Hastalığın doğru evrelendirilmesi ise doğru tedavi için şarttır. Özellikle konvansiyonel yöntemlerle saptanamayan uzak metastazı olan olgularda gereksiz operasyon önlenebilmektedir. Konvansiyonel evrelemeye PET/BT’nin eklenmesiyle hastaların yaklaşık 1/3’ünde evrelemenin değiştiği, bunlarında önemli bir kısmında hasta yönetiminin değiştiği birçok çalışmada belirtilmiştir (1).
Akciğer kanserinde sağkalım oranı oldukça düşük olup tüm evreler göz önünde bulundurulduğunda 5 yıllık yaşam süresi yaklaşık % 14’tür (2). Bu nedenle prognostik faktörlerin belirlenmesi de hasta yönetiminde önem taşımaktadır. Akciğer kanserinde en önemli prognostik faktör tümörün evresidir. Bunun dışında ek prognostik faktörleri araştırmaya yönelik çeşitli çalışmalar yapılmaktadır. PET/BT’de saptanan primer tümörün SUVmax değerinin prognoza ve ortalama sağkalıma etkisine dair literatürde çelişkili çalışmalar mevcut olup bu konuda daha detaylı araştırmalar gerekmektedir.
Biz retrospektif özellikteki çalışmamızda; akciğer kanseri tanı, evreleme ve tedavi yönetimine PET/BT’nin katkısını araştırmayı amaçladık. Ayrıca PET/BT’deki primer lezyonun SUVmax değerinin prognoza ve sağkalıma etkisini değerlendirdik.
2
3.GENEL BİLGİLER
3.1. Akciğerlerin Anatomisi
Akciğerler göğüs boşluğu içinde uzanmakta olup her iki hemitoraksta plevral yapraklar içerisinde yerleşmiştir. Akciğerler, orta mediastinumda yer alan, içinde kalbin de bulunduğu yapılarla birbirlerinden ayrılırlar. Bronşiyal ağaç ve alveoller dahil olmak üzere ana bronş ve distalinde bulunan solunum sisteminin tüm elemanları akciğerlerin içinde yer alır. Her akciğer göğüs boşluğunun şekline uyacak şekilde dört yüzeye sahiptir. Akciğerin mediastinal yüzünde pulmoner damar, sinir ve bronşların geçtiği hilum pulmonis denilen dikey bir yarık bulunur (3,5). Diyaframın dışbükey kubbesi üzerine uygun olarak akciğerin alt yüzeyi konkav olup basis pulmonis olarak adlandırılır. Akciğerin apex pulmonis denilen üst yüzeyi, klavikula seviyesinin üzerinde uzanır. Facies costalis, akciğerlerin en geniş yüzü olup kaburgaların iç yüzü ile temastadır. Sağ ve sol akciğer temelde benzer olmakla birlikte, aynı değillerdir. Sol akciğer sağa göre biraz daha küçük olup iç yüzü üzerinde kalbin oluşturduğu bir çukurluk (impressio cardiaca) vardır. Sağ akciğerde üç ve sol akciğerde iki lob bulunur (3). Her iki akciğer kendine ait bronşu, arteri ve veni olan segmentlere ayrılmıştır. Sağ akciğer on segment, sol akciğer ise dokuz segmentten oluşmaktadır (Şekil 1).
3 3.1.1. Plevra
Her iki akciğeri ayrı ayrı bir kese şeklinde saran çift katlı seröz bir zardır (3-5). Plevranın parietal yaprağı, göğüs kafesinin iç yüzü ile diyaframın çok büyük bir bölümünü örter ve mediastinumu yanlardan sınırlar. Plevranın visseral yaprağı ise akciğerlerin yüzeyi ile loblar arasındaki yüzleri örter. Aralarındaki kapiller aralığa cavitas pleuralis denmekte olup bu alan solunum sırasında kolaylık sağlayan sıvı içerir. Parietal ve visseral plevranın birbirine yaklaşarak oluşturdukları bölüme ligamentum pulmonale denilir. Bu ligament ise akciğerleri destekler (4,5).
3.1.2. Pulmoner Alveoller
Alveoller, akciğerlerin gaz alışverişinin meydana geldiği birimlerdir (3). Alveollerin duvarında tip I ve tip II alveolar hücreler bulunmakta olup tip II hücreler alveolların yüzey gerilimini azaltan bir fosfolipid olan sürfaktan sentezlerler (4,5).
3.1.3. Bronş Ağacı
Trakea, bifurcatio trachea’dan sonra iki ana bronşa ayrılır ve her ana bronş akciğer içine uzanır. Sağ ana bronş daha kalın ve daha dikey konumlu olduğundan yabancı partiküllerin bu bronşa kaçma olasılığı daha yüksektir. Ana bronşlar devam ettikçe lober ve segmental bronşları oluşturlar. Bronşiyal ağaç bronşiyoller denilen daha küçük tübüller şeklinde devam eder (3,5).
3.1.4. Akciğerlerin Lenfatik Drenajı Lenf Düğümleri
Toraksın viseral lenf düğümleri akciğerler, plevra ve mediastinumun lenfatik drenasyonunu sağlar. Bu lenf nodlarının lokalizasyonunun bilinmesi ile, hastalık varlığında tanı için ipuçları elde edilebilir (6). Akciğeri drene eden lenf nodulleri pulmoner ve mediastinal lenf nodları olmak üzere iki ana gruba ayrılır. Pulmoner lenf nodları, bronkopulmoner ve intrapulmoner lenf nodlarından oluşur (4,7,8,9,10). Akciğerin lenfatik drenajında önemli role sahip olan mediastinal lenf nodları ise, anatomik olarak 4 grupta incelenebilir. Bunlar; trakeobronşiyal, paratrakeal, ön mediastinal ve posterior mediastinal lenf nodlarıdır. Trakeobronşiyal ve paratrakeal lenf düğümleri akciğer ve bronşların büyük bölümünün lenfatik drenajını sağlar (4,5,6,11).
4 3.2. Akciğer Kanseri
3.2.1. Epidemiyoloji
Kanser tüm dünyada önemli bir sağlık sorunudur. Erkeklerde en yaygın görülen kanser türleri sırasıyla; akciğer kanseri, prostat kanseri, mesane kanseri ve kolorektal kanserler iken kadınlarda ise sırasıyla meme, akciğer ve kolorektal kanserlerdir. Dünyada genel olarak kanser vakalarının % 12,4’ünü akciğer kanseri oluşturmakta olup kanser nedeniyle gelişen ölümler arasında tüm dünyada her iki cinste ilk sırada yer almaktadır (12). Erkeklerde akciğer kanseri nedeniyle ölümler kadınlara göre daha fazla olmasına rağmen, aradaki fark kadınların sigara kullanımına bağlı olarak gittikçe azalmaktadır. Ayrıca bazı meslek çalışanlarında akciğer kanseri sıklığının artmış olduğu bildirilmiştir. Radon gazı ilk mesleki solunumsal karsinojen olarak tanımlanmıştır. Asbest yoğunluğu ve süresi ile ilişkili olarak akciğer kanseri gelişiminde rol alabilen bir karsinojen olarak belirtilmiştir (13).
3.2.2. Etiyoloji
Akciğer kanseri hemen her zaman çevresel maruziyetle ilişkili olmasına rağmen çevresel karsinojenlere karşı hassasiyet bireysel farklılık gösterebilmektedir. Hastalığın oluşumu, çevresel etiyolojik ajanlara maruziyetle bunlara karşı bireysel yatkınlığın etkileşimi ile ilişkilidir. Ayrıca sigara ve asbest gibi birden fazla faktörün bir arada bulunması, bir veya birden fazla çevresel etkenle beraber genetik yatkınlığın birlikteliği hastalığın ortaya çıkmasında sinerjistik etkiye neden olabilmektedir.
3.2.2.1. Sigara
Sigara içimi, akciğer kanseri vakalarının yaklaşık olarak %90’nından sorumludur. Sigara içenlerde akciğer kanseri riski hiç sigara içmemiş olanlara oranla 20 kat artmıştır. Bu risk günlük içilen sigara miktarı, sigara içme süresi ve sigaraya başlama yaşıyla bağlantılıdır (14). Field karsinojenezis teorisine göre, sigara dumanına maruz kalan bronş epitelinde birtakım yapısal değişiklikler meydana gelerek kanser oluşur. Bu değişiklikler sırasıyla; hiperplazi, metaplazi, displazi, karsinoma in-situ ve invaziv kanserdir(15).
3.2.2.2. Mesleki maruziyet
Mesleki maruziyete bağlı kanserler arasında akciğer kanseri en sık görülenidir. Özellikle katran ve is içeren ortamlarda çalışan isçilerde risk artmıştır. Arsenik, krom, nikel
5
gibi metallere mesleki maruziyet durumunda da artmış risk mevcuttur. Silika maruziyeti ile akciğer kanseri ilişkisi tartışmalı olmakla beraber bir meta-analizde iki kat risk artışına yol açtığı belirtilmiştir. Sigara içimi bazı mesleki akciğer karsinojenlerinin etkisini arttırmaktadır(16,17).
3.2.2.3. Asbest
Asbestin mesleki karsinojen olma etkisi güçlü kanıtlara dayanır. Asbest liflerinin inhalasyonu, akciğer kanseri gelişimine yol açabilmektedir.
3.2.2.4. Diğer etiyolojik faktörler • Radyasyon
• Beslenme • Hava kirliliği • Genetik duyarlılık
• Geçirilmiş akciğer hastalıkları 3.2.3. Patoloji
Akciğer kanserlerinin histopatolojik sınıflaması Dünya Sağlık Örgütü’nün (DSÖ) 2004 yılında önerdiği sınıflama sistemine dayanmaktadır (Tablo 1). Bu sınıflamaya göre akciğer kanserleri; malign epitelyal tümörler ve mezenkimal tümörler olmak üzere iki ana gruba ayrılmıştır. Adenokarsinom, skuamöz hücreli karsinom, küçük hücreli karsinom ve büyük hücreli karsinom en sık görülen akciğer kanseri tipleridir. Akciğer kanserinin hücre tipi hem tedavi hem prognoz ile ilişkilidir.
6
Tablo 1.Dünya Sağlık Örgütü’nün (DSÖ) 2004 yılında önerdiği akciğer kanseri histopatolojik sınıflaması
3.2.3.1. Skuamöz Hücreli Karsinom
Ülkemizde bronkojenik karsinomlar arasında en sık görülen karsinom türü skuamöz hücreli karsinomdur (18). Genellikle, büyük bronşların mukozası kaynaklıdırlar. Sıklıkla hasarlı epitel veya displazi odağıyla yakın ilişkilidirler. Çoğu olguda tümör proksimal veya hiler lezyon olarak saptanmakta olup erken dönemde metastaz yapması genelde beklenmez. Büyük hacimli, bronş içinde granüler veya polipoid lezyon şeklinde obstrüksiyon yapmaya meyilli, genelde kıkırdağı ve ona komşu lenf nodlarını invaze eden tümörlerdir.
7 3.2.3.2. Büyük Hücreli Karsinom
Büyük hücreli karsinomlar tüm bronkojenik karsinomların yaklaşık %10'unu oluşturmaktadır. İndiferansiye karsinom olarak da adlandırılan, hücresel farklılaşma göstermeyen bu tümörlerde bazen kesin tanı konulamaz. Tümör genelde büyük hacimli olup iyi sınırlı nekrotik kitleler oluşturur. Ayrıca çoğunlukla subplevral yerleşimli olup yaklaşık %60'ı periferik akciğer dokusundan kaynaklanır. Büyük hücreli karsinomlar genellikle lokal invazyon ve yaygın metastaz yapma eğilimindedir. Olguların yaklaşık %50'sinde beyin metastazı saptanır.
3.2.3.3. Küçük Hücreli Karsinom
Küçük hücreli karsinomlar trakeobronşiyal ağacın herhangi bir bölümünden kaynaklanmakta olup %75-80'i santral yerleşimlidir. Tümör genelde submukozayı invaze eder ve semptom vermeden önce vasküler yapılar, mediastinal lenf nodları ve yumuşak dokulara yayılım gösterir. Skuamöz hücreli karsinomlarda görülen bronş içi obstrüksiyona neden olan lezyonun aksine, dış basıya sebep olan submukozal ya da lenf nodu yayılımı daha sık izlenir. Olguların %70’inde tanı anında tümör toraks dışına yayılım göstermiştir. Toraksa sınırlı tümörlerde kemoterapi ve radyoterapi ile olguların %50'sinden fazlasında tam yanıt görülebilir. Bu olguların da yaklaşık %30'unda 2 yıla kadar uzayan remisyon izlenebilmektedir. En sık görülen uzak metastaz alanları sırasıyla; kemik, karaciğer, kemik iliği, beyin ve ekstratorasik lenf nodlarıdır.
3.2.3.4. Adenokarsinom
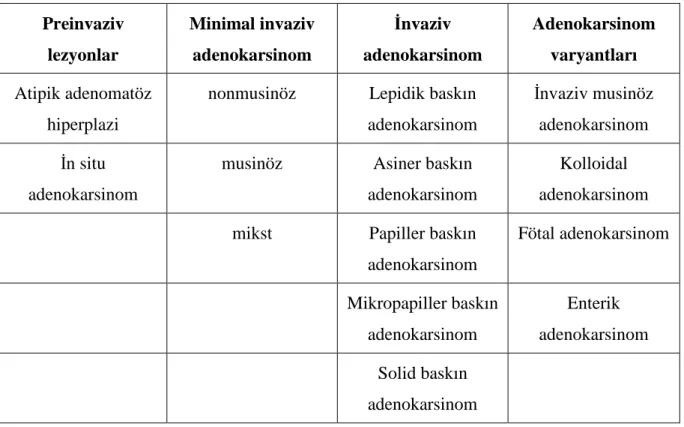
Adenokarsinom akciğer kanserinin dünyada en sık, ülkemizde ise 2. sıklıkta görülen subtipidir. Adenokarsinomların %55-60’ı periferik akciğer dokusundaki glanduler yapılardan köken alırlar. Periferik adenokarsinomlar subplevral yerleşimli, düzgün sınırlı ve merkezinde pigmente, fibrotik odak bulunan tümoral yapılardır. Adenokarsinomlar en sık karaciğer, adrenal bezler, kemik ve merkezi sinir sistemine metastaz yapmaktadır. Olguların %50'sinden fazlasında otopsi ile saptanan beyin metastazı saptanmaktadır. %12 olguda ise tek başına beyin metastazı görülür. 2011 yılında Journal of Thoracic Oncology dergisinde yayımlanan bir makalede Uluslararası akciğer kanser araştırma birliği/ Amerikan Toraks Derneği ve Avrupa Solunum derneklerinden (IASLC/ATS/ERS) multidisipliner bir uzman grubu tarafından akciğer adenokarsinomları için yeni bir sınıflama önerisi getirilmiştir (19). Yeni akciğer adenokarsinom sınıflandırması Tablo 2’de yer almaktadır. Yeniliklerden bir tanesi
8
bronkoalveoler adenokarsinom (BAK) teriminin oldukça geniş bir tümör grubunu kapsamı içine alması nedeniyle artık kullanılmamasıdır. Eski adıyla bronkoalveoler karsinom; Adenokarsinoma in situ (AIS), minimal invaziv adenokarsinom (MIA), lepidik baskın adenokarsinom (nonmusinöz), lepidik komponent içeren invaziv adenokarsinom ve invaziv müsinöz adenokarsinom (eski adıyla musinöz bronkoalveoler karsinom) olmak üzere beş gruba ayrılmıştır. Yeni adlandırmalar kullanıldığında beraberinde parantez içinde (eski adıyla bronkoalveoler karsinom) olarak belirtilmesi önerilmektedir (Tablo 3)(19). Daha önce, 1999/2004 DSÖ sınıflandırmasında da “mikst subtip” terimi kullanılmıştır. Yeni sınıflandırmada histolojik paternlerin semikantitatif %5’lik dilimler halinde değerlendirilmesi ile tek bir predominant pattern seçilerek kapsamlı bir histolojik subtipleme yapılması görüşü ifade edilmektedir. Böylece her bir tümör hem predominant patternine göre sınıflandırılmakta hem de subtipler yüzdelerine göre bildirilebilmektedir. Başlıca histolojik patternler; lepidik, asiner, papiller, mikropapiller ve solid patterndir.
- lepidik (alveol duvar yüzeyi boyunca tip II pnömositlerin ve klara hücrelerinin proliferasyonu)
- asiner (fibroz stromayı invaze eden yuvarlak-oval şekilli malign glandüler hücreler) - papiller (fibrovasküler merkezlerin yüzeyinde büyüyen malign kübik-kolumnar tümör hücreleri)
- mikropapiller (hava boşlukları içinde küçük papiller kümeler halinde çoğalan ve fibrovasküler merkezleri bulunmayan salgısal hücreler)
- solid (bariz nukleolusları olan çoğunlukla veziküler nükleuslu bol stoplazmalı tabakalar halinde çoğalan tümör hücreleri)
Semikantitatif açıklamalı subtiplemenin bir avantajı da multipl primer tümörün intrapulmoner metastazlardan ayırt edilmesini sağlamasıdır. Bu subtipleme multipl tümörü daha net bir şekilde kıyaslama olanağı vermekte olup evrelemede önemli bir üstünlük sağlamaktadır. Örneğin erken evre hastalıkta mikropapiller patternin saptanması, kötü prognoz belirtisi olması nedeniyle özellikle önemlidir. Yeni akciğer adenokarsinom sınıflandırması ile tümörün spesifik özelliklerinin saptanması sayesinde hastaların tedavisine önemli katkılar sağlanacağı düşünülmektedir.
9
Tablo 2. Uluslararası Akciğer Kanseri Çalışma Derneği (IASLC), Amerikan Toraks Derneği (ATS) ve Avrupa Solunum Derneği (ERS)- Rezeke edilen spesmenlerde akciğer adenokarsinom sınıflaması Preinvaziv lezyonlar Minimal invaziv adenokarsinom İnvaziv adenokarsinom Adenokarsinom varyantları Atipik adenomatöz hiperplazi
nonmusinöz Lepidik baskın adenokarsinom
İnvaziv musinöz adenokarsinom İn situ
adenokarsinom
musinöz Asiner baskın adenokarsinom
Kolloidal adenokarsinom mikst Papiller baskın
adenokarsinom Fötal adenokarsinom Mikropapiller baskın adenokarsinom Enterik adenokarsinom Solid baskın adenokarsinom
Tablo 3. Uluslararası Akciğer Kanseri Çalışma Derneği, Amerikan Toraks Derneği ve Avrupa Solunum Derneği çalışma gruplarının sunduğu daha önce bronkoalveolar karsinom olarak sınıflandırılan yeni adenokarsinom kategorileri
Adenokarsinoma in situ
Minimal invaziv adenokarsinom
Lepidik baskın adenokarsinom (nonmusinöz)
Lepidik komponent içeren invaziv adenokarsinom
10 3.2.4. Klinik
Akciğer kanserli hastaların %90’ından fazlasında semptom mevcuttur. Bu hastaların ise %27’sinde primer tümör ilişkili semptomlar görülür. Olguların %34’ünde halsizlik, anoreksi ve kilo kaybı gibi nonspesifik semptomlar mevcut olmakla birlikte semptomatik hastaların %32’si ise metastaza bağlı belirtiler sebebi ile başvurur (20,21). Eşlik eden hastalıklar, erken dönemde nonspesifik semptomların görülmesi ve sağlam kişilerde dahi görülebilen belirtiler nedeniyle tanıda ilk planda akciğer kanseri düşünülmeyebilir. Akciğer kanserinde görülen başvuru semptomlarının nedenleri ve sıklığı Tablo 4’de özetlenmiştir (21).
Tablo 4. Akciğer kanserinde görülen başvuru semptomlarının sıklığı ve nedenleri (21)
3.2.5. Evreleme
Akciğer kanserli hastaların tanı sırasındaki evresiyle uygulanacak tedavi seçimi ve prognoz yakından ilişkili olup en önemli prognostik faktör tümörün evresidir. Akciğer kanseri evrelemesinde IASLC (Uluslararası Akciğer Kanseri Çalışma Derneği) tarafından geliştirilen TNM (T: primer tümör, N: bölgesel lenf bezi, M: uzak metastaz) evreleme sistemi kullanılır.
11
12 T Evrelemede Özel Durumlar
• Direkt visseral plevra invazyonu T2 iken, malign sıvı olmadan parietal plevra invazyonu T3 olarak evrelendirilir. Primer tümörün komşuluğunda bulunmayan paryetal ya da visseral plevradaki tümöral lezyonlar T4 kabul edilir.
• Mediastinal organ tutulumu olmadan sınırlı düzeyde sadece mediastinal plevra ve yağ doku invazyonu olması T3 olarak tanımlanır.
• Nervus vagus dallandıktan sonra rekürren laringeal sinirin direkt invazyonu T3 iken, aortikopulmoner penceredeki lenf bezi invazyonuna bağlı bu sinirin tutulumu T4 olarak değerlendirilir.
• Perikard içerisinde pulmoner arter ve ven invazyonu T4, perikard dışında invazyonu ise T3 olarak evrelendirilir.
• Diyaframa ve toraks duvarına direkt invazyon T3, tümör komşuluğu bulunmayan tutulumlar ise M1 olarak tanımlanır.
• Sempatik gangliyon invazyonu bulunan superior sulkus tümörleri (Horner sendromu dahil) T3, brakiyal pleksusun geniş bir şekilde tutulumundan kaynaklanan Pancoast sendromu (C8-T1 düzeyinde ağrı ve el ve parmak kaslarında atrofi, Horner sendromu) ise T4 olarak değerlendirilir.
• Batın organlarına direkt tümöral invazyon T4 olarak tanımlanır.
• Vertebraya komşu tümörlerde vertebra korpusu ya da kostotransvers foramen invazyonu T4, radyolojik olarak vertebrada tümöre bağlı erozyon gösterilemeyip sadece çevre yumusak doku tutulumu (plevra, prevertebral fasya veya periost) varsa tümör T3 olarak değerlendirilir. Ancak cerrahi ile periost invazyonu kanıtlanırsa patolojik olarak lezyon T4 olarak evrelendirilir.
• Senkron tümörler birbirlerinden bağımsız olarak evrelendirilir.
• Frenik sinir invazyonu mediastene derin invazyon olmadan gerçekleşirse tümör T3 olarak değerlendirilir.
13 Lenf Nodu İstasyonu Anatomik Sınıflama;
Akciğer kanseri evrelemesinde tedavi seçeneğini belirlemede patolojik lenf nodu varlığı/yokluğu göz önüne alınan önemli bir faktördür. En güncel TNM evreleme sistemi olan 7. edisyonun önerisine göre lenf nodu istasyonları 6 zona ayrılmaktadır (Tablo 6) (23, 24).
1. Üst zon: (Düzey 1- 4)
2. Aortikopulmoner zon (AP zon): (Düzey 5 ve 6) 3. Subkarinal zon: (Düzey 7)
4. Alt zon: (Düzey 8 ve 9) 5. Hiler zon: (Düzey 10 ve 11) 6. Periferal zon: (Düzey 12-14)
Akciğer kanseri evrelemesini yapabilmek için metastatik lenf nodunun lokalizasyonu tespit edilmelidir. Bu nedenle, torakotomi öncesi görüntüleme yöntemleri ile transbronşial iğne biyopsisi, USG eşliğinde transözefagial iğne biyopsisi, transtorasik iğne biyopsisi, VATS ve mediastinoskopi gibi tanı yöntemleri kullanılmaktadır.
14 Lenf Nodları (N)
1- Alt servikal, supraklavikular, sternal çentik: Brakiosefalik venin üst sınırının trakeanın orta hattını çaprazladığı noktadan geçen horizontal doğrunun üstünde kalan lenf nodları.
2- Üst paratrakeal: Aort kavsi üst kenarından geçen horizontal doğru ile bir numaralı alan arasında kalan lenf nodları.
3- Prevasküler/retrotrakeal: Büyük damarların önünde veya trakeanın arkasındaki orta hat lenf nodları olup tümör ile aynı taraflı olduğu kabul edilir.
4- Alt paratrakeal: Sağ tarafta, trakea orta hattının sağında, aort kavsinin üst kenarından geçen doğrunun altından, üst lob bronşunun en üst kenarı hizasına kadar uzanan ve ana bronşu da kapsayan alanda yer alan, mediastinal plevra içinde kalan lenf bezleri. Sol tarafta ise, trakea orta hattının solunda, aynı üst ve alt sınırlar içinde kalan, ligamentum arteriyozumun sağındaki alanda yer alan ve mediastinal plevra içinde kalan lenf nodları.
5- Subaortik: Ligamentum arteriyozum, aorta ya da sol pulmoner arterin lateralinde yer alan ve sol pulmoner arterin ilk dalının proksimalinde kalan, mediastinal plevra içinde yer alan lenf nodları.
6- Paraaortik: Çıkan aortanın ve aort kavsinin ya da innominant arterin önünde ve yanında yer alan, üstte aort kavsinin üst sınırından geçen yatay eksenin altında kalan lenf nodları.
7- Subkarinal: Karinanın alt seviyesinde yer alan lenf nodları. 8- Paraözefagial: Özefagusa komşu lenf nodları.
9- Pulmoner ligament: Pulmoner ligamentin içinde kalan lenf nodları.
10- Hiler: Mediastinal plevranın distali ile lober bronş ayrımı arasında yer alan proksimal lober lenf nodları.
11- Interlober: Lober bronşlar arasında kalan lenf nodları. 12- Lober: Lober bronşların distalindeki lenf nodları. 13- Segmental: Segmental bronşlara komşu lenf nodları.
15 Şekil 2. Lenf nodu istasyonları
Uzak Metastaz (M) Evrelemesi
TNM evreleme sistemi 7. edisyonda M1 kategorisi M1a ve M1b olarak iki gruba ayrılmıştır (Tablo 5). Akciğer ve/veya plevra dışındaki uzak metastazlar M1b olarak sınıflandırılmaktadır. M1a kategorisi ise a) plevral nodüller b) kontralateral lobtaki nodül(ler) c) malign plevral veya perikardial efüzyon gibi durumları içermektedir. Beş yıllık sağkalım süreleri; plevral tutulumu olan hastalarda %6, kontralateral akciğere metastazı olan hastalarda %3 ve uzak metastazı olan hastalarda %1 olarak saptanmıştır.
Akciğer kanserinde tedavi seçimi ve prognoz tahmini açısından benzer klinik özellikler gösteren TNM kümeleri 7 evre grubunda toplanır. Belirlenemeyen kanser (TXN0M0) için evreleme anlamlı değildir. Uygulanan yöntem bir harf ile gösterilerek TNM evrelendirme sisteminde belirtilebilir (klinik [c], cerrahi [s], patolojik [p], tedavi sonrası yeniden evreleme [r], otopsi evrelemesi [a];örn: sEvreIIA).
16
Tablo 7. TNM sınıflamasına göre akciğer kanserinde evreleme (22)
Evre 0: TisN0M0
Karsinoma in situ hastalarını tanımlar. Evre IA: T1N0M0
Nodal veya uzak metastazı bulunmayan, lober bronşlardan daha proksimalde invazyonu olmayan 3 cm’den küçük çaplı tümörleri kapsar. Prognoz bu hastalarda diğer evre gruplarına göre çok daha iyidir.
Evre IB: T2N0M0
T2 tümör dışı nodal veya uzak metastaz bulunmayan hastalardır. Evre IIA: T1N1M0
Küçük boyutlu primer tümör ile hiler veya intrapulmoner lenf bezi metastazı birlikteliğini tanımlar. Konvansiyonel görüntüleme yöntemleri ile Evre IIA tanısı sıklıkla konulamaz. Cerrahi uygulanan diğer evrelerdeki hastalarda pEvreleme EvreIIA’ya dönüşebilmektedir. Evre IIB: T2N1M0, T3N0M0
17
Benzer sağkalım oranlarına sahip olan iki anatomik tümör yayılım tipini temsil eder; intrapulmoner ve/veya hiler lenfatik metastazı bulunan T2 tümör ile nodal ya da uzak yayılımı olmayan ancak lokal invaziv T3 tümörü kapsar.
Evre IIIA: T3N1M0, T1N2M0, T2N2M0, T3N2M0
Aynı taraf mediasten yayılımı gösteren ancak yaşamsal organlarda invazyon bulgusu ya da uzak metastazı olmayan tümöral yayılım tiplerini içerir.
Evre IIIB: T4N0M0, T4N1M0, T4N2M0, T4N3M0, T1N3M0, T2N3M0, T3N3M0
Uzak metastazı bulunmayan tüm T4 tümörler ve/veya tüm N3 lenf nodu metastazı bulunan tümörleri belirler.
Evre IV: Herhangi bir T, Herhangi bir N, M1
Uzak metastaz varlığını tanımlar. Primer tümör ile aynı akciğerde fakat farklı lobdaki malign nodül varlığı veya aksiller, abdominal ya da inguinal lenfatik istasyonlardaki metastaz M1 olarak değerlendirilir.
18
19
3.2.6. Akciğer Kanser Tanı Ve Metastaz Tarama Yöntemleri
Posterior Anterior ve Lateral Akciğer Grafisi Bilgisayarlı Tomografi Bronkoskopi -Transtorasik İnce İğne Aspirasyonu - Plevral Sıvı Aspirasyonu/Plevral Biyopsi- Endobronşiyal Ultrasonografi - Video Eşliğinde Torakoskopi - Mediastinoskopi ve/veya Anterior Mediastinotomi - Lenf Bezi Biyopsisi - Torakotomi - Beyin Manyetik Rezonans/Bilgisayarlı Tomografi - Tüm Vücut Kemik Sintigrafisi - Pozitron Emisyon Tomografisi/Bilgisayarlı Tomografi
3.2.6.1. PA(Posterior Anterior) ve Lateral Akciğer Grafileri
Plevral sıvı, hiler-mediastinal genişleme, diyafragma yüksekliği, konsolidasyon, atelektazi ve nodül-kitle gibi lezyonlar ve bulgular saptanabilir.
3.2.6.2. Bilgisayarlı Tomografi (BT)
BT tümör çapının ve mediasten tutulumunun belirlenebilmesi için değerli bir tanı yöntemidir. Toraks BT'de tümörün trakea, karina, mediasten, kalp, büyük damarlar, özefagus ve göğüs duvarı ile ilişkisi değerlendirilir. Bu alanların tutulup tutulmamasına bağlı olarak evre belirlenir ve tümör rezektabilitesine karar verilir (25). Toraks BT'de kısa aksı 1 cm'den büyük olan mediastinal lenf bezleri patolojik kabul edilmekle birlikte bu bulgunun yanlış pozitif olma oranı nispeten yüksektir (%30) (26,27). Surrenal bez ve karaciğer metastazları da üst abdomen BT ile değerlendirilir (28).
3.2.6.3. Beyin Manyetik Rezonans Görüntüleme (MRG)
Beyin metastazlarını saptamada BT ve/veya MRG standart görüntüleme yöntemleri olup beyin MRG’ın duyarlılığı beyin BT’den yüksektir (21, 29).
3.2.6.4. Bronkoskopi
Akciğer kanser kuşkulu hastalarda tanı, evreleme, tedavi seçimi ve tedaviyi takip etmekte kullanılmaktadır. Akciğer kanserlerinde bronkoskopik olarak endobronşiyal, submukozal ve peribronşiyal tümör görünümleri olabilir. Bronkoskopi ile saptanan lezyon tipine göre bronş biyopsisi, transbronşiyal biyopsi (TBB), bronşiyal fırçalama, bronş lavajı, transbronşiyal iğne aspirasyonu (TBİA) ve bronkoalveoler lavaj (BAL) yapılmaktadır (30).
20
3.2.6.5. Transtorasik İnce İğne Aspirasyon Biyopsisi (TTİİAB)
USG veya BT eşliğinde perkütan olarak uygulanmaktadır. Akciğerlerde malignite kuşkulu nodül, kitle ve konsolidasyon oluşturan lezyonların tanısı ile mediasten kitlelerinin tanısında kullanılmaktadır (31).
3.2.6.6. Plevral Sıvı Aspirasyonu/Plevral Biyopsi
Plevral sıvının sitolojik incelemesinin tanı değeri %60-75'tir. Adenokarsinomlarda diğer tip tümörlere göre sitolojik tanı oranı daha yüksektir. Kapalı plevral biyopsinin tanı etkinliği ise %40-70' dir. Birlikte uygulandığında tanı değeri sınırlı oranda artabilmektedir (32).
3.2.6.7. Mediastinoskopi ve/veya Anterior Mediastinotomi
Mediastinoskopi trakea, karina, vena cava süperior komşuluğundaki lezyonların tanısı, üst ve alt paratrakeal, pretrakeal, hiler, subkarinal, supraaortik lenf bezlerinin preoperatif evrelemesi amacıyla yapılmaktadır. Anterior mediastinotomi, anterior mediasten tümörleri ve özellikle aortikopulmoner pencerede mevcut lenf bezlerinin incelemelerinde uygulanmaktadır (31). Endobronşial ultrasonografi uygulamaları sonrası, kullanımında ciddi gereksinim azalması olmuştur (33).
3.2.6.8. Endobronşiyal Ultrasonografi (EBUS)
Endobronşiyal ultrasonografi (EBUS), hava yolu duvarının ve hava yoluna komşu yapıların daha iyi değerlendirilmesini sağlayan, özellikle mediastinal lenf nodları örneklemesinde tanısal değeri konvansiyonel bronkoskopiye oranla daha fazla olan bir ultrason yöntemidir. Konvansiyonel bronkoskopide, bronkoskopist ancak havayollarının iç yüzeyini ve lümenini görebilirken endobronşiyal ultrason sayesinde trakeobronşiyal duvarı ve etrafındaki 4 cm derinliğe kadar olan yapıları gözlemleyebilir. Bronkoskopun işlem kanalına sığabilecek boyutta geliştirilmiş ultrasonik problar yardımı ile damar ve kitle gibi peribronşiyal yapılar değerlendirilebilir, lezyonun yeri net olarak saptanıp, daha güvenli ve uygun örnekler alınabilir.
EBUS sayesinde, kanser evrelemesi veya sarkoidoz, lenfoma gibi hastalıkların tanısı, mediastinoskopi gibi daha invazif işlemlere gerek duyulmadan konulabilmekte, periferik intrapulmoner nodüller VATS’a gerek kalmadan EBUS’la örneklenebilmektedir. Minimal invazif olması, hastanın işlemler için yatışının gerekli olmaması, sadece lokal anestezi ve
21
sedasyonla işlemin gerçekleştirilebiliyor olması ve tanı oranının yüksek olması diğer avantajları iken, subaortik ve paraözofageal lenf nodlarının örneklenememesi, çok yaygın olmaması, işlemde sadece küçük iğnelerin kullanılıyor olmasından mikrometastazların atlanabilmesi ise dezavantajlarıdır. Bronkoskopide ve TBİA’nda karşılaşılabilecek komplikasyonlar dışında EBUS’a spesifik komplikasyon bildirilmemiştir. Konvansiyonel TBİA ile %40-70 olan tanı oranı, EBUS’un kullanımıyla %85-95’e yükselmiştir.
3.2.6.9. Video Eşliğinde Torakoskopi (VATS)
VATS yöntemiyle mediastinoskopi ile ulaşılan mediastinal lenf nodlarına ulaşabilmektedir. Ancak mediastinoskopi, VATS ile kıyaslandığında daha basit ve hızlı bir yöntemdir. Bu nedenle VATS, mediastinoskopinin yerini alamamıştır. Bununla birlikte standart servikal mediastinoskopi ile subaortik, paraaortik, paraözofageal ve inferior ligamenter lenf nodlarına ulaşılamaz. VATS ile bu alanlardaki lenf nodlarına ulaşılarak biyopsi almak mümkündür. VATS’ın bu alanların örneklenmesinde başarılı olduğu gösterilmiştir. Landrenau toraks BT görüntülerinde, aortopulmoner pencere, subkarinal bölge ve periazygos alanında büyümüş lenf bezi bulunan hastalarda VATS’ın lenfatik metastaz saptamada duyarlılık ve özgüllüğünü %100 bulmuştur (34). Bu nedenle invaziv evreleme gerektiğinde VATS, mediastinoskopiyi tamamlayacak mükemmel bir yöntemdir. Paraözofageal ve inferior ligamenter lenf nodlarından örnek almada VATS, elimizdeki tek invaziv seçenek gibi görünmektedir. Paraaortik ve subaortik lenf bezlerinden örnek almak için kullanılabilecek diğer invaziv alternatif yöntemler ise mediastinotomi (Chamberlain prosedürü) ve extended servikal mediastinoskopidir. Extended mediastinoskopinin inme gibi ciddi komplikasyon riski taşıması sebebiyle VATS bu yönteme tercih edilebilir. Mediastinotomiyle karşılaştırıldığında ise VATS ile aortopulmoner pencere dışı lenf nodlarına (7,8,9,10 numara) da ulaşılabilmesi, kot rezeksiyonuna ihtiyaç duyulmaması ve ayrıca plevranın da metastaz açısından inspekte edilebilmesi gibi avantajlar mevcuttur. VATS, akciğer kanserinin evrelemesinde diğer yöntemleri tamamlayacak bir yaklaşım olarak, yüksek tanısal doğruluk oranıyla kullanılabilir.
3.2.6.10. Lenf Bezi Biyopsisi
Supraklavikuler bölge ve servikal bölge gibi lokalizasyonlarda palpabl lenf nodu varlığında yapılır.
22 3.2.6.11. Torakotomi
Tanı gereken durumlarda nadiren direkt torakotomi yapılır. Erken saptanan olgularda, diğer yöntemlerle tanı konulmadığı durumlarda, rezeksiyon şansı da varsa hasta doğrudan torakotomiye verilebilir (31).
3.2.6.12. Tüm Vücut Kemik Sintigrafisi
Kemik sintigrafisi, aksiyel ve uzun kemiklerin anterior ve posterior planar imajlanması ile erken metabolik değişiklikleri gösteren bir yöntemdir. Duyarlılığının yüksek, radyasyon riskinin ise nispeten düşük olması nedeniyle klinik açıdan avantajlı bir yöntem olmasının yanı sıra özgüllüğü düşüktür (35).
3.2.6.13. F-18 FDG PET/BT
PET insan vücuduna verilen pozitron yayıcı radyonüklidlerin dağılımını üç boyutlu (tomografik) olarak görüntüleyen tanısal bir nükleer tıp yöntemidir. Bu görüntüleme yöntemi pek çok patofizyolojik durumda, erken dönemde henüz yapısal bozukluklar gelişmeden meydana gelen metabolik ve biyokimyasal değişiklikleri göstererek erken tanıyı mümkün kılar. PET anatomik görüntüleme yöntemlerinin bir alternatifi olmayıp çoğunlukla onları tamamlayıcı fonksiyonel bilgiler sağlayan bir yöntemdir (36) .
3.2.6.13.1. PET’in Tarihçesi
Bin dokuz yüz doksanlı yıllarda F-18 fluorodeoksiglukoz (FDG) ile yapılan PET uygulamalarının onkolojide önem kazanmasıyla PET yöntemine olan ilgi artmış ve buna bağlı olarak PET kamera teknolojisinde önemli gelişmeler meydana gelmiş olup maliyetler azalmıştır. Ülkemizde ise ilk kez 2000 yılında kullanılmaya başlanmıştır.
3.2.6.13.2. PET Görüntüleme
PET tarayıcı veya PET kamera adı verilen sistemlerle hastaya intravenöz olarak uygulanan radyofarmasötiğin dağılımı belirlenir. PET cihazları, yatar pozisyondayken hastanın içinden geçebileceği bir boşluk ve bunun çevresinde hasta vücudundan gelen radyoaktif ışınları tespit eden bir gantri ünitesi ile gelen bilgilerin aktarıldığı bilgisayar ünitesinden oluşur (37).
23
Flor (F)-18, Karbon (C)-11, Nitrojen (N)-13 ve Oksijen (O)-15 PET görüntülemesinde en çok kullanılan pozitron (β+) yayıcı radyonüklidlerdir. Vücut içerisine verilen bu radyonüklidlerden ortama yayılan pozitronlar karşılarına çıkan bir elektron ile çarpışarak yok olurlar ve enerjiye dönüşerek birbirine zıt yönde hareket eden 511 keV sabit enerjide iki gama (γ) ışını meydana gelir (Anhilasyon, pozitron yok olması ya da çift oluşumu). Oluşan yüksek enerjili foton çiftleri eş zamanlı “koinsidans” deteksiyon yapabilen PET kameraları tarafından algılanarak görüntüye çevrilirler. PET kamera sistemiyle hasta vücudundan gelen sinyallerin tespiti ile oluşturulan ‘emisyon görüntüleme’ ve hasta vücudundan gelen fotonların değişik doku katmanlarından geçerken kaybettiği enerji hesaplanarak elde edilen ‘transmisyon görüntüleme’ yapılmaktadır. Eski sistem PET kameralarında transmisyon görüntüleme detektör içerisine yerleştirilen ve gama ışınımı yapan radyoaktif kaynaklar vasıtasıyla yapılırdı. Günümüzde sadece PET görüntüleme sistemini barındıran cihazlar üretimden kalkmış olup, hybrid görüntüleme sistemi olan PET/BT kamera sistemi kullanılmaktadır. PET/BT kameralarında ise transmisyon görüntülemede radyoaktif kaynak yerine X-ışın hüzmesi kullanılmaktadır. X-ışını ile yapılan transmisyon sonucu PET görüntülemeyle eş zamanlı ve eş pozisyonlu konvansiyonel BT görüntüleri de elde edilir. Eşdeğer PET ve BT kesitlerinin üst üste çakıştırılması ile “PET-BT füzyon” görüntüleri oluşturulur. Kombine PET/BT olarak da adlandırılan bu sistemlerde emisyon görüntülerindeki atenüasyon düzeltme işleminin doğruluğu artarken, aynı zamanda ve aynı pozisyonda yüksek rezolüsyonlu morfolojik (BT) görüntüleme de yapılmış olur. BT görüntülerinin elde edilmesiyle PET görüntülerinde izlenen lezyonların lokalizasyonu çok daha etkin bir biçimde belirlenebilmekte ve dolayısıyla tanısal doğruluk oranı artmaktadır. Ayrıca bu sistemlerde transmisyon süresi çok kısaldığından toplam görüntüleme süresi konvansiyonel PET kameralara göre belirgin olarak azalmaktadır. Böylece çok daha kısa zamanda daha etkin atenüasyon düzeltme işlemi yapılabilirken aynı anda X-ışın transmisyon tomografi (BT) görüntülemesi yapılmış olmaktadır.
F–18 ile işaretli fluoro–2-deoksi-D-glikoz (FDG) bileşiği rutin klinik uygulamalarda en sık kullanılan PET radyofarmasötiğidir. FDG bir glikoz analogu olup glikoz membran taşıyıcı proteinler (GLUT 1-4) aracılığıyla hücre içine alınır ve hücre içerisinde heksokinaz enzimi ile fosforile edilerek FDG–6-fosfat’a dönüştürülür. FDG–6-fosfat ise daha sonraki aşama olan izomeraz enzimi için substrat olmadığından katabolize edilemez ve hücre içinde retansiyon gösterir. Malign hücrelerde artmış FDG tutulumu, artan hipoksi sonucu glikolizin artması ve glikoz membran taşıyıcı proteinler (özellikle GLUT–1) ile hekzokinaz enzim miktarının
24
artmasına bağlıdır. Ayrıca malign hücrelerde glikoz–6-fosfataz enzim aktivitesinin düşük olması nedeniyle FDG–6-fosfat defosforile edilerek yıkılamaz ve neticede tümör hücresi içerisinde birikir. Hücre içerisinde biriken FDG–6-fosfattan ortama yayılan pozitronların oluşturduğu anhilasyon fotonları aracılığıyla da artan glikoz metabolizması izlenebilir. Bununla birlikte glikoz kullanımının artması maligniteye özgü değildir. Malign olmayan birçok tümör, aktif granülomatöz hastalıklar, enfeksiyöz/enflamatuar reaksiyonlar ve iyileşen kırıklarda yoğun FDG tutulumu görülebilir. Ayrıca normalde gri korteks çok glikoz kullandığı için beyin yoğun FDG tutulumuna sahiptir. Bunun dışında kalp ve üriner sistem en bariz aktivite tutan yerler olup miyokard dokusundaki tutuluş tokluk durumunda belirginleşir. Mediasten kan havuzu aktivitesinden ötürü her zaman gözükür. Akciğerlerde FDG tutuluşu çok düşüktür. Karaciğer, dalak ve böbrek aktiviteleri kan havuzundan daha fazladır ve kolayca ayırt edilebilirler. Sindirim kanalında (özellikle sağ hemikolonda) değişik seviyelerde fizyolojik FDG tutulumu görülebilir. İskelet kasları aktivasyon durumunda yoğun FDG tutuluşu gösterir. Baş-boyun bölgesinde dil kökü, tonsiller, tükrük bezleri ve lenfoid doku kısmen yoğun FDG tutar. Larenks kasları ise özellikle uptake fazında konuşan hastalarda belirgin olarak FDG tutulumuna sahip izlenir.
Güncel FDG-PET/BT çalışmalarının büyük bir çoğunluğunu onkolojik uygulamalar oluşturmakta olup bu endikasyonla yapılan bir PET/BT görüntülemesinde önce bir topogram, ardından BT ve hemen sonrasında da PET görüntüleri alınır. Daha sonra elde edilen BT ve PET görüntüleri bilgisayarda birleştirilerek lezyonların kesin lokalizasyonu sağlanmış olur. Onkolojik amaçla yapılan PET uygulamalarında verteksten uyluk üst kısma kadar olan alan tarama için genellikle yeterli kabul edilmekte olup tüm vücut görüntüleme olarak geçmektedir. Beyin görüntüleme bazı merkezlerde rutin tarama alanına dahil edilmemektedir. Bunun nedeni beyin gri korteksindeki fizyolojik yoğun FDG tutulumdan dolayı beyin metastazlarının gösterilmesinde FDG-PET’in duyarlılığının düşük olmasıdır. Malign melanom gibi bazı tümörlerde ve klinik şüphe varlığında ise beyin ve alt ekstremiteler de tarama alanına dahil edilmekte ve gerçek tüm vücut görüntüleme olarak tanımlanmaktadır.
PET/BT görüntüleri görsel ve yarı nicel değerlendirme yapılarak yorumlanmaktadır. Görsel değerlendirmede normal anatomi ya da fizyoloji ile uyumlu olmayan “artmış” FDG tutulumları patolojik olarak kabul edilmektedir. Hastanın öyküsü ve morfolojik görüntüleme bulguları eşliğinde şüpheli alanlar daha dikkatli bir şekilde gözden geçirilmektedir. PET görüntülerinde yarı nicel değerlendirme amacıyla en sık kullanılan parametre maksimum standart uptake değeri (SUVmax) olup birim dokudaki FDG tutulum yoğunluğunun vücut
25
içerisindeki ortalama FDG yoğunluğuna oranlayan yarı nicel bir ölçüttür. Bu indeks, birim alandaki radyoaktivite konsantrasyonunun enjekte edilen doza ve hastanın vücut ağırlığına normalize edilmesi ile hesaplanır.
SUVmax = Seçilen alanın ortalama aktivitesi (mCi/ml)x vücut ağırlığı (g) / Enjekte edilen doz (mCi)
Bununla birlikte; FDG enjeksiyonundan çekim zamanına kadar geçen zaman, plazma glikoz seviyesi, vücut ağırlığı veya vücut yüzey ölçümü, tarayıcının rezolüsyonu gibi faktörler SUVmax değerini etkileyebilmektedir. Bu nedenle SUVmax değerinin kesin tanı değeri yoktur.
3.2.6.13.3. F-18 FDG PET Uygulama Ve Yorumlama
Bazal seviyedeki endojen glikoz ve insülin düzeylerinde FDG’nin kas tutulumu düşük, tümör tutulumu ise optimal olmaktadır. Hiperinsülinemi ve hiperglisemi tümör hücresi içine FDG girişini azaltacağından hasta en az 4 saat en çok 12 saat aç bırakıldıktan sonra PET çekimi yapılmalıdır. İnsülin ve oral antidiyabetikler 4 saat öncesinden kesilmesi gerekirken kullanılan diğer ilaçların kesilmesine gerek yoktur. Çekim yapılmadan önce kan glikoz değeri ölçülür, 60-150 mg/dl arası en ideal değerdir. Pelvis bölgesi detaylı incelenecekse, mesanede biriken aktivitenin bu alanda bir lezyonu maskelemesini önlemek için hastaya sonda takılabilir (36,37). FDG enjeksiyonundan sonra kas tutulumunu azaltmak için hasta sakin ve rahat bir ortamda hareketsiz bir şekilde bekletilir. Bekleme süresi; FDG dağılımının dengeye ulaşması ve yeterli tümör tutulumunun oluşması için 45-60 dk’dır. Bu süre içerisinde hastanın konuşmaması, yememesi ve içmemesi söylenerek vokal kordlar ile çiğneme ve yutmayla ilgili kaslarda en düşük seviyede FDG tutulumu sağlanmaya çalışılır. Yeterli süre sonrasında mesane boşaltılır ve hasta sırtüstü pozisyonda PET kamerası yatağına yatırılır. Onkoloji çalışmalarında verteksten uyluk bölgesine kadar tüm vücut taranır. Bu alan için görüntüleme süresi yaklaşık yarım saattir. Daha fazla alan taramak gerektiğinde bu süre uzar ve hastanın toleransı azalır. PET tarayıcısı inceleme alanındaki vücut bölümlerinden elde ettiği radyoaktif sinyalleri alır. Gelişmiş bilgisayar sistemleri ve yazılımları aracılığıyla ‘‘rekonstriksiyon’ teknikleri kullanılarak incelenen vücut bölümlerinin aksiyal, koranal ve sagital eksenlerde görüntüleri oluşturularak (36,37) PET görüntüleri görsel ve yarı nicel (SUVmax) olarak değerlendirilir.
26 3.3. Akciğer Kanserinde F-18 FDG PET-BT
Akciğer kanserlerinin büyük çoğunluğunda diğer birçok kanser hücrelerinde olduğu gibi glikoz metabolizması artmıştır. En yüksek FDG tutulumu gösteren akciğer kanser tipleri skuamöz hücreli ve büyük hücreli kanserlerdir. Adenokarsinomlar ise özellikle iyi diferansiye olanlar daha az glikoz kullanırlar. Karsinoid tümörler ve bronkoalveoler hücreli kanserler düşük FDG tutulumuna sahip olup, bu nedenle PET/BT görüntülemede yanlış negatif sonuçlara yol açabilirler (37).
Akciğer kanserlerindeki PET’in kullanım endikasyonları: Soliter pulmoner nodüllerin ayırıcı tanısı
KHDAK’lerinde evreleme
KHDAK’lerinde nüks belirlenmesi ve yeniden evreleme KHDAK’lerinde tedaviye yanıtın belirlenme
KHDAK’lerinde prognoz tahmin edilmesi KHDAK’lerinde radyoterapi planlama Plevral malignite tanısı ve evrelendirme
Küçük hücreli akciğer kanserlerinin evrelendirme 3.3.1. Soliter Pulmoner Nodüllerin Ayırıcı Tanısı
Soliter pulmoner nodüller, lenf nodu büyümesi, atelektazi ya da pnömöni ile ilişkili olmayan, çevresi normal akciğer dokusu ile sarılı olan, çapı 3 cm’den küçük, yuvarlak veya oval parankimal akciğer lezyonları olarak tanımlanmıştır. Tespit edilen akciğer nodüllerinin çoğunda radyolojik olarak benign veya malign ayırımı yapılamaz. Bir akciğer nodülü saptandıktan sonra klinik öykü ve malignite riski değerlendirilerek ya izleme alınır ya da biyopsi yapılır. Ancak biyopsi ile her zaman kesin sonuç alınamadığından akciğer nodülü olan olguların yarısından fazlası gereksiz cerrahi işleme maruz kalır (37,38). Fokal akciğer lezyonlarının malign-benign ayırımı açısından PET oldukça değerlidir. Gould ve arkadaşlarının yaptığı bir çalışmada fokal akciğer lezyonlarında (n=1474) PET’in duyarlılığı %83-100 (ortalama=%96), özgüllüğü ise %50-100 (ortalama=%73,5) saptanmıştır. Sadece 3 cm’den
27
küçük pulmoner nodüller (n=456) ele alındığında PET’in duyarlılığı ortalama %93.9, özgüllüğü ise ortalama %85.8 bulunmuştur (38). Bu çalışmadan da anlaşılacağı gibi PET’in doğruluğu %100 olmayıp yanlış negatif ve yanlış pozitif sonuçlar elde edilebilir. Yanlış negatiflik malign oldukları halde düşük FDG tutan lezyonlar, yanlış pozitiflik ise malign olmadıkları halde yüksek FDG tutulumu olan lezyonlardır. Yanlış negatiflik hiperglisemi durumunda, 1cm’den küçük lezyonlarda, bronkoalveoler hücre tipli kanserler ve musinöz kanserlerin yaklaşık yarısı ile bazı karsinoid tümörlerde görülmektedir. PET’in uzaysal çözünürlüğünün sınırlı olması nedeniyle özellikle 6 mm’den küçük boyutlu nodüllerde tanısal doğruluk düşüktür. En sık yanlış pozitiflik nedenleri ise sarkoidoz, tüberküloz, koksidomikoz, aspergilloz ve diğer bazı enfeksiyonlardır. Soliter pulmoner nodüllerde şu an için en uygun yaklaşım; PET pozitif ise biyopsi ve/veya rezeksiyon planlamak, negatif ise takip etmektir (36,37).
3.3.2. KHDAK’lerinde Evreleme
KHDAK’lerinde doğru evreleme prognozun belirlenmesi ve en uygun tedavi modalitesinin seçimi açısından oldukça önemlidir. Evre I ve evre II tümörler erken evre olarak kabul edilir. Bu evrelerdeki hastalara lokal tedavi (tercihen cerrahi veya kardiyopulmoner fonksiyonların yetersiz olduğu hastalarda RT) uygulanır. Evre IIIA tümörler (aynı taraf N2 lenf nodu metastazı varlığı) ise lokal ileri evre olarak kabul edilmekte olup lokal ve sistemik tedavilerin kombinasyonu uygulanır (40).
Primer Tümör (T) Evreleme
T evreleme esas olarak BT bulgularına dayanmakta olup PET’in tek başına T evrelemeye katkısı düşüktür. Bununla birlikte PET/BT’nin mediastinal ve göğüs duvarı invazyonu ile BT’de görülen kitlesel lezyonun atelektazik komponentten ayırt edilmesinde T evrelemeye katkısı vardır. Plevral metastazlar ile malign plevral efüzyonun saptanması da PET/BT’nin ek katkılarıdır (41).
Mediasten (N) evrelemesi
BT görüntüleme ile lenf bezi metastazını değerlendirmek kısmen zor olmaktadır. BT’de genelde lenf bezi kısa eksen çapının 1 cm’den büyük olması patolojik kabul edilmektedir. Bu durumda 1 cm’den küçük boyutlu metastatik lenf bezleri gözden kaçabilmekte ve ayrıca metastaz dışı sebeplerle büyümüş lenf bezleri de yanlış pozitif sonuçlara neden olabilmektedir. Boyut kriter olarak alındığında; büyümüş lenf bezlerinin %40’ında malignite
28
tespit edilemezken, benign olarak değerlendirilen lenf bezlerinin %15’inde N2 veya N3 hastalık mevcut olabilmektedir (42). Mediastinal lenf bezlerini değerlendirmede mediastinoskopi altın standart olarak kabul edilmekle birlikte mediastinoskopi ile subaortik, paraaortik, paraözofageal ve inferior ligamenter lenf nodlarına ulaşılamaz. Mediastinoskopinin mediastinal lenf bezi değerlendirmesindeki duyarlılığı %90’dır ( 43).
FDG PET/BT, KHDAK’lerinin evrelemesinde preoperatif noninvaziv mediastinal ve hiler lenf bezi değerlendirilmesinde önemli rol oynamaktadır. Birçok klinik çalışmada, mediastinal lenf nodlarının değerlendirilmesinde FDG PET/BT’in BT’den daha üstün olduğu gösterilmiştir (44). BT ve FDG PET/BT'nin N evrelemedeki doğrulukları sırasıyla %69 ve %84 olarak belirtilmiştir (45). FDG PET/BT’de kısmen yüksek oranda yanlış pozitif sonuçlar izlenebilmesi (%13-22) nedeniyle mediastinal evrelemede mediastinoskopinin yerini tutamamaktadır. Bu sebeple PET pozitif hastalarda mutlaka mediastinoskopi veya diğer invaziv işlemlerle doğrulama gerekmektedir (45,46). Sınırlı uzaysal çözünürlük sebebiyle mikroskobik metastazlar saptanamadığından PET ile mediastinal evrelemede %5-8 oranında yanlış negatif sonuçlar elde edilebilmektedir (29,42,47). Sonuç olarak; bazı klinisyenler evre I-II olgularda mediastende büyümüş lenf nodu varlığında PET negatif olsa bile mediastinoskopi önermekte iken, diğer bazı klinisyenler ise mediastinoskopiye gerek duymadan direkt torakotomi yapılmasını savunmaktadır (42,48).
Uzak Metastaz (M) Evrelemesi
Uzak metastaz varlığı evre IV hastalık anlamına gelmekte olup hastayı kür amaçlı tedaviler yerine genellikle cerrahi dışı ve palyatif tedavilere yönlendirmektedir. KHDAK hastalarının yaklaşık %40’ında ilk başvuru sırasında, genelde adrenal bezler, karaciğer, kemik ya da beyinde uzak metastaz vardır. Lokalize gibi görünen bir hastalık için uygulanan radikal tedavi sonrasında hastaların %20’sinde muhtemelen ilk evreleme sırasında var olan bilinmeyen mikrometastazlar nedeniyle erken uzak nüksler gelişmektedir (49). Başka bir ifadeyle küratif cerrahi girişimlerden sonraki 5 yıllık sağkalım oranının %60’dan düşük olmasının nedenlerinden biri, görüntüleme yöntemleri ile saptanamamış olan gizli uzak metastazlardır.
Aynı anda tüm vücut görüntülenebildiğinden FDG-PET akciğer kanserinin beklenmedik metastazlarının saptanmasında etkin bir yöntemdir (50). Uzak metastazların saptanması açısından FDG PET/BT’in doğruluğu, duyarlılığı ve özgüllüğünün incelendiği 581 hastanın
29
incelendiği bir meta-analizde bu değerler sırasıyla %96, 94 ve 97 olarak bulunmuştur. FDG PET/BT’nin beyin dışındaki uzak metastazları saptamada diğer görüntüleme yöntemlerine göre doğruluğu daha yüksektir. KHDAK’nin santral sinir sistemi metastazı sık görülmekte olup M1 hastalık tanılı olguların %18’inde saptanmıştır (51). Beyin gri korteksi yüksek metabolik aktivite gösterdiğinden beyin metastazlarını saptamada FDG PET/BT’in duyarlılığı düşüktür.
Kemik, karaciğer ve toraks dışı diğer lenf nodu metastazları ile sekonder malignitelerin saptanmasında FDG PET/BT’in özgüllüğü ve duyarlılığı BT’den daha yüksektir (52,53). FDG PET/BT’nin sürrenal metastazları saptamada duyarlılığı yüksek olup özellikle SUVmax değerinin 3.1’in üzerindeki lezyonlarda duyarlılık %98, özgüllük %92 ve yalancı negatiflik oranı ise %3.8’dir (54,55). Ayrıca FDG PET/BT kemik metastazlarını saptamada da yararlı bir yöntemdir. Özellikle sternum ve vertebra metastazlarını göstermedeki etkinliği BT’den yüksektir (56). Kemik metastazlarını saptamada FDG-PET/BT’nin duyarlılığı, özgüllüğü ve pozitif-negatif prediktif değeri kemik sintigrafisinden üstündür (57).
3.3.3. KHDAK’lerinde Nükslerin Belirlenmesi Ve Yeniden Evreleme
KHDAK’lerinde BT ile nükslerin saptanması tedavi sonrası oluşan yaygın değişiklikler sebebiyle sıkıntılı olmaktadır. PET lokal nüksleri, tedavi sonrası değişikliklerden %62-100 özgüllük ve %97-100 duyarlılık ile ayırt edebilir. Ayrıca nüks şüphesi olan lezyonlarda tümör viabilitesini değerlendirmek için invaziv girişimler gerekebilir. FDG PET/BT histopatolojik tanı açısından biyopsi yerinin seçilmesinde ve erken nükslerin saptanmasında yararlı bir yöntemdir.
3.3.4. KHDAK’lerinde Tedaviye Cevabın Araştırılması
FDG PET, tedavi sonrasında rezidü tümörün belirlenmesinde önemli bir rol oynamaktadır. Burry ve arkadaşlarının tedavi sonrası rezidü hastalığın belirlenmesinde FDG PET ve BT’yi karşılaştırdıkları çalışmalarında; BT’nin duyarlılığı %72 olarak bulunmuş iken olguların tamamında PET ile rezidü hastalık belirlenebilmiştir (58). Ayrıca tedaviye cevabın erken dönemde tahmini hastaların gereksiz yere uzun süreli toksik ve pahalı tedaviler almasını önlemek açısından çok önemlidir. Birinci basamak kemoterapi sırasında olguların yaklaşık 1/3’ünde tümör progresyonu izlenmektedir. Efektif kemoterapi ile primer tümörün SUVmax değerinde hızlı düşme olduğu gösterilmiştir (59). Cerfolio ve arkadaşlarının neoadjuvan kemoterapiye yanıtı değerlendirmede FDG PET ve BT’yi kıyasladıkları çalışmalarında