T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
MEME KANSERİ MOLEKÜLER
GENETİK ALT SINIFLARININ
≤
35 VE >35 YAŞ KADINLARDA
KARŞILAŞTIRILMASI
UZMANLIK TEZİ
Dr. Hatice ÖZIŞIK
DANIŞMAN:
Doç. Dr. Ş.Burçak Karaca
ÖNSÖZ
İhtisas sürem boyunca yanında çalışmaktan onur duyduğum ve ayrıca tecrübelerinden yararlanırken göstermiş olduğu hoşgörü ve sabırdan dolayı değerli hocam, İç Hastalıkları Anabilim Dalı Başkanı Sayın Prof. Dr. Fehmi Akçiçek’e,
Uzmanlık eğitimimin her aşamasında beni içtenlikle destekleyen ve yol gösteren, hem tıbbi hem akademik ilminden faydalandığım, tezimin her aşamasında yardımcı olan Sayın Doç. Dr. Burçak Karaca’ya,
Tezimle ilgili her aşamada yine bana yardımcı olan Doç. Dr. Raika Durusoy’a,
İç Hastalıkları eğitiminde görev aldığım rotasyonlarda bana yardımcı olan hocalarıma, birlikte çalışmaktan zevk aldığım asistan arkadaşlarıma, değerli uzman hekimlere, klinik-poliklinik hemşire ve çalışanlarına,
Benim bu günlere gelmemi, bu başarıyı tatmamı sağlayan, bana her türlü güçlüğün altından nasıl kalkabileceğimi öğreten, gerek maddi gerek manevi destekleri ile her zaman yanımda olan, daima gurur duyduğum ve her zaman onlara layık olmaya çalışacağım sevgili anneme, babama, kardeşime , ayrıca her zaman yanımda olan ve hayatımın anlamı olan sevgili eşim Melih ÖZIŞIK’a sonsuz sevgi, saygı ve teşekkürlerimi sunarım.
İ
ÇİNDEKİLER
ÖZET... iv
İNGİLİZCE ÖZET (SUMMARY)... vi
KISALTMALAR ... viii
1-GENEL BİLGİLER ...1
1.1 MEME KANSERİNDE EPİDEMİYOLOJİ ...1
1.2 MEMENİN ANATOMİSİ ...1
1.3 MEME KANSERİNDE ETYOLOJİ VE RİSK FAKTÖRLERİ ...3
1.4 MEME KANSERİNDE TANISAL GÖRÜNTÜLEME YÖNTEMLERİ...5
1.5 MEME KANSERİNİN KLİNİK ÖZELLİKLERİ ...6
1.6 MEME KANSERİNİN PATOLOJİSİ ...6
1.7 MEME KANSERİNİN EVRELEMESİ...9
1.8 MEME KANSERİNİN BİYOLOJİSİ ...13
1.9 MEME KANSERİNDE MOLEKÜLER PROFİL VE YENİ PATOLOJİK SINIFLAMA ...16
1.10 MOLEKÜLER SINIFLAMADA TEDAVİ YAKLAŞIMI ...24
1.11 MEME KANSERİNDE TEDAVİ ...25
2-GEREÇ VE YÖNTEM ...29
2.1 Çalışmanın Tipi ve Evreni...29
2.2 Çalışmanın Amacı ...29
2.3 Çalışmanın Etik İzni...29
2.4 Çalışmada Kayıt Altına Alınan Veriler ...29
2.5 Reseptör ekspresyonunun değerlendirilmesi...29
2.6. İstatistiksel Analiz ...31
3-BULGULAR...32
4-TARTIŞMA ...37
ÖZET
Giriş ve Amaç:Dünya çapında, meme kanseri kadınlarda kanserden ölümlerin önde gelen nedenidir. Meme kanseri riski yaşla birlikte artış göstermektedir. Literatür bilgilerine göre, ≤35 yaş olan hastalarda 5 yıllık hastalıksız sağkalım ve genel sağkalım süreleri, >35 yaş olan hastalardan büyük oranda daha kısadır. Yeni moleküler patolojik sınıflamaya göre, triple negatif ve HER-2 (+) meme kanseri subgrupları, luminal olanlara göre daha kötü prognostik özelliklere sahip olduğu bilinen bir gerçektir. Bu rasyonelden yola çıkılarak, yaşın moleküler subgrupları belirlemede bir etkisi olup olmadığının, ≤35 yaş ve >35 yaş olan hastalardaki farklı prognostik gidişin, farklı iki gruptaki moleküler subgrupların dağılım farkından kaynaklanıp kaynaklanmadığının gösterilmesi amaçlanmıştır.
Metod
Çalışmaya Ege Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Medikal Onkoloji Bilim Dalı’na 2000-2011 yılları arasında meme kanseri tanısı ile başvuran ≤35 yaş olan toplam ikiyüz on altı (N=216), >35 yaş olan hastalar içinden randomizasyon yoluyla ikiyüzoniki (N=212) meme kanseri hastası alınmıştır. Çalışmaya alınan hastaların her birinin demografik, klinik, patolojik ve tedavi ile ilgili verileri takip dosyaları ve patoloji raporları incelenerek kayıt altına alındı. Moleküler subtiplemeyi belirlemek amaçlı, östrojen reseptörü (ER), progesteron reseptörü (PR), cerb-B2 ve Ki-67 proliferasyon indeksleri kullanıldı. Buna göre, Luminal A hastalık ER(+), PR(+), cerb-B2 (-),Ki -67≤ %15 olarak belirlendi. Luminal B için, ER ya da PR (+) liği yanı sıra cerb-B2 (-)/(+),Ki -67> %15 kabul edildi. Triple negatif hastalıkta, her üç reseptör negatif olarak, HER-2 pozitif hastalıkta ise sadece cerb-B2 (+) olarak kabul edilerek sınıflama yapıldı.
Bulgular
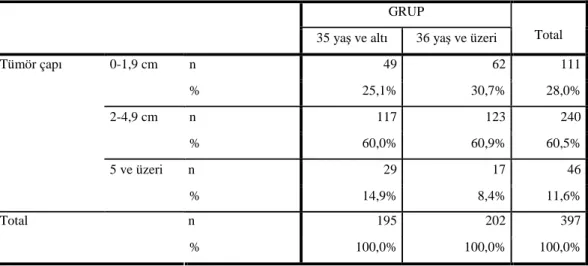
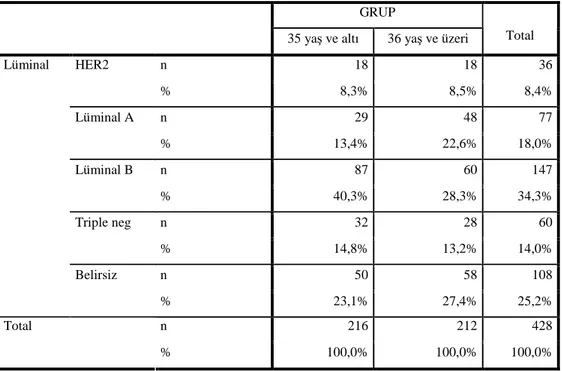
Moleküler subtipler açısından değerlendirme yapıldığında ; <35 yaş 216 hastadan moleküler subtipi belli olan 166 hastada ve >35 yaş 212 hastanın da 154 tanesinde uygun moleküler değerlendirme yapılabilecek sonuçlara patolojik olarak ulaşılabildi. Buna göre, <35 yaş grubunda 87’si (%40.3) Luminal B, 32’si (%14.8) Triple negatif subtipler vakaların
yarısından fazlasını oluşturmaktaydı. Geri kalan hastaların 29’u (%13.4) luminal A, 18’i (%8.3) HER-2 pozitif olarak saptandı.
>35 yaş hasta grubunda ise benzer şekilde en sık görülen grup (%28.3) Luminal B iken, bu grubu iyi prognostik özelliklere sahip olan Luminal A (%22.6) takip etmekteydi. Geri kalan vakaların ise, 28’i (%13.2) Triple negatif, 18’i (%8.5) HER2 + olarak saptandı. Bizim çalışmamızda, iki farklı yaş grubu arasında moleküler subtipler açısından istatistiksel anlamlı fark saptanmadı. Ancak daha kötü prognostik özelliklere sahip olduğu bilinen triple negatif subtip <35 yaş grubunda rakamsal olarak daha fazla olarak belirlendi.
Sonuç
Meme kanserinin, genç kadınlarda daha kötü bir prognostik gidişata sahip olduğu bilinen bir gerçektir. Yeni moleküler sınıflama ile prognoz arasında sıkı bir ilişki olduğu da bilinmektedir. Ancak, bizim çalışmamızda, iki farklı yaş grubu arasında moleküler subtipler arası istatistiksel anlamlı bir fark saptanamıştır. Bu durum, çalışma popülasyonun küçüklüğü ile açıklanabileceği gibi, yaşın diğer klinikopatolojik verilerden bağımsız bir prognostik faktör olma özelliği taşıdığının da göstergesi olabilir. Konuyla ilgili, genotipik analiz bazlı daha geniş hasta serileriyle yapılmış çalışmalara gereksinim vardır.
SUMMARY
Introduction and Aim:Breast cancer is one of the major causes of death related to cancer in women around the world. Breast cancer risk increases with age. According to the literature, in patients who are ≤35 years old the survival rates in general or without the disease, are shorter compared to the same data in >35 years old patients. According to the new molecular pathological classification, it’s known that triple negative and HER-2(+) breast cancer groups have worse prognostic properties compared to the luminal ones. In the light of this rationale, we aimed to determine whether age is effective in the determination of the molecular subgroups and whether the reason behind the different prognostic course between ≤35 years old and >35 years old patients is caused by the distribution difference of the molecular subgroups in two different groups.
Method
The study was hold in Ege University Medical Oncology Department on 212 (N=212) breast cancer patients taken from 216 (N=216) patients who are ≤35 years old and diagnosed with breast cancer between 2000-2011 with the randomization method. All of the patients included in the study were examined in demographic, clinical, pathological and treatment-related data and their follow-up records and pathological reports were reviewed and recorded. In order to determine the molecular subtype, estrogen receptor (ER), progesteron receptor (PR), cerb-B2 and Ki-67 proliferation indexes were used. According to this data, Luminal A disease was determined as ER(+), PR (+), cerb-B2 (-), Ki-67≤%15. For Luminal B, ER or PR (+) and cerb-B2(-)/(+) was accepted with Ki-67>%15. In the triple negative disease, all three receptors were accepted as negative, in HER-2 positive disease, only cerb-B2 (+) was accepted and the classification was made accordingly.
Results
In the evalution for the molecular subtypes, it was determined that in 166 patients among ≤35 years old out of 216 patients and in 154 patients among >35 years old out of 212 patients, data suitable for molecular evaluation was obtained. According to this finding, %87 (%40.3) of the ≤35 group was Luminal B and %32 of them (%14.8) were subjects with Triple negative subtypes and these together formed more than half of the patients. In the remaining
patients, %29 of them (13.4) were luminal A and %18 of them (%8.3) were determined as HER-2 positive.
In the ≤35 years old patient group, similiarly the most frequent group was (%28.3) Luminal B and this group was followed by Luminal A (%22.6) with better prognostic properties. In the remaining subjects, %28 of them (%13.2) were Triple negative, %18 of them (%8.5) were determined as HER2+. In our study, a statistically significant difference was not found between two different age groups in the aspect of molecular subtypes. However, the triple negative subtype which is known to have worse prognostic properties in the ≤35 age group was determined as more numerically.
Discussion
Breast cancer is known to have a worse prognostic course in young women. The existence of a close relationship between the new molecular classification and the prognosis is also well-known. However, in our study, a statistically significant difference between two different age groups in the aspect of molecular subtypes was not found. This situation may be explained by the small sample size, but it may also shows us that the age may be an independent prognostic factor from any other clinicopathological data. More studies based on genotypical analysis must be carried out on this subject.
KISALTMALAR
ER : Östrojen reseptörü
PR : Progesteron reseptörü
HER2 : İnsan epidermal büyüme faktörü reseptörü 2 FISH : Flöresan in situ hibridizasyon
CK 5/6 : Sitokeratin 5/6 CK 8/18 : Sitokeratin 8/18
IHK : İmmunohistokimyasal
MR : Manyetik rezonans
Ki-67 LI : Ki-67 labeling indeks
KT : kemoterapi
IDK : İnvaziv duktal karsinom
ILK : İnvaziv lobüler karsinom
BRCA1 : Breast cancer gen 1 BRCA2 : Breast cancer gen 2
EGFR : Epidermal büyüme faktör reseptörü
HR : Hormon reseptörü
ALND : Aksiller lenf nodu diseksiyonu
1.GENEL BİLGİLER
1.1 MEME KANSERİNDE EPİDEMİYOLOJİ
2008 yılında dünya çapında 1.383.500 yeni meme kanseri tanısı alan olgu olduğu hesaplanmıştır[1]. Her yıl yaklaşık 234,580 Amerikalı kadın invaziv meme kanseri tanısı almakta ve 40,030 kadın bu hastalıktan 2013 te hayatını kaybedecektir[2]. Dünya çapında meme kanseri kadınlarda kanserden ölümlerin önde gelen nedenidir. Meme kanseri toplam kanser olgularının %23 ünü, kanserden ölümlerin %14 ünü oluşturur.
Meme kanseri riski yaşla birlikte artış göstermektedir. Olguların çoğu 50 yaşından sonra tanı almaktadır. Fakat birinci derece akrabalarından birinde meme kanseri görülen hastalarda çoğunlukla daha erken yaşta da meme kanseri olabilmektedir. Hastalığın en sık görüldüğü ortanca yaş 61 olarak tespit edilmiştir. Amerikalı bir kadında doğumdan 39 yaşına kadar meme kanseri %0,48; 40-59 yaş arası %3,86, 60-69 yaş arası %3,51 ve 70 yaşından sonra %6,95 olasılıkla gelişebilmektedir. Tüm yaşamı boyunca bir kadında meme kanseri gelişme olasılığı %12,8’dir[3]. Her 8 kadından biri hayatı boyunca meme kanserine yakalanmaktadır.
Sık görülmesine rağmen meme kanserinin mortalitesi birçok tümöre göre daha iyidir. Meme kanserinde sağkalım oranları ırksal özelliklere ve ülkelerin gelişmişlik seviyelerine göre değişir. Beş yıllık toplam sağkalım Kanada’da %86,ABD’de %88, Güney Afrika’da beyazlarda %86, siyahlarda %64’dür[4, 5].
1.2 MEMENİN ANATOMİSİ
Esas fonksiyonu yeni doğana süt temini olan meme dokusu, modifiye aksesuar bir ter bezidir[6, 7]. Meme dokusu göğüs ön duvarda transvers planda 2. ve 6. kostalar arasında; lateralde orta axiller çizgi ve medialde sternum kenarı arasında bulunur. Ağırlığı 30 gr ile 500 gr arasındadır. Laktasyon döneminde ağırlığı 500 gr’ı geçebilir. Deri,subkutan doku ve meme dokusundan oluşur. Meme dokusu epitelyal ve stromal elemanlardan oluşur. Santralinde 6. interkostal aralık hizasında meme başı ve bunun çevresinde pigmente alan olan areola bulunur. Yaklaşık 3/ 4 kadarı pektoralis majör, kalan 1/ 4 kısmı ise lateralde serratus anterior kası üzerinde bulunur. Meme dokusu üzerini örten deriye Cooper’ın asıcı bağları ile tutunur [8].
Meme arteria mammaria interna, arteria mammaria eksterna ve arteria interkostalisler ile beslenir. Venöz drenajı vena mamaria interna ve vena interkostalisler ile aksillaya doğru olur[8, 9] . Memenin lenfatiklerinin kutanöz, aksiller , interkostal torasik ve posterior interkostal lenfatikler olmak üzere dört ana drenaj yolu vardır. Kutanöz lenfatikler, memenin superior, medial ve inferior kutanöz lenfatiklerinin çoğu, subareolar pleksus da dahil aksillanın lateraline drene olur. Memenin alt sınırından rektus abdominalis kılıfındaki epigastrik pleksusa buradan subdiafragmatik ve subperitoneal lenfatik pleksusa boşalır.Akım daha sonra karaciğere ve karın içindeki lenfatiklerle devam edebilir ve bu yolla meme kanseri metastazı karaciğere ulaşabilir[8].
Aksiller lenfatikler, memenin lenfatik akımının %75-97 kadarını alır. Aksilladaki lenf nodülleri 6 gruptur ve hepsi kostokorokoid fasianın altında yer alır. İnternal torasik lenfatikler, meme lenf akımının %3-25 'ini taşır. Bu bölgeye ait lenfatik damarlar içe dönerek pektoralis majör kasını ve interkostal kasları delip internal meme nodüllerine ulaşırlar[8].
Posterior interkostal lenfatikler, toraks içinde, kosta ve vertebraların birleşim yerlerinin önündeki posterior interkostal lenf nodüllerine açılır. Memenin innervasyonu 2. ve 6. interkostal sinirler ile sağlanır[8].
1.3 MEME KANSERİNDE ETYOLOJİ VE RİSK FAKTÖRLERİ
Meme kanserinin etyolojisi multifaktöriyeldir. Yaş, cinsiyet, genetik, diyet, hormonal düzensizlik gibi pekçok faktöre bağlıdır.
YAŞ:
Yaş ve cinsiyet meme kanseri risk faktörleri arasında en önemlileridir. Meme kanseri kadınlarda erkeklerden 100 kat daha sık görülür[11].Yaşın ilerlemesi bir çok kadında meme kanseri için risk faktörüdür. Yaklaşık meme kanserinin %85’ i kadınlarda 50 yaş ve sonrasında ortaya çıkar.
30 ve 39 yaş arasındaki kadınlarda meme kanseri gelişimi ortalama olarak %0.04 dür ve her yıl başına %10 ve üzerinde risk artar[12]. ABD de tüm meme kanserli hastaların %5.5’ini 40 yaşından önce meme kanseri tanısı almış olan hastalar oluşturmaktadır [13].
Yaşlı hastalarla karşılaştırıldığında genç kadınların mamografi ile taramanın yarar sağlamadığı hızlı büyüyen kanserlere sahip olduğu kanıtlanmıştır[14]. Bir görüntülemede hızlı ilerleyen tümör görüntülenemeyecek kadar küçük olabilir, bir sonraki görüntülemeye kadar da hızlı bir şekilde ilerlemiş evreye ulaşabilir.
40-49 yaş arası kadınlarda iki kat artmış meme kanseri riski ile ilişkili olan faktörler; birinci derece akrabada meme kanseri olması ve dens görünümde memeye (BIRADS 4) sahip olmaktır [15].
Genç kadınlarda kontrlateral meme kanseri riski artmıştır. BRCA mutasyonu taşıyan genç kadınlarda mortalite riski artmıştır[16].
Tablo-1:Yaş kategorilerine göre meme kanserinin yıllık insidansı[17]
Yaş Yıllık insidans/100 000 kadın
<20 0.1 20-24 1.4 25-29 8.1 30-34 24.8 35-39 58.4 40-44 116.1 45-49 198.5
AİLE VE GENETİK FAKTÖRLER:
Tüm meme kanserlerinin %5-10’unu oluşturur. Klinik özellikleri sporadik meme kanserlerinden farklıdır. Tanı yaşının erken olması, erkek aile bireylerinde sık olması, bilateral olması, mutasyon ile ilişkili olabilecek over, kolon, prostat, pankreas, endometrium ve bazı sarkomlarla birlikte görülmesidir.
Birçok birinci derece akrabada premenopozal meme kanseri öyküsü olması yaşam boyu meme kanseri riskini %50 gibi yüksek bir oranda artırır. Genellikle bu risk BRCA1 ve BRCA2 mutasyonu ile ilişkilidir.
Kalıtsal meme kanserinden sorumlu BRCA1/BRCA2 , Li fraumeni sendromundan sorumlu p53, Cowden sendromundan sorumlu PTEN genleridir.
HORMONAL FAKTÖRLER:
Kadınların uzun süre östrojen gibi üreme hormonlarına maruz kalması meme kanseri gelişiminde risk faktörlerinden biridir[18]. Doğum sayısının fazla olması, menarşın ileri yaşta başlaması, erken menopoz meme kanseri riskini azaltmaktadır. İlk doğum yaşı arttıkça meme kanseri riski artmaktadır. Artan siklus sayısı, prolifere olan duktal dokuda artmış DNA hasarına neden olmakta, bu durum da direkt meme kanserine yol açabilecek mutasyon riskini artırmaktadır[19, 20]. Postmenopozal dönemde hormon tedavisi kullananlarda meme kanseri riski kullanmayanlara göre artmaktadır. Özellikle ailesinde meme kanseri öyküsü olan kadınlarda oral kontraseptif kullanımı, meme kanseri riskini artırmaktadır[21, 22].
DİYET VE YAŞAM TARZI:
Yüksek yağ içerikli diyet ve kırmızı etin riski artırdığı saptanmıştır.
Tüketilen miktara bağlı olarak alkol kullanımı ile meme kanseri riski arasında anlamlı pozitif ilişki vardır[23]. Günde birkaç ölçek alkol alan kadınlar alkol kullanmayanlara göre 1.1-1.9 kat daha yüksek riske sahiptir[24, 25]. Bazı çalışmalarda egzersiz ile meme kanseri riskinde azalma olduğu tespit edilmiştir[26]. Bu konuda giderek artan oranda, egzersizin etkisini olumlu bulan çalışmalar mevcuttur.
RADYASYON MARUZİYETİ:
Amerika Birleşik Devletleri’nde meme kanseri olgularının yaklaşık %1’inin mamografiye bağlı olduğu düşünülmektedir [27]. Özellikle 10-14 yaş arasında radyasyona maruz kalma, ilk 3 dekatta radyoterapi alma riski artırır.
PREMALİGN LEZYONLAR:
Proliferatif lezyonlardan atipi içerenlerde meme kanseri riski 4-5 kat, atipi içermeyenlerde ise bu risk 2 kat artmıştır. Proliferatif, atipi içeren lezyonu olan ve birinci derece akrabada meme kanseri öyküsü olan kadınlarda 11 kat artmış risk söz konusudur[28]. 1.4 MEME KANSERİNDE TANISAL GÖRÜNTÜLEME YÖNTEMLERİ
a) Mamografi:
Asemptomatik erken evre meme kanserlerini mamografi açıkça tespit edebilmektedir.7 yıl sürecinde izlemde meme kanseri mortalitesinde mamografi ile %7 azalma olmuştur [29].
b) Digital mamografi:
Geleneksel mamografiye benzerdir ancak görüntü elektronik detektör tarafından tutulur ve bilgisayarda depolanır[30]. Dijital mamografi premenopozal ve peri menopozal kadınlar ve yoğun meme dokusuna sahip kadınlar için daha doğru sonuçlar vermiştir [31] . c) MR görüntüleme:
Meme kanserini saptamak için kullanılan MR IV kontrast madde uygulamasını gerektirir ve Amerika Birleşik Devletleri’nde mamografiden daha pahalıdır [32]. Meme MR’ı retrospektif [33-36] ve prospektif [37-41] çalışmalarda yüksek riskli kadınlarda invaziv kanseri belirlemede mamografiden daha duyarlı ancak daha az spesifiktir.
MRI ve mamografi kombinasyonu aile öyküsü olan meme kanseri riski yüksek olan (>%20-25 yaşam boyu riski olan ) kadınlarda Amerikan Kanser Derneği tarafından önerilmektedir [42].
Meme tomosentezi (3-D mamografi olarak da bilinir) rutin klinik kullanım için standart mamografiye yardımcı olarak ABD Gıda ve İlaç İdaresi tarafından onaylanmıştır [43].
Tomosentez dijital mamografinin bir modifikasyonudur; hareketli bir X ışını kaynağı ile dijital detektör kullanılır. Verilerin üç boyutlu görünümleri elde edilir ve görüntülerin ince bölümlerini oluşturmak için bilgisayar algoritmaları kullanılır.
Standart dijital mamografi ile karşılaştırıldığında 10 saniyeden biraz daha uzun maruz kalma maruz kalınan radyasyon dozunu ve hareket artefaktları riskini artırır[44, 45].
Bu teknik dens meme dokusu olan ve meme kanseri riski yüksek olan kadınları taramada ümit vericidir. Ancak günümüzde bu tekniğin rutin kullanımını doğrulayan büyük prospektif çalışmalar yoktur.
1.5 MEME KANSERİNİN KLİNİK ÖZELLİKLERİ
Birçok erken evre meme kanseri asemptomatiktir. Memede elen gelen kitle ya da tarama amaçlı çekilen mamografide saptanır. Ayrıca meme başında akıntı, deride çekilme ve nadiren memede ağrı şeklinde de kendini gösterebilir. Süt rengi akıntı benign sebeplere bağlı iken meme başından spontan gelen kanlı ya da seröz akıntı genelde meme kanseri ile ilişkilidir. Meme kanseri olan hastaların %10’unda memede ağrı görülmektedir. Memede ağrı aynı zamanda premenstruel kadınlarda sık görülen premenstrüel bir bulgudur. Adet dönemi boyunca bir yere lokalize olup devam eden ağrı durumunda altta yatan bir hastalıktan
şüphelenilmelidir. Hastaların çok az bir kısmı sadece aksillada kitle nedeni ile başvurmaktadır [46].
1.6 MEME KANSERİNİN PATOLOJİSİ
Meme kanserinde prognoz ve tedaviyi belirlemede primer tümör ile ilgili en önemli verilerden biri tümörün histopatolojik türüdür. En yaygın kullanılan sınıflama Dünya Sağlık Örgütü Meme Tümörleri Sınıflaması’nın Azzopardi tarafından yeniden düzenlenen şekli olup Tablo 2’de görülmektedir [47].
Tablo 2.Meme tümörlerinin histopatolojik sınıflandırması
1-EPİTELYAL TÜMÖRLER
A.BENİGN
-İntraduktal papillom -Meme başı adenomu -Adenom
a.Tübüler b.Laktasyon
B.MALİGN 1.Noninvaziv
a.İn situ (intraduktal) duktal karsinom b.İn situ lobüler karsinom
2.İnvaziv
a.İnvaziv duktal karsinom b.İnvaziv lobüler karsinom c.Müsinöz karsinom d.Medüller karsinom e.Papiller karsinom f.Tübüler karsinom g.Adenoid kistik karsinom h.Sekretuar (Juvenil ) karsinom i.Apokrin karsinom
j.Metaplastik karsinom
3.Meme başının Paget karsinomu
2-MİKS KONNEKTİF DOKU VE EPİTELYAL TÜMÖRLER 3-ÇEŞİTLİ TÜMÖRLER
4-SINIFLANDIRILAMAYAN TÜMÖRLER
5-MEME DİSPLAZİSİ/FİBROKİSTİK HASTALIK 6-TÜMÖRE BENZER LEZYONLAR
Duktal Karsinoma İn situ
Mamografide mikrokalsifikasyonlar şeklinde bulgu verir. Malign hücreler bazal membranı invaze etmeden duktusların içinde prolifere olurlar. Fizik muayenede genellikle ele gelen kitle saptanmaz. Komedo ve non-komedo olmak üzere ikiye ayrılır. Komedo
genelde hormon reseptörü negatif, Her-2 overekspresyonu pozitif, nükleer derecesi yüksek ve daha kötü prognozludur. Non-komedo ise nükleer derecesi genelde düşük, hormon reseptörü pozitif,
Her-2 overekspresyonu negatif ve daha iyi prognozludur. Lobüler Karsinoma İn situ
Genelde meme biopsisi sırasında insidental olarak tespit edilir. Non invaziv karsinomların %30-50’sini, tüm meme kanserlerinin %1-6’sını oluşturur. Olguların %70’inde multisentrik, %30-40’ında bilateraldir.
İnvaziv Duktal Karsinom(IDK)
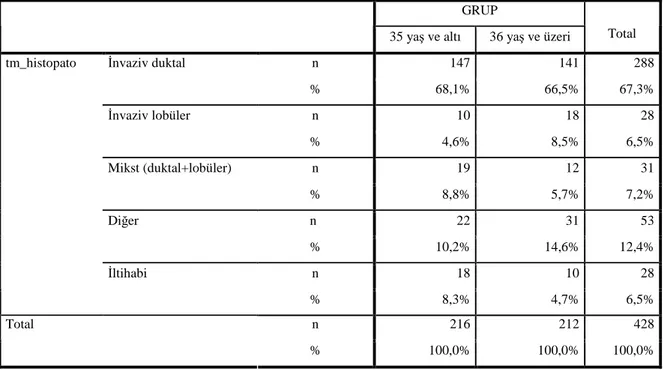
IDK meme kanserlerinin en büyük sınıfını oluşturur. Bu tümör aynı zamanda başka türlü spesifiye edilmeyen(No otherwise specified=NOS) veya spesifik tipi olmayan IDK(Infiltrating Ductal Carcinoma of No Special Type=NST) olarak da adlandırılır. IDK bütün infiltratif meme kanserlerinin %47-75’ini oluşturur [48]. IDK, 50 yaş ve üzeri kadınlarda genellikle palpasyon ve mamografi ile tespit edilen bir kitle şeklinde ortaya çıkar. Deri fiksasyonu, ödem, portakal kabuğu görüntüsü, meme başı çekilmesi ve akıntısı Paget hastalığı ve üzeri ülsere büyük tümörler gibi ağır tablolar 1980’li yıllardan önce sık görülürdü. Makroskobik olarak IDK, iyi sınırlı veya yıldız şeklinde infiltratif ve dışarıya doğru itilmiş kitle şekillerinin kombinasyonu şeklinde görülebilir. Yaygın fibrozis olursa skiröz karsinom olarak adlandırılır. İyi sınırlı veya nodüler tümörler, yuvarlakça veya lobüle görünümdedir. Nekroz yaygın değildir. Büyüklüğü birkaç milimetreden çoklu santimetrelere ulaşan boyutlarda olabilir. Mikroskobik olarak tümör, duktusları döşeyen ve içini dolduran solit hücre yuvaları, tubuluslar, bez yapıları, birbirleri ile birleşen kitleler ve tüm bunların karışımları şeklinde yapılar meydana getiren malign hücrelerden oluşur. Sıklıkla perivasküler ve perinöral invazyonlar görülür ve %20 olguda yoğun bir lenfoplazmositer infiltrasyon vardır. Tubuller ve hücre yuvaları myoepitelyal hücrelerle çevrelenmez ve bazal membran içermezler[7, 48].
İnvaziv Lobüler Karsinom(ILK)
Tüm invaziv meme karsinomlarının yaklaşık %15’ini oluşturur[49]. Makroskobik olarak ya düzensiz, infiltratif ya da iyi sınırlı, sertleşmiş kitleler olarak karşımıza çıkabilir, bazen lezyon gözle görülemeyebilir. Mikroskobik olarak ILK kısa, tek sıra, düz (İndian file)
ya da duktuslar, damarlar, lobüller etrafını çevreler şekilde dizilimler yapan yer yer de lobüler yapılanma oluşturan uniform, küçük, yuvarlak, düşük grade nükleer özelliklere sahip hücreler görülür. Aynı zamanda ILK’un alveoler, solid, pleomorfik ve miks varyantları da bulunmaktadır [7, 48].
Tubuler Karsinom
Meme kanserlerinin %1-2’sini oluşturan iyi prognozlu bir tümörlerdir. Genel boyutu 0.2-2 cm arasında değişir. Prognozu iyidir ve mamografi ile tarama sırasında tanı konur. Müsinöz Karsinom
İntraselüler ve ekstraselüler müsin üreten tümörlerdir .Bu tümörler; müsinöz karsinom, müsinöz kistadenokarsinom ve taşlı yüzük hücreli karsinom olarak üçe ayrılır [50].
Medüller Karsinom
Meme kanserlerinin %1-7’sini oluşturur. Makroskobik olarak yuvarlak iyi sınırlı ve yumuşaktır. Griden beyaza kadar değişen, sıklıkla kanama alanları ve nekroz içerir. Boyutu genellikle 2-2.9 cm arasındadır. Prognozu iyidir [51].
Paget Hastalığı
Meme karsinomlarını %1-5’ini oluşturur, meme başının yüzey epitelyumu içinde belirgin nükleoluslu, büyük nükleuslu, geniş ve soluk sitoplazmalı, büyük hücrelerle karakterizedir. Önce meme başında kızarıklık ve areolayı içine alan kaşıntı olur, sonra ülserasyon, pullanma, erozyonla karakterize sulantılı egzamatoid değişiklikler meydana gelir. Genellikle tek taraflıdır ancak bilateral vakalar da saptanmıştır [7].
1.7 MEME KANSERİNİN EVRELEMESİ
Meme kanserinde evreleme hastalığın anatomik yayılımını esas alır. Fizik muayene, görüntüleme yöntemleri ve laboratuar parametreleri prognoz hakkında her zaman doğru bilgi vermemektedir. Cerrahi olarak çıkarılan materyalin incelenmesi ile yapılan patolojik evreleme prognoz tayininde oldukça değerlidir. 1960’lardan itibaren hem çeşitli merkezlerin farklı tedavi yöntemlerinin kıyaslanması hem de standart bir yaklaşımın belirlenebilmesi için TNM sistemi kullanıma girmiştir. T primer tümör boyutunu, N bölgesel lenf düğümlerini, M ise uzak metastazı temsil etmektedir [52].
Tablo 3 TNM(AJCC-2009)
PRİMER TÜMÖR BOYUTU (T) (en büyük çap)
Tx: Primer tümör değerlendirilemiyor T0: Primer tümör bulgusu yok Tis: İnsitu karsinom
Tıs (DKIS) Duktal Tıs (LKIS) Lobuler
Tıs (Paget) Beraberinde kitle olmaksızın meme başının Paget hastalığı T1: Tümör 0 ila 2 cm arasında
T1mic: Mikroinvazyon tümör 0,1 cm’den küçük T1a : Tümör 0,1-0,5 cm arasında
T1b : Tümör 0,5-1 cm arasında T1c : Tümör 1-2 cm arasında T2: Tümör 2-5 cm arasında T3: Tümör 5 cm’den fazla
T4: Herhangi bir boyuttaki tümörde T4a : Göğüs duvarına yayılım
T4b : Ödem (peau d’ orange dahil), cilt ülserasyonu, ya da ipsilateral memede sınırlı satellit cilt nodülleri
T4c : 4a + 4b
T4d : İnflamatuar meme kanseri
BÖLGESEL LENF DÜĞÜMLERİ (N)
Nx : Bölgesel nodlar değerlendirilemiyor (Daha önce çıkartılmış olanlar da dahil) N0 : Bölgesel nod metastazı yok
N1 : Aynı tarafta aksillada fikse olmayan lenf nodu metastazı
N2 : Aynı tarafta birbirine veya çevreye fikse aksiller lenf nodu metastazı ya da klinik olarak aksiller lenf nodu metastazı yokluğunda aynı tarafta internal mammarian lenf nodlarında klinik olarak belirgin metastaz
N2a Aynı tarafta birbirine ya da çevreye fikse aksiller lenf nodu metastazı
N2b Klinik olarak belirgin aksiller lenf nodu metastazı yokluğunda sadece aynı tarafta internal mammarian lenf nodlarında klinik olarak belirgin metastaz
N3 : Aksiller lenf nodu varlığı veya yokluğunda aynı taraf infraklaviküler lenf nodu(ları)nda metastaz ya da aynı tarafta klinik olarak belirgin internal mammarian ve aksiller lenf nodu metastazı ya da aksiller ve internal mammarian lenf nodu varlığı veya yokluğunda supraklaviküler lenf nodu metastazı
N3a: Aynı tarafta infraklaviküler lenf nodu metastazı
N3b:Klinik olarak belirgin aksiller lenf nodu metastazı yokluğunda sadece aynı tarafta internal mammarian lenf nodlarında klinik olarak belirgin metastaz
LENF NODLARININ PATOLOJİK SINIFLAMASI (pN)
pNx : Bölgesel nodlar değerlendirilemiyor
pN0 : Histolojik olarak lenf nodu metastazı yok,izole tümör hücreleri için ek inceleme yapılmamış pN0(-) Lenf nodu metastazı histoloji ve İHK ile negatif
pN0(+) Lenf nodu metastazı histoloji ile negatif,İHK ile pozitif,İHK ile saptanan metastaz >0,2 mm
pN0(mol-) Lenf nodu metastazı histoloji ve RT-PCR ile negatif
pN0(mol+) Lenf nodu metastazı histoloji ile negatif ve RT-PCR ile pozitif
pN1 :Klinik olarak belirgin olmayan,sentinel lenf nodu disseksiyonunun mikroskobik incelemesinde tespit edilen 1-3 aksiller ve/veya internal mammarian lenf nodu metastazı
pN1mi:Mikrometastaz (0,2-2mm arasında) pN1a 1-3 aksiller lenf nodu metastazı
pN1b Klinik olarak belirgin olmayan ancak sentinel lenf nodu diseksiyonunun mikroskobik incelemesinde tespit edilen internal mammarian lenf nodu metastazı
pN1c:Klinik olarak belirgin olmayan ancak sentinel lenf nodu diseksiyonunun mikroskobik incelemesinde tespit edilen 1-3 aksiller ve internal mammarian lenf nodu metastazı pN2 : 4-9 aksiller lenf nodunda metastaz ya da aksiler lenf nodu metastazı yokluğunda klinik olarak belirgin internal mammarian lenf nodu metastazı
pN2a:4-9 aksiller lenf nodunda metastaz (tümör boyutu en az >2 mm)
pN2b:Aksiller lenf nodu metastazı yokluğunda klinik olarak belirgin internal mamarian lenf nodu metastazı
pN3 : 10 veya daha fazla aksiller lenf nodunda metastaz ya da infraklaviküler lenf nodu metastazı ya da bir veya daha fazla aksiller lenf nodu pozitifliği varlığında aynı tarafta klinik olarak belirgin internal mammarian lenf nodu metastazı ya da klinik olarak internal mamarian lenf nodlarında metastaz yokluğunda üçten fazla aksiller lenf nodunda metastaz ya da aynı tarafta supraklaviküler lenf nodu metastazı
pN3a:0 veya daha fazla aksiller lenf nodunda metastaz(tümör boyutu en az >2 mm) ya da infraklaviküler lenf noduna metastaz
pN3b:Bir veya daha fazla aksiller lenf nodu pozitifliği varlığında aynı tarafta klinik olarak belirgin internal mamarian lenf nodu metastazı ya da klinik olarak belirgin olmayan ancak sentinel lenf nodu diseksiyonu ile tespit edilen mikroskobik düzeyde 3'ten fazla aksiller lenf nodu metastazı
UZAK METASTAZ
Mx:Uzak metastaz değerlendirilemiyor M0 : Uzak metastaz yok
M1 : Uzak metastaz var
Tablo 4 KLİNİK EVRELEME(AJCC-2009)
Evre 0 Tis N0 M0 İntraduktal kanser(in situ duktal karsinom) Evre 1 T1 N0 M0 -Küçük tümör, lenf nodu tutulumu yok - < 2 cm (-) LN
-Sadece T1 N0 MO' ı içerir Evre 2a T0N1M0 - 2-5 cm
T1N1M0 - Aksillada (+) LN, birbirine fikse LN yok T2N0M0 -T0-2N1M0 ya da T2-3N0M0' ı içerir Evre2b T2N1M0
T3N0M0
Evre3 - Lokal ileri evre hastalık
-Fikse tüm tümörler ya da deri değişiklikleri -5 cm, (+) internal meme LN, deri metastazı
Evre 3a T0N2M0 -Teknik olarak opere edilebilen lokal ileri evre metastazsız(M0) meme kanseri T1N2M0 - T>5 cm ve palpabl aksiller LN ya da
T2N2M0 -Herhangi bir boyutta tümör ve fikse aksiller LN T3N1M0 - T3N1-2M0 ya da T1-2N2M0'ı kapsar
T3N2M0
Evre 3b T4N0M0 - Negatif cerrahi sınır elde etme olasılığı düşük olduğundan opere edilmeyen grup
T4N1M0 - Göğüs duvarı ya da deriye (T4) uzanım gösteren herhangi bir boyutta tümör ya da aynı taraf internal mammarian LN(+)(N3)
T4N2M0 -Herhangi bir T4 ya da herhangi bir N3M0 Evre3c -Herhangi bir TN3M0'ı kapsar Evre4 Herhangi bir T - Uzak metastaz
Herhangi bir M1 - Göğüs duvarına primer tümörün invazyonu ve eğer göğüs duvarına invazyon gösteren nodül bulunuyorsa
1.8 MEME KANSERİNİN BİYOLOJİSİ
Meme kanseri morfolojik, moleküler ve klinik olarak çeşitlilik içeren heterojen bir hastalıktır.
Bu heterojenite sadece tümör boyutu , histolojik derece, yaş, lenf nodu tutulumu gibi parametreler veya hastaların tanı ve tedavisinde kullanılan östrojen reseptörü (ER), progesteron reseptörü (PR) , insan epidermal büyüme faktörü reseptörü 2 (HER2) gibi biyolojik belirteçlerle açıklanamaz. Meme kanserinin moleküler sınıflaması son 10 yıl içinde gen ekspresyon dizileri gibi teknolojilerin gelişimi ile aydınlatılmıştır. Selüler mikroçevre ve hastanın kalıtımsal özellikleri hastalığın sonuçlarını, patofizyolojisini ve tedaviye cevabını etkiler. Bu nedenle meme kanseri tedavisini planlarken her hastaya göre kişiselleştirme yapılması gerekir.
Örneğin, bazı tedaviler kadının premenopozal ya da postmenopozal olmasına göre seçilir. Meme kanserinin kendisi ile ilişkili birçok faktör tedaviyi kişiselleştimeye yardımcıdır. Meme kanseri özellikle moleküler seviyede birçok yönden farklıdır. Tümörle ilgili bu faktörler prognozla ilgili bilgi verir ve her kişi için en iyi yararı sağlayan kişiselleştirilmiş tedaviye yardımcı olur. Premenopozal kadınlarda tamoksifen tercih edilirken postmenopozal kadınlarda aromataz inhibitörleri tamoksifene tercih edilir. HER2 + meme kanserine sahip hastalarda tedaviye HER 2’ye karşı geliştirilmiş bir monoklonal antikor olan trastuzumab eklenir.
1.8.1 Östrojen ve Progesteron Reseptörleri
Östrojen normal meme epiteli ve meme kanserinin gelişmesinde önemlidir. Ayrıca östrojen düzeyi meme kanseri tedavisinde de oldukça önemlidir. İki tür östrojen reseptörü vardır; ER ve Erâ. ER ilk izole edilen östrojen reseptörüdür. Meme, uterus ve overlerde eksprese edilir.
Erâ ise daha yaygın eksprese edilir, meme kanseri ile ilişkisi net değildir [53]. ER’nün majör ligand –bağımlı transkripsiyonel aktivite fonksiyonu homodimerizasyonuna bağlıdır. Bu homodimer hedef genlerdeki östrojene tepki veren elementlere bağlanarak çeşitli koaktivatörlerle birlikte transkripsiyonu artırır [54].
Meme kanserlerinin yaklaşık %70 kadarı ER eksprese eder; bu tümörler ER negatif olanlara göre daha yavaş çoğalma ve daha iyi diferansiye olma eğilimindedir . Antiöstrojen
tedavinin adjuvan kullanımı rekürrensi önlemede, metastaz varlığında ise sağ kalımı uzatmada etkilidir. Meme kanserinde ER hem bir prognostik faktör, hem de prediktif faktördür [55].
PR , iki ayrı izoformu olan (PRA ve PRB) östrojen ile regüle edilen bir gendir. PRB meme kanserine daha spesifiktir. PR promotor geninde oluşan bir polimorfizm nedeniyle PRB transkripsiyonunda artış olması meme ve endometrium kanserinde artmış risk ile ilişkilidir [56]. PR, ER pozitif tümörlerde değişken oranlarda eksprese edilir ve bu değişkenlik prognoz ile ilişkilidir. ER pozitif/PR negatif tümörler genellikle 50 yaş üzerinde görülür ve ER pozitif /PR pozitif tümörlere göre daha büyük boyut ve daha sık nodal tutulum ile birliktelik gösterir. ER/PR pozitif tümörler, ER pozitif/PR negatif tümörlere göre antiöstrojen tedaviye daha iyi yanıt verir [57].
Multigen analizleri hormon reseptörü (HR) pozitif hastalarda rekürrens riskini tahmin etmede önemli olan araçlardır. Örneğin, Oncotype DX formalin ile fikse parafin dokulardaki 21 genin (5 referans gen içeren) ekspresyon düzeylerini analiz eder. Ayrıca uzak rekürrens olasılığını tahmin eden rekürrens skorunu (RS) üretir [58]. Aynı zamanda HR pozitif erken meme kanseri olan kadınlarda KT’nin yararını öngörmeyi sağlar[59]. Oncotype DX HR pozitif hastaların sınıflandırılmasında güçlü bir araç olmasına rağmen rutin klinik kullanımda çok pahalıdır. Birçok onkolog hem ucuz hem de kullanımı kolay olan immunohistokimyasal (IHK) değerlendirmeyi tercih etmektedir.
Oncotype DX değerlendirme:
- Geleneksel klinikopatolojik değişkenler tarafından öngörülemeyen kişiselleştirilmiş rekürrens skorunun oluşmasını sağlar [59].
- ER pozitif, HER2 negatif meme kanserli hastalarda kemoterapinin yararını tahmin etmek için ortaya çıkan ilk ticari multigen ekspresyon değerlendirmesidir [60].
- Birçok analiz tamoksifen kullanan kadınlarda rekürrens skorunun aynı zamanda lokorejyonel ve uzak rekürrensi öngördüğünü göstermiştir [61] .
1.8.2 HER2(ERBB2)
Protoonkogen olan ERBB2 (HER2); ERBB1(EGFR,HER1), ERBB3 (HER3) , ERBB4 (HER4)’ü de içeren benzer büyüme faktör reseptörleri ailesinin bir üyesidir ve bir tirozin kinaz reseptörünü kodlar. HER2 liganda direk bağlanmadığı [62] gibi, liganda
bağlanan ailenin diğer üyeleri ile heterodimerize olabilmesi aktivitesi için kritik basamaktır[63]. HER2 geni 17q21’de yerleşiktir. HER2’nin amplifikasyonu ve/veya protein overekspresyonu meme kanserli hastaların %20’sinde görülür, daha agresif seyir ve kısalmış yaşam süresi ile ilişkilidir[64]. HER2 pozitifliği ile kemoterapiye yanıt arasında da ilişki saptanmıştır. HER2 pozitif meme kanserleri antrasiklin içeren protokollere, antrasiklin içermeyen protokollere göre daha iyi yanıt verirler [65]. HER2 reseptörünün ilettiği sinyallerin bloke edilmesi için çeşitli ilaçlar ortaya konmuştur. Proteinin ekstraselüler bölümüne karşı geliştirilmiş ilk insan monoklonal anti-HER2 antikoru olan trastuzumabın, HER2 pozitifliği olan, hem erken evre hem de metastatik meme karsinomu bulunan hastalarda yüksek klinik olarak yarar sağladığı gösterilmiştir. HER2 amplifikasyon oranı trastuzumab tedavisi uygulanacak hastanın seçilmesine yardımcı olmaktadır [66, 67]. Buna göre, IHK’sal olarak %30 (++) şiddette boyanan ya da FISH + olan hastalara bu tedavi önerilir.
1.8.3 Ki-67
Ki-67 proteini orijinal olarak ilk defa Gerdes ve arkadaşları tarafından bir kobay fareyi Hodgkin lenfoma hücreleri ile immünize etmeleri sonucu 1983 yılında tarif edilmiştir. Bu yapı, çoğalan bütün hücrelerde izlenmiş ve araştırılan hücre popülasyonunun büyüyen bölümünü araştırmada kullanılan önemli bir belirteç olmuştur. Ki-67 ismi, Almanya’nın Kiel
şehrinden ve 96 oyuklu plak içerisindeki orijinal klon sayısından köken almaktadır.
Tümör proliferasyon durumunu hesaplamak için sıklıkla kullanılan bir belirteçtir. Ki-67 proteini 395 kD ağırlığında büyük nükleer bir proteindir. Ki-Ki-67, G0 fazı haricinde hücre döngüsünün bütün aktif fazlarında bulunur. Çünkü proliferasyon durumu tümörün agresifliği ile yakından ilişkilidir. Ki-67 labeling indeks (LI) meme kanserini de içeren birçok tümör tipleri için kurulan prognostik bir belirteç olarak kabul edilir [68, 69]. Önceki klinik çalışmalar HR pozitif meme kanseri hastalarında Ki-67 LI’in iyi bir prognostik belirleyici olduğunu açığa çıkarmıştır [70, 71].
Ki -67, HR pozitif meme kanserli hastalarda güçlü prognostik bir belirteç olmasına rağmen günlük pratikte sık kullanılan belirteçlere eklenmesi tartışmalıdır[68]. Dahası prediktif değeri Oncotype DX gibi multigen analizlerinden daha zayıftır.
Ki-67 özellikle triple negatif ve hormon reseptör pozitif gruplarda erken meme kanserli hastalarda prognostik grupları ayırmada oldukça yardımcıdır [72-74]. Neoadjuvan
endokrin tedavi ve KT sırasında Ki-67’de meydana gelen değişikliklerin tedaviye yanıtı ve prognoza olan etkileri içerdiğini belirten bazı çalışmalar vardır [75-79].
St Gallen International Expert Consensus Ki-67 proliferasyon ölçümünün kullanılmasını önermektedir [80-82]. Bu konsensus kararlarına göre; ER pozitif tümörü olan ve yüksek Ki- 67 (i.e.> %30) düzeyine sahip kadınlar kemo-hormonoterapi almalıdır, düşük Ki-67 (≤%15) (luminal A tümörler) yalnızca hormonoterapi almalı ve orta seviye (%16-30 ) tedavi kararı için belirleyici değildir.
1.8.4 p53
p53 proteini moleküler kütlesine göre isimlendirilmiştir; 53 kilodaltondur. p53 proteini hücresel tümör antijeni p53, fosfoprotein p53 ya da tümör supresor p53 proteini olarak da bilinir ve TP53 geninde kodlanmıştır. p53 proteini hücre siklusunu düzenler ve böylece kanseri önleyen tümör supresör olarak fonksiyon görür. Apoptozda rol alır, anjiogenezi inhibe eder ve genomik stabiliteyi sağlar.
Meme kanserlerinin %20’den %50’sine kadarında p53 tümör supresör gende mutasyonlar veya p53 proteinin birikimi bildirilmiştir [83, 84].
Son çalışmalar luminal A subtipindeki tümörlerde luminal B subtipine göre düşük oranda p53 mutasyonu[85-88] gösterilmiştir ve luminal A subtipinin daha az proliferatif [89, 90] olduğu gösterilmiştir. p53 durumu ve proliferasyon belirteçlerinin kombinasyonunun luminal A ve luminal B ayrımında kullanılabileceği önerilmektedir.
Tümör supresör gen olan p53, normal hücre yaşamında çeşitli stres durumlarına karşı cevap olarak önemli bir role sahiptir. p53 fonksiyonunda bozulma tümör progresyonu ile ilişkilidir. Son çalışmalarda, p53 gen anormalliklerinin [91] ve çekirdekteki p53 protein birikiminin[92, 93] HR pozitif hastalarda sağlam prognostik belirleyici olduğu gösterilmiştir. 1.9 MEME KANSERİNDE MOLEKÜLER PROFİL VE YENİ PATOLOJİK SINIFLAMA
Gen ekspresyonundaki çeşitliliklere dayanan moleküler profil iki farklı şekilde kullanılır:
1- Meme kanserlerini geleneksel histopatolojik kriterlerin (grade, histoloji, hormon reseptörlerinin immunohistokimyasal analizi, HER2 overekspresyonu ) ötesinde karakterize etmek
2- Klinik sonuç ve tedaviye yanıtın göstergesi olarak kullanılır.
Meme kanserinin hücresel ve moleküler heterojenitesi ve hücre çoğalması, ölümü ve farklılaşmasını kontrol eden çok sayıda gen içermesi multipl genetik değişikliklerin çalışılmasının önemini vurgulamaktadır. Gen ekspresyon profili meme kanser hücresinde binlerce genin aktivitesinin ölçümüne de izin vermektedir.
Genomdaki DNA amplifikasyon ve delesyonları tetkik edilerek moleküler sınıflama yapılabilir. Bu veriler ‘intrinsik gen seti’ ve klinik sağ kalım verilerinin ikisi de kullanılarak incelenmiş, HER2’ye benzer yüksek düzeydeki gen amplifikasyonlarının tespit edilebileceği ve bunların tedavi hedefleri olarak kullanılabileceği bildirilmiştir [94]. Aynı zamanda moleküler heterojenite klinikte çoğunlukla konvansiyonel histopatoloji ile çakışır ve ER, PR, HER2 statusu ve tümör grade’i ile değerlendirilmektedir[95].
Meme tümörlerinin tedaviye cevapları ve klinik seyirleri farklıdır. Perou ve arkadaşlarının 2000 yılında yaptığı çalışmada, 8102 insan genlerini temsil eden tamamlayıcı DNA mikrodizileri kullanılarak meme tümörü olan 42 farklı bireyin cerrahi örneği ile gen ekspresyon paternlerindeki farklılıklar tanımlanmıştır. Bu paternler her tümörün farklı bir moleküler portresi olmasını sağlamıştır. Tümörlerin yirmisi 16 haftalık doxorubisin kemoterapisinden önce ve sonra iki kez örneklenmiştir ve iki tümör aynı hastanın lenf nodu metastazı ile eşleşmiştir. Aynı kişiden alınan iki tümör örneğindeki gen paterni, herhangibir başka örnek için olandan hemen hemen her zaman birbirine daha benzerdir. Tümörlerin gen ekspresyon paternlerindeki yaygın farklılıklarla tümörlerin subtiplere ayrılabileceği anlaşılmıştır [96].
Meme kanserli hastaların prognozunun belirlenmesinde intrinsik subtiplerin tanımlanmasının yararlı olduğu kanıtlanmıştır [97]. Gen ekspresyon dizileri nicel ve tekrarlanabilirdir ancak yüksek maliyetleri bunların kullanımını sınırlandırmaktadır. Formalinle fikse parafine gömülü materyallerin kullanımı ile de gen ekspresyon dizilerinin sonuçlarına yaklaşabilme mümkün olmuştur [70].
Tablo 4 .Meme Kanseri moleküler subtiplerinin tanımlanması[70, 98]
İntrinsik subtip[96] Klinikopatolojik tanımlama Notlar
Luminal A ‘Luminal A’
ER ve/veya PR+[99] HER2 –[64]
Kİ-67 düşük(<%14)*
ki-67 LI kesim noktası PAM50 intrinsik subtiple karşılaştırılarak yapılmıştır
Luminal B ‘Luminal B(HER2 -)’
ER ve/veya PR + HER2-
Ki-67 yüksek
Multipl genetik dizilerde yüksek proliferasyon markırları kötü
prognoz göstergesidir[90]
‘Luminal B(HER2 +)’ ER ve/veya PR pozitif Herhangibir ki-67
HER2 overekspresyonu veya amplifikasyonu
Hem endokrinhem de antiHER2 tedavisi endikedir.
Erb-B2 overekspresyonu ‘HER2 +(non luminal)’ HER2 overekspresyonu veya Amplifikasyonu
ER ve PR negatif
‘Bazal-benzeri’ ‘Triple negatif(duktal)’ ‘Triple negatif’ ve ‘bazal benzeri’ subtipler yaklaşık %80
çakışmaktadır.** ER ve PR negatif,HER2 –
CK 5/6 ve/veya EGFR+
*Ki-67 cut-off değeri prognostik faktör olarak gen dizi verilerinin karşılaştırılması ile elde edilmiştir [70]. **Triple negatif uzak rekürrens riskinin düşük olduğu medüller ve adenoid kistik karsinom gibi bazı histolojik tipler de içerir. Gerçek bazal-benzeri tümörleri seçmek için bazal keratinle boyamanın yardımcı olduğu gösterilmesine rağmen genel kullanım için tekrarlanabilirliği yetersizdir[100].
1.9.1 Luminal subtipler
‘Luminal’ kelimesi bu tümörlerin gen ekspresyonunun benzerliği ve memenin luminal epitelinden kaynaklanmasından türetilmiştir, genellikle luminal sitokeratin 8 ve 18 eksprese ederler. ER pozitif meme kanserlerinin büyük çoğunluğunu oluştururlar. Ancak luminal A ve luminal B subtipleri moleküler ve prognostik olarak anlamlı farklılıklara sahiptir.
1.9.1.1 Luminal A
Literatür bilgisine göre; en sık görülen alt tiptir ve tüm meme kanserlerinin %50-60’ını oluşturur. Meme kanalında uzanım gösteren luminal epitelde, tipik olarak eksprese edilen ER transkripsiyon faktör tarafından aktive edilen genin ekspresyonu ile karakterize edilir. Hücre proliferasyonu ile ilişkili genlerin ise düşük ekspresyonu bulunmaktadır [85, 96].
İnfiltratif lobüler karsinomların çoğunun, lobüler karsinoma in situların tümünün moleküler profilini luminal A oluşturur. Luminal A’nın İHK profili; ER, PR, bcl-2 ve sitokeratin CK 8/18 ekspresyonu, HER2 ekspresyon yokluğu, Ki-67 ile ölçülen düşük proliferasyon oranı ve düşük histolojik derece ile karakterizedir. Luminal A tipinde GATA3 belirteci ekspresyonu en yüksek seviyededir. İyi prognozlu olan luminal A tipinde relaps oranı %27,8’dir, diğer alt tiplerden belirgin olarak daha düşüktür [101]. Sağkalım ile relaps zamanı arası daha uzundur. Daha yüksek kemik metastazı insidansı (%18.7) ile farklı bir rekürrens biçimine sahiptir ve santral sinir sistemi, karaciğer ve akciğer gibi diğer lokalizasyonlarda rekürrens %10’dan daha azdır.
Bu alt tipin tedavisinde premenopozal hastalarda çoğunlukla tamoksifen gibi selektif östrojen reseptör modülatörleri veya fulvestrant kullanılmakta ve postmenopozal hastalarda ise aromataz inhibitörleri tek başlarına kullanılmaktadır [102].
1.9.1.2 Luminal B
Tüm meme kanserlerinin %10-20’sini oluşturur. Luminal A’ya göre; daha agresif fenotipe, daha yüksek proliferatif indeks ve histolojik dereceye ve daha kötü prognoza sahiptir .Kemik hala en sık rekürrens yeri(%30) olmasına rağmen bu alt tip karaciğer gibi yerlerde de yüksek bir rekürrens oranına (%13.8) sahiptir. Sağ kalım ile relaps zamanı arası daha kısadır (1.6 yıl) [101]. Luminal A ve luminal B; her ikisi de ER eksprese eder ancak luminal B’nin prognozunun çok farklı olmasından dolayı bu iki subtipin ayrımını yapabilmek için gerekli olan belirteçleri bulmak için yoğun çaba harcanmaktadır.
Bu iki subtip arasındaki temel biyolojik fark; genellikle EGFR ve HER2 de eksprese eden Luminal B alt tipinde, proliferasyon genleri olan Ki-67 ve siklin B1’in ekspresyonlarının artmasıdır. İHK açıdan bakıldığında Luminal A ve Luminal B arasındaki ayrım için Ki-67 proteininin ekspresyonu kullanılmaktadır [70]. Luminal A alt tipi tümörler ER+/HER2- ve düşük Ki-67 olarak tanımlanırken, Luminal B alt tipi tümörler ER+/HER2- ve yüksek Ki-67 veya ER+/HER2+ olarak tanımlanmıştır. Bu tanımın tüm luminal alt tip tümörleri içermemesi önemlidir (Luminal B tümörlerin %6’dan fazlası ER-/HER2 -). Ki-67 belirlenmesindeki teknik, bu belirtecin değerlendirilmesinde değişken bir faktör eklenmesi nedeni ile standardize edilememektedir. (Luminal A ve B ayrımı için cut-off değer %13.25)[70]. St Gallen International Expert Consensus 2013’te ise 2011’in aksine Ki-67 cut-off değerinin %14 olmasının Luminal B subtipi tanımlamada uygun bir eşik değer olmadığı oybirliğiyle kabul edilmiştir. Çoğunluk cut-off değer için %15-25 arasında değişen değerleri kullanmaktadır.
Tamoksifen ve aromataz inhibitörleri ile tedaviye rağmen Luminal B tümörler, Luminal A tümörlere göre daha kötü bir prognoza sahiptirler fakat Luminal B tümörlerde neoadjuvan kemoterapi ile patolojik tam yanıt başarısı %17 ile daha iyidir (Luminal A’da %7) [103]. Bu değerlerin sırasıyla %36 ve %43 olan HER2+ ve bazal-benzeri tümörlere göre de daha düşük olduğu açıktır [104]. Bu nedenlerden ötürü meme kanserinin bu alt tipinin tedavisi halen zordur. Bunların hangi mekanizmalarla proliferasyon ve metastaz yaptığı henüz tam olarak anlaşılamamıştır. Birçok çalışma luminal B tümörlerin tedavisine odaklanmıştır; PI3K/AKT/m TOR yolaklarını farklı seviyelerde inhibe eden birçok molekül üzerinde çalışılmaktadır [105].
1.9.2 HER2 pozitif tip
Bu moleküler subtip tüm meme kanserlerinin %15-20’sini oluşturur. Bu moleküler alt tip HER2 geninin ve HER2 yolağı ve/veya 17q12 kromozomdaki HER2 amplifikasyonu ile ilişkili diğer genlerin yüksek ekspresyonu ile karakterizedir. Bu alt tip aynı zamanda hücresel proliferasyon ile ilişkili genlerin artmış ekspresyonuna sahiptir. Bu alt tip bazal benzeri grubun gen ekspresyonunu göstermemesine rağmen karakteristik luminal genlerin düşük ekspresyonunu gösterebilir. Morfolojik olarak bu tümörler yüksek proliferatiftir, %75’i yüksek histolojik dereceye sahiptir, %40’dan fazlası da p53 mutasyonuna sahiptir. ER- /HER2+ İHK profili esas alt tip ile tamamen uyumlu değildir. Çünkü İHK’de mikroarray ile artmış protein ekspresyonuna sahip tümörler HER2 tümörlerinin sadece %70’idir.
Aksine mikroarray analizlerde HER2 amplifikasyonu ve artmış ekspresyonu ile birlikte olan tüm tümörler HER2 grubunu içermez [106, 107]. Ayrıca klinik olarak ER+/HER2+ olan tümörlerin önemli bir kısmı moleküler olarak Luminal B gibi sınıflandırılır.[106]
HER2 amplifikasyonu olan tümörler ayrıca üç alt tipe ayrılarak sınıflandırılır. %50-55 arasında 10 yıllık sağkalıma sahip iki grup ile karşılaştırıldığında diğer grup %12 sağkalım oranı ile belirgin kötü prognoza sahiptir[108].
Klinik açıdan bakıldığında, son 10 yılda anti-HER2 tedavi (trastuzumab) sadece metastatik hastalıklarda değil aynı zamanda erken evrede de sağ kalımda önemli gelişmelere neden olmuştur. Buna rağmen, HER2 alt tipi kötü prognoz ile karakterizedir[109-112].
Neoadjuvan çalışmalarda hem HER2 hem de bazal-benzeri alt tip, Luminal A ve Luminal B tümörlere göre daha yüksek yanıt oranı ile birlikte yüksek bir kemosensitiviteye sahiptir[106].
Tümörler hücrelerin güçlü membran boyanması (+3) durumunda HER2 (+) kabul edilir. HER2 protein ekspresyonu için 0 ya da +1 boyanma sergileyen tümörler HER2 (–) olarak kabul edilir. HER2 için şüpheli membran boyanması durumunda (+2) FISH yöntemi gen amplifikasyonunu değerlendirmek için kullanılır.
1.9.3 Triple negatif tip
Tüm meme kanserlerinin%10-20’sini oluşturur. Normal meme miyoepitelyal hücrelerinde bulunan yüksek molekül ağırlıklı sitokeratin 5 ve 17, P-cadherin, caveolin 1 ve 2, nestin, CD 44 ve EGFR genlerinin ekspresyonunu göstermesi nedeni ile bu şekilde isimlendirilir. Ayrıca sitokeratin 8/18 ve Kit gibi luminal epitelyumun karakteristik genlerinin ekspresyonunu da gösterir fakat seviyeleri luminal karsinoma göre belirgin düşüktür. Klinik olarak erken yaşta görülür. Sıklıkla Afrika kökenli kadınlarda görülür. Ayrıca tanı sırasında geniş tümör boyutuna, yüksek histolojik dereceye ve sıklıkla lenf nodu tutulumuna sahiptir[113].
Triple negatif tip; genişlemiş sınırı olan infiltratif duktal karsinom olma eğilimindedir ve yüksek mitotik indekse, nekroza, belirgin bir stromal lenfosit cevabına sahiptir [114]. Viseral organların hakim olduğu (en çok akciğer, santral sinir sistemi ve lenf nodları) metastatik relapsları agresiftir [101, 115]. Bu alt tipteki tümörlerin en önemli özelliği meme
kanserinde üç anahtar reseptör olan ER, PR, HER2’nin ekspresyon yokluğudur. Bundan dolayı klinik pratikte bazal benzeri ve triple negatif terimleri sıklıkla birbiriyle değiştirilir. İki grup arasında genomik anlamda %30’dan fazla uyumsuzluk tanımlandığından beri eş anlamlı terimler olarak kullanılmamaktadırlar[116]. İHK profil ile bazal benzeri tipi tanımlama girişimleri beş belirtecin seçilmesine yol açmıştır: ER, PR, HER2, EGFR ve CK5/6. Bu belirteçlerin bu alt tipi sınıflandırmada spesifitesi %100 ve sensitivitesi %76’dır [98].
Bazal benzeri tümörlerde kemoterapiye cevap yüksek [117] olmasına rağmen ilk üç yılda yüksek relaps oranı [118] ile luminal tiplere göre daha kötü prognoza sahiptirler[85, 119].
Bu nedenle uygun tedavi stratejileri düzenlemek ve yeni terapötik ajanlar tanımlamak kritik bir öneme sahiptir. Bazal benzeri tip tümörlerin kötü prognozları ve agresifliği p53 mutasyonunun bu tümörlerde yüksek oranda bulunması ile açıklanabilir [85]. Ayrıca bazal benzeri alt tipte BRCA1 mutasyonlu tümörler bulunmuştur [119]. Epigenetik mekanizmalar ya da mutasyon ile BRCA1’in fonksiyonunda azalmayı içeren değişiklikler; bazal benzeri tümörlerin oluşmasına, ER ekspresyonunun bulunmamasına ve kötü prognoza eğilim yaratmaktadır [113].
BRCA1, DNA tamirinde kritik rol oynar ve BRCA1’in inaktivasyonu tümör gelişiminde genetik instabiliteye ve hataların birikimine yol açar. Bu özellikler platin tuzları gibi DNA hasarının sitotoksik indükleyicilerinin gelişiminde temel rol oynar. Özellikle triple negatif tümörleri tedavi etmek için poli-ADP riboz polimeraz -1 (PARP-1) inhibitörleri geliştirilmiştir. PARP-1 DNA tek zincir kırıklarının onarımında anahtar rol oynar. PARP-1 inhibisyonu BRCA-1 ile defektif DNA onarımı kapsamında çift zincirli DNA’nın kırılmalarının birikimine ve hücre ölümüne yol açar. BRCA1 ve BRCA2 mutasyonlu meme kanserlerinde monoterapi olarak Faz 1 çalışmalarda kullanılan olaparib (AZD2281)in yüksek yanıt oranları ve klinik yararı olduğu gösterilmiştir (sırasıyla %47 ve %63)[120].
1.9.4 Normal meme tipi
Bu alt tipin gerçek varlığı hakkında şüpheler vardır ve bazı araştırmacılar mikroarray esnasında normal doku ile yüksek bulaşmadan dolayı tekniksel bir artefakt olabileceğine inanırlar[121]. Gerçekte mikro diseksiyon ile izole edilen neoplastik hücre örneklerinin büyük serilerinde, tekniksel artefakt hipotezini destekleyecek şekilde normal meme tipi bulunamamıştır.
Tüm meme kanserlerinin %5-10’unu oluşturur. Fibroadenomların ve normal meme örneklerinin intrinsik alt tiplerin sınıflandırılmasında gruplandırılmıştır ve yeterince iyi tanımlanmamıştır. Adipoz dokuların karakteristik genlerini eksprese eder, luminal ve bazal benzeri tip arası orta bir prognoza sahiptir ve genellikle neoadjuvan kemoterapiye cevap vermez. ER, PR ve HER2 ekspresyonu yoktur, bu yüzden bu tümörler triple negatif gibi sınıflandırılabilir. CK 5 ve EGFR negatif olduğundan bazal benzeri tip olarak düşünülmez. Bu tipin nadir olmasından dolayı klinik önemi belirlenememiştir ve üzerine az çalışma yapılmıştır.
1.9.5 Claudin-low tip
Tüm meme kanserlerinin %12-14’ünü oluşturur. Meme kanserinin ilk moleküler alt tip sınıflandırmasından sonra 2007’de yeni bir intrinsik alt tip tanımlanmıştır. Bu alt tip sıkı bağlantıları ve claudin-3, -4, -7’yi, cingulini, ocludini ve E-cadherini kapsayan intraselüler adezyonları içeren genlerin düşük ekspresyonu ve farklılaşmış luminal hücre yüzey markırları (EpCAM ve MUC1) ile karakterizedir. Bundan dolayı bu alt tip claudin-low olarak adlandırılmıştır. Bu alt tipin luminal gen grupları ve HER2’nin düşük ekspresyonu gibi bazı karakteristik genleri paylaştığı düşünülürse, bu alt tip hiyerarşik gruplandırmada bazal benzeri tümörlerin yakınında yer alır. Bu yeni grupta bazal benzeri tümörlerin aksine tümör immun sistem hücrelerinin yüksek infiltrasyonunu gösteren immun yanıt ile ilişkili 40 genlik bir grubun artmış ekspresyonu vardır [106, 122]. Hücre proliferasyonu ile ilişkili genlerin ekspresyonu düşük olsa da bu tümörler kötü prognoza sahiptir. Ayrıca bu tümörler mezenkimal değişim için bulunan genlerin bir alt grubunun artmış ekspresyonuna sahiptir. Bu özellikler bir kanser kök hücre fenotipinin elde edilmesini akla getirmiştir. Yüksek derecede infiltratif duktal karsinomaya benzeyen bu tümörler, metaplastik veya medüller diferansiasyon ile birlikte bulunabilir ve nadir görülen bir alt gruptur [122, 123].
IHK’sal olarak genellikle triple negatiftirler ancak bazal benzeri tipte olduğu gibi, triple negatif ve claudin-low uyumu %100 değildir. Claudin-low tümörlerin yaklaşık %20’sinde hormon reseptörleri negatiftir [107]. Bu alt tip bazal ile luminal tip arası orta değerli, yetersiz bir neoadjuvan tedavi cevabı göstermektedir. Uzun dönemde kötü bir prognoza sahiptir [107].
1.10 MOLEKÜLER SINIFLAMADA TEDAVİ YAKLAŞIMI
St Gallen International Expert Consensus for Early Breast Cancer 2011 tedavi kararı vermede moleküler sınıflamanın yararlı olduğunu kabul etmiştir.
Luminal A’da yüksek riskli durumlar hariç endokrin tedavi, Luminal B’de kemoterapi ve endokrin tedavi ve buna ek olarak HER2 pozitifliği varlığında anti-HER2 tedavi ve Triple negatif birçok hastada kemoterapi güvenlidir. Aşağıdaki tabloda St Gallen International Expert Consensus for Early Breast Cancer 2011’in tedavi yaklaşımı özetlenmiştir.
Tablo 5.Subtipler için önerilen sistemik tedavi
‘Subtip’ Tedavi seçimi Tedavi ile ilgili notlar
‘Luminal A’ Endokrin tedavi Bazı durumlarda sitotoksik tedavi de gerekir (Yüksek lenf nodu tutulumu gibi).
‘Luminal B(HER2-)’ Endokrin ve/veya
Sitotoksik tedavi
ER reseptör ekspresyonu düzeyi ve hasta seçimine
göre sitotoksik ajan seçilir .
‘Luminal B(HER2+)’ Sitotoksik tedavi+ Anti HER2+endokrin tedavi
Bu grupta sitotoksiklerin kullanılmamasını destekleyen hiçbir veri bulunmamaktadır.
‘HER2 +(non luminal) Sitotoksik tedavi+anti HER2
Çok düşük riskli hastalar (T1a ve nod negatif) sistemik adjuvan tedavi verilmeden izlenebilir.
‘Triple negatif(duktal)’ Sitotoksik tedavi ‘Özel histolojik tipler’*
A.Endokrin tedaviye yanıtlı
B.Endokrin tedaviye yanıtsız
Endokrin tedavi
Sitotoksik tedavi Medüller ve adenoid kistik karsinom eğer lenf nodu tutulumu yoksa adjuvan sitotoksik tedavi gerekmez.
*Özel histolojik subtipler: Endokrin yanıtlı (kribriform, tubuler, musinöz); endokrin yanıtsız(apokrin, medüller,adenoid kistik ve metaplastik)
1.11 MEME KANSERİNDE TEDAVİ
Meme kanseri tedavisi hastalık evresine göre planlanır. Bu planlama yapılırken hastanın yaşı, menopoz durumu, patoloji sonuçları, ER, PR, HER2 durumu dikkate alınır. Tedavi seçenekleri cerrahi, kemoterapi, radyoterapi ve hormonoterapiden oluşan multidisipliner tedavidir.
1.11.1 Meme kanserinde cerrahi
Cerrahi tedavi meme kanserinin temel taşını oluşturmaktadır. Son 20 yılda erken evre meme kanserinin tedavisinde oldukça büyük değişiklikler olmuştur [124]. Modifiye radikal mastektominin yerini meme koruyucu cerrahi almıştır. Yirmi yıldan fazla takip süresi olan çalışmalar sonucunda meme koruyucu cerrahinin mastektomiye eşdeğer sağkalım sağladığı gösterilmiştir [125]. Aynı zamanda sentinel lenf düğümü biyopsisinin kullanımı ile birlikte aksiller küretaj sayısındaki azalma cerrahinin morbiditesinde de azalmaya neden olmuştur. Meme koruyucu cerrahi tekniği mastektomiden daha komplikedir bu nedenle meme koruyucu cerrahinin uygulanma oranları merkezlere göre değişiklik göstermektedir. Uygun hasta seçimi, cerrahi sınır sorunu, optimal kozmetik sonucun elde edilmesi ve adjuvan tedavilerin zamanlaması ve seçimi gibi konular hala tartışmalıdır. Meme koruyucu cerrahinin amacı 10 yıllık nüks oranını %5-10 arasında ve yıllık nüksü de %1 civarında tutmaktır [126].
Meme koruyucu cerrahi
-Lumpektomi: Tümörün temiz kenar elde edilecek şekilde çıkarılması ; gerekli olan temiz kenarların tam genişliği tartışmalıdır.En iyi kozmetik sonuçlar üst dış kadrandaki lezyonlarda sağlanır. Kanser ne kadar periferde ve meme ne kadar büyükse memenin korunması daha kolay ve şekil kusuru daha az olur.
-Kadranektomi(segmentektomi): Meme kanserinin segmental gelişme biçimine göre
şekillendirilmiştir. Kenarda yaklaşık 3 cm’lik normal doku ve üzerindeki bir miktar cilt alttaki kas fasyası ile birlikte tümör blok olarak çıkarılır. Kaslar çıkarılmaz.
Mastektomi:
-Modifiye radikal mastektomi (MRM): ALND, pektoralis majör kası ve lateral pektoral sinirin korunarak memenin çıkarılması buna minör pektoral kas da eklenebilir.
-Total mastektomi : ALND yapılmaksızın basit mastektomidir. 1.11.2 Radyoterapi:
Meme kanserinde radyoterapi lokal hastalığın kontrolünü sağlamakta oldukça etkilidir. Aynı zamanda meme koruyucu cerrahi uygulanan hastalarda da oldukça önemlidir [127]. Mastektomili hastalarda kemoterapiyi takiben önerilmektedir. Bu yaklaşım lokal nüks oranlarını azaltmaktadır [128]. Radyoterapi özellikle aksiller lenf nodu tutulumu olan hastalarda sağkalımı da uzatmaktadır.
1.11.3 Kemoterapi
The Early Breast Cancer Trialist’ Collaborative Group (EBCTCG) 2005’te erken evre meme meme kanserinde çeşitli sistemik adjuvan tedavilerin meme kanseri rekürrensi ve yaşam süreci üzerine olan 10 ve 15 yıllık etkilerini yayınlamıştır. Bu çalışmada CMF (siklofosfamid, metotreksat, fluorourasil); FAC (fluorourasil, doxorubisin, siklo fosfamid) ya da FEC (fluorourasil, epirubisin, siklosfamid) gibi antrasiklin içeren kombinasyonlar, tamoksifen kullanılmıştır.
Yaklaşık 6 ay boyunca antrasiklin içeren polikemoterapi (FAC ya da FEC) kullanımı 50 yaşından önce tanı alan kadınlarda yıllık meme kanserinden ölüm oranını %38 azaltmıştır. 50-69 yaş arasında tanı alan kadınlarda ise yaklaşık %20 yıllık meme kanserinden ölüm oranını azaltmıştır. Bu durum büyük ölçüde tamoksifen kullanımı, ER durumu, nodal tutulum ve tümörün diğer özelliklerinden bağımsızdır.
Bu tedavi rejimleri CMF tedavisinden daha etkilidir. Sadece ER+ hastalığı olanlarda, 5 yıllık adjuvan tamoksifen kullanımı yıllık meme kanserin den ölüm oranını %31 azaltmıştır. Bu durum da büyük ölçüde yaş, kemoterapi kullanımı, PR durumu ve tümörün diğer özelliklerinden bağımsızdır. 5 yıl tamoksifen kullanımı önemli ölçüde 1-2 yıl tamoksifen kullanımından daha etkilidir.
Tek ajan kemoterapi rekurrens oranını azaltmaktadır, polikemoterapi (FAC ya da FEC) sadece rekürrens oranını değil aynı zamanda meme kanserinden ölüm oranını da azaltır. ER+ hastalığı olan hem genç hem de yaşlı kadınlarda kemoendokrin tedavi verilmesi yalnızca
endokrin tedaviden daha yararlıdır. Ayrıca hem yaşlı hem de genç kadınlarda kemoterapi sadece uzak metastazı değil aynı zamanda lokal rekürrensi de azaltır [55].
The Early Breast Cancer Trialist’ Collaborative Group (EBCTCG) 2012 metaanalizinde meme kanserinde adjuvan tedavide taxanlar da analize dahil edilmiştir [129]. Bu analizde standart doz antrasiklin içeren tedavilerin CMF ile eşdeğer olduğu, ancak yoğun antrasiklin içeren rejimlerden daha az etkili olduğu belirtilmiştir.
Bu analize göre; taxanlar (dosetaksel, paclitaxel) erken evre meme kanserinde en etkili ajanlardır. Taxanların kullanımının yararı yaş, lenf nodu durumu, tümör çapı, tümör grade’i ve ER durumundan bağımsızdır.
Lokal ileri evre meme kanserinde neeoadjuvan kemoterapi ile iyi objektif yanıt almak ve cerrahi uygulanabilen hasta sayısını arttırmak mümkündür. Meme kanserli hastalarda yüksek doz kemoterapi uygulamalarında net sonuçlar elde edilememiş olup klinik çalışmalar devam etmektedir [130].
Kemoterapi metastatik meme kanserinde temel palyatif tedavidir. Değişik kombinasyonlar kullanılmaktadır. CMF, CAF, CEF, CA sıklıkla ilk sırada kullanılmaktadır. Antrasiklin içeren rejimler daha etkindir ancak kardiyotoksisite açısından dikkatli olunmalıdır. Taksanlar son yıllarda kullanıma girmiş olan etkili sitotoksik ilaçlardır. Dosetaxel üç haftada bir 80-100 mg/m2 uygulanır ya da birbirini izleyen üç hafta haftada bir 30-40 mg/m2 ve bunu izleyen bir hafta boş bırakılarak kullanılır [131]. Dosetaksel kullanımı ciddi sıvı retansiyonu ile ilişkilidir ancak bu sistemik etki premedikasyon olarak dekort uygulaması ile azaltılabilir [132].
Paklitaxel, haftada bir 80-100 mg/m2 ya da üç haftada bir 175 mg/m2 uygulanır [131, 133, 134]. Alerjik reaksiyonlara neden olabilir. Paklitaxelde miyopati ve miyalji riski dosetaxelden daha fazladır. Orta dereceli karaciğer yetmezliğinde paklitaxel uygulanabilir ancak dosetaxel uygulanamaz. Dosetaxelin myelosupresif etkisi daha fazladır.
Mitomisin, sisplatin, etoposid, vinorelbin, kapesitabin ve gemsitabin kullanılabilecek diğer ilaçlardandır. Randomize çalışmalarda, kemoterapinin kombinasyon olarak kullanımının tek ajan olarak kullanımına göre daha iyi yanıt elde edilmesini sağladığı ve daha uzun hastalıksız sağkalım ve orta düzeyde genel sağkalım avantajı sağladığı belirtilmiştir [130] . Ancak kombinasyon rejimleri daha toksiktir[135].



![Tablo 4 .Meme Kanseri moleküler subtiplerinin tanımlanması[70, 98]](https://thumb-eu.123doks.com/thumbv2/9libnet/3040537.2774/26.892.103.790.135.852/tablo-meme-kanseri-molekuler-subtiplerinin-tanimlanmasi.webp)