T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
TÜRKĠYEDE'KĠ ENDEMĠK BAZI BUPLEURUM TAKSONLARININ SAĠKOSAPONĠN VE FENOLĠK MADDE
ĠÇERĠKLERĠNĠN HPLC ĠLE KARġILAġTIRILMASI
HAYRĠYE PÜR YÜKSEK LĠSANS Biyoloji Anabilim Dalı
Mart-2012 KONYA Her Hakkı Saklıdır
TEZ BĠLDĠRĠMĠ
Bu tezdeki bütün bilgilerin etik davranıĢ ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalıĢmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Hayriye PÜR 06.03.2012
iv ÖZET
YÜKSEK LĠSANS
TÜRKĠYEDE'KĠ ENDEMĠK BAZI BUPLEURUM TAKSONLARININ SAĠKOSAPONĠN VE FENOLĠK MADDE ĠÇERĠKLERĠNĠN HPLC ĠLE
KARġILAġTIRILMASI
HAYRĠYE PÜR
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
DanıĢman: Yrd. Doç. Dr. Mehtap AKIN 2012, 106 Sayfa
Jüri
Yrd. Doç. Dr. Mehtap AKIN Prof.Dr. Mustafa KÜÇÜKÖDÜK
Doç. Dr. Yüksel KAN
Bu araĢtırmada Türkiyede'ki bazı endemik Bupleurum taksonlarının saikosaponin ve fenolik madde içeriklerinin HPLC ile karĢılaĢtırılması amaçlanmıĢtır.
AraĢtırmada Bupleurum taksonlarından olan Bupleurum sulphureum Boiss.&Bal., Bupleurum turcicum Snogerup, Bupleurum lycaonicum Snogerup, Bupleurum heldreichii Boiss.&Bal., Bupleurum pauciradiatum Fenzl türlerine ultrasonikasyon yöntemi ile soğuk ekstraksiyon uygulanmıĢ ve türlerdeki kateĢin, epikateĢin, izokuersetin, kuersetin, podofilotoksin, saikosaponin-a ve saikosaponin-d içerikleri HPLC ile belirlenmiĢtir. Verilerin tek yönlü varyans analizleri SPSS (11.5) paket programı kullanılarak hesaplanmıĢ, türler ve kısımlar kendi aralarında Duncan Çoklu KarĢılaĢtırma Testi ile karĢılaĢtırılmıĢtır. Yapılan karĢılaĢtırmalar tablolar ve grafikler halinde verilmiĢtir.
Elde edilen sonuçlara göre; bu türlerde kateĢin, epikateĢin, izokuersetin, kuersetin, podofilotoksine rastlanmıĢ, fakat saikosaponin A ve D‟ye çoğunlukla rastlanmamıĢtır.
v ABSTRACT
MS
THE COMPARISON OF THE SAIKOSAPONIN AND PHENOLIC MATERIAL CONTENTS OF SOME ENDEMIC BUPLEURUM TAXA IN TURKEY
THROUGH HPLC
HAYRĠYE PÜR
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN BIOLOGY
Advisor: Asist. Prof. Mehtap AKIN 2012, 106 Pages
Jury
Asist. Prof. Mehtap AKIN Prof. Mustafa KÜÇÜKÖDÜK
Assoc. Prof. Yüksel KAN
The aim of the current study was to compare the saikosaponin and phenolic material contents of some endemic Bupleurum taxa in Turkey with HPLC.
In the research, the species of Bupleurum sulphureum Boiss.&Bal., Bupleurum turcicum Snogerup, Bupleurum lycaonicum Snogerup, Bupleurum heldreichii Boiss.&Bal., Bupleurum pauciradiatum Fenzl, which are known as Bupleurum taxa, were applied cold extraction through ultrasonication and the catechin, epicatechin, isoquercetin, quercetin, podophilotoxin, saikosaponin -a and saikosaponin-d contents in the species were determined through HPLC. One-way variance analyses of the data were carried out at the package program of SPSS (11.5), species and the parts were compared within themselves through Duncan Multiple Comparisons Test. The comparisons were tabulated and given in graphics.
Depending on the the results obtained, it was found that the species mostly had catechin, epicatechin, isoquercetin, quercetin and podophilotoxin, but they contained saikosaponin -a and saikosaponin-d in small quantities.
vi ÖNSÖZ
Bu çalıĢma Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı‟nda yüksek lisans tezi olarak hazırlanmıĢtır.
Yüksek lisans çalıĢmam boyunca her türlü yardım ve desteğini esirgemeyen, bilgi ve tecrübelerinden faydalandığım danıĢman hocam Sayın Yrd. Doç. Dr. Mehtap AKIN‟a, laboratuvar çalıĢmalarımdaki yardımları ve destekleri için Sayın Yrd. Doç. Dr. Gökhan KARS‟a, Sayın Yrd. Doç. Dr. Meltem DEMĠREL KARS‟a ve Sayın ArĢ. Gör. Dr. Hatice TANER SARAÇOĞLU‟na, istatistik çalıĢmalarım konusunda yardımlarını esirgemeyen Sayın Yrd. Doç. Dr. Bülent ÇELĠK‟e, projeye maddi desteklerinden dolayı Bilimsel AraĢtırma Projeleri (BAP) Koordinatörlüğüne, özellikle yaptığım çalıĢmaların her aĢamasında maddi ve manevi desteklerini esirgemeyen babam Ġbrahim PÜR‟e ve değerli aileme sonsuz teĢekkürlerimi sunarım.
Hayriye PÜR KONYA-2012
vii ĠÇĠNDEKĠLER ÖZET……… iv ABSTRACT……… v ÖNSÖZ……… vi ĠÇĠNDEKĠLER……… vii SĠMGELER VE KISALTMALAR……… x 1.GĠRĠġ……… 1 2.KAYNAK ARAġTIRMASI……… 9
2.1. Apiaceae (Umbelliferae) familyası……….. 14
2.2. Bupleurum türlerinin genel özellikleri... 15
2.2.1. Bupleurum sulphureum Boiss. & Bal ………... 16
2.2.2. Bupleurum turcicum Snogerup ………... 18
2.2.3. Bupleurum lycaonicum Snogerup ………. 19
2.2.4. Bupleurum heldreichii Boiss. & Bal ………. 21
2.2.5. Bupleurum pauciradiatum Fenzl ………..………. 22
3. MATERYAL VE YÖNTEM………. 24
3.1. Materyal………..……… 24
3.1.1. Bitki materyali………..……… 24
3.1.2. Kullanılan kimyasallar………..………. 24
3.1.2.1. Bitki materyalinin HPLC ye hazır hale getirilmesi için kullanılan kimyasallar ………..……… 24
3.1.2.2. HPLC de kullanılan kimyasallar………... 24
3.1.2.3. HPLC için hazırlanan standartlar……….. 25
3.1.3. Kullanılan cihazlar………..……… 25
3.2. Yöntem………..……… 25
3.2.1. Ekstraksiyona hazır hale getirilmesi……….……….…. 25
3.2.2. Ekstrelerinin hazırlanıĢı………..………….... 26
3.2.2.1. Ultrasonikasyon………..……….. 26
3.2.2.2. Rotary evaporatörde uçurma………..….. 26
3.2.2.3. Liyafilizatörle toz hale getirilmesi………. 26
3.2.3. HPLC yöntem parametreleri………..………. 26
3.2.3.1. Saikosaponin A ve Saikosaponin D için; …………..………... 26
3.2.3.2. Fenolik Maddeler için; ………..………... 27
3.2.3.3. Podofilotoksin için; ………..……….…... 27
3.2.4. Ġstatistik analizleri………..………. 28
4. ARAġTIRMA SONUÇLARI VE TARTIġMA……….. 29
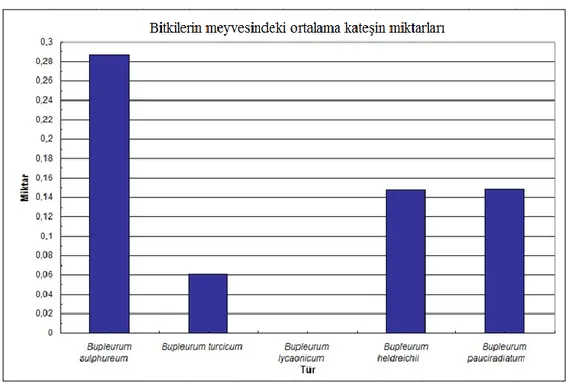
4.1. KateĢin……….. 31
4.1.1. KateĢin miktarlarının bitki türlerine göre karĢılaĢtırılması……… 31
viii
4.1.1.2. Meyve……….. 32
4.1.1.3. Çiçek……… 34
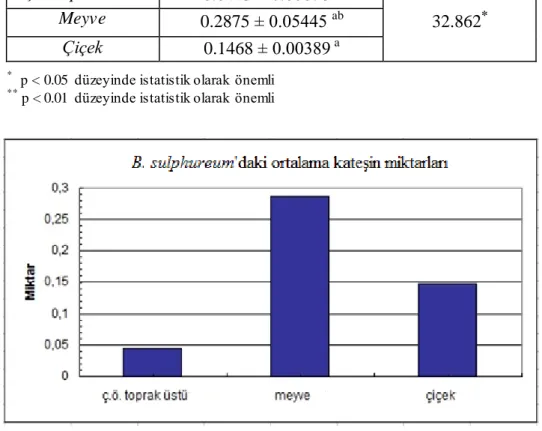
4.1.2. KateĢin miktarlarının bitkilerin kısımlarına göre karĢılaĢtırılması……… 35
4.1.2.1. Bupleurum sulphureum Boiss. & Bal ………. 35
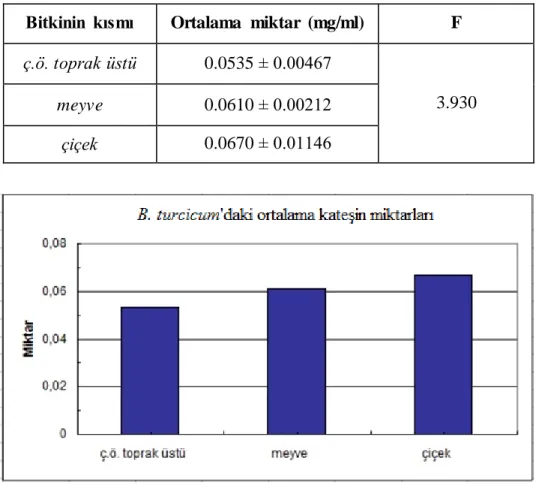
4.1.2.2. Bupleurum turcicum Snogerup ……….. 36
4.1.2.3. Bupleurum lycaonicum Snogerup ……….. 37
4.1.2.4. Bupleurum heldreichii Boiss. & Bal ……….. 38
4.1.2.5. Bupleurum pauciradiatum Fenzl ……… 39
4.2. EpikateĢin……… 40
4.2.1. EpikateĢin miktarlarının bitki türlerine göre karĢılaĢtırılması……… 40
4.2.1.1. Çiçeklenme öncesi toprak üstü……… 40
4.2.1.2. Meyve……… 41
4.2.1.3. Çiçek……… 43
4.2.2. EpikateĢin miktarlarının bitkilerin kısımlarına göre karĢılaĢtırılması…… 44
4.2.2.1. Bupleurum sulphureum Boiss. & Bal ………. 44
4.2.2.2. Bupleurum turcicum Snogerup ……….. 45
4.2.2.3. Bupleurum lycaonicum Snogerup ……….. 46
4.2.2.4. Bupleurum heldreichii Boiss. & Bal ……….. 47
4.2.2.5. Bupleurum pauciradiatum Fenzl ……… 48
4.3. Ġzokuersetin……….. 49
4.3.1. Ġzokuersetin miktarlarının bitki türlerine göre karĢılaĢtırılması………… 49
4.3.1.1. Çiçeklenme öncesi toprak üstü……… 49
4.3.1.2. Meyve……….. 50
4.3.1.3. Çiçek……… 52
4.3.2. Ġzokuersitin miktarlarının bitkilerin kısımlarına göre karĢılaĢtırılması…. 53 4.3.2.1. Bupleurum sulphureum Boiss. & Bal ………. 53
4.3.2.2. Bupleurum turcicum Snogerup ……….. 54
4.3.2.3. Bupleurum lycaonicum Snogerup ……….. 55
4.3.2.4. Bupleurum heldreichii Boiss. & Bal ……….. 56
4.3.2.5. Bupleurum pauciradiatum Fenzl ……… 57
4.4. Kuersetin………..… 58
4.4.1. Kuersetin miktarlarının bitki türlerine göre karĢılaĢtırılması………….… 58
4.4.1.1. Çiçeklenme öncesi toprak üstü……….… 58
4.4.1.2. Meyve………. 59
4.4.1.3. Çiçek……… 61
4.4.2. Kuersetin miktarlarının bitkilerin kısımlarına göre karĢılaĢtırılması…… 62
4.4.2.1. Bupleurum sulphureum Boiss. & Bal ………. 62
4.4.2.2. Bupleurum turcicum Snogerup ……….. 63
4.4.2.3. Bupleurum lycaonicum Snogerup ……….. 64
4.4.2.4. Bupleurum heldreichii Boiss. & Bal ……….. 65
4.4.2.5. Bupleurum pauciradiatum Fenzl ……… 66
4.5. Podofilotoksin………. 68
4.5.1. Podofilotoksin miktarlarının bitki türlerine göre karĢılaĢtırılması……… 68
4.5.1.1. Çiçeklenme öncesi toprak üstü……… 68
4.5.1.2. Meyve………. 69
4.5.1.3. Çiçek……… 70
4.5.2. Podofilotoksin miktarlarının bitkilerin kısımlarına göre karĢılaĢtırılması 71 4.5.2.1. Bupleurum sulphureum Boiss. & Bal ………. 71
4.5.2.2. Bupleurum turcicum Snogerup ……….. 72
ix
4.5.2.4. Bupleurum heldreichii Boiss. & Bal ……….. 74
4.5.2.5. Bupleurum pauciradiatum Fenzl ……… 75
4.6. Saikosaponin D.……… 76
4.6.1. Saikosaponin D miktarlarının bitki türlerine göre karĢılaĢtırılması…….. 76
4.6.1.1. Çiçeklenme öncesi toprak üstü……… 76
4.6.1.2. Meyve……… 77
4.6.1.3. Çiçek……… 78
4.6.2. Saikosaponin D miktarlarının bitkilerin kısımlarına göre karĢılaĢtırılması 79 4.6.2.1. Bupleurum sulphureum Boiss. & Bal ………. 79
4.6.2.2. Bupleurum turcicum Snogerup ……….. 80
4.6.2.3. Bupleurum lycaonicum Snogerup ……….. 81
4.6.2.4. Bupleurum heldreichii Boiss. & Bal ……….. 81
4.6.2.5. Bupleurum pauciradiatum Fenzl ……… 81
5. SONUÇLAR VE ÖNERĠLER……… 96
5.1. Sonuçlar……….. 96
5.2. Öneriler ……… 97
KAYNAKLAR……… 99
x
SĠMGELER VE KISALTMALAR
Kısaltmalar
TT: Tamamlayıcı Tıp
TAT: Tamamlayıcı Alternatif Tıp
HPLC: Yüksek Basınçlı Sıvı Kromotografi Ç.Ö.T.Ü.: Çiçeklenme Öncesi Toprak Üstü PPT: Podofilotoksin
TLC: Ġnce Katmanlı Kromotoğrafi UV: Ultraviyole
MS: Kütle Spektrometre IR: Ġnfrared Spektrometre
NMR: Nükleer Manyetik Rezonans Spektrometre LC-MS: Sıvı Kromotografi- Kütle Spektrometre LC-PDA: Sıvı Kromotografi- Foto Diyot Dizi F: Varyans Testi
1. GĠRĠġ
Geleneksel tıp, sağlıklı kalmanın yanı sıra, fiziksel ve zihinsel hastalıkları teĢhis etme, engelleme ya da tedavi etmek için doğal kaynaklardan faydalanılarak, farklı kültürlerde kullanılan yerel teoriler, inanç ve deneyimlere dayalı uygulamaların tümüdür. Geleneksel tıp genelde alternatif ya da tamamlayıcı tıp olarak da ifade edilir (Dünya Sağlık Örgütü, 2008).
Bitkilerle tedavi (fitoterapi), bitkiler, bitki materyalleri, bitkisel preparatlar ve etken madde olarak bitkilerin bir parçasını ya da tümünü içeren mamul bitkisel ürünleri kapsamaktadır (Dünya Sağlık Örgütü, 2008).
Bazı Asya ve Afrika ülkelerinde nüfusun %80‟i hastalıkların tedavisinde öncelikli olarak geleneksel tıbba güvenmektedir. Pek çok geliĢmiĢ ülkede ise nüfusun % 70 ile % 80‟i alternatif ya da tamamlayıcı tıbbı bir Ģekilde kullanmıĢtır (örn: akupunktur) (Dünya Sağlık Örgütü, 2008).
Geleneksel tıp birçok enfeksiyon ve kronik hastalık durumlarında kullanılmaktadır. Örneğin yaklaĢık 2000 yıldır Çin‟de kullanılan bir bitki olan Artemisia
annua L. bitkisinden elde edilen artimisinin keĢfi ve çıkarılmasıyla yeni sıtma ilaçları
geliĢtirilmiĢtir. Ancak uluslararası piyasalardaki sahte ürünler, kötü kalite ya da yetiĢkinlere yönelik bitkisel ürünler hastalar için ciddi güvenlik tehditleri oluĢturmaktadır. Bunun için 100‟den fazla ülke yasalarında bitkisel ürünlerle ilgili düzenlemeler yapmıĢtır. Buna karĢılık, çoğu ülkenin geleneksel tıp için ulusal politikaları bulunmamaktadır. Geleneksel tıp ürünlerinin uygulamalarında düzenlemeler yapılması geleneksel tıp terapilerinin tanımlarındaki ve sınıflandırılmasındaki farklılıklar yüzünden oldukça zordur. Basit bir bitkisel ürün ülkelere göre bir yiyecek, diyet takviyesi ya da bitkisel tıp ürünü olarak tanımlanabilmektedir. Ulusal düzeyde yapılacak düzenlemelerde, bu tür farklılıklar ürünlerin uluslararası eriĢimi ve dağıtımında kendini göstermektedir (Dünya Sağlık Örgütü, 2008).
Bitkisel tedaviler geleneksel tıbbın en popüler biçimi olup, uluslararası piyasalarda oldukça fazla ilgi görmektedir. Batı Avrupa‟daki yıllık gelirler 2003-2004 yılları arasında 5 milyar dolarlık bir miktara ulaĢmıĢtır. Bu ürünlerin Çin‟de satıĢından elde edilen gelir 2005 yılında 14 milyar dolar olmuĢtur. Brezilya‟da ise 2007 yılında elde edilen gelir 160 milyon dolar olmuĢtur (Dünya Sağlık Örgütü, 2008).
Diğer taraftan pek çok insan geleneksel ilaçların bitkisel (doğal) olması nedeniyle güvenli olduğuna yani herhangi bir risk taĢımadığına inanmaktadır. Oysa,
2 geleneksel ilaçlar ve uygulamalar eğer ürün ya da terapi yeteri kadar kaliteli değilse ya da uygun biçimde veya baĢka ilaçlarla birlikte kullanılırsa zararlı ve yan etkilere sahip olabilmektedir.
Yapılan bir çalıĢmada hastaların tamamlayıcı tıp (TT) ve bunlarla ilgili bilgiden yararlanma boyutlarını ve bunlarla ilgili tutumlarını incelemek amacıyla, tıp uygulamaları için rastgele seçilen 25 aileye yapılan ziyaretlerle 740 hasta üzerinde inceleme yapılmıĢtır. TT kullandığını bildirenlerin 1/3 ü genellikle bir doğal ilacı (%67.6) geleneksel ilaçlarla birlikte kullandığını ifade etmiĢlerdir. Doğal ilaç kullananlar arasında %56.2 si bunların hiçbir yan etkiye neden olmadığını, %44.7 si kullandığı doğal ilacı doktoruna söylemediğini, %11 i de çok nadir söylediğini bildirmiĢtir. Doğal ilaçların yan etkiye neden olabileceği inancı ile ilaç kullanımını aile doktoruna bildirme eğilimi arasında önemli bir iliĢki bulunmuĢtur (p = 0.03). Ġlaç kullanmayanlarla karĢılaĢtırıldığında herhangi bir TT kullanıcısı yaĢ olarak daha büyük (her yaĢa göre 1.05 kat artıĢla), kendi sağlık durumunun kötü olduğunu belirtiyor (8.6 kat daha fazla görülme sıklığı), aile doktoruna daha sık gidiyor ve Doğu Avrupa kökenliydi. Sonuç olarak doğal ilaçların kullanımı kapsamlı olmasına rağmen, hastanın bunların potansiyel yan etkileri konusundaki bilgisi zayıftı. Bu yüzden, güvenli kullanım için hasta farkındalığının artmasının yanında, geleneksel ve diğer ilaçların tedarikçileri arasındaki eğitim, iĢbirliği ve iletiĢim de son derece önemlidir. (Shmuel ve ark., 2003).
Bir baĢka çalıĢmada ise Ernst (1995), geleneksel tıbbın dıĢında bir bakım türü olarak tanımlanan tamamlayıcı tıbbın (TT) Ġngiltere‟nin yanı sıra diğer ülkelerde de geliĢmekte olduğu belirtilmiĢtir. Ġngiltere‟de en yaygın terapilerin elle yapılan tedaviler (nüfusun % 36‟sı tarafından baĢvurulmaktadır), bitkisel tedavi (%24), homoepati (%16) ve akupunktur (%16) olduğu bulunmuĢtur. TT‟nin çeĢitliliği yüzünden, bunu genellemek problem oluĢturmaktadır. TT‟nin yararlılığı üzerine yapılan tartıĢmalar daha çok duygusal içeriklidir ve bu yüzden verimli değildir (Ernst, 1995).
ABD‟de yetiĢkinler arasında tamamlayıcı ve alternatif tıp (TAT) kullanımı üzerine 18 yaĢ ve üzeri 31.044 kiĢi üzerinde birebir görüĢme yöntemiyle yapılan bir araĢtırmada Barnes ve ark. (2002), terapiye dua dahil edildiğinde yetiĢkinlerin % 62‟si son 12 ay içinde bir tür TAT terapisini kullandığını ifade etmiĢlerdir. Özellikle sağlık nedeni için dua tanımın dıĢında tutulduğunda, yetiĢkinlerin % 36‟sının son 12 ayda bir tür TAT terapisi kullanmıĢlardır. Son 12 ay içinde en çok kullanılan TAT terapileri Ģu Ģekilde olmuĢtur: Doğal ürünler (%18.9), derin nefes alma egzersizleri (%11.6),
meditasyon (%7.6), omurgaya uygulanan masaj tedavisi (kiral uygulama) (%7.5), yoga (%5.1), masaj (%5.0) ve diyete bağlı terapiler (%3.5) (Barnes ve ark., 2002).
Geleneksel bitkilerin kullanımı ile ilgili araĢtırmacılar yalnızca bu bitkilerin bilimsel kulanım yüzdesini belirleme üzerine değil aynı zamanda içerdikleri etkili bileĢenleri de tespit etmeyi amaçlamaktadırlar. Tıbbi kullanılabilirliği olan hedef bitkilerin, bilim adamlarının bilgisi ile geleneksel kullanımındaki bilgilerin bir araya getirilmesi ile rastgele uygulanan prosedürlerden dolayı meydana gelen gereksiz deneme ve yanlıĢ kullanımlarına son verilebilir (O'Gara ve ark., 2000). Biyolojik aktiviteyi tespit etmek için çeĢitli uygulamalar mevcuttur. Bu uygulamalar Öncelikle in-vitro Ģartlarda daha sonra doğal ürünlerdeki tepkisi in-vivo koĢullarda değerlendirilir. Kaba yada parçalı ekstraktların bazen antimikrobiyal, antiinflamatuvar, antioksidan, antihelmintik, antiamoebik, anthistosomal ve antimalariyal aktivite bulundurdukları rapor edilmiĢtir (O'Gara ve ark., 2000).
Newton ve arkadaĢları tarafından 2000 yılında 350 doğal ürünün antimikobakteriyel aktivite gösterdiği yayınlanmıĢtır (Billoa ve ark., 2005). Bazı bileĢenler, örneğin, alkoloidler (Houghton ve ark., 2002; Newton ve ark., 2002), flavonoidler (Lin ve ark., 2002) yada diğer terponoidlerin (Cantrell ve ark., 2001) antimikobakteriyel aktivite gösterdiği literatürde bildirilmiĢtir. Bu anlamda tıbbi bitkiler orijinal aktif ilaçlar ya da yeni etkili ajanlar konusunda çok önemli kaynaktır.
Tıbbi bitkiler asırlar boyunca çeĢitli Ģekillerde, çeĢitli amaçlar için kullanılmıĢtır. Türk halkının çoğunluğu kırsal bölgelerde yaĢadığı için bitkilerle yakından ilgilidir. Bitkiler gıda, baharat, boyar madde ve büyü yapmak amacıyla kullanılmaktadır.
Tedavi amacıyla kullanmak için de bitkiden en fazla nasıl yararlanılır düĢüncesiyle çeĢitli Ģekillerde hazırlanır. En basit yol, droğu toz haline getirerek kullanmaktır. Böylece hem etken maddesi dıĢa çıkarak etki süresi artacaktır hem de vücuda alması kolay olacaktır.
Toz (pulveres): Bitki parçaları havanda dövülür ve bir miktar suya karıĢtırarak içilir.
Hap (pilulae): Ġnce toz halindeki droğun bir yardımcı madde (sıvağ) yardımı ile hap haline getirilmesiyle elde edilir. Hapların ağırlığı 1-2.5 gram arasında olmalıdır. Sıvağ olarak ise bal, Ģeker Ģurubu, niĢasta, leblebi unu, arap zamkı, meyan balı gibi tedavi etkisi bulunmayan maddeler seçilmelidir.
Ġnfüzyon (infusa): Drogların ilaç olarak kullanılmasında en çok kullanılan Ģeklidir. Ġnfüzyonu hazırlamak için ufalanmıĢ bitki parçaları üzerine kaynar su dökülür
4 ve kapalı bir kapta, sık sık karıĢtırılarak, çok hafif ateĢ üzerinde 5 dakika tutulur, soğuduktan sonra süzülerek içilir. Kullanılacak drog miktarı 100 grama 2 gram Ģeklindedir.
Dekoksiyon (decocta): UfalanmıĢ bitki parçaları üzerine soğuk su ilave edilir ve hafif ateĢ üzerinde, sık sık karıĢtırarak yarım saat ısıtılır ve sıcak iken süzülerek içilir. Kullanılacak drog miktarı 100 grama 2 gram Ģeklindedir.
Ġnfüzyon ve dekoksiyon yönteminde bitkinin hangi parçasının kullanıldığı önemlidir. Kök, yaprak, çiçek ve meyve için farklı süreler kullanılır.
Merhem (unguenta): Katı yağ, sıvı yağ, lanolin ve vazelin gibi yağlar kullanarak, yapılan ve harici kullanılan yöntemdir. Havanda toz haline gelmiĢ bitki sıvağ maddesi ile karıĢtırılarak elde edilir.
Tıbbi yağ (olea medicata): Genellikle haricen kullanılan bir yöntemdir. 10 kısım kuru droğun 100 kısım zeytinyağı ya da haĢhaĢ yağı içinde 2 hafta kadar güneĢte tutulması ve sonra da süzülmesi ile elde edilir. Kantaron yağı, Sedefotu yağı, Papatya yağı, Kudretnarı yağı gibi yağlar bu yol ile elde edilir.
Kokulu yağ (olea aromatica): Kokulu çiçek veya bitki parçalarının 1-3 gün zeytinyağı veya susam yağı içinde tutulması ve süzülmesiyle elde edilir. 500 gram kuru veya taze çiçek 2000 gram yağ içinde, adi ısıda, 1-3 gün bırakılır. Sonra süzülür ve sıvı kısım içine tekrar 500 gram çiçek konulur. 3 gün sonra süzülerek hazırlanır. Haricen kullanılır.
Tentür (tincturae): Bitkisel materyal su, alkol veya eter gibi çözücüler ile tüketilen sıvı preparattır. Bir kısım kurutulmuĢ ve toz edilmiĢ drog 5 kısım alkol ile kapalı bir ĢiĢe içinde sık sık çalkalanarak 10 gün tutulur ve sonra süzülür. Bekletme karanlık bir yerde ve normal sıcaklıkta yapılmalıdır.
Hulasa (extracta): Bitkisel materyalin su, alkol veya eter gibi uçurulabilen çözücüler ile tüketilmesi sonucu elde edilen solüsyonun belli bir orana kadar uçurulması ile elde edilen preparatlardır. Bunlar genellikle bal kıvamında veya toz halinde preparatlardır (Yarar, 1948).
Fenoller, oksijenli aromatik bileĢiklerden olup, bir veya daha fazla hidroksil (OH) grubu taĢıyan en az bir aromatik halkaya sahip organik ve kristal yapıdaki maddelerdir. Renksizdir ancak hava ile temas ettiklerinde kırmızı renk gösterirler. Suda orta derecede, organik çözücülerde (alkol, eter vb.) iyi çözünür. Çok zehirlidir, cilde değmesi durumunda yanıklar meydana getiriler. Seyreltik çözeltileri dezenfektan olarak
kullanılır. Birden çok polimerin (polifenoller, flavonoidler vb.) çıkıĢ maddesidir (Keskin, 1981; Tekman ve ark., 1981; Bilgener, 1998).
Flavonoidler genelde stabil bileĢiklerdir. Taze, kurutulmuĢ ve öğütülmüĢ gıdalardan sıcak ya da soğuk çözgenlerle ekstrakte edilebilirler. Bunun için uygun çözgenler; etanol, metanol, aseton ya da dimetilformamid içeren sulu çözeltilerdir (Robard ve Antolovich, 1997).
Flavonoid iskeleti çoğunlukla heterosiklik bir halka oluĢturacak Ģekilde oksijen ile kapalı halde bulunan üç karbonlu bir zincirle bağlanmıĢ iki fenolik halkadan (A ve B) oluĢur. Bazı durumlarda üç karbonlu zincir açık halde bulunabilir. Bu yapı kalkon olarak adlandırılan bir alt grubu oluĢturur. Flavonoid gruplarının karakteristik özelliklerini merkez heterosiklik halka belirler ve flavonoidler bu özelliklerine göre sınıflandırılabilirler. Bitkilerde bulunan birçok flavonoid bileĢiğini farklılaĢtıran merkez halka yapısı ve B halkasına eklenen gruplardır.
Hidroksil grubu içeren ve üçüncü karbonlarında doymuĢ bağ içeren flavonoidler, flavanol olarak bilinirler. Flavan-3,4-dioller ve flavan-3-oller bu gruba dahildir. Birçok flavan-3-ol izole edilmiĢ olmasına rağmen bunların sadece dört tanesi meyvelerde bulunur. Bunlar (+)katesin, (-)epikatesin, (+)gallokatesin ve (-)epigallokatesindir (Shahidi ve Naczk, 1995).
Sekil 1.1.: Meyvelerde bulunan dört flavan-3-ol‟ün kimyasal yapısı (Margalit 2004).
Flavonoller, 3- hidroksiflavon içeren (3- hidroksi-2 fenilkromen- 4-1) bir flavonoid sınıfıdır. Bunların çeĢitliliği fenolik-OH grubunun farklı pozisyonlarından kaynaklanır. Bir baĢka flavonoid sınıfı olan flavanollerden (kateĢinde olduğu gibi) ayrılır. Flavonoller meyve ve sebzelerin büyük bir kısmında mevcuttur. Batı
6 populasyonlarında tahmini günlük alım flavonoller için günlük 20-50 mg aralığındadır. Bireysel alım tüketilen diyet türüne göre farklılık gösterir (Cermak ve Wolffram, 2006).
Flavonlar ve flavonoller gıdalarda genellikle aglikonlar veya glikozitler olarak bulunurlar. Meyvelerdeki flavon ve flavonol içeriği bitkinin yetiĢtiği Ģartlara, aldığı ıĢığa, olgunluğuna, büyüklüğüne ve çeĢidine bağlı olarak değiĢir. Flavonol ve flavon glikozitlerin oluĢumu ıĢığa bağlıdır. Bu bileĢenler meyve ve sebzelerde bazı tip renk problemlerinden sorumlu olabilirler (Shahidi ve Naczk, 1995).
KUERSETĠN ĠSOKUERSETĠN
ġekil 1.2.: Flavonollerden kuersetin ve izokuersetinin kimyasal bağ yapısı
Bitkilerin sekonder metabolizma ürünlerinden olan flavonoidlerden antosiyaninlerin çiçek ve meyve pigmenti olduğu, polimer fenoller olan ligninlerin de hücre duvarında yapı materyali olarak görev yaptığı bilinmektedir. Antosiyaninler ve kondanse tanenleri içerisine alan flavonoidler, fenilpropanoid sentezi sırasında oluĢan p-coumaric asitten meydana gelir. Flavonoidlerin diğer bir grubu da hidroliz olabilen gallik asit ve türevleri doğal ortamda Ģikimik asit sentez yoluyla sentezlenir (Keskin, 1981; Bilgener, 1998).
Podofilox olarak da bilinen Podofilotoksin (PPT) Podofilium türlerinin köklerinden ve rizomlarından çıkarılan alkoloid olmayan, polifenol grubundan olan toksin bir lignandır. Topikal bir jel olan Kondilox ticari ismiyle, bazı HPV türlerinin neden olduğu dıĢarıdaki genital siğilleri tedavi etmek için deri lezyonu olarak kullanılır. PPT ve türevleri müsil, vezikan, antiromatoid, antiviral ve antitümör ajanlar gibi tıbbi uygulamalarda geniĢ bir alan oluĢturur. Bu türevler arasında etoposid, teniposid ve etofoslar bulunmaktadır. Bunların antikanser aktiviteleri üzerinde çok sayıda çalıĢma bulunmakta ve akciğer kanseri, lenfomalar ve genital tümörler dahil değiĢik kemoterapilerde kullanılmaktadır (Xu ve ark., 2009).
ġekil 1.3.: Podofilotoksinin kimyasal bağ yapısı
Saponinler yapısal olarak aglikan (steroid veya triterpenoid lipofilik bir çekirdek) ve glikan (karbonhidrat grubu) olmak üzere iki kısımdan oluĢan glikozitlerdir (Güçlü ve Uyanık, 2004). Saponinlerin aglikan kısımları “genin” ya da “sapogenin” olarak adlandırılır ve içerdiği aglikan grubuna göre triterpen glikozitler, steroid glikozitler ve stereoid alkaloid glikozitler olarak sınıflandırılır (Sezgin ve Artık, 2010). Sezgin ve Artık (2010) çalıĢmalarında saponinlerin antifungal, antibakteriyel ve antikanser etkilerinin olduğu bildirmiĢlerdir.
Triterpenoid saponinler saponin bileĢikleri grubuna ait triterpenlerdir. Triterpenler birkaç oksijenin bağlı olduğu 30 karbonlu dört ya da beĢ halkalı bir yapılandırmada düzenlenen büyük bir bileĢik grubuna aittir. Triterpenler C30 bileĢiği oluĢturmak için sitosolik mevalonat yoluyla bir C5 izopren birimden oluĢurlar ve doğada steroidaldir. Kolesterol bir triterpen örneğidir. Fitosteroller ve fitoekdisteroidler de triterpendir. Triterpenler özel yapılarına göre yirmi kadar alt gruba ayrılmıĢtır. Bütün terpenoid bileĢiklerin memelilerde biyoaktivitesi bulunmasına karĢın, Panax ginseng ve
Eleutherococcus senticosus gibi bitkilerde adaptojenik etkisi için önemlidir.
Adaptojenik bitkilerdeki çoğu triterpenoid bileĢikler, değiĢik Ģeker moleküllerinin triterpen birimine bağlanması anlamına gelen saponin glikozitler olarak bulunur. Bu Ģekerler bakteriler tarafından bağırsak içinde kolayca çözülebilir ve aglikonun (triterpen) emilimine yardımcı olur (Klein, 2006).
8
ġekil 1.4. : (1) Saikosaponin-a; (2) saikosaponin-c; (3) saikosaponin-d; (4) saikosaponin-b1; (5) saikosaponin-h; (6) saikosaponin-b2.
Ġsimleri saikosaponin-a (1), -c (2), -d (3) olan üç önemli oleanan saponin ve pek çok önemsiz saponinler bitkilerden elde edilir. Bunların yapıları ġekil 2.4.‟de verilmiĢtir. Bu saikosaponinler farmakoloji ve immunoloji alanında geniĢ bir Ģekilde çalıĢılmaktadır. Aktiviteler saikosaponin -a ve –d‟nin, antikanser, antiinflamatuvar, kortikosteron salgılaması, plazma kolesterol düĢürücü aksiyon, hemolitik aktivite, membran akıĢkanlığına etki ve hepatik hasara karĢı koruyucu aktiviteye sahip olduğu bildirilmiĢ, ancak saikosaponin –c‟de hiçbir biyolojik aktivite gözlenmemiĢtir (Xiu-Qin ve ark., 2005).
AraĢtırmamızda Apiaceae familyasına ait Bupleurum spp. cinsinin Türkiye endemiği olan 5 türünün (B. sulphureum Boiss.&Bal., B. turcicum Snogerup, B.
lycaonicum Snogerup, B. heldreichii Boiss.&Bal., B. pauciradiatum Fenzl) bazı fenolik
ve saikosaponin yapılarının HPLC ile incelenmesi ve bu doğrultuda tıp ve eczacılık alanında yeni araĢtırmalara ıĢık tutması amaçlanmıĢtır.
2. KAYNAK ARAġTIRMASI
Bupleurum türleri geneleksel Çin tıbbında sıklıkla kullanılan bitkilerdendir
(Yano ve ark., 1994). B. sulphureum Boiss.&Bal., B. turcicum Snogerup, B. lycaonicum Snogerup, B. heldreichii Boiss.&Bal., B. pauciradiatum Fenzl türleri Türkiye‟ye endemik türlerdir. Bitkisel kimyasallar (fitokimyasallar); polifenoller, organo-sülfürler, karotenoidler, saponinler, fitosteroller, alkaloidler, terpenoidler baĢta olmak üzere çok sayıda grup ve otuz bine yakın çeĢit altında incelenir. Kuersetin, rutin, izokuersetin, kateĢin, robinin, tannin, bitkisel fenollere örneklerdir. Bitkisel fenollerin antioksidan aktivitesi ve kemopreventif özelliklerinin olduğu bilinmektedir (Cai ve ark., 2004). Polifenolik bileĢikler fizyolojik ortamda proteinlerle hidroksil grupları yoluyla fenolate iyonlarına ayrılır. Proteinlerin peptit bağlarının elektronegatif atomlarıyla hidrojen bağı veya bazik aminoasitlerin pozitif yan zincirleriyle iyonik bağlar oluĢtururlar. Bu etkileĢim proteinlerin üç boyutlu yapılarını ve aktivitelerini bozabilir. Literatürde p-glikoproteinlerin polifenolik bileĢikler tarafından bu tür etkileĢimler sebebiyle inhibe edilmiĢ olabileceği önerilmiĢtir (Manthey ve Guthrie, 2002).
Radix bupleuri geleneksel Çin tıbbında kullanılan bir ilaç olup kurutulmuĢ
Bupleurum chinense DC. ve Bupleurum scorzonerfolium WILD köklerinden elde
edilmektedir (Li ve ark., 2005). Temel olarak triterpen saponinleri içermektedir (saikosaponin a, b1–4, d, e, f, h ve saikogeninler a–g) (Chang 1987; Tang ve Eisenbrand, 1992). Özellikle saikosaponin-a ve -d‟nin antikanser etkiye sahip olduğu ve hücre zarının akıcılığını etkilediği belirtilmiĢtir (Li ve ark., 2005).
Bupleurum türleri üzerine yapılan çalıĢmalarda saponinler ve fenollerin tıbbi
önemi göz önüne alınarak incelemeler yapılmıĢ ve birçok değiĢik yöntemle ekstreleri çıkarılmıĢtır. Bupleurum rotundifolium‟dan yedi adet oleanane tipi triterpen saponinlerin in-vivo antiinflamatuvar etkisi incelenmiĢ ve bütün saponinlerin farelerde TPA-endeksli kulak ödemine karĢı etkili olduğu ve ayrıca 3 ve 6 no‟lu saponinlerin TPA çok dozlu deri kronik enflamasyonu modeli üzerinde etkili olduğu bulunmuĢtur (Navarro ve ark., 2001). Yine saponinlerin tıbbi etkileri göz önünde bulundurularak B.
scorzonerraefolium, B. falcatum‟da saponinlerin farelerde nefrotoksik serum nefrit
üzerine etkileri incelenmiĢ ve saikosaponin-c‟nin nefritin geliĢimini neredeyse tamamen engellediği ancak buna rağmen immün kompleks tortusu üzerinde bir etkisi olmadığı bulunmuĢtur (Chen ve ark., 2008). Benzer olarak, Umbelliferae bitkilerinden antiproliferatif bileĢenlerde, B. rotundifolium‟un meyvelerinden dokuz yeni triterpenoid
10 saponin elde edilmiĢ bunların insan gastrik adenokarsinoma (MK-1) hücre geliĢimine karĢı engelleyici bir etkisi olduğu gözlenmiĢtir (Fujioka ve ark., 2006).
B. scorzonerifolium Çin literatüründe antiinflamatuvar ve antihepatotoksik
olarak belirtilmektedir. Aynı zamanda bitkinin kökünde bulunan saikosaponinlerin de antiinflamatuvar ve antikarsinojenik aktivitesi olduğu gösterilmiĢtir (Mahato ve ark., 1988; Hsu ve ark., 2004). B. chinense saponinlerinin (BCS) farelerde ovalbümine verilen immün tepkiler üzerine hemolitik etkinlikleri ve adjuvan etkisi araĢtırılmıĢ ve BCS‟nin çok az hemolitik etki gösterdiği bulunmuĢtur (Sun, 2006). Yapılan baĢka bir araĢtırmada (Wang ve ark., 2004) Bupleurum kaoi‟nin CCl4-endeksli hasara karĢı
hepotoprotektif kapasitesi ile antioksidan enzimlerin etkisi incelenmiĢ ve R ve F1 fraksiyonlarının en yüksek oranda saikosaponin içeriğe sahip olduğu ve bunun da karaciğeri CCl4‟ün neden olduğu hasardan çok etkili bir Ģekilde koruduğu bulunmuĢtur.
Cheng ve ark. (2007), çocuklarda büyük oranda ölüme neden olduğu bilinen CVB1 enfeksiyonu üzerinde yaptıkları araĢtırmada B. kaoi‟nin CVB1 enfeksiyonuna karĢı engelleyici bir antiviral etkisi olduğunu bulmuĢlardır.
Birçok bitki ve mikroorganizmadan elde edilen doğal bileĢiklerin (karotenoidler, fenolik bileĢikler v.b) kanser ve diğer hastalıkların tedavisinde baĢarılı bir Ģekilde kullanıldığı bilinmektedir (Saklani ve Kutty, 2008; Gua ve ark. 2008; Sasaki ve ark., 2002; Sasaki ve ark., 2005). Bupleurum türleri kanser tedavisinde kullanılan ilaçların ve kemoterapinin yan etkilerinin meydana getirdiği negatif sonuçların önlenmesi için alternatif olarak görülmüĢtür. Bu amaçla Bupleurum türleri incelenmiĢ ve Cheng ve ark. (2003) B. scorzonerifolium in-vitro ve in-vivo A549 insan akciğer kanser hücrelerindeki antiproliferatif etkisi incelenmiĢ ve in-vivo çalıĢmanın sonucunda BS-AE nin A549 subkutan zenograf tümörlerinin geliĢimini engellediği görülmüĢtür. Bu da kimyasal kompozisyonunun çalıĢılması gerektiği sonucunu ortaya çıkarmıĢtır. Son zamanlarda B.
scorzonerifolium kökünden elde edilen toplam özütün ise akciğer kanseri model
hücrelerinde apoptozu aktive edip, telomeraz aktivitesini düĢürdüğü bulunmuĢtur (Cheng ve ark., 2003).
Ġncelemeler sonucunda birçok yeni saponinler bulunmuĢtur. Örneğin; Bupleurum
rigidum subsp. rigidum‟un bioaktif bileĢenleri incelenmiĢ ve toprak üstü kısımlarından
daha önceden bilinen bir saponinin yanı sıra altı yeni saponin bulunmuĢ ve bunların yapıları MS, IR ve NMR spektroskopi ve kimyasal ayrıĢtırılma yöntemiyle çalıĢılmıĢtır. Toprak üstü kısımdan çıkarılan iki saponinin oleanolik asit iliĢkisi bulunmuĢtur (Contreras ve ark., 2002). B. chinese‟nin toprak üstü kısımlarının kimyasal içeriği
üzerine yapılan bir çalıĢmada beĢ adet bileĢik elde edilmiĢ olup, bunlardan üç tanesine bu türde ilk defa rastlanmıĢtır (Wang ve ark., 2009). Bir baĢka çalıĢmada Bupleurum
polyclonum‟dan triterpenoid glikozitler izole edilmiĢ on altı adet triterpenoid glikozit
bulunmuĢ ve bunlardan üç tanesine ilk defa rastlanmıĢtır (Seto ve ark., 1986).
Bupleurum türlerinin toprak üstü kısımlarından alınan flavonoidlerin HPLC
analiziyle Çin‟in farklı bölgelerinden toplanan yirmi sekiz numunede on iki adet flavonoid belirlenmeye çalıĢılmıĢ ve sonuç olarak test aralıklarında r2>0.9995‟lik iyi bir lineer iliĢki tespit edilmiĢtir (Zhang ve ark., 2010). Çin‟in Güney Batısında tıbbi olarak kullanılan Bupleurum cinslerin altı türünün toprak üstü kısımlarının kimyasal bileĢenleri incelenmiĢ ve sonuçta sekiz adet flavonoid bileĢiği ile altı adet triterpenoid saponin elde edilmiĢtir (Luo ve ark., 1991).
Bitkisel ürünler genellikle meme kanseri (% 12), karaciğer hastalıkları (% 21), HIV (% 22), astım (% 24) ve romatolojik bozuklukları (%26) da içeren kronik tıbbi durumları olan hastalar tarafından kullanılmaktadır. Sentetik ilaç üretimi kalitesinde ve standartlar temelinde bitkisel ilaç üreten firmaların sayısı giderek artmaktadır. 1998'de en çok satan yedi bitkisel ilaç gingko, John's wort (Hypericum perforatum: sarı kantaron), ginseng, garlic, echinacea, saw palmetto ve kava‟dır (Bent ve Ko, 2004).
Fenol gruplarında yer alan hidroksil gurubunun sayısı bileĢiğin mikroorganizmalara olan toksik etkisinin miktarı ile iliĢkilidir. Bu konu ile ilgili en büyük kanıt hidroksil grubu fazla olan fenol bileĢenin toksitesinin artmasıdır (Geiisman, 1963). Buna ilaveten birçok yayında okside olmuĢ fenollerin mikroorganizmaları inhibe ettiği belirlenmiĢtir (Scalbert, 1991; Urs ve ark., 1975). Bu anlamda fenolik etkinin toksik metabolizmasına baktığımızda, mikroorganizmadaki enzim mekanizmasının, oksitlenmiĢ bileĢenler tarafından inhibe edildiği belirlenmiĢtir. Bunun yanı sıra sülfür bileĢenleri ile etkileĢim ya da proteinlerle olan spesifik olmayan bağlantılarda yine mikroorganizmayı inhibe edebilmektedir (Mason ve ark., 1987).
Tıbbi açıdan öneme sahip pek çok bitki türünde flavonoidlerin aktif indirgenler oldukları düĢünülür (Okuda ve Yoshida, 1992; Çam ve HıĢıl, 2003). Bitkilerde genellikle glikozitler Ģeklinde bulunan flavonoidler hidrofilik aktivite ve kimyasal stabiliteye sahip bileĢiklerdir. Bitkilerdeki antioksidatif aktivite flavonoidlere veya diğer stabil antioksidanlara bağlanabilir (Zhao ve Dieter, 2002; Çam ve HıĢıl, 2003).
Fenolik bileĢikler neredeyse bütün bitkisel kaynaklı gıdalarda ve içeceklerde bulunmuĢtur. Fenolik bileĢiklerin seviyeleri aynı türe ait bitkilerin farklı varyeteleri arasında bile çok farklı düzeyde olabilmektedir. Bitkilerde bazı bölümlerde daha yoğun
12 Ģekilde bulunmaktadır. Örneğin, flavonlar ve flavonol glikozitlerinin biçimlenmesi ıĢığa son derece bağımlı olduğu için bu bileĢikler bitkilerin yapraklarında ve dıĢ kısımlarında yoğun halde bulunurlar (Herrman, 1988; Bravo, 1998). Bitkisel gıdaların fenolik bileĢik içeriği genetik faktörler ve çevresel Ģartlara bağlıdır. Diğer etkilerden tohum kalitesi, olgunlaĢma derecesi, varyete, süreç, depolama gibi faktörler de fenolik bileĢik miktarı üzerine etki eder (Kühnau, 1976; Herrman, 1988; Bravo, 1998).
Yenilebilir flavonoidler son dönemde in-vitro ve in-vivo çalıĢmalarda insan sağlığında önemli rol oynayan birçok biyolojik yararları olduğuna dair yayınlar bulunmaktadır. Flavonoidler potansiyel antioksidanlar olup serbest radikalleri ortadan kaldıran, metal yakalayıcıdır. Aynı zamanda lipit peroksidasyonunu önler, antiinflamatuvar, antikanserojenik, antiartik ve antimikrobiyel aktivite gösterir. Epidomolojik çalıĢmalara göre flavonoid içeren besinlerin tüketilmesi kardiyovasküler rahatsızlıklar gibi kronik rahatsızlıkların riskini de azaltmaktadır (Cowan, 1999).
Saponinlerin sitotoksik ve antikanser aktiviteleri hücre zarındaki kolesterol ile kompleks oluĢturmasından kaynaklanmaktadır. Sonuç olarak hücre zarında porlar oluĢur ve hücrede sızıntılara neden olarak apoptoz tetiklenir. Saponinler aynı zamanda amfipatik özelliklerinden dolayı makromolekül ve polar ilaçların hücre zarından emilimini artırmak amacıyla da kullanılmaktadır. Yapılan bir çalıĢmada, Phytolacca
americana‟dan elde edilen triterpen saponinlerin dirençli rahim kanseri hücrelerinde
dirençliliği geri çevirici özellikleri olduğu gösterilmiĢtir (Wang ve ark., 2008).
Saponinler bazı deniz hayvanlarında ve çeĢitli bitkilerde, özellikle baklagillerde, doğal olarak bulunan glikozitlerdir (Milgate ve Roberts, 1995; Oleszek, 2002; Osbourn, 2003). Bu glikozitler, içeceklerde sabit köpük elde edilmesinde, madencilikte, fotoğrafçılıkta, kozmetik ve ilaç sanayinde kullanılabilmektedir (Cheeke, 1999). Ayrıca saponinlerin balık zehiri olarak kullanıldıkları, ağaç küflerinin geliĢimini inhibe etmede ve bitkileri böcek saldırılarına karĢı korumada etkili oldukları bildirilmektedir (Milgate ve Roberts, 1995; Osbourn, 2003). Yüksek dozlarının toksik olduğu bilinen (Ergün ve ark., 2002; Milgate ve Roberts, 1995) saponinlerin geçmiĢ yıllarda daha çok antinutrisyonel etkileri üzerinde durulmuĢtur (Morgan ve ark., 1972). Son yıllarda ise saponinlerin hipokolesterolemik, antikarsinojenik, antioksidan, antiinflamatör, antimikrobiyal, etkilerinin yanında immun sistem üzerine olumlu etkileri olduğu bildirilmektedir (Mahato ve ark., 1988; Ono ve Yamaguchi, 1999; Story ve ark., 1984; Vegemania, 1995).
Bupleurum özütlerinden saponinlerin izolasyonu için Barrero ve ark., (2000)
makalesinde belirtilen protokol bazı değiĢiklikler yapılarak araĢtırmamızda uygulanacaktır. Bu protokole göre bitki özütleri MeOH/H2O‟da çözüldükten sonra
tert-butilmetil eterle ekstrakte edilerek yaklaĢık 30 gram eter özütü elde edilir. Su fazı tekrar n-BuOH‟da ekstrakte edilir, solvent uçurma iĢlemi gerçekleĢtirilir ve Butanol fazı kromatografik yöntemlerle ayrıĢtırılır. Butanol fazı (yaklaĢık 2 gram) silika jel kolonunda CHCl3-MeOH ile elute edilecektir. Bazı fraksiyonlardan HPLC‟de
H2O±CH3CN yoğunluk farklarıyla saikosaponinler elde edilecektir.
HPLC flavonoid analizlerinde son 20 yılda en çok kullanılan teknik olmuĢtur (Robard, Antolovich, 1997; Merken, Beecher, 2000). HPLC gıdalarda flavonoidlerin analizinde yeni bir boyut getirmiĢtir. Temel avantajları, flavonoid karıĢımları için çok iyi rezolüsyon sağlaması, kalitatif ve kantitatif tayin yapılabilmesi ve hızlı analize imkan vermesidir. Normal faz kromotografi polaritesi yüksek flavonoidlerin kolonda fazlaca alıkonması ve seperasyon karakteristiklerinin dereceli olarak değiĢmesi nedeniyle tercih edilen bir teknik değildir. Bu nedenle zıt faz kromotografi flavonoid analizlerinde karakteristik olmuĢtur. C18 kolon (3-5 µm partikül çaplı) kullanarak yapılan analizlerde sulu bir mobil faz (Çözücü A) ve metanol veya asetonitril gibi organik modifiye edici çözgenler (Çözücü B) kullanılmaktadır. Mobil faza düĢük miktarda ilave edilen asetik asit, formik asit ve fosfat tamponları flavonoidlerin seperasyonunu olumlu yönde etkilemektedir (Merken ve Beecher, 2000).
Son zamanlarda nitelikli ürün sıkıntısının yanı sıra artan talep yüzünden birçok diğer Bupleurum spp. kökleri Çin‟de tıpta farklı alanlarda kullanılmaktadır. Bu ham ilacın kimyasal analizlerinin ince katmanlı kromotoğrafi (TLC) ve yüksek performanslı sıvı kromotoğrafisi (HPLC) ile birlikte rapor edilmiĢtir. Ancak, TLC yönteminin doğruluğu ve yeniden üretilebilirliği tatmin edici düzeyde değildi. Saikosaponin-a,-c ve -d‟nin 220 nm üzerindeki ultraviyole (UV) bölgesinde herhangi maksimum emilim göstermediği için, genellikle belirtilen HPLC yöntemlerinin çoğunda 210 nm‟nin altında analiz edilmiĢtir. Gerçek saikosaponinlerin çoğu istikrarsız aliloksit bağlantısı içerir ve bu yüzden orta düzey bir asit uygulamasıyla yapay dien saponinlere dönüĢtürülür; saikosaponin-a‟dan saikosaponin-b1 ve saikosaponin-d‟den saikosaponin-b2. Saikosaponin-b1 ve -b2‟nin doğal Radix Bupleurum bileĢenleri olmadığı ancak ekstraksiyon iĢlemi sırasında oluĢtuğunu bildirilmiĢtir. Bu dönüĢtürülen dien-saponinler karakteristik ve güçlü absorbsiyon maximumları (250 nm‟de) gösterir ve yüksek duyarlılıktaki HPLC-UV ile kolayca tespit edilebilmektedir. Bu yüzden saikosaponin-a
14 ve -d içerikleri bunların dönüĢüm ürünleriyle analizleriyle belirlenebileceği muhtemel bir yöntem sağlamaktadır. Bu dönüĢüm daha önce saikosaponin-a ve -d analizine uygulanmıĢtı ancak belirtilen dönüĢüm reaksiyonunun tam ve nicel olduğu ispatlanmamıĢtır. Bu çalıĢmada dönüĢtürme Ģartları iyileĢtirilmiĢ ve LC-MS ve LC-PDA saikosaponin-a ve -d‟nin tam ve nicel olarak saikosaponin -b1 ve -b2‟ye dönüĢtürüldüğünü ispatlamak için kullanıldı. Bu iyileĢtirilmiĢ yöntem 17 ticari örneğin niteliğini değerlendirmek için uygulanmıĢtır (Xiu-Qin ve ark., 2005).
Liu ve arkadaĢlarının (2005) ultrasonikasyonla ilgili yaptığı bir çalıĢmada Ģu iĢlemler uygulanmıĢtır: Bütün bitkisel malzemeler hepsi birlikte biriktirilip blender yardımıyla toz haline getirilmiĢtir. Toz haline getirilen bitkiler 1/10 oranında ekstraksiyon solüsyonuyla karıĢtırılarak 40 ºC de 2 saat süreyle ultrasonikasyona tabi tutulmuĢtur. Kullanılan ekstraksiyon cihazları % 0, %30, %70 ve %95 e ayarlı etanol içerikleriyle, etanol ve su karıĢımından oluĢmuĢtur. Elde edilen ekstarksiyon karıĢımı tülbentle süzülmüĢ ve elde edilen içerik rotary evaporatörüyle yoğunlaĢtırılmıĢtır. XCHT tozu verilerek buzdolabında -20 ºC de dondurulmuĢtur.
2.1. Apiaceae (Umbelliferae) familyası
Tek veya çok yıllık otsu, nadiren çalımsı bitkilerdir. Yapraklar alternat, nadiren subopozit veya çevrel diziliĢli, genellikle stipulasız, basit veya çok parçalıdır; petiolleri genellikle geniĢ ve taban kını (okrea) Ģeklindedir. Çiçek durumu genellikle bileĢik Ģemsiye, nadiren basit Ģemsiye veya baĢçık veya oldukça indigenmiĢ simozdur. Brakte ve brakteoller var veya yok. Çiçekler epigin, hermafrodit veya tek eĢeyli (nadiren dioik). Sepaller yok ya da çok küçüktür (genellikle eĢit boylarda değildir). Petaller 5 adet genellikle uç kısımları içe kıvrık ve iki parçalı, hepsi aynı büyüklükte veya çevredeki petaller içtekilerden daha büyük (ıĢınsal tip), beyaz, sarı, sarımsı- yeĢil, soluk mavi veya pembedir. Stamen 5 adet, karpeller (1-) 2 adet; ovüller her gözde 1 adet sarkık, stilus 2 adet, genellikle stilopodyum denen bir tabanı vardır. Meyve, kuru 1-2 adet olgunlukta açılmayan silindirik, yanlardan ve sırt kısmından basık merikaplardan ibarettir. Bu merikarplar birbirine bakan dar veya geniĢ yüzeylerinden ara bölgelerle birbirinden ayrılırlar. Meyve çıplak veya tüylü, pulsu çıkıntılı, kılçıklı veya dikenlidir; merikarplar genellikle basit veya eksen boyunca yarılan bir karpofora bağlıdır. Karpofor nadiren yoktur. Her merikarpta genellikle 5 primer ve 4 sekonder boylu boyunca çıkıntıya (kosta) sahiptir; çizgiler bazen kanatsı veya ibriksi çıkıntı Ģeklindedir, bunlar valekulumlar ile birbirinden ayrılır. Salgı kanalları hemen her zaman vardır. Kostaların
Ģekli ve mezokarplardaki salgı kanalı adedi, türlere göre farklılık gösterir. Meyve Ģizokarp ve üzerinde 2 adet kalıcı stilopodyum vardır (Davis, 1972).
Apiaceae familyası karakteristik özellikleri ile kolaylıkla ayırt edilen, tüm dünyada yayılıĢı olan yaklaĢık 455 cins ve 3700 kadar türe sahip geniĢ bir familyadır. Kozmopolit bir familya olup çoğunlukla ılıman bölgelerde yaygındır (Heywood V.H., 1979). Türkiye‟de 99 cins ve yaklaĢık 453 türü yetiĢmektedir (Davis, 1972).
2.2. Bupleurum türlerinin genel özellikleri
Bupleurum cinsinin botanik sınıflandırması Ģu Ģekildedir (Davis, 1972; Tanker
ve ark., 2007). Bölüm Spermatophyta Altbölüm Angiospermae Sınıf Magnoliopsida Altsınıf Rosidae Takım Apiales
Familya Apiaceae (Umbelliferae) Cins Bupleurum
Tek yıllık veya çok yıllık, nadiren çalımsı bitkiler olup, tüy içermez ve kök ile gövdenin birleĢme kısmı fibroz bir karaktere sahip değildir. Yapraklar daima bölünmemiĢ, tek parça halinde, bütün, bazen ince diĢli serrulat özellik gösterir. Brakte (bazı geniĢ yapraklı türlerde bulunmamakla birlikte) ve brakteolleri mevcuttur. Petaller sarı, beyaz, erguvan renkli olup, iyi geliĢmiĢ içe kıvrık apikal lob, petal gövdesinin orta hattına yapıĢıktır. Meyve silindirik, çok değiĢken, üzerindeki sırt halindeki 5 adet kabarık hat (ridge), çizgisel kanadı andıran bir yapı sergilemekte, nadiren de belirsizdir. Meyve yüzeyi düz veya çeĢitli özellikte süslere sahiptir. Sırttaki salgı kanalları 1-5 adet olup, vasküler yerleĢim göstermektedir. Merikarpların birleĢme bölgesinde de (komissür), sayıları 2-10 arasında değiĢen salgı kanallarına rastlamak mümkündür. Olgun meyvelerde nadir de olsa salgı kanalları belirgin değildir (Snogerup, 1972).
16 2.2.1. Bupleurum sulphureum Boiss. & Bal.
Tek yıllık, 10-45 cm boyunda tabandan veya gövdenin orta kısmından orta derecede yalancı dikotomik dallanma gösterir. 3-6 cm boyunda 1-3 mm geniĢliğinde ve Ģeritsidir. IĢın adedi (3-)4(-5), boyları 3-25 mm gibi çok farklı uzunlukta, pedunkule oranı 1/6-2/5. Brakte 3, lanseolat- aristat, uzun ıĢına oranı 1/ 2 veya daha fazla, boyu 7-15 mm, eni ise 2-3 mm.dir. Brakteol 5, içbükey, oval-eliptik, apiculate, arista 1-2.5 mm, kenarları hafifçe serrat, 3 ana damarın arasında ve dıĢ kısmında iyi geliĢmiĢ ikincil damarlar mevcut, 8- 10 mm boyunda ve yaklaĢık 4 mm eninde, büyük kısmı otsu yapıda be çiçeklenme döneminde sülfür-parlak sarı renktedir. Umbelildeki çiçek adedi 6- 8 mm, pedisel boyu 0.5- 0.6 mm. Petal sarımsı, obovat- oblong, 1-3 mm, özellikle uç kısmı düzensiz lobulate- denate, kıvrılma hattı düzensiz 4 loblu, içe kıvrık lob dar ve bifid. Anter 0.4 mm, filament 0.6-0.8 mm, stilopodyum 0.5- 0.7 x 0.3- 0.4 mm, stilus 0.4- 0.5 mm. Meyve 2- 2.5 x 1.2- 1.5 mm, oblong, siyah-kahverengi, yüzeyi düzgün, sırt çizgisi ipliksidir. Çiçeklenme Haziran- Temmuz.
Step, kuru açık araziler, kalkerli topraklarda ve tarla arsız otları olarak rastlanmaktadır, 400- 1500 metre arasında bulunur (Davis, 1972).
Bu tür Mersin ve Isparta yörelerindeki halk tarafından “TavĢan kulağı” ismiyle tanınmaktadır (Bayram, 2007; Anonim, 2008; Yıldızbakan ve ark., 2011).
ġekil 2.5.: B. sulphureum Boiss. & Bal. bitkisinin arazideki görünümü
18
2.2.2. Bupleurum turcicum Snogerup
Tek yıllık, 5-20 cm boyunda, tabandan yalancı dikotomik dallanma gösterir. Yapraklar 1.5-5 cm boyunda 1-1.5 mm eninde ve Ģeritsidir. IĢın adedi 3- 4 ve birbirinden az farklı uzunlukta, 5- 25 mm. Uzun ıĢının pedunkule oranı 1-2. Brakte adedi 3-4, boyu 2.5-8 x 0.3- 0.8 mm, boyunun uzun ıĢına oranı 1/ 2- 1/ 3 tür. Brakteol 5 adet, 2- 8 x 0.3-0.6 mm, keskin sivri uçlu ve kenarları serrulattır. Umbelüldeki çiçek adedi 5- 7, pedisel boyu 1- 1.5 mm. Petal sarı, 0.7- 0.8 mm ve sivri uçlu papilleri mevcuttur. Ġçe kıvrık lob geniĢ uzun ve bifid, dar tabanlı geniĢ obovoidal. Anter 04- 0.5 mm, filament 0.5-0.6 mm, stilopodyum 0.7- 0.8 x 0.1- 0.2 mm, stilus 0.7- 0.8 mm. Meyve 1.5- 2 x 1- 1.2 mm, ovoidal Ģekilli, yoğun sıralar halinde dizili 0.4- 0.5 mm lik papillerle kaplıdır. Çiçeklenme Haziran- Temmuz.
Stepler, tuzlu bataklıklar ve otlaklarda, yaklaĢık 900- 1100 m. de yaĢarlar (Davis, 1972).
ġekil 2.8.: B. turcicum Snogerup bitkisinin herbaryumdaki görünümü
2.2.3. Bupleurum lycaonicum Snogerup
Tek yıllık, 15-40 cm, üst kısmında yalancı dikotomik dallanma gösterip, ana umbellaya yakın olanlar iyi geliĢmiĢtir. Yapraklar 2-7 cm boyunda 1-1.5 mm geniĢliğinde ve Ģeritsidir. IĢın adedi 4-7, eĢit veya az farklı uzunlukta, ıĢın boyu 10-20 mm, uzun ıĢının pedunkule oranı 1-2/3. Brakte 5, dar ve ovat, kısa ve sivri uçlu, 3-5 x 0.5- 0.7 mm, boyunun uzun ıĢına oranı 1/3- 1/6. Brakteol 5, braktelere benzer 2-4 x 0.6-0.7 mm. Umbelildeki çiçek adedi (3-)5(-6), boyu 0.6- 1.7 mm. Petal 0.4- 0.5 mm, ovat- orbikular, erguvan renkli, içe kıvrık lob petal boyunun 3/ 4 ü kadar, geniĢ, uzun ve bifid. Anter 0.25- 0.3 mm, filament 0.5-0.8 mm, stilopodyum 0.5- 0.7 x 0.2- 0.3 mm, stilus 0.2- 0.4 mm. Meyve 1.5- 2.5 x 1.3- 1.7 mm, ovoido-prizmatik, kahverengi, retuse, çok ince granulose- papillose, sırt çizgileri ipliksidir. Çiçeklenme Haziran- Temmuz.
Orman, maki ve taĢlı yamaçlarda, 1100- 1500 m. de yetiĢir (Davis, 1972).
Bu tür Mersin yöresindeki halk tarafından “TavĢan kulağı” ismiyle bilinmektedir (Yıldızbakan ve ark., 2011).
20
ġekil 2.9.: B. lycaonicum Snogerup bitkisinin arazideki görünümü
2.2.4. Bupleurum heldreichii Boiss. & Bal.
Dik, tek yıllık, 25-50 cm boyunda, güçlü gövdeli bitkilerdir. Gövde yaprakları 2-4 x 1-3 cm, eliptik- ovat, cordate- amplexicual, istekiler hemen hemen orbikular, perfoliat ve sarımsıdır. IĢın 8-12, 5-10 mm boyunda, birbirine göre az farklı uzunlukta, uzun ıĢının pedunkule oranı 1/3. Brakteoller 5,3 ü büyük, 2 si küçük, 5-10 x 3-5 mm, eliptik oblong- obovat lanseolat ve uç kısmı akuminat, büyük brakteol uzunluğunun 1/3 ie 1/2 si oranında birleĢiktir. Umbelüldeki çiçek adedi 8-15, pedisel 2-2.5 mm. Petaller altın sarısı, subsemiorbikular, 0.5-0.6 mm. Anter 0.4-0.5 mm. Meyve 2.9-3.1 x 1.2 mm, yüzeyi düzensiz tuberkulat, ridge kanatlı, 0.1-0.2 mm geniĢliğinde. Çiçeklenme Mayıs-Temmuz.
Yamaç ve kayalıklar, tuzlu topraklar ve stepler, daha az oranda da tarla arsız otu olarak, 800-1200 m. yüksekliklerde bulunur (Davis, 1972).
Bu tür Isparta çevresinde “TavĢan kulağı” ismiyle tanınmaktadır (Anonim, 2008).
22
ġekil 2.12.: B. heldreichii Boiss. & Bal. bitkisinin herbaryumdaki görünümü
2.2.5. Bupleurum pauciradiatum Fenzl
Tek yıllık, 30-90 cm boyunda, dik duruĢlu ve genellikle uzun dalları vardır. Gövde yaprakları 3-10 cm uzunluğunda, 2-4 mm geniĢliğindedir. Raylar 2-3 adet, 0.2-20 mm uzunluğunda olup uzunlukları eĢit değildir. Ana umbel 4-6 çiçeklidir. Brakteler 3 adet ve 2-5 mm uzunluğunda, brakteoller 4-5 adet, 3-4 mm uzunluğunda ve 0.4-0.6 mm geniĢliğindedir. Petaller 0.4-0.5 mm uzunluğunda ve sarımsı-mor renklidir. Anterler 0.25-0.3 mm uzunluğunda, stilopodium yaklaĢık 0.5 mm geniĢliğinde, stilus yaklaĢık 0.15 mm uzunluğundadır. Çiçeklenme zamanı Haziran-Eylül
Orman, maki ve yamaç alanlarda yetiĢir. 500-1400 m yüksekliklerde bulunur (Davis, 1972).
Bu tür Mersin yöresindeki halk tarafından “TavĢan kulağı” ismiyle tanınmaktadır (Yıldızbakan ve ark., 2011).
ġekil 2.13.: B. pauciradiatum Fenzl bitkisinin arazideki görünümü
24 3. MATERYAL VE YÖNTEM
3.1. Materyal
3.1.1. Bitki materyali
B. sulphureum Boiss.&Bal., B. turcicum Snogerup, B. lycaonicum Snogerup, B. heldreichii Boiss.&Bal., B. pauciradiatum Fenzl türlerinin çiçeklenme öncesi toprak
üstü kısımları, çiçekleri ve meyveleri incelendiğinden Mayıs, Haziran, Temmuz ve Ağustos aylarında Konya ve çevresinden bitkiler toplanmıĢtır.
Çizelge 3.1.: Bitkilerin toplandığı lokasyon B.sulphureum
Boiss.&Bal. Konya- BeyĢehir yolu
B.turcicum
Snogerup Konya- Cihanbeyli Tuz gölü
B.lycaonicum
Snogerup Konya- BeyĢehir yolu
B.heldreichii
Boiss.&Bal. Konya- Karapınar
B.pauciradiatum
Fenzl Karaman- BaĢkıĢla
3.1.2. Kullanılan kimyasallar
3.1.2.1. Bitki materyalinin HPLC ye hazır hale getirilmesi için kullanılan kimyasallar
Metanol (Merck)
% 70‟lik Etanol (Merck)
3.1.2.2. HPLC de kullanılan kimyasallar Asetonitril (Merck)
Metanol (Merck)
% 2,5 lik Formik asit (Merck) Saikosaponin A (Sigma) Saikosaponin D (Sigma) Podofilotoksin (Sigma) KateĢin (Sigma)
Kuersetin (Sigma) Ġzokuersetin(Sigma)
3.1.2.3. HPLC için hazırlanan standartlar
1- Saikosaponin A (15 mg), 3 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 2- Saikosaponin D (15 mg), 3 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 3- Podofilotoksin (75 mg), 15 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 4- KateĢin (150 mg), 30 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 5- EpikateĢin (150 mg), 30 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 6- Kuersetin (150 mg), 30 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 7- Ġzokuersetin (30 mg), 6 ml metanolde çözülerek 5 mg/ml hazırlanmıĢtır. 15 adet örnek ise 150 mg tartılıp 3 ml de çözülerek 50 mg/ml hazırlanmıĢtır. 3.1.3. Kullanılan cihazlar
Mekanik parçalayıcı (Yazıcılar Öğütücü)
Ultrasonikasyon (Elma, Transsonic Digital S, D-78224 Singen/Htw, Germany) Rotary evaporatör (Heidolph Laborota 4000)
Liyofilizatör (Edwards Modulya 4K frizer) HPLC (Varian Prostar HPLC system)
Kullanılan kolon: Pursuit 5u C18 (150x4,6 mm)
Dedektör: PDA (5 dalga boyunu aynı anda okuyabilen UV visible) 3.2. Yöntem
3.2.1. Ekstraksiyona hazır hale getirilmesi
Zamanında toplanan bitkiler gölgede ve serin bir ortamda kurutulmuĢtur. Çiçeklenme öncesi toprak üstü kısmın incelenmesi için bitkiler köklerinden ayrılmıĢtır. Çiçek ve meyve kısmını incelemek için ise, çiçeklenme ve meyve döneminde toplanan bitkiler yine kurutma iĢleminden sonra çiçek ve meyveleri bitkiden ayrılmıĢtır. Daha sonra hazırlanan bitki kısımları ayrı ayrı mekanik parçalayıcı (laboratuvar değirmeni) ile toz hale getirilmiĢtir. Böylece 15 örneğimiz olmuĢtur.
26 3.2.2. Ekstrelerinin hazırlanıĢı
3.2.2.1. Ultrasonikasyon
Saponin bileĢenlerinin yapılarının yüksek ısıda bozulmaması için bitki tozlarına soğuk ekstraksiyon yapılmıĢtır. AraĢtırmamızda malzemelerin çözücüdeki çözünürlüğünü artırmak için ultrasonik banyo kullanılmıĢtır.
Toz haline gelen 15 örnek, ayrı ayrı tartılmıĢtır; her örnekten 6,5 gram alınmıĢtır ve üzerine 65 ml % 70 lik etanol ilave edilmiĢtir. Ultrasonikatör cihazının gücü % 100, sıcaklığı 25- 30 °C ye ayarlanmıĢtır. Cihazın haznesine bir miktar su konularak erlenlerdeki örnekler hazneye yerleĢtirilmiĢtir. Her bir örnek 1 saat ultrasonikasyona tabi tutulduktan sonra Whatman kağıdı yardımıyla süzülen örnekler balonların içine konulmuĢtur, balonların ağızları pamuk ve parafin ile kapatılmıĢtır.
3.2.2.2. Rotary evaporatörde uçurma
40 °C‟nin altında bir sıcaklıkta ve düĢük basınçta Rotary evaporatör ile çözücüler tamamen tükenene kadar uçurulmuĢtur. Örnekler %70 lik etanolde çözdürülmüĢtür. Daha sonra -25 °C de tutularak dondurulmuĢtur.
3.2.2.3. Liyafilizatörle toz hale getirilmesi
Dondurulan örneklerin liyofilizatörde toz haline getirilmesi sağlanmıĢtır. 3.2.3. HPLC yöntem parametreleri
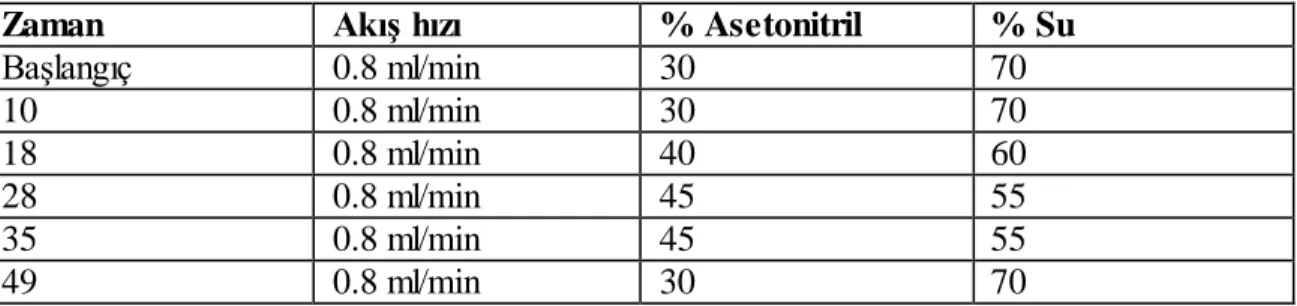
3.2.3.1. Saikosaponin A ve Saikosaponin D için; Mobil faz: Asetonitril: Distile su(dH2O) = 30:70
Kolon sıcaklığı: 25 o
C PDA dalga boyu: 203 nm Runtime: 40 dk
Çizelge 3.2.; Saikosaponin A ve Saikosaponin D‟nin zamana bağlı mobil faz oranları
Zaman AkıĢ hızı % Asetonitril % Su
BaĢlangıç 0.8 ml/min 30 70 10 0.8 ml/min 30 70 18 0.8 ml/min 40 60 28 0.8 ml/min 45 55 35 0.8 ml/min 45 55 49 0.8 ml/min 30 70
3.2.3.2. Fenolik Maddeler için; Mobil faz:
B pompası: Metanol
C pompası: % 2,5 lik Formik asit suda Kolon sıcaklığı: 25 o
C PDA dalga boyu:
KateĢin: 280 nm EpikateĢin: 280 nm Kuersetin: 360 nm Ġzokuersetin: 360 nm Runtime: 63 dk
Çizelge 3.3.; KateĢin, epikateĢin, kuersetin, izokuersetinin zamana bağlı mobil faz oranları
Zaman AkıĢ hızı % B pompası % C pompası
BaĢlangıç 1 ml/min 0 100 7 1 ml/min 0 100 42 1 ml/min 20 80 57 1 ml/min 60 40 58 1 ml/min 0 100 63 1 ml/min 0 100 3.2.3.3. Podofilotoksin için;
Mobil faz: (metanol-asetonitril):distile su = (20:30):50 B pompası: su
C pompası: metanol-asetonitril Kolon sıcaklığı: 25 o
C PDA dalga boyu: 285 nm Runtime: 15 dk
Çizelge 3.4.; Podofilotoksinin zamana bağlı mobil faz oranları
Zaman AkıĢ hızı % C pompası % B pompası
BaĢlangıç 0.8 ml/min 50 50
28 3.2.4. Ġstatistik analizleri
BeĢ farklı bitki türünün özütünden HPLC ile elde edilen kateĢin, epikateĢin, izokuersetin, kuersetin, podofilotoksin ve saikosaponin A ve D miktarları ortalama ve standart sapma olarak tablolarda sunulmuĢtur. Ayrıca her ortalama miktarlarının değiĢimini gösteren grafikler çizilmiĢtir. HPLC ile elde edilen kateĢin, epikateĢin, izokuersetin, kuersetin, podofilotoksin ve saikosaponin A ve D miktarları arasında istatistiksel olarak anlamlı fark olup olmadığı tek yönlü varyans analizi ile incelenmiĢtir. Anlamlı bulunanlarda farkın hangi gruptan kaynaklandığını tespit etmek amacıyla Duncan Çoklu KarĢılaĢtırma Testi kullanılmıĢtır. Verilerin sunumu ve değerlendirilmesi amacıyla SPSS (11.5) istatistik paket programı kullanılmıĢtır. Ġstatistik önemlilik seviyesi olarak 0.05 veya 0.01 kabul edilmiĢtir.
4. ARAġTIRMA SONUÇLARI VE TARTIġMA
AraĢtırmada 5 endemik Bupleurum türünün çiçeklenme öncesi topraküstü kısmı, çiçek ve meyve kısmından elde edilen özütlerdeki KateĢin, EpikateĢin, Ġzokuersetin, Kuersetin, Podofilotoksin, Saikosaponin A ve Saikosaponin D bileĢiklerine bakılmıĢtır.
HPLC cihazı ile belirlenen KateĢin, EpikateĢin, Ġzokuersetin, Kuersetin, Podofilotoksin, Saikosaponin A ve Saikosaponin D bileĢiklerinin ortalama miktarları ve standart sapmaları Çizelge 4.1. ve Çizelge 4.2. deki gibidir.
Çizelge 4.1.: Fenolik maddelerin ortalama miktarları ve standart sapmaları
Örnekler KateĢin (mg/ml) EpikateĢin (mg/ml) Ġzokuersetin (mg/ml) Kuersetin (mg/ml) Podofilotoksin (mg/ml) ç.ö.t.ü. 0.0443±0.0008 0.0509±0.0030 6.2200±0.5374 0.8100±0.0707 0.0325±0.0033 B. sulphureum Boiss.&Bal.
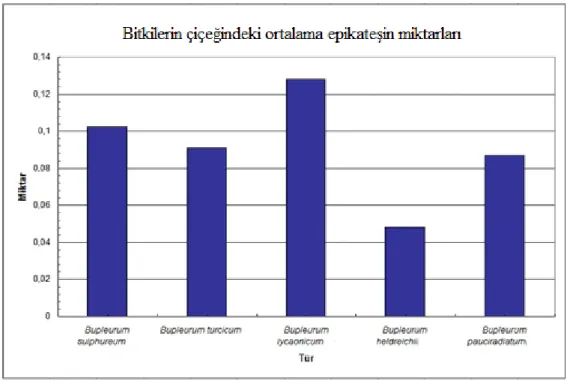
meyve 0.2875±0.0544 0.0893±0.0046 9.2200±0.000 0.1070±0.000 tespit edilemedi
çiçek 0.1468±0.0039 0.1025±0.0078 9.5300±0.8344 0.1968±0.0202 tespit edilemedi
ç.ö.t.ü. 0.0535±0.0047 0.0710±0.0113 2.4200±0.1414 0.0182±0.0017 0.0369±0.0054 B. turcicum
Snogerup meyve 0.0610±0.0021 0.0518±0.0086 1.8300±0.1838 0.0136±0.000 0.0118±0.0002 çiçek 0.0670±0.0115 0.0910±0.0037 4.0200±0.0283 0.0171±0.000 tespit edilemedi
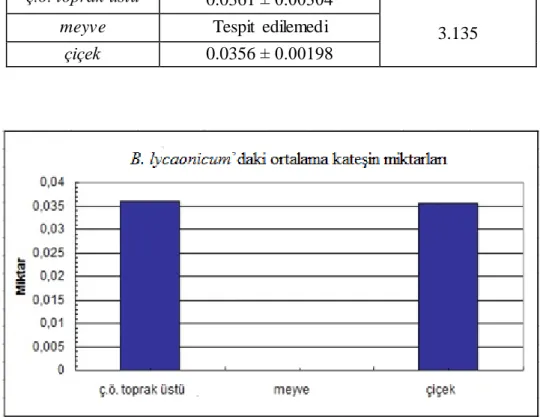
ç.ö.t.ü. 0.0361±0.0030 0.0545±0.0032 9.7800±0.3111 0.0194±0.000 tespit edilemedi
B. lycaonicum Snogerup
meyve tespit edilemedi tespit edilemedi 1.6115±0.0375 tespit edilemedi 0.0127±0.0019
çiçek 0.0356±0.0020 0.1281±0.0037 3.5533±0.8989 tespit edilemedi 0.0079±0.0002 ç.ö.t.ü. 0.0592±0.0045 0.0519±0.0011 1.7300±0.0424 1.0400±0.0566 0.0091±0.0006 B. heldreichii
Boiss.&Bal. meyve 0.1478±0.0102 0.0456±0.0018 1.6300±0.0707 0.0203±0.0018 tespit edilemedi çiçek 0.0542±0.0026 0.0482±0.0046 3.9800±0.1414 0.8200±0.000 0.0165±0.0010 ç.ö.t.ü. 0.1578±0.0071 0.1528±0.0037 7.6400±0.7354 1.3200±0.1414 0.0185±0.0008 B.
pauciradiatum Fenzl
meyve 0.1484±0.0107 0.0925±0.0026 3.5550±0.0778 0.5700±0.0283 tespit edilemedi
30
Çizelge 4.2.: Saikosaponinlerin ortalama miktarları ve standart sapmaları
Örnekler Saikosaponin A
(mg/ml)
Saikosaponin D
(mg/ml) ç.ö.t.ü. tespit edilemedi tespit edilemedi
B. sulphureum
Boiss.&Bal. meyve tespit edilemedi tespit edilemedi
çiçek tespit edilemedi tespit edilemedi
ç.ö.t.ü. tespit edilemedi 0.2665±0.0071
B. turcicum Snogerup meyve tespit edilemedi 1.3193±0.1488
çiçek tespit edilemedi 1.2783±0.0329
ç.ö.t.ü. tespit edilemedi 0.0589±0.0049
B. lycaonicum Snogerup meyve 0.6429±0.0284 tespit edilemedi
çiçek tespit edilemedi tespit edilemedi
ç.ö.t.ü. tespit edilemedi tespit edilemedi B. heldreichii
Boiss.&Bal. meyve tespit edilemedi tespit edilemedi
çiçek 0.0050±0.0015 0.0238±0.0034
ç.ö.t.ü. tespit edilemedi 0.0440±0.0008
B. pauciradiatum
Fenzl meyve tespit edilemedi tespit edilemedi
çiçek 0.0120±0.000 0.0798±0.0077
Türler faktörü ve bitkinin kısım faktörüne bağlı ortalama bileĢik miktarlarının karĢılaĢtırılması aĢağıdaki grafiklerdeki gibidir.
Tablolardaki tür faktörü ve bitkinin kısım faktörünün seviye ortalamaları arasındaki farklılık küçük harflerle gösterilmiĢtir. Farklı harfler ile gösterilen ortalamalar arasındaki fark istatistik olarak önemli, aynı harfler ile gösterilen ortalamalar arasındaki fark ise istatistik olarak önemli değildir.