1.GİRİŞ
Kimya biliminin gelişmiş en önemli alanlarından biri de yüksek moleküllü birleşmeler (polimerler) kimyasıdır. Polimerler, büyük moleküllerden oluşan maddelerdir. Doğal polimerik maddeler yiyeceklerin, giyeceklerin, yapı ve taşıt malzemesinin temel öğesidir. İnsanın günlük gereksinimleri ya da uygarlık düzeni içinde yararlandığı hemen hemen bütün maddeler, doğal organik ürünlerden sağlanır. Canlıların temel yapı taşı olan protein, nükleik asit, selüloz gibi birçok bileşik polimerik yapıdadır. 3000 den fazla glikoz molekülünden oluşan ve bitkilerde hücre çeperinin temel bileşeni olan selüloz, patates, mısır, pirinç gibi bitkilerde bulunan nişasta, aminoasitlerin bir araya gelmesiyle oluşan proteinler ve genetik şifreyi taşıyan nükleik asitler de nükleotitlerden oluşan doğal polimerlerdendir.
Polimerlerin günlük hayatımızda bir çok kullanım alanına sahip olmaları Organik kimya ve Fizikokimya anabilim dallarında çalışan bilim adamlarının Polimer kimyası üzerinde çalışmalar yapmalarına imkan sağlamış ve son 50 yıl içinde fiziksel ve kimyasal analiz yöntemlerinin gelişmesi ile polimerlerin yapıları aydınlatılmıştır. Eğer tek hücreli canlılardan, çok hücreli canlılara kadar temel yapının ne olduğuna bakacak olursak, temel yapı bilgisini taşıyan DNA veya RNA’nın temelde 20 kadar aminoasit ve bunları birbirlerine bağlayan fosfat bağlarından meydana geldiğini görürüz. Ama canlılardaki bu çeşitlilik, amino asit sıralamasındaki değişiklikten ve konformasyonlarından kaynaklanmaktadır. Ayrıca organların tamamının tekrarlanan moleküler yapılardan oluştuğunu görebiliriz. İnsan yaşamını kolaylaştırmak ve hatta uzatmak amacıyla birçok çalışma yapılmaktadır. Polimerik biyomateryellerin başarıyla üretilmesiyle birlikte yapay organ yapımındaki başarılı çalışmalar polimerlerin önemini her geçen gün daha da artırmakta ve polimer kimyasının hızlı bir gelişim içerisinde olduğunu göstermektedir.
1.1 Polimer Kimyasının Tarihsel Gelişimi
Polimer konusundaki ilk çalışmalar 19. yüzyılın ortalarında gerçekleşmiştir. İçinde bulunduğumuz yüzyılın başlarında, bu tür maddeler çeşitli amaçlarda kullanılmak üzere endüstriyel ölçülerde yapıldı. Ancak, sentetik yüksek polimerlerin
oluşmasını düzenleyen temel bilimsel ilkeler 1925 – 1935 yıllarında bulunabildi.1839 yılında Goodyear; kauçuk ağacının özsuyunu kükürt ile kaynattığında esnek, sağlam siyaha yakın bir madde elde etmiştir. Goodyear'ın bu buluşu halen üretimdedir(Pierre-Gilles de Gennes Jacques Bados, 1999). 1846 yılında Schönbein; selüloz, sülfirik asit(H2SO4) ve nitrik asitten nitroselülozu, 1865 yılında Schutzenberger selüloza dayanarak bugün yarı sentetik olarak adlandırılan selüloz asetatı sentezlemiştir. Daha sonra 1869 yılında John W. Hyatt; nitrik asidin selüloza tepkimesiyle elde edilen ve temel maddesi nitroselüloz olan selüloiti üretmiştir. Yine selüloz kullanılarak üretilen yapay ipek, 1891 yılında Louis Marie Hilaire Bernigaut tarafından gerçekleştirilmiştir. Amerikalı bilim adamı Leo Hendrick Baekeland, 1907 de tamamen sentetik ilk polimer olan fenol-formaldehit reçinelerinin üretimini başarmıştır. 1924 de ise Hermann Staudinger'in Makromolekül Hipotezini ileri sürmesiyle, polimer teknolojisi önemli bir ufuk kazanmıştır. Bu teoriye göre, doğal kauçuk ve polistirenin, küçük birimleri birarada bulunduran uzun zincirli moleküller olduğu ileri sürülerek, polimer üretiminin deneme yanılma aşamasından kurtulmasına neden olmuştur. Makromolekül Hipotezi sonraki yıllarda birçok polimerin üretimine ışık tutmuştur. 1927 de selüloz asetat ve polivinil klorür, 1928 de polimetil metakrilat ve Carothers tarafından Naylon adı verilen poliamidler , 1929 da üre-formaldehit reçineleri, 1936 da poliakrilonitril, stiren-akrilonitril kopolimeri ve polivinil asetat, 1937 de poliüretan, 1938 de Teflon ticari ismi ile anılan politetrafloroetilen, 1939 da melamin-formaldehit (formika) reçineleri, 1940 da bütil kauçuğu ve silikonların hammaddesi olan silanlar, 1941 de polietilen, polietilen teraftalat, 1942 de doymamış poliesterler ve Orlon ticari isimli poliakrilonitril fiber üretimi gerçekleştirilmiştir.
1952 de Max planck Enstitüsü araştırmacılarından K.Ziegler bazı alüminyüm alkali bileşiklerini katalizör olarak kullanarak etilenin düşük basınçta polimerizasyonunu gerçekleştirmiştir. Ziegler ve Giulio Natta sterospesifik polimerizasyonu diğer olefinlere de uygulamışlardır. 1954 de polikarbonat ve 1956 da polifenil oksit sentezlenmiştir. Son yıllarda yüksek ısıl ve mekanik dayanıklığa sahip poliimid, poliarilsülfonlar, poliarilamidler, polifenilsülfit, polibütil teraftalatpolietereketon, polifenil gibi önemli plastikler geliştirilmiştir(Pişkin, 1987).
1977 yılına gelindiğinde ise Shirakawa, MacDiarmid ve Heeger, 2000 yılında kendilerine kimya Nobel ödülünü getirecek olan buluşu gerçekleştirmişlerdir. Poliasetilenin, doping edilmesiyle bir metal kadar iletkenliğe sahip olacağını keşfederek polimer kimyasında yeni bir alan açılmasına önderlik etmişlerdir.
1.2 Polistiren Hakkında Genel Bilgi
Günümüzdeki plastiklerin en önemlilerinden biri olan polistirenin ticari üretimine 1930 yılında başlanmıştır. Polistiren doymamış hidrokarbon olan stirenden elde edilir. Stiren endüstriyel olarak etilbenzenin katalizör ortamında dehidrojenasyonu ile elde edilir. Sert ve ucuz bir plastik olan polistiren günlük yaşantımızda polietilenden daha yaygın olarak kullanılmaktadır. Polistiren plastikleri, kalıplanmış eşya ve elektrik malzemesi yapımında kullanılır. Polistiren köpükleri, ısı ve ses yalıtımı malzemesi olarak, çarpmalara karşı koruyucu ambalaj malzemesi olarak oldukça yaygın biçimde kullanılmaktadır. ABD de polistirenin %25 i yiyecek paketlemesinde kullanılmaktadır. Bilinen polistiren köpük ürünleri ayak üstü yemek sistemlerindeki kaplarda, tabaklarda, fincan vb. yapımı, sert ambalaj malzemesi üretiminde kullanılmaktadır. Yeniden kullanıma alınan polistiren yalıtım malzemelerinin yapımında, büro malzemeleri, yiyecek tepsileri, atık kapları, izolasyon araçları, oyuncak ve enjeksiyon kalıplama sistemiyle elde edilen malzemenin üretiminde kullanılmaktadır(Güler ve Çobanoğlu, 1997).
Polistiren, stirenin radikalik ve iyonik polimerleşmesinden elde edilir. Stirenden katyonik metotla elde edilen polistiren düşük molekül ağırlıklı iken, radikalik metotla sentezlenen polistirenler amorf ve büyük molekül ağırlıklı olurlar.
Stiren; kütle polimerizasyonu, çözelti polimerizasyonu, emülsiyon polimerizasyonu ve süspansiyon polimerizasyonu olmak üzere dört şekilde polimerleştirilebilir (Mehmedov ve Zeynelova 1981).
Kütle polimerizasyonu metodu ile elde edilen polistiren diğer metotlarla elde edilen polimerlere göre nispeten daha saf olmaktadır. Ancak polimerleşmeyle birlikte viskozitenin artması karıştırmayı imkansız hale getirir ve reaksiyon ortamında homojen bir ısı yayılımı sağlanamaz. Bu yüzden elde edilen üründe ortalama molekül ağırlığı az olmaktadır. Süspansiyon polimerizasyon metodunda kullanılan
çözücüde, hem monomerİ hem de elde edilen polimeri çözülmemelidir. Bu metotla elde edilen polistirenin özellikleri blok polimerleşme metodunda elde edilen polistirenin özelliklerine yakındır. Çözelti polimerizasyon metodunda kullanılan çözücü hem monomeri hem de polimeri iyi çözmelidir. Bu metotta çözücü, polimerizasyon ortamını seyrelttiği için viskozite düşer, karıştırma kolaylaşır ve daha etkin bir ısı transferi yapılabilir. Bu yüzden elde edilen üründe ortalama molekül ağırlığı yüksek olmaktadır. Ancak ortama katılan çözücü bazı sorunlar meydana getirir. Polimeri çözücüden ayırmak ve çözücüye zincir transferi ortaya çıkan en önemli sorunlardır. Bu yöntemde çözücü olarak zincir transfer sabiti küçük olan maddeler seçilmelidir(Eastmond, 1967). Emülsiyon polimerizasyon metodunda; polistiren elde etmek için stiren, su, emülgatör ve başlatıcı kullanılmaktadır. Emülsiyon polimerizasyon metodunda reaksiyon kinetiği bakımından diğer polimerizasyon türlerine göre belirgin bir ayrım vardır. Diğer polimerizasyon yöntemlerinde polimerizasyon hızının artması ile elde edilen polimerin ortalama molekül ağırlığı az olmaktadır. Emülsiyon polimerizasyon metodunda ise, polimerizasyon hızını azaltmadan polimerin molekül ağırlığını artırma imkanı vardır. Bir baka deyişle, reaksiyon mekanizması farklı olduğu için, reaksiyonu hızlı tutarak yüksek molekül ağırlıklı polimerler elde edilebilir.
1.3 Polistirenin Özellikleri
Polistiren renksiz, kokusuz, şeffaf, suya dayanıklı, lineer, yüksek dielektrik özelliğine ve yüksek yalıtım kabiliyetine sahip olan inert bir polimerdir. Polistirenin yoğunluğu; 1,05-1,08 g/cm3 dür. Ticari polistiren, ataktik ve amorftur. Polistirenin ısıya, darbeye ve ultraviole ışınlarına karşı fazla dayanıklı olmaması, düşük yumuşama sıcaklığına sahip olması kullanım alanını daraltmaktadır. Polistirenin bu özelliklerinin geliştirilmesi için stirenin aşı ve blok kopolimerleri sentezlenmektedir. Polistiren 80-150 °C’de elastiki, 200-250 °C’de ise parçalanmaktadır. Polistiren, aromatik bileşiklerde, hidrokarbonlarda, ketonlarda ve esterlerde kolay çözünmektedir. Ancak alifatik hidrokarbonlarda, eterlerde, düşük molekül ağırlıklı hidrokarbonlarda çözünmemektedir. Polistiren asitlere, alkalilere ve suya karşı çok dayanıklıdır. Polistiren, yüksek dielektrik özelliğine sahip olmasından dolayı optik
camların ve optik cihazların yapımında kullanılmaktadır. Polistiren, bu özelliklerinin yanı sıra; sıcaklığa, atmosfere ve darbeye karşı dayanıklılığının az olması, muhtelif substratlara karşı adhezyon kabiliyetinin olmaması gibi önemli eksiklikleri de vardır. Polistirenin bu eksikliklerinin giderilmesi ve bazı özelliklerinin geliştirilmesi amacıyla, modifikasyon metoduyla polifonksiyonel polistiren türevlerinin elde edilmesi yönünde çalışmalar yapılmaktadır.
1.4 Polistirenin Modifikasyonu
Polistirenin ısıya, atmosfere, UV ışınlara ve darbeye karşı dayanıklılığını arttırmak amacıyla fiziksel ve kimyasal modifikasyon olmak üzere iki çeşit modifikasyon metodundan yararlanılmaktadır. Fiziksel modifikasyon metodunda, polistiren; polibütadien, polibütadienstiren, polikloropren gibi polimerlerle mekanik olarak karıştırılarak fiziki özellikleri arttırılabilmektedir. Bu metotla elde edilen polistirenlerin, elastikliği yüksek olup darbeye karşı dayanıklı olmalarına rağmen polistirenle karıştırılmış polimerlerin yapısındaki çift bağdan dolayı atmosfere karşı dayanıklılıklarının az olduğu tespit edilmiştir. Polimerlerin yapısındaki çift bağ, atmosferde oksidasyona uğrayarak materyalin darbeye karşı dayanıklılığının azalmasına sebep olmaktadır. Ayrıca fiziksel modifikasyon metodunda meydana gelen birbirine karışmayan iki fazlı sistemde polimerler çok küçük tanecikler halinde polistiren fazında yayılması fazlar arasında hiçbir kimyasal bağ olmadığı için zaman geçtikçe materyalin özelliklerini yitirmesine sebep olmaktadır. Polistiren türevlerinin yüksek fiziko-mekanik özelliklere sahip olması için bu fazlar arasında kimyasal bağ olmalıdır(Braun 1970).
Kimyasal modifikasyon metodunda ise, polistiren polifonksiyonel modifikatörlerle modifikasyona uğratılır. Bu metotla elde edilen polistiren türevlerinin ısıya ve darbeye karşı olan dayanıklılığının artırılması ve substratlara karşı adhezyon kabiliyeti sağlaması, polistirenin önemini daha da arttırmaktadır. Bu yüzden kimyasal modifikasyon son yıllarda modern tekniğin taleplerini karşılayabilen polimer materyallere olan ihtiyaç ile ilgili olarak sürekli gelişme göstermekte, özellikle polifonksiyonel gruplu polimerler sürekli gelişmektedir(Losev 1971, Strepihiyev 1976, Philip 1972, Kurbanova ve ark. 1974-1990).
Kimyasal modifikasyonla; büyük molekül ağırlığına sahip bileşikler, küçük molekül ağırlığına sahip bileşikler(monomerler) gibi kimyasal reaksiyonlara girerek yeni tip polimerler meydana getirirler. Sentezlenen polimerleri, uygun monomerler kullanarak polimerleştirmek mümkün değildir. Kimyasal modifikasyon ile yapılan polimerleşme, aynı polimerin monomerinden sentezinden hem ucuz hem de kolay gerçekleşmektedir. Ancak kimyasal modifikasyonun uygulamasında bazı zorluklarla karşılaşılmaktadır. Örneğin; Modifikasyonda sterik ve statik sebeplerden dolayı bazı durumlarda reaksiyon tamamıyla sonuna kadar gitmez ve ortamda reaksiyona girmeyen başlangıç maddeleri kalır. Reaksiyona girmeyen bu başlangıç maddelerini polimerden ayırmak zor olmaktadır. Oysa monomerlerin kimyasal reaksiyonunda, reaksiyona girmeyen başlangıç maddelerini ayırmak mümkündür. Kimyasal modifikasyon reaksiyonlarında, beklenen modifikasyon reaksiyonun dışında yan reaksiyonlar da olmaktadır. Oluşan yan ürünleri modifiye polimerden ayırmak mümkün değildir. Monomerlerin kimyasal reaksiyonlarında ise; gerçekleşen yan reaksiyonun ürünlerini fiziksel veya kimyasal metotlarla ayırmak mümkündür. Bu sebeplerden dolayı polimerlerin kimyasal modifikasyon metotları, yan reaksiyonların meydana gelmemesi için çok dikkatli seçilmelidir.
Polistiren, düşük molekül ağırlıklı bileşiklere göre reaksiyon kabiliyeti daha zayıf olmasına rağmen, belirli reaksiyon şartlarında hem alifatik karbon zincirinden hem de aromatik halkasından yer değiştirme reaksiyonu verir( Tonimoto, 1968). Fonksiyonel grup, katyonik katalizörler kullanıldığında polistirenin aromatik halkasına, radikalik katalizörler kullanıldığında ise polistirenin alifatik zincirine bağlanır.
Polistiren alifatik karbon zincirinden oksitlenme, halojenlenme, metalleşme gibi yer değiştirme reaksiyonu verebilmektedir. Polistirenin alifatik karbon zincirinden verdiği yer değiştirme reaksiyonlarına aşağıda bazı örnekler verilmiştir(Marton ve ark. 1959; Gaylord, 1983,1992; Mitsuaki ve Masuasi, 1967).
Polistirenin halojenleşmesi, katyonik katalizörlerle(AlCl3) yapılırsa yer değiştirme aromatik halkada, fotokimyasal olarak yapıldığında ise yer değiştirme polistirenin fenil halkasına göre α-konumundaki karbon atomunda olmaktadır.
CH2 CH AlCl3 Cl(Br) CH2 CH Cl2(Br)2 CH2 CH Cl2(Br)2 CCl(Br) CH2 + + Fotokimyasal
Simirnov(1958), polistirenin metalorganik türevlerini sentezlemiştir. Polistiren, metalik K veya Na2O ile 80 oC ‘de etkileştirilmiş ve polistirenin fenil halkasına göre α-konumunda K ve Na türevlerini elde etmiştir.
CH2 CH Na2O C CH2 K(Na) K;
Elde edilen bu (Na)K-polistireni, Marton ve ark.(1959) karboksilleştirerek, düz zincire karboksil grubu bağlı polistireni, Traylor(1960) ise etilen oksit ile reaksiyonundan düz zincire hidroksil grubu bağlı polistireni sentezlemişlerdir.
Polistirenin aromatik halkasında gerçekleştirilen reaksiyonlar, alifatik düz zincirde gerçekleştirilen reaksiyonlara göre artış göstermektedir. Bunun sebebi ise polistirenin aromatik halkasındaki aktif fenil grubundan ileri gelmektedir. Polistirenin aromatik halkasından yapılan kimyasal modifikasyon reaksiyonlarından halojenlenme, nitrolama, sülfolama, açilleme gibi reaksiyonları aşağıda görülmektedir.
CH2 CH Cl2 CH2 CH CH2 CH CH2 CH CH2 CH CH2 CH CH2 CH Cl SO3 SO3H NO2 HNO3 RCOCl COR ClCH2OCH3/ ZnCl2 CH2Cl HNO3 / I2 H2SO4 I C4H9Li CH2 CH Li
Polistirenin modifikasyon reaksiyonlarından: Halojenleme, nitrolama, sülfolama, alkilleme, açilleme ve diğerleri geniş olarak incelenmiş ve bazı kullanım alanları bulunmuştur( Mets ve ark., 1971; Swiger, 1976; Mogno,1977; Frect ve ark., 1979; Gibson, 1980; Gaylord ve ark., 1983, 1987, 1992). Kurbanova ve ark. (1974-1990), polistirenin kimyasal modifikasyonu için araştırmalar yapmış molekül ağırlığı 500 000 olan emülsiyon polistirenin; maleik anhidrit, epiklorhidrin, bütadien
ve izoprenle katyonik katalizörler ortamında alkilleme, açilleme ve alkenilleme reaksiyonlarını incelemiş ve değişik fonksiyonel gruplu polistirenler sentezlemişlerdir. Elde edilen ürünlerdeki fonksiyonel grupların polistirene; substratlara karşı adhezyon kabiliyeti, darbeye karşı dayanıklılık, ışığa hassaslık gibi yeni özellikler kazandırdıklarını tespit etmişlerdir. Ayrıca yapılan birçok çalışmada, kimyasal modifikasyon ile elde edilmiş modifiye polistirenin, yüksek fiziksel ve mekanik özelliklere, nisbi uzamaya ve termik özelliklere sahip olduğu tespit edilmiştir.
Polistirenin polifonksiyonel modifikatörlerle katyonik katalizörler ortamında kimyasal modifikasyon reaksiyonları sonucunda elde edilen polifonksiyonel polistirenler, aşağıdaki reaksiyon şemasında gösterilmiştir.
CH2 CH CH2 C CH CH2 R H CH3 O C C O O CH2 CH CH2Cl O CH2 CH CH2 CH CH2 CH CH2 CH CH2 CH CH2 CH CO CH3 CH2 CH CH2Cl OH NaOH CH2 C CH CH2 CH2 CH CH2 CH CH2 CH CH2 O CH3 CH3 R , ( ) (n )m ( ) (n )m ( ) (m )n R ( ) (m )n ( )k
Şemadan da görüldüğü gibi polistirenin epiklorhidrinle katyonik katalizör ortamında kimyasal modifikasyonundan aromatik halkasında klorhidrin gruplu polistiren, daha sonra da bazik ortamdaki reaksiyonundan yapısında epoksi grubu
bulunan polistiren, dien hidrokarbonlarla(bütadien, izopren) kimyasal modifikasyonundan aromatik halkasında oligodien grup bulunan polistiren, asetik anhidritle kimyasal modifikasyonundan aromatik halkasında açil grubu bulunan polistirenler sentezlenmiştir.
Polistirene alkil, sikloalkil gruplarının bağlanmasıyla, ısıya dayanıklı katkı maddeleri elde edilmiştir(Aliyev, 1971).
CH2 CH C6H11Cl AlCl3 CH2 CH CH2 CH C6H11 + 20 Co ( ) (n )m
Polistirenin, aromatik doymamış asidin kloranhidridi ile reaksiyonundan ışığa hassas polimer elde edilmiştir(Garney, 1967).
CH2 CH AlCl3 C6H5 CH=CHCOCl CO CH=CH C6H5 CH2 CH +
Kenyon(1955,1958) Friedel-Crafts reaksiyonu ile polivinilasetofenonu elde etmiş ve elde edilen polivinilasetofenonun da aldehitlerle reaksiyonundan ışığa hassas polistireni sentezlemiştir.
CH2 CH CH3COCl AlCl3 CH2 CH COCH3 RCHO CH2 CH COCH CH R + +
2. POLİMERLEŞME REAKSİYONLARI
Polimerler, büyük moleküllerden oluşan maddelerdir. Polimer moleküllerini oluşturmak üzere birbirleri ile kimyasal bağlarla bağlanan küçük moleküllere "monomer" denir. Monomer birimlerinden başlayarak polimer moleküllerinin elde edilmesine kadar olan reaksiyonlara ise "polimerleşme reaksiyonları" denir. Polimerleşme reaksiyonları sonucunda yüksek moleküllü polimerler meydana gelir.
Çok sayıda monomer molekülü kovalent bağlarla birbirine bağlanarak polimeri meydana getirmektedir.
nM nM M n veya M M
M, tekrarlanan birimleri, n ise polimerleşme derecesini göstermektedir. Polimerler, küçük moleküllü bileşiklerin polimerleşme reaksiyonu, polikondensasyon reaksiyonu ve polimerlerin kimyasal metotlarla diğer polimerlere dönüşüm reaksiyonları(polimer analoji dönüşüm)ile sentezlenebilir.
Polimerlerin özellikleri ve kimyasal reaksiyonları, onları meydana getiren monomer birimlerinin yapısına, miktarına, fonksiyonel grupların tabiatına ve sayısına bağlı olmaktadır.
1929 da Carothers polimerleri; kondensasyon polimerleri ve katılma polimerleri olmak üzere iki grup altında topladı. Kondensasyon polimerleri ise en az iki fonksiyonlu grup(−COOH, −NH2, −OH ) içeren monomerlerin aralarından küçük bir molekülün (H2O, HCl, NH3 gibi) ayrılmasıyla oluşurlar. Katılma polimerleri(zincir polimerleri) ise serbest radikal, anyonik, katyonik, koordinasyon polimerleşmesi ile elde edilebilir. Bu reaksiyonlarda oluşan polimerlerin temel molekülünün kaba formülü ile monomerin kaba formülü aynıdır.
2.1 Basamaklı Polimerizasyon ve Kinetiği
Basamaklı Polimerizasyon reaksiyonu, genel olarak büyüklükleri farklı iki molekül arasında meydana gelen reaksiyonları kapsar. Bu tür reaksiyonların en önemli örneği kondensasyon polimerizasyonudur. Kondensasyon polimerizasyonun da küçük moleküller kondensasyon reaksiyonları ile bağlanarak polimer moleküllerini meydana getirirken, reaksiyon sonucu küçük gruplar ayrılır. Örneğin,
dikarboksilli asitler ile glikollerden poliesterlerin, dikarboksilli asitler ile diaminlerden poliamidlerin oluşmasında yan ürün olarak su çıkar. Reaksiyona giren maddelerin yapısına göre sudan başka amonyak, karbondioksit metanol vb. küçük moleküllerde meydana gelebilir. Basamaklı polimerizasyona örnek olarak bir poliamid olan naylon–6,6 nın oluşum mekanizması gösterilebilir:
H2N(CH2)6NH2 + HOOC(CH2)4COOH H2N(CH2)6NHCO(CH2)4COOH + H2O HN(CH2)6NHCO(CH2)4CO n
H OH
Polimerik maddelerin, basamaklı polimerizasyon ile sentezinde esterleşme, amidleşme, ve aromatik substitusyon gibi çok değişik kimyasal reaksiyonlardan faydalanılır.
İki fonksiyonel gruplu monomerlerin kondensasyonundan yüksek molekül ağırlıklı lineer bir polimer oluşurken, molekül başına ikiden daha fazla fonksiyonel grup içeren polifonksiyonel monomerlerin kondensasyonundan dallanmış ve çapraz bağlı polimerler meydana gelir.
Kondensasyon reaksiyonu, farklı sayıda monomer birimleri içeren moleküller arasında meydana geleceği için, reaksiyon karışımında birçok farklı uzunlukta zincir meydana gelebilmektedir.
Basamaklı polimerizasyonun ilk basamağında bir dimer oluşur. Bu dimer ya kendisi gibi bir dimerle kondensasyona girerek tetramer, ya da henüz reaksiyona girmemiş bir monomerle kondensasyona girerek bir trimer verir. Meydana gelen trimer ve tetramer, kendi aralarında, bir başka monomer ya da dimer molekülü ile reaksiyona girebilirler. Böylece polimerizasyon basamaklı bir yolla adım adım ilerlerken polimerin molekül ağırlığı da sürekli olarak artar(Baysal, 1982). Reaksiyon karışımında bulunan küçük, büyük her çeşit iki molekül birbiri ile reaksiyon verebilir.
O O O O O O O O O O O O O O O O O O O O O O O O O O (a) (b) O O O O O O O O O O O O O (c)
Şekil 2.1:Basamaklı polimerizasyon reaksiyon şeması
Reaksiyon şeması Şekil 2.1 de gösterilen basamaklı kondensasyon reaksiyonu ile amino asitten, (H2N–M–COOH) poliamidin oluşumunda, karboksil (–COOH) gruplarının konsantrasyonundaki değişim incelenerek polimerizasyona ait hız eşitlikleri çıkarılabilmektedir.
Kondensasyonun, amin (–NH2) ve karboksil (–COOH) gruplarının konsantrasyonuna göre ikinci mertebeden olması beklenmektedir.
][COOH] NH [ d ] A [ d 2 k t − = (2.1)
Karboksil gruplarının konsantrasyonunu [A] ile gösterirsek eşitlik (2.1) aşağıdaki gibi olur.
][A] NH [ d ] A [ d 2 k t − = (2.2)
Kondensasyon reaksiyonunda her karboksil grubuna karşılık bir amino grubu bulunmasından dolayı, aşağıdaki eşitlik
d[A]
dt = − k[A] 2
(2.3)
yazılabilir.
Kondensasyon hız sabitinin zincir uzunluğuna bağlı olmadığı kabul edilerek, reaksiyon boyunca hız sabiti, k’nın sabit kaldığı ifade edilebilir. Eşitlik 2.3 düzenlenerek belirli integrali alınırsa eşitlik 2.4 ve 2.5 elde edilir.
⌡ ⌠ [A] [A]0 d[A] [A]2 = ⌡⌠ t 0 - kdt (2.4)
[A] = 1 + kt[A]0 [A]0 (2.5)
t zamanında reaksiyona girmiş karboksil gruplarının kesrini bir p parametresiyle gösterirsek;
p = [A]0 - [A] [A]0 (2.6)
eşitliği yazılır. Bu eşitlik düzenlenirse t zamanında reaksiyona girmiş karboksil kesri,
p;
p = 1 + kt[A]0 kt[A]0 (2.7)
olarak bulunur.
2.2 Zincir Polimerizasyonu
Katılma polimerleri zincir reaksiyonları ile monomerlerin doğrudan doğruya polimer moleküllerine bağlanmaları ile oluşur. Monomer ve reaksiyon sonucunda oluşan polimer molekülü aynı kimyasal bileşime sahiptir. Zincir polimerleşmesi monomerin aktifleşmesi, zincir büyümesi ve zincir sonlanması olmak üzere üç basamakta gerçekleşmektedir. Monomer molekülleri ısı, ışık veya katalizörlerin etkisiyle aktifleşir. Aktifleşen monomer bir başka monomerle birleşerek onu da
aktifleştirir. Bu şekilde çok sayıda monomer molekülü birleşip polimer zincirinin büyümesini sağlar ve son basamakta ise büyümekte olan polimer zinciri sonlanır(Şekil 2.2). O O O O O O O O O O O O O O O O O O O O O O O O O O (a) (b) O O O O O O O O O O O O O (c)
Şekil 2.2: Zincir polimerizasyon süreci.
Monomer birimleri sadece büyüme reaksiyonunda tek tek zincire katılabilirler. Zincirin büyümesinden sorumlu olan aktif merkez çok sayıda monomer birimlerinin katılması sırasında tek bir polimer molekülüne bağlı kaldığı için, reaksiyonun daha başlangıcında polimer moleküllerinin oluştuğu ve reaksiyon karışımında monomerle yüksek molekül ağırlıklı polimer moleküllerinin dışında hemen hemen hiçbir ara ürün bulunmadığı görülür. Zincir reaksiyonunu başlatan aktif merkezlerin serbest radikal, anyon ve katyon niteliğinde olduğu deneysel olarak bulunmuştur (Flory, 1937)
2.2.1 Radikal Zincir Polimerizasyonu ve Kinetiği
Katılma polimerizasyonun en önemli tiplerinden biri çiftleşmemiş elektron içeren serbest radikallerle başlatılan polimerizasyondur. Serbest radikaller genel olarak katalizör ya da başlatıcı denilen ve bazı koşullarda kararsız maddelerin parçalanması ile oluşur. Bu serbest radikal bir vinil monomerinin çifte bağı ile reaksiyona girerek monomere katılır ve yeniden çiftleşmemiş elektronu bulunan bir radikal verir. Çok kısa bir süre içerisinde çok sayıda monomer molekülü büyümekte olan zincire katılır. En sonunda iki serbest radikal birbiri ile reaksiyona girer ve polimer molekülleri oluşur.
C O O C O O C O O C O O CH2=CHX C O OCH2CHX C O O (CH2CHX)
(başlatıcı) (serbest radikal)
2
.
.
+ .
(serbest radikal) (vinil polimeri) (büyüyen zincir)
.
2 n aktifliğini yitiren ürünler
(büyüyen zincir) (polimer)
Vinil polimerizasyonunun bir zincir mekanizması üzerinden yürüdüğü 1920 yıllarında Staudinger tarafından ortaya atılmış, Flory(1937), vinil polimerizasyonu kinetiği üzerindeki incelemeleri ile radikal polimerizasyonun başlama, çoğalma ve sonlanma aşamalarını gerektiren bir zincir reaksiyonu olduğunu göstermiştir.
Radikal zincir polimerizasyonunda aktif merkezler, tek elektronlara sahip serbest radikallerdir. Serbest radikallerin monomerlere etkimesiyle başlayan zincir polimerleşmesinin kinetik analizinde temel özellik polimerizasyon hızının başlatıcı konsantrasyonunun kare kökü ile orantılı olmasıdır:
v =k[I]1/ 2[M] (2.8)
Radikalik zincir polimerizasyonunda üç temel reaksiyon basamağı vardır. (a) Başlama basamağı
I R R M1 M R + . + v = ki[I] (hızlı) . . . (2.9)
Yukarıdaki reaksiyon şemasında, I, başlatıcı; R·, başlatıcının oluşturduğu radikal ve ·M1, bir monomer radikalidir. Serbest radikal zincir polimerleşmesinde hız tayin basamağı; başlatıcının homolizi ile R· radikallerinin oluşum basamağıdır; bundan dolayı reaksiyon hızı başlama basamağının hızı, v’ye eşittir.
(b) Zincirin büyümesi M2 M M1 M3 M M M M M2 M4 M M3 ... +
.
.
+.
.
+.
n-1.
n +.
.
v = kp[M][·M] (2.10)Bu basamakların sonucu olarak radikallerin toplam konsantrasyonlarının artış hızı, başlama basamağının hızına eşittir. Buradan
d[·M] dt oluşum = 2o/ki[I] (2.11)
yazılabilir. Burada o/, başlama basamağının verimi olup bir zinciri başlatabilen R· radikallerinin kesridir.
(c) Zincirin sonlanması
M M M
.
n +
.
m n+mSonlanma hızının, zincir uzunluğuna bağlı olduğunu kabul edilerek, sonlanma için hız denklemi,
v = kt[·M]2 (2.12)
eşitliği yazılabilir.
Buna göre radikal konsantrasyonunun değişme hızı
d[·M] dt sonlanma = − 2 kt[·M] 2 (2.13)
şeklinde ifade edilir. Uygulamada başka sonlanma basamakları da olabilir. Ayrıca zincir aktarımı gibi yan reaksiyonlar da meydana gelebilir ve bu durumlarda, bir zincir büyümeye devam ederken, aşağıdaki reaksiyonla yeni bir zincir başlamaktadır.
M
M +
.
Mn.
+ MnToplam radikal konsantrasyonu, polimerizasyonun esas kısmı boyunca yaklaşık olarak sabit kalmaktadır. Bu nedenle net radikal oluşum hızı sıfıra eşit alınabilir:
d[·M] dt = 2o/ki[I]- 2 kt[·M] 2 = 0 (2.14)
Buna göre radikal zincirlerinin kararlı-hal konsantrasyonu,
[·M] = o/ki kt 1/ 2 [I]1/ 2 (2.15)
Zincirlerin yayılma hızı (monomerin tüketilme hızı) d[·M] dt = − kp[·M][M] (2.16) d[·M] dt = −kp o/ki kt 1/ 2 [I]1/ 2[M] (2.17)
eşitlikleri elde edilir. Kinetik zincir uzunluğu, v, zincir yayılma mekanizması verimliliğinin bir ölçüsüdür. Bu terim, harcanan monomer birimleri sayısının, başlama basamağında oluşan aktif merkez sayısına oranı olarak tanımlanmaktadır:
v = harcanan monomer birimlerinin sayısı
oluşan aktif merkezlerin sayısı (2.18)
Bu durumda, kinetik zincir uzunluğu yayılma ve başlama hızlarının oranına eşittir.
v = yayılma hızı başlama hızı (2.19)
Başlama hızı sonlanma hızına eşit olduğundan, 2.17 eşitliği
v = kp[·M][M] 2kt[·M]2 =
kp[M]
2kt[·M] (2.20)
şeklinde yazabilir. Eşitlik 2.13, radikal konsantrasyonu yerine yazıldığında
v = k[·M][I]-1/ 2 k = 1
2 kp(o/kikt) -1/ 2
(2.21)
eşitliği elde edilir. Sonuç olarak başlatıcı konsantrasyonu ne kadar düşükse ve başlama basamağı hız sabiti ne kadar küçükse, kinetik zincir uzunluğu o kadar büyük olmaktadır.
2.2.2 Anyonik Zincir Polimerizasyonu ve Kinetiği
Anyonik polimerizasyonda büyümeyi sağlayan aktif uçlar anyonik karakterdedir. Yan grup siyano ve karbonil(ester, keton, aldehit veya asit) gibi elektron çekici özellikte olduğunda karbon-karbon çift bağındaki elektron yoğunluğunu azaltarak anyonik başlatıcıların etkisini kolaylaştırır ve polimerizasyon karbanyonlar üzerinden ilerler.
Anyonik polimerizasyon, alkali metaller, Grignard bileşikleri, alüminyum alkiller veya iyonlaştırıcı ışınlarla başlatılır. Başlatıcının eksi yüklü kısmı doğrudan monomere katılarak ilk anyonik aktif merkez oluşur.
H2C=C + R' M H R R' H2C C M H R - +
Tepkimede; R’-M, n-bütil lityum gibi bir anyonik başlatıcıyı, R ise fenil yada siyano gibi elektron çekici bir grubu göstermektedir. Büyüme aşamasında monomer molekülleri ard arda zincir ucundaki iyon çifti arasına yerleşir. Anyonik polimerizasyonda normalde sonlanma tepkimeleri gözlenmez. Büyüme adımları ortamdaki monomer molekülleri tamamen harcanana kadar sürer. Sonlanma ise; karbon dioksit, su, alkol gibi dışardan ortama katılan maddelerden proton koparılması ile olur.
H2C C M + H2O H R H2C C H + MOH H R - +
Anyonik polimerizasyonlarda en basit kinetik davranış tamamen iyonlarına ayrışabilen başlatıcıların kullanıldığı sistemlerde gözlenir. Bu tür sistemlerde başlatıcının(EY) tamamının aşağıdaki tepkimeyle iyonlarına ayrıştığı varsayılır(Saçak, 2002).
Başlama adımında monomer molekülü başlatıcıdan gelen −
E anyonuna,
E Y M_ + + + E M Y_ + +
şeklinde katılır.
Büyüme adımı çözücü türüne bağlı olarak serbest iyonlar ( −
EM ) ve iyon çiftleri ( − +
Y
EM ) üzerinden ilerleyebilir. İyon çiftleri ile yürüyen reaksiyon denkleminden E M Y M_ + E M M Y + _ + reaksiyon hızı ; v = kE−(Y+)[E−(Y+)][M] (2.22)
şeklinde, serbest iyonlar üzerinden yürüyen reaksiyon denklemi için de E M M_ + E M M_
reaksiyon hızı;
v = kE−[E−][M] (2.23)
şeklinde yazılır.
Anyonik zincir polimerleşmesinde polimerlerin oluştuğu sistemlerde reaksiyonun genel hızı, iyon çiftleri ve serbest iyonların katılımı ile gerçekleşen büyüme reaksiyonlarının hızlarının toplamı olarak kabul edilmektedir.
v = kE−(Y+)[E−(Y+)][M] + kE−[E−][M] (2.24) Burada iyon çiftleri, E−(Y+); serbest anyonlar, E−; pozitif iyonlar ise (Y+) ile gösterilmektedir. Bu tür sistemlerde iyon çiftleri ve serbest anyonların konsantrasyonları aşağıda verilen denge reaksiyonuna benzer biçimde belirlenir.
E (Y ) E + (Y )- + K - +
Bu eşitlikte K denge sabitidir. Tepkimenin denge ifadesi ise aşağıda gösterildiği gibi olmaktadır.
K = )] (Y [E )] ][(Y [E + − + − (2.25)
[E−] = [(Y+)] olduğu için, 2.25 eşitliği
K = )] (Y [E ] [E 2 + − − (2.26)
şeklinde yazılır. Eşitlik 2.26’dan serbest anyon konsantrasyonu [E−] = K1/2[E−(Y+)]1/2 olarak bulunur. Serbest anyon konsantrasyonu eşitlik 2.24 de yerine yazılırsa
v = k E−(Y+) [E−(Y+)][M] + kE- K1/2[E−(Y+)]1/2[M] (2.27)
eşitliği elde edilir. Eşitlik 2.27 yeniden düzenlenirse,
] M ][ ) (Y E [ − + v = kE−(Y+) + 1/2 2 1 E )] (Y E [ − + −K k (2.28)
şeklinde yazılabilir. Anyonik zincir polimerleşmesi için genel hız eşitliği,
v = kp[M−][M] (2.29)
eşitliği ile ifade edilir. Polimerleşme reaksiyonlarında aktif merkezlerin sadece iyon çiftlerinden oluştuğu kabul edilerek 2.28 ve 2.29 eşitliklerinin karşılaştırılması yapılırsa, kp = kE−(Y+) + 1/2 2 / 1 E ] ) (Y E [ − + −K k (2.30) kp = kE−(Y+) + + − − 1/2 2 1 E [E (Y )] 1 K k (2.31)
sonucu çıkar. kp = ƒ(1/[A−(C+)]1/2) fonksiyonuna göre deneysel veriler dikkate alınarak çizilen grafikte, elde edilen doğrunun kesim noktasından iyon çiftleri ile büyüme basamağının hız sabiti, eğiminden de serbest anyonlar ile büyüme basamağının hız sabiti ile iyon çiftlerinin ayrışma reaksiyonunun denge sabiti bulunmaktadır.
2.2.3 Katyonik Zincir Polimerizasyonu ve Kinetiği
Katyonik polimerizasyon, artı yüklü aktif merkezler üzerinden ilerleyen iyonik polimerizasyondur. Yan grup; alkoksi, alkil, alkenil, fenil gibi elektron verici özellikte olduğunda karbon-karbon çift bağındaki elektron yoğunluğu artırarak katyonik başlatıcıların etkisini kolaylaştırır ve polimerizasyon karbonyum iyonları üzerinden ilerler.
Katyonik polimerizasyon, lewis asitleriyle ve kuvvetli protonik asitlerle başlatılabilir. Lewis asitleri genelde, tek başlarına polimerizasyonu başlatmada yetersizdirler, proton verme özelliğine sahip kokatalizör ya da yardımcı katalizör denilen bileşikler yanında etkindirler. Su, metanol gibi bileşikler Lewis asitleri yanında kokatalizör görevi yaparlar ve Lewis asitleri ile aşağıdaki gibi tepkimeye girerler.
BF3 + H2O F3B:OH2 F3BOH + H +
-Kuvvetli protonik asitler ise iyonlaşıp kolayca proton verirler ve ortamda bir monomer bulunursa kuvvetli protonik asit, monomere bir proton aktarır ve ilk katyonik aktif merkezi oluşturur.
H2SO4 H + HSO+ 4 -H + -HSO4 + H2C=C R R H3C C A R R + - +
-Oluşan katyonik aktif merkeze ard arda katyon-anyon bağı ile monomerler bağlanır. İlk katılımla dimer oluşur ve benzer katılımlarla polimer zinciri büyür.
Büyüme adımı zincir transfer tepkimeleri hızının düşük olduğu düşük sıcaklıklarda hızla ilerler. Polimer zinciri, zincir transfer tepkimeleriyle aktifliklerini kaybeder ve sonlanır.
Katyonik polimerizasyonların kinetiği, incelenen sistemdeki sonlanma reaksiyonunun mekanizmasına bağlı olarak değişmektedir. Ayrıca katyonik polimerleşmenin ortamda bulunan safsızlıklara karşı çok duyarlı olmasından dolayı katyonik zincir polimerleşme reaksiyonlarının tümünü kapsayan genel bir kinetik mekanizmanın yazılması mümkün değildir. Ancak, çok sayıda bu tür tepkimeler için geçerli olan kinetik eşitliklerin elde edilme olanağı vardır.
Aktif merkezlerin katalizör kompleksi ile monomerin etkileşmesi sonucunda meydana geldiği göz önüne alınarak başlama tepkimesi
C + RH H [RC]K
[RC] H + M HM [RC]
+
-- + ki +
-biçiminde yazılabilir. Burada, C: katalizör ; RH: kokatalizör; M: monomeri göstermektedir. Başlama tepkimesinin hızı,
vi = Kki[C][RH][M] (2.32)
eşitliği ile verilebilir. Genel olarak büyümenin iyon çiftleri vasıtasıyla meydana geldiği kabul edilerek büyüme basamağı
HM [RC] + M HM M [RC]+ - kp +
-n n
biçiminde yazılır. Büyüme basamağının hızı, ][M] (RC) HM [ p p − + =k v (2.33)
eşitliği ile verilebilir. Bu eşitlikteki [HM+(RC)−]
büyümekte olan makrokarbonyum iyonlarının konsantrasyonunu göstermektedir. Katyonik polimerleşme reaksiyon mekanizmasına göre sonlanma reaksiyonu ise
HM M [RC] M + H [RC]n + - kt n +1 +
-şeklinde monomere zincir transferidir. Bunun sonucu olarak polimer molekülünün ucunda doymamış bir bağ oluşur. Sonlanma basamağının hızı,
vt = kt[HM+(RC)−]
(2.34)
eşitliği ile verilebilir. Büyümekte olan iyon çiftleri için karalı hal koşulunun geçerli olduğu varsayılarak, başlama ve sonlanma hızlarının eşit olacağı kabul edilip vi = vt şeklinde yazılabilir.
Kki[C][RH][M]= kt[HM+(RC)−] (2.35) eşitliği yazılır. Eşitlik 2.35 den [HM+(RC)−]
değeri eşitlik 2.33 de yerine yazılır ve polimerleşmenin genel hızının da büyüme basamağının hızı ile belirlendiği dikkate alınırsa eşitlik 2.36’da ki katyonik zincir polimerleşmesinin hız eşitliği elde edilir.
v = vp = 2 t p i [C][RH][M] k k Kk (2.36)
Bu eşitliğe göre, katyonik zincir polimerleşmesinin reaksiyon hızı katalizör kompleksi ile birinci, monomer konsantrasyonuna ile ikinci dereceden doğru orantılıdır(Saçak, 2002).
3. LİTERATÜR ÖZETLERİ
S. Guruvenketa, G. Mohan Raoa, , Manoj Komathb, Ashok M. Raichurc, Plasma
surface modification of polystyrene and polyethylene, Applied Surface Science 236
(2004) 278–284
Yapılan çalışmada, polistiren ve polietilen örnekleri argon ve oksijen plazmaları ile ele alınmıştır. ECR cihazında argon ve oksijen plazmaları kullanılmış ve bu plazmaların polimerin yüzeyini değiştirdiği görülmüştür. Polimerin yüzey modifikasyonunun zaman karşı davranışı modifikasyondan önce ve sonraki örneklerin suyla temas açısı ölçülerek değerlendirilmiştir. Hem polistiren hem de polietilenin mikrodalga enerjisindeki artışının yanında temas açısındaki azalışı gözlenmiştir. Plazma parametreleri, Langmiur araştırma ölçümleri kullanılarak değerlendirilmiştir. IR spektrumlarındaki değişmelerden hem polietilen hem de polistirenin oksijen bazlı fonksiyonel gruplarla reaksiyona girdiği tespit edilmiştir.
S.A. Mitchell, M.R. Davidson, N. Emmison, R.H. Bradley, Isopropyl alcohol plasma
modification of polystyrene surfaces to infuence cell attachment behaviour,
Surface Science 561 (2004) 110–120
Bu çalışmada bir izopropil alkol plazması, zayıf bir hidrofilik film tarafından polistiren yüzeyinin modifikasyonu için kullanılmıştır. Bu filmler, X-ray fotoelektron spektroskopisinde, Atomik kuvvet mikroskobunda incelenmiş ve filmlerin suyla temas açıları ölçülmüştür. Bu çalışmalar sonunda 600 saniye’den sonra yüzey modifikasyonundaki artış ile birlikte oksijenin kapladığı alanın arttığı gözlenmiştir. Monokromatik XPS sonuçlarından, karboksil grubunun ortamda olmaması, karbonil ve alkol/eter gruplarının oksijen yüzeyini oluşturduğunu göstermiştir. Hücre kültürü için modifiye edilmiş yüzeylerin uygunluğu değerlendirilmiştir ve dönüştürülmüş fıbroblast(1BR.3N) hücrelerinin gelişiminde %10 (v/v) serum proteinlerinin olduğu bulunmuştur. Plazmanın 60 s’den sonra hücreye bağlanma sonuçları ile bir karboksil grup ilave edilerek polistiren doku kültürünün toplam yüzeyindeki oksijen konsantrasyonundaki artma hızları karşılaştırılmıştır. Kimyasal heterojen yüzey
ürününün çözünmüş hücrelere bağlanma çalışmaları için basit bir kimyasal teknik kullanılmıştır. Fıbroblast(1BR.3N) hücrelerinin işlenmemiş hidrofilik bölgelerindeki plazmanın tercihli bağlanmaya maruz kaldığı bulunmuştur.
Halina Kaczmarek, Malgorzata Swiatek, Alina Kaminska, Modification of
polystyrene and poly(vinyl chloride) for the purpose of obtaining packaging
materials degradable in the natural environment, Polymer Degradation and
Stability 83 (2004) 35–45
Bu çalışmada, polistiren(PS) ve polivinil klorür(PVC)’ün indirgenebilirliğini artırmak amacıyla, %1–5 oranında keton (asetofenon ya da benzofenon) ilavesi ile modifiye edilmiştir. Modifiye edilmiş polimerlerin ince filmleri üzerine, UV ışınlarının etkisi araştırılmıştır. PS ve PVC’nin kimyasal yapısındaki değişmeler UV-vis. ve FTIR spektroskopisi kullanılarak incelenmiştir. İndirgenme reaksiyonları, ortalama molekül ağırlıkları ve molekül ağırlığındaki dağılımları karşılaştırılarak izlenmiştir. Mekanik özellikleri standart gerilmeye ait test ölçümleri kullanılarak çalışılmıştır. Ketonların varlığı her iki polimerin fotokimyasal kararlıklarında oldukça büyük değişikliklere sebep olduğu görülmüştür. Polistirenin oksidatif foto indirgenmesi aynı koşullarda tamamlanmış, katkı maddelerinin bazılarının miktarının değiştirilmesiyle PVC’de meydana gelen benzer süreçlere göre daha hızlı olduğu bulunmuştur. Her iki polimerin fotokimyasal muamele sürecindeki farklar, bileşenlerin farklı karışabilirliği ile açıklanabilir. Aynı zamanda ilave edilen asetofenon ya da benzofenon’un PS’nin mekanik özelliğini çok az değiştirmesi böyle düzenlemeleri, doğal çevrede basitçe ayrışabilen plastiklerin üretiminde kullanma olanağını akla getirmiştir.
D.F. Siqueira-Petri, G. Wenz, P. Schuunk, T. Schimmel, M. Bruns, M.A. Dichtl,
Surface Modification of Thin Polystyrene Films, Colloid&Polym. Science
277(1999), 673–679
Yapılan çalışmada, zamanın bir fonksiyonu olarak %50’lik ve %96’lık sülfirik asit ile polistiren filmlerinin sülfolanması gösterilmiştir. Daha önceki literatür
raporlarının aksine seyreltik sülfirik asitli polistiren filmlerinin sülfolanması işleminin, 30 saniye ile 1 saatlik reaksiyon zaman aralığı içerisinde gerçekleştiği görülmüştür. Modifiye edilmiş polistirenin hidrofilikliği, reaksiyona girmemiş polistiren filmlerine kıyasla oldukça artmıştır. Yüzeydeki polistirenin sülfolanması X-ışın fotoelektron spektroskopisinde incelenmiştir. Yüzey morfolojosi, rodamin B boyası ile fluoresans mikroskobu kullanılarak sülfolanmış polistiren matriksi ve reaksiyona girmemiş alanların oluşturduğu sistem olarak tanımlanmıştır. Sülfolanmış polistiren yüzeyindeki polikatyon dialildimetilamonyum kloritin adsorpsiyonu gerçekleştirilmiş ve adsorplanmış polikatyonun kalınlığı 2,2 nm olarak bulunmuştur.
Takurou N. Murakami, Yoshinori Fukushima, Yoshiaki Hirano,Yoshikazu Tokuoka, Mitsuo Takahashi, Norimichi Kawashima, Surface modification of polystyrene and
poly(methyl methacrylate) by active oxygen treatment, Colloids and Surfaces B:
Biointerfaces 29 (2003) 171-179
Bu çalışmada, hidrofobik polistiren (PS) ve polimetilmetakrilat (PMMA)’ın ozon muamelesi ile, UV ışınları ve damıtılmış su içinde ozon/UV ile yüzey modifikasyonunun olanağı incelenmiştir. Ele alınan filmlerin yüzey durumları ve taneciklerin temas açısı, atomik kuvvet mikroskobu (AFM) ve FT-IR ölçümleri yoluyla araştırılmıştır. Temas açısı ölçümlerine göre, PS filmlerinde ultra saf suyun temas açı değerleri zamanla azalmıştır. En dikkate değer azalma ozon/UV ile yapılan çalışmada görülmüştür. Aromatik halkalı PS’nin tanecik ve film yüzeyleri, hidroksil(OH) ve karbonil(C=O) grupları ile yeterli derecede modifiye edildiği bulunmuş ve en dikkate değer sonuçlar ozon/UV ile muamelesinde elde edilmiştir. PS ve PMMA’nın yüzey modifikasyonunda deneysel sonuçlar, damıtılmış suda ozon/UV ile muamelenin aromatik halkalı polimerlerin yüzey modifikasyonu için faydalı tekniklerden biri olarak kullanılabilir olduğunu göstermiştir.
J. Zekonyte, J. Erichsen, V. Zaporojtchenko, F. Faupel, Mechanisms of argon
ion-beam surface modification of polystyrene, Surface Science 532–535 (2003)
Polimerlerin yüzey karakteristikleri, bu polimerlerin ara yüzey özelliklerini ve teknolojik performanslarını tanımlayan önemli faktörlerdir. Bir polimer filminin fiziksel ve kimyasal özelliklerindeki değişiklikler, maddeyi bir türlü yüzey modifikasyonuna örneğin iyon-ışın modifikasyonu tekniğine maruz bırakarak belirlenebilir. Polistiren, iyon ışınlarına maruz bırakılarak yüzey özelliklerindeki değişiklikler araştırılmıştır. Temel mekanizmayı anlamak için düşük iyon dozları ile kontrollü şartlar altında Argon iyonu muamelesinden sonra polistirenin yüzey modifikasyonu çalışması için X-Ray fotoelektron spektroskopisi(XPS) kullanılmıştır. Polistirenin Argon iyonu ile muamelesi polimer yüzeyinde bozunmaya neden olmuş ve polimerin yüzeyi yeniden düzenlenmiştir. Polistiren film yüzeyinin iyon ile muamelesi sırasında oksidasyon, aromatiklik kaybı, bağların yeniden düzenlenmesi ve yüzey çapraz bağlanma meydana gelmiştir.
Jürgen Schellenberg,, Norio Tomotsu, Syndiotactic polystyrene catalysts and
polymerization, Prog. Polym. Sci. 27 (2002) 1925–1982
1985’te ilk sindiotaktik polistirenin sentezlenmesinden sonra bu polimerin sentezi, günümüze kadar özellikle kataliz ve polimerizasyon araştırmaları için çok önem kazanmış ve bu ürünü hızlı bir şekilde ticari bir ürün haline getirmiştir. Bu literatür araştırması katalitik sistemler üzerine ayrıntılı bir gözden geçirme imkanı vermiştir ve özellikle stirenin geçiş metal kompleksleriyle sindiospesifik homopolimerizasyonu araştırılmıştır. Stirenin sindiospesifik polimerizasyonu için katalitik sistemleri; geçiş metal kompleksleri, kokatalizörler(metilaluminoksan ve boron bileşikleri), aktivatörler ve zincir transfer maddeleri oluşturur ve katalizörler destekler. Geçiş metal kompleksleri; ilk geçiş metal kompleksleri, 4 grup metal kompleksleri(mono ve bis-siklopentadienil kompleksi, diğer halkalı sistemler ile metal kompleksler ve binükleer katalizörler, halkasız sistemler ile metal kompleksler) ve diğer geçiş metallerinin metal komplekslerini kapsar. Sonuç olarak, sindiotaktik polistiren metilaluminoksan tarafından aktif hale getirilen titanyum bileşikleri ile elde edilebilir ve özel aromatik metal kompleksleriyle birleşmede yüksek oranlarda polimerizasyon yapılabilir.
Emmanuelle Imbert-Laurenceau, Marie-Claire Berger, Graciela Pavon-Djavid, Alain Jouan, Veronique Migonney, Surface modification of polystyrene particles for
specific antibody adsorption, Polymer 46 (2005) 1277–1285
Yapılan birçok çalışma, biyolojik bileşikler ve uygun kimyasal gruplarla işlevsellik kazanmış polistiren tanecikleri arasında biyospesifik etkileşimlerin olabildiğini göstermiştir. Bu çalışmada, benzer doğal biyoaktif kabiliyetli kimyasal gruplar taşıyan polimer tanecikleri ve antikorlar gibi biyolojik moleküller arasındaki biyospesifik etkileşimler araştırılmıştır. Bu amaçla polistiren tanecikleri çeşitli amino asitlerle sübstitüte edilmiştir. Polistiren taneciklerinin fonksiyonelizasyon ürünleri aminoasidin çeşidine bağlı olarak bulunmuştur. Fonksiyonelleşmiş lateksler ve antivirüs antikorları arasındaki etkileşimler ile virüs antikorlarıyla etkileşimleri sistematik olarak karşılaştırılmıştır. Sonuçlar, antivirüs antikorlarının adsorpsiyonu polistiren taneciklerinin yüzeyinin kimyasal bileşimine, sübstitüte olmuş aminoaside, sübstitüsyon miktarı ve polimer taneciklerinin yüzey yük yoğunluğuna bağlı olduğunu göstermiştir. Bu farklar antikor adsorpsiyonunun kapasitesindeki değişme ve ilgili sabitler ile açıklanabilir.
A. Nakao, T. Kobayashi, M. Iwaki, Surface Modification of Polystyrene by K ion
Implantation, Nuclear Instruments and Methods in Physics Research B.
191(2002), 685-689
Bu çalışmada, potasyum iyonu aşılanması ile yüzey modifikasyonu yapılmış polistirenin özellikleri ve hidrofilik fonksiyonların katılma mekanizması araştırılmıştır. Potasyum atomlarının derinlik dağılımı Rutherford geri dağılma spektroskopisi (RBS) ile incelenmiştir. Temas açısının düşüşü, X ışını foto-elektron spektroskopi çalışmasında potasyum atomunun konsantrasyonundaki artış ile ilgili olduğu bulunmuştur. Polistiren yüzeyinin üzerinde ya da yanındaki potasyum atomlarının beklenmedik görünüşlerini incelemek için polistirendeki potasyum iyon aşılaması 5×1015’den 5×1016 iyon cm-2 aralıklarda 50 ve 150 keV’luk enerjilerde yapılmış ve polistirenin potasyum ile aşılanmış katmanındaki oluşum Rutherford geri dağılma spektroskopisi (RBS) ile araştırılmıştır. Potasyum atomlarının derinlik
dağılımı, düşük bir miktar potasyum iyonu için Gaussian dağılımı göstermiş ve TRIM-98 ile hesaplanan kuramsal dağılım ile uyum içerisinde olduğu bulunmuştur. Orta miktarlarda, potasyum derinlik profili trapezodial dağılımına dönüştü. Yüksek miktarda potasyum zenginleştirmesi ise yüzeyde bulunmuş ve 50-150 keV arasındaki enerji aralığında farklı olaylar göstermiştir. Potasyum atomlarının zenginleştirme mekanizmasının, TRIM sonuçlarıyla ilişkisi, yoğunluk parametrelerindeki değişiklikleri, yüzey bağlama ve yer değiştirme enerjileri incelenmiştir.
Mousa Ghaemy, Solaiman Roohina, Grafting of Maleic Anhydride on Polyethylene
in a Homogeneous Medium in the Presence of Radical Initiators, Iranian Polymer
Journal, 12 (1), 2003, 21-29
Polietilenin fonsiyonelizasyonu, serbest radikaller ile başlatılan maleik anhidritin homojen aşı reaksiyonları ile gerçekleştirilmiştir. Benzoil peroksit, dikümilperoksit ve azobisizobütironitril gibi serbest radikaller oluşturan kimyasal maddeler kullanılmış ve bu serbest radikallerin verimliliği kıyaslanmıştır. Reaksiyona çözücü, zaman ve sıcaklığın etkileri ile aşılama yüzdesine monomer konsantrasyonunun etkisi araştırılmıştır. Başlatıcı, çözücü, atmosfer ve monomer konsantrasyon türlerine ait etkilerin karşılaştırılması, polietilen makroradikallerinin transfer reaksiyonlarının çoğunlukla zincir boyunca oluştuğunu göstermiştir. Monomer konsantrasyonu ve polimer türünün etkisi ile reaksiyonun mekanizması ayrıca doğrulanmıştır. Maleik anhidritin yan grupları ve polimaleik anhidritin yan zincirleri, maleik anhidrit molekülünün çift bağına polietilen makroradikallerinin katılması ve polimaleik anhidrit ile polietilen makroradikallerinin bir birleşimi ile oluşturulur.
William R. Bussing, Nikolaos A. Peppas, Friedel-Crafts crosslinking methods for
polystyrene modification: 1. Preparation and kinetics, Polymer, Volume 24, Issue 2,
February 1983, Pages 209-216
Polimerizasyon iki aşamada gerçekleştirilmiş olup, çapraz bağlı aşılama reaksiyonu polistirenin modifikasyonu için geliştirilmiştir. İlk aşamada stiren SnCl4
katalizörü kullanılarak 25 oC’de dikloretan içinde polimerleştirilmiştir. Katyonik katalizör ile sentezlenen polistiren, ikinci aşamada bir Fredel-Crafts reaksiyon sisteminde 50 oC’de dikloretan içinde 1,4-dimetil–2,5-diklorometil benzen ile aşılanmıştır. Reaksiyon kinetiği, reaksiyon sisteminden kalan HCl titre edilerek izlenmiştir. Maksimum reaksiyon hızının, hem 1,4-dimetil–2,5-diklorometil benzenin başlangıç konsantrasyonu hem de SnCl4’ün başlangıç konsantrasyonu ile değişimi araştırılmıştır. Reaksiyonun ilerlemesini tespit etmek ve bir reaksiyon mekanizması önermek için aşılanmış polistiren konsantrasyonunun tayini ve onların UV spektrumlarının analizi kullanılmıştır.
4. MATERYAL ve METOT
4.1 Kullanılan Kimyasal Maddeler ve Cihazlar
Çalışmalar için kullanılan polistiren Sigma firmasından temin edilmiş olup molekül ağırlığı Mn=140 000 Mw=230 000 olan polimerdir. Diğer kimyasal maddelerden kloroform, maleik anhidrit, bortriflorür BF3O(C2H5)2, metanol, etanol ve potasyum hidroksit Merck firmasından alınmıştır. Çalışma boyunca Fizikokimya anabilim dalı araştırma laboratuarında bulunan vakumlu etüv, manyetik karıştırıcı ve harici su sirkülasyonlu su banyosundan yararlanılmıştır.
4.2 Polistirenin Kimyasal Modifikasyonu ve Optimum Şartın Tespiti
Polistirenin kimyasal modifikasyon reaksiyonu için; katalizör olarak bortriflorür BF3O(C2H5)2, kullanılarak maleik anhidritin ve kloroformun miktarlarının yanı sıra sıcaklık ve katalizör miktarları da değiştirilerek uygun şart tespit edilmeye çalışılmıştır.
Çalışmalarda, farklı reaksiyon şartlarının modifiye polistirendeki karboksil grubu miktarına etkisi üzerine araştırmalar yapılmıştır. Çalışmalar boyunca düşük molekül ağırlığına sahip polistirenin kimyasal modifikasyon reaksiyonuna maleik anhidrit konsantrasyonunun, polistiren konsantrasyonunun, çözücü miktarının ve sıcaklığın etkisi incelenmiştir.
Polistirenin maleik anhidrit ile Lewis asiti katalizörlüğünde açillenmesi, maleik anhidritin hem çift bağından hem de anhidrit grubundan olmak üzere iki şekilde gerçekleşebilir. Yapılan bir çalışmada etilbenzenin maleik anhidritle açillenmesinden elde edilen ürünün; spektral ve kimyasal analizi sonucunda, açilleme reaksiyonunun anhidrit grubunun kırılmasıyla gerçekleştiği görülmüştür.
Polistirenin maleik anhidrit ile açilleme reaksiyonu, katyonik katalizörler ortamında anhidrit grubunun kırılması ile başlamaktadır.
Buna göre birinci basamakta maleik anhidrit, Lewis asidi ile etkileşip bir kompleks meydana getirmektedir.
BF3O(C2H5)2 O O O O O O BF3O(C2H5)2 _
+
... CO CH CH COOBF+ (1) 3İkinci basamakta bu kompleks polistirenle etkileşmektedir.
( CH2 CH ) O O O BF3O(C2H5)2 ( CH2 CH ) ( CH2 CH ) _ m n
+
... k CO CH CH COOBF+ 3 ( ) (2)Üçüncü basamakta ise polistirenin aromatik halkasından bir hidrojen ve BF3’ün ayrılmasıyla açilasyon grubu aromatik halkanın o- ve p- köşelerine bağlanarak açilleme gerçekleşmektedir.
( CH2 CH ) ( CH2 CH ) _ BF3 _ ( CH2 CH ) ( CH2 CH ) m k CO CH CH COOBF + 3 H m k CO CH CH COOH (3)
4.3 Modifikasyon Reaksiyonunun Bazı Kinetik Parametrelerinin Tayini
Kloroform çözücüsünde, polistirenin ve maleik anhidritin Lewis asiti katalizörlüğünde modifikasyon reaksiyonunun farklı reaksiyon şartlarında ilk hızları, hız sabitleri ve aktivasyon enerjisi hesaplanmıştır.
Reaksiyon için harici su sirkülasyonlu termostat ve kapalı bir reaktör kullanılmıştır. Belirli miktarlarda tartılan polistiren ve maleik anhidrit kloroformda çözüldükten sonra katalizör ilavesiyle reaksiyon başlatılmıştır. Reaksiyonun başlamasıyla birlikte 1., 2., 4., 6., 8. ve 10. dakikada reaksiyon karışımından 1 mL numune alınmıştır. Numune, katalizörün aktifliğini durdurmak amacıyla içerisinde yaklaşık 2 mL su bulunan bir beher içerisine alındıktan sonra her biri polistirene bağlanan karboksil grubunun tayini geri titrasyon metodu ile yapılmıştır. Bunun için içinde numune bulunan behere belirli miktarda NaOH ilave edildi. İlave edilen NaOH’ın karboksil grubuyla reaksiyona girmeden kalan kısmı fenolftalein indikatörü yanında 0,1 N HCl ile geri titre edildi. Numunelerin titrasyonu sonucunda harcanan HCl miktarına bağlı olarak harcanan NaOH’ın hacmi tespit edildi. NaOH’ın hacminden polistiren ile reaksiyona giren maleik anhidritin, mol sayısı ve mol sayısından da konsantrasyonu hesaplandı. Maleik anhidritin konsantrasyon
değerlerinin zamana karşı çizilen grafiklerin eğri denklemlerinden yapılan her bir çalışma için reaksiyon hızı(v) ve hız sabiti(k) hesaplanmıştır.
Harcanan NaOH miktarından açillemeye giren maleik anhidritin mol sayısı miktarı aşağıdaki eşitlik 4.1’den hesaplanmıştır.
∆nMA = (∆VNaOH TNaOH)
MNaOH (4.1)
∆VNaOH : 1 mL numunedeki polistirene modifikasyon reaksiyonu sonucunda maleik anhidritin bağlanmasıyla oluşan karboksil grubu için sarf olunan 0,1 N NaOH’in miktarı
TNaOH : 1 mL NaOH çözeltisinde bulunan NaOH’in gram miktarı MNaOH : NaOH’in mol kütlesi
∆nMA : Açillemeye giren maleik anhidritin mol miktarı
Reaksiyonun ilk hızı, monomerin ve maleik anhidritin konsantrasyonunun zamana göre değişmesi eşitlik 4,2’den hesaplanmıştır.
v0 = − d[MA]dt (4.2)
Reaksiyon ortamında polistiren, maleik anhidrit ve katalizörün konsantrasyonlarının her bir deneme için ikisinin sabit tutulmasıyla reaksiyon, pseudo 1. mertebeden reaksiyon eşitliğine uyarlanmıştır. Bu reaksiyon eşitliği göz önüne alınarak eşitlik 4,3’ten hız sabitleri hesaplanmıştır.
k1 = 1t lna - xa (4.3)
Çözücü miktarının modifikasyona etkisi incelenirken ise katalizör konsantrasyonunu sabit kabul edilerek hız sabitleri pseudo 2. mertebeden reaksiyon denklemine indirgenmiş ve hız sabitleri 2. mertebeden farklı konsantrasyonlara sahip iki reaktantın hız sabiti eşitliğinden bulunmuştur.
k2 = t(a - b) 1 ln b(a - x) a(b - x) (4.4)
Çalışmalar farklı sıcaklıklar içinde tekrarlanarak bu sıcaklıktaki reaksiyon hız sabitleri bulunmuştur. Farklı sıcaklıkta gerçekleştirilen reaksiyonlar için bulunan hız sabitlerinden yararlanarak reaksiyonun aktivasyon enerjisi hesaplanmıştır.
5. DENEYSEL BÖLÜM
5.1 Molekül Ağırlığı Mn =140 000 Mw =230 000 Olan Polistirenin Modifikasyon Reaksiyonunun Kinetik Parametrelerinin İncelenmesi
Yapılan deneylerde maleik anhidrit miktarının reaksiyon hızına etkisini incelemek için sabit katalizör konsantrasyonunda, dört farklı polistiren konsantrasyonu için denemeler yapıldı.
Polistiren konsantrasyonu, [PS]0 =0,2400 molL-1 ve katalizör konsantrasyonu, [BF3O(C2H5)2]0 = 0,0060 molL-1 sabit tutularak, maleik anhidritin 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 konsantrasyonlarında denemeler yapıldı. Maleik anhidritin farklı konsantrasyonları için her bir denemede katyonik katalizör, BF3O(C2H5)2 varlığında polistirene bağlanan maleik anhidrit konsantrasyonun zamanla değişim grafikleri çizilerek reaksiyonların ilk hızları bulundu.
Tablo 5.1: 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 maleik anhidrit konsantrasyonlarında yapılan denemelerde hesaplanan v0 ve k değerleri
[PS]0 molL-1 [BF3O(C2H5)2]0 molL-1 [MA]0 molL-1 k x10–3 dak-1 v0x10–3 molL-1dak−1 0,2400 0,0060 0,06 0,12 0,18 0,24 36,70 25,00 8,90 3,30 2,20 3,00 1,60 0,80
[MA]0=0,06 M [MA]0=0,12 M [MA]0=0,18 M [MA]0=0,24 M 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0 1 2 3 4 5 6 7 8 9 10 t, dakika [M A ]o x1 0 -2 , m ol L -1
Şekil 5.1: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS]0= 0,2400 molL-1, [BF3O(C2H5)2]0= 0,0060 molL-1, t=25oC,
mL 20
VCHCl3 =
Polistiren konsantrasyonu, [PS]0 =0,3600 molL-1 ve katalizör konsantrasyonu, [BF3O(C2H5)2]0 =0,0060 molL-1 sabit tutularak, maleik anhidritin 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 konsantrasyonlarında denemeler yapıldı. Maleik anhidritin farklı konsantrasyonları için her bir denemede katyonik katalizör, BF3O(C2H5)2 varlığında polistirene bağlanan maleik anhidrit konsantrasyonun zamanla değişim grafikleri çizilerek reaksiyonların ilk hızları bulundu.
Tablo 5.2: 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 maleik anhidrit konsantrasyonlarında yapılan denemelerde hesaplanan v0 ve k değerleri
[PS]0 molL-1 [BF3O(C2H5)2]0 molL-1 [MA]0 molL-1 k x10–3 dak-1 v0x10–3 molL-1 dak-1 0,3600 0,0060 0,06 0,12 0,18 0,24 23,33 50,80 13,33 6,67 1,40 6,10 2,40 1,60
[MA]0=0,06 M [MA]0=0,12 M [MA]0=0,18 M [MA]0=0,24 M 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0 1 2 3 4 5 6 7 8 9 10 t, dakika [M A ] o x1 0 -2 , m ol L -1
Şekil 5.2: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS]0= 0,3600 molL-1, [BF3O(C2H5)2]0= 0,0060 molL-1, t=25oC,
mL 20 VCHCl3 =
Polistiren konsantrasyonu, [PS]0 =0,4800 molL-1 ve katalizör konsantrasyonu, [BF3O(C2H5)2]0 =0,0060 molL-1 sabit tutularak, maleik anhidritin 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 konsantrasyonlarında denemeler yapıldı. Maleik anhidritin farklı konsantrasyonları için her bir denemede katyonik katalizör, BF3O(C2H5)2 varlığında polistirene bağlanan maleik anhidrit konsantrasyonun zamanla değişim grafikleri çizilerek reaksiyonların ilk hızları bulundu.
Tablo 5.3: 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 maleik anhidrit konsantrasyonlarında yapılan denemelerde hesaplanan v0 ve k değerleri
[PS]0 molL-1 [BF3O(C2H5)2]0 molL-1 [MA]0 molL-1 k x10–3 dak-1 v0x10–3 molL-1 dak-1 0,4800 0,0060 0,06 0,12 0,18 0,24 21,67 25,00 5,00 2,92 1,30 3,00 0,90 0,70
[MA]0=0,06 M [MA]0=0,12 M [MA]0=0,18 M [MA]0=0,24 M 0,00 0,05 0,10 0,15 0,20 0,25 0 1 2 3 4 5 6 7 8 9 10 t, dakika [M A ] 0 x1 0 -2 m ol L -1
Şekil 5.3: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS]0= 0,4800 molL–1, [BF3O(C2H5)2]0= 0,0060 molL–1, t=25oC,
mL 20 VCHCl3 =
Polistiren konsantrasyonu, [PS]0 =0,6000 molL-1 ve katalizör konsantrasyonu, [BF3O(C2H5)2]0 =0,0060 molL-1 sabit tutularak, maleik anhidritin 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 konsantrasyonlarında denemeler yapıldı. Maleik anhidritin farklı konsantrasyonları için her bir denemede katyonik katalizör, BF3O(C2H5)2 varlığında polistirene bağlanan maleik anhidrit konsantrasyonun zamanla değişim grafikleri çizilerek reaksiyonların ilk hızları bulundu.
Tablo 5.4: 0,06 molL-1; 0,12 molL-1; 0,18 molL-1; 0,24 molL-1 maleik anhidrit konsantrasyonlarında yapılan denemelerde hesaplanan v0 ve k değerleri
[PS]0 molL–1 [BF3O(C2H5)2]0 molL–1 [MA]0 molL–1 k x10–3 dak–1 v0x10–3 molL–1 dak–1 0,6000 0,0060 0,06 0,12 0,18 0,24 23,33 5,83 11,11 3,75 1,40 0,70 2,00 0,90
[MA]0=0,06 M [MA]0=0,12 M [MA]0=0,18 M [MA]0=0,24 M 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0 1 2 3 4 5 6 7 8 9 10 t, dakika [M A ] 0 x1 0 -2 , m ol L -1
Şekil 5.4: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS]0=0,6000 molL–1, [BF3O(C2H5)2]0=0,0060 molL–1, t=25oC,
mL 20 VCHCl3 =
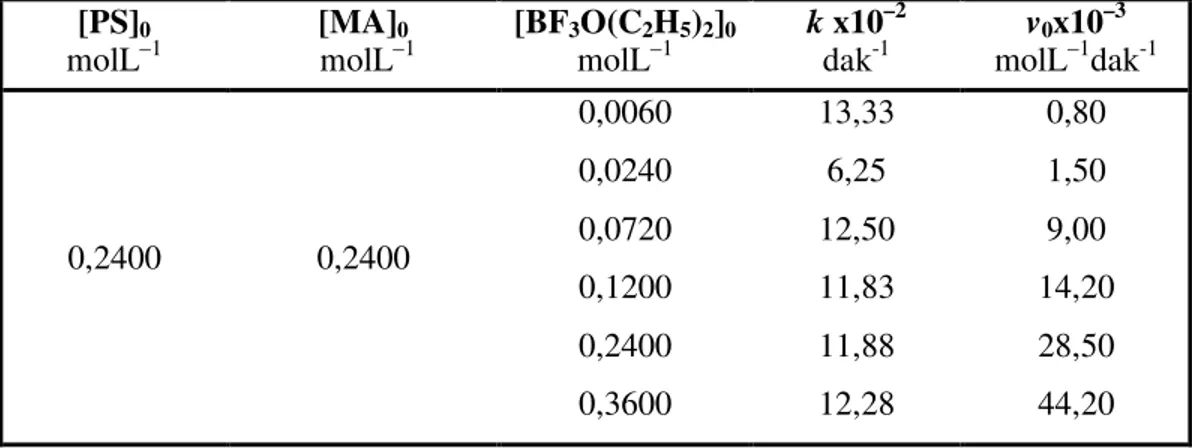
Reaksiyon hızına BF3O(C2H5)2 katalizör konsantrasyonunun etkisini incelemek için [MA]0= 0,2400 molL–1 ve [PS]0= 0,2400 molL–1 sabit tutularak, katalizörün 0,0060 molL–1; 0,024 molL–1; 0,072 molL–1; 0,120 molL–1; 0,240 molL–1 ; 0,360 molL−1
konsantrasyonlarında denemeler yapıldı.
BF3O(C2H5)2 ‘ün farklı konsantrasyonlarında polistirene bağlanan maleik anhidrit konsantrasyonun zamanla değişim grafikleri çizilerek reaksiyonların ilk hızları bulundu.


![Şekil 5.2: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS] 0 = 0,3600 molL -1 , [BF 3 O(C 2 H 5 ) 2 ] 0 = 0,0060 molL -1 , t=25 o C,](https://thumb-eu.123doks.com/thumbv2/9libnet/4791134.92287/40.918.202.773.121.438/şekil-farklı-maleik-anhidrit-konsantrasyonlarının-zamanla-değişim-eğrileri.webp)
![Şekil 5.3: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS] 0 = 0,4800 molL –1 , [BF 3 O(C 2 H 5 ) 2 ] 0 = 0,0060 molL –1 , t=25 o C,](https://thumb-eu.123doks.com/thumbv2/9libnet/4791134.92287/41.918.204.775.123.442/şekil-farklı-maleik-anhidrit-konsantrasyonlarının-zamanla-değişim-eğrileri.webp)
![Şekil 5.4: Farklı maleik anhidrit konsantrasyonlarının zamanla değişim eğrileri, [PS] 0 =0,6000 molL –1 , [BF 3 O(C 2 H 5 ) 2 ] 0 =0,0060 molL –1 , t=25 o C,](https://thumb-eu.123doks.com/thumbv2/9libnet/4791134.92287/42.918.200.774.122.458/şekil-farklı-maleik-anhidrit-konsantrasyonlarının-zamanla-değişim-eğrileri.webp)

![Şekil 5.7: Sabit reaktant konsantrasyonunda farklı sıcaklıklarda modifikasyon reaksiyonuna giren maleik anhidrit konsantrasyonunun zamanla değişim eğrileri, t = 25 o C, [PS] 0 = 0,2400 molL –1 , [MA] 0 = 0,2400 molL –1 , [BF 3 O(C 2 H 5](https://thumb-eu.123doks.com/thumbv2/9libnet/4791134.92287/45.918.197.777.325.791/konsantrasyonunda-sıcaklıklarda-modifikasyon-reaksiyonuna-anhidrit-konsantrasyonunun-değişim-eğrileri.webp)