T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
STİREN-DİVİNİLBENZEN TERPOLIMERİNİN
Pb(II) GİDERİMİNDEKİ ETKİNLİĞİ
Zehra BRAVO
YÜKSEK LİSANS TEZİ
ÇEVRE MÜHENDİSLİĞİ ANABİLİM DALI
T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
STİREN-DİVİNİLBENZEN TERPOLIMERİNİN
Pb(II) GİDERİMİNDEKİ ETKİNLİĞİ
Zehra BRAVO
YÜKSEK LİSANS TEZİ
ÇEVRE MÜHENDİSLİĞİ ANABİLİM DALI
Bu tez 26.01.2006 tarihinde aşağıdaki jüri tarafından oybirliği ile kabul edilmiştir.
Prof. Dr. Handan GÜLCE Yrd. Doç. Dr. Ahmet OKUDAN Yrd. Doç. Dr. Gülnare AHMETLİ (Üye) (Üye) (Danışman)
İÇİNDEKİLER Sayfa No ÖZET ……….. i ABSTRACT ……… ii ÖNSÖZ ………... iii ŞEKİL LİSTESİ ………. iv TABLO LİSTESİ ……… vi İÇİNDEKİLER ... vii 1. GİRİŞ ……… 1 1.1. Çalışmanın Önemi ……….. 1 1.2. Çalışmanın Önemi ……….. 1 2. ADSORPSİYON ……….. 2 2.1. ADSOPRSİYON TÜRLERİ ……….. 3 2.1.1. Fizisorpsiyon ……… 3 2.1.2. Kemisorpsiyon ………. 3 2.1.3. İyonik Adsorpsiyon ………. 4
2.2. Adsorpsiyonu Etkileyen Kuvvetler ……… 4
2.3. Adsorpsiyonun Çevre Amaçlı Kullanımı ………... 5
2.4. Adsorpsiyon İzotermleri ………. 5
2.4.1. Langmuir İzotermi ……….. 6
2.4.2. Freundlich İzotermi ………. 7
3. POLİMERLER ……… 8
3.1. Polimerler Türleri ve Polimerizasyon Reaksiyonları………. 9
3.2. Kopolimerizasyon ……….. 9
3.3. Süspansiyon Polimerizasyonu ……… 10
3.4. Çapraz Bağlanma ……… 10
3.5. Polimer –Metal Kompleksleri ……….... 11
4. KAYNAK ARAŞTIRMASI ……… 15
5. MATERYAL VE METOT ………. 17
5.1. Kullanılan Kimyasal Maddeler ……… 17
5.1.1. Stiren………. 17
5.1.2. Divinil-benzen………... 18
5.1.3. Metakrilik Asit……….. 19
5.1.4. Alil- metakrilat……….. 19
5.2. Deneyde Kullanılan Cihaz ve Aletler ………. 20
5.3. Deneyde Kullanılan Cam Malzemeler………. 20
5.4.Stiren – divinilbenzen Terpolimerlerinin Sentezinin Gerçekleştirildiği Deney Sistemi………. 20
5.5. Stiren-Divinilbenzen Allil Metakrilat Terpolimeri (SDBAM) ve Stiren-Divinilbenzen Metakrilik Asit Terpolimerlerinin (SDBM) Sentezi Yöntemi……… 21
5.6. Pb(II) İyonunun SDBAM ve SDBM ile Adsorpsiyonu ……….. 22
5.6.1. Pb(II) Stok Çözeltisinin Hazırlanması ……… 22
5.6.2. Seyreltme Çözeltisinin Hazırlanması ……….. 22
5.7. Atomik Adsorpsiyon Cihazı Analizleri………... 23
5.8. IR-analizleri ……… 23
6. DENEYSEL SONUÇLAR ... 24
6.1. SDBM ve SDBAM’nin IR-spektrumları……… 24
6.2. Pb(II) Giderimine Zamanın Etkisi ………. 24
6.2.1. Nötral Ortam ………. 25
6.2.2. Asidik Ortam ……… 27
6.3. Pb(II) İyonu Gideriminin İzoterm Eğrileri ve İzotermleri ……….. 29
6.3.1. Nötral Ortam ………. 29
6.3.2. Asidik Ortam ……… 35
7. SONUÇLAR ... 41
KAYNAKLAR ………. 44
ÖNSÖZ
Bu çalışmada bana yardımcı olan, çalışmanın her aşamasına desteğini esirgemeyen, bilgi ve deneyimlerinden faydalandığım Sayın Yrd. Doç. Dr. Gülnare Ahmetli’ye teşekkür ederim.
Çalışmam boyunca her türlü bilgi ve deneyimlerinden faydalandığım Sayın Yrd. Doç. Dr. Esra Tarlan’a teşekkür ederim.
Çalışmanın laboratuar aşamasında destek ve yardımlarından dolayı Sayın Arş. Grv. Zehra Yılmaz’a teşekkür ederim.
Ve çalışmam sırasında gösterdikleri sabırdan, her türlü maddi ve manevi destekten dolayı eşime, oğluma ve aileme sonsuz teşekkürler…
Zehra BRAVO
ÖZET Yüksek Lisans Tezi
STİREN-DİVİNİLBENZEN TERPOLİMERLERİNİN Pb(II) GİDERİMİNDEKİ ETKİNLİĞİ
Zehra BRAVO Selçuk Üniversitesi Fen Bilimleri Enstitüsü Çevre Mühendisliği Anabilim Dalı
2006, 49 Sayfa
Bu çalışma üç farklı adsorbentin; SDBAM terpolimerinin, SDBM terpolimerinin ve aktif karbonun, Pb(II) metal iyonunun adsorpsiyonu sonuçlarını içermektedir. Pb(II) iyonunun adsorpsiyon karakteristiğinin değişimleri; pH’a, zamana ve konsantrasyona bağlı olarak araştırıldı. Adsorpsiyon numuneleri her 30-60-120-180 ve 240 dakikada alınarak ölçüm yapıldı. Aynı işlemler hem asidik, hem de nötr ortam için ayrı ayrı tekrarlandı. Sonuçların elde edilişinde atomik absorpsiyon cihazı kullanıldı. Sonuçlar Langmuir ve Freundlich izotermleri çıkarılarak incelendi.
İncelenen üç adsorbanın adsorpsiyon kapasitelerine göre yüksekten düşüğe sıralanışı; SDBM, SDBAM ve aktif karbon olmuştur.
Anahtar Kelimeler: SDBAM terpolimeri, SDBM terpolimeri, aktif karbon,
ABSTRACT M. Sc Thesis
THE EFFECTİVETY OF STIREN-DIVINILBENZEN TERPOLYMER IN THE ADSORPTION OF Pb(II)
Zehra BRAVO Selcuk University
Graduate School of Natural and Applied Sciences Department of Environmental Engineering
2006, 49 Page
This study shows the results of adsorption of Pb metal ions onto three different materials; terpolimer SDBAM, terpolimer SDBM and activated carbon. The changes of adsorption behaviours of Pb ions according to the Ph, time and concentration were investigated. The samples of adsorpsion were taken at 30.-60.-120.-180. and 240. minutes. Same experiments repeated under both acidic and neutral conditions. To get the results, Atomic Absorption equipment was used. The results are investigated by Langmuir and Freundlich İzoterms.
According to the adsorpsion capacities three adsorbans are ordered from higher to lower as SDBM, SDBAM and activated carbon.
ŞEKİL LİSTESİ Sayfa No
Şekil 2.1. Langmuir Adsorpsiyon İzoterminin Lineerize Şekli……… 6
Şekil 2.2. Freundlich Adsorpsiyon İzoterminin Lineerize Şekli………... 7
Şekil 3.1. Amberlite XAD-2 ve Amberlite XAD-4’ün Kimyasal Yapısı……… 13
Şekil 3.2. Amberlite XAD-7nin Akrilik Ester Oluşumu………. 13
Şekil 3.3. Amberlite XAD-8’in Akrilik Ester Oluşumu………... 14
Şekil 5.1. Stiren – divinilbenzen Terpolimerlerinin Sentezinin Gerçekleştirildiği Deney Sistemi………. 20
Şekil 6.1. Nötr Ortamda SDBM İle Pb(II) İyonu Giderimine Zamanın Etkisi……… 25
Şekil 6.2. Nötr Ortamda SDBAM İle Pb(II) İyonu Giderimine Zamanın Etkisi……. 26
Şekil 6.3. Nötr Ortamda Aktif Karbon İle Pb(II) İyonu Giderimine Zamanın Etkisi... 26
Şekil 6.4. Asidik Ortamda SDBM İle Pb(II) İyonu Giderimine Zamanın Etkisi……. 27
Şekil 6.5. Asidik Ortamda SDBAM İle Pb(II) İyonu Giderimine Zamanın Etkisi…... 28
Şekil 6.6. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimine Zamanın Etkisi……….. 28
Şekil 6.7. Nötr Ortamda SDBM ile Pb(II) İyonu Gideriminin İzoterm Eğrisi………. 29
Şekil 6.8. Nötr Ortamda SDBM ile Pb(II) Giderimi için Langmuir İzotermi………. 29
Şekil 6.9. Nötr Ortamda SDBM ile Pb(II) Giderimi için Freundlich İzotermi………. 30
Şekil 6.10. Nötr Ortamda SDBAM ile Pb(II) İyonu Gideriminin İzoterm Eğrisi…… 31
Şekil 6.11. Nötr Ortamda SDBAM ile Pb(II) Giderimi için Langmuir İzotermi……. 31
Şekil 6.12. Nötr Ortamda SDBAM ile Pb(II) Giderimi için Freundlich İzotermi…… 32
Şekil 6.13. Nötr Ortamda Aktif Karbon ile Pb(II) İyonu Gideriminin İzoterm Eğrisi………. 33
Şekil 6.14. Nötr ortamda Aktif Karbon ile Pb(II) giderimi için Langmuir İzotermi… 33 Şekil 6.15. Nötr ortamda Aktif Karbon ile Pb(II) giderimi için Freundlich İzotermi.. 34
Şekil 6.16. Asidik Ortamda SDBM ile Pb(II) İyonu Gideriminin İzoterm Eğrisi…… 35
Şekil 6.17. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için Langmuir İzotermi……….. 35
Şekil 6.18. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için Freundlich İzotermi………. 36
Şekil 6.19. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için İzoterm Eğrisi... 37
Şekil 6.20. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için Langmuir İzotermi……….. 37
Şekil 6.21. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için Freundlich
İzotermi………... 38 Şekil 6.22. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi İzoterm Eğrisi.. 39 Şekil 6.23. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için Langmuir İzotermi………. 39 Şekil 6.24. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için Freundlich İzotermi………. 40
TABLO LİSTESİ Sayfa No Tablo 2.1. Değişik Ara Yüzeylerde Meydana Gelen Adsorpsiyon Türleri…………. 2 Tablo 5.1. Stirenin Fiziksel Özellikleri (Kimya Ansiklopedisi, 1961)……… 17 Tablo 5.2. Divinilbenzenin Fiziksel Özellikleri( Kimya Ansiklopedisi, 1961)…….. 18 Tablo 5.3. Metakrilik Asitin Fiziksel Özellikleri ( Kimya Ansiklopedisi, 1961)…… 19 Tablo 6.1. Nötr Ortamda SDBM ile Pb(II) İyonu Yüzde Giderim Değerleri………... 25 Tablo 6.2. Nötr Ortamda SDBAM ile Pb(II) İyonu Yüzde Giderim Değerleri……… 26 Tablo 6.3. Nötr Ortamda AK ile Pb(II) İyonu Yüzde Giderim Değerleri……… 27 Tablo 6.4. Asidik Ortamda SDBM ile Pb(II) İyonu Yüzde Giderim Değerleri……... 27 Tablo 6.5. Asidik Ortamda SDBAM ile Pb(II) İyonu Yüzde Giderim Değerleri…… 28 Tablo 6.6. Asidik Ortamda AK ile Pb(II) İyonu Yüzde Giderim Değerleri…………. 29 Tablo 6.7. Nötr ortamda SDBM ile Pb(II) giderimi Langmuir İzotermi Sabitleri….. 30 Tablo 6.8. Nötr ortamda SDBM ile Pb(II) giderimi için Freundlich İzotermi
Sabitleri………. 30 Tablo 6.9. Nötr ortamda SDBAM ile Pb(II) giderimi için Langmuir
İzotermi Sabitleri………. 32
Tablo 6.10. Nötr ortamda SDBAM ile Pb(II) giderimi için Freundlich İzotermi Sabitleri………... 32
Tablo 6.11. Nötr ortamda Aktif Karbon ile Pb(II) giderimi için Langmuir
İzotermi Sabitleri……….. 34
Tablo 6.12. Nötr ortamda Aktif Karbon ile Pb(II) giderimi için Freundlich
İzotermi Sabitleri………. 34
Tablo 6.13. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için
Langmuir İzotermi Sabitleri………... 36
Tablo 6.14. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için
Freundlich İzotermi Sabitleri………. 36
Tablo 6.15. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için
Langmuir İzotermi Sabitleri………... 38
Tablo 6.16. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için
Freundlich İzotermi Sabitleri………. 38
Tablo 6. 17. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi
için Langmuir İzotermi Sabitleri……… 40
Tablo 6.18 . Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için
Freundlich İzotermi Sabitleri………. 40
GİRİŞ
1.1. Çalışmanın Amacı
Bu çalışmanın amacı, stiren-divinilbenzen terpolimerlerinin sentezlenmesi ve bu terpolimerlerin aktif karbon da dahil olmakla atık sularda bulunabilecek ağır metallerden olan Pb(II) giderimindeki etkinliğinin incelenmesidir.
1.2. Çalışmanın Önemi
Bazı doğal polimerlerin, bilinen bazı monomerler kullanılarak belli koşullarda polimerleşme tepkimesine sokularak suda çözünmeyen çapraz bağlı bazı yeni ürünler elde edildiği ve bu sistemlerin, özellikle sularda yer alan ağır metallerin uzaklaştırılmasında kullanıldığı bilinmektedir. Bu tür sistemlere çapraz bağlı nişastanın çeşitli katyonik polimerler ile oluşturduğu ürünler örnek olarak verilebilir.
Bu çalışmada özellikle çevre mühendisliğinde kullanılan adsorpsiyon yöntemi ile sudan ağır metallerin uzaklaştırılmasında polimerik yapılı stiren-divinilbenzen-metakrilik asit ve stiren-divinilbenzen-allilmetakrilattan adsorbent olarak faydalanılmıştır.
2. ADSORPSİYON
Adsorpsiyon, bir maddenin yüzeye tutulması olayıdır. Bir başka ifadeyle adsorpsiyon; karışmayan iki faz etkileştirildiğinde ara yüzeyde türlerden birisinin bir fazdaki derişimi artarken diğer fazdaki derişiminin azalması olarak tanımlanmaktadır. Adsorpsiyon olayında yüzeye tutturulan maddeye “adsorplanan”, tutan yüzeye ise “adsorplayıcı” adı verilir.
Adsorpsiyon prosesleri geniş bir öneme sahiptir. Katı yüzeyine adsorpsiyon, heterojen katalizörlerle değişik saflaştırma yöntemlerinde önem kazanmaktadır. Değişik ara yüzeylerde olan adsorpsiyonlar Tablo 2.1’de görülmektedir (Aydın, 1983).
Tablo 2.1. Değişik Ara Yüzeylerde Meydana Gelen Adsorpsiyon Türleri
(Aydın, 1983).
Arayüzey Arayüzeyde Oluşan Önemli Olaylar
Katı-gaz Gaz adsorpsiyonu, sürtünme, süblimleşme, katılarda çekme dayanıklılığı, toz, duman, katıların katı ve gaz vermek üzere parçalanması, katılarla gazların kimyasal reaksiyonu, kataliz
Katı-sıvı Çözünmüşlerin adsorpsiyonu, elektrot işlemleri, katıların sıvılarda çözünme hızları, lehimleme, ısıtılabilirlik, suya karşı koruma, minerallerin yüzdürülmesi, kataliz, katı soller
Katı-katı Adhezyon ve kohezyon, sürtünme, alaşımların direnci, katılar arasındaki reaksiyonlar
Sıvı-gaz Buharlaşma, damıtma, yüzey gerilimi, köpük, sis Sıvı-sıvı Emülsiyonlar
2.1. ADSOPRSİYON TÜRLERİ
Yüzeyde tutunma fiziksel kuvvetler sayesinde gerçekleşiyorsa, buna ‘fiziksel adsorpsiyon’(fizisorpsiyon veya Van der Waals adsorpsiyonu) denir. Adsorplanan ve adsorplayıcı arasında oldukça yüksek enerjili kimyasal bağ oluşumu ile tutunma gerçekleşiyor ise, o zaman tutunma ‘kimyasal adsorpsiyon’ (kemisorpsiyon) adını alır (Özer ve ark., 1997). Elektrostatik çekim kuvvetlerinin etkisi ile iyon yüzeydeki yüklü bölgelere tutunursa, bu tür bağlanma iyonik adsorpsiyondur (Bağ ve ark., 1997).
2.1.1. Fizisorpsiyon
Yüzey ile tutunan madde arasındaki dispersiyon ve polar etkileşimlerinin bir sonucu olarak ortaya çıkan fizisorpsiyonda adsorpsiyon enerjisi en çok –20 kJ/mol’dür. Fizisorpsiyonda tutunma zayıf kuvvetlerle olduğu için ortaya çıkan enerji miktarı düşüktür. Bu enerji, tutunan madde yapısındaki bağları kırmaya yeterli değildir. Bu nedenle fiziksel adsorpsiyonda yüzeye tutunan türlerin özellikleri tamamen korunmaktadır (Özer, ve ark., 1997).
2.1.2. Kemisorpsiyon
Kemisorpsiyonda daima adsorplayıcı ile yüzey arasında bir yük aktarımı söz konusudur. Bu nedenle kemisorpsiyon monomolekülerdir. Fizisorpsiyona oranla kemisorpsiyon enerjisi çok yüksek olup –200 kJ/mol mertebesinde olabilir. Fizisorpsiyonla kemisorpsiyon karşılaştırıldığında;
1- Fizisorpsiyon, aktiflenmemiş olduğundan dolayı bütün sıcaklıklarda hatta çok düşük sıcaklıklarda bile hızlıdır. Düşük sıcaklıklarda aktiflenmemiş kemisorpsiyon gözlenirken, yüksek sıcaklıklarda aktiflenmiş kemisorpsiyon gözlenir.
2- Kemisorpsiyonda kimyasal reaksiyon bir aktifleşme enerjisi ile olmaktadır. Fiziksel adsorpsiyonda ise aktivasyon enerjisine gerek yoktur.
3- Fiziksel adsorpsiyonda bağlanma zayıf etkileşimlerle olduğundan basınç veya sıcaklık şartı bozulduğunda hemen desorpsiyon olmaktadır. Kimyasal adsorpsiyonda ise olay tersinmezdir.
4- Yüzeyde elektron transferi yapabilen merkezler kalmadığında kemisorpsiyon sona ermektedir. Fiziksel adsorpsiyonda ise böyle bir engel yoktur. Uygun sıcaklık ve basınç şartı sağlandığında daha çoklu tabakalar halinde de tutunmanın olduğu görülmektedir (Özer ve ark., 1997).
2.1.3. İyonik Adsorpsiyon
İyonik adsorpsiyonda adsorplayıcı ile adsorblananın iyonik güçleri önemlidir. İyonlar eş yüklü ise daha küçük olan tercihli olarak yüzeye tutulur.
Çoğu adsorpsiyon olayında her üç adsorpsiyon türü birlikte veya ard arda görülür. Biyosorpsiyon olarak tanımlanan biyolojik adsorpsiyon da böyle bir adsorpsiyon olayıdır (Bağ ve ark., 1997).
Metal iyonlarının sulu çözeltiden biyokütle tarafından uzaklaştırılmasına “biyosorpsiyon” denir (Bağ ve ark., 1997). Biyosorpsiyon kinetiği iki basamakta incelenir. Birinci basamak mikroorganizma ile metal arasında çok kısa sürede dengenin kurulduğu fiziksel adsorpsiyon (pasif adsorpsiyon) veya iyon değişimidir. İkinci basamak ise, metabolik aktiviteye bağlı olarak oluşan kimyasal adsorpsiyondur (Özer ve ark., 1997). Metal iyonlarının biyosorpsiyonu adsorpsiyon, kompleks oluşturma, iyon değiştirme şeklinde gerçekleşmektedir.
Bazı mikroorganizmaların sulu çözeltiden metal iyonlarını adsorplama yeteneğine sahip olduğu bulunmuştur. Suda yaşayan alg, bakteri ve maya türü gibi pek çok mikroorganizmanın ağır metalleri seçimli olarak biriktirdiği gözlemlenmiştir (Özer, 1994; Aksu ve ark., 1995).
2.2. Adsorpsiyonu Etkileyen Kuvvetler
Adsorpsiyonda, adsorplanan ve yüzey arasında bir denge söz konusudur. Bu dengeyi basınç, sıcaklık, yüzey yapısı ve ayrıca bağlanmanın türü etkilemektedir.
Adsorplanan gazın basıncı arttığında adsorpsiyon miktarı artar. Çözeltilerle çalışılıyorsa, çözelti derişimi artığında da adsorpsiyon artar.
Kemisorpsiyonda katı yüzeyinde bir bağ oluşumu vardır. Bu bağ, adsorplanan ile adsorplayıcı arasında ortaklaşa elektron kullanılmasıyla olacağı gibi, elektron değişimi ile de olmaktadır.
Adsorpsiyonda bağlanmanın türü kadar, yüzeyin kimyasal yapısı ve alanı da önemlidir. Adsorplayıcı ne kadar ince toz haline getirilip yüzey alanı büyütülürse, yani gözenek hacmi artırılırsa, adsorplanan miktarı artar (Özer ve ark, 1997).
2.3. Adsorpsiyonun Çevre Amaçlı Kullanımı
Hızlı kentleşmenin olumsuz bir sonucu olan su kirliliği, suyun doğal çevrimine dışardan yapılan etkiler sonucu ortaya çıkmaktadır. Su kirliliği, su kaynaklarının, suyun kalitesini düşürerek kullanımını bozacak düzeyde organik, inorganik, biyolojik ve radyoaktif kirleticiler içermesi olarak tanımlanmaktadır. Çevre bakımından kirliliğe neden olan en önemli etmenler; radyoaktivite, ağır metal iyonları ve toksik organik bileşiklerdir. Radyoaktif kirlilik, atmosferdeki radyoaktif maddelerin yağışlarla yeryüzüne inerek yüzey sularına karışması veya nükleer deney veya kaza sızıntıları sonucu ortaya çıkan bir kirliliktir. Organik ve ağır metal kirliliği ise, endüstride soğutma ve yoğunlaşma suları, kimya endüstrisi atık suları, petrol endüstrisi atık suları, selüloz ve kağıt endüstrisi atık suları, tekstil endüstrisi atık suları ve tarımsal işletme atık suları ile ortaya çıkmaktadır (Altuğ, 1990; Yavuz, 1994).
Görüldüğü gibi çevreyi oluşturan üç önemli unsur hava, toprak ve su üzerindeki kirlilikler birbirini etkilemektedir. Dolayısı ile bu unsurların biri üzerinde yapılacak çalışma, kirliliği önlemede dolaylı olarak diğerlerine de yansıyacaktır.
2.4. Adsorpsiyon İzotermleri
Adsorpsiyon dengesi, “adsorpsiyon izotermi’’ olarak bilinen bağıntılarla ifade edilebilir. Çözeltide kalan derişim c ile, adsorplayıcının birim ağırlığı başına tuttuğu madde miktarı q arasındaki ilişkiler adsorpsiyon izotermi olarak tanımlanır. Adsorpsiyon izotermlerinin matematik açıdan uygun formüllerle ifadesi için başlıca üç yaklaşım geliştirilmiştir: Langmuir izotermi, Freundlich izotermi ve BET izotermi (Şengül, 1997.).
2.4.1. Langmuir İzotermi
Yüzey kimyası alanındaki çalışmalarından dolayı 1932 yılında Nobel ödülü alan Amerikalı bilim adamı Irving Langmuir (1881-1957) tarafından 1916 yılında kimyasal adsorpsiyon için çok basit bir izoterm denklemi türetilmiştir. Tek tabakalı fiziksel adsorpsiyon ve çözeltiden adsorpsiyon içinde geçerli olan bu eşitliğe Langmuir denklemi denir. Adsorpsiyon ve desorpsiyon hızları birbirine eşitlenerek Langmuir denklemine kolaylıkla geçilebilmektedir. Langmuir, teorik düşüncelerinden hareket ederek ve
• Adsorpsiyon tek moleküllüdür,
• Adsorpsiyon dengesi bir dinamik dengedir, adsorpsiyon hızı madde konsantrasyonu ve adsorbanın örtülmemiş yüzeyi ile orantılıdır.
kabullerine dayanarak adsorpsiyon için kendi adı ile bilinen bağıntıyı önermiştir (Berkem,1984).
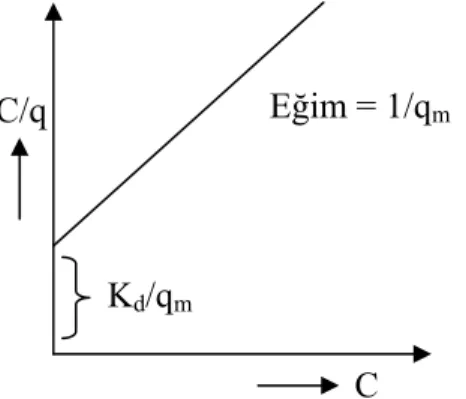
C/q= Kd/qm + C/qm
C: denge konsantrasyonunu
q: 1 g adsorban madde tarafından tutulan madde miktarını (mmolM+n/gİyon değiştirici) qm: maksimum kapasiteyi (mmolM+n/gİyon değiştirici)
Kd: ayrışma sabitini göstermektedir.
C/q ile C arasında grafik çizilirse Şekil 2.1’de görülen doğru elde edilir. Bu doğrunun ekseni kestiği noktadan Kd/qm, doğrunun eğiminden de 1/qm değerleri
bulunarak Kd ve qm değerleri hesaplanır.
C/q Eğim = 1/qm
Kd/qm
C
2.4.2. Freundlich İzotermi
Freundlich izotermi aşağıdaki formül ile ifade edilir (Şengül, 1997.):
qe=X/M=kf.C1/n
Burada;
qe : birim adsorban madde başına düşen adsorplanmış madde miktarı (mg/g)
M: adsorban maddenin ağırlığı (g) X: adsorplanan madde miktarı (mg) kf: Freundlich sabiti
n: sabit (n›1)
C: adsorblanan maddenin çözeltideki kalıntı derişimi (mg/L) Freundlich izoterminin lineerize edilmesi ile
logX/M= logkf + 1/n logC
elde edilir.
log X/M
1/n log kf
log C
3. POLİMERLER
Polimerler; çok sayıda aynı yada farklı grupların kimyasal bağlarla, az veya çok düzenli bir biçimde bağlanarak oluşturduğu uzun zincirli, başka bir ifadeyle yüksek molekül kütleli bileşiklerdir.
Polimerler doğal yada sentetik olabilir. Doğal polimerlerin modifikasyonu ile elde edilen polimerlere yarı sentetik polimerler denir (Kurimura, and Kaneko, 1990).
Sentetik polimerler genellikle çok sayıda tekrarlanan, “mer” veya “monomer” denilen basit birimlerden oluşur. Monomer birimlerinden başlayarak polimer moleküllerinin elde edilmesine yol açan reaksiyonlara “polimerizasyon reaksiyonları’’ denir. Ancak gerek laboratuarda gerekse pratik uygulamalar için hazırlanan polimerlerin çoğu genellikle, 5,000-250,000 molekül ağırlığı bölgesinde bulunur ( Yiğit, 1986).
Molekül kütlesi 500-600 civarında olan polimerlere “oligomer” denir. Bir polimerin yeterli fiziksel özelliğe sahip olabilmesi için molekül kütlesinin 104’ün üzerinde olması gerekir.
Doğal polimerlerin bazıları farklı yapıda değişik birimlerin bir araya gelmesiyle oluşmuştur. Biyopolimerler olarak adlandırılan ve yaşamla ilgili birçok önemli faaliyetin yürütülmesinde rol alan proteinler, nükleik asitler (DNA, RNA) ve enzimler bu tür doğal polimerlere örnektir. Bu karmaşık yapıdaki yüksek molekül kütleli bileşikler çoğu zaman, daha uygun bir sözcük olan “makromoleküller” olarak adlandırılmaktadır.
Organik polimerler, diğer organik maddelerin aldıkları adlara göre alt gruplarda sınıflandırılabilirler. Örneğin, alifatik ve aromatik olabilirler. Genellikle, aşağıda örneklendiği gibi tekrarlanan grubun kimyasal adının önüne “poli” sözcüğü konularak, ilgili polimerin adı türetilir.
Polimerleri oluşturan monomerlerin aynı türden olması ile homopolimerler oluşurken, birden daha fazla farklı monomerin oluşturduğu polimerler “kopolimer” olarak adlandırılmaktadır.
Kopolimerler yada homopolimerler oluşturulurken, doğrusal yada dallanmış zincirler yanında, seçilen tekniğe uygun olarak çapraz bağlı kopolimerik yada homopolimerik yapılar elde edilebilmektedir. Çapraz bağlı polimerler, üç boyutlu
olarak, ağ yapıda bulundukları ve güçlü kovalent bağlarla birbirine bağlandıkları için hiçbir çözücüde çözünmezler.
Uygun seçilmiş çözücüler içinde bir süre bekletilen çapraz bağlı polimerler şişmeye başlarlar. Bu durumda, şişmiş halde bulunan çapraz bağlı polimerlere jel adı verilmektedir. Genel anlamda, bünyesine çözücü alarak şişme yeteneğine sahip çapraz bağlı kopolimerler veya homopolimerlere ’’kserojel’’ denmektedir. İçerisine kütlesinin %20’sinden daha fazla su alabilen çapraz bağlı polimerik yapılara ise“hidrojel” adı verilmektedir (Karadağ ve ark., 1995).
3.1. Polimer Türleri ve Polimerizasyon Reaksiyonları
Sentetik polimerik maddeler ilk önce Carothers’in yaptığı bir sınıflamaya göre kondensasyon polimerleri ve katılma polimerleri adı verilen iki bölüme ayrılırlar.
Kondensasyon polimerleri; kondensasyon polimerizasyonu ile elde edilen polimerik maddelerdir.
Katılma polimerleri; zincir reaksiyonları ile monomerlerin doğrudan doğruya polimer moleküllerine girmeleri ile oluşur. Zincir taşıyıcı, bir iyon (anyon ve katyon) olabildiği gibi, çiftleşmemiş bir elektronu bulunan ve serbest radikal denilen etkin bir madde de olabilir. Serbest radikaller, genel olarak katalizör yada başlatıcı denilen ve bazı koşullarda kararsız maddelerin parçalanması ile oluşur (Kurbanova ve ark., 1997).
3.2. Kopolimerizasyon
İki yada daha çok monomer birimlerinin bir yüksek polimer içinde bağlanması olayına “kopolimerizasyon”, böyle bir reaksiyon ile elde edilen ürüne ise “kopolimer” denir. Çeşitli kopolimer moleküllerinde ve hatta bir tek kopolimer molekülünün değişik kısımlarında farklı monomer birimlerinin sayılarının birbirlerine göre hep aynı oranda olması zorunlu değildir.
Kopolimerizasyon işleminin uygulamada getirdiği çeşitlemeleri görmek için polistirenin incelenmesi klasik bir örnek olarak bilinmektedir. Polistiren kolay kırılan, darbe direnci düşük, çözücülere dayanıksız bir plastik olup oldukça sınırlı yerlerde kullanılabilir. Stirenin kopolimerizasyonu ile elde edilen polimerik ürünler ise
polistirenin kullanılma alanlarını genişletmekte ve bu polimerin bildiğimiz en faydalı maddelerden biri olmasını sağlamaktadır. Stirenin kopolimerleri (ve termopolimerleri) sadece plastik olarak değil, elastomer olarakta kullanılır. Stirenin akrilonitril ile kopolimerizasyonu ile darbe direnci yüksek, çözücülere dayanıklı polimerler elde edilir. Butadien ile verdiği kopolimerler ise elastometrik özelliklere yol açar. Stirenin akrilonitril ve bütadien ile verdiği termopolimerler ise her üç özellik aynı anda geliştirilebilir. Etilen-propilen kopolimerlerinde, ikinci bileşenin miktarını değiştirmekle plastik özelliklerine geçen polimerlerin yapılması sağlanmıştır (Huglin ve ark., 1986).
3.3. Süspansiyon Polimerizasyonu
Polar olmayan birçok monomerin polimerizasyonunda, sulu bir dispersiyonda yapılan polimerizasyon, blok ve çözelti polimerizasyonlarının önemli sakıncalarını önler. Monomer, sulu fazda 0,01-0,5 cm çapında damlacıklar halinde dağıtılır (süspansiyon). Stabilizör katılır ve mekanik karıştırma ile damlaların birleşmesi önlenir. Stabilizör olarak, jelatin, metil selüloz, poli(vinil alkol) gibi suda çözünür organik polimerler, elektrolitler yada kaolin, magnezyum silikatlar, alüminyum hidroksit gibi suda çözünmeyen inorganik bileşikler kullanılır.
Süspansiyon polimerizasyonda, polimerizasyonu başlatıcı madde monomer damlalarında çözünür. Her monomer damlası küçük bir blok polimerizasyon sistemini andırır. Bu damlalarda blok polimerizasyon kinetiği geçerlidir. Isı denetimi oldukça kolaydır. Ancak elde edilen polimerik ürünün, yıkanıp kurutulması ve katkı maddelerinden arıtılması gerekir (Carenza, ve ark., 1993).
3.4. Çapraz Bağlanma
Homopolimerik veya kopolimerik zincirler doğrusal, dallanmış yada az sayıda çapraz bağlanmış ve yüksek oranda çapraz bağlı durumda bulunabilirler. Doğrusal ve dallanmış polimerler zincir yapılarına bağlı olarak polar ve apolar çözücülerde çözünürler. Dallanmış polimerlerde her dallanma tek bir zincire aittir. Oysa çapraz bağlı polimerlerde zincirler birbirlerine güçlü kovalent bağlarla bağlanmıştır. Doğrusal halde çözünür olan bir polimer, çapraz bağlı halde çözünmez.
Çapraz bağlı ve ağ yapısına sahip polimerler monomerlerinden saf olarak veya çapraz bağlayıcı maddelerle birlikte, kimyasal veya iyonlaştırıcı radyasyon kullanılarak; kütle, çözelti, süspansiyon, emülsiyon, gaz fazı ve plazma polimerizasyonu sonunda elde edilebilirler. Çapraz bağlı polimerlerin termal olarak başlatılan serbest radikal polimerizasyonu ile elde edildikleri bilinmektedir. Yine çapraz bağlayıcı maddeler ile çapraz bağ oluşumunun hızlandırıldığı ve artırıldığı da bilinmektedir.
Çapraz bağlı polimerik madde yada ürün uygun bir çözücüde bir süre bekletildiğinde şişme özelliği gösterir.Çapraz bağlı polimerlerin tanınması için çapraz bağlı zincirin uzunluğu, dallanma noktası, çapraz bağlar arası sayıca ortalama molekül kütlesi, çapraz bağ yoğunluğu ve etkin çapraz bağların molar derişimi gibi önemli özelliklerinin bilinmesi gerekir(Akkaş, 1997).
3.5. Polimer –Metal Kompleksleri
Polimer- metal kompleksleri, polimerik ligandların metal iyonları ile meydana getirdiği komplekslerdir. Çözelti ortamında çalışıldığında, polimer ana iskeletinin fizikokimyasal özelliklerine bağlı olarak polimer metal komplekslerinde mikroheterojen bölgelerin oluşumu, ortamda çözücü olmadan oluşan komplekslerdeki mikroheterojen bölgelerden farklı olmaktadır. Polimer – metal komplekslerinin en önemli reaksiyonları, bu mikroheterojen bölgelerin karakteristik yapısına göre gerçekleşmektedir Tip 1, 2, 3 kompleksleri aşağıdaki gibi açıklanmaktadır.
Tip 1 Polimer ligand ile metal iyonlarının komplekleşmesi ile oluşan
kompleksler,
(1-1) Tek dişli veya çok dişli ligand asılı grubu içeren kompleksler. (1-2) Molekül içi ve moleküller arası köprü kompleksleri.
Tip 2 İki fonksiyonlu polimer ligandın metal iyonu ile kompleksleşmesi ile
oluşan yeni polimerler,
(2-1) Düz zincir içeren polimer ligandlar (iki fonksiyonlu ligand tarafından veya basit bileşik veya iyon tarafından bağlanma).
(2-2) Ağ yapıya sahip polimer ligandlar.
Tip 1 ve Tip 2 kompleksleri genellikle çözeltilerden, polimerik veya monomerik ligandın metal iyonları ile karıştırılması ile hazırlanır. Tip 3 kompleksleri, vinil grubu veya üçlü bağ içeren monomerik komplekslerin polimerizasyonu ile hazırlanır (Kurinura ve Kaneko, 1996).
Bilim adamları, çevre kirliliği oluşturan metal iyonlarının çeşitli ortamlardan uzaklaştırılmasında, metal iyonları karışımlarının ayrılmasında ve ayrıca polimere tutunmuş metal iyonlarını katalizör olarak kullanmada bile polimerlerin, metal iyonları ile seçici olarak kompleks yapabilme özelliğinden yararlanmaktadırlar. İçme suyundan ve endüstriyel atıklardan, metal iyonları başta olmak üzere çeşitli kirleticilerin ve hatta organik maddelerin uzaklaştırılmasında, üzerinde metal iyonları ile kompleks yapabilecek ligand bulunan polimerlerin uygulanabilmesi, diğer yöntemlere göre bazı avantajlar sağlamaktadır (Şahiner, 1997).
3.6. Polimerik Adsorbentler
Son 20 yıldır adsorpsiyonda pratik olarak iyonik organikleri adsorplamada iyon değiştirici reçineler yaygın olarak kullanılmaktadır. Daha sonraları daha büyük kapasitelerde adsorpsiyon gerçekleştirebilmek için büyük ağsı yapıda reçineler geliştirilmiştir. Gözenekli büyük ağsı iyon değiştirici reçinelerin hazırlanması çalışmalarıyla sentetik polimerik adsorbentler oluşturuldu (Kunin ve ark., 1962).
Şekil 3.1, 3.2, 3.3 makroağsı polimerlerin 3 tipinin kimyasal yapısını göstermektedir. Sıvı çözeltideki iyonik olmayan organik bileşiklerin giderimi için polar olmayan ve orta polaritedeki adsorbentler tercih edilmektedir.
Şekil 3.1. Amberlite XAD-2 ve Amberlite XAD-4’ün Kimyasal Yapısı (Hackman, 1978). CH3 CH2 C CH2 CH3 C O C O R O O C C CH3 CH2 O C O R O O C C CH3 CH2
CH3 CH2 C CH2 CH3 C O C O R O O C C CH3 CH2 O C O R CH3 C C CH2 CH3 CH2 C O ORı CH3 C C CH2 O ORı C O R O
Şekil 3.3. Amberlite XAD-8’in Akrilik Ester Oluşumu (Hackman, 1978.)
Polar olmayan adsorbentlerden Amberlite XAD-2 ve Amberlite XAD-4’ün kimyasal yapısı Şekil 3.1’de sırasıyla gösterilmektedir. Şekil 3.2 ve 3.3’te ise orta polaritede olan Amberlite XAD-7 ve Amberlite XAD-8’in akrilik ester oluşumları gösterilmektedir.
4. KAYNAK ARAŞTIRMASI
Pb(II) iyonunun adsorpsiyonla giderimi üzerine yapılan çalışmaların özeti aşağıda verilmiştir:
Dhakal, R.P. ve Ghimire, K.N. yaptıkları çalışmada; alginik asit ve onların türevlerinde Pb(II), Zn(II) ve Cu(II)’nin adsorpsiyon davranışını incelemişlerdir. Metal iyonları için seçicilikler Pb(II)>Cu(II)>Zn(II) şeklinde ifade edilmiştir. Pb(II) giderimi asidik polisakkaritlerle ve ticari olarak elde edilebilen katyon değiştirici DIAION WK ile incelenmiştir. Deneysel sonuçlar kimyasal modifiyeli asidik polisakkaritlerin karşılaştırılmalı ayrılma işleminden daha iyi nitelikli olduğunu göstermiştir. Pb(II) iyonunun arınma ve elverişli ayrılması uygulamalarının yüksek olanak sağladığını ileri sürmüşler (Dhakal ve ark., 2005).
Denizli, A. ve ark., yaptıkları çalışmada; metakrilol klorür ve 1- glutomik asidin metil esteri gibi metal kompleks ligand yada komonomer kullanarak N- Metakrilol-(1)-glutamik asit (MAGA) sentezlemişler. MAGA FTIR ve NMR ile karakterize edilmiştir Poly(HEMA-MAGA) bağları şişme çalışmaları, yüzey alanı ölçümleri ve elemental analizlerle karakterize edilmiştir. Poly(HEMA-MAGA) bağlarının yüzey alanları 56,7 m2/g’dır. Poly(HEMA-MAGA) bağları Pb(II) iyonu giderimi çalışmalarında kullanılmıştır. Adsorpsiyon eşitliği 60 dakikada elde edilmiştir. Polimer yapısı ile MAGA’nın birleştirilmesiyle Pb(II) iyonu adsorpsiyon kapasitesi önemli ölçüde azalmıştır. pH’daki azalış ile Pb(II) iyonu adsorpsiyonu azalmıştır. Adsorpsiyon kapasiteleri; Pb(II) için 42,5 mg/g, Hg(II) için 26,8 mg/g, 17,6 mg/g olarak tespit edilmiştir (Denizli ve ark., 2004).
Demirbaş, A., yaptığı çalışmada; alkali gliserol tarafından kavak ve kayın ağacı kütüklerindeki modifiye edilmiş lignin üzerinde Pb(II) ve Cd(II) toksik metal iyonlarının adsorpsiyonunu çalışmıştır. Sırasıyla Pb(II) ve Cd(II) için modifiye ligninin adsorpsiyon kapasiteleri 8,2-9,0 ve 6,7 – 7,5 mg/g olarak bulunmuştur. Maksimum adsorpsiyon yüzdesi, 330K sıcaklıkta ve 4 saatte Pb(II) iyonu için 98,5 ve 290K sıcaklıkta ve 10 saatte Cd(II) iyonu için 95,0’dır. Adsorpsiyon prosesinin endotermik doğası; sıcaklık azalışı ile her iki metal iyonunun adsorpsiyonunun azaldığını göstermiştir. Pb(II) ve Cd(II) iyonlarının maksimum adsorpsiyon yüzdeleri 48-42 saate
kadar azalmıştır. Pb(II) iyonunun adsorpsiyonu için maksimum pH değeri 5,0’dır (Demirbaş, 2003).
Meunier, N.ve Blais, J.F. yaptıkları çalışmada; zararlı maddelerden temizlenmiş asidik topraklarda ağır metal iyonlarından özellikle kurşunun doğal adsorbentlerle giderimini çalışmışlardır. Kakao kabuğu, sedir kabuğu, ladin kabuğu, asidik kayalar ve volkanik kayaların bulunduğu cam kapların sallanmasıyla sorpsiyon işlemi gerçekleştirilmiştir. Kakao kabuğunun en iyi sorbent etkisi asidik topraktaki davranışı ile Pb(II) adsorpsiyonunun 2,60 mg/g’lık miktarında gözlemlenmiştir. Sedir kabuğu ile metal giderimi için çok asidik çözeltiler kullanılmıştır ve etkisinin kakao kabuğundan daha az olduğu tespit edilmiştir (Meunier ve ark., 2002).
Zhang, L.M. yaptığı araştırmada; suda çözünmeyen kopolimerler içeren amin gruplar tarafından sulu çözeltilerdeki Pb(II) ve Cu(II) iyonlarının adsorpsiyonunu incelemiştir. Adsorpsiyona deney süresi, çözeltinin pH değeri, metal iyonu konsantrasyonunun etkisi dikkate alınmıştır. İki saatlik adsorpsiyon süresi ile yeterli adsorpsiyon eşitliğine ulaşılmıştır ve adsorpsiyon eşitliği ile Langmuir izoterm eşitliği arasında uygunluk sağlanmıştır. Adsorpsiyon kapasitesi Langmuir izotermine göre Pb(II) ve Cu(II) iyonu için sırasıyla 2,09 ve 2,12 mmol/g bulunmuştur (Zhang, 2002).
Petrnele, W.S. ve ark. yaptıkları çalışmada; şeker kamışında bulunan karboksimetil lignin üzerinde Cd(II) ve Pb(II) adsorpsiyonuna sıcaklığın, pH’nın ve iyonik kuvvetin etkisini çalışmışlardır. Langmuir modelinde kesikli tekniği kullanılarak adsorpsiyon eşitliği bilgisi elde edilmiştir. pH arttıkça Pb(II) adsorpsiyonu artmıştır. Karboksimetil lignin özellikle pH 6, 300C ve 0,1 mol/dm-3 iyonik kuvvette Pb(II) adsorplamıştır (Petrnele ve ark., 1999).
Salih, B. ve ark. yaptıkları çalışmada; farklı pH değerlerinde (2,0-8,0) ve Hg(II), Cd(II), Cr(III) ve Pb(II)’nun farklı miktarlarını (25-500 ppm) içeren sulu çözeltilerden ağır metal giderimi için ditizon ile çapraz bağlanmış poli-(EGDMA- HEMA) mikro bağları sentezlemişlerdir. Ditizon ile çapraz bağlanmış poli-(EGDMA-HEMA)’nın maksimum adsorpsiyon kapasitesi; Pb(II) için 155,2, Cr(III) için 62,2, Hg(II) için 43,1, Cd(II) için 18,3 mg/g olarak bulunmuştur. Ayrıca sentetik atık sulardan ağır metal adsorpsiyonunu çalışmışlardır. Adsorpsiyon kapasiteleri Cd(II) için 4,3, Hg(II) için 13,2, Cr(III) için 7,2,ve Pb(II) için 16,4 mg/g olarak bulunmuştur.Ağır metal iyonlarının desorpsiyonu 0.1M HNO3 kullanılarak gerçekleştirilmiştir (Salih ve ark., 1998).
5. MATERYAL VE METOT 5.1. Kullanılan Kimyasal Maddeler
Çalışmada stiren, p-divinilbenzen (DVB), allil metakrilat, radikal başlatıcı azobis-izo butironitril (AINB), metakrilik asit, aktif karbon, polivinil alkol, Pb(NO3)2,
%65’lik derişik HNO3 ve distile su kullanılmıştır.
Kullanılan kimyasal maddelerden stiren, DVB, AINB, Pb(NO3)2, HNO3 E.
Merck, Almanya firmasından temin edilmiştir.
Sentezde kullanılan kimyasal maddelerden bazılarının özellikleri aşağıda belirtilmiştir.
5.1.1. Stiren ( C6H5CH=CH2 )
Polistiren, iyon değiştiriciler, boya üretiminde kullanılan stiren; etil benzenden elde edilir. Stiren açık arı renkte, yağımsı, kendine özgü kokuya sahip bir sıvıdır (Kimya Ansiklopedisi, 1961). - H2O +H2 +O2 CH=CH2 Stiren C6H5C2H5 C6H5COCH3 C6H5CH(OH)CH3 asetofenon 1-fenil-etanol-1 Etil-benzen
Tablo 5.1. Stirenin Fiziksel Özellikleri (Kimya Ansiklopedisi, 1961)
Formülü C6H5CH=CH2
MA(g/mol) 104,14
k.n.(0C) 145,2
e.n.( 0C) -30,628
d 420 0,906
Çözünürlük Metanol, etanol, aseton
5.1.2. Divinil-benzen (C6H4(CH=CH2)2)
Yüksek sertliğe sahip, ısıya dayanıklı kopolimerler ve çözünmeyen iyon değiştiriciler üretiminde kullanılır. Divinilbenzenin 3 izomeri bulunmaktadır. Sanayide divinilbenzenden elde edilir (Kimya Ansiklopedisi, 1961).
Tablo 5.2. Divinilbenzenin Fiziksel Özellikleri ( Kimya Ansiklopedisi, 1961).
Formülü C6H4 (CH = CH2 ) MA(g/mol) 130,18 k.n.(0C) 1,2- izomer 78,5 1,3- izomer 210,55 1,4- izomer 180 e.n.( 0C) 1,2- izomer – 1,3- izomer -52,25 1,4- izomer 31 d 4t 1,2- izomer 0,934 (210C) 1,3- izomer 0,9294 (200C) 1,4- izomer 0,913 (400C) +Cl2 C6H4 (C2H5)2 C6H4(C2H4Cl)2 C6H4(C2H4OH)2 C6H4(CH = CH2)2 divinilbenzen dietilol - benzen
5.1.3. Metakrilik Asit ( CH2 = C- COOH ) CH3
Organik cam, tekstil sanayisinde uygulanan polimerler üretiminde kulanılır. Kloroform ve asetondan elde edilir. Sıvı haldedir (Kimya Ansiklopedisi, 1961).
CH3 COCH3 + CHCl3 CH2 = C - COOH CH3 KOH Kloform Aseton Metakrilik Asit
Tablo 5.3. Metakrilik Asidin Fiziksel Özellikleri (Kimya Ansiklopedisi, 1961)
Formülü CH2 = C (CH3) – COOH
MA(g/mol) 86,09
k.n.(0C) 160,5
d 420 1,0153
Çözünürlük Su, alkol, eter
5.1.4. Allil - metakrilat (CH2 = C(CH3) – COO – CH2CH = CH2)
Metakrilik asidin esterleri asetondan elde edilir.
Renksiz sıvıdır ( Kimya Ansiklopedisi,1961). Alil-metakrilat OH CH3 CN CH2
=
CHCH2OH CH3 C - H2O CN C CH3 C O+
HCN CH3 CH2 H2SO4 CH3 aseton C (CH3) CH2 COOCH2CH = CH25.2. Deneyde Kullanılan Cihaz ve Aletler
IR-spektrofotometresi: Pye Unicam SP 1025 (Selçuk Üniversitesi Fen Edebiyat Fakültesi Kimya Bölümü-KONYA)
Atomik Absorpsiyon Cihazı: GBC marka, SensAA model ( S.Ü. Müh.-Mim.Fak. Kimya Müh. Bölümü )
Analitik terazi, mekanik karıştırıcı, etüv.
5.3. Deneyde Kullanılan Cam Malzemeler
Pipetler, erlenler, beherler, balon jojeler, mezür ve tüpler.
5.4. Stiren – divinilbenzen Terpolimerlerinin Sentezinin Gerçekleştirildiği Deney Sistemi
Kopolimerleşme reaksiyonu, Şekil 5.1’de verilen iki ağızlı cam balonda gerçekleştirilmiştir. Isıtma için kontrollü ısıtmalı elektrikli bir ısıtıcı kullanılmıştır. Deney sistemi geri soğutucu ile donatılmıştır.
Şekil 5.1. Stiren-divinilbenzen Terpolimerlerinin Sentezinin Gerçekleştiği Deney Sistemi 7 4 1 2 3 5 6
1- Geri Soğutucu 2- Su Çıkışı 3- Su Girişi 4- Karıştırıcı Motoru 5- Karıştırıcı 6- Kontrollü Isıtıcı 7- Cam Balon
5.5. Stiren-Divinilbenzen Allil Metakrilat Terpolimeri (SDBAM) ve Stiren- Divinilbenzen Metakrilik Asit Terpolimerlerinin (SDBM) Sentez Yöntemi
Terpolimerlerin sentezi için stiren, divinilbenzen, metakrilik asit ve alil – metakrilat kullanılmıştır.
Cam balonda 0,35g polivinil alkol, 60mL 60C0’de ısıtılmış distile suda çözülerek oda sıcaklığına kadar soğutulmuştur. 10,4 mL stiren, 1,4 mL divinil-benzen, 0,32 mL allil metakrilat (SDBAM için), 0,32 mL metakrilik asit (SDBM için), 0,21g radikal başlatıcı AIBN (azobis- izobutironitril) cam balona ilave edilerek reaksiyon başlatılmıştır. Kopolimerleşme reaksiyonu için sıcaklık 800C’a ayarlanarak sürekli karıştırmaya 20 saat devam ettirilmiştir.
Reaksiyon tamamlandıktan sonra ortama metanol ilave edilerek polimer ortamdan ayrıştırılmış, sıcak su ile birkaç defa yıkanarak 600C’da kurutulmuştur (Kurbanlı ve ark., 1996). CH3 CH2 CH CH CH2 CH2 CH CH2 C COOH n SDBM
CH2 CH CH CH2 CH2 CH CH2 C COOCH2 SDBAM CH CH2 CH3 n
5.6. Pb(II) İyonunun Aktif Karbon, SDBAM ve SDBM ile Adsorpsiyonu 5.6.1. Pb(II) Stok Çözeltisinin Hazırlanması
0,1598 g Pb(NO3)2 minimum miktarda (1:1) HNO3’de çözünerek üzerine 10 mL
derişik HNO3 ilave edilmiştir. Çözelti distile su ile 1000 mL’ye tamamlanarak
1mL’sinde 100 mg Pb2+ olan çözelti elde edilmiştir.
5.6.2. Seyreltme Çözeltisinin Hazırlanması
Numunelerin seyreltme işlemleri %10’luk HNO3 çözeltisi ile yapılmıştır.
Bunun için yaklaşık 150 mL %65’lik derişik HNO3 çözeltisi alınarak distile su ile 1000
mL’ye tamamlanmıştır.
5.5.3. Pb(II) İyonunun Adsorpsiyon Deneyi
Pb(II) iyonunun adsorpsiyonu için iki stiren-divinilbenzen terpolimeri ve aktif karbon kullanılmıştır. 10, 20, 30, 40, 50, 60 mg/L konsantrasyonlarda 100 mL’lik Pb(II) sentetik atıksu numunelerine 0,05 g adsorban madde ilave edilerek nötr ve asidik ortam için 2 set hazırlanmıştır.
Nötr ortam olarak pH 7’de çalışılmıştır. Stok ve seyrelme çözeltileri asit ile hazırlandığı için pH’ları 1-2 aralığındadır. Ortamı nötrleştirmek için çözeltiye çok derişik NaOH ilavesi yapılarak pH 7’ye ayarlanmıştır.
Asidik ortam olarak pH 2’de çalışılmıştır. Hazırlanan çözeltiler zaten asidik olduğu için ortama herhangi bir müdahalede bulunulmamıştır.
Hazırlanan çözeltiler karıştırıcıya yerleştirilerek karıştırıcı 200C ve 220 rpm hızda çalıştırılmıştır.
5.7. Atomik Absorpsiyon Cihazı Analizleri
0, 30, 60, 120, 180 ve 240 dk’larda 1’er mL numuneler alınarak 10 katına seyreltme çözeltisi ile seyreltilmiş ve atomik absorpsiyon cihazında analiz edilmişlerdir.
Pb lambası ve Hava/Asetilen alev başlığı ile 217nm.’de çalışılmıştır.
5.8. IR-analizleri
Sentezlenen terpolimerlerin kimyasal yapıları IR-spektrumları ile aydınlatılmıştır.
6. DENEYSEL BULGULAR
Bu çalışmada atık sulardan Pb(II) ağır metalinin gideriminin araştırılması için, SDBM ve SDBAM terpolimerleri ile aktif karbon kullanılmış, bu maddelerle Pb(II)’nun adsorpsiyonu çalışılmıştır.
Çalışmada zaman, konsantrasyon ve pH’ın giderim üzerine etkisi araştırılmıştır.
6.1. SDBM ve SDBAM’nin IR-spektrumları
SDBM’nin IR-spektrumunda 2960 cm-1’de görülen pik – CH3 grubunun, 1500
cm-1’de görülen pik benzen halkasının, 3000 cm-1’de görülen pik karboksilin –OH grubunun varlığını göstermektedir.
SDBAM’nin IR-spektrumunda 1700 cm-1’de görülen pik doymamış esterin, 1730-1717 cm-1’de görülen pik α,β-doymamış asit esterinin C = O grubunun, 3150-3050 cm-1’de görülen pik α,β-doymamış asit esterinin C = C bağının, 2960 cm-1’de görülen pik CH3 grubunun, 1445 cm-1’de görülen pik – CH – CH = CH2 grubunun
varlığını göstermektedir.
Bu sonuçlar terpolimerin kimyasal yapısına metakrilik asit ve allilmetakrilatın bağlandığını kanıtlamaktadır.
6.2. Pb(II) Giderimine Zamanın Etkisi
Deney sırasında numuneler; 0, 30, 60, 120, 180 ve 240 dk.’larda alınıp adsorpsiyona zamanın etkisi incelenmiştir.
Deney 2 farklı pH ortamında yapıldığı için elde edilen sonuçlar da her ortam için farklı olmuştur.
6.2.1. Nötral Ortam 1. SDBM için
Deneyde ölçümler 240 dakikaya kadar devam etmiştir. Sonuçlar aşağıda grafik olarak verilmiştir. Grafikte x ekseni zaman değerlerini, y ekseni ise zamanlara karşılık çözeltide kalan madde konsantrasyonunu göstermektedir.
0 10 20 30 40 50 60 70 0 30 60 90 120 150 180 210 240 t, dk C , mg /L
Şekil 6.1. Nötral Ortamda SDBM İle Pb(II) İyonu Giderimine Zamanın Etkisi Tablo 6.1. Nötral Ortamda SDBM ile Pb(II) İyonununYüzde Giderim
Değerleri
C, (mg/L) 10 20 30 40 50 60
% Giderim (240. dk) 62,0 80,3 66,0 62,7 94,1 85,6
1. SDBAM için
Nötral ortamda yapılan çalışma 240 dakikaya kadar devam etmiştir. Elde edilen sonuçlar Şekil 6.2’de verilmiştir. Grafikte x ekseni zaman değerlerini, y ekseni ise zamana karşı çözeltide kalan Pb(II) iyonu konsantrasyonunu vermektedir. SDBAM’nin etkin bir giderim gerçekleştirmediği gözlemlenmiştir.
0 10 20 30 40 50 60 70 0 30 60 90 120 150 180 210 240 t, dk C , mg /l
Şekil 6.2. Nötral Ortamda SDBAM İle Pb(II) İyonu Giderimine Zamanın Etkisi Tablo 6.2. Nötral Ortamda SDBAM ile Pb(II) İyonunun Yüzde Giderim
Değerleri
C, (mg/L) 10 20 30 40 50 60
% Giderim (240. dk) 43,4 10,8 12,8 5,9 8,4 14,4
2. Aktif Karbon için
Deneysel çalışmalar 240 dakikaya kadar devam etmiştir. Elde edilen sonuçlar Şekil 6.3’de verilmiştir. Grafikte x ekseni zaman değerlerini, y ekseni ise zamana karşı çözeltide kalan Pb(II) iyonu konsantrasyonunu vermektedir. Aktif karbonun herhangi bir giderim gerçekleştirmediği gözlemlenmiştir.
0 10 20 30 40 50 60 70 0 30 60 90 120 150 180 210 240 t, dk C , mg /L
Şekil 6.3. Nötral Ortamda Aktif Karbon İle Pb(II) İyonu Giderimine Zamanın Etkisi
Tablo 6.3. Nötr Ortamda AK ile Pb(II) İyonunun Yüzde Giderim Değerleri
C, (mg/L) 10 20 30 40 50 60
% Giderim (240. dk) 25,5 0,2 11,7 0,7 3,8 5,6
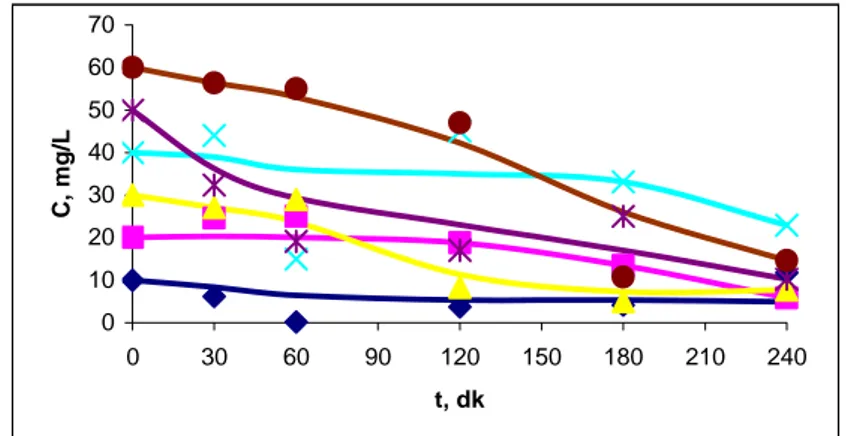
6.2.2. Asidik Ortam 1. SDBM için
Deneysel çalışmalar 240 dakikaya kadar devam etmiştir. Elde edilen sonuçlar Şekil 6.4’de verilmiştir. Grafikte x ekseni zaman değerlerini, y ekseni ise zamana karşı çözeltide kalan Pb(II) iyonu konsantrasyonunu vermektedir.
0 10 20 30 40 50 60 70 0 30 60 90 120 150 180 210 240 t, dk C , mg /L
Şekil 6.4. Asidik Ortamda SDBM İle Pb(II) İyonu Giderimine Zamanın Etkisi Tablo 6.4. Asidik Ortamda SDBM ile Pb(II) İyonunun Yüzde Giderim
Değerleri
C, (mg/L) 10 20 30 40 50 60
% Giderim (240. dk) 62,8 71,0 74,4 17,2 79,6 75,6
2. SDBAM için
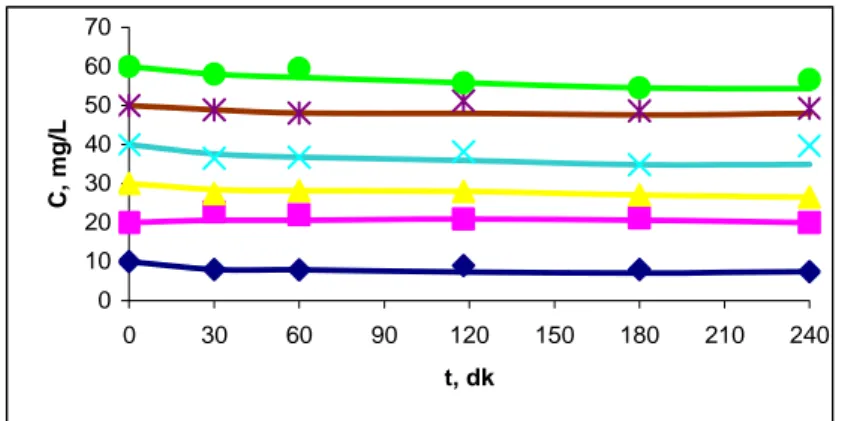
Deneysel çalışmalar 240 dakikaya kadar devam etmiştir. Elde edilen sonuçlar Şekil 6.5’de verilmiştir. Grafikte x ekseni zaman değerlerini, y ekseni ise zamana karşı çözeltide kalan Pb(II) iyonu konsantrasyonunu vermektedir. İlk 30 dk’da adsorpsiyonun daha hızlı gerçekleştiği görülmektedir.
0 10 20 30 40 50 60 70 0 30 60 90 120 150 180 210 240 t, dk C , mg /L
Şekil 6.5. Asidik Ortamda SDBAM İle Pb(II) İyonu Giderimine Zamanın Etkisi Tablo 6.5. Asidik Ortamda SDBAM ile Pb(II) İyonunun Yüzde Giderim
Değerleri
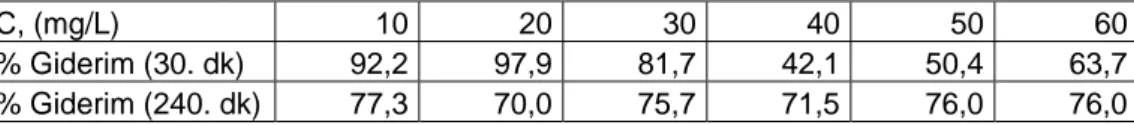
C, (mg/L) 10 20 30 40 50 60
% Giderim (30. dk) 92,2 97,9 81,7 42,1 50,4 63,7 % Giderim (240. dk) 77,3 70,0 75,7 71,5 76,0 76,0
3. Aktif Karbon için
Deneysel çalışmalar 240 dakikaya kadar devam etmiştir. Elde edilen sonuçlar Şekil 6.6’de verilmiştir. Grafikte x ekseni zaman değerlerini, y ekseni ise zamana karşı çözeltide kalan Pb(II) iyonu konsantrasyonunu vermektedir. Aktif karbonun herhangi bir giderim yapmadığı gözlemlenmiştir.
0 10 20 30 40 50 60 70 80 0 30 60 90 120 150 180 210 240 t, dk C , mg /L
Şekil 6.6. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimine Zamanın Etkisi
Tablo 6.6. Asidik Ortamda AK ile Pb(II) İyonunun Yüzde Giderim Değerleri
C, (mg/L) 10 20 30 40 50 60
% Giderim (240. dk) 8,0 0,5 0,3 5,0 0,4 20,8
6.3. Pb(II) İyonu Gideriminin İzoterm Eğrileri ve İzotermleri 6.3.1. Nötral Ortam 1. SDBM için 0 10 20 30 40 50 60 0 5 10 15 20 25 C, mg/L q , mg /g
Şekil 6.7. Nötral Ortamda SDBM ile Pb(II) İyonu Gideriminin İzoterm Eğrisi
Nötral ortamda SDBM’in istenen izoterm eğrisi 240. dakikadaki adsorpsiyonlar için elde edilmiştir. Bu durum SDBM’in giderim gerçekleştirdiğini göstermektedir. SDBM için adsorpsiyon kapasitesi qm 45 mg/g olarak tespit edilmiştir.
y = 0,022x + 0,1056 R2 = 0,8146 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0 5 10 15 20 25 C, mg/L C /q, m g /g
Şekil 6.8. Nötral ortamda SDBM ile Pb(II) giderimi için Langmuir İzotermi
Nötral ortam için Şekil 6.8’de verilen Langmuir izotermi incelendiğinde R2 değerinin 1’e yakın olduğu tespit edilmiştir. Bu veriler ışığında SDBM’in kimyasal bağ kuvvetleri ile etkin bir bağlanma gerçekleştirdiği gözlemlenmiştir.
Tablo 6.7. Nötral ortamda SDBM ile Pb(II) giderimi için
Langmuir İzotermi Sabitleri kd/qm 0,1056 1/qm 0,022 qm (mg/g) 45,45 kd 4,80 y = 0,3905x + 1,0935 R2 = 0,3796 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 0 0,5 1 1 log C log q ,5
Şekil 6.9. Nötral ortamda SDBM ile Pb(II) giderimi için Freundlich İzotermi
Nötral ortam için Freundlich izotermi grafiği incelendiğinde R2 değerinin % 70’den az olduğu tespit edilmiştir. Bu durumda SDBM’in fiziksel bağ kuvvetleri ile herhangi bir bağlanma gerçekleştirmediği gözlemlenmiştir.
Tablo 6.8. Nötral ortamda SDBM ile Pb(II) giderimi için Freundlich İzotermi
Sabitleri
logk 1,0935 k 12,40 1/n 0,3905
2. SDBAM için 0 1 2 3 4 5 6 7 8 9 10 0 10 20 30 40 50 C, mg/L q, m g/g
Şekil 6.10. Nötral Ortamda SDBAM ile Pb(II) İyonu Gideriminin İzoterm Eğrisi
SDBAM’nin nötral ortamda 240. dakikadaki adsorpsiyonlar için etkin bir giderim gerçekleştiremediği gözlemlenmiştir. Şekil 6.10’da bu tespiti doğrulamaktadır. Grafikten qm= 7,13 mg/g bulunmuştur. Kapasitenin bu düşük değeri giderimin fazla
olmadığını göstermektedir. y = 0,1402x + 0,5981 R2 = 0,6749 0 1 2 3 4 5 6 7 8 9 0 10 20 30 40 5 C, mg/L C/ q , g /L 0
Şekil 6.11. Nötral ortamda SDBAM ile Pb(II) giderimi için Langmuir İzotermi
Nötral ortam için şekil 6.11’de verilen Langmuir izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç SDBAM’nin kimyasal bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6.9. Nötral ortamda SDBAM ile Pb(II) giderimi için Langmuir İzotermi Sabitleri kd/qm 0,5981 1/qm 0,1402 qm (mg/g) 7,13 kd 4,27 y = -0,0954x + 0,9382 R2 = 0,055 0 0,2 0,4 0,6 0,8 1 0 0,5 1 1,5 log C log q 2
Şekil 6.12. Nötral ortamda SDBAM ile Pb(II) giderimi için Freundlich İzotermi
Nötral ortam için Şekil 6.12’de verilen Freundlich izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç SDBAM’nin fiziksel bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6.10. Nötral ortamda SDBAM ile Pb(II) giderimi için Freundlich İzotermi Sabitleri
logk 0,9382 k 8,67 1/n -0,054
3. Aktif karbon için 0 1 2 3 4 5 6 7 8 0 10 20 30 40 50 6 C, mg/L q , mg /g 0
Şekil 6.13. Nötral Ortamda Aktif Karbon ile Pb(II) İyonu Gideriminin İzoterm
Eğrisi
Şekil 6.13’de aktif karbon için hesaplanan veriler çok dağınık olduğundan istenilen izoterm eğrisi 240. dakikadaki adsorpsiyonlar için elde edilememiştir. Bu da adsorpsiyonun gerçekleşmediğini göstermektedir. Şekil 6.13 ve 6.14 de bu sonucu desteklemektedir. y = -2,0316x + 138,28 R2 = 0,0856 0 50 100 150 200 250 300 350 0 10 20 30 40 50 60 C, mg/L C/ q, g/ L
Şekil 6.14. Nötral ortamda Aktif Karbon ile Pb(II) giderimi için Langmuir İzotermi
Nötral ortam için Şekil 6.14’de verilen Langmuir izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç aktif karbonun kimyasal bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6.11. Nötral ortamda Aktif Karbon ile Pb(II) giderimi için Langmuir İzotermi Sabitleri kd/qm 138,28 1/qm -2,0316 qm (mg/g) -0,49 kd -68,06 y = 0,2148x - 0,0623 R2 = 0,0071 -1,5 -1 -0,5 0 0,5 1 0 0,5 1 1,5 log C log q 2
Şekil 6.15. Nötral ortamda Aktif Karbon ile Pb(II) giderimi için Freundlich İzotermi
Tablo 6.12. Nötral ortamda Aktif Karbon ile Pb(II) giderimi için Freundlich İzotermi Sabitleri
logk -0,0623 k 0,87 1/n 0,2148 n 4,66
Nötral ortam için Şekil 6.15’de verilen Freundlich izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç aktif karbonun fiziksel bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
6.3.2. Asidik Ortam 1. SDBM için 0 20 40 60 80 100 0 5 10 15 20 C, mg/L q , mg /g
Şekil 6.16. Asidik Ortamda SDBM ile Pb(II) İyonu Gideriminin İzoterm Eğrisi”
Şekil 6.16’da SDBM’in asidik ortamda oluşturulan izoterm eğrisinden, beklenen adsorpsiyon eğrisinin oluştuğu ve adsorpsiyonun gerçekleştiği 240. dakikadaki adsorpsiyonlar için tespit edilmiştir. SDBM’in adsorban kapasitesi grafikten 90 mg/g olarak bulunmuştur. y = -0,0113x + 0,2872 R2 = 0,5586 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0 5 10 15 20 C, mg/L C /q, g/ L
Şekil 6.17. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için Langmuir İzotermi
Asidik ortam için Şekil 6.17’de verilen Langmuir izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç SDBM’in kimyasal bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6.13. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için Langmuir İzotermi Sabitleri
kd/qm 0,3028 1/qm 0,0171 qm (mg/g) 58,48 kd 17,71 y = 1,5064x + 0,2881 R2 = 0,9604 0 0,5 1 1,5 2 2,5 0 0,2 0,4 0,6 0,8 1 1,2 1,4 log C log q
Şekil 6.18. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için Freundlich İzotermi
Asidik ortam için Şekil 6.18’de verilen Freundlich izotermi incelendiğinde R2 değerinin 1’e yakın olduğu görülmektedir. Bu sonuç SDBM’in fiziksel bağ kuvvetleri ile etkin bir bağlanma gerçekleştirdiğini göstermektedir.
Tablo 6.14. Asidik Ortamda SDBM ile Pb(II) İyonu Giderimi için Freundlich İzotermi Sabitleri
logk 0,2881
k 1,94
1/n 1,5064
2. SDBAM için 0 20 40 60 80 100 0 5 10 15 20 C, m g/L q , m g /g
Şekil 6.19. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için İzoterm Eğrisi
Şekil 6.19’da SDBAM’nin asidik ortam için oluşturulan izoterm eğrisinden, beklenen adsorpsiyon eğrisinin oluştuğu ve adsorpsiyonun gerçekleştiği 240. dakikadaki adsorpsiyonlar için tespit edilmiştir. SDBAM’nin adsorban kapasitesi grafikten 81 mg/g olarak bulunmuştur. y = 9E-05x + 0,172 R2 = 0,0002 0 0,05 0,1 0,15 0,2 0,25 0 5 10 15 20 C, mg/L C /q, g/ L
Şekil 6.20. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için Langmuir İzotermi
Asidik ortam için Şekil 6.20’de Langmuir izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç SDBAM’nin kimyasal bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6.15. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için
Langmuir İzotermi Sabitleri
kd/qm 0,172 1/qm 0,00005 qm mg/g 20000,00 kd 3440,00 y = 0,9532x + 0,8081 R2 = 0,9496 0 0,5 1 1,5 2 2,5 0 0,2 0,4 0,6 0,8 1 1,2 1,4 log C lo g q
Şekil 6.21. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için Freundlich İzotermi
Asidik ortam için Şekil 6.21’de verilen Freundlich izotermi incelendiğinde R2 değerinin 1’e yakın olduğu görülmektedir. Bu sonuç SDBAM’nin fiziksel bağ kuvvetleri ile etkin bir bağlanma gerçekleştirdiğini göstermektedir.
Tablo 6.16. Asidik Ortamda SDBAM ile Pb(II) İyonu Giderimi için Freundlich İzotermi Sabitleri
logk 0,8081 k 6,43 1/n 0,9532
n 1,05
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 0 10 20 30 40 50 60 C, mg/L q , mg /g
Şekil 6.22. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi İzoterm Eğrisi
Şekil 6.22’de aktif karbon için hesaplanan veriler çok dağınık olduğu için istenilen izoterm eğrisi 240. dakikadaki adsorpsiyonlar için elde edilememiştir. Bu da adsorpsiyonun gerçekleşmediğini göstermektedir. Şekil 6.23 ve 6.24 de bu sonucu desteklemektedir. y = 1,8937x + 28,844 R2 = 0,1736 0 20 40 60 80 100 120 140 160 0 10 20 30 40 50 60 C, mg/L C/ q , g /L
Şekil 6.23. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için Langmuir İzotermi
Asidik ortam için Şekil 6.23’de verilen Langmuir izotermi incelendiğinde R2
değerinin %70’den az olduğu görülmektedir. Bu sonuç aktif karbonun kimyasal bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6. 17. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için Langmuir İzotermi Sabitleri
kd/qm 28,844 1/qm 1,8937 qm mg/g 0,53 kd 15,23 y = -0,2769x + 0,1673 R2 = 0,0176 -1 -0,8 -0,6 -0,4 -0,2 0 0,2 0,4 0,6 0,8 0 0,5 1 1,5 log C log q 2
Şekil 6.24. Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için Freundlich İzotermi
Asidik ortam için Şekil 6.24’de verilen Freundlich izotermi incelendiğinde R2 değerinin %70’den az olduğu görülmektedir. Bu sonuç aktif karbonun fiziksel bağ kuvvetleri ile bir bağlanma gerçekleştiremediğini göstermektedir.
Tablo 6.18 . Asidik Ortamda Aktif Karbon ile Pb(II) İyonu Giderimi için Freundlich İzotermi Sabitleri
logk 0,1673 k 1,47 1/n -0,2769
n -3,61
Nötral ortamda yapılan çalışmada;
• SDBM’ın adsorpsiyonuna 240 dk’ya kadar devam ettiği görülmüştür. • SDBAM ile önemli ölçüde giderim olmadığı gözlemlenmiştir
• Aktif karbonla önemli ölçüde giderim olmadığı gözlemlenmiştir.
Nötral ortamda SDBM ile gerçekleştirilen adsorpsiyon verilerinin Langmuir izotermine uyduğu buna bağlı olarak ta kimyasal bağ kuvvetlerinin etkin olduğu ve tek tabakalı bir adsorpsiyon gerçekleştiği, Freundlich izotermine uymadığı bunun neticesinde de fiziksel bağ kuvvetleri ile herhangi bir bağlama gerçekleştiremediği gözlemlenmiştir.
SDBM’nin adsorpsiyon kapasitesi izoterm grafiklerinden yaklaşık olarak 45mg/g bulunmuştur.
Nötral ortamda SDBAM ile gerçekleştirilen adsorpsiyonun verilerinin Langmuir izotermi ve Freundlich izoterminin her ikisine de uymadığı ve SDBAM’nin herhangi bir bağlanma gerçekleştiremediği gözlemlenmiştir.
SDBM’in adsorpsiyon kapasitesi 7,13 mg/g bulunmuştur.
Nötral ortamda AK ile gerçekleştirilen adsorpsiyonun verilerinin Langmuir izotermi ve Freundlich izoterminin her ikisine de uymadığı ve aktif karbonun herhangi bir bağlanma gerçekleştiremediği gözlemlenmiştir.
Yukarıdaki verilerden faydalanarak nötral ortamda denenen adsorban maddeler adsorplama kapasitelerine göre şu şekilde sıralanabilir:
SDBM > SDBAM> AK
Bu sıralamadan nötr ortamda en iyi giderimi yapan adsorban maddenin adsorplama kapasitesi en yüksek olan SDBM olduğu görülmektedir.
Asidik ortamda yapılan çalışmada;
• SBAM’ın ilk 30 dk’da daha etkili olmak üzere adsorpsiyonuna 240 dk’ya kadar devam ettiği görülmüştür.
• Aktif karbon ile giderim olmadığı gözlemlenmiştir.
Asidik ortamda SDBM ile gerçekleştirilen adsorpsiyonun verilerinin Langmuir izotermine uymadığı buna bağlı olarak da kimyasal bir bağ gerçekleştiremediği; Freundlich izotermine uyarak fiziksel bağ kuvvetleri ile etkin ve çok tabakalı bir bağlanma gerçekleştirdiği gözlemlenmiştir.
Asidik ortamda SDBM’nin izoterm grafiğinden adsorpsiyon kapasitesi 90 mg/g olarak bulunmuştur.
Asidik ortamda SDBAM ile gerçekleştirilen adsorpsiyonun verilerinin Langmuir izotermine uymadığı buna bağlı olarak da kimyasal bir bağ gerçekleştiremediği; Freundlich izotermine uyarak fiziksel bağ kuvvetleri ile etkin ve çok tabakalı bir bağlanma gerçekleştirdiği gözlemlenmiştir.
Asidik ortamda SDBAM’in izoterm grafiğinden adsorpsiyon kapasitesi 81 mg/g olarak bulunmuştur.
Asidik ortamda AK ile gerçekleştirilen adsorpsiyonun verilerinin Langmuir izotermi ve Freundlich izoterminin her ikisine de uymadığı ve aktif karbonun herhangi bir bağlanma gerçekleştiremediği gözlemlenmiştir.
Yukarıdaki verilerden faydalanarak asidik ortamda denenen adsorban maddeler adsorplama kapasitelerine göre şu şekilde sıralanabilir:
SDBM > SDBAM > AK
Bu sıralamadan asidik ortamda en iyi giderimi yapan adsorban maddenin adsorplama kapasitesi en yüksek olan SDBM olduğu belirlenmiştir.
SDBM’nin her iki ortamda daha iyi adsorplama özelliği göstermesinin sebebi yapısındaki iyon değiştirici grup olan karboksilin -OH grubuna bağlı olarak açıklanabilir. Bu durum SDBM’nin Langmuir izotermlerinden de görülmektedir.
SDBAM’ın yapısında iyon değiştirici grup bulunmamaktadır. Nötr ortamda adsorplama yapamaması buna bağlı olabilir. Asidik ortamda ise Freundlich izotermine
göre fiziksel bağlanmanın ağırlıklı olduğu görülmektedir. Bu durum da asidik ortamdaki iyon kuvvetlerinin artmasına bağlı olarak açıklanabilir.
KAYNAKLAR
Altuğ, F., 1990. Çevre Sorunları, Uludağ Üniv. Güçlendirme Vakfı, Yayın No:41, Uludağ Üniv. Basımevi, Bursa, 30.
Aydın, B.F., Atlan E., 1983. Haliçte Su Kirliliğini Oluşturan Faktörlerin Tüm Mevsimler Boyunca Dağılımı, Tübitak MAM 499, Doğa, Sayı 7.
Beauchesne, I., Meunier, N., Drogui, P., Hausler, R., Mercier,G., Blais, J.F., 2005. Electrolytic Recovery of Lead in Used Lime Leachate from Municipal Waste Incinerator, Journal of Hazardous Materials, 120, 1-3, 201-21.
Berkem, A.R., Bayburt S., 1986. Fizikokimya, İTÜ Yayınları, İstanbul.
Burillo, G. and Ogawa, T., 1983. The Gamma Ray-Induced Crossliking of Polyacrylamide in the Solid State, Journal of Polymer Science: Polymer Letter Edition, 21, 615-620.
Carenza, M., Yoshida, M., Kumakura, M. and Fujımura, T., 1993. Hydrogels Obtained by Radiation-Induced Polymerization for Yeast Cells Immobilization, Eur. Polym. J., 21, 1, 49-53.
Demirbas, A., 2003. Adsorption of Lead and Cadmium Ions in Aqueous Solutions onto Modified Lignin from Alkali Glycerol Delignication, Journal of Hazardous Materials, 109, 1-3 , 221-226.
Denizli,A., Garipcan, B., Karabakan, A., Senöz, H., 2004. Synthesis and Characterization of Poly(hydroxyethyl Methacrylate-N-Methacryloyl-(l)-Glutamic Acid) Copolymer Beads for Removal of Lead Ions, Materials Science and Engineering, Article in Press.
Denizli, A., Salih, B., 1995. Çevre Sularında Ağır Metal Kirliliği, Standart Ekonomik ve Teknik Dergisi, Çevre Özel Sayısı:5.
Dhakal, R.P., Ghimire, K.N., Inoue, K., Yano, M., and Makino, K., 2005. Acidic Polysaccharide Gels For Selective Adsorption of Lead (II) Ion, Separation and Purification Technology, 42, 3, 219-225.
Efendiev, A.A. and Kabanov, V.A., 1982. Pure and Appl. Chem., 54, 11, 2077-2092. Hackman, E.E., 1978. Toxic Organic Chemicals Destruction and Waste Treatment, New
Jersey.
Huglin, M.B. and Zakaria, M.B., 1986. Swelling Properties of Copolimeric Hydrogels Prepared by Gamma Irradiation, Journal of Applied Polymer Science, 31, 457-475.
J. C. Y. Ng, W. H. Cheung and McKay, G., 2002. Equilibrium Studies for the Sorption of Lead from Effluents Using Chitosan Chemosphere, 52, 6 , 1021-1030.
Karadağ, E., Saraydın, D. and Güven, O., 1997. Cationic Dye Adsorption by Acrilamide/ Itoconic Acid Hydrogels in Aqueous Solutions, Polymers for Advanced Technologies, 9, 9, 574- 578.
Kimya Ansiklopedisi, 1961. Devlet Bilim Basımevi, Moskova.
Kurbanlı, R., Mirzaoğlu, R., Karataş, İ., Kara, H., 1996. Polimer Kimyası, Deneyler ve Analizler, ISBN 975-448-118, S.Ü. Fen- Edeb. Fak. Yayınları, Konya.
Kurbanova, R., Mirzaoğlu, R., Karataş, İ., Uçan, H.İ., 1997. Polimer ve Plastikler Teknolojisi, Konya.
Kurimura, Y. and Kaneko, M., 1996. Metal- Polymer Complexes, ed. Salamone, J.C., Poymeric materials encyclopedia, 6 (M-O), 4149-4155.
McMillan, W.G., and Teller, E., J., 1951. J.PHys. Colloid Chem.
M. Mouflih, A. Aklil and S. Sebti, 2005. Removal of Lead from Aqueous Solutions by Activated Phosphate, Journal of Hazardous Materials, 119, 1-3, 183-188.
Mourad, A., Kerdjoudj, H., 2004. Separation of Metallic Ions Using Cation Exchange Resin in The Presence of Organic Macrocation, Analytica Chimica Acta 508, 2, 247-253.
Misak, N.Z., 2000. Some Aspects of the Application of Adsorption Isotherms to Ion Exchange Reactions, Reactive and Functional Polymers, 43, 1-2 , 153-164. Meunier, N., Blais, J.F., Tyagi, R.D., 2002. Selection of a Natural Sorbent to Remove
Toxic Metals from Acidic Leachate Produced During Soil Decontamination, Hydrometallurgy, 67, 1-3 ,19-30.
Otero, M., Rozada, F., Calvo, L.F., Garcia, A.I., Moran, A., 2003, Elimination of Organic Water Pollutants Using Adsorbents Obtained from Sewage Sludge, Dyes and Pigments.
Özer, A., Özer, D., Ekiz, H.İ., Aksu, Z., Kutsal, T. ve Çağlar, A., 1997. Demir (III) İyonlarının Schizomeris Lebleinii’ye Adsorpsiyonu, J. of Engineering and Environmental Sciences, 21, 183- 188.
Peternele, W.S., Winkler-Hechenleitner, A.A. and Pineda, E.A.G., 1999. Adsorption of Cd(II) and Pb(II) onto Functionalized Formic Lignin from Sugar Cane Bagasse, Bioresource Technology, 68, 1 , 95-100.
Salih, B., Denizli, A., Kavaklı,C., Say, R., and Pişkin, E., 1998. Adsorption of Heavy Metal İons onto Dithizone-Anchored Poly(EGDMA-HEMA) Microbeads, Talanta, 46, 5, 1205-1213.
Şengül, F., Küçükgül, E.Y., 1997. Çevre mühendisliğinde Fiziksel ve Kimyasal Temel İşlemler ve Süreçler, D.E.Ü. Mühendislik Fakültesi Basım Ünitesi, İzmir.
Yiğit, F., Bilim Uzmanlığı Tezi, Hacettepe Üniversitesi, Ankara, 1986.
Zhang, L.M, Chen, D.Q., 2002. an İnvestigation of Adsorption of Lead (II) and Copper(II) Ions by Water-Insoluble Starch Graft Copolymers, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 205, 3, 231-236.