T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
FİZYOLOJİ ANABİLİM DALI
IN VİTRO PARKİNSON HASTALIĞI MODELİNDE TİMOKİNONUN APOPTOTİK MEKANİZMALAR ÜZERİNE ETKİSİ
UFUK ŞAHBAZ
DANIŞMAN
PROF. DR. TANER DAĞCI
İZMİR 2019
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
FİZYOLOJİ ANABİLİM DALI
IN VİTRO PARKİNSON HASTALIĞI MODELİNDE TİMOKİNONUN APOPTOTİK MEKANİZMALAR ÜZERİNE ETKİSİ
UFUK ŞAHBAZ
DANIŞMAN
PROF. DR. TANER DAĞCI
İZMİR 2019
ÖN SÖZ
Bu tez çalışmasının uygulanması ve yazımı uzun ve zorlu bir süreç oldu ve bana böyle bir işin asla tek başına yapılamayacağını, hem iş gücü, hem beyin gücü hem de manevi destek anlamında gerçek bir takım çalışması olduğunu gösterdi. Bu bağlamda;
Uzmanlık eğtimi ve tez sürecinde bana desteğini esirgemeyen, tüm teknik imkanlarını paylaşan ve akıl hocalığı yapan danışman hocam sayın Prof. Dr. Taner Dağcı’ya,
Eğitimim boyunca bana her türlü bilgi ve deneyimleriyle destek olan ve huzurlu bir çalışma ortamı oluşturan Fizyoloji Anabilim dalındaki değerli hocalarıma,
Çalışmam boyunca bilgisi ve emeğiyle bana büyük yardımı dokunan ve laboratuarını açan sayın Doç. Dr. Güliz Armağan’a,
Tezimin uygulamasında iİmkanlarından yararlandığım Ege Üniversitesi Tıp Fakültesi Fizyoloji A.D. ve Ege Üniversitesi Eczacılık Fakültesi Farmasötik Bilimler Araştırma
Laboratuvarı (FABAL)’a,
Çalışmada büyük emeği olan Biyokimya AbD asistanları Derviş Birim ve Gizem Kaftan’a,
Bu stresli dönemimde yanımda olan, hayatımdaki sevgi ve huzur ortamını eksik etmeyen, kötü günlerimde beni tolere eden sevgili eşim Özge Dereli Şahbaz’a,
Beni yetiştirip bugünlere getiren, hayatımın her anına katkısı olan ve çalışmalarım süresince bana desteğini eksik etmeyen aileme,
İşyerimde bana her türlü manevi desteği ve bilgi paylaşımlarını esirgemeyen sevgili asistan arkadaşlarıma,
Her adımda arkamda hissettiğim tüm fizyoloji aileme,
III İÇİNDEKİLER ÖN SÖZ...I İÇİNDEKİLER...II ÖZET...III ABSTRACT...IV TABLOLAR VE ŞEKİLLER LİSTESİ...V KISALTMALAR LİSTESİ...VI 1.GİRİŞ...1 2.GENEL BİLGİLER...3 2.1. PARKINSON HASTALIĞI...3 2.1.1. TARİHÇE...3 2.1.2. EPİDEMİYOLOJİ...3 2.1.3. PATOGENEZ...4 2.1.4. KLİNİK...5 2.1.4.1. TREMOR...6 2.1.4.2. BRADİKİNEZİ...6 2.1.4.3 RİJİDİTE...7 2.1.4.4. POSTÜR DENGESİZLİĞİ...7 2.1.5. TEDAVİ...7 2.2. TİMOKİNON...8
2.3. PARKİNSON HASTALIĞI HÜCRE KÜLTÜRÜ MODELİ...10
2.3.1. SH-SY5Y HÜCRE HATTI...10
IV 2.4. APOPTOZ...12 2.4.1. GENEL BİLGİ VE TARİHÇE...12 2.4.2. MORFOLOJİ...12 2.4.3. MEKANİZMA...13 2.4.3.1. EKSTRENSEK YOLAK...13 2.4.3.2. PERFORİN/GRANZİM YOLAĞI...14 2.4.3.3. İNTRENSEK YOLAK...14 2.4.3.4. ORTAK YOL...15 3.GEREÇ VE YÖNTEM...17
3.1. HÜCRE KÜLTÜRÜNDE KULLANILAN YÖNTEMLER...18
3.1.1. HÜCRELERİN ÇOĞALTILMASI...18 3.1.2. HÜCRELERİN PASAJLANMASI...19 3.1.3. HÜCRELERİN SAYILMASI...19 3.1.4. HÜCRELERİN TOPLANMASI...19 3.1.5. HÜCRELERİN LİZATLANMASI...20 3.1.6. HÜCRELERİN DONDURULMASI...20
3.2. PROTEİN ANALİZİNDE KULLANILMIŞ YÖNTEMLER...20
3.2.1. PROTEİN MİKTAR TAYİNİ...20
3.2.2. WESTERN BLOT YÖNTEMİ...21
3.3. HÜCRE CANLILIĞI VE WESTERN BLOT ANALİZLERİ...21
3.3.1. MTT HÜCRE CANLILIĞI TESTİ İLE 6-OHDA DOZ VE SÜRE YANITLARININ BELİRLENMESİ...21
3.3.2. 6-OHDA VE MTT HÜCRE CANLILIĞI TESTİ İLE TİMOKİNON DOZUNUN BELİRLENMESİ...22
V 3.3.3. WESTERN BLOT İLE 6-OHDA’NİN APOPTOTİK BAX PROTEİNİ
ÜZERİNE ETKİSİNİN İNCELENMESİ...23
3.3.4. WESTERN BLOT İLE 6-OHDA VE TİMOKİNONUN APOPTOTİK PROTEİNLERE ETKİSİNİN İNCELENMESİ...23
3.4. İSTATİSTİKSEL DEĞERLENDİRME...24
4.BULGULAR...25
4.1. MTT HÜCRE CANLILIĞI TESTİNDE 6-OHDA DOZ VE SÜRE YANITLARI ...25
4.2. 6-OHDA VE MTT HÜCRE CANLILIĞI TESTİNDE TİMOKİNON DOZ VE SÜRE YANITLARI...25
4.3. WESTERN BLOT UYGULAMASINDA 6-OHDA’NİN APOPTOTİK BAX PROTEİNİ ÜZERİNE ETKİSİ...26
4.4. WESTERN BLOT UYGULAMASINDA 6-OHDA VE TİMOKİNONUN APOPTOTİK PROTEİNLERE ETKİSİ...27
5.TARTIŞMA...31
6.SONUÇ VE ÖNERİLER...33
VI ÖZET
Amaç: Parkinson Hastalığı (PH) ciddi yaşam konforu ve iş gücü kaybına hatta ölüme sebep olan, toplumsal olarak da ülke ve dünya ekonomisine ciddi bir yük oluşturan nörodejeneratif bir
hastalıktır. Yaşla birlikte ilerleyen bu hastalık, insan ömrünün uzadığı günümüzde daha da fazla önem kazanmıştır. Ancak henüz kesin bir tedavi, veya koruyucu bir yöntem geliştirilememiştir. Biz bu çalışmada PH’de timokinonun koruyucu bir ajan olarak potansiyelini inceledik.
Gereç ve Yöntem: Çalışmamızda SH-SY5Y hücrelerine 6-hidroksidopamin (6-OHDA) uygulamasıyla oluşturulmuş PH hücre kültürü modeli kullanılmıştır. Modele uygulanacak 6-OHDA ve timokinonun doz ve uygulama süresinin belirlenmesi ve timokinonun nöron koruyucu etkisinin gösterilmesi için MTT ile spektrofotometrik inceleme yapılarak hücre canlılığı tespit edilmiştir. 6-OHDA 100 µM ve timokinon 2.5 µM konsantrasyonda uygulanmıştır. Western Blot yöntemiyle 6-OHDA’nın Bax proteini ve 6-OHDA ve timokinonun kaspaz-3, bcl-2 ve bcl-xl protein düzeylerine etkisi incelenmiştir. Elde edilen veriler One way ANOVA ve Tukey testleri ile analiz edilmiştir.
Bulgular: MTT testinde timokinonun hücre canlılığını arttırdığı, nöronlarda koruyucu bir etkisi olduğu görülmüştür (p<0.05). 6-OHDA, bax’ı 6 ve 12 saat 100 µM konsantrasyonda
uygulandığında arttırmıştır (p<0.05). Timokinon ve 6-OHDA, Bcl-2’yi 6 saat uygulamada etkilememiştir (p>0.05), 12 saatte ise 6-OHDA Bcl-2’yi kontrole göre azaltmış (p<0.05), timokinon + 6-OHDA ise 6-OHDA uygulamasına göre Bcl-2’yi arttırmıştır (p<0.0005). 6 saat uygulamada 6-OHDA bcl-xl düzeyini azaltmış (p<0.005), timokinon + 6-OHDA, 6-OHDA uygulamasına göre bcl-xl düzeyini arttıramamıştır (p>0.05), ancak timokinon tek başına
uygulandığında bcl-xl düzeyini arttırmıştır (p<0.05). Timokinon 6 ve 12 saat uygulamada kaspaz-3 düzeyini arttırırken (p<0.0005), 6-OHDA azaltmıştır (p<0.0005). 6 saat uygulanan timokinon + 6-OHDA, 6-OHDA uygulamasına göre kaspaz-3’ü arttırmıştır (p<0.0005) ancak 12 saat
uygulamada bu iki değer arasında anlamlı bir fark bulunmamıştır (p>0.05).
Sonuç: Bu çalışma verileri sonucunda timokinonun SH-SY5Y hücre canlılığını koruduğu, bcl-2 ve bcl-xl düzeylerini de arttırdığı görülmüştür. Dolayısıyla timokinonun nöron koruyucu bir etkisinin olduğu ve bu etkiyi apoptoz mekanizmasını baskılayarak oluşturduğu gösterilmiştir. Bu bulgular ışığında timokinonun PH’de nöroprotektif etkilerinin olduğu düşünülmekle beraber, daha ileri çalışmalara ihtiyaç duyulmaktadır.
VII Anahtar Sözcükler: Parkinson Hastalığı; Timokinon; 6-Hidroksidopamin; SH-SY5Y
VIII ABSTRACT
Objective: Parkinson’s Disease (PD) is a neurodegenerative disease that seriously hampers life standards and working ability and can even cause death. It is also a serious burden on the
economy of our country and world. Human life span has greatly increased in recent years and so diseases that progresses with age like PD have become more important. Still, an effective cure or protection method against this disease could not yet be developed. In this study, we investigated thymoquinons potential as a protective agent.
Methods: In our study we have used a PD model of 6-OHDA administrated SH-SY5Y cells. To determine 6-OHDA and thymoquinone doses we would use on our model and whether
thymouinone has a neuroprotective effect, we have used spectrophotometer analysis with MTT cell viability test. We determined the doses of thymoquinone and 6-OHDA as 2.5 µM and 100 µM respectively. Western blotting method was used to determine the effect 6-OHDA had on the apoptotic protein Bax and 6-OHDA and thymoquinone had on the caspase-3, bcl-2 and bcl-2. Statistical analyisis was made using the Tukey and ANOVA tets.
Results: MTT test showed us thymoquinone improved cell viability and so has a neuroprotective property (p<0.05). In the western blot test we saw 6-OHDA increased Bax levels when
administrated for 6 and 12 hours (p<0.05). Thymoquinone and 6-OHDA did not have a
significant effect on bcl-2 when administrated for 6 hours, but in 12 hours 6-OHDA decreased bcl-2 levels significantly compared to control (p<0.05) and thymoquinone increased bcl-2 compared to 6OHDA (p<0.05). In 6 hours adminitrastion, 6-OHDA decreased bcl-2 levels significantly (p<0.005) but thymoquinone had no significant effect on bcl-2 levels compared to 6-OHDA (p>0.05). However when given without 6-6-OHDA, thymoquinone could make significant increase in bcl-2 levels compared to control (p<0.05). Thymoquinone increased and 6-OHDA decreased caspase-3 levels significantly when administrated for both 6 and 12 hours (p<0.0005). In 6 hours, thymoquinone increased caspase-3 levels compared to 6-OHDA (p<0.0005) but showed no significant change in 12 hours (p>0.05).
Conclusions: This study shows thymoquinone preserves cell viability of SH-SY5Y cells and increases bcl-2 and bcl-2 proteins. Thus it was deduced that thymoquinone has a neuroprotective property which takes effect through inhibiting apoptosis. In light of these findings, thymoquinone can be said to hold promise for a future protective PD medicine, however to accomplish this, further research needs to be cunducted.
IX Key Words: Parkinson’s Disease; Thymoquinone; 6-Hydroxydopamine; SH-SY5Y
X ŞEKİLLER LİSTESİ
Şekil 1: PH'nin ülkelere göre prevelans ve insidansının yaşa göre değişimi Şekil 2: PH gelişiminde rol oynayan genetik faktörler ve etkili oldukları yolaklar Şekil 3: Çörekotu bitkisinin tohumları ve timokinonun kimyasal yapısı
Şekil 4: Kullanım sıklıklarına göre SH-SY5Y besiyerleri Şekil 5: Kaspaz-3'ün ektstrensek yolağının basamakları Şekil 6: Kaspaz-3'ün intrensek yolağının basamakları
Şekil 7: Farklı konsantrasyon ve sürelerde uygulanan 6-OHDA’nın hücre canlılığı üzerine etkisi Şekil 8: 6-OHDA aracılı hücre ölümünde farklı konsantrasyonlarda uygulanan timokinonun hücre canlılığı üzerine etkisi
Şekil 9: 6-OHDA uygulaması sonucu bax protein düzeylerinin zamana bağlı değişimi
Şekil 10: Timokinon, 6-OHDA ve Timokinon+6-OHDA’nın 6 ve 12 saat uygulanmasıyla Bcl-2 düzeylerinde oluşan değişim
Şekil 11: Timokinon, 6-OHDA ve Timokinon+6-OHDA’nın 6 ve 12 saat uygulanmasıyla Bcl-2 düzeylerindeki değişim
Şekil 12: Timokinon, 6-OHDA ve Z-DEVD-FMK’nın tek başlarına ve kombine olarak birbirlerine göre Kaspaz-3 düzeylerinde yaptığı etkilerin karşılaştırılması
XI KISALTMALAR LİSTESİ
µl: Mikrolitre µM: Mikromolar
6-OHDA: 6-hidroksidopamin ANOVA: Varyans analizi
Apaf-1: Apoptotik kinaz aktive edici faktör 1 ATCC: Amerikan Tip Kültürü Koleksiyonu Bad: Bcl-2 ilişkili ölüm promotörü
Bak: Bcl-2 homoloğu antagonist/öldürücü Bax: Bcl-2 ilişkili x proteini
BCA: Bikinkoninik asit Bcl-2: B hücreli lenfoma 2
Bcl-2: B hücreli lenfoma ekstra büyük Bcl-w: Bcl-2 benzeri protein 2
Bcl-x: Bcl-2 benzeri protein 1
Bcl-xs: B hücreli lenfoma ekstra küçük Bid: BH3 ile etkileşen bölge ölüm agonisti Bik: Bcl-2 ile etkileşen öldürücü
Bim: Bcl-2 benzeri protein 11 Blk: B lenfosit kinaz
BSA: Bovin serum albümini Ca: Kalsiyum
XII CO2: Karbondioksit
COMT: Katekol-O-metiltransferaz COX: Siklooksijenaz
DJ-1: Protein deglikaz
DMEM/F12: DMEM + Ham’in F12 besiyeri DMEM: Dulbecco’nun modifiye eagle besiyeri DMSO: Dimetil sülfoksit
DNA: Deoksiribonükleik asit
ECCAC: Avrupa Hücre Kültürü Koleksiyonu EDTA: Etilendiamintetrasetik asit
FasL: Apoptoz uyarıcı fragman ligand FasR: Apoptoz uyarıcı fragman reseptör FBS: Fetal Bovin Serum
ICAD: CAD inhibitörü IFN: İnterferon
L-DOPA: L-3,4-dihidroxifenilalanin LRRK2: Lösin-zengin tekrar kinazı 2 MAO: Monoamin oksidaz
MAO: Monoamin oksidaz
MEM/F12: MEM + Ham’in F12 besiyeri MEM: Minimum esansiyel besiyeri Mg: Magnezyum
XIII mM: Milimolar
MN9D: Embriyonik ventral mezensefalik ve nöroblastoma hücre hattı MPP+: 1-metil-4-fenilpiridinyum
MPTP: 1-metil-4-phenil-1,2,3,6-tetrahidropiridin
MTT: (3-(4,5-Dimetiltiazol-2-yl)-2,5-Difeniltetrazolyum Bromid) NEB: New England Biyolaboratuarları
Neuro-2a: Fare nöroblastoma hücre hattı NM23-H1: Nükleozid difosfat kinaz geni NuMa: Nükleer mitotik aparat proteini p53: tümör protein 53
PARP: Poli (ADP-riboz) polimeraz PBS: Fosfat tampon solüsyonu PC12: Feokromasitoma hücre hattı pcDNA3.1: Plazmid vektör
PH: Parkinson Hastalığı
PINK1: Fosfataz ve tensin homoloğu ile indüklenmiş kinaz 1 PVDF: Poliviniliden diflorid
RPMI 1640: Roswell Park Memorial Enstitüsü besiyeri
SDS-PAGE: Sodyum dodesil sülfat-poliakrilamid jel elektroforezi shRNA: Kısa firkete ribonükleik asit
SH-SY5Y: Nöroblastoma hücre hattı siRNA: Küçük interferans ribonükleik asit SK-N-SH: Nöroblastoma hücre hattı
XIV SNc: Substansiya nigra pars kompakta
SNCA: Sinüklein alfa
TEMED: Tetrametiletilendiamin TNF: Tümör Nekroz Faktör
TNFR1: Tümör nekroz faktör reseptör 1 TQ: Timokinon
UPDRS: Birleşik parkinson hastalığı ölçüm skalası
1 1. GİRİŞ
Parkinson Hastalığı dünyada 2. en sık görülen nörodejeneratif hastalıktır (1). Çok ciddi iş gücü kaybı, yaşam kalitesi düşüşü ve ölüme sebep olup hem kişilere hem de ülke ve dünya ekonomisine çok büyük yük olmaktadır (2). Bütün yarattığı sorunlara rağmen henüz PH’ye kalıcı bir tedavi bulunamamıştır, hastalar ancak semptomatik tedavilerle yaşamlarını idame
ettirebilmektedirler. Kalıcı bir çözüm sunulabilmesi için kesin bir tedavi yöntemi veya hastalık oluşmadan önce engelleyebilecek koruyucu bir yöntem bulunması şarttır.
Timokinon önceki çalışmalarda nöronlar da dahil olmak üzere pek çok hücre tipinde koruyuculuğu gösterilmiş bir moleküldür (3,4). Türkiye’de yaygın olarak tüketilen çörekotunun tohumlarından elde edilir, bu tohumlar tarih boyunca da tıbbi tedavi amaçlı kullanılmışlardır (3). Timokinon çeşitli kanserlerin tedavisinde kaullanılabilirliği açısından da yaygın şekilde araştırma konusu olmuştur (5–8). Nöron hasarını engelleyebilmesi açısından timokinon PH’ye karşı
potansiyel koruyucu bir ajan olarak düşünülmüş, hastalık gelişme ihtimali yüksek bireylerde hastalık oluşumunu engelleyici bir ajan olarak kullanımı açısından araştırılmaya değer bulunmuştur.
Apoptoz, nöron hasarı oluşumunda etkili olabilecek pek çok mekanizmadan birisidir. Aynı zamanda vücudun fizyolojik süreçlerinde de görevli bir mekanizma olması nedeniyle fizyoloji bilimi açısından önemli bir yere sahiptir. Bağışıklık sisteminde, embriyolojik gelişim süreçlerinde, kullanılmayan organların körelmesinde görevlidir ve bütün bu süreçlerin düzenli işlemesini sağlamaktadır (9). Ancak sonuçta yıkımla ilişkili bir süreçtir ve aşırı tetiklenmesi durumunda hücre hasarıyla sonuçlanabileceği, dolayısıyla PH’de bir rolü olabileceği
düşünülmüştür.
Bu araştırma kültür ortamının hassas bir şekilde ayarlanabilmesi, uygulanacak toksik ve koruyucu maddelerin dozunun hassas bir şekilde belirlenebilmesi ve elde edilecek sonuçlar açısından daha homojen bir örnek oluşturulabilmesi açısından in vitro hücre kültürü ortamında uygulanmak üzere planlanmıştır. Hücre tipi olarak insan hücrelerine benzerliği ve dopaminerjik yolakları barındırması açısından SH-SY5Y hücreleri seçilmiş, PH modeli oluşturmak için de bu amaçla çok sık kullanılan ve güvenilirliği kanıtlanmış 6-OHDA molekülü seçilmiştir (10).
Apoptoz sürecinde pek çok protein görevlidir, bunların arasında Bcl-2 ve Bcl-xl antiapoptotik, Kaspaz-3 apoptotik proteinlerdir ve apoptozun gidişatını gözlemlemek için
2 kullanılabilirler (11). Literatürde daha önce bu 3 proteinin Western Blot çalışmasıyla,
timokinonun apoptoz üzerinden nöron koruyucu etkisini gösteren bir çalışma bulunmamaktadır. Biz bu çalışmada hem MTT tekniği ile timokinonun SH-SY5Y hücreleri üzerinde hücre
canlılığını koruyucu etkisini, hem de Western Blot tekniği ile bu etkiyi apoptotik süreçler üzerinden gerçekleştirdiğini göstermeyi amaçladık.
3 2. GENEL BİLGİLER
2.1. PARKİNSON HASTALIĞI 2.1.1. TARİHÇE
Parkinson Hastalığı (PH) ilk kez 1817 yılında James Parkinson tarafından “titreyen palsi” ismi ile tanımlanmıştır, daha sonra 19. yüzyılda Charcot, James Parkinson’a atıfta bulunarak hastalığı “Parkinson Hastalığı” diye nitelendirmiştir (12). 1919 yılında PH’nın tipik patolojisi olan substansiya nigra’daki dopaminerjik nöron kaybı gösterilmiş, Arvid Carlsson’un 1957 yılında dopaminin nörotransmitter olarak ne kadar önemli bir yeri olduğunu göstermesi de ona 2000 yılında Nobel kazandırmıştır (13). 1960’da PH’de striatumda dopamin konsantrasyonunun azaldığının gösterilmesi, levadopanın tedavide kullanılmasına olanak sağlamıştır (14). Son zamanlardaki gelişmeler ise genetik mutasyonlar, ubiquitin proteosomları, otofaji ve apoptoz gibi mekanizmalar üzerinde durmaktadır (15,16).
2.1.2. EPİDEMİYOLOJİ
PH, Alzheimer Hastalığı’ndan sonra ikinci en sık görülen nörodejeneratif hastalıktır, aynı zamanda en sık görülen nörodejeneratif hareket bozukluğudur (1). Her 1000 kişiden 1-2’sinde, 60 yaş üzerindeki nüfusun ise %1’inde görülmektedir (17). Yaş ilerledikçe PH gelişme riski de artar (18). PH’ye neden olabilen diğer risk faktörleri arasında genetik faktörler (%10-15), ağır metal maruziyeti, oksidatif stres yer alır (19). Esansiyel tremor hastalığı öyküsü PH’nin riskini de arttırır (20).
4
Şekil 1 PH'nin ülkelere göre prevelans ve insidansının yaşa göre değişimi(1).
2.1.3. PATOGENEZ
PH’nin patogenezinde asıl patoloji, Substansiya Nigra pars compacta (SNc)’da dopaminerjik nöron kaybıdır. SNc’daki nöronların %70i öldüğünde bile striatumun
kompanzasyonu nedeniyle klinik bulgular görülmeyebilir, dolayısıyla PH tanısı koyulduğunda hücrelerin çoğu ölmüş olabilir. Nöron ölümü patogenezinde dopamin metabolizması, oksidatif stres ve mitokondriyal işlev bozukluğu, endoplazmik retikulum stresi, protein yıkım
mekanizmalarının bozulması ve nöroinflamasyonun yer aldığı düşünülmektedir (21).
PH’de ikinci tipik patolojik bulgu ise Lewy cisimciklerinin varlığıdır, bunlar 5-25 µm boyutunda yoğun eozinofilik bir çekirdeği, berrak bir halesi olan intrasitoplazmik inklüzyonlardır (22). Lewy cisimcikli demans hastalığında da Lewy cisimcikleri görülür (23). Lewy cisimcikleri ubiquitin ve nörofilaman gibi PH’de marker olarak kullanılabilen proteinler içerir (24,25). PH’nin patogenezinde rol oynayan önemli genetik faktörlerden olan α-sinüklein geninin proteini de Lewy cisimcikleri içerisinde tespit edilmiştir (22).
Hem çevresel hem genetik faktörler PH gelişiminde rol oynar. Çevresel faktörler arasında herbisidler (MPTP ve MPP), pestisidler (rotenon ve paraquat), ağır metal zehirlenmeleri (demir, bakır, kurşun gibi) yer alır (26). Kafa travması ve influenza ve kızamık gibi enfeksiyonlarla PH’yi ilişkilendiren çalışmalar olsa da bu etiyolojiler tartışmalıdır (27). Diyetle yağ asidi tüketimi, kafein, nikotin alımı ve antioksidanların ise PH riskini düşürdüğü gösterilmiştir (1).
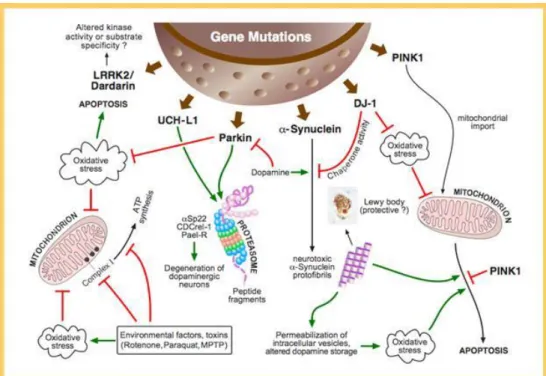
5 Ailesel PH’de genetik riski arttıran çeşitli nokta mutasyonları tespit edilmiştir: SNCA, PINK1, LRRK2, Parkin, DJ-1 gibi (21). Ailesel PH ile ilişkili bulunan ilk gen SNCA’dır ve PH’de ekspresyonunun arttığı gözlenmiştir (28). SNCA gen kopyalarının iki-üç katına çıkmasıyla α-sinüklein üretiminin artmasının PH gelişmesi için yeterli olduğu gösterilmiştir (29). PINK-1 ise SNCA’nın aksine ekspresyonu azaldığında PH’ye neden olur, PINK-1 delesyonu olan sıçanlarda yapılan çalışmalarda α-sinüklein birikimi ve PH gelişimi gösterilmiştir (30). PH hastalarında yapılan genetik analizlerde LRRK2 genindeki missense mutasyonların PH ile ilişkili olduğu bulunmuştur (31). Pluripotent kök hücrelerden elde edilen dopaminerjik nöronlarda yapılan bir çalışmada Parkin geninin işlevini bozan mutasyonların, dopaminerjik hücrelerde dopamin alımını, salımını ve MAO enzimlerini etkileyerek PH’ye yol açtığı gösterilmiştir (32).
Şekil 2 PH gelişiminde rol oynayan genetik faktörler ve etkili oldukları yolaklar(33).
2.1.4. KLİNİK
PH’de dört temel bulgu vardır: istirahat tremoru, bradikinezi, rijidite ve postür
dengesizliği. Ani gelişen ve 10 saniyeden kısa sürede geçen donmalar görülebilir, buna motor blok da denir. Donma PH için karakteristiktir ancak her vakada görülmeyebilir, en sık bacaklarda ve yürürken görülür, PH’deki düşmelerin sebeplerinden biridir (34). Primitif glabellar refleks ve
6 palmomental refleks gibi yetişkinlerde görülmemesi gereken primitif refleksler ortaya çıkabilir (35,36). Bulbar işlev bozukluğu ile yutma güçlüğü, dizartri, konuşmanın monotonlaşması ortaya çıkabilir (37). Değerlendirmede sık kullanılan ve en yerleşik skala Birleşik Parkinson Hastalığı Hastalık Değerlendirme Skalası (UPDRS)’dir (38).
PH’nin pek çok motor sistem dışı bulgusu da mevcuttur. Ortostatik hipotansiyon (39), terleme bozukluğu (40), erektil bozukluk, sfinkter bozuklukları gibi otonomik bulgular görülebilir. Demans riski PH hastalarında 6 kat artmıştır (41). Depresyon, anksiyete, apati görülebilir (42). Farmakolojik tedavi uyku sorunlarına yol açsa da PH’nin kendine ait uyku bozuklukları da mevcuttur (43). Hızlı göz hareketleri uyku davranış bozukluğu PH hastalarının üçte birinde görülür, aynı zamanda PH gelişim riskinin arttığının göstergesidir (44). Bu bozukluk şiddet içerikli rüyalara, uykuda bağırma ve şiddet içerikli tekme yumruk gibi hareketler
yapılmasına neden olur (45). Koku bozukluğu, ağrı, parestezi, akatizi gibi duysal bozukluklar da PH’ye eşlik edebilir ancak genelde çok spesifik bulgular olmadıkları için tanınmaları zordur (46).
2.1.4.1. TREMOR
İstirahat tremoru PH’nin en sık görülen ve en kolay tanınan bulgusudur. Tek taraflı görülür ve uzuvların distal kısımlarında daha belirgindir. Elde supinasyon-pronasyon hareketleri şeklinde görülür ve bir elden öbürüne yayılır. El dışında dudaklar, çene ve bacaklarda da tremor görülebilir ancak boyun, kafa ve sesi etkilemez, bu bölgede titreme olması durumunda esansiyel tremor düşünülmelidir. Titremeler uykuda ve titreyen uzvun aktivitesiyle azalır. Tremoru olan PH hastalarında ortabeyin A8 bölgesinde bir grup nöronda dejenerasyon olduğunu gösteren
çalışmalar vardır (34).
2.1.4.2. BRADİKİNEZİ
Bradikinezi hareketlerin yavaşlığı anlamına gelir ve PH’nin en karakteristik bulgusudur. Kolay tanındığı için genellikle PH’nin ilk farkedilen bulgularındandır. Bazal ganglionlarla ilgili bozuklukların tipik bulgusudur, dolayısıyla hareketlerin planlanması, başlatılması, yapılmasında bozukluk, ayrıca ardışık ve aynı anda birden fazla hareketin yapılamamasını kapsar. İlk olarak hareketlerde genel bir yavaşlama ve tepki süresinde uzama ile ortaya çıkar. Yutma bozulduğu için ağızdan salya sızması, mimiklerde, göz kırpmada ve yürürken kolları sallamada azalma da görülebilir. Tanı için hastaya ardışık hızlı hareketler yaptırılır, hareketlerde yavaşlık ve
7 hareket yapmaya zorlanırsa tepki çok hızlı verilebilir, bu duruma “kinesia paradoxica” (çelişkili hareket) denir ve PH’de motor programların sağlam olduğu ancak başlatılamadığını düşündürür (34). PH’deki dopaminerjik bozulmayla paralel gittiği için dopaminerjik sistemin durumunu en iyi gösteren bulgudur (47).
2.1.4.3. RİJİDİTE
Sertlik anlamına gelir ve pasif olarak yaptırılan hareketlere direnç görülmesi demektir. Uzuvların, gövde ve boynun hem proksimal hem distalinde görülebilir. Genelde “dişli çark” bulgusuyla beraber görülür, pasif hareketin direnci kırmasıyla aniden uzvun hareketi, hemen ardından da uzvun tekrar dirençli hale gelmesiyle hareketin aniden durması ile oluşan art arda ani hareket-ani durmaların dişli bir çarka benzeyen hareketini tarif eder (34). Rijidite bulgusu çok hafif ise hastanın pasif harekete karşı bilinçli ters hareket yaptığı Foremont manevrası ile tanınabilir (48). Boyun, dirsek ve dizlerde fleksiyon, skolyoz gibi postural deformitelere yol açabilir (49). Eklem ağrıları görülebilir, özellikle omuz ağrısı rijiditenin en erken ortaya çıkış şekillerinden biridir ancak artrit gibi diğer hastalıklarla çok karıştığından tanınması zordur (50).
2.1.4.4. POSTÜR DENGESİZLİĞİ
Diğer bulgulara göre daha geç ortaya çıkar, postural reflekslerin kaybı ile oluşur. Çekme testi ile tanı konur; hasta omuzlarından tutulup hızla arkaya çekilir, geriye iki adımdan fazla atması veya hiç bir postural refleks göstermemesi postür dengesizliğini gösterir (34). PH’de düşmelerin en sık sebebi postür dengesizliğidir, kalça kırığı riskini ciddi oranda arttırır (51). Düşmelerin sıklığı, hastalığın şiddetiyle orantılıdır (52).
2.1.5. TEDAVİ
PH tedavisinde kullanılan temel ilaç grupları L-DOPA, COMT inhibitörleri, dopamin reseptör agonistleri ve MAO-B inhibitörleridir. Bunlar arasından en yaygın kullanılan ilaç tedavisi L-DOPA’dır, ilk bulunan ve 40 yıldan fazla bir süredir en çok kullanılan PH ilacıdır. Kan-beyin bariyerini geçtikten sonra beyinde dopamine dönüşerek etki gösterir ve etkisini arttırmak, yan etkileri de azaltmak amacıyla karbidopa gibi kan beyin bariyerini geçemeyen dopa dekarboksilaz inhibitörleriyle beraber kullanılır (53,54). Bir COMT inhibitörü olan tolkapon ise dopaminin yıkılmasında görevli COMT enzimini inhibe ederek dopaminin etkinliğini arttırır (55). Bromokriptin ve pergolid gibi dopamin reseptör agonistleri ise doğrudan dopaminin uyardığı reseptörler üzerinden dopaminerjik etki ile PH semptomlarını geriletebilirler (56). Selejelin gibi
8 MAO-B inhibitörleri ise dopaminin geri alımını sağlayan MAO-B enzimini baskılayarak
dopaminin sinaptik aralıkta daha uzun süre kalmasını, dolayısıyla etkisinin artmasını sağlarlar (57).
L-DOPA tedavisinin bulunmasından sonra cerrahi tedavilerin kullanımı azalmış olsa da ilaç tedavisine yanıt vermeyen vakalarda hala kullanılmaktadırlar ve gelişen cerrahi teknikler ile geçerlilikleri artmaktadır (58). Cerrahi tedavilerden biri fazla aktive bir beyin bölgesinin
hasarlanmasıdır ve çoğunlukla yapılan ameliyat globus pallidusun hasarlandığı palliodotomi işlemidir, tremorları azaltmak için yapılır (59). En sık yapılan cerrahi işlem ise derin beyin stimülasyonudur, bu işlemde cerrahi olarak beyin dokusu içerisine bir elektriksel stimülatör yerleştirilir ve istenilen beyin bölgelerinin uyarılması sağlanır (60).
Var olan tedaviler sınırlı olduğu ve kalıcı bir tedavisi olmadığı için PH’de yalnızca semptomatik tedavi uygulanabilmekte, dolayısıyla hasta memnuniyeti ve uyumu düşük kalmaktadır, dolayısıyla yeni tedavi yöntemleri, bunların yanısıra da koruyucu yöntemlerin araştırılmasına eğilmek gerekmektedir (61).
Egzersizin PH riskini azalttığını gösteren pek çok prospektif insan çalışması bulunduğu gibi (62), tedavide işe yarayabileceğini gösteren çalışmalar da vardır (63,64). Nikotin ve kafein de PH gelişme riskini azaltan koruyucu maddeler arasında yer almaktadır (65,66). Çeşitli yollarla alınan D vitaminin antioksidan ve antiinflamatuar etkiyle PH riskini azalttığını gösteren
çalışmalar yapılmıştır (67). Pek çok antioksidan maddenin PH’de koruyucu etki gösterebileceğine yönelik çalışmalar yapılmaktadır, bu çalışmaların hepsi olumlu sonuç vermese de araştırmaya değer pek çok antioksidan madde tespit edilmiştir (68–70).
2.2. TİMOKİNON
Diğer İsimleri: 2-Izopropil-5-metil-1,4-benzokinon. Timol. p-Menta-3,6-dien-2,5-dion Sistematik ismi: 2-Metil-5-(1-metiletil)-2,5-sikloheksadien-1,4-dion
9 Kaynağı: Çörek otu 26.8–54.8%
Şekil 3 a:Timokinonun içinde bulunduğu çörekotu bitkisinin tohumları. b:Timokinonun kimyasal yapısnın şematik görüntüsü (71) .
Çörekotu (Nigella Sativa) tohumları Türkiye’de poğaça börek tarzı hamur işlerinde ve başka pek çok gıdada yaygın olarak tüketilen, Türk kültüründe önemli bir yeri olan bir bitkidir. Geçtiğimiz yıllarda pek çok bitkisel kökenli ilaç, tedavilerde kullanılmaya başlanmıştır, tarih boyunca da pek çok kaynak bitkisel tedavilerin tıp alanında kullanıldığını göstermektedir (3). Nigella Sativa, Ranunculacea ailesine ait pek çok farmakolojik özelliği olan bir bitkidir ve tohumlarından elde edilen yağın içinde en çok bulunan etkin madde timokinondur (TQ) (72). Nigella Sativa tarih boyunca Hintliler, Araplar ve Asya ülkeleri tarafından pek çok hastalığın tedavisinde kullanılmıştır (73).
TQ’nun kan şekeri, lipid düzeyleri üzerine etkileri ve bronş genişletici etkileri
bulunmaktadır (72). Beyin, meme, akciğer, böbrek gibi pek bölgenin kanserlerinde ilerlemeyi veya metastazı azaltan etkileri olduğunu gösteren çalışmalar vardır (5–8). TNF-α, COX enzimleri, IFN-γ ve interlökinler üzerinden antiinflamatuar etkileri pankreatik duktal
adenokarsinom hücrelerinde gösterilmiştir (74). Sıçanlarla yapılan bir deney tek enjeksiyonda sisplatin toksisitesine karşı böbreği koruduğunu göstermiştir (75). Farelerde antikanser ilaçlarla yapılan deneylerde, bu ilaçların toksik etkisine karşı karaciğerde doza bağımlı koruyucu etkisi olduğu görülmüştür (76). Timokinonun en önde gelen koruyucu etkilerinden biri antioksidan etkisidir, serbest radikalleri toplayarak hücreleri oksidatif hasara karşı korumaktadır (77,78). Timokinon vüdutta metabolize olduğunda dihidrotimokinona dönüşür, dihidrotimokinon timokinondan daha güçlü bir antioksidandır (76). Genetik mutasyonlar üzerine etkisi ise
10 tartışmalıdır, hem mutajenik hem antimutajenik etkileri olduğunu gösteren çalışmalar vardır (79,80).
TQ’nun nöroprotektif ve nöromodülatör etkileri olduğunu gösteren pek çok çalışma bulunmaktadır (3,4). TQ mikroglia hücrelerinden antioksidan maddelerin salımını arttırarak antioksidan ve nöroprotektif etki gösterirken (81), aktive mikroglialardan salınan süper oksit, hidrojen peroksit gibi serbest oksijen radikallerinin de miktarını azaltır (82). Hayvanlardaki PH modellerinde de TQ’nun nöroprotektif ve antioksidan etkileri gösterilebilmiştir (83,84).
Alzheimer Hastalığı modelinde amiloid beta’nın apoptotik etkisini baskılayarak nöroprotektif etki göstermiştir (85). Bir kemoterapötik olan sisplatinin oluşturduğu periferik nöron hasarına karşı koruyucu etkisi gösterilmiştir (86). Arsenik toksisitesiyle oluşan anksiyete ve nörodejenerasyonu da anti-inflamatuar ve antioksidan etkisiyle azalttığı gösterilmiştir (87).
Nöroprotektif etkide apoptozun da önemli bir rolü vardır (4). TQ’nun antinflamatuar ve apoptozu baskılayıcı etkilerini gösteren çalışmalar bulunmaktadır (88,89). Kanser hücrelerine etkisi olduğu gösterilen çalışmalarda ise apoptozu uyardığı gözlenmiştir (90,91).
2.3. PARKİNSON HASTALIĞI HÜCRE KÜLTÜRÜ MODELİ
PH’nin tedavisinde etkin yöntemlerin bulunması için, üzerinde deney yapmak amacıyla PH modeli oluşturulabilecek hücre modelleri kullanılması şarttır. İnsan dopaminerjik hücrelerini elde etmek ve yaşatmak zor olduğu için bu hücrelerin yerini alabilecek hazır hücre hatları
kullanılmaktadır. Bu amaçla en çok kullanılan hücre hattı SH-SY5Y nöroblastoma hücre hattıdır. Kullanılan diğer hücreler arasında kemirgenlerden alınan mezensefalik primer kültür hücreleri, primer nöronlar, kök hücreler ve PC12, Neuro-2a, MN9D hücre hatları sayılabilir (92). Primer kültürler fizyolojik olarak orjinaline daha yakın olsalar da bakımları zordur, ölümsüz olmazlar ve diseksiyon yerine bağlı olarak örnekler farklılık gösterebilirler (93).
2.3.1. SH-SY5Y HÜCRE HATTI
SH-SY5Y hücre hattı SK-N-SH hücre hattının bir alt hattıdır, SK-N-SH hattı 1970’de metastatik nöroblastomu olan 4 yaşında bir kız hastanın biyopsisinden elde edilmiştir. SH-SY5Y hücre hattı hem tirozin-hidroksilaz hem de dopamin-β-hidroksilaz aktivitesine sahip olduğundan hem dopamin hem noradrenalin sentez kapasitesine sahiptir (94). Kanser hücreleri olduklarından dolayı bir takım genetik anormallikler gösterebilirler ama dopaminerjik yolaklar çoğunlukla
11 korunmuştur. Dolayısıyla PH modeli olarak çok sık kullanılmalarına rağmen, aslında saf
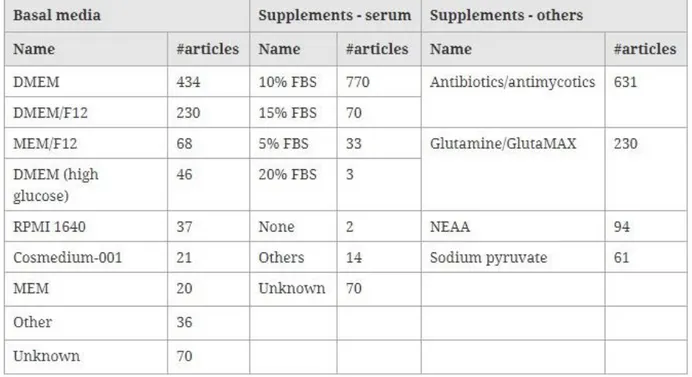
dopaminerjik nöronlar değillerdir, ancak PH modeli için hala en uygun hücre tipidir (95). SH-SY5Y hücrelerini yetiştirmek için ATCC ve ECCAC gibi üretici firmaları daha çok MEM/F12 besiyerini önerseler de en çok kullanılan besiyeri DMEM ve DMEM/F12’dir. Bunu MEM/F12, DMEM (high clucose) ve RPMI 1640 besiyerleri takip eder, ek olarak pek çok protokol besiyerine FBS (fetal bovin serum), glutamin ve antibiyotik eklenmesini önermektedir (Şekil 4) (92). FBS; büyüme faktörleri, hormonlar, amino asitler ve lipidler içermektedir, dolayısıyla besiyerine eklenip eklenmemesi, eklenirse miktarı ve tipi önemlidir (96).
Şekil 4 Kullanım sıklıklarına göre besiyerleri (92)
SH-SY5Y hücreleri sadece PH değil, Alzheimer Hastalığı, nörotoksisite, iskemi ve Amyotrofik Lateralizan Skleroz Hastalığı modeli oluşturmakta da kullanılmaktadır (97,98). Belli bir amaçla kullanılmak üzere SH-SY5Y hücreleri çeşitli işlemlerle özelleştirilebilir, örneğin en sık kullanılan yöntem retinoik asit kullanılarak hücrelerin dopaminerjik ve nöronal özelliklerini kuvvetlendirmektir, ancak çoğu çalışma herhangi bir özelleştirme yöntemi kullanmamaktadır (99).
2.3.2. PH MODELİ OLUŞTURMA YÖNTEMLERİ
PH modeli oluşturmak için uygun hücrelerin üzerine nörotoksik maddeler eklenmelidir, bunun için kullanılabilecek nörotoksik maddeler arasında 6-hidroksidopamin (6-OHDA), MPP
12 (1‐methyl‐4‐phenylpyridinium) , rotenon ve paraquat sayılabilir (100,101). Bu kimyasallar hücredeki bir çok yolağı etkileyerek mitokondriyal işlev bozukluğuna ve serbest oksijen
radikallerinin artışıyla oksidatif strese neden olurlar, bu şekilde hücrelerde PH benzeri bir patoloji oluşmasını sağlarlar (102–104). İkinci bir yöntem de bazı genlerin silinmesi veya aşırı
ekpresyonu ile PH oluşturulmasıdır, delesyon için siRNA veya shRNA, aşırı ekspresyonda gereken genlerin DNA’ya yerleştirilmesi için ise pcDNA3.1 gibi vektörler kullanılmaktadır (92).
6-OHDA nöron hasarı yaptığı için PH modeli oluşturulmasında kullanılmaktadır ve bu amaçla kullanılabildiği keşfedilen ilk moleküldür (105,106). Hem hayvan hem de hücre kültürü çalışmaları, bu hasarın apoptotik yolaklar üzerinden oluştuğu lehine bulgular sunmaktadır (107,108).
2.4. APOPTOZ
2.4.1. GENEL BİLGİ VE TARİHÇE
Apoptoz terimi ilk kez Kerr, Wylie ve Currie tarafından 1972 yılında kullanılmıştır ve morfolojik olarak farklı bir hücre ölümü tipini tarif eder (109). Apoptoz programlanmış hücre ölümüdür, ölümüne genetikle karar verilmiş hücrelerin intiharıdır. Apoptoz büyüme ve yaşlanma sırasında dokulardaki hücre sayısını koruyan homeostatik mekanizmalarda rol alır. Bağışıklık sistemi aracılığıyla veya bir hücre hastalık ve zararlı ajanlar gibi dış etkenlerle zarar gördüğünde bir savunma mekanizması olarak çalışır. Fas ve TNF reseptörü taşıyan bazı hücreler bu
reseptörlere ligand bağlanması yoluyla apoptoza gidebilirken, bazı hücreler ise bir hormon ya da büyüme faktörü bağlanmadığı sürece kendiliğinden apoptoza girmeye meyillidirler. Radyasyon, antikanser ilaçlar, hipoksi gibi faktörler dozlarına bağlı olarak apoptozu tetikleyebilir veya tetiklemeyebilir ve hatta çok yüksek dozlarda apoptoz yerine nekroz oluşmasına da sebep olabilirler (9).
2.4.2. MORFOLOJİ
Morfolojik olarak apoptozun erken döneminde hücrede küçülme ve piknoz görülür. Dolayısıyla hem çekirdek hem sitoplazmadaki sıkışmış organeller iki bölgenin de koyu renkli görülmesine neden olur. Ardından hücre zarı bazı bölgelerden dışarı bombeleşir ve apoptotik
13 cisimler olarak hücreden ayrılır. Apoptotik cisimler yoğun organel kümeleri ve bazen hücre çekirdeği parçaları içerirler ve hücre zarıyla kaplıdırlar. Apoptotik cisimler oluştuktan çok kısa bir zaman sonra makrofajlar tarafından fagositoz ile temizlenip fagolizozomlar içerisinde
yıkılırlar. Bu sebeple ve apoptotik hücreler hücre içeriklerini interstisyel aralığa boşaltmadıkları, çevre hücreler de anti inflamatuar sitokinler salgılamadıkları için inflamasyonla ilgili hiç bir morfolojik değişiklik oluşmaz (9).
2.4.3. MEKANİZMA
Apoptoz mekanizması 3 yolak üzerinden çalışır; ekstrensek yolak (ölüm reseptörü yolağı), intrensek yolak (mitokondriyal yolak) ve perforin-granzim yolağı. Perforin-granzim yolağı granzim A veya granzim B enzimleri üzerinden apoptozu tetikleyebilir. Ekstrensek, intrensek ve granzim B yolaklarının hepsi Kaspaz-3 yarıklanmasıyla başlayan bir yolağı aktive ederler. Granzim A ise kaspazdan bağımsız paralel bir yolak ile tek zincirli DNA hasarı
üzerinden hücre ölümüne neden olur. Kaspaz enzimleri vücutta proenzim formunda bulunur. Aktive oldukları zaman bir proteaz kaskadını başlatırlar, bu kaskat apoptotik sinyalin
güçlenmesine ve sonunda hızla hücre ölümüne sebep olur. Protein çapraz bağlanması da
apoptozun önemli bir özelliğidir ve doku transglutaminazı ile oluşturulur. DNA’nın parçalanması Ca ve Mg bağımlı endonükleazlarla sağlanır. Apoptotik cisimlerin fagositozu normalde hücre zarı iç yüzünde yer alan fosfatidilserinin dış yüzeye çıkması, annexin I ve kalretikulin gibi proteinlerin zar yüzeyinde eksprese olması aracılığıyla sağlanır (9).
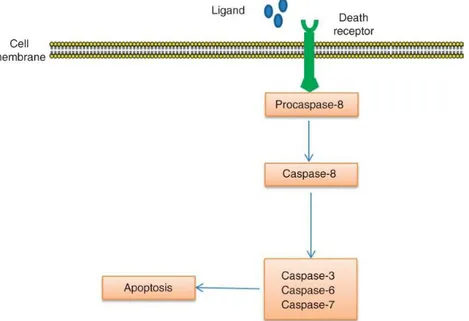
2.4.3.1. EKSTRENSEK YOLAK
Ekstrensek yolak; TNF reseptör ailesinden transmembran ölüm reseptörleri aracılığı ile tetiklenir. En bilinen ligand/reseptör kombinasyonları FasL/FasR, TNF-α/TNFR1, Apo3L/DR3, Apo2L/DR4 ve Apo2L/DR5’dir. Ligand reseptörüne bağlandığında reseptörler adaptör
proteinleri kullanarak prokaspaz-8’i bağlar. Reseptör, adaptör protein ve prokaspaz-8’in birleşmesi ile ölüm uyarıcı sinyal kompleksi oluşur. Ölüm uyarıcı sinyal kompleksi prokaspaz-8’in kendini yıkarak aktive olmasını sağlar. Aktive olmuş kaspaz-8 Kaspaz-3’ün aktive olmasını sağlar böylece apoptoz tetiklenmiş olur (9).
14
Şekil 5 Kaspaz-3'ün ektstrensek yolağının basamakları
2.4.3.2. PERFORİN/GRANZİM YOLAĞI
Perforin/granzim yolağı; CD8+ T lenfositleri aracılığıyla oluşur (bu hücreler ekstrensek yol üzerinden de apoptozu tetikleyebilir.) Tümör hücreleri veya virüsle enfekte hücrelerle
karşılaşan T hücreleri perforin isminde bir transmembran proteini ile membranda delikler açarlar ve bu deliklerden içeri granzim A ve B içeren granüller boşaltırlar. Granzim A ve B birer serin proteaz enzimidirler. Granzim B prokaspaz-10’u kaspaz-10’a dönüştürür, kaspaz-10 da kaspaz 3 oluşumu ile apoptozu tetikler. Granzim B Kaspaz-3’ü doğrudan da uyarabilir. Granzim B aynı zamanda Bid proteinini aktifleyip sitokrom c salınmasına yol açarak mitokondriyal yolak üzerinden de apoptozu tetikleyebilir. Granzim A ise bir DNAse enzimini (DNAse NM23-H1) baskılayan SET kompleksini yıkarak, bu enzimin aktivasyonuna, dolayısıyla DNA’nın parçalanmasına neden olarak apoptoza katkı yapar (9).
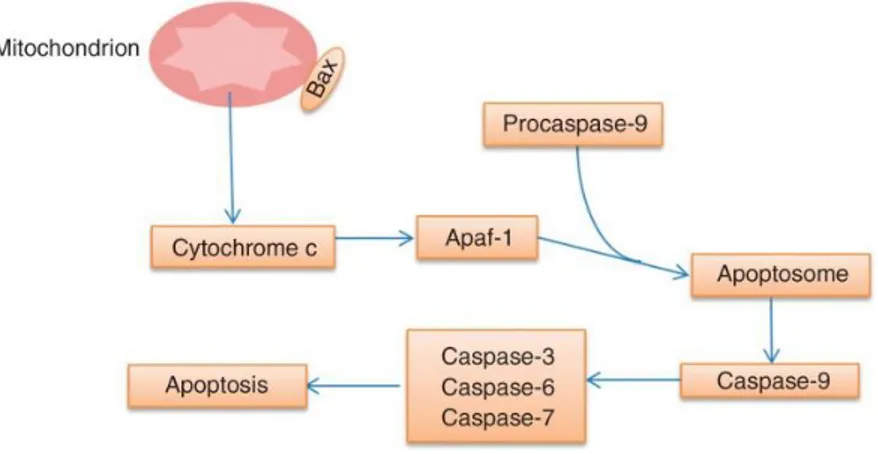
2.4.3.3. İNTRENSEK YOLAK
İntrensek yolak; mitokondri tarafından başlatılan bir takım hücre içi sinyallerin, hücre içindeki belli hedeflere ulaşmasıyla apoptoza neden olur. Mitokondrinin bu sinyalleri
oluşturmasını sağlayan negatif ve pozitif uyaranlar vardır. Negatif uyaranlar ölüm programlarını baskılayan hormon ve sitokin gibi bazı maddelerin ortadan kalkmasıyla apoptozu uyarır. Pozitif uyaranlar ise virüsler, radyasyon, serbest radikaller gibi zarar verici etkenlerdir. Tüm bu
uyaranlar iç mitokondri zarındaki porların açılmasına, zar potansiyelinin kaybolmasına ve apoptozu uyarıcı iki protein grubunun sitozole salınmasına neden olur. İlk grup içinde sitokrom
15 c’nin bulunduğu bir grup proteinden oluşur. Sitokrom c, Apaf-1 ve prokaspaz-9’a bağlanarak bir apoptozom oluştururlar. Bu kompleksin oluşması prokaspaz-9’un kaspaz-9’a dönüşmesine neden olur. Kaspaz-9 da Kaspaz-3’ü aktive ederek apoptozu tetikler. İkinci grup proteinler ise hücre çekirdeğine girerek çeşitli aşamalarda DNA’nın parçalanmasına neden olurlar (9).
Şekil 6 Kaspaz-3'ün intrensek yolağının basamakları(84).
Bu apoptotik mitokondriyal olaylar Bcl-2 (B-cell lymphoma 2) protein ailesi üzerinden gerçekleşir. 2 ailesinde 25 gen vardır ve bunların bir kısmı apoptozu engelleyici (2, Bcl-x, Bcl-xl, Bcl-xs, Bcl-w, BAG) bir kısmı da apoptozu uyarıcıdır (Bcl-10, BaBcl-x, Bak, Bid, Bad, Bim, Bik, Blk). Bcl-2 protein ailesini düzenlemede de tümör baskılayıcı gen p53’ün önemli bir düzenleyici rolü vardır. p53 apoptoz uyarıcı bir protein olan Bax’ı uyarır, kendisi de apoptoz engelleyici bir protein olan Bcl-2 tarafından baskılanır. Bcl-2 ailesinin asıl mekanizmasının mitokondriyal zar geçirgenliğini etkileyerek sitokrom c salımını kontrol etmesi olduğu düşünülmektedir (110).
2.4.3.4. ORTAK YOL
Uygulama yolağıdır; granzim A hariç tüm yolaklar bu son yolakta birleşirler. Bu noktada başlatıcı kaspazlar (kaspaz-2, -8, -9, -10) Kaspaz-3’ü aktive ederek uygulayıcı kaspazların (Kaspaz-3, -6, -7) aktive olmasına yol açarlar böylece uygulama yolağı başlatılmış olur. Uygulayıcı kaspazlar daha sonra sitokeratinler, PARP, membran iskelet proteini alfa fodrin, çekirdek proteini NuMa gibi pek çok substratı kırparak apoptozun biyokimyasal ve morfolojik değişikliklerinin ortaya çıkmasını sağlarlar. Kaspaz-3 bu yolağın en önemli enzimidir, CAD’ı kırparak inhibitörü olan ICAD’den ayrılmasını sağlar, aktive CAD da kromozomal DNA’yı yıkarak kromatin kondansasyonuna yol açar. Kaspaz-3 aynı zamanda Gelsolin’in aktive olmasını
16 sağlar, gelsolin de aktin filamanlarının yıkılmasını sağlayarak hücre iskeletini parçalar.
Apoptozun son aşaması olan fagositoz fosfatidilserinin yüzeye çıkmasıyla tetiklenir, bunun da Fas, Kaspaz-3 ve kaspaz-8’in aminofosfolipid translokaz aktivitesini bozması nedeniyle olduğu düşünülmektedir (9).
PH’da SNc’de yaşlanma ile oluşan nöron kaybından daha hızlı bir nöron kaybı görülür. Daha önce insan beyni ile yapılan çalışmalarda bu nöron kaybının birden fazla mekanizmayla ortaya çıktığı ve nedeninin apoptoz ve otofaji olabileceği gösterilmiştir (15).
17 3.GEREÇ VE YÖNTEM
Kullanılan cihazlar: • Buzdolabı (-20ºC) (Bosch)
• Buzdolabı (-80ºC) (Sanyo MDF – U3086S) • Distile su makinesi (Human power I) • Donduma kabı (Mr. Freezer)
• Elektrikli pipet (IBS integra pipetboy comfort) • Isıtıcılı su sirkülatör cihazı (MAY WBC3044 – PR) • Işık mikroskobu (Olympus CK2)
• Jel dökme aparatı, transfer modülü ve güç kaynağı(Bio-rad) • Karbondioksit inkübatörü (Thermo HERAcell vios 160i) • Kırık buz makinesi (Brema GB903A – IF90)
• Kızılötesi görüntüleme sistemi (Li-cor, Odyssey) • Laminar Hava Kabini Class II (Nuaire Tip A2) • Mikroplaka okuyucu (Thermo Multiskan GO) • Orbital Karıştırıcılar (Boeka) (IKA)
• Otoklav (Nüve OT40L) • Pipet (Thermo)
• Santrifüj cihazı (Thermo SL16R)
• Soğutuculu santrifüj cihazı (Sigma 3K30) • Toma lamı (Brightline)
• Vorteks (Biosan V – 1)
Kullanılan kimyasal maddeler: • 6-Hidroksi Dopamin (Sigma)
• Akrilamid/bisakrilamid çözeltisi (Sigma) • Amonyum persulfat çözeltisi (Sigma) • Amonyum persülfat (Sigma)
• Antikorlar (anti-bax, anti-Bcl-2, anti-bcl-xl, anti-Kaspaz-3, anti-β-aktin) (Cell Signaling) • DMEM-F12 besiyeri (Gibco)
18 • FBS (fetal sığır serumu) (Biowest)
• Glisin (Sigma)
• Halt Proteaz inhibitor kokteyli (Pierce) • IRDye 680LT Goat anti-Rabbit (Li-cor) • IRDye 800CW Goat anti- Mouse (Li-cor) • L-glutamin (Gibco)
• MTT (3-[4,5-Dimetiltiazol-2-il]-2,5-difeniltetrazolium bromid; Tiazolil blue formazan) (Sigma) • Odyssey bloklama tamponu (PBS) (Li-cor)
• PBS (Fosfat Tampon Solüsyonu) (Gibco) • Prosieve EX Transfer tamponu (Lonza) • Prosieve EX yürütme tamponu (Lonza) • Sodyum dodesil sülfat (Sigma)
• Sodyum orthovanadat (NEB) • Streptomisin ve Penisilin (Gibco)
• TEMED (1,2-Bis(dimetilamino) etan) (Sigma) • Timokinon (Sigma)
• Tripan mavisi %0.5 (Gibco) • Tripsin (Sigma)
• Triz baz (Sigma)
• Trizma hidroklorik çözeltisi (Sigma) • Tween 20 (Sigma)
• Yükleme tamponu (Cell Signaling)
3.1. HÜCRE KÜLTÜRÜNDE KULLANILAN YÖNTEMLER 3.1.1. HÜCRELERİN ÇOĞALTILMASI
Çalışmada laboratuarımızda bulunan insan SH-SY5Y nöroblastoma hücre serileri (ATCC) kullanıldı. %88 (DMEM/F12), %10 fetal sığır serumu (FBS), %1 2mM L-glutamin ve %1
100U/ml penisilin ve streptomisinden oluşan besi yeri 6 ml T25 kültür kaplarına koyuldu. Hücreler -80ºC’den çıkarılıp 37ºC’ye ısıtıldı, üzerine besi yeri eklenip santrifüj edilerek DMSO uzaklaştırıldı, ardından hücreler 1 ml besiyeri ile karıştırılıp içinde 6 ml besiyeri olan T25 kültür kaplarına ekilip %5 CO2 ve 37ºC’de CO2 inkübatöründe inkübe edilerek çoğaltıldı.
19 3.1.2. HÜCRELERİN PASAJLANMASI
Hücreler 2 günde bir yeni T25 kültür kaplarına pasajlandı. Pasajlamada kullanılacak besiyeri, tripsin ve fosfat tampon solüsyonu (PBS) işlemden önce sıvı ısıtıcı ile 37ºC’ye ısıtıldı. Kültür kaplarındaki besiyeri boşatıldı, 2 ml PBS hücrelerin yapışmış olduğu yüzeylere
çarptırılmadan kültür kabına eklenerek kap yıkandı. 1 dakika sonra PBS boşaltılıp kültür kaplarına 1 ml tripsin eklenerek 2 dakika beklendi. Hücrelerin kalktığı ışık mikroskobuyla gözlendikten sonra kültür kaplarına 2 ml besiyeri eklendi. Hücre, tripsin ve besiyerinden oluşan karışım 15 ml’lik tüplere pipet ile toplandı, 1500 devir/dakikada 5 dakika santrifüje koyuldu. Üstte kalan sıvı atıldı, kalan hücre tortusu üzerine 1 ml besiyeri eklendi, pipetle çek-bırak yapılarak karıştırıldıktan sonra uygun sayıda kültür kabına eşit paylaştırılarak ekildi. Kültür kapları artı şeklinde hafifçe sallanarak hücrelerin dağılması sağlandı. %5 CO2 ve 37ºC’deki inkübatöre kaldırıldı.
3.1.3. HÜCRELERİN SAYILMASI
96 veya 6 kuyucuklu kültür kaplarına ekilmeden önce hücreler her kuyuda istenen sayıda olmaları amacıyla sayıldı. Kültür kaplarındaki besiyeri boşatıldı, 2 ml PBS hücrelerin yapışmış olduğu yüzeylere çarptırılmadan kültür kabına eklenerek kap yıkandı. 1 dakika sonra PBS boşaltılıp kültür kaplarına 1 ml tripsin eklenerek 2 dakika beklendi. Hücrelerin kalktığı ışık mikroskobuyla gözlendikten sonra kültür kaplarına 2 ml besiyeri eklendi. Hücre, tripsin ve besiyerinden oluşan karışım 15 ml’lik tüplere pipet ile toplandı, 1500 devir/dakikada 5 dakika santrifüje koyuldu. Üstte kalan sıvı atıldı, kalan hücre tortusu üzerine 1 ml besiyeri eklendi, pipetle çek-bırak yapılarak karıştırıldı. Pipetle 10 µl örnek alınıp 10 µl tripan mavisi ile karıştırıldı. Elde edilen karışım 5x5’lik toma lamına yerleştirilip mikroskop ile 5 orta boy kare sayıldı. Elde edilen sayılar toplanıp 100000 ile çarpılarak 1 ml içerisindeki toplam hücre sayısı belirlendi.
3.1.4. HÜCRELERİN TOPLANMASI
Hücre kapları buz üzerine alınıp besiyeri pipetle uzaklaştırıldıktan sonra her kuyucuğa 1 ml soğuk PBS eklendi. PBS 10 kere çek bırak yapılarak hücreler yüzeyden ayrıldıktan sonra her kuyucuk için ayrı bir kaba alındı. Kaplar +4ºC’de 10000 devir/dakika santrifüjlenerek üstte kalan sıvı atıldı. Kültür kapları PBS ile yıkanıp ilk seferki kaplara alınarak santrifüjleme işlemi iki kere
20 daha tekrarlandı. Üçüncü işlemden sonra sıvı atılıp tekrar santrifüj edilip üzerindeki sıvı pipetle çekilerek hiç sıvı kalmaması sağlandıktan sonra lizatlama işlemine kadar -80ºC’de bekletildi. 3.1.5. HÜCRELERİN LİZATLANMASI
Lizis tamponu hazırlandı (1 M Tris (pH 7.5), 0.5 M EDTA, NP-40, Distile su, Halt Proteaz inhibitor kokteyli, 100 mM sodyum orthovanadat (NEB pH 10)). Hücreler buz üzerinde 30 dakika çözdürüldükten sonra her kaba 80µl soğuk lizis tamponu eklendi. Hücre kapları 30 dakika boyunca her 5 dakikada bir sırasıyla 20, 10 ve 5 saniye vortekslenerek buzda bekletildi. 30 dakika sonunda +4ºC’de 14000 devir/dakikada santrifüjlendi. Üstte kalan sıvı protein tayini için kullanılmak üzere -80 ºC’de saklandı.
3.1.6. HÜCRELERİN DONDURULMASI
Üretim sırasında elde edilen fazla hücreler ileri aşamalarda kullanılmak üzere -80ºC’de donduruldu. Kültür kabındaki besiyeri pipetlenerek uzaklaştırıldı. Hücreler serumdan
arındırılmak için PBS ile yıkandı. PBS pipetlenerek uzaklaştırıldı. Kültür kabına tripsin eklenip 2 dakika hücrelerin kalkması beklendi. Hücrelerin kalktığı gözlendikten sonra tripsin hacminin en iki katı besiyeri ortama eklendi. Hücreler pipetlenerek tek hücre süspansiyonu haline getirildi ve 15 ml tüpe aktarıldı. Hücre süspansiyonu 1500 rpm’de 5 dakika santrifüjlendi. Üstte kalan sıvı uzaklaştırılıp dipteki tortu 1 ml besiyerinde sulandırılıp üstte belirtilen yönemle sayıldı. 1 ml hücre süspansiyonu dondurma tüpü içerisine koyulup, üzerine 1 ml dondurma besiyeri (%80 FBS + %20 DMSO) eklendi. Tüpler dondurma kabına yerleştirildi, kap da -80ºC buzdolabına
kaldırıldı. 24 saat sonra donmuş hücreler bir saklama kabına aktarılıp dondurma kabı tekrar kullanım için kaldırıldı.
3.2. PROTEİN ANALİZİNDE KULLANILMIŞ YÖNTEMLER 3.2.1. PROTEİN MİKTAR TAYİNİ
Protein miktar tayininin belirlenmesi için BCA Protein Assay Kiti kullanıldı. Miktar tayini yapılmış olan örneklerden 5 µl alınarak önce lizis tamponu ile 25 µl’ye tamamlandı (1:5 seyreltme). Ardından üzerine BCA içeren çalışma çözeltisi 200 µl eklendi. Aynı işlemler standart eğri grafiği çizmek üzere farklı konsantrasyonlarda hazırlanmış olan sığır serum albümini (BSA) için de yapılmış ve karışım 37°C’de 30 dakika inkübe edilerek oluşan rengin absorbansı ölçüldü. Ölçüm 562 nm dalga boyunda mikroplaka okuyucuda yapıldı. Bilinen BSA
21 konsantrasyonlarına karşı okunan absorbans değerleri kullanılarak çizilen standart eğri grafiği yardımıyla örneklerdeki protein miktarı tayin edildi.
3.2.2. WESTERN BLOT YÖNTEMİ
SDS-PAGE ile jel üzerinde proteinlerine ayrılan örnekler poliviniliden difluorid (PVDF) membrana transfer edilmek üzere transfer tankına alındı. Transfer işlemi +4°C’de 200 mA’de 1.5 saat yapıldı. Transfer sonrasında membran 1X yıkama tamponu ile 10 dakika çalkalayıcıda yıkandı. Membran 2 saat boyunca içinde bloklama tamponu bulunan kap içinde çalkalayıcıda bekletildi. Daha sonra membran primer antikorları (bax, bcl-2, Bcl-xl ve Kaspaz-3 antikorları) içeren solüsyonlarda bir gece boyunca +4°C’de çalkalayıcıda bekletildi. Membran 3 kez 10’ar dakika 1X yıkama tamponu ile yıkandı. Yıkama sonrasında anti β-aktin ile 1 saat oda
sıcaklığında membran bekletildi. Tekrar 3 kez 10’ar dakika 1X yıkama tamponu ile yıkandı. Kızılotesi boya ile işaretli sekonder antikor ile 1 saat boyunca oda sıcaklığında karanlıkta bekletildi. Membran 6 kez 10’ar dakika 1X yıkama tamponu ile yıkandı. Oda sıcaklığında kurutularak membran üzerindeki proteinlere ait bantlar kızılötesi görüntüleme sisteminde görüntülendi. İlgili proteinlere ait bantlar dansitometrik olarak 3 farklı programla (Imagej, Fiji, Image Studio Lite) değerlendirildi ve referans proteine oranlanıp sayısal olarak ifade edildi.
3.3. HÜCRE CANLILIĞI VE WESTERN BLOT ANALİZLERİ
3.3.1. MTT HÜCRE CANLILIĞI TESTİ İLE 6-OHDA DOZ VE SÜRE YANITLARININ BELİRLENMESİ
Timokinon dozunun belirlenmesi için yapılacak hücre canlılığı testinde kullanılacak 6-OHDA’nın doz ve süresinin belirlenmesi için 6 grup oluşturuldu. 3 farklı 96 well plate’e 6 grubun hepsi eklenerek her bir plate 6, 12, 24 saatlik farklı sürelerde bekletildi:
• Kontrol (Sadece hücre) • Hücre + 1 µM 6-OHDA • Hücre + 10 µM 6-OHDA • Hücre + 100 µM 6-OHDA • Hücre + 500 µM 6-OHDA • Hücre + 1000 µM 6-OHDA
22 SH-SY5Y hücreleri 3 tane 96 well plate’e, her plate’de grup başına 5 kuyucuk olacak şekilde (plate başına 30 kuyucuk) ve her kuyucukta 100 µl besiyeri içerisinde 5000 hücre olacak şekilde ekildi, hücrelerin plate’e yapışmaları için 37º CO2 inkübatöründe 24 saat bekletildi. 2, 20, 200, 1000 ve 2000 µM konsantrasyonlarda 6-OHDA hazırlandı. Kontrol grubu kuyucuklarına 100 µl sadece besiyeri, diğer grupların kuyucuklarına da elde edilmek istenen konsantrassyonun iki katı olarak hazırlanmış 6-OHDA solüsyonlarından 100’er µl eklenerek tüm kuyucuklar 200 µl’ye tamamlandı. Her plate 6, 12 ve 24 saat olacak şekilde planlandığı süre boyunca 37ºC’de CO2 inkübatöründe bekletildi. Sürelerin sonunda plateler mikroplaka okuyucu spektrofotometre ile ile 440 ve 600 nm dalga boyunda okundu.
3.3.2. 6-OHDA VE MTT HÜCRE CANLILIĞI TESTİ İLE TİMOKİNON DOZUNUN BELİRLENMESİ
MTT ile Hücre canlılığı testinde kullanılmak üzere 6 grup oluşturuldu: • Kontrol (Sadece hücre)
• Hücre + 100 µM 6-OHDA
• Hücre + 100 µM 6-OHDA + 0.25 µM TQ • Hücre + 100 µM 6-OHDA + 2.5 µM TQ • Hücre + 100 µM 6-OHDA + 12.5 µM TQ • Hücre + 100 µM 6-OHDA + 25 µM TQ
3 grup kuyucuğa da hücre canlılığında karşılaştırma amacıyla sırasıyla besiyeri + 6-OHDA, sadece besiyeri ve 6-OHDA + TQ + besiyeri koyuldu.
2mM ve 200 µM’lık konstantrasyonlarında 6-OHDA, 50 µM, 25 µM, 5 µM, 0.5 µM’lık konstantrasyonlarda TQ çözeltileri hazırlandı. Hücreler 96 kuyucuklu kültür kabına, kuyucuk başına 5000 hücre olacak şekilde 100’er µl hücreli besiyeri, 5x6 kuyucuğa ekildi. 24 saat inkübe edilerek hücrelerin kuyucukların tabanına yapışması sağlandı. 24 saat sonunda ön muamele için 3,4,5 v 6. sütunlara sırasıyla 50 µM, 25 µM, 5 µM, 0.5 µM’lık TQ çözeltilerinden 100’er µl eklendi. Kültür kabı 1 saat inkübatörde bekletildi. 1 satin sonunda kontrol kuyucuklarına 100 µl besiyeri, 6-OHDA kuyucuklarına 100 µl 200 µM konsantrasyonda 6-OHDA, TQ + 6-OHDA
23 kuyucuklarının hepsine de 10 µl 2mM konsantrasyonda 6-OHDA eklenerek her kuyucukta eşit konstantrasyonda (100 µM) 6-OHDA olması sağlandı. 7. ve 9. Sütunlardaki kuyucuklara da gerekli konstantrasyonlarda TQ ve 6-OHDA eklendikten sonra hücreler 24 saat inkübatörde bekletildi. 24 saat sonunda büyün kuyucuklara 10 µl MTT çözltisi eklendi, 2 saat inkübe edildi. Ardından plateler mikroplaka okuyucu spektrofotometre ile ile 440 ve 600 nm dalga boyunda okundu.
3.3.3. WESTERN BLOT İLE 6-OHDA’NİN APOPTOTİK BAX PROTEİNİ ÜZERİNE ETKİSİNİN İNCELENMESİ
6-OHDA’nin apoptoz üzerine bir etkisi olup olmadığını ve varsa hangi doz ve sürede etki gösterdiğini belirlemek için Western Blotlama yöneminde kullanılmak üzere hücre üretimi için 4 farklı sürede (3, 6, 12, 24 saat) denemek amacıyla 3 grup oluşturuldu:
• Kontrol (sadece hücre) • Hücre + 50 µM 6-OHDA • Hücre + 100 µM 6-OHDA
4 tane 6 well plate içerisine her gruptan 2’şer kuyucuk ve her plate’de 1 ml 1x106 hücre olacak şekilde SH-SY5Y hücreleri ekildi, plate’e tutunmaları için 24 saat 37º CO2 inkübatöründe bekletildi. 1mM konsantrasyonda 6-OHDA çözeltisi hazırlandı. Her plakada 50 µM 6-OHDA gruplarının kuyucuklarına 50 µl, 100 µM 6-OHDA gruplarının kuyucuklarına 1 mM’lık 6-OHDA çözeltisi eklendi. 4 plaka 3, 6, 12, 24 saat olacak şekilde 4 farklı süre 37º CO2 inkübatöründe bekletildi. Sürelerin sonunda hücreler daha önce anlatılan tekniklerle toplandı, lizatlandı ve western blot uygulaması yapıldı.
3.3.4. WESTERN BLOT İLE 6-OHDA VE TİMOKİNONUN APOPTOTİK PROTEİNLERE ETKİSİNİN İNCELENMESİ
7 grup oluşturuldu, her grup 6 ve 12 saat inkübe edilerek toplam 14 grup planlandı: • Kontrol – sadece hücre 6/12 saat
• TQ 6/12 saat • 6-OHDA 6/12 saat • Z-DEVD-FMK 6/12 saat • 6-OHDA + TQ 6/12 saat
24 • 6-OHDA + Z-DEVD-FMK 6/12 saat
• 6-OHDA + Z-DEVD-FMK + TQ 6/12 saat
6-OHDA 50 mM, TQ 12.5 mM, Z-DEVD-FMK (Kaspaz-3 inhibitörü) 5 mM
konsantrasyonda olacak şekilde çalışma çözeltileri hazırlandı.12 kuyucuklu kültür kabına her kuyucukta 5x105 hücre olacak şekilde 500’er µl, içinde hücre bulunan besiyeri koyuldu. 24 saat inkübatörde hücrelerin kabın tabanına tutunması beklendi. TQ ve Z-DEVD-FMK kuyucuklarına önce 5’er µl TQ ve Z-DEVD-FMK eklenerek 1 saat inkübatörde bekletildi. 1 saatin sonunda 6-OHDA kuyucuklarına 5’er µl 6-6-OHDA eklendi. Kontrol kuyucuklarına herhangi bir çözelti eklenmedi. Kültür kapları gruparına göre 6 veya 12 saat 37º CO2 inkübatöründe bekletildi. Sürelerin sonunda hücreler daha önce anlatılan tekniklerle toplandı, lizatlandı ve western blot uygulaması yapıldı.
3.4. İSTATİSTİKSEL DEĞERLENDİRME
Deney gruplarında tüm örnekler hücre canlılığı analizinde en az beş kez, protein analizinde en az üç kez ve üç tekrarlı olacak şekilde çalışıldı. Sayısal değerlendirmelerde
ortalama değerler ve standart sapmalar rapor edildi. Deney grupları arasındaki istatistiksel farklar ANOVA (analysis of variance) yöntemi ile %95 güven aralığında değerlendirildi, gruplar
25 4.BULGULAR
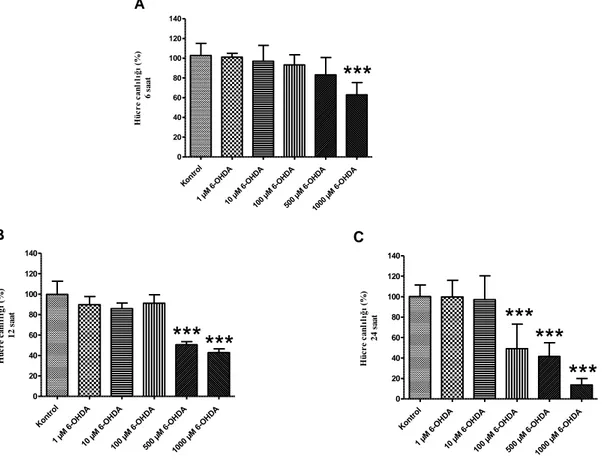
4.1. MTT HÜCRE CANLILIĞI TESTİNDE 6-OHDA DOZ VE SÜRE YANITLARI MTT hücre canlılığı testi ile 3 farklı süre (6, 12 ve 24 saat) ve 5 farklı doz
konsantrasyonunda (1, 10, 100, 500, 1000 µM) 6-OHDA kontrol gruplarıyla karşılaştırıldı (şekil.1). 6 saat uygulamada 1000 µM konsantrasyonda kontrole göre anlamlı bir farklılık
görüldü (p<0.0005). 12 saat uygulamada 500 ve 1000 µM konsantrasyonda kontrole göre anlamlı bir farklılık gözlendi (p<0.0005). 24 saat uygulamada ise 100, 500 ve 1000 µM
konsantrasyonlarda kontrole göre anlamlı farklılık saptandı (p<0.0005).
Kon trol 1 µM 6-OH DA 10 µ M 6-OHDA 100 µ M 6-OHDA 500 µ M 6-OHDA 1000 µM 6-OHDA 0 20 40 60 80 100 120 140 H üc re c an lı lı ğı ( % ) 6 s a a t Kont rol 1 µM 6-OHD A 10 µ M 6-OHD A 100 µ M 6-OHD A 500 µ M 6-OHD A 1000 µM 6-OHD A 0 20 40 60 80 100 120 140 Hü cr e ca nl ıl ığ ı (% ) 1 2 s a a t Ko ntro l 1 µM 6-OHD A 10 µ M 6-OHD A 100 µ M 6-OHD A 500 µ M 6-OHD A 1000 µM 6-OHD A 0 20 40 60 80 100 120 140 Hü cr e ca nl ıl ığ ı (% ) 2 4 s a a t A B C
***
*** ***
***
***
***
Şekil 7 Farklı konsantrasyon ve sürelerde uygulanan 6-OHDA’nın hücre canlılığı üzerine etkisi (***: İşaretli hücre canlılığı değerleri kendi grafiklerindeki kontrol gruplarına göre anlamlı azalmış bulunmuştur. (p<0.0005))
4.2. 6-OHDA VE MTT HÜCRE CANLILIĞI TESTİNDE TİMOKİNON DOZ VE SÜRE YANITLARI
26 MTT hücre canlılığı testi ile 6-OHDA’e karşı timokinonun nöron koruyucu etkisi
incelendi. 24 saat 4 farklı konsantrasyonda (0.25, 2.5, 12.5 ve 25 µM) timokinon uygulandı. Önceki basamakta belirlendiği üzere kontrol hariç tüm gruplara timokinon uygulamasından 1 saat sonra 100 µM konsantrasyonda 6-OHDA uygulandı. Tek başına 6-OHDA uygulanan grup
beklendiği üzere canlı hücre sayısını anlamlı şekilde azalttı (p<0.05). 0.25, 2.5 ve 25 µM timokinon uygulanan grupların hepsi, sadece 6-OHDA uygulanan gruba göre canlı hücre
sayısında anlamlı bir artış gösterdiler (p<0.05). 12.5 µM timokinon uygulanan grup kontrole göre anlamlı farklılık göstermedi (p>0.05).
Con trol 100 µM 6 -OH DA 0.25 µm T + 6-OH DA 2.5 µm T + 6-OH DA 12.5 µm T + 6-OH DA 25 µ m T + 6-O HDA 0 20 40 60 80 100 120 140 H üc re c an lı lı ğı ( % ) 2 4 s a a t *** *** **
Şekil.8 6-OHDA aracılı hücre ölümünde farklı konsantrasyonlarda uygulanan timokinonun hücre canlılığı üzerine etkisi (***: 0.25 ve 2.5 µM konsantrasyon timokinon uygulaması, 6-OHDA’nın hücre canlılığında oluşturduğu azalmayı anlamlı şekilde geriletti. (p<0.0005), 25 µM
konsantrasyon da anlamlı değişiklik oluşturdu ancak 0.25 ve 2.5 µM kadar etkili değildi (p>0.005).)
4.3. WESTERN BLOT UYGULAMASINDA 6-OHDA’NİN APOPTOTİK BAX PROTEİNİ ÜZERİNE ETKİSİ
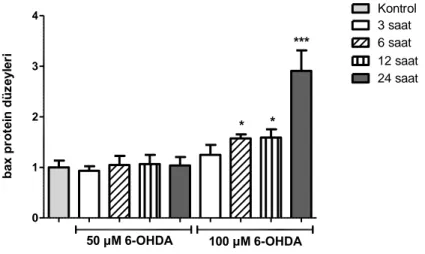
6-OHDA’nın proapoptotik bir protein olan bax üzerindeki etkisini görmek amacıyla yapılan western blot çalışmasının sonucunda 50 µM konsantrasyonda 24 saatte bile 6-OHDA’nın bax düzeyini anlamlı arttırmadığı gözlendi (p>0.05). 100 µM konsantrasyonda ise 6-OHDA’nın bax düzeylerini anlamlı bir şekilde arttırabildiği görüldü (p<0.05). Bu konsantrasyondaki artış 6. saatte gözlenmeye başlandı, 12 ve 24. saatlerde de devam ettiği görüldü.
27 0 1 2 3 4 6 saat Kontrol 12 saat 3 saat 24 saat 50 µM 6-OHDA 100 µM 6-OHDA * *** * b ax p ro te in d ü ze yl er i
Şekil 9 OHDA uygulaması sonucu bax protein düzeylerinin zamana bağlı değişimi (*: 6-OHDA’nın kontrole göre Bax protein düzeyini anlamlı arttıtrdığı (p<0.05) doz 100 µM bulundu ve bu artışı 6 ve 12 saat uygulamada gösterebildi.)(***: Aynı dozda 24 saat uygulamada Bax artışı daha anlamlı bulundu (p<0.0005).)
4.4. WESTERN BLOT UYGULAMASINDA 6-OHDA VE TİMOKİNONUN APOPTOTİK PROTEİNLERE ETKİSİ
Timokinonun Bcl-2, Bcl-xl ve Kaspaz-3 üzerinde yaptığı değişiklikleri incelemek
amacıyla bu proteinlerin 6 ve 12. saatteki düzeylerine bakıldı. Bcl-2 ve Bcl-xl’de timokinon ve 6-OHDA’nın etkileri bakılırken, Kaspaz-3’de antiapoptotik Z-DEVD-FMK’nın etkisine ve
timokinon ve 6-OHDA ile etkileşimine de bakıldı.
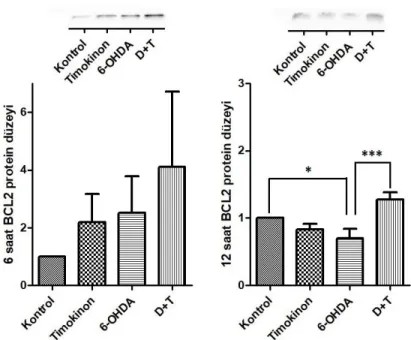
Bcl-2’nin 6. saatteki düzeyleri timokinon ve 6-OHDA etkisi açısından anlamlı bulunmadı (p>0.05). 12. saatteki düzeylerinde ise timokinon tek başına anlamlı bir değişim oluşturmazken (p>0.05) 6-OHDA anlamlı bir azalmaya neden oldu(p<0.05). Timokinon ön uygulaması yapılıp 6-OHDA uygulanmış grupta ise sadece 6-OHDA uygulanmış gruba göre anlamlı bir artış gözlendi (p<0.0005) (Şekil 10).
28
Şekil 10 Timokinon, 6-OHDA ve Timokinon+6-OHDA’nın 6 ve 12 saat uygulanmasıyla Bcl-2 düzeylerinde oluşan değişim. (* : 12 saat 6-OHDA uygulaması bcl-2 düzeyini kontrole göre anlamlı şekilde düşürdü (p<0.05), ***: 12 saat Timokinon ön uygulaması bcl-2 düzeyini 6-OHDA’inin düşürdüğü düzeye göre anlamlı şekilde arttırdı (p<0.0005).)
Bcl-xl’nin 6. saatteki düzeylerinde kontrole göre timokinon tek başına anlamlı bir artış (p<0.05), 6-OHDA de anlamlı bir azalma (p<0.005) oluşturdu. Timokinon ön uygulaması yapılıp 6-OHDA uygulanmış grupta sadece 6-OHDA uygulanmış gruba göre anlamlı bir farklılık
gözlenmedi (p>0.05). Bcl-xl’nin 12. saatteki düzeylerinde timokinon ve 6-OHDA’nın anlamlı bir etkisi görülmedi (p>0.05) (Şekil 11).
29
Şekil 11 Timokinon, 6-OHDA ve Timokinon+6-OHDA’nın 6 ve 12 saat uygulanmasıyla Bcl-xl düzeylerindeki değişim. (*: 6 saat Timokinon uygulaması kontrole göre Bcl-xl düzeyinde anlamlı bir artış oluşturdu (p<0.05).
Kaspaz-3’ün 6. saatteki düzeyleri timokinon ile arttı, 6-OHDA ile düştü. Timokinon ön uygulamasının Kaspaz-3 düzeyine etkisi, sadece 6-OHDA uygulamasına göre anlamlı bir etki oluşturmadı (p>0.05). DEVD-FMK ile Kaspaz-3 düzeyleri anlamlı azaldı (p<0.0005). FMK ile 6-OHDA’nın beraber uygulanması Kaspaz-3 düzeyini kontrole ve Z-DEVD-FMK’nın tek başına uygulamasına göre anlamlı arttırdı (p<0.0005). Timokinon ön uygulamasıyla beraber 6-OHDA verilmesi kaspaz-3 düzeyini, sadece Z-DEVD-FMK uygulaması ve 6-OHDA ile Z-DEVD-FMK’nın beraber uygulamasına göre anlamlı arttırdı (p<0.0005). 12. saatte timokinon ve 6-OHDA’nın oluşturduğu kaspaz-3 düzeyleri 6. saatteki gibi timokinon ile artmış ve 6-OHDA ile azalmış olarak bulunurken, timokinon ön uygulamasıyla 6-OHDA’nın beraber verilmesi anlamlı bir değişiklik oluşturmadı (p>0.05). 6. saatte olduğu gibi, Z-DEVD-FMK Kaspaz-3 düzeyini azalttı ve Z-DEVD-FMK uygulamasına göre 6-OHDA ile Z-DEVD-FMK, kaspaz-3 düzeyini arttırdı (p<0.0005). Z-DEVD-FMK, 6-OHDA ve timokinon ön uygulaması ise Z-DEVD-FMK’ya göre 6. saatin aksine Kaspaz-3 düzeyini azalttı (p<0.0005) (Şekil 12).
30
Şekil 12 A: Timokinon, 6-OHDA ve Z-DEVD-FMK’nın tek başlarına ve kombine olarak birbirlerine göre Kaspaz-3 düzeylerinde yaptığı etkilerin karşılaştırılması. (***:Kontrole göre timokinon Kaspaz-3 düzeyini anlamlı arttırdı(p<0.0005), Z-DEVD-FMK’nın Kaspaz-3’de oluşturduğu azalmayı 6-OHDA ve timokinon anlamlı şekilde arttırdı(p<0.0005).) B: Aynı 3 molekülün 12 saat uygulamayla Kaspaz-3 düzeylerindeki etkilerinin karşılaştırılması. (***: Timokinon’un 6 saatteki 3 düzeyi arttırıcı etkisi devam etti (p<0.0005), 6-OHDA Kaspaz-3’ü kontrole göre anlamlı azalttı (p<0.0005), Z-DEVD-FMK uygulamasına göre 6-OHDA Kaspaz-3 düzeylerini anlamlı arttırdı (p<0.0005).