T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
PNEUMOCYSTİS JİROVECİİ’NİN KANTİTATİF PCR YÖNTEMİ
İLE TANIMLANMASI VE DİĞER TANI YÖNTEMLERİ İLE
KARŞILAŞTIRILMASI
Tuba SEYHAN
YÜKSEK LİSANS TEZİ
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
Danışman
Prof. Dr. Duygu FINDIK
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
PNEUMOCYSTİS JİROVECİİ’NİN KANTİTATİF PCR YÖNTEMİ
İLE TANIMLANMASI VE DİĞER TANI YÖNTEMLERİ İLE
KARŞILAŞTIRILMASI
Tuba SEYHAN
YÜKSEK LİSANS TEZİ
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
Danışman
Prof. Dr. Duygu FINDIK
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 13202024 proje numarası ile desteklenmiştir.
ii
ÖNSÖZ
Selçuk Üniversitesi Tıp Fakültesi Mikrobiyoloji Laboratuvarı’na gelen Pneumocystis jirovecii şüpheli hastalardan alınan örneklerde Pneumocystis jırovecii’nin kantitatif PCR yöntemi ile tanımlanması ve diğer tanı yöntemleri ile karşılaştırılması amaçlanan çalışmamda her türlü yardım ve desteğini esiremeyen tez danışmanım Mikrobiyoloji Anabilim Dalı Başkanı Prof. Dr. Duygu FINDIK’a, tezin tüm aşamalarında yardımlarını gördüğüm Prof. Dr. E. İnci TUNCER, Doç. Dr. Uğur ARSLAN ve Yrd. Doç. Dr. Hatice TÜRK DAĞI’na en içten şükranlarımı sunmayı bir borç bilirim.
Ayrıca tezimin her kademesinde şahsıma gösterdikleri iyi niyet, yakın arkadaşlık ve yardımları için Mikrobiyoloji Anabilim Dalı çalışanlarına minnet, sevgi ve saygılarımı sunar, her zaman yanımda olan eşime ve canım aileme teşekkür ederim.
Tuba SEYHAN KONYA-2015
iii İÇİNDEKİLER SİMGELER ve KISALTMALAR ... iv 1. GİRİŞ ... 1 1.1. Genel Özellikler ... 1 1.2. Epidemiyoloji ... 3 1.3. Yaşam Şekilleri ... 4 1.4. Patogenez ... 6 1.5. Klinik Belirtiler ... 6 1.6. Tanı ... 7 1.7. Tedavi ... 10 1.8. Korunma ... 10 2. GEREÇ ve YÖNTEM ... 11 2.1. Örneklerin Toplanması ... 11 2.2. Örneklerin Hazırlanması ... 11
2.3. Giemsa Boyama Yöntemi ... 12
2.4. Gomori Metenamin Gümüşleme (Gomori-Grocot) Boyama Yöntemi ... 12
2.5. Direkt Floresan Antikor Boyama Yöntemi ... 13
2.6. Kantitatif PCR Yöntemi ... 14
2.6.1. Dekontaminasyon Yöntemi ... 14
2.6.2. DNA İzolasyonu ... 14
2.6.3. Kantitatif PCR ... 15
3. BULGULAR ... 18
3.1. Hastaların Giemsa Sonuçları ... 19
3.2. Hastaların Gomori Metenamin Gümüşlüme Sonuçları ... 19
3.3. Hastaların DFA Sonuçları ... 20
3.4. Hastaların PCR Sonuçları ... 20
4. TARTIŞMA ... 22
5. SONUÇ ve ÖNERİLER ... 26
6. KAYNAKLAR ... 27
7. EKLER ... 30
Ek A: Etik Kurul Kararı ... 30
iv
SİMGELER VE KISALTMALAR
ABD: Amerika Birleşik Devletleri
AIDS: Acquired Immune Deficiency Syndrome BAL: Bronkoalveoler Lavaj
β: Beta
CMV: Cytomegalo virus
DFA: Direkt Floresan Antikor Yöntemi DNA: Deoksiriboneükleik Asit
DTT: Dithiothreitol ETA: Endotrakeal Aspirat
HAART: High Active Antiretroviral Therapy HIV: İnsan Bağışıklık Yetmezlik Virüsü LDH: Laktat Dehidrojenaz
MSG: Majör Yüzey Glikoproteini μl: Mikrolitre
μm: Mikrometre ml: Mililitre nm: Nanometre
PBS: Fosfat buffer saline PCP: Pneumocystis pnömonisi PCR:Polimeraz Zincir Reaksiyonu
v
ÖZET
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
Pneumocystis jirovecii’nin Kantitatif PCR Yöntemi ile Tanımlanması ve
Diğer Tanı Yöntemleri ile Karşılaştırılması
Tuba Seyhan
Tıbbi Mikrobiyoloji Anabilim Dalı YÜKSEK LİSANS TEZİ / KONYA-2015
Pneumocystis jirovecii’nin neden olduğu Pneumocystis pnömonisi günümüzde yüksek
mortalite hızıyla immünsüpresif tüm hastalarda korkulan bir hastalık haline gelmiştir. Pneumocystis pnömonisi HIV ile enfekte olan hastalarda daha fazla görülmesine rağmen diğer immün yetmezlikli hastalarda da görülebilmektedir. P. jirovecii kültürde üreyemediği için tanıda kültür dışındaki yöntemlerden yararlanılmaktadır. Son yıllarda rutin boyama ve direkt floresan antikor yöntemlerinin yanında, duyarlılığı daha yüksek olan kantitatif PCR yöntemi kullanılmaya başlamıştır.
Bu çalışmada Pneumocystis pnömonisi şüpheli 100 hastadan alınan solunum yolu örneklerinden kantitatif PCR, direkt floresans antikor yöntemi, Giemsa, Gomori metenamin gümüşleme boyama yöntemleri ile P. jirovecii saptanması amaçlanmıştır. Örneklerde kantitatif PCR yöntemi ile dört(%4), direkt floresans antikor yöntemi ile dört (%4), Gomori metanamin gümüşleme yöntemi ile bir örnekte P. jirovecii saptanmıştır. Giemsa yöntemi ile hiçbir örnekte P. jirovecii belirlenememiştir. Direkt floresan antikor ve Gomori metenamin gümüşleme yönteminde tespit edilen bir örnek (%1) dışında diğer bütün pozitif sonuçlar farklı hastalara ait örneklerden elde edilmiştir.
Direkt floresan antikor yöntemi tanımlamada altın standart olarak kabul edilmekle birlikte tecrübe ve birikim gerektiren bir yöntemdir. PCR temelli yöntemler ise tanıda duyarlı ve altın stadartla uyumlu yöntemler olarak kullanıma girmiştir. Ancak bizim çalışmamızda testler arasında tam bir uyum bulunamamış bu da bize tanıda tek yönteme bağlı kalınmaması gerektiğini düşündürmektedir. Sonuç olarak bulgularımıza göre klinik şüphe varsa P.jirovecii tanısında en az iki yöntemin birlikte kullanılması, laboratuvar imkanları doğrultusunda hem direkt floresan antikor hem de PCR yöntemlerinin birlikte yapılması gerektiğini düşünmekteyiz.
Anahtar Sözcükler: Direkt floresan antikor, Giemsa, Gomori metenamin gümüşleme,
vi
SUMMARY
REPUBLIC of TURKEY SELCUK UNIVERSITY HEALTH SCIENCES INSTITUTE
Detection of Pneumocystis jirovecii by Quantitative PCR and Comparison with Other Diagnostic Methods
Tuba Seyhan
Department of Medical Microbiology MASTER THESIS / KONYA-2015
In recent years, pneumonia caused by Pneumocystis jirovecii has become a dreadful disease in all immunosuppressive patients because of its high mortality rates. Although seen more often in HIV-infected patients, Pneumocystis pneumonia can also be seen among other immunocompromised hosts. Since P. jirovecii cannot grow, methods other than culture are utilized for its diagnosis. In addition to traditional staining and direct fluorescent antibody methods, quantitative PCR which is more sensitive than others has currently been used.
In this study, we aimed to identify P. jirovecii in the respiratory samples taken from 100 patients with suspected Pneumocystis pneumonia by quantitative PCR, direct fluorescence antibody, Giemsa, and Gomori methenamine silver staining methods. P. jirovecii was determined in four samples (4%) by quantitative PCR; four (4%) by direct fluorescence antibody; and in a sample (1%) by Gomori methanamine silver staining method. All samples stained with Giemsa were negative for
P.jirovecii. All positive results belonged to different patient samples except for a single specimen
(1%) that was detected positive by both direct fluorescent antibody and Gomori methenamine silver staining methods.
Although direct fluorescent antibody method is considered gold standard, it requires experienced staff in laboratories. PCR-based techniques have lately been introduced as sensitive diagnostic methods and are compatible with the gold standard method. However, lack in full compliance among the assays used in our study suggests that the diagnosis should not be relied on a sole method. As a result, according to our findings, if there is a clinical suspicion for Pnemocystis pneumonia, we recommend utilization of at least two different diagnostic methods regarding available laboratory facilities, both the direct fluorescent antibody and the PCR methods.
Key words: Direct fluorescent antibody, Giemsa, Gomori methenamin silver staining,
1
1. GİRİŞ
1.1. Genel Özellikler
Pneumocystis (P.) carinii f. sp. hominis veya yeni adlandırması ile Pneumocystis jirovecii, insanlarda görülen Pneumocystis pnömonisinin (PCP) etkenidir (Stringer ve ark 2002). P. jirovecii Acquired immune deficiency syndrome (AIDS) başta olmak üzere primer immün yetmezlik, solid organ veya hematolojik malignitesi olan, organ transplantasyon yapılan, steroid tedavisi alan ve bağışıklık sistemi baskılanmış kişilerde morbidite ve mortalitenin en önemli nedenidir (Miller1999, Arend ve ark 1995).
Günümüzde Pneumocystis infeksiyonlarının önemi, AIDS hastalığının giderek yaygınlaşması nedeniyle artmıştır (Arend ve ark 1995). Bağışıklığı baskılanmış hastalarda ölümcül PCP etkeni olduğundan birçok tanı yönteminin geliştirilmesini beraberinde getirmiştir (Thomas ve ark 2004).
Pneumocystis jirovecii’nin tam olarak tanımlanması ve sınıflandırılması yıllarca sürmüştür. Pneumocystis ilk olarak 20. yüzyılın başlarında Carlos Chagas tarafından bulunmuş ve Trypanosome’nın yeni bir formu olarak tanımlanmıştır. Dr. Antonia Carinii’de 1910 yılında aynı tanımlamayı fare akciğerlerinde yapmıştır. Birkaç yıl sonra Delanöes Pneumocytis’i ayrı bir tür ve cins olarak tanımlamış ve Dr. Carinii anısına Pneumocytis carinii olarak isimlendirmiştir (Thomas ve ark 2004).
Frenkel insanlar ve diğer memeliler üzerinde yapılan çalışmalar sonucu 1976 yılında fenotipik farklılıklara dayanarak mikroorganizmayı insanlarda ilk tanımlayan Çek parazitolog Otto Jirovec’i anısına insan kaynaklı Pneumocytis için Pneumocytis jirovecii ismini önermiştir (Stringer ve ark 2002).
P. jirovecii tek hücreli, ökaryotik bir mikroorganizma olup, önceleri protozoon olarak kabul edilmesine rağmen nükleotid sekans DNA dizi analizleri P. jirovecii’nin ökoryotlardan mantarlara benzerlik gösterdiği kesinleşmiştir (Stringer 1996).
P. jirovecii’nin protozoon olduğunu düşündüren bazı özellikler morfolojik yapılarının benzemesi, mantara ait bazı fenotipik özelliklerinin bulunmayışı, mantar ilaçlarına karşı duyarsız olması, protozoon infeksiyonlarının tedavisinde kullanılan
2 ilaçlara karşı duyarlılığının olmasıdır. Yapılan DNA sekans analizleri ile P.jirovecii’nin mantar olduğu kesinleşmiş olsa da bu organizmayı diğer mantarlardan ayıran özellikler; mantar besiyerinde üreyememesi, ribozomal RNA’yı kodlayan sadece bir tek gen kopyasına sahip olması, amfoterisin ve ketonazollere karşı duyarsız olmasıdır (Girginkardeşler ve ark 2007).
Mantarlara benzeyen özellikleri; kist duvarının ultrastrüktürel yapısı, sekiz adet intrakistik cisimcik içeren kist formları; dihidrofolat redüktaz geninin nukleotid sekansı ve ribozomal RNA’nın küçük alt birimindeki filogenetik analizlerdir (Edman ve ark 1988, Edman ve ark 1989).
Çizelge.1.1.1. Pneumocystis jirovecii mantar taksonomisi içinde aşağıdaki gibi
sınıflandırılmaktadır (Yıldıran 2008).
Çizelge.1.1.2. Önemli Pneumocystis türlerinin günümüzdeki adlandırılması (Yıldıran
2008).
Konak İki Terimli İsimlendirme Üç Terimli İsimlendirme
İnsan Pneumocystis jirovecii P.carinii f. sp. hominis Fare Pneumocystis murina P.carinii f. sp. muris Sıçan Pneumocystis carinii P.carinii f. sp. carinii Sıçan Pneumocystis wakefieldiae P.carinii f. sp. ratti Tavşan Pneumocystis oryctolagi P.carinii f. sp. oryctolag
Pneumocystis pnömoni tanısı balgam, bronkalveoler lavaj (BAL), bronşial fırçalama, bronş yıkama suyu ve açık akciğer biyopsisi gibi örneklerde, klasik boyama yöntemleri (Giemsa, Gomori metenamin gümüşleme boyası vb.) direkt floresan antikor yöntemi (DFA) ve son yıllarda yaygın kullanım alanı bulunan polimeraz zincir reaksiyonu (PCR) gibi yöntemlerle yapılmaktadır (Güneş ve ark 2002).
Topluluk (Kingdom): Fungi Bölüm (Phylum): Ascomycota Sınıf (Class): Archiascomycetes Takım (Order): Pneumocystidales Aile (Family): Pneumocystidaceae Cins (Genus): Pneumocytis
3 Pneumocystis pnömonisi düşünülen hastalarda alınan en uygun örnekler balgam ve BAL’dır. Özellikle tuzlu su nebilizasyonu sonrası elde edilen indüklenmiş balgam tanı değerini arttırmaktadır (Ng ve ark 1989).
1.2. Epidemiyoloji
P. jirovecii’nin bulaşma yolu ve çevresel kaynağı tam olarak tanımlanamamıştır. Hayvanlar ve insanlar üzerine yapılan çalışmalarda latent infeksiyonun tekrar ortaya çıktığı savunulmakla birlikte; çevresel kaynaklardan bulaşın olabileceği gibi hava ile bulaşın da olası olduğudur (Thomas ve ark 2004).
Havadan alınan örneklerle yapılan çalışmalarda Pneumocystis DNA’sına rastlanmıştır (Wakefıeld 1996). PCP olan hastaların bulunduğu odalardan ve koridorlardan alınan hava örneklerinde P. jirovecii DNA’sı görülmüştür (Olsson ve ark 1998). Kaynağı ne olursa olsun farelerle yapılan bir çalışmada P. jirovecii’nin insanlara hava yoluyla bulaştığı görülmüştür (Dumoulin ve ark 2000).
Yapılan çeşitli çalışmalarda P. jirovecii deney hayvanların pek çoğunun akciğerlerinde görülmüş fakat doğal rezervuarı tam olarak açıklanamamıştır (Yoshida ve ark 1981).
Genelde latent infeksiyon oluşturan P. jirovecii bağışıklık sistemi baskılanmamış kişilerde hastalık oluşturmazken bağışıklık sistemi baskılanmış kişilerde hastalık oluşturabilmektedir (Stringer ve ark. 2002).
P. jirovecii’nin epidomiyolojisini incelemek için Amerika Birleşik Devletleri’nde (ABD) yetişkin hastalar üzerinde yapılan bir çalışmada hastaları enfekte eden suşların hastaların doğdukları yerde bulunanlardan daha çok yaşadıkları yerdekine benzedikleri bununda infeksiyonun çocukluktan beri taşınmasından çok insandan insana bulaştığını göstermiştir (Beard ve ark 2000).
P. jirovecii antikorlarının serokonversiyonu primer infeksiyon tanısında önemlidir. Şilide yirmi aylık bebeklerden alınan örneklerle yapılan çalışmada antikor pozitifliği %85 olarak bulunmuştur (Vargas ve ark 2001).
4 Çocuklar ve erişkinler üzerinde yapılan bir çalışmada 233 çocuk 91 erişkin olmak üzere toplam sağlıklı 324 kişinin serum örneğinde P. jirovecii’e karşı oluşan antikor prevelansı saptanmıştır. Erişkinlerde ve çocuklarda bu oran sırasıyla % 58,2 ve % 72,5 olarak bulunmuştur. İnfeksiyonun çok yaygın olduğu ve erişkinlerdeki düşük antikor prevelansın P. jirovecii’ye karşı gelişen serolojik cevabın kalıcı olmamasına ve özgül antikorların varlığının bu patojenle tekrar karşılaşmaya bağlı oluşabileceği düşünülmüştür (Medrano ve ark 2003).
Erişkinde PCP gelişimi için en önemli risk faktörü CD4+ sayısının 200 hücre/μL’nin altına düşmesidir. HIV (Human Immunodeficiency Virus) negatif hastalarda PCP gelişimi için en önemli risk faktörleri hücresel bağışıklıkla ilgili bozukluklar ve kortikosteroid kullanımıdır (Benson ve ark 2004).
Pneumocystis pnömoni epidemiyolojisi AIDS epidemisinin ortaya çıkışıyla birlikte dramatik bir değişim göstermiştir. PCP 1980’li yıllarda ABD’de AIDS’li erişkinlerin ve adolesanların yaklaşık üçte ikisinde AIDS’i ortaya çıkaran bulgu olmuştur. Pneumocystis pnömonisinin profilaksisi, High active antiretroviral therapy (HAART)’nin 1996-1998 yıllarında uygulamaya girmesiyle insidansı % 21,5’e düşmüştür. PCP insidansında kaydedilen düşüşe rağmen, bugün hala HIV ile enfekte hastalarda PCP, en önemli fırsatçı hastalıktır (Yıldıran 2008).
1.3. Yaşam Şekilleri
P. jirovecii morfolojik olarak ışık ve elektron mikroskobunda incelendiğinde yaşam şekillerinin 3 değişik formda olduğu saptanmıştır.
1-Trofozoid formu 1-5 μm çapında olup, pleomorfik yapıdadır ve genellikle kümeler halinde görülmektedir. En çok trofozoit form görülmekte olup, hücre merkezinde olmayan bir çekirdeği, retiküler sitoplazması, mitokondrileri ve az gelişmiş bir hücre duvarı ile 2-5 μm boyutlarında değişken bir morfoloji gösterir. Elektron mikroskobunda nukleus, sitoplazma, mitokondri ve tübüler çıkıntılar (filopodia) görülür. Giemsa ile nukleus kırmızı, sitoplazma ise mavi boyanır (Girginkardeşler ve ark 2007).
5
Şekil 1.3.1. Pneumocystis jiroveci’nin trofozoit ve kist formu (CDC, 2015).
2-Prekist formu: Trofozoit ve kist arasındaki form olarak tanımlanır. 5-8μm büyüklüğündeki prekistlerin morfolojik özellikleri tam olarak belirgin değildir. Üç evrede incelenmektedir.
a. Erken prekist: Şekil olarak oval ve hücre duvarı iki katmanlıdır.
b. Ara prekist: Erken prekiste göre daha yuvarlaktır, hücre duvarı daha kalın ve üç katmandan oluşur. Ara prekist içinde iki veya dört nukleus bulunmaktadır.
c. Geç prekist: Diğer evrelere göre daha yuvarlaktır ve şekil olarak kiste benzemektedir. Hücre duvarı üç katmanlıdır. Dörtten fazla nükleus bulunmaktadır. Bu evrenin en belirgin özelliği nukleuslarının etrafındaki sitoplazma ile birlikte iki katmanlı bir zarla çevrilmiş olmasıdır (Tekinşen 2011).
3-Kist formu: Diğer formlara göre daha büyüktür (5-8 μm çapında), kalın bir hücre duvarına sahiptir. Hücre duvarı içinde birbirinden bağımsız sekiz intrakistik cisim (sporozoit 1-2 μm boyutlarında) bulunmaktadır (Ruffalo ve ark 1986).
Pneumocytis’in hücre yüzeyi galaktoz/N-asetilgalaktozamin asetilglikozamin ve glikoz/mannozdan oluşmaktadır. Hücre duvarının genel yapısını β-1,3 glikan oluştururken lipid olarak kolesterol daha fazladır (Yıldıran 2008).
En önemli Pneumocytis antijeni 95-14 kilodalton ağırlığındaki majör yüzey glikoproteinidir (MSG). MSG türe özgü ve ortak epitoplar içerir, humoral ve hücresel bağışık yanıtların oluşmasına neden olur ve Pneumocystis’in konak ile etkileşiminde merkezi rol oynar (Yıldıran 2008).
6
1.4. Patogenez
Deneysel hayvan çalışmalarında da görüldüğü gibi P.jirovecii insanlara başlıca hava yoluyla bulaşmaktadır. P.jirovecii hava yoluyla alındıktan sonra savunma mekanizmalarından kaçarak alveoller içinde birikmektedir. P.jirovecii’nin infeksiyon oluşturması için hücre yüzeyine bağlanması gerekir.
P. jirovecii inhale edildikten sonra alveollere ulaşır. Trofozoid formlar adezyon molekülleri olan fibronektin ve vitronektin aracılığıyla tip 1 pnömositlere bağlanır. P. jirovecii’nin alveoler duvara yapışmasıyla trofozoid ve kistlerde artış olur, reaktif alveoler makrofajlar ortaya çıkar. En önemli antijeni MSG’dir. MSG, trofozoid formların alveoler epitel hücresine bağlanmasına eşlik eder. Makrofajlara mannoz reseptörleri aracılığıyla bağlanarak etkenin uzaklaştırılmasını engeller. Bağlanmaya fibronektin aracılık eder(Elbüken 2007).
Normal konağın alveolüne giren P. jirovecii alveolar makrofaj gibi savunma mekanizmaları yoluyla hızla yok edilir. Yapılan bir çalışmada P. jirovecii’nin alveolar makrofajlara invitro bağlandığı fakat fagositoz ve organizmanın lizisinin sadece P. jirovecii antikorları varlığında ortaya çıktığı bildirilmiştir (Masur ve ark 1978).
1.5. Klinik Belirtiler
Pneumocystis pnömonisinde klinik bulgular dispne, taşipne, nonprodüktif öksürük, ateş ve siyanozdur (Elbüken 2007).
Pneumocystis pnömonisinde gözlenen tipik radyolojik bulgular yüksek çözünürlüklü bilgisayar tomografisinde buzlu cam görünümü ve kalınlaşmış interlobuler septa olarak gözlenmiştir (Kalyoncu ve ark 2007).
Son zamanda yapılan çalışmalarda Cytomegalovirus (CMV) pozitifliği ile P. jirovecii pozitifliğinin birlikte görüldüğü belirtilmiş. CMV’nin yaptığı immünyetmezlik P.jirovecii pozitifliğine neden olduğu düşünülmektedir. İlaçlar nedeniyle meydana gelen immünyetmezlik halinin, CMV infeksiyonu eklenmesiyle daha da arttığı düşünülmektedir (Özkoç ve ark 2010).
7 Laktat dehidrogenaz (LDH) enzim düzeyleri PCP hastalarında tanı için bir belirteç değildir ancak akciğer hasarının ve inflamasyonunun bir göstergesi olarak kabul edilmektedir. Bu yüzden PCP hastalarındaki LDH seviyeleri genelde tedaviye yanıtın değerlendirilmesi amacıyla kullanılmaktadır ve başarılı tedavinin ilk haftasında LDH seviyesi düşüş göstererek normal seviyelere gelmiştir (Quist ve ark 1995, Özkoç ve ark 2010).
Hastalarda başka infeksiyonların klinik bulguları ile karıştırılabilmektedir. Bu yüzden hastanın risk grubunda olup olmadığına dikkat edilmelidir.
1.6. Tanı
P.jirovecii’i kültürde üretmek zor olduğundan BAL, balgam, akciğer biyopsisi vb. örnekler ile mikroskobik tanı yapılır (Thomas ve ark 2004).
İnfeksiyonun kesin tanısı, uyumlu bir klinikle beraber hastanın balgam, indüklenmiş balgam, endotrakeal aspirat sıvısı (ETA), BAL veya akciğer doku biyopsisi gibi örneklerin de organizmanın morfolojik olarak histolojik boyalar ve floresans antikor yöntemleriyle gösterilmesi ya da daha duyarlı moleküler yöntemlerle saptanması ile konulabilmektedir (Yanık ve ark 2012).
Pneumocystis normal balgam örneklerinde nadiren bulunur ve tanısal değeri düşüktür. Tuzlu su inhalasyonu sonrası elde edilen indüklenmiş balgam örneğinde ise P. jirovecii daha fazladır. İnvaziv girişim gerektiren BAL ve akciğer biyopsisi gibi örneklerin tanı değeri balgama göre daha düşüktür (Walzer 2010).
İndüklenmiş balgam örneğinin tanıdaki değeri % 50-90 arasında değişiklik göstermekle birlikte PCP tanısı koymak için yapılan ilk tanı örneği olarak önerilmektedir (Thomas ve ark 2004).
Eğer indüklenmiş balgam örneği negatif sonuç verirse beraberinde BAL sıvısının alındığı bronkoskopi yöntemi uygulanması önerilmektedir (Girginkardeşler ve ark 2007).
Bu örneklerden P. jirovecii tanımlamak için çeşitli boyalar kullanılmaktadır. Kist duvarlarını Gomori metenamin Gümüş, Toluidin Blue O, Kalkoflor Beyazı veya
8 Cresyl Echt Violet gibi boyalar boyarken; trofozoit formu içerisindeki intrakistik cisimcikleri Wright-Giemsa, Diff-Quık, Gram Weigert ve Papanicolaou gibi boyalar boyar (Thomas ve ark 2004).
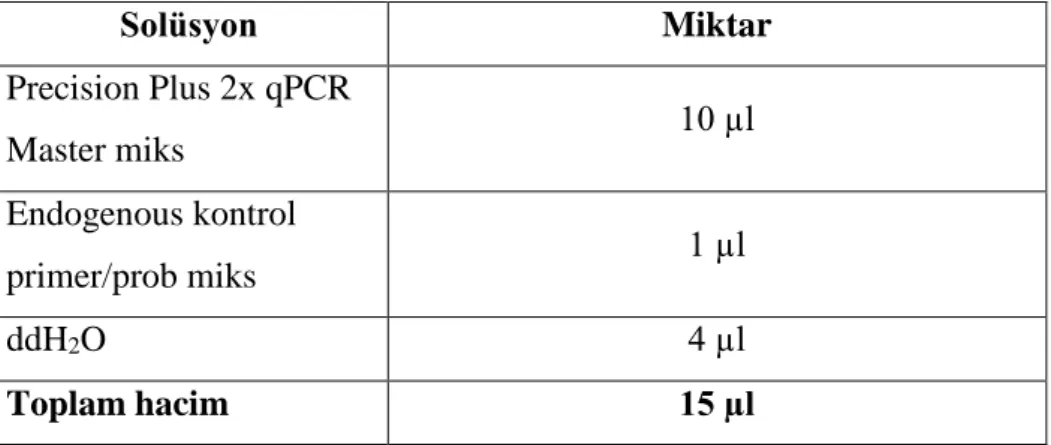
Şekil 1.6.1. P. jirovecii tanısında kullanılan boyama yöntemleri: a) Gomori
Metenamin Gümüşleme b) Giemsa, c) Kalkoflor mavisi d) DFA (Thomas ve ark 2004).
Giemsa ve Giemsa benzeri boyalar kist duvarını boyamazlar. Fakat yaşam siklusunun çeşitli evrelerine ait formların sitoplazmalarını açık mavi, çekirdeklerini eflatunumsu pembe boyarlar. Bu boyama yöntemleri ile BAL, indüklenmiş balgam ve diğer solunum yolu örneklerinde P.jirovecii tanısına gidilebilir. Boyama yöntemleri PCP tanısında maliyetin düşük ve hızlı sonuç vermesi nedeniyle önerilmektedir (Tekinşen 2011).
Direkt ve indirekt floresan konjugatlı monoklonal antikorları Pneumocystis türleri içinde kist veya organizmanın tüm formlarında bulunan yüzey glikoproteinlerini hedefleyerek boyar. Bu boyama yöntemi tüm formları hedefleyerek boyasa da trofozoit form daha fazla görüldüğünden trofozoit forma karşı daha duyarlıdır. P.jirovecii trofozoitleri boyama sonrası elma yeşili renkte görülür (Tekinşen 2011).
İmmünfloresans yöntemi tanıda kısa sürede sonuç alınması, kolay uygulanabilmesi, yüksek duyarlılık ve özgüllüğünün bulunması gibi olumlu özelliklere sahiptir (Özmen 2011).
Pneumocystis tanısında direkt floresan antijen testi de dahil olmak üzere mikroskobik yöntemlerin tanıdaki değeri sınırlıdır. Kantitatif PCR tanıda yardımcı
9 olabilir ancak bugüne kadar rutin kullanımda geçerli bir kantitatif PCR testi bulunmamaktadır (Hauser ve ark 2011).
Serolojik tanı yöntemi P. jirovecii’ye karşı oluşan antikorların ve serumdaki antijenlerin saptanmasına yöneliktir. P. jirovecii’nin serolojik tanı yöntemleri Enzyme Linked Immunosorbent Assayyöntemi ile yapılmaktadır. Sağlıklı insanların çoğunda P. jirovecii’ye karşı antikorların bulunması nedeniyle, serumda antikorların araştırılması tanı için önemli değildir. Bu yüzden serolojik olarak dolaşımdaki antijenleri doğrudan saptamak daha anlamlı olmaktadır. Farelerle yapılan deneysel çalışmada dolaşımda majör antijenlerin 50.000 kilodalton olduğu bildirilmektedir (Ishımaru ve ark 1992).
Moleküler yöntemlerin P. jirovecii’nin tanısındaki duyarlılığını ölçmek için yapılan çalışmalarda duyarlılığın standart mikroskobik yöntemlere göre daha yüksek olduğu kanıtlanmış böylece moleküler yöntemlerin tanıdaki önemini artmıştır. Moleküler yöntemlerin dezavantajı pahalı ve yoğun emekli olmasıdır. Standart mikroskobik yöntemler moleküler yöntemlere göre daha spesifik ve nispeten düşük maliyetlidir (Lipschik ve ark 1992, Armbruster ve ark 1995, Olsson ve ark 2001).
Pneumocystis’in moleküler tiplendirmesinde DNA sekans analizleri sıklıkla kullanılan yöntemlerdendir. Sekans analizleri timidilat sentaz, superoksit dismutaz ve mitokondriyal ssrRNA bölgelerinin farklı memeli konaklarındaki Pneumocystis türlerinin farklılığını ortaya koymuştur. Sekans analizleri P. jirovecii’nin tiplendirilmesinde belirleyici olamamış çünkü P. jirovecii izolatları arasında düşük sekans farklılıkları bulunmaktadır (Tekinşen 2011).
Yardımcı tanı yöntemi olarak serumda yükselen LDH enzim düzeylerine bakılmaktadır fakat PCP hastalarında tanı koymak için yeterli olmamakla beraber altta yatan akciğer hasarının ve inflamasyonunun bir göstergesi olarak kabul edilmektedir. Bu yüzden PCP hastalarındaki LDH seviyeleri genelde tanı amacıyla değil tedaviye yanıtın değerlendirilmesi amacıyla kullanılmaktadır (Quist ve ark 1995).
10
1.7. Tedavi
Pneumocystis pnömonisi risk altında olan hastalar aşağıdaki gibidir:
Yüksek doz kemoterapi hastaları
Hodgkin ve non-Hodgkin Lenfoma
HIV hastaları
Yüksek dozda kortikosteroid kullanan hastalar (kemoterapi ile beraber)
Pneumocystis pnömonisi tedavisinde alternatif birçok ilaç olmasına rağmen ilk tercih edilecek ilaç trimetoprim-sulfametoksazoldür. Tedavide son derece etkilidir (Cooley ve ark 2014). PCP’yi hafif belirtiler ile atlatan hastalara genel olarak oral ve ayaktan tedavi uygulanır (Thomas ve ark 2004).
1.8. Korunma
Korunma, PCP atağı hiç geçirmemiş kişilerde ilk atağı önlemeye yönelik veya daha önce atak geçirenlerde yeni atakları önlemeye yönelik olabilmektedir. Kullanılan ilaçların hiçbirinin bu organizmaya karşı öldürücü olmaması nedeni ile korunmanın hastanın bağışıklığı baskılandığı sürece devam edilmesi önerilmektedir (Tekinşen 2011).
HIV ile infekte hastaların PCP’ye karşı birincil proflaksi alması gerekmektedir. CD4+ sayısının üç ay süreyle 200/mm3’ten fazla olmasıyla gösterilen yüksek antiretroviral tedaviye cevap alındığı durumlarda birincil profilaksi kesilmelidir. Daha önce PCP geçirmiş hastalarda önerilen ömür boyu ikincil profilaksi de CD4+ sayısı 200/mm3’ün üzerine çıktığında kesilmelidir. CD4+ sayısı 200/mm3’ün altına düştüğünde profilaksiye tekrar başlaması önerilmektedir (Thomas ve ark 2004).
11
2. GEREÇ ve YÖNTEM
2.1. Örneklerin Toplanması
Kasım 2013-Kasım 2014 tarihleri arasında Selçuk Üniversitesi Tıp Fakültesi kliniklerinde takip edilen 100 hasta çalışmaya alınmıştır. Hastalar malignitesi olan, akciğerin tanısal görüntülenmesinde anormal bulgular görülen, nötropenik veya kronik hastalığı olup uzun süredir immünyetmezlik ilacı kullanan pediatrik ve yetişkin kişilerden oluşmaktadır. İncelemeye alınan klinik örnekler: BAL, balgam, nazofaringeal sürüntü, ETA’dır.
2.2. Örneklerin Hazırlanması
Pneumocystis şüpheli 100 hastadan alınan balgam, BAL, ETA ve nazofaringeal sürüntü örnekleri çalışmada kullanıldı.
BAL, ETA ve nazofaringeal örnekler 10 dakika 13.000 rpm’de santrifüj edildi. Süpernatant atılarak çökelti Giemsa ve Gomori metenamin gümüşleme boyama için lama yayıldı, kurutuldu ve metanol ile tespit edildi.
DFA için BAL, ETA ve nazofaringeal örneklerden santrifüj sonrası dipteki çökelti 0,2-0,5 ml (pH 7,2) fosfat buffer saline (PBS) ile sulandırıldı, özel olarak üretilen teflon lamlara prosedüre uygun şekilde 25 μl yayılarak kurutuldu.%100’lük aseton ile tespit edilerek -20˚C’de en fazla 2 gün saklandı.
DFA için Balgam örneklerinin hazırlanması; içerisine eşit hacimde olacak şekilde % 0,3 DTT (dithiothreitol) içeren distile su ilave edildi. 37˚C’lik etüvde 30 dakika bekletildi. 13.000 rpm’de 5 dakika santrifüj edildi. 0,5 ml çökelti kalacak şekilde üstteki kısım döküldü. Dipteki çökelti 0,2-0,5 ml (pH:7,2) PBS ile sulandırıldı. DFA için özel teflon lamlara prosedüre uygun şekilde 25μl yayılarak kurutuldu. %100’lük asetonla 5 dakika tespit işlemi yapıldıktan sonra -20˚C de en fazla 2 gün saklandı.
12
2.3. Giemsa Boyama Yöntemi
Sıvı stok Giemsa boyası bir mezürde her lam için 3-4 ml olacak şekilde 1: 9 oranında distile su ile sulandırılıp karışım homojen hale gelene kadar çalkalandı.
Daha önceden metanol ile tespit edilen lamların üzerini hazırlanan Giemsa boyası dökülerek 30 dakika bekletildi. Bu süre sonunda lamlar şiddetli akmayan çeşme suyu ile yıkandı. Yıkama işleminden sonra lamlar kurumaya bırakıldı. Hazırlanan preparatlar immersiyon yağı damlatılarak mikroskopta immersiyon objektifi (100x) ile incelendi.
Boyama sonrası mikroskobik incelemede trofozoitler ve intrakistik cisimlerin koyu mor, kist sitoplazmasının eflatunumsu pembe görülmesi beklendi.
2.4. Gomori Metenamin Gümüşleme (Gomori-Grocot) Boyama Yöntemi
Boyama işlemi Bio Optica Milano (Milano, İtalya) kiti ile yapıldı. Çalışma firma önerileri doğrultusunda aşağıdaki gibi yapıldı.
Kit içerisindeki solüsyonlar ve açıklamaları A solüsyonu - Periodic Asit Solüsyon 1000 ml B solüsyonu - Silver Nitrate Solüsyon 1000 ml
C solüsyonu - Heksamethylentetramine Solüsyon 1000 ml D solüsyonu - Sodium Tetraborate Solüsyon 1000 ml E solüsyonu - Gold Klorit Solüsyon 1000 ml
F solüsyonu - Fixing Solüsyon 1000 ml
1. Boyama için daha önceden hazırlanıp tespit edilen preparat üzerine 10 damla A solüsyonu damlatılarak 20 dakika bekletildi.
2. 10 dakika sonunda preparat distile su ile yıkandı. 3. 10 damla B solüsyonu damlatılarak 1 dakika bekletildi.
4. Lamlar 5 dakika çeşme suyunda yıkandıktan sonra 4 kez distile su ile şale içerisinde yıkandı.
5. Lam saklama kabında 17 ml distile su içerisine 20 damla C solüsyonu,10 damla D solüsyonu ve 20 damla E solüsyonu damlatılarak karıştırıldı.
13 6. Preperat lam saklama kabının içerisine konularak 60˚C’lik etüvde 1saat
bekletildi.
7. Etüvden çıkan lam saklama kabı 10 dakika soğumaya bırakıldı. 8. Lamlar 6 kez distile su ile şale içerisinde yıkandı.
9. Preperat üzerine 10 damla F solüsyonu damlatılarak 3 dakika inkübasyona bırakıldı.
10. Distile su ile yıkandı.
Yıkama işleminden sonra lamlar kurumaya bırakıldı. Kuruyan lamlar ksilende bekletildikten sonra lamelle kapatıldı. Hazırlanan preparatlar immersiyon yağı damlatılarak mikroskopta immersiyon objektifi (100x) ile incelendi.
2.5. Direkt Floresan Antikor Boyama Yöntemi
Boyama işlemi Cellabs Pneumo cell (Brookvale, Avustralya) kiti ile yapıldı. Firma önerileri doğrultusunda aşağıdaki gibi çalışıldı.
Kullanılan solüsyonlar:
RP2 (Monoklonal Antibody Reagent) RM (Anti Mouse FITC Reagent) RMF (Mounting Fluid)
İndüklenmiş balgam ve diğer örneklerden alınan 25 μl PBS ile sulandırılan örnekler teflon lam üzerindeki kuyucuğa yayılıp havada kurutuldu. Örnekler kurutulduktan sonra %100’lük asetonla 5 dakika boyunca fiske edildi.
25 μl RP2 solüsyonu fikse edilmiş lam üzerine tüm kuyucuğu kaplayacak şekilde damlatıldı. Nemli etüvde karanlıkta 37˚C’de 30 dakika boyunca inkübe edildi. Bu işlem yapılırken lamların kurumamasına dikkat edildi. Etüvden çıkarılan lamlar şale içerisinde PBS ile 1-2 dakika yıkandıktan sonra fazla nemi atılarak kurutuldu.
25 μl RM solüsyonu kuyucukları kaplayacak şekilde damlatıldı. Nemli etüvde karanlıkta 37˚C de 30 dakika boyunca inkübe edildi. Etüvden çıkan lamlar PBS ile 1-2 dakika şale içerisinde yıkandıktan sonra kurutuldu.
14 Lamlara 1 damla RMF damlatıp lamelle kapatıldı. Floresan mikroskopta bakılmaya hazır hale gelen lamlar (40x) objektifte değerlendirildi.
Pozitif organizmaların tek ya da kümeler halinde ekstraselüler matrikste yuvarlak elma yeşili, parlak bir görüntü oluşturması beklendi.
2.6. Kantitatif PCR Yöntemi
2.6.1 Dekontaminasyon Yöntemi
Balgam ve diğer örnekler DNA izolasyonu yapılmadan önce dekontaminasyon işlemine alındı.
Dekontaminasyon işlemi aşağıdaki prosedüre göre yapıldı.
5-10 ml örnek 50 ml’lik tüplere ilave edildi. Üzerine eşit hacimde NaOH-NALC solüsyonu ilave edildi. 20 saniye vorteks işleminden sonra 20 dakika oda derecesinde bekletildi. Tüpler üzerine toplam hacim 50 ml olacak şekilde fosfat tampon çözeltisi ilave edildikten sonra 20 saniye vorteks yapıldı. Soğutmalı santrifüjde 3000 g’de 15 dakika santrifüj edilip üst sıvı atıldı. Çökelti üzerine 1-2 ml fosfat tampon çözeltisi eklenip vorteks yapıldı.
2.6.2. DNA İzolasyonu
DNA izolasyonu Qiagen-EZ1 RNA Tissue (Hilden, Almanya) kiti kullanılarak yapıldı. Çalışma firma önerileri doğrultusunda aşağıdaki gibi uygulandı.
-20˚C’de saklanan örnekler kantitatif PCR yapılmak üzere oda ısısında çözdürülüp vorteks yapıldı. Çözünen örnekler 13000 rpm’de 10 dakika santrifüj edilerek üzerindeki süpernatant atıldı.
1,5 ml‘lik ependorf tüpün içindeki çökeltinin üzerine 200 μl G2 ve 10 μl proteinaz K solüsyonu ilave edilerek vortekslendi. Isı bloğunda 56˚C’de 15 dakika daha sonra 95˚C’de 10 dakika inkübasyona bırakılan örneklerin oda sıcaklığına gelmesi beklendi.
15 Örnekler Qiagen EZ1 Advanced XL (Hilden, Almanya) cihazına otomatik izolasyon yapılmak üzere yerleştirildi. 15 dakika sonra izole edilmiş 50 μl DNA örneği elde edildi.
2.6.3. Kantitatif PCR
Kantitatif PCR, firma önerilerine göre Rotor-gene Q (Hilden, Almanya) cihazında yapıldı.
Kullanılan solüsyonlar aşağıdaki gibidir. 1. P. jirovecii primer prob miks 2. İnternal kontrol primer prob miks 3. Endogenous kontrol primer/prob miks 4. İnternal kontrol ekstraksiyon DNA 5. P.jirovecii pozitif kontrol
6. Kalıp preparasyon suyu
7. Precision plus 2x qPCR master miks kit
Liyofilize halde bulunan P.jirovecii primer prob miks, internal kontrol primer prob miks ve endogenous kontrol primer prob miks hacimleri 165 μl olacak şekilde saf su ile sulandırıldı. İnternal kontrol ekstraksiyon DNA hacmi 600 μl olacak şekilde saf su ile sulandırıldı.
Pozitif kontrol kalıp preparasyon suyu ile hacmi 500 μl olacak şekilde sulandırıldı. Pozitif kontrollerin hazırlanışı aşağıdaki gibidir.
5 adet 0,5 ml’lik ependorf tüpler hazırlandı ve her bir ependorf tüp içerisine 90 μl kalıp preparasyon suyu eklendi.
İlk tüpe 10 μl sulandırılan pozitif kontrol eklenerek vorteks yapıldı ilk tüpten 10 μl alınıp ikinci tüpe ikinci tüpten 10 μl alınarak üçüncü tüpe, beşinci tüpe kadar bu şekilde dilüsyon yapıldı. Son tüpteki 10 μl fazla solüsyon dışarı atıldı.
1. tüpteki DNA miktarı 200000 U/μl 2. tüpteki DNA miktarı 20000 U/μl 3. tüpteki DNA miktarı 2000 U/μl
16 4. tüpteki DNA miktarı 200 U/μl
5. tüpteki DNA miktarı 20 U/μl 6. tüpteki DNA miktarı 2 U/μl
İnternal kontrol ekstraksiyon solüsyonu DNA izolasyonu sırasında her bir örnek için 4 μl olacak şekilde ependorflara ilave edildi.
Çizelge 2.6.3.1. Her bir DNA örneği için master miks protokolü.
Çizelge 2.6.3.2. Her bir DNA örneği için endojen mastermiks protokolü.
Master miksler hazırlandıktan sonra ardından 1,5 ml’lik tüpler, örnek adedi kadar numaralandırılıp, içlerine 15’er μl hazırlanılan master miks ilave edildi. Daha sonra, ekstraksiyonu yapılan DNA, pozitif kontrol ve negatif kontrolden 5’er μl alınıp, ilgili tüplerin içerine eklenip ağızları kapatıldı. Toplam hacim 20 μl olacak şekilde tüm PCR tüpleri Qiagen Rotor-gene Q cihazına yerleştirilip DNA amplikasyonu gerçekleştirildi.
Solüsyon Miktar
Precision Plus 2x qPCR master miks 10 µl
P. jirovecii primer prob miks 1 µl
İnternal kontrol ekstraksiyon primer
prob miks 1 µl ddH2O 3 µl Toplam hacim 15 µl Solüsyon Miktar Precision Plus 2x qPCR Master miks 10 µl Endogenous kontrol primer/prob miks 1 µl ddH2O 4 µl Toplam hacim 15 µl
17 P. jirovecii için PCR cihazının döngü siklusları.
95˚C — 15 dakika 95˚C —10 saniye
60˚C —1 dakika 50 siklus şeklinde gerçekleştirildi. 72˚C — 20 saniye
18
3. BULGULAR
Çalışma Kasım 2013–Kasım 2014 tarihleri arasında Selçuk Üniversitesi Tıp Fakültesi Mikrobiyoloji laboratuvarında yapılmıştır. P.jirovecii ile infekte olabileceği düşünülen toplam 100 hastadan alınan BAL, balgam, ETA ve nazofaringeal sürüntü örnekleri işleme alınmıştır.
Çalışmaya alınan örneklerin 93’ü BAL, dördü balgam, ikisi ETA ve biri nazofaringeal sürüntü örneğidir.
Çizelge 3.1. P. jirovecii pozitif ve negatif bulunan hastaların servislere göre dağılımı.
Servisler
P. jirovecii pozitif
(DFA, Giemsa, Gomori metenamin gümüşleme,
PCR)
P. jirovecii negatif
(DFA, Giemsa, Gomori metenamin gümüşleme,
PCR)
Göğüs Hastalıkları 7 82
Reanimasyon - 1
Çocuk Onkoloji - 1
Dahiliye Yoğun Bakım - 2
Tıbbı Onkoloji 1 1
İnfeksiyon Hastalıkları - 2
Göğüs Cerrahisi - 2
Hematoloji Onkoloji - 1
TOPLAM 8 92
Çalışmaya alınan 100 hastanın 8’inde P.jirovecii saptanmıştır (% 8). 8 pozitif hastanın 3’ü kadın, 5’i erkektir. Pozitif kadın ve erkeklerin yaş ortalaması sırasıyla 53 ve 48 olarak hesaplanmıştır. P. jirovecii pozitifliği görülmeyen 92 hastanın 19’u kadın (% 21), 73’ü erkek (% 79)’dir. P.jirovecii pozitif ve negatif bulunan hastaların servislere göre dağılımı Çizelge 3.1.’de gösterilmiştir.
P. jirovecii pozitif bulunan 8 hastanın; 7’si bronş ve akciğer malign neoplasmi, 1 hasta ana bronş malign neoplasmi tanısı almıştır. 8 pozitif örnekten dördünün tanısı DFA, dördünün tanısı da PCR ile konmuştur. DFA pozitif bir hasta metenamin gümüşleme boyası ile de pozitif olarak saptanmıştır (Çizelge 3.2).
19
Çizelge 3.2. Toplam sekiz P.jirovecii pozitif bulunan örneğin yönteme ve hastaların
aldığı tanıya göre dağılımı.
Hasta Örnek DFA Giemsa
Gomori metenamin gümüşleme
PCR Tanı
1 Balgam + - - - Bronş ve akciğer
malign neoplasmi
2 BAL + - - - Bronş ve akciğer
malign neoplasmi
3 BAL + - - - Ana bronş malign
neoplasmi
4 BAL - - - + Bronş ve akciğer
malign neoplasmi
5 BAL - - - + Bronş ve akciğer
malign neoplasmi
6 BAL - - - + Bronş ve akciğer
malign neoplasmi
7 BAL + - + - Bronş ve akciğer
malign neoplasmi
8 BAL - - - + Bronş ve akciğer
malign neoplasmi
3.1. Hastaların Giemsa Sonuçları
Çalışmaya alınan BAL, balgam, ETA ve nazofaringeal sürüntü 100 örneklerinden Giemsa boyama sonucunda pozitif sonuç alınamamıştır.
3.2. Hastaların Gomori Metenamin Gümüşleme Sonuçları
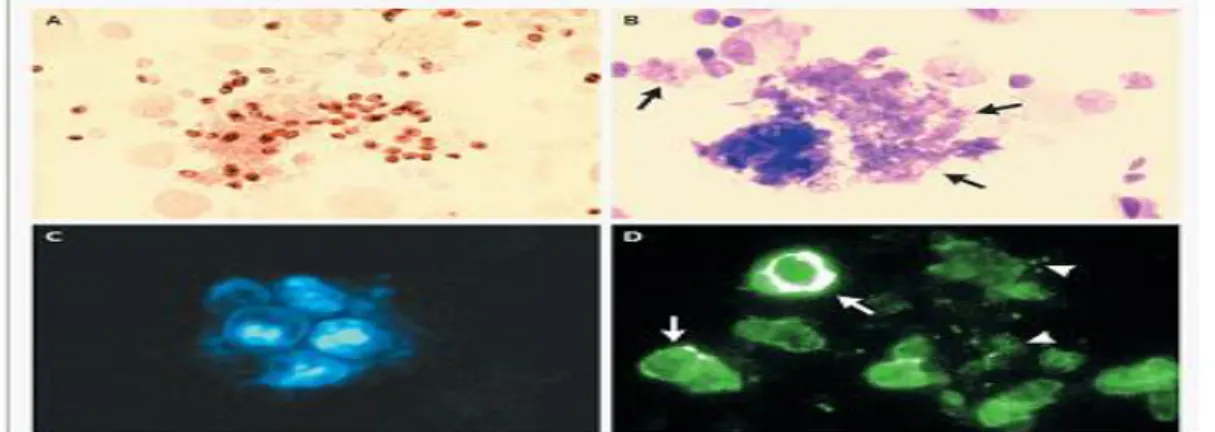
Çalışmaya alınan BAL, balgam, ETA ve nazofaringeal sürüntü 100 klinik örnekten Gomori metenamin gümüşleme boyama sonucunda bir pozitif sonuç alınmıştır (Şekil 3.2.1).
20
Şekil 3.2.1. P.jirovecii Gomori Metenamin Gümüşleme pozitif örnek
mikroskobisi.
3.3. Hastaların DFA Sonuçları
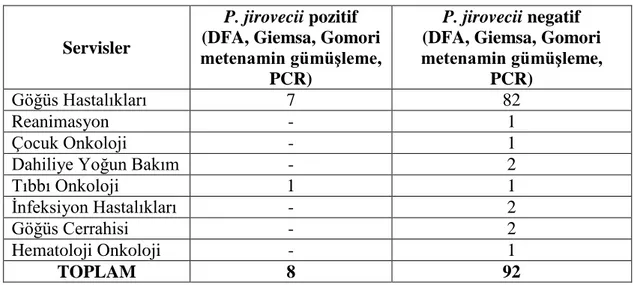
Çalışmaya alınan toplam 100 örneğin (BAL, balgam, ETA ve nazofaringeal sürüntü) DFA boyama sonucunda; BAL örneklerinin dördünde pozitif sonuç alınmıştır (Şekil 3.3.1).
Şekil 3.3.1. P.jirovecii DFA pozitif örnek mikroskobisi 3.4. Hastaların PCR Sonuçları
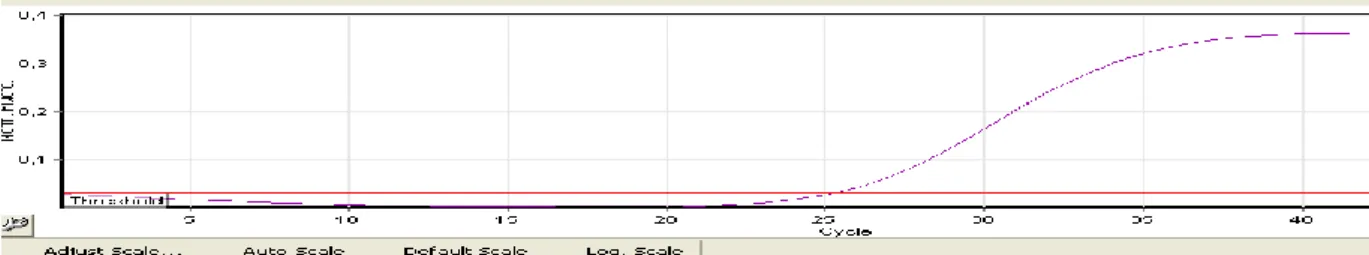
Çalışmaya alınan toplam 100 örneğin (BAL, balgam, ETA ve nazofaringeal sürüntü) kantitatif PCR sonucunda; BAL örneklerinin dördünde pozitif sonuç alınmıştır.
Şekil 3.4.1. P.jirovecii 470-510 nm de okunan kantitatif PCR pozitif hasta
sonucu (Çalışmamızdan).
21
Şekil 3.4.2. P.jirovecii 530-550 nm de okunan kantitatif PCR pozitif hasta
internal kontrol sonucu (Çalışmamızdan).
22
4. TARTIŞMA
Pneumocystis pnömonisi %20’den fazla mortalite hızıyla tüm immünyetmezlikli hastalar için korkulan bir hastalık olmaya devam etmektedir (Hauser ve ark 2011).
Pneumocystis pnömonisi HIV ile enfekte olan hastalarda daha fazla görülmesine rağmen diğer immünyetmezlik hastalarında da görülebilmektedir. (Transplantasyon hastaları, anti-tümör tedavisi alanlar gibi) (Matsumura ve ark 2011).
Ülkemizde 2003-2011 yılları arasında toplanan Pneumocystis şüpheli 255 solunum yolu örneğine DFA testi uygulanmış; 138’i (%54) pozitif, 117’si(%46) negatif olarak bulunmuştur. Pozitif bulunan hastaların %54’ü hematolojik malignitesi olan hastalardır buna göre hematolojik malignite HIV dışında P. jirovecii pozitif hastalarda, altta yatan en sık hastalık olarak belirlenmiştir (Yanık ve ark 2012). Bizim çalışmamıza aldığımız toplam 100 örneğin tanıları; 64 hasta bronş ve akciğer malign neoplazmi, 6 hasta ana bronş akciğer malign neoplazmi, 65 hasta da pnömonidir. Hastalardan birinde ise HIV pozitiftir. DFA pozitif üç örneğin tanısı bronş ve akciğer malign neoplazmi biri ise ana bronş malign neoplazmidir. Kantitatif PCR pozitif dört örneğin tanısı bronş ve akciğer malign neoplazmidir. Gomori metenamin gümüşleme pozitif örneğin tanısı bronş ve akciğer malign neoplazmidir.
PCP kesin tanısı balgam, indüklenmiş balgam, BAL, trakeal aspirasyon gibi örneklerle P.jirovecii’nin morfolojik olarak gösterilmesiyle konur. Normal balgam örneğinin tanı değeri indüklenmiş balgam örneğinin tanı değerinden daha düşüktür. İnvaziv BAL ve akciğer biyopsisi örneklerinin tanı değeri indüklenmiş balgamdan daha yüksektir (Yıldıran 2008). Bizim çalışmaya aldığımız örneklerin 93’ü BAL, dördü balgam, ikisi ETA ve bir örnek nazofaringeal sürüntüdür. DFA pozitif dört örneğin üçü BAL biri indüklenmiş balgam’dır. PCR pozitif dört örneğin tümü BAL örneğidir. Gomori metenamin gümüşleme pozitif bir örnekte BAL örneğidir.
P. jirovecii’nin kültürü yapılamadığından spesifik tanısı respiratuvar örneklerde antijenin saptanmasına ya da mikroskobik incelemeye bağlıdır. P. jirovecii’nin mikroskobik tanısı Giemsa, Papanicolaou, Gomori metenamin gümüşleme ve DFA boyalarının yanı sıra monokolonal antikorları kullanarak histokimyasal boyama yöntemleri ile de yapılmaktadır (Nassar ve ark 2006).
23 Böbrek transplantasyonu sonrası pnömoni gelişen bir hastadan alınan BAL örnekleri ile yapılan çalışmada Giemsa, Gomori metenamin gümüşleme ve toluidin blue O boyaları ile tanıya gidilmiş. P. jirovecii trofozoit ve kistleri saptamıştır (Özkoç ve ark 2010). PCP tanısında kullanılan farklı milkroskobik yöntemlerin tanısal değerlerinin karşılaştırıldığı çalışmada DFA boyama (%91), kalkoflor mavisi (%74), gümüşleme (%77) ve Diff-quik (%48) boyalarına göre istatiksel olarak daha duyarlı bulunmuştur (Hauser ve ark 2011). Bizim çalışmamızda da Gomori metenamin gümüşleme, DFA, Giemsa boyaları kullanılmıştır. Gomori metenamin gümüşleme boyama ile bir pozitif, DFA boyama ile dört pozitif sonuç elde edilmiştir. Gomori metenamin gümüşleme ile pozitif bulunan bir hasta DFA ile de pozitif bulunmuştur. Giemsa boyama ile pozitif sonuç bulunamamıştır.
Son on yılda, rutin boyama yöntemleriyle saptanamayan sayıca düşük P. jirovecii seviyelerinin saptanmasına imkan sağlayan kantitatif PCR testi geliştirilmiştir. Yapılan çalışmalarda uygulanabilirliği, duyarlılığı ve özgüllüğü açısından kantitatif PCR testinin altın standart olarak düşünülen direkt floresan testinin yerine kullanılabileceği gösterilmiştir (Fillaux ve ark 2013).
HIV ile enfekte olmayan hastalarda HIV ile enfekte olan hastalardan daha düşük mantar yükü ile PCP gelişebilir bu durum mikroskobik incelemede yanlış negatifliklere neden olmaktadır. Bu nedenle PCR, PCP tanısı için yüksek duyarlılıkta bir yöntem olarak kullanılabilmektedir. Pnömoni belirti ve bulguları olmayan kişilerde Pneumocystis DNA’sının tespiti P.jirovecii kolonizasyonu olarak tanımlanmıştır. Geleneksel PCR’de pozitif sonuçlar kolonizasyonu infeksiyondan ayıramamasına rağmen kantitatif PCR kullanılarak yapılan çalışmalarda PCP hastalarındaki pnömoniye özgü gen kopyalarının sayısı kolonize olanlara göre daha yüksek olduğu görülmüştür (Matsumura ve ark 2011).
P. jirovecii tanısı ile ilgili yapılan bir çalışmada Giemsa, toluidin blue O, DFA ve PCR ile karşılaştırılmalı tanıya gidilmiş ve 57 klinik örnek çalışmaya alınmıştır. 7 (%12,3) kantitatif PCR pozitif örneğin Giemsa ile beşi (%8,7), toluidin mavisi O ile dördü (%7), DFA ile 6 ‘sı (%12,3) pozitif olarak sonuçlandırılmıştır. Örneklerden sadece bir tanesi DFA ile pozitif, kantitatif PCR ile negatif bulunmuştur. Yapılan
24 çalışma sonucunda kantitatif PCR’a göre Giemsa duyarlılığı %72, toluidin mavisi O duyarlılığı %57, DFA duyarlılığı %86 bulunmuştur (Durgut 2013).
Ülkemizde Pneumocystis kolonizasyonu ve tanıda kullanılan yöntemlerin karşılaştırılması ile ilgili yapılan diğer bir çalışmada BAL ve bronş lavaj örneklerinden 100 hastada Gomori metenamin gümüşleme, toluidin mavisi O, Wright-Giemsa, DFA ve nested PCR ile tanıya gidilmiştir. Gomori metenamin gümüşleme, toluidin mavisi O ve Wright-Giemsa ile pozitif sonuç alınamamıştır. DFA testi ile 13 hastada (%13), nested PCR ile 16 hastada (%16) P.jirovecii pozitif olarak bulunmuştur. 8 hastada hem PCR hem DFA sonuçları pozitif bulunmuştur (%8). P. jirovecii saptanan hasta örneklerinin 13’ü BAL (%13), 8’i bronş lavaj (%8) örneğidir (Özmen 2011)
Erciyes Üniversitesinde yapılan bir çalışmada toplamda 100 BAL, ETA, nazotrakeal aspirat, plevra örneklerin de P. jirovecii araştırılmış, tanıya Giemsa boyama, DFA, kantitatif PCR ile gidilmiştir. Giemsa boyama, DFA ve kantitatif PCR testlerinde iki BAL örneği pozitifken (%2), 6 BAL örneğinde sadece kantitatif PCR ile pozitif (%6) bulunmuştur (Tekinşen 2011).
Dokuz Eylül Üniversitesi Tıp fakültesinde, immün sistemi normal ve iyatrojenik olarak baskılanmış hastalarda PCP ve P.jirovecii kolonizasyonu araştırılmak üzere bronkoskopi yapılan toplam 92 hasta (66 erkek, 26 kadın; yaş aralığı: 18-93 yıl, ortanca: 58.5) çalışmaya alınmıştır. Çalışmaya alınan hastaların 65’i immünoyetmezlik ilacı (38’i anti-kanser, 15’i anti-rejeksiyon/immünomodülatör ve 12’si kortikosteroid tedavisi alan, 27’si ise almayan hastalardır. Hastalara ait BAL sıvısı örnekleri P.jirovecii ribozomal RNA büyük alt ünitesini kodlayan mitokondriyal geni çoğaltan iki turlu nested PCR yöntemi ile değerlendirilmiş; ayrıca tüm örnekler Giemsa ve Gomori metenamin gümüş boyama yöntemiyle boyanarak incelenmiştir. Çalışmada, nested PCR ile 92 BAL örneğinin 31 (%33,7)’inde P.jirovecii DNA’sı saptanmıştır. Birinci PCR aşamasında, immünosüpresif altı (%6,4) hasta pozitif iken, nested PCR ile immünoyetmezlikli 65 hastanın 26 (%40)’sı ve immünokompetan 27 hastanın beşi (%18,5) pozitif bulunmuştur. Nested PCR ile pozitif saptanan 31 örneğin sadece beşinde (%16,1) Giemsa ve boyaları ile P.jirovecii kist ve trofozoitleri gözlenmiştir (Özkoç ve Delibaş 2015)
25 Fransa’da yapılan çok merkezli bir çalışmada bağışıklığı baskılanmış 287 hastada ateş ve/veya pnömoniyi araştırmak üzere alınmış 353 ardışık BAL sıvısı incelenmiştir. 17 numune (%5) hem DFA hem de PCR ile pozitif, 63 numune (%18) DFA negatif fakat PCR pozitif, 273 numune (%77) ise hem DFA hemde real-time PCR negatif olarak saptanmıştır (Botterella ve ark 2011).
Japonyada yapılan bir çalışmada bağışıklığı baskılanmış pulmoner infiltratlı hastalarda P.jirovecii kolonizasyonunu PCP’den ayırmak için kantitatif PCR ve 1-3 β-D glukan testleri yapılmıştır. Aynı çalışmada PCP’li olduğundan şüphelenilen toplam 147 hastanın 40’ı BAL, 107’si indüklenmiş balgam numesi, kesin PCP’li 11, muhtemel PCP’li 42, P. jirovecii kolonizasyonlu 15 ve kolonizasyonsuz 60 hasta çalışmaya alınmıştır. PCR ve 1-3 β-D glukan test sonuçlarındaki pozitiflik PCP hastaları ile muhtemel PCP hastalarında, kolonize hastalara göre anlamlı ölçüde daha fazla bulunmuştur. Gerek kantitatif PCR gerek 1-3 β-D glukan testleri P.jirovecii kolonizasyonunu gerçek PCP’den ayırt etmede yüksek derecede, muhtemel PCP’den ayırt etmede orta derecede doğruluk göstermiştir. Tanıda kullanılan 1-3 β-D glukan serum belirteçleri arasında PCP tanısı için en iyi test olarak belirlenmiştir. Ancak 1-3 β-D glukan testi ile P.jirovecii’yi kolonizasyondan ayırmak için yapılan çalışmalar sınırlı sayıdadır (Matsumura ve ark 2011). Bizim çalışmamamızda 1-3 β-D glukan testi çalışılmamıştır. Bizim çalışmaya aldığımız 100 örnekten dördünde sadece DFA pozitif (%4), dördünde sadece kantitatif PCR pozitif (%4), bir örnekte ise hem DFA hem de Gomori metenamin gümüşleme pozitif (%1) olarak saptanmıştır.
Pneumocystis’in kistik ve trofozoit evrelerini mikroskobik yöntemler doğrulasa da Pneumocystis tanısı için en iyi korelasyonu gösterse de PCR temelli yöntemler hastalarda Pneumocystis infeksiyonun tanısına daha duyarlı ve uyumludur. Diğer yandan mikroskobinin tanısal performansı değişkendir. Örneğin test edilen materyaldeki organizma sayısı ve mikroskobu değerlendiren kişinin tecrübesine yüksek oranda bağlıdır (Tia ve ark 2011).
26
5. SONUÇ ve ÖNERİLER
P. jirovecii son yıllarda immünyetmezlikli hastalarda tehdit oluşturan bir etken olmaya devam etmektedir buda P. jirovecii’ye olan ilgiyi arttırmıştır. P. jirovecii tanısında altın standart olarak kabul edilen DFA yönteminin yerini son yıllarda yüksek derecede duyarlı bir teknik olması sebebiyle PCR testleri almıştır.
Bizim çalışmamıza aldığımız 100 örnek BAL, balgam, ETA, nazofaringeal sürüntü örnekleridir. Bu örneklerde PCR, DFA, Giemsa ve Gomori metenamin gümüşleme tanı yöntemleri ile P. jirovecii araştırılmıştır ve farklı örneklerde farklı yöntemlerle pozitiflikler bulunmuştur. Dört örnekte DFA pozitif (%4), dört örnekte kantitatif PCR pozitif (%4), bir örnekte ise hem DFA hem de Gomori metenamin gümüşleme pozitif (%1) bulunmuştur. P. jirovecii pozitif olan sekiz hastanın; yedisi bronş ve akciğer malign neoplasmi iken, bir hasta ana bronş malign neoplasmidir. DFA çalışılıp pozitif bulunan dört örneğin üçü BAL, biri indüklenmiş balgamdır. Kantitatif PCR pozitif bulunan dört örneğin tümü BAL örneğidir. Gomori metenamin gümüşleme pozitif bir örnekte BAL’dır.
Çalışmamızda pozitiflikler farklı hastalardan alınan örneklerde farklı yöntemlerle saptanmıştır. Bir hastadan alınan örnekte iki boyama yönteminde (DFA ve Gomori metanamin gümüşleme P.jirovecii saptanmıştır. Bu bize tanıda tek yönteme bağlı kalınmaması gerektiğini düşündürmektedir. Giemsa çok kullanılan bir yöntem olmasına rağmen kişisel deneyimler ön plana çıkmaktadır ayrıca mikroorganizma sayısı da tanı da çok önemlidir Pneumocystis infeksiyonun tanısında PCR temelli yöntemler daha duyarlı ve uyumludur. Diğer yönden DFA yöntemi ise tanımlamada tecrübe ve birikim gerektiren bir yöntemdir ancak altın standart olarak kabul edilmektedir. Sonuç olarak bulgularımıza göre klinik şüphe varsa P.jirovecii tanısında en az iki yöntemin birlikte kullanılması gerektiği ve laboratuvar imkanları varsa hem DFA hem de PCR’ın birlikte yapılmasının uygun olacağı düşünülmüştür.
27
6. KAYNAKLAR
Armbruster C, Pokieser L, Hassl A. 1995. Diagnosis of Pneumocystis carinii pneumonia by bronchoalveolar lavage in AIDS patients. Comparison of Diff-Quik, fungifluor stain, direct immunofluorescence test and polymerase chain reaction, Acta Cytol, 39 (6), 1089-93.
Arend SM, Kroon FP, Vant Wout JW. 1995. Pneumocystis carini pneumonia in patients without AIDS, 1980 through 1993. Ananalysis of 78 cases, Arch Intern Med., 155, 2436-41.
Beard CB, Carter JL, Keely SP, Huang L, Pieniazek NJ, Moura INS, Roberts JM ve ark. 2000. Genetic variation in Pneumocystis carinii ısolates from different geographic regions: ımplications for transmission, Emerging Infectious Diseases, 3, 265-71.
Benson CA, Kaplan JE, Masur H, Pau A, Holmes KK. 2004. Treating opportunistic infections among HIV-infected adults and adolescents, MMWR Recomm Rep., 17, 53 (RR-15), 1-112.
Botterel F, Cabaret O, Foulet F, Cordonnier C, Costa JM. and Bretagnea S. 2011. Clinical Significance of Quantifying Pneumocystis jirovecii DNA by using Real-Time PCR in bronchoalveolar lavage fluid from imunocompromised patients, Journal of Clinical Microbiology, 227-31.
CDC Home Centers for Disease Control and Prevention, DPDx-Laboratory Identification of Parasitic Diseases of Public Health Concern Erişim tarihi 27 Nisan 2015, Erişim adresi, http://www.cdc.gov/dpdx/pneumocystis/gallery.html.
Cooley L, Dendle C, Wolf J, Teh B W, Chen SC, Boutlis C ve Thursky K. A. 2014, Consensus guidelines for diagnosis, prophylaxis and management of Pneumocystis jirovecii pneumonia in patients with haematological and solid malignancies, Internal Medicine Journal 44,1350-64.
Dumoulin A, Mazars E, Seguy N, Gargallo-Viola D, Vargas S, Cailliez JC, Aliouat EM, Wakefield AE, Dei-Cas E. 2000. Transmission of Pneumocystis carinii disease from immunocompetent contacts of infected hosts to susceptible hosts, Eur J Clin Microbiol Infect Dis., 19, 671-8.
Durgut EG. 2013. Pneumocystis jiroveci tanısında gıemsa, toluidine blue O (TBO), direk floresan antikor (DFA) ve gerçek zamanlı polimeraz zincir reaksiyonu (PZR) yöntemlerinin karşılaştırılması, Yüksek Lisans Tezi, Gazi Üniversitesi Sağlık Bilimleri Enstitüsü, Ankara.
Edman JC, Kovasc JA, Masur H, Santi DV, Elwood HJ, Sogin ML. 1988. Ribosomal RNA sequence shows Pneumocystis carinii to be a member of the Fungi, Nature, 11, 334 (6182), 519-22.
Edman JC, Edman U, Cao M, Lundgren B, Kovacs JA, Santi DV. 1989. Isolation and expression of the
Pneumocystis carinii dihydrofolate reductase gene. Proc. Natl. Acad. Sci., 86, 8625- 29.
Elbüken G. 2007. Pneumocystis jiroveci infeksiyonu ve akciğer tutulumu, Uludağ Üniversitesi Tıp Fakültesi Dergisi, 33 (2), 97-103.
Fillaux J. and Berry A. 2013. Real-Time PCR Assay for the Diagnosis of Pneumocystis jirovecii Pneumonia, Methods in Molecular Biology, 943, 159-70.
Girginkardeşler N, Ok Ü, Korkmaz M. 2007. Pneumocystis pnömonisi. Özcel MA., Özbel Y., Ak M. eds., Özcel’in Tıbbi Parazit Hastalıkları, Türkiye Parazitoloji Derneği Yayını : 22, 451-72.
Güneş İ, Kalkancı A, Kuştimur S, Ergüven S, Özet G, Ekim N. 2002. Pneumocystis carinii pnömonisi tanısında gomori metenamin gümüşleme, direkt floresan antikor ve iki türlü polimeraz zincir reaksiyonu yöntemlerinin karşılaştırılması, Mikrobiyoloji Bült., 38,105-12.
Hauser PM, Bille J, Lass-Florl C, Geltner C, Feldmesser M, Levi M ve ark. 2011. Multicenter, Prospective Clinical Evaluation of Respiratory Samples from Subjects at Risk for Pneumocystis
28 jirovecii ınfection by use of a commercial Real-Time PCR assay, Journal of Clinical Microbiology,
49(5), 1872–78.
Ishımaru T, Shimono N, Sawae Y ve Niho Y. 1992. Purification of Pneumocystis carinii trophozoites and identification of their circulating antigens, Journal of Clinical Microbiology, 30 (12), 3263-67. Kalyoncu U, Karadag O, Akdogan A, Kısacık B, Erman M, Erguven S ve Ertenli AI. 2007. Pneumocystis
carini pneumonia in a rheumatoid arthritis patient treated with adalimumab, Scandinavian Journal of Infectious Diseases, 1-3.
Lipschik GY, Andrawis VA, Ognibene FP, Kovacs JA, Gill, VJ, Nelson, NA, Lundgren, JD, Nielsen, JO. 1992. Improved diagnosis of Pneumocystis carinii infection by polymerase chain reaction on induced sputum and blood, Elsevier, 2 (8813), 203–6.
Masur H, Jones TC. 1978. The interaction in vitro of Pneumocystis carinii wıth macrophages and L-cells, The Journal of Experimental Medicine, 147, 157-70.
Matsumura Y, Ito Y, Iinuma Y, Yasuma K., Yamamoto M, Matsushima A, Nagao M, Takakura S ve Ichiyama S. 2011. Quantitative real-time PCR and the (1 fi 3)-b-D-glucan assay for differentiation between Pneumocystis jirovecii pneumonia and colonization, Clin Microbiol Infect, 18, 591–7. Medrano FJ, Respaldiza N, Medrano A, Varela JM, Montes-Cano M, de la Horra C, Wichmann I, Ferrer
S ve Calderón E. 2003. seroprevalence of Pneumocystis human ınfection in southern Spain, The Journal of Eukaryotic Microbiology, 50 (6), 649-50.
Miller RF. 1999. Pneumocystis carinii infection in non AIDS patients. Current Opin Infec. Dis., 12, 371. Nassar A, Zapata M, Little JV ve Siddiqui MT. 2006. Utility of reflex gomori methenamine silver
staining for Pneumocystis jiroveci on bronchoalveolar lavage cytologic specimens: A review, Diagnostic Cytopathology, 34 (11), 719-23.
Ng VL, Gartner I, Weymouth LA, Goodman CD, Hopewell PC, Hadley WK. 1989. The use of mucolysed induced sputum for the identification of pulmonary pathogens associated with human immunodeficiency virus infection, Arch Pathol Lab Med., 113, 488-93.
Olsson M, Lidman C, Latouche S, Björkman A, Roux P, Linder E, Wahlegren M. 1998. Identification of
Pneumocystis carinii f. sp. hominis gene sequences in filtered air in hospital environments, Journal
of Clinical Microbiology, 1737–1740.
Olsson M, Stralin K., Holmberg H. 2001. Clinical significance of nested polymerase chain reaction and immunofluorescence for detection of Pneumocystis carinii pneumonia, Clin Microbiol Infect, 7 (9), 492-97.
Özkoç S, İnceboz T, Sifil A, Tuncay S, Akısü Ç. 2010. Böbrek transplantasyonunda Pneumocystis pnömonisi, Turkiye Parazitol Derg., 34, 186-9.
Özkoç S, Delibaş BS. 2015. İyatrojenik immünosüpresif ve immünokompetan hastalarda pneumocystis
jirovecii pnömonisi ve kolonizasyonunun araştırılması, Mikrobiyoloji Bul 49 (2), 221-30.
Özmen A. 2011. Bronkoalveolar lavaj (BAL) ve bronşial lavaj (BL) yapılan hastalardaki Pneumocystis
jirovecii kolonizasyonu ve tanıda kullanılan yöntemlerin karşılaştırması, Uzmanlık Tezi, Uludağ
Üniversitesi, Sağlık Bilimleri Enstitüsü, Bursa.
Quist J ve Hill AR. 1995. Serum Lactate Dehydrogenase (LDH) in Pneumocystis carini Pneumonia, Tuberculosis and Bacterial Pneumonia, Chest, 108, 415-8.
Ruffolo JJ, Cushion MT. and Walzer PD.1986. techniques for examining Pneumocystis carinii in fresh specimens, Journal of Clinical Microbiology, 27(1), 17-21.
29
Stringer JR, Beard CB, Miller RF, Wakefield AE. 2002. A new name (Pneumocystis jirovecii) for
Pneumocystis from humans. Emerg Infect Dis, 8, 891-96.
Tekinşen FF. 2011. Klinik örneklerde çeşitli yöntemlerle Pneumocystis jirovecii araştırılması, Doktora Tezi, Erciyes Üniversitesi Sağlık Bilimleri Enstitüsü, Kayseri.
Thomas CF, Limper AH. 2004. Pneumocystis pneumonia: The new England, Journal of Medicine, 350, 2487.
Tia T, Putaporntip C, Kosuwin R, Kongpolprom N, Kawkitinarong K. And Jongwutiwes S. 2012. A highly sensitive novel PCR assay for detection of Pneumocystis jiroveci DNA in bronchoalveloar lavage specimens from immunocompromised patients, Clin Microbiol Infect, 18, 598–603.
Vargas SL, Hughes WT, Santolaya ME, Ulloa AV, Ponce CA, Cabrera CE, Cumsille F, Gigliotti F. 2001. Search for primary ınfection by Pneumocystis carinii in a cohort of normal, healthy infants primary
P. carinii infection in healthy infants, CID, 32, 855-61.
Wakefıeld EA. 1996. DNA sequences identical to Pneumocystis carinii f. sp. carinii and Pneumocystis
carinii f. sp. hominis in samples of air spora, Journal of Clinical Microbiology, 1754–9.
Walzer PD, Smulian AG. 2010. Pneumocytis species. In: Mandell GL, Bennett JE, Dolin R (eds), Principles and Practatice of Infectious Diseases, Philadelphia: Churchill Livingstone; 3377-87. Yanık K, Karadağ A, Usta E, Ünal N, Yılmaz H, Hökelek M. 2012. Pneumocystis jirovecii pnömonisi
şüphesi ile 2003-2011 yılları arasında Ondokuz Mayıs Üniversitesi Tıp Fakültesi Parazitoloji Laboratuvarına gönderilen solunum yolu örneklerinde direkt floresans antikor test sonuçlarının değerlendirilmesi, Türk Mikrobiyoloji Cem Derg., 42 (4), 132-6.
Yıldıran ŞT. 2008. Pneumocystis türleri, In:İnfeksiyon Hastalıkları ve Mikrobiyolojisi, Ed: Willke Topçu A, Söyletir G, Doğanay M, 3.baskı, İstanbul, Nobel tıp kitabevleri, 2469- 76.
Yoshida Y, Yamada M, Shiota T, Ikai T, Takeuchi S, Ogino K. 1981. Provocation experiment: Pneumocystis carinii in several kinds of animals, Zentralbl Bacteriol Mikrobiology Hyg A., 250, 206-12.
30
7.EKLER
31
8.ÖZGEÇMİŞ
1986 yılında Muğla’da doğdu. 2010 yılında Selçuk Üniversitesi Fen Fakültesi Biyoloji Bölümünden mezun oldu. 2012 yılında Selçuk Üniversitesi Tıp Fakültesi Tıbbı Mikrobiyoloji Anabilim Dalında yüksek lisansa başladı. Halen yüksek lisans eğitimine devam etmektedir.