T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
ENZĠM MĠMĠK ÇALIġMALARINDA VE LĠPAZ ĠMMOBĠLĠZASYONUNDA KULLANILABĠLECEK KALĠKSAREN
BĠLEġĠKLERĠNĠN SENTEZĠ VE BAZI ENANTĠYOSEÇĠMLĠ TEPKĠMELERDE
KULLANILMASI
Arzu UYANIK DOKTORA TEZĠ
Kimya Anabilim Dalı
Eylül-2011 KONYA Her Hakkı Saklıdır
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Arzu UYANIK
iv ÖZET
DOKTORA TEZĠ
ENZĠM MĠMĠK ÇALIġMALARINDA VE LĠPAZ ĠMMOBĠLĠZASYONUNDA KULLANILABĠLECEK KALĠKSAREN BĠLEġĠKLERĠNĠN SENTEZĠ VE BAZI
ENANTĠYOSEÇĠMLĠ TEPKĠMELERDE KULLANILMASI
Arzu UYANIK
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
DanıĢman (lar): Yrd. Doç. Dr. Nejdet ġEN Prof. Dr. Mustafa YILMAZ
2011, 182 Sayfa Jüri
Prof. Dr. Ayhan Sıtkı DEMĠR Yrd. Doç. Dr. Nejdet ġEN Prof. Dr. Mustafa YILMAZ Prof. Dr. Abdülkadir SIRIT
Doç. Dr. Aydan YILMAZ
Kaliksarenler, çok sayıda bileşikle konak-konuk kompleksleri oluşturabilmelerinden dolayı supramoleküler kimyada makrosiklik bileşiklerin önemli bir sınıfını temsil ederler. Kaliks[4]arenler çok sayıda uygulama için hem fenolik OH gruplarından hem de fenolik halkanın p- pozisyonlarından kolaylıkla fonksiyonlandırılabilirler.
Bu tez farklı kaliks[4]aren bileşiklerinin sentezlenmesini ve onların enzim-mimik ve lipaz immobilizasyonu çalışmalarında kullanılmalarını kapsayan iki uygulama alanını içermektedir. Bu amaç için imidazol ve amit grubu taşıyan kaliks[4]aren türevleri sentezlendi ve yapıları FTIR, 1HNMR ve 13CNMR gibi spektroskopik yöntemlerle aydınlatıldı. Sentezlenen imidazol bazlı kaliks[4]aren türevleri enzim-mimik çalışmalarında kullanıldı. Yapılan kinetik çalışmalar sonucu bunlardan bazılarının hem p-nitrofenil asetat (p-NPA) hem de p-nitrofenil palmitat (p-NPP)‟ın hidroliz reaksiyon hızlarını önemli derecede artırdığı gözlendi.
Kaliks[4]aren amit türevleri Candida rugosa lipaz (CRL)‟ın sol-jel immobilizasyonu prosesinde yeni katkı maddeleri olarak kullanıldı. Kaliksaren bazlı immobilize lipazların katalitik etkinliklerini araştırmak için rasemik Naproksen metil esteri ve rasemik 2-fenoksi propiyonik asit metil esterinin enantiyoseçimli hidroliz reaksiyonları kullanıldı. Kaliks[4]aren bazlı immobilize lipazların kullanılması ile serbest sol-jel lipazla kıyaslandığında enantiyoseçimlilikte önemli bir artış olduğu görüldü.
v ABSTRACT
Ph.D THESIS
SYNTHESĠS OF CALIXARENE DERIVATIVES FOR LIPASE
IMMOBILIZATION AND ENZYME-MIMIC STUDIES AND THEIR USE FOR SOME ENANTIOSELECTIVE REACTIONS
Arzu UYANIK
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
DOCTOR OF PHILOSOPHY IN CHEMISTRY
Advisor(s): Assist. Prof. Nejdet ġEN Prof. Mustafa YILMAZ
2011, 182 Pages
Jury
Prof. Ayhan Sıtkı DEMĠR Assist. Prof. Nejdet ġEN Prof. Mustafa YILMAZ Prof. Abdülkadir SIRIT Assoc. Prof. Aydan YILMAZ
Calixarenes represent an important class of macrocyclic compound due to their potential for forming host–guest complexes with numerous classes of compounds in supramolecular chemistry. Calix[4]arenes can be easily functionalized both at the phenolic OH groups (lower rim) and, at the para positions of the phenol rings (upper rim) to tailor them for many applications.
This thesis covers the synthesis of different calix[4]arene derivatives in order to utilize them in the enzyme mimic and enzyme immobilization studies. For this purpose, calix[4]arenes bearing imidazol and amide were synthesized and characterized by the spectroscopic techniques such as FTIR, 1HNMR and 13
CNMR. The synthesized imidazol based calix[4]arene derivatives were tested as enzyme models. From the kinetic studies, some of them showed significant rate accelerations in the hydrolyze reaction of both p-NPP (p-nitrophenyl palmitate) and p-NPA (p-nitrophenyl acetate).
Calix[4]arene amide derivatives were used as the new additives for the immobilization of Candida rugosa lipase (CRL) by sol-gel method. The catalytic properties of those immobilized derivatives were assessed in both the enantioselective hydrolysis reactions of (R,S)-Naproxen methyl ester and (R,S)-2-phenoxy propionic acid methyl ester. Improved enantioselectivity was observed with the calixarene-based immobilized lipases as compared sol-gel free lipase.
vi ĠÇĠNDEKĠLER TEZ BĠLDĠRĠMĠ ... iii ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... x 1. GĠRĠġ ... 1 1.1. Supramoleküler Kimya ... 1 1.1.1. Konak-konuk kimyası ... 2 1.1.2. Kaliksarenler ... 4 1.1.2.1. p-ter-Bütilkaliks[4]aren‟in sentezi ... 5 1.1.2.2. Kaliks[4]arenlerin konformasyonları ... 6 1.1.2.3. Kaliksarenlerin fonksiyonlandırılması ... 7
1.1.2.4. Kaliksarenlerin uygulama alanları ... 9
1.2. Enzimler ... 14
1.2.1. Yapay Enzimler ... 15
1.2.2. Enzim-mimik olarak kaliksarenler ... 16
1.3. Lipaz ... 17
1.3.1. Ara yüzeysel aktivasyon ... 18
1.3.2. Lipaz kaynakları ... 19
1.3.3. Lipazların özellikleri (Öztürk, 2001) ... 21
1.3.4. Lipaz katalizli reaksiyonlar ... 23
1.4. Enzim İmmobilizasyonu ... 24
1.4.1. İmmobilizasyon metotları ... 25
1.4.1.1. Adsorpsiyon-temelli immobilizasyon ... 26
1.4.1.2. Kovalent bağlanma ile enzim immobilizasyonu ... 26
1.4.1.3. Enzim hapsetme ... 27
1.4.1.4. Sol-jel bazlı enzim immobilizasyonu ... 28
1.4.1.4.1. Enzim immobilizasyonunda kullanılan sol-jel matriksinin kimyasal yapısı: ... 30
vii
2. KAYNAK ARAġTIRMASI ... 33
2.1. Lipaz İmmobilizasyonu ... 33
2.2. “Enzim-Mimik” Olarak Kaliksarenler ... 43
2.3. Çalışmanın Amacı ve Kapsamı ... 52
3. MATERYAL VE METOT ... 53
3.1. Enstrümental Teknikler ... 53
3.2. Kimyasal Sentezler ve Karakterizasyon ... 53
3.2.1. 5,11,17,23-Tetra-ter-bütil-25,26,27,28-tetrahidroksikaliks[4]aren (1)55 3.2.2. 5,11,17,23-Tetra-ter-bütil-25,27-bis(3-bromopropoksi)-26,28-dihidroksi kaliks[4]aren (2) ... 55
3.2.3. 5,11,17,23-Tetra-ter-bütil-25,27-bis(3-bromopropoksi)-26,28-dihidroksi kaliks[4]aren ile imidazol‟ün etkileştirilmesi (3) ... 56
3.2.4. 5,11,17,23-Tetra-ter-bütil-25,27-bis(3-ftalimidopropoksi)-26,28-dihidroksi kaliks[4]aren (4) ... 58
3.2.5. 5,11,17,23-Tetra-ter-bütil-25,27-bis(3-aminopropoksi)-26,28-dihidroksi kaliks[4]aren (5) ... 58
3.2.6. 5,11,17,23-Tetra-ter-bütil-25,27-bis(3-aminopropoksi)-26,28-dihidroksi kaliks[4]aren ile 4 (5)-imidazol karboksi aldehit‟in ekileştirilmesi (6) ... 59
3.2.7. 5,11,17,23-Tetra-ter-bütil-25,27-dimetoksikarbonilmetoksi 26,28-dihidroksi kaliks[4]aren (7) ... 62
3.2.8. 5,11,17,23-Tetra-ter-bütil-25,27-dimetoksikarbonilmetoksi 26,28-dihidroksi kaliks[4]aren ile etilendiamin‟in etkileştirilmesi (8) ... 62
3.2.9. Bileşik 8‟in hekzametilentetraamin ile etkileştirilmesi (9) ... 63
3.2.10. Bileşik (9) ile 3-aminopropilimidazol‟ün etkileştirilmesi (10) ... 63
3.2.11. 5,11,17,23-Tetra-ter-bütil-25,27-dimetoksikarbonilmetoksi 26,28-dihidroksi kaliks[4]aren ile dietilentriamin‟in etkileştirilmesi (11) ... 66
3.2.12. 5,11,17,23-Tetra-ter-bütil-25,27-dimetoksikarbonilmetoksi 26,28-dihidroksi kaliks[4]aren ile 3,6 diokza-1,8 diaminooktan‟ın etkileştirilmesi (12) ... 66
3.2.13. 5,11,17,23-Tetra-ter-bütil-25,27-dihidroksikarbonilmetoksi 26,28-dihidroksi kaliks[4]aren (13) ... 69
3.2.14. 5,11,17,23-Tetra-ter-bütil-25,27-diklorokarbonilmetoksi 26,28-dihidroksi kaliks[4]aren (14) ... 69
3.2.15. . p-ter-bütilkaliks[4]arenin diamit türevinin sentezi (15) ... 70
3.2.16. 5,11,17,23-Tetra-ter-bütil-25,26,27,28-tetrametoksikarbonilmetoksi kaliks[4]aren (16) ... 70
3.2.17. 5,11,17,23-Tetra-ter-bütil-25,26,27,28-tetrahidroksikarbonilmetoksi kaliks[4]aren (17) ... 71
viii
3.2.18. 5,11,17,23-Tetra-ter-bütil-25,26,27,28 tetraklorokarbonilmetoksi
kaliks [4] aren (18) ... 71
3.2.19. p-ter-bütilkaliks[4]arenin tetraamit türevinin sentezi (19) ... 72
3.3. Enzim mimik Çalışmaları ... 73
3.4. Lipaz İmmobilizasyonu ... 75
3.4.1. Sol-jel enkapsülasyon metodu (Reetz ve ark., 2003) ... 75
3.4.1.1. Aktivite tayini (Chiou ve Wu, 2004 ) ... 76
3.4.1.2. Protein miktarı (Bradford, 1976) ... 76
3.4.2. İmmobilize lipazlar ile (R/S)-Naproksen metil esterinin enantiyoseçimli hidrolizi ... 77
3.4.3. İmmobilize lipazlar ile (R/S)-2-fenoksi propiyonik asit metil ester‟inin enantiyoseçimli hidrolizi ... 78
4. ARAġTIRMA BULGULARI VE TARTIġMA ... 81
4.1. Kaliksaren Bileşiklerinin Sentezi ... 81
4.2. Enzim Mimik Çalışmaları ... 88
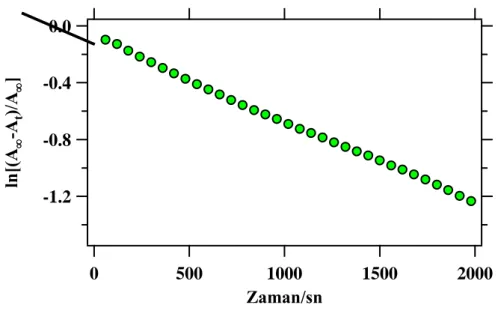
4.2.1. Enzim modelleri 3, 6 ve 10 ile p-NPA‟nın hidroliz reaksiyonu ... 89
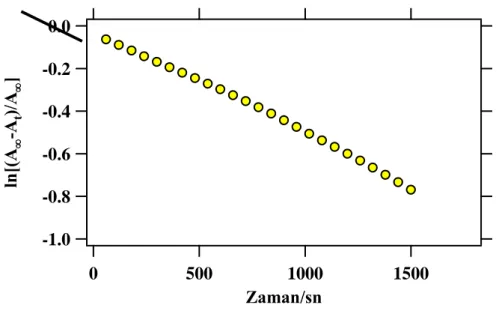
4.2.2. Enzim modelleri 3, 6 ve 10 ile p-NPP‟nin hidroliz reaksiyonu ... 105
4.3. İmmobilizasyon ve Enantiyoseçimli Reaksiyonlar ... 111
4.3.1. Katkı maddesi olarak kaliksaren‟in kullanıldığı sol-jel kapsülleme . 111 4.3.2. İmmobilize lipazların aktivitesine pH‟ın etkisi ... 113
4.3.3. İmmobilize lipazların aktivitesine sıcaklığın etkisi ... 115
4.3.4. İmmobilize lipazın termal kararlılığı ... 116
4.3.5. İmmobilize lipazlar ile (R/S)-Naproksen metil esterinin enantiyoseçimli hidrolizi ... 118
4.3.6. İmmobilize lipazlar ile (R/S)-2-fenoksi propiyonik asit metil esterinin enantiyoseçimli hidrolizi ... 127 5. SONUÇLAR VE ÖNERĠLER ... 134 5.1. Sonuçlar ... 134 5.2. Öneriler ... 136 KAYNAKLAR ... 137 EKLER ... 151
ix
x ÖNSÖZ
Bu çalışma, Selçuk Üniversitesi Fen Fakültesi Kimya Bölümü Öğretim Üyeleri Yrd. Doç. Dr. Nejdet ŞEN ve Prof. Dr. Mustafa YILMAZ danışmanlığında FBE-08101022 numaralı tez projesi kapsamında hazırlanmıştır.
İlk olarak, bu çalışmanın yapılmasında desteklerini esirgemeyen değerli hocalarım Yrd. Doç. Dr. Nejdet ŞEN‟e ve Prof. Dr. Mustafa YILMAZ‟a çok teşekkür ederim. Ayrıca Tez İzleme Komitesi Üyesi hocalarım S.Ü. Ahmet Keleşoğlu Eğitim Fakültesi Kimya Öğretmenliği Bölümü Öğretim Üyesi Prof. Dr. Abdülkadir SIRIT‟a, S.Ü. Fen Fakültesi Kimya Bölümü Öğretim Üyesi Doç. Dr. Aydan YILMAZ‟a teşekkürlerimi sunarım. S.Ü. Fen Fakültesi Kimya Bölümü Başkanı Prof. Dr. İbrahim KARATAŞ başta olmak üzere diğer hocalarıma da teşekkür ederim. Bunların dışında, değerli yorumları ile yaptığı katkılardan dolayı ODTÜ Fen-Edebiyat Fakültesi Kimya Bölümü Öğretim Üyesi Prof. Dr. Ayhan Sıtkı DEMİR‟e teşekkürlerimi sunarım.
Ayrıca bu çalışmayı 08101022 numaralı proje ile destekleyen Selçuk Üniversitesi Bilimsel Araştırma Proje Koordinatörlüğü‟ne de teşekkür ederim.
Çalışmalarım esnasında yardımlarını esirgemeyen laboratuvar arkadaşlarım Arş.Gör.Dr. Ezgi AKCEYLAN‟a, Arş.Gör.Dr. Özlem ŞAHİN‟e, Uzman Serkan ERDEMİR‟e, Arş.Gör.Dr. Elif YILMAZ‟a, Kübra ETÇİ‟ye, Tuba AKSOY‟a, Enise AKÖZ‟e, Ali Osman KARATAVUK‟a, Serkan SAYIN‟a ve Mustafa ASLAN‟a teşekkür ederim.
1. GĠRĠġ
1.1. Supramoleküler Kimya
Supramoleküler kimya farklı kimyasal bileşenlerden meydan gelen kompleks moleküler sistem çalışmalarıyla ilgili bir kimya alanıdır. Cram, Lehn ve Pedersen‟in 1987 yılında Nobel ödülünü alması ile birlikte, supramoleküler kimya, çağdaş kimyanın önemli bir alanı haline gelmiştir (Gokel, 1999). Supramoleküler kimya, moleküller arası bağ ve moleküller arası yapı kimyası olarak tanımlanabilir (Lehn, 1995). Moleküller arası bağlar; iyon çifti oluşumunu (elektrostatik), hidrofilik ve hidrofobik etkileşimleri, hidrojen bağı oluşumunu, konak-konuk etkileşimlerini ve van der Walls etkileşimlerini içerir (Şekil 1.1.).
N OH O O
-N H NH O +HN İyon-iyon etkileşimi (400-4000 kJ/mol)
+
O O O O O O İyon-dipol etkileşimi (50-500 kJ/mol) O O O O O O O O etkileşimi (50-500 kJ/mol) N N N N O O O N O O N N N H H H Hidrojen bağı (10-200 kJ/mol) H2O H2O H2O H2O H2O H2O H2O H2O H2O H2Ovan der Waals (hidrof obik) (0.05-40 kJ/mol) OH HO HO OH O2N O2N NO2 NO2 Dipol-dipol etkileşimi (5-25 kJ/mol) - - - - -
-ġekil 1.1. Supramoleküler etkileşimler
Supramoleküler etkileşimler, enzimlere veya reseptörlere substrat bağlanması, protein komplekslerinin oluşumu, genetik kodun taşınması, sinir iletim prosesleri ve hücresel tanıma (immünoloji) gibi önemli spesifik biyolojik proseslerin temelini oluşturur.
Bu nonkovalent ve çok noktalı moleküller arası etkileşimlerin tam olarak anlaşılabilmesi, substrata kuvvetlice ve seçici olarak bağlanarak supramoleküler yapı oluşturabilecek yapay reseptör moleküllerin tasarlanmasını sağlayabilir (Vögtle, 1991). Literatürdeki mevcut çalışmalara bakarak, kimya alanındaki araştırmaların çoğunlukla moleküler sistemlerden supramoleküler sistemlere doğru yöneldiği görülmektedir.
Moleküler reseptörler ve substratlar supramoleküler bir türün partnerleridir. Bir spesifik substratın reseptörüne seçici olarak bağlanması ile bir süpermolekül oluşabilir. Substrat genellikle bağlanması araştırılan daha küçük bileşendir. Bu terminoloji, biyolojik reseptörler ve onların substratları arasındaki ilişkiyi ifade eder. Sentetik reseptörlerin geliştirilmesinde bir hayli yol kat edilmiştir. Bu reseptörlerin komplekslerinin oluşumunda temel kuvvet hidrojen bağıdır (Zimmerman ve Wu, 1989). Moleküler tanıma, kimya, biyoloji, eczacılık (klinik biyokimya) ve çevre alandaki etkisinden dolayı önemli köşe taşlarından biridir. Özellikle biyolojik proseslerde metal katyonlarının seçimli teşhisi ilgi duyulan önemli konulardan birisi olmuştur (Valeur, 1993). Ayrıca önemli biyolojik hedeflerin moleküler tanınması organik kimyanın önemli alanlarından birini oluşturur ve model sistemlerle gerçekleştirilen çalışmalar amino asitler, nükleik asit heterosiklik bazları, nükleotitler ve karbonhidratlar gibi pek çok reseptör ortaya çıkarmıştır (Galan ve ark, 1992).
1.1.1. Konak-konuk kimyası
Bir molekül (konak) diğer uygun bir moleküle (konuk) bağlandığı zaman “konak-konuk” kompleksi veya supramolekül oluşur. Konak-konuk kimyasının oluşmasında aşağıdaki üç önemli anlayış etkilidir:
1) Paul Erlich tarafından ortaya çıkarılan tanım. Buna göre: “Eğer moleküller bağlı değilse etkin değildirler”. Bu şekilde biyolojik reseptör kavramı ortaya çıkarılmıştır.
2) Emil Fischer tanıması: Buna göre bağlanma seçici olmak zorundadır. Bu ise “anahtar-kilit” modeli ile tanımlanır. Bu anlayış moleküler tanımanın temelini oluşturur (Şekil 1.2.).
3) Seçici bağlanmanın konak ve konuk arasındaki karşılıklı çekim ve benzerliği içermesi gerektiği gerçeği (Steed ve Atwood, 2000).
ġekil 1.2. Fischer‟in “anahtar-kilit” modeli
Taç eterler ile başlayarak, konak-konuk alanında başlıca katyonların kompleksleşmesi üzerine odaklanılmıştır. Genellikle nötr moleküller arasındaki hidrojen bağları, yük/dipol çekimleri ve polar hidrojen bağlarından daha zayıf olmasına rağmen, yapılan pek çok çalışma hidrojen bağı ağının, çözelti içerisinde kararlı olan nötr komplekslerin oluşmasında kullanılabileceğini göstermektedir (Bell ve Liu, 1988). Konak-konuk kimyası, öncelikli olarak en azından bir tanesi yüklü olan partnerler (metal ve alkilamonyum iyonları) arasındaki etkileşimlere odaklanmıştır. Siklodekstrinler, taç eterler ve kaliksarenler gibi pek çok moleküler-kap tipi konaklar (Şekil 1.3.) yapısal gevşeklilerinden dolayı konuklarla rahatça etkileşime girebilirler (Marquez ve ark., 2004).
n O O OH O OH HO O O OH HO OH O O HO HO OH O O OH O OH HO O O HO O OH OH O HO O OH OH O O O O O O O R R R R OH OH HO OH
Siklodekstrin Taç eter Kaliksaren
R=H
1.1.2. Kaliksarenler
Fenol-formaldehit kimyası ile ilgili çalışmalar ilk olarak 1872 yılında Adolf Von Baeyer ile başlamıştır (Takemura, 2002). Ancak reaksiyon ürünleri saf olarak elde edilememiştir ve yeterli analitik teknik olmadığı için de tam olarak karakterize edilememiştir. Bu alandaki bir sonraki adım, 1894‟te L. Lederer (Naoya ve Sotaro, 2002) ve O. Mannase (Baekeland, 1908) tarafından ılımlı ve kontrol edilebilen bazik koşullarda hidroksimetil fenollerin sentezlenmesi ile atılmıştır. 1902 yılında Leo Hendrik Baekeland, fenol ve formaldehitin bazik ortam kondenzasyonu neticesindeki çapraz bağlı polimerleşme ile ticari adı “Bakalit” olan fenol-formaldehit rezinlerini hazırlamıştır. 1944 yılında Alois Zinke ve Eric Zeigler‟in p-substitüe fenolleri kullanarak kontrollü çapraz-bağlanma ile rezinden ziyade kristalik bir bileşiğin sentezlenmesi ile fenol-formaldehit kimyasına beklenmedik bir dönüş yapılmıştır (Mnuk ve Fetl, 1993). Aynı yıl Joseph Niederl ve Heinz Vogel asetaldehit ve rezorsinolden bir siklik tetramerik bileşik sentezlemişlerdir (Cornforth ve ark., 1973). John Cornforth ve ark., Zinke‟nin reaksiyonlarını tekrarlamışlar ve enzim benzerleri olarak kaliksarenlerin önemini fark etmişlerdir. X-ray kristalografisi ile nihai olarak Zinke reaksiyonu ile sadece siklik tetramerlerin oluştuğu doğrulanmıştır (Conforth ve ark., 1955; Gutsche,1989).
“Kaliksaren” kelimesi 1975 yılında David Gutsche tarafından ortaya atılmıştır. Günümüzde kaliksarenler, farklı merkezi boşluğa sahip fenolik birimlerin metilen köprüleri ile o-pozisyonundan birbirine bağlandığı halkalı oligomer sınıfı olarak tanımlanmaktadır (Vicens ve Boehmer, 1991; Stewart ve Gutsche, 1999).
ġekil 1.4. Kaliksarenler
Kaliksarenler aril birimlerinin sayısına göre (n=4, 5, 6, 7, 8, 9,….., 20) sınıflandırılabilirler (Audhuy-Peaudecerf ve ark., 1994; Gutsche ve ark., 1990). n=4, 6, 8
ve n=5, 7 olan kaliksarenlerin baz katalizli sentezine karşın, n=9-20 olan kaliksarenler asit-katalizli kondenzasyonla hazırlanırlar.
Günümüzde “kaliksarenler”, siklodekstrinler ve taç eterlerden sonra, “üçüncü nesil supramoleküller” olarak adlandırılır (Gutsche, 2008). p-Sübstitüe kaliks[n]arenlerin karakteristik özellikleri arasında; yüksek erime noktasına sahip olması, hem fenolik-OH‟dan hem de fenolik birimlerin p- pozisyonlarından fonksiyonlandırılabilmeleri (Gutsche ve ark., 1986), farklı konformasyonlara sahip olmaları (Gutsche ve ark., 1981) ve yaygın organik çözücülerde çözünürlüklerinin çok düşük olması sayılabilir. Ancak, kaliksarenlerin CHCl3 ve piridin gibi çözücülerde yeterli derecede çözünmesi
kaliksarenlerin NMR karakterizasyonuna olanak sağlamaktadır.
1.1.2.1. p-ter-Bütilkaliks[4]aren’in sentezi
p-ter-Bütilkaliks[4]aren‟in sentezi ilk olarak David Gutsche tarafından optimize edilmiştir. Buna göre ilk olarak p-ter-bütil fenolün ve %37‟lik formaldehitin 100-120 o
C sıcaklıkta kondenzasyonu gerçekleştirilir ve ardından difenil eter içerisinde geri soğutucu altında kaynatılır (Gutsche ve ark., 1990; Gutsche ve ark., 1986) (Şekil 1.5.). Daha sonra reaksiyon karışımı soğutulur, etilasetat ilave edilen karışımdan ham ürün süzülerek ayrılır ve toluen içerisinde kristallendirilirek %50 verimle parlak, beyaz kristaller elde edilir. Oluşan rombik kristallerin erime noktası 342-344oC‟dir.
HCHO
0,045 ekv.NaOH 100-120oC 2 saat
difenileter ile 2saat kaynatılır
p -ter-bütilfenol formaldehit p -ter-bütilkaliks 4 aren
+
R=ter-bütil R R R R OH OH HO OH R OHOligomerleşme üzerine baz konsantrasyonunun etkisi ve ürünlerin verimi Gutsche ve ark. tarafından incelenmiştir. Yüksek baz konsantrasyonlarında hekzamer oluşumu gözlenmiştir. Ayrıca bazı oluşturan katyonun, verim ve ürün dağılımı üzerine bazı etkilerinin bulunduğu belirlenmiştir. Örneğin LiOH, NaOH tetramer ve oktamer, KOH, RbOH ve CsOH genellikle siklik hekzamer oluşturma yönünde davranmaktadır (Gutsche ve ark., 1990).
1.1.2.2. Kaliks[4]arenlerin konformasyonları
Kaliksaren konformasyonları arasındaki denge substitüentlerin tipine, çözücüye, sıcaklığa ve makrosikliğin büyüklüğüne bağlıdır. Kaliksarenler (n=4 için) koni, kısmi koni, 1,2-karşılıklı ve 1,3-karşılıklı konformasyonlarında bulunur (Şekil 1.6.).
Cone OH HO HO OH
Koni Kısmi koni 1,3-KarĢılıklı 1,2-KarĢılıklı
ġekil 1.6. p-ter-bütilkaliks[4]aren‟in konformasyonları
Kaliks[4]arenin hangi konformasyonda olduğu bu bileşiğin köprü Ar-CH2-Ar
protonlarının 1
H-NMR spektrumlarına bakılarak ayırt edilebilir (Çizelge 1.1.).
Çizelge 1.1. Kaliks[4]aren konformasyonunun 1H-NMR spektroskopisi ile belirlenmesi
Konformasyon Ar-CH2-Ar 1H NMR spektrumu
Koni Kısmi koni 1,3-karşılıklı 1,2- karşılıklı
Bir çift dublet
İki çift dublet (1:1) veya bir çift dublet ve bir singlet (1:1) Bir singlet
Genellikle sübstitüe olmamış kaliksarenler oda sıcaklığında ve çözelti içerisinde değişken bir konformasyona sahiptir. Burada konformasyonel dönüşümün azaltılması için başlıca iki yol vardır (Gutsche, 1989): Bunlardan birincisi fenolik-OH ve fenolik-p pozisyonlarından halkaya büyük hacimli gruplar bağlamak; ikincisi ise her bir aril halkasına molekül içi köprüler kurmak (Takeshita, 1995). Konformasyonlar arasındaki dönüşüm hızına sübstitüentlerin yanı sıra çözücüler de etki etmektedir. Kloroform, toluen, brombenzen ve karbondisülfür gibi çözücüler konformasyon dönüşüm serbest enerjisini yükseltir. Bu da çözücünün kaliksarenlerle kompleks oluşturduğunu gösterir. Aseton ve asetonitril gibi çözücülerin bilhassa piridinin, molekül içi hidrojen bağlarını bozması sebebiyle konformasyon dönüşümüne etkisinin büyük olduğu düşünülmektedir (Gutsche ve ark., 1981). Aromatik halka arasındaki metilen hidrojenleri yüksek sıcaklıklarda singlet pik verirken düşük sıcaklıklarda bir çift dublet pik verir. Bu durum kaliks[4]arenlerin sıcaklık değişmesiyle konformasyonlarının değiştiğini göstermektedir (Gutsche, 1989)
1.1.2.3. Kaliksarenlerin fonksiyonlandırılması
Kaliksarenlerin halkalı yapıdaki taç eterlere ve siklodektrinlere göre sentezlerde çok fazla tercih edilmesinin nedeni kolaylıkla türevlendirilebilmesidir. Kaliksarenlerin çözünürlüklerinin sınırlı olmasından dolayı, istenilen amaca yönelik kaliksarenler elde etmek için, kaliksarenlerin fenil halkasının para konumundan (upper rim) veya fenolik oksijen (lower rim) üzerinden değişik fonksiyonel gruplarla türevlendirilmesi gerekmektedir (Şekil 1.7.).
HO HO OH OH 4 OH HO HO OH Upper rim Lower rim f enolik OH bölgesi fenolik halkaların para pozisyonu
ġekil 1.7. Kaliksarenlerin fenolik-OH ve p- pozisyonları
Kaliksarenlerin fenolik -OH gruplarından fonksiyonlandırılması eter, ester, keton, fosfin, imin, oksim gruplarının bağlanması ile oluşturulur (Yilmaz, 1999; Ting ve ark.,1990; Cameron ve Loeb, 1997). Fenolik -OH gruplarının fonksiyonlandırılması değişik reaktif ve reaksiyon koşullarının seçilmesi ile başarılabilir. Kaliks[4]arenin 1,2-di-, 1,3-di-, tri-, tetra- eterleri veya esterleri uygun koşullarda sentezlenmektedir (Gutsche ve Lin, 1986; Böhmer ve ark., 1993).
Fenil halkasının para köşesine bağlı ter-bütil gruplarının AlCl3 / toluen ortamında
tamamen giderilmesiyle (dealkilleme), kaliksarenlerin p-konumuna değişik fonksiyonel grupların bağlanması mümkün olmaktadır. Ayrıca kısmi O-açilli veya O-alkilli kaliksarenlerin ter-bütil grupları seçimli olarak dealkilleme işlemiyle uzaklaştırılabilmektedir (Dalbavie ve ark., 2000). Daha sonra, amaca göre sülfolama nitrolama, bromlama, açilleme klormetilleme diazolama, formilleme ve alkilleme gibi kısmi yer değiştirme reaksiyonları gerçekleştirilebilir (Shinkai ve ark., 1986; Hamada ve ark., 1990; Gutsche ve Lin, 1986; Nagasaki ve ark., 1993; Deligöz ve Ercan, 2002; Arduini ve ark., 1991). Kaliksarenler üzerine yapılan reaksiyonlar elektrofilik “kinon-metit” tipi substitüsyon reaksiyonlardır. Gutsche ve Nam (1988) tarafından önerilen bu metot, uygun bir sekonder aminle kaliksarenin aminometilasyon daha sonra kuaternizasyon ve düşünülen reaksiyonlar için başlangıç maddesi olabilecek nükleofil ile
p-ter-tetrakis(siyanometil)kaliksarenin reaksiyonudur. Burada örneğin, siyano grupları kuaterner amonyum grubu ile yer değiştirir, daha sonra amino gruplarına indirgenebilir veya karboksilik gruplarına hidroliz edilebilir. Kaliks[4]arenin allil eterlerinin p-Clasien çevrilmesi metodu ise, fenolik grupların p-pozisyonuna fonksiyonel grupların transferinin gerçekleştiği bir metottur (Gutsche ve Pagoria, 1985).
1.1.2.4. Kaliksarenlerin uygulama alanları
Literatürde, kaliksarenlerin farklı uygulamalarda kullanıldığı pek çok çalışma bulunmaktadır. Bu çalışmalardan bazıları aşağıda farklı başlıklar altında verilerek açıklanmaya çalışılmıştır.
Molekül /iyon taşıyıcı olarak
Kaliksarenler farklı konformasyonlara ve taç eterler gibi halkalı yapı ve özellikle sepet benzeri boşluklara sahip olduklarından birçok organik bileşikle veya iyonla kompleks yapabilme özelliğine sahiptirler. Yılmaz ve grubunca (Ozcan ve ark., 2009) gerçekleştirilen bir çalışmada Fe3O4 manyetik nano parçacıkları ile aminopropiltrimetoksi
silan (APTMS) etkileştirmiş ve bu da kaliks[4]aren diester türevi ile etkileştirerek manyetik özellik gösteren kaliks[4]aren elde etmişlerdir (Şekil 1.8.). Daha sonra kaliks[4]aren bazlı bu manyetik nano parçacık dikromat iyonunun ekstraksiyon çalışmalarında kullanılmıştır.
Oshima ve ark. (2007) tarafından yapılan bir çalışmada ise kalisarenin enzimlerdeki aminoasit grupları ile kompleks oluşturabildikleri ile ilgili bir çalışma yapılmıştır. Bu çalışmada Sitokrom c enzimindeki lisin grubuna ait NH3+ ile karboksilli asit grubu
bulunduran kaliksaren kompleks yapmış (Şekil 1.9.) ve bu enzimin organik ortamda çözünerek katalizör işlevi görmesi sağlanmıştır.
Enzimdeki katyonik lisin grupları OR OR OR OR OR RO R=CH2COOH NH3+ NH3+
ġekil 1.9. Kaliksaren ile enzimdeki amino asit grubuna ait amonyum grubunun etkileşmesi
Elektrot ve sensör çalışmalarında
Kim ve grubu (2003) antrasen gibi florofor taşıyan 1,3 konformasyonunda farklı iki metal katyonu taşıma bölgesi bulunduran kaliks[4]aren bileşiği sentezlemiş (Şekil 1.10.) ve bu bileşiğin bazı iyonlara karşı floresans özelliklerini incelemiştir. Yapılan çalışmada bileşik herhangi bir metalle kompleks yapmadığında floresans özellik göstermemiştir. Cs+‟nın bileşiğin crown-6 bölgesini tercih etmesi ve kompleksleşmesi molekülde floresans özellik göstermiş ve daha sonra bu komplekse Cu+2
iyonu ilave edildiğinde Cu+2‟nin diğer bağlanma bölgesi ile etkileşmesi hem Cs+‟nın bu molekülden uzaklaşmasına hem de düşük
O O O O O O O O CN O H N O O O O O O O O O CN O H N O O O O O O O O O CN O H N O Cs+ Cs + Cu+2 Cu+2 Cs+
Floresans yok Floresans Düsük Floresans.
ġekil 1.10. Kaliks[4]arenin sensör olarak kullanımı
Kaliksarenler kullanılarak birçok iyon seçimli elektrot yapılmıştır. Bunlardan biri Ramanjaneyulu ve ark. (2010) tarafından gerçekleştirilmiştir. Yapılan bu çalışmada polimer destekli kaliksaren türevi (Şekil 1.11.) sezyum için iyon seçici elektrot olarak kullanılmıştır. N O O HO OH N NO2 HC CH H3C H3C CH CH3 3 .. ..
ġekil 1.11. Cs iyonofor olarak kullanılan kaliks[4]areni türevi
Monolayer çalışmalarında
Chen ve ark. (2007) fenolik OH bölgesinde etilester, karboksilik asit ve taç eter grupları ve fenolik bölgenin p pozisyonunda ise tiyol grubu bulunan kaliks[4]aren bileşiği
sentezlemiştir. Bu bileşiğin bir altın film üzerinde oluşturduğu monolayer sistemi (Şekil 1.12.) ise bazı proteinlerin belirlenmesinde kullanılmıştır.
ġekil 1.12. Au film üzerindeki kaliksaren monolayeri
Kromatografi çalışmalarında
Erdemir ve Yılmaz (2010), silikajel bağlı yeni bir kaliks[4]aren bileşiği sentezlemişler (Şekil 1.13.) ve bunu HPLC‟de sabit faz olarak kullanmışlardır.
O O O O NH Si O HN Si O
ġekil 1.13. Sabit faz olarak kullanılan kaliksaren türevi
Bu sabit fazı bazı aromatik hidrokarbonlar, fenolik bileşikler, aromatik aminler ve bazı ilaç maddelerinin kromatografik ayırımında kullanmışlardır.
Katalizör çalışmalarında
Akceylan ve Yılmaz (2011), yaptıkları çalışmada amin türevli 3 farklı kaliksaren bileşiği sentezlemişler ve bunları akiral faz transfer katalizörü olarak kullanmışlardır. Faz transfer reaksiyonu olarakta p-nitrobenzilbromür ile sodyum metil bütirat ve sodyum kaprolat arasındaki esterleşme reaksiyonunu kullanmışlardır (Şekil 1.14.).
OH HO HO OH N N N N OH HO HO OH N N OH HO HO OH N N NO2 BrH COONa n kat. NO2 OCO n n=1 n=5 5 6 7
ġekil 1.14. Akiral katalizör olarak kullanılan kalikaren türevleri ve katalizledikleri faz transfer reaksiyonu
Bozkurt ve ark. (2008), cinchona alkaloid türevli kaliks[4]aren sentezleyerek bunu, N-(difenilmetilen)glisin etil esteri ile benzil bromür arasındaki faz transfer alkilasyon reaksiyonunda (Şekil 1.15.) kiral faz-transfer katalizörü olarak kullanmışlardır.
Ph Ph N O O Ph Ph N O O -Cl+H 3N O O * * BnBr,PTC 50% aq. baz H+ OHOH O O N N+ HO N N+ OH n n Br -Br
1.2. Enzimler
Enzimler çoğunlukla biyokatalizörler olarak adlandırılırlar. Enzimler biyolojik sistemlerin önemli ve gerekli bileşenleri olup yaşam için önemli olan kimyasal reaksiyonları katalizler. Enzimlerin yardımı olmaksızın bu kimyasal prosesler ya oldukça yavaş hızlarda olacak ya da hiç olmayacaktı (Laidler, 1958).
1835 yılında J.J. Berzelius kimyasal kataliz teorisini geliştirmiştir. Ardından 1894‟ de Emil Fischer, enzimlerin etkinliğini ve seçicililiğini açıklamak için ünlü “anahtar-kilit” modelini önermiştir (Robyt ve White, 1987). Bu modele göre katalizin gerçekleşmesi için katalizlenecek sistemdeki molekül, enzimdeki bir bölgeye uyacak yapısal uygunluk içerisinde olmalıdır (Şekil 1.2.). Enzimlerin katalitik ve kinetik özellikleri 20. yüzyılın başlarında çalışılmıştır. 1913 yılında L. Michaelis ve M. L. Menten, enzim reaksiyonlarına substrat konsantrasyonun bağımlılığını gösteren klasik çalışmalarını gerçekleştirmişlerdir. Bu çalışmada, kinetik verilerin açıklanmasında enzim-substrat kompleksinin oluşumu esas alınmıştır (Robyt ve White 1987). 1926‟da J. B. Summer ilk enzimi (jack bean urease) kristallendirmiştir. Kısa bir süre sonra J. H. Northrup ve M. Kunitz (1932) pepsin, tripsin ve kimotripsin enzimlerini kristallandirmişlerdir. Bu kristalik bileşiklerin analizi ile enzimlerin protein yapısı ortaya çıkarılmıştır. Enzimler genellikle substratlarına bağlanırlar ve sonra iki veya daha fazla uygun fonksiyonel grupla kataliz işlemini gerçekleştirirler. Bu düzen substrat seçiciliği, reaksiyon seçiciliği ve stereoseçiciliğe neden olur. Bağlanma; metal koordinasyonu, Lewis asit-baz koordinasyonu, organik çözücülerde hidrojen bağı oluşumu vb. ile gerçekleşebilir (Breslow, 1995). Bir katalizin temel özelliği kimyasal reaksiyonun hızı ile ilgilidir. Tüm kataliz türlerinde katalizör substratla birlikte kompleks oluşturur ve bu kompleks, sonunda bozularak katalizör ve ürünler meydana gelir (Laidler, 1958).
Enzimler, uygun mikro-çevreler meydana getirirler ve bu mikro çevreler içerisinde substratlar uygun yönelimler içerisinde bulunurlar. Böylece reaksiyonun aktivasyon enerjisi düşürülür ve reaksiyon hızı artar (Matthews, 1993). Pek çok farklı enzim olduğu için, enzimlerin bir takım sınıflandırmalar içerisinde tartışılması daha uygundur. Çeşitli sınıflandırma metotları mevcuttur ancak hiçbiri tamamen tatmin edici değildir. Örneğin katalizlediği reaksiyon bakımından enzimler; hidrolitik enzimler, preteolitik enzimler, karbohidrazlar, esterazlar vb. şeklinde sınıflandırılabilir (Laidler, 1958). Enzimler ayrıca kemoterapik araçlar olarak özellikle kalıtımsal hastalıkların teşhisinde ve tedavisinde diagnostik indikatörler olarak da kullanılmaktadırlar. Ayrıca enzimlerin spesifikliğinin,
düzenleme özelliğinin, yapısal özelliğinin ve etkileşim mekanizmasının anlaşılması canlı hücrelerin fonksiyonelliğinin anlaşılabilmesi için önemli ipuçları sağlamaktadır (Robyt ve White, 1987).
1.2.1. Yapay Enzimler
Doğal enzimlerin sahip olduğu etkin katalitik özellikler, bilim adamlarını enzimleri taklit edebilecek yapıları ortaya çıkarmaya yöneltmiştir. Genel olarak bu çalışma sahası “biyomimetik kimya” ve “yapay enzim” terimleri ile tanımlamıştır. Yapay enzimlerle ilgili çalışmalar 20. yy‟ın ortalarında başlamıştır. Örneğin biyomimetik kimya terimi 1972 yılında R. Breslow tarafından ortaya atılmıştır. (Breslow, 1995)
Yapay enzimler sahası oldukça aktiftir ve bu alanda önemli başarılar elde edilmiştir. Örneğin yapay enzimler, in vivo reaksiyonları katalizleyen yeni bir sınıf tıbbi araçları temsil ederler. Böyle katalizörler doğal enzimlere göre daha kararlı ve kolay işlenebilir olmalıdır. Ayrıca, doğal biyokimyasal proseslerde rol oynayan enzimler gibi değil, ilgilenilen tüm reaksiyonları katalizleyebilmelidirler (Breslow ve Singh, 1998). Enzim katalizi seçimli kompleksleşme ve geçiş halinin kararlılığına bağlıdır. Bu yüzden yapay enzimlerin geliştirilmesindeki önemli bir hedef, geçiş hali yapısının elektrostatik ve boyutsal özelliklerini tamamlayıcı sentetik reseptörlerin tasarlanmasıdır (Tecilla ve ark., 1990). Enzim katalizli reaksiyonların seçiciliği, enzim katalizli reaksiyonların hızı kadar önemlidir. Enzim, reaksiyonu katalizlemeden önce substrata bağlanır. Seçiciliğin bir yönü farklı moleküllerin olduğu bir ortamda sadece özel bir substratla bağlanabilme yeteneğidir. Örneğin, bu tarz bir seçicilik olmasa protein sentezinin genetik kontrolü mümkün olmazdı. Seçimli bağlanma ayrıca antijenlerde de görülebilir. Antijenler çoğunlukla hedeflerine seçimli olarak bağlanırlar. Çoğu araştırmacı antijen mimikler yapmış ve uygun durumlarda çok güçlü ve seçimli bağlanma gözlemiştir (Breslow ve Singh, 1998). Yapay enzim geliştirilmesindeki bir diğer hedef, yapay enzimlerin, doğal enzimlerle gerçekleştirilemeyen reaksiyonlarda kullanılabilmesidir (Murakami ve ark., 1996). Metal iyonları genellikle çok etkili katalizörler olduğu için, çoğu enzim bunun avantajını kullanır. Yani, metal iyonu katalizini substrat bağlama ile birleştiren enzim mimik sentezi önemli bir konudur. Aslında, literatürde yapay enzim olarak adlandırılan ilk bileşik bir metal iyonun katalitik grubu ile bir siklodekstrinin bağlama grubunu birleştiren yapıdır (Breslow ve Overman, 1970).
Doğal katalizörlerin etki mekanizmalarını taklit eden basit organik sistemlerin ortaya çıkarılmasının önemi iki basit düşünce ışığında anlaşılabilir:
»Kararlılıklarının az olması ve doğal substratlara karşı seçimli davranmalarından dolayı enzimlerin endüstriyel olarak kullanımları kısıtlanmıştır. Ayrıca biyolojik olmayan koşullar altında kolayca denatüre olmalarından dolayı enzimler geniş çapta kullanılamamaktadırlar.
»Çok az sayıda enzimatik etkileşim mekanizması anlaşılabilmiştir. Dolayısıyla pek çoğu için spesifik bir yapının bir reaksiyonu nasıl artırdığı ile ilgili öğrenilmesi gerekli çok şey vardır. Enzim modelleri yapı, mekanizma ve hız artışı temelinde enzimlerin etkileşim mekanizmalarının anlaşılması amacıyla önemli bilgiler sunabilmektedir.
Bir enzim modeli, substrata bağlanabilecek iyi bir bağlanma bölgesi içermelidir. Bir diğer önemli nokta ise aktif bölge bir ön düzenlenme yapabilmeli ve substratın yönelimine uyum sağlayabilmelidir. Yani molekülün bir bütün olarak esnek özellik göstermemesi bu amaç için bir dezavantajdır. Bu bağlamda, şimdiye kadar, substrata bağlanma özelliğine sahip pek çok yapay enzim geliştirilmiştir.
1.2.2. Enzim-mimik olarak kaliksarenler
Konak ve konuk arasındaki etkileşimlerin kontrol edilebilmesi ile etkin sentetik enzimlerin geliştirilmesi mümkün olabilir (Kelly ve Maguire, 1987). Konak genellikle, büyükçe bir merkezi oyuk ya da boşluğu bulunan enzim veya sentetik siklik bileşik gibi bir büyük moleküldür. Konuk, tek atomlu bir katyon, basit bir inorganik anyon vb. olabilir. Daha kurallı olarak konak, çakışan bağlanma bölgesine sahip moleküler yapı, konuk ise buna uygun bir yapıya sahip türdür (Steed ve Atwood, 2000). Konuk moleküllerin supramoleküler konakların boşlukları içerisine girme yatkınlığı ile yeni kimyasal dönüşümler olabilir ve bu, enzimatik aktivitenin taklit edilebilmesini sağlayabilir.
Kaliksarenlerin supramoleküler kimya alanındaki önemi, halkalı yapılarındandır. Kaliksarenin fenolik OH bölgesine ya da fenolik birimlerin p pozisyonları metal bağlayıcı gruplarla modifiye edilebilirken, yapıdaki merkezi boşluk, iyonları ve küçük molekülleri kapsülleyebilme yeteneğine sahip olabilir (Şekil 1.16.). Gutsche 1980‟lerde bu bileşiklerin enzim-mimik olarak kullanılabileceği düşüncesini ortaya çıkarmıştır. Aslında Gutsche‟nin kaliksarenlere olan ilgisini, yapay aldolaz mimikle ilgili gerçekleştirdiği çalışma tetiklemiştir. Früktoz-1,6-difosfatın biyosentezinden sorumlu olan bu enzimi taklit etmek için, Gutsche bir pozitif yüklü merkeze yataklık eden bir yapı iskeleti, bir proton çeken
grup ve özel bir uzaysal düzende hidrojen bağı oluşturucuya ihtiyaç duymuştur. Polimerler ve peptitler lineerdir ve istenilen özellikleri sağlamazlar. İlk olarak 1960 yılında Pedersen tarafından hazırlanan taç eterler çok esnektir ve siklodekstrinlerin fonksiyonlandırılması oldukça zordur.
ġekil 1.16. Enzim-mimik olarak kaliksaren
Bu yüzden kaliksarenler büyük bir ilgiye sahiptirler çünkü bunlar siklodekstrinlere benzer yapıya sahiptirler ancak kontrollü bir şekilde kolayca fonksiyonlandırılabilirler. Bu bileşikler sayesinde enzimlerin in vivo katalitik aktivitesine benzeyen in vitro sistemler oluşturulabilir. Kaliksarenler önceden fonksiyonlandırılarak konak molekül olarak dizayn edilebilirler
1.3. Lipaz
Enzimler veya biyokatalizörler substrat ile spesifik olarak etkileşen ve sonunda substratın transformasyonu/dönüşümü ile ürün oluşumuna neden olan biyomoleküllerdir. Biyokatalizörlerin inorganik katalizörlere kıyasla üstünlüğü yüksek seçicilik, hızlı reaksiyon, non-toksisite, biyolojik bozunabilirlik, laboratuvar koşullarında tekrar üretilebilirlik, ılımlı pH, sıcaklık ve basınç koşulları sayılabilir (Chaniotakis, 2004). Endüstriyel ölçekte kullanılan enzim gruplarından biri lipazlardır (gliserol ester hidrolazlar E.C. 3. 1. 1. 3). Lipazlar sulu ortamda esterlerin hidroliz reaksiyonlarını, organik ortamda da esterleşme/transesterleşme reaksiyonlarını kataliz edebilirler. Substratlara karşı gösterdikleri seçicilik lipazların farklı uygulama alanlarında kullanılmalarını sağlamaktadır ve bu alan gün geçtikçe genişlemektedir (Vulfson ve ark., 1994). Lipazlar süt-yiyecek endüstrisinde, yağ endüstrisinde ve sağlık alanında tat ve aroma bileşenlerinin üretiminde kullanılırlar (Mojović ve ark., 1993; Knežević ve ark., 1998; Lortie 1997; Bornscheuer ve
ark.,2002). Ayrıca lipazlar, deri ve deterjan endüstrisinde sürfaktant üretiminde ve bazı analitik uygulamalarda da kullanılırlar (Šiler-Marinković, 1995). Lipazların önemli bir uygulama alanı da optikçe aktif bileşiklerin üretilmesinde karşımıza çıkmaktadır (Zaks ve Dodds, 1997; Rasor ve Voss, 2001).
1.3.1. Ara yüzeysel aktivasyon
Lipazların doğal substratları özellikle su içerisinde çözünmez, dolayısıyla da reaksiyon su-lipit ara yüzeyinde kataliz edilir (Arpigny ve Jaeger, 1999; Derewenda ve Sharp, 1993). Çoğu lipazın katalitik etkinlik mekanizması X-ray kristalografi (Maruyamaa ve ark., 2000) çalışmaları ışığında “ara yüzeysel aktivasyon” olarak adlandırılan bir adımı içerir. Enzimin aktif bölgesi, polipeptit zincirinin sarmal bölümü ile oluşan bir “kapak” (lid) ile polar çözücülerden izole edildiği için, homojen sulu ortamda bu enzimler kapalı formda (pasif konformasyonda) bulunurlar (Secundo ve ark., 2006; Mingarro ve ark., 1995) (Şekil 1.17.).
ġekil 1.17. Candida rugosa lipaz enziminin canlandırılan resmi. Sarı bölgeler hidrofobik aminoasitleri, maviler diğer bütün aminoasitleri ve kırmızı da aktif bölgeyi göstermektedir. Not: Aktif bölge etrafında
hidrofobik halka bulunmaktadır (Gonzalez-Navarro ve ark., 2001)
Bu kapağın iç tarafı aktif tarafın hidrofobik bölgesine karşılık gelen non-polar aminoasitlerden meydan gelmiştir. Ancak, ikinci bir lipidik faz varlığında, lipaz ara yüzeyde adsorplanır. Kapak, konformasyonel değişikliğe uğrar ve bu durum enzimin hidrofobik kısmını açığa çıkarır ve böylece enzim substratla, non-polar çözücü ile veya bir
hidrofobik polimer taşıyıcı ile etkileşebilecek hale gelir (Gonzalez-Navarro ve ark., 2001; Palomo ve ark., 2005) (Şekil 1.18.). Lipazlar α/β kıvrımlarına sahip monomerik proteinlerdir. Bu yapıda β yaprağı α sarmalları ile çevrelenmiştir (Tyndall ve ark., 2002; Jeong ve ark., 2002). Lipazların katalitik merkezi Ser-Asp (veya Glu)-His üçlüsünden oluşur. Katalitik serin kalıntısı bir klasik pentapeptittir. Diğer klasik yapısal element amit NH gruplarından oluşmuş oksianyon oyuğudur. Oksianyon oyuğu, ara yüzeysel aktivasyona maruz kalan lipazlarda kapalı konformasyondan açık konformasyona geçerken oluşur.
ġekil 1.18. Aktif bölgenin ara yüzeyde etkin hale dönüşmesinin şematik gösterimi
1.3.2. Lipaz kaynakları
Lipazlar bitki, hayvan ve mikroorganizma kaynaklı olup, lipit üretiminde önemli bir rol üstlenirler. Bu enzimler lipitlerin bir organizmadan diğerine transferini kolaylaştırmak için kullanılan sindirim enzimleridir ve organizma içerisinde enerji kaynağı olarak kullanılan yağların taşınması ve biriktirilmesi için kullanılırlar. Çizelge 1.2.‟de yaygın kullanılan lipazlar verilmiştir.
Çizelge 1.2. Yaygın olarak kullanılan lipazlar T ic ar i K ay na ğı v e Ġs im A man o , F lu k a, S ig m a A man o ( li p ase ( A Y ), M ei to S an g y o ( li p ase M Y , li p ase O F -3 6 0 N o v o zy me s (TL I M , S P 5 2 4 , Li p o la se ® ) A ma n o ( li p ase G ) A man o ( li p ase M ) A man o ( M A P ), N o v o zy mes ( R M I M , Li p o zy me ®), F lu k a A ma n o ( li p ase F ), A ma n o ( li p ase D ), A ma n o ( li p ase N ), F lu k a, S ig ma , S ei k ag ak u K o g y o C o . (J ap an ) N o v o zy me s (S P 5 2 6 ) N o v o zy mes ( S P 5 2 5 o r N o v o zy m4 3 5 ) b S ig m a A ma no ( lip ase A , A P) , R öh m, N ov oz ym es (P al at ase ®) A ma n o ( li p ase L) A ma n o ( li p ase R ) A ma n o ( P , P -3 0 , P S , LPL -8 0 , LPL -2 0 0 S ), F lu k a, S ig ma A ma n o ( li p ase A H ) A ma n o ( li p ase A K ), A ma n o ( li p as e Y S ) , B io ca ta ly st s L td . li p ase B , W ak o P u re C h emi ca l (O sa k a) S ig ma , G en zy me , A sa h i C h emi ca l, B io ca ta ly st s Lt d . A ma n o ( K -10) M ei to S an g y o ( li p ase Q L) D iğ er Ġs im le r C a n d id a c yl in d ra ce a T h erm o m yc es l a n u g in o sa Pe n ic il li u m c yc lo p iu m Mu co r ja va n ic u s Mu co r m ie h ei R . ja va n ic u s, R . d el em a r, R. n iv eu s a Bu rk h o ld er ia c ep a ci a c Pse u d o m o n a s g lu m a e L ip az ın K ay na ğı M eme li L ip az ı P o rc in e p an cr ea s Fun g a l L ip a zl a r C a n d id a ru g o sa H u m ic o la l a n u g in o sa Pe n ic il li u m c a m em b er ti i Rh iz o m u co r ja va n ic u s Rh iz o m u co r mi eh ei Rh iz o p u s o ryz a e C a n d id a a n ta rc ti ca A C a n d id a a n ta rc ti ca B Asp er g il lu s n ig er C a n d id a l ip o ly ti ca Pe n ic il li u m r o q u ef o rt ii B a k te ri y el L ip a zl a r c Pse u d o m o n a s c ep a ci a Pse u d o m o n a s c ep a ci a Pse u d o m o n a s f lu o re sc en s Pse u d o m o n a s f ra g i C h ro m o b a ct er iu m v is co su m Pse u d o m o n a s sp . Al ca li g en es sp . Kı sa lt m a PPL CRL HLL PcamL RJL RM L R O L C A L -A C A L -B ANL CLL Pro q L P C L P C L -AH PFL P fr ag iL C V L d
1.3.3. Lipazların özellikleri (Öztürk, 2001)
Lipazların optimum pH’ı
Lipazlar aktif bölgelerindeki kalıntılarının iyonlaşma durumuna ve orijinlerine bağlı olarak sadece belirli pH‟larda katalitik olarak aktiftirler. Bazik, asidik ve nötral kalıntılar lipazın aktif bölgesinin içindedir ve bu yüzden katalitik bölgedeki kalıntılar sadece özel bir iyonlaşma durumunda aktiftir. Lipazlar geniş bir asidik ve bazik pH değerlerinde (yaklaşık 4‟den 10‟a kadar) bulunabilmesine rağmen, çoğu lipazın optimum pH‟ı 7 ile 9 arasında değişir. Mikrobiyal lipazlar pH 6.0-7.5 arasında oldukça iyi aktivite gösterirler.
Termal kararlılık ve optimum sıcaklık
Enzimlerin ısı karşısındaki kararlılığını iki faktör etkileyebilir. Bunlardan ilki enzim yapısıdır. Enzim molekülünde hidrofobik amino asit içeriğinin fazla olması sıkı bir yapı sağlar ki bu da enzimin dış çevredeki bir değişiklikten kolaylıkla bozunmasını engeller. Ayrıca, disülfit köprüleri ve diğer bağlar yüksek ısı ile kimyasal bozunmaya karşı dayanıklılığı artırır. İkinci olarak, yapıda bulunabilecek polisakkarit ve +2 yüklü katyonlar gibi spesifik bileşenler molekülü kararlı hale getirebilir. Genellikle lipazların geniş bir sıcaklık aralığında aktif olduğu bilinmektedir. Hayvansal ve bitkisel kaynaklı lipazların ısıya karşı kararlılıkları genellikle mikrobiyal lipazlardan daha azdır. Pankreatik lipazlar 40
oC‟nin üzerinde saklandığında aktivitelerini kaybederken Aspergillus niger lipaz 50 oC‟de
kararlıdır.
Molekül kütlesi
Farklı kaynaklardan elde edilen lipazların molekül kütleleri çeşitlilik gösterir ancak bu sayı genellikle 20,000 ile 60,000 Da arasında değişir. Bazılarının molekül kütlesi çok yüksektir, örneğin Candida cylindraceae lipazınki 120,000 Da dır. Bunun sebebi düşük molekül kütleli protein moleküllerinin kendi kendine birleşmesiyle açıklanabilir. Pek çok enzim 30-40 kDa arasında molekül kütlesine sahiptir fakat Geotrichum candidum (GCL) ve Candida rugosa (CRL) gibi lipazlar yaklaşık 60 kDa gibi yüksek molekül kütlesine sahiptir.
İzoelektrik nokta
Net yükün sıfır olduğu nokta izoelektrik nokta olarak adlandırılır ve pI şeklinde gösterilir. pI yakınında, proteinler daha az çözünme eğilimindedirler ancak pI noktasından uzaklaştıkça proteinler daha fazla çözünme eğilimindedirler. Sulu çözelti içerisinde, yüklü gruplar polar su molekülleri ile etkileşirler ve doğal olarak hidrofobik olan proteini kararlı hale getirirler. Az sayıda yüklü grup ve çok sayıda alifatik veya aromatik yan zincir proteinin su içerisinde daha az çözünmesine neden olur. pI noktasından uzaklaştıkça, iyonize olan grup sayısı artar ve çözünürlük artar. Bu yüzden, izoelektrik nokta, proteinlerin çözünürlüklerini ve proteinler arasındaki etkileşimleri etkileyen önemli bir parametredir.
Aminoasit bileşimi
Lipazların lipit-su ara yüzeyinde adsorpsiyonu lipaz katalizli reaksiyonlar için gereklidir. Bu yüzden enzimin amino asit bileşiminin bilinmesi yapı-işlev ilişkisinin belirlenmesi için önemlidir. Mikrobiyal enzimlerin amino asit bileşimi Çizelge 1.3.‟de görülmektedir.
Çizelge 1.3. Mikrobiyal lipazların aminoasit bileşimi
Aminoasit
kalıntısı Bacillus spp. P. nitens C.viscosum G. candidum C. rugosa
A B Phenylalanine Tyrosine Leucine Isoleucine Methionine Valine Half-cystine Alanine Glycine Proline Glutamic acid Serine Threonine Aspartic acid Arginine Histidine Lysine Tryptophan TOTAL 4 10 22 7 1 18 1 26 24 9 16 14 22 22 7 6 4 2 215 10 13 16 11 2 21 4 17 17 10 20 18 17 36 8 5 11 2 238 21 29 96 33 17 87 2 120 112 34 89 80 105 110 34 27 51 3 1050 6 8 26 8 1 23 0 31 18 8 19 22 28 26 9 7 4 3 247 28 18 40 18 0 24 0 34 40 26 30 28 22 54 20 10 16 8 416 26 17 41 23 12 24 5 43 46-47 28 33 39 31-32 58 12 4 17 5 464-466
1.3.4. Lipaz katalizli reaksiyonlar
Lipaz katalizli reaksiyonlar iki ana kategori içerisinde sınıflandırılabilirler. Bunlar ester sentezi ve hidrolizdir. Hidroliz reaksiyonu sulu ortamda, sentez ise organik ortamda gerçekleştirilir. Reaksiyonlar aşağıdaki gibi gösterilebilir (Şekil 1.19.):
►Hidroliz:
R1COOR2 + H2O R1COOH + R2OH
►Ester Sentezi:
R1COOH + R2OH R1COOR2 + H2O
►Asidoliz:
R1COOR2 + R3COOH R3COOR2 + R1COOH
►ĠnteresterleĢme:
R1COOR2 + R3COOR4 R3COOR2 + R1COOR4
►Alkoliz:
R1COOR2 + R3OH R1COOR3 + R2OH
ġekil 1.19. Lipaz katalizli reaksiyonlar
Son üç reaksiyon genellikle transesterifikasyon olarak adlandırılır. Hidrolazlar olarak lipazlar; gıda, deterjan, kozmetik, deri, süt ve kağıt gibi çeşitli endüstri alanlarında kullanılabilirler. Kiral ilaçların sentezlenmesinde enzimlerin özellikle lipazların kullanılması genel bir metot olarak kabul görmektedir (Margolin, 1993; Patel,2003). Yıllar geçtikçe de ilaç üretiminde enzimlerin katalizör olarak kullanıldığı ilginç çalışmalar yapılmaktadır. Ayrıca lipazlar organik çözücülerde enzimatik hidroliz ve transesterleşme reaksiyonları ile tek-izomerli kiral bileşik hazırlanmasında da kullanılmaktadır (Gotor, 2002). Asimetrik sentezde lipazların uygulanmasına örnek olarak rasemik alkollerin, asitlerin, esterlerin veya aminlerin kinetik rezolüsyonu ve prokiral bileşiklerin desimerizasyonu sayılabilir (Ghanem ve Aboul-Enein, 2004; Garcia-Urdiales ve ark., 2005). Literatürde tek enantiyomerli ilaç üretimi konusunda bir hayli çalışma bulunmaktadır. Ayrıca, prokiral ilaçların kinetik rezolüsyonu (KR) veya enantiyoseçici enzimatik desimerizasyonu (EED) konularına pek çok ilaç şirketlerince de özel bir önem verilmektedir (Straathof, 2002).
Her yıl yağ endüstrisi alanında çoğunlukla hidroliz ve transesterifikasyon reaksiyonları için milyonlarca ton yağ kullanılmaktadır. Transesterifikasyonla dönüştürülen yağ hacmi yakıt endüstrisinde fatty asit ester (biyodizel olarak da bilinir) üretimi için gelen talep doğrultusunda giderek artmaktadır. Hidroliz ve transesterifikasyon için kullanılan şu anki prosesler normal olarak inorganik bir homojen katalizör, yüksek sıcaklık ve basınç gerektirir. Bu metotlarda enerji kullanımı oldukça fazladır çünkü şiddetli koşullar (sıcaklık ve basınç) yan reaksiyonların oluşmasına neden olur ve sonuç olarak gerekenden daha fazla saflaştırma işlemi gerekir. Ayrıca, ısıya dayanaklı doymamış yağlar bir ön hidrojenasyona tabi tutulmadan bu proseste kullanılmazlar (Saxena ve ark., 1999). Bu bağlamda, yağ kimya endüstrisinde lipazların kullanımı oldukça önemli bir konudur. Örneğin bir Japon firması sabun üretiminde ticari olarak Candida rugosa lipazları kullanmıştır. Bu çalışma ile geleneksel metottan (Colgate-Emery process) elde edilenden daha üstün özelliklere sahip ürünler elde edilmiştir. Üstelik enzimatik metotların kullanımı ile gerçekleşen bu proses maliyet olarak uygundur. Ancak enzimlerim kullanımı henüz yeterli derecede ticari ilgi kazanamamıştır. Bunun için farklı nedenler sayılabilir: Yatırımcıların geleneksel metotlar için ısrarcı olması, büyük ölçekli lipaz kullanımın getireceği ekonomik külfet, istenilen oranda üretim için enzimatik reaksiyonların kontrol edilememesi korkusu. Bu yüzden enzimlerin büyük çaplı uygulama alanları için etkili, kararlı ve kullanımı kolay sistemlerin geliştirilmesine bağlıdır. Bu noktada, immobilizasyon belki de bu tarz enzimlerin geliştirilmesi için en uygun stratejidir (Gao, 2004).
1.4. Enzim Ġmmobilizasyonu
Yıllardır farklı uygulamalar için immobilize enzim geliştirilmesi ile ilgili pek çok çalışma yapılmaktadır. Bu uygulamalarda immobilize enzimlerin yeniden kullanılabilirliği, üretim maliyetinin düşüklüğü ve prosesin kontrol edilebilmesi önemli avantajlar arasında sayılabilir. Aşağıda, immobilize enzimlerin genel kullanım alanları şematik olarak (Şekil 1.20.) gösterilmiştir (Vandamme, 1993; Cristallini ve ark., 1997).
İmmobilize Enzimlerin Uygulama Alanları
ġekil 1.20. İmmobilize enzimlerin kullanım alanları
Ancak, immobilize enzimin doğası ne olursa olsun ya da immobilize enzim nasıl hazırlanırsa hazırlansın, tanım olarak herhangi bir immobilize enzim, iki temel fonksiyona sahip olmak zorundadır. Bunlardan ilki ayırmaya (örn. katalizörlerin uygulama ortamından izolasyonu veya yeniden kullanımı, prosesin kontrolü) yardım etmek için tasarlanan non-katalitik fonksiyonlar, diğeri ise non-katalitik fonksiyonlardır . Katalitik fonksiyonlar istenen zaman ve bölgede, hedef bileşikleri dönüştürmek için tasarlanır. Non-katalitik fonksiyonlar, büyük oranda immobilize enzimin özellikle şekil, büyüklük, sıkılık ve seçilen taşıyıcının uzunluğu gibi geometrik özelliklere bağlıdır. Oysa katalitik fonksiyonlar, aktivite, seçicilik, kararlılık, pH ve sıcaklık profili gibi katalitik özelliklerle ilgilidir. Genellikle bu iki bileşenin (katalitik ve nonkatalitik özellikler) özelliği immobilize enzimin en son uygulama alanını belirler. Bu yüzden, enzim immobilizasyonunda yapılacak ilk iş uygun bir immobilizasyon metodunun seçilmesidir (Cao, 2005).
1.4.1. Ġmmobilizasyon metotları
Enzim immobilizasyon teknikleri konusunda çok fazla yayın bulunmaktadır (Messing, 1975; Bickerstaff, 1997; Katchalski-Katzir ve Kraemer 2000; Gemeiner, 1992). Amino açilaz, penisilin G açilaz, pek çok lipaz, proteazlar, nitrilazlar, amilaz, invertaz, vb. gibi yüzlerce enzim farklı şekillerde immobilize edilerek endüstriyel proseslerde kullanılmaktadır.
Enzim immobilizasyonu ile ilgili temel metotlar sadece birkaç kategoriye ayrılmasına rağmen adsorpsiyon, kovalent bağlama, tuzaklama, tutuklama, çapraz-bağlama ve bu orijinal metotlar temelinde yüzlerce kombine metot geliştirilmektedir (Mosbac, 1980; Katzbauer ve ark., 1995). Heterojen Biyokatalizörler Seçici Adsorbentler İlaçlar Analitik Cihazlar Katı-faz Protein Kimyası
1.4.1.1. Adsorpsiyon-temelli immobilizasyon
Adsorpsiyon temelli enzim immobilizasyonu, kullanılan ilk immobilizasyon metotları arasındadır. Bununla ilgili ilk çalışma 1916 yılında Nillson ve Griffin tarafından yapılmıştır (Nelson ve Griffin, 1996). Bu çalışmada invertaz, fiziksel adsorpsiyonla kömür üzerinde tutturulmuştur. Endüstriyel olarak kullanılan ilk immobilize enzim ise amino asit açilazın selülöz üzerinde adsorpsiyonu ile hazırlanmıştır (Tosa ve ark., 1967). Bu öncü çalışmalardan bu yana adsorpsiyonla enzim immobilizasyonu aşağıdaki avantajlardan dolayı geniş çapta araştırılmıştır.
►Tersinirlik; hem proteinin saflaştırılmasını hem de taşıyıcıların yeniden kullanılması
►Basitlik; enzim immobilizasyonunun ılımlı koşullar altında yapılabilmesi
►Kovalent immobilizasyonun (Albayrak ve Yang, 2002) tersine, herhangi bir kimyasal modifikasyon olmadığı için aktivitenin büyük oranda korunması olanağı (Sharma ve Yamazaki, 1984);
Genellikle adsorpsiyon yoluyla immobilize edilen enzimler taşıyıcıdan uzaklaşma yönünde hareket ederler çünkü enzim ve taşıyıcı arasında zayıf etkileşimler bulunmaktadır ve bu etkileşim iyonik şiddet, pH gibi desorptif kuvvetlerle engellenebilir. Bazen enzimler uygun taşıyıcılar üzerinde güçlü bir şekilde adsorplanırlar (Rexova-Benkova ve ark., 1982) veya adsorpsiyon, uygulama koşulları altında yeterince güçlüdür. Bu nedenle, son zamanlarda bu metodun doğasından kaynaklanan dezavantajları ortadan kaldırmak için pek çok varyasyon geliştirilmektedir. Örnek olarak, adsorpsiyon-çapraz bağlama, modifikasyon-adsorpsiyon, seçici adsorpsiyon-kovalent bağlama ve adsorpsiyon-kaplama sayılabilir.
1.4.1.2. Kovalent bağlanma ile enzim immobilizasyonu
Uygun taşıyıcılara enzimlerin kovalent bağlanması enzim immobilizasyonu için geliştirilen ikinci metottur. Kovalent bağlanma ile enzim immobilizasyonu günümüzde kullanılan önemli bir metottur çünkü kovalent bağlar genellikle enzim ve taşıyıcı arasında daha güçlü bir etkileşime neden olur. Bu yüzden, enzimin kullanılan matriksten sızması minimum düzeydedir.
ġekil 1.21. Enzimlerin taşıyıcı üzerinde kovalent immobilizasyonu: (A) Enzimin kovalent bağ yapan fonksiyonel grubu; (B) Enzim ile taşıyıcıyı bağlayan grup (linker); (C) Taşıyıcı; (D) Ara boşluk
Genellikle, enzimlerin taşıyıcılara kovalent bağlanması ile gerçekleştirilen bu immobilizasyon, enzim yüzeyindeki aktif amino asit grupları ve taşıyıcı yüzeyinde bulunan aktif fonksiyonel gruplar arasındaki kimyasal reaksiyona dayanır (Şekil 1.21.) (Cao, 2005). Bu metot güçlü bir enzim immobilizasyon metodudur. Çünkü bağlanma tersinmezdir ve enzim konformasyonundaki çok noktalı bağlanmadan dolayı yapı daha kararlı ve daha sağlamdır.
1.4.1.3. Enzim hapsetme
Enzimlerin hapsedilmesi kelime anlamından da anlaşılacağı gibi, enzim moleküllerinin veya enzim çözeltilerinin bir matriks içerisinde tutulmasıdır. Matriks, katalitik bileşenin (çözünebilen/çözünemeyen enzim preparatının) bir sıvı ortamda (polimer çözeltisi) yayılması ile hazırlanır. Bu şekilde, enzimin kimyasal veya fiziksel metotla tutulduğu çözünmeyen bir matriks oluşur (Şekil 1.22.).
ġekil 1.22. Biyokatalizörlerin hapsedilmesi
Hapsetme tekniği enzim immobilizasyon metotları arasındaki en basit metotlardan biridir. Bu metot kullanılarak birden fazla enzim eş zamanlı olarak immobilize edilebilir (Wei ve ark., 2002). 1950‟lilerin ortalarında enzimlerin fiziksel olarak inorganik bir jel matriks (cam) içerisinde biyolojik aktivitelerinin korunarak immobilize edilebileceği ilk kez gösterilmiştir (Dickey, 1995). Ancak, enzim immobilizasyonunda hapsetmenin önemi, 1960‟lı yılların başında Bernfeld ve Wan (1963) tarafından enzim moleküllerinin polimerleşme ile oluşan jel matriks içerisinde hapsedilebileceği gösterildikten sonra fark edilebilmiştir. Daha sonra Mosbach tarafından bu metodun kullanımı daha geniş bir sahaya yayılmıştır (Mosbach ve Mosbach, 1966). Damla, membran, film, disk ve lif şekillerinde hazırlanabilen matriksler küçük substrat moleküllerine karşı geçirgen olmalıdır. Orijinal hapsetme tekniklerinde enzimler (veya tüm hücreler) ilk olarak bir çözelti içerisinde dağıtılmak ve fiziksel bir bariyer oluşturma amacıyla katılaştırılmak zorundaydı. Günümüzde, matriks oluşumu için farklı yöntemler kullanılmaktadır. Bunlar arasında çapraz bağlama, polimerizasyon gibi kimyasal yollar, fiziksel jelleştirme gibi fiziksel yollar veya bu iki yolun birleşimi şeklinde farklı yolar kullanılmaktadır. Hapsetme için kullanılacak materyaller ve hapsedilecek enzimler arasındaki etkileşime bağlı olarak, hapsetme metodunun farklı varyasyonları bulunmaktadır. Bunlara örnek olarak: Kovalent yolla hapsetme, çapraz-bağlamayla hapsetme, adsorpsiyonla hapsetme, ekleme-hapsetme sayılabilir (Kil‟deeva ve ark., 1968).
1.4.1.4. Sol-jel bazlı enzim immobilizasyonu
Geleneksel silika bazlı sol-jel prosesi, sol olarak bilinen silikanın homojen bir süspansiyonunu oluşturmak için tetrametoksisilan (TMOS) ya da tetraetoksisilan (TEOS)
gibi bir alkoksitin asit ya da baz yardımı ile hidrolizini içerir. Oluşan sol daha sonra olgunlaştırma ve kurutma işlemine maruz bırakılır ve böylece daha fazla polikondenzasyon reaksiyonu ve çözücü uzaklaşması olur. Böylece polikondenzasyonla jel oluşumu gerçekleşir ve enzim jel içerisinde hapsedilir. Bu basamaklar Şekil 1.23.‟de özetlenmiştir.
RO Si OR OR OR 4 H2O Si 4 ROH H+/OH -Si OR OR OR 3 H2O Si 3 ROH H+/OH -R' R' HO OH OH OH OH OH OH Si Si H+/OH -HO OH O OH Si R' H2O OH OH Si R' OH OH OH OH OH HO Si HO OH O OH Si R' OH OH H+/OH- O Si O O Si R' O Si O O Si OH Si R' Si O O O Si R' O O O
A)
B)
C)
OH nġekil 1.23. Sol-jel matriksinin hazırlanması
Sahip olduğu pek çok özelliğinden dolayı sol-jel prosesi önemli bir immobilizasyon metodudur. Bunlar arasında:
(1) Yüzey alanı, tanecik büyüklüğü, morfoloji gibi kontrol edilebilir mikro yapı. Prekürsör tipi, katalizör tipi, prekürsörler oranı, su/prekürsör oranı, kurutma ve
![ġekil 1.15. Kiral katalizör olarak kaliks[4]aren türevi ve kullanıldığı faz transfer alkilasyon reaksiyonu](https://thumb-eu.123doks.com/thumbv2/9libnet/4672061.87515/23.892.178.739.816.1108/ġekil-kiral-katalizör-türevi-kullanıldığı-transfer-alkilasyon-reaksiyonu.webp)

![ġekil 2.19. Kaliks[4]aren-Cu +2 kompleksi ile HPNP‟nin etkileşim mekanizması](https://thumb-eu.123doks.com/thumbv2/9libnet/4672061.87515/57.892.341.631.234.548/ġekil-kaliks-aren-cu-kompleksi-hpnp-etkileşim-mekanizması.webp)