T.C.
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
ROSACEAE FAMĐLYASINDAKĐ
FARKLI BĐTKĐ TÜRLERĐNDEN ĐZOLE EDĐLEN Erwinia amylovora (Burr.) Winslow et al. 'NIN BĐYOKĐMYASAL VE POLĐMERAZ ZĐNCĐR REAKSĐYONU (PCR) TESTLERĐYLE TANILANMASI
Rüveyda ATASAĞUN
YÜKSEK LĐSANS TEZĐ BĐTKĐ KORUMA ANABĐLĐM DALII
T.C.
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
ROSACEAE FAMĐLYASINDAKĐ FARKLI BĐTKĐ TÜRLERĐNDEN ĐZOLE EDĐLEN Erwinia amylovora (Burr.) Winslow et al. 'NIN BĐYOKĐMYASAL VE
POLĐMERAZ ZĐNCĐR REAKSĐYONU (PCR) TESTLERĐYLE TANILANMASI
Rüveyda ATASAĞUN YÜKSEK LĐSANS TEZĐ BĐTKĐ KORUMA ANABĐLĐM DALI
DANIŞMAN
Yrd. Doç. Dr. KUBĐLAY KURTULUŞ BAŞTAŞ
ÖZET
Yüksek Lisans Tezi
ROSACEAE FAMĐLYASINDAKĐ FARKLI BĐTKĐ TÜRLERĐNDEN ĐZOLE EDĐLEN Erwinia amylovora (Burr.) Winslow et al. 'NIN BĐYOKĐMYASAL VE
POLĐMERAZ ZĐNCĐR REAKSĐYONU (PCR) TESTLERĐYLE TANILANMASI
Rüveyda ATASAĞUN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü
Bitki Koruma Anabilim Dalı
Danışman:Yrd. Doç. Dr.Kubilay K. BAŞTAŞ
2009, 79
Jüri: Doç. Dr. Nuh BOYRAZ
Yrd. Doç. Dr. Mustafa Yorgancılar
Yrd. Doç. Dr. Kubilay K. BAŞTAŞ (Danışman)
Erwinia amylovora (Burr.) Winslow et al.’ın sebep olduğu ateş yanıklığı
hastalığı Rosaceae familyasına ait 39 genusta yer alan bitkilerin en ciddi ve tahripkar bakteriyel hastalığıdır. 2006 ve 2007 yıllarında, Konya ilinde Rosaceae familyasına ait farklı konukçulardan ve bu konukçuların farklı çeşitlerinden bakteriyel izolasyonlar yapılmıştır. E. amylovora’ nın teşhisinde, 5% SNA, King B besiyerlerinde gelişim, oksidatif/fermentatif test, 36 °C’de gelişim, levan üretimi, sakkarozdan indirgenen bileşikler, asetoin üretimi, jelatinin sıvılaştırılması, nişasta, maltoz, inulin, gliserol ve mannitol, sorbitol ’den asit üretimi, ureaz aktivitesi, indol oluşumu, esculinin hidrolizi ve tütünde hipersensitif reaksiyon testleri esas alınmıştır. Đzolatların moleküler karakterizasyonunda, plasmid pEA29’e göre sentezlenen
oligonükleotit primerlerle yaklaşık 1 kb’lik fragment, PCR ile amplifiye edilmiştir. Patojenisite testlerinde, her izolat, elde edildiği konukçusunun fidanlarına ve ham armut meyvelerine 108 hücre/ml yoğunlukta bakteriyel süspansiyonun inokulasyonu ile gerçekleştirilmiştir. Çalışmada 213 adet bitki örneği toplanmış olup bunlardan 148 adet bakteri izole edilmiştir. Yapılan biyokimyasal, moleküler ve patojenisite testleri sonucunda 84 adedi Erwinia amylovora olarak tanılanmıştır. Elde edilen
Erwinia amylovora izolatlarının 38 tanesi elma (Malus communis), 17 tanesi armut
(Pyrus communis), 10 tanesi ayva (Cydonia vulgaris), 4 tanesi alıç (Crateagus sp.), 2 tanesi ateş dikeni (Pyracantha sp.), 3 tanesi dağ muşmulası (Cotoneaster
salicifolius), 1 tanesi yayılıcı dağ muşmulası (Cotoneaster horizantalis), 9 tanesi de
süs elması (Malus floribunda) olarak belirlenirken, Đl genelinde farklı konukçulardaki etmenle bulaşıklılık durumları; Malus communis % 37.6, Pyrus
communis % 39.5, Cydonia vulgaris % 47.6, Pyracantha sp. % 66.6, Cotoneaster sp.
% 100, Crateagus sp. % 80 ve Malus floribunda % 27.2 olarak tespit edilmiştir.
ABSTRACT
M.S. Thesis
IDENTIFICATION OF Erwinia amylovora (Burr.)Winslow et al. FROM THE DIFFERENT PLANT SPECIES OF ROSACEAE FAMILY WITH BIOCHEMĐCAL AND POLYMERASE CHAIN REACTION (PCR) TESTS
Rüveyda ATASAĞUN
Selçuk University
Graduate School of Natural and Applied Sciences
Department of Plant Protect
Supervisor : Asist Prof. Dr. Kubilay K. BAŞTAŞ
2009, 79
Jury: Doc. Dr. Nuh BOYRAZ
Asist. Prof. Dr. Mustafa YORGANCILAR Asist. Prof. Dr. Kubilay K. BAŞTAŞ (Supervisor)
Fire blight caused by Erwinia amylovora (Burr.) Winslow et al., is the most serious and destructive bacterial disease in 39 genus of the family Rosaceae. It was made bacterial isolations from different hosts belonging to Rosaceae family and their varieties in Konya Provinces in 2006 and 2007 years. In the identification of E.
amylovora, growth on 5% SNA, King’s B media, oxidative/fermentative test, growth
at 36 °C, levan production, reducing substances from sucrose, acetoin production, gelatin liquefaction, acid production from lactose, maltose, starch, mannitol, sorbitol, glycerol and inositol, urease activity, indol test, esculin hydrolysis and hypersensitive
reaction on tobacco tests were based. In molecular characterization of isolates, fragment of approximately 1 kb amplified by PCR and with oligonucleotide primers derived from plasmid pEa29. Each isolate of E. amylovora was inoculated bacterial suspension with 108 cfu/ml concentrations to seedlings of which obtained host and immature pear slices in pathogenicity tests. In the study, 148 bacteria are isolated from the 213 collected materials. 84 Erwinia amylovora isolates were identificated by biochemical, molecular and patogenicity tests. It contains 38 Malus communis isolates, 17 Pyrus communis isolates, 10 Cydonia vulgaris isolates, 4 Crateagus sp. isolates, 2 Pyracantha sp. isolates, 3 Cotoneaster salisifolius isolates, 1 Cotoneaster
horizantalis isolates and 9 Malus floribunda isolates. In Konya province, percent of
infection with fire blight pathogen of Erwinia amylovora was found ; % 37.6 for
Malus communis, % 39.5 for Pyrus communis, % 47.6 for Cydonia vulgaris, % 66.6
for Pyracantha sp., %100 for Cotoneaster sp. ,% 80 for Crateagus sp.,% 27.2 for
Malus floribunda.
TEŞEKKÜR
Çalışmamın her aşamasında benden yardımını esirgemeyen danışmanım Sayın Yrd. Doç. Dr. Kubilay K. BAŞTAŞ’a, bölümümüzün her türlü imkanını kullanmamı sağlayan bölüm başkanımız Sayın Prof. Dr. Ahmet GÜNCAN’a, değerli hocam Sayın Doç. Dr. Nuh BOYRAZ’a, Tarla Bitkileri Bölümü hocalarından Sayın Yrd. Doç. Dr. Mustafa YORGANCILAR’a, bölümümüz asistanlarından Araş. Gör. Murat KARACA’ya ve Araş. Gör. Serkan YEŞĐL’e, Tarla Bitkileri Biyoteknoloji Laboratuarında görevli asistan ve yüksek lisans öğrencisi arkadaşlarıma, yüksek lisans çalışma arkadaşlarıma, Sarayönü Đlçe Tarım Müdürlüğü personeline ve her zaman yanımda olan, hep destek olan çok değerli aileme yardımlarından dolayı ayrı ayrı teşekkür ederim.
ĐÇĐNDEKĐLER Sayfa No ÖZET... i ABSTRACT ... iii TEŞEKKÜR ... v ĐÇĐNDEKĐLER ... vi ŞEKĐLLER LĐSTESĐ ... ix ÇĐZELGELER LĐSTESĐ ... xi 1.GĐRĐŞ ... 1 2. KAYNAK ARAŞTIRMASI ... 3 3.MATERYAL VE METOT ... 15 3.1. Materyal ... 15 3.1.1. Bitki materyali ... 15 3.2. Metot ... 18 3.2.1. Patojenin izolasyonu ... 18
3.2.1.1 Örneklerin laboratuara getirilmesi ... 18
3.2.1.2. Erwinia amylovora’nın izolasyonu ... 18
3.2.2. Patojenin tanısı ... 20
3.2.2.1. Koloni morfolojisi ... 20
3.2.2.2. Biyokimyasal testler ... 20
3.2.2.2.1. 360C’de gelişim ... 21
3.2.2.2.2. Gram reaksiyon testi ... 21
3.2.2.2.3.Üreaz oluşumu test ... 22
3.2.2.2.4. Đndol üretimi testi ... 22
3.2.2.2.5.Jelatinin hidrolizi testi ... 23
3.2.2.2.6. % 5 SNA’da gelişim... 24
3.2.2.2.7. King B besiyerinde Flouresan pigment oluşumu ... 24
3.2.2.2.8. Acetoin üretimi ... 25
3.2.2.2.9. Oksidatif- Fermentatif test ... 26
3.2.2.2.10. Sakarozdan indirgenen bileşikler ... 27
3.2.2.2.11. Esculin hidrolizi ... 28
3.2.2.2.13. Karbonhidratlardan asit üretimi ... 29
3.2.2.3. Patojenisite testi ... 30
3.2.2.3.1. Ham armut testi ... 30
3.2.2.3.2. Armut fidanlarının sürgünlerine inokulasyon ... 30
3.2.2.4. Tütünde hipersensitif reaksiyon testi ... 30
3.2.2.5. Moleküler tanılama ... 31
3.2.2.5.1. DNA izolasyonu ... 31
3.2.2.5.1.1. PstI fragmentinin amplifikasyonu için spesifik primer kullanımı ... 32
3.2.2.5.2. Moleküler tanıda kullanılan kimyasallar ... 32
3.2.2.5.3. Erwinia amylovora’nın DNA amplifikasyonu için Polymerase Chain Reaction (PCR) karışımının hazırlanması ... 33
3.2.3.5.4. PstI fragmentinin PCR protokolü ... 34
3.2.2.5.5. PCR ürünlerinin elektroforez sisteminde belirlenmesi ... 34
3.2.2.5.5.1. Agaroz jelin ve elektroforez tampon solüsyonunun hazırlanması ... 34
3.2.2.5.5.2. Amplifiye edilen bakteriyel DNA örneklerinin elektroforez sisteminde yürütülmesi ... 34
3.2.2.5.5.3. Agaroz jelin görüntülenmesi ve sonuçların incelenmesi ... 35
3.2.3. Kültürlerin saklanması ... 35
4. ARAŞTIRMA BULGULARI ... 36
4.1. Bitki Materyali ... 36
4.2. Patojenin Tanısı ... 40
4.2.1. Patojenin izolasyonu ... 40
4.2.1.1 Örneklerin laboratuvara getirilmesi ... 40
4.2.1.2. Patojenin izolasyonu ... 43
4.2.2. Koloni morfolojisi ... 43
4.2.3. Biyokimyasal Test Sonuçları ... 43
4.2.3.1. 360C’de gelişim ... 44
4.2.3.2. Üreaz oluşumu testi ... 44
4.2.3.3. Đndol üretimi testi ... 44
4.2.3.4. Jelatinin hidrolizi testi ... 45
4.2.3.5. KOH testi ... 45
4.2.3.7. King B besiyerinde Fluoresans pigment oluşumu ... 46
4.2.3.8. Acetoin üretimi... 46
4.2.3.9. Oksidatif- Fermentatif test ... 47
4.2.3.10. Sakarozdan indirgenen bileşikler ... 47
4.2.3.11. Aesculin hidrolizi ... 47
4.2.3.12. Cystein’den H2S üretimi ... 48
4.2.3.13. Karbonhidratlardan asit üretimi ... 48
4.2.4. Patojenisite Testleri ... 54
4.2.4.1. Ham armut testi ... 54
4.2.4.2. Armut fidanlarının sürgünlerine inokulasyon ... 55
4.2.5. Tütünde Hipersensitif Reaksiyon Testi ... 56
4.2.6. Moleküler tanılama ... 57 4.2.6.1. PCR amplifikasyon sonuçları ... 57 5. TARTIŞMA ... 61 6. SONUÇ VE ÖNERĐLER ... 65 7. KAYNAKLAR ... 69 ÖZGEÇMĐŞ ... 80
ŞEKĐLLER LĐSTESĐ
Şekil 4.2.1.1 A Hastalıklı armut sürgünü, B Armut ağacının gövdesinde bakteriyel
akıntı (ooze), C Ateş yanıklığı belirtisi gösteren ayva sürgünü, D Armut ağacında çiçek yanıklığı ... 41
Şekil 4.2.1.2 A Elma sürgününde çoban değneği belirtisi, B Elma sürgününde
bakteriyel akıntı (ooze), C Elma ağacının gövdesinde bakteriyel kanser oluşumu, D Elma meyvesine bakteriyel akıntı ... 42
Şekil 4.2.2.1. % 5 SNA besiyerinde Erwinia amylovora kolonilerinin gelişimi ... 43 Şekil 4.2.3.2.1. Üreaz testi sonucu (negatif) 1- Kontrol, 2- Ea1, 3- Ea2, 4-Ea3,
5- Xylophilus ampelinus ... 44
Şekil 4.2.3.4.1. Jelatinin hidrolizi testi sonucu (pozitif) 1- Ea5, 2- Kontrol ... 45 Şekil 4.2.3.5.1. KOH testi (pozitif)……….46 Şekil 4.2.3.9.1. Oksidatif- fermentatif test sonucu (pozitif) 1-Kontrol, 2- Ea31,
3-Ea3, 4-Ea19, 5-Ea73 ... 47 Şekil.4.2.3.12.1. Cystein’den H2S üretimi testi (negatif). K-Kontrol, 1- Xanthomonas campestris pv. phaseoli 2- Ea4………..48 Şekil 4.2.3.13.1. Maltose’dan asit üretimi testi (negatif) 1- Kontrol, 2- Ea213- Ea32
4-Ea64 5- Ea28 6-Ea42 7-Ea57... 49
Şekil 4.2.3.13.2. Nişasta’dan asit üretimi testi (negatif) 1- Kontrol, 2- Ea8 3-Ea20
4-Ea71 5-Ea29 6-Ea43 7-Ea81 ... 49
Şekil 4.2.3.13.3. Sorbitolden asit üretimi testi (pozitif) 1-Kontrol,2- Ea5 3-Ea71,
4- Pseudomonas syringae pv. phaseolicola ... 50
Şekil 4.2.4.1.1. Ham armut testinde ooze oluşumu ... 55 Şekil 4.2.4.2.1 (A) Hastalık bulaştırılmış Santa Maria armut fidanı, (B) Kontrol
olarak bırakılmış Santa Maria armut fidanı ... 56
Şekil 4.2.4.2.2. Ateş dikeninde çoban değneği belirtisi ... 56 Şekil 4.2.5.1. Tütünde hipersensitif reaksiyon testi (pozitif) ... 57 Şekil 4.2.6.1.1. Elma izolatlarının 1000 bp’de bant oluşturduğu PCR sonuçları. M-
DNA Marker 1- Ea5, 2- Ea6, 3-Ea7, 4-Ea8, 5- Ea9, 6- Ea10, 7-Ea11, 8-Ea13, 9-Ea14, 10-Ea15, 11-Ea20, 12- Ea21, 13-Ea22, 14- Ea31, 15-Ea32, 16-Ea33, 17-Ea34, 18-Ea35, 19-Ea36, 20-Ea37, K-Kontrol. ... 58
Şekil 4.2.6.1.2. Elma izolatlarının 1000 bp’de bant oluşturduğu PCR sonuçları. M-
DNA Marker, 1- Ea38, 2-Ea39, 3- Ea 49, 4- Ea50, 5- Ea51, 6- Ea52, 7-Ea53, 8- Ea55, 9- Ea56, 10-Ea57, 11-Ea58, 12- Ea59, 13- Ea60, 14-Ea61, 15-Ea65, 16-Ea66, 17-Ea67, 18-Ea70 ... 58
Şekil 4.2.6.1.3. Armut izolatlarının 1000 bp’de bant oluşturduğu PCR sonuçları. M-
DNA Marker, 1-Ea1, 2-Ea2, 3- Ea3, 4- Ea12, 5-Ea16, 6- Ea23, 7-Ea24, 8- Ea25, 9-Ea26, 10-Ea27, 11-Ea28, 12-Ea29, 13-Ea30, 14- Ea62, 15-Ea63, 16-Ea64,
17- Ea71 ... 59
Şekil 4.2.6.1.4. Ayva izolatlarının 1000 bp’de bant oluşturduğu PCR sonuçları. M-
DNA Marker, 1- Ea4, 2- Ea17, 3- Ea18, 4-Ea19, 5- Ea40, 6-Ea41, 7- Ea42, 8- Ea43, 9- Ea54, 10- Ea72, K-Kontrol ... 59
Şekil 4.2.6.1.5. Çeşitli süs bitkilerinin 1000 bp’de bant oluşturduğu PCR sonuçları.
M- DNA Marker, 1- Ea44, 2-Ea45, 3- Ea46, 4- Ea47, 5-Ea48, 6- Ea68, 7- Ea69, 8- Ea73, 9-Ea74, 10- Ea75, 11-Ea76, 12-Ea77, 13- Ea78, 14-Ea 79, 15-Ea80, 16-Ea81, 17-Ea82, 18- Ea83, 19-Ea84, 20-Referans kültür (Ea5382), K- Kontrol ... 60
ÇĐZELGELER LĐSTESĐ
Çizelge 3.1.1.1. Konya ilinde, Rosaceae familyası bitkilerinden toplanan örnekler . 15
Çizelge 3.1.1.1. devam ... 16
Çizelge 3.1.1.1. devam ... 17
Çizelge 3.1.1.1.devam ... 18
Çizelge 3.2.2.2.1 Erwinia amylovora tanısı için yapılan biyokimyasal testler ... 21
Çizelge 4.1.1. Farklı konukçulardan elde edilen toplam izolat ve elde edilen Erwinia amylovora izolatları sayısı ... 36
Çizelge 4.1.1. devam ... 37
Çizelge 4.1.1.devam ... 38
Çizelge 4.1.1. devam ... 39
Çizelge 4.1.1.devam ... 40
Çizelge 4.1.2. Konya ilinde Rosaceae familyasındaki konukçulara göre bulaşıklılık durumu ... 40
Çizelge 4.2.3.1. Erwinia amylovora izolatlarının biyokimyasal testlere verdiği sonuçlar ... 51
Çizelge 4.2.3.1. devam ... 52
Çizelge 4.2.3.1. devam ... 53
1. GĐRĐŞ
Erwinia amylovora (Burr.) Winslow et al.’ın neden olduğu ateş yanıklığı
hastalığı, armut, elma, ayva, yenidünya gibi yumuşak çekirdekli meyve türlerinin içinde bulunduğu Rosaceae familyasının 37 cinsine ait 129 türde belirti oluşturduğu rapor edilmektedir. Bu cinslerin içinde en şiddetli yanıklık belirtisi gösterenler ve ekonomik olarak, önemli ölçüde zarar görenler; başta Pyrus ve Malus olmak üzere
Cydonia, Cotoneaster, Crataegus, Pyracantha ve Sorbus cinsleridir (Van der Zwet
ve Keil, 1979).
Özellikle armutlarda büyük zararlara neden olan hastalık, dünyada ilk defa belirlenen bitki bakteri hastalığı olma özelliğini taşımaktadır (Van der Zwet ve Keil, 1979).
Ateş yanıklığının bilinen en eski gözlemleri 1780’de ABD’de Newyork Hudson Vadisi’nde olmuştur. Bu tarihten sonra, hastalık başta ABD olmak üzere dünya ülkelerine hızla yayılmaya başlamıştır. Türkiye’de ilk defa 1985 yılında Afyon ili Sultandağı ilçesinde armutlarda tespit edilerek kesin tanısının yapıldığı hastalığın ayva, elma ve yeni dünyalarda da bulunduğu bildirilmiştir (Öktem ve Benlioğlu, 1988 ).
Patojen açısından elverişli şartlarda, hastalığın bitkideki ilerleyişi çok hızlı olmakta ve böylece kısa bir sürede, çok önemli ekonomik kayıplara neden olmaktadır. Örneğin, 1900-1910 arasında Kalifornia’daki toplam armut ağacı sayısında %28 oranında düşüş tespit edilmiştir. 1908’e Hollister ve Santa Clara Vadisi’ndeki armut ağaçlarının 2/3’sinde ateş yanıklığı gözlemlenmiş ve 5.000.000 dolardan fazla kayıp olduğu bildirilmiştir. 1914’de Illinois’da elma ve armutlardaki ürün kaybı 1.500.000 dolar olmuştur. 1927-1928’de Yeni Zelanda’da elmalardaki şiddetli sürgün enfeksiyonu sonucu kayıp %100’dür. Birleşik Devletlerde yalnız 1936’da toplam armut üretimi %14 oranında azalmış, bu da yaklaşık 23.000 ton olup, maliyeti 4.000.000 dolardan fazladır. 1951-1960 yılları arasındaki yıllık kayıp armutlarda 1.500.000 dolar, elmalarda 2.500.000 dolardır. 1955’de Güneydoğu
lowa’da bir fidanlıktaki elma ve armut ağacı kaybı 200.000’dir. 1958-1969 yıllarında Đngiltere’deki toplam kayıplar; 20.000 armut, 20.000 alıç, 15.000 Cotoneaster ve 2000 ateş dikenidir. 1963’de California’da armutlardaki ateş yakınlığı zararı %14 olurken, elmalardaki oranda %5’dir. 1975’de Hollanda’da 2.000.000’dan fazla
Cotoneaster (dağ muşmulası), 13.000 ateş dikeni, 8700 Stranvaesia (Alev ağacı) ve
4500 Sorbus (Üvez) tahrip olmuştur (Van der Zwet ve Keil, 1979). 1976 yılında California’da, sadece armutlarda, 47.000.000 dolarlık kayıp olduğu bildirilmektedir (Van der Zwet ve Beer, 1991).
Özellikle yumuşak çekirdekli meyvelerde sorun olan bu hastalık üzerine dünyada çalışan araştırıcılar, konunun ve hastalığın önemli görülmesi üzerine, 40 yıl kadar önce bir araya gelerek bir çalışma grubu oluşturmuşlar ve yaptıkları araştırmaları değerlendirmek, ileriye dönük projeler hazırlamak üzere 3 yılda bir “workshop”lar düzenlemektedirler.
Bu araştırmanın amacı, ülkemizde uygun şartlar altında büyük zararlara sebep olan önemli bir bakteriyel patojen Erwinia amylovora’nın hızlı ve kesin tanısının biyokimyasal ve moleküler düzeyde yapılarak farklı konukçulardaki varlığının belirlenmesi amaçlanmıştır. Böylece farklı konukçulardaki hastalık etmeni ile bulaşıklılık durumu belirlenirken patojenin farklı izolatları arasındaki, mevcut ise, farklılıkların belirlenebilmesi planlanmıştır. Ayrıca çalışma hastalıkla mücadele için önemli sonuçlar doğuracak ve konukçu patojen interaksiyonları açısından dayanıklı çeşitlerin yetiştirilmesine olanak sağlayacak bilgiler elde edilebilecektir.
2. KAYNAK ARAŞTIRMASI
Ateş yanıklığı hastalığı dünyada yaklaşık iki asırlık geçmişi olan bir hastalıktır. 18. yüzyılında ateş yanıklığının nedeni olarak böcek ve fungus olmak üzere iki teori gelişmiş ancak 1882’de Burrill tarafından patojenin ilk bakteriyel tanımlanması yapılarak Micrococcus amylovorus olarak isimlendirilmiştir. Etmene en son 1920’de Winslow ve arkadaşları tarafından Erwinia cinsi içinde yer verilerek
Erwinia amylovora ismi verilmiştir (Van der Zwet ve Keil, 1979).
Schroth ve Hilderbrand (1980)’e göre ateş yanıklığı hastalığı etmeni Erwinia
amylovora (Burr.) Winslow et al., Enterobacteriaceae familyasında Erwinia cinsi
içinde yer alan, gram negatif, fakültatif anaeorob, 3.0 nm uzunluğunda, 0.5-1.0 nm çapında, kısa çubuk şekilli ve peritrik kamçılı bakterilerdir. Đn vitro’da optimum 21-28°C arasında gelişen bakterinin, termal ölüm noktası 45-50°C’ dir. Optimum pH gelişimi 6,0-7,5’dir (Van der Zwet ve Keil, 1979).
Etmen gelişimi için nikotonik aside ihtiyaç duymaktadır. Ayrıca etmen amylovorin adı verilen toksini sentezleyebilmektedir (Schroth ve ark., 1974, Agrios, 1997, Aldwinckle ve Jones, 1990).
Patojen konukçu bitkilerde sentezleyebildiği amylovorini yapay besiyerinde sentezleyememektedir. Duyarlı konukçu bitkiler amylovorinden olumsuz yönde etkilenirken dayanıklı konukçu bitkiler amylovorinden etkilenmemektedir. E.
amylovora yapay besiyerinde +4°C’de uzun süre canlılığını korurken doğal
koşullarda 90 gün sonunda canlılığını yitirmektedir. E. amylovora sürgün, meyve, ağaç kabuğu gibi çeşitli bitki dokularında damlacıklar halinde ‘ooze’ adı verilen bakteriyel akıntılar ve ‘strand’ adı verilen bakteriyel iplikçikler oluşturmaktadır. Ooze içindeki bakteriler genellikle virulent olup 2 yıl veya daha uzun bir süre patojenitelerini sürdürmektedir. Sert yapıda olan ve zamanla kırılabilen iplikçiğin % 20’sini bakteriyel hücre oluşturmaktadır (Van der Zwet ve Keil, 1979; Tokgönül, 1991). Erwinia amylovora, sakkaroz içeren besiyerlerinde mukoid koloniler oluşturan, birçok şeker, organik asit ve şeker alkoloidlerini karbon kaynağı olarak
kullanabilen ama, büyüme faktörü olarak nitrojen ve nikotinik asidin amino kaynaklarına ihtiyaç duyan gram negatif bir bakteridir (Agrios, 1997).
Hastalıklı bitki parçacıklarından elde edilen Erwinia amylovora izolatları Miller-Schroth besi ortamında geliştirilmiş ve koloni merkezinin koyu portakal, kenarlarının ise açık renkli oluşu nedeniyle izolatlarının tipik Erwinia amylovora özelliği taşıdığını belirlemişlerdir (Momol ve Zeller, 1992). Ünlü (2002), yaptığı çalışmada Erwinia amylovora’nın gelişimi için yarı seçici besi ortamı olarak MS (Miller ve Schroth 1972) ve SNA (Sakaroz Nutrient Agar) besi ortamlarını kullanmış ve bu besiyerlerinde levan oluşumu ve kubbemsi bakteri oluşumuna rastlamıştır. 108 ve 109 h/ml yoğunluğunda hazırlanan E. amylovora bakteri süspansiyonlarına daldırılarak bulaştırılan iğneleri ham armut meyvelerine 1-2 mm derinlikte batırılmış ve daha sonra bu meyveleri içerisinde ıslatılmış kurutma kağıtları olan petri kaplarına alarak inkübe edilmiş ve iğnelenen yerlerde Erwinia amylovora’nın karakteristik bakteriyel akıntıları gözlenmiştir ( Saygılı, 1995).
Bahar başlarında ılık nemli havalar esnasında, ilk simptomlar genellikle çiçeklerde görülür. (Fahy ve Persley, 1983). Çiçekler önce sulanmış gibi görünür sonra hızla pörsür, kahverengine döner siyahlaşır ve düşebilir veya ağaçta asılı kalabilir. Bu belirtiler hemen aynı mahmuzdaki diğer yapraklara veya yakın dallardaki yapraklara sıçrar. Yapraklarda ana damar boyunca ve yaprak kenarlarında kahverengi-siyah lekeler başlar. Siyahlaşma ilerlerken, yapraklar kıvrılır ve pörsür, aşağı doğru asılı kalır ve genelde bükük yanık filizlere asılı kalırlar (Maden, 1989). Bu ateş yanıklığının en tipik belirtilerindendir. Bu yapraklar yazın koyu yeşil yapraklı sıhhatli sürgün veya ağaçlar ile kışın sıhhatli ağaçların çıplak dallarıyla zıt bir görünüm oluştururlar. Diğer hiç bir meyve hastalığında yapraklar bu kadar sağlam, ölü sürgünlere asılı kalmaz (Çınar, 1988 ). Genellikle elmalarda yapraklar kahverengileşir, armutlarda koyu kahveden siyaha döner (Fahy ve Persley, 1983).
Uç sürgünler ve dip sürgünler genelde direkt olarak enfeksiyon alır ve uçtan aşağı doğru solarlar. Bu sürgünlerin kabuğu kahverengi-siyaha döner ve önce yumuşaktır, fakat sonra çöker ve sertleşir (Maden, 1989). Yanık sürgünlerde tipik
karakteristik simptom sürgün uçlarının çoban değneği ya da kanca gibi bir forma dönüşmesidir ve yapraklar siyahlaşarak sürgünlere asılı kalırlar (Van der Zwet ve Keil, 1979).
Simptomlar meyve mahmuzları ve uç dallardan aşağı doğru ilerler ve yan dallara gelirler. Burada kanserler oluşur. Enfeksiyonlu ince dalın etrafındaki dal kabuğu önce sulu görünür, daha sonra koyulaşarak çöker ve kurur. Eğer kanser genişlerse ve dalı çevirirse, dalın enfeksiyon üstündeki kısmı ölür. Eğer enfeksiyon tam çevirmeden durursa, o zaman dormant veya inaktif bir kanser oluşur bu da çökük ve bazen çatlak kenarlıdır (Maden, 1989). Uç noktadan başlayan hastalık, şiddet derecesine göre sürgünü, kalın dallara kadar kurutabilir (Karaca, 1977).
Meyve enfeksiyonları genellikle saptan olur. Küçük olmayan meyveler sulu bir hal alır, sonra kahverengine döner, pörsür, mumyalaşır ve sonunda siyahlaşırlar. Ölü meyveler enfeksiyondan bir kaç ay sonrada ağaca asılı kalırlar (Maden, 1989; Fahy ve Persley, 1983). Ayrıca hasat sonrası paketlenen meyvelerde de etmen bulunabilmektedir (Van der Zwet ve Keil, 1979).
Nemli koşullar altında, süt rengi yapışkan akıntı damlaları yeni enfeksiyonlu herhangi bir kısımda görülebilir. Akıntı genellikle hava ile temas eder etmez kahverengine döner. Damlalar birleşip daha büyük damlaları oluşturabilir, bu da akarak bitki yüzeyinde bir tabaka oluşturur (Maden, 1989). Sonunda köke kadar yayılan bakteriler tüm ağacın kurumasına yol açabilirler. Ateş yanıklığı; kuruyan taze yapraklar, küçük meyvelerle tıpkı sert çekirdekli meyvelerde görülen Monilya hastalığını andırır (Karaca, 1977).
Hastalık yangından sonraki bir ağacın görünümüne çok benzer. Bu nedenden dolayı hastalığa ateş yanıklığı denilmiştir (Çınar, 1988). Hastalığın literatürde görülen öteki isimleri şunlardır: Çiçek yanıklığı, meyve yanıklığı, dal yanıklığı, elma yanıklığı ve armut yanıklığı (Karaca, 1977).
Bakteriler bir önceki mevsim sırasında oluşan kanserlerin kenarlarında, diğer konukçulardaki kanserlerde ve muhtemelen tomurcuklarda ve belirgin şekilde sağlam görülen odun dokularında kışlarlar. Onlar çoğunlukla büyük dallarda canlılıklarını sürdürürler ve 1 cm çaptan daha küçük filizlerde nadiren kışlayabilirler. Đlkbaharda, bakteriler canlı kaldığı bu kanserlerde aktif hale gelirler, çoğalırlar ve bitişik sağlam kabuğa yayılırlar. Nemli veya ıslak havalarda bu bakteriyel kümeler tarafından su alınır, öyle ki hacimce dokunun kapasitesinden daha fazla büyür, böylelikle onların bir kısmı lentiseller ve doku üzerindeki yarıklardan dışarı çıkar. Bakteriyel akıntı veya salgı olarak adlandırılan bu salgı hücre ve öz suyu, milyonlarca bakteri ve bakteriyel yan ürünlerden ibarettir. Akıntı ilk defa ekseri armutlar çiçek açarken görülür. Arı, sinek, karınca gibi değişik böcekler bu tatlı ve yapışkan akıntı tarafından çekilir ve onunla bulaşırlar. Onlar sonra çiçekleri ziyaret ettiği zaman bakteri içeren salgının birazını çiçeklerin nektarına bırakırlar. Bazı durumlarda bakteriler kanserlerdeki akıntıdan sıçratıcı yağmur damlaları ile de taşınabilir. Akıntılar kuruduğu zaman o ekseri havai iplikçiler oluşturur, bunlar da rüzgarla taşınarak bir inokulum görevi üstlenirler (Van der Zwet ve Keil, 1979).
Bakteriler nektarda hızlı bir şekilde çoğalırlar, nektartodlara ulaşırlar ve çiçek dokuları içine penetrasyon yaparlar. Enfeksiyonlu bir çiçeği ziyaret eden arılar nektardaki bakterileri sonra ziyaret ettiği tüm çiçeklere taşırlar. Bir defa çiçeğe girince bakteri hızla çoğalır. Salgıladığı maddelerle onlar orta lamelin ve hücre duvarının bazı yapı maddelerini parçalarlar. Bakteriler, esas olarak hücreler arası boşluklarda olmak üzere, aynı zamanda parçalanmış orta lamelden de içeri doğru hareket ederler. Bazen çiçeğin hücrelerinin nazik hücre duvarları parçalanır ve protoplazma istila edilir. Bazı durumlarda birkaç kat hücre parçalanabilir. Bu bakterilerle dolu oldukça büyük boşlukların oluşmasına neden olur. Bakteriler çiçeklerden aşağı doğru çiçek sapına oradan da meyve mahmuzunun kabuğu içine hareket ederler. Mahmuzun enfeksiyonu onun üzerindeki tüm çiçeklerin, yaprakların ve meyvelerin ölümüne neden olur (Van der Zwet ve Keil, 1979).
Yaprakların penetrasyonu ve istilası aynı çiçeklerdeki gibi olur. Stoma ve hidatodlar bakterilere giriş kapısı olarak yardımcı olmalarına rağmen yaprak
enfeksiyonlarının çoğu böcek, dolu gibi nedenlerle açılan yaralardan olmaktadır. Bakterilerin palisad parankimasından çok süngerimsi mezofilde daha iyi ve daha hızlı geliştiği gözükmektedir. Damar prankimasından bakteriler petiole geçer ve petiol yoluyla gövdeye ulaşabilir (Van der Zwet ve Keil, 1979).
Hastalığın yayılmasında, genel olarak böcekler en önemli faktörlerden biri olarak kabul edilmektedir. 1891’de balarıları ve yabanarılarının bakteriyi çiçekten çiçeğe yaydığının gözlenmesinden beri tozlayıcı böceklerin patojenin yayılması konusunda üzerinde en çok düşünülen taşıyıcı olmuşlardır. Yapılan araştırmalar sonucunda 77 böcek cinsinin patojeni yayabildiği saptanmıştır (Van der Zwet ve Keil, 1979).
Yağmur, patojenin kanserlerden veya taze inokulumdan yayılmasında önemli bir faktördür. Ağacın üst kısımlarındaki bitkisel organlardan, bakteriler yağmur damlaları ile ağacın alt kısımlarına yayılmaktadır. Yağmurun dolaylı bir etkisi de çiçeklerdeki nektarla ilişkilidir. Kuru hava şartlarında çiçekler içindeki nektar, bakteri gelişimi için çok fazla konsantredir. Ancak yağmurun etkisiyle konsantre haldeki nektar seyreltik hale gelerek bakteri çoğalması ve enfeksiyon kolaylaşır (Van der Zwet ve Keil, 1979).
Rüzgarla yayılmada bakteri genellikle sis tanecikleri veya yağmur damlalarıyla taşınır. E. amylovora’ nın ürettiği bakteriyel iplikçikler rüzgar yardımıyla uzun mesafelere taşınabilmektedir. Bakteriyal iplikçiklerin rüzgarla bulutlara kadar taşınabildiği ve rüzgarın etkisiyle çok uzaklara kadar ulaşıp yağmur damlalarıyla konukçusuna bulaştığı saptanmıştır (Van der Zwet ve Keil, 1979).
Ateş yanıklığının yayılımında kuşlarında etkili olabileceği, örneğin; Sturnus
vulgaris (sığırcık), Phylloscopus trochilus (bülbül) gibi göçmen kuşların bakteriyi
ülkeler arasında taşıdıkları düşünülmektedir (Van der Zwet ve Keil, 1979).
Türkiye’de ateş yanıklığının ilk görüldüğü Afyon Sultandağı Đlçesi’nin yakınlarında bulunan göllerinde güneyden gelen göçmen kuşların barınma ve
dinlenme yeri olduğu belirlenmiş ve özellikle Mısır ve Kıbrıs’tan gelen göçmen kuşların hastalığı ilk kez bu bölgede ülkemize bulaştırdıkları sanılmaktadır (Öktem ve Benlioğlu, 1988).
Ateş yanıklığı insanlar, bahçe aletleri, meyve yada aşı gözüyle yayılabilir. Budama aletleri, hastalıklı dallardan sağlıklı dallara ateş yanıklığını yaymada en önemli rolü oynar. Budama makasları ve testereler, kanserli dallar ve gövdenin budanmasından sonra dezenfekte edilmezlerse, bakterinin kolayca diğer dallara ve ağaçlara bulaşmasına neden olabilirler (Van der Zwet ve Keil, 1979).
Eğer inokulumla temas ederlerse eller, elbiseler, ayakkabılar ve hatta bahçe aletlerinin tekerlekleri de yayılmada rol oynayabilirler (Van der Zwet ve Keil, 1979).
E. amylovora’ nın Đngiltere’ye bulaşmasında, bulaşık meyve kasalarının
neden olduğuna inanılmaktadır (Van der Zwet ve Keil, 1979).
Ateş yanıklığı hastalığının etmeni Erwinia amylovora Amerika, Avrupa ve Akdeniz ülkelerindeki armut ağaçlarında ve Rosaceae familyasındaki diğer bitkilerde ciddi bir hastalıktır (Zutra ve ark., 1986).
Yapılan survey ve tanılama testleriyle, Erwinia amylvora dünyanın farklı ülkelerinde ve farklı konukçularda tespit edilmiştir. Patojen bunlar arasında yumuşak çekirdekli meyve ağaçları, süs bitkileri ve bazı sert çekirdekli meyvelerin farklı türlerinde önemli zararlara sebep olmaktadır (Maden 1989; Shabi, 1989; LaRue ve Vincent, 1990; Psallidas, 1990; Shabi ve ark.,1990; Sletten, 1990; Grimm ve ark., 1991; Arsenjevic ve ark., 1991; Arsenijevic ve Panic, 1992; Lopez ve Fucikowsky, 1992; Tehabsam ve ark., 1992; Van der Zwet, 1992; Mazarei ve ark., 1994; Sobiczewski ve ark., 1997; Mohan ve Biffman 1999; Knapic ve ark., 2004; Behalova, 2004; Kazempour ve ark., 2006).
Ateş yanıklığı hastalığı Türkiye’de ilk olarak 1985 yılında Orta- Batı Anadolu Bölgesinde Afyon’un Sultandağı Đlçesindeki armut bahçelerinde görülmüş ve 1987 yılında Isparta ve Burdur’da yayıldığı bildirilmiştir ( Öktem ve Benlioğlu, 1988 ).
Bu tarihten sonra ülkemiz için yapılan survey çalışmalarıyla hastalığın tüm Türkiye’ye yayıldığı ve çoğu bölgemizde de önemli kayıplara neden olduğu belirlenmiştir (Çıtır, 1989; Demir ve Gündoğdu, 1992; Momol ve ark.,1992; Saygılı ve ark., 1998; Hepaksoy ve ark.,1998; Benlioğlu ve Özakman, 1998; Baştaş ve Katırcıoğlu, 1998).
Ateş yanıklığı hastalığı etmeni Erwinia amylovora’nı Türkiye’nin değişik bölgelerinden ve konukçularından 100’ün üzerinde örnek olarak toplanmış ve yapılan patojenisite testleri, biyokimyasal testler ve PCR (Polimerase Chain Reaction) analizleri sonucunda bunlardan 75 tane izolatın Erwinia amylovora olduğu tespit edilmiştir. Bu izoalatlardan 41 tanesini armut, 21 tanesini ayva, 9 tanesini elma, 2 tanesini ateş dikeni, 1 tanesini yeni dünya ve 1 tanesini de muşmula izolatı oluşturmaktadır. Armut çeşitlerinin içinde 35 tane Santa Maria armut çeşidi, 4 tane Williams armut çeşidi ve 2 tane de Ankara armudu çeşidi bulunmaktadır, bu da en hassas armut çeşidinin Santa Maria armut çeşidi olduğunu göstermektedir (Ünlü, 2002).
Amasya ilinde armutlarda Santa Maria ve Williams en hassasken bunları Mustafabey, Akça ve Ankara armutlarının takip ettiği belirlenmiştir. En dayanıklı armut çeşidinin ise Keklik olduğu belirlenmiştir. Araştırma bölgesinde yetiştirilen ayva çeşitlerinden Eşme ve Ekmek ayvası çeşitlerinin hastalığa karşı duyarlı oldukları tespit edilmiştir. Elma çeşitlerinden ise Golden Delicious ve Starking Delicious çeşitlerinin diğer eşitlerden daha dayanıklı oldukları ve bunları Misket çeşidinin takip ettiği tespit edilmiştir. Fakat yerel yazlık elma (Alyanak) ve Stark Earlist çeşitleri hastalığa çok duyarlı olarak bulunmuştur (Mirik, 2000).
Tokat ilinde yetiştiriciliği yapılan elma, armut ve ayva çeşitlerinin dayanıklılık ve hassasiyet durumları incelenmiştir. Armut çeşitlerinden Williams,
Santa Maria ve Akça en hassas çeşitler olurken, bunları Mustafabey ve Ankara çeşitleri takip etmiştir. En dayanıklı armut çeşidi olarak da Keiffer çeşidi tespit edilmiştir. Ayvalardan ise Eşme, Ekmek ve limon ayvası çeşitleri hastalığa karşı çok duyarlı olarak bulunmuştur. Tokat’ta da Golden Delicious ve Starking Delicious çeşitleri hastalığa dayanıklı olarak tespit edilmiş ve bunları Misket çeşidi takip etmiştir. Amasya’da olduğu gibi Tokat’ta da Yaz Elması ile Stark Earlist çeşitleri hastalığa en hassas elma çeşitleri olarak tespit edilmiştir (Mirik, 2000).
Bulgaristan’ın Plovdiv bölgesinde, Erwinia amylovora ayvada tespit edilmiş ve aynı simptomlar armut, elma ve muşmulada da bulunmuştur. Bu dört konukçunun karakterizasyonu, ortak bakteriyolojik metotlardan morfolojik, kültürel ve fizyolojik testler kullanılarak sağlanmıştır. Bu izolatların çoğu E. amylovora’ya spesifik PCR ve AFLP (Amplified Fragment Length Polymorphism) genom analizi gibi moleküler metotlarla da testlenmiştir (Bobev ve ark., 1998).
Erwinia amylovora’nın tanılanmasında 36 0C’de gelişim, üreaz oluşumu testi (Dye, 1968), indol üretimi testi (Dickey ve Kelman, 1988), jelatinin hidrolizi testi (Klement ve ark., 1990), KOH testi (Fahy ve Hayward, 1983), % 5 SNA’da gelişim, King B besiyerinde fluoresans pigment oluşumu, acetoin üretimi (Dye, 1968), oksidatif- fermentatif test (Ayers ve ark., 1919), sakarozdan indirgenen bileşikler (Klement ve ark., 1990), aesculin hidrolizi (Sneath, 1956; Schaad, 1988), sistinden H2S oluşumu (Klement ve ark., 1990), karbonhidratlardan asit üretimi, tütün
yaprağında aşırı duyarlılık reaksiyonu (Klement, 1963; Klement ve ark., 1990; Lelliott ve Stead, 1987; Mohan ve Schaad, 1987) gibi biyokimyasal testler esas alınmaktadır.
Elma sürgünleri ile yapılan patojenisite testlerinde, Erwinia amylovora’nın virülent strainlerinin ateş yanıklığı simptomu oluşturduğu, avirülent strainlerin ise, inokulasyon bölgelerinde küçük kahverengi lekeler oluşturduğu saptanmıştır. Hem virülent tip hem de avirülent tip bakteri doku içinde çoğalmıştır. Avirülent strainlerin inokulasyonundan 24 saat sonra çoğalması dururken virülent strainlerinin çoğalmaya devam ettiği görülmüştür. Ayrıca virülent ve avirülent E. amylovora, HR
(Hipersensitif Reaksiyon)’i teşvik etmektedir. Tütün yaprakları elektron mikroskobu ile incelendiğinde sitozim, mitokondri, kloroplast membranlarında yığınların oluştuğu saptanmıştır (Wei ve ark., 1992).
E. amylovora epifitik olarak yayılmaktadır. Epifitik E. amylovora yoğunluğu
ile enfeksiyon riski arasındaki korelasyon düşünülmüştür. Şimdiye kadar ateş yanıklığı riski bahçe çevresindeki klimatolojik ve fenolojik risk oluşumlarına bağlı uyarı sistemleri ile tahmin ediliyordu. Her iki faktörün de patojenin gelişimine etkili olduğu bilinir. Fakat gerçek patojen konsantrasyonunu ölçülmemiştir. Avrupa Birliği ülkelerinin bazılarında antibiyotik formulasyonların engelleyici uygulamalarına izin verilir. Bu da yoğun kimyasal uygulamasını engeller. Bu kimyasal uygulamalar ileride etkili epifitik patojen popülasyonunun ortaya çıkarılmasıyla azalacaktır. Çevredeki epifitik ateş yanıklığı popülasyonun hızlı bir şekilde tanılanması PCR’a dayalı metodlar ile mümkün olacaktır. Araştırmada meyve bahçesindeki çiçeklerdeki
E. amylovora popülasyonunu tayin etmeyi ve özel koşullardaki moleküler
tanımlamanın hassasiyetini göstermek için örnekleme stratejileri yapılmıştır (Crepel ve ark., 1998).
Elma ve armutta, çiçekte, yaprakta, sürgünde ve ham meyvede E.
amylovora’nın simptomsuz epifitik olarak uzun süre yaşadığı rapor edilmiştir. E. amylovora’nın küçük popülasyonlarını konvensiyonel teşhis metodları tespit edemez
ve bu sebeple hassas ve özel PCR’a dayalı metodlar geliştirilmiştir. Bu metod 187 bp’lik E. amylovora’ya özgü DNA’nın çoğaltılmasıyla geliştirilmiştir. 187 bp’lik ürün DNA’nın kullanımı veya bozulmamış bakterinin kalıp olarak bulunmasıdır. 10 konukçu türden ve 5 ayrı ülkedeki uluslar arası koleksiyondan 69 E. amylovora kültürü elde edilip primer kullanımı ile başarılı bir şekilde tanılanmıştır. Diğer 29
Erwinia türünden ve diğer 4 ayrı bakteri cinsinden PCR ürünleri amplifikasyonu
yapılmıştır. PCR esaslı bu metod bitki dokusundaki E. amylovora’yı tespit etmede kullanılmıştır (Guilford ve ark., 1996).
12 yıllık bir periyotta Đsrail’den E. amylovora’nın 205 strain’lik koleksiyonu izole edilmiştir. Strainler Đsrail’de armut, elma, yenidünya ve ayva yetiştiriciliği
yapılan değişik yerlerden toplanmıştır. Değişik konukçularda virülenslik oluşturma dereceleri, serolojik ve moleküler karakterlerle karakterize edilmiştir. Çiçeklenmiş armut ve elma dallarında ve armut ağaçlarında patojenisite testleri yürütülmüştür. Çeşitli ırklar arasında dal ve çiçek yanıklığı şiddeti bakımından önemli farklılıklar görülmemiştir. ELISA ve immunofluoresens denemelerde Đsrail strainleri arasında serotipik grup gözlenmemiştir. Genomik çeşitlilik 24 rastgele 10 bazlık primerler kullanılarak RAPD (Random amplified polymorphic DNA) analizleriyle yapılmıştır. Test edilen tüm strainler (45’i Đsrail, 11 tanesi Mısır, Kıbrıs ve Yunanistan) kullanılan primerler bakımından aynı RAPD bantları göstermiştir (Manulis ve ark., 1998).
Kuzey Amerika ve Yeni Zelanda’da meyve yetiştiriciliği yapılan bölgelerden değişik konukçulardan izole edilen E. amylovora’nın 189 straini iki PCR tekniği ile genetik parmakizleri saptanmıştır. Bunlar rep-PCR (Repetitive element PCR) ve PCR ribotyping’tir. Sonuçta meyve ağaçlarından izole edilen E. amylovora strainleri genetik olarak homojendir ve Rubus türlerinden elde edilen strainlerden basit ve hızlı bir PCR tekniği ile ayırt edilebilir (McManus ve Jones, 1994).
Değişik coğrafik alanlardan ve farklı konukçu bitkilerden elde edilen E.
amylovora’nın 16 straini arasındaki genetik çeşitlilik RAPD analizleriyle
araştırılmıştır. Bu çalışma sonucunda E. amylovora strainleri arasındaki genetik çeşitlilik RAPD analizleriyle gösterilmiş, RAPD fragmentlerinin moleküler ve istatistik analizleri kullanılarak strainler arasındaki farklılık ve benzerlik tespit edilebilmiştir ( Momol ve ark., 1997 ).
Erwinia amylovora birçok metodla kesin olarak tespit edilebilmektedir. Buna
rağmen teşhis protokolleri moleküler biyolojideki yeni avantajlar sunarak fitobakteriyologlara göre modifiye edilir. Ateş yanıklığı salgınından bu yana, izole edilen E. amylovora ırklarının tanımlanmasında ve ayırt edilmesinde polimeraz zincir reaksiyonu (PCR), hızlı ve güvenilir bir yaklaşımdır. E. amylovora’nın karakterizasyonu için özellikle 3 teknik kullanılır. Bu teknikler: pEA29 PCR, ribotyping, REP PCR (Brown ve ark., 1998 ).
Kore’deki Asya armutlarının (Pyrus pyrifoliai) nekrotik dallarından ateş yanıklığını andıran simptomlar gözlemlenmiştir. Bu nekrotik dallardan izole edilen bakteri ile bir seri mikrobiyolojik, patolojik ve moleküler denemeler yapılmıştır. Bu denemelerin bazılarında Kore’de Asya armutlarından izole edilen Enterobacter
pyrinus’dan farklılık E. amylovora patojenine de benzerlik göstermiştir. Genellikle
yarı seçici besiyeri olan MM2 Cu agar ortamındaki koloni morfolojisi E. amylovora
gibi mukoid fakat sadece sarıdır. Yeni Asya patojeni armut dilimlerinde ooze üretmiş ve armut fidanlarında nekrotik simptomlar oluşturmuştur. pEA29 plazmidinden elde edilen primerler veya E. amylovora’nın ams bölgesinden yapılan PCR analizleri bu patojen için negatif olmuştur. Her iki patojen arasında farklılık 16s/23s rRNA bölgeleri kullanılarak bulunmuştur. PFGE (Pulsed-Field Gel Electrophoresis) analizleri ile E. amylovora’dan faklı olduğu tamamen ortaya konmuştur. Đki set primer E. amylovora için çalışmamış sadece bu yeni patojenin tahmininde kullanılabilir ve Pyrus pyrifolia konukçusuna bağlı olarak Erwinia pyrifolia diye isimlendirilmiştir (Kim ve ark., 1998).
Avustralya’dan elde edilen Cotoneaster spp. izolatlarıyla, Đngiltere ve Yeni Zelanda’dan elde edilen Pyrus communis, Malus spp., Crateagus monogyna ve
Cotoneaster melanacarpus izolatları moleküler düzeyde incelemiş ve PCR’ da Ea 71
primerleri ile 187 bp’lik bant oluşumu gözlenmiştir. AP-PCR (Arbitrarily Primed PCR) ve RAPD ile Cotoneaster’den elde edilen DNA’ların Erwinia amylovora’ya has bantlar oluşturduğunu saptanmıştır (Taylor ve Hale, 1998).
21 ülkeden 13 konukçudan toplanılan ateş yanıklığı izolatlarının fenotipik, biyokimyasal ve genetik olarak karakterizasyonu yapılmışıtr. Fenotipik ve genetik analizlerde gram testler, Crosse-Goodman besiyerinde koloni tanılanması ve pEA29 plazmidinin PCR analizleri yapılmıştır ( Brown ve ark., 1996).
Ateş yanıklığı patojeni, E. amylovora’nın tespiti ve tanılanması PCR çalışmalarıyla 6 saatten az sürede yapılmıştır. Etmenin hücrelerinde bulunan 29 kb’lik plazmidden elde edilen iki oligomerle, 0.9 kb’lik fragment kullanıldığında
100’ün üzerinde E. amylovora hücresinde gözlenebilir bant ortaya çıkmıştır (Bereswill ve ark., 1992).
Ateş yanıklığı etmeni Erwinia amylovora’nın hücrelerinde bulunan 29 kb’lik pEA29 plazmidinden elde edilen Erwinia amylvora A ve Erwinia amylovora B primerleri kullanılarak 900 kb ile 1100 kb arasında tek bant oluşumu gözlemlenmiştir (Lecomte ve ark., 1997).
Momol ve arkadaşları (1998) yaptıkları çalışmada 29 kb’lik pEA29 plazmidinden elde edilen iki olgonükleotidi kullanarak 1 kb’da tek bant oluşumunu gözlemlemişlerdir.
3. MATERYAL ve METOT 3.1. Materyal
3.1.1. Bitki materyali
Konya iline bağlı 6 ilçeden ateş yanıklığı hastalığı belirtisi taşıyan 101 adet elma (Malus communis), 43 adet armut (Pyrus communis), 21 adet ayva (Cydonia
vulgaris), 5 adet alıç (Crateagus sp.), 3 adet ateş dikeni (Pyracantha sp.), 3 adet dağ
muşmulası (C. salicifolius), 1 adet yayılıcı dağ muşmulası (C. horizantalis ), 2 adet gül (Rosa sp.), 1 adet muşmula (Mespilus sp.) ve 33 adet süs elması (Malus
floribunda) olmak üzere toplam 213 adet örnek toplanmıştır (Çizelge 3.1.1.1).
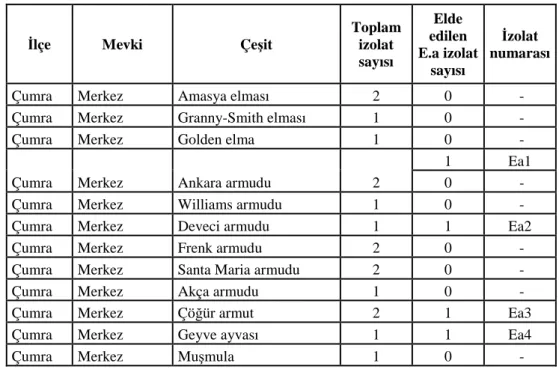
Çizelge 3.1.1.1. Konya ilinde, Rosaceae familyası bitkilerinden toplanan örnekler
ĐLÇE MEVKĐĐ CĐNSĐ ÇEŞĐDĐ ADET
Çumra Merkez Elma Amasya Elması 2 Granny-Smith Elması 1 Golden Elma 1 Merkez Armut Ankara Armudu 2 Williams Armudu 1 Deveci Armudu 1 Frenk Armudu 2
Santa Maria Armudu 2
Akça Armut 1
Çöğür Armut 2
Merkez Ayva Geyve Ayvası 1
Merkez Muşmula Muşmula 1
Đçeri Çumra Elma
Golden Elma 2 Starking Elma 1 Gala Elması 1 Jonathan Elması 1 Jarsay-mac Elması 1 Alman Elması 2 Breaburn Elması 1 Red Chief Elması 1 Gaziosmanpaşa Elması 1 Alyanak Elması 1
Đçeri Çumra Armut
Çöğür Armut 1
Ankara Armudu 2
Çizelge 3.1.1.1. (devam)
ĐLÇE MEVKĐĐ CĐNSĐ ÇEŞĐDĐ ADET
Ereğli
Karaburun
Elma
Sarı Đngiliz Elması 5 Granny-Smith Elması 1
Golden Elma 1
Starking Elma 1
Armut Williams Armudu 1
Ayva Ekmek Ayvası 4
Merkez Elma
Starking Elma 1
Mondial Gala Elması 2
Fuji Elması 2 Jarsay-mac Elması 3 Summer-red Elması 2 Zengen Armut Commice Armudu 1 Concorde Armudu 1 Abbate Armudu 1 Conference Armudu 1 Karatay Elmalı Mahallesi Armut
Ankara Armudu 1
Santa Maria Armudu 3
Frenk Armudu 1 Meram Alakova Elma Starking Elma 2 Golden Elma 2 Granny-Smith Elması 2
Armut Ankara Armudu 1
Ayva Ekmek Ayvası 1
Hatunsaray Elma Amasya Elması 3 Starking Elma 4 Golden Elma 4 Granny-Smith Elması 2 Cevaal Elması 1
Altın Çekirdek Elması 1
Güz Elması 1 Armut Ankara Armudu 3 Williams Armudu 1 Çakıl Armut 2 Güz armudu 1
Ayva Ekmek Ayvası 6
Eşme Ayvası 1
Alıç Alıç 3
Havzan Süs Elması Süs Elması 10 Karahüyük Elma
Amasya Elması 1
Tavşanbaşı elma 1
Ayva Ekmek Ayvası 2
Çizelge 3.1.1.1. (devam)
ĐLÇE MEVKĐ CĐNSĐ ÇEŞĐDĐ ADET
Meram Yaylapınar
Elma Starking Elma 1
Golden Elma 1
Süs Elması Süs Elması 5 Armut
Santa Maria Armudu 2
Ankara Armudu 1
Frenk Armudu 1
Ayva Ekmek Ayvası 1
Meram Yenibahçe Elma
Starking Elma 1
Golden Elma 2
Jonathan Elması 1 Alyanak Elması 1
Ayva Ekmek Ayvası 1
Sarayönü Başhüyük Elma Golden Elma 1 Granny-Smith Elması 1 Gala Elması 2 Pinova Elması 2 Breaburn Elması 1
Büyükzengi Elma Golden Elma 1
Değirmenli Elma
Starking Elma 1
Sarı Đngiliz Elması 1
Ayva Ekmek Ayvası 2
Ladik Elma Amasya Elması 2 Starking Elma 1 Golden Elma 2 Granny-Smith Elması 2 Altın Çekirdek Elması 2 Jarsay-mac Elması 1 Armut Ankara Armudu 2 Dağ Armudu 1 Yaz Armudu 1 Gül Gül 1 Merkez Elma Starking Elma 1 Golden Elma 2
Altın Çekirdek Elması 2 Sarı Đngiliz Elması 1
Cevaal Elması 1
Breaburn Elması 1 Ambassy Elması 2 Top Red Elması 1
Armut Ankara Armudu 1
Ayva Ekmek Ayvası 1
Ateş Dikeni Ateş Dikeni 1
Gül Gül 1
Çizelge 3.1.1.1. (devam)
ĐLÇE MEVKĐ CĐNSĐ ÇEŞĐDĐ ADET
Selçuklu
Esenler Süs Elması Süs Elması 5 Erenköy
Elma Starking Elma 2
Armut Commice Armudu 1
Ayva Ekmek Ayvası 1
Kampus
Ateş Dikeni Ateş Dikeni 2 Cotoneaster C. horizantalis 1 Cotoneaster C.salicifolius 3
Aydınlık Evler Alıç Alıç 2
Metehan Sokak Süs Elması Süs Elması 4
Otogar Süs Elması Süs Elması 8
TOPLAM 213
3.2. Metot
3.2.1. Patojenin izolasyonu
3.2.1.1 Örneklerin laboratuara getirilmesi
Konya ilinin 6 ilçesinden ve farklı konukçularından ateş yanıklığı belirtisi gösteren ağaçlardan hastalıklı sürgünler hastalık simptomunun bittiği kahverengi dokunun 15 cm altından ve 10 cm üzerinden kesilerek etiketli polietilen torbalara konularak paketlenmiş ve serin yerde muhafaza edilmiştir. Kesim işleriminde kullanılan makaslar her defasında % 1’lik Na-hipoklorit veya % 70’lik etil alkol ile sterilize edilmiştir. Örneklerin izoalsyonu en geç bir hafta içerisinde yapılmış ve bu süre içerisinde + 4 0C’de saklanmıştır (Vantomme ve ark., 1981).
3.2.1.2. Erwinia amylovora’nın izolasyonu
Bitki örnekleri öncelikli olarak üzerindeki çamur ve tozlardan arındırmak için akan musluk suyunda iyice yıkanmıştır. Daha sonra %1’ lik sodyum hipokloritte 1 dakika tutulmuştur ve 3 seri steril saf sudan geçirildikten sonra laminar kabinde, steril bir bistüri yardımıyla birkaç mm boyunda parçalara ayrılmıştır. Bu küçük parçalar içerisinde 10 ml steril saf su veya steril % 6’lık peptonlu su içerisine atılarak 30 dakika bekletilmiştir. Örnekler 10-3- 10-6 oranlarında seyreltilerek steril öze yardımı ile Nutrient Agar (NA), Sakkaroz Nütrient Agar (SNA) ve King B besiyerlerine çizgi ekim yapılmıştır. Ekim yapılan besiyerleri 23-250C’de inkübe
edilmişlerdir. SNA besiyerinde tipik levan şeklinde oluşan kolonilerden saflaştırma yapılmıştır (Saygılı, 1995).
Besiyerleri ve içerikleri aşağıda verilmiştir;
Nutrient Agar (NA)
gr/L • Beef extrakt 1 • Yeast ektrakt 2 • Bakteriyolojik pepton 5 • NaCl 5 • Agar 15 pH=7,2 King B gr/L • Proteose peptone 20,0 • K2HPO4.3H2O 1,5 • MgSO4.7H2O 1,5 • Agar 15,0 • Glyserol 10 • Destile su 1 pH=7.2 (King ve ark., 1954)
Sakaroz Nutrient Agar
gr/100 ml
• Nutrient broth 0.8
• Agar 1,5
• Sakkaroz 5 pH = 7.0
3.2.2. Patojenin tanısı 3.2.2.1. Koloni morfolojisi
Đzolasyonu yapılan hastalıklı bitki örneklerinden elde edilen bakteriyel süspansiyonlar 0.1 ml NA ve King B besiyerleri üzerine ekimleri yapılmış 23-25ºC’de 48-72 saat inkübe edildikten sonra tek koloni gelişimi incelenmek üzere % 5 SNA besiyerine çizgi ekim yapılmış, koloni gelişimleri değerlendirilmiştir.
3.2.2.2. Biyokimyasal testler
Ateş yanıklığı etmeni Erwinia amylovora’nın biyokimyasal testleri Fahy ve Parsley (1983), Lelliot ve Stead (1987), Schaad ve ark. (2001)’e göre tespit edilmiş olan testlere göre yapılmış olup bu testler; 36 0C’de gelişim, üreaz oluşumu testi (Dye, 1968), indol üretimi testi (Dickey ve Kelman, 1988), jelatinin hidrolizi testi (Klement ve ark., 1990), KOH testi (Fahy ve Hayward, 1983), % 5 SNA’da gelişim, King B besiyerinde fluoresans pigment oluşumu, acetoin üretimi (Dye, 1968), oksidatif- fermentatif test (Ayers ve ark., 1919), sakkarozdan indirgenen bileşikler (Klement ve ark., 1990), esculin hidrolizi (Sneath, 1956; Schaad, 1988), sistinden H2S oluşumu (Klement ve ark., 1990), karbonhidratlardan asit üretimi, tütün
yaprağında aşırı duyarlılık reaksiyonu (Klement, 1963; Klement ve ark., 1990; Lelliott ve Stead, 1987; Mohan ve ark., 1987) yapılarak elde edilen fitopatojen bakterilerin biyokimyasal özellikleri belirlenmiştir. Aynı koşullarda her bir test 3 kez tekrarlanmıştır. Bu testlere Erwinia amylovora’nın göstermiş olduğu reaksiyonlar çizelge 3.2.2.2.1’de verilmiştir.
Çizelge 3.2.2.2.1 Erwinia amylovora tanısı için yapılan biyokimyasal testler
Test Erwinia amylovora
Tütünde aşırı duyarlılık +
Ham armut testi +
360C'de gelişim - Üreaz oluşumu - Đndol üretimi - Jelatinin hidrolizi + KOH testi + %5 SNA'da gelişim +
King B besiyerinde Fluoresans pigment oluşumu -
Acetoin üretimi +
Oksidatif fermentatif test +
Sakkarozdan indirgenen bileşikler +
Aesculin hidrolizi -
Cystein'den H2S oluşumu -
Karbonhidratlardan asit üretimi :
• Maltose - • Nişasta - • Đnulin - • Glycerol - • Mannitol - • Sorbitol +
+ : Pozitif sonuç , - : Negatif sonuç
3.2.2.2.1. 360C’de gelişim
Nütrient Agar besiyerine bakterinin çizgi ekimi yapılmış 360C’de 3 gün inkübe edilmiştir. Besiyeri üzerinde bakteri gelişimi oluşmuşsa pozitif olarak, oluşmamışsa negatif olarak değerlendirilmiştir.
3.2.2.2.2. Gram reaksiyon testi
% 3’lük KOH çözeltisinden bir lam üzerine 1 veya 2 damla konulmuş, bakteri izolatlarının her biri öze ile alınarak bu çözelti içerisinde 5-10 saniye karıştırıldıktan sonra, öze yukarı doğru yükseltilmiştir. Eğer KOH viskoz bir hal almış ve uzamış ise bu sonuç pozitif bir reaksiyon olarak kabul edilmiştir. Gram (-) bakterilerde bu
özellik görülürken gram (+) bakterilerde ise, bunun tersi durumda çökelme söz konusudur (Fahy ve Hayward, 1983).
3.2.2.2.3. Üreaz oluşumu testi
Test için önerilen besiyeri
g/L • NH4H2PO4 0,5 • K2HPO4 0,5 • MgSO4.7H20 0,2 • NaCl 5 • Yeast extract 1 • Crezol kırmızısı 0,016 • Destile su 800 ml pH: 6,3
Yukarıda belirtilen kimyasallar tartılarak bir erlen içine konmuş ve sterilize edilerek 550C’ye ayarlı su banyosuna konmuştur. Her bir tüpe 5’er ml besiyerinden konmuştur. Diğer taraftan; % 10’luk urea solusyonu steril filtreden geçirilmiş ve son konsantrasyon % 2 olacak şekilde 200 ml’ye tamamlanmıştır. Đçerisinde besiyeri olan tüperlin üzerine 5’er ml ilave edilmiştir. Ortamda yeast extract olduğundan, tüpler üreli ve üresiz olmak üzere iki gruba ayrılmış ve üzerine izolatlar aşılanmıştır. Tüpler 270C’de 7 gün inkübe edilmiştir. Sonuçta, üre amonyağa dönüşürse, pH değeri alkali yönde değiştiğinden pozitif reaksiyon olarak değerlendirilmiştir (Dye, 1968).
3.2.2.2.4. Đndol üretimi testi
Test için g/L
• Tryptone 10 g
• Yeast etract 5 g
Kovac’s ayıracı : 5 g dimethyl aminobenzaldehyde 75 ml amil alkolde
50-550C’ye ayarlı su banyosuna konularak yavaş yavaş eritilmiştir. Soğuduktan sonra üzerine 25 ml HCl ilave edilmiştir.
Besiyeri hazırlanıp tüplere 5’er ml konmuş ve 1200C’de 15 dakika steril edilmiştir. Steril edilen besiyerine bakteri aşılanmış ve 270C’de çalkalayıcıya konulmuştur. Aşılama yapıldıktan 2-5 gün sonra, 1 ml’lik bakteri örnekleri üzerine hazırlanan kovacs ayıracı ilave edilerek testlenmiştir. Đndol, ayıraçta bulunan amil alkol ile ekstrakte edilmiş ve ayıraçla reaksiyona girerek 15 dakikada kiraz kırmızısı bir renk alırsa, reaksiyon pozitif, kırmızı renk almazsa reaksiyon negatif olarak değerlendirilmiştir (Dickey ve Kelman, 1988).
3.2.2.2.5. Jelatinin hidrolizi testi
Test için; g/L • Peptone 5.0 • Beef extract 3.0 • Gelatin 120 • Distile su 1000 ml
kimyasallar yukarıda verilen şekilde tartılmış ve 1000 ml distile su içerisinde çözüldükten sonra 500C’de su banyosunda eritilmiştir. Daha sonra bu çözeltiden, 5 ml tüplere konmuş ve 1210C’de otoklavda 15 dakika sterilize edilmiştir. Tüplere bakteri öze ile aşılandıktan sonra 200C’de 7-14 gün inkübe edilmiştir. Kontroller yapılmadan önce tüpler 30 dakika süreyle +40C’de buzdolabında bekletildikten sonra tüplerdeki jelatinin akıcı halde olması pozitif reaksiyon, jelatinin katı halde olması ise negatif reaksiyon olarak değerlendirilmiştir (Klement ve ark., 1990).
3.2.2.2.6. % 5 SNA’da gelişim
Bakteriyel izolatları
• Sakkaroz 5g
• Nutrient agar 2 g
• Destile su 100 ml
yukarıda içeriği verilen besiyeri üzeine çizgi ekimleri yapılmış ve 23-25 ºC’de 5 gün inkübe edilmiştir. Levan sucrase enziminin sakkarozu kullanması sonucu oluşan konveks, mukoid koloniler pozitif, konveks ve mukoid yapıda olmayan koloniler ise negatif olarak belirlenmiştir (Klement ve ark., 1990; Lelliot ve Stead, 1987).
3.2.2.2.7. King B besiyerinde Flouresan pigment oluşumu
SNA ortamında 24 saatte geliştirilen bakteri izolatları King B besi ortamına çizildikten sonra inkübatörde 23-250C’ de 2 gün bekletilerek, UV (Ultra viyole) translimünatör altında karanlık odada kontrol edilmiştir. Yeşil fluoresan pigment oluşturanlar pozitif, diğerleri ise negatif olarak değerlendirilmiştir.
King B besi ortamı;
• Proteose pepton 20 g • K2HPO4 1.5 g • MgSO4.7H20 1.5 g • Agar 15 g • Gliserol 10 ml • Distile su 1000 ml litre pH : 7.2 olarak ayarlanmıştır.
3.2.2.2.8. Acetoin üretimi Bu test için; g/L • Glikoz 5.0 • NH4H2PO4 0,5 • K2HPO4 0.2 • MgSO4.7H20 0.2 • NaCl 5.0 • Yeast extract 5.0 • Distile su 1000 ml
hazırlanan besiyeri deney tüplerine konularak otoklavda steril edilmiştir. Daha sonra bu tüplere aşılanan bakteriler 270 C’de 2-5 gün süreyle inkübe edilmiştir. Burada gelişen bakteriler Voges-Prokauer ve Metil kırmızısı testlerinde kullanılmıştır.
Voges- Prokauer testi, bakteri kültüründen alınan 1 ml örnek bir tüpe konularak 0.6 ml napthol ve 0.2 ml %40’lık KOH (Potasyum hidroksit)çözeltisi ile 2 saat karıştırılıp renk oluşumu gözlenmiştir. Erwinia amylovora için pembe renk oluşumu pozitif reaksiyon olarak değerlendirilmiştir.
Metil kırmızısı testinde ise, 0.1 g methyl kırmızısı 300 ml % 95’lik etil alkolde çözündükten sonra üzerine 200 ml saf su eklenmiştir. Bu karışımdan birkaç damla, 5 günlük bakteri kültüründen ilave edilmiştir. pH değeri 4.2 veya daha düşük ise kırmızı rek oluşmuştur. Bu sonuçta metil kırmızısı pozitif reaksiyon olarak değerlendirilmiştir (Dye, 1968).
3.2.2.2.9. Oksidatif- Fermentatif test Bu test için g/L • Pepton 1.0 • NH4H2PO4 1.0 • KCl 0.2 • MgSO4.7H20 0.2 • Bromthymolblue 0.08 • Agar 3.0 • Distile su 900 ml pH: 7.0-7.1’e ayarlanmıştır.
yukarıdaki kimyasallarla besiyeri hazırlanmış ve su banyosunda eritilerek tüplere 4.5 ml dökülmüş ve otoklavda sterilize edilmiştir.
% 10 oranındaki glikoz için, 100 ml saf suya 10 g glikoz tartılmış ve bakteri filtresinden geçirilmiştir. Bu filtreden, 0.5 ml alınmış ve su banyosundaki 4.5 ml’lik esas ortam üzerine dökülmüş ve iyice karıştırılıp donması sağlanmıştır. Besi yerinin rengi, zeytin yeşili renktedir. Her bakteri için iki tüp alınmış ve bakteriler aşılanmıştır. Bu tüplerden birinin üzerine 2-3 ml steril parafin konmuştur.
14 gün boyunca kontrol edilmiştir ve besi yerinin rengi sarıya dönmüşse, pH değeri 6.0’a düşmüştür. Glikozdan üretilen asit ortaya çıkmıştır. Oksidatif reaksiyonda, yalnızca aerobik koşullarda, açık tüplerin üst kısmında aist üretilmiştir. Fermentatif reaksiyonda ise, hem aerobik hem de anaerobik koşullarda asit üretilmiştir. Açık ve kapalı tüplerin diplerinde asit üretimi görülmüştür. Gaz üretimi ise kapalı tüpün içindeki besi yerinin bozulmasıyla veya yarı geçirgen ortamın çatlamasıyla ortaya çıkmıştır. Đnokule edilen tüplerde pH değişikliğine bakılırken, kontrol tüpleriyle karşılaştırılmıştır (Ayers ve ark., 1919).
3.2.2.2.10. Sakkarozdan indirgenen bileşikler Benedict ayıracı Solusyon A: Sodyum sitrat 173 g Na2CO3 100 g Distile su 850 ml Solusyon B: CuSO4 18 g Distile su 150 g
Solusyon B yavaşça solusyon A’nın içine karıştırılarak benedict ayıracı elde edilmiştir.
Sakarozdan indirgenen maddeler için besiyeri
g/L • Sakaroz 40.0
• Pepton 10.0
• Beef extract 5.0
• Distile su 1000 ml
Hazırlanmış ve 5’ er ml tüplere konduktan sonra steril edilmiştir. Daha sonra tüplere bakteri aşılanmış ve tüplerin üzerine 5’er ml benedict ayıracı konularak hafifçe çalkalandıktan sonra kaynar su içerisinde 10 dakika tutulmuştur. Tüp içerisinde sarımsı renk oluşturan bakteriler pozitif olarak değerlendirilmiştir (Klement ve ark., 1990).
3.2.2.2.11. Esculin hidrolizi
Esculin hidrolizini belirlemek için aşağıda verilen besiyeri hazırlanmıştır. g/L • Yeast extract 5.0 • NaCl 5.0 • MgSO4.7H2O 0.2 • K2HPO4 0.5 • NH4H2PO4 0.5
• Ferric ammonium citrate 50 mg
• Esculin 1.0
pH: 6.8
Yukarıda verilen besiyerinin pH’ı 6.8’e ayarlanmış ve otoklavda sterilize edilmiştir. Tüplere 5 er ml dağıtılan besiyeri üzerine bakteri ekimi yapıldıktan sonra 28 0C’de çalkalayıcıda 28 gün bekletilmiştir. Besi yeri kahverengi-siyah arası renk alanlar pozitif olarak değerlendirilmiştir (Sneath, 1956; Schaad, 1988).
3.2.2.2.12. Sistein’den H2S üretimi Bu test için g/L • NH4H2PO4 0.5 • K2HPO4 0.5 • MgSO4.7H2O 0.2 • Yeast extract 0.2 • Cystein hydrocloride 0.1 • Distile su 1000 ml
şeklinde hazırlanarak tüplere konulmuş ve steril edilmiştir. % 5’lik kurşun asetata batırılmış kurutma kağıtları da steril edilmiştir. Steril tüpler içindeki ortama bakteri aşılandıktan sonra kurşun asetatlı kağıtlarda renk değişimi olup olmadığı 14
gün boyunca gözlenmiştir. Eğer renk siyahlaşıyorsa reaksiyon pozitif, siyahlaşmıyorsa negatif olarak değerlendirilmiştir (Klement ve ark., 1990).
3.2.2.2.13. Karbonhidratlardan asit üretimi
Test için önerilen besiyeri
g/L • NH4H2PO4 1,0 • KCl 0,2 • MgSO4.7H2O 0,2 • Bromthymolbleu 0,08 • Agar 12,0 • Damıtık su 900 ml pH: 7,0
yukarıdaki şekilde hazırlanmış, tüplere 4.5 ml konulmuştur. Daha sonra otoklavda 1200C’de 15 dakika sterilize edilmiştir.
Testte kullanılacak karbonhidratlardan (maltose, nişasta, inulin, glycerol, sorbitol, mannitol) 10 g tartılmış ve 100 ml su içerisinde eritilmiş ve filtrasyonla sterilize edilmiştir. Sterilize edilen karbonhidratlardan 0.5 ml eklenmiş ve eğik agar olarak korunmuştur. Karbonhidratların oranı sonuç olarak % 1’lik bir kısmı oluşturmuştur.
Bu şekilde hazırlanan tüplere, bakteri aşılanmış ve 24-270C’de inkübe edilmiştir. Eğer asit oluşmuşsa, tüplerde renk değişimi olmuş (sarıya dönüşmüş) ve bu değişim pozitif olarak değerlendirilmiştir (Ayers ve ark., 1919).
3.2.2.3. Patojenisite testi
3.2.2.3.1. Ham armut testi
Ham armutlar % 10’luk sodyum hipoklorit ile 4 dakika yüzey sterilizasyonuna tabi tutulmuştur. Steril kabinde 7-8 mm kalınlıkta dilimler halinde kesilen ham armutlar steril nemli petri kaplarına yerleştirilmiştir. Bu dilimlerin üzerine SNA’ da geliştirilen 108 hücre/ml yoğunluğundaki bakteri izolatları steril iğne ile bulaştırılarak 270 C’de inkübe edilmiştir. Ooze (bakteriyel eksudat) oluşturan izolatlar kaydedilmiştir (Van der Zwet, 1986).
3.2.2.3.2. Armut fidanlarının sürgünlerine inokulasyon
Elde edilen bütün Erwinia amylovora izolatları % 5 SNA içeren besiyerinde 24-48 saat 27 °C’ ye ayarlı inkübatörde geliştirilmiştir. 108 hücre/ml yoğunlukta bakteriyel süspansiyon hazırlanmıştır. Hazırlanan bu süspansiyondan Santa Maria armut çeşidinin armut sürgünlerine enjekte edilmiş ve 270C’de inkübasyona bırakılmıştır. Kontrol olarak ise armut sürgünlerine H2O enjekte edilmiştir. Armut
sürgünlerinde önce koyu kahverengi daha sonra ise siyah renkte sürgün yanıklığı şeklinde simptom oluşturanlar değerlendirilmiştir (Aldwinckle ve Preczaewski, 1976). Ayrıca hazırlanan bu bakteriyel süspansiyondan ateş dikeni bitkisine de inokulasyon yapılmış ve çoban değneği belirtisi oluşturup oluşturmamasına göre değerlendirilmiştir.
3.2.2.4. Tütünde hipersensitif reaksiyon testi
Elde edilen bütün Erwinia amylovora izolatları % 5 SNA içeren besiyerinde 24-48 saat 27 °C’ ye ayarlı inkübatörde geliştirilmiştir. 108 hücre/ml yoğunlukta bakteriyel süspansiyon hazırlanmıştır. Süspansiyonlar steril enjektörlerle tütün (Nicotiana tabacum L. White Burley ) yapraklarının alt kısmından damar aralarına enjekte edilmiştir. Đnokule edilen bitkiler en az 8 saat, ışıklı bir ortamda muhafaza edilerek inokluasyonun yapıldığı kısımda nekroz oluşup oluşmadığı tespit edilmiştir.
Ölü doku oluşumu pozitif, oluşmaması ise negatif olarak değerlendirilmiştir (Klement ve ark., 1966; Lelliot ve Stead, 1987).
3.2.2.5. Moleküler tanılama
Elde edilen ve Erwinia amylovora olduğu biyokimyasal testlerle belirlenen izolatların PCR metodu kullanılarak moleküler tanılamaları yapılmıştır.
3.2.2.5.1. DNA izolasyonu
PCR çalışmalarında bakterinin direkt hücresiyle çalışılabilmekteyken bakterinin DNA’sı da izole edilerek çalışılabilmektedir. Çalışmamızda Erwinia
amylovora bakterisinin DNA’sı izole edilmiştir (Llop ve ark., 1999). Đzolasyon
protokolü aşağıda verilmiştir.
1. 1,5 ml’lik mikrofüj tüpüne 1 ml sıvı nütrient broth’da 270C’de 24 saat çalkalanmış bakteri kültürü konulmuştur.
2. 13.000 devir/dak.’da 5 dakika santrifüj yapılarak pellet oluşturulmuş ve üstteki sıvı kısım atılmıştır.
3. 500 µl ekstraksiyon solüsyonu eklenmiş ve 1 saat oda sıcaklığında çalkalanmıştır.
4. Tüpler 5000 devir/dak.’da 5 dakika santrifüj edilmiştir.
5. Üstteki sıvı kısımdan 450 µl alınarak yeni bir tüpe konulmuştur. 6. Yeni tüplerin üzerine 450 µl isopropanol ilave edilerek birkaç kez ters
düz edilir ve 1 saat oda sıcaklığında bekletilmiştir. 7. 13.000 devir/ dak.’da 5 dakika santrifüj edilmiştir.
8. Üstteki sıvı kısım atılır ve oda sıcaklığında kurumaya bırakılmıştır. 9. Kuruyan pellet 200 µl deiyonize su içerisinde çözüldükten sonra
tüpler karışıtırılmıştır.