ÇOCUKLUK ÇAĞI PNÖMOKOK
ENFEKSİYONLARINDA PENİSİLİN DİRENCİ
Dr.Ali GÜNEŞ
(
UZMANLIK TEZİ)
TEZ YÖNETİCİSİ
Prof. Dr. M Ali TAŞ
DİYARBAKIR-2008
T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ ÇOCUK SAĞLIĞI VE HASTALIKLARI
İÇİNDEKİLER KISALTMALAR I TABLOLAR II RESİMLER III ÖNSÖZ 1 GİRİŞ ve AMAÇ 2 GENEL BİLGİLER 4 TARİHÇE 4
MORFOLOJİ VE BOYANMA ÖZELLİKLERİ 5
KÜLTÜR ÖZELLİKLERİ 6
PNÖMOKOKLARIN MOLEKULER YAPITASLARI 10
PNÖMOKOK ANTİJENLERİ 11
PNÖMOKOK TOKSİNLERİ 13
PATOJENİTE ve HASTALANDIRICILIK ÖZELLİKLERİ 14
KONAĞIN ÖZGUN SAVUNMA MEKANİZMALARI 16
EPİDEMİYOLOJİ 18
PNÖMOKOK ENFEKSİYONLARINDA PENİSİLİN DİRENÇ DURUMU 21
ANTİBİYOTİK DUYARLILIĞI VE MEKANİZMASI 27
PNÖMOKOK ENFEKSİYONLARI 33
PNÖMOKOK ENFEKSİYONLARINDA LABORATUVAR BULGULARI 34
PNÖMOKOK ENFEKSİYONLARINDA TANI 35
PNÖMOKOK ENFEKSİYONLARININ TEDAVİSİ 37
PNÖMOKOK ENFEKSİYONLARINDA KORUNMA 40
MATERYAL VE METOD 43 BULGULAR 44 TARTIŞMA VE SONUÇ 48 ÖZET 55
KISALTMALAR
PDP: Penisilin dirençli pnömokok
ODPD: Orta düzey penisilin direnci YDPD: Yüksek düzey penisilin direnci
MIC: Minimal İnhibitör Konsantrasyon
SSS: Spesifik Solubl Substans
PBP : Penisilin Bağlayıcı Protein
CRP : C reaktif protein
PFGE: Pulsed Field Gel Electrophoresis
RFLP: Restriction Fragment Lenght Polymorphism
BOS: Beyin omurilik sıvısı
CDC: Centers for Disease Control and Prevention
TABLOLAR
Sayfa
Tablo -1: Türkiye'de pnomokoklarda penisilin direncinin belirlenmesine
yönelik çalışmalar 26
Tablo -2: PBP tipleri ve molekül ağırlıkları 30
Tablo -3: Menenjit dışı pnömokok infeksiyonlarında MIC değerlerine göre antibiotik tedavisi 39
Tablo- 4: Pnömokok aşı şeması 41 Tablo-5: Penisiline MIC değerleri 46
ŞEKİLLER
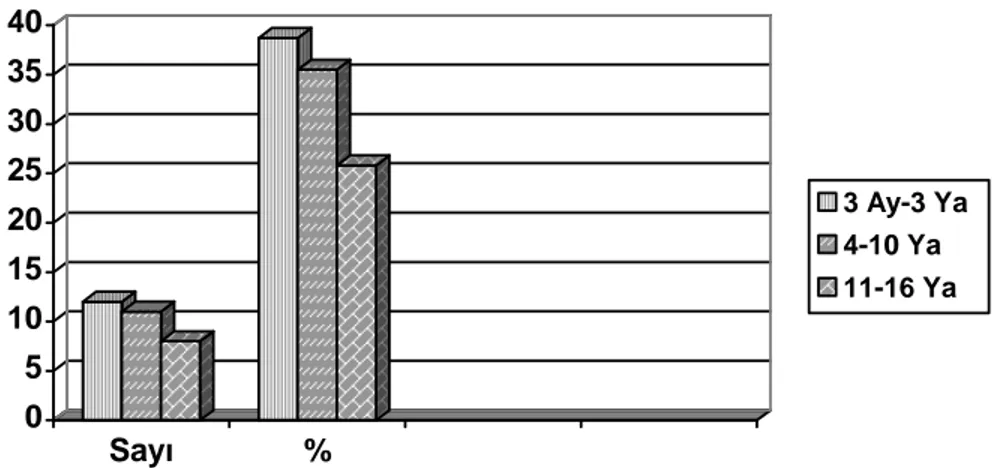
Şekil -1:Hastaların cinsiyet dağılımları ve yüzdes i 44Şekil -2: Hastaların yaş aralığı 44
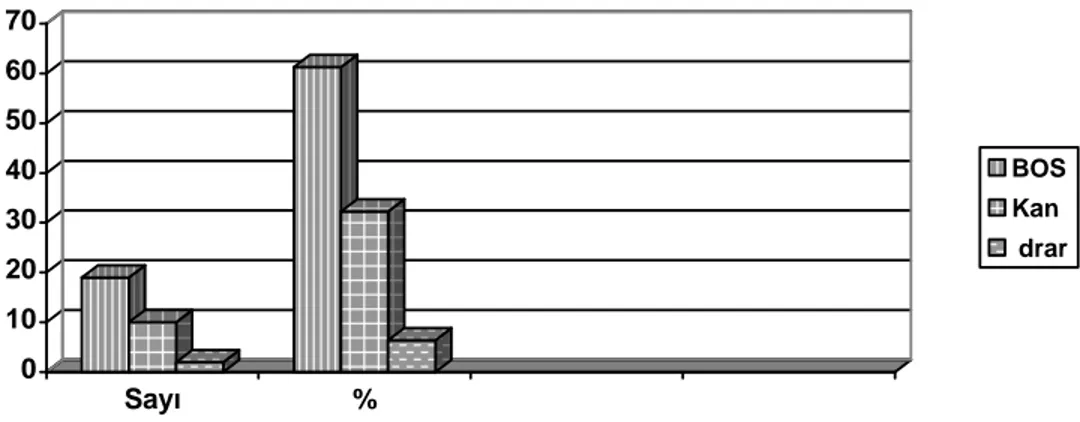
Şekil -3: Örneklerin alındığı vücut sıvıları 45
Şekil-4:Hastalardaki altta yatan nedenler 45
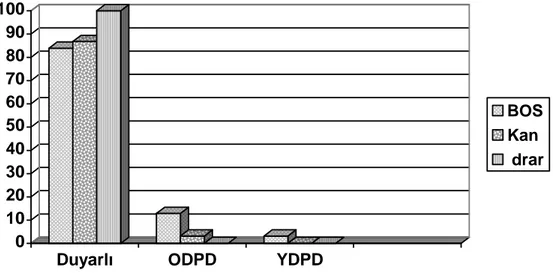
Şekil -5: Penisiline direnç durumu 46
RESİMLER
Sayfa
Resim -1: Gram boyamada görülen diplokoklar 5 Resim -2: Optokine duyarlılık 8
Resim-3: Safrada çözünürlülük 9
ÖNSÖZ
Streptokoklar çocukluk çağında pnömoni, menenjit, bakteriyemi, üst solunum yolu enfeksiyonu, deri ve yumuşak doku enfeksiyonu ve endokardit gibi oldukça geniş bir hastalık grubunun etiyolojisinde rol almaktadır. 1967 yılına kadar pnömokok enfeksiyonlarında penisilin rahatlıkla ampirik olarak kullanıyordu. 1967 yılında dirençli kökenlerin bildirilmesinden sonra penisilin ciddi te rapötik problemlere neden olmuştur. Ülkemizde çocuklarda tüm bölgeleri gösteren direnç paternleri ile ilgili çalışmaların azlığı nedeniyle Çocuk sağlığı ve Hastalıkları Kliniğine başvuran çocuk hastalardan izole edilen Streptococcus pneumoniae kökenlerinde ki penisilin direncini tayin etmek için bu çalışmayı planladık. Çocuklarda ciddi morbidite ve mortalite nedeni olan S. pneumoniae için antibiyotik direnç oranlarının bilinmesi gereklidir. Bölgemizde çocuklarda bu konuda yapılmış geniş kapsamlı bir çalışma yoktur. S. pneumoniae için direnç durumlarının bilinmesi ampirik tedavide yol gösterici olacaktır.
Uzmanlık eğitimim süresince yetişmemde büyük katkıları olan Anabilim Dalı Başkanımız ve tez danışmanım olan Saygıdeğer Hocam Prof. Dr. Mehmet Ali Taş’a, Değerli Hocalarım Prof. Dr Kenan Haspolat , Prof. Dr Celal Devecioğlu, Prof. Dr Fuat Gürkan, Prof. Dr Aydın Ece, Prof. Dr Murat Söker, Doç. Dr. Mehmet Boşnak, Doç. Dr Bünyamin Dikici, Doç. Dr. Mehmet Kervancıoğlu, Yrd. Doç. Dr Selahattin Katar, Yrd. Doç. Dr Sultan Ecer, Yrd. Doç. Dr M Nuri Özbek, Yrd. Doç. Dr Ayfer Gözü, Yrd Doç. Dr Fatma Çelik, Uzm Dr Mustafa Taşkesen ve numunelerin toplanmasında yardımlarını esirgemeyen Uzm Dr Ekrem Yaşar‘ a teşekkürü bir borç bilirim. Ayrıca çalışmalarım sırasında katkı ve yardımlarını esirgemeyen tüm doktor arkadaşlarıma, klinik hemşire ve çalışanlarına ve Enfeksiyon Hastalıkları Kliniği çalışanlarına, asistanlığım süresi boyunca bana destek olan eşime, aileme ve çocuklarıma teşekkürlerimi sunarım.
Dr. Ali GÜNEŞ Diyarbakır-2008
GİRİŞ VE AMAÇ
Antibiyotik öncesi zamanlarda Streptococcus pneumoniae menenjit, sepsis, pnömoni ve akut otitis media (AOM) ba şta olmak üzere çok sayıda enfeksiyonun etkeniydi. Antibiyotiklerin kullanıma girmesiyle Streptococcus pneumoniae' nın oluşturduğu enfeksiyonların tedavisinde belirgin bir iyileşme sağlanmış tır(1).
Streptococcus pneumoniae suşlarının yıllarca penisiline duyarlı kalması ve yan etkilerinin az olması nedeniyle penisilin ampirik olarak yayg ın biçimde kullanılmıştır. 1960’lı yılların sonlarından itibaren dirençli suşlar ortaya çıkmış ve antibiyotik kullanımıyla Streptococcus pneumoniae'da penisilin direnci bugünkü dramatik boyuta ulaşmıştır(2).
Streptococcus pneumoniae'da penisilin direnci dünyada düzensiz bir dağılım göstermesine karşın her bölgede rastlanmakta ve giderek artmaktad ır(3). Günümüzde en yüksek direnç oranları Güney Afrika, Macaristan ve İspanya’dan bildirilmektedir. Ülkemizde yapılan araştırmalarda da direnç oranı genellikle yüksek olarak saptanmıştır(4-12)
Pnömokok direncinin ortaya çıkışı, etkeni olduğu enfeksiyonların tedavisinde uygulanan ampirik tedavilerin sorgulanmasına yol açmıştır. Özellikle dirençli suşların neden olduğu menenjitlerin tedavisinde penisilinin başarısız oluşu yeni tedavi biçimlerinin aranmasını gündeme getirmiştir.
Antibiyotiklere direnç oranı bölgesel farklılıklar gösterdiğinden pnömokok enfeksiyonlarında her ülkenin tedavi yöntemi, direnç konusunda yapılan bölgesel araştırmalara dayanmaktadır. Ülkemizde özellikle çocukluk yaş grubunda henüz pnömokok enfeksiyonlarının tedavisine ışık tutacak oranda geniş araştırmalar yapılmamıştır.
Streptococcus pneumoniae doğumdan kısa bir süre sonra çocukların nazofarenksine yerleşmekte ve bunların bir kısmı enfeksiyon hastalıklarına yol açmaktadır(13). Streptococcus pneumoniae çocuklarda görülen enfeksiyonların en önemli etkenlerinden biri olduğundan ve penisilinin ise çocuklarda yaygın olarak kullanılmasından dolayı direnç sorunu, çocukları ve çocuk hekimlerini özellikle ilgilendirmektedir(14).
Penisiline duyarlılığı azalmış Streptococcus pneumoniae su şlarının diğer antibiyotik gruplarına da direnç göstermesi bu mikroorganizman ın etken olduğu enfeksiyonların tedavisini giderek zorlaştırmaktadır. Bu durum yeni tedavi seçeneklerinin geliştirilmesini ve direnç gelişiminin ve yayılmasının önlenmesi konusunda önlem alınmasını gerekli kılmaktadır(15).
Pnömokok direncinin giderek artması nedeniyle hastalardan izole edilen bütün suşlarının antibiyotiklere duyarlılık düzeyinin saptanması ve antibiyograma göre tedavi verilmesi önerilmektedir. Uygun antibiyotik kullanımının direnç gelişimini azaltabileceği öne sürülmektedir. Bu nedenle her ülkenin kendi antibiyotik direnç durumunu bilmesi ve tedavi seçeneklerini bu bilgilere göre yönlendirmesi gerekmektedir.
Bu çalışmanın amacı, çocuklarda ciddi mortalite ve morbidite nedeni olan S. Pneumoniae’nın bölgesel bir referans hastanesi olarak 3. basamak sağlık hizmeti veren kliniğimize yatarak kültürlerinde pnö mokok saptanan hastalarda penisilin direncini saptamak ve ona yönelik tedavi planları oluşturmaktır.
GENEL BİLGİLER
TARİHÇE
Streptococcus pneumoniae 1881 yı lında Fransa'da Pasteur ve ABD'de Sternberg tarafından saptanmıştır. Kısa bir süre sonra ise Fraenkel ve Weichselbaum lober pnömoni ile ilgisini göstermiş, ardından otitis media, menenjit ve artrit etkeni olabileceği gösterilmistir. Bu dönemde lober pnömoninin başlıca etkeni olarak görüldüğünden bakteri için pneumococcus terimi kullanılmış, 1974 yılında Streptococcus pneumoniae olarak yeniden adland ırılmıştır(16).
Felix ve Georg Klemperer'in 1890'ların başlarında öl ü pnömokoklarla bağışıklanmış hayvanların sonraki pnömokok enfeksiyonuna karşı koruma sağladığını ve bağışık hayvanlardan alına n serum ile bu bağışıklığın başkalarına aktarılabildiğini göstermesi bugün humoral immunite olarak adlandırılan bağışıklık tipinin temelini oluşturmuştur(16) .
Pnömokokların bulunması ve diğer özelliklerinin saptanması ile ilgili tarihsel gelişimi aşağıda gösterilmiştir(17).
Pnömokokların ilk kez Pasteur ve Stenberg tarafından bulunması 1881 Frenkbel ve Welchselbaum'un pnömokok -pnömoni ilişkisini saptamaları 1887 Felix ve Klemperer tarafından pnömokok pasif bağışıklığının bulunmas ı 1890 Dochoz ve Gillespie'nm pnömokoklara ait serotipleri belirlemeleri 1913 Heidelberger ve Avery'mn pnömokok immunitesiyle ilgili çalışmaları 1920 Felton'un kapsüler polisakkaritleri ilk kez saf olarak hazırl aması 1925 A very, Mc.Leod ve Mc.Carrty tarafından transformasyonun keşfi 1944
Hansman'ın ilk PDP'leri belirlemesi 1967
Appelbaum ve arkadaşları tarafından ilk kez PDP'lerin bulunması 1977 ABD'de 14 ve 23 Valent Pnomokok polisakkarit aşılarının lisans alması 1977-83 Zighelboim ve arkadaşları tarafından ilk kez PBP'lerin bulunması 1980 Protein konjuge edilmiş pnömokok polisakkarit aşıları ile ilgili çalışmalar 1990
MORFOLOJİ VE BOYANMA ÖZELLİKLERİ
Pnömokoklar lanset ya da mum alevi şeklinde görünümleri olan, 0.5 -1.5 mm büyüklüğünde, sporsuz ve hareketsiz gram pozitif koklardır. Genellikle diplokoklar halinde görülür, ancak hem büyüklüklerinde hem de görünümlerinde farklılıklar bulunabilmektedir. Balgam, apse materyali, seröz sıvılar ve vücut dokularında kısa zincirler ve nadiren tek tek koklar halinde bulunurlar. Özellikle düşük magnezyum konsantrasyonlu ve içerisinde tipe özgü antikorlar bulunan besiyerlerinde üretilmeleri, pnömokokların zincir oluşturma özelliğini artırmaktadır(18). Organizmadan yeni ayrıldıkları zaman tipe özgül, dar ya da geniş bir kapsül bulundururlar. Kapsül oluşumu kan, serum, haben gibi proteinli besiyerlerindeki pasajlarda devam ederse de, diğer besiyerlerinde kısa sürede kaybolur. Kapsüller çoğu kez homolog serumlar kullan ılarak suretiyle yapılan ve kapsül yapısının daha iyi belirlenebildiği kapsül şişme reaksiyonu sonrasında boyanarak gösterilebilir(19).
Pnömokoklar bakteriyolojik boyalarla kolaylıkla boyanabilir ve Gram pozitiftirler. Fakat eskimiş kültürlerinde çoğu Gram negatif olarak görülürler. Sıvı besiyerinde üretilen kültürler uzun süre etüvde kalacak olursa otolitik enzimler nedeniyle önce canlı bakteri sayısında bir azalma meydana gelir, sonra da kültürün berraklaştığı görülür. Otoliz, safra tuzları ve sodyum deoksikolat gibi yüzeyi etkileyici maddeler tarafından stimule edilir.( 16,18)
KÜLTÜR ÖZELLİKLERİ
Pnömokoklar, fakültatif anaerob bakterilerdir. Adi besiyerlerinde üremeleri çoğu kez zordur ve üreyebilmeleri için kompleks besiyerlerine ihtiyaç duyarlar. Yarı sentetik besiyerlerinin çoğu jelâtin, kazein hidrozilat, vitaminler, değişik katkı maddeleri ve aminoasitleri içerir. Pürin ve pirimidin ilavesi ile üreme belirgin olarak artırılabilir. % 10 serum yada kan ilave edilmiş besiyerlerinde kolaylıkla ürerler. Serumlu buyyonda homojen bula nıklık yaparak çoğalırlar ve asit ortamda dibe çökme eğilimi gösterirler. Serum içeren katı besiyerleri yüzeyinde 37°C’de 24-36 saatlik inkübasyonun ardından yuvarlak, küçük, parlak, hafif konveks, 0.5–1.5 mm çapında koloniler meydana getirirler(18). Kapsüllü pnömokoklar virulandır ve daha mukoid koloniler olan V kolonileri (S: Smooth = düzgün) oluştururlar. Pnömokoklar kapsüllerini kaybettiğinde düzgün olmayan Luanullu R kolonileri de (R: Rough = pürtüklü) oluştururlar. Kanlı agarda alfa hemoliz meydana getirirler ve kolonile rin çevresinde tamamlanmamış bir hemoliz zonu oluştururlar. Hemoglobinin parçalanması sonucu yeşil renkte oluşan bu hemolizden sorumlu olan madde alfa hemolizindir ve bütün pnömokoklar tarafından salgılanır (16,18).
Pnömokoklar için optimal üreme ısısı 37° C ve optimal pH 7.4-7.8'dir. Isının 25-42°C arasında ve pH'nın da 6.9-8.8 arasında bulunduğu koşullarda üreyebilirler (16). Katalaz oluşturmadıkları için kültürlerin uzun süreli inkubasyonunda , ortamda hidrojen peroksit birikimi olur ve buna bağlı olarak bakteriler sitolize uğrarlar. Katı besiyerinde ilk üremelerinde % 5-10 karbondioksitli ortama gereksinim duyarlar. Bakteriyel antagonizma nedeniyle, diğer alfa hemolitik streptokoklarla birlikt e aynı ortamda bulunduğunda, pnömokokların büyüme limiti sınırlanır ve üremeleri güçleşir. Anaerob ortamda üretildiklerinde kolonilerin çevresinde oksijene dayanıksız pnömolizin O'dan dolayı bir hemoliz zonu meydana gelir ( 18).
Genellikle karbonhidratları çok miktarda laktik asit ile az miktarda vilatil asit ve etil alkol oluşturmak suretiyle fermente ederler. İnulinin dışındaki şekerler üzerine olan etkilerinin bu bakterilerin tanısında herhangi bir önemi yoktur.
Pnömokoklar üretilmiş oldukları kültür ortamında değişiklik gösterebilen bakterilerdir. Bu değişiklikler:
S-R form değişiklikleri : Katı besiyerinde üreyen pnömokoklar kapsüllü, düzgün S koloniler oluştururlar. Homolog anti serumlu besiyerlerinde ise kapsülsüz, kaba ve granüllü R kolonileri oluştururlar. R kolonili buyyon kültürlerin farelere inokulasyonu sonrasında R formundaki koloniler, S formuna dönüşebilirler. S formundaki pnömokoklar virulan, R formundaki pnömokoklar ise çoğunlukla avirulandır. Pnömokokların tipe özgül yapıları kapsüllere ve bu kapsülde bulunan polisakkarit yapısındaki "Spesifik Solubl Substati s" (SSS) maddesine bağlıdır (19). Kapsüllerini kaybeden pnömokoklar tip özelliklerini de kaybetmiş olurlar. Pnömokok enfeksiyonu esnasında organizmada anti SSS antikorla rı meydana gelir. Hastalığın ileri günlerinde bu antikorlar karşısında organizmada kapsülsüz ve R kolonisi yapan pnömokokların baskın hale geldiği saptanmıştır. R formuna geçen pnömokoklar, sık hayvan pasajları yapılarak yada üreme ortamına anti-R bağışık serumu eklenerek güç de olsa S formuna dönüşebilirler (17).
Transformasyon: Pnömokoklarda görülen bir diğer değişiklik transformasyondur. Transformasyon, belli bir tipten olup da kaps üllerini kaybederek R şekline geçen pnömokokların, başka bir tip pnömokok DNA’sı içeren besiyerlerinde üretilmesi sonucu S formunu alarak DNA' nın ait olduğu tipe dönüşmesidir (16,17).
Bunun dışında pnömokoklarda nadiren bakteriyofajlar aracılığı ile gerçekleşen serotip değişikliği (transdüksiyonu) ve antibiyotiklere direnç gelişimi de bildirilmektedir(17).
Kültür ortamında pnömokoklar diğer hemolitik streptokoklarla benzer kolo ni yapıları gösterirler.
Pnömokokların diğer hemolitik streptokoklardan ay ıran bazı özellikler vardır. Bunlar:
İnülini fermante etme özellikle ri: Pnömokokların hemolitik streptokoklardan ayrımında kullanılır. Pnömokoklar inülini fermante ettikleri halde; S.salivarins ve S.sanguis dışında diğer alfa hemolitik streptokoklar in ülini fermante edemezler. Bununla birlikte, bazı pnömokok kökenlerinin inüline etki göstermedikleri belirlendiğinden, bu test son zamanlarda değerini kaybetmiştir (17).
Optokin (Ethyl Hydrocuprein Hydrochloride) duyarlılık testi : Pnömokoklar, bir kinin derivesi olan optokinin düşük konsantrasyonlarında (1/500.000) üreyemedikleri halde, hemolitik streptokoklar daha y üksek konsantrasyonlarda (1/4000) üreyebilirler. Son yıllarda optokine dirençli pnömokokların görülmesi, ayırıcı tanıda safrada erime deneyinin de yapılması gerekliliğini ortaya çıkarmıştır (19)
Resim 2: Optokine duyarlılık
Safra ve safra tuzlarında otolize olma özelliği: Sıvı besi yerlerinde üreyen pnömokok kültürlerine % 10–20 oranında sığır veya tavşan safrası ilave edildiğinde, pnömokoklarda otoliz görüldüğü halde, diğer hemolitik streptokoklarda otoliz görülmez (2,17). Pnömokokların safrada otolize olma nedenleri, Otolizin olarak adlandırılan ve peptidoglikanı eritebilen enzimler üretmeleri ve bu enzimlerin de safra ile karşılaşmaları sonrasında aktive olabilmelerinden kaynaklanmaktadır. Safra, birçok suşun otolizinlerini aktive ederek pnömokok suşlarını süratle eritir (17). Günümüzde, safra yerine çoğunlukla safra tuzlan kullanılmaktadır. Bunun nedeni kolay hazırlanabilmeleri ve sterilize edilebilmelerinden kaynaklanmaktadır. Safra tuzlarının % 1'lik konsantrasyonları, en uygun kimyasal yapıyı teşkil etmeleri nedeniyle tercih edilmektedir ( 18). Isı ile öldürülmüş olan pnömokoklar safrada erimezler (16).
Safrada erime deneyi, pnömokokların identifikasyo nları açısından son derece önemli bir tanı yöntemidir. Öyle ki, yakın zamanlara kadar safra ile karşılaştırılmalarının ardından erimeyen suşlar pnömokok olarak adlandırılmazlardı. Ancak DNA probe test ile bazı safraya dirençli pnömokok izolatlarının tespit edilmiş olması "Atipik pnömokok" kavramının ortaya atılmasına neden olmuştur. Böyle atipik pnömokok suşları safrada erimezler. Bunun, otolizinlerin aktive olmaması veya safra nedeniyle inhibisyona uğramalarından kaynaklanabileceği düşünülmektedir. Bu suşların menenjit gibi invaziv hastalıklardan daha sık sorumlu tutulmaları nedeniyle, klinik önemleri giderek artmaktadır (17).
Resim-3: Safrada çözünürlülük
Pnömokokları diğer streptokoklardan ayıran özelliklerinden birisi de hayvanlara olan etkileridir. Laboratuar hayvanlarının pnömokoklara olan duyarlılıkları değişiktir. Fare ve tavşan çok duyarlı; kobay daha az duyarlı ; köpek, kedi, güvercin ve tavuk ise dirençlidir. İntratrakeal inokülasyonlarla maymunlarda lober pnömoni oluşturulabilir. Fare ve tavşanlarda çabuk ilerleyen fatal bir septisemi gelişir ve bu hayvanlarda bronkopnömonik tipte bir akciğer enfeksiyonu oluşur. Pnömokok enjekte edilmiş fareler sepsis sebebiyle 48 saat içinde öldükleri halde, diğer hemolitik streptokokların enjeksiyonu böyle bir duruma neden olmamaktadır.(18,19).
Sonuç olarak rutin mikrobiyoloji laboratuarlarında pnömokokların tanımlanabilmeleri için şu dört reaksiyona bakmak yeterlidir (16):
1- Kanlı agarda alfa hemoliz oluşturmaları 2- Katalaz negatifliği
3- Optokin duyarlılığı
4- Safrada erimesi
PNÖMOKOKLARIN MOLEKÜLER YAPITAŞLARI
Hücre duvarı: Gram pozitif bakterilerin tipik hücre duvarı yapıtaşları olan teikoik asil ve peptidoglikan, pnömokoklarda da hücre duvarının baskın elamanlarıdır. (20,21). N-asetil müramik asit ve N-asetil glikozaminin ardı ardına sıralanmasından meydana gelen peptidoglikan yapı , pnömokoklarda bakteri hücre duvarının geniş bir bölümünü meydana getir ir. Bu örgü, hücrenin iskeletini oluşturur ve antijenik yapıdan sorumludur. Bakteriyi osmotik güçlere karşı korur. Bu işlevin yerine getirilmesi yan bağlarla örülü şeker zincirleri aracılığı ile meydana gelmektedir. Hücre duvarı bütünlüğünü sağlayan bağlar karboksi ve transpeptidaz gibi enzimlerle lineer ve çaprazlama bağlanan çok sayıda şeker ve peptid zincirlerinden oluşmaktadır (21,22) .
Resim 4 : Pnömokoklarda hücre duvar yapısı(20)
Pnömokoklardaki D-Alanil D-Alanin peptidazlar (D.D peptidazlar), substrat analog olan B laktam antibiyotiklere kovalan olarak bağlanırlar. Bundan dolayı 'Penisilin Bağlayıcı Protein (PBP) adını alırlar. Yüksek molekül ağırlıklı PBP'ler
(>60 kDa) daha öncelikli antibiyotik hedeflerini oluşturmaktadır. PBP 1 ve PBP 2 yüksek molekül ağırlıklı olup penisilin afinitesinden asıl sorumlu olan esansiyel proteinlerdir. PBP 1 fonksiyonel olarak aralarında değişkenlik gösteren 1a ve 1BM alt tiplerine ayrılmaktadır. PBP 2 ise 2a, 2b, 2x olmak üzere üç proteinden meydana gelmektedir. PBP 3'ün molekül ağırlığı diğer PBP'ler içerisinde en düşük olanıdır(23). PBP'lerin her biri ayrı bir genetik determinantın ürünüdür. Penisilin direnci açısından bakıldığında, yüksek düzey dirençli pnömokok suşları için en az dört ayrı PBP determinant değişikliği gerekmektedir (24).
Bazı enzimler de çapraz bağlı peptidoglikanı hidrolize etmekte ve bunların tümüne 'otolizinler' ya da 'peptidoglikan hidrolazlar' ismi verilmektedir. Transglikozilazlar ve transpeptidazlar gibi otolizinler, genell ikle hücre membranıyla ilintili ve görevleri yeni peptidoglikan birimlerinin mevcut örgüye sokulması olan enzimlerdir (22).
Teikoik asit, hücre duvar yapısında bulunan, gliserol ya da ribitolün tekrarlayan birimlerinden oluşan ve fosforilkolin içeren bir korbohidrat polimeridir. Peptidoglikana, hücre duvarının en dış yüzeyinde kovalan olarak bağlanır ve kapsülün içine doğru uzanan fragmanları ile birlikte C polisakkaridi meydana getirir. Bu bölge inflamatuvar süreçlerde ortaya çıkan akut faz reaktanları ya da ‘C reaktif proteinler' denen proteinlerle reaksiyondan sorumlu olan bölgedir (21).
PNÖMOKOK ANTİJENLERİ
Pnömokoklarda kapsül ve somatik antijen olmak üzere başlıca iki tip antijen vardır. Bunlar:
Kapsül antijenleri: Pnömokok kapsül polisakkaridleri dall anan veya dallanmayan 5–6 karbonlu monosakkaridlerin oluşturduğu yüksek molekül ağırlıklı (500.000–2.000.000 dalton) polimerlerdir. Hücre yüzeyinde hidrofilik jeller oluştur (21,25).
Kapsül bakteriyi fagositoza karşı koruduğundan virulans üzerine etkili ol ur. Nitekim serumlarında kapsül polisakkarid (SSS maddesi) antikoru bulunan kimseler, o tip pnömokok enfeksiyonuna karşı dayanıklılık göstermektedirler (26,27).
Kapsül antijenlerinin klinik önemi birkaç biçimde ortaya konulabilir:
Sadece kapsüllü suşlar insanlar ve duyarlı laboratuar hayvanları için patojenik olup aktif ya da pasif immünizasyon ile enfeksiyona karşı koruma sağlar.
Hayvanlara tip 3 pnömokok kapsül polisakkarid yapısını bozan bir enzim uygulanması, enfeksiyona karşı koruyucu bir özellik oluşturmaktadır.
Daha az miktarda kapsüle sahip tip 3 varyantlar, matür kapsüllü tip 3 suşlardan daha az, kapsülsüz pnömokoklardan daha fazla virulandır(28). Kapsül aynı zamanda fagositozdan kurtulmada temel rol oynamaktadır.
Kapsül polisakkaridlerindeki antijenik farklılıklara göre 80 pnömokok serotipi belirlenmiştir (29,30). Pnömokoklar serolojik olarak üç şekilde tiplendirilmektedir (20);
1- Kapsül şişme reaksiyonu,
2- Tipe özgül anti serumlarla aglütinasyon
3- Tipe özgül anti serumlarla SSS'nin presipitasyonudur.
Tavşanların bağışıklanması ile serotipe özgün aglütinasyonu sağlayan antikorların açığa çıktığı ve kapsülün belirgin hale geldiği gösterilmiştir. Buna "quellung" (şişme) reaksiyonu denir. Amerikan numaralama sisteminde, serotiple r tanımlanma sırasına göre sıralanmıştır. Daha çok kabul gören Danimarka numaralama sistemi ise serotipleri antijenik benzerliklerine göre gruplamaktadır(21).
Belli serotipe sahip pnömokoklar sıklıkla penisiline daha fazla diren ç göstermektedir. Özellikle 6,14,19,23 en çok karşılaşılan tiplerdir. Bu durum, çoğu penisilin dirençli suşa karşı koruma sağlayan aşıların üretimi açısından önem taşımaktadır.
Somatik antijenler: Üç tür somatik antijenleri vardır. Bunlar:
C antijeni: Hücre duvarının asıl elemanı türe özel bir karbohidrat olan polisakkarid C dir. Teikoik asit polimeri olan C antijeni kolin, trideoksidiaminohegsoz, galaktoz, ribitol, glikoz ve fosfat yapısındadır. Organizma onunla birleştiğinde presipitasyona yol açan C reaktif protein (CRP) ismi verilen bir madde oluşturur. Bu protein 110.000 dalton ağılığında ve β globulin yapısında bir pentamerdir. CRP ve C maddesince oluşturulan kompleksler kompleman aktive etmektedir (20,28).
M antijeni: Tipe özgül bir protein antijeni olan M proteini, S. pyogen es'in M proteini için aynı yapısal özellikte olmakla birlikte, immünolojik olarak farklı etkiye sahiptir (27). Pnömokokların M proteinine karşı gelişen anti-M protein antikorları, fagositozu inhibe edemezler. Bundan dolayı koruyucu özellikleri bulunmamaktadır (20).
F antijenleri: Pnömokokların diğer bir somatik antijeni de, Forsman antijenleri ile benzerlik gösteren lipoteikoik asit yapısındaki F antijenleridir (20).
PNÖMOKOK TOKSİNLERİ
Pnömokoklar, virülan etkilerini oluşturan ve konak doku enfeksiyonlarında önemli rol oynayan çeşitli toksinler üretmektedirler. Bunlar: pnomolizin O, noraminidaz, ve kolin bağlayıcı proteinlerdir.
Pnömolizin O: Tüm pnömokok serotipleri "tiyol" ile aktive olan pn ömolizin isimli bu toksini üretmektedirler. Konak hücre membranında kolesterole tutunup delikler (por) oluşturur ve hücrelerin parçalanmasına yol açar. Pnömolizin fagositik ve epiteliyal hücreler için silotoksiktir. IgG'nin Fc kısmına bağlanarak yaptığı kompleman aktivasyonu yan ında TNF-a, interlokin-1 üretimini de indükleyerek inflamasyona neden olur (21). Halen bilinmeyen kimi mekanizmalarla bakteriyemiyi indüklediğine inanılmaktadır (31). Tavşan ve farelerde deri ve iç organlarda hemorajilere yol açar ve bu nedenle "purpura oluşturucu faktör" adıyla da anılır. Bu maddenin ağır pnömokok sepsislerinde görülen purpurik döküntülerden sorumlu olduğu düşünülmektedir. Ayrıca pnömokokların salgıladığı noraminidaz enziminin aktivasyonunu artırarak hastalandırıcılık özelliklerini etkilediği kabul edilmektedir. Pnömolizin O oksijene duyarlıdır ve anaerop koşullardaki β Hemolizden sorumludur(20,27).
Nöraminidaz: Bu enzim, mükoz membran yüzeyinde bulunan sialik asidi parçalar ve bakterinin tutunduğu GlcNAc-Gal molekülünü açığa çıkararak bakteri aderansına ve kolonizasyona neden olur (21). İki tip noraminidaz vardır. Bunlardan biri pnömokokun nazofarenks epiteline tutunmasına sağlar. Diğeri ise serumda bulunan komplemanı aktive eden pnömokok yüzey proteinlerini örterek kompleman aktivasyonunu engeller (25). Farelerin noraminidaz ile bağışıklanması, parenteral pnömokok uygulanması sonucu gelişen enfeksiyona karşı orta düzey bir koruma
sağlar. Yani bu durum, nöraminidazın virulansa katkısı olduğunu, fakat bakteri kolonizasyonu açısından ise fazla bir etkisi nin olmadığını ifade etmektedir (21).
Kolin Bağlayıcı Proteinler: Pnömokokların hücre duvarında kolin ile nonkovalan bağlarla bağlanmış çeşitli proteinler bulunmaktadır. Bu kolin bağlayıcı proteinler (KBP) topluluğu birkaç önemli molekülü içermektedir. Bunlar koruyucu bir protein olan PspA, ana, adozin, CbpA ve otolitik bir enzim olan LytA'dir ( 31).
PspA hemen hemen tüm pnömokokların yüzeyinde bulunmaktadır (25). PspA'ya karşı oluşan antikorların deney hayvanların, aynı veya farklı pnömokok suşu ile enfeksiyona karşı koruduğu saptanmış ve pspA'dan yoksun genetik mutantların farelere karşı daha az virulan oldukları gösterilmiştir ( 21).
Kolin bağlayıcı protein A (CbpA), insan hücrelerine adezyonda ve kolonizasyonda rol alan salgısal IgA' ya ve komplemanın C3 fraksiyonuna bağla nan, ancak komplemanın ayrımına neden olmayan proteinlerdir.
Lyt A (otolizin) bakteri hücre duvarını yapısal proteinlerin yapışma bölgesinden ayıran ve hücre duvarının yeniden biçimlendirilmesinde görev alan enzimlerdir. Otolizinden yoksun bakterilerin den ey hayvanlarında daha az virulan oldukları ve antikor üretiminin kısmen koruyucu olduğu gösterilmiştir (21).
Pnömokok yüzey adezin A (PsaA) bir yüzey permeazi olan PsaA t üm pnömokoklarda bulunmakta ve çalışmaları halen devam eden konjuge prot ein aşılarda bu toksinlerden yararlanılmaktadır (25).
PATOJENİTE VE HASTALANDIRICILIK ÖZELLİKLERİ
Pnömokokların patojenitesinden sorumlu ilk basamak kolonizasyondur. Çoğu kez kolinize olan ve patojen özellikler göstermeyen bakteriler, immün sistemin baskılandığı durumlarda inflamasyon, kompleman aktivasyonu ve fagositik aktivitelerini artırarak hastalıklara yol açabilirler.
Pnömokoklarla kolonizasyon ilk günlerde belirmeye başlar. 4 günlük -18 aylık çocuklarda ilk nazofaringeal kolonizasyon ortaya çıkar. Pnömokoklar bakteriyel yüzey adezinleri (Psp A ve kolin bağlayıcı proteinler) ve epiteliyal hücre reseptörlerin düzgün etkileşimleri sonucu farengeal hücrelere yapışırlar.
Pnömokok konağın fagositik hücrelerince sindirilme ve öldürülme süreçlerinden kaçabildiğinden hastalık oluşturabilmektedir. Esas patojenik etki konak dokularda çoğalma ve yoğun inflamatuvar cevap oluşması ile gerçekleşmektedir.
Fagositozdan kurtulmada as ıl rolü kapsül oynamaktadır ve bu üç temel mekanizma ile oluşmaktadır (21). İlki kompleman komponentlerini konak fagositlerinin kompleman reseptörlerinden ayıran fiziksel bir bariyer olmasıdır. Kapsül, pnömokokun yüzey proteinlerini ve kapsülün altına yerleşen C3b fraksiyonunu dolaşımdaki antikorlardan saklamaktadır. İkincisi fagositik hücreler üzerinde kapsül polisakkaridini tanıyacak reseptörlerin bulunmamasıdır. Üçüncüsü ise kapsülün fagositlerle bakteri arasıdaki elektrostatik itmeden sorumlu olmasıdır (21,25,32).
Bakterinin hücre duvarı inflamasyonun güçlü bir indükleyicisidir. Bakteriyel lizis esnasında açığa çıkan hücre duvarı partiküllerinin oldukça inflamatuvar olduğu bildirilmiştir. Teikoik asit içeren bakteriler inflamasyonu olduk ça güçlü indüklerler. Peptidoglikandan yoksun teikoik asitin ise inflamasyonu daha az tetiklediği, basınç değişiklikleri oluşturmaksızın beyin ödemi oluşturduğu gösterilmiştir (33).
Pnömokok hücre duvarındaki teikoik asit ve peptidogikan hem sitokin oluşumunu indükler, hem de alternatif yol aracılığı ile komplemanı aktive eder. Bunun dışında hücre duvar polisakkaridlerine karşı oluşan antikorların klasik yolu aktive ettiği de bildirilmiştir. Sonuçta pnömokoksik enfeksiyona klasik ve alternatif kompleman yolunun aktivasyonu ile yoğun bir inflamatuvar yanıt eşlik etmektedir.
Pnömolizin, yüzey proteini, salgısal IgA, otolizin gibi diğer yapısal maddeler de pnömokok hastalığının patogenezine katkıda bulunurlar. Bu maddeleri üretmeyen genetik ürünü mutatların virülanslarının düşük olduğu gösterilmiştir. Yine deney hayvanlarında bu maddelerle aşılama sonucu antikor oluşumu ile korunma sağlanmaktadır. Ancak insanlarda bu maddelere karşı koruyucu bir antikor henüz gösterilememiştir (21).
Pnömokokların hastalandırıcı özelliklerini artıran konağa ait çeşitli risk faktörleri vardır. Normal şartlar altında organi zmalar östaki borusuna, sinüslere veya bronşlara ulaştıklarında temizleyici mekanizmalarla, özellikle de siliyer aktivite ile
kolayca süpürülürler. Ancak bazı koşullarda mukosiliyer temizlemede yetmezlik oluşması hastalandırıcılık özelliğini artırır.
Siliyer fonksiyon bozukluklarında, mikroorganizmalar derin dokulara yayılır ve semptomlarının uzamasına neden olur (34). Akut viral enfeksiyonlar, sigara tiryakiliği yada meslek hastalıkları gibi kronik patolojilerde, silyalı bron şial hücre hasarına bağlı mukus üretimi artmakta, bakteriyel klerensi engellemekte ve bunun sonucunda enfeksiyon belirmektedir(21).
Pnömokokların alt solunum yoluna ulaşarak enfeksiyon oluşturabilmeleri için aşağıda belirtilen mekanizmaların işlevinde bir bozu lma olması gereklidir. Bunlar:
Epiglottal refleksin bozukluğu,
Bronş epitelinde mikroorganizmaların yüzeyel mukozaya yapışması ve orada sınırlandırılıp alt solunum yoluna ulaşmasını engelleyen mekanizmaların bozukluğu.
Solunum yolu epitelinin silya fonksiyonlarının bozukluğu,
Öksürük refleksinin yetersizliği,
Terminal bronş ve bronşiollerden lenfatik drenajı sağlayan sistemin bozukluğu. Mononükleer alveoler makrofajların (dust cells) sayısal yada fonksiyonel bozukluğu (32).
KONAĞIN ÖZGÜN SAVUNMA MEKANİZMALARI
Pnömokokların enfeksiyon oluşturmasını engelleyen konağa ait çeşitli savunma mekanizmaları vardır. Bunlar;
Pnömokok kapsül antikorları: Antikapsüler antikorların varlığı immünitenin ideal olmasa da olumlu kabul edilen dolaylı bir göstergesidir. Bunun yanında kolonizasyon da antikor oluşumuna neden olmaktadır. Kolonizasyonu takibeden 30 gün içerisinde 2/3 vakada serotipe özgün antikor gelişmektedir (21).
Dalak ve Pnömokok enfeksiyonu: Kan dolaşımından pnomokokları temizleyen başlıca organ dalaktır. Kanın dalak içinden yavaş geçişi, Bilroth kordonlarında ve splenik sinüslerde yerleşimli retiküloendoteliyal hücrelerle uzamış temas süresi, opsonize olmamış partiküllerin temizlenmesine olanak tanımaktadır. Splenektomili ya da dalak fonksiyonları bozuk kişilerde hayatı tehdit eden pnömokok
enfeksiyonları ortaya çıkabilmektedir. Orak hücreli anemili çocuklarda pnömokoksik bakteriyemi ve menenjitin 100 kat daha fazla görülmesinin kompleman anomalilerinden çok splenik disfonksiyona bağlı olduğu düşünülmektedir (21).
Pnömokok enfeksiyonuna zemin hazırlayan konağa ait faktörler
Pnömokoklara yönelik konak savunma mekanizmaları humoral ve hücresel immünite üzerinden gerçekleşmektedir. Aşağıdaki pnömokoksik enfeksiyona predispozisyon hazırlayan durumlar belirtilmiştir (21):
DEFEKTIF ANTIKOR ÜRETIMI : Primer; Konjenital agammaglobulinemi, genel Değişken Agammaglobulinemi, Selektif IgG subklas eksikliği
Sekonder; Multiplmyelom, kronik lenfositik lösemi, lenfoma, HlV enfeksiyonu
DEFEKTIF KOMPLEMAN: Kompleman azlığı yada yokluğu (C1,C2,C3,C4)
YETERSIZ PNL SAYISI: Primer; Siklik nötropeni
Sekonder; İlaçla indüklenen nötropeni, aplastik anemi
PNL FONKSIYONLARINDA AZALMA : Alkolizm, karaciğer sirozu, renal yetmezlik, FcdeltaII/R131 aleli reseptörlerinde afinite, kortikosteroid tedavisi
PNÖMOKOKSİK BAKTERİYEMİNİN YETERSİZ KLERENSİ : Primer; Konjenital aspleni, hipospleni
Sekonder; Splenektomi, orak hücreli anemi(otosplenektomi)
MULTİFAKTÖRİYEL NEDENLER : Infant dönemi, yaşlılık, alkolizm, glukokortikosteroid tedavisi, kronik hastalık, hospitalizasyon, malnütrüsyon, yorgunluk, karaciger sirozu, stres, renal yetmezlik, soğuğa maruz kalma, Diabetes Mellitus
TEMAS RİSKİNDE ARTMA : Kreşler, askeri eğitim kamplar
RESPİRATUVAR INFEKSIYON AN AMNEZİ: İnfluenza, diğerler
İNFLAMATUVAR DURUMLAR : Sigara içiciliği, kronik obstrüktif akciğer hastalığı, astım
EPİDEMİYOLOJİ
Çoğu mikroorganizma gibi pn ömokokların da ekolojik odağı nazofarinkstir. Boğaz kültüründe pnömokok izolasyon sıklığı erişkinlerde %5-10 iken; çocuklarda % 20-40’lara ulaşmaktadır. Çocuklardaki yenilenen ekimlerde ise bu oranın %40 –60’a kadar çıkabileceği bildirilmiştir ( 21). Kapalı ortamlarda yaşayanlarda %60'lara varan taşıyıcılık oranları bildirilmektedir. İlk nazofaringeal kolonizasyon 4 günlük ile 18 aylık çocuklarda ortaya çıkmakta ve pn ömokok ile kolonize 3 yaş altı çocuklardan izole edilen suşların %65'ini 6. 14. 19, 23 serotipleri oluşturmaktadır. Kreşlerde çok sayıda küçük çocuğun yakın teması pn ömokok taşıyıcılığı ve kolonizasyon döngüsünü kolaylaştırmaktadır (35). Kolonizasyon ve enfeksiyon görülme sıklığı mevsimsel değişiklikler gösterir ve özellikle de kı ş ortasında en sık görülür(32).
Pnömokoklarda bazı serotiplerin daha sıklıkla hastalık oluşturduğu gösterilmiştir. Çocuklar ve erişkinler için bu serotipler farklıdır. Pn ömokoksik pnömoninin erişkinlerde %80'inden serotip 1, 2, 3, 4, 6, 7, 8, 9, 12, 14, 19, 23, 25, 51, 56 sorumlu olduğu halde, çocuklarda serotiplerin yarısından fazlasını 6A, 6B, 14, 19F, 19A, 23F oluşturmaktadır (32) .
Pnömokoklarda bulaşma, yakın temasla havadan aerosol veya damlacıkların inhalasyonu ile olmaktadır. Pnömokoklar, yakın temas dışında havada as ılı kalabilen partikülleri sayesinde bir bireyden diğerine kolaylıkla yayılabil ir. Yeni yürümeye başlayan çocuklar kreşlerde bu organizmaların yayılımı a çısından önemli rol oynar. Yetişkinlerin toplu yaşadıkları yurtlar, askeri kamplar, cezaevleri, hastaneler, düşkünlere ve kimsesizlere ait barınaklar , pnömokok epidemiyolojisi açısından önemli risk faktörleridir (21,25,32).
Pnömokok enfeksiyonları yenidoğanlarda, 2 yaş altı çocuklarda ve 65 yaş üzeri grupta mortalitesi yüksek, ciddi enfeksiyonlara yol açmaktadır. Riskli gruplarda antibiyotik öncesi dönemde pn ömokoksik pnömoniye bağlı ölüm oranı % 77 iken, bu oran 1950-60’lı yıllarda % 28'e 1970’lı yıllarda ise % 25'e gerilemiştir ( 36). ABD'de ise her yıl 150–570 bin kişinin pnömokoksik pnömoniye, 16–55 bin kişinin pnömokok bakteriyemisine ve 2600 –6200 bireyin ise pnömokoksik menenjite yakalandığı ve bunların da sırasıyla % 5 , % 20 ve %30'unun ölümle sonuçlandığı
bildirilmiştir (25). Tedavi edilmemiş bakteriyemik hastalarda mortalite %80'l ere kadar ulaşmaktadır (37).
Pnömokoksik menenjitler epidemiler şeklinde seyreden meningokoksik menenjitler bir yana bırakılırsa, sporadik vakaların birincil nedenini oluşturmakta ve mortalitesi % 10–60 arasında değişmektedir (38,39).
Pnömokoklar erişkin ve çocuklarda otitis medianın en önde gelen nedenidir. Yapılan çalışmalarda çocuklarda etkenin izol e edildiği otit ve sinüzit vakalarının %40-50'sinden tüm vakaların da %30-40'ından pnömokokların sorumlu olduğu ortaya konmuştur (21,40)
İsviçre’de 1985–1994 yıllarında 17 yaş altı çocukların dahil edildiği bir çalışmada 393 olgunun %42'sini menenjit , %28'ini pnömoni ve %26'sını da bakteriyemi oluşturmuştur. Yıllık insidans 17 ya ş altı çocuklarda 100.000 de 2,5 iken; 2 yaş altında 100.000'de 11 olarak belirlenmiştir. Mortali te menenjit görülen vakalarda %8,6 ve bakteriyemik hastalarda ise %8,9 bulunmuştur (41). Hindistan'da yapılan bir çalışmada 12 ya ş altı çocuklarda görülen pnömokok enfeksiyonların %37,3’ünü menenjit, %29.6'sını pnömoni, %7.6’sını da bakteriyemilerin oluşturduğu bildirilmiştir (42). Yaşlı popülasyonda (65 yas üzeri) pn ömoni, 5–65 yaş grubunda ise menenjitle daha sık karşılaşıldığı bildirilmektedir ( 43).
Enfeksiyonun görülme sıklığı beyaz ve zenci ırkta da farklılık göstermektedir. Kuzey Amerika'dan alınan Atlanta verilerinde ortalama enfeksiyon görülme insidans ı 100.000 de 28 iken, beyazlarda bu oran 100.000 de 18, zencilerde ise 48 olarak saptanmıştır. Yine 2 yaş altındaki çocuklarda insidans, zencilerde 100.000'de 300, beyazlarda ise 100'e kadar çıkmaktadır. Bunun dışında sosyoekonomik düzeyi düşük kesimlerde invazif pnömokok hastalığının daha yoğun olduğu bildirilmektedir (44).
Ülkemizde 1992–94 yılları arasında Cerrahpaşa Tıp Fakültesinde yapılan bir çalışmada 49 invaziv pnömokokun 20'si (%40) BOS, 16'si (%32) kan, 6'si (%12) kan ve BOS, 3'u (%6) plevra, 1 (%2) plevral sıvı ve kan, 1 ( %2) periton sıvısı, 1 (%2) eklem ve 1 (%2)'i de plevral sıvı, kan ve idrardan izole edilmi ştir(45). Kartal Eğitim Hastanesi'nde 1997-98 yılları arasında izole edilen pnömokokların %39'u BOS, %39 kan ve %11'i de plevral sıvı kaynaklı olduğu bildirilmiştir ( 46). Bunun dışında GATA
Haydarpaşa Eğitim Hastanesi'nde Uçan ve arkadaşlarının yaptığı bir çalışmada lober pnömonili hastaların %61'inde sorumlu ajanların pn ömokoklar olduğu belirlenmiştir (47).
Dünyanın pek çok yerinde yapılan çalışmalar pn ömokokların toplumdan kazanılmış pnömonilerin en sık etkeni olduklarını ortaya koymaktadır ( 40,48). Ülkemizde, Sağlık Bakanlığı kayıtlarına göre 1992 yılında viral pn ömoni tanısıyla 4782, bakteriyel pnömoni tanısı ile 87541 olgu hastaneye yatırılmış ve sırasıyla 76 ve 2441 kişi hayatını kaybetmiştir. Devlet İstatistik Enstitüsü verilerine göre tüm ölümler arasında pnömoni 6.sırada yer almaktadır (49).
Pnömokok enfeksiyonlarının mevsimlerle ilişkisi olduğu bilinmektedir. Pnömoni, otitis media ve bakteriyemi için hastalığı n Ekim-Kasım ayları arasında yoğunlaştığı, şubat ayında da zirveye ulaştığı bildirilmiştir. Bu mevsimsel değişikliğin ilk döneminde artan viral solunum yolu enfeksiyonları ile yakından ilişkili olabileceği ileri sürülmektedir (21).
Penisilin ilk kullanıma girdiği dönemden itibaren pnömokoksik enfeksiyonların ampirik tedavilerinde güvenle kullanılan antibiyotiklerinden birisi olmuştur. Ne var ki, son yıllarda giderek artış gösteren penisilin direnci onların tedavi alanındaki etkinliklerini sınırlandırmış v e bu direncin değişik boyutlarda dünyanın her yerinde bir sorun haline gelmesine neden olmuştur. Pn ömokoklarda penisilin direncinin gelişimi için bir zaman sürecine gerek vardır. Bu sürecin gelişim safhaları ve epidemiyolojik özellikleri Baquero tarafından ortaya konmuştur. Buna göre, pnömokokların antibiyotiklere direnç kazanması, çeşitli aşamalardan geçerek, birkaç evrede gerçekleşmektedir. Bunlardan ilki gizli dönemdir. Gizli dönemde dirençli suşların sayısı ve kolonizasyon oranları düşüktür. Bu dönemde β laktam antibiyotiklerle karşılaşmaya bağlı olarak mutasyonlar görülmekte ve sayıca az olan bu tip mutant suşlarda gizli bir seleksiyon devam etmektedir. Bunu Kritik dönem izler. Bu dönemde; mutasyonlar devam ederken, ayrıca kolonizasyon oranlarında artış da görülmektedir. Kritik d önem, toplumda direnç seviyesinin ilk olarak belirlenmeye başladığı İstatistiksel verilerin ortaya çıktığı ve çeşitli önlemlerin alınmasını gerekli kılan dönemdir. Son dönem ise ; Penetrasyon dönemidir. Bu faz dirençli suşların kolonizasyon oranlarının yüksek değerlere ulaştığı ve bireyler
arasında süratle yayılım gösterdiği bir dönemdir. Toplu yaşam merkezleri bu dönemde, o bölgedeki dirençli suşların yayılımı ve taşıyıcılık oranlarının artması açısından kritik bir öneme sahiptir (32).
Pnömokoklarda penisilin direncinde PBP'lerin önemli bir rolü bulunmaktadır. Bu proteinlerin penisiline azalmış ilgileri direnç gelişimine neden olmaktadır. PBP genlerinin pulsed field gel electrophoresis (PFGE) ve restriction fragment lenght polymorphism (RFLP) gibi niolektiler tekniklerle tiplendirilebilmesinin mümkün oluşu, yer kürede yayılan penisilin dirençli pnömokokların klonal tiplendirilmesine olanak sağlamıştır (50). Literatürde en yaygın olarak bilineni 23F Ispanyol/ABD klonudur (51-57). Bu klona ait izolatlar penisilin, tetrasiklin, kloramfenikole de direnclidir. TMP/SMX ve makrolid direnci de sık görülmektedir. İkinci bir kıtalararası pn ömokok klonu da penisilin ve TMP/SMX dirençli serotip 14 veya serotip 9 Fransız/İspanyol klonudur. Üçüncü klon ise çoklu ilaç direnç genlerini taşıyan serotip 6B'ye ait klondur (58).
Bir klona ait serotipler genellikle aynı tiptendir. Aynı klona ait DNA içeren bir suş farklı serotipte ise, en olası açıklama ; bu bakterinin kapsülü kodlayan ekzojen bir DNA edindiğidir. Bu yeni kapsülün varlığı bakteriye konağın immün sistemine karşı koruyucu bir avantaj sağlamaktadır. Bunun yanısıra kapsüler transformasyon, antibiyotik dirençli fenotipin duyarlı suşlar arasında yayılmasında da aracı bir mekanizma olabilmektedir (50).
Ülkemizin serotip ve klonal analizi henüz ortaya konulamamıştır. 1995 yılında 12 orta direnç, 1 yüksek düzey dirençli pnömokok Atlanta'da analiz edilmiştir. Buna göre orta düzey dirençli izolatlar tip 6B, 19F, 23F , 34, 35F şeklinde dağılım gösterirken yüksek düzey dirençli izolat tip 6B olarak tiplendirilmiştir ( 60).
PNÖMOKOK ENFEKSİYONLARINDA PENİSİLİN DİRENÇ
DURUMU
ABD’de 1978–87 yılları arasında Centers For Disease Control and Prevention
(CDC)'a ulaşan 5000 invazif pn ömokok izolatından sadece 1 tanesi dirençli iken, bu
oran 1991'de 60 katlık bir artışla %1.3 ’e ulaşmıştır. Aynı bildirimde 1991'de orta
sefalosporinler, makrolidler, TMP-SMX ve kloramfenikolden en az birine d irençli
olduğu gösterilmiştir (61). Her ne kadar penisilin dirençli ilk pn ömokok (PDP)
enfeksiyonları çocuklarda görülmüş ve direnç bu grupta en yüksek düzeyde
saptanmış olsa da, direnç prevelansı 65 yaş üzeri popülasyonda dramatik olarak
artış göstermektedir. Günümüzde PDP enfeksiyonlarının %30'dan fazlasının bu yaş
grubu üzerindeki popülasyonda görüldüğü bildirilmektedir ( 62). ABD'de en yüksek
PDP edinme oranlarının, 4 ya şın altında ve özellikle de kreş benzeri kalabalık
ortamlarda bulunan çocuklarda oldu ğu bildirilmiştir (63). 1996 yılında Oregon'da 12
hastanenin katılımı sonucu aktif sürveyans sistemi aracılığıyla toplanan 178 invazif
izolatın %14'ü penisilin dirençli bulunmuştur. Yine aynı hastanelerde bireysel olarak
izole edilen toplam 1092 izolatın % 16'si penisilin dirençli olarak bulunmuştur (30).
1998 yılına gelindiğinde Tennessee'de klinik izolatlarda orta düzey diren ç %20 iken;
yüksek düzey direnç %36 gibi korkutucu seviyelere ulaşmıştır ( 64). 1997–98 yıllarını
içeren 34 merkezli bir çalışma , Amerikan epidemiyolojik verilerinin bir özeti olarak
kabul edilebilir. 1601 klinik izolatın katıld ığı bu çalışmada suşların %70.5’ i penisilin
duyarlı, 17.4’ü orta düzey dirençli ve %12.1'i yüksek düzey dirençli bulunmuştur.
Suşların %16'sında da çoklu antibiyo tik direnci saptanmıştır. 1994-1995 yılları
arasındaki 30 merkezli 1527 klinik izolatlık çalışmayla kıyaslandığında, sırasıyla
%76.4 duyarlı, %14.1 orta düzeyde penisilin direnci ( ODPD) ve %9.5 yüksek düzey
penisilin direnci(YDPD) olarak bulunmuştur (65).
Orta Amerika'da 1998'de Dominik Cumhuriyeti'nde penisilin direnci %48 olarak bildirilirken; serotip 14, 6 ve 3 en çok görülen suşlar olarak belirtilmiştir. Serotip 14 pnömokokların %75'inin uluslararası İspanyol/Fransız klonuna ait oldukları gösterilmiştir (66). Kolombia'da ise 1994-99 arasında penisilin direnci %22.2
saptanırken; 14, 6A/6B, 23F, 5, 19F, 1, 18C numaralı serogrupların tüm izolatları n %80.6'sını oluşturduğu ortaya konulmuştur (61).
Latin Amerika ülkelerinden Arjantin'de 1993-99 yılları arasında yapılan bir çalışmada %16.7 yüksek düzey, %14.1 orta düzey direnç bildirilmiş bir başka çalışma da ise 1998-99 'da bu oranların %47.8 olduğu rapor edilmiştir (68,69,67). Komşu ülke Brezilya'da ise 1999 yılında %28.3 oranında orta düzey direnç saptanırken, yüksek düzey dirence rastlanmamıştır ( 70). Şili penisilin direncinin en ürkütücü boyutta olduğu Latin Amerika ülkesidir. Şili’de1999 yılında orta düzey direnç %49.4, yüksek düzey direnç ise %16.3 olarak bildirilm iştir(71).
Günümüzde tüm Amerika kıtasını kapsayan aktif bir sürveyan s ağı aracılığı ile veriler daha düzenli derlenebilmektedir. Bu sistemin verilerine göre tüm Amerika kıtasında penisilin duyarlılığı %73.9, orta düzey direnç %17.6 ve yüksek düzey direnç ise %8.5 olarak ifade edilmektedir. Sürveyans sistemi ağı en düşük direnci %2 ile Kanada'dan bildirirken ; %40'lara varan direnç patterniyle en yüksek direnç oranı ABD’den bildirilmiştir (72).
Avrupa da pnömokok epidemiyolojisinin belirgin çizgilerle ortaya konulduğu bir başka coğrafi bölgeyi oluşturmaktadır. Yapılan çok merkezli çalışmalarda Portekiz'de %31, Fransa'da %41-55, İspanya’da %45-55 ve Yunanistan'da da %50'lik direnç oranları bildirilmiştir. Buna karşın Avusturya %0 , Almanya %12-13, İsviçre %12 ve İngiltere ise %14 gibi daha düşük penisilin direnç profiline sahiptir (102). Fransa'da 1984-86 yıllarında penisilin direnci % 1.1 iken 1990 yılında %48'e, 1997-98 döneminde ise %41 ile 55 seviyelerine ulaşmıştır (73-74,55). Almanya'da ise 1992-94 yılları arasında %1.8 olan penisilin direnci , yıllar içerisinde artmış ve 1997-98 yıllarına gelindiğinde %12 olarak belirlenmiştir (75)).
İspanya, Avrupa'daki en yüksek oranların bildirildiği ülkelerden birisidir. İspanya’da 1979-84 arasında izolatların %4.6'sında , 1983-89'da %8'inde yüksek düzey direnç tesbit edilmiştir. 1990-96 arasında çok merkezli 9243 izolatı içeren büyük bir çalışmada yüksek düzey direnç oranı %13.7 düzeylerinde bulunmuştur (76). 1997-98 yıllarında ise penisilin direnci %45 -55 düzeylerine erişmiştir (102).
İtalya, çoğu Akdeniz ülkesinin aksine PDP'nin ender izole edildiği bir ülkedir. 1993’te %5.5’ten 1996'da %7.7’ye yavaş bir trend ile yükselmiştir. 1993 -96 arasında toplanan 700 pnömokoktan ayrıştırılan 39 PDF izolatı PFGE ve RFLP aracılı irdelendiğinde suşların yarıdan fazlasının iki uluslarası epidemik pn ömokok klonuna ait olduğu gösterilmistir. Bu klonlardan ilkinin 23F'in 19 numaralı serotipe kapsüler transformasyon aracılı dönüştüğü İspanyol/ABD serotip 23 klonu, diğerinin ise serotip 9 uluslararası Fransız/İspanyol klonu olduğu gösterilmiştir ( 55). 1999'a gelindiğinde %4.2'lik yüksek düzey ve %7.7'lik orta düzey olmak üzere %11.9 oranında penisilin direnci bildirilm ektedir (77).
Avrupanın değişik ülkelerinde farklı oranlar mevcuttur. Belçika'da görülen PD P enfeksiyonlarının Fransa'dan klonal yayılma yoluyla aktarıldığına dair veriler bulunmaktadır. Bu nedenle Belçika’da 1993'te %2.3 olan penisiline direncin bir yıl içinde %7.6'ya yükseldiği bildirilmektedir ( 78). Yugoslavya'da 1994-99 dönemini ilgilendiren bir calışmada klinik izolatlarda penisilin direnci %39.9 saptanırken (94) , komşusu Slovakya da ise %34.1'lik bir direnç görülmektedir. Slovak çalışmasında 19A, 23F, 19F, 14. 18 ve 6 numaralı serotiplerin tüm izolatların %48.6'sını oluşturduğu bildirilmiştir (56).
Asya'nın epidemiyolojik haritası da aktif bir sürveyans sistemi ile ortaya konulmaya çalışılmaktadır. Bu sistemin verilerine göre en yüksek penisilin direnc i %79.7 ile Kore'dedir. İkinci sırayı %65.3 il e Japonya almaktadır. Vietnam % 60.8, Srilanka %41.2 Taiwan %38.7 S ingapur %23.1, Endonezya %21, Çin %9.8 ,
Malezya %9, Hindistan %3.8 ile direnç haritasında yerini almıştır. Bu sonuçların özellikle Uzak Doğu açısından son derece ürkütücü olduğu söylenebilir. Çok merkezli bu çalışma bölgede 23 (%30.2), 19 (%24,9) ve 6 (%15) numaralı
serotiplerin en yaygın olduğunu ortaya koymuştur. PFGE analizlerinde Kore , Japonya, Singapur, Taiwan, Tayland ve Malezya'dan izole ed ilen suşların uluslarası İspanyol 23F klonu ile uyumlu olduğu gösterilmiştir ( 56).
Afrika'da PDP'lar ile ilgili verilerin yeterli olmadığı bilinmektedir. Hatta bu kıta açısından epidemiyolojik birikimin , pnömokoksik hastalığın bölgesel ciddiyeti ile ters orantılı olduğu bile rahatlıkla söylenebilir ( 73). Pnömokoklarla ilgili en sağlıklı veriler G.Afrika'dan bildirilmektedir. 1979 ’da %4.9 olan penisiline direnç 1990 ylında
%14.4'e ulaşmıştır. Çoklu direnç ise en sıklıkla 6B , 14, 19A ve 23 F ile ilişkili bulunmuştur (52). 1996 yılına gelindiğinde Güney Afrika ve Kenya'daki direncin % 40 düzeyine ulaştığı bildirilmiştir(32). Yine bu kıtada çoklu direnç giderek artış göstermektedir (80). Kuzey Afrika'da 1998-99 döneminde penisiline %3 yüksek düzey. %13.3, orta düzey direnç saptandığına dair bir çalışma ise Fas'dan bildirilmiştir (51).
Avustralya ilk PDP'un saptandığı bölgedir. Ancak direnç beklendiği kadar yüksek değildir. 1989-94 arasında bölgede orta düzey direnç %15.4 saptanırken yüksek düzey dirençli izolat bildirimi yapılmamıştır (81).
Ülkemizden ilk veriler Erbaş ve arkada şlarınca yapılan ve 1989-90 yıllarını kapsayan çalışma ile başlamıştır ( 82). Sadece Kirby-Bauer disk diffüzyon tekniğinin kullanıldığı araştırmada penisilin direnci %12.3 olarak saptanmışt ır. İkinci çalışma Tunçkanat ve arkadaşlarınca minimum inhibitor konsantrasyon (MI C) değerleri hesaplanarak yapılmış, suşların %26.3'ü orta düzey ve %7.3'ü ise yüksek düzey dirençli bulunmuştur (12). Gür ve arkadaslarının 1994 yılında yayınladıkları başka bir araştırmada ise, 70 pnömokok suşunda orta düzey direnç % 30, yüksek düzey direnç %17 olarak belirlenmiştir ( 83). Bu veri Türkiye'den o ana dek bildirilen en yüksek değerleri içermektedir. Ülkemizde PD P ile ilgili yapılan çalışmalar ve alınan sonuçlar Tablo 1'de gösterilmiştir.
Bu çalışmalarda PDP direnci %9.7 ile %54.2 arasında değişmektedir. Klinik izolatlarla yapılan çalışmalarda elde edilen PD P saptanma oranı Sümerkan (1992 -94), Öncül (1993-97) ve Akın (1998) çalışmalarında sırasıyla %11 , %12 ve %14.3 bulunmuştur (45,46,87). Taşıyıcılarda ise Öncül'ün çalışmasında %12.2'lik direnç saptanmıştır. (87).
Bakteriyemik pnömokoksik enfeksiyon insidansı, HlV pozitif çocuklarda ve erişkinlerde AIDS tablosunun öncesinde ve sonrasında 10 kata varan artışlar göstermektedir. Diğer bir deyişle HIV ile enfekte bireylerdeki pn ömokoksik enfeksiyonlar klinik açıdan diğer bağışık sistemi baskılanmış konakların enfeksiyon seyrini anımsatmaktadır (90). Yapılan çalışmalarda HIV'li hastalarda pnömokoksik menenjitin daha sık görüldüğü bildirilmektedir. Ancak bu popülasyonda mortalitenin bariz düşük olduğu saptanmıştır (91).
PDP ve HIV enfeksiyonu arasında bir ilişkinin olabileceği düşünülmektedir. New York'ta yapılan bir çalışmada, 20 -44 yaş arası invazif PDP enfeksiyonuna maruz kalan erişkinlerin %71.4'ünün eş zamanlı olarak HIV ile enfekte olduğu bildirilmiştir (63). Başka bir çalışmada da 1997 -98 yılları arasında, İspanya’da HlV'li hasta popülasyonunda bakteriyemiye neden olan mikroorganizmalar içerisinde en yüksek prevelansın pnömokoklara ait olduğu saptanmış ve PDP ile HİV arasında yakın bir ilişki olabileceği fikri ortaya atılmıştır. ( 92).
Tablo -1: Türkiye'de pnömokoklarda penisilin direncinin belirlenmesine yönelik çalışmalar (7,12,32,45,46,82,84,83,85,86, 87,88,89)
Çalışma Grubu Olgu Sayısı ODPD (%) YDPD (%) Yıl Metod
Erbaş 65 12,3 - 1989-90 Disk diffüzyon
Tunçkanat 68 26.3 7.3 1992 Agar dilüsyon
Gür 70 30 17 1994 Agar dilüsyon
Sümerkan 49 22 - 1992-94 Agar dilüsyon
Mulazimoğlu 94 13 1 1994
Kanra 40 30 - 1994-95 Agar dilüsyon
Öngen 49 29 - 1994 tüp dilüsyon
Şener 120 44,2 10 1995-97 Agar dilüsyon
Kansak 20 50 - 1996-97 E test
Ay dın 9 14,2 - 1997 Agar dilüsyon
Özalp 53 40 2 1997 E test
Kocagöz 86 21 3,5 1997 E test
Öncül 148 12.2 - 1997 Mikrodil.
Öztürkeri 72 26 1997 Disk DiffÜ.
Sümerkan 132 23.4 - 1996-98 E test
Gönüllü 80 31.3 10 1998 E test
Akıncı 41 9,7 - 1998 E test
Ak 28 14.3 - 1998 E test
Pnömokoklarda direnç gelişiminde bazı risk faktörleri bulunmaktadır. Genel olarak pnömokok enfeksiyonlarının oluşumuna neden olabilen risk faktörlerine benzerlik göstermektedir. Bunlar :
5 yaş altı (özellikle 2 yaşından küçük çocuklar) ve 65'ini aşan yaşlılar
Kreş ya da bakım evlerinde bulunanlar,
Bireysel ve toplumsal antibiyotik kullanımının yaygın olduğu pop ülasyonlarda antibiyotik kullanımını takip eden 3 aylık dönemde,
Malignite gibi altta yatan debilizan hastalık varlığında; s ıklıkla da hematolojik kanserlerde
HIV pozitif hastalarda, özellikle de TMP -SMX ile enfeksiyon tedavisi sonrasında
Serotip 6A, 6B, 9, 14, 19F, 23F ile gelişen pn ömokok enfeksiyonlarında, Yüksek direnç prevalenslı bölgelerde yaşıyor o lmak
Hospitalize edilen hastalarda hastanede kalım süresinin uzaması sonucunda PDP enfeksiyonlarında artışlar görülür.
2 yaş altında ve bakım evlerine devam eden çocuklar PD P kolonizasyonu ve enfeksiyonu açısından en riskli grubu oluşturmaktadırlar. Bunun la birlikte HIV ile enfekte hastalarda yada yaşlılarda PD P prevelansı gün geçtikçe artmaktadır(30,38,93,94).
ANTİBİYOTİK DUYARLILIĞI VE DİRENÇ MEKANİZMASI
Penisilin, 1940'lı yıllardan beridir pnömokok enfeksiyonlarında ilk seçenek olarak başarılı şekilde kullanılan bir antibiyotiktir (16). Pnömokoklarda enterokoklarda olduğu gibi penisiline potansiyel bir direnç bulunmamakta, genel olarak tüm beta laktamlara duyarlı olarak kabul edilmektedir. Bu nedenle penisilin pnömokok enfeksiyonların ampirik tedavisin de ilk seçenek antibiyotik olarak kabul edilmiştir. Antibiyoterapinin erken dönemlerinde penisilin için tüm Pnömokoklar 0.02 µg/ml ya da daha düşük bir MIC değeri ile inhibe olabilmekteydi. Günümüzde pnömokokların penisiline direnç geliştirmeleri nedeniyle bu oranlar yaş, coğrafik bölge, altta yatan hastalıkların varlığı ve serotipe bağlı olarak yükseldi. MI C değerleri 0.1-1 µg/ml arasında bulunan pnömokoklar penisilin için orta düzey; 2 µg/ml 'nin üzerinde bulunan pnömokoklar ise yüksek düzey dirençli olar ak kabul
edilmektedir. MIC değerleri 0.06 µg/ml ve altında bulunan pnömokoklar ise duyarlı olarak kabul edilmektedirler (95).
Beta laktam antibiyotiklerin hepsi molekül yapılarında ortak beta laktam halkası içermektedir. Bu halka bakteri duvar sentezinde kullanılan disakkarid peptitlerin karboksi terminali ile yapısal benzerlik göstermektedir. Bu benzerlik nedeniyle duvar sentezini sağlayan enzimler olan PBP'lere, bu madde yerine
Betalaktam antibiyotikleri bağlanmakta, beta laktam antibiyotiğin bağlanması ile
enzimleri bloke olan bakterinin duvar sentezinin inhibe olması nedeniyle bakteri ölmektedir (96).
Antibiyotik kullanımının yaygınlaşması, direnç sorununu beraberinde getirmiştir. Bir bakteri türünde herhangi bir antibiyotiğe karşı direnç gelişmesi 2 şekilde olmaktadır.
Mutasyon : Duyarlı olan bakteri suşunun taksonomik olarak kendisine benzer bir dirençli bakteri grubundan DNA par çasını alarak, kendi kromozomal yapısına geçirmesi sonucu oluşmaktadır ve oldukça sık görülmektedir (97,98).
Özellikle belli bir direnç mekanizmasının ortaya çıkmasında etkin olan faktördür. Antibiyotiklerle sık karşılaşan bakterilerde antibiyotiğin etkinliğini ortadan kaldırmaya yönelik mutasyon geliştirmeleri bakterilerin önemli savunma mekanizmalarından birini oluşturmaktadır. Antibakteriyel ajanların yanlış ve yaygın kullanımı, dirençli suşların seleksiyona neden olaca ğından yayılmalarını hızlandırmaktadır. Pnömokokların oksasilin ile sık karşılaştırılmaları sonucu MIC değerlerinin giderek yükseldiği ve zamanla direnç geliştiği gösterilmiştir (15).
Seleksiyon : Mutasyonu takiben antibiyotik bask ısında ortamda bulunan duyarlı suşların engellenmesi ve yalnızca dirençli suşların çoğalabilmesidir. Pnömokoklara karşı sıkça beta laktam antibiyotik kullanımının bu tip bir etkiyle duyarlı suşları ortadan kaldırıp dirençli suşların seleksiyonuna yol açtığı belirlenmiştir (100).
Bunun dışında, yeni gelişen direnç mekanizmasının plazmid ve/veya trasduser faj (transformasyona neden olan DNA parçaları) gibi mekanizmalarla hücreden hücreye yayılması sonucu da yeni dirençli populasyonlar oluşabilmektedir. Direncin
aktarımı bu şekilde genomik yapılarla oluştuğunda horizontal, bakteri suşlarıyla oluşuyorsa klonal yayılımdan bahsedilmektedir. Bunlar, toplumda direnç sıklığının süratle artmasından ve dirençli suş taşıyıcılığının artışından sorumlu olan yayılma şeklidir (101,102). Plazmid ya da diğer direnç gelişme mekanizmalarının önemi dirençli aynı bakteri türünün değişik bireyler arasında yayılmasına neden olabilmeleridir.
Beta laktam antibiyotiklere diren ç üç mekanizma ile gelişmektedir :
Antibiyotiklerin hücre içine girişinin azalması: Beta laktam antibiyotikler için az görülen bir direnç mekanizmasıdır. Gram (+) bakterilerde bildirilmemiştir.
Beta laktamaz yapımı: Bakteri tarafından salgılanan enzim, beta laktam halkalarını parçalar. Bu direnç özellikle stafilokoklarda sık görülmektedir. Son yıllarda enterokoklarda da giderek artmıştır. Bazı Gram (+) bakterilerin tersine pnömokoklarda plazmid kaynaklı beta laktamaz üretimi mevcut değildir (100).
PBP'lerdeki değişim: Bakteri hücre membranında yer alan ve penisiline olan affinitelerinden dolayı PBP adı verilen enzimler transglikasyon, transpeptidasyon ve karboksipeptidasyon gibi reaksiyonları indüklerler(100). PBP'lere bağlı direnç, mutasyonlar yada bakterilerden yeni genlerin transferi ile mevcut PBP'lerin beta laktam affinitelerinin azalmas ı yada affinitesi düşük yeni bir PBP sentezlenmesi şeklinde olur (98). Bu mekanizma ile olu şan direnç pseudomonaslarda, pnömokoklarda, metisiline dirençli S. aureus ve S. epidermidis'de, penisiline diren çli N. gonorrhoeae'de ve N.meningitidis'de, ampisiline diren çli H.influenzae'de ve penisilin/sefaklor'e dirençli enterokoklarda kesin olarak g österilmiştir (103). PBP'lerdeki değişiklikler, farklı peptidoglikan yapılarının üretimi ile sonuçlanabilmektedir. Yeni üretilmiş değişik hücre duvar yapısı ile pnömokok, penisilinin inhibitor etkisinden kolay lıkla kaçabilmektedir (16,26). Pnömokoklarda Tablo 2'de gösterildiği gibi beşi yüksek ve biri düşük molekül ağırlıklı olmak üzere altı tip PBP'nin bulunduğu bilinmektedir (104)
Pnömokoklarda penisilin direnci y üksek molekül ağırlıklı PBP'lerin değişik formlarının oluşmasına bağlıdır. Penisiline ve diğer beta laktamlara dirençte PBP la, PBP 2b ve PBP 2x genlerinin rol ü iyi bilinmektedir. PBP 2b'de en ufak bir de ğişiklik penisiline direnç gelişimi açısından yeterli olabilmektedir. Oysa geni ş spektrumlu
sefalosporinlerde PBP la ve PBP 2x'e aff inite daha fazladır. Dolayısıyla geniş spektrumlu sefalosporinlerdeki diren ç bu PBP'lerdeki değişimler sonucu olabilmektedir (96). Penisiline dirençli ve duyarlı pnömokoklarda PBP la, PBP 2b ve PBP 2x genlerinin nukleotid dizileri k ıyaslandığında dirençli suş genlerinin mozaik yapı formu oluşturdukları görülmüştür (16,100). PBP'lerle ilgili yapılan deneysel çalışmalar sırasında dirençli suş DNA'larının kullanılarak duyarlı suşlara transforme edilmesi ve duyarlı suşlarda yüksek seviyede direnç oluşturulması, direnç mekanizmaları ile ilgili yeni bir tartışma konusunu gündeme getirmiştir (105). Chalkey ve arkadaşlarının 1990'da yaptığı bir çalışmada taksonomik olarak birbirlerine yakın gruplarda bulunan S. pneumoniae, S. mitior ve S. sanguls su şları arasında dirençli gen aktarımının in vitro ortamda oluşturulabileceği ve yeni kazanılan genlerle birlikte mozaik yap ının teşkil ettiği gösterilmiştir (106). 0luşan transformasyonun işlerlik kazanabilmesi ve mozaik genlere ba ğlı direncin ortaya çıkabilmesi için kazanılan DNA ile alıcı DNA arasındaki dizilim farklılığının % 25-30'un altında olması gerekmektedir. Bu durum da b öyle bir transformasyon sonucu aktarılabilir direncin ancak birbirlerine yak ın türler arasında gerçekleşebileceği fikri ortaya atılmıştır (106,107,97,108). Genetik yapının transferi ile ilgili çalışmaların ardından riskli bölgelerde zamanla kazanılan yüksek seviyeli direncin yayılımı ile ilgili ilk fikirler oluşmaya başlamış ve toplu yaşam birimlerinde bu tip diren ç aktarımının daha kolaylıkla gerçekleşebileceği bildirilmiştir (16,29). Direnç çeşitli şekilde bireyler arasında geçiş yapabilmektedir.
Tablo -2: PBP tipleri ve molekül ağırlıkları
PBP Molekül ağırlığı (Da)
PBP la 98.000 PBP Ib 95.000 PBP2a 81.000 PBP 2b 79.000 PBP 2x 85.000 PBP3 43.000
Penisiline dirençli pnömokokların genetik materyalleri üzerinde yapılan çalışmalar, direncin şu üç yoldan biri yada bir kaçı ile yayılabileceğini ortaya koymuştur (6,109):
1- Direnç genleriyle yayılım: Pnömokoklarla taksonomik ilişkisi bulunan ve penisilin direnci taşıyan S.viridatis gibi bakterilerin DNA'sı duyarlı pnömokoklar tarafından çalınarak yeni DNA materyalindeki direnç genleri ile penisilin direnci kazanılmaktadır. Pnömokoklar bu mutasyonu yeni jenerasyona aktarabilmektedir (110). Taşıyıcılar arasında yüksek oranda direnç gelişimi en sık bu yolla meydana gelmektedir (16).
2- Horizontal yayılım : Mozaik PBP genlerinin duyarlı suşlar arasında aktarımı ve yeni mozaik genler vasıtasıyla direncin yayılımıdır (101,102).
3- Klonal yayılım : Penisiline direnç geliştirmiş pnömokok klonlarının bireyler arasında aktarımıdır. Horizontal ve klonal yay ılım, toplu yaşam birimlerinde yaşayanlarda ve aile içi yakın temasa maruz kalanlarda sıklıkla görülmektedir (111).
Duyarlı suşlara yüksek seviyeli penisilin direncinin in vitro transformasyonu i çin birçok aşamalar gerekebilir (100). Bu aşamalar, direnci donör suşlarındaki DNA'nın zaman içinde duyarlı pnömokok DNA segmentlerine entegre olmalarından kaynaklanmaktadır (100,112). Genetik yapıların bu geçişi alıcı ve donör DNA'larında bir dizi benzer değişikliği gerekli kılar (113).
Genetik transformasyon için gerekli aşamalar kısa bir evre, yada uzun süreli bir evre sonrası da gelişebilir. Direnç gelişimi ile ilgili süreç farklılığı alıcı suşların genetik yapılarındaki farklılıklarından kaynaklanmaktadır (100,114). Klinik izolatlar üzerinde yapılan çalışmalar ve deneysel transformasyonlarda PBP yap ılarında gelişen moleküler düzeydeki farklılıkların, penisilin direncinin farklı seviyeleriyle ilişkili olabileceği gösterilmiştir (100,110).
Beta laktam antibiyotikler PBP'lere spesifik Ri y üzleri ile bağlanır. Her beta laktam için PBP'lerin farklı bağlanma affiniteleri bulunmaktad ır (97, 115). Bu durum sefotaksim, seftizoksim ve seft riakson gibi bazı sefalosporinlerin penisilin dirençli pnömokoklar üzerinde penisilin G'den daha b üyük aktivasyona sahip olma nede nini açıklayabilmektedir (105).