T.C.
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
Prof. Dr. Kaan KAVAKLI
KARDİYAK TRANSPLANTASYON YAPILAN PEDİATRİK
YAŞ GRUBU HASTALARDA MORTALİTE VE
MORBİDİTEYİ ETKİLEYEN FAKTÖRLERİN
RETROSPEKTİF DEĞERLENDİRİLMESİ
UZMANLIK TEZİ
Dr. Nazile HASANOVA
Tez Danışmanı
Prof. Dr. Zülal ÜLGER TUTAR
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANA BİLİM DALI PROF. DR. KAAN KAVAKLI
KARDİYAK TRANSPLANTASYON YAPILAN PEDİATRİK
YAŞ GRUBU HASTALARDA MORTALİTE VE
MORBİDİTEYİ ETKİLEYEN FAKTÖRLERİN
RETROSPEKTİF DEĞERLENDİRİLMESİ
UZMANLIK TEZİ
Dr. Nazile HASANOVA
Tez Danışmanı
Prof. Dr. Zülal ÜLGER TUTAR
ii ÖNSÖZ VE TEŞEKKÜR
Uzmanlık eğitimim boyunca bilgi ve deneyimleri ile eğitimime katkıda bulunan, kliniğimiz Ana Bilim Dalı Başkanı Sayın Prof. Dr. Kaan KAVAKLI başta olmak üzere tüm Çocuk Sağlığı ve Hastalıkları Öğretim Üyelerine,
Ege Üniversitesi Tıp Fakültesinde ilk kez pediatrik yaş grubunda kardiyak transplantasyon işlemlerinin başlatılması ve hastanemizin ülke çapında önemli peditrik kardiyak transplantasyon merkezlerinden biri haline getirilmesinde sonsuz emeği geçen, tez süreci boyunca manevi destek ve bilgi birikimini esirgemeyen çok değerli tez hocam Çocuk Kardiyoloji Öğretim Üyesi Sayın Prof. Dr. Zülal ÜLGER TUTAR’a,
Tez çalışmamın istatistiksel analizlerini gerçekleştiren ve süreç boyunca sabırla desteğini sunan Ege Üniversitesi Tıp Fakültesi Biyoistatistik Ana Bilim Dalı Başkanı Sayın Prof. Dr. Mehmet N. ORMAN’a,
Sürekli yoğun olmalarına rağmen verilere ulaşmamda kalpten destek veren ve bütün sorularıma güleryüzle yanıt veren Sayın hemşire Emine USLU ve tüm Kalp ve Damar Cerrahisi Nakil Birimi Öğretim Üyeleri ve Hemşirelerine,
Her türlü zorluk ve kısıtlılığa rağmen çocukların sağlığı uğruna elinden gelenin en iyisini yapmak için gayret eden tüm Çocuk Sağlığı ve Hastalıkları Ana Bilim Dalı uzman, asistan, hemşire ve personellerine,
Hayatım boyunca her zaman, her koşulda yanımda olan, bana kol kanat geren, eğitim almamı, bu günlere gelmemi sağlayan, herşeyimi borçlu olduğum en büyük destekçim, canım annem Peri HASANOVA’ya
Bu zorlu süreçte desteğini hiç bir zaman eksik etmeyen, göstermiş olduğu sonsuz sabrı ve sevgisiyle hep yanımda olan sevgili eşim Doğa Tuğrul GÜNEŞ’e
Mutluluk kaynağım, hayat enerjim, her şeyim, canım kızım İpek GÜNEŞ’e Teşekkür ve saygılarımı sunarım.
Dr. Nazile HASANOVA İzmir, Temmuz 2019
iii İÇİNDEKİLER
ÖZET ... vii
ABSTRACT ... ix
TABLOLAR LİSTESİ ... xi
ŞEKİLLER LİSTESİ ... xii
KISALTMALAR LİSTESİ ... xiv
1.GİRİŞ VE AMAÇ ... 1 2.GENEL BİLGİLER ... 2 2.1. Kalp Yetmezliği ... 2 2.1.1. Tanım ... 2 2.1.2.Etiyopatogenez ... 2 2.1.3. Epidemiyoloji ... 4
2.1.4. Kalp Yetmezliği Bulguları ... 5
2.1.5. Kalp Yetmezliği Sınıflandırması ... 6
2.1.6. Tanısal Yöntemler ... 8
2.1.7. Tedavi Yöntemleri ... 9
2.1.7.1. Farmakolojik Tedavi... 9
2.1.7.2. Mekanik Destek Tedavileri ... 10
2.2. Kardiyak Transplantasyon ... 12
2.2.1. Kardiyak Transplantasyonun Tarihçesi ... 12
2.2.2. Endikasyon ve Kontrendikasyonlar ... 12
2.2.3. Transplantasyon Öncesi Hasta ve Donör Değerlendirilmesi ... 17
2.2.4. Cerrahi Teknikler ... 20
2.2.5. Donör Kalbine Karşı Oluşan İmmün Yanıt ... 20
2.2.6. İmmünsupresif Tedavi ... 22
iv
2.2.6.2. İdame İmmünsupresif Tedavi ... 23
2.2.7. Kardiyak Transplantasyon Sonrası Gelişen Komplikasyonlar ... 26
2.2.7.1. Graft Disfonksiyonu ... 27
2.2.7.2. Rejeksiyon ... 28
2.2.7.2.1. Endomiyokardiyal Biyopsi ... 29
2.2.7.2.2. Rejeksiyon Derecelendirme Sistemi ... 31
2.2.7.2.3. Rejeksiyon Tedavisi ... 34 2.2.7.3. Enfeksiyon ... 36 2.2.7.3.1. Bakteriyel Enfeksiyonlar ... 37 2.2.7.3.2. Viral Enfeksiyonlar ... 38 2.2.7.3.3. Fungal Enfeksiyonlar ... 40 2.2.7.3.4. Enfeksiyonların Önlenmesi ... 42 2.2.7.4. Ritm Bozuklukları ... 42
2.2.7.5. İlaç Yan Etkileri... 43
2.2.7.6. Malignite ... 45
2.2.7.7. Nörogelişimsel Sorunlar ... 47
2.2.8. Pediatrik Kardiyak Transplantasyon Sonrası Mortalite ve Sağkalım ... 48
3. GEREÇ VE YÖNTEM ... 51
3.1. Etik Kurul Onayı ... 51
3.2. Çalışmaya Alınan Hastaların Değerlendirilmesi ... 51
3.2.1. Demografik ve Antropometrik Verilerin Değerlendirilmesi ... 51
3.2.2. Primer Tanı ve Komorbiditelerin Değerlendirilmesi ... 51
3.2.3. Hastaların Nakil Öncesi Yapılan Anjiografi Verilerinin Değerlendirilmesi . 51 3.2.4. Nakil Öncesi Yapılan Serolojik Tetkiklerin Değerlendirilmesi ... 52
3.2.5. Köprüleme Yöntemi Olarak Mekanik Destek Cihazlarının Kullanımı İle İlgili Verilerin Değerlendirilmesi ... 52
v
3.2.6. Donör İle İlgili Verilerin Değerlendirilmesi ... 52
3.2.7. Transplantasyon Tekniği ve Erken Postop Döneme Ait Verilerin Değerlendirilmesi ... 52
3.2.8. İmmünsupresyon Tedaviye Ait Verilerin Değerlendirilmesi ... 52
3.2.9. Pediatrik Kardiyak Transplantasyon Sonrası Gelişen Komplikasyonlar Ait Verilerin Değerlendirilmesi ... 53
3.2.10. Hastaların Uzun Dönem İzlemine Ait Verilerin Değerlendirilmesi ... 53
3.3. İstatiksel Analiz ... 53
4. BULGULAR ... 55
4.1. Demografik ve Antropometrik Verilerin Değerlendirilmesi... 55
4.2. Primer Tanı ve Komorbiditelere Ait Verilerin Değerlendirilmesi ... 56
4.3. Hastaların Nakil Öncesi Yapılan Kardiyak Kateterizasyon Verilerinin Değerlendirilmesi ... 58
4.4. Nakil Öncesi Yapılan Serolojik Tetkiklerin Değerlendirilmesi ... 58
4.5. Nakil Öncesi Mekanik Destek Cihazlarının Kullanımı İle İlgili Verilerin Değerlendirilmesi ... 59
4.6. Donör İle İlgili Verilerin Değerlendirilmesi ... 60
4.7. Transplantasyon Tekniği ve Erken Postop Döneme Ait Verilerin Değerlendirilmesi ... 60
4.8. İmmünsupresyon Tedaviye Ait Verilerin Değerlendirilmesi ... 62
4.9. Transplantasyon Sonrası Gelişen Komplikasyonlar Ait Verilerin Değerlendirilmesi ... 63
4.9.1. Rejeksiyon ... 63
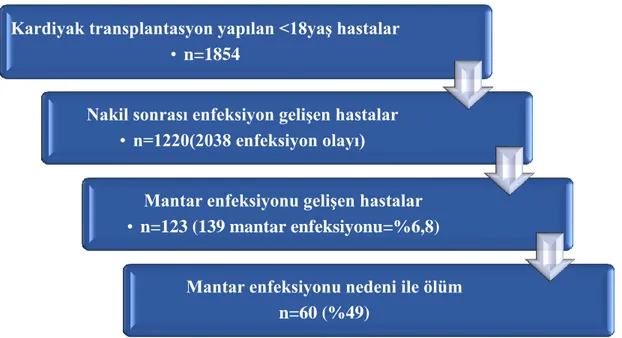
4.9.2. Enfeksiyonlar ... 68
4.9.3. Kapak Disfonksiyonları ... 71
4.9.4. İlaç yan etkileri... 71
4.9.5. Ritm bozuklukları ... 73
vi
4.10. Kardiyak Transplantasyon Sonrası Uzun Dönem İzlem Sonuçları... 75
5.TARTIŞMA ... 77
6.SONUÇLAR ... 87
7. KAYNAKLAR ... 88
8.EKLER EK 1. Etik Kurul Onayı ... 113
EK 2. Olgu Rapor Formu ... 116
EK 3. Bilgilendirilmiş Olur Formu ... 118
vii ÖZET
KARDİYAK TRANSPLANTASYON YAPILAN PEDİATRİK YAŞ GRUBU HASTALARDA MORTALİTE VE MORBİDİTEYİ ETKİLEYEN FAKTÖRLERİN
RETROSPEKTİF DEĞERLENDİRİLMESİ
Amaç: Kalp yetmezliği(KY) sadece erişkin yaş grubu için değil, pediatrik yaş
grubu için de önemli mortalite ve morbidite nedenidir. KY Amerikan Kardiyolojik Koleji Derneği(ACCF)/Amerikan Kalp Derneği(AHA) tarafından 2013 yılında yayınlanan kılavuzda ventriküllerin kanla dolum veya ejeksiyonun her hangi yapısal veya fonksiyonel neden ile bozulmasından kaynaklanan klinik sendrom olarak tanımlanmıştır. Çocuklarda en sık görülen KY nedenleri konjenital kalp hastalığı(KKH) ve kardiyomiyopatilerdir (KMP). Bunun dışında miyokardit, intoksikasyonlar, ritm bozuklukları, intrakardiyak tümörler, sistemik hastalıklar gibi birçok neden KY’e sebep olabilir.
KY tedavisinin esas amacı hastalığın progresyonunu önlemek ve transplantasyon listesine alınan hastaların klinik durumunun stabil tutulmasıdır. Bu amaçla medikal tedavi, mekanik destek tedavi ve kardiyak transplanstayon uygulanmaktadır. Kardiyak transplantasyon, eskiden terminal dönem hastalar için son seçenek tedavi yöntemi olmasına karşın günümüzde medikal tedaviye yanıt alınamayan ağır kalp yetmezliğinde altın standart tedavi yöntemi olarak kabul edilmiştir.
Bu çalışmada kardiyak transplantasyon yapılan pediatrik yaş grubu hastalarda mortalite ve morbiditeyi etkileyen hasta ve donör kaynaklı faktörlerin belirlenmesi ve bu hasta grubunda uzun dönem sonuçların araştırılması amaçlanmıştır.
Gereç ve Yöntem: Ege Üniversitesi Tıp Fakültesi Çocuk Kardiyoloji Bilim Dalı
tarafından takip edilen, Ekim 2007 ile Haziran 2019 tarihleri arasında kardiyak transplantasyon yapılan 22 hasta çalışmaya dahil edimiştir. Hastaların bütün verileri dosya tarama yöntemi kullanılarak retrospektif olarak değerlendirilmiştir.
Bulgular: Dahil edilen 22 hastanın 6’sı(%27,3) kız, 16’sı(%72,7) erkekti. Medyan
transplantasyon yaşı 13,1(min 5,6–maks 17yıl)olarak hesaplandı. Hastaların KY etiyolojilerine bakıldığında, Dilate Kardiyomiyopati(DKMP) en sık neden olarak belirlendi (n=17; %77). Restriktif Kardiyomiyopati(RKMP) (n=2; %9), Aritmojenik Sağ Ventrikül Displazisi(ARVD) (n=2; %9) ve Hipertrofik Kardiyomiyopati(HKMP) (n=1 ; % 5) diğer KY nedenleridir.
viii
Hastaların transplantasyon listesinde medyan bekleme süreleri 9,5(min 0,6–maks 38) ay olarak hesaplandı. Bekleme süresinde 14(%63,6) hastaya mekanik destek cihazları ile kardiyak transplantasyona köprüleme yapılmıştır.
Kardiyak transplantasyon sonrası 12(%54,5) hastada toplam 18 hastane yatışı gerektiren enfeksiyon atağı, 14(%63,6) hastada toplam 23 rejeksiyon atağı, 10(%45,5) hastada ilaç yan etkisi, 5(%23) hastada aritmi görüldü. Kapak onarımı veya değişimi gerektiren kapak disfonksiyonu görülmedi.
Yirmi iki hastadan 4’ü(%18,2) nakil sonrası ilk 6 ay içinde kaybedildi. 1 yıllık, 5 yıllık ve 10 yıllık ağkalım oranları %81,8, %81,8 ve %81,8; Sağkalım süresi ise ortalama 9,85±0,97 yıl olarak hesaplandı. Enfeksiyon, rejeksiyon, aritmi ve ilaç yan etkisi nedeni ile kaybedilen hasta olmadı.
Kardiyak transplantasyondan hemen sonra 4 hasta Erken graft disfonksiyonu(EGD) nedeni ile İntra aortik balon pompa(IABP) desteğine alındı. Bu 4 hastadan 1’inde KY bulguları geriledi; diğer 3 hasta devam eden KY bulguları nedeni ile ekstrakorporeal membran oksijenasyonu(ECMO) desteğine alındı ve 3 hastanın hepsi kaybedildi. Transplantasyon sonrası IABP ve ECMO gereksinimi ile mortalite arasında istatistiksel anlamlı ilişki saptandı (p= 0,013 ve p=0,003).
Sonuç: Kardiyak transplantasyon yapılan pediatrik yaş grubu hastalarda sağkalım
oranı %81,8’dir. EGD dışında mortaliteye sebep olan komplikasyon gelişmemiştir. Rejeksiyon ataklarından sadece 1’i ağır dereceli rejeksiyon idi. İmmünsupresif tedaviye dirençli veya KY gelişmesine sebep olan ciddi rejeksiyon atağı görülmemiştir.
Kalp transplantasyonunun en önemli kısıtlılığı donör sayısının yetersizliğidir. Merkezimizde 2015-2019 yılları arasında kardiyak transplantasyon listesinde beklerken 162 hasta kaybedilmiştir ve bunların 15’i çocuk hastadır. Yine aynı zaman diliminde toplam 5 çocuk hastaya kardiyak transplantasyon yapıldı ve bu 5 hastanın hepsi yaşamına devam etmektedir. Bu da kardiyak transplantasyon bekleyen her 4 çocuktan 1’ine(%25) transplantasyon yapılırken; 3’ünün(%75) kaybedildiğini göstermektedir. Kardiyak transplantasyon, son dönem kalp yetmezliği gelişen hastalarda yaşam kalitesini ve yaşam süresini artıran altın standart tedavi yöntemidir.
Anahtar Kelimeler: Kalp yetmezliği; pediatrik kardiyak transplantasyon;
ix ABSTRACT
DETERMINE RETROSPECTIVELY THE FACTORS AFFECTING MORTALITY AND MORBIDITY IN PEDIATRIC AGE CARDIAC TRANSPLANT
RECIPIENTS.
Aim: Heart failure is important cause of mortality and morbidity not only for
adults, but also for pediatric age group. In the guideline published in 2013 by The American College of Cardiology Foundation(ACCF) and the American Heart Association(AHA), heart failure is described as a complex clinical syndrome that results from any structural or functional impairment of ventricular filling or ejection of blood. The most common causes of the heart failure are congenital heart disease and cardiomyopathies. In addition, many causes such as myocarditis, intoxications, arrhythmias, intracardiac tumors, systemic diseases can cause heart failure.
The main purpose of the heart failure treatment is prevent progression of disease and to keep the patients listed in the heart transplantation list stable. Medical treatment, mechanical support and cardiac tranplantation are used for this purpose. Although cardiac tranplantation is last option for terminal stage heart failure in the past, nowadays this is accepted as the gold standart treatment for severe heart failure unresponsive to treatment.
In this study, we aimed to investigate the recipient and donor releated factors which influence mortality and morbidity and long term outcomes in our pediatric heart transplantation patients.
Material and Methods: Twenty-two patients undergoing cardiac transplantation between October 2007 and June 2019 followed by Ege University Pediatric Cardiology Department were included in the study. All data of the patients were evaluated retrospectively using file scanning method.
Results: Of 22 patients included, 6(27.3%) were female and 16(72.7%) were
male.The median transplantation age was 13.1(min 5.6-max 17) years.When the etiology of heart failure investigated, dilated cardiomyopathy was assessed as the most common cause (n = 17; 77%). Restrictive Cardiomyopathy (RCMP) (n = 2; 9%), Arrhythmogenic Right Ventricular Dysplasia (n = 2; 9%) and Hypertrophic Cardiomyopathy (n = 1; 5%) are other causes of heart failure.
x
Median waiting time in the transplant list was 9.5(min 0.6–max 38) months. During the waiting period, 14(63.6%) patients were bridged to cardiac transplantation with mechanical support devices.
After cardiac transplantation, 12(54.5%) patients had 18 infection attacks requiring hospitalizations, 14(63.6%) patients had a total of 23 rejection attacks, 10(45.5%) patients had drug side effects and 5(23%) patients had arrhythmias. There was no valve dysfunction requiring valve repair or replacement.
Four of 22 patients(18.2%) died in the first 6 months after transplantation. The 1-year, 5-year and 10-year survival rates were 81.8%, 81.8% and 81.8%; The mean survival time was calculated 9.85 ± 0.97 years. No patient died due to infection, rejection, arrhythmia and drug side effects.
Whereupon cardiac transplantation, 4 patients supported with intra-aortic balloon pump due to early graft dysfunction. In one of these 4 patients, heart failure symptoms regressed; The other 3 patients were supported by extracorporeal membrane oxygenation due to ongoing heart failure symptoms and all 3 patients died. There was a statistically significant relationship between IABP and ECMO requirement after transplantation and mortality (p = 0.013 and p = 0.003).
Conclusion: The survival rate in pediatric patients undergoing cardiac
transplantation was 81.8%. There was no complication causing mortality other than EGD. Only one of the rejection attacks was severe rejection. There were no serious rejection attacks that were resistant to immunosuppressive therapy or caused heart failure.
The most important limitation of heart transplantation is the insufficient number of donors. In our center, 162 patients died while waiting on the list of cardiac transplantation between 2015-2019 and 15 of them were children. During the same period 5 pediatric patients underwent cardiac transplantation and all 5 survived. This is shown that 1(25%) of 4 children waiting for cardiac transplantation were transplanted and 3(75%) were died. Cardiac transplantation is the gold standard treatment that increasing of life quality and survival in patients with end-stage heart failure.
xi TABLOLAR LİSTESİ
Tablo 1: KY nedenleri ... 3
Tablo 2: Yaşa göre KY semptom ve bulguları ... 6
Tablo 3: ACCF/AHA KY sınıflandırması ... 6
Tablo 4: EF‘na esaslanan KY sınıflandırması ... 7
Tablo 5: Ross sınıflandırması ... 7
Tablo 6: Modifiye Ross skorlaması ... 8
Tablo 7: Kısa dönem ve uzun dönem için tercih edilebilen VAD ve onların vücut ağırlığı, vücut yüzey alanı uyumluluğu ... 11
Tablo 8: Pediatrik kardiyak transplantasyonun endikasyonları ve önerilmeyen durumlar ... 16
Tablo 9: Pediatrik retransplantasyon endikasyonları ve önerilmediği durumlar. ... 17
Tablo 10: Nakil öncesi hasta değerlendirilmesi ... 18
Tablo 11: GD sınıflandırması ... 27
Tablo 12: Akut hücresel rejeksiyon derecelendirmesi ... 32
Tablo 13: AMR derecelendirmesi ... 33
Tablo 14: KAV derecelendirmesi ... 34
Tablo 15: Anjiografik olarak saptanan lezyonların derecelendirilmesi ... 34
Tablo 16: Kardiyak transplantasyon sonrası sık kullanılan ilaçlar ve yan etkileri ... 44
Tablo 17: 2008 WHO PTLD sınıflandırılması ... 46
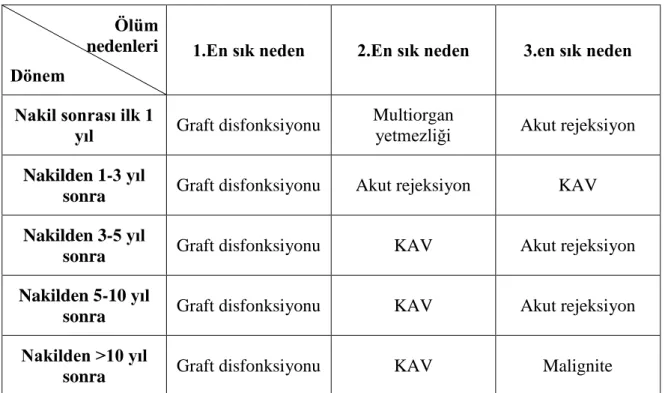
Tablo 18: ISHLT-2015 raporu: Ölümün gerçekleştiği döneme göre en sık mortalite nedenleri. ... 49
Tablo 19: Hastaların demografik ve antropometrik özellikleri ... 56
Tablo 20: Köprüleme yönteminde kullanılan cihazlar ve köprüleme sürelerinin dağılımı ... 59
xii ŞEKİLLER LİSTESİ
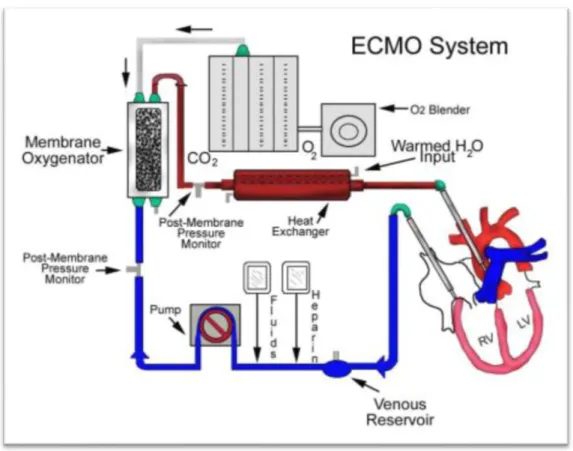
Şekil 1: ECMO.sistemi ... 11
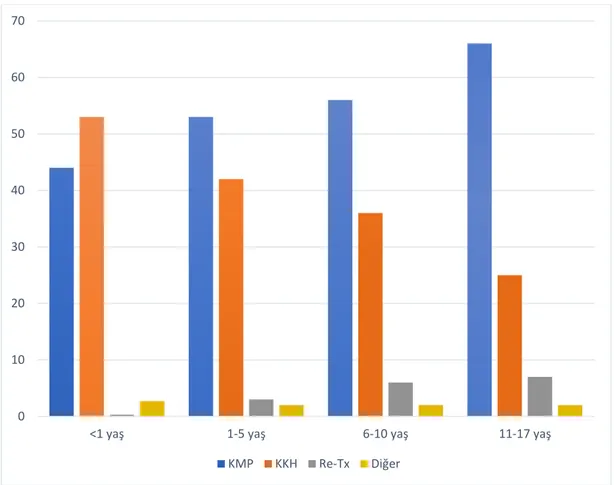
Şekil 2: ISHLT verilerine göre 2004-2014 yıllarında yapılan kardiyak transplantasyon nedenlerinin yaşa göre dağılımı ... 13
Şekil 3: Donör kalbine karşı konakçının immün yanıtı ve immünsupresif ajanların etki mekanizmaları (Kaynak 32) ... 21
Şekil 4: Kardiyak transplantasyon sonrası gelişen enfeksiyonlar ... 37
Şekil 5: PHTS-2010 verilerine göre nakil sonrası gelişen enfeksiyonlar, mantar enfeksiyonları ve ölüm oranları. ... 41
Şekil 6: İnvazif mantar enfeksiyonu etkenlerinin dağılımı ... 41
Şekil 7: ISHLT-2015 raporu: Yaş gruplarına göre ortanca sağkalım yılları ... 49
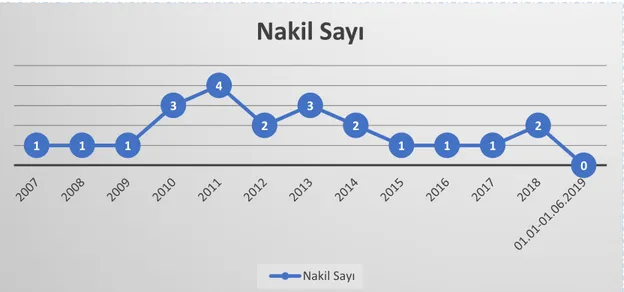
Şekil 8: Nakil sayısının yıllara göre dağılımı ... 55
Şekil 9: Hastaların primer tanı dağılımı ... 57
Şekil 10: Komorbiditelerin dağılımı ... 58
Şekil 11: IABP ve mortalite ilişkisi. ... 61
Şekil 12: ECMO ve mortalite ilşkisi ... 61
Şekil 13: İdame immünsupresyonda kullanılan kombinasyonların dağılımı ... 62
Şekil 14: Donör özellikleri ve rejeksiyon ... 64
Şekil 15: Rejeksiyon atakları ve derecelerinin cinsiyete göre dağılımı ... 65
Şekil 16: Rejeksiyon zamanı klinik, laboratuvar ve EKO bulgularının dağılımı ... 67
Şekil 17: Trasnplantasyon sonrası hastane yatışı gerektiren enfeksiyonların dağılımı ... 68
Şekil 18: CMV enfeksiyonu gelişen ve gelişmeyen hasta gruplarında rejeksiyon atak sayısı dağılımı ... 70
Şekil 19: CMV ve tekrarlayan rejeksiyon atakları ... 70
Şekil 20: Trasnplantasyon sonrası kapak disfonksiyonlarının dağılımı ... 71
xiii Şekil 22: Transplantasyon sonrası gelişen ritm bzoukluklarında kullanılan tedavi
yöntemleri ... 74
xiv KISALTMALAR LİSTESİ
KY : Kalp yetmezliği
ACCF : Amerikan Kardiyolojik Koleji Derneği
AHA : Amerikan Kalp Derneği
KKH : Konjenital kalp hastalığı
MP : Kardiyomiyopati
DKMP : Dilate kardiyomiyopati
RKMP : Restriktif kardiyomiyopati
ARVD : Aritmojenik sağ ventrikül displazisi
HKMP : Hipertrofik kardiyomiyopati
IABP : İntra aortik balon pompa
ECMO : Ekstrakorporeal membran oksijenasyonu
ISHLT : Uluslararası Kalp ve Akciğer Transplantasyonu Derneği
SSS : Sempatik sinir sistemiililitre
RAAS : Renin-anjiotensin-aldesteron sistemi
AT II : Anjiotensin II
ANP : Atriyal natriüretik peptit
BNP : B tipi natriüretik peptit
VSD : Ventriküler septal defekt
PDA : Patent duktus arteriozus
WHO : Dünya Sağlık Örgütü
EF : Ejeksiyon fraksiyonu
HFpEF : EF’nu korunan KY
HFrEF : EF düşüklüğü ile seyreden KY
cm : santimetre
xv EKO : Ekokardiyografi
ACEİ : Anjiotensin dönüştürücü enzim inhibitörleri
BY : Böbrek yetmezliği
İCD : İmplante edilebilir kardiyoverter defibrilatör
CRT : Kardiyak resenkronizasyon tedavisi
VAD : Ventrikül destek cihazı
kg : kilogram
CsA : Siklosporin A
PVR : Pulmoner vasküler direnç
PHT : Pulmoner hipertansiyon
TPG : Traspulmoner gradiyent
HİV : İnsan immün yetmezlik virüsü
KAV : Koroner Arter Vaskülopati
PRA : Panel Reaktif Antikor
HAV : Hepatit A virüsü
HBV : Hepatit B virüsü
HCV : Hepatit C virüsü
EBV : Epstein-Barr virüsü
CMV : Sitomegalovirüs
PGD : Primer Graft Disfonksiyonu
VA : vücut ağırlığı
HLA : İnsan Lökosit Antijeni
APC : antijen sunan hücre
MHC : majör doku uyumu kompleksi
NFAT-Ps : Aktive olmuş T hücrelerin nüklear faktörü – fosforilize formu
xvi IL-2 : İnterlökin 2
m-TOR : memelilerin rapamisin hedefi
CNI : kalsinörin inhibitörleri
ATG : Anti-timosit globülin
mg : miligram
IL-2 Ra : İnterlökin 2 Reseptör antagonisti
m-TORi : m-TOR inhibitörü
DNA : Deoksi-ribonükleik Asid
ml : mililitre
HT : hipertansiyon
FGF : Fibroblast kaynaklı Büyüme Faktörü
PDGF : Trombosit kaynaklı Büyüme F aktörü
VEGF : Vasküler endotelial Büyüme Faktörü EGF : Epidermal Büyüme Faktörü
PTLD : Posttransplantasyon Lenfoproliferatif Hastalık
GFR : Glomerüle filtrasyon hızı
AZA : Azatiopirin
MMF : Mikofenolat mofetil
DM : Diabetes Mellitüs
GD : Graft Disfonksiyonu
SGD : Sekonder Graft Disfonksiyonu
ACR : Akut Hücresel Rejeksiyon
EMB : Endomiyokardiyal biyopsi
AMR : Antikor aracılı rejeksiyon
LVAD : Sol ventrikül destek cihazı
xvii IL-10 : İnterlökin-10
EKO : ekokardiyografi
MRG : Magnetik Rezonans Görüntüleme
MRS : Magnetik Rezonans Spektroskopi
Pro BNP : Pro Beyin Natriüretik Peptit
CK-MB : Kreatinin Kinaz Miyokard tipi
LMCA : Sol Ana Koroner Arter
CA :Koroner Arter
DSA : Donör Spesifik Antijen
TLI : Total Lenfoid Işınlanma
8-MOP : 8-metoksipsoralen
PHTS : Pediatrik Kalp Nakli Çalışma grubu
D+/R- : Donör serolojisi pozitif, alıcı serolojisi negatif
D+/R+ : Donör ve alıcı serolojisi pozitif
D-/R+ : Donör serolojisi negatif, alıcı serolojisi pozitif
D-/R- : Donör ve alıcı serolojisi negatif
CMV-Ig : CMV-İmmünglobulini
EBV-Ig : EBV –İmmünglobulini
VZV : Varicella Zoster Virüsü
VZV-Ig : VZV-İmmünglobulini
SOT : Solid Organ Transplantasyonu
SVT : supraventriküler taşikardi
AV : atriyoventriküler
VT : ventriküler taşikardi
UNOS : Birleşik Organ Paylaşım Ağı
xviii SPSS :Statistical Package for Social Sciences
SD : Standart Sapma
AGTE : Ankara Gelişim Testi
KBY : Kronik böbrek yetmezliği
1 1.GİRİŞ VE AMAÇ
KY anatomik veya fonksiyonel nedenlere bağlı kalbin dokulara oksijen sunumundaki yetersizlik olarak tanımlanmakta olup çocukluk çağının önemli morbidite ve mortalite nedenlerinden biridir. KKH ve KMP en sık KY nedenleridir.
KY tedavisinde farmakolojik ajanlar, mekanik destek cihazları kullanılmaktadır. Son dönem KY için en ideal tedavi yöntemi kardiyak transplantasyondur. Pediatrik kardiyak transplantasyon ilk kez 1964 tarihinde Ebstein anomalisi olan 18 günlük bebeğe Adrian Kontowitz tarafından yapılmıştır. Günümüzde Uluslararası Kalp ve Akciğer Transplantasyonu Derneği’nin(ISHLT) verilerine göre 100’den fazla pediatrik kalp nakli merkezi vardır ve bu merkezlerde her yıl 500’den fazla çocuğa kardiyak transplantasyon yapılmaktadır.
Donör sayısının yetersiz olması, nakil sonrası gelişen graft disfonksiyonu, rejeksiyon, kullanılan immünsupresif tedavilere bağlı enfeksiyon artışı başta olmak üzere farklı ilaç yan etkileri, kardiyak transplantasyonun önemli kısıtlılıklarındandır. Kardiyak transplantasyonun uygulanmaya başladığı yıllardan günümüze kadarki süreç değerlendirildiğinde, zamanla sadece kardiyak transplantasyon sayısında değil sağkalım oranı ve sağkalım süresinde artış, erken graft disfonksiyonu ve tedavi gerektiren rejeksiyon ataklarında ise azalma kaydedilmiştir.
Çalışmada Ege Üniveristesi Tıp Fakültesi Çocuk Kardiyoloji Bilim Dalı tarafından takip edilen 22 pediatrik kardiyak transplantasyon hastasının bilgilerinin retrospektif olarak değerlendirilerek mortalite ve morbiditeyi, transplantasyon başarısını etkileyen hasta ve donör kaynaklı faktörlerin belirlenmesi ve bu hasta grubunda uzun dönem sonuçların araştırılması hedeflenmiştir.
2 2.GENEL BİLGİLER
2.1. Kalp Yetmezliği 2.1.1. Tanım
Sadece erişkin yaş grubu için değil, pediatrik yaş grubu için de önemli mortalite ve morbidite nedeni olan KY ACCF/AHA tarafından 2013 yılında yayınlanan kılavuzda ventriküllerin kanla dolum veya ejeksiyonun herhangi yapısal veya fonksiyonel neden ile bozulmasından kaynaklanan klinik sendrom olarak tanımlanmıştır(1).
2.1.2.Etiyopatogenez
Doğumsal veya edinsel, kalp ile ilişkili ve kalp dışı birçok neden KY ile sonuçlanabilmektedir. Tablo 1’de KY’nin nedenleri özetlenmiştir.
Ortaya çıkma nedenlerinden bağımsız olarak, miyokardın kasılma yeteneğinin bozulması kardiyak outputun düşüşü ile sonuçlanır. Doku perfüzyonu ve arteriyel basıncın korunması için sempatik sinir sistemi(SSS), renin-anjiotensin-aldesteron sistemi(RAAS) gibi kompansatuvar mekanizmalar aktive olur. Sonuç olarak, artmış katekolamin ve anjiotensin II(AT II) kalp atım sayısını ve kontraktiliteyi artırarak ve vazokonstriksiyon yaparak, aldesteron ise su ve sodyum tutulumunu artırarak, azalmış kardiyak outputu artırmaya çalışır. Bu mekanizmalar kısa dönemde geçici olarak dolaşım bozukluğunu kompanse etse de, uzun dönemde KY önlemekte yetersizdir. Vazokonstriksiyon, su-tuz tutulumu nedeniyle afterload artar ve bu da miyokard hipertrofisine, dolayısıyla apaptozun tetiklenmesine sebep olmaktadır. Ayrıca uzun dönemde AT II’nin endotel disfonksiyonunu ve miyokard fibrozisini tetiklemesi de KY ilerlemesine sebep olmaktadır. Diğer yandan, bütün bu kardiyotoksik etkileri önlemeye yönelik atriyal natriuretik peptit(ANP), B tipi natriuretik peptit(BNP), bradikinin gibi peptitler vazodilatasyon, diuretik ve natriuretik etki gösterir. Neprylisin enzimi tarafından hızla yıkıldığı için ANP, BNP uzun dönemde KY progresyonunu önleyememektedir(2),(3).
3 Tablo 1: KY nedenleri
Yapısal olarak normal kalpte görülen nedenler KKH Kardiyak nedenler: Primer KMP Miyokardit Aritmiler Miyokard enfaktüsü
Volüm yükünü artıran nedenler: Ventriküler septal defekt Patent duktus arteriozus Valvuler regurjitasyon Basınç yükünü artıran nedenler: Mitral stenoz Pulmoner stenoz Aort stenozu Aortik koarktasyon Non-kardiyak nedenler: Sepsis Anemi Toksikasyon Hipotiroidi Tirotoksikoz Sistemik hastalıklar Kompleks KKH: Hipoplastik sol kalp
Büyük arter transpozisyonu
Çocuklarda en sık görülen KY nedeni KKH ve KMP’dir(4).
Her 1000 canlı doğumdan 8’inde KKH görülmektedir(5) (6). Her KKH, KY sebebi değildir. Ventriküler septal defekt(VSD), patent duktus arteriozus(PA), valvuler regurjitasyon, volüm artışı nedeni ile kalbin önyükünü artırarak KY sebep olabilir. Mitral stenoz, pulmoner stenoz, aortik stenoz, aort koarktasyonu ise basınç artışı nedeni ile sonyükü artırarak KY sebep olmaktadır. Hipoplastik sol kalp, büyük arter transpozisyonu gibi kompleks KKH da önemli KY nedenlerindendir.
KMP koroner arter hastalığı, hipertansiyon, Kawaaski hastalığı, KKH, kapak disfonksiyonu, perikardiyal efüzyon, miyokardit gibi KY nedenleri olmaksızın kalp kasını etkileyen heterojen hastalıklar grubudur. KMP insidansı 0,8-1,3/100000 olup yapısal normal kalpte görülen en sık çocukluk çağı KY ve kardiyak transplantasyon nedenidir(5),(6),(7).
Dünya Sağlık Örgütü(WHO)WHO ve Uluslararası Kardiyoloji Federasyonunun sınıflandırmasına göre 5tip KMP vardır: dilate(DKMP), restriktif(RKMP), hipertrofik(HKMP), aritmojenik sağ ventrikül displazisi(ARVD) ve sınıflandırılamayan. Endomiyokardiyel fibroelastoz ve non –compaction KMP sınıflandırılamayan tipe aittir. En sık tipi olan DKMP, sarkomerik protein mutasyonu, mitokondriyel sitopatiler gibi
4
ailesel nedenlerden veya edinsel (ilaç intoksikasyonu, miyokardit, nutrisyonel nedenler ve s.) olabilir. HKMP, RKMP daha az sıklıkta görülmekle birlikte ani ölüm ve atriyal fibrillasyonun sıklıklagörüldüğü KMP çeşitleridir(8).
Miyokardit, sıklıkla viral enfeksiyon, nadiren de non-enfeksiyöz nedenlerle gelişen miyokard dokusunun enflamasyonudur. Coxackie A/B, Echovirus, Adenovirüsen en sık miyokardit etkenleridir. Hastalık çoğu zaman iyileşme ile sonuçlanırken bazı hastalarda KY gelişebilmektir.
Ventriküler, supraventriküler aritmiler, atriyoventriluker blok ve ekstra vurular miyokardın senkron kasılmasını bozarak, ventriküllerin kanla dolum ve ejeksiyon sürelerini etkileyerek KY’ne neden olabilmektedir.
Miyokard enfarktüsü çocukluk çağında ateroskleroza bağlı ender görülür. Koroner arter çıkış anomalisi(ALCAPA gibi), koroner arteri tutan vaskulite neden olan Kawasaki hastalığı miyokard enfarktüsü sebebi olabilir(8).
Sepsis, anemi, kardiyotoksik etkenler, sistemik hastalıklar da KY ile sonuçlanabilir. Toksik etkenlerden, özellikle kanser hastalarının tedasinde kullanılan antrasiklin grubu ilaçlara bağlı KY geliştiği bilimektedir(9). Glikojen depo hastalıkları, lizozomal depo hastalıkları, sistemik lupus eritematozus gibi sistemik hastalıklar da KY ile sonuçlana bilir(8).
2.1.3. Epidemiyoloji
Pediatrik KY’nin dünyadaki insidansı ve prevelansı ile ilgili yeterli veri yoktur. KY nedeni ile hastane yatışı yapılan hastaların yıldan yıla artması her geçen yıl hastalık insidansının arttığını göstermektedir. Şöyle ki, 1997-2006 yılları arasında ABD’de KY nedeni ile hastane yatışı yapılan pediatrik yaş grubu hastalar araştırılmıştır. 1997 yılında KY nedeni ile 11000 hasta hospitalize edilirken 2006 yılında bu rakam 14000’e kadar yükselmiştir. Bunu dışında hospitalize edilen hastalarda %7,3 gibi yüksek mortalite oranı saptanmıştır(10). AHA tahminlerine göre 2030 yılında ABD’de KY tanılı hasta sayısının 8 milyona ulaşacağı (yani her 33 kişiden biri) ve bu hastaların tedavi masraflarının yaklaşık 160 milyar dolar olacağı öngörülmektedir(11) .
Hastalığın insidans ve prevelansı ülkeden ülkeye değişmektedir. Şöyle ki, İrlanda ve Birleşik Krallıkda yıllık KY insidansı 0,87/100000 iken Taiwanda 7,4/100000, yani 8,5
5
kat daha fazla olduğu çalışmalarca belirtilmiştir. Büyük hasta grubunda sadece bir prevelans çalışması mevcuttur; bu çalışmada, İspanyada KY prevelansının 83,3/10000 olduğu gösterilmiştir. Sadece KY değil, KY sebepleri de ülkeden ülkeye değişmektedir. WHO 2009 yılı raporuna göre KYîn dünya genelinde en sık nedenleri KKH ve KMP iken düşük gelirli ülkelerde sıtma ve malnütrisyona bağlı ciddi anemi ön plandadır. KY Norveçte %8, Nijeryada ise %82,2 KKH nedeni ile gelişmekte. Japonyada %36,1, ABD’de %79 KY nedeni KMP’dir(12),(13).
2.1.4. Kalp Yetmezliği Bulguları
KY bulgu ve semptomları hastalığın evresi, ejeksiyon fraksiyonu(EF) düşüşü veya korunması durumu, sağ veya sol ventrikülün etkilenmesi, sistolik veya diyastolik fonksiyon bozukluğunun daha belirgin olması, hastanın yaşı gibi birçok faktöre bağlı olarak değişmektedir. 2013 yılında Kanada Kardiyovasküler Derneğinin yayınladığı kılavuzda en sık görülen bulgu ve semptomların hasta yaşına göre farklı olduğu belirtilmiştir (Tablo 2). KY semptomları olarak 0-2 yaş infant ve oyun çocuklarında en sık >20dk süren beslenme, beslenme sırasında takipne, terleme, büyüme geriliği gibi beslenme sorunları görülürken büyük çocuklarda halsizlik, efor intoleransı, dispne daha sık görülmektedir(14).
Hastalığın seyrinde dekompansasyon sonucu konjesyon veya perfüzyon bozukluğunun gelişmesi hastalarda farklı bulgu ve semptomlar oluşturur. Perfüzyon bozukluğuna bağlı hipotansiyon, taşikardi, daralmış nabız basıncı, soğuk ekstremiteler, bilinç değişikliği görülürken, konjesyon gelişen hastalarda hepatomegali, asit, yüz ve ekstremitelerde ödem, akciğer ödemine bağlı dispne, ortopne, takipne görülür(14).
6 Tablo 2: Yaşa göre KY semptom ve bulguları
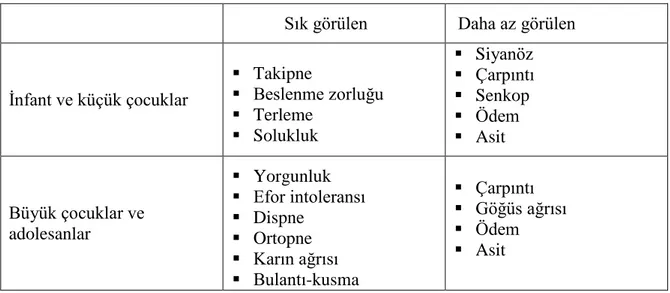
Sık görülen Daha az görülen
İnfant ve küçük çocuklar Takipne Beslenme zorluğu Terleme Solukluk Siyanöz Çarpıntı Senkop Ödem Asit Büyük çocuklar ve adolesanlar Yorgunluk Efor intoleransı Dispne Ortopne Karın ağrısı Bulantı-kusma Çarpıntı Göğüs ağrısı Ödem Asit
2.1.5. Kalp Yetmezliği Sınıflandırması
KY için farklı sınıflandırmalar bulunmaktadır. ACCF/AHA tarafından hastalığın evresi ve progresyonu esas alınarak sınıflandırma geliştirilmiştir (Tablo3). New York Kalp Derneği(NYHA) egzersiz kapasitesi ve hastaların semptomatik durumunu esas alan sınıflandırma sistemi pediatrik yaş grubu için uygun değildir(1) .
KY her zaman EF düşüklüğü ile seyretmez. Bu nedenle, ACCF/AHA EF korunan (HFpEF) ve EF düşüklüğü ile seyreden (HFrEF) olarak KY sınıflandırlmasını da önermiştir (Tablo4) (1).
Tablo 3: ACCF/AHA KY sınıflandırması
Evre Tanımı
A Yapısal kalp hastalığı ve KY semptomu olmayan,KY için yüksek riskli hastalar
B Yapısal kalp hastalığı olup KY semptomu olmayan hastalar C Semptomatik hastalar
7 Tablo 4: EF‘na esaslanan KY sınıflandırması
HFrEF ≤%40 Sistolik HF
HFpEF ≥%50 Diastolik HF
HFpEF %41-49 Ara sınıf
HFpEF >%40 HFrEF sınıfında olup iyileşme sonucu EF yükselen hastalar
Pediatrik yaş grubu için ilk sınıflandırma 1992 yılında Ross tarafından oluşturulmuştur (Tablo 5) (15). Ross sınıflandırması infant ve küçük çocuklar için uygun olup, Laer ve ark. tarafından modifiye edilerek daha büyük çocuklarda da uygulanabilen, yaşa göre skorlama sistemi geliştirilmiştir. (Tablo 6) (16) .
Tablo 5: Ross sınıflandırması
Sınıf Tanımı
Sınıf I Asemptomatik
Sınıf II Büyüme geriliği olmadan infantlarda beslenme sırasında terleme veya hafif
takipne, daha büyük çocuklarda efor sırasında dispne
Sınıf III
Büyüme geriliğinin eşlik ettiği infantlarda beslenme sırasında belirgin terleme ve takipne, beslenme süresinin uzaması, daha büyük çocuklarda efor sırasında belirgin dispne
Sınıf IV Dinlenme halinde takipne, terleme, dispne, inleme, çekilme
8 Tablo 6: Modifiye Ross skorlaması
Modifiye ROSSSkorlaması
0 1 2
Terleme Sadece başta Aktifken baş ve vücutta
Dinlenmede baş ve vücutta
Takipne Nadir Bazen Sıklıkla
Efor sırasında solunum hızı (dk) 0-1 yaş 1-6 yaş 7-10 yaş 11-14 yaş <50 <35 <25 <18 50-60 35-45 25-35 18-28 >60 >45 >35 >28 Kalp hızı (dk) 0-1 yaş 1-6 yaş 7-10 yaş 11-14 yaş <160 <105 <90 <80 160-170 105-115 90-100 80-90 >170 >115 >100 >90 Hepatomegali <2 cm 2-3 cm >3 cm dk: dakika
0-2:KY yok ml 3-6:Hafif KY 7-9:Orta KY 9-12:Ağır KY
2.1.6. Tanısal Yöntemler
KY tanısı öykü, fizik muayene, laboratuar tetkikler ve görüntüleme yöntemleri ile konur. Ekokardiyografi(EKO) KY tanısı ve hasta izleminde sık kullanılan non-invazif görüntüleme yöntemidir. EKO ile kalp boşluklarının hacmi, duvar kalınlığı, EF ölçümü yapılabilir, anatomik bozukluklar saptanabilir. Bunun dışında kardiyak magnetik rezonans ve bilgisayarlı tomografi, kardiyak kateterizasyon yöntemleri ile de kalbin kompleks yapısal anomalileri saptanabilir. Elektrokardiyogram(EKG) aritmi ilişkili KY tanısı ve KY’ne sekonder gelişen ritm bozukluklarının saptanması amacı ile sık kullanılmaktadır. KY neden olabilecek ağır anemi, tirotoksikoz veya ciddi hipotiroidi, elektrolit denkesizliği gibi nedenlerin saptanması ve aynı zamanda KY’ne bağlı gelişen organ tutulumlarının saptanması (karaciğer yetmezliği, böbrek yetmezliği gibi) saptanması amacı ile laboratuar
9
tetkikler yapılmalıdır. BNP düzeyi tanısal amaçlı değil, genellikle hastalığın şiddeti, tedaviye yanıtının değerlendirilmesi için izlemde kullanılır(3),(17).
2.1.7. Tedavi Yöntemleri
KY tedavisinin esas amacı hastalığın progresyonunu önlemek ve nakil listesinde olan hastaların klinik durumunun stabil tutulmasıdır(4). Bu amaçla medikal tedavi, mekanik destek tedavi ve son dönem KY için altın standart olan kardiyak transplanstayon uygulanmaktadır.
2.1.7.1. Farmakolojik Tedavi
ISHLT tarafından yayınlanan 2014 kılavuzunda HFrEF ve HFpEF grubu için farklı tedavi yaklaşımları belirtlimiştir. HFrEF grubundan farklı olarak HFpEF grubu hastalara rutin anjiotensin dönüştürücü enzim inhibitörleri(ACEİ), diuretik kullanımı önerilmemektedir, sadece HT gelişen hastalara başlanması gerekmektedir. Yine bu gruptaki hastalara pozitif inotrop tedavi endikasyonu yoktur. HFrEF grubundaki hastaların tedavisinde ACCF/AHA evrelemsine göre B sınıf asemptomatik hastalara progresyonu önlemek amaçlı rutin olarak ACEİ ve β-blokör kullanımı önerilmektedir. Her iki grup ilaç, KY progresyonuna sebep olan RAAS ve SSS etkilerini bloke ettiği için dolayısıyla miyokard hipertrofisi, apoptozu ve fibrozisi önlemektedir. Mortalite ve morbidite açısından pozitif etkileri çalışmalarca kanıtlanmıştır. C evresinde olan hastaların medikal tedavisinde ACEİ, β-blokör dışında digoksin, diuretikler, aldesteron antogonisti kullanılmaktatdır. Digoksin C ve D evresindeki hastalarda, dar terapötik aralığa ve ileti kusurları gibi ciddi yan etkilere sahip olduğu için ilaç kan düzeyi 0,5-0,9ng/ml tutulacak şekilde kullanılmalıdır, renal yolla atıldığı için böbrek yetmezliği(BY) gelişen hastalarda dikkatli olunmalıdır. Diuretikler sadece volüm yükü olan hastalara başlanmalıdır, rutin kullanımı önerilmemektedir. Aldestron antogonisti olan sprinolakton, diuretik etki ile birlikte aldesteronun indüklediği miyokard fibrozisini de önleme etkisine sahiptir; Hiponatremi, hiperkalemi ve BY gelişen hastalarda dikkatli olunmalıdır. Anjiotensin reseptör antogonistleri, sadece ACEİ tedavisinin fayda ettiği, yan etki nedeni ile tolere edilmemesi durumunda tercih edilebilir. Antiaritmik tedavi bütün KY tanılı hastalara değil, ileti defektinin eşlik ettiği durumlarda endikedir. Aynı şekilde, antikoagulan tedavinin rutin kullanımı da önerilmemektedir. İntrakardiyak trombüsü olan hastalara, trombüs öyküsü
10
olup EF<%25 olan hastalara, atriyal fibrillasyon, atriyal flutter gelişen hastalara antikoagulan tedavi olarak Warfarin veya heparin başlanmalıdır. Adrenalin, noradrenalin, dopamin, dobutamin gibi pozitif inotropik ajanlar hipotansiyon gelişen, perfüzyon bozukluğu bulgulatı saptanan dekompanse hastalarda kullanılmaktadır; Palyatif tedavidir, uzun dönem kullanıma uygun değildir(3),(12),(17).
2.1.7.2. Mekanik Destek Tedavileri
İmplante edilebilir kardiyoverter defibrilatör(İCD), kardiyak resenkronizasyon tedavisi(CRT), ECMO ve ventrikul destek cihazı(VAD) medikal tedaviye dirençli KY gelişen hastalarda kullanılan mekanik destek cihazlarıdır. Mekanik destek tedavisi transplantasyona kadarki köprüleme tedavisini oluşturmaktadır.
İCD ve CRT artiminin neden olduğu KY veya KY zemininde gelişen yaşamı tehdit eden, medikal tedaviye dirençli ritim bozukluklarının tevavisinde kullanılabilir. Ayrıca, ailede ani kardiyak ölümün eşilk ettiği KMP öyküsü olan hastalarda, açıklanamayan senkop gelişen KY tanılı hastalarda, kardiyak arrest gelişip kurtarılan KY tanılı hastalarda İCD veya CRT düşünülmelidir(3),(17).
Kardiyojenik şok veya arrest gelişen KY hastalarının acil kardiyovasküler desteği ECMO ile sağlanmaktadır(17). ECMO aracı ile venöz kan akciğerlere uğramadan oksijenasyon sisteminden geçerek gaz değişimini gerçekleştirdikten sonra yine kalbe uğramadan sistemik dolaşıma pompalanır. Böylece, kalp ve akciğer dinlenmeye alınarak dolaşım desteği sağlanmış olur. Mortalite ve komplikasyon oranı çok yüksek olan tedavi yöntemidir.
Diğer medikal tedavilere rağmen ≥1 inotropik ajan kullanımı gerektiren, hastaneden taburcu edilemeyen, organ tutulumun eşlik ettiği sınıf III ve sınıf IV KY hastalarına VAD implantasyon endikasyonu vardır. Sağ ventrikul, sol ventrikul veya her iki ventrikulu destekleyen, kalıcı veya geçici kullanıma uygun farklı VAD’lar bulunmaktadır. Hastanın vücut ağırlığı ve vücut yüzey alanına uygun cihaz seçimi yapılmaktadır (Tablo 7) (3).
11 Tablo 7: Kısa dönem ve uzun dönem için tercih edilebilen VAD ve onların vücut ağırlığı,
vücut yüzey alanı uyumluluğu
Kısa dönem kullanım için VAD Uzun dönem kullanım için VAD
Pedimag: 3,5-10 kg Centrimag: >10kg İmpella: >40kg
Berlin HE: >5kg veya 0,7m2 HeartWare: 0,7-1,4m2
HeartWare veya HeartMate: ≥1,5m2
kg: kilogram
VAD hem transplantasyona kadarki dönemde köprüleme yöntemi olarak hem de nakil için kontrendikasyonu olan hastalarda kurtarma tedavisi olarak kullanılmaktadır. ECMO ile kıyaslandığında daha az antikoagulasyon gereksinimi, daha az sıklıkta tromboz veya kanama olaylarının gelişmesi, hastaların mobilize olup taburcu edilebilmesi açısından VAD daha avantajlıdır ve köprüleme tedavisi için daha uygundur(3).
12 2.2. Kardiyak Transplantasyon
2.2.1. Kardiyak Transplantasyonun Tarihçesi
Günümüzde son dönem kalp yetmezliğinde altın standart tedavi yöntemi olan kardiyak transplantasyon ilk olarak Alexis correl ve Charles Guthrie taradından 1905’te Chicago Üniversitesinde köpekler üzerinde yapılmış; Yıllarca kardiyak transplantasyon sadece hayvan deneylerinde uygulanarak cerrahi teknikler geliştirilmiştir. 1930 yılında Mayo klinikte hayvan deneyleri yaparken Frank Mann ilk kez allograft rejeksiyonu fark ederek tanımlamaya çalışmıştır(18).
Klinikte kardiyak transplantasyon ilk kez Hardy ve ark. tarafından 23 ocak 1964 yılında yapılmış ve ksenogreft olarak şempanze kalbi kullanılmıştır. Hasta transplantasyon sonrası sadece 18 saat yaşamıştır. İnsanlararası ilk nakil ise 3 aralık 1964 yılında Güney Afrikada yapılmış, Christian Barnardın son dönem iskemik kardiyomiyopati tanılı 54 yaşında kadın hastaya yaptığı kardiyak transplantasyon sonrası 18.günde hasta pnömoni nedeni ile eksitus olmuştur. 3 gün sonra, 6 aralık 1964 tarihinde Adrian Kontowitz, Ebstein anomalisi olan 18 günlük bebeğe ilk pediatrik kardiyak transplantasyonu yapmıştır(19).
Türkiyede ise ilk kardiyak transplantasyon Ankara’da, Türkiye Yüksek İhtisas Eğitim ve Araştırma Hastanesi’nde Kemal Beyazıt tarafından 1968 senesinde yapılmıştır, Hasta nakilden 18 saat sonra exitus olmuştur. Türkiyede ilk başarılı pediatrik kardiyak transplantasyonu ise 2001 yılında Özdoğan ve ark. tarafından 8 yaşındaki hastaya yapılmıştır(20),(21),(22).
Hastaların çoğu erken postoperatif dönemde rejeksiyon nedeni ile kaybediliyordu. Bu yüzden 1970’li yıllarda sadece kardiyak transplantasyon açısından değil, genel olarak organ nakilleri açısından duraksama dönemi olmuştur. 1968 yılında 17 ülke, 52 merkezde toplam 10, 1969 yılında 50, 1970 yılında ise 18 kardiyak transplantasyon yapılmıştır. Güçlü immünsupresif ajan olan Siklosporin A’nın bulunması ve 1980’li yıllarda klinik kullanıma girmesi ile birlikte nakil sayısında tekrar artış olmuştur.
2.2.2. Endikasyon ve Kontrendikasyonlar
24.Bethesta konfransına konu olan kardiyak transplansyon endikasyon ve kontrendikasyonları yayınlandığı 1993 yılından sonra birkaç kez değiştirilmiştir. Değişimin esas nedeni kompleks kardiyopatilerin cerrahi onarım yöntemlerinin gelişimidir.
13
Kardiyak transplantasyonun uygulanmaya başladığı ilk yıllardan farklı olarak günümüzde KKH tedavisinde ilk seçenek kardiyak transplantasyon değil, cerrahi düzeltmedir. Buna rağmen KKH jardiyak transplantasyonun önemli nedeni olmaya devam etmektedir. Yaşa göre değişmekle beraber en sık kardiyak transplantasyon nedeni KMP, ikinci en sık nedeni ise KKH’dır. 0-1yaş grubunda ise KKH en sık kalp nakli nedenidir(23),(24).
Şekil 2: ISHLT verilerine göre 2004-2014 yıllarında yapılan kardiyak transplantasyon
nedenlerinin yaşa göre dağılımı
24. Bethesta konfransında maksimum medikal tedaviye rağmen son dönem KY bulgularının varlığı kardiyak transplantasyon endikasyonu olarak kabul edilmiştir. Bunun dışında tedaviye dirençli yaşamı tehdit eden aritmiler, ameliyatla çıkarılamayan primer kardiyak tümörler, kardiyak patoloji ile ilişkili olan büyüme geriliği, KKH onarımı sonrası
0 10 20 30 40 50 60 70
<1 yaş 1-5 yaş 6-10 yaş 11-17 yaş
14
gelişen ventrikuler disfonksiyonunun da kardiyak transplantasyon endikasyonu olabileceği bildirilmiş. Konfransta aynı zamanda kardiyak transplantasyon için kontrendike durumlar da belirtilmiştir(25):
Nakil sonrası prognozu negatif etkileyecek sistemik hastalıklar Geridönüşümsüz parenkimal akciğer hastalığı
Geridönüşümsüz böbrek yetmezliği Geridönüşümsüz karaciğer yetmezliği Serebrovasküler olay
Uç organ tutulumunun eşlik ettiği insulin bağımlı DM Aktif enfeksiyon
Eşlik eden neoplazi
Geridönüşümsüz pulmoner vasküler direnç(PVR) yüksekliği (>6wood veya vazodilatatör tedavi sonrası >3 Wood)
Akut pulmoner emboli veya enfarktüs Ağır obezite
Ağır osteoporoz Divertikulit Aktif peptik ülser Madde bağımlılığı Psikiyatrik hastalıklar
En son 2007 yılında KKH, KMP ve replantasyon açısından pediatrik kardiyak transplantayson endikasyonları AHA alt komisyon üyeleri tarafından gözden geçirilerek yenilenmiştir. Pediatrik kardiyak transplantasyon ile ilgili randomize kontrollü çalışma eksikliği nedeni ile endikasyonların belirlenmesinde randomize olmayan çalışmalar kanıt düzeyi B, uzman fikir birliği ise kanıt düzeyi C olarak kabul edilmiştir. Kılavuzda transplantasyonun etkinliği ile ilgili kanıtlar dikkate alınarak transplantasyonun önerildiği ve önerilmediği durumlar Sınıf I, SınıfII ve Sınıf III olarak gruplandırılmıştır:
Sınıf I: kardiyak transplantasyonun faydalı ve etkili olduğuna dair kanıtların bulunduğu durumlar.
Sınıf II: kardiyak transplantasyonun yararlılığı / etkinliği hakkında çelişkili kanıtlar veya görüş ayrılığı olduğu durumlar.
15
Sınıf IIA: ağırlıklı olarak kardiyak tranplantasyonun etkili olacağına dair kanıtlar mevcut.
Sınıf IIB: kardiyak transplantasyonun etkili olacağına dair az sayıda kanıt mevcut.
Sınıf III: kardiyak tranplantasyonun etkili olmayacağına dair kanıtların bulunduğu durumlar(26).
Tablo 8’de transplantasyon, Tablo 9’da retransplantasyon endikasyonları ve önerilmeyen durumlar gösterilmiştir.
16 Tablo 8: Pediatrik kardiyak transplantasyonun endikasyonları ve önerilmeyen durumlar
Sınıf I
Evre D KY
Fiziki aktivitenin ciddi kısıtanmasına sebep olan evre C KY(ölçülebiliyorsa maksimum oksijen tüketiminin(max VO2)<%50 saptanması)
Büyüme geriliğine sebep olan evre C KY
İlaç veya implante edilebilen defibrillatör ile tedavi edilemeyen, yaşamı tehdit eden aritmilere sebep olan evre C KY
Rekatif pulmoner hipertansiyonun(PHT) eşlik ettiği RKMP nedenli evre C KY
PVR>6Wood/m2, transpulmoner gradiyent(TPG)>15 mm Hg saptanan ve pulmoner vazodilatatörler veya inotropik ajanlar ile PVR, TPG değerlerinde düşüş
gözlemlenen (PVR<6Wood/m2 ve TPG<15 mm Hg) hastalarda diğer nakil endikasyonlarının varlığı durumunda nakil yapılabilir
Sınıf IIA
Reaktif PHT eşlik ettiği ve ilerde kardiyak transplantasyona engel olabilecek geridönüşümsüz PVR gelişim riski yüksek olan evre C KY
Daha önce KKH onarım ameliyatı yapılan evre C KY hastalarında ventrikul disfonksiyonu olmadan bazı anatomik veya fizyolojik koşulların mevcutluğu:
1) PHT veya ilerde kardiyak transplantasyona engel olabilecek geridönüşümsüz PVR gelişim riski
2) Cerrahi düzeltmenin mümkün olmadığı ağır atriyoventriküler veya aort kapak yetmezliği, siyanoz
3) Cerrahi tedaviye rağmen persiste eden protein kaybettiren enteropati
Fonksiyonel tek ventrikullu infantalarda durumu zorlaştıran bazı anatomik veya fizyolojik koşulların mevcutluğu:
1) Proksimal koroner arterlerin ağır stenozu veya atrezisi 2) Ağır ventriküler disfonksiyon
3) Atrioventrikuler(AV) veya semiluner kapakçıkların yetmezliği veya darlığı
Sınıf IIB
Geçirilmiş hepatit B, hepatit C ve insan immün yetmezlik virüsü(HİV) enfeksiyonu Alkol veya uyuşturucu bağımlığı
Psikolojik bozukluklar, dokumente edilmiş tedaviye uyumsuzluk hali Ailenin psikososyal durumunun nakil sonrası süreç için uygun olmaması
Sınıf III
Diğer organ veya sistemlerin geridönüşümsüz hastalıkları Geri dönüşümsüz ağır PVR
17 Tablo 9: Pediatrik retransplantasyon endikasyonları ve önerilmediği durumlar.
Sınıf I Ventrikuler disfonksiyon ve en azından orta ağırlıklı koroner arter vaskülopati(KAV) birlikteliği
Sınıf IIA Normal ventrikuler fonksiyon ve en azından orta ağırlıklı KAV birlikteliği
Sınıf III
KAV mevcut olsa bile akut rejeksiyon atağı sırasında retransplantasyon önerilmemektetdir
İlk nakli takip eden 6 ay içinde retransplantasyon yapılması önerilmemektedir.
2.2.3. Transplantasyon Öncesi Hasta ve Donör Değerlendirilmesi
KY tanılı hastanın nakil adaylığına karar vermeden önce endikasyonun belirlenmesi, kontrendike durumların, eşlik eden hastalıkların, hasta ve ailenin psikososyal durumunun transplantasyon için uygunluğunun saptanması amacıyla nakil öncesinde detaylı değerlendirme yapılmalıdır. Bu değerlendirme öykü, fizik muayene, laboratuar tetkikleri, görüntüleme yöntemleri, diş hekimi, psikiatri uzmanı ve sosyal hizmetler uzmanının görüşü ve gereğinde genetik tahlilleri kapsar (Tablo 10). Değerlendirme sonucuna göre hastanın aşılanma durumuna göre yaşına uygun eksik aşılar yapılmalıdır. Transplantasyon listesine alınan hastalar yıllık olarak tekrar değerlendirilir, nakil ihtiyacının devam etmesi veya nakil listesinden çıkarılmasına karar verilir(25),(27).
18 Tablo 10: Nakil öncesi hasta değerlendirilmesi
Genel bilgiler
Detaylı öykü
Kapsamlı fizik muayene Tam kan sayımı
Kan biyokimya tetkiki(karaciğer ve böbrek fonksiyonları, elektrolitler, kan lipit profili)
Koagulasyon parametreleri(PZ, APTZ, İNR)
Tam idrar tahlili, 24 saatlik idrarda protein atılımı ve kreatinin klirensi
Solunum fonksiyon testi Gaitada gizli kan tespiti
Konsultasyonlar
Psikiyatri uzmanı Diş hekimi
Sosyal hizmetler uzmanı
Kardiyovaskuler sistem bilgileri
EKG EKO
Göğüs grafisi
Sağ kalp kateterizasyonu
Egzersiz testi ile oksjen tüketiminin(pik VO2) ölçümü Sol kalp kateterizasyonu*
Miyokard biyopsisi*
Kardiyak MR/MR ssintigrafi*
İmmunolojik bilgiler
Kan grubu tayini HLA tiplendirme
Panel reaktif antikor(PRA) tarama
Enfeksiyon ve aşılanma durumuna ait bilgiler
Hepatit A(HAV),hepatit B(HBV) ve hepatit C(HCV) serolojisi HİV serolojisi
Epstein-Barr virüsü(EBV) serolojisi Sitomegalovirüs(CMV) serolojisi
Herpes virüs, suçiçeği, kızamık, kızamıkçık seroljisi Toxoplasma seroljisi
Lyme serolojisi*
İdrar kültürü ve antibiyogramı Boğaz kültürü ve antibiyogramı Gaita parazit bakısı*
*Sadece gerekli hasta grubunda
Donör kalbinin nakle uygunluğunun ve donör-alıcı uyumunun belirlenmesi amaçlı değerlendirilen donör özellikleri:
19
Donör yaşı: ileri donör yaşının primer graft disfonksiyonu(PGD) (özellikle nakil sonrası ilk 30 gün içinde gelişen erken graft disfonksiyonu), 5 ve 15 yıllık sağkalım için risk faktörü olduğu kanıtlanmıştır.
Donör vücut ağırlığı(VA) ve boyu: Donör/Alıcı VA oranının >2 ve <1 olması primer graft disfonksiyonunu ile ilişkili olduğu için donör ve alıcı VA farkının <%30 (kız donörden erkek alıcıya aktarılacaksa donör VA ile alıcı VA farkının <%20) olması uygun kabul edilmektedir. Aynı şeklide, donör/alıcı boy oranının <0,87 olmasının 1yıllık sağkalımı kötü etkilediği sonucuna varılmıştır.
Donör kan grubu: Donör ve alıcı arasında kan grubu uyumuna mutlaka dikkat edilmelidir.
Donör insan lökosit antijeni(HLA) ile alıcı HLA antikorlarının sanal
crossmatch’: Bu test sadece nakil öncesi HLA sensitizasyonu gelişen (PRA≥%10)
alıcıya transplanstayon yapılması durumunda uygulanmaktadır.
Tedavi başarısını negatif etkileyecek donör kaynaklı faktörlerin önceden
belirlenmesi: Donör CMV, EBV, HİV, HBV, HCV seroljisi, ölüm öncesi hastane
kaynaklı enfeksiyon geçirmesi, komorbiditeler gibi sağkalımı, nakil sonrası komplikasyonları etkileyen faktörler belirlenmeli ve bu faktörlere yönelik gerekli önlemlerin alınmalıdır. Aort veya mitral kapak disfonksiyonu olan donör kalbinin transplantasyonu ile eşzamanlı kapak onarım veya değişim ameliyatı da yapılmalıdır. Donör ve alıcı CMV seroloji sonucuna göre farklı antiviral profilaksi şeması uygulanmalıdır. Kronik HBV, HCV, HİV enfeksiyonu olan donör kalbinin nakli uygun değildir. Ölüm öncesi hastane kaynaklı ağır enfeksiyon gelişen donörlerin kalbi bazı şartlar sağlandığı takdirde kullanılabilir. Bu şartlar: 1) Enfektif endokardit değilse, 2) Enfeksiyon geliştikten sonra kısa sürede(<96 saat) ölüm gerçekleşmişse, 3) Donör kalbinin eksplantasyonundan önce alınan kan kültürlerinde patojen üremesi saptanmamışsa, 4) Donör enfeksiyon etkenine özgü antibiyotik tedavisi almışsa, 5)Donör miyokard fonksiyonu normal ise donör kalbi kullanılabilir. Bu durumda, ilki nakli takip eden 24 saat içinde olmak üzere aralıklı kan kültürü alınmalı ve etkene özgü antibiyotik tedavisi başlanmalıdır.
Donör eksitüs nedeni: Beyin ölümü gerçekleşen hastalar donör adayı olabilir, fakat bazı durumlarda donör kalbinin kullanılması uygun gdeğildir. Yüksek doz pozitif inotropik ajanların kullanımı, persiste eden semptomatik ventrikuler aritmi, uzun süreli kardiyopulmoner resusitasyon(CPR) öyküsü, EF<%40 olan donör kalbinin kullanılması uygun değildir. Sol ventrikul hipertofisi saptanan donör kalbi, EKG’de
20
hipertrofi bulgusu yoksa ve sol ventrikul duvar kalınlığı ≤14 mm ise kullanılabilir. Karbonmonoksid zehirlenmesi nedeni ile ölen donör kalbinin kullanılabilmesi için bazı şartlar karşılanmalıdır. Bu şartlar:1) Normal EKG ve EKO bulguları, 2) Minimal inotrop gereksinimi, 3) Kardiyak markerlerin minimal artışıdır(24),(28),(29).
2.2.4. Cerrahi Teknikler
Biatrial teknikle kardiyak transplantasyonu ilk kez köpekler üzerinde uygulayarak, Lower R. tarif etmiş ve uzun yıllar ortotopik kardiyak transplantasyon için standart yöntem olarak kabul edilmiştir(30). Biatrial teknikte sağ atrium, sol atrium pulmoner arter ve aorta olmak üzere toplam 4 anastamozla transplantasyon gerçekleştirilmektedir. Eksizyondan dolayı atrium anatomisinin bozulması ve buna bağlı olarak da atrioventriküler kapak disfonksiyonu ve insizyon hattına yakın yerleştiği için sinoatriyal düğüm tahribi sonucu ritm bozuklukları bu cerrahi tekniğin esas dezavantajlarıdır. Bu nedenle sinoatriyal düğümü koruyan, atrium anatamosini bozmayan yeni cerrahi teknikler araştırılmış ve 1991 yılında ilk kez Sievers H.H tarafından bikaval yöntem tarif edilmiştir. Bu yöntemle tranplantasyon yaptığı iki hastada postop dönemde aritmi ve triküspid kapak yetmezliği görülmemiştir. Bikaval yöntemde toplam 5 anastamoz yapılmakta, standart biatrial yöntemden farklı olarak sağ atrium eksize edilmeden inferior ve superior vena cavaya ayrıca anastamoz yapılıyor(31).
2.2.5. Donör Kalbine Karşı Oluşan İmmün Yanıt
Allograft implantasyonu sonrası gelişen immün yanıtın patogenezini anlamadan rejeksiyonun patogenezini, immünsupresyonun önemini, kullanılan ajanların etki mekanizmasını anlamak mümkün değildir.
Konağın allografta karşı geliştirdiği immün yanıt çok sayda, birbiri ile ilişkili zincirleme olaylardan ve 3 aşamadan ibarettir. Aşamalar ve immünsupresif ajanların etki mekanizması Şekil 3’te gösterilmiştir.
21 Şekil 3: Donör kalbine karşı konakçının immün yanıtı ve immünsupresif ajanların etki
mekanizmaları (Kaynak 32)
İlk aşama alloantijenin tanınmasıdır. Antijen sunan hücre(APC) üzerindeki major doku uyumu kompleksi(MHC) aracılığı ile alloantijen T hücreler tarafından tanınır. Makrofajlar, dendritik hücreler, T ve B lenfositler, endotelial ve epiteliyal hücreler APC görevini üstlenir. MHC 1 CD8 T hücreler, MHC 2 ise CD4 T hücreler tarafından algılanır.
İkinci aşama T hücrelerin aktivasyonudur. Bu aşama 2 farklı sinyal yolağı aracılığı ile oluşur. 1)T hücreler üzerindeki CD3 ile APC üzerindeki MHC etkileşimi ve 2)T hücreler üzerindeki CD28 ile APC üzerindeki CD80 veya CD86 etkileşimi sonucu T hücre aktivasyonu gerçekleşir.
Son aşama, aktive olmuş T hücrelerin proliferasyonu ve differensasyonudur. Bu aşama birbirini izleyen olaylar sonucu gelişir. İlk olarak aktive olmuş T hücre sitoplazmasındaki artmış iyonize kalsiyum tarafından kalsinörin enzimi aktive edilir. Kalsinörin enzimi aktive olmuş T hücrelerin nüklear faktörünün-fosforilize formunun(NFAT-P) aktive olmuş Thücrelerin nüklear faktörü-defosforilize formuna(NFAT) dönüşümünü gerçekleştirir. NFAT tarafından interlökin 2(IL-2) sentezi tetiklenir ve artmış IL-2 memelilerin rapamisin hedefi(m-TOR) aracılığı ile nükleotid sentezi ve hücre dögüsünün indüksiyonunu sağlanır.(32).
22 2.2.6. İmmünsupresif Tedavi
İmmünsupresyon, kardiyak transplantasyon da dahil, bütün organ ve doku nakillerinde tedavinin başarısı için kritik öneme sahiptir. 1980’li yılların başlarında CsA, sonlarında takrolimusun kullanıma girmesi ile rejeksiyon oranlarında dramatik azalma, sağkalım oranlarında ise artış gözlemlendi. Etkili immünsupresif tedavinin amacı, rejeksiyon gelişmesini engellemek ile birlikte ilaç yan etkilerinden korunmaktır. İmmunsupresif ajanların ömür boyu kullanılması gerektiği göz önünde bulundurulursa ilaç ilişkili komplikasyon ve morbiditelerin, hastaların yaşam kalitesi üzerine ne kadar etkili olduğu anlaşılabilir. İlaç ilişkili komplikasyonlar, non-spesifik immünsupresyona bağlı (enfeksiyon, lenfoproliferatif hastalık, malignite gibi.) ve end-organ toksitesi (renal disfonksiyon, diabetes mellitus, osteoporoz, obezite, hiperlipidemi, miyelosupresyon gibi) olarak gruplandırılabilir.
İmmünsupresyon tedavisi indüksiyon ve idame tedavi şeklinde uygulanmaktadır(33),(34),(35). Tedavinin etkinliği hastanın gen polimorfizmi ve etnik kökeni ile ilişkili olduğu bazı çalışmalarda belirtilmiştir(36),(37),(38),(39). Bu nedenle immünsupresif ajan seçimi hastaya özgü olmalıdır.
2.2.6.1. İndüksiyon Tedavisi
Kardiyak transplantasyonu takip eden birkaç gün süreyle uygulanan indüksiyon tedavisinin esas amacı hiperakut ve akut rejeksiyonu önlemekle birlikte erken portoperatif dönemde kalsinörin inhibitörleri(CNI) dozunu azaltmak veya kullanımını geciktirmektir. Ayrıca, 2010 yılında yayınlanan ISHLT kılavuzunda nakil sonrası steroidsiz immünsupresyon veya steroid tedavisinin erken kesilmesi planlandığı durumlarda rutin indüksiyon tedavisini önerilmektedir(28). Poliklonal antikorlar (fare veya at antiglobulini) ve monoklonal antikorlar (OKT3(muromonab) veya basiliximab, daclizumab gibi IL-2 reseptör antogonistleri) indüksiyon tedavisinde kullanılmaktadır.
Anti-timosit globülin (ATG), insan timositleri ile immünize edilmiş tavşan veya at kanından elde edilen poliklonal antikordur. İndüksiyon tedavisi ve tedaviye dirençli veya hemodinamik bozulma ile sonuçlanan rejeksiyon tedavisinde kullanılır. Tavşan ATG 1,5mg/kg/gün, at ATG ise 15mg/kg/gün dozda, postop 5 gün, 6 saatlik yavaş infüzyon şeklinde kullanılır. Baş ağrısı, karın ağrısı, döküntü, ateş, miyalji, lökopeni ve
23
trombositopeni sık görülen, serum hastalığı ve anafilaksi ise nadir görülen yan etkileridir. At ATG kullanımından önce mutlaka deri testi yapılması gereklidir(34).
OKT3, T hücre üzerindeki CD3 antijenine karşı oluşan fare monoklonal antikorudur. İlk veya ikinci dozunda sitokin salınım sendromuna neden olduğu için tedavinin yoğun bakım ünitelerinde verilmesi uygundur. Ateş, bulantı, kusma, pulmoner ödem, dispne gibi yan etkileri sık görülmektedir. Hastaların çoğu anti-murin antikoru geliştirdiği için tekrarlayan dozlarda tedavi etkinliği azalmaktadır. Ayrıca rejeksiyon önlemede IL-2 reseptör antagonistleri(IL-2Ra) ve ATG’e göre üstünlüğü yoktur. Bütün bu nedenlerden dolayı günümüzde indüksiyon tedavisinde OKT3 kullanılmamaktadır (34),(35).
İndüksiyon tedavisinde kullanılan diğer monoklonal antikorlar IL-2 reseptör antagonisti olan daclizumab ve basiliximabdır. Her iki ajan T hücreler üzerinde olan IL -2 reseptörünün α zincirine bağlanarak T hücre proliferasyonunu önler. Baş ağrı, bulantı, kusma, hipertansiyon, döküntü gibi genellikle kolay tolere edilebilen yan etkiler ve nadiren anafilaksi görülmektedir. Basiliximab 2-15 yaş arası hastalara, transplantasyonun 6.saatinde ve 4.gününde, 12mg/m2/doz (maksimum 20 mg)30 dakikalık infüzyonla verilir. Daclizumab etkinliği açısından basiliximab ile aynıdır. Fakat 2 hafta arayla, toplam 5 doz uygulanması gereği uzamış hastane yatışlarına neden olduğu için artık indüksiyon tedavisinde kullanılmamaktadır(34),(35).
ATG, OKT3 ve IL-2Ra ajanlarını kıyaslayan çok sayda çalışmalarda rejeksiyon önlemede, ATG’in daha etkili olduğu(40),(41),(42), sağkalım açısından diğer ajanlara göre ATG ile indüksiyon yapılan hastalarda daha iyi sonuçlar elde edildiği(42),(43),(44), bununla birlikte enfeksiyon, malignite ile ilişkili olmadığı(41),(45),(46) gösterilmiştir.
2.2.6.2. İdame İmmünsupresif Tedavi
İdame immünsupresyonda ise hastalar ömür boyu ikili veya üçlü kombinasyonlar şeklinde immünsupresif ajanlarla tedavi edilmektedir. Esas immünsupresif ajan olarak genelde CNI, bazen m-TOR inhibitörleri(m-TORi) grubu tercih edilir ve antiproliferatif ajanlar, veya steroid ile kombine edilir(33),(34),(35). Takrolimus+MMF±steroid kombinasyonu en çok tercih edilen üçlü idame immünsupresyon tedavisidir(24).
CNI grubu immünsupresif ajanlar deoksiribonükleik asid(DNA) transkripsiyonu ve