T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
MAHONYA (Mahonia aquifolium) MEYVESĠ ANTOSĠYANĠNLERĠNĠN ENKAPSÜLASYONU VE DEPOLAMA STABĠLĠTELERĠNĠN BELĠRLENMESĠ
ALĠ YILDIRIM YÜKSEK LĠSANS TEZĠ Gıda Mühendisliği Anabilim Dalı
Ağustos-2019 KONYA Her Hakkı Saklıdır
ÖZET
YÜKSEK LĠSANS TEZĠ MAHONYA (Mahonia aquifolium) MEYVESĠ ANTOSĠYANĠNLERĠNĠN ENKAPSÜLASYONU VE DEPOLAMA STABĠLĠTELERĠNĠN BELĠRLENMESĠ
ALĠ YILDIRIM
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Gıda Mühendisliği Anabilim Dalı DanıĢman: Doç. Dr. Hacer ÇOKLAR
2019, 63 Sayfa Jüri
Doç. Dr. Hacer ÇOKLAR Prof. Dr. Mehmet AKBULUT
Dr. Öğr. Üy. Ayhan DURAN
Antosiyaninler birçok meyve ve sebzenin pembeden mora kadar değişen renklerini veren doğal pigmentlerdir. Mahonya (Mahonia aquifolium) antosiyanince zengin bir meyvedir.
Bu tez çalışması ile Mahonia aquifolium meyvesi antosiyaninlerinin çeşitli duvar materyalleri kullanılarak enkapsülasyonu ve enkapsülasyon sonrasında antosiyaninlerin ısı ve ışık faktörlerine karşı stabilitesinin belirlenmesi amaçlanmıştır. Enkapsülasyon için duvar materyali olarak gum arabik (GA), maltodekstrin (MD) ve bunların eşit kombinasyonu (MD+GA, 1:1 w/w) kullanılmıştır. Çalışmada mahonya meyvesinden elde edilen meyve suyu örneklerine mekaniksel homojenizasyon (MH) (15000 rpm, 30 dak) ve ultrasonik destekli mekaniksel homojenizasyon (UMH) (35 kHz, %50 Güç‟te 15 dak ve 15000 rpm‟de30 dak) olmak üzere iki homojenizasyon yöntemi uygulanmıştır.
Elde edilen sonuçlara göre MH yönteminde GA, MD ve her ikisinin eşit karışımlarındaki enkapsülasyon etkinliği sırasıyla % 98.53, 93.89 ve 97.89; UMH yönteminde ise enkapsülasyon etkinliği sırasıyla % 98.47, 93.85 ve 97.40 olarak tespit edilmiştir. MH ve UMH yöntemiyle yapılan enkapsülasyonlar arasında etkinlik bakımından önemli bir farklılık görülmemiştir. Buna bağlı olarak çalışmaya MH yöntemiyle devam edilmiş olup, mahonya meyvesinin suyu elde edilerek ve uygun oranda duvar materyali ilavesi sonrasında MH yöntemiyle homojenize edilip dondurma-kurutma yöntemiyle kurutulmuştur. Enkapsüle edilmiş örnekler oda sıcaklığında iki farklı aydınlatma koşulunda (karanlık ve ışık altında) 90 gün ve 3 farklı sıcaklıkta (50, 65 ve 80 oC) 20 gün boyunca depolanmıştır. Depolanan
örneklerde toplam monomerik antosiyanin içeriği, antosiyanin degradasyonu için kinetik parametreler ve reflektans renk değerleri (L*, a*, b*, h ve C*) belirlenmiştir. Enkapsüle edilmiş örneklerde antosiyanin degradasyonunun birinci dereceden reaksiyon kinetiğine uygun olarak gerçekleştiği belirlenmiştir.
Aktivasyon enerjisi (Ea) değerleri MD, GA ve MD+GA için sırasıyla 75.4, 54.1 ve 58.9 kJ/mol
olarak bulunmuştur. Her üç duvar materyali arasında her üç sıcaklıkta da en uzun yarılanma ömürleri GA ile enkapsüle edilen örneklerde belirlenmiştir. GA ve MD+GA kombinasyonu ile enkaplsüle edilen ve iki farklı aydınlatma ortamında depolanan örneklerin yarı ömürleri arasında önemli bir fark belirlenmemiştir. Toplam renk farkı (∆E) verileri incelendiğinde renk değişimi açısından sıcaklığa karşı en yüksek stabilite sağlayan materyalin MD olduğu ve bunu sırası ile GA ve GA+MD karışım materyalinin takip ettiği görülmüştür.
Anahtar Kelimeler: Antosiyanin, depolama, enkapsülasyon, kinetik, Mahonia aquifolium, renk, total monomerik antosiyanin miktarı
ABSTRACT MS THESIS
THE ENCAPSULATION OF MAHONIA (Mahonia aquifolium) FRUIT ANTHOCYANINS, AND THEIR STABILITY DURING THE STORAGE
Ali YILDIRIM
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN FOOD ENGINEERING
Advisor: Assoc. Prof. Dr. Hacer ÇOKLAR 2019, 63 Pages
Jury
Assoc. Prof. Dr. Hacer ÇOKLAR Prof. Dr. Mehmet AKBULUT
Asst. Prof. Ayhan DURAN
Anthocyanins are natural pigments that give the color of many fruits and vegetables ranging from pink to purple. Mahonia (Mahonia aquifolium) fruit is rich in anthocyanins.
The aims of this thesis were to encapsulate anthocyanins of Mahonia aquifolium fruits using various wall materials and also to determine the stability of anthocyanins against heat and light after encapsulation. Gum arabic (GA), maltodextrin (MD), and equal amounts of gum arabic and maltodextrin mixtures (MD+GA, 1:1 w/w) were used as wall materials. In the study, mahonia fruit juice was homogenized by two different methods namely mechanical homogenization (15000 rpm for 30 min) and ultrasound-assisted mechanical homogenization (35 kHz 50 % Power at 15 min and 15000 rpm for 15 min).
According to the results, encapsulation efficiencies of MD, GA, and their mixture were 98.53, 93.89, and 97.89% by the mechanical method and 98.47, 93.85, and 97.40% by the ultrasound-assisted mechanical method, respectively. However, there was no significant difference in terms of the encapsulation efficiency between the MH and UMH methods. In accordance, the study was continued with the MH method and the mahonia fruit juice was homogenized by the MH method after the addition of wall material in the appropriate ratios and freeze-dried. The encapsulated samples were kept under two different lighting (at the dark and light) for 90 days at room temperature and at 3 different temperatures (50, 65, and 80 °C) for 20 days. Total monomeric anthocyanin content, kinetic parameters for anthocyanin degradation and reflectance color values (L*, a*, b*, h, and C*) were determined in the stored samples.
It was determined that anthocyanin degradation in encapsulated samples followed the first-order kineticActivation energy (Ea) values for MD, GA and MD+GA were found to be 75.4, 54.1 and 58.9 kJ / mol, respectively.
Among all three wall materials, the longest half-lives at all three temperatures were determined in the samples encapsulated with GA. There was no significant difference between the half-lives of the samples encapsulated with the combination of GA and MD+GA and stored in the lightening conditions. According to the total color difference (∆E) data, it was found that the highest stability against temperature in terms of color change occurred in the samples encapsulated with MD and it was followed by GA and GA+MD encapsulated samples, respectively.
Keywords: Anthocyanin, storage, encapsulation, kinetic, Mahonia aquifolium, color, content of total monomeric anthocyanin,
ÖNSÖZ
Tezimin hazırlanmasında büyük bir özveri göstererek, çalışmamın her aşamasında tecrübelerinden, bilgilerinden faydalandığım ve desteğini aldığım danışman hocam sayın Doç. Dr. Hacer ÇOKLAR‟a, analizlerin planlanması, yürütülmesi ve değerlendirilmesinde birikimlerini benimle paylaşan hocam Prof. Dr. Mehmet AKBULUT‟a ve analizlerin yapılma aşamasında bana yardımcı olan değerli dostlarım Iliasu ALHASSAN, Semih KILINÇ, Esma ULUCAN ve Serdar YEŞİL‟e teşekkürlerimi sunarım. Ayrıca, hayatım boyunca attığım her adımda, çalışmamın her aşamasında benden hiçbir fedakarlığı esirgemeyen ve manevi desteğini gördüğüm babam Hüseyin YILDIRIM‟a, annem Hatice YILDIRIM‟a, abim Ufuk YILDIRIM‟a, yeğenlerim Elif YILDIRIM ve Beyza YILDIRIM‟a sonsuz teşekkür ederim.
.
Ali YILDIRIM KONYA-2019
ĠÇĠNDEKĠLER ÖZET ... vii ABSTRACT ... viii ÖNSÖZ ... ix ĠÇĠNDEKĠLER ... x SĠMGELER VE KISALTMALAR ... xi 1. GĠRĠġ ... 12 2. KAYNAK ARAġTIRMASI ... 14 3. MATERYAL VE YÖNTEM ... 22 3.1. Materyal ... 22
3.2. Mahonya meyvesi suyunun eldesi ... 22
3.3. Enkapsülasyon ... 22
3.4. Depolama ... 22
3.5. Analiz Yöntemleri ... 23
3.5.1. Enkapsülasyon etkinliğinin (EE) belirlenmesi ... 23
3.5.2. Toplam monomerik antosiyanin tayini ... 23
3.5.3. Renk tayini ... 24
3.6. Kinetik katsayıların hesaplanması ... 25
3.6.1.Reaksiyon hız sabitinin (k) hesaplanması ... 25
3.6.2. Aktivasyon enerjisinin (Ea) hesaplanması ... 25
3.6.3. Sıcaklık katsayısının (Q10) hesaplanması ... 26
3.6.4. Yarılanma süresinin (t1/2) hesaplanması ... 26
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 27
4.1. Enkapsülasyon etkinliği ... 27
4.2. Enkapsüle Mahonia aquifolium Antosiyaninlerinin Farklı Sıcaklık ve Işık Etkisinde Parçalanma Kinetiği ... 29
4.2.1. Reaksiyon hız sabiti (k) ... 29
4.2.2. Aktivasyon enerjisi (Ea), sıcaklık katsayısı (Q10) ve D değeri ... 31
4.2.3. Yarılanma süresi (t1/2) ... 33
4.3. Reflektans renk sonuçları ... 34
5. SONUÇLAR VE ÖNERĠLER ... 49 5.1 Sonuçlar ... 49 5.2 Öneriler ... 51 KAYNAKLAR ... 52 EKLER ... 56 ÖZGEÇMĠġ ... 62
SĠMGELER VE KISALTMALAR Simgeler °C : Santigrat derece pH : Hidrojen kontrasyonunun gücü R2 : Korelasyon sabiti L* : Renk (parlaklık) a* : Renk (kırmızı/yeşil) b* : Renk (sarı/mavi) C* : Chroma h : Hue β : Beta t1/2 : Yarılanma süresi M : Molar Q10 : Sıcaklık katsayısı k : Reaksiyon hız sabiti Ea : Aktivasyon enerjisi
R : İdeal gaz sabiti
K : Kelvin derece
J : Joule
T : Sıcaklık
aw : Su aktivitesi
ΔΕ : Toplam renk farkı
Kısaltmalar
ark. : Arkadaşları
MD : Maltodekstrin
GA : Gam arabik
EE : Enkapsülasyon etkinliği
1. GĠRĠġ
Renk, gıda maddelerinin ve canlıların sahip olduğu en önemli görsel özelliklerinden biridir. Gerek yasal gerekse sentetik katkıların kullanımı konusundaki tüketici endişeleri nedeniyle sentetik boyaların kullanımına alternatif olarak doğal kaynaklardan elde edilen gıda renklendiricilerine büyük talep vardır (Giusti ve Wrolstad, 2003). Elde edilen bulgular, doğal bitkilerden elde edilen pigmentlerin yüksek biyolojik etkinliklere sahip olduğunu ve her pigment grubuna bağlı olarak farklı özellikler sergilediğini düşündürmektedir (Boo ve ark., 2012).
Renk, ürün hakkında tüketiciye bilgi veren önemli parametrelerden biridir. Gıdalara renk yapay veya doğal renklendiriciler sayesinde kazandırılır (Özen ve Akbulut, 2008).
Doğadaki en yaygın pigmentlerden birisi de antosiyaninlerdir. Antosiyaninler bitkiler alemindeki en büyük suda çözünür pigment grubudur ve flavonoidler olarak bilinen bileşikler ailesine aittir. Ana antosiyanin kaynakları yaban mersini, kiraz, ahududu, çilek, siyah kuş üzümü, kara havuç ve mor üzümdür. Son yıllarda, bazı çalışmalar antosiyaninlerin antioksidan, antienflamatuar, antimikrobiyal ve antioksinojenik aktiviteler de dahil olmak üzere geniş bir biyolojik aktivite gösterdiğini rapor etmiştir (Mazza, 2007). Ek olarak, in vivo biyolojik aktivitelere katkıda bulunan spesifik antosiyanin metabolitleri, antosiyaninlerin katkı maddesi ve sinerjik etkinliğinin yanı sıra yapı-aktivite ilişkileri de araştırılmaktadır (Li ve ark., 2017).
Antosiyanin içeriği zengin bitkilerden birisi de mahonyadır. Mahonya, Kuzey Amerika ormanlarında yaygındır. Çok parlak üst yüzeyli ve dikenli dişli kenarlı, yeşil yaprakları olan, 1-2 metreye kadar büyüyen, bahçelerde ve parklarda yaygın olarak bulunan bir bitkidir. Mahonya, koyu kırmızı meyveeti ve 2-5 arasında parlak tohum içeren mavi, pus kaplı meyvelere dönüşen sarı çiçeklere sahiptir. Mahonyanın birçok türü mevcuttur. Türkiye‟de en çok yetiştirilen Mahonya türü Mahonia aquifolium‟dur (Marakoglu ve ark., 2010). Sarı boya çalısı olarakta bilinen Mahonia aquifolium, güzel kokulu sarı çiçeklere, mor renkli meyvelere sahip, Berberidaceae familyasından, çalı formunda bir süs bitkisidir. Ayrıca
Mahonia aquifolium‟un meyveleri yenilebilir özelliktedir. Mahonia aquifolium'un kökü ve
odunu berberin, palmatin, berbamin, oksiasantin, bervülin, magnoflorin ve kolumbamin gibi birçok izokinolin alkaloitini içerir (Gulliver ve Donsky, 2005). Mahonya türlerinin hem kök hem de kök kabuğu, popüler halk ilaçları olarak kullanılmaktadır. Bitki bakteriyel, anti-fungal ve anti-inflamatuar etkileri de dahil olmak üzere birçok kanıtlanmış biyolojik aktiviteye sahiptir (Wong ve ark., 2009).
Mahonya aqufolium‟un antosiyanince zengin olması gıda sektörü için alternatif doğal
bir renk kaynağı oluşturmaktadır. Ancak antosiyaninler ısı, ışık gibi faktörlerden etkilenmektedir. Bu durum antosiyaninlerin korunumunu değerli kılmaktadır. Bu doğal renk maddeleri için enkapsülasyon en uygun koruma ve dayandırma yöntemlerinden biri olabilir.
Enkapsülasyon çeşitli biyoaktif maddelerin kapsüller içine hapsedilerek çevresel etkenlerden korunmasını sağlarken, belirli koşullar altında içeriğindeki maddelerin ortama salınmasını sağlayan yeni bir teknolojidir (Çoruhli, 2013). Kararsızlık, çözünürlük ve taşıma problemlerinin üstesinden gelmek için doğal gıda renk renklendiricilerinin mikrokapsülasyonunda kullanılabilen çeşitli teknikler ve duvar malzemeleri vardır (Özkan ve Bilek, 2014). Kullanılan kapsülleyici veya duvar malzemeleri genel olarak nişasta, nişasta türevleri, proteinler, zamklar, lipitler veya bunların herhangi bir kombinasyonundan oluşur (Shahidi ve Han, 1993).
Çekirdek malzemelerin kapsüllenmesi için çeşitli teknikler mevcuttur. Genel olarak yöntemler kimyasal, fiziko-kimyasal ve fiziko-mekanik olmak üzere üçe ayrılır. Belirtilen bu teknikler, birkaç farmasötik maddenin mikro kapsüllemesi için yaygın olarak kullanılmaktadır. Kapsüllenecek çekirdek maddenin fiziksel doğasına bağlı olarak, kullanılan teknik değişmektedir (Jyothi ve ark., 2010).
Püskürterek kurutma, püskürterek soğutma, ekstrüzyonla kaplama, akışkan yataklı kaplama, lipozom tutma, koaservasyon, inklüzyonla kaplama, santrifüjlü ekstrüzyon ve rotasyonel süspansiyon ayırma dahil kapsüller oluşturmak için çeşitli teknikler kullanılır. Çünkü kapsüllenmiş malzemeler nemden, ısıdan veya diğer aşırı koşullardan korunabilmekte, böylece kararlılıklarını arttırmakta ve canlılığı korumaktadır. Bu nedenlerden dolayı gıda endüstrisinde enkapsülasyon uygulamaları son yıllarda artmıştır. Aroma maddeleri, asitler, bazlar, yapay tatlandırıcılar, renklendiriciler, koruyucular, mayalama maddeleri, antioksidanlar, gibi çok sayıda bileşik grubu enkapsüle edilmiştir (F. Gibbs, 1999).
Mahonya bitkisi üzerine birçok çalışma yapılmasına karşın yüksek antosiyanin içeriğine sahip mahonya meyvelerinin gıda endüstrisinde kullanımına yönelik çok az çalışma bulunmaktadır. Ayrıca Mahonia aqufolium meyvelerinin içerdiği antosiyaninlerin korunumu ve kullanım süresinin artması için enkapsülasyon teknolojisinin kullanımı üzerine bir çalışma yapılmamıştır. Bu çalışmanın amacı Mahonya (Mahonia aquifolium) meyvesi antosiyaninlerinin enkapsülasyonu ve depolama stabilitelerinin belirlenmesidir.
2. KAYNAK ARAġTIRMASI
Tüm canlılarda pigmentler bulunur. Pigmentler çekici renkler sağlamalarının yanı sıra organizmaların gelişiminde de rol oynarlar.
Antosiyaninler, bitkiler aleminde en yaygın bulunan doğal pigmentlerden biridir (Li ve ark., 2017). Antosiyaninler, geniş renk yelpazeleri, sağlığa zararsız olmaları ve faydalı sağlık etkileri nedeniyle giderek ilgi uyandıran önemli bir doğal renklendiricidir. Gıda, eczacılık ve kozmetik endüstrileri için büyük uygulama potansiyeline sahiptir (Castaneda-Ovando ve ark., 2009).
Doğal gıda pigmentlerinin üretimi dünya çapında büyümeye devam etmektedir. Antosiyaninler, karotenoidler, betalainler ve klorofiller gibi pigmentler gıdaları renklendirmek için kullanılmaktadır. Bununla birlikte, sentetik renklendiricilerle karşılaştırıldığında doğal pigmentlerin düşük stabiliteleri nedeniyle gıda işleme, depolama ve ticarileştirme sırasında renk kayıpları ile ilgili zorlukları vardır. Çekici renk, meyve ve meyve ürünlerinin ana duyusal özelliklerinden biridir. Kırmızı meyve sularının rengi stabil olmayıp bozulmaya karşı duyarlıdır, bu da çoğu zaman mat ve zayıf bir meyve rengine yol açar. Rein ve Heinonen (2004) çalışmalarında, fenolik asitler ve ticari renk arttırıcıları ile zenginleştirilmiş dört farklı meyve suyunun renk stabilitesini ve kopigmentasyonunu araştırmışlardır. Fenolik asit zenginleştirmesi, depolama sırasında meyve sularının rengini iyileştirmiş ve stabilize etmiştir.
Rein (2005)‟in yapmış olduğu araştırmada, antosiyanin renkleri ve bu kararsız pigmentleri stabilize eden ve geliştiren faktörler çalışılmıştır. Üzümsü meyve antosiyanin renkleri, fenolik asit ve doğal bitki özütü ilavesiyle başarılı bir şekilde iyileştirilmiştir.
Antosiyaninler, bitkilere renk vermekten başka, oksidanlara karşı koruma etkileri olduğu için, sağlığa yararlı etkilere sahiptir (Kong ve ark., 2003). Antosiyaninler, insan sağlığı için, sitoprotektif, antimikrobiyal ve antitümör aktivitelerinden nöroprotektif, anti-obezite ve lipidomik potansiyele, antosiyaninlerin ilaç olarak reçete edildiği özelliklere kadar geniş bir yelpazede sağlık destekleyici özellikler sergilerler. Buna rağmen, bu fitokimyasallar diğer flavonoidlerden daha az ilgi görmüştür ve literatürde, özellikle farmakolojik ve toksikolojik açıdan hala bir boşluk vardır. Ayrıca, epidemiyolojik çalışmalar antosiyanin alımı ile kronik ve dejeneratif hastalıkların daha düşük insidansı arasında doğrudan bir ilişki olduğunu düşündürmektedir (Smeriglio ve ark., 2016).
Doğada 600'den fazla yapısal olarak farklı antosiyanin tespit edilmiştir. Nöronal ve kardiyovasküler hastalıkların, kanserin, diyabetin, enflamasyonun ve bunun gibi birçok hastalığın önlenmesine yardımcı olan diyet antioksidanları olarak kabul edilmesi nedeniyle
antosiyaninlere olan ilgi artmıştır. Antosiyaninlerin antioksidan etkileri sayesinde aterosklerozu (damar sertleşmesi) önlediği ifade edilmektedir. Bu nedenle, antosiyanin açısından zengin besinlerin diyette yer alması sağlığı artırmaya yardımcı olabilir. Bununla birlikte, antosiyaninlerin gıda ve tıbbi ürünlere dahil edilmesi, işleme ve depolama sırasında çevre koşullarına karşı düşük stabiliteleri nedeniyle sorun oluşturabilmektedir. Enkapsülasyon, bu bileşikleri bu ürünlere dahil etmenin etkili bir yolu gibi görünmektedir. Kapsülleme ajanları, ışık, nem ve oksijen gibi ortamdaki olumsuz koşullara karşı koruyucu bir kaplama görevi görür. Kapsüllenmiş biyoaktif bileşiklerin kullanımı daha kolaydır ve daha yüksek stabilite sağlar (Yousuf ve ark., 2016).
Mahonia aquifolium, güzel kokulu sarı çiçeklere, mavi-mor renkli meyvelere sahip,
Berberidaceae familyasından, çalı formunda bir süs bitkisidir. Ayrıca Mahonia aquifolium‟un meyveleri yenilebilir özelliktedir. Mahonia aquifolium (Pursh) Türkiye'de süs bitkisi olarak kullanılan önemli bir tıbbi bitkidir. Gunduz (2013), seçilmiş dört adet M. aquifolium meyvelerinin ağırlığı ve boyutları, çözünebilir katı içeriği, asitliği, pH'ı, toplam fenolik içeriği, antioksidan aktivitesi ve toplam monomerik antosiyanin kapasiteleri gibi çeşitli morfolojik ve fitokimyasal özelliklerini incelemiştir. Meyve genişliği ve uzunluğunu sırasıyla ortalama 8.4 ve 10.2 mm olarak, meyve ağırlığı ve tohum ağırlığı 2.9-7.3 gr ve 0.4-1.2 gr arasında belirlemiştir. Toplam fenolik madde miktarı 5009.3-6646.8 µg GAE/gr taze ağırlık (FW) arasında değişmektedir. Antioksidan aktiviteleri, 12.9 µmol Trolox eşdeğeri (TE)/gr FW‟dir. Toplam monomerik antosiyanin miktarı ise 52.8-361.0 µg cy-3-glu/gr FW aralığında çıkmıştır. Sonuçlar, M. aquifolium'un iyi bir fenollik bileşik, antosiyanin ve antioksidan kaynağı olduğunu göstermiştir.
Mahonia aquifolium'un toprak altı kısmından magnoflorin, berberin, palmatin,
jatrorizin ve kolumbamin olmak üzere beş alkaloid izole edilmiştir. Bu bitkinin yüzeyde kalan kısmı ise berberin, palmatin ve jatrorrhizin içermektedir (Şekil 2.1.) (Košťálová ve ark., 1981).
Fenolik bileşikler, özellikle antosiyaninler, mahonya meyvelerinde bulunan başlıca antioksidan bileşiklerdir. Coklar ve Akbulut (2017) yapmış oldukları çalışmayla farklı çözücülerdeki mahonya meyvesi ekstrelerinde antioksidan aktivite, toplam fenolik ve toplam monomerik antosiyanin içeriklerini belirlemişlerdir. Meyvelerin antosiyanin fraksiyonunun antioksidan aktivitesinin, fenolik fraksiyonundan yaklaşık iki kat daha yüksek olduğunu tespit etmişlerdir. Fenolik ve antosiyanin bileşiklerinin mahonya meyvelerinin antioksidan aktivitesine katkısının % 83'ün üzerinde olduğunu belirtmişlerdir.
ġekil 2.1. 'Mahonia aquifolium’ protoberberin alkaloitlerinin kimyasal yapıları (Volleková ve ark., 2003)
Mahonia türlerinin kökü popüler halk ilaçlarıdır. Bitki anti-bakteriyel, anti-fungal ve anti-inflamatuar etkileri de dahil olmak üzere birçok kanıtlanmış biyolojik aktiviteye sahiptir. Wong ve ark. (2009) Mahonia oiwakensis ekstraktlarının insan akciğer kanseri hücrelerinin
büyümesini inhibe ederek akciğer kanserine karşı terapötik potansiyele sahip olabileceğini belirtmişlerdir.
Biyoaktif bileşikler kimyasal olarak kararsızdır ve oksidatif bozulmaya karşı duyarlıdırlar. Kapsülleme, biyoaktif bileşikleri çevresel streslerden koruyarak fizikokimyasal işlevsellikleri geliştirebilir, sağlık destekleyici ve hastalık karşıtı aktivitelerini arttırabilir (Shishir ve ark., 2018).
Mikrokapsülleme, katı parçacıkların, sıvı damlacıkların ve gazların ince polimerlerle kaplanması işlemidir (Jackson ve Lee, 1991). Püskürterek kurutma, sprey soğutma, ekstrüzyon kaplama, akışkan yataklı kaplama, lipozom sıkışması, koaservasyon, inklüzyon kompleksi, santrifüjlü ekstrüzyon mikrokapsüller oluşturmak için kullanılan çeşitli tekniklerdir. Gıda bileşenlerinin doğru yerde ve doğru zamanda kontrollü olarak salınması, mikrokapsülleme ile sağlanabilecek önemli bir fonksiyonelliktir. Zamanında ve hedefe yönelik bir salım, gıda katkı maddelerinin etkinliğini artırır, gıda bileşenlerinin uygulama aralığını genişletir ve optimal dozajı sağlar, böylece gıda üreticisi için maliyet etkinliğini artırır. Reaktif, hassas veya uçucu katkı maddeleri (vitaminler, kültürler, tatlar, vb.) mikroenkapsülasyon yoluyla stabil hale dönüştürülebilir (Desai ve Jin Park, 2005).
Hem mikro hem de nano kapsülleme geniş bir uygulamaya sahiptir, ancak nano kapsülleme, kapsülleme amaçlı umut verici bir yaklaşım olabilir. Maltodekstrin, gamlar,
proteinler ve bunların kombinasyonu biyoaktif bileşiklerin kapsüllenmesinde yaygın olarak kullanılmaktır (Shishir ve ark., 2018).
Son yıllarda tüketici kaygıları nedeniyle doğal renklendiricilere artan bir ilgi vardır. Antosiyaninlere gıda endüstrisinde büyük ilgi gösterilmektedir, çünkü geniş bir renk yelpazesi ve nutrasötik aktiviteler sunmaktadırlar. Bununla birlikte, işleme ve depolama sırasında çevre koşullarına olan düşük kararlılıklarından ötürü antosiyaninlerin gıdalarda kullanımı sınırlı kalmaktadır. Mikrokapsülleme teknolojisinin, stabiliteyi artırması sayesinde antosiyaninlerin gıda formülasyonlarında kullanımında etkili olacağı düşünülmektedir (Mahdavi ve ark. (2014); Mahdavi ve ark. (2016)).
Antosiyaninlerin mikrokapsüllenmesinin işlem koşulları farklı çalışmalarda araştırılmıştır. Jiménez-Aguilar ve ark. (2011) etanollü yabanmersini ekstraktlarını, çözünürlüğü % 35 ulaşana kadar konsantre etmişler ve 140 ve 160 °C hava giriş sıcaklığında ve 8.5, 9.1 ve 9.6 mL/dak. besleme hızlarında kapsülleyici bir madde olarak mesquite zamkı kullanılarak püskürtülerek kurutmuşlardır. Toplam fenolik madde, toplam antosiyanin içeriği ve mikrokapsüllerin rengindeki en düşük kayıpların 140 °C hava giriş sıcaklığında olduğunu tespit etmişlerdir. Başka bir çalışmada Silva ve ark. (2013), 140, 160 ve 180 °C'lik üç farklı hava kurutma sıcaklığı uygulamıştır. Maltodekstrin ve gam arabik kullanımının, mikroenkapsülasyon işleminde daha homojen parçacıkların oluşmasını sağladığını belirlemişlerdir. Sonuçlara göre duvar materyali olarak maltodekstrin ve 180 °C'lik hava kurutma sıcaklığı en uygun mikrokapsülleme koşullarını sağlamıştır.
Desobry ve ark. (1997) saf β-karoteni, maltodekstrin içinde üç farklı kurutma işlemi (püskürterek, dondurma ve tambur) ile kapsüllemişlerdir. Stabilite şartlarını, % 11 ve 32 bağıl nem ve 25, 35 ve 45 °C sıcaklık olarak belirlemişlerdir. Oksidasyonun, ilki hızlı, ikincisi yavaş olmak üzere birinci dereceden kinetiği izlediğini tespit etmişlerdir. Depolama başlanğıcında β-karotende hızlı bir şekilde kayıp meydana gelmiş ve bu hızlı kaybın yüzey karotenoidlerinin oksidasyona uğraması sonucu oluştuğunu elde etmişlerdir. Tambur kurutma işleminin püskürterek ve dondurma kurutma işlemine göre depolama boyunca β-karoten için daha iyi koruma sağladığını belirlemişlerdir.
Dut meyvesi dünyanın pek çok bölgesinde yetiştirilebilen, mineraller, C vitamini, fenolik maddeler, antioksidanlar ve antosiyaninlerce zengin yararlı bir besin kaynağıdır. Kara dut (Morus nigra) doğal haliyle yani taze olarak veya çeşitli ürünlere işlenerek de tüketilen bir dut çeşididir. Kara dut meyvesinin zengin antosiyanin içeriğine sahip olması, gıda sanayinde doğal renklendirici olarak veya ürünlerin zenginleştirilmesinde kullanımını sağlamaktadır. Çoruhli (2013), dut meyvesi üzerine yapmış olduğu bu çalışmayla dut antosiyaninlerinin
kitosan kaplı kalsiyum-aljinat tanecikler içine hapsedilerek enkapsüle edilmesi ve yanıt yüzey metodu kullanılarak enkapsülasyonda kullanılan bazı etkenlerin (kitosan miktarı, ekstrakt miktarı ve jelleşme ortamındaki karıştırma süresi) en uygun hale getirilmesini amaçlamıştır. Enkapsülasyon etkinliği ekstrakt-kitosan miktarları, ekstrakt-süre ve kitosan miktarı-süre interaksiyonu dışındaki tüm etkilere bağlı bulunmuştur. Meyve ekstraktının mide sıvısındaki salınım oranının zamana, ekstrakt-kitosan miktarlarına, ekstrakt miktarına ve süre interaksiyonlarına büyük ölçüde bağlı olduğunu tespit etmişlerdir.
Karadeniz ve ark. (2018), buğday tohumu yağını kapsülleyerek depolama süresince fizikokimyasal özelliklerini ve kararlılıklarını incelemiştir. Enkapsülasyonda duvar materyali olarak maltodekstrin gam arabik, peynir altı suyu protein konsantresi, kitosan ve sodyum kazeinat kullanmışlardır. Buğday tohumu yağının kapsüllenmesinde kitosan ve gam arabik, peynir altı suyu protein konsantresinden daha iyi kapsülleme özelliklerine sahip olduğunu bulmuşlardır.
Bakowska-Barczak ve Kolodziejczyk (2011), siyah frenk üzümü meyvelerinin (Ribes
nigrum L.) biyoaktif bileşiklerinin mikrokapsülleme sonrasında antioksidan aktivitelerini
incelemişlerdir. Maltodekstrin ile kapsüllenmiş polifenollerin stabilitesini 12 ay depolama süresince 8 ve 25 oC'de değerlendirmişler ve depolama boyunca fenolikler için daha iyi
koruma sağladığını belirlemişlerdir.
Kaderides ve ark. (2015) yapmış oldukları bu çalışmada gıda endüstrisinde nar kabuğu uygulaması için fenolik bileşiklerin ultrason destekli ekstraksiyonu ve daha sonra sprey kurutma ile kapsüllenmesine dayanan yeni bir yöntem geliştirmişlerdir. Maksimum kapsülleme verimliliğini % 99.80 olduğunu belirlemişlerdir.
Rodrigo ve ark. (2007) domates püresi ve çilek suyunun ısıl (100-140 oC, 0-120 dak.) ve yüksek basınçlı ısıl (300-700 MPa, 60 dk, 65 oC) ortamda, üç farklı pH değerinde (2.5, 3.7
ve 5) renk bozulmasını incelemişlerdir. İşlem gören her bir numunenin Hunter renk skalası
L*, a* ve b* değerlerini ölçmüşlerdir. Domates ve çilek renginin termal bozunmasının birinci
dereceden kinetiğe uyduğunu tespit etmişlerdir. Domates püresinin aktivasyon enerjisini 129.12×10-2 kJ/mol olarak hesaplamışlardır. pH‟sı 2.5, 3.7 ve 5 olan çilek reçellerinde ise aktivasyon enerjisinin sırasıyla 181.40, 162.60 ve 85.77×10-2
kJ/mol olduğunu bulmuşlardır. pH 5'deki çilek renginin ısıya karşı daha az dayanıklı olduğunu, ancak bozunma sabitinin sıcaklık değişimine daha az duyarlı olduğunu tespit etmişlerdir.
Tonon ve ark. (2010), dört tip taşıyıcı madde kullanılarak (maltodekstrin 10DE, maltodekstrin 20DE, arap zamkı ve tapyoka nişastası) sprey kurutmayla ürettikleri toz halindeki acai suyunun antosiyanin stabilitesi ve antioksidan aktivitesini 120 gün boyunca
farklı sıcaklıklarda (25 ve 35 o
C) ve su aktivitelerinde (0.328 ve 0.529) depolayarak değerlendirmişlerdir. Hem sıcaklık hem de su aktivitesindeki artışın antosiyanin stabilitesini olumsuz yönde etkilediğini belirtmişlerdir. Antioksidan aktivitenin su aktivitesinin artmasıyla da azaldığı, ancak 35 °C'de depolanan tozlar için daha yüksek olduğu tespit edilmiştir. Araştırmalarında maltodekstrin (10DE), incelenen tüm koşullar için en iyi pigment ve antioksidan aktivite korumasını sağlayan taşıyıcı ajan olmuştur.
Jiménez-Aguilar ve ark. (2011) yabanmersini ekstraktını gam arabik ile enkapsüle etmişlerdir. Mikroenkapsülasyon işlemi ile karanlıkta 4 °C'de 4 hafta süreyle depolanan örneklerin fenolik madde ve antosiyanin miktarında düşük oranda bozulma görüldüğünü ve antioksidan aktivitenin daha fazla korunduğunu belirtmişlerdir.
Idham ve ark. (2012) doğal kırmızı bir renklendirici üretmek amacıyla kerkede (Hibiscus sabdariffa L) ekstraktını mikrokapsülleme tekniği ile enkapsüle etmişlerdir. Kapsülleme çalışması için dört farklı duvar materyali (maltodekstrin, gam arabik, maltodekstrin-gam arabik kombinasyonu ve nişasta) kullanmışlardır. Kapsüllenmiş pigmentlerin stabilitesini, 105 güne kadar üç farklı depolama sıcaklığında (4, 25 ve 37 o
C) araştırılmışlardır. Kapsüllenmiş kerkede ekstraktlarını kapsüllenmemiş kerkede ekstraktlarıyla kıyasladıklarında özellikle 37 oC‟de depolama sırasında pigmentlerin yarı ömrünün büyük
ölçüde (p<0.05) arttığını belirlemişlerdir. Depolama sıcaklığının, L*, a* ve b* değerlerini etkilemediğini (p>0.05) tespit etmişlerdir. Bununla birlikte, elde ettikleri veriler doğrultusunda kapsülleme ajanı ve saklama süresinin önemli ölçüde (p<0.05) renk değişikliklerini etkilediği, depolama sırasında L* ve a* değerleri azalırken, b* değerinin arttığı sonucuna varmışlardır.
Ersus ve Yurdagel (2007) yüksek antosiyanin içeriğine sahip siyah havuç ektraktını enkapsüle etmede taşıyıcı ve kaplama maddeleri olarak farklı DE değerindeki maltodenkstrinleri (Stardri 10 (10DE), Glucodry 210 (20–23DE) ve MDX 29 (28–31 DE)) kullanmıştır. Stabilite açısından en iyi duvar materyalinin Glucodry 210 olduğunu bulmuşlardır.
Mahdavi ve ark. (2016) zengin bir antosiyanin kaynağı olan kadın tuzluğu (Berberis
vulgaris) ekstraktını, üç farklı duvar malzemesiyle (maltodekstrin, maltodekstrin-gam arabik,
maltodekstrin-jelatin) enkapsüle etmiştir. Kapsüllenmiş pigmentlerin depolama stabilitesini dört depolama sıcaklığı altında (4, 25, 35 ve 42 °C), dört bağıl nemde (% 20, 30, 40 ve 50) ve 90 güne kadar ışık altında incelemişlerdir. Tüm duvar malzemelerinin, kapsüllenmemiş antosiyaninlerle karşılaştırıldığında depolama sırasında kapsüllenmiş pigmentlerin yarı ömrünü büyük ölçüde arttırdığını görmüşlerdir. En yüksek kapsülleme verimliliğini gösteren
maltodekstrin-gam arabik kombinasyonunun tüm sıcaklıklarda daha düşük degradasyon gösterdiği ve pigmentlerin stabilize edilmesinde en etkili duvar malzemesi olarak bulunduğu belirtilmiştir. Kapsüllenmiş pigmentleri, sentetik renk alternatifi olarak jöle tozunun renklendirilmesinde kullanmışlar ve tüketici tarafından kabul edilebilirliğe göre jöle tozu formülasyonunda en iyi kapsüllenmiş doğal renk konsantrasyonunu tanımlamak için duyusal değerlendirme yapmışlardır. Değerlendirilen tüm duyusal özellikler için kapsüllenmiş pigment ilave edilmiş jölenin, yapay renklendirici içeren jöleden daha yüksek puan aldığını belirlemişlerdir.
Chisté ve ark. (2010) mangosten (Garcinia mangostana L.) meyvesinden elde edilen antosiyanin ekstraktlarının stabilitesi ve yarı ömrü üzerine ışık kaynağı (flüoresan, akkor, kızılötesi ve ultraviyole) ve depolama sıcaklığının (5, 28, 40 ve 50 oC) etkisini incelenmiştir.
Farklı ışıklandırma koşulları altında antosiyanin degradasyonu için kinetik parametrelerin, birinci dereceden reaksiyon modeline uyduğu görülmüştür. Elde edilen veriler doğrultusunda, floresan ışık altında depolanan ürün daha yüksek bir yarı ömür süresine (597 saat) sahiptir ve ardından akkor (306 saat), ultraviyole (177 saat), kızılötesi (100 saat) gelmektedir. Ayrıca, araştırmacılar farklı sıcaklıklardaki depolamanın kinetik davranışının da birinci dereceye uyduğunu ve 5, 28, 40 ve 50 o
C‟de yarı ömür süresinin sırasıyla 4006, 370, 125 ve 93 saat olduğunu tespit etmişlerdir.
Ahmed ve ark. (2004) erik püresinde reflektans renk (L*, a* ve b*) değişimi ve antosiyaninin bozunma kinetiğini farklı sıcaklıklarda (50-90 °C) incelemişlerdir. Sonuçları, antosiyaninin termal bozunmasının ve kırmızılığın (a*) azalmasının birinci dereceden reaksiyon kinetiğini izlediğini göstermiştir. Antosiyanin degradasyonu ve kırmızı renk değişimi için aktivasyon enerjisi değerlerini sırasıyla 37.48 ve 25.86 kJ/mol olarak elde etmişlerdir.
Osorio ve ark. (2010) corozo (Bactris guineensis) meyvesinin ekstraktlarını maltodekstrin ile püskürterek kurutma işlemine tabi tutmuşlardır. Yapmış oldukları mikrokapsüllerin depolama kararlılık testleri, antosiyanin pigmentlerinin salınımının birinci derece kinetikleri izlediğini ve işlem hızının sıcaklık ve nem ile arttığını göstermiştir. Mikrokapsüllemenin coroza meyvesi antosiyaninlerini 50 °C'nin üzerindeki sıcaklıklarda koruduğunu, ancak 50 °C'nin üzerindeki sıcaklıklarda kırmızıdan kahverengiye bir renk değişiminin meydana geldiğini tespit etmişlerdir.
Başka bir çalışmada ise Harbourne ve ark. (2008) sıcaklığın siyah frenk üzümü antosiyaninlerinin stabilitesine olan etkisini, 4-140 °C'lik bir sıcaklık aralığında
değerlendirmişlerdir. 4 °C'de 0.16×10-3
h-1 olan reaksiyon hızı sabitinin (k) 140 °C'de 9.954 h-1 'e yükseldiğini tespit etmişlerdir.
3. MATERYAL VE YÖNTEM
3.1. Materyal
Bu araştırmada materyal olarak Mahonya (Mahonia aquifolium) meyveleri kullanılmıştır. Meyveler Haziran-Ağustos ayları arasında Selçuk Üniversitesi Alaaddin Keykubat Kampüsü içerisinde bulunan peyzaj amacıyla yetiştirilen çalılardan toplanmıştır ve tazeliğini kaybetmeden -30 oC‟de analiz anına kadar depolanmıştır.
Enkapsülasyon işleminde maltodekstrin ve gam arabik kullanılmıştır. Gam arabik Molar Kimyevi Maddeler Paz. Tic.‟den (Türkiye), maltodekstrin ise Nante Kimya ve Ambalaj San. Tic. Ltd. Şti.‟den (Türkiye) temin edilmiştir.
3.2. Mahonya meyvesi suyunun eldesi
Sapları ayrılarak ezilen mahonya meyveleri enzim inaktivasyonu için 95 °C‟ye 15 saniye süresince ısıtılmış ve suyun posadan ayrılması için 6000 devir/dak.‟da 10 dak. santrifüj edilmiştir.
3.3. Enkapsülasyon
Meyve suyu duvar materyali karışımının son briksi 20 olacak şekilde mahonya suyuna duvar materyali ilave edilmiştir. Enkapsülasyonda kullanılacak duvar materyalleri % 100 maltodekstrin, % 100 gam arabik ve % 50:50 gam arabik:maltodekstrin kombinasyonu olarak belirlenmiştir. Enkapsülasyon yöntemi olarak ise homojenizatör ile mekanik enkapsülasyon yapılmıştır. Mekanik homojenizasyon 30 dakika süresince 15000 devir/dak.‟da gerçekleştirilmiştir. Homojenize edilen örnekler -30 oC‟de dondurulduktan sonra
liyofilizatörde (Scanvac Coolsafe 110-4 pro) kurutulmuştur. Kurutulan ve toz haline getirilen enkapsüle edilmiş mahonya suyu örnekleri ışık ve hava geçirmeyen bir kaba havası alınarak konulmuş ve daha sonra uygulanacak diğer işlem anına kadar -18 oC‟de depolanmıştır.
3.4. Depolama
Dondurma kurutma yöntemiyle kurutulmuş toz enkapsüle örnekler sıcaklık ve ışık varlığı olmak üzere iki ayrı depolama için eşit miktarda tartılarak numune kaplarına
yerleştirilmiştir. Sıcaklığın etkisini araştırmak üzere örnekler 50, 65 ve 80 o
C‟de 20 gün depolanmış ve 2 gün aralıklarla örnekler alınmıştır.
Işığın etkisine bakılacak örnekler ise 90 gün boyunca 25 oC‟de karanlık ve ışıklı
[Kompak flüoresan lamba (1200 lumen)] ortamlarda ayrı ayrı depolanmış ve 10 günde bir örnek alınmıştır. Alınan numuneler analiz süreçlerine kadar -30 oC‟de derin dondurucuda
depolanmıştır.
3.5. Analiz Yöntemleri
3.5.1. Enkapsülasyon etkinliğinin (EE) belirlenmesi
200 mg enkapsüle edilmiş örnek tartılmış ve uygun oranda metanol:asetik asit:saf su (50:8:42, v:v:v) eklenmiştir. Bu dispersiyon vortekslendikten sonra ultrasonik su banyosunda 20 dak. bekletilerek karıştırılmış ardından işlemler bir kez daha tekrarlanmıştır. 10000 rpm‟de 5 dak. santrifüj edilmiştir. Süpernatantta monomerik antosiyanin tayini yapılmıştır. Buradan toplam antosiyanin miktarı elde edilmiştir.
Yüzeysel antosiyanin hesaplaması için, 200 mg enkapsüle edilmiş toz halindeki mahonya antosiyaninlerine uygun oranda etanol:metanol (1:1, v:v) karışımı ile muamele edilmiştir. Bu dispersiyonlar oda sıcaklığında vortekslenmiş ve sonra filtre edilmiştir. Bu örneklerle yine monomerik antosiyanin analizi yapılarak elde edilen sonuçlar Eşitlik 3.1, 3.2, 3.3 ile enkapsülasyon etkinliği hesabında kullanılmıştır (Robert ve ark., 2010).
( ) *( ) + (3.1)
3.5.2. Toplam monomerik antosiyanin tayini
Toplam monomerik antosiyanin miktarı pH diferansiyel metoduyla belirlenmiş ve sonuçlar mg siyanidin-3-glukozit eşdeğeri/L olarak verilmiştir. Örnekler potasyum klorit ve sodyum asesatla seyreltilmiş ve 515 ve 700 nm dalga boyundaki absorbans değeri ölçülmüştür. Toplam monomerik antosiyanin miktarı siyanidin-3-glukozit eşdeğeri olarak aşağıdaki formülle hesaplanmıştır (Giusti ve Wrolstad (2003); Ko ve ark. (2017)).
( ) ( ) ( ) (3.3)
Burada;
MW =Siyanidin-3-glukozidin moleküler ağırlığı (449,2 g/mol)
Ɛ =Siyanidin-3-glukoziti için molar yok etme (extinction) kat sayısı (26900 M-1
cm-1) D = Seyreltme faktörü
l =Işığın kat ettiği yol (1 cm)
3.5.3. Renk tayini
Saf suda çözündürülenenkapsüle edilmiş mahonya sularının L*, a*, b*, h ve C* değerleri Konika Minolta CM-5 model kolorimetre (Konika-Minolta, Osaka, Japan) ile ölçülmüştür. Şekil 3.1.‟de verilen CIELAB renk skalasına göre L* parlaklığı (L*=0, siyah;
L*=100, beyaz), +a* kırmızılığı, -a* yeşilliği ve +b* değeri sarılığı, -b* maviliği ifade eder. L* değerinde 50 griliği ifade etmekte olup, 100‟e doğru artan örneklerde beyazlık, 0‟a doğru
azalma ise siyahlığın artışını ifade etmektedir. +a* değeri arttıkça örneklerde kırmızılık artarken, - a* değeri artarken yeşillik artmaktadır. Aynı durum b* değeri içinde geçerli olup
+b* değeri arttıkça örneklerde sarılık, -b* değeri arttıkça ise mavilik artış göstermektedir. h
(hue) değeri renk tonunu ve C* değeri (Chroma) ise renk doygunluğunu göstermektedir (Akbulut ve COklar, 2008).
3.6. Kinetik katsayıların hesaplanması
Enkapsüle edilmiş mahonya meyvesi suyunun farklı sıcaklıklarda depolanması sırasında antosiyaninlerin degradasyon kinetiği araştırılmıştır. Çalışılan tüm sıcaklıklarda mahonya meyvesi antosiyaninlerinin degradasyonunun birinci dereceden reaksiyon kinetiğine uygun olarak gerçekleştiği belirlenmiştir. Antosiyaninlerin sıcaklıktan etkilenme kinetik değerlerinin elde edilmesinde Arrhenius eşitliğinden yararlanılmıştır.
3.6.1.Reaksiyon hız sabitinin (k) hesaplanması
Reaksiyon hız sabitinin hesaplanması için her bir sıcaklıktaki süreler “x” eksenine, ısıtma süresince belirli aralıklarla alınan örneklerin antosiyanin değerlerinin doğal logaritması ise “y” eksenine yerleştirilmiş ve bu şekilde yarı logaritmik bir grafiğin doğrusal eğrisi elde edilmiştir. Elde edilen bu grafiğin denkleminin eğimi reaksiyon hız sabiti (k) olarak alınmıştır. Birinci derece reaksiyon kinetik formülü Eşitlik 3.4.‟te verilmiştir.
(3.4)
Co: Antosiyaninlerin başlangıçtaki konsantrasyonu
C: t süre sonunda kalan antosiyanin konsantrasyonu
k: Reaksiyon hız sabiti (dak-1)
t: süre (dak.)
3.6.2. Aktivasyon enerjisinin (Ea) hesaplanması
Aktivasyon enerjisi Arrhenius Eşitliği‟nden (3.5) yararlanılarak hesaplanmıştır (Labuza ve Riboh, 1982).
(3.5)
k: Hız sabiti
Ea: Aktivasyon enerjisi (J/mol) T: Sıcaklık (K)
A: Frekans faktörü
3.6.3. Sıcaklık katsayısının (Q10) hesaplanması
Sıcaklık katsayısı bir reaksiyonun sıcaklığının 10 oC artırılmasıyla reaksiyonda hızının
kaç kat artacağını belirten değerdir. Eşitlik 3.6‟ya göre hesaplanmıştır.
( ) ( )
(3.6)
3.6.4. Yarılanma süresinin (t1/2) hesaplanması
Yarılanma süresi (t1/2) araştırma konusu bileşiğin veya herhangi bir kalite kriterinin
%50‟sinin parçalanması için gereken süredir. Birinci derece reaksiyonlar için yarılanma süresinin hesaplanmasında denklem 3.7 kullanılmıştır (Labuza, 1984).
4. ARAġTIRMA SONUÇLARI VE TARTIġMA
4.1. Enkapsülasyon etkinliği
Enkapsülasyon tekniği sayesinde aktif bileşenin, nem, ışık, oksijen veya ısı gibi çevre koşullarından korunduğu daha önce yapılan çalışmalarda belirtilmiştir. Kapsülleme teknikleri için optimum işlem koşulları her aktif ve duvar malzemesi için sağlanmalıdır (Özkan ve Bilek, 2014).
Bu çalışmada mahonya meyvesinden elde edilen ve duvar materyali ilave edilen mahonya suyu örneklerine mekaniksel (MH) ve ultrasonik destekli mekaniksel (UMH) olmak üzere iki farklı homojenizasyon yöntemi uygulanarak enkapsülasyon etkinliği üzerindeki etkileri belirlenmiştir.
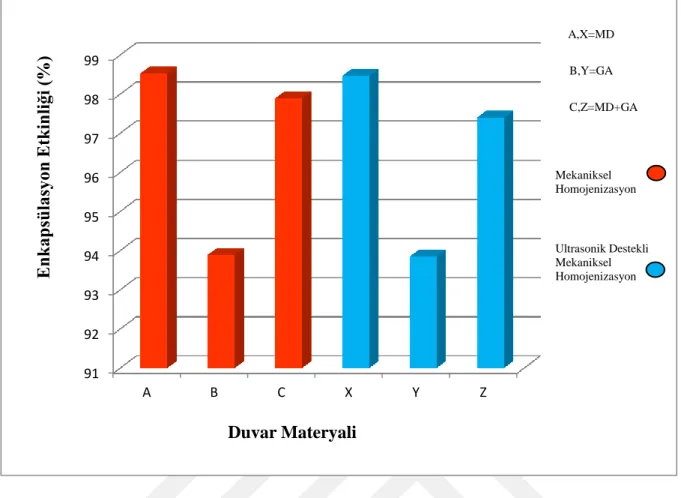
Çizelge 4.1.ve Şekil 4.1.'de taşıyıcı materyal olarak maltodekstrin (MD), gam arabik (GA), ve gam arabik:maltodekstrin (GA:MD) kombinasyonu (1:1) kullanılarak mahonya meyvesi antosiyaninlerinin farklı homojenizasyon yöntemleriyle enkapsüle edilmesi sonrasında elde edilen enkapsülasyon etkinliği sonuçları gösterilmiştir. Mahonia aquifolium meyvesi antosiyaninlerinin MH yönteminde MD, GA ve MD+GA karışımında enkapsülasyon etkinliği sırasıyla % 98.53, 93.89 ve 97.89 olarak belirlenirken UMH yönteminde ise enkapsülasyon etkinliği sırasıyla % 98.47, 93.85 ve 97.40 olarak tespit edilmiştir. En yüksek enkapsülasyon etkinliği MH yöntemi ile MD‟de görülürken, en düşük enkapsülasyon etkinliği UMH ile GA‟de tespit edilmiştir. MH yöntemiyle ve UMH yöntemiyle yapılan enkapsülasyonlar arasında etkinlik bakımından çok önemli bir farklılık görülmemiştir.
Çizelge 4.1. Taşıyıcı materyal olarak MD, GA ve GA:MD kombinasyonu (1:1) kullanılarak mahonya meyvesi antosiyaninlerinin farklı homojenizasyon yöntemleriyle enkapsüle edilmesi sonrasında elde edilen enkapsülasyon etkinliği
Enkapsülasyon Etkinliği (%) Duvar Materyali Mekaniksel
homojenizasyon
Ultrasonik destekli mekaniksel homojenizasyon
MD 98.53 98.47
GA 93.89 93.85
MD+GA 97.89 97.40
ġekil 4.1. Taşıyıcı materyal olarak MD, GA ve MD+GA kombinasyonu (1:1) kullanılarak mahonya meyvesi antosiyaninlerinin farklı homojenizasyon yöntemleriyle enkapsüle edilmesi sonrasında elde edilen enkapsülasyon etkinliği
Enkapsülasyon etkinliği, duvar materyalinin, iç malzemeyi mikrokapsül içinde tutma potansiyeli anlamına gelir ve ayrıca, antosiyanin içeriğinin raf ömrü üzerine de etkilidir.
Kerkede antosiyaninlerinin MD, GA ve MD+GA kombinasyonu ve nişasta ile enkapsüle edildiği bir araştırmada en yüksek antosiyanin kapsülleme etkinliğinin % 99.87 ile MD+GA kombinasyonunda olduğu bunu sırasıyla MD (% 99.69), MD+GA (% 98.4) ve nişastanın (% 96.7) takip ettiği belirtilmiştir (Idham ve ark., 2012).
Kaderides ve ark. (2015), nar kabuğu ekstraktını MD-peynir altı suyu proteini izolatı, MD-yağsız süt tozu, yağsız süt tozu, MD-GA ve MD ile enkapsüle etmiştir. Kapsülleme etkinliği, MD-peynir altı suyu proteini izolatı için ortalama % 98.64 iken, MD-yağsız süt tozu, yağsız süt tozu, MD-GA ve MD için sırasıyla % 97.17, 91.49, 73.82 ve 69.80‟e düştüğünü rapor etmişlerdir. 91 92 93 94 95 96 97 98 99 A B C X Y Z E n k ap sü lasyo n E tkin li ği (% ) Duvar Materyali A,X=MD B,Y=GA C,Z=MD+GA Mekaniksel Homojenizasyon Ultrasonik Destekli Mekaniksel Homojenizasyon
4.2. Enkapsüle Mahonia aquifolium Antosiyaninlerinin Farklı Sıcaklık ve IĢık Etkisinde Parçalanma Kinetiği
Depolama ve dağıtım sırasında, yiyecekler çok çeşitli çevresel koşullara maruz kalır. Sıcaklık, nem, oksijen ve ışık gibi çevresel faktörler, gıda bozulmasına neden olabilecek çeşitli reaksiyon mekanizmalarını tetikleyebilir. Bu nedenle, gıdaların raf ömrünün değerlendirilmesi için özel prosedürler geliştirilmeden önce gıda bozulmasına neden olan farklı reaksiyonların iyi bir şekilde anlaşılması şarttır (Singh, 1994).
Kinetik modeller genellikle gıda güvenliğinin nesnel, hızlı ve ekonomik bir değerlendirmesi için kullanılır. Kinetik modelleme, işlemenin kritik kalite parametreleri üzerindeki etkisini tahmin etmek için de kullanılabilir. Reaksiyon sırası, hız sabiti ve aktivasyon enerjisi de dahil olmak üzere bozunma kinetiği bilgisi, depolama sırasında gıda kalitesi kaybını ve ısıl işlem işlemlerini tahmin etmek için çok önemlidir. Gıda işlemede dikkat edilmesi gereken önemli faktörlerden biri besin kaybıdır. Bu nedenle, istenmeyen değişimi en aza indirmek ve belirli gıdaların kalitesini optimize etmek için kinetik çalışmalara ihtiyaç vardır (Patras ve ark., 2010).
Farklı sıcaklıklarda, karanlık ve ışık ortamlarında depolanan enkapsüle edilmiş mahonya meyvesi suyu antosiyaninlerinin reaksiyon hız sabitleri (k) belirlenmiştir. Numunelerin hız sabitleri kullanılarak aktivasyon enerjisi (Ea), Q10, D değeri ile yarılanma
ömürleri (t1/2) hesaplanmıştır.
4.2.1. Reaksiyon hız sabiti (k)
Farklı sıcaklıklarda, karanlıkta ve ışıklı ortamda depolanmış örneklerde monomerik antosiyanin analizi yapılmış ve elde edilen veriler depolama sırasında antosiyanin parçalanmasının birinci dereceden reaksiyon kinetiğine uyduğunu göstermiştir. Gıda kalitesinde kayba neden olan çoğu reaksiyonun sıfır veya birinci dereceden kinetiğe göre ilerlediği daha önce yapılan araştırmalarda ifade edilmektedir (Pua ve ark., 2008).
Kara ve Erçelebi (2013), Wang ve Wang (2000), Wang ve Xu (2007) ve Chisté ve ark. (2010)‟a göre antosiyaninlerin termal bozulması birinci dereceden reaksiyon kinetiğine göre olmaktadır.
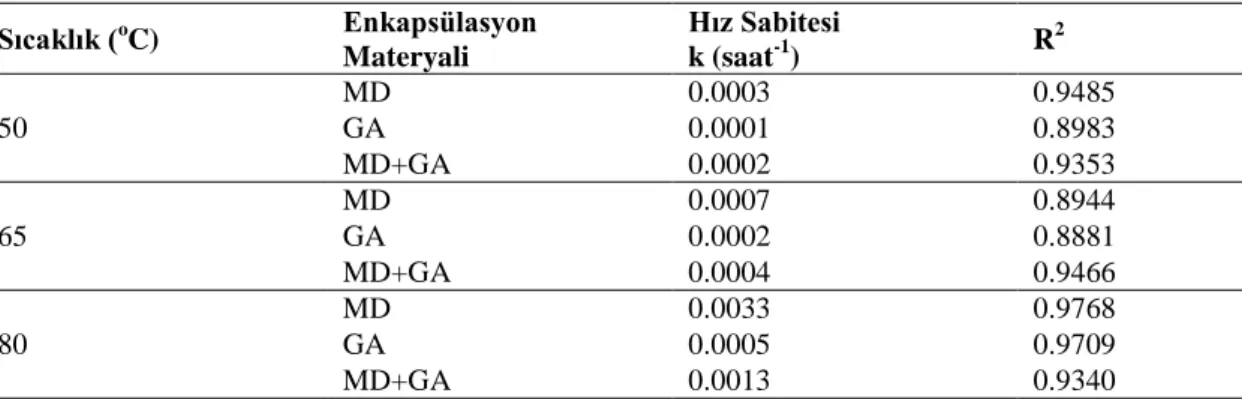
Çizelge 4.2.‟de farklı duvar materyalleriyle enkapsülasyonu gerçekleştirilmiş mahonya meyvesi antosiyaninlerinin 50, 65 ve 80 oC sıcaklıklardaki reaksiyon hız sabitleri (k, saat-1 ) ve korelasyon katsayıları (R2
Çizelge 4.2. MD, GA ve MD+GA karışımı ile enkapsüle edilen mahonya meyvesi suyunun seçilen sıcaklıklardaki hız sabitleri Sıcaklık (oC) Enkapsülasyon Materyali Hız Sabitesi k (saat-1) R 2 50 MD 0.0003 0.9485 GA 0.0001 0.8983 MD+GA 0.0002 0.9353 65 MD 0.0007 0.8944 GA 0.0002 0.8881 MD+GA 0.0004 0.9466 80 MD 0.0033 0.9768 GA 0.0005 0.9709 MD+GA 0.0013 0.9340
Tüm sıcaklıklardaki hız sabiti değerleri kendi arasında değerlendirildiğinde en yüksek hız sabitinin MD ile enkapsüle edildiği örneklerde olduğu görülmektedir. En düşük değerler ise GA ile enkapsüle edilen örneklerde belirlenmiştir.
Literatürdeki birçok çalışmada bildirildiği üzere sıcaklık antosiyaninlerin stabilitesi üzerine olumsuz etki yapmaktadır ((Tonon ve ark., 2010); Osorio ve ark. (2010); Chisté ve ark. (2010); Rodrigo ve ark. (2007)).
Bactris guineensis meyvesinin antosiyaninleri MD ile kapsüle edilmiştir. Analiz
örneklerin 100 °C'ye kadar oldukça kararlı olduklarını ortaya koymuştur. Mikrokapsüllerin depolanma stabilitesi testleri, işlem hızının sıcaklık ile arttığını göstermiştir. Depolama için en uygun şartlar sırasıyla 37 °C olarak belirlenmiştir (Osorio ve ark., 2010).
Idham ve ark. (2012) tarafından Roselle calyces antosiyaninleri, MD, GA, MD+GA kombinasyonu ve nişasta kullanılarak mikrokapsülleme tekniği kullanılarak kapsüllenmiştir. Depolama sıcaklığındaki artış, yalnızca GA ve nişasta ile kapsüllenmiş antosiyaninler için 4 ve 25 °C hariç tüm numunelerin oran sabitinde (k) bir artışa neden olmuştur. Sonuçlar, 4 °C 'de, bozulma oranı sabit değerinin çok düşük olduğunu ve kapsüllenmiş numuneler için kontrol numunesinin 5.7x10−3/gün ile 4.2-7.7x10−3/gün arasında değiştiğini göstermektedir. Antosiyanin bozunması için hız sabitinin en yüksek değeri, değerlendirilen tüm kaplama materyalleri için 37 °C'de gözlenmiştir.
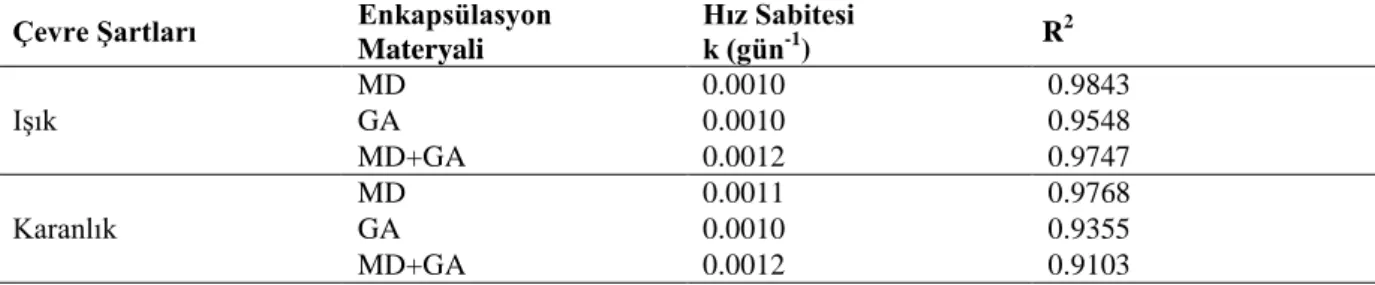
Çizelge 4.3.‟de farklı duvar materyalleriyle enkapsülasyonu gerçekleştirilmiş mahonya meyvesi suyunun ışığın etkisine bağlı olarak reaksiyon hız sabitleri ve korelasyon katsayıları belirlenmiştir. Tüm duvar materyalleri için ışığın etkisi göz önüne alındığında reaksiyon hız sabiti değerlerinin birbirlerine çok yakın olduğu tespit edilmiştir. Bu durumdan, ışık ortamında depolanma olsa dahi stabilitenin korunduğu anlaşılmaktadır. Her üç duvar materyalinin de antosiyaninleri ışıktan koruduğu görülmektedir.
Çizelge 4.3. MD, GA ve MD+GA karışımı ile enkapsüle edilen mahonya meyvesi suyunun ışığın etkisine bağlı olarak reaksiyon hız sabitleri
Çevre ġartları Enkapsülasyon
Materyali Hız Sabitesi k (gün-1 ) R 2 Işık MD 0.0010 0.9843 GA 0.0010 0.9548 MD+GA 0.0012 0.9747 Karanlık MD 0.0011 0.9768 GA 0.0010 0.9355 MD+GA 0.0012 0.9103
Antosiyaninlerin ışıktan etkilendiği ve çoğunlukla parçalanmaya uğradığı yapılan araştırmalarda ifade edilmektedir.
Chisté ve ark. (2010), mangosten meyvesi kabuğundan elde edilen antosiyanin ekstraktının farklı ışık kaynakları (flüoresan, akkor, kızılötesi ve ultraviyole) etkisi altında stabilitesini incelemişlerdir. Kızılötesi ışık, antosiyanin içeriğini çok hızlı bir şekilde düşürürken, depolama süresi boyunca en yüksek antosiyanin bozunma hızı kızılötesi ışıkta görülmüştür. Kızılötesi ışık kaynağını ultraviyole, akkor ve flüoresan ışıkların takip ettiği belirtilmiştir. Bozunma reaksiyonu sabit oranı (k), 1.1x10-3
-6.9x10-3 sa-1 arasında değişmiştir.
4.2.2. Aktivasyon enerjisi (Ea), sıcaklık katsayısı (Q10) ve D değeri
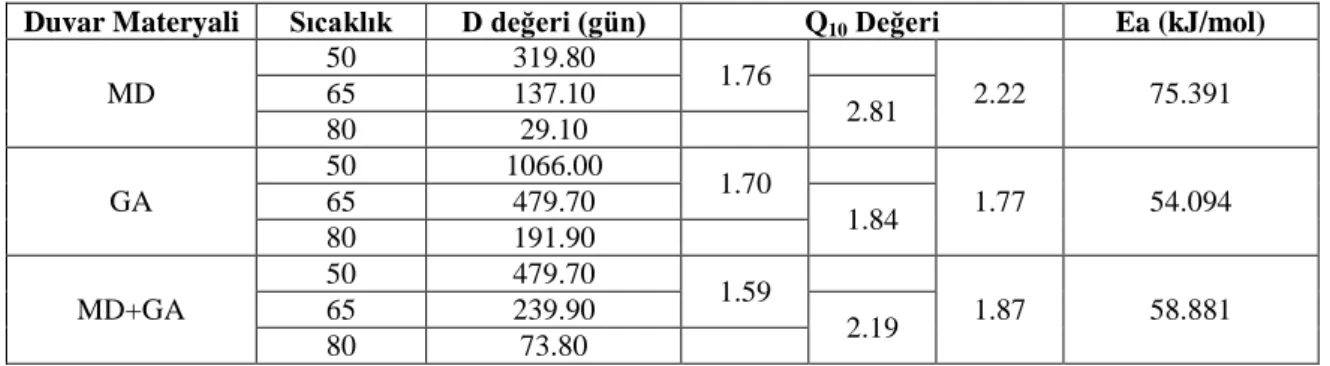
Çizelge 4.4.‟de farklı duvar materyalleriyle enkapsüle edilen mahonya meyvesi antosiyaninlerinin termal parçalanma kinetiğine ait aktivasyon enerjisi, sıcaklık katsayısı (Q10), D değerleri verilmiştir.
Aktivasyon enerjisi (Ea), reaksiyonun başlayabilmesi için gerekli olan en düşük enerji miktarıdır. Aktivasyon enerjisi (Ea) değeri, reaksiyonun sıcaklık hassasiyetinin bir ölçüsüdür, yani sıcaklık yükseltilirse ne kadar hızlı olacağını ifade etmektedir (Labuza, 1984).
Aktivasyon enerjisi değerleri MD, GA ve MD+GA için sırasıyla 75.391, 54.094, 58.881 kj/mol olarak bulunmuştur. En düşük aktivasyon enerjisine sahip materyalin GA olduğu ve arkasından MD+GA ve MD ile enkapsüle edilen örneklerin geldiği görülmüştür.
CAO ve ark. (2011) kan portakal suyu antosiyaninlerinin termal bozunma degradasyonu için Ea değerini 55.81 kJ/mol olarak bulmuştur.
Ahmed ve ark. (2004) erik püresi antosiyaninlerinin termal bozulma kinetiği için aktivasyon enerjisini 37.48 kJ/mol olarak elde etmişlerdir.
Çizelge 4.4. MD, GA ve MD+GA karışımı ile enkapsüle edilen mahonya meyvesi suyunun bazı kinetik parametreleri (aktivasyon enerjisi, sıcaklık katsayısı (Q10), D değeri)
Duvar Materyali Sıcaklık D değeri (gün) Q10 Değeri Ea (kJ/mol)
50 319.80 1.76 2.22 75.391 MD 65 137.10 2.81 80 29.10 50 1066.00 1.70 1.77 54.094 GA 65 479.70 1.84 80 191.90 50 479.70 1.59 1.87 58.881 MD+GA 65 239.90 2.19 80 73.80
Wang ve Xu (2007) 8.90 ve 65.0 oBx değerindeki böğürtlen (Rubus fruticosus L.) suyu ve konsantresindeki antosiyaninlerin termal degradasyonunu ve depolama stabilitelerini incelemişlerdir. Isıtma sırasında böğürtlen antosiyaninlerinin parçalanması için aktivasyon enerji değerlerini, böğürtlen suyu için 58.95 kJ/mol böğürtlen suyu konsantresi için ise 75.5 kJ/mol olarak tespit etmişlerdir. 8.90 oBx‟teki böğürtlen suyundaki antosiyaninlerin daha hızlı bir şekilde bozulduğunu rapor etmişlerdir.
Farklı duvar materyalleriyle enkapsüle edilen mahonya meyvesi antosiyaninlerinin % 90‟nının parçalanması için geçen süre yani D değeri Çizelge 4.4.‟te görülmektedir.
Sıcaklık artışına bağlı olarak tüm duvar materyallerinde D değerinde düşüş görülmüştür. En yüksek D değeri 50 oC‟de 1066 gün ile GA ile enkapsüle edilen örneklerde,
aynı sıcaklıkta en düşük D değeri ise 319.8 gün ile MD‟de hesaplanmıştır. 65 ve 80 oC‟de de
benzer durum görülmüştür. Elde edilen verilerden anlaşıldığı üzere D değeri açısından sıcaklığa karşı en yüksek stabilite sağlayan materyalin GA olduğu bunu sırasıyla MD+GA ve MD‟nin takip ettiği anlaşılmaktadır.
Çizelge 4.4.‟te farklı duvar materyalleriyle enkapsüle edilen mahonya meyvesi antosiyaninlerinin sıcaklık katsayısı (Q10) değerleri verilmiştir. Q10 sıcaklıktaki 10 oC artışın
reaksiyon hızını kaç kat artacağını ifade eder. En büyük Q10 değeri MD‟de 65 ve 80 oC
arasında 2.81 olarak, aynı sıcaklık aralığında en düşük Q10 değeri ise 1.84 olarak GA‟te
görülmüştür. Elde edilen veriler doğrultusunda MD ile enkapsüle edilen örnekler sıcaklık değişiminden en fazla etkilenirken GA ile enkapsüle edilen örnekler en az etkilendiği söylenebilir.
Yapılan bir araştırmada mangosten kabuğundan elde edilen antosiyanin ekstraktında antosiyanin degradasyonu için Q10 değerleri 5-28, 28-40 ve 40-50 oC‟de sırasıyla 10.8, 2.9 ve
4.2.3. Yarılanma süresi (t1/2)
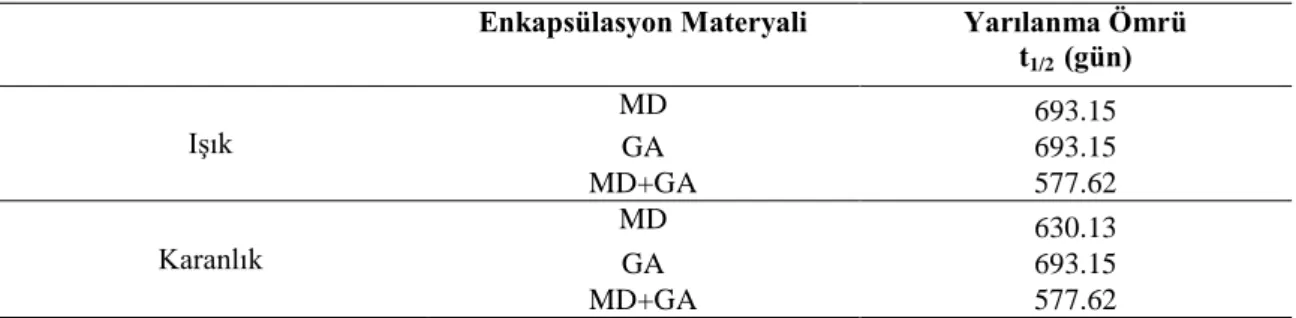
Yarılanma ömrü ürünün raf ömrü hakkında bilgi veren önemli parametrelerden biridir. Madde miktarının yarıya inmesi için geçen zamana yarılanma süresi denir. Farklı duvar materyalleriyle enkapsüle edilen mahonya meyvesi antosiyaninlerinin termal degradasyonuna ait yarılanma süresi (t1/2) Çizelge 4.5.‟te, ışık altında degradasyonuna ait yarılanma süresi
değerleri ise Çizelge 4.6.‟te verilmiştir.
50, 65 ve 80 °C‟de depolanan GA örneklerinde 324.90, 144.41 ve 57.76 gün olmak üzere en uzun yarılanma süresi belirlenmiştir. En kısa yarılanma süresi ise 50, 65 ve 80 °C‟de sırasıyla 96.27. 41.26. 8.75 gün ile MD‟de tespit edilmiştir. Elde edilen verilere göre MD ile enkapsüle edilen örneklerin her üç sıcaklıkta da daha hızlı bozunuma uğradığı, GA‟in ise antosiyanin parçalanmasını daha fazla geciktirdiği söylenebilir.
CAO ve ark. (2011)‟ı kan portakal suyunun termal bozulma kinetiğini seçilen sıcaklıklarda (70-90 °C) incelediklerinde yarılanma sürelerini 70, 80 ve 90 °C'de sırasıyla 8.21, 5.33 ve 2.79 saat olarak bulmuşlardır.
Tonon ve ark. (2010) maltodekstrin ile enkapsüle edilen açai suyu antosiyaninlerinin yarı ömrünün gum arabik ile enkapsüle edilenlerden daha yüksek olduğunu belirlemişlerdir.
Çizelge 4.5. MD, GA ve MD+GA karışımı ile enkapsüle edilerek 50, 65 ve 80 oC‟de depolanan mahonya
meyvesi suyunun yarılanma ömrü (t1/2)
Sıcaklık (o
C) Enkapsülasyon Materyali Yarılanma Ömrü
(t1/2 (gün)) 50 MD 96.27 GA 324.90 MD+GA 144.41 65 MD 41.26 GA 144.41 MD+GA 72.20 80 MD 8.75 GA 57.76 MD+GA 22.22
Işıklı ortamda ve karanlıkta depolanan örneklerin yarılanma ömürleri incelendiğinde (Çizelge 4.6.) genel olarak GA ve MD+GA kombinasyonu ile enkapsüle edilen örneklerin ışıktan etkilenmediği görülmektedir. MD ile enkapsüle edilen örneklerin karanlıkta depolanması ile yarılanma ömrünün 693.15 gün, ışıklı ortamda depolanması durumunda ise 630.13 gün olduğu hesaplanmıştır. GA‟in duvar materyali olarak antosiyaninleri ışıktan daha iyi muhafaza ettiği görülmektedir.
Çizelge 4.6. MD, GA ve MD+GA karışımı ile enkapsüle edilerek ışıklı ve karanlık ortamda depolanan mahonya meyvesi suyunun yarılanma ömrü (t1/2)
Enkapsülasyon Materyali Yarılanma Ömrü
t1/2 (gün) Işık MD 693.15 GA 693.15 MD+GA 577.62 Karanlık MD 630.13 GA 693.15 MD+GA 577.62
Mangosten kabuğundan elde edilen antosiyanin ekstraktının yarı ömrü üzerine farklı ışık kaynaklarının etkisinin araştırıldığı bir çalışmada flüoresan ışığı altında antosiyaninlerin yarı ömürlerinin 597 saat, akkorda 306 saat, ultraviyolede 177 saat ve kızılötesinde ise 100 saat olduğu rapor edilmiştir (Chisté ve ark., 2010).
Taşıyıcı madde olarak MD kullanıldığı, böğürtlen (Rubus glaucus Benth) antosiyaninlerinin dondurarak kurutulduğu ve içeceklerin renklendirilmesinde kullanıldığı bir araştırmada antosiyanin parçalanmasına ait yarılanma ömrünün 27-32 gün arasında değiştiği, ışık altında depolanan içeceklerdeki antosiyaninlerin yarılanma ömrünün karanlıkta depolananlardan daha yüksek olduğu belirlenmiştir (Estupiñan ve ark., 2011).
MD, MD+GA, MD-jelatin ile enkapsüle edilen kadın tuzluğu (Berberis vulgaris) ekstraktında enkapsülasyon ile antosiyanin parçalanma yarı ömrünün önemli ölçüde arttığı, en iyi duvar materyalinin ise MD+GA kombinasyonunun olduğu rapor edilmiştir (Mahdavi ve ark., 2016).
4.3. Reflektans renk sonuçları
Meyve ve meyve ürünlerinin temel duyusal özelliklerinden biri renktir ve önemli bir kalite parametresi olarak kabul edilir. Bu durum rengin araştırmalar içerisinde önemli bir yer edinmesini sağlamıştır. Mahonia aqufolium meyvesi suyu antosiyaninlerinin depolama stabilitelerinin yanında enkapsüle edilmiş örneklerin renk analizleri gerçekleştirilmiştir.
Duvar materyalleri olarak MD, GA ve kombinasyonları kullanılarak enkapsüle edilen
Mahonia aquifolium meyvesi sularının farklı sıcaklıklarda (50, 65, 80 °C) 22 gün ve ışık
etkisinde 100 gün depolanması sonucunda elde edilen refrektans renk değerleri (L*, a*, b*, C* ve h) ve ∆E değerleri Çizelge 4.7., 4.8., 4.9., 4.10., 4.11., 4.12., 4.13., 4.14., 4.15., 4.16., 4.17., 4.18., 4.19.‟de verilmiştir. L* değeri parlaklığı, a* değeri kırmızılığı ve yeşilliği, b* değeri sarılığı ve maviliği ifade ederken C* ve h değerleri ise sırasıyla renk doygunluğunu ve
hunter renk skalasındaki açı değerini göstermektedir. L*, a* ve b* refrektans renk değerleri,
renk değişimini en iyi şekilde gösteren ve stabilitenin belirlenmesinde kullanılan önemli parametrelerdir (Rodrigo ve ark., 2007).
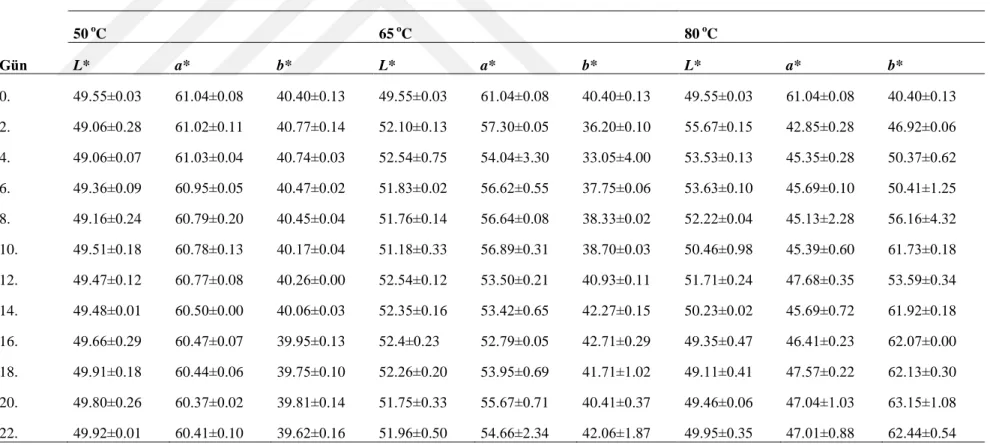
Çizelge 4.7.‟ de görüldüğü üzere MD ile enkapsüle edilen ve 50, 65, 80 o
C‟de depolanan Mahonia aqufolium meyvesi suyunun 0. Gündeki (Kontrol örnekleri) L*, a* ve b* değerleri sırasıyla 49.55±0.03, 61.04±0.08 ve 40.40±0.13 olarak tespit edilmiştir. Depolamanın 22. gününde L*, a* ve b* değerleri 50 oC‟de depolananlarda 49.92±0.01, 60.41±0.10 ve 39.62±0.16, 65 oC‟de depolananlarda 51.96±0.50, 54.66±2.34 ve 42.06±1.87 ve 80 oC‟de depolananlarda ise 49.95±0.35, 47.01±0.88 ve 62.44±0.54 olarak ifade edilmiştir. MD ile enkapsüle edilen örneklerde depolama süresince bütün sıcaklık parametrelerinde L* değerlerinde çok az bir artış görülmüştür. a* değerinde sıcaklık ve süre artışıyla birlikte bir azalış görülürken b* değerinde bir artış tespit edilmiştir. 80 °C‟ de depolanan örneklerde a* değerinde en büyük azalış ve b* değerinde en fazla artış belirlenmiştir.
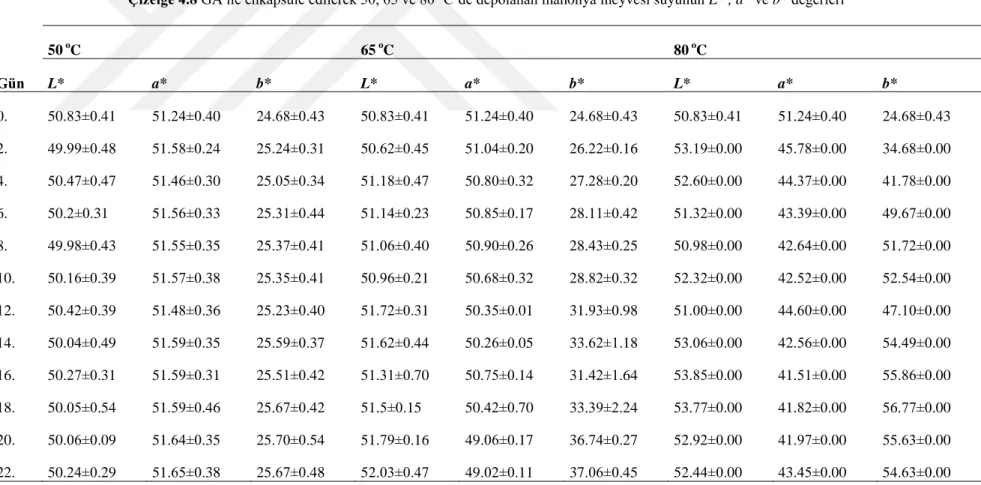
Çizelge 4.8.‟deki verilere göre GA ile enkapsüle edilen ve 50, 65, 80 °C‟de depolanan
Mahonia aqufolium meyvesi suyunun 0. Gündeki (Kontrol örnekleri) L*, a* ve b* değerleri
sırasıyla 50.83±0.41, 51.24±0.40, 24.68±0.43 olarak tespit edilmiştir. Maltodekstrin ile enkapsüle edilen örneklerde depolama süresince bütün sıcaklık parametrelerinde L* değerlerinde çok az bir değişim görülmüştür. L* değerinde 50 °C‟de çok az bir azalma, 65 ve 80 °C‟de çok az bir artış olduğu tespit edilmiştir. L* değerleri 22. günde 50, 65, 80 °C‟de sırasıyla 49.91±0.18, 52.26±0.20, 49.11±0.41 olarak belirlenmiştir. a* değerinde depolama sıcaklığı arttıkça azalma olurken, b* değerinde artma olmuştur. 80 °C‟de a* değerinde en fazla azalma, b* değerinde en fazla artış olmuştur. a* değeri 22. günde 47.01±0.88 değerine düşerken, b* değeri 62.44±0.54‟e yükselmiştir.
MD+GA karışımı ile enkapsüle edilen ve 50, 65, 80 °C‟de depolanan Mahonia
aqufolium meyvesi suyunun 0. Gündeki (kontrol örnekleri) L*, a* ve b* değerleri Çizelge
4.9.‟da belirtilmiş olup sırasıyla 46.64±0.73, 52.56±0.98, 26.53±1.43 olarak gösterilmiştir. L* değerinde 50 °C‟de çok az bir azalma, 65 ve 80 °C‟de çok az bir artış tespit edilmiştir. L* değerleri 22. günde 50, 65 ve 80 °C de sırasıyla 46.50±0.69, 49.05±0.66 ve 47.06±0.25 olarak belirlenmiştir.
Depolamanın 22. gününde MD+GA karışımı ile enkapsüle edilen örneklerin a* ve b* değerleri 50 °C‟de depolananlarda 52.47±0.81 ve 27.82±1.39, 65 °C‟de depolananlarda 51.16±0.98 ve 35.23±0.53, 80 °C‟de depolananlarda ise 47.78±0.26 ve 58.21±1.31 olarak belirlenmiştir. a* değerinde depolama sıcaklığı arttıkça azalma olurken, b* değerinde artma olmuştur. 80 °C‟de a* değerinde en fazla azalma, b* değerinde en fazla artış olmuştur.
MD ile enkapsüle edilen ve 50, 65 ve 80 oC‟de depolanan Mahonia aqufolium meyvesi suyunun 0. Gündeki (Kontrol örnekleri) C* ve h renk değerleri sırasıyla 73.20±0.14 ve 33.50±0.05 olarak tespit edilmiştir. 22. günde C* ve h renk değerleri ise sırasıyla 50 °C‟de 72.24±0.16 ve 33.26±0.06, 65 °C‟de 69.02±0.71 ve 37.60±2.41, 80 °C‟de 78.16±0.96 ve 53.03±0.28 olarak belirlenmiştir. C* değeri 50 ve 65 °C‟de azalırken 80 °C‟de artmıştır. h değeri ise 50 °C‟de azalırken, 65 ve 80 °C‟de artmıştır. C* değerindeki azalma en fazla 65 °C‟de belirlenmiştir. h değerindeki artış en fazla 80 °C‟de olmuştur (Çizelge 4.10.).
GA ile enkapsüle edilen ve 50, 65 ve 80 °C‟de depolanan Mahonia aqufolium meyvesi suyunun 0. Gündeki (kontrol örnekleri) C* ve h değerleri sırasıyla 56.87±0.54 ve 25.71±0.21 olarak tespit edilmiştir. 22. günde C* ve h değerleri ise sırasıyla 50 °C‟de 57.67±0.55 ve 26.43±0.26, 65 °C‟de 61.45±0.19 ve 37.09±0.40, 80 °C‟de 69.80±0.00 ve 51.50±0.00 olarak belirlenmiştir. Çizelde 4.11.‟deki verilerde C* ve h değerlerinin seçilen tüm sıcaklık parametrelerinde artığı tespit edilmiştir. C* ve h değerlerindeki artış en fazla 80 °C‟de görülmüştür.
MD+GA karışımı ile enkapsüle edilen ve 50, 65 ve 80 °C‟de depolanan Mahonia
aqufolium meyvesi suyunun 0. Gündeki (kontrol örnekleri) C* ve h değerleri sırasıyla
58.88±1.52 ve 26.77±0.82 olarak Çizelge 4.12.‟de verilmiştir. 22. günde C* ve h değerleri ise sırasıyla 50 °C‟de 59.39±1.37 ve 27.91±0.82, 65 °C‟de 62.12±0.51 ve 34.56±0.91, 80 °C‟de 75.31±1.18 ve 50,62±0,48 olarak belirlenmiştir. C* ve h değerlerinin seçilen tüm sıcaklık parametrelerinde artığı tespit edilmiştir. C* ve h değerlerindeki artış en fazla 80 °C‟de görülmüştür.
MD, GA ve MD+GA ile enkapsüle edilen örneklerin renk parametreleri üzerine depolama sıcaklığı ve süresine ait varyans analizi sonuçları sırasıyla ile 1, 2 ve EK-3‟de yer almaktadır.
MD ve GA ile enkapsüle edilen örneklerin L*, b*, h ve C* değerlerinin depolama süresi, depolama sıcaklığı ve depolama süresi x depolama sıcaklığı interaksiyonundan istatistiksel olarak p< 0.01 düzeyinde etkilendiği görülmüştür. Bunun yanı sıra MD ile enkapsüle edilen örneklerin a* değerinin depolama sıcaklığı ve depolama sıcaklığı x depolama süresi interaksiyonundan etkilendiği fakat depolama süresinden etkilenmediği belirlenmiştir. GA ile enkapsüle edilen örneklerin L*, b*, h ve C* olduğu a* değeri de hem depolama sıcaklığı hem de depolama süresinden etkilendiği (p<0.01) görülmüştür.
Çizelge 4.7 MD ile enkapsüle edilerek 50, 65 ve 80 oC‟de depolanan mahonya meyvesi suyunun L*, a* ve b* değerleri 50 oC 65 oC 80 oC Gün L* a* b* L* a* b* L* a* b* 0. 49.55±0.03 61.04±0.08 40.40±0.13 49.55±0.03 61.04±0.08 40.40±0.13 49.55±0.03 61.04±0.08 40.40±0.13 2. 49.06±0.28 61.02±0.11 40.77±0.14 52.10±0.13 57.30±0.05 36.20±0.10 55.67±0.15 42.85±0.28 46.92±0.06 4. 49.06±0.07 61.03±0.04 40.74±0.03 52.54±0.75 54.04±3.30 33.05±4.00 53.53±0.13 45.35±0.28 50.37±0.62 6. 49.36±0.09 60.95±0.05 40.47±0.02 51.83±0.02 56.62±0.55 37.75±0.06 53.63±0.10 45.69±0.10 50.41±1.25 8. 49.16±0.24 60.79±0.20 40.45±0.04 51.76±0.14 56.64±0.08 38.33±0.02 52.22±0.04 45.13±2.28 56.16±4.32 10. 49.51±0.18 60.78±0.13 40.17±0.04 51.18±0.33 56.89±0.31 38.70±0.03 50.46±0.98 45.39±0.60 61.73±0.18 12. 49.47±0.12 60.77±0.08 40.26±0.00 52.54±0.12 53.50±0.21 40.93±0.11 51.71±0.24 47.68±0.35 53.59±0.34 14. 49.48±0.01 60.50±0.00 40.06±0.03 52.35±0.16 53.42±0.65 42.27±0.15 50.23±0.02 45.69±0.72 61.92±0.18 16. 49.66±0.29 60.47±0.07 39.95±0.13 52.4±0.23 52.79±0.05 42.71±0.29 49.35±0.47 46.41±0.23 62.07±0.00 18. 49.91±0.18 60.44±0.06 39.75±0.10 52.26±0.20 53.95±0.69 41.71±1.02 49.11±0.41 47.57±0.22 62.13±0.30 20. 49.80±0.26 60.37±0.02 39.81±0.14 51.75±0.33 55.67±0.71 40.41±0.37 49.46±0.06 47.04±1.03 63.15±1.08 22. 49.92±0.01 60.41±0.10 39.62±0.16 51.96±0.50 54.66±2.34 42.06±1.87 49.95±0.35 47.01±0.88 62.44±0.54