T.C.
DOKUZ EYLÜL ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ KARDĠYOLOJĠ ANABĠLĠM DALI
ATRĠYAL FĠBRĠLASYONLU HASTALARDA SOL
ATRĠYUMDA TROMBÜS ve SPONTAN EKO
KONTRAST VARLIĞI ile BETA FĠBRĠNOJEN 455 G/A
POLĠMORFĠZMĠ ve GLĠKOPROTEĠN IIIa PlA1/A2
POLĠMORFĠZMĠ ARASINDAKĠ ĠLĠġKĠ
UZMANLIK TEZĠ
DR.VOLKAN BOZDEMĠR
TEZ DANIġMANI
PROF.DR. ÖNDER KIRIMLI
2
T.C.
DOKUZ EYLÜL ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ KARDĠYOLOJĠ ANABĠLĠM DALI
ATRĠYAL FĠBRĠLASYONLU HASTALARDA SOL
ATRĠYUMDA TROMBÜS ve SPONTAN EKO
KONTRAST VARLIĞI ile BETA FĠBRĠNOJEN 455 G/A
POLĠMORFĠZMĠ ve GLĠKOPROTEĠN IIIa PlA1/A2
POLĠMORFĠZMĠ ARASINDAKĠ ĠLĠġKĠ
UZMANLIK TEZĠ
DR.VOLKAN BOZDEMĠR
TEZ DANIġMANI
PROF.DR. ÖNDER KIRIMLI
3
TEġEKKÜR
Kardiyoloji uzmanlık eğitimim süresince bilgi ve deneyimlerinden yararlandığım, kişisel ve mesleki gelişimime katkıda bulunan değerli hocalarım; Prof.Dr.Sema Güneri, Prof.Dr.Özhan Göldeli, Prof.Dr.Ömer Kozan, Prof.Dr.Önder Kırımlı, Doç.Dr.Özgür Aslan, Doç.Dr.Özer Badak, Doç.Dr Bahri Akdeniz, Doç.Dr.Nezihi Barış‟a teşekkürü bir borç bilirim.
Uzmanlık eğitimim boyunca birlikte çalıştığım tüm asistan ve uzman olmuş arkadaşlarıma, Kardiyoloji Anabilim Dalı sekreteri Nesrin Eren‟e, koroner yoğun bakım sorumlusu Aylin Çandarlı‟ya, koroner yoğun bakım ve kardiyoloji servisinde çalışan tüm hemşire ve personel arkadaşlarıma, yardımlarını, bilgilerini, emeklerini esirgemedikleri için teşekkür ederim. Bu tezin oluşumasında birlikte çalıştığımız, değerli hocam Prof.Dr.Önder Kırımlı‟ya, genetik analizlerin yapılmasını sağlayan Doç.Dr.Ayfer Ülgenalp‟e ve tezin yazım aşamasında katkılarından dolayı tüm hocalarıma ayrıca teşekkür ederim.
Sevgi ve desteklerinden hayatın her aşamasında kuvvet aldığım, sevgili ailem ve sevgili eşime fedakarlıkları ve anlayışları için teşekkür ederim.
Dr.Volkan Bozdemir İZMİR-2008
4
ĠÇĠNDEKĠLER
I)GENEL BĠLGĠLER 6
I.I ATRĠYAL FĠBRĠLASYON 6
I.I.A.Tanım Ve Sınıflama 6 I.I.B.Epidemiyoloji ve Prognoz 6 I.I.C.Patofizyolojik Mekanizmalar 7 I.I.D.Hemodinamik Etkiler 8 I.I.E.Tromboembolizm 8 I.I.F.Yönetim 10
I.II ARTERĠAL TROMBOZA YATKINLIK ĠLE ĠLĠġKĠLĠ GENLER 24
I.II. A.Beta Fibrinojen 455 G/A polimorfizmi 24
I.II. B.Gilikoprotein IIIa HPA-1b (Pla2) polimorfizmi 25
II.AMAÇ 27
III. METOT 29
IV. ĠSTATĠSTĠKSEL ANALĠZ 30
V.BULGULAR 31
V.I.Hasta özellikleri ve demografi 31
V.II. Hastaların ekokardiografik özellikleri 31
V.III. Sol atriyum içinde trombüs varlığı ve hasta özellikleri 33
V.IV. Sol atriyum içinde SEK yoğunluğu ve hasta özellikleri 35
V.V.Beta fibrinojen G/A polimorfizminin ve trombüs ve/veya SEK varlığı
ile ilişkisi 36
V.VI. Beta Fibrinojen G/A polimorfizminin sıklığının çalışma popülasyonu
İçindeki KAH ve SVO/TIA varlığı ile ilişkisi 39
V.VII. Glikoprotein IIIa PlA2 polimorfizmi varlığı trombüs ve/veya yoğun
SEK varlığı ile ilişkisi 40
V.VIII. Glikoprotein PlA2 polimorfizmi sıklığının çalışma popülasyonu
İçindeki KAH ve SVO/TIA varlığı ile İlişkisi 42
VI. TARTIġMA 43
VI.I.Sol atriyum içinde trombüs veya SEK varlığı ile Beta fibrinojen G/A
polimorfizmi arasındaki ilişki 43
VI.II. Sol atriyum içinde trombüs veya SEK varlığı ile Glikoprotein IIIa PlA2
polimorfizmi arasındaki ilişki 46
VI.III. Ekokardiografik özellikler ile sol atriyal trombüs ve SEK varlığı
5
VII. SONUÇ 49
VIII. ÇALIġMANIN KISITLILIKLARI 50
IX. ÖZET 51
X.SUMMARY 52
XI. KISALTMALAR 54
6
I-) GENEL BĠLGĠLER
I.I. ATRĠYAL FĠBRĠLASYON
I.I.A. TANIM ve SINIFLAMA
Atriyal fibrilasyon (AF); Koordine olmayan atriyal aktivasyon ile atriyal mekanik fonksiyonun kaybının birlikte olduğu bir supraventriküler taşiaritmidir. Elektrokardiografik olarak AF‟de düzenli P dalgalarının yerini zamanlama, şekil ve büyüklük bakımından birbirinden farklı; 400–700/dakika hızında düzensiz dalgalar (fibrilasyon dalgaları) alır. Atriyal fibrilasyonda ventrikül hızını atriyoventriküler nodun ileti özelikleri belirler, normal bir atriyoventriküler nodun varlığında çoğu zaman düzensiz ve hızlı bir ritim ortaya çıkar (1).
Atriyal fibrilasyon etiyoloji, ortaya çıkış şekli, süresi, elektrokardiografik özelikleri gibi birçok özelliğine göre sınıflandırılmıştır. Bunlardan en çok kullanılanı zaman içindeki seyrine göre yapılan sınıflandırmadır (2,3). Eğer hasta iki veya daha fazla AF epizodu geçirdiyse rekürren AF sınıfına girer, AF epizodu kendiliğinden ve yedi gün içinde sonlanırsa (genelde ilk 24 saat) paroksismal AF, yedi günden uzun süren AF epizodu persistan AF olarak sınıflandırılır, persistan AF zamanla permenant AF'ye dönüşür (kardiyoversiyonun başarısız olması veya denenmemesi ile).
Paroksismal AF zaman içinde persistan AF'ye ilerleyebileceği gibi hem paroksismal hem de persistan AF zamanla permenant AF' ye dönüşebilir. Bahsedilen tüm tanımlamalar 30 saniye veya daha fazla süren ve geçici bir nedene bağlı olmayan (cerrahi, myokard enfarktüsü, pulmoner emboli, hipertroidizim gibi) durumlar için geçerlidir (4).
Atriyal fibrilasyon süre özeliklerinden bağımsız olarak yapısal özeliklerine göre valvüler ve valvüler olmayan AF olarak ikiye ayrılır, valvüler olmayan AF; romatizmal mitral kapak hastalığı, protez kapak hastalığı, mitral kapak onarımı geçirmiş olgular dışında kalan olgulara verilen isimdir (1).
I.I.B. EPĠDEMĠYOLOJĠ VE PROGNOZ
AF erişkin nüfusta en sık karşılaşılan ritim problemidir ve ritim bozukluğuna bağlı hastaneye yatışların üçte birinden sorumludur (5). Prevelansının genel popülasyonda % 0.4–1 arasında 80 yaşın üstünde ise %8 dolaylarında olduğu tahmin edilmektedir. Ülkemizde 3869 olguyu 8 yıl izleyen bir çalışmada 1990 yılında %0.35 olan AF prevelansının 1998 de %0.71‟e ulaştığı bildirilmiştir. Framingham kalp çalışmasında erkek cinsiyet, diabetes
7
mellitus (DM), sigara içimi, yapısal kalp hastalığının varlığı ve ciddiyeti, yaş, hipertansiyon (HT) AF gelişimi için bağımsız risk faktörleridir (6). AF uzun dönemde özelikle kadınlarda artmış inme, kalp yetmezliği ve tüm nedenlere bağlı ölüm ile birliktedir. AF tüm nedenlere bağlı ölümde bir çalışmada 1.4, başka bir çalışmada 2.3 kat rölatif risk artışı ile ilişkili bulunmuştur(8–9). Ölüm sıklığındaki artış önemli ölçüde inmedeki artış ile beraberdir (8–9). Bu anlamda inme AF'nin yönetiminde en çok üzerinde durulan ve korunma önlemleri açısından hala yeterli güvenlik/etkinlik düzeyine ulaşılamamış bir durumdur. Non valvüler AF'li olgularda iskemik inme yıllık %5 dolaylarındadır, buna sessiz serebral iskemileri de ilave edersek oran %7'ye çıkmaktadır, bu AF‟si olmayan popülasyona göre 2–7 kat armış bir riski temsil eder (9,10). Romatizmal kalp hastalığı olan AF‟li olgularda inme riski 17 kat artmıştır, bu oran non valvüler AF'li olgulara göre 5 kat artmış riski temsil eder (12). AF kalp yetmezliği çalışmalarında mortalitenin ve morbidetinin güçlü bir belirtecidir, AF kalp yetmezliğini, kalp yetmezliği AF'yi alevlendirmektedir (12).
I.IC. PATOFĠZYOLOJĠK MEKANĠZMALAR
AF‟de en sık gözlenen pathoanotomik değişiklik atriyal fibrozis ve atriyal kas kaybıdır. Histolojik çalışmalar yama tarzında fibrozis odakları ve arada normal atriyal lifler ile karekterizedir. Bu homojen olmayan dağılım homojen olmayan bir elektrik iletimine neden olmakta ve bu süreç atriyal fibrilasyonun başlaması ve devamında etkili olmaktadır (13). Atriyal fibrilasyonda fibrozise katkıda bulunan faktörler; ekstrasellüler matriks (ECM) remodelingi, insulin benzeri büyüme faktörü 2 (IMP–2) downregulasyonu, matriks metalloproteaz 2 (MMP–2) upregülasyonu, myozin ağır zincire karşı otoimmun aktivite, angiotensin II, transforming growth faktör (TGF) beta-1 upregülasyonudur (14,15). Bu anlamda anjiotensin converting enzim (ACE) inhibitörleri ve angiotensin II reseptör blokerleri fibrozisi azaltarak, AF ye karşı koruyucu olabilmektedir (16,17).
AF her ne kadar atriyal dokuda non homejenite ile ilişkili olsa da paroksismal AF'li birçok hastada pulmoner ven izolasyonu AF gelişimini engellemektedir. Bu açıdan bakıldığında özellikle pulmoner venler etrafındaki bir veya birden çok elektriksel odağın, en azından AF'nin tetiklenmesinde önemli rol oynadıkları sonucu çıkmaktadır. AF'li hastalar üzerinde yapılan çalışmalarda pulmoner venler etrafındaki atriyal dokunun diğer atriyal dokulara göre ve yine sağlıklı kontrol grubunundaki pulmoner ven dokularına göre refrakter periyodunun daha kısa olduğu tespit edilmiştir (18,19).
8
Sonuç olarak atriyal fibrilasyonun kesin nedeni şu an için net olarak bilinmemekle beraber, varsayım; özellikle büyük venlerin kalbe girdikleri noktalardaki miyokard dokusundan köken alan hızlı ektopik vuruların neden olduğu uyarıların yarattığı, atriyumda refrakterliği farklı doku adaları etrafında dönen, tekli veya çok sayıda reentran dalganın sonucunda ortaya çıktığıdır (20).
I.I.D HEMODĠNAMĠK ETKĠLER
Atriyal fibrilasyon hem atriyumun kasılma fonksiyonunun kaybı hem de ventriküler hızın kontrolsüz artması ve düzensiz olması nedeniyle ciddi hemodinamik kötüleşmeye yol açabilir (21).
Atriyal kasılma özellikle diyastolik fonksiyonların bozulduğu durumlarda ventrikül doluşunun önemli bir parçasını oluşturur, atriyal kasılmanın kaybı diyastolik doluşun azalmasına, dolayısıyla kardiyak debinin azalmasına neden olur. Bununla beraber düzensiz ventriküler aktivitenin de atım hacminde azalmaya ve koroner kan akımında azalmaya neden olduğu gösterilmiştir (22).
Uzun süreli ventriküler hızın fazla olması taşikardinin indüklediği dilate kardiyomyopatiye neden olabilir. Ventrikül hızının kontrolü bu durumun gerçekleşmesini engeller, dilate kardiyomyopati gelişen olguların ise normale dönmesini sağlar. Bu durumun gelişmesi için geçen süre net bilinmemekle beraber her hastada aynı sonuç ortaya çıkmamaktadır (23).
Ventriküler hızın sürekli fazla olmasıyla gelişen ventriküler dilatasyon gibi atriyal hızın da sürekli fazla olması atriyal dilatasyona neden olur ve bu hız sinüs ritminin sağlanması dışında azaltılamayacağı için özellikle permenant AF' de önüne geçilemeyen bir süreçtir (24).
I.I.E TROMBOEMBOLĠZM
Atriyal fibrilasyon ile ilgili problemlerin ve tedavi konusundaki güçlüklerin büyük bölümü tromboembolizm riski ve bu riskin azaltılması ile ilgilidir. İskemik inmeli olguların %15-25‟inden atriyal fibrilasyonun sorumlu olduğu düşünülmektedir (25,26). Bununla beraber atriyal fibrilasyonu olan ve iskemik inme geçiren olguların %25‟inden fazlasında intrensek serobrovasküler hastalık, başka bir kardiyak emboli kaynağı veya proksimal aortadaki ateromatöz patoloji sorumludur (27,28).
9
Yıllık inme oranı hiçbir yapısal kalp hastalığı olmayan genç hastalarda %0,5 iken, önceden inme geçiren AF'li olgularda %12‟lere yükselmektedir (23,28–30). AF'li olgular sinüs ritmindeki olgular ile karşılaştırıldığında ortalama olarak 6 kat artmış bir iskemik inme riski mevcuttur (29,30,31).
Trombotik materyal sıklıkla sol atriyum apendiksi (SAA) içinde oluşur ve bu bölge rutin transtorasik ekokardiyografi (TTE) ile net olarak görüntülemez, SAA'yı ve fonksiyonlarını değerlendirmek için transözefajiyal ekokardiyografi (TÖE) yapılması gerekmektedir (32). SAA içindeki trombüsü saptamada TÖE' nin sensivitesi ve spesifitesi %99 düzeyindedir (33).
Atriyal fibrilasyonda trombüs oluşum mekanizması halen çok net şekilde ortaya konmuş değildir, Virchow triadı; staz, endotel disfonksiyonu, hiperkoagulopati üçlüsü atriyum içinde oluşan trombüste de etkili mekanizmadır. Atriyal fibrilasyonda kontraktilitenin kaybı stazın en önemli nedenidir (34), SAA yapı olarak staza müsait olduğundan AF de en sık trombüs yerleşim yeri sol atriyum apendiksidir.
Sol atriyum apendiksi dar ağızlı, tüp şeklinde çengel gibi bir kıvrıma sahip olan trabeküler yapılı bir oluşumdur, bunun aksine sağ atriyal apendiks geniş ağızlı üçgen şeklinde bir yapıdır. Sol atriyal apendiksin üst superiorunda pulmoner ven, inferomedialinde sol ventrikül serbest duvarı bulunmaktadır, her iki apendikste atriyumların düz yüzeylerinin tersine trabeküler bir yapıya sahiptir (35).
AF‟de tromboz riskini arttıran birçok biyokimyasal anormallik bulunmaktadır. AF süresince sol atriyum apendiksi içerisinde Nitrik Oksit (NO) düzeyleri belirgin düşük ve protrombotik Plazminojen Aktivatör İnhihibitörü (PAI–1) düzeyleri ise artmış olarak saptanmıştır (36). Ayrıca AF'li hastalarda plazma beta tromboglobulin, platelet faktör 4, von Willebrand faktör (vWF), trombomodulin ve fibrinojen düzeylerinde artış gösterilmiştir (37,38). SPAF III çalışmasında AF'li olgularda artan vWF düzeylerinin inme için risk öngördürücüleri ile korele olduğu saptanmıştır (39).
Kardiyoversiyon ile sinüs ritminin sağlandığı hastalarda atriyal mekanik fonksiyonlar hemen düzelmez, atriyal stunnig atriyal fibrilasyonun süresine göre değişmekle beraber maksimum üç dört hafta kadar sürer. Atriyal stunning fazı boyunca tromboemboli riski mevcuttur. Kardiyoversiyon sonrası gözlenen tromboemboli olaylarının %80'ni ilk üç gün içerisinde gerçekleşir, neredeyse tamamı ise ilk 10 gün içinde olur (40-41). Bu yüzden 48 saatten uzun süren veya zamanı bilinmeyen bütün AF vakalarında kardiyoversiyon sürecinde
10
antikoagülasyon önerilir (antikoagülasyonu kontraendike olanlar dışında) (1).
Atriyal fibrilasyon fazı boyunca, bazı hastalarda, TÖE esnasında, sol atriyum (SA) ve sol atriyum apendiksi (SAA) içerisinde azalmış akım hızlarına bağlı spontan eko kontrast (SEK) olarak isimlendirilen bir görüntü izlenir. SEK sigara dumanı şeklinde, ekodens bir görüntüdür ve genellikle semi kantitatif olarak; hafif,orta,yoğun olarak sınıflandırılır (42).
SEK oluşum mekanizması net olarak ortaya konulmadıysa da ön planda eritrositlerin fibrinojen aracılı agregasyonu olduğu düşünülmektedir (43). SEK'in AF‟de stazın bir göstergesi olduğu, SA büyüklüğü, SAA azalmış akım hızı, sol ventrikül (SV) disfonksiyonu, fibrinojen düzeyi ve hematokrit seviyesi ile ilişkili olduğu gösterilmiştir (44–47). SEK varlığı ve yoğunluğunun artmış tromboembolik risk ile beraber olduğu gösterilmiştir (48).
I.I.F) YÖNETĠM
Atriyal fibrilasyonlu olguların tedavi ve izlemi günümüzde üç temel nokta üzerinden yapılmaktadır.
1) Hız kontrolü
2) Tromboembolizmin engellenmesi 3) Ritim kontrolü
Ritim veya hız kontrolü seçeneklerinden bağımsız her hastada tromboembolizmin engellenmesi konusunda efor sarf edilmelidir(1). Tedavi seçenekleri; AF‟nin tipi ve süresine, semptomlarının ciddiyetine, birliktelik gösterdiği kardiyovasküler hastalıklara, hastanın ek komorbid durumuna, uzun dönem ve kısa dönem hedeflere, farmakolojik ve non farmakolojik seçeneklere göre belirlenmelidir (49).
I.I.F.I) HIZ KONTROLÜ
Hedef hastadan hastaya değişmesine rağmen genel olarak; kalp hızının istirahatta 60– 80 vuru/dk, orta derece egzersizde 90–115 vuru/dk arası, holter EKG kullanıldığında hız kontrolü ise 24 saatlik ortalama kalp hızının 100 vuru/dakikanın altında olması olarak tanımlanmıştır (50). Sürekli kontrolsüz taşikardi ventrikül fonksiyonlarında bozulmaya yol açabileceği için (taşikardi aracılı kardiyomyopati), hız kontrolü önemli bir hedeftir (51).
11 ACC/AHA/ESC 2006 önerileri (1)
Klas I
o Persistan ve permenant AF'li hastalarda istirahat kalp hızının ölçülmesi ve beta bloker (BB) veya non dihidropridin kalsiyum kanal blokerler (N-DpKKB) ajanlarla kontrol altına alınması ( (Kanıt Düzeyi[KD]:B).
o Preeksitasyon yokluğunda kalp yetmezliği ve hipotansiyondan kaçınmak şartıyla IV BB, N-DpKKB akut tedavide ventrikül hızını yavaşlatmak için kullanılabilir (KD: B).
o Aksesuar yol yokluğunda kalp yetmezliği + AF‟si bulunan olgularda hız kontrolü için intravenöz (IV) digoksin ve amiodorone kullanılabilir (KD:B). o Aktivite esnasında AF ile ilişkili semptomları ortaya çıkanlarda egzersiz kalp
hızına yönelik farmakolojik tedavi düzenlenmelidir (KD:C).
o Kalp yetmezliği veya sol ventrikül disfonksiyonu bulunan veya sedanter yaşayan AF'li hastalarda digoksin oral tedavisi hız kontrolü için verilebilir (KD:C).
Klas IIa
o AF‟de hız kontrolü için digoksin ve BB veya N-DpKKB kombinasyonu (KD:B).
o Farmakolojik tedavi etkisiz veya ciddi yan etkilere yol açıyorsa AV nod ablasyonu ve pacemaker implantasyonu (KD:B).
o Diğer ajanlar etkisiz kaldığında hız kontrolü için IV amiodorone (KD:C). o AF‟ye ilave atriyoventriküler (AV) aksesuar yolu olanlarda elektriki
kardiyoversiyon (EKV) gerekmiyorsa IV ibutilide veya prokainamid (KD:C). Klas IIb
o BB, N-DpKKB, digoksin veya bunların kombinasyonu ile istirahat ve egzersizde ventrikül hızı yeteri kadar kontrol edilemiyorsa PO amiodorone kullanımı (KD:C).
o Hemodinamik olarak stabil aksesuar yol üzerinden iletisi olan AF‟de IV prokainamid, disopramid, ibutilide veya amiodorone kullanımı (KD:B).
Klas III
o Paroksismal AF de hız kontrolü için yalnız digoksin kullanımı (KD:B). o Diğer tedavi seçeneklerini denemeden AV nod ablasyonu (KD:C).
12
o Dekompanse kalp yetmezliği bulunan AF‟li hastalarda IV N-DpKKB (KD:C). o AF ile beraber preeksitasyon bulunan hastalarda IV dijital veya N-DpKKB
kullanımı (KD:C).
Eğer aritmi hemodinamiyi tehdit ediyorsa acil kardiyoversiyon endikasyonu mevcuttur. Hız kontrolü çoğu zaman tek ilaç ile sağlanamaz bu açıdan kombinasyon tedavisi AF‟de sık başvurulan bir yöntemdir, digoksin ve beta bloker kombinasyonu digoksin ve KKB kombinasyonundan daha etkilidir (52).
Büyük klinik çalışmalarda bahsedilen kalp hızı hedefine ulaşılamayıp pacemaker implantasyonu ve AV nod ablasyonu ihtiyacı gerektiren olguların oranı %5 kadardır. AV nod ablasyonu dışında AV nod modifikasyonu da bir seçenektir. AV nod modifikasyonu yapılan olguların total AV blok riski daha azdır, fakat rekürrens riskleri mevcuttur (53–55).
I.I.F.II) RĠTĠM KONTROLÜ
Ritim kontrol planı tercih edilen hastalarda, iki amaç mevcuttur. Birinci amaç sinüs ritminin sağlanması, ikinci amaç sinüs ritminin devamlı hale getirilmesidir.
I.I.F.II. A) SĠNÜS RĠTMĠNĠN SAĞLANMASI
Elektriksel Kardiyoversiyon: Elektriksel kardiyoversiyon kalbin intrensek aktivitesine senkronize olarak (Genellikle EKG‟de R dalgası) direkt elektrik şoku vererek ritmi normal sinüs ritmine döndürme işlemidir.
Göğüs duvarı direnci, AF süresi ve sol atriyum çapına bağlı olarak, genel olarak
%75–93 arasında başarı oranları bildirilmektedir (56,57). Elektriksel kardiyoversiyon işlemi sırasında işlem başarısını arttırmak, en az toplam enerji miktarı ile en güvenli işlemi gerçekleştirmek için dikkat edilmesi gereken noktalar elektrotların pozisyonu, kullanılan dalganın şekli ve başlangıç enerji miktarıdır.
Genel olarak kardiyoversiyon işlemi için anteroposterior ve anterolateral olmak üzere iki ayrı elektrod pozisyonu kullanılır. Yapılan birçok çalışmada anteroposterior uygulama ile daha az enerji gereksinimi olduğu ve daha fazla başarı oranları saptandığı bildirilmektedir (58,59). Göğüs duvarı direncinin artışının işlem başarısını olumsuz etkilediği bilindiği için işlem sırasında elektrotlara mümkün olduğunca fazla baskı uygulanması, etkinliği pratik olarak arttırmanın yöntemlerinden birisidir. Bifazik şok dalgası kullanan cihazlar ile
13
monofazik şok dalgası kullanan cihazlara göre, daha az enerji gerektiği ve daha fazla başarı sağlandığı bildirilmektedir (60,61). Başlangıçta daha yüksek enerji kullanımı ile daha az toplam enerji uygulandığı için bugün için önerilen monofazik cihazlarda 200 Joule, bifazik cihazlarda 150 Joule enerji ile işleme başlanmasıdır (4).
Farmakolojik Kardiyoversiyon: 1 hafta ve üzerinde bir süredir AF‟de olduğu tespit
edilen olgularda elektriksel kardiyoversiyon başarısı, farmakolojik kardiyoversiyona göre belirgin fazla iken, ilk 1 hafta içindeki ve özellikle ilk 72 saat içindeki AF olgularında farmakolojik kardiyoversiyon alternatif yöntemdir. Farmakolojik kardiyoversiyon ile ilgili yakın zamanda yapılan bir düzenlemede, uygun seçilmiş vakalarda %70‟lere varan etkinlik bildirilmiştir. Ancak yapılan bazı çalışmalarda bu grup hastalarda plasebo ile kendiliğinden sinüs ritmi sağlanması %50 civarında bildirildiği için farmakolojik kardiyoversiyon çoğu zaman süreci hızlandırmak için uygulanmaktadır (62).
ACC/AHA/ESC 2006 önerileri (1) Klas I
o Uygun hastalarda farmakolojik kardiyoversiyon için flecainide, dofetilide, propafenon, ibutilide kullanımı (KD:A).
Klas IIa
o Kardiyoversiyon için amiodorone kullanımı (KD:A).
o Persistant AF‟li ve daha önceden hastanede en az bir kere tedavi görmüş sinüs veya AV nod disfonksiyonu, dal bloğu, QT uzaması, brugada sendromu ve/veya yapısal kalp hastalığı olmayan hastalarda ayaktan tek oral bolus doz (pill in pocket) propefenon veya flecainide (anti aritmik tedaviden önce BB veya N-DpKKB başlamak koşuluyla) (KD:C).
o Paroksismal veya persistant AF li olgularda sinüs ritminin restorasyonu acil değilse ayaktan amiodorone verilmesi (KD:C).
Klas IIb
o Farmakolojik kardiyoversiyon (KV) için kinidin veya prokainamid kullanımı (KD:C).
Klas III
o KV için digoksin veya sotalol kullanımı (KD:A).
o KV için ayaktan kinidin, prokainamid, disopramid, dofetilide başlanması (KD:B).
14
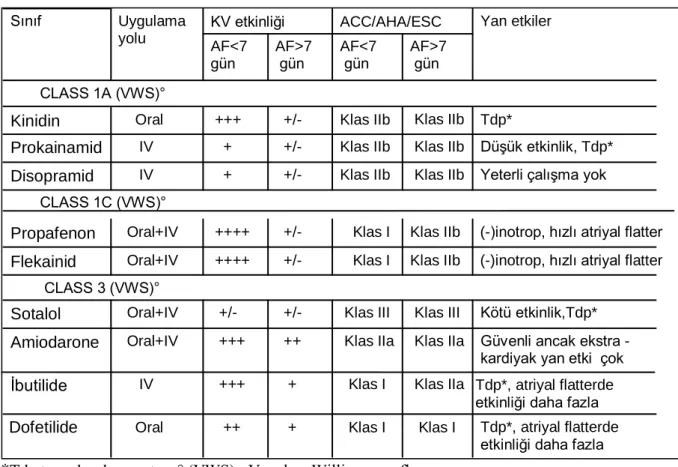
Farmakolojik kardiyoversiyon için önerilen ilaçlar, uygun tedavi zamanları ve potansiyel yan etikleri Tablo 1‟de özetlenmiştir.
Tablo 1: Farmakolojik Kardiyoversiyon İçin Önerilen İlaçlar ve Özellikleri
*Tdp:torsades de puantes, ° (VWS) : Vaughan Williams sınıflaması
I.I.F.II. A. II.) SĠNÜS RĠTMĠNĠN SÜREKLĠLĠĞĠNĠN SAĞLANMASI
Kardiyoversiyon ile sinüs ritmi sağlanan olgularda en önemli problem atriyal fibrilasyonun tekrarlamasıdır. AF‟de tekrarlama zamana bağlı olarak 3 dönemde incelenir. i) Çabuk tekrarlama (immediate): Kardiyoversiyon işlemi sonrası ilk birkaç dakikada ii) Erken tekrarlama: İşlem sonrası ilk birkaç dakika ile 2–4 hafta arası
iii) Geç tekrarlama: İlk 4 haftadan sonra
Hiç tedavi yapılmadığı durumda kardiyoversiyon uygulanmış AF olgularında 1 yıl içinde AF tekrarlama olasılığı yaklaşık %75 kadardır (63). Bu nedenle kardiyoversiyon sonrası hastaları sinüs ritminde tutmak için çeşitli girişimler söz konusudur.
Tdp*, atriyal flatterde etkinliği daha fazla Klas I Klas I + ++ Oral Dofetilide Tdp*, atriyal flatterde etkinliği daha fazla Klas IIa Klas I + +++ IV Ġbutilide
Güvenli ancak ekstra - kardiyak yan etki çok Klas IIa Klas IIa ++ +++ Oral+IV Amiodarone Kötü etkinlik,Tdp* Klas III Klas III +/- +/- Oral+IV Sotalol CLASS 3 (VWS)°
(-)inotrop, hızlı atriyal flatter Klas IIb Klas I +/- ++++ Oral+IV Flekainid
(-)inotrop, hızlı atriyal flatter Klas IIb Klas I +/- ++++ Oral+IV Propafenon CLASS 1C (VWS)°
Yeterli çalıĢma yok
Klas IIb Klas IIb + IV Disopramid DüĢük etkinlik, Tdp* Klas IIb Klas IIb +/- + IV Prokainamid d Tdp* Klas IIb Klas IIb +/- +++ Oral Kinidin CLASS 1A (VWS)° AF>7 gün AF<7 gün AF>7 gün AF<7 gün Yan etkiler ACC/AHA/ESC KV etkinliği Uygulama yolu Sınıf
15
AF‟de sinüs ritminin sürekliliğinin sağlanmasına yönelik girişimler 2 başlık altında incelenir. A) Farmakolojik yöntemler.
B) Farmakolojik olmayan yöntemler.
FARMAKOLOJĠK YÖNTEMLER
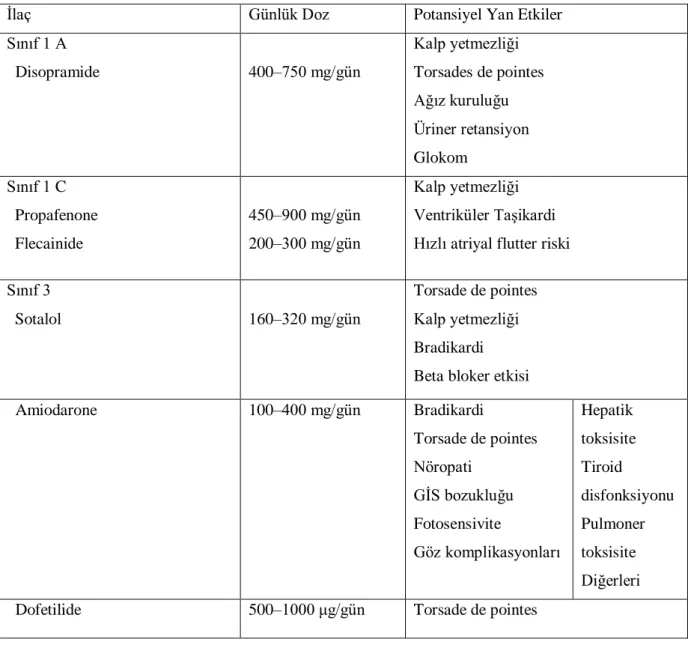
Günümüzde AF‟nin tekrarlama olasılığını azaltmada sık kullanılan ilaçlar Tablo II de özetlenmiştir.
Tablo II: Atriyal fibrilasyonlu hastalarda sinüs ritminin idamesinde kullanılan ilaçlar ve dozları
İlaç Günlük Doz Potansiyel Yan Etkiler
Sınıf 1 A Disopramide 400–750 mg/gün Kalp yetmezliği Torsades de pointes Ağız kuruluğu Üriner retansiyon Glokom Sınıf 1 C Propafenone Flecainide 450–900 mg/gün 200–300 mg/gün Kalp yetmezliği Ventriküler Taşikardi Hızlı atriyal flutter riski Sınıf 3
Sotalol 160–320 mg/gün
Torsade de pointes Kalp yetmezliği Bradikardi Beta bloker etkisi
Amiodarone 100–400 mg/gün Bradikardi Torsade de pointes Nöropati GİS bozukluğu Fotosensivite Göz komplikasyonları Hepatik toksisite Tiroid disfonksiyonu Pulmoner toksisite Diğerleri
Dofetilide 500–1000 μg/gün Torsade de pointes
Kullanılan ajanlardan en etkili olan aslında amiodorone olmakla birlikte yüksek ve ciddi yan etki sıklığı nedeni ile kullanımında zorluklar ile karşılaşılmaktadır. Propafenon ve flecainide atriyal fibrilasyonu 1:1 atriyal flattere değiştirebildikleri için, bu ajanların AF‟li
16
olgularda AV düğüm üzerine etkili ilaçlar (beta bloker, kalsiyum kanal blokeri) ile birlikte kullanımı önerilmektedir. Klasik yeni kuşak ajanlar dışında kalan disopramide özellikle bradikardi ile ilişkili, yemek sonrası, kusma sonrası görülen yani vagal aracılı AF‟de bir seçenek olarak kullanılabilmektedir.
Atriyal fibrilasyonlu olgularda sinüs ritminin idamesinde kullanılacak antiaritmik tedavi, hastanın kalp hastalığının olup olmamasına, kalp hastalığı mevcut ise tipine, ciddiyetine ve tedavi eden hekimin kullanılan ilaçlar ile ilgili deneyimine bağlı olarak kararlaştırılmalıdır.
FARMAKOLOJĠK OLMAYAN YÖNTEMLER
CERRAHĠ: Maze prosedürü olarak adlandırılmaktadır. Maze I-II-II olmak üzere üç
tipi bulunur. Cerrahi sırasında atriyumlarda direk kesi ile radyofrekans enerjisi ile veya kriyoablasyon yöntemi ile lezyonlar oluşturma hedeflenir. Şu an için randomize kontrollü bir çalışması bulunmamaktadır fakat mitral kapak cerrahisi geçiren olgularda yapılan işlemin 15 yıllık sonuçları %70 - 95 gibi bir başarı oranı göstermektedir (64,65). Mitral kapak cerrahisi planlanan sık tekrarlayan ciddi semptomatik AF atakları olan olgularda uygun bir yöntem olabilir.
KATATER ABLASYONU: İlk ablasyon yöntemleri maze prosedürünü taklit etmekteydi, (atriyal endokardta linear skar oluşturulması) %40–50„lik bir başarı oranı ve yüksek komplikasyon oranı mevcuttu (66,67). İlk çalışmalarda amaç AF‟nin yayılımını önlemek için elektriksel engeller oluşturmaya yönelikti fakat AF‟yi tetikleyen fokal odakların (özellikle pulmoner ven ağızları) tespiti ve bu bölgelerin ablasyonu, non fluroskopik guidence sistemi, intrakardiyak ekokardiyografi, dairesel enerji veren sistemler işlem başarısını yükseltti (68).
Paroksismal AF‟de başarı oranları %80–90 gibi yüksek düzeylere ulaşmaya başlamıştır(69,70), fakat persistan veya permenant AF‟de hala düşüktür. Günümüzde AF ablasyonu için ideal aday; sık tekrarlayan, ilaç tedavisine yanıtı az, ataklar sırasında semptomatik olan ve ciddi düzeyde yapısal kalp hastalığı olmayan hastalardır.
AF ablasyonun olası komplikasyonları; pulmoner ven stenozu (major komplikasyon, ortalama %6), tromboembolizm (%0-%5), atriaözefajial fistül oluşumu, sol atriyum kaynaklı flatter oluşturulması, tamponad olarak sıralanabilir.
17
ATRĠAL PACE ve ATRĠAL DEFĠBRĠLATÖRLER: Bradikardi nedeniyle yapılan
atriyal pace veya dual pace ile ventriküler pacinge göre düşük inme ve azalmış AF atağı olduğu gösterilmiştir (71), fakat atriyal pace‟in primer korunmada yeri yoktur bununla beraber post op AF‟de yararlı olabileceğine dair veriler mevcuttur.
Atriyal defibrilatörler; yüksek sağ atriyum ile koroner sinüs arasında şok vererek etki gösterirler, ortalama 3 Joule enerji gereksinimi mevcuttur, defibrilasyonda etkilidir fakat 1 Joule üstünde enerjiler sedasyonsuz zor tolere edilebildiğinden kullanımı kısıtlıdır (72).
I.I.F.II. B. RĠTĠM ve HIZ KONTROL STRATEJĠLERĠNĠN KARġILAġTIRILMASI
Ritim kontrolü ve hız kontrolü seçenekleri özel klinik durumlarda birbirlerine üstünlükleri olan yöntemlerdir, genel anlamda hangi stratejinin seçileceğine birebir hasta bazlı karar vermek daha doğru olacaktır.
Yakın zamanda her iki stratejinin karşılaştırıldığı 5 büyük çalışma yayınlanmıştır. Tüm çalışmalarda hastalar ritim ve hız kontrol gruplarına randomize edilmişlerdir.
PIAF (Pharmacological Intervention in Atrial Fibrillation trial) çalışması ilk yayınlanan çalışmadır. Toplam 252 hasta çalışmaya alınmış ve 1 yıl süresince izlenmişlerdir. Tüm hastalar çalışma boyunca oral antikoagulan (OAK) tedavi kullanmışlardır. Çalışmanın birincil son noktası semptomatik iyileşme oranı, ikincil son noktalar ise yaşam kalitesi, hastaneye yatış, kanama ve ilaç yan etkisidir. Her iki grup arasında birincil son nokta ve yaşam kalitesi arasında fark yok iken; ritim kontrol grubunda egzersiz kapasitesi daha iyi, hız kontrol grubunda ise hastaneye yatış ve ilaç yan etkisi daha azdır (73).
AFFIRM (Atrial Fibrillation Follow-up Investigation of Rhythm Management) çalışması bu konuda yapılmış en büyük çalışmadır. Çalışmaya toplam 4060 hasta alınmış ve hastalar ortalama 3,5 yıl izlenmiştir. OAK ritim kontrol grubunda olup 3 ay boyunca sinüste kalan olgularda kesilmiş diğer hastalarda tüm çalışma boyunca devam edilmiştir. Çalışmanın birincil son noktası ölüm, ikincil son noktalar ise yaşam kalitesi, fonksiyonel kapasite, kanama, hastaneye yatış, ilaç yan etkisi ve maliyettir. Çalışma sonunda primer son nokta açısından her iki grup arasında anlamlı fark saptanmamış ancak hız kontrol lehine bir eğilim saptanmıştır. İlaç yan etkisi ve hastaneye yatış hız kontrol grubunda anlamlı olarak daha az saptanmıştır (74).
18
RACE (Rate Control versus Electrical cardioversion for persistent atriyal fibrillation) çalışması AFFIRM çalışmasından sonra en büyük çalışma olup çalışmaya 522 hasta dahil edilmiştir. Hastalar ortalama 2,3 yıl izlenmiştir. Çalışmanın birincil son noktası kardiyovasküler ölüm, kalp yetersizliği nedeni ile hastaneye başvuru, tromboembolik olaylar, ciddi kanama, kalıcı kalp pili yerleştirilmesi ve ciddi ilaç yan etkisinden oluşan klinik son noktaların birleşimidir. Birincil son noktada her iki grup arasında anlamlı fark yok iken hız kontrol grubunda daha az hastaneye yatış ve ilaç yan etkisi gözlenmiştir (75).
STAF (Strategies of Treatment of Atrial Fibrillation trial) çalışmasına 200 persistan AF olgusu alınmış ve hastalar 1,7 yıl izlenmişlerdir. Ölüm, inme, geçici iskemik atak, kardiyopulmoner resüsitasyon, kanama ve sistemik emboli kombinasyonu birincil son noktayı oluşturmuştur. Yine bu çalışmada da birincil son nokta açısından fark yok iken, hız kontrol grubunda daha az hastaneye yatış olmuştur (76).
HOT CAFE (How to Treat Chronic Atrial Fibrillation) çalışmasına 205 hasta alınmış ve ortalama 1,7 yıl izlem yapılmıştır. Ölüm, tromboembolik komplikasyonlar, intrakranial veya diğer kanamalar birleşik son noktası primer son noktayı oluşturmuştur. Sinüs ritmindeki hastalarda daha iyi egzersiz performansı izlenmiş fakat yaşam kalitesi açısından ve primer son noktalar açısından fark saptanmamıştır (77).
I.I.F.III) TROMBOEMBOLĠ RĠSKĠNĠN AZALTILMASI
Tromboembolik olaylar atriyal fibrilasyonda en önemli mortalite ve morbidite nedenidir, güncel tedavi yaklaşımları ile tromboemboli riskinin tamamen ortadan kaldırılması mümkün olmamakta, fakat antiagregan ve antikoagulan tedavi ile risk azaltılabilmektedir. Sağlanan bu risk azalması ise başka bir risk ve iş yükünü beraberinde getirmekte, bu nedenle de riski yüksek gurubun tayini ve tedavinin özelleştirilmesi ayrı bir önem taşımaktadır.
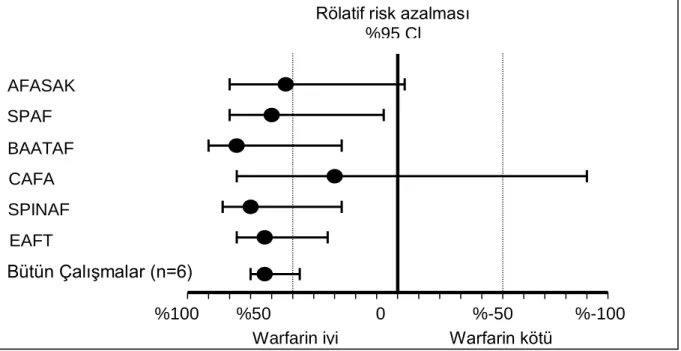
Özellikle romatizmal kalp kapak hastalığı olanlarda kontrendike olmadıkça warfarin ile antikoagülasyon konusunda genel bir uzlaşma mevcuttur. Kalp kapak hastalığına bağlı olmayan AF nedeni ile izlenen hastalarda tromboembolizmden primer korunmada beş randomize kontrollü çalışma yayınlanmıştır. Bu çalışmalar “Boston Area Anticoagulation Trial for Atrial Fibrillation (BAATAF)”, “Canadian Atrial Fibrillation Anticoagulation (CAFA)”, “Stroke Prevention in Nonrheumatic Atrial fibrillation (SPINAF)”, “SPAF” ve “Copenhagen Atrial Fibrillation Aspirin Anticoagulation (AFASAK)” çalışmalarıdır (78–82). Bu beş çalışmanın meta analizinde antitrombotik tedavi almayanlarda yıllık iskemik inme
19
riski %4.5 iken, warfarin ile bu risk %1.4‟e gerilemiş, yani %68'lik bir rölatif risk azalması saptanmıştır. Bu çalışmalarda majör kanama oranı warfarin ile %1.3 diğer grupta (plasebo veya ASA) ise %1 olarak rapor edilmiştir. “European Atrial Fibrillation Trial (EAFT)” çalışması inme veya geçici iskemik atak öyküsü olan AF hastalarını warfarin, asetil salisilik asit (ASA) ve plaseboya randomize eden bir sekonder koruma çalışmasıdır (83). Bu çalışmada warfarin kullanımı ile plaseboya göre %66 rölatif risk azalması saptanmıştır. Hastaların yüksek riskli olmaları sebebi ile bu grupta warfarinin mutlak yararı daha fazla olmuştur. ASA ile plasebo karşılaştırıldığında ASA plaseboya göre yaklaşık %22 lik bir rölatif risk azalması sağlamıştır. Direkt ASA ve warfarini karşılaştıran çalışmalar AFASAK, AFASAK II, EAFT, SPAF II ve “Primary prevention of Atrial Thromboembolism in patients with nonrheumatic Atrial Fibrillation trial (PATAF)” çalışmalarıdır. Bu çalışmaların meta-analizinde warfarin ASA ile karşılaştırıldığında %36'lık bir rölatif risk azalması sağlamıştır ki bu da istatistiksel olarak önemli oranda anlamlıdır.
Genel anlamda bakıldığında kalp kapak hastalığına bağlı olmayan tüm AF olgularında yapılan çalışmalarda warfarin kullanımı ile plaseboya oranla %60'ın üzerinde bir risk azalması sağlanmaktadır (Şekil 1).
Şekil 1 Atriyal Fibrilasyonda Warfarin ile Placebonun Karşılaştırılması
Warfarin kullanımına ilişkin en önemli endişe artmış kanama riski ile ilişkilidir. Kanama riski özellikle yaşlı hastalarda belirgindir. Katı izlem planı olan randomize kontrollü çalışmalara göre, gerçek klinik pratikte ve özellikle International Normalized Ratio (INR)
%100 %50 0 %-50 %-100 Warfarin iyi Warfarin kötü
Rölatif risk azalması %95 Cl SPINAF AFASAK I(82) CAFA SPAF BAATAF Bütün ÇalıĢmalar (n=6) EAFT
20
değerlerinde sık inip çıkmalar olanlarda kanamalar daha sık izlenmektedir (84,85). Büyük kanamaların çoğu INR düzeyi 5 ve üzerinde iken görülür, INR düzeyi 2‟nin altına indiğinde belirgin tedavi etkisi izlenmemektedir (86). Bu nedenle günümüzde önerilen, INR hedefinin en uygun 2,5 olmak üzere 2–3 arasında olmasıdır.
ACC/AHA/ESC 2006 önerileri (1) Klas I
o Lone AF ve antikoagülan kontraendikasyonu olmayan her AF‟de tromboembolizmden korunmada antitrombotik tedavi düzenlenmesi (KD:A). o Antitrombotik tedavinin kişinin inme/kanama riski göz önüne alınarak
seçilmesi (KD:A).
o Mekanik kapağı olmayan tromboembolizm açısından yüksek riskli hastaların INR 2–3 arasında olacak şekilde vitamin K antagonisti (VKA) ile tedavisi (yüksek riskli grup: romatizmal kapak hikayesi bulunan atriyal fibrilasyon olguları, serebrovasküler olay hikayesi bulunan atriyal fibrilasyon olguları) (KD:A).
o Birden fazla orta derecede risk faktörüne sahip AF‟li hastaların VKA ile tedavisi (orta derece risk faktörleri : yaş>75 olması, HT, kalp yetmezliği, ejeksiyon fraksiyonun < %35 olması, DM ) (KD:A).
o INR nin başlangıçta en az haftada bir, kronik tedavide en az ayda bir ölçülmesi (KD:A).
o Düşük riskli hastalarda veya oral antikoagülan (OAK) kontraendikasyonu olanlarda 81–325 mg ASA kullanımı (KD:A).
o Mekanik kalp kapağı bulunan AF‟li hastalarda INR düzeyinin en az 2.5 ve üzeri tutulması (KD:B).
o Antitrombotik tedavi seçiminin atriyal flutter için de atriyal fibrilasyondaki gibi düzenlenmesi (KD:C).
Klas IIa
o AF ile birlikte Yaş > 75 (özelikle kadın), HT, DM, kalp yetmezliği, azalmış SV fonksiyonları özeliklerinden sadece birinin varlığında ASA veya OAK kullanımının hastanın kanama riskine düzenli takip edip edilemeyeceğine ve hastanın tercihine göre seçilmesi (KD:A).
21
o AF ile birlikte 65–74 yaşları arasında olan koroner arter hastalığı varlığı ve/veya kadın cinsiyet özelliklerinden bir veya daha fazlası varlığında ASA veya OAK kullanımının hastanın kanama riskine düzenli takip edip edilemeyeceğine ve hastanın tercihine göre seçilmesi (KD:A).
o AF‟nin paterninden bağımsız antitrombotik tedavinin risk gruplarına göre seçilmesi (KD:B).
o Mekanik kapak dışı AF‟li olguda cerrahi veya kanama riski taşıyan diagnostik girişim öncesi bir haftaya kadar heparin verilmeden OAK kesilmesi (KD:C). o Düzenli aralıklarla hastaların antikoagülasyon ihtiyacının yeniden
değerlendirilmesi (KD:C). Klas IIb
o 75 yaş üstü kanama riski artmış fakat OAK için açık kontraendikasyonu bulunmayan veya orta derecede risk faktörüne sahip standart yoğunlukta antikoagülasyonu tolere edemeyen hastalarda primer korunmada düşük INR değerinin hedef seçilmesi (INR 1.6-2.5) (KD:C).
o Cerrahi prosedür planlanan ve OAK‟nın 1 haftadan uzun süre kesilmesi planlanan hastada unfraksiyone heparin veya düşük molekül ağırlıklı heparin verilmesi (bu uygulamanın yararı kesin değildir) (KD:C).
o PCI veya cerrahi revaskülarizasyon uygulanan AF‟li hasta hastada OAK‟ya ek düşük doz ASA ve/veya clopidogrel 75 mg birlikte kullanımı (fakat bu strateji açık olarak değerlendirilmemiştir ve artmış kanama riski taşımaktadır) (KD:C). o PCI‟ya giden hastalarda OAK‟nın arteriyel ponksiyon yerinden kanamayı engellemek için kesilmesi ve prosedürden en kısa zaman sonra yeniden başlanması, ASA‟nın bu boşlukta geçici olarak verilmesi ardından warfarin (INR 2–3) + clopidogrel başlanması (çıplak metal stentte en az 1 ay, sirolumus kaplı stentte en az 3 ay, paclitaxel kaplı stentte en az 6 ay olmak üzere) (KD:C).
o INR 2.0-3.0 arasında olacak şekilde OAK kullanan AF‟li hastada inme veya sistemik embolizm gelişmesi halinde INR hedefinin 3.0–3.5 olarak değiştirilmesi (KD:C).
Klas III
22
Atriyal fibrilasyonlu olgularda önemli karar antikoagülan seçimi konusundadır mevcut bilgilerimiz ışığında antikoagülasyon kararı trombüs oluşumuna meyil yaratan durumların tespiti ve skorlaması üzerinde yapılmaktadır, fakat bu değerlendirme trombüs patogenezi ile doğrudan ilişkili değildir. 2006 ACC/AHA/ESC atriyal fibrilasyon kılavuzu antikoagülasyon ihtiyacını tayin edebilmek için belirlediği temel beş risk faktörünün baş harflerinden oluşan CHADS2 skorlamasını geliştirmiştir. (Tablo III)
Tablo III CHADS2 skorlaması
HT = Hipertansiyon; DM = Diabetes Mellitus
Skoru ≥4 olanlar antikoagülasyon şiddetle önerilir, skoru 0 olanlar antikoagülan tedaviden fazla yarar görmezler skoru 1–4 arasında olan grubun antikoagülasyonu bazı durumlarda tartışmalıdır, genel olarak antikoagülasyon önerileri tabloda özetlendiği gibidir. (Tablo IV) 1 Kalp yetmezliği 1 DM 1 HT 1 YaĢ 75 üzerinde olması
2 Skor Ġnme veya geçici iskemik atak hikayesi
CHADS2 risk kriteri
Antikoagülasyon ile tedavi edilmemiĢ nonvalvüler AF de inme riski (CHADS2 indexi)
23 Tablo IV: Anti trombotik tedavi önerileri
DM = Diabetes Mellitus; KAH = Koroner Arter Hastalığı; KKY = Konjestif Kalp Yetmezliği;
SVEF = Sol Ventrikül Ejeksiyon Fraksiyonu; RKH = Romatizmal Kapak Hastalığı; TEE = Trasnözefajiyal Ekokardiografi; INR = International Normalize Ratio; OAK = Oral Antikoagülan
Kardiyoversiyon iĢlemi için antikoagülasyon: Kardiyoversiyon döneminde artmış
bir tromboemboli riski mevcuttur. Tromboemboli riskini azaltmak için önerilen geleneksel yaklaşım, işlem öncesi yaklaşık 3–4 hafta INR düzeyi etkili olacak şekilde antikoagülasyon ve işlem sonrasında da antikoagülasyonun devamı şeklindedir (1). Bu yaklaşımın alternatifi TÖE kılavuzluğunda kardiyoversiyon işleminin gerçekleştirilmesidir. Bu yöntemde kardiyoversiyon işlemi öncesi hastaya TÖE uygulanmakta ve TÖE‟de kalp boşlukları ve özellikle sol atriyum apendiksinin içinde trombüs saptanmaz ise kardiyoversiyon işlemi uygulanabilmektedir (87).
Daha yüksek değerlere çıkılabilinir
KLAS-I Oral antikoagülasyon(INR:2,0–3.0) veya Aspirin
81–325 mg/gün) YaĢ 75 erkek baĢka risk fak. yok
KLAS-I Oral antikoagülasyon(INR:2,0–3.0)
YaĢ 75 kadın
KLAS-IIa OAK (INR 2,0–3,0 )
TÖE ile trombüsün devamlılığı
KLAS-I OAK (INR 2,0–3,0 ) Tromboemboli öyküsü KLAS-I OAK (INR 2,0–3,0 ) Protez kapak KLAS-I Oral antikoagülasyon(INR:2,0–3,0) RKH (Mitral Stenoz) KLAS-I Oral antikoagülasyon(INR:2,0–3,0) SV EF %35 + HT KLAS-I Oral antikoagülasyon(INR:2,0–3,0) YaĢ >65 + KKY KLAS-I Oral antikoagülasyon(INR:2,0–3,0)
YaĢ 65–74 DM yada KAH
KLAS-I Aspirin(81–325 mg/gün)
YaĢ 60–74, risk fak. yok
KLAS-I Aspirin(81–325 mg/gün)
YaĢ<60, kalp hastalığı var ancak risk fak. yok
KLAS-I Aspirin(81–325 mg/gün) ya da tedavi yok
YaĢ <60, kalp hastalığı yok
ÖNERĠLER ANTĠTROMBOTĠK TEDAVĠ
24
I.II ARTERĠYEL TROMBOZA YATKINLIK ĠLE ĠLĠġKĠLĠ GENLER
I.II.A BETA FĠBRĠNOJEN 455 G/A POLĠMORFĠZMĠ
Plazma fibrinojeni trombüsün yapısını oluşturan başlıca protein olan fibrinin kaynağıdır. 1980 yılında ilk kez Meade ve ark. artmış fibrinojen düzeyi ile artmış kardiyovasküler ölüm arasında ilişki olduğunu rapor etmiştir (88). Framingham kalp çalışmasında 554 erkek ve 761 kadın hastanın 12 yıllık izlemi sonucunda fibrinojen ile iskemik kalp hastalığı arasında ilişki gösterilmiştir (89). Bununla beraber birçok çalışmada artmış fibrinojen seviyeleri ile periferik arter hastalığı, inme, venöz tromboz arasında bağlantı olduğu gösterilmiştir (90–92).
Fibrinojen karaciğerde sentezlenen bir akut faz reaktanıdır, inflamatuvar durumlarda kanda seviyesi hızla artar, bunun dışında HT, DM, sigara tüketimi, yaşlanma, oral kontraseptif kullanımı, menapoz, obezite, gebelik durumlarında serumda seviyesi artarken, düzenli egzersiz, düşük miktarda alkol tüketimi, balık yağı tüketimiyle kanda seviyesi azalır. Fibrinojen trombosit agregasyonunun bir mediyatörü olduğu gibi aynı zamanda plazma vizkositesinin de belirleyicilerindendir. Fibrinojen 340-kDa büyüklüğünde dimerik bir glikoproteindir; her dimer alfa-beta ve gama olmak üzere üç farklı polipeptid zincir içerir, zincirler birbirlerine disülfit köprüler ile bağlıdır. Bu üç polipeptid zincir 4. kromozomun q28 kolunda kodlanır (93).
Fibrinojeni kodlayan gen ile ilgili birçok polimorfizm tanımlanmıştır fakat bunlardan en çok beta zincir polimorfizmi üzerinde durulmuştur, çünkü beta zincir erişkin fibrinojen sentezindeki hız kısıtlayıcı basamaktır. Bu açıdan bu zinciri ilgilendiren DNA değişiklikleri mutant fibrinojen üretiminin yanında fibrinojen seviyelerini de etkilemektedir (94). Bu polimorfizmlerden en çok üstünde durulan beta zincirinde 455 G/A polimorfizmine yol açan A allelinin seviyesinin artmasıdır. A alleli; erişkin popülasyonda ortalama %20 kadar bulunmaktadır, homozigotluğunun ise farklı popülasyonlarda %1–5 arasında olduğu bildirilmiştir (103). Yapılan çalışmalarda beta fibrinojen 455 G/A‟nın A allelinin homozigotluğu (A/A) durumunda kan fibrinojen seviyelerinde artış olduğu gözlenmiş fakat heterozigot polimorfizmde fibrinojen seviyesi, kontrol grubuna benzer bulunmuştur ( 99,117,118).
25
Beta zincir polimorfizmi fibrinojenin fizyolojik yanıtlara da artmış cevabı ile de ilişkili olabilir, nitekim ağır egzersiz ile A alleli varlığında artmış fibrinojen cevabı izlenmiştir (95). Beta fibrinojen 455 G/A polimorfizminin kardiyovasküler olaylar ile ilişkisi birçok çalışmada değerlendirilmiş, diyabetik hastalarda artmış A alleli seviyesinin kardiyovasküler olay sıklığında artış ile birlikte olduğu saptanmıştır (96,97). ECTIM çalışmasında beta fibrinojen bcl-I ve 455 G/A polimorfizminde arteriyel hastalık gelişme riskinin yüksek olduğu görülmüştür (98). Beta fibrinojen 455 G/A mutasyonun koroner arter hastalığının seyri üzerine etkisinin araştırıldığı bir çalışmada erkeklerde koroner arter hastalığının progresyonunu arttırdığını gösteren veriler elde edilmiştir (99). Yakın zamanda yapılan bir başka çalışmada 455 G/A polimorfizminin inme geçiren olgularda artmış laküner infarkt sıklığı ile birlikte olduğu saptanmıştır (100).
Bunun aksine 455 G/A mutasyonu ile kardiyovasküler olaylar arasında bağlantı saptamayan çalışmalarda mevcuttur (104).
Eritrositlerin agregasyonu koroner arter hastalarında nispeten sık gözlenen bir olgudur, beta fibrinojen 455 G/A polimorfizmi olan hastalarda artmış eritrosit agregasyonu olduğu saptanmıştır (101,102). Atriyal fibrilasyonlu olgularda TÖE sırasında sık gözlenen ve SEK olarak adlandırılan olgunun temel olarak eritrositlerin fibrin aracılı agregasyonu olduğu düşünülmektedir. Bu ve tromboz oluşumu ile beta fibrinojen polimorfizmi arasındaki bağlantılar nedeniyle; Beta fibrinojen 455 G/A polimorfizmi olan hastalarda sol atriyum ve sol atriyum apendiksi içinde trombüs ve SEK oluşumuna yatkınlık olasılığı mevcuttur, fakat bu düşünce henüz araştırılmamış bir konudur.
I.II.B GLĠKOPROTEĠN IIIA HPA-1b (PlA2) POLĠMORFĠZMĠ
Glikoprotein IIb/IIIa reseptörleri integrin sınıfında yer alan proteinlerdir ve
dolaşımdaki trombositlerin yüzeyinde bulunmazlar, trombosit aktivasyonu ile yüzeyde sunulmaya başlarlar ve trombositlerin fibrin ve vWF aracılı agregasyonunda en önemli rolü üstlenirler. Glikoprotein IIb/IIIa reseptölerine yönelik antiagregan tedavi önerileri bu mekanizma üzerinden iş görmektedir.
Trombosit yüzeyinde bulunan glikoprotein reseptörleri ile ilgili bir çok mutasyon ve bunların yarattığı tromboza eğilimi araştıran bir çok çalışma mevcuttur, en sık araştırılan ve trombotik olaylar ile ilişkisi en çok gözlenen glikoprotein IIIa‟nın HPA(Human Platelet Antigen)-1b polimorfizmidir. Glikoprotein IIIa‟nın HPA 1a (PlA1) ve HPA 1b(PlA2) olmak
26
üzere iki alleli bulunmaktadır, genel popülasyonda 1a alleli sıklığı %85 oranında HPA-1b ise %15 sıklıkta izlenmektedir (105).
PLA1 alleli varlığında trombosit fonksiyonları normal seyrederken, PLA2 alleli artmış trombotik olaylar ile beraberdir. PLA2 alleli olanlarda, özellikle gençlerde artmış myokard enfarktüsü ve kararsız anjina varlığı gösterilmiştir (106,107). Glikoprotein IIIa PLA2 alleli sıklığının aterosklerozdan çok tromboz ile ilişkili olduğu düşünülmektedir, Mikkelson ve ark. yaptığı bir çalışmada ani kardiyak ölüm olgularının otopsi incelemelerinde, PLA2 allelinin koroner tromboz nedeniyle MI geçiren olgularda çok daha yüksek olduğunu saptanmıştır (114).
Glikoprotein IIIa PLA2 alleli varlığıyla trombotik olaylar arasında bağlantı saptamayan çalışmalarda mevcuttur(108), bu konu ile ilgili çalışmalarda olgu grubunun küçük olması ve kontrol gruplarının ileri derecede non homojen olması nedeniyle konuyla ilgili tartışma hala sürmektedir.
Daha önceki bir çok çalışmada arteriyel tromboz ile bağlantısı araştırılmış olan trombosit yüzey reseptörü glikoprotein IIIa'nın PLA-2 polimorfizminin, atriyal fibrilasyonda trombüs oluşumuna eğilimin artması ile ilişkisi olup olmadığı henüz araştırılmamıştır.
27
II-AMAÇ
Atriyal fibrilasyonda mortalite ve morbidetinin en önemli nedeni olan tromboembolik olay; düzenli kasılma fonksiyonunu kaybetmiş atriyumlar içinde oluşan trombüs materyalinin embolisi ile ortaya çıkmaktadır. Atriyal fibirilasyonda trombüs oluşumunun patofizyolojisi net aydınlatılmamıştır, açık bir doku yaralanması olmadığı için oluşan trombotik materyal, hemostazın sağlanmasına yönelik oluşan trombüsten farklılık arzediyor olabilir. Staz ile ilişkili trombotik süreç, damar yaralanması sonucu gelişen tromboz ile aynı yolu, farklı bir şekilde aktive ediyor olabilir. Geleneksel risk sınıflama yöntemleri, endotel disfonksiyonu, SA hemodinamisi üzerine yoğunlaşmış, trombüsü oluşturan elemanlar üzerine yeteri kadar eğilmemiştir. Bu bağlamda arteriyel tromboz oluşumuna meyil yaratan genetik bozuklukların atriyumlarda trombüs oluşumuna katkısı olup olmadığı bilinmeyen bir konudur. Geleneksel risk faktörleri açısından düşük riskli gruplarda da, kıyasla daha az olsa da, tromboemboli gelişebildiği buna karşın risk faktörleri yoğun bireylerde antikoagülasyon olmaksızın bu kliniğin bir ömür boyu ortaya çıkmayabileceği bilinmektedir. Zeminde yatan bir genetik bozukluğun tromboz eğiliminin artışı ile ilişkisinin saptanması belli bir grubun uygunsuz antikoagülasyon kararına etki edebilir, risk profilini değiştirebilir.
Atriyal fibrilasyonda bir çok küçük ve orta boy çalışmada; koagülasyona etki eden biyokimyasal parameterler ve koagülasyon elemanlarının serum düzeyleri ile trombüs veya embolik olaylar arasındaki ilişki araştırılmıştır. Fakat bu biyokimyasal analizler; bir çok anlık bireysel faktörden etkilenebilen parametreler olduklarından, tanısal ve prognostik kullanımları kısıtlanmaktadır, bu açıdan tromboembolik riskin saptanmasında yer bulamamışlardır. Bununla beraber genetik analiz; anlık bireysel değişkenlerden ve tedavi biçiminlerinden etkilenmeyecek bir analiz biçimi olduğundan, diğer biyokimyasal risk belirteçlerine üstün ve onlara göre daha tutarlıdır. Atriyal fibrilasyonda tromboz oluşumu ile ilişkisi olan bir mutasyon tespiti; genetik analizin biyokimyasal analizlere olan üstünlüğü ve tutarlılığı nedeniyle, gelecekte, tromboembolik riskin daha doğru tahmininde kullanılabilir.
Çalışmamızda atriyal fibrilasyonda sol atriyumda trombüs oluşumuna yatkınlık yaratabileceğini düşündüğümüz biri trombosit biri de koagülasyon sistemine ait iki mutasyonu incelemeyi amaçladık. Trombosit ve koagülasyon sistemine ait iki ayrı mutasyonun incelenmesi, trombüs oluşumunda aktif rol oynayan bu iki ayrı sürecin sol atriyal trombüs oluşumunda önemi hakkında da sınırlı da olsa bir fikir verebilecekti. Bu açıdan sol atriyal trombüs oluşumu ile glikoprotein PlA1/A2 polimorfizmi ve beta fibrinojen 455 G/A
28
polimorfizminin arasındaki ilişkinin araştırılması planlandı.
Glikoprotein PlA1/A2 polimorfizmi; aktive olmuş trombositlerin yüzeyinde bulunan glikoprotein IIIa reseptörünün aktivitesinde değişikliğe yol açarak tromboza meyil yaratabilecek bir mutasyondur ve arteriyel tromboz ile ilişkisi gözlenmiştir. Beta fibrinojen 455 G/A polimorfizmi; koagülasyon sürecinde aktif bir rol oynayan fibrinojenin aktivitesinde değişikliğe yol açabilecek bir mutasyondur ve bu mutasyonun da arteriyel tromboz ile ilişkisi gözlenmiştir. Bu iki mutasyonun, atriyal fibrilasyonlu hastalarda, sol atriyumda trombüs oluşumu ile bağlantısı henüz araştırılmamış bir konudur.
Çalışmaya sol atriyumda trombüs saptanan hastalar bir grubu, trombüs saptanmayan hastalar diğer grubu oluşturmak üzere iki grup hasta alınması planlandı. Her iki grupta trombüs varlığı, SEK varlığı, trombüs ve yoğun SEK varlığı ile beta fibrinojen 455 G/A polimorfizmi ve glikoprotein PlA1/A2 polimorfizmi arasında ilişki olup olmadığının test edilmesi amaçlandı.
29
III.METOT
Hasta Seçimi: Hastalar; Dokuz Eylül Üniversitesi Tıp Fakültesi Kardiyoloji Anabilim
Dalına, Nisan 2006 – Ağustos 2007 yılları arasında başvuran ve KV öncesi TÖE‟si yapılan hastalardan seçildi. Hasta seçiminde; SA trombüsü olan hastalar bir grubu, olmayan hastalar (kontrol grubu) diğer grubu oluşturacak şekilde iki grup belirlendi. Bunun dışında arşiv taraması yapılarak, 2002-2006 yılları arasında, KV öncesi TÖE‟si yapılıp SA‟da trombüs saptanan hastalardan, aşağıdaki kriterlere uygun hastalar çalışmaya dahil edildi. Çalışma protokolü için Dokuz Eylül Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulundan izin alındı.
DAHİL EDİLME KRİTLERLERİ 1) 18 yaş ve üzerinde olma
2) Persistant atriyal fibrilasyon varlığı 3) Aydınlatılmış onamın alınmış olması
DIŞLANMA KRİTERLERİ
1) Geçici bir nedene bağlı AF olguları
2) Romatizmal kapak patolojisine bağlı AF olguları 3) Ciddi yapısal veya konjenital kalp hastalığı olan olgular 4) Antikoagülan kullanan hastalar
5) Sol atriyum çapı ≥ 5.5 cm olan hastalar 6) Ejeksiyon fraksiyonu ≤30 olan olgular
Transtorasik Ekokardiyografi: Çalışmaya alınan tüm hastalara HP Sonos 4500 cihazı ile
transtorasik ekokardiyografi yapıldı. Transtorasik ekokardiyografide, Amerikan Ekokardiyografi Cemiyetinin tanımladığı standartlar göz önünde bulundurularak kardiyak çaplar ölçüldü (115). M-Mode Ekokardiyografi yöntemiyle EF hesaplandı. Color Doppler ile mitral yetmezlik (MY) varlığı ve ciddiyeti araştırıldı. 1. derece (hafif) = color Doppler ile saptanan küçük santral jet (<4cm2 veya jet alanı / SA alanı < %20), vena kontrakta < 0.3 cm olanlar, 2. derece (orta) = vena kontraktası 0.3-0.69 arasında olup ciddi MY kriterlerini karşılamayanlar, 3-4. derece (ağır) = 0.7 cm.den büyük vena kontraktası olan ve büyük santral jeti olanlar ( jet alanı / SA alanı > % 40 ) veya sol atriyum duvarlarını yalayarak sol
30
atriyumda dönen jet akımı olanlar (SA ve SV çapları dilate ve/veya pulmoner venlerde sistolik geri akım mevcut ise 4. derece olarak yorumlandı) olarak sınıflandı (116).
Transözefajiyal Ekokardiyografi: Çalışmaya alınan tüm hastalara HP Sonos 4500 cihazı ile
TÖE yapıldı. TÖE‟de sol atriyum apendiksi başta olmak üzere kardiyak yapılar içinde trombüs veya SEK varlığı araştırıldı. SEK; kalp boşlukları içinde girdap yapan yavaş akımlı duman görünümü varlığı ile teşhis edildi. Yoğunluğuna göre; 0 = ekojenite yokluğu, 1 = minimal ekojenite, sadece yüksek gain ayarlarında görülüyor, tüm kardiyak siklus boyu devam etmiyor, 2 = orta yoğunlukta ekojenite, normal gain ayarlarında görülebiliyor, tüm kardiyak siklusta devam ediyor, 3 = yoğun ekojenite, düşük gain ayarlarında bile görülebiliyor, tüm kardiyak siklus boyunca görülüyor, SA içinde girdap hareketi yapıyor. SEK bu kriterlere göre, 0-3 arasında semi kantitatif olarak sınıflandırıldı (119).
Genetik Analiz: Çalışmaya alınan tüm hastalardan periferik venöz yoldan yaklaşık 2–3 cc
kan EDTA‟lı tüpe alındı, alınan kanlar dondurularak saklandı. DNA ekstraksyonu için eriyen kandan 100 µl alınan örnek 3000 devirde çözücü solüsyon ile 5 dk. santirfüj edildi. Üstte kalan 1 ml sıvı alındıktan sonra 1ml çözücü solüsyon tekrar eklenerek 12000 devirde tekrar santirfüj edildi ve üstte kalan 1ml sıvı ayırtıldıktan sonra ayıraç solüsyon ile karıştırılarak (GenXtract Blood DNA Extraction System) DNA izolasyonu yapıldı. PCR (polimeraz zincir reaksiyonu) ve reverse hibridizasyon yöntemi ile araştırılan DNA fragmanları çoğaltıldı ve araştırılan genetik profiller kardiyovasküler hastalık test stripleri kullanılarak saptandı.
IV.ĠSTATĠSTĠKSEL ANALĠZ
İstatistiksel değerlendirmeler için SPSS 11.0 programı kullanıldı. Sürekli değişkenlerin istatistiksel analizi „Mann-Whitney U Test‟ ile yapıldı. Sürekli değişkenler parametrik ya da non–parametrik olmalarına göre ortalama veya ortanca ± standart sapma olarak belirtildiler. Niteliksel değişkenler arasındaki karşılaştırmalar „ki-kare‟ ve „Fisher Exact Test‟ ile yapıldı. Niceliksel değişkenler arasındaki karşılaştırmalar non-parametrik testlerden „Mann - Whitney U Test‟ ile yapıldı.
31
V-BULGULAR
V.I.HASTA ÖZELLĠKLERĠ ve DEMOGRAFĠ
Çalışmaya sol atriyumda trombüslü olan 24, olmayan 23 olmak üzere toplam 47 hasta dahil edildi. Koroner arter hastalığı (KAH) 11 hastada (%23), DM 13 hastada (%27), HT 22 hastada (%46), geçirilmiş iskemik serebrovasküler olay (İSVO) veya geçici iskemik atak (GİA) öyküsü 6 hastada (%12) mevcuttu. Hastaların demografik özellikleri Tablo V‟de gösterilmiştir.
Tablo V Hastaların Demografik Özellikleri
Erkek Cinsiyet n (%) 21 (%44) Kadın Cinsiyet n (%) 26 (%56) YaĢ (yıl) 69.5 ± 7.4 Kadın (yıl) 70.61 ± 6.9 Erkek (yıl) 68.19 ± 8.0 KAH sıklığı n (%) 11 (%23) GeçirilmiĢ ĠSVO/GĠA sıklığı n (%) 6 (%12) DM sıklığı n (%) 13 (%27) HTsıklığı n (%) 22 (%46)
KAH = Koroner Arter Hastalığı; DM = Diabetes Mellitus; HT = Hipertansiyon; İSVO = İskemik Serebrovasküler Olay; GİA = Geçici İskemik Atak
V.II HASTALARIN EKOKARDĠOGRAFĠK ÖZELLĠKLERĠ
Hastaların ortalama EF si %56.49 ± 11.6, SA çapı 4.5 ± 0.36 cm, MY ciddiyeti 1.91 ± 0.71 idi. 47 hastanın 2 tanesinde transözefajial işleminde SEK saptanmazken 34 hastada hafif SEK, 4 hastada orta SEK, 7 hastada yoğun SEK gözlendi. Hastaların ekokardiografik verileri tablo VI‟da, hastaların SEK yoğunluğu şekil 2 de gösterilmiştir.
32 Tablo VI. Hastaların Ekokardiografik Özellikleri
SVEF % 56.49 ± 11.6 SA (cm) 4.5 ± 0.36 MY (ortalama derece) 1.91 ± 0.71 SEK Yok 2 (%4.2) Hafif 34 (%72.3) Orta 4 (%8.5) Yoğun 7 (%14,8)
SVEF = Sol Ventrikül Ejeksiyon Fraksiyonu; MY = Mitral Yetmezliği; SEK = Spontan Eko Kontrast; SA = Sol Atriyum
Şekil 2 Sol Atriyum İçinde SEK yoğunluğu
33
V.III SOL ATRĠYUM ĠÇĠNDE TROMBÜS VARLIĞI ve HASTA ÖZELLĠKLERĠ
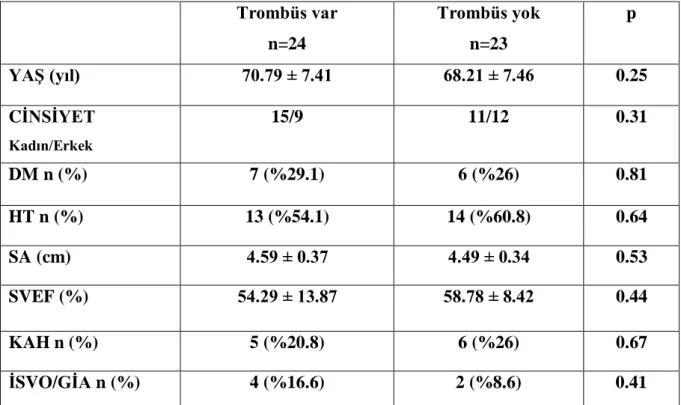
Çalışmaya sol atriyum içinde trombüsü olan 24 hasta ve olmayan 23 hasta dahil edildi. İki gruptaki hastalarda yaş, cinsiyet, DM, HT, SA boyutu, SVEF, KAH varlığı açısından anlamlı farklılık yoktu. İki grubun bazal özelikleri tablo VII‟de gösterilmiştir.
Tablo VII Sol Atriyum İçinde Trombüs Varlığına Göre Grupların Özellikleri
Trombüs var n=24 Trombüs yok n=23 p YAġ (yıl) 70.79 ± 7.41 68.21 ± 7.46 0.25 CĠNSĠYET Kadın/Erkek 15/9 11/12 0.31 DM n (%) 7 (%29.1) 6 (%26) 0.81 HT n (%) 13 (%54.1) 14 (%60.8) 0.64 SA (cm) 4.59 ± 0.37 4.49 ± 0.34 0.53 SVEF (%) 54.29 ± 13.87 58.78 ± 8.42 0.44 KAH n (%) 5 (%20.8) 6 (%26) 0.67 ĠSVO/GĠA n (%) 4 (%16.6) 2 (%8.6) 0.41
DM = Diabetes Mellitus; HT = Hipertansiyon; SA = Sol Atriyum; SVEF = Sol Ventrikül Ejeksiyon Fraksiyonu, KAH = Koroner Arter Hastalığı; İSVO = İskemik Serebrovasküler Olay; GİA = Geçici İskemik Atak
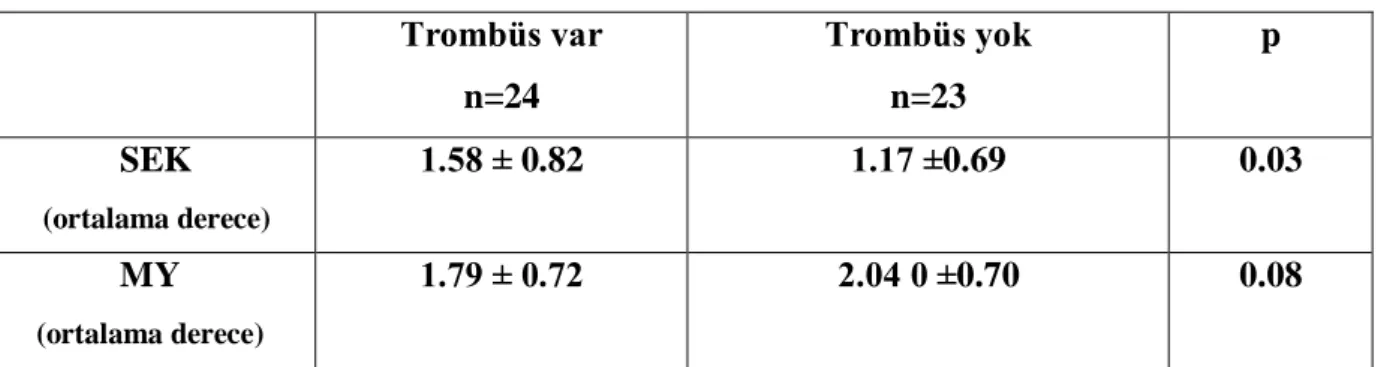
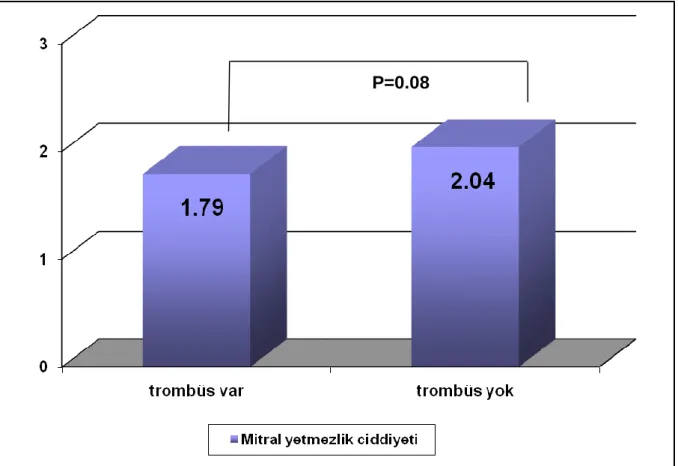
Her iki grup hasta SEK yoğunluğu ve MY ciddiyetine göre analiz edildi. Trombüs olan grupta SEK yoğunluğu trombüsü olmayan gruba göre anlamlı olarak daha fazla (p=0.03), MY ciddiyeti ise anlamlılığa yakın olarak daha az saptandı (p=0.08). Bulgular Tablo VIII, Şekil 3 ve Şekil 4‟de gösterilmiştir.
34
Tablo VIII SEK Yoğunluğu ve MY Ciddiyeti ile Trombüs İlişkisi
Trombüs var n=24 Trombüs yok n=23 p SEK (ortalama derece) 1.58 ± 0.82 1.17 ±0.69 0.03 MY (ortalama derece) 1.79 ± 0.72 2.04 0 ±0.70 0.08
SEK = Spontan Eko Kontrast; MY = Mitral Yetmezlik
Şekil 3 SEK Yoğunluğu ve Trombüs İlişkisi
35
Şekil 4 Mitral Yetmezlik Ciddiyeti ile Trombüs İlişkisi
V.IV SOL ATRĠYUM ĠÇĠNDE SEK YOĞUNLUĞU ve HASTA ÖZELLĠKLERĠ
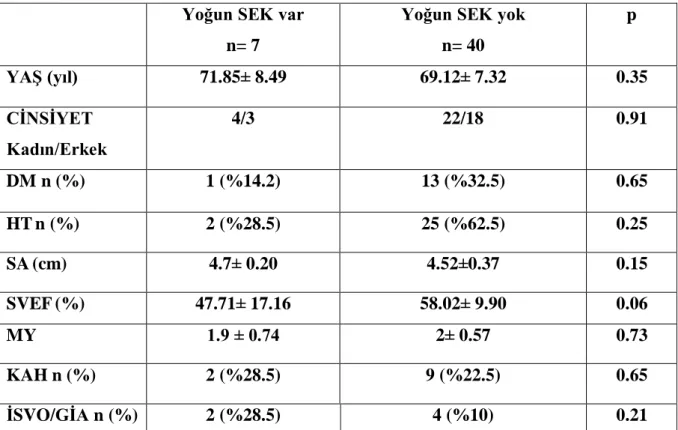
SEK olan hastalar yoğun SEK var, yoğun SEK yok olmak üzere tekrar iki gruba ayrıldılar. 47 hastadan 7 tanesinde yoğun SEK mevcuttu. Yoğun SEK olan ve olmayan hastalarda yaş, cinsiyet, DM, HT, KAH, İSVO/GİA varlığı SA boyutu açısından gruplar arasında anlamlı fark yoktu. SVEF SEK yoğun olan grupta istatistiksel anlamlılığa yakın olarak diğer gruba kıyasla daha az olarak saptandı (p=0.06). Bulgular Tablo IX‟da gösterilmiştir.
36
Tablo IX Yoğun SEK Varlığına Göre Grupların Özellikleri
Yoğun SEK var n= 7
Yoğun SEK yok n= 40 p YAġ (yıl) 71.85± 8.49 69.12± 7.32 0.35 CĠNSĠYET Kadın/Erkek 4/3 22/18 0.91 DM n (%) 1 (%14.2) 13 (%32.5) 0.65 HTn (%) 2 (%28.5) 25 (%62.5) 0.25 SA(cm) 4.7± 0.20 4.52±0.37 0.15 SVEF(%) 47.71± 17.16 58.02± 9.90 0.06 MY 1.9 ± 0.74 2± 0.57 0.73 KAH n (%) 2 (%28.5) 9 (%22.5) 0.65 ĠSVO/GĠA n (%) 2 (%28.5) 4 (%10) 0.21
SEK = Spontan Eko Kontrast; DM = Diabetes Mellitus; HT = Hipertansiyon; SA = Sol Atriyum; SVEF = Sol Ventrikül Ejeksiyon Fraksiyonu; MY = Mitral Yetmezliği; KAH = Koroner Arter Hastalığı; İSVO = İskemik Serebrovasküler Olay; GİA = Geçici İskemik Atak
V.V BETA FĠBRĠNOJEN 455 G/A POLĠMORFĠZMĠ ve TROMBÜS ve/veya SEK VARLIĞI ile ĠLĠġKĠSĠ
Beta fibrinojen 455 G/A polimorfizmi, 47 hastalık çalışma popülasyonunda 14 hastada (%29) saptandı. Polimorfizm, 14 hastadan 12 tanesinde heterozigot (G/A), 2 tanesinde ise homozigot (A/A) olarak görüldü. Homozigot mutasyona sahip hastaların ikisi de sol atriyum içinde trombüsü olan hastalardı. Trombüsü olan 24 hastadan 9 hastada (%37.5), trombüsü olmayan gruptaki 23 hastadan 5 hastada (%15.1) polimorfizm saptandı. Trombüsü olan hastalarda beta fibrinojen mutasyonu 2.48 kat fazla gözlenmesine rağmen değerler istatistiki anlamlılığa ulaşmadı (p=0.23). Bulgular Tablo X‟da gösterilmiştir.
37
Tablo X Beta Fibrinojen 455 G/A Polimorfizmi ve Trombüs İlişkisi
Trombüs var n=24
Trombüs yok n=23
p
Beta fibrinojen G/A polimorfizmi (+) 9 (%37.5) 5 (%15.1) 0.23
Şekil 5 Sol Atriyum İçinde Trombüs Varlığı ile Beta Fibrinojen G/A Polimorfizmi İlişkisi
Beta fibrinojen G/A polimorfizmi olan hastalar SEK yoğunluğuna göre incelendiğinde; yoğun SEK olan gruptaki 7 hastadan 4 hastada polimorfizm (%57.1), yoğun SEK olmayan gruptaki 40 hastadan 10 hastada polimorfizm (%25) gözlendi. Yoğun SEK beta fibrinojen polimorfizmi olan grupta ortalama olarak iki kat daha fazla ortaya çıkmasına rağmen fark istatistiksel açıdan anlamlılığa ulaşmıyordu (p=0.17). Bulgular tablo XI ve Şekil 6 da gösterilmiştir.
Tablo XI Beta Fibrinojen 455 G/A Polimorfizmi ve Yoğun SEK İlişkisi
Yoğun SEK var n=7
Yoğun SEK yok n=40
p
Beta fibrinojen G/A polimorfizmi (+) 4 (%57.1) 10 (%25) 0.17
SEK = Spontan Eko Kontrast
p=0.34
38
Şekil 6 Yoğun SEK Varlığı ile Beta Fibrinojen 455 G/A Polimorfizmi İlişkisi
Beta fibrinojen 455 G/A polimorfizmi olan hastalar yoğun SEK ve/veya trombüs varlığına göre incelendiğinde yoğun SEK ve/veya trombüs olan gruptaki 27 hastadan 12 hastada polimorfizm (%44.4) gözlenirken, yoğun SEK ve/veya trombüs olmayan 20 hastadan 2 hastada polimorfizm (%10) gözlendi. Her iki grubu birleştirince beta fibrinojen polimorfizmi olan grupta trombüs ve/veya yoğun SEK varlığı istatistiksel açıdan anlamlı olarak fazla olduğu saptandı (p=0.01). Bulgular tablo XII‟de gösterilmiştir.
Tablo XII Trombüs ve/veya Yoğun SEK ile Beta Fibrinojen 455 G/A Polimorfizmi İlişkisi
Trombüs ve/veya yoğun SEK var n = 27
Trombüs ve yoğun SEK yok n=20
p
Beta fibrinojen G/A polimorfizmi (+)
12 (%44.4) 2 (%10) 0.01
SEK = Spontan Eko Kontrast
p=0.17
39
Şekil 5 Yoğun SEK ve/veya Trombüs Varlığına Göre Beta Fibrinojen G/A Polimorfizmi Dağılımı
V.VI BETA FĠBRĠNOJEN 455 G/A POLĠMORFĠZMĠNĠN ÇALIġMA
POPÜLASYONU ĠÇĠNDEKĠ KAH ve ĠSVO/GĠA VARLIĞI ĠLE ĠLĠġKĠSĠ
Çalışma popülasyonu içindeki KAH veya İSVO/GİA‟sı olan hastalarda beta fibrinojen 455 G/A polimorfizmi, KAH veya İSVO/GİA hikayesi olmayan hastalara göre benzer sıklığa sahipti. İki grup arasında anlamlı farklılık saptanmadı. Bulgular tablo XIII‟de gösterilmiştir.
Tablo XIII Beta Fibrinojen G/A Polimorfizmi ile KAH ve İSVO/GİA Arasındaki İlişki
Beta Fibrinojen G/A polimorfizmi var
n=14
Beta Fibrinojen G/A polimorfizmi yok n=33 p KAH 3 (%21.4) 8 (%24.2) 0.83 ĠSVO/GĠA 1 (%7.1) 5 (%15.1) 0.46 KAH+ ĠSVO/GĠA 3 (21.4) 12 (%36.3) 0.32
KAH = Koroner Arter Hastalığı; İSVO = İskemik Serebrovasküler Olay; GİA = Geçici İskemik Atak
p=0.01