T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI
ANABİLİM DALI
SUBAKUT SKLEROZAN PANENSEFALİTLİ
ÇOCUKLARDA RETROSPEKTİF DEMOGRAFİK VE KLİNİK
DEĞERLENDİRME
Dr. Özlem ERTEN UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
SUBAKUT SKLEROZAN PANENSEFALİTLİ
ÇOCUKLARDA RETROSPEKTİF DEMOGRAFİK VE KLİNİK
DEĞERLENDİRME
Dr. Özlem ERTEN UZMANLIK TEZİ
Tez Danışmanı
Yrd. Doç. Dr. Fesih AKTAR
İÇİNDEKİLER
TEŞEKKÜR...I ÖZET...III ABSTRACT...V TABLOLAR DİZİNİ...VII ŞEKİLLER DİZİNİ...VIII KISALTMALAR...IX 1. GİRİŞ VE AMAÇ...1 2. GENEL BİLGİLER...22.1. Subakut Sklerozan Panensefalit...2
2.1.1.Tanım….. 2
2.1.2.Epidemiyoloji2 2.1.3.Patogenez 4 2.2. Klinik Bulgular...9
2.3. Tanı….. 14
2.3.1. Beyin Omurilik Sıvısı (BOS)...16
2.3.2. Elektroensefalografi (EEG)...16
2.3.3. Görüntüleme Yöntemleri...18
2.3.3.1. Bilgisayarlı Beyin Tomografi...19
2.3.3.2. Manyetik Rezonans Görüntüleme...19
2.3.4. Beyin Biyopsisi...20 2.4. Tedavi.…...21 2.4.1. İsoprinosin 21 2.4.2. İnterferon-alfa...22 2.4.3. Ribavirin 23 2.4.4. İnterferon-beta...24 2.4.5. Diğer İlaçlar 24 2.4.6. Semptomatik Tedavi...24
2.5. Aşılamanın Önemi.…...25
2.6. Prognoz.…...25
2.7. Özel Durumlar…...26
2.7.1. Erişkin Dönemde SSPE...26
2.7.2. Gebelikte SSPE...26 3. GEREÇ ve YÖNTEM...28 3.1. Tanımlamalar...29 3.2. İstatistiksel analiz...30 3.3. Etik Kurul...30 4. BULGULAR...32 5. TARTIŞMA...40 6. SONUÇLAR...46 7. KAYNAKLAR...47
TEŞEKKÜR
Uzmanlık eğitimim boyunca bilgi ve deneyimlerinden yararlandığım değerli hocalarım; Prof. Dr. Celal DEVECİOĞLU, Prof. Dr. Kenan HASPOLAT, Prof. Dr. Aydın ECE, Prof. Dr. Murat SÖKER, Doç. Dr. Ayfer GÖZÜ PİRİNÇÇİOĞLU, Doç. Dr. Mustafa TAŞKESEN, Doç. Dr. Meki BİLİCİ, Doç. Dr. İlyas YOLBAŞ, Doç. Dr. Alper AKIN, Doç. Dr. Sabahattin ERTUĞRUL, Doç. Dr. Velat ŞEN, Yrd. Doç. Dr. İlhan TAN, Yrd. Doç. Dr. Ali GÜNEŞ’e, her zaman yanımızda olan ve bilgilerini bizimle paylaşan uzmanlarımıza,
Tez çalışmamın planlanması, yönlendirmesi ve hazırlanmasında yol gösterici olan, yoğun çalışma temposu içerisinde bana değerli vaktini ayıran, bilgi ve deneyimlerinden faydalandığım tez danışmanım Sayın Yrd. Doç. Dr. Fesih AKTAR’a,
Asistanlığımın ilk iki yılında eğitimime büyük katkıları olan Uludağ Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı Başkanı Sayın Prof. Dr. Betül Berrin SEVİNİR başta olmak üzere tüm pediatri ailesine,
Asistanlığım boyunca her anı paylaştığım ve birlikte çalışmaktan büyük onur ve mutluluk duyduğum sevgili asistan arkadaşlarıma, hemşire, sekreter ve tüm personel arkadaşlarıma, tecrübelerimin artmasına büyük katkıları olan hastalarıma,
Her zaman sevgilerini ve desteklerini yanımda hissettiğim; hayatımın her anında benimle olan sevgili Ailem’e, zorlu asistanlık süresince gösterdiği sabır ve destekleri nedeni ile eşim Özgür Fırat ERTEN’e ve büyüdüğünü fark edemediğim, birgün beni anlayacağını umarak kızım EYLÜL’e,
Sonsuz teşekkür eder ve saygılarımı sunarım.
Dr. Özlem Erten Diyarbakır-2017
ÖZET
Giriş ve Amaç: Subakut sklerozan panensefalit (SSPE), kızamık virüsünün merkezi sinir sistemini tutması ile oluşan ilerleyici bir çocukluk çağı hastalığıdır. Hastalık hızlı seyretmekte olup; genellikle belirtiler başladıktan sonra birkaç yıl içinde ölüm gerçekleşmektedir. Bu çalışmada SSPE’li hastalarda epidemiyolojik, klinik ve laboratuvar bulguları ve tedavi sonrası oluşan değişikliklerin incelenmesi amaçlanmıştır.
Gereç ve Yöntemler: Bu çalışma Ocak 1990 - Aralık 2016 yılları arasında Dicle Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı’nda yapıldı. Çalışmaya yaşları 1 – 18 yaş arasında olan ve SSPE tanısı konmuş 42 hasta retrospektif olarak alındı. Tüm vakaların demografik verileri, hastalık öyküleri, fizik muayene bulguları, laboratuvar parametreleri, beyin omurilik sıvısı (BOS) bulguları, verilen tedaviler, tedavi sonrası takip ve sonuçlara ait tüm veriler kaydedildi.
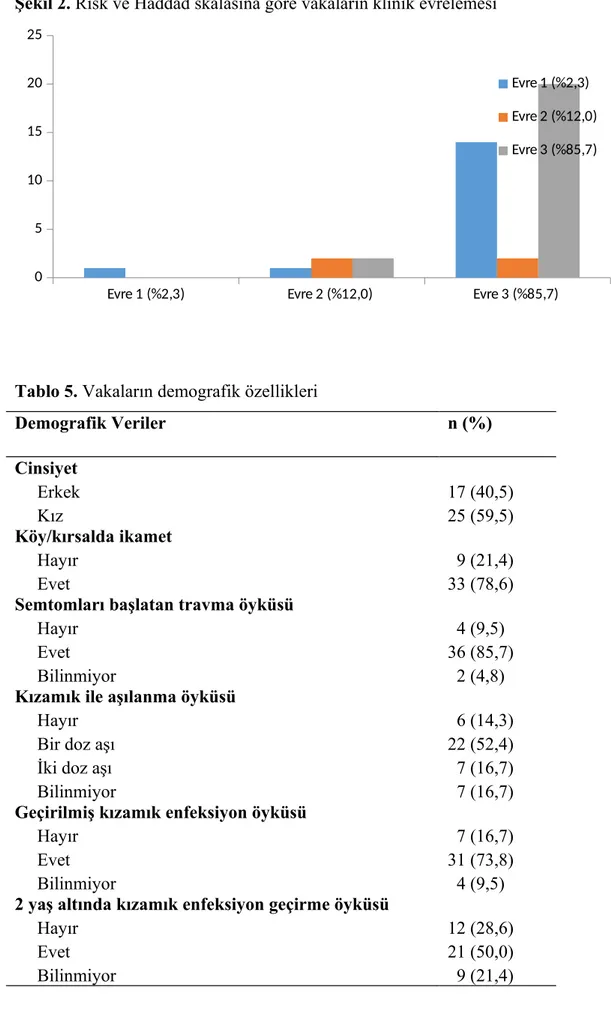
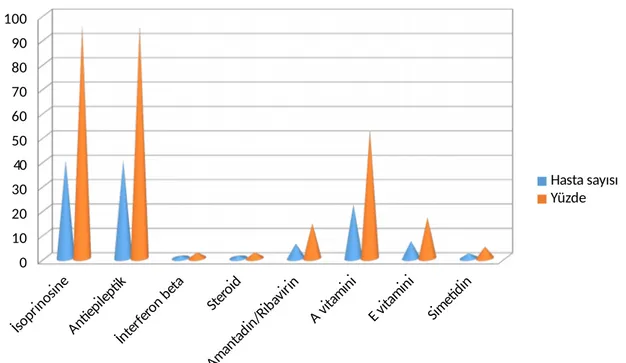
Bulgular: Hastaların %59,5’i kız ve %40,5’i erkek, yaş ortalamaları 123,7 ± 37,7 ay (36 – 192 ay) idi. %78,6’sı köy/kırsalda yaşıyordu. %52,4’üne bir doz ve %16,7’sine iki doz kızamık aşısı yapılmıştı. %73,8’i daha önce kızamık enfeksiyonu geçirmişti. En sık başlangıç semptomları yürümede dengesizlik, entelektüel (kognitif/bilişsel) fonksiyonlarda bozulma, ani sıçramalar ve konuşmada bozukluk idi. En sık fizik muayene bulguları kognitif defisit, akinetik mutizm, akinetik rijit sendrom ve epileptik nöbet idi. Çalışmaya alınan 42 hastanın 36’sının klinik evresi Evre 3 idi. Hastaların %78,6’sında her dört nörolojik bozulma indeksi de anormaldi. %95,2’si tedavide isoprinosine ve en az bir antiepileptik ilaç kullanırken, %14,3’ü amantadin/ribavirin kullanıyordu. Hastaların ortalama takip süresi 63,3 ± 45,4 ay idi. %28,6’sı exitus olurken, exitus olan vakalar semptomlar başladıktan sonra ortalama 31,6 ± 35,9 ayda kaybedildi.
Tartışma ve Sonuç: SSPE tanısı anamnez, fizik muayene, klinik, serum ve BOS’da kızamık antikor titresinin yükselmesi, karakteristik elektroensefalogram (EEG) paterni ve beyin biyopsisinde panensefalitin gösterilmesi ile konur. SSPE hastalığının bölgemizde iyi tanınması nedeni ile daha erken evrelerde tanı konulması beklenmektedir. Ancak çalışmamızda SSPE tanısı semptomların başlangıcından ortalama 69,6 ± 111,4 gün sonra konulmuştur. Bu sonuç bize tanı koymada gecikildiğini, SSPE’nin farklı semptom ve bulgularla karşımıza çıkabileceği için erken tanıda klinik şüphenin önemini birkez daha ortaya koymaktadır.
SSPE tedavisi genel olarak yaşam süresini uzatma ve yaşam kalitesini iyileştirmeye yönelik olup günümüzde hastalığın kesin bilinen bir tedavisi bugün için yoktur. SSPE vakalarında yaşam süresi değişmekle birlikte genellikle birkaç yılda exitus ile sonuçlanmaktadır.
Sonuç olarak; SSPE yaygın aşılama programına rağmen ülkemiz için önemli bir sağlık sorunu olmaya devam etmektedir. SSPE çok farklı klinik tablolarla karşımıza çıkabildiği için hastalığın iyi tanınması çok önemlidir. Kronik ve ilerleyici bir hastalık olan SSPE’nin hala tedavisi olamamakla beraber mevcut tedaviler hastalığın seyrini yavaşlatmakta ancak tedavi seçeneklerinin de arttırılması gerekmektedir.
ABSTRACT
Background: Subacute sclerosing panencephalitis (SSPE) is a progressive disorder of the central nervous system caused by measles virus in childhood. The disease progression is mostly rapid, which may lead to death within a few years after its onset. In this study, we aimed to investigate epidemiological, clinical and laboratory findings and to evaluate treatment responses of patients with SSPE.
Materials and Methods: This retrospective study included 42 patients who were admitted to Dicle University, Faculty of Medicine, Department of Pediatrics and were diagnosed with SSPE between January 1990 and December 2016. Demographic data, physical examination findings, laboratory results, cerebrospinal fluid (CSF) findings of all cases, treatments applied, follow-up data, and treatment responses were recorded.
Results: Of all patients, 59.5% were females and 40,5% were males with a mean age of 123,7 ± 37,7 (range: 36 to 192) months. A total of 78.6% were living in villages and rural areas. A total of 52.4% of the patients received one dose and 16.7% of the patients received two doses of measles vaccination. Of the patients, 73.8% had measles infection before. The most common initial symptoms were impaired walking, impaired intellectual (cognitive) functions, sudden jumps, and speech disorder. The most frequent physical examination findings were cognitive deficit, akinetic mutism, akinetic rigid syndrome, and epileptic seizure. Thirty-six patients had Stage 3 disease, and 78.6% of the patients had abnormal results in the all four neurological impairment indices. Of the patients, 95.2% received isoprinosine and at least one antiepileptic medication, while 14.3% used amantadine/ribavirin. The mean follow-up was 63.3 ± 45.4 months. The mean time from the symptom onset to mortality was 31.6 ± 35.9 months in 28.6 of the patients.
Discussion: The diagnosis of SSPE is made by medical history, physical examination, clinical, serum test results, and elevated measles antibody titers in CSF, characteristic electroencephalogram (EEG) patterns, and panencephalitis in brain biopsy. It is expected that the diagnosis of SSPE will be given for an earlier period due to the good recognition in our region. However, the mean time from the symptom-onset to diagnosis of SSPE was 69,6 ± 111,4 days in our study. This result once again highlights the importance of the clinic suspicion, which indicates that it is delayed in diagnosing and that SSPE may be confronted with different symptoms and findings.
Currently, there is no known treatment for SSPE, and the treatment is often to prolong the life span and to improve the quality of life of patient. The life span of these patients is variable which usually results in death in a few years.
Conclusion: Subacute sclerosing panencephalitis continues to be a major health problem for our country, despite the widespread vaccination program. As SSPE may present with many different clinical pictures, it is of utmost importance that the disease must be well-recognized. As a chronic and progressive disease, SSPE is still not able to be treated and current treatment options can only slow the progression of the disease. Further treatment options are needed to be developed.
TABLOLAR DİZİNİ
Tablo 1. Jabbour ve Gascon klinik evrelemesi………..12
Tablo 2. Risk ve Haddad tarafından düzenlenen klinik evreleme….………....14
Tablo 3. Nörolojik bozulma indeksi (neurologic disability index=NDI)………...…..….…15
Tablo 4. Dyken'e göre SSPE tanı kriterleri...………..………...…….15
Tablo 5. Vakaların demografik özellikleri……….33
Tablo 6. SSPE hastalarının anamnez özellikleri………35
Tablo 7. SSPE hastalarının fizik muayene bulguları……….36
Tablo 8. SSPE hastalarında nörolojik bozulma indeksi……….…………37
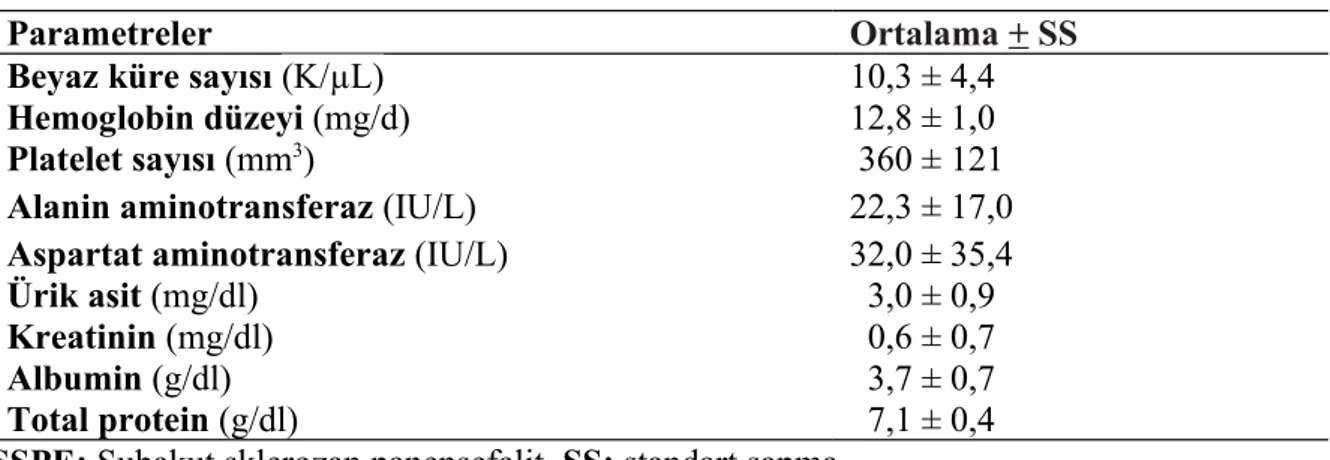
Tablo 9. SSPE hastalarının laboratuvar parametreleri……….………..37
ŞEKİLLER DİZİNİ
Şekil 1. SSPE'nin tipik EEG bulgusu………...18 Şekil 2. Risk ve Haddad skalasına göre vakaların klinik evrelemesi……….33 Şekil 3. SSPE vakalarının kullandığı tedaviler………….………..39
KISALTMALAR
ALT AST BBT BOS CD DNA DSÖ EEG ELISA HIV IFA IL INF MRG MRS MSS NAA NDI RNA Alanin aminotransferaz Aspartat aminotransferaz Bilgisayarlı beyin tomografi Beyin omurilik sıvısıCluster of differentiation Deoksiribonükleik asit Dünya Sağlık Örgütü Elektroensefalografi
Enzyme linked immunosorbent assay İnsan immün yetmezlik virüsü
Immuno florescent assay İnterlökin
İnterferon
Manyetik rezonans görüntüleme
Magnetik rezonans spektroskopik görüntüleme Merkezi sinir sistemi
N-asetil aspartat
Nörolojik bozulma indeksi Ribonükleikasit RT-PCR SLAM SSPE Th TNF UNICEF
Real-time kantitatif polimeraz zincir reaksiyonu Signaling lymphocyte activation molecule Subakut sklerozan panensefalit
T helper
Tümör nekrozis faktör
1.
GİRİŞ ve AMAÇ
Subakut sklerozan panensefalit (SSPE), kızamık virüsünün merkezi sinir sistemini (MSS), tutması ile oluşan ilerleyici bir hastalıktır (1,2). Yaygın demiyelinizasyon ve enflamasyon, kötüleşmenin ana nedeni olup hastalık ölümcül seyretmektedir (3). MSS’e yerleşen yıllar içinde aktive olan virüs; nöron, akson, glial hücreler, miyelin kılıfı ve destekleyici hücrelere zarar vererek kliniğin başlamasına neden olur. İlk klinik bulgular, genellikle zekâ ve davranış bozuklukları ve bazen de epileptik nöbetler şeklinde başlamakla beraber bazen de atipik bulgularla da karşımıza çıkabilmektedir. SSPE patogenezi tam olarak aydınlatılamamış olup davranış değişiklikleri, myoklonus, mental kötüleşme, ekstrapiramidal disfonksiyon, görme bozukluğu ile karakterize bir hastalıktır. İrritatif lezyonları destrüktif lezyonlar izler ve demans gelişir (1). SSPE tanısı destekleyici ve doğrulayıcı tanı kriterleri ile konmaktadır. Destekleyici tanı kriterleri: Rutin elektroensefalografi (EEG)’de aralıklı, yüksek amplitüdlü keskin-yavaş dalgalar olması ve intravenöz diazepam 5 mg yapıldıktan sonra baskılanmamalarıdır. Doğrulayıcı tanı kriterleri: Beyin omurilik sıvısında (BOS) kızamık IgG’nin yüksek saptanması (BOS/serum IgG ve total IgG oranları ile hesaplanan kızamık IgG sentez indeksinin intratekal sentezi gösterecek şekilde yüksek olması) veya beyin biyopsisi veya postmortem alınan doku örneklerinde tipik histolojik bulgular (kızamık inklüzyon cisimlerinin görülmesi) olmasıdır (1).
SSPE’li hastalarda EEG tanıda önemli rol almasına karşılık her zaman tipik bulgular görülmemektedir. EEG bilateral, simetrik, senkronize yüksek voltajlı, polifazik, sterotipik delta dalgaları şeklinde periyodik komplekslerle karakterizedir. SSPE’de manyetik rezonans görüntüleme (MRG) bulguları beyin tutulumunu göstermektedir ancak klinik bulgularla korelasyonu zayıftır (4,5). Günümüzde kesin bilinen bir tedavisi yoktur. İsoprinosin tedavide en sık kullanılan, antiviral ve immünomodülatör etkileri olmasına karşılık tedavi etkinliği tartışmalı olan bir ajandır. Tedavide zaman içerisinde kortikosteroidler, interferon (IFN) alfa, IFN-beta, ribavirin, intravenöz immunglobulin ve simetidin de kullanılmasına rağmen tam ve kısmi remisyon çok az hastada görülmektedir. Hastalık hızlı seyretmekte olup; genellikle belirtiler başladıktan sonra birkaç yıl içinde ölüm gerçekleşmektedir (3,6).
Bu çalışmada SSPE tanısı ile takip edilen hastalarda epidemiyolojik, klinik, laboratuvar bulgularını incelemek ve tedavi sonrası oluşan değişikliklerin incelenmesi ve yorumlanması amaçlanmıştır.
2. GENEL BİLGİLER
2.1. Subakut Sklerozan Panensefalit2.1.1.Tanım
SSPE, defektif veya mutasyona uğramış kızamık virüsünün MSS’yi etkilemesi ile oluşan ilerleyici yavaş virüs enfeksiyonudur. İlk kez Dawson tarafından 1933 yılında ilerleyici mental kötüleşmesi ve istemsiz hareketleri olan, daha fazla gri cevherde olmak üzere bol miktarda nöronal inklüzyon cisimcikleri olan bir vaka tanımlamış ve subakut inklüzyon cisimciği ensefaliti olarak adlandırmıştır (3,7). Gri ve beyaz cevherde tutulum yapan yavaş virüs enfeksiyonu için Greenfield ilk defa 1960 yılında SSPE tanımını kullanmıştır. Connoly serum ve BOS’da kızamık antikoru artışını 1967 yılında saptamış, beyin dokusunda virüsü 1969 yılında Barbosa ve arkadaşları elde etmişlerdir (8). San Fransisco’da 1995 yılında SSPE ile ilgili toplantı yapılmış, bu hastalıkla ilgili organizasyon ilk kez oluşturulmuştur. Bu organizasyon, 1996 yılında Ankara’da toplanmış, isoprinosin ve IFN-alfa tedavilerinin SSPE tedavisindeki yerini belirlemek amacı ile araştırma kurulu oluşturulmuştur (1).
2.1.2. Epidemiyoloji
Kızamık enfeksiyonu halen sık görülmektedir. Kızamık virüs aşısı kullanıma girmeden önce Dünya Sağlık Örgütü (DSÖ), dünya çapında kızamık enfeksiyonu ve komplikasyonlarından yılda sekiz milyon ölüm olduğunu tahmin etmiştir (9). SSPE gelişmekte olan ülkelerde daha sık görülmekle birlikte dünyanın her tarafında görülmektedir. Gelişmiş batı ülkelerinde çok uzun süre insidansı 1/100.000 olarak kabul edilmiştir (2,10). Farklı yayınlarda, kızamık virüs enfeksiyonu geçirenlerdeki sıklığı 0,6-2.2/100 000 arasında olduğu belirtilmektedir. Yapılan çalışmalarda batıda da SSPE sıklığının son zamanlarda arttığı belirtilmekte, Amerika Birleşik Devletleri’nde SSPE insidansının 6,5-11/100 000 olduğu, İngiltere’de ise kızamık aşılama sayısındaki azalmadan dolayı 1990-2002 yıllarında SSPE insidansının arttığı ve 1/25 000 olarak bildirilmiştir (10,11). Görülme sıklığı Hindistan’da 21/1.000.000, Papua Yeni Gine’de 98/1.000.000, Ortadoğu’da 2.4/1.000.000, Güney Çin’de 1/1.000.000 olarak bildirilmiştir (12-15). Türkiye’de ise 1975-1987 yılları arasında yıllık insidans 0,827/1.000.000 olarak bildirilmiş ancak 1997-1999 yılları arasında 0.461/1.000.000’e düştüğü bildirilmiştir. Görülme sıklığının azalması aşılama oranlarındaki artışa bağlanmıştır (16). SSPE sıklığı İstanbul’da 2002-2004 yılları arasında yapılan bir çalışmada 2/1 000 000 olarak bildirilmiştir (17). Görülme sıklığının 2004 yılında artmasının nedeni artan kızamık
enfeksiyonlarına bağlanmıştır (16,18).
SSPE genel olarak bir çocukluk çağı hastalığıdır. Görülme yaşı ortalama 5-15 yaştır (2). SSPE tanılı hastaların özgeçmişine bakıldığında kızamık enfeksiyonunu %80 oranında 4 yaşından önce %50 oranında da 2 yaşından önce geçirmiş oldukları görülmektedir. Bir yaş altında kızamık virüs enfeksiyonu geçirenlerde beş yaşından sonra geçirenlere oranla SSPE geçirme sıklığı 16 kat artmaktadır (2). Gelişmiş ülkelerde kızamık virüs enfeksiyonu ve SSPE sıklığının aşılama oranlarındaki artışla beraber belirgin olarak azaldığı görülmüş ve SSPE görülme yaşının ortalama 14 yaştan 9 yaşa düştüğü bildirilmiştir (19,20). Kızamık enfeksiyonu geçirilmesinden sonra SSPE’nin ortaya çıkması için genellikle 5-10 yıllık latent dönem gerekmektedir. Türkiye’de 1995-1999 yılları arasında SSPE tanısı alan hastaların tanı yaşı 7.6 ± 4.5 yıl, kızamık enfeksiyonu geçirme yaşları da 20.7 ± 20.1 ay olarak tespit edilmiş ve latent dönemin de 5.9 ± 4.3 yıla gerilediği tespit edilmiştir (16). Kızamık enfeksiyonunda cinsiyet ayrımı görülmemesine karşın, SSPE 3-4 kat erkeklerde daha fazla tespit edilmiştir (2,16).
DSÖ ve The United Nations Children’s Fund (UNICEF) ilk doz kızamık aşısına ek olarak kişisel ve toplum bağışıklığını en yüksek düzeye çıkarmak için tüm çocuklara ikinci bir doz aşı yapılmasını önermektedir (21,22). Aşılı kişilerde de SSPE görülebilmektedir. Brouns ve ark. 9 aylıkken aşı yapılmış 8,5 yaşında SSPE’li bir kız çocuğu bildirmişlerdir (23). SSPE nin aşılanmış çocuklarda da görülmesi bu olgularda aşı yapılmadan önce subklinik kızamık enfeksiyonunun geçirilmiş olabileceğini düşündürmektedir. Sporadik SSPE olgularına zayıflatılmış kızamık aşısının yol açabileceğine dair herhangi bir kanıt yoktur (10). Erken dönemde anneden geçen antikorların koruyucu olması standart aşılama yaşının 15. ayda, endemik bölgelerde ise yaşamın 6-9. aylarında yapılmasının gerekli olduğu düşünülmektedir (24). Kızamık aşısının ülkemizde yapılan birkaç çalışmaya göre de 12. aydan önce yapılması ile yeterli antikor düzeyi oluşturulmadığı tespit edilmiştir. Metintaş ve ark. yaptıkları çalışmada 9-11 aylarda aşılanmış 31 çocukta aşı sonrası %61,3 oranında seropozitiflik tespit etmişlerdir (25). Kuyucu ve ark. yaptıkları bir çalışmada yaşları 11-24 ay arasında olan, 9 aylıkken aşılanmış 200 çocuk üzerinde %71,5 oranında seropozitiflik tespit etmişlerdir (26). Kızamık virüsünün genetiğinde oluşan değişiklikler de aşı başarısızlıklarının önemli bir nedeni olabilir. Kızamık virüsüne hastanın gösterdiği hassasiyet de aşı başarısızlığından kaynaklanabilir. Kızamık enfeksiyonundan ve SSPE’den korunmanın en önemli yolu aşılama yapılmasıdır (23).
Ülkemizde SSPE tanısının son zamanlarda daha erken yaşlarda ortaya çıktığı tespit edilmiş ve bu durumun birçok nedene bağlı olabileceği belirtilmiştir. Bu nedenler: kırsal kesimde yaşama, mental geriliğin olması, kalabalık ortamda yaşam, düşük doğum ağırlığına sahip olma, düşük sosyoekonomik koşullar, beslenme durumları, coğrafi farklılıklar, annenin eğitim düzeyinin düşük olması, aşılamanın yapılmaması, kızamık enfeksiyonu geçirilen dönemde hastalık seyrini etkileyebilecek ek hastalık geçirme öyküsü olması (Örn: Ebstein-Barr virüs, parainfluenza tip 1), olarak belirtilmiştir (2,16,17,27,28). Ciddi kafa travması öyküsü de SSPE’li hastalarda daha sık görülmektedir (16). Tüm bu nedenler dikkate alınarak 2001 yılında Anlar ve ark.’ları, ülkemizde SSPE yaşının 1995 yılından sonra 5 yaş kadar öne kaydığını tespit etmişlerdi (16). Daha büyük yaştaki SSPE hastaları da ele alındığında, bunun nedeninin, kızamık enfeksiyonu ile SSPE klinik bulgularının oluşması için geçen sürenin kısalması ile ilişkili olduğu sonucuna varılmıştır. Bunun nedeni, erken yaşta geçirilen kızamık enfeksiyonu ve bağışıklık sisteminin bu dönemde istenen düzeyde olmaması, olarak bildirilmiş ancak kızamık virüs enfeksiyonu geçirme yaşı ile latent dönem arasında bağlantı saptanamadığı bildirilmiştir (16). Diğer ülkelerde SSPE ile ilgili böyle bir sonuç bildirilmemiştir.
SSPE insidansının yaygın aşılama programlarıyla azaldığı görülmüştür.
2.1.3. Patogenez
Kızamık virüsü, Paramiksovirüs ailesinden Morbilivirüs alt grubuna ait olan zarflı bir ribonükleikasit (RNA) virüsüdür (29). Elektron mikroskobunda daire şeklinde 100-250 nm çapında görülür. Proteolitik enzimler, eter, aseton, formalin gibi kimyasal maddeler ve ultraviyole ile etkinliği kısa sürede yok olur. Bu özelliği sağlayan dış zarın lipid ve protein içermesidir (30,31). Kış sonu ve sonbaharda epidemiler yapmasının nedeni düşük ısılara dayanıklı olmasıdır. Akut kızamık virüs enfeksiyonu ile SSPE semptomlarının başlaması arasında uzun süre vardır. Virüsün beyne yerleşimi ise akut kızamık enfeksiyonu sırasında olmaktadır ancak hangi yollarla beyne ulaştığı tam olarak bilinmemektedir. Kızamığın akut deri döküntüleri sırasında, enfekte olan endotel hücreleri döneminde, serebral endotel hücrelerinin de enfekte olduğu öngörülmektedir (31,32). Kızamık virüsünün beyinekızamığın akut ekzantem döneminde diğer endotel hücreleri gibi enfekte olan beynin endotel hücreleri ile taşındığı düşünülmektedir (2).
Kızamık virüsünün yapısında insan vücuduna girdikten sonra bir takım değişiklikler olduğu çalışmalarla gösterilmiştir. Bu değişiklikler; MSS’e yerleşen ve uzun süre latent kalan, latent dönemin sonunda matriks proteini (M), membran füzyonuna neden olan glikoprotein (F) ve hemaglutinin (H)’deki yapısal değişikliklerdir. Bu değişiklikler sonucu mutant virüs oluşmakta, bu mutant virüs beyin dokusunda protein sentezleyerek çoğalmakta ve beyin dokusunda immün sistem olmadığından enfeksiyon oluşturduğu gösterilmiştir. M proteinindeki mutasyonlar, konak hücreden tomurcuklanmayan viriona neden olmakta, virüs bir süre sessiz kalarak konak içinde bağımsızlaşarak harabiyete yol açmakta ve nedeni bilinmeyen bir şekilde yıllar sonra tekrar aktifleşerek SSPE’ye neden olmaktadır (1,33,34). MSS’de mutant virüs öncelikle nöronları enfekte eder. Önceleri sadece intranükleer virüs varlığı saptanırken yapılan çalışmalarda nöronal uzantılar, akson ve dendritlerde de virüsün varlığı tespit edilmiştir. Transnöronal ve aksonal yolla hastalık yayılmaktadır. Demyelinizasyonla beraber oligodentrositlerdeki enfeksiyon aksonal enfeksiyona sekonder olabilir (31,35,36). Kızamık virüsü nöron dışı hücrelerde de yayılmaktadır. Bu yayılım hem ekstrasellüler olarak hem de çok çekirdekli sinsitya oluşumuna yol açarak hücre füzyonuna neden olmakta ve sitopatik etki yapmaktadır. Real-time kantitatif polimeraz zincir reaksiyonu (RT-PCR) ve immün floresan yöntemlerle beyin dokusunda kızamık virüsü gösterilmiştir (37). Buna karşılık kızamık virüsü fibroblastlarla birlikte kültür edilmezse SSPE’li hastaların beyinlerinden çok az ekstrasellüler virüs üretilebilir (29). Hiçbir SSPE hastasında aşı genotipi olan genotip A saptanmamıştır (34,38). Bu da kızamık aşısının SSPE’ye yol açabileceği görüşünün doğru olmadığını göstermektedir.
Kızamık virüsünün vahşi tipinin 20’nin üzerinde genotipi tanımlanmış olup heterojen bir genetiğe sahiptir. Bu genotipler geçici olarak farklı coğrafi dağılıma sahiptir. Virüs kökenini ve epidemiyolojik bağlantıları tespit etmede bu bilgiler fayda sağlamaktadır (10, 39). SSPE hastalarında viral genomda çok sayıda nokta mutasyon tespit edilmiş olup M proteininde de çok sayıda değişiklik saptanmıştır (40,41). Persistan enfeksiyondan H ve F proteinlerinde değişiklikler sorumlu iken M proteininde belirgin değişiklikler saptanmamıştır (42,43). Bir kemokin olan CXCL-10 SSPE hastalarında yüksek bulunmuş fakat T hücre işlevinde etkisi yoktur (44).
Yapılan birçok immünolojik çalışmada sağlıklı kontrol grubuna göre SSPE’li hastalarda mononükleer hücre proliferasyonu daha düşük saptanmıştır. BOS’da ölçülen IL-10
salgısının yüksek ve INFdüzeyinin düşük saptanması Th1 yanıtının SSPE’de gelişmediğini ve IL-10 aracılığıyla immün yanıtın baskılandığını göstermektedir. Fonksiyonel olmayan p40 altünitesine sahip olan IL-12 artışı tespit edilmesi, yetersiz bir immün yanıtın geliştiğini düşündürür (45). Kızamık virüs aşısı ve PPD (saflaştırılmış protein türevi)’ye karşı IL-12 düzeyinin SSPE’li hastalarda düşük tespit edilmesi, SSPE hastalarında Th1 yanıtının defektif olduğu görüşünü desteklemektedir (46). Yaptıkları çalışmada Direskeneli ve ark. SSPE’li hastaların BOS ve serumunda artmış IL-12 düzeyi saptamaları, Th1 tipindeki immün yanıtta etkili olmayan IL-12 üreten hücrelerin varlığını düşündürmektedir (44). Karp ve ark. 1996 yılında yaptığı çalışmada, monositlerin kızamık virüsü ile enfeksiyonu, CD46 üzerinden IL-12 artışı ile baskılandığı tespit edilmiştir (47). Ichiyama ve ark. SSPE tanılı 23 olgu ile yaptıkları bir çalışmada, BOS ve serumda sitokin düzeylerini araştırmışlar ve olguların ateş yüksekliğinin serumda artmış IL-6 ve IL-10 düzeyi ile bağlantılı olduğunu ve myoklonik atılmaların BOS’da artış gösteren IL-6 düzeyleri ile ilişkili olduğunu tespit etmişler (13). Taşdemir ve ark. Bir çalışmada DD genotipinin ve D allelinin SSPE vakalarında kontrol grubuna göre çok yüksek düzeyde saptamış ve SSPE gelişimi ile “Angiotensin Converting Enzyme Insertion/Deletion” polimorfizminin DD genotipi arasında ilişki olabileceğini belirtmişlerdir (48). Akut kızamık enfeksiyon seyrini, Ebstein-barr virüs, Parainfluenza gibi viral enfeksiyonların eş zamanda geçirilmesi de etkilemektedir. MSS’de sitokin aracılı yanıt ile veya viral enfeksiyonun direkt etkisi ile çeşitli hücrelerde apoptoz gelişmekte bu da SSPE’deki oligodendroglia ve nöronal hücre ölümünün patogenezinde rol almaktadır (49). SSPE’deki klinik gidişattan nöron ve oligodendrogliaların lizis ve apoptoz ile kaybı olabilir. Bazı viral enfeksiyonlar antibcl-2’yi regüle ederek ya da bcl-2 benzeri viral proteinleri sentezleyerek intrasellüler dirençle konak hücre ölümünü engeller (50). Anlar ve ark.’nın yaptıkları çalışmada 19 SSPE hastasının beyin biyopsisinde bcl-2’yi ve apoptozda doku hasarına yol açan deoksiribonükleik asit (DNA) fragmanlarını göstermişler (49). Nöron kaybı olan dokuların nöronlarında ve oligodentroglialarda DNA parçaları bulunur. DNA parçaları reaktif astrositozlarda bulunsa da güçlü bcl-2 ekspresyonu bulunmuştur. Sitokinlerin ve serbest radikallerin yaptığı enflamasyondan sonra da apoptoz görülebilir. Öte yandan reaktif astrositlerde apoptozun olmaması bcl-2 varlığı nedeni ile olabilir (48-50).
Kızamık virüsünün insanlarda hücreye tutunması ve hücre içine girmesini sağlayarak viral büyümeyi sağlayan etkenler: CD46 (membran kofaktör protein) ve CD150 (diğer ismiyle SLAM: ‘signaling lymphocyte activation molecule’)’dir (51). CD46, hücreyi
kompleman yıkımından korur ve bazı aşı suşları için hücresel almaçtır. Bu suşlarla enfekte olan hücreler CD46 almaçları azalarak hücre yıkımını azaltır fakat vahşi kızamık virüsü ile enfekte olunca bu gerçekleşmez ve hücre kompleman yıkımına duyarlı olur. Çoğu vahşi virüs SLAM molekülünü kullanmayı CD46 kullanmaya tercih eder (34). Virüsün nöron hücrelerine girip, MSS’de yayılım mekanizmaları, nöron hücrelerinde CD46 molekülünün sporadik olarak bulunması ve SLAM saptanmaması nedeni ile tam olarak açıklanamamıştır (51).
SSPE tanılı kişilerin beyin kesitlerinde, kızamık virüsü ile enfekte ve lezyonal bölgelerde CD46 saptanmazken, kızamık virüsü içermeyen ve lezyondan uzak bölgelerde CD46 normal beyindeki dağılım gibi saptanmıştır. SSPE’de sadece enflamatuar bölgelerdeki lökositlerde SLAM saptanmış, kızamık virüsü ile enfekte hiçbir hücre grubunda SLAM bulunmamıştır ki normal beyin dokusunda da SLAM saptanmaz (52). Kızamık enfeksiyonu patogenezini, CD46’yı almaç olarak kullanan vahşi virüs tipleri yanında CD46 kullanmayan virüslerin kullanacağı almaç varlığı ile açıklanabileceği belirtilmiştir (53,54). Kızamık virüsünün hücre içine girmesinden sonra, bazı hücre yüzey molekülleri ile etkileşir.Henüz bu moleküller net olarak bulunamamıştır. Bu moleküllerin kızamık virüs glikoproteini ile etkileşerek kompleks yaptığı ve bu kompleks oluşumu sonrasında sinyal gönderen moleküller şekline döndüğü, bu moleküllerinde hücrenin yaşaması, çoğalması ve kendi işlevlerini sürdürebilmesinde rol oynadığı düşünülebilir (54).
SSPE hastaların beyin atrofileri ile uyumlu şekilde BOS’da anti-CD9 (tetraspanin ailesinin bir üyesi) antikor düzeyi yüksek bulunmuş ve nörolojik hastalıkların bazılarında da yüksek saptanmasına karşılık en yüksek değere SSPE hastalarında rastlanmıştır (55).
Bir çalışmada, SSPE hastalarında lenfosit alt grupları, hücreiçi tümör nekrozis faktör alfa (TNF-alfa) ve kanda interlökin-4 (IL-4) seviyeleri değerlendirilmiş ve aynı yaştaki kontrol grubuna göre CD8+ düzeyleri yüksek saptanmış ve klinik seyirde hızlı ilerlemenin artan CD+ düzeyi ile ilişkili olabileceği saptanmış (56). Hastalık patogenezinde lenfosit alt gruplarındaki değişikliğin yeri yoksa SSPE hastalığının kliniğinde rol alabileceği belirtilmiştir (56).
Anti-enflamatuar sitokin olan IL-1 antagonisti düzeyine ve hücre hasar ve yıkımında önemli yere sahip olan IL-1 beta düzeylerine, SSPE hastalarının BOS’unda bakılmış ve düzeylerinin yükselmediği görülmüştür. Bu durum tedavi düzeyinde değerlendirilmiş ve
IL-1antagonist düzeyinin sadece intraventriküler IFN-alfa tedavisinden etkilendiği saptanmıştır (57).
MSS’nin kronik enfeksiyonlarında BOS’da saptanan oligoklonal bantlar ve IgG düzeyindeki artış, enfeksiyon etkenine karşı oluşan antikorlardan kaynaklanmaktadır (58). Bu şekilde oligoklonal patern SSPE hastalarının BOS’unda da saptanmıştır (2). Bir SSPE hastasının beyninden CD38+ plazma hücreleri elde edilmiş, her hücre tarafından ‘tek hücre RT-PCR’yöntemi ile üretilen IgG hafif ve ağır zincirleri saptanmış, yüksek düzeyde üretilen IgG’lere dayanarak üretilen işlevsel rekombinant antikorların özellikleri saptanmış; sekiz rekombinant antikor saptanmış kızamık virüsünü bu antikorların beşinin tanıdığı saptanmıştır. Böylece, nedeni bilinmeyen enflamatuar MSS hastalıklarında, hastalıkla ilişkili antijenleri tanımada bu yöntemin yararlı olabileceği belirtilmiştir (59).
SSPE hastaların viral serolojileri BOS’larında bakılmış, herpes simpleks virüs tip 1 IgG ve sitomegalovirüs DNA düzeyleri kontrollere kıyasla yüksek saptanmıştır. Bu da, MSS’ye bazı virüs girişlerini ve enflamasyon ile antikor sentezinin artabileceğini gösterebilir (60).
Bir çalışmada 21 SSPE hastasında serum retinol düzeylerine bakılmış ve kontrol grubuna göre düşük saptanmıştır (61).
Erken dönem SSPE hastalarından alınan beyin biyopsisinde, beyin parankiminin beyaz cevherinde, meninkslerde, kortikal ve subkortikal gri cevherde hafif enflamasyon gösterilmiştir. Genellikle plazma hücresi ve lenfosit infiltrasyonu, nöronal dejenerasyon, astrosit proliferasyonu, gliozis, perivasküler hücre birikimi ve demiyelinizasyon bulunmaktadır. SSPE hastalarında bulunan demiyelinizasyondan oligodentrositlerin viral enfeksiyonu sorumlu olabilir (35). Makroskobik değerlendirme sonraki evrelerde yapıldığında hafiften orta dereceye kadar serebral kortekste atrofi görülebilir. Kortikal yapılarda disorganizasyon ve nöronlarda dejenerasyon mikroskopik inceleme ile görülebilir. Beynin pariyeto-oksipital bölgesi en sık etkilenen bölüm olup bunu serebral hemisferlerin anterior bölgesi, subkortikal yapılar, beyin sapı ve spinal kord takip etmektedir (62). Hashimoto ve ark. bir SSPE hastasını 20 yıl takip etmişler ve lezyonun rostro-kaudal yönden beyin sapına doğru ilerlediğini görmüşler (63). Meninkslerde ve beyin parankiminde lenfosit, fagosit ve plazma hücrelerinin fokal yâda diffüz perivasküler infiltrasyonu görülür. Nöron ve glial hücrelerin nükleus ve sitoplazmasında inklüzyon cisimcikleri bulunur. Homojen eozinofilik Cowdry A inklüzyon cisimcikleri hızlı ilerleyen ve fatal hastalığı olan
hastaların nöronlarında ve oligodendroglialarında diffüz olarak görülür. Cowdry B inklüzyon cisimcikleri küçük yapıda ve çok sayıda olup beyin sapında bulunur. Viral antijenleri içeren viral partiküllerin bu inklüzyon cisimcikleri ile uyumlu olduğu sonraki çalışmalarda gösterilmiştir (49,50,64-66). Yumakları içeren hücrelerin viral genom içerdikleri in situ hibridizasyon yöntemi ile gösterilmiştir. Buna dayanarak da viral enfeksiyonun yumak formasyonuna neden olduğu düşünülmektedir (64,66). SSPE’in geç döneminde enflamatuvar alanı ve inklüzyon cisimciklerini bulmak zor olabilir. Parankim nekrozu ve gliozis şeklinde histopatolojik değişiklikler kendini gösterir (64). SSPE’li hastalarda yapılan serebral dokudaki infiltratif hücre infiltrasyonuna yönelik çalışmalarda, B hücrelerinin parankim infiltrasyonlarında, CD4+ T hücrelerinin ise perivasküler bölgede bulunduğu belirlenmiştir (67). İnfiltre olan hücreler zaman içinde değişebilir. Anlar ve ark.’nın yaptıkları bir çalışmada, hızlı progresyon gösteren hastalarda CD4+ olduğunu göstermişlerdir (56). Yavaş progresyon gösteren SSPE hastalarında B lenfositlerin baskın olduğu tespit edilmişken akut kızamık ensefalitinde ise T lenfosit baskınlığı tespit edilmiştir (68). Hofman ve ark.’nın yaptıkları çalışmalarda, CD4+ baskınlığını 6 SSPE hastasında, Nagano ve ark. ise CD4+ veya CD8+ve CD4+ hücre baskınlığını 3 SSPE vakasında bildirmişlerdir (67,69). Farklı bulunan bu verilerin hasta seçiminden, çevresel faktörlerden, genetik faktörlerden ve tedavi şeklinden kaynaklanabileceği düşünülmektedir (56). Anlar ve ark. çalışmada 2 SSPE hastasında ki bu hastalar tedavi alan stabil hastalar olmalarına rağmen, CD19+ düzeyini düşük saptamışlar ve antikor sentezi ile klinik gidişin paralel olmadığını saptamışlardır (56). Çalışmalarının bazılarında astrosit ve mikrogliada en sık antijen pozitifliği saptanırken, bazılarında da oligodendroglia ve nöron da tespit edilmiştir. Bu farklılıkta büyük ihtimalle aşırı viral yükle ya da hastalığın farklı evrelerinden dolayı hızlı ilerleyen hastalıktan kaynaklanmaktadır. SSPE’de enflamasyon derecesi ile kızamık antijeninin hücresel dağılımı arasında ilişki yoktur. Viral antijen ve RNA kronik SSPE hastalarında birlikte bulunmayabilir. Viral antijen veya genomun biyopsi örneklerinde saptanmamasının SSPE hastalığının dışlamadığını göstermektedir (35,68).
2.2. Klinik Bulgular
SSPE, 6-8 yıllık sessiz dönem sonrası ilerleyici nörolojik bulgularla karşımıza gelen genelde çocukluk dönemi hastalığı olarak görülmektedir (2). Sıklıkla 5-15 (4-52) yaş arası görülmektedir (19,20). Genellikle sinsi başlangıçlıdır. Genelde orta derecede entellektüel
kötüleşme ve davranış değişiklikleri görülür. Başlangıç döneminde nörolojik bulgular genellikle eşlik etmez. Davranış değişiklikleri dikkat çekmeyebilir. Okul başarındaki düşme ile beraber ebeveynler ve öğretmenler mental gerilemeyi anlayabilirlerse de sıklıkla bu dönem gözden kaçabilmektedir (3). Hastalık spesifik olmayan myoklonik nöbetlerle de karşımıza gelebilir. Myoklonik nöbetler başta başlar daha sonra gövde ve ekstremitelerde meydana gelir. Myoklonik nöbetler heyecan durumunda artarken, uyku döneminde kaybolur. Myokloniler yürümede zorlanma, periyodik baş düşmeleri veya düşme şeklinde olabilir. Hastalığın erken döneminde myoklonuslar belirgin olmayabilir, ancak hasta ayakta durup, kollarını öne uzattığında meydana gelebilir bunu baş, boyun, gövde ve kolların periyodik düşmeleri izleyebilir. Yavaş göz kırpmaları ve yüz kaslarının kasılmaları bu nöbetlere genellikle eşlik eder. Piramidal ve ekstrapiramidal bulgular genellikle hastalarda sıklıkla gelişir. Ataksi, distoni ve diskinezi az sayıda hastada görülebilir. Jeneralize tonik klonik nöbetler ve parsiyel nöbetler de oluşabilir (3,12,70). SSPE nadiren çocuklarda akut ensefalopati ve yetişkinlerde kronik ilerleyici hastalık gibi seyredebilir. SSPE ile ayırıcı tanıda beyaz cevher patolojilerini içeren multiple skleroz düşünülmelidir (71). Hastaların %10- 50’sinde koryoretinit, optik atrofi ve kortikal körlük rapor edilmiştir. Nörolojik belirtilerle aynı zamanda genellikle görme semptomları da görülür fakat nörolojik belirtiler görülmeden birkaç yıl önce de görülebilir (72,73). Koryoretinitli bir hastada Park ve ark. kızamık virüsü ile uyumlu görünüm gösteren birçok filamentöz, mikrotübüler ve intranükleer viral inklüzyonları retinanın nükleer tabakasında göstermişlerdir (74). Görme kaybı ile başvuran ve optik atrofisi ve maküler dejeneratif lezyonu olup, SSPE tanısı alan bir vakayı Berker ve ark. bildirmişlerdir (75). Maküler retinit bulgusu olan 14 ve 17 yaşında iki erkek hasta, SSPE tanısı almış ve Serdaroğlu ve ark. tarafından bildirilmiştir (76). Klasik nörolojik bulguları görülmeden de Optik atrofi ile birlikte maküler değişiklikleri olan yâda sadece maküler retiniti olan hastalar bile SSPE yönünden incelenmeli, nörolojik bulgular görülmeden tanı konmalı ve tedaviye en kısa sürede başlanmalıdır. Hastalığın ileri dönemlerinde myokloniler azalabilir hatta kaybolabilir ancak tetraparezi gelişip spastisite meydana gelir (77). Otonomik disfonksiyon da hastalarda görülebilir. Barsak ve mesane disfonksiyonu, aşırı terleme gibi termoregülasyon bozuklukları hastalığın ilerlemesi ile görülebilir (78). Belirgin ısı dalgalanmaları termoregülasyon kaybı ile olan otonomik bozukluktan kaynaklanır. Duyusal bozukluğun ilerleyici olması nedeni ile hasta bitkisel hayata girer. Deserebre ve dekortike rijidite meydana gelir ve düzensiz nefes alıp vermeler başlar. Hastalar sıklıkla hiperpreksi, kardiovasküler kollaps ya da hipotalamik bozukluğa bağlı kaybedilir (78,79). SSPE ailesel olarak nadir görülür. SSPE olan iki kardeşi Tuxhorn
ve ark. ailesel SSPE vakası olarak bildirmişlerdir. Bu da bazı ailelerde kızamık virüsünün persistansını sağlayan spesifik virüs bağlanma reseptörü alt tipi olabileceğini düşündürmektedir (80).
SSPE’li hastalar çoğu 1-3 yıl arasında olmak üzere ortalama 18 ay yaşam süresi gösterir (81-83). Klinik bulgular %10 SSPE hastasında tipik değildir. Kliniği akut yâda fulminan giden vakalar da vardır (84-86). Akut fulminan SSPE hastalığı tanı konulduktan 3 ay sonra ölüme yol açabilmekte hatta 4 hafta içinde kaybedilen hastalar mevcuttur. Hastaların yaklaşık %10’unda fulminan seyir görüldüğünü Risk ve Haddad yaptıkları çalışmada belirtmişlerdir (79). Akut fulminan SSPE hastalığının mekanizması tam olarak bilinmemektedir. Ancak hızlı ilerleyen hastalıktan sorumlu mekanizmalar, kızamık virüs enfeksiyonunun erken yaşta geçirilmesi, diğer viral etkenlerin eş zamanlı olarak geçirilmesi, konak immünitesinin yetersiz olması ve virüsün virülansını yüksek olması olarak düşünülmektedir. Üç yaşında akut fulminan SSPE hastalığı tanısı alan bir erkek çocuğu Imai ve ark. bildirmişlerdir. Uyuklama ve sol hemipleji ile başvuran hasta 4 ay sonra çok odaklı serebral kanama nedeni ile öldüğü belirtildi (87). Yetişkin dönemde SSPE tanısı alan hastalarda spontan remisyon oranı çocuklara oranla daha yüksekken, yetişkinlerde de ilerleyici ve ölümcül klinik seyre sahiptir (20). Yetişkin dönemde tanı alan SSPE hastalarında parsiyel spontan remisyon oranı %27 olarak literatürlerde belirtilmektedir (88).
SSPE tanısı alan hastalar 1969 yılından beridir klinik olarak evrelendirilerek takip edilmektedir. Jabbour ilk evrelendirmeyi 1969 yılında yapmış ve klinik özelliklerine göre dört klinik evre tanımlamıştır (Tablo 1).
Tablo 1. Jabbour ve Gascon klinik evrelemesi (89)
Evre 1a Davranış, bilişsel, kişilik değişikliği (dikkat bozukluğu/hiperaktivite, okul performansında düşüş, sosyal uyumsuzluk). Yürümede güçlük yoktur.
Evre 1b Periyodik olmayan myoklonik kasılma. Evre 1A’dakine benzer mental/davranışsal semptomlar. Bağımsız yürüme bozulmamıştır.
Evre 2a Mental yıkımda artış, myoklonik kasılma. Myoklonik spazmlar periyodik, jeneralize ve senkron, sık sık düşmeler nedeni ile bağımsız yürümeyi beceremezler.
Evre 2b Apraksi, agnozi, konuşma güçlüğü; spastisite, ataksi gibi motor bulgular. Ambulasyon yardımla sağlanır.
Evre 3a Konuşmada azalma, görme problemleri, myoklonik kasılmalarda sıklaşma (multifokal, spazm araları kısa (3-5 saniye), süreleri uzundur (3-4 saniye)), konvülziyon. Bağımsız olarak oturur, ayakta durabilir ancak bağımsız yürüyemez.
Evre 3b Spontan konuşmada kayıp, körlük, yatağa bağımlılık, disfaji, elektroansefalogramda (EEG) yaygın yavaşlama; kore ve ballismus gibi anormal hareketler
Evre 4 Myoklonik kasılmaların ve EEG’deki periyodik komplekslerin kaybolması
İlerleyen yıllarda çeşitli evreleme sistemleri ortaya konmuşsa da SSPE hastalığı üç yâda dört evrede izlenmiştir. Bu evreler ve özellikleri:
Evre 1: Bulgular çok hafiftir. Ailenin ya da hastanın öğretmeninin fark ettiği çok belirgin olmayabilen kişilik değişiklikleri mevcuttur. Bu değişiklikler; içe kapanma, huzursuzluk, okul başarısında düşme, sinirlilik veya saldırganlık gibi önceden var olmayan değişikliklerdir. Nörolojik bozukluk belirgin değildir. Başlangıç atipik bulgularla da olabilir. Hastalar optik atrofi, papil ödem, koryoretinit, kortikal körlük, kafa içi basınç artışı, subakut koma ya da koma gibi SSPE’nin başlangıç bulguları olmayan bulgularla da gelebilirler (1,90,91). Bu evrede hücre işlevi bozulmuştur, hücre kaybı yoktur. İrritasyon ve enflamasyon beyindeki gri madde hücrelerinde meydana gelmektedir. Görüntülemede bulgu
yoktur. EEG sonucu normal ya da özgül olmayan bulgularla sonuçlanmaktadır (1). Dyken 1985 yılında yaptığı bir çalışmaya göre nörolojik işlev kaybını Evre-1’de %1-33 arasında saptamıştır (92).
Evre 2: Tipik stereotipik myoklonilerin görüldüğü ve SSPE tanısının kolaylıkla konduğu evredir. Baş düşmesi ile başlayan myoklonileri tüm vücuda yayılan myokloniler izler. Bu dönemde bilinç açıktır. Bilişsel işlevlerde kötüleşme devam eder. Jeneralize veya fokal epileptik nöbetler de görülebilir. Beyin dokusunda hasarlanmanın ilerlemesi nedeni ile bu evrenin sonunda myoklonilerin yoğunluğu azalabilir (1,90,91). Masif myoklonusların ortaya çıkma nedeni, bazal ganglionları içine alan motor sistemin etkilenmesidir. Myoklonus, geçici elektrik deşarjlarıdır. Bu deşarjlar büyük nöron gruplarında aynı anda oluşur ve irritasyona bağlıdır. Motor sistemin yaygın hasarına bağlı olarak bu evrenin sonunda myoklonuslar kaybolmaya başlar (1). 1985 yılında Pampiglione ve Harden tarafından tanımlanan ve SSPE hastalığı için tanısal olan EEG bulgusu Evre 2’e aittir (1,93).
Evre 3: En tipik özelliği ekstrapiramidal bulguların ortaya çıkmasıdır. Bu evrede idrar ve gaita inkontinansı başlayabildiği ve hastaların yatağa bağımlı olmaya başlayabilmekteler. Bazal ganglion tutulumunu gösteren distoni, maske yüz, tortikollis ve kurşun boru sertliği gibi bulgular olabilmektedir (1,91). Bazal ganglionlar tamamen hasarlandığından myoklonuslar tamamen kaybolur. Beyin sapındaki motor sistemler etkilenmeye başlar. Demans orta-ciddi derecede görülür (1).
Evre 4: Koma halinin olduğu vejetatif evredir. Alt nöroanatomik bölgeler etkilenmeye başlar. Yatağa tam bağımlılık gelişmiştir. Kalp fonksiyonlarında bozukluklar, vücut ısısı otoregülasyonunda bozulma, hipertermi ve hipotermi görülür. Otonom sinir sisteminde de bozulmalar mevcuttur. Dekortike ve deserebre rijitide gelişir. Bu evrenin sonunda ölüm kaçınılmazdır (1,90). Semptomlara dayanılarak SSPE seyri Risk ve Haddad tarafından düzenlenmiştir (Tablo 2).
Anlar ve ark. Türkiye’de 80 SSPE hastasını değerlendirmiş ve %56,2 oranla myoklonusu en sık bulgu olarak saptamışlar (91). Myoklonusa entelektüel bozulma da eşlik edebilmektedir. %56,2 hastanın %70’inde bilgisayarlı beyin tomografi (BBT) normal, %17’sinde beyin atrofisi saptanmıştır (94).
Sıklıkla SSPE hastalarında myoklonik nöbetlerin görülmesine karşın nadiren de atonik, tonik veya tonik klonik nöbetler görülebilmektedir (95).
Tablo 2. Risk ve Haddad tarafından düzenlenen klinik evreleme (79).
Evre 1 Psikoentellektüel değişiklikler ve/veya nonspesifik nörolojik semptomlar Evre 2
2a 2b 2c
Stereotipik ataklar ile olan miyokloniler Düşme atakları yok
Düşme atakları ile Yatağa bağımlı Evre 3 3a 3b 3c Yatağa bağımlı
Amaçsız istemsiz hareketler Ağrılı uyaranla istemsiz hareketler Derin koma, ölüm
Nadiren SSPE hastalık doğuştan kızamık enfeksiyonu sonrası görülebilmektedir (96). Myoklonik nöbet ve geçici görme kaybı bulunan 14 yaşındaki bir erkek hastada, BOS incelemesinde kızamık antikorlarının negatif olduğu, çekilen EEG’de periyodik kompleks saptanmamış ancak beyin biyopsisinde histolojik ve moleküler inceleme sonrası SSPE tanısı kesinleşmiştir (97). SSPE’nin sık görülmediği bölgelerde ensefalit ile karışabileceği, pseudotümör serebri tablosu ile de bulgu verebileceği bilinmelidir (98,99). Mental bulgular ortaya çıkmadan önce EEG bulgusu ile SSPE tanısı konan bir hasta da bildirilmiştir (94).
Hastaların %10-50’sinde görme ile ilgili bulgular tespit edilmiştir. Bu bulgular koriyoretinit, optik atrofi, kortikal körlük, papillit ve papil ödem görülebilir. Nörolojik bulgular görülmeden yıllar önce görme bulguları görülebilir (2,76). Hastalarda görme kaybı MSS ile ilişkili bulgular olmadan önce de oluşabilir (100). Nörolojik bozulma indeksi Tablo 3’te gösterilmiştir (101,102).
2.3. Tanı
SSPE ilk evresinde şikâyetlerle beraber hastalığı hatırlamak çok önemlidir çünkü SSPE’nin erken evrelerinde meydana gelen davranış değişiklikleri yakınları tarafından yanlış yorumlanmakta ve sıklıkla psikiyatriste başvurmaktadırlar. Bununla beraber myoklonus
varlığında klinik tanı kolaydı. Tüm hastalarda myoklonus görülmeyebilir. Atoni olmayabilir veya gözden kaçabilir (103). SSPE hastalığının klinik tablosu diğer nörodejeneratif hastalıklardan ayırtedilmelidir. Çok nadir olmakla birlikte, parsiyel nöbetleri olan, lateralize nörolojik bulguları yâda papil ödem bulunan SSPE hastalarının az bir kısmı intrakranial yer kaplayan lezyon şeklinde yanlış tanı alabilmekte (14). Atipik SSPE tanısı son yıllarda daha sık koyulmaktadır. Bazen EEG’de karakteristik yavaşlama görülmeyebilir. MSS’nin enflamatuvar hastalıkları ile SSPE’nin ayırımında SSPE’nin açık progresyonunun ve tipik EEG bulgularının gözlenmemesi tanıyı zorlaştırır.
Tablo 3. Nörolojik bozulma indeksi (neurologic disability index=NDI) (101,102) 1- Davranış/zekâ: irritabilite, kişilik, içe kapanma, zekâ ve yüksek kortikal işlevler 2- Myokloni/nöbet: görüldüğü bölge, süresi, sıklığı, büyük nöbet varlığı,
eşzamanlılık, ataksi, fokal nöbet
3- Motor/duyusal: refleksler ve tonus, kuvvet ve kas hacmi, anormal duruş ve ‘’enkoordinasyon’’, hareketler, duyusal değişiklikler
4- Vejetatif/sistemik: görme işitme, konuşma, otonomik sistem, beslenme durumu, yeme-yutma bozukluğu
Yorum: Anormallik yoksa 0, belirgin anormallik varsa 4 puan verilir. Toplam 80 puan üzerinden yüzde hesaplanır. Yüksek puan daha fazla bozulmayı gösterir.
SSPE hastalığının tanısı anamnez, fizik muayene, klinik, serum ve BOS’da kızamık antikor titresinin yükselmesi, karakteristik EEG paterni ve beyin biyopsisinde panensefalitin gösterilmesi ile konur (104).
Tablo 4. Dyken’e göre SSPE tanı kriterleri Klinik
EEG BOS
Kızamık antikorları Beyin biyopsisi
İlerleyici, subakut mental kötüleşme ile myoklonus benzeri tipik bulguları
Periyodik, stereotip, yüksek voltajlı deşarjlar Oligoklonal pattern veya gamaglobulin yüksekliği
Serumda yüksek titre (> 1:256) ve/veya BOS’da ( > 1:4) panensefalitin gösterilmesi
*5 kriterden 3’ünün sağlanması tanı koydurur.
Dyken’e göre tanı kriterlerinden üçü karşılanırsa SSPE tanısı konulur (Tablo 4) (104). 2.3.1.Beyin Omurilik Sıvısı (BOS)
BOS SSPE hastalarında incelenmiş ve genellikle normal olarak saptanmıştır. Ancak bazen lenfositlerin hâkim olduğu hafif pleositoz, normal glukoz değerine ek olarak normal yâda hafifçe artmış protein düzeyi saptanabilir. Gama-globulin total proteinin %20’sini oluşturup BOS’ta artan proteinden sorumludur. BOS’daki IgG artışı nedeniyle normal çocuklardaki 5-10 mcgr/dl olan BOS IgG SSPE hastalarında 5-10-54 mcgr/dl’e çıkar (5-105,5-106). BOS’da gamaglobülinlerin artmış seviyesi çoğu hastada MSS’de oluşan enflamatuvar süreci yâda enfeksiyon varlığını gösterir. BOS izoelektrik odaklanma yâda agora jel elektroforez ile incelendiğinde oligoklonal bant sıklıkla görülür. Oligoklonal bant, MSS’de plazma hücrelerine dönen B hücre serisini göstermekte olup, sınırlı tipte gamaglobülin üretimi anlamına gelmektedir (107). BOS’da saptanan IgG’nin çoğu kızamık virüsüne karşı gelişmektedir ve kızamık virüs aracılığı ile oligoklonal bantlar adsorbe edilebilmektedir (108). Kızamık virüsüne karşı gelişen antikor titrelerinin BOS’da artışı SSPE tanısını koydurur. Serumda kızamık antikor titresinin 1/256, BOS’da 1/4 veya daha fazla olması SSPE tanısı koydurur. BOS’da kızamık antikor titresi / serum da kızamık antikor titresinin oranı 200’ün altındadır. Normalde bu oran 200-500 olarak saptanır. Bu oranının normal olması, diğer viral antikorların ve albümin değerinin normal olması, kan beyin bariyerinin normal olduğunu gösterir. MSS içerisinde kızamık antikoru düzeyinin artmasında artan sentez sorumlu tutulmaktadır (109,110). Kompleman fiksasyon metodu, virüs nötralizasyonu, hemaglütinasyon inhibisyonu ve Enzyme Linked Immunosorbent Assay (ELİSA) kullanılan diğer serolojik yöntemlerdir. Kızamık virüsüne spesifik IgM’e olduğu kadar IgG’nin tespitinde de önemli yere sahiptir ELİSA ve duyarlılığı yüksektir (111). Kızamık virüsü genomunun BOS’da tespiti ile SSPE’nin tanısı doğrulanabilir. PCR ile kızamık virüs RNA’sı tespit edilebilir (3).
BOS’da kızamık antikorlarında artış saptanmadığı durumlarda lomber ponksiyon 2-3 hafta sonra tekrarlanmalıdır (90). Olası dalgalanmalara bağlı olarak SSPE hastalarının %40’ında kızamık antikorlar BOS’da düşük saptanabilir (90,91)
2.3.2.Elektroensefalografi (EEG)
SSPE başlangıç döneminde EEG normal saptanabilir veya orta derecede nonspesifik yavaşlama dışında anormallik görülmeyebilir (3,90). Klinik bulgular başlamadan, anormal EEG bulguları bildirimi çok az vakada vardır (91,112,113). Radermecker tarafından 1949 yılında EEG’deki karakteristik periyodik kompleksler gösterilmiştir. Gaches tarafından 1971 yılında ayrıntılandırılmıştır. Tipik klinik bulgu myoklonustur ve myoklonik fazda tipik EEG
bulgusu görülür. Bu EEG bulgusu tanısaldır. Başlangıçta EEG’de tespit edilen yüksek amplitüdlü, bifazik ya da trifazik özellik gösteren diken veya yavaş dalga boşalımları, normal zemin ritmi ile karşımıza çıkar. Zaman içerisinde zemin aktivite bozulur ve myoklonik deşarjların belirginliği azalır (101). SSPE hastalarında tipik EEG bulgusu, bilateral, simetrik, senkronize, yüksek voltajlı (200-500mV) polifazik, stereotipik delta dalgaları içeren periyodik komplekslerle karakterizedir ki bu periyodik kompleksler 3-10 saniye aralıklarla tekrar eder ve myoklonik atılmalarla birebir ilişkilidir (Şekil-1) (2,114).
Atipik EEG bulguları da tespit edilmektedir. Keskin ve yavaş dalga deşarjlarının 4-7 sn gibi uzun süreli izlemi sonrasında da 1-4 sn süresi kadar baskılanan; her 2 saniyede bir ortaya çıkan 4-5 keskin dalgadan oluşan periyodik kompleksler, diken dalga ve yavaş diken dalgaları, frontal ritmik delta aktivitesi, frontal bölgede fokal diken ve yavaş diken dalgaları, periyodik jeneralize hızlı burst dalgalar, pre-semptomatik dönemde multifokal paroksismal yüksek amplitüdlü yavaş dalgalar uykuda kayıt sırasında geçici anormal alfa dalgaları, periyodik kompleksleri takiben yüksek amplitüdlü jeneralize ritmik keskin dalgalar, periyodik kompleksler öncesinde bisenkronize oksipital diken dalgalar her 2 saniyede bir 4 veya 5 keskin dalga içeren periyodik kompleksler tarzında atipik bulgular da birçok vakada bildirilmiştir (115-119). Atipik EEG bulguları daha çok hızlı ilerleyen akut klinik tablo ve daha uzun hastalık sürecinde daha sık görülmektedir (115). Çeşitli hipotezler gündeme gelsede periyodik komplekslerin kaynağı halen de bilinmemektedir. Birinci hipotez, nöronlarda anormal eksitabilite oluşması, hipersenkronizasyonun patolojik olması ve periyodik tetikleme, ikinci hipotez beyin sapı yapılarının “pacemaker” gibi davranması, üçüncü hipotez ise serebrumun talamusa komşu subkortikal kısmından kaynaklanmış olabileceğidir (115). SSPE’nin ileri evrelerinde periyodik kompleksler arasındaki süre giderek kısalır (3). Myoklonus oluşmadan çekilen EEG’de periyodik kompleksler öncelikle uykuda tespit edilir. Bu kompleksler uyanık ve standart EEG çekimi sırasında intravenöz diazepam verilmesi ile belirginleşebilir. Hastalığın ileri evrelerinde EEG’de yüksek amplitüdlü ve rastgele yavaşlamalar tespit edilir ki bu genellikle organizasyon bozukluğuna bağlanır. SSPE’nin terminal döneminde dalgaların amplitüdü düşebilir, kaybolabilir ve zamanla dalgalar görülebilir (3,116). Terminal dönemde konvülziyonlar kaybolabilir (120). Aydın ve ark. EEG’de diazepama yanıt vermeyen non-konvülsif status epileptikus tablosunda olan ve fenitoin verildikten sonra tipik periyodik komplekslerin EEG’de tespit edildiği bir vakayı bildirmişlerdir (121). Hastada sekonder generalize non-konvülsif status epileptikusun varlığı diazepama yanıt vermeyişinin nedeni olabilir. Kızamığın endemik
olduğu ve SSPE’nin yaygın görüldüğü yerlerde sekonder non- konvülsif status epileptikusun ayırıcı tanısında SSPE mutlaka düşünülmelidir (121).
Periyodik kompleksleri Yaqub ve ark. 3 tipe ayırmıştır. Tip I’de periyodik kompleksler dev delta dalgaları ile karakterizedir. Tip II’de hızlı diken dalgalarının araya girdiği periyodik dev delta dalgaları görülmektedir. EEG zemini periyodik komplekslerin bu patterninde genelde yavaştır. Tip III de ise uzun diken dalga deşarjları arasına dev delta dalgalarının girdiği periyodik kompleksler görülmektedir. Yaqub video-split EEG monitorizasyonunun atoni veya myoklonus gibi zamanla ilişkili EEG periyodik komplekslerini göstermede daha duyarlı olduğunu tespit etmiştir. Ayrıca tip II periyodik kompleksin daha iyi prognoz ile ve tip III’ün kötü prognozla ilişkili olduğunu göstermiştir (14).
Şekil 1. SSPE’nin tipik EEG bulgusu (1)
2.3.3. Görüntüleme Yöntemleri
Görüntülemenin yeri SSPE hastalığı tanısında sınırlıdır. Ayırıcı tanı ve hastalığın gidişatı hakkında bilgi vermesi açısından görüntüleme yöntemleri önemlidir. Günümüzde en duyarlı görüntüleme yöntemi MRG’dir. Periventriküler ve subkortikal beyaz cevher lezyonların SSPE hastalarında en sık görüldüğü alanlardır. Daha az sıklıkla korteks, bazal ganglion, serebellum, spinal kord ve korpus kallosum tutulumu görülmektedir. Hastalığın klinik evresi ile görüntülemelerde tespit edilen bulgular arasında genellikle korelasyon sağlanamamıştır (122).
2.3.3.1. Bilgisayarlı Beyin Tomografi
BBT hastalığın erken döneminde genellikle normal saptanır. Diffüz serebral ödeme bağlı hastalığın ilerleyen dönemlerinde interhemisferik fissür ve hemisferik sulkuslar kapanır ve ventriküller küçülmüş olarak görülür. Jeneralize veya fokal serebral atrofiye bağlı olarak ventriküler dilatasyon hastalığın geç dönemlerinde görülebilir, fakat nadiren de olsa hastalığın başlangıcından yıllar sonra dahi BBT normal olabilir. Bazal ganglion ve kortekste hipodens alanlarda BBT’de bildirilmiştir (83). Anlar BBT’nin %70’inin, Öztürk ve ark. ise %50’sinin normal olduğunu saptamışlardır (4,91).
2.3.3.2. Manyetik Rezonans Görüntüleme
Beyaz cevherdeki anormallikleri saptamada MRG BBT’ye göre daha duyarlıdır. Erken evre SSPE’de T2 ağırlıklı kesitlerde sınırları tam belli olmayan hiperintens beyaz cevher lezyonları sıklıkla tespit edilmektedir. Bu alanlar oksipital subkortikal beyaz cevherde frontal bölgeden daha sık görülür (3). Beyin sapı ve serebellum lezyonları nadirdir (122,123). Gri madde tutulumu ileri klinik ve MRG evrelerinde dahi hastaların çoğunda korunmuştur. Erken lezyonlar genellikle subkortikal beyaz cevher ve gri maddede saptanmıştır. Bu lezyonlar ağırlıklı olarak serebral hemisferlerin arka bölümlerini tutmuş olup asimetriktir. Daha ileri dönemde beyaz cevherde yüksek sinyal değişikliklerinin
derinleştiği ve serebral atrofinin ilerlediği gözlenmiştir (3,112). Lezyonlarda kontrast tutulum olması ve kitle etkisi SSPE hastalığında beklenen bulgu olmamasına rağmen, bazı araştırmacılar hastalığın erken dönemindeki birkaç hastada hafif kitle etkisi ve kontrast tutulumu rapor etmişlerdir (122). Çalışmalarında Ohya ve ark. ilk evrede kortikal tutulumu subkortikal beyaz cevher, beyin sapı ve spinal kord tutulumunun izlediğini bildirmişlerdir (64). Beyaz cevher değişiklikleri ve atrofi derecesine dayanarak Brismar ve ark. bir evreleme sistemi geliştirmişlerdir. Bu evreleme yöntemi hastalığın klinik bulguları ile korele olmamasına karşın hastalığın gidişatının takibinde faydalı olabilir (65). Kulcyzcki ve ark. yaptıkları çalışmada SSPE hastalarının takip sırasında çekilen BBT ve MRG serilerinde enflamasyonun oksipital beyaz cevherde başlayıp frontal beyaz cevhere yayıldığını tespit etmişlerdir (124). Yaptıkları çalışmada Hergüner ve ark. 16 hastada MRG’de yüksek sinyal yoğunluğunu en sık retrotrigonal beyaz cevherde saptamışlardır (125).
Aydın ve ark. yaptıkları çalışmada klinik durumda bozulmaya eşlik eden N-asetil aspartat (NAA)’da azalmanın nöron kaybını ve bozulmuş nöronal fonksiyonları gösterebileceğini proton magnetik rezonans spektroskopik görüntüleme (MRS) ile göstermişler ve semptomların süresi ile myoinositol konsantrasyonunun artması arasında ilişki saptamamışlardır (126). NAA H-MRS’de nöronal canlılığın işaretleyicisi sayılmaktadır. Klinik durum ile NAA düzeyinin H-MRS’de paralel olarak saptanması, SSPE hastalarının takibinde H-MRS’nin faydalı olacağını gösterebilir. Genelde MRS incelemelerinde NAA/kreatinin oranında azalma, miyoinositol/kreatinin oranında artış saptanmaktadır (126). Standart MRG ile birlikte difüzyon ağırlıklı görüntüleme erken evre SSPE’de beyin lezyonu gelişmiş olsa dahi lezyonun belirlenmesinde ve kesin tanıya gitmede yardımcı olabileceği için kullanılabilir (123). SSPE’li hastaların erken dönemde konvansiyonel MRG bulguları normal olabilir. Erken evrelerde dahi Kantitatif Diffüzyon Tensor MRG incelemesi beyaz cevherdeki değişiklikleri saptayabilir ve tedavinin planlanmasında faydalı olabilir (127). Yapılan bir çalışmada 20 SSPE hastasının MRS sonucu incelenmiş ve tüm hastalarda NAA düzeyi düşük, miyoinositol düzeyi yüksek saptanmış ve hastalığın klinik ağırlığı ile NAA ve miyoinozitol düzeyi bağlantılı bulunmuştur (126).
2.3.4. Beyin Biyopsisi
Beyin biyopsisi SSPE tanısı için artık nadiren gereklidir. SSPE hastalığının erken döneminde tanımlanan tipik histopatolojik bulgularını göstermede faydalı olacaktır beyin
biyopsisi. Revers transkripsiyon PCR ile SSPE vakalarında dondurulmuş ya da parafine gömdürülmüş beyin dokusu örneklerinden kızamık virüs RNA’sının değişik bölgeleri tespit edilmiştir. Kızamık virüs genomunu göstermede nükleik asit hibridizasyon teknikleri de kullanılmaktadır. Frozen kesit değerlendirmesi immünofloresan teknik ile yapılmakta ve kızamık virüs antijen varlığını göstermek amacı ile kullanılabilmektedir (3).
2.4. Tedavi
SSPE’nin kesin tedavisi bugün için yoktur. Farmakolojik tedavisi, antiviral ajanlar ve semptomatik tedavi şeklindedir. Hayatta kalma süresini uzattığı bildirilen, bazı antiviral ajanların uzun süreli verilmesi ile ve immünomodülatör ajanların kullanılması bazı randomize olmayan çalışmalarla gösterilmiştir. Tedavinin başarısı tartışılmalıdır. Bazı hastalarda uzun süre spontan remisyon sağlanmıştır (3,30). En çok kullanılan iki ilaç isoprinosine ve IFN’dir (1,2,101). Bunların dışında simetidin, amantadin, kortikosteroidler, intravenöz immunoglobulin, isoprinosin, ribavirin ilaçları da SSPE tedavisinde denenmiştir (2,90).
2.4.1. İsoprinosin
İsoprinosin antiviral ve immünomodülatör etkinliği olan bir ilaçtır. Etkinliği SSPE’de gösterilen ilk ilaçtır. İsoprinosin makrofaj ve lenfositlerin fonksiyonlarını düzenler. İmmün sistemi kızamık virüsüne karşı aktive eder. İsoprinosin immünomodulatör etkisi ilacın dozuna ve hastanın bağışıklık durumuna göre değişmektedir. “Natural killer” (NK) hücrelerin fonksiyonlarını ve CD4+ lenfositlerin sayısını arttırır. Oral yoldan 100 mg/kg /gün (maksimum doz 3gr/gün) 3-4 bölünmüş dozlarda kullanılır. IL-1 ve IL-2’nin üretimini IFN’ların fonksiyonlarını potansiyalize ederek arttırır (3,56,128). Hastaların stabilizasyon ve düzelme şansını arttırır. Remisyonu indüklediği hastaların %30’unda bildirilmektedir ve bu remisyonların uzun süre devam ettiği bilinmektedir (128).Ancak isoprinosinin hastalık seyrine etkinliği açısından çelişkili açıklamalar vardır. Bazı çalışmalarda SSPE hastalarında klinik seyirde iyileşme sağladığı ve sağ kalımı arttırdığı ortaya koyulmuşken, Anlar ve ark. SSPE’de prognozu etkilemediğini bildirmektedirler (129,130). SSPE hastalarında immün fonksiyonlarda bozulma ileri evrelerde artmakta buda isoprinosinin immünomodülatuvar etkisinin farklı olduğunu düşündürebilmektedir (131). Sıklıkla relapslar tedaviye rağmen görülmekte ve remisyona girdikten sonra dahi hastalara uzun süre isoprinosin kullanmaları önerilmelidir. İsoprinosin kullanımı ile ilgili elde edilen çelişkili sonuçlar tedavide
kullanımını tartışmalı kılmıştır (2). 15 SSPE hastası ile yapılan bir çalışmada tüm hastalara isoprinosin verilmiş ve izlemlerinde 10 hastada klinik düzelme gözlemlenmiş ve yan etkilerin gelişmediği bildirilmiş, düşük risk ve yarar oranı ele alındığında ilacın ömür boyu kullanılması gerektiği belirtilmiştir. Serum ürik asit düzeyleri isoprinosin hiperürisemi yaptığı ve böbrek taşlarına neden olduğu için kontrollerde bakılmalıdır (132). Hafif ve orta derecede gastrointestinal semptomlar isoprinosinin en sık yan etkisi olup ilacın dozu azaltıldığında birkaç gün içinde kaybolmaktadır (56,133). Yan etkilerinin az olması ve oral yoldan kullanılması nedeni ile ülkemizde de SSPE hastalığında ilk tercih ilaçtır.
2.4.2. İnterferon- alfa
BOS IFN düzeyleri SSPE hastalarında düşük saptanmıştır. SSPE’de relaps ve doğal remisyonların patofizyolojisi bilinmemekle birlikte virüsün replikasyonu ile vücudun immün yanıt arasındaki dengenin belirleyici olabileceği düşünülmektedir (3). İnterferon tedavide kullanıldığında viral replikasyonu baskılar ve hastanın immün sistemini güçlendirir. İntravenöz ve intratekal yoldan IFN kullanımı denenmiştir. Daha sonra Panich ve ark. intraventriküler ilaç kullanımını denemiş bunu da sağ lateral ventrikülün ön boynuzuna genel anestezi altındaki hastada kateter yerleştirerek, subkutan olarak yerleştirilen ommaya rezervuarı denen bir pompa yardımıyla ilaç vermişlerdir. Üç hastada iyileşme tespit edilmiş ancak bu üç hastanın ikisinde tedavi bittikten sonra relaps oluşmuştur (134). Tedavi rejimi 6 hafta sürmelidir. Tedavide önce 100.000 ünite/m2 verilmekte ve ardından haftada 5 gün
1.000.000 ünite/m2’ye çıkarılmaktadır. Bu tedavi süreci 2-6 aylık aralıklarla toplam 6 kez
tekrarlanmalıdır. İsoprinosin ve intraventriküler IFN-alfa tedavisinin beraber verildiğinde daha etkili olduğu bazı çalışmalarda bildirilmiştir (133,134). Gökçil ve ark. hastaların tamamı IFN-alfa alan bir grup ile isoprinosin alan ve almayan 53 hastanın tedavi ve takiplerini incelemişler ve 30 (%59) hastada iyileşme veya anlamlı stabilizasyon olduğunu gözlemlemişler (135). Anlar ve ark. intraventriküler IFN-alfa ve oral isoprinosin tedavilerini 22 hastaya vermişler ve hastaları uzun süre (3 ay ile 108 ay) takip etmişler ve IFN-alfa alan hastaların sağ kalım sürelerini almayanlara göre daha uzun bulmuşlardır. Aynı çalışmada aynı zamanda tedaviye erken başlamanın ve uzun süre yüksek doz IFN-alfa verilmesinin de klinik takipte daha iyi sonuçlandığını tespit etmişler ve isoprinosin verilmesinin prognozu etkilemediğini bildirmiştir (129). 1996-2000 yıllarını içine alan bir çalışmayı Gascon yapmıştır. Bu çalışma tek kör, rastgele kontrollü bir çalışma olup isoprinosine ve