T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
İNAKTİF HBSAG TAŞIYICILIĞI İLE
HBEAG NEGATİF KRONİK HEPATİT B’DE
KANTİTATİF HBSAG DÜZEYİ VE KLİNİK ÖNEMİ
İÇ HASTALIKLARI UZMANLIK TEZİ Dr.Süleyman KILIÇ
DİYARBAKIR 2013
T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
İNAKTİF HBSAG TAŞIYICILIĞI İLE
HBEAG NEGATİF KRONİK HEPATİT B’DE
KANTİTATİF HBSAG DÜZEYİ VE KLİNİK ÖNEMİ
İÇ HASTALIKLARI UZMANLIK TEZİ Dr.Süleyman KILIÇ
TEZ DANIŞMANI Prof. Dr. Kendal YALÇIN
ANABİLİM DALI BAŞKANI Prof. Dr. Mehmet Emin YILMAZ
TEŞEKKÜR
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan; bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’ na başta olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof. Dr. M.Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Vedat GÖRAL, Prof. Dr. Orhan AYYILDIZ. Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Alpaslan Kemal TUZCU, Prof. Dr. Muhsin KAYA, Prof. Dr. Ali Kemal KADİROĞLU ve Biyoistatsitik ABD öğretim üyesi Prof. Dr. Ömer SATICI’ya teşekkürlerimi sunarım.
Tezimi oluşturmamda büyük emeği geçen tez danışmanım İç Hastalıkları öğretim üyelerinden Prof. Dr. Kendal YALÇIN hocama teşekkürlerimi sunarım.
Tezimi hazırlarken destekleri ile bana yardımcı olan Uzman Dr. Nazım EKİN, Doç. Dr. Ebubekir ŞENATEŞ ve tüm Gastroenteroloji bölümüne teşekkürlerimi sunarım.
Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D., Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D., Göğüs Hastalıkları ve Tüberküloz A.B.D. ve Radyoloji A.B.D. başkanlarına ve değerli öğretim üyelerine,
Birlikte çalışmaktan büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına.
Ayrıca bu günlere gelmemde büyük pay sahibi olan ve desteklerini hiçbir zaman benden esirgemeyen annem, babam, kardeşlerim ve arkadaşım Dr. Ahmet Engin ATAY’a teşekkürlerimi sunarım.
İÇİNDEKİLER
TEŞEKKÜR---I İÇİNDEKİLER ---II TABLOLAR ---IV ŞEKİLLER---V SİMGELER VE KISALTMALAR---VI ÖZET VE ANAHTAR SÖZCÜKLER---VII ABSTRACT-KEYWORDS---IXI.GİRİŞ ve AMAÇ---1
II.GENEL BİLGİLER---3
2.1. HEPATİT B VİRUSU---3
2.1.1. Virus yapısı ve özellikleri---3
2.1.2. HBV genomu---3 2.1.3. HBV genotip ve serotipleri---5 2.1.4. HBV yaşam döngüsü---6 2.1.5. HBV yapısal proteinleri---7 2.2. HBV EPİDEMİYOLOJİSİ---8 2.3. HBV PATOGENEZİ---9
2.4. HBV MUTANTLARI VE MUTASYONLARIN KLİNİK ÖNEMİ---10
2.5. KRONİK HEPATİT B’DE KLİNİK ---11
2.6. HBV İNFEKSİYONUNUN TANI YÖNTEMLERİ---13
2.6.1. Serolojik tanı yöntemleri---14
2.6.2. Moleküler tanı yöntemleri ---17
2.7. KRONİK HBV İNFEKSİYONUNDA TEDAVİ---18
2.8. KRONİK HEPATİT B TEDAVİSİNDE KULLANILAN İLAÇLAR----19
2.8.1. İnterferonlar---20
2.8.2. Lamivudin---20
2.8.3. Adefovir dipivoksil---21
2.8.4. Entekavir---24
2.8.6. Telbivudin ( L-deoksitimidin)---24
2.8.7. Tenofovir disoproxil fumarate---25
III. MATERYAL VE METOD---26
3.1. İstatistiksel Veriler---27
IV. BULGULAR---28
V. TARTIŞMA ---45
VI. SONUÇ---51
TABLOLAR
Tablo-1. Genotiplerin coğrafik dağılımı Tablo-2. Kronik hepatit B klinik fazları
Tablo-3. HBV infeksiyonunun farklı dönemlerinde serolojik ve moleküler göstergeler Table-4. Öncelikle her 6-12 ay da bir takip edilmesi gereken kronik hepatit B’li
hastalar
Table-5. Kronik hepatit B Tedavisinde değerlendirilmesi gereken hastalar
Tablo-6. İnaktif HBsAg taşıyıcısı ve HBeAg negatif kronik hepatit B’li hastaların demografik, biyokimyasal, serolojik ve histopatolojik bulguları
Table-7. ALT düzeylerine göre hastaların Demografik özellikleri, Biyokimyasal, Serolojik ve Histopatolojik Bulguları
Table-8. HBV DNA düzeylerine göre hastaların Demografik özellikleri, Biyokimyasal, Serolojik ve Histopatolojik Bulguları
Table-9. HbsAg düzeylerine göre hastaların Demografik özellikleri, Biyokimyasal, Serolojik ve Histopatolojik Bulguları
Table-10. Inaktif HbsAg taşıyıcıları ve HbeAg negatif kronik hepatit B’li hastaların yaş, ALT, HBsAg ve HBV DNA dağılımları
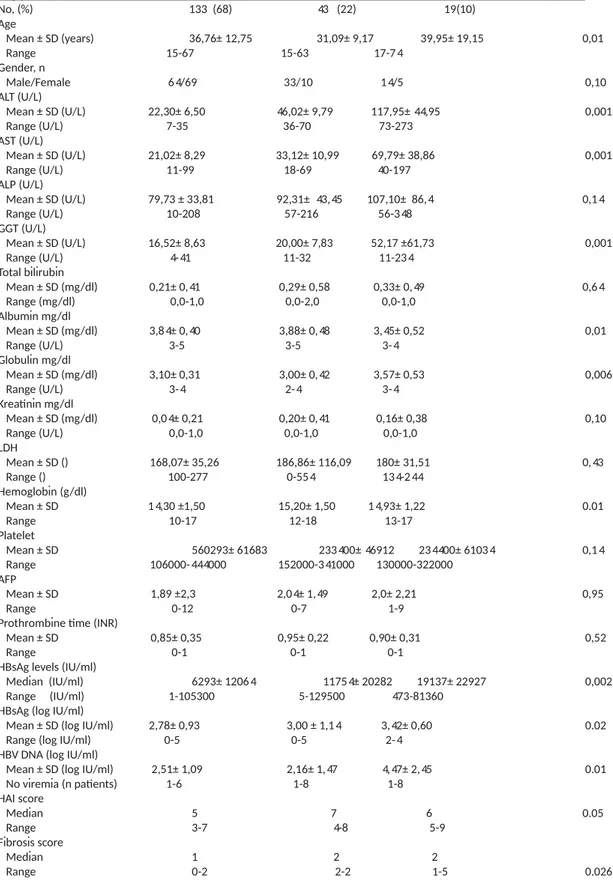
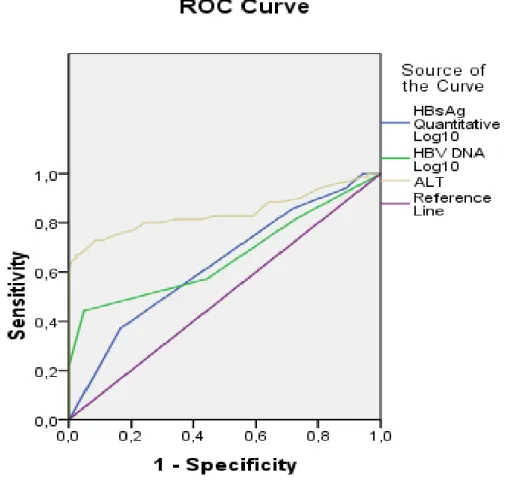
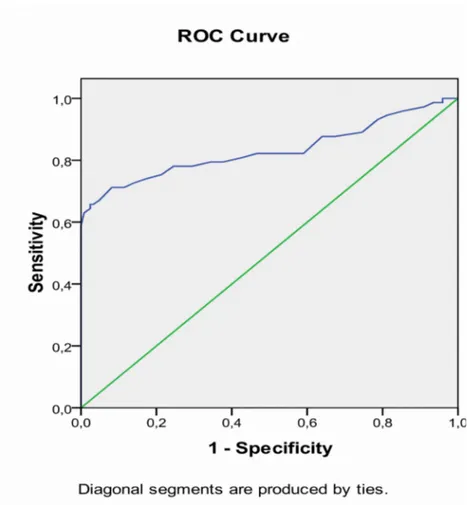
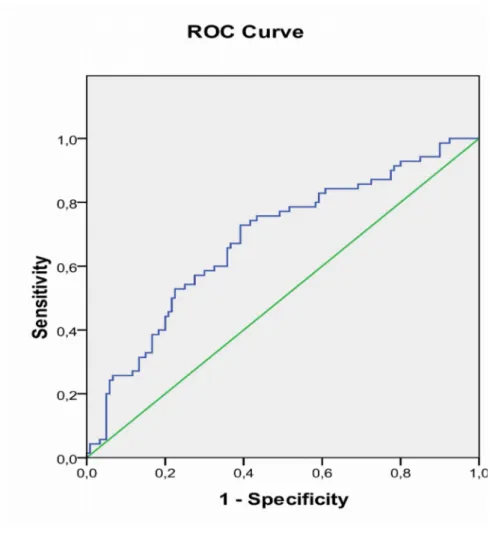
Tablo-11. İnaktif HBsAg Taşıyıcı Bireylerde Değişkenlerin Korelasyonu Tablo-12. Kronik Hepatit B’li Bireylerde Değişkenlerin Korelasyonu Tablo 13. Kantitatif HBsAg, HBV DNA ve ALT’ye ait ROC analizleri Tablo 14. Kantitatif HBsAg Log10’aait ROC analizi
Tablo 15. HBV DNA Log10’a ait ROC analizi Tablo 16. ALT’ye ait ROC analizleri
ŞEKİLLER
Şekil-1. HBV genom organizasyonu ve sentezlenen RNA Şekil-2. HBV yaşam döngüsü
Şekil-3. Akut viral hepatit B seyrinde serolojik göstergeler Şekil-4. Kronik hepatit B seyrinde serolojik göstergeler Şekil-5. Adefovir dipivoksil
SİMGELER VE KISALTMALAR LİSTESİ
Alb : Albumin
AKŞ : Açlık kan şekeri
ALT : Alanin amino transferaz ALP : Alkalen fosfataz
ALA-S : Aminolevulinik asit sentetaz AST : Aspartat amino transferaz CRP : C-Reaktif Protein
ELISA : Enzyme-Linked Immuno Sorbent Assay GGT : Gamaglutamil transferaz
Glb : Globulin
HBsAG : Hepatit B yüzey antijeni HBeAG : Hepatit B e antijeni HBV : Hepatit B virüs
HCC : Hepatocellular carcinoma HCV : Hepatit C virüs
HDV : Hepatit D virüs
INR : Uluslar arası normalleştirme oranı (International Normalized Ratio) IL-1 : İnterlökin-1
LDH : Laktat Dehidrogenaz NO : Nitrik oksit
PCR : Polimeraz Zincir Reaksiyonu PTZ : Protrombin zamanı
TfR : Transferrin reseptörü
TNF-alfa : Tümör nekroz faktör alfa USG : Ultrasonografİ
ÖZET
Amaç: Dünya çapında yaklaşık olarak 350 milyon kişinin hepatitis B virüsü (HBV) ile
infekte olduğu düşünülmektedir. Noninfeksiyöz subviral bir partikül olan hepatit B yüzey antijeni (HBsAg) düzeyinin kantitatif analizi HBV infeksiyonlu bireylerde önemli bir takip parametresidir. Bu çalışmada inaktif HBsAg taşıyıcısı ve HBeAg negatif kronik hepatit B'li vakaların ayırımına yardımcı olacak serolojik, virolojik ve biyokimyasal testlerin öneminin incelenmesi amaçlanmıştır.
Materyal-Metod: 123 inaktif HBsAg taşıyıcısı ve 72 HBeAg negatif kronik hepatit B'li
hasta prospektif çalışmaya dahil edildi. Hastaların yaş, cinsiyet ve BMI gibi demografik özellikleri kaydedildi. Tam kan, protrombin zamanı (PTZ), biyokimyasal parametreler, HBV DNA, HBsAg, HBeAg, anti-HBe, anti-HBs, alfa feto-protein (AFP) gibi parametreler incelendi. Karaciğer biyopsisinin histopatolojik incelemesinde Ishak’ın Modifiye Knodell Skorlama sistemi kullanıldı. HBsAg düzeyinin kantitatif analizinde Elecsys 2010 sistemi kullanıldı. HBV DNA düzeyi COBAS AmpliPrep/COBAS TaqMan HBV Test yöntemi ile çalışıldı.
Bulgular: İnaktif HBsAg taşıyıcısı ve HBeAg negatif kronik hepatit B'li grup arasında
platelet, ALT, AST, HBsAg, HBV DNA ve HAI grade açısından anlamlı farklar mevcuttu (sırasıyla p=0.04 p=0.001, p=0.001, p=0.002, p=0.001, p=0.001) HBsAg düzeyi ile ALT, AST ve GGT arasında anlamlı korelasyon (sırasıyla p=0.013, p=0.008, p=0.029) saptanırken serum HBV DNA ile HBsAg, AST, ALT ve GGT arasında korelasyon anlamlı idi (sırasıyla p=0.01, p=0.001, p=0.001, p=0.001). İnaktif HBsAg taşıyıcı grubun %19'nun HBsAg düzeyi kantitatif olarak 10000 IU/ml'nin üzerinde iken HBeAg negatif kronik hepatit B 'li grubun %13'nün HBsAg düzeyi 1000 IU/ml'nin altında idi. ALT düzeyleri açısından değerlendirildiğinde HBeAg negatif kronik hepatit B'lilerin %29'da ALT düzeyi normal aralıkta ve %45'de 1-2 kat artmış idi. Çalışmamızda 25 hastaya karaciğer biyopsisi yapıldı. Histopatolojik incelemede, nekroinflamasyon skoru, HBeAg negatif kronik hepatit B’li grupta yüksek olarak saptandı.
Sonuç: HBsAg düzeyinin kantitatif analizi gerek inaktif HBsAg taşıyıcı gerekse HBeAg
negatif kronik hepatit B'li bireylerde önemli bir takip parametresi olabilecek potansiyele sahiptir. Sadece serum HBV DNA ve ALT düzeyi ile takip edilen HBeAg negatif kronik
takip prosedürleri ve tedavi rejimlerine maruz kalmaktadırlar. Her ne kadar daha fazla ve geniş kapsamlı çalışmalarla desteklenmesi gerekse de, HBsAg düzeyinin kantitatif analizi hepatit B'li hastaların takibinde HBV DNA ve ALT düzeylerini destekleyici bilgiler sağlayabileceğini düşünmekteyiz.
ABSTRACT
Aim: Chronic hepatitis B virus (HBV) infection affects approximately 350 million people
worldwide. Quantitative analysis of HBsAg, a noninfectious subviral particle, is an important follow-up parameter of patients with HBV infection. Our aim is to determine a cut- off value of HBsAg, HBV DNA and ALT to discriminate inactive carriers from chronic hepatitis B, and also to evaluate relation of these two parameters with biochemical and histopathological findings.
Material-methods: One hundered twenty three inactive HBsAg carriers and 72 HbeAg
negative chronic hepatitis B patients were enrolled prospectively. Demographic features like age, gender and body mass ındex (BMI) were recorded. Hemogram, prothrombin time (PTT), biochemical parameters, HBV DNA, HBsAg, HBeAg, anti-HBe, anti-HBs, alfa feto-protein (AFP) were analyzed. Ishak's modified Knodell scoring system was used for histopathologic examination. Serum HBsAg levels were quantified using the Elecsys 2010 assay. Serum HBV DNA levels were measured by usingCOBAS AmpliPrep/COBAS TaqMan HBV Test.
Results: There was a significant difference between inactive HBsAg carriers and HbeAg
negative chronic hepatitis B groups in terms of platelet count, ALT, AST, HBsAg, HBV DNA levels and HAI grade (sırasıyla p=0.04 p=0.001, p=0.001, p=0.002, p=0.001, p=0.001). A significant correlation was observed between serum HBsAg levels and ALT, AST ve GGT (p=0.013, p=0.008, p=0.029; respectively) HBV DNA levels were significantly correlated with HBsAg, AST, ALT and GGT levels (p=0.01, p=0.001, p=0.001, p=0.001; respectively). HBsAg level was higher than 10000 IU/ml in 19 % of inactive HBsAg carriers group. Thirteen percent of HbeAg negative chronic hepatitis B group have HBsAg level lower than 1000 IU/ml. ALT level was within normal range in 29% of HbeAg negative chronic hepatitis B and elevated 1-2 times in 45% of same group.
Conclusion: Quantification HBsAg level has a potential to be a follow-up marker of both
inactive HBsAg carriers and HbeAg negative chronic hepatitis B patients. A considerable amount of patients with HbeAg negative chronic hepatitis B that were followed up only with ALT and HBV DNA were misdiagnosed as inactive carries and underwent to inappropriate follow-up procedures and therapeutic regimens. We conclude that quantitative analysis of HBsAg; in addition to HBV DNA and ALT, provides
studies with large number of participants are required to clarify this data.
I. GİRİŞ
Hepatit B virüsü (HBV) kronik hepatit, siroz ve hepatoselüler karsinomun en önemli nedeni olup ciddi bir sağlık sorunudur. Tüm dünyada yaklaşık 2 milyara yakın insanın hepatit B virüsü ile temas ettiği anlaşılmıştır. Kronik HBV taşıyıcılarının sayısı günümüzde 350 milyonu geçmiş olup her yıl tahminen 500.000 ile 1,2 milyon arasında insan HBV infeksiyonundan ölmektedir. Akut infeksiyondan 6 ay sonra HBsAg / anti-HBs serokonversiyonu olmamış ise kronik HBV infeksiyonu söz konusudur. Kronik HBV infeksiyonu ya inaktif taşıyıcılık (%50) ya da kronik hepatit (%50) şeklinde seyreder. Kronik hepatitlilerin %60’ında zamanla siroz gelişir (10-50 yıl arası değişen bir süreç).
Replikatif HBV infeksiyonu uzun yıllar yüksek titrelerde serum HBV DNA düzeyi (HBeAg pozitiftir) ve normal veya normale yakın ALT düzeyi ile karakterli bir evreden (immuntolerans dönemi) sonra, ALT yüksekliği (biyopside nekroinflamatuvar aktivite), serum HBV DNA titresinde azalma ve HBeAg/anti-HBe serokonversiyonu ile karakterli ikinci evreye girer (immunklirens dönemi). Bu ikinci evre sonunda iyileşme (HBeAg negatif, anti-HBe pozitif ve serum HBV DNA negatif) olur veya HBeAg negatif, anti-HBe pozitif ve serum HBV DNA pozitifliği ile tanımlanan mutant ("precore" veya "core promoter" mutasyonları) HBV infeksiyonu gelişir. Bu mutant HBV infeksiyonu, HBV genotipi (genotip D) ile ilgilidir ve ülkemizde sıktır. Son dönem ise serum HBV DNA negatifleşmesinden sonraki evredir.
Hepatitis B yüzey antijeni (HBsAg) noninfeksiyöz subviral bir partikül olup kronik HBV enfeksiyonunda önemli bir takip parametresidir.İnaktif HbsAg taşıyıcılar ile HbeAg negatif kronik hepatit B enfeksiyonu sıklıkla örtüşmektedir ve tedavi ve takip stratejileri önemli farklılıklar gösterdiği için bu 2 klinik antitenin ayırımı önemlidir. Kronik HBV enfeksiyonunda HBsAg düzeyinin değerlendirildiği güncel çalışmalar olmakla birlikte HbeAg negatif kronik hepatit B ve inaktif HBsAg taşıyıcıları ayırımında HBsAg düzeyinin irdelendiği çalışma sayısı oldukça sınırlıdır. Bu çalışmaların çoğunda HBsAg düzeyi kalitatif olarak değerlendirilmiş olup kantitatif olarak HBsAg düzeyinin incelendiği çalışma bizim tıbbi literatürde yaptığımız araştırmada bulunmamaktadır.
Bu çalışmamızın amacı daha önce tedavi almamış veya son 6 aydır tedavi almayan HBeAg negatif kronik hepatit B’li hastalar ve inaktif HBsAg taşıyıcılarında kantitatif HBsAg düzeyi başta olmak üzere, serum HBV DNA ve diğer serolojik ve biyokimyasal parametrelerin karşılıklı olarak incelenmesi amaçlandı. Bu sayede klinik pratikte kimi zaman birbirinden ayırt edilemeyen bu 2 hastalık grubunun ayırımı hedeflendi.
II. GENEL BİLGİLER
2.1. HEPATİT B VİRUSUHBV, direk kan ve kan ürünleri ile bulaşan hepatit formu ilk kez 1883 yılında Lurman tarafından tanımlanmıştır. 20.yüzyıl başlarında kızamık ve kabakulak immunproflaksisi yapılanlarda salgınlar halinde sarılık görülmüştür (4,5). 1965 yılında Blumberg australya antijeni adını verdiği hepatit B yüzey antijenini (HBsAg), 1971 yılında Dane elektron mikroskobik incelemsinde dane partikülünü bulmuş, sonraki yıllarda kor antijeni, DNA polimeraz gibi virüs genomu ve proteinleri tanımlanmıştır (6).
2.1.1.Virus Yapısı ve Özellikleri
V doku tropizmi olan hepadna virus ailesinden hepatotrop bir DNA virüsüdür (7,8). Virionda elektron mikroskobisinde üç yapı tanımlanmıştır, 42 nm çapında infeksiyöz dane pertikülü, 22 nm çapında sferik partikül ve 22 nm büyüklüğünde flamentöz partiküller (9).DNA viruslerinden en küçüğü olan HBV zarflı olup kısmen çift iplikli çembersel DNA’danoluşur. DNA virusu olmasına rağmen revers transkriptaz enzimini kodlar ve bu enzim ile RNA aracısı üzerinden replikasyona uğrar. HBV infekte hücre çekirdeğinde bir minimikrozom şeklinde bulunan kovalent bağlı çembersel DNA (cccDNA) denilen replikasyon ve transkripsiyon aracı molekülüne dayanan replikasyon stratejisine sahiptir.
Zarflı bir virüs olmasına rağmen eter, ısı, donma, düşük pH ve çözmeye oldukça dirençlidir, bu da dezenfektanlara direnci sağladığı gibi kişiden kişiye bulaşmanın etkinliğini sağlar (7,10).
2.1.2. HBV genomu
HBV kısmen çift sarmallı sirküler bir DNA’ya shiptir ve 42 nm büyüklüğündeki bu genomun tümü 3200 nükleotidten oluşan uzun (L veya negatif) ve kısa (S veya pozitif) iki DNA sarmalı içermektedir. HBV genomu 4 açık okuma bölgesi (open reading frame=ORF) içermektedir (pre-S/S, pre-C/C, P ve X). Şekil-1’de HBV genomunun organizasyonu görülmektedir. S geni pre S1, preS2 ve S bölgeleri olmak üzere üç farklı başlangıç kodonuna sahiptir. C geninde ise, iki farklı başlangıç kodonu, preC ve C bölgeleri bulunmaktadır. Pre C ve C genleri HBeAg’nin, C geni ise HBcAg’nin
sentezlenmesini. sağlar P geni revers transkriptaz aktivitesine sahip DNA polimeraz enzimini, X geni ise transaktivasyon proteini olan x proteinin sentezler (11).
Şekil-1. HBV genom organizasyonu ve sentezlenen RNA (12)
HBV zarf proteinleri, küçük, orta ve büyük yüzey antijenleri olmak üzere protein ve glikoprotein yapısında proteinlerdir. Bunlar küçük olan HBs antijeni (SHBs Ag), orta HBs antijeni (MHBs Ag) ve büyük HBs antijeni (LHBs Ag)’dir. İnfeksiyöz dane partikülünün yapısında her üç bileşende yer alır. L ve M proteinleri daha az oranda virüs zarfının yapısında bulunurken S bileşeni virüs zarfındaki ana proteindir. HBV yüzey antijenleri non-infektif filamentöz ve sferik yüzey antijenleri partiküllerininde yapısını oluşturur. Sferik ve flamentöz partiküllerin antikorları ile oluşturdukları komplekslerin HBV ile infekte kişlerde izlenen immun kompleks reaksiyonlarından sorumlu olduğu bilinmektedir (7,8,13).
2.1.3.HBV genotip ve serotipleri
HBV’nin tüm genom dizisinin % 8’inde veya S geninin % 4’ünde farklılık taşıyan varyantlar genotip olarak adlandırılmaktadır. Buna göre HBV genomu A’dan H’ye kadar sekiz ana genotip oluşturmaktadır. Bunun yanında HBs antijenindeki yapısal farklılıklarına göre “a” ortak determinantı taşıyan dokuz grup HBV serotipi incelenmektedir. Genotip ve serotipler birbirleri ile tam olarak örtüşmemekte, serotip benzerlikleri genetik ilişkiyi doğrulamamaktadır. Virusun coğrafik dağılımı ile genotiplerin serotiplere göre daha uyumlu olduğu ve moleküler epidemiyolojik çalışmalarda genotiplerin kullanımının daha yaralı olduğu belirlenmiştir. Farklı genotiplerle ko-enfeksiyon olabileceği gibi genotipler arası rekombinasyonlarda olabileceği ıspatlanmıştır (14,15,16).Genotiplerin coğrafik dağılımı Tablo-1’de görülmektedir (17). Türkiye’de yapılan birçalışmada akut hepatit B’ye neden olan etkenlerin tümünün genotip D olduğu gösterilmiştir(18).
Viral genotip farklılıklarının HBV infeksiyonunun doğal gidişini ve antiviral tedavi yanıtını etkileyebileceğine dair veriler vardır. Genotip C’de karaciğer hastalığının aktivitesi ve siroza ilerleme riski genotip B’den fazladır. Spontan HBeAg serokonversiyonu genotip B de genotip C’den fazladır (19,20).
Tablo-1. Genotiplerin coğrafik dağılımı (17)
Tip Çoğrafik Dağılım
A ABD, Kuzey Avrupa, Orta Afrika, Güney Afrika, Venezuella B Çin, Endonezya, Vietnam, Tayvan, Güneydoğu Asya
C Kore, Çin, Japonya, Polinezya, Tibet, Vietnam, Doğu Asya D Afrika, Akdeniz bölgesi, Hindistan, Tunus,Doğu Avrupa E Batı ve Orta Afrika
F Fransa, Alaska, Brezilya, Kolombiya, Amerika Yerlileri,Venezuella
G Fransa, ABD
HBV’nin insan hepatositlerine tutunma ve giriş için kullandığı yüzey molekülleri henüz tam olarak aydınlatılamamıştır. LHBs’nin amino terminalinde izlenen pre-S1 bölgesinin hedef hücreye tutunmada en önemli görevi üstlenen epitopları içerdiği saptanmıştır. HBV’nin organ ve doku özgüllüğünün belirlenmesinde hücreye tutunmayı sağlayan bölgeler dışındaki pre-S1 kısımlarının etkili olduğu bilinmektedir. Diğer ilginç bir nokta ise oldukça iyi korunmuş bir viral protein olan X proteinin pre-S1 tutunma bölgesi ile olan benzerliği nedeniyle tutunmada rol aldığı olasılığını akla getirmektedir. Her ne kadar pre-S1 tutunmada ana epitopları taşısada ikinci bir epitopun tutunmada rol aldığı saptanmıştır.
Tutunma sonrasında virüs zarfı ile hücre membranı arasında füzyon meydana gelir ve viral nükleokapsid stoplazmaya salınır. Kapsidin parçalanmasıyla viral genomik DNA ve polimeraz hücre çekirdeğine taşınır (8,21,22,23).
HBV, negatif ve pozitif iplikli çembersel DNA olmak üzere iki tip DNA taşır. Replikasyon döngüsünün başlamasıyla bu iki DNA’da cccDNA’ya dönüştürülür. Replikasyon’un en önemli aşaması olan bu aşama hepatosite virüs inokülasyonundan sonra 24 saatte meydana geldiği saptanmıştır. cccDNA HBV’nin hepatosite dirençliliği ve sürekliliği ile ilgili moleküldür ve antiviral tedavi sonrası izlenen reaktivasyon’dan da sorumludur. cccDNA, viral DNA’nın nükleer membrandan çekirdeğe ulaşmasıyla hücresel RNA polimerazlar tarafından viral transkripsyon başlamasıyla sentezlenir. Viral RNA’lardan virüse ait proteinler; nükleokapsid proteini veya HBcAg, HBeAg ve viral polimeraz, zarf proteinleri, X proteinleri sentezlenir. Viral RNA ayrıca viral genomik DNA için kalıp olan pregenomik RNA olarakta işleme alınır. Viral genomik DNA sentezi için RT pregenomik RNA’nın 5’ ucuna bağlanır ve böylece nükleokapsid içinde viral DNA sentezi başlar. Burada viral RT’nin kendisi DNA sentezini başlatır. Kısmi çift iplikli DNA oluştuğunda nükleokapsid partikülleri endoplazmik retikuluma zarf yapılarını kazanmak üzere geçerek olgunlaşma sürecine girerler. Oluşan nükleokapsidlerden bir kısmı cccDNA kopya havuzunu arttırmak için hücre çekirdeğine dönebilmektedir. Üç zarf proteinini içeren partiküller endoplazmik retikulumdan golgi aparatına tomurcuklanır, bu esnada olgunlaşan virionlar kan dolaşımına salınır (15). Şekil-2’de HBV’nin replikasyon ve yaşam döngüsü gösterilmektedir (24).
2.1.5.HBV yapısal proteinleri
Yüzey proteinleri: S geni tarafından kodlanan yüzey proteinleri hem dane partikülünün yüzeyinde hem infekte hastaların karaciğer ve serumunda sferik ve flametöz partiküllerin yapısında bulunur (25,26).S geni üzerindeki başlangıç kodonuna göre üç farklı yüzey proteini sentezlenir. Okuma işlemi S genindeki ilk kodon’dan başlarsa pre-S1, preS2 ve S bölgelerinin tümü okunur ve büyük yüzey proteini (LHBs) oluşur. L proteininin konak hücreye bağlanmada etkili olduğu ve hepatositte hasara yol açarak hepatosellüler karsinom gelişimine yol açabileceği düşünülmektedir (27). Okuma ikinci kodondan başlarsa pre-S2 ve S bölgelerinin ürünü orta büyüklükte M (MHBs) proteini oluşur. Replikasyon olmadığında HBsAg içinde yer almaz, bu nedenle pre-S2 antijen varlığı viral replikasyon varlığı olarak kabul edilir (28).Okuma işlemi sadece S bölgesini içerirse küçük zarf proteini olan S (SHBs) proteini sentezlenir. HBs antijeninin büyük kısmını oluşturan SHBs zarf’ın majör proteini olarak bilinir ve B lenfositler için epitopik bölgeye sahiptir (28,29). Sadece S proteinleri bulunan HBsag den saflaştırılmış aşılar HBV’ye karşı etkin koruma sağlar (30).
Kor proteinleri: HBV genomunda C geni pre-C ve C olmak üzere iki bölgeye ayrılır. Pre-C bölgesi HBeAg üretiminden sorumlu olup, C bölgesi HBcAg sentezler (25,29). HBV ile infekte hasta hepatositlerinde gösterilebilen HBcAg sıklıkla intranükleer yerleşimlidir. Ancak aktif hastalık döneminde ve aşırı viral replikasyon gösteren olgularda stoplazmada da yaygın olarak saptanabilir (25,28,31).
P proteini: P geni HBV’nin en uzun genidir ve p proteinini kodlar. P proteini; revers transkriptaz, endonükleaz ve hem DNA hem RNA bağımlı polimeraz aktivitesine sahiptir (29,32).
X proteini: X geni HBV genomundaki en küçük gen bölgesidir. Sentezlediği HBxAg’nin viral döngüdeki rolü henüz bilinmemektedir (26,33,34). HBxAg’nin hepatosellüler karsinom gelişiminde rol alabileceği ve serumda erken saptanan anti-HBx antikorlarının hepatosellüler karsinom erken tanısında yaralı olabileceği öne sürülmüştür (35,36).
2.2. HBV EPİDEMİYOLOJİSİ
Bulaşma yolları: HBV’nin dört ana bulaş yolu vardır.
1-Perkütan bulaş: İnfekte kan ve vücut sıvıları ile mukozal veya kütanöz temasıyla bulaş olur. Çağul transfüzyon yapılanlar, hemodiyaliz hastaları, damar içi uyuşturucu alanlar ve sağlık çalışanları risk grubunu oluşturur (37).
2-Cinsel temas: Homoseksüeller ve çok eşliler risk grubudur (37).
3-Perinatal-Vertikal bulaş: İnfekte anneden yenidoğana bulaş, HBeAg pozitif anneden doğan çocukların % 70-90’ı infekte olur, bunların % 90’ı kronikleşir. HBeAg negatif anneden doğan çocukların % 10-40’ı infekte olur ve bunlarında % 40-70’i kronikleşir. Anne sütünde de HBsAg tespit edilmiştir, ancak bu durum çocuğu sütten kesmeyi gerektirmez (37,38).
4-Horizontal bulaş: İnfekte kişilerle cinsellik içermeyen yakın temas ile bulaşma. Çeşitli vücut sıvılarında HBsAg bulunmuştur. Plevra ve periton sıvısında serumdaki kadar viral yük vardır. Tükrük ve semendeki viral yük serumdakinden daha düşüktür ancak tükrük ve semende sürekli infeksiyöz virionlar bulunur. Endemik bölgelerde cilt çatlakları ve mukozal membranlardan geçiş çocuklarda infeksiyona neden olabilir (37,38,39).
HBV infeksiyonunun dünyadaki dağılımı coğrafik bölgelere göre düşük, orta ve yüksek endemisite bölgelerine ayrılmıştır. Bölgedeki HBsAg ve anti-HBs pozitifliği, infeksiyonu alınma yaşı ve virüsün en sık hangi yolla bulaştığı göz önüne alınarak bu
ayırım yapılmıştır. HBsAg pozitif olma sıklığı dünya genelinde % 0.1-20 arasındadır (37,40).
HBV infeksiyonu açısından kırsal kesimde yaşayanlar daha fazla risk altındadır (41). Düşük endemisite bölgelerinde (ABD, Kanada, Batı Avrupa, Avustralya, Yeni Zelanda) HBsAg pozitif olanların prevalansı % 0.1-2’dir. İnfeksiyon genelde yetişkin çağda alınır. Cinsel temas ve perkütanöz temas en önemli bulaş yoludur (37,39). Orta endemisite bölgelerinde (Japonya, Orta Asya, Orta Doğu, Orta Amerika) HBsAg pozitiflik prevalansı % 2-5 oranındadır. İnfeksiyon çoğunlukla çocukluk, ergenlik ve genç erişkinlik döneminde alınır. Başlıca bulaş yolu perkütanöz ve horizontaldir (42).
Yüksek endemisite bölgelerinde (Sahra altı Afrika, Güneydoğu Asya, Çin, Alaska) HBsAg pozitiflik prevalansı % 5-20 oranındadır ve yetişkinlerin % 70’ten fazlası infeksiyona karşı bağışıktır. Maternal, perinatal ve horizontal yollar ana bulaş yolarıdır (42).
HBV hepatosellüler karsinomun % 60-80 nedenidir. Konik HBV olanlar 100 kat daha fazla oranda hepatosellüler karsinoma yakalanırlar. İnfeksiyonun alınması ile hepatosellüler karsinom gelişmesi arasında geçen zaman ortalama 30 yıldır. Hepatosellüler karsinom insidansı coğrafik bölgelere ve etnik gruplara göre farklılık göstermektedir (42).
Dünya sağlık örgütü 1992’de tüm yenidoğanların aşılanmasını önermesiyle dünyada HBV aşısı rutin aşılama programına alındı (43). Böylece yenidoğan, infant ve adölesanlarda infeksiyon sıklığı azalmıştır.
Türkiye’de toplum genelinde yapılan taramalarda HBsAg pozitifliği bölgeden bölgeye farklı olmakla beraber % 1.7-21 arasında değişmektedir. HBsAg pozitifliği anlamlı olarak erkeklerde daha fazladır (42). Bununla birlikte ülkemizdeki en önemli bulaş yolu horizontaldir (37,44). Kronik HBV infeksiyon’lu olan hastalarda ülkemizdeki baskın genotip genotip D’dir (45).
2.3. HBV PATOGENEZİ
Kronik HBV infeksiyonunda meydana gelen karaciğer hasarı çoğu kez immun sistem ve HBV ile infekte hepatositlerin etkileşimine bağlıdır. İnterferon-alfa, beta, gama, TNF alfa gibi antiviral sitokinler virüsün temizlenmesine katkı sağlarken, sitotoksik T lenfositlerince infekte hepatositlerin ortadan kaldırılması hem virüsün temizlenmesinde hemde süregen karaciğer hasarına katkıda bulunmaktadır (44).
Hücresel immun yanıtı sağlayan sitotoksik T lenfosit yanıtının düşük düzeyde, yetersiz veya gelişmemiş (yenidoğan) olması kronik HBV infeksiyonu gelişmesinde etkilidir (15).
2.4. HBV MUTANTLARI VE MUTASYONLARIN KLİNİK ÖNEMİ HBV yüksek düzeyde virion yapım ve yıkımı ile karakterizedir, bu özelliği revers transkriptaz enziminin onarım özelliğinin olmamasıyla bir araya geldiğinde replikasyonda yüksek düzeyde hata oluşmasına neden olmaktadır. Buna bağlı olarak infekte kişide virüs populasyonu genetik olarak birbirinden farklı ama yakın özellikler taşıyan varyantların kombinasyonu olarak izlenir. İnfekte konakta herhangi bir mutasyonu taşıyan virusler, aşılama, antiviral tedavisi gibi etkenlerle normal virüslerin azalmasıyla baskın hale gelirler (15).
Bazal kor promoter/prekor ve kor bölge mutasyonları: HBeAg’nin olmaması veya düşük düzeyde olması ile ilişkili iki önemli mutasyon saptanmıştır. Birincisi, pre-kor bölgesinde stop kodonu oluşmasıdır. Stop kodonu oluşması ile HBeAg sentezlenmesi durmakta ancak HBcAg üretimi ve HBV replikasyonu devam etmektedir (15).
Diğer bir mutasyon grubu olan bazal kor promoter bölgesi mutasyonları meydana gelmesi HBe antijeninde azalmaya ve viral yükte artışa yol açmaktadır (15).
Kor bölgesi proteinleri pre-genomik RNA bağlanma bölgesini, ek olarak B ve sitotoksik T lenfositlerin epitoplarınıda içermektedir. Kor bölgesinde bu epitoplarda mutasyon taşıyan virüsler, kronik HBV ile infekte hepatosit’lerin sitotoksik T lenfositler tarafından temizlenmesi aşamasında korunurlar. Kor geninde izlenen mutasyon oranları, pre-kor stop kodonunun varlığı, HBe antijeni sentezi ve karaciğer hastalğının aktivitesi ile ilişkilidir (15,46).
X bölgesi mutasyonları: X proteininin sentezi ve özellikleri, bazal kor promoter bölge mutasyonlarından etkilenmektedir. Bu bölge mutasyonları x geninde de değişikliklere neden olmakta sonuçta HBx antijeni transaktivasyon aktivitesi kazanamamaktadır (46).
Zarf bölge mutasyonları: Pre-S bölgesi HBV’nin en yüksek heterojenite gösteren bölgesidir. Pre-S2 proteinlerini sentezleyemeyen virüsler özellikle asemptomatik taşıyıcılarda görülmektedir. Pre-S2, pol (polimeraz) proteini bağlayıcı bölgesiyle çakışmakta bu nedenlede pre-S2 bölge mutasyonlarında polimeraz enzim aktivitesinde önemli değişikliklere sebep olmaktadır (46).Günümüzde uygulanan pek çok HBV aşısı HBs antijeni taşımakta ve yüzey antijeni yapısında yerleşen majör hidrofobik bölgeye karşı
immun yanıt oluşumuna neden olarak koruyucu bağışıklık oluşturmaktadır. Bu bölge mutasyonları aşı başarısızlığına neden olmaktadır (47).
Polimeraz bölge mutasyonları: Nükleotid/nukleozit analoglarının kronik hepatit B tedavisinde kullanılması ile pol geninde mutasyon taşıyan virüslerin ortaya çıkması ve çoğalması bu ilaçların etkinliğinde azalmaya yol açmıştır. Etkinlikte oluşan bu azalma pol geni mutasyonunun önemini ortaya çıkarmıştır. Lamivudin, Adefovir dipivoxil, entekavir gibi anti viral ilaç dirençleri bu şekilde gelişmektedir (15).
2.5. KRONİK HEPATİT B İNFEKSYONUNDA KLİNİK
HBV alınmasından sonra HBsAg, HBeAg ve yüksek titrede HBV DNA pozitifliğinin altı aydan uzun sürmesi kronik HBV infeksiyonuna gidişi gösterir (48). Karaciğerde hepatositlerin ölümüne eşlik eden inflamasyonun varlığı kronik viral hepatit için karakteristiktir (49). Çoğu vaka akut infeksiyonu asemptomatik geçirdiğinden kronik hepatit B’li hastaların ancak % 40-50’sinde sarılık hikayesi vardır (50).
HBV infeksyonunun kronikleşme olasılığı, virüsün başlıca bulaşma yaşına göre değişir. HBV infeksiyonunun kronikleşme olasılığı enfeksiyonu yenidoğan döneminde perinatal yolla kazanmış olgularda % 90 (51), bir-beş yaş arası çocuklarda horizontal yolla infekte olanlarda % 20-50 (52,53) ve erişkin dönemde infeksiyon kapanlarda % 5-10 kadardır (54). Ayrıca erkek cinsiyette, immun yetersizliği olan hastalar, hemodiyaliz hastaları, homoseksüeller, hemofili hastaları ve down sendromlularda kronikleşme oranı daha yüksektir (55,56).
Kronik hepatit B infeksiyonunda üç klinik faz tanımlanmıştır (57). 1-İmmun tolerans fazı
2-İmmun aktif faz (immun klirens fazı) 3-İnaktif hepatitis B fazı (inaktif faz)
İmmun tolerans fazında klinik ve patolojik değişiklikler az olmasına karşın HBV replikasyonu yüksek orandadır. Bu fazda virüsle infekte hepatosite karşı immun yanıt yeterli olmadığından yüksek miktarda viral replikasyon olmakta ancak karaciğer hasarı oluşmadığından ALT yükselmemektedir. Bu fazda ALT normal, HBeAg pozitif, HBV DNA yüksek titrede pozitif ve karaciğer biyopsisi normaldir (49,58). Perinatal kazanılmış infeksiyonda immun tolerans fazı 10-40 yıl devam edebililirken çocukluk veya erişkinlikte kazanılmış HBV infeksiyonunda bu dönem çok kısa sürer veya hiç görülmez (49).
İmmun klirens fazında HBV’ye karşı konağın immun yanıt geliştirmesiyle ALT yükselmesi ve karaciğerde inflamasyon oluşur. Virüsle infekte hepatositler immun sistem tarafından temizlenir (59,60). Karaciğer hasarı ve ALT yükselmesi sonucu hepatik dekompansasyon gelişebilir. İmmun yanıtın şiddeti arttıkça transaminaz yüksekliğinin ve karaciğer hasrının şiddetinin arttığı söylenebilir (61,62).
İmmun klirens fazının devamında HBeAg serokonversyonu (HBeAg kaybı ve/veya anti HBe oluşması) ve HBV DNA kaybı görülür. HBeAg serokonversyonu olanların %85’inde klinik remisyon (inaktif infeksyon) gelişmektedir (63,64). Bu fazda pre-kor bölge mutasyonu gelişmesi durumunda HBeAg kaybolur ancak viral replikasyon devam ettiği için HBV DNA düzeyi yükselmeye devam eder (bu dönemde gelişen serokonversyon ile karıştırılmamalı). ALT yükselmesinin de eşlik etmesiyle HBeAg negatif kronik hepatit B olarak tanımlanır (49). Tablo-2’de kronik hepatit B’nin klinik fazları görülmektedir (57).
Tablo-2. Kronik hepatit B klinik fazları (57)
FAZ HBeAg/anti HBe durumu HBV DNA ALT düzeyi Karaciğer biyopsi Tedavi endikasyonu İmmun Tolerans
HBeAg+ >20.000IU/mL Normal Normal veya minimal aktivite Hayır İmmun Klirens HBeAg+ veya anti-HBe+
>2.000IU/mL Yüksek Aktif inflamasyon
Evet
İnaktif Faz HBeAg negatif/HBe+
<2.000IU/mL Normal Normal veya minimal aktivite
Hayır
İmmun klirens fazının süresi ve hepatit alevlenme sıklığı ile siroz ve hepatosellüler karsinom gelişmesi arasında ilişki mevcuttur. Hepatit alevlenme sıklığı arttıkça siroz ve hepatosellüler karsinom gelişme riski artmaktadır (65).
Kronik hepatit B hastalarının büyük çoğunluğu asemptomatiktir. Bazı hastalarda halsizlik, yorgunluk, epigastrik ağrı, kas ve eklem ağrıları gibi nonspesifik şikayetler olabilir. Anksiyete başta olmak üzere endişe hali, yoğunlaşmada zorluk, uyku bozuklukları ve depresyon gibi psikiyatrik bozukluklar görülebilir. Bu bulguların hastaların yaşam
kalitesini olumsuz etkilediği mental ve genel sağlık skorlarında normal insanlara kıyasla düşmelere neden olduğu gösterilmiştir. İleri evre karaciğer hastalıklarında saptanan sarılık, örümcek nevüs, splenomegali ve asit gibi bulgularda saptanabilir (49).
Zarf proteinleri olan sferik ve flametöz partiküller ile konak antikorları ile oluşan İmmun kompleksler nedeniyle karaciğer dışı organların tutulmasına bağlı olarak poliarteritis nodoza, vaskülitik raş, glomerulonefrit ve poliartralji oluşabilir (49).
Kronik hepatit B infeksiyonunun prognozunu belirleyen bazı faktörler tanımlanmıştır. Siroz’a gidişi etkileyen kötü prognostik faktörler, infekte kişilerin ileri yaşta olması (E>40,K>50), genotip C ile infekte olması, yüksek HBV DNA replikasyonu olması, alkol alışkanlığı, HCV, HIV veya HDV ile ko-infeksiyon olarak sayılmaktadır. Hepatosellüler karsinoma ilerleyiş için risk faktörleri ise, erkek cinsiyet, ailede hepatosellüler karsinom hikayesi, ileri yaş, anti-HBe kaybı ile HBeAg yeniden oluşması, siroz varlığı, genotip C ile infeksiyon, kor promoter bölge mutasyonu ve HCV ile ko-infeksiyon varlığı sayılabilir.
Sigara kullanımı ve karsinojen olan aflatoksin gibi çevresel faktörlerde kötü prognoza katkı sağlarlar (66).
Kronik hepatit B’li olgularda hastalığın aktivite belirtileri olan aminotransferaz yüksekliği, viral replikasyon göstergesi olan yüksek HBV DNA saptanması hastalık progresyonunu gösterir. Hepatitin progresyonu siroz, portal hipertansyon, asit, özofagus varis kanaması, hepatorenal sendrom ve hepatosellüler karsinom gibi komplikasyolarla sonuçlanabilir. Progresyon gösteren kronik hepatit B olgularının % 15-20’si beş yıl içinde siroza ilerleme,siroz hastalarında % 20’sinde hepatosellüler karsinom gelişir (49).
2.6. HBV İNFEKSYONUNDA TANI YÖNTEMLERİ
Günümüzde HBV tanısında kullanılan serolojik ve moleküler tanı yöntemleri akut infeksiyonun erken tanısı, akut ve kronik infeksiyonun birbirinden ayırt edilmesi ve vireminin kalıcılığının tespit edilmesinde kullanılmaktadırlar. Serolojik yöntemlerden ayrı larak Moleküler tanı yöntemleri serolojik yöntemlerin yetersiz kaldığı durumlarda tanı konulmasında, değişik HBV serolojileri varlığında antiviral tedaviye karar verme ve tedavinin takibinde, mutasyona uğramış HBV mutantlarının araştırılmasında ve hepatosellüler karsinom oluşum mekanizmasının araştırılmasında yaralanılmaktadır (11,67).
Tablo-3. HBV infeksiyonunun farklı dönemlerinde serolojik ve moleküler göstergeler (68) Hepatit B infeksiyonunun evresi HBsAg Anti-HBs HBeAg Anti-HBe Anti-HBc HBV-DNA Akut infeksiyon Erken Dönem + - + - IgM + Pencere Dönemi - - - - IgM +/-Düzelme Dönemi - + - + IgG +/-Kronik İnfeksiyon Replikatif Dönem + - + - IgG, IgM >100.000 Kopya/mL Nonreplikatif inaktif taşıyıcılık dönemi + - - + IgG <100.000 Kopya/mL Reaktivasyon + - +/- - IgM >100.000 Kopya/mL HBeAg(-) Kronik İnfeksiyon (prekor veya mutant + - - + IgG >100.000 Kopya/mL
2.6.1. Serolojik Tanı Yöntemleri
Günümüzde kullanılan serolojik yöntemler, HBV S geni tarafından üretilen HBs antijeni, C geni tarafından üretilen HBe ve HBc antijenleri ve bunlara karşı gelişen antikorların varlığını araştırmaktadır. Bu testlerden, akut ve kronik infeksiyon ayırımında, infektivitenin değerlendirilmesinde, bağışıklık durumunun tayininde, kan ve organ vericilerinin taranmasında yararlanılmaktadır (68).
HBsAg/anti-HBs: Akut HBV infeksiyonunda ilk saptanan antijen HBsAg’dir. Semptomların ortaya çıkmasından üç-beş hafta önce serumda saptanabilir düzeydedir. Semptomlar ortaya çıktığı dönemde kan düzeyi pik yapar ve iki-altı ay içinde azalarak kaybolur. HBs Ag kaybolduktan bir süre sonra koruyucu antikoru olan anti-HBs ortaya çıkar. Anti-HBs genellikle serumda hayat boyu saptanabilir düzeyde kalır. Akut HBV infeksiyonu seyrinde pencere dönemi diye adlandırılan dönem HBsAg’nin kaybolduğu ve
henüz anti-HBs’nin oluşmadığı dönemdir. Akut HBV infeksiyon’undan sonra anti-HBs oluşması iyileşmeyi ve bağışıklığı gösterir. Kronik HBV infeksiyon’unda genellikle anti-HBs negatiftir. Anti-anti-HBs hepatit B aşılaması sonrasında oluşur. Hepatit B immunglobulin verilmesiyle, kan transfüzyonuyla ve anneden bebeğe pasif olarakta aktarılabilmektedir, Ancak pasif olarak aktarılan bu antikorlar birkaç ay gibi kısa bir sürede kaybolurlar (68).
HBsAg’nin altı aydan uzun süre kanda saptanması kronikleşmeyi gösterir. Kanda HBsAg pozitif saptanması iki klinik durumu, akut infeksiyon veya kronik infeksiyonu düşündürür. Aşılama sonrası kısa bir süre için olsa da kanda HBsAg saptanabilir (68).
HBeAg/anti-HBe: Akut infeksiyon seyrinde HBsAg ortaya çıkmasından kısa bir süre sonra HBeAg ortaya çıkmakta ve HBsAg’den öncede kaybolmaktadır. Serumda HBeAg saptanması, bulaşıcılık, infektivite aktif replikasyon göstergesi olarak kabul edilmektedir. HBeAg serumda kaybolmasından sonra anti-HBe antikorları oluşur. Hastaların bir kısmında HBeAg ve anti-HBe çok kısa bir süre aynı anda bulunabilir. Anti-HBe pozitifleşmesi viral replikasyonun azaldığı ve hastalığın iyileşmeye doğru gittiği anlamına gelmektedir. Ancak pre-kor bölge mutasyonu oluşması gibi durumlarda anti-HBe varlığına rağmen viral replikasyon devam etmektedir. Bir diğer farklı durumda HBeAg pozitif olmasına rağmen aktif viral replikasyonun olmaması durumudur (68). HBeag üç-dört aydan uzun süre serumda pozitif saptanması kronikleşmeye gidişi gösterir. Kronik HBV infeksiyon’u seyrinde HBeAg pozitifliğinin sürekli olması ağır karaciğer hastalığı riskini arttırmaktadır (69).
Kronik infeksiyonda HBeAg pozitif olanların serumlarında, anti-HBe pozitif olanların serumlarına göre daha yüksek konsantrasyonda HBV bulunmaktadır. Bu nedenle HBeAg pozitif olan hastaların cinsel, perkütan veya perinatal yolla HBV’yi bulaştırma ihtimalleri çok daha fazladır. Antiviral ilaç tedavisi ile HBeAg kaybı ve anti-HBe oluşması hedeflenmektedir (67,70).
HbcAg/anti-Hbc: HBcAg hızlıca antikoru ile birleştiğinden serumda tespit etmek zordur. Bu sebeple günümüzde serolojik testlerde anti-HBc antikoru kullanılmaktadır. Yeni geliştirilen bir yöntemle HBcAg düzeyi tespit edilebilmektedir ancak günümüzde rutin kullanımda değildir (71). Anti-HBc, HBsAg saptandıktan kısa bir süre sonra ve anti-HBs oluşmadan önce serumda saptanır. İlk saptanan anti-HBc IgM’dir ve infeksiyon başladıktan birkaç hafta sonra pik yaparak ortalama dört-sekiz ay içinde azalarak kaybolur (HBsAg’den daha uzun süre bazen 12 ay serumda saptanabilir). Anti-HBc IgM’in serumda
döneminde saptanabilen tek serolojik gösterge olmasıdır. Ayrıca kronik hepatit B’nin akut alevlenmeleri sırasındada serumda yükselir ama bu yükselmeler akut infeksiyona göre hafif düzeylerdedir. Anti-HBc IgG kişinin HBV ile karşılaştığını göstermekle beraber akut mu kronik mi ayırt edememektedir. Tüm serolojik göstergeler negatif olmasına rağmen Anti-HBc IgG antikorlarının tek başına pozitif saptandığı durumlar: Akut HBV infeksiyonundan iyileşmiş ancak anti-HBs düzeyi saptanamayacak düzeye inmiş olanlar, HBsAg’nin saptanamayacak düzeyde olduğu kronik infeksiyonlular, uzamış pencere dönemi (bu dönem uzayınca anti- HBc IgM antikorları anti-HBc IgG antikorları ile yer değiştirir), yalancı pozitiflik ve kan transfüzyonu sonrası yada anneden antikorların bebeğe pasif olarak aktarılmasıdır (iki-üç ay içinde kaybolur) (68).
Şekil-3. Akut viral hepatit B seyrinde serolojik göstergeler (72).
2.6.2. Moleküler Tanı Yöntemleri
HBV infeksiyonunda farklı moleküler tanı yöntemleri kalitatif ve kantitatif yöntemlerle HBV DNA düzeyini ölçmektedir. Moleküler tanı yöntemlerinin en sık kullanım alanları dört başlık altında toplanabilir (68,73).
-Serolojik tanının yetersiz kaldığı durumlar
HBsAg negatif HBV infeksiyonunun tanısında HBeAg negatif ve anti-HBe pozitif HBV infeksiyonu tanısında (pre-kor mutantlarda görülen durum) Anti-HBs pozitif HBV infeksiyonu tanısında.
-Tedavi etkinliğinin izlenmesi
HBV DNA düzeyinin moleküler yöntemle kantitatif olarak ölçülmesi, antiviral tedavinin etkili olup olmadığını, verilen tedavinin süresini ve dozunu belirlememize, gerektiğinde tedavi protokolünü değiştirmemize yardımcı olur (68,73).
-Antiviral ilaç direncinin saptanması
HBV ilaç direnç testleri; tek veya çoklu mutasyonları saptayan genotipik testler veya ilaç varlığında HBV’nin hücre içerisinde replikasyonunu direk ölçen fenotipik testler ile yapılabilmektedir. HBV direnç tayininin, serum HBV DNA ve ALT düzeyi yükselmeden önce belirlenebileceği gösterilmiştir. İlaç direnci gelişmesiyle hastalığın aktivitesinde artış olacağından, aktivite gelişmeden ilaç direncinin saptanması klinik açıdan önemlidir (68,73).
2.7. KRONİK HBV İNFEKSİYONUNDA TEDAVİ
Kronik HBV infeksiyonunun takibi dikkatli yapılmadığında hastaların üçte birinden fazlasında karaciğer sirozu ve hepatosellüler karsinom gelişebildiğinden ciddi bir hastalıktır (74). Antiviral tedavi kullanımı ve hepatosellüler karsinom için araştırma enstitülerinin kurulmasıyla morbidite ve mortalitede anlamlı azalmalar sağlanabilir (75).
Tedaviye karar verme üç adımda gerçekleştirilebilir. Birinci adımda, HBV infeksiyonlu bireyler tanımlamalıdır, hastaların çoğu ya asemptomatiktir yada hastalıklarının farkında değillerdir. Risk taşıyan gruplarda bu amaçla HBsAg, anti-HBs testleri yapılmalıdır.
İkinci adımda, bu hastaların kronik infeksiyonları HBsAg’nin en az altı ay pozitif olması ile gösterilmeli, Kronik infeksiyon fazı (Tablo-2); karaciğer fonksyon testleri, HBeAg ve anti- HBe gibi serolojik testler ve HBV DNA ölçümü yapılarak tespit edilmeli. Son adımda, kronik HBV infeksiyonu olduğu tespit edilen hastalar sağlık hizmeti sunumu konusunda güvence altına alınmalı, yaşam boyu karaciğer fonksyon testleri, serolojik testler ve HBV DNA düzeyine bakılması sağlanmalıdır. İnfeksiyonun inaktif, reaktif veya unstabil fazına bakılmaksızın her altı ayda bir bakılması tercih edilebilir (75).
Kronik HBV infeksiyon’u olan hastalardan immun tolerans (HBeAg pozitif, HBV DNA>20.000 iü/ml, normal ALT) fazındakiler ile inaktif HBsAg taşıyıcıları (HBsAg pozitif, HBeAg negatif, anti-HBe pozitif, anti-HBc pozitif, normal ALT) tedavi edilmeden 6-12 ay ara ile ALT düzeyleri bakılarak takip edilir. ALT düzeyinde artışlar gözlenirse tedavi açısından değerlendirilir (Tablo-4) (76). İmmun aktif fazdaki (HBV DNA artışı, HBV DNA>2.000 iü/ml, ALT artışı E >30 u/l K >19 u/l, HIV, HDV, HCV ko-infeksiyonu) olan hastalar ve 30 yaşından büyük immun tolerans fazındaki hastalar tedavi için değerlendirmeye alınırlar (Tablo-5) (76).
Table-4. Öncelikle her 6-12 ay da bir takip edilmesi gereken kronik hepatit B’li
30 yaşından küçük immun tolerans fazındaki Hastalar
HBeAg positif
ALT ısrarlı normalliği
İnaktif hepatit B fazındaki hastalar
HBeAg negatif ve anti-HBe pozitif Normal ALT
HBV DNA < 2.000 IU/mL
Table-5. Kronik hepatit B Tedavisinde değerlendirilmesi gereken hastalar (76).
18 yaş üzeri hastalar
Yükselmiş HBV DNA
ALT artışı > 30 U/L erkek, > 19 U/L kadın HBV DNA > 2.000 IU/Ml
HIV, HDV veya HCV ile ko-infeksyon
30 yaşından büyük immun tolerans fazındaki hastalar
Kronik HBV infeksiyonu tedavisinde amaç; siroz, hepatosellüler karsinom ve ölüme gidişi önlemektir. Birinci hedef HBV replikasyonunun baskılanması veya durdurulması ile HBV DNA’nın baskılanmasıdır. Bunun yanında ALT düzeyinin normale dönmesi ve histolojik iyileşme sağlanması da hedeflenmektedir. Uzun dönemde siroz, hepatosellüler karsinom gibi komplikasyonların önlenmesi ile yaşam kalitesinde iyileşme ve yaşam süresinde uzama sağlanmaktadır (77,78).
2.8. KRONİK HBV İNFEKSYONUNDA KULLANILAN İLAÇLAR
Kronik hepatit B tedavisinde kullanılacak ilacın risk yarar profili uygun olmalı, kalıcı etkinlik sağlamalı, toksik etkisi olmamalı veya minimal olmalı, direnç gelişimi minimal olmalıdır (78).
2.8.1. İnterferon Tedavisi
Hepatit B virüs infeksiyonunun kronikleşmesinde nedeni tam olarak aydınlatılmamış bir immun yetersizlik tablosunun olduğu kabul edilmektedir (79).
İnterferon iki mekanizma ile antiviral etki gösterir. Birincisi immun modülatör etkisi ile HBV ile infekte hepatosite karşı hücresel immun yanıtı arttırır. İkincisi direk antiviral etki ile viral DNA sentezini inhibe eder (80).
Yapılan çalışmaların meta analizinde standart interferon üç-altı aylık tedavisi plasebo ile karşılaştırıldığında ortalama virolojik yanıt, ortalama HBeAg kaybı ve HBsAg kayıp oranları anlamlı olarak daha yüksek bulunmuştur (81). Standart interferon, pegile interferonlarla karşılaştırıldığı çalışmalarda pegile interferonların daha avantajlı olduğu gösterilmiştir. Bu nedenle Günümüzde interferon molekülüne polietilen glikol eklenmesiyle (pegilasyon) uzamış plazma ömrüne sahip pegile interferonlar kullanılmaktadır. Klasik interferonlardan farklı olarak pegile interferonların haftada bir kez kullanım kolaylığına sahip olmakla birlikte yan etki açısından bir farklılık saptanmamıştır (73,82,83).
Pegile interferonların en sık görülen yan etkileri; üst solunum yollarında grip benzeri yakınmalar, baş ağrısı, yorgunluk, ciltte lokal reaksiyon, iştahsızlık, bulantı, artralji, myalji, kilo kaybı, emosyonel değişiklikler, depresyon ve hematolojik (lökopeni, nötropeni, trombositopeni) yan etkilerdir. Bu yan etkiler gelişirse doz ayarlaması yapılır veya gerekirseilaç kesilir (84).
Dekompanse karaciğer sirozu olanlarda ciddi infeksiyon ve hepatit alevlenmesi riskinden dolayı önerilmemektedir. Ayrıca immun süpresif hastalarda kontrendikedir (85).
2.8.2. Lamivudin
Kronik HBV infeksyon’u tedavisinde 1998 yılında FDA onayı almış, güvenilirliği ve etkinliği ıspatlanmış bir nükleozid (Sitozin) analoğu olan lamivudin, stoplazmada bulunan enzimler vasıtasıyla fosforillenip yeni yapılmakta olan viral DNA’ya bağlanır. Böylece viral DNA sentezi ile replikasyonu sonlandırır (85,86).
Kronik HBV infeksiyon’unda Lamivudin 100 mg/gün dozunda kullanılır. Kronik böbrek yetersizliğinde doz ayarı gerekir (kreatinin klirensi<50 ml/dk olunca) (85,86).
Lamivudinin plasebo ile karşılaştırıldığı çalışmalarda HBV DNA düzeyindeki azalma, ALT düzeyindeki normalleşme, HBeAg serokonversyonu ve karaciğer histolojisindeki düzelme anlamlı olarak elde edilmiştir (86,87).
HBeAg pozitif hastalarda yapılan çalışmada bir yıllık lamivudin tedavisi ile HBeAg serokonversyonu ve histolojik düzelme anlamlı yüksek değerlerde çıkmış ve HBeAg serokonversyonu tedavi süresiyle orantılı olarak artmıştır (76).
HBeAg negatif hastaların tedavisinde ne kadar süre kullanılacağı net değildir. Yapılan çalışmalar lamivudinin bir yıl kullanımdan sonra hastaların çoğunda HBV DNA’yı baskıladığı, ancak tedavi kesildikten sonra çok yüksek düzeylerde relaps geliştiği görülmüştür. Bu yüzden HBV DNA negatifleşmesi elde edilmesinden sonra altı ay daha lamivudin verilmesi önerilmektedir (76).
Lamivudin ayrıca interferon alfa tedavisine yanıtsız hatalarda, kompanse ve dekompanse sirozu olanlarda güvenle kullanılabilir (76).
Kronik HBV tedavisinde tedavi süresi uzadıkça lamivudine karşı direnç gelişme sıklığının artması lamivudin kullanımını sınırlayan en önemli özelliğidir. Lamivudin direnci en sık HBV polimeraz geninin YMDD motifindeki mutasyon (rtM204V/I) sonucu gelişmektedir (88). Bu mutasyonun sıklığı her geçen yıl artarak dört yılın sonunda % 67’lere kadar ulaştığı görülmüştür (89).
HBV polimeraz geninde YMDD mutasyonu gelişmesi ile lamivudine klinik ve virolojik yanıt azalır (90). Lamivudin direnci hepatit progresyonunda artış, siroz gelişimi, sirozlularda dekompansasyon ve hepatosellüler karsinom gelişmesi gibi klinik kötüleşmeyi arttırır (91,92). Bu amaçla klinik kötüleşme olmadan belirli aralıklarla lamivudin direnç testi yapılması önerilmektedirv(76). Yapılan çalışmalarda HBV DNA’nın ölçülebilir düzeye gelmesi YMDD mutasyonunun ön habercisi olduğu gösterilmiştir (93).
YMDD mutasyonu ile ilişkili olabilecek faktörler: tedavi öncesi BV DNA düzeyi, vücut kitle indeksi, başlangıç ALT düzeyi, başlangıç virolojik yanıtının yetersiz oluşu olarak bulunmuştur (94).
Lamivudin tedavisi genellikle çok iyi tolere edilir, yan etki nedeniyle ilaç kesilmesi rapor edilmemiştir (76). Laktik asidoz ve pankreatit nadirde olsa ilaca bağlı görülebilmektedir (85,86).
2.8.3. Adefovir Dipivoxil
Adefovir dipivoxil adefovirin oral alınabilen bir ön ilacıdır (95). Antiretroviral reverse trankriptaz inhibitörü olan adefovir dipivoxil oral alındıktan sonra gastrointestinal sistemde absorbsiyon süresince ve sonrasında hızlı bir şekilde spesifik olmayan esterazlarla enzimatik hidrolize uğrar ve adefovir oluşur. Hücre içinde fosforilasyon reaksiyonlarına uğrayarak aktif molekül olan adefovir difosfata dönüştürülür. 10 mg/gün tek doz olarak alındığında maximum plazma konsantrasyonuna ortalama 45-100 dk sonra ulaşır. Oral
Adefovir dipivoxil 2002 yılında FDA onayı almış Lamuvidin’e dirençli ve mutant HBV enfeksiyonları da dahil olmak üzere aktif kronik HBV tedavisinde kullanılan bir adenin dinükleotid analoğudur (97-99). Aynı zamanda diğer Hepadnaviruslar, retroviruslar ve Herpes viruslara karşı etkinliği gösterilmiştir (100). Bununla beraber Lamuvidin, Emtrisitabin, Fansiklovir ve anti-HBV Immünglobuline direnci olduğu bilinen tüm HBV virüslerine karşı etkili olduğu gösterilmiştir (101,102).
Adefovir böbreklerden glomerüler filtrasyon ve aktif tübüler sekresyonla değişmeden atılır. Atılmadan önce metabolize olmaz (103). Adefovire bağlı renal toksisite HBV tedavisindeki düşük dozlarda nadir görülürken HIV tedavisinde kullanıldığı yüksek dozlarda nefrotoksisite gelişir (76). Renal toksisitenin şiddeti ve sıklığı tedavi dozu ve süresi ile ilişkilidir (103). Böbrek yetersizliği olanlarda doz ayarlanmasına gidilmelidir. Kreatinin klirensi 20-49 ml/dk arasında iken günaşırı 10 mg, 10-19 ml/dk arasında iken 3 günde bir 10 mg, son dönem böbrek yetmezliği olanlarda haftada bir gün 10 mg önerilir (76). Orta ve ileri karaciğer yetersizliği olanlarda Adefovir farmakokinetiği ile ilgili belirgin bir değişiklik görülmemiştir. Adefovir 12-36 saat arası uzun yarılanma ömrü nedeniyle günde bir kez verilebilir.
Adefovir hem HBeAg pozitif hem de HBeAg negatif kronik HBV de biyokimyasal, virolojik ve histolojik iyileşme sağladığı gösterilmiştir (97,98). Adefovir’le 144 hafta süren uzun dönem tedavide biyokimyasal virolojik ve histolojik cevabın sabit olduğu gösterilmiştir (78). Kronik HBV’li olgularda Adefovirin antiviral etkinliğinin HBV genotipi, HBeAg durumu veya ırktan etkilenmediği gösterilmiştir (104). Bu çalışmada 96. haftaya kadar hiçbir hastada Adefovire direnç gözlenmezken, 96. haftadan sonra sadece 1 hastada direnç saptanmıştır (105).
Kompanse HBeAg negatif kronik HBV li hastaların plasebo kontrollü 48 haftalık tedavi sonrası Adefovir alan hastalarda histolojik, virolojik ve biyokimyasal iyileşme anlamlı olarak daha iyi iken yan etki profili plaseboya benzer bulunmuştur. Bu süreç dahilinde adefovire direnç gelişmemiştir (98). Lamuvidin dirençli Kronik HBV’li hastalarda devam eden Lamuvidin tedavisine Adefovir eklenmesiyle veya Adefovir ile değiştirilmesiyle hastalarda virolojik ve biyokimyasal iyileşme olduğu görülmüştür (106-109).
HBeAg pozitif lamivudine dirençli kompanse karaciğer hastalığı olan hastalarda yapılan bir çalışmada; lamivudine adefovir eklenmesi ile adefovir monoterapisine geçilen grup arasında ortalama HBV DNA düzeyinde düşme, ALT normalleşme oranları e HBeAg
kaybı oranları benzer bulunmuştur (110). Buna bağlı olarak lamivudine direnç gelişen hastalarda tek başına adefovir tedavisin yeterli olduğu ve lamivudine devam etmenin bir faydası olmadığı ileri sürülmüştür (110,111).
Adefovir, lamivudin ve entekavire dirençli olgularda etkilidir. Etkinliği lamivudine kıyasla daha az olmakla beraber direnç gelişimi lamivudinden daha azdır ve daha geç gelişir. Adefovire direnç, HBV DNA polimerazının D domaininin 236. kodonunda N236T ve B domaininin 181. kodonunda A181V mutasyonu gelişmesiyle ilgilidir (76,112). Adefovir lamivudine dirençli kronik HBV infeksiyon’lu karaciğer transplantasyonlu hastalarda, dekompanse karaciğer hastalığı olanlarda ve HIV ko-infeksiyonlularda etkili olduğu ıspatlanmıştır (99,113). Adefovire direnç gelişimi nadirdir (106). Ancak adefovir tedavisi kesildikten sonra yüksek oranda relaps geliştiğini gösteren çalışmaların varlığı nedeniyle tedavinin ne kadar süreceği konusu net değildir (78,128-130).
Şekil-5. Adefovir dipivoksil
Şekil-6. Adenozin monofosfat
yüksek oranda HBV DNA süpresyonuna mükemmel etkili olduğunu göstermiştir (114,115). HBeAg ve HBsAg klirensi diğer nükleozid analogları ile aynıydı. Entekavire antiviral direnç tedavinin bir ve ikinci yılında % 1’den daha az ortaya çıktı (116). Buna karşıt olarak daha önceden lamivudin direnci olanlarda ya entekavir direnci veya hafif yanıt oranları raporlandı (117). Entekavire dirençli HBV türleri adefovire duyarlıdır. Başlangıç raporları HBeAg pozitif ve HBeAg negatif her iki hasta grubunda da iki yıllık entekavir tedavisi ile hastaların % 85’inden fazlasında saptanamayacak düzeyde HBV DNA düzeyi elde edilmiştir (118).
2.8.5. Emtricitabine (L-Fluorocytidine)
Etki gücü ve direnç paterni lamivudine benzeyen bir L-nükleozid analoğudur. Randomize kontrollü çalışmalarda emtricitabine 200 mg/gün dozunda 52 haftalık tedavisi ile HBV DNA saptanamayacak düzeyde saptanan hasta oranları HBeAg pozitif olanlarda % 39 iken HBeAg negatiflerde % 79 idi (karşılaştırıldığında plasebo alıcılarında % 2 idi) (119).
Direnç oranları HBeAg pozitiflerde % 17 iken HBeAg negatiflerde % 3’tü ve direnç paterni lamivudine benzerdi. Bu nedenle emtricitabine ve lamivudinin direnç paternleri ve yanıt oranlarının ikiside benzerdir (118).
2.8.6. Telbivudin (L-Deoxythymidine)
Hücre kültürü ve hayvan modellerinde HBV’ye güçlü etkili bir L-nükleozid analoğudur. Faz II çalışmalarında telbivudin tedavisi HBV DNA’da 5.8-6.5 log10 düzeyinde düşme sağladı (120,121). Devam eden çok merkezli büyük çalışmalarda telbivudin tedavisi ile HBeAg kayıp oranları lamivudin ile karşılaştırıldığında benzerdi (%26 ya karşı%23), fakat telbivudin ile daha yüksek oranda HBV DNA kaybı oldu (%60-%40) (122). Telbivudine direnç oranları lamivudinden daha düşüktü ve sadece rtM204I mutasyonu olmaksızın rtM204V/rtL180M saptandı. Bu nedenle telbivudin lamivudinden daha düşük direnç oranları ve güçlendirilmiş etkili olması olasıdır, fakat direnç oranları kabul edilmiş diğer tedavilerden oldukça yüksektir (118).
2.8.7. Tenofovir Disoproxil Fumarate
HBV ve HIV’in ikisine in vivo ve in vitro güçlü etkili bir asiklik adenin nükleotid analoğudur (123). Tenofovir HIV infeksiyonunda kullanılmak için lisans aldı ve HIV/HBV
co-infeksyonlu hastalarda yaygın olarak değerlendirildi (124-126). Tenofovir adefovirden daha güçlü ve lamivudine dirençli HBV türlerine etkili bir ajan gibi görünmektedir.
Lamivudin direnci olmaksızın HIV ko-infeksyonu ve HBeAg pozitif kronik hepatit B topluluklarında küçük karşılaştırmalı çalışmalar sürmektedir. Tenofovir, lamivudine dirençli ve adefovire yanıt yetersizliği olanlarda kurtarıcı olabilir (127). Bu sonuçlar tenofovirin lamivudine dirençli hastalarda seçilen ilaç olabileceğini ve tipik HBV tedavisinde eninde sonunda adefovirin yerine geçebileceğini ileri sürmektedir. Kronik hepatit B tedavisinde tenofovirin faz III çalışmalarına yeni başlanmıştır (108).
Diğer antiviral ajanlar çalışma aşamasında olan Clevudin ve timisindir (76).
Dicle Üniversitesi Tıp Fakültesi Gastroenteroloji Polikliniğine Ocak 2012 ile Ocak 2013 tarihleri arasında başvuran, ALT ve serum HBV DNA düzeyinden bağımsız olarak non-sirotik HBeAg negatif kronik HBV infeksiyonu olan 111’i erkek, 84’ü kadın toplam 195 hasta prospektif olarak çalışmaya alındı (normal veya yüksek ALT ve düşük veya yüksek serum HBV DNA düzeyi).
Antiviral tedavi alan hastalar, HCV ko-enfeksiyonu, son dönem karaciğer yetmezliği, siroz, hepatosellüler karsinom, otoimmun hastalıklar, immunsupresif tedavi alanlar, şiddetli sistemik hastalıkların varlığı veya multiorgan disfonksiyonu, trombosit düşüklüğüne neden olan ilaç kullanımı, kronik alkol kullanımı (>30 gr/gün), ultarasonografik incelemede ileri düzeyde hepatosteatoz saptananlar, Wilson hastalığı, hemokromatozis, primer bilyer siroz, sklerozan kolanjit, alfa-1 antitrpsin eksikliği, malignitesi bulunan bireyler çalışma dışı bırakılmıştır.
Her 2 grubun yaş, cinsiyet ve BMI gibi demografik özellikleri kaydedildi. Hemoglobin, lökosit, platelet sayısı, protrombin zamanı (PTZ), INR, ALT, AST, ALP, GGT, total bilirubin, albumin, globulin, kreatinin, laktat dehidrogenaz (LDH), HBV DNA, HBsAg, HBeAg, anti-HBe, anti-HBs, alfa feto-protein (AFP) gibi parametreler incelendi.
Tam kan incelemesi Abbott firmasının ARCHITECT C 16000 cihazında Abbott firmasının orijinal kitleri ile çalısıldı. Bu yöntemle hemoglobin, lökosit, platelet normal değerleri sırasıyla 12.2-18.1 g/dl, 4.6-10.20 K/uL ve 142-424 K/uL arasında idi. PTZ ve INR Medistar firmasının CA 7000 cihazında Medistar firmasının orijinal kitleri ile çalısıldı. Bu yöntemle PTZ normal degeri 10-14.5 saniye, INR normal değeri 0.88-1.2 arasında idi.
Biyokimyasal parametrelerden glukoz, ALT, AST, ALP, GGT, total bilirubin, albumin ve globulin Abbott firmasının ARCHITECT C 16000 cihazında Abbott firmasının orijinal kitleri ile çalışıldı. Bu yöntemle glukoz, ALT, AST, ALP, GGT, total bilirubin, albumin, globulin, normal degerleri sırasıyla 70-109 mg/dl, 10-35 U/L 10-40 U/L, 40-150 U/L, 5-55 U/L, 0.2-1 mg/dl, 3.5-5 gr/dl, 2.9-3.3 gr/dl. AFP, Intermed firmasının Immulite 2000 cihazında Intermed firmasının orijinal kitleri ile çalışıldı. Bu yöntemle AFP normal değeri 0.5-5.5 IU/ml arasında idi.
HBsAg (kalitatif), anti-HBs, HBeAg, anti-HBe, anti-HBc IgG, anti-HBc IgM ve anti-HCV incelemeleri MakroEIA yöntemi ile Roche firmasının Cobas e 601 cihazında (ELECSYS 2010, Roche Diagnostics GmbH, D-68298 Mannheim, Germany) Roche firmasının orijinal kitleri ile çalışıldı.
HBV DNA düzeyi COBAS AmpliPrep/COBAS TaqMan HBV Test yöntemi ile çalışıldı (Roche Diagnostics GmbH, D-68298 Mannheim, Germany). Alt sınır: 20 IU/ml Lineer aralık: 20 – 1.7x108 IU/ml, 1 IU/ml = 5.82 copies/ml.
HBsAg düzeyi kantitatif olarak HBsAg 2 QUANT kiti , Roche Cobas 6000 cihazı
E 601 modülü, Electrochemiluminescence yöntemi ile çalışıldı. Anti-HDV total düzeyi, Metkim firmasının Eti-max 3000 cihazında Metkim firmasının orijinal kitleri ile çalışıldı (Enzyme ImmunoAssay (ELISA), DiaSorin S.p.A. Via Crescentino, snc, 13040 Saluggia (VC) Italy). Karaciğer biyopsisinin histopatolojik incelemesinde Ishak’ın Modifiye
Knodell Skorlama sistemi kullanıldı.
Boy ölçümü elastiki olmayan mezura ile ayakta ölçüldü. Ayakkabısız olarak topuktan, tepeye kadar olan mesafe ölçüldü. Vücut ağırlığı klasik baskül ile tayin edildi. Vücut kitle indeksi (VKI, BMI), ağırlığın (kg) boy uzunluğunun (m) karesine oranlanması (kg/m²) ile tespit edildi. Normal VKİ aralığı 18-25 kg/m² olarak alındı. 17.12.2012 tarihli 107 sayı numaralı Dicle Üniversitesi Tıp Fakültesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu onayı alındı.
3.1. İstatistiksel incelemeler
Çalışmada elde edilen verilerin istatistiki değerlendirilmesinde SPSS (Statistical Package for Social Sciences) for Windows 17 paket programı kullanıldı. İstatistiksel olarak aritmetik ortalama, standart sapma, standart hata, minimum, maksimum değerler gibi belirtici istatistikler hesaplandı. Oran ve yüzdeler belirlendi. Frekans dağılımları oluşturuldu. Ölçülebilir sürekli değişkenlerde; 2 grup karşılaştırmalarında tek yönlü varyans analizi kullanıldı. Kategorik değişkenlerin hesaplanmasında Ki-Kare testi kullanıldı.Ölçülebilir sürekli değişkenler arasındaki ilişki ölçümünde, Pearson’un r korelasyon katsayısı ve testi kullanıldı.Anlamlılık düzeyi p<0.05 olarak alındı. P: * 0.05 ** 0.01 ***0.001 önemlilik düzeyi olarak kullanıldı.
Bu tek merkezli prospektif çalışmada HBeAg negatif kronik HBV infeksiyonu olan 195 vaka değerlendirildi. Çalışma grupları tedavi almamış veya son 6 aydır tedavi almayan toplam 195 HBeAg negatif kronik hepatit B virüs infeksiyonlu hastadan oluşturuldu. Hastaların 111’i erkek ve 84’ü kadın idi.
Tablo-6'da inaktif HBsAg taşıyıcı ve HBeAg negatif kronik hepatit B'li hastaların demografik özellikleri, biyokimyasal analizleri ve serolojik sonuçları izlenmektedir. Her 2 grup yaş, cinsiyet ve VKİ açısından karşılaştırıldığında anlamlı bir farklılık izlenmedi. Hemogram incelemesinde hemoglobin düzeyi istatiksel olarak farklılık arzetmezken (p:0,006), trombosit değerinin HBeAg negatif kronik hepatit B'li grupta anlamlı düzeyde düşük olarak saptandı (p=0.04). PTZ değeri her 2 grupta benzer olarak izlendi. Biyokimyasal parametrelerden ALT, AST ve GGT değerlerinin her 3'de anlamlı olacak şekilde HBeAg negatif kronik hepatit B'li grupta yüksek idi (sırasıyla p=0.001, p=0.001 ve p=0.01). ALP, total bilirubin, albumin, globulin, LDH ve kreatinin gibi diğer biyokimyasal parametrelerde istatiksel olarak anlamlı düzeyde farklılık saptanmadı. AFP düzeyi de her 2 grupta benzer idi.
HBsAg düzeyinin kantitatif analizinde, HBeAg negatif kronik hepatit B'li grupta (3.18 log10 IU/mL) inaktifHBsAg taşıyıcılarına (2.72 log10 IU/mL) göre yüksek saptandı (p=0.002) (Tablo 6). Aynı şekilde HBV DNA düzeyi HBeAg negatif kronik hepatit B'li grupta (3,14 log10 IU/mL) inaktifHBsAg taşıyıcılarına (2,20 log10 IU/mL) göre yüksek izlendi (p=0.001) (Tablo 1).Virion başına düşen subviralpartikül oranını gösteren HBsAg/HBV DNA oranı HBeAg negatif kronik hepatit B'li grupta (42.16) ve inaktif HBsAg taşıyıcısı grubunda (64.9) benzer idi (Tablo 6). Gruplar histopatolojik olarak karşılaştırıldığında nekroinflamasyon skoru, HBeAg negatif kronik hepatit B'li grupta yüksek olarak saptandı (p=0.001). Fibrozis skoru ise gruplar arasında anlamlı farklılık göstermemekteydi (p=0,14).
Tablo-6. İnaktif HBsAg taşıyıcısı ve HBeAg negatif kronik hepatit B’li hastaların
Değişken İnaktif HBsAg taşıyıcı HBeAg negatif kronik hepatit B P değeri Yaş 36.66 34.42 0.25 Cinsiyet (E/K) 64/58 47/26 0.10 BMİ (kg/m2) 24.25 23.70 0.70 Hemoglobin(g/dl) 14.35 14.86 0.06 Platelet(K/uL) 257946.67 235862.75 0.04 PTZ (INR) 0.87 0.88 0.84 ALT(U/L) 23.62 58.96 0.001 AST(U/L) 21.67 39.77 0.001 ALP(U/L) 82.14 89.31 0.45 GGT(U/L) 16.68 30.09 0.01 Total bilirubin(mg/dl) 0.21 0.28 0.53 Albumin(gr/dl) 3.84 3.75 0.38 Globulin(gr/dl) 3.12 3.18 0.59 LDH(U/L) 167.70 180.13 0.28 Kreatinin(mg/dl) 0.052 0.147 0.17 AFP(U/L) 2.00 1.86 0.75
HBsAg (log10 IU/mL) 2.72 3.18 0.002
HBV DNA (log10 IU/mL) 2.20 3.34 0.001
HBsAg / HBV DNA 64.90 42.16 0.14
HBsAg, kalitatif 5172.46 4591.65 0.10
HAI grade (Median, range) 3.25 5.88 0.001
HAI stage (Median, range) 1.0 1.5 0.14
İnaktif HBsAg taşıyıcısı ve HBeAg negatif kronik hepatit B’li hastalar ALT düzeyleri normal sınırlarda olanlar (grup 1), normalin 1-2 katı kadar yüksek olanlar (grup 2) ve 2 katından daha yüksek olanlar (grup 3) olarak 3 gruba ayrıldı. Bu 3 grubun demografik özellikleri, biyokimyasal ve serolojik parametreleri ile histopatolojik