BAŞKENT ÜNİVERSİTESİ TIP FAKÜLTESİ
ANESTEZİYOLOJİ ANABİLİM DALI
PEDİYATRİK KALP CERRAHİSİNDE TROMBOELASTOGRAF
KULLANIMI ve STANDART LABORATUVAR TETKİKLERİ İLE
KARŞILAŞTIRILMASI
UZMANLIK TEZİ
Dr. ASIM ESEN
ANKARA
2005
BAŞKENT ÜNİVERSİTESİ TIP FAKÜLTESİ
ANESTEZİYOLOJİ ANABİLİM DALI
PEDİYATRİK KALP CERRAHİSİNDE TROMBOELASTOGRAF
KULLANIMI ve STANDART LABORATUVAR TETKİKLERİ İLE
KARŞILAŞTIRILMASI
UZMANLIK TEZİ
Dr. ASIM ESEN
Tez Danışmanı
Doç. Dr. Elif A. Akpek
ANKARA
2005
ÖZET
Bu çalışmanın amacı, konjenital kalp cerrahisi uygulanan hastaların koagülasyon sistem değişikliklerinin değerlendirilmesinde, (1) tromboelastograf ile standart laboratuvar tetkikleri arasında bir fark olup olmadığını araştırmak, ve (2) siyanotik ve asiyanotik patolojiye sahip hastaların bu farklı yöntemlere nasıl cevap verdiğini incelemektir.
Başkent Üniversitesi Klinik Araştırma ve Etik Kurulu’nun izni ve çocukların ailelerinden onay alındıktan sonra, açık kalp cerrahisi uygulanarak biventriküler düzeltme ameliyatı planlanan ve yaşları 3 ay ile 10 yıl arasında olan 24 çocuk prospektif düzende çalışmaya alındı. Tüm hastalarda anestezi indüksiyon ve idamesi ile kardiyopulmoner bypass ve cerrahi teknikler standart tutuldu.
Standart laboratuvar tetkikleri olarak protrombin zamanı (PTZ), aktive parsiyel tromboplastin zamanı (aPTT), platelet sayısı, fibrinojen ve D-dimer değerleri; tromboelastograf değerlendirilmesi için ise Roteg ile ilk pıhtı başlangıcı (R), pıhtı oluşum zamanı (K), alfa açısı (α), ve maksimum pıhtılaşma (maksimum amplitüd, MA) ölçüldü. Kan örnekleri santral venöz kateterden 3 zaman diliminde yapıldı: (1) indüksiyondan hemen sonra, cerrahi başlamadan önce (t1), (2) ameliyatın sonunda yoğun bakıma
çıkmadan önce (t2), ve (3) yoğun bakımda 24’üncü saat (t3).
Ameliyat sırasında ve sonrasında alınan standart laboratuvar tetkiklerinde platelet sayısında zaman içerisinde hafif bir düşme, PTZ değerlerinde ise normal üzerinde hafif bir artış tespit edildi. Fibrinojen ve aPTT değerlerinde ise önemli bir değişiklik kaydedilmedi. ACT değerleri her iki grupta da normal sınırlarda olmak üzere siyanotik grupta anlamlı şekilde daha düşüktü (p= 0.015). TEG ölçümlerinde ilk pıhtı başlangıcı, pıhtı oluşum zamanı ve alfa açısının EXTEG değerleri siyanotik ve asiyanotik gruplarda anlamlı fark gösterdi. TEG ve standart laboratuvar parametrelerinin hiçbirisinin yoğun bakımda ilk 24 saatlik kanama miktarı ile ilişkileri anlamlı bulunmadı.
TEG ölçümleri ile standart laboratuvar tetkiklerinin karşılaştırılmasında, başlangıç platelet sayılarının hem INTEG hem de EXTEG ölçümlerindeki ilk pıhtı başlangıcı (R), pıhtı oluşumu (K), ve maksimum amplitüd (MA) başlangıç değerleri ile korelasyonu bulundu
(p<0.05, hepsi için). Protrombin zamanı başlangıç değeri ise sadece ilk pıhtı başlangıcı ile ilişkili bulundu. Ameliyat sonundaki ölçümlerin değerlendirmesinde, hiçbir laboratuvar tetkiki ile TEG ölçümleri ilişkili bulunmadı.
Sonuç olarak, açık kalp cerrahisi uygulanan çocukların ameliyat sırasında ve sonrasında yapılan koagülasyon sistem değerlendirmesinde, siyanotik ve asiyanotik çocukların TEG ölçümlerinde, standart laboratuvar tetkikleri ile gösterilemeyen anlamlı değişiklikler kaydedilmiştir.
ABSTRACT
The aim of this study was, (1) to evaluate whether there were differences between the thromboelastrography and standard laboratory test results of congenital heart surgery patients’ coagulation profile, (2) to evaluate the differences in cyanotic and acyanotic patients in this manner.
After the approval of Başkent University Ethics Committee and written consent from the parents of the patients were obtained, 24 patients, ages between 3 months-10 years, who were assigned for biventricular correcting surgery using cardiopulmonary bypass, were included to our study.
Standard laboratory tests included prothrombin time (PT), activated partial thromboplastin time (aPTT), platelet count and fibrinogen and d-dimer values. Thromboelastrography tests included first beginning of the clot formation by Roteg, clot formation time (K), angle of alpha (α), and maximum clotting (maximum amplitude, MA). Blood samples were obtained from the central venous line at 3 different times:
(t1) = immediately after the induction, before the surgery started, (t2) = at the end of the
operation, before transporting to the pediatric cardiac surgery ICU, (t3) = postoperative 24th
hour in the ICU.
The standard laboratory tests’ results during and after the operation, indicated a mild decrease in platelet number and an increase in prothrombin time. There were no significant differences in fibrinogen and aPTT values. Activated clotting time values were in normal ranges in both of the groups however the ACT values of the cyanotic group patients were significantly lower than acyanotic ones (p=0.015). Thromboelastrography measurements were found significantly different for first clot formation, clot formation time and α angle EXTEG degrees between the acyanotic and cyanotic groups. Neither TEG nor the standard laboratory parameters were found related to the drainage amounts in 1st 24 hours in the ICU.
When TEG results and standard laboratory tests were compared, beginning platelet numbers were found to be correlated both for the INTEG and EXTEG measurements for the first clot formation beginning, clot formation time and maximum amplitude (p<0.05, for all). Induction PT values were found to be related only with the 1stclot formation. No correlation was found between the laboratory test results and TEG measurements at the end of the operation.
In conclusion, in children with congenital cardiac anomalies assigned for the open heart surgery, TEG measurement results showed significant differences when compared to standard laboratory tests both during and after the surgery.
İÇİNDEKİLER
Sayfa
İÇ KAPAK ii
ÖZET iii
İNGİLİZCE ÖZET (ABSTRACT) v
İÇİNDEKİLER vii KISALTMALAR ix TABLO DİZİNİ x ŞEKİLLER DİZİNİ xi GİRİŞ 1 GENEL BİLGİLER 2 1. KOAGÜLASYON SİSTEMİ 2 1.1. Primer hemostaz 1.1.a. Vazokonstriksiyon 1.1.b. Trombosit adezyonu 1.1.c. Trombosit agregasyonu 4 4 4 5 1.2. Koagülasyon kaskadı
1.2.a. Koagülasyon faktörleri 1.2.b. Fibrin formasyonu
5 5 7
1.3. Fibrinolizis 8
2. KOAGÜLASYON SİSTEMİNİN DEĞERLENDİRİLMESİNDE KULLANILAN TESTLER
2.1. Kanama zamanı 2.2. Protrombin Zamanı
2.3. Aktive Parsiyel Tromboplastin Zamanı (aPTT)
2.4. Trombin Zamanı (TT) 9 9 9 9 10 10 3. KALP CERRAHİSİNDE KOAGÜLASYON
3.1. Kardiyopulmoner bypass’ ta fibrinolizis 3.2. Kardiyopulmoner bypass’ ta trombositler
10 12 12
3.3. Hipotermi
3.4. Bypass hattının etkisi
13 14 4. TROMBOELASTOGRAFİ 14 HASTALAR ve YÖNTEM 20 BULGULAR 23 TARTIŞMA 32 SONUÇ 35 KAYNAKLAR 36
KISALTMALAR
KPB Kardiyopulmoner bypass
TEG Tromboelastografi TF Doku faktörü (tissue factor) t-PA Doku plazminojen aktivatörü
vWF vonWillebrand faktör
IL Interleukin TNFα Tümör nekroz faktörü- alfa
NO Nitrik oksid
GP Glikoprotein
ACT Activated coagulation time
PTZ Protrombin zamanı
aPTT Aktive parsiyel tromboplastin zamanı
INR International normalization ratio
XC Aortik kros klemp
TDP Taze donmuş plazma
TABLO DİZİNİ
sayfa
Tablo 1. ROTEG® ile değerlendirilen parametreler 16
Tablo 2. Hastaların demografik ve cerrahi özellikleri 24
Tablo 3. Rutin laboratuvar tetkikleri ile değerlendirilen koagülasyon durumu 25
Tablo 4. Tromboelastografi ile elde edilen koagülasyon parametreleri 28
Tablo 5. Hastaların KPB sonrası kanama miktarı ve kan ve TDP transfüzyon
ihtiyaçları
29
Tablo 6. Hastaların kanama miktarı ve kan transfüzyonu ihtiyaçlarının asiyanotik
ve siyanotik hastalarda karşılaştırması
30
ŞEKİLLER DİZİNİ
sayfa
Şekil 1. Klasik koagülasyon kaskadı 7
Şekil 2. Koagülasyon yolları ile ilişkili TEG verileri 17
Şekil 3. Hemostaz kinetiğinin TEG ile değerlendirilmesi 18
Şekil 4. Tromboelastografide tanısal paternler 19
Şekil 5. Tüm hastaların INTEG ile değerlendirilen koagülasyon durumu 26
GİRİŞ
Normal çalışan bir koagülasyon sistemi sağlıklı yaşam için vazgeçilemez bir olgudur. Öyle ki, bir savunma sistemi olarak da adlandırılmaktadır. Herhangi bir sebeple ortaya çıkan kanamanın durdurulması kadar, lezyon yerinde oluşan pıhtının temizlenmesi de önemlidir. Koagülasyon ve fibrinolizis arasında hassas bir denge mevcuttur (1,2).
Hemostazda rol alan ana elemanlar arasında damar duvarı, kan akımı, trombositler, koagülasyon faktörleri ve inhibitörleri, fibrinolizis faktörleri ve inhibitörleri, akut faz proteinleri, fosfolipidler, prostoglandinler ve sitokinler sayılabilir. Bu elemanlar arasında sürekli bir etkileşim mevcuttur. Aynı zamanda, bu elemanların bir çoğu düşük hızda ve sürekli olarak tüketilir ve sentezlenir (1-3).
Genel olarak, cerrahi uygulamalarda hemostazın önemli olmasının yanısıra, pediyatrik kardiyovasküler cerrahi uygulamalarında hemostaz ayrı bir öneme sahiptir. Bu önem başlıca, yaş grubunun gelişimi bakımından tüm vücut sistemlerinde devam etmekte olan bir geçiş dönemi olmasından, uygulamaların doğrudan kalp ve damarlara yönelik olmasından, siyanotik kalp hastalığı varlığından, kardiyopulmoner bypass ve total sirkülatuvar arrest uygulamalarından kaynaklanmaktadır (3,4).
Kardiyovasküler cerrahi sonrası kanamanın kontrol altına alınmasında, standart protokoller ve hastaların klinik durumunun yanısıra, standart laboratuvar tetkikleri ile ölçülen koagülasyon profili dikkate alınan esaslardır.
Planlanan çalışmanın amacı, konjenital kalp cerrahisi uygulanan hastaların koagülasyon sistem değişikliklerinin değerlendirilmesinde, (1) tromboelastograf ile rutin laboratuvar tetkikleri arasında bir fark olup olmadığını araştırmak, ve (2) siyanotik ve asiyanotik patolojiye sahip hastaların bu farklı yöntemlere nasıl cevap verdiğini incelemektir.
GENEL BİLGİLER
1. KOAGÜLASYON SİSTEMİ
Hemostaz, kanamayı durdurmak üzere pıhtı oluşumu ve lizisinin, patolojik pıhtılaşma (tromboz) oluşturmadan kontrollü bir şekilde aktivasyonudur. Bir diğer ifade ile de, kan damarlarındaki tüm sıvıların korunmasını sağlayan dolaşım sistemi özelliğidir. Bu amaçla vasküler faktörler, trombositler, ve koagülasyon proteinleri gibi çok sayıda ve çeşitte komponent rol almaktadır. Bunların bir kısmı dolaşımda çok az miktarda bulunur, çoğu da inaktif formdadır. Bu komponentler, lüzumu halinde depolardan yüksek miktarlarda salınabilir ve hızla sentezlenebilir. Ayrıca, tetikleyici bir faktörle karşılaşıldığında çok kısa bir sürede aktiflenebilirler. Dolaşımda çok küçük konsantrasyonlarda olmaları, bu komponentler arasında önemli bir etkileşim olmasını önler (1,2).
Koagülasyon kabaca üç aşamada gerçekleşir ve sonlanır.
1. Hasar sonrası ilk olarak damar duvarı, trombositler ve bazı plazma proteinlerinin rol aldığı primer hemostaz,
2. Hemen arkasından, dakikalar içinde koagülasyon faktörlerinin işe katılmasıyla oluşan sekonder hemostaz,
3. Yine dakikalar içinde fibrinolizisin başlaması ve saatler içinde de oluşan pıhtının parçalanması.
Kısaca koagülasyona katılan komponentlere göz atacak olursak;
Trombositler, muhtemelen koagülasyonda rol alan en önemli kan hücresi grubudur.
0,3×0,5 µm büyüklüğünde, diskoid şekilli olan bu hücreler esas olarak kemik iliğinde ve yüksek oranda özelleşmiş matür megakaryositlerde yapılır. Biyosentezi, plazmada düşük konsantrasyonlarda bulunan trombopoetin ile indüklenir. Plazmada yaklaşık olarak 150,000-450,000/µlt miktarında bulunur. Trombositlerin üçde ikisi kanda, kalan üçte biri de dalakta depolanmış olarak bulunur. Dolaşım ömrü 7-10 gün arasında değişir.
Hücre iskeleti, aktif olarak hücre şeklini değiştirmeyi sağlayan aktin ve spektrin gibi flamentlerden zengindir.
Normal durumda trombojenik değillerdir. Herhangi bir uyaranla aktifleşmeleri halinde koagülasyonda etkin rol alırlar. Aktiflenmiş trombositlerden çok sayıda sitokin, bazı proteinler ya da düşük molekül ağırlıklı maddeler salıverilir (1,2).
Koagülasyon faktörleri ve bunların inhibitörleri plazma proteinleridir. Primer sentez yerleri
karaciğerdir. Dolaşımda inaktif formda bulunurlar.
Damar duvarı, 3 ana tabakadan oluşur: İntima, media ve adventisya. İntima esas olarak
endotel hücreleri ve bazal membrandan oluşur. Endotel hücreleri, bu hücrelerin lümene bakan yüzeyleri ve bu yüzdeki reseptörler, proteoglikanlar ve enzimler kan ile uyumludur. Ancak IL-1 ve TNFα gibi maddelerle uyarılırlarsa prokoagülan ve antifibrinolitik özellik kazanırlar. Subendotelyum ve bazal membran çok güçlü tromboz uyarıcı dokulardır. Damar duvarına ait bazı hemostatik özellikler arasında, vazokonstriksiyon, vWF üretimi, t-PA üretimi, trombomodulin üretimi, çeşitli proteinler ve hücreler için reseptörleri bulundurmak, NO üretimi, PGI2 üretimi, FX ve FIX aktivasyonu ve bu faktörleri bağlama,
antitrombinin trombomodulin ile bağlanmasını engelleme, trombinin trombomodulin ile bağlanmasını engelleme, vb. gibi etkiler sayılabilir.
Kan akımının yavaş olması trombozla yakından ilişkilidir. Arterlerdeki akım hızı venlere
göre daha yüksektir. Ayrıca lümenin orta kısımlarındaki akım, duvara yakın kısımlardakine göre daha hızlıdır. Orta kısımlarda büyük hücreler daha fazla bulunurken, trombosit gibi küçük hücreler kenarlarda daha fazla bulunur. Bu durum, trombositlerin esas etki alanları olan duvar ile ve endotel üzerindeki glikokaliksle daha yakın olmasını ve daha etkin olmasını sağlar.
Diğer kan hücreleri: Eritrositlerin ve lökositlerin en temel etkileri kan viskozitesi
üzerinden gerçekleşir. Ayrıca, trombositlerin damar duvarına daha yakın olmalarını da sağlarlar. Çeşitli hormonlar, interlökinler, koagülasyon aktivatörleri sekrete ederler. Koagülasyon faktörleri için reseptörler ve doku faktörleri sunarlar. Damarsal yapıların invazyonu ile aterosklerotik plak oluşumuna katkıda bulunurlar.
1.1. Primer Hemostaz
Primer hemostaz, vazokonstriksiyon, trombosit adezyonu, agregasyonu ve şekil değiştirmesini içeren bir dizi olaydan oluşur.
1.1.a. Vazokonstriksiyon
Özellikle küçük damarlarda kan kaybının önlenmesinde etkilidir. Kan damarlarının kasılması otonom sinir sistemi, düz kas hücreleri ve serotonin, epinefrin, norepinefrin gibi bazı mediyatörlerin kompleks etkileşimi ile olur. Vazodilatasyon ise, esas olarak prostaglandinler, özellikle de PGI2 ile ilişkilidir. Vasküler tonusda çeşitli mekanizmalar söz
sahibidir. Bunların en önemlileri renin-anjiyotensin sistemi ve NO aracılı olanlardır.
Vazokonstriksiyon çok hızlı gelişir ve küçük damarlarda kanamanın durdurulmasında etkilidir. Ancak büyük damarlarda yetersiz kalabilir ve olaya başka mekanizmaların, özellikle de trombositlerin katılımı gerekir.
1.1.b. Trombosit adezyonu
Trombositlerin hasarlı kan damarları gibi fizyolojik olmayan yüzeylerle teması halinde oluşan, oldukça kompleks bir olaydır. Kollajenden zengin ekstrasellüler matriks ve subendotelyal yapılar esas rolü oynar. Çeşitli dokularda farklı kollajen tipleri vardır ve hepsinin adezyon uyarıcı etkisi de birbirinden farklıdır. Kollajen ve trombositler arasındaki etkileşim trombosit yüzeyindeki reseptörler ve glikoproteinler aracılığı ile olur. Daha ileri etkileşimlerde vWF ve fibrinojen gibi plazma proteinleri, akım durumu ve sürtünme kuvvetleri de rol alır. Trombositleri aktif hale getiren diğer etkenler arasında trombin, ADP, tromboksan A2, serotonin, epinefrin ve aktive trombositler sayılabilir.
Düşük sürtünme kuvveti etkisi altında, kollajen için primer reseptörler GPIa-IIa, GPVI ve GPIV’dür. Yüksek sürtünme kuvveti altında ise, vWF’e ihtiyaç vardır ve GPIb-IX-V kollajen için gereken reseptörlerdir. Yine GPIIb/IIIa’nın aktivasyonu da kollajen tarafından sağlanır. vWF, megakaryositler, özellikle de endotelyal hücrelerde sentezlenen, plazmanın en büyük glikoproteinlerinden biridir. Ayrıca subendotelyum ve trombosit granülleri de
vWF’den zengindir. Trombositlerin kollajene sıkıca tutunmasını sağlayan vWF, bir tür moleküler tutkal işlevi görür.
1.1.c. Trombosit agregasyonu
Primer hemostazın son safhası trombosit agregasyonu ile sıkı ilişki içindedir. Çeşitli etkenlerle aktif hale gelen trombositler agregasyonu sağlar ve hızlandırır.
Çok önemli bir olay da aktive trombositlerin membranından dolaşıma bırakılan trombojenik mikropartiküllerdir. Bu partiküller koagülasyon faktörleri için ideal bir yüzey oluşturur ve trombin oluşumunu güçlü bir şekilde başlatırlar (1,2,5,6).
1.2. Koagülasyon kaskadı
Daha önce ifade edildiği gibi plazmada, koagülasyon faktörleri ve bunların inhibitörleri de dahil, çok sayıda protein vardır. Bunların etkileşimi çok sıkı kontrol altındadır. Koagülasyon sisteminin aktivasyonu, vücuttaki birçok sistemde olduğu gibi, substratların özel bölgelerinden proteolitik olarak parçalanması ile gerçekleşir (2,7).
1.2.a. Koagülasyon Faktörleri
Yüksek oranda glikozillenmiş bir plazma proteini grubudur. Birçoğu çok düşük konsantrasyonlarda bulunur. Doku faktörü dışındakiler plazmadadır ve aktif hale gelmek için bir proteolitik aktivasyon adımına gereksinim duyarlar.
Bazı koagülasyon faktörleri K vitamini bağımlıdır ve glutamik asit zincirinin modifikasyonu ile sonuçlanan bir dizi enzimatik modifikasyona uğrarlar. Bu durum, tromboembolik olayların profilaksi ve tedavisinde K vitamini antagonistlerinin kullanımına imkan tanır.
Koagülasyon çok düşük seviyelerde sürüp giden bir olaydır. Önemli bir aktivasyon olmaması halinde hemostaz etkilenmez. Koagülasyon sisteminin aktiflenmesinde iki önemli yol vardır:
1- Doku faktörü ile aktivasyon: Ekstrinsik yol
2- Fizyolojik olmayan yüzeylerle temas: İntirinsik yol
Bu iki yol tek başlarına tamamlanmaz ve kaskadın FX adımında birleşirler. Bundan sonraki adımlar ortaktır.
Ekstrinsik yol: Koagülasyonun fizyolojik aktivasyonu neredeyse tamamen doku faktörü
(tissue factor, TF) yolu ile gerçekleşir. Doku faktörü bir membran proteinidir ve genellikle endotel yüzeyi, lökositler ve plazmada yeterli miktarda bulunmaz. Buna karşın, subendotelyal doku TF’den zengindir. Aterosklerotik plaklar ve monositler, lipopolisakkaritler ve IL- 1 ile uyarıldıktan sonra TF üretebilir (1,2,8).
Doku faktörü intrasellüler, transmembran ve ekstrasellüler zincirlerden ibarettir. Hücrelerin hasarı ya da stimülasyonu ile yeniden sentezlenebilir. Sentezin fizyolojik uyarıcıları arasında IL- 1, TNFα, trombin, C5a gibi birçok sitokin vardır (8).
TF ve FVII’nin teması, bir aktif kompleks oluşumuna yol açar. Bu kompleks de FX’u aktive eder. Fosfolipidlerin ve kalsiyum iyonlarının bulunması halinde olay daha etkindir (8).
Gerçekte bu sistem daha komplekstir. Sisteme, proteaz inhibitörleri ile pozitif ve negatif
feedback reaksiyonları da dahildir. FVIII, FIX ve FXI’in rolleri hakkında da son
zamanlarda yeniden birçok araştırma yapılmıştır.
İntrinsik yol: Kanın yapay yüzeylerle teması, özellikle yüzeyler negatif yüklüyse, bazı
proteinlerin kompleks etkileşimini tetikler. Biyolojik yüzeylerdeki negatif yükleri membran yapılarından olan sülfatidler oluşturur. Bunlar herhangi bir hasar durumunda kana bırakılır. Kesin olmamakla birlikte bu sürecin başlamasına, endotel kaynaklı sistein proteaz da katılabilir. Bu olaylar koagülasyonun kontakt fazını oluşturur (1,2,9).
Kontakt faz pozitif feedback reaksiyonları ile karakterizedir. Kallikreinin aktive ettiği FXIIa’nın varlığında, yüksek molekül ağırlıklı kininojenin etkisiyle prekellikreinden kallikrein oluşur. Yine kallikreinle aktive olan FXIIa, FXI’i aktive eder. FXI, tek başına koagülasyon faktörü olarak adlandırılabilecek bir proteindir. Eksikliğinde (Hemofili C)
bazen orta şiddette bazen de daha şiddetli kanamalar ortaya çıkabilir. FXIa FIX’u, FIXa’ da FX’u aktive eder. Kaskaddaki tüm adımlar kalsiyuma gereksinim duyar ve fosfolipid bağımlıdır (1).
Kontakt aktivasyon nonfizyolojik yüzeylerle temas durumunda çok önemli rol oynar. Kardiyopulmoner bypass’da bu etkileşim, bir proteaz inhibitörü olan aprotininle etkin bir şekilde engellenebilir.
Şekil 1. Klasik koagülasyon kaskadı
1.2.b. Fibrin formasyonu
Koagülasyon kaskadının son fazı fibrin oluşumudur. Fibrinojen büyük, multimerik bir plazma proteinidir. Yapısındaki α, β ve γ zincirleri birbirine disülfit bağlarıyla bağlanmıştır. Fibrinojenin trombinle fibrinopeptid A ve B olarak adlandırılan parçalara ayrılmasıyla ‘eriyebilir fibrin’ oluşur. Fibrinojendeki bu önemli yapısal değişiklik polimerizasyonu başlatır. Belirli bir moleküler büyüklüğe ulaşıldığında fibrinin
eriyebilirliği önemli derecede azalır. Bu durum, ağ şeklinde, erimesi güç bir polimer oluşumu ile sonuçlanır ve pıhtı yapımı gerçekleşir (1,2,7).
FXIII plazmada fibrinojene bağlıdır. Trombinin etkisi sonrasında, neredeyse eş zamanlı olarak, kalsiyum bağımlı bir reaksiyonla aktive olur. FXIIIa fibrin monomerleri arasında çapraz bağ oluşmasını sağlar. Ayrıca pıhtı ile başka bazı proteinler arasında da çapraz bağ oluşmasını sağlar.
Pıhtının gücü ve stabilitesi, yani fiziksel özellikleri, hemostaz işindeki temel fonksiyon olan kanamayı mekanik olarak engelleyebilme kapasitesini belirler. Pıhtı aslında bir zarar kontrol aracı olarak, damar hasarının düzelmesi sürerken yavaşça eriyen geçici bir durdurucudur.
1.3. Fibrinolizis
Fibrinolizis sistemi pıhtı lizisinden sorumludur. Ancak kollajen yıkımı, anjiogenezis, tümör metastazı ve matriks metalloproteazların proteolitik kaskadı da bu sistem içinde yer alır. Fibrinolizis, koagülasyon sistemi ile bazı benzerliklere sahiptir. Faktörler ve inhibitörleri, onları oluşturan parçalar açısından homologdur ve moleküler değişim esnasındaki prekürsörleri ortaktır. Fibrinolizis sistemi de bazı proenzimlerin aktivasyonu için ön basamaklara ihtiyaç duyar. Kofaktör fonksiyonları önemli rol oynar. Sistemdeki esas enzim plazminojendir. Plazminojenin iki önemli aktivatörü t-PA (doku plazminojen aktivatörü) ve u-PA (ürokinaz plazminojen aktivatörü) dır. Her iki aktivatör de prekürsördür ve proteolitik bir aktivasyon gerekir (1).
Plazminojen fibrine afinitesi olan bir moleküldür. Spesifik lizin bağlayıcı bölgeler aracılığıyla fibrine sıkıca bağlıdır. Doku plazminojen aktivatörünü (t-PA) endotel hücreleri sentezler ve dolaşıma salar. Staz veya fibrin formasyonu gibi uyaranlar t-PA’ nın sentez ve salıverilmesini artırır. Doku plazminojen aktivatörünü de fibrine güçlü afinite gösterir. Fibrin bir kofaktör gibi davranarak t-PA ile plazminojenin proteolitik ayrılmasına yardım eder. Fibrin, özellikle de kısmen yıkılmış fibrin t-PA aracılı plazminojen aktivasyonunu artırır. Plazminojen fibrine bağlanır ve bu durum otoproteolitik olarak plazmine dönüşümüne katkıda bulunur (1,2,10,11).
Plazmin nispeten spesifik değildir, ancak güçlü bir enzimdir. Fibrin ağını parçalar ve farklı büyüklüklerde fibrin yıkım ürünleri oluşturur. Bu ürünlerden en küçüğü d-dimer’dir ve tanısal önemi vardır.
Ürokinaz plazminojen aktivatörü ile olan fibrinolizis aktivasyonu, fibrinolizisteki ikinci yoldur. u-PA plazmada proürokinaz şeklinde bulunur. Çok düşük konsantrasyonlardadır. Tek zincirli olan bu proürokinaz, aktivasyon sonrası çift zincirli u-PA halini alır. Aktivasyonda FXIIa, kallikrein ve plazmin rol alır (1).
2. KOAGÜLASYON SİSTEMİNİN DEĞERLENDİRİLMESİNDE KULLANILAN TESTLER
Normal hemostatik mekanizma kan damarlarının kasılması, trombosit tıkacı oluşumu ve koagülasyonu içerir. Koagülasyon bozukluklarını değerlendirmede PT, PTT, TT ve kanama zamanı yardımcı olur. Bunların yanında trombosit sayısı ve periferik yaymada kullanılır.
2.1. Kanama Zamanı
Küçük ve yüzeyel kesilerde koagülasyonun sağlanması bir trombosit tıkacı oluşmasına bağlıdır. Bu nedenle bu tür kesilerde kanamanın durma zamanı koagülasyonun vasküler ve trombositlerle ilgili aşamalarının değerlendirilmesine yardımcı olur.
Ön kola standart bir insizyon yapılır. Venöz staz oluşturmak için, kola bağlanan tansiyon aleti manşonu 40 mmHg’ya kadar şişirilir. Her 30 sn’de bir kanamanın durup durmadığı kontrol edilir (1). (Ivy yöntemi)
2.2. Protrombin Zamanı
Protrombin zamanı koagülasyon sisteminin ekstrinsik yolunu değerlendirmek için yaygın bir şekilde kullanılmaktadır. Genellikle preoperatif dönemde kullanılan antikoagülanların etkisini değerlendirmek için kullanılır. Protrombin zamanı ile faktör VII, X, V, II ve I değerlendirilir. Ayrıca K vitamini defisiti, karaciğer hastalığı ve pıhtılaşma faktörlerine karşı gelişen antikorların varlığında da PT uzar (1).
2.3. Aktive Parsiyel Tromboplastin Zamanı (aPTT)
Koagülasyon sisteminin intrinsik yolunun değerlendirilmesi yanında heparin ve benzeri antikoagülanların etkilerinin değerlendirilmesinde de kullanılır. ‘Parsiyel Tromboplastin’ in anlamı, kullanılan ayıracın doku faktörü içermemesi, sadece fosfolipid içermesindendir. Hemofili A ve B nispeten daha sık görülen hastalıklar olduğundan aPTT PT’ ye göre daha önemli kabul edilir (1).
2.4. Trombin Zamanı (TT)
Trombin zamanı yada trombin pıhtılaşma zamanı fibrinojen/fibrin polimerizasyonunu gösteren basit bir testtir. Trombinin plazmaya eklenmesinin fibrin oluşumuna sebep olmasına dayanır.
Ayrıca plazmadaki heparin içinde kalitatif bir testtir. Eğer plazmada heparin varsa, heparin-AT III kompleksi eklenen trombinin bir kısmını nötralize edecektir ve pıhtılaşma zamanı uzayacaktır. Uzama, plazmadaki fibrin yıkım ürünlerinin fazla olması halinde de olur. Oral antikoagülanlar ise testi etkilemez (1).
3. KALP CERRAHİSİNDE KOAGÜLASYON
Kardiyopulmoner bypass (KPB), 50 yılı aşkın bir süredir kalp cerrahisinde rutin olarak kullanılmaktadır. Kalp cerrahisi sonrasında hastaların ~% 20’ si kanar ve % 2-6’ sı kanama nedeniyle tekrar ameliyata alınır (12,13). Kanayan hastaların yaklaşık yarısı cerrahi nedenlerle kanarken geriye kalan kısmı da koagülopatilere bağlı olarak kanar. Cerrahi tekniklerdeki gelişmelere ve kullanılan malzemelerdeki iyileşmelere rağmen kan ve kan ürünü transfüzyonu hala önemli miktarlardadır. Bu durum hasta profilinin değişmesine bağlı olabilir. Çünkü artık, daha komplike cerrahi işlemler daha yaşlı ve genel durumu daha bozuk hastalara uygulanmaktadır.
Kanama nedeniyle ameliyata alınmak, morbidite ve mortaliteyi olumsuz etkileyen güçlü ve bağımsız bir risk faktörüdür. Bu hastalarda, operatif mortalite, akut respiratuar distres sendromu, uzamış mekanik ventilasyon, sepsis ve atriyal aritmiler özellikle artmıştır (14,15). Ek olarak, tekrarlayan ameliyatlar ve artan kan transfüzyonu, kan ile geçen hastalıklar ve yara enfeksiyonu riskini de artırır (16).
Kardiyopulmoner bypass hattındaki yabancı yüzeylerle kanın teması hemostatik ve inflamatuar sistemde yoğun bir aktivasyona sebep olur. Kan ile yabancı yüzeylerin temasının devam etmesi, normal hemostatik cevabın abartılı olmasına, buna bağlı olarakta, fibrinolitik sistemin aktivasyonunda olduğu gibi koagülasyon faktörlerinin ve trombositlerin tüketilmesine yol açar. Sistemik heparin kullanımı koagülasyon sisteminin aktivasyonunu tam olarak önleyemez.Yabancı yüzeyle kanın temasının yanında, hemodilüsyon, hipotermi, mekanik travma, preoperatif dönemde kullanılan bazı ilaçların hemostatik etkileri ve hastaların mevcut yandaş hastalıkları perioperatif koagülasyon anormalliklerini etkiler (2).
Kan yabancı yüzeyle temas ettiğinde, kan proteinleri hızlıca yabancı yüzeye yapışırlar. Bu proteinler arasında FXII, FVII, vWF, fibrinojen, yüksek molekül ağırlıklı kininojen (HMWK), IgG, albumin, fibronektin ve Hb bulunur (17-20). Yakın zamana kadar, FXII yoluyla intrinsik yolun aktivasyonunun, koagülasyon sisteminin aktivasyonunda major yol olduğu düşünülüyordu. Ancak yapılan bazı çalışmalarda intrinsik yolda hafif, ekstrensek yolda ciddi aktivasyon olduğu görüldü ve KPB esnasında koagülasyonu tetikleyen esas yolun TF/FVIIa yoluyla ekstrensek yol olduğu sonucuna varıldı (21,22). Endotelyal hücreler ve monositler TF yolunun aktivasyonunda major rol oynar (23). İn vitro çalışmalar göstermiştir ki, TNF, IL-1 ve lipopolisakkarit gibi inflamatuar mediatörler endotel hücreleri ve monositler üzerinde TF sunumunu indüklerler (24,25).
Kardiyopulmoner bypass’ ın başlamasıyla F II, V, VII, IX, X ve XIII’ ün plazma konsantrasyonları azalır. F V’ deki azalma olması beklenenden daha fazladır. Ancak bu azalmaya rağmen hala koagülasyon için gereken miktarlardadır. Tüm koagülasyon faktörleri KPB’ tan sonraki 12 saat içinde normal seviyelerine gelirler (26).
3.1. Kardiyopulmoner bypass’ ta fibrinolizis
Kardiyopulmoner bypass’ ta fibrinolitik yanıt heterojen ve multifaktöryeldir (27). Kardiyopulmoner bypass esnasında gelişen yaygın mikrovasküler koagülasyon ve trombin üretimi fibrinolizisin aktivasyonu ile, bu da plazminojenin üretiminde ve plazmine dönüşümünde artışla sonuçlanır. Fibrinolitik aktivite KPB esnasında belirgin olarak artar ve bypass’ın sonlanmasından kısa bir süre sonra normale döner (28). Pompa, oksijenatör, kardiyopleji solüsyonu (yüksek potasyum, düşük ısı) ve ameliyat sahasından aspire edilen kan fibrinolizis’ in aktivasyonunda rol oynarlar (29-32).
Fibrinolizis, endotel hücrelerinin aktivasyonu ve t-PA salıvermeleri ile de aktiflenebilir (33). Kardiyopulmoner bypass’ ın başlamasıyla t-PA seviyesi’ de artar ve en yüksek seviyesine 30’ uncu dakikada ulaşır. Sonra yavaş yavaş azalır. Protamin verilmesinden sonra bir artış daha olur. Doku plazminojeni aktivatörü’nün yükselmesiyle aynı zamanda plazminojen aktivatör inhibitörü 1 (PAİ 1) seviyeleri de azalır. Ancak cerrahinin sonlanmasından sonra artar. Plazminojen aktivatör inhibitörü 1’ deki bu postoperatif artış, arteryel trombüs, greft tıkanması, derin ven trombozu, strok ve miyokard infarktüsü riskinde artışla birliktelik gösterir
3.2. Kardiyopulmoner bypass’ ta trombositler
Kardiyopulmoner bypass’ ta trombositlerin sayı ve fonksiyonu olumsuz etkilenir. Trombositopeni esas olarak prime solüsyonu ile dilüsyona bağlıdır (26). Kardiyopulmoner
bypass’ ın başlamasından kısa bir süre sonra preoperatif değerin % 50’ sine kadar düşer
(26,34). Halloway ve ark.’ nın yaptığı çalışmada trombositopeni’ nin derecesinin hemodilüsyonun yapabileceğinden daha fazla olduğu görülmüştür (35). Diğer muhtemel trombositopeni sebepleri arasında yabancı yüzeylere adezyon, mekanik hasar ve organ sekestrasyonu sayılabilir (36). Düşük trombosit sayısı ameliyattan sonraki birkaç gün sürer. Artış trombosit turnover’ına bağlıdır.
Kardiyopulmoner bypass’ ın indüklediği bir çok hemostatik anormallik olmasına rağmen, cerrahi nedenlere bağlı olmayan postoperatif kanamanın ana sebebinin, önceden var olmayan trombosit disfonksiyonuna bağlı olduğu düşünülmektedir. Kanama zamanı KPB’
ın başlamasından kısa bir süre sonra uzar ve bypass boyunca daha da artar. Protamin verilmesinden sonra azalır ve yaklaşık 4 saat içinde normale döner (26,37). Trombosit disfonksiyonu yabancı yüzeylerle temasa, adezyonun geçici aktivasyonuna ve tüketime bağlı gibi görünmektedir (26,38,39). Trombositlerin adenozin difosfat (ADP) yada kollojenle uyarılan agregasyonu da bozulmuştur (26,37).
Kardiyopulmoner bypass, trombosit reseptör defekti de oluşturmaktadır. Kardiyopulmoner
bypass’ tan sonra trombositlerin agregasyonunu ve aktivasyonunu ilgilendiren yapısal
değişiklikler olur (38). Trombositlerin aktivasyonu ile trombosit membranında glikoprotein bağlayan bölgeler ortaya çıkar.Bu bölgeler hücreler arası etkileşimde rol oynar (36). vWF’ de bağlayan membran proteini glikoprotein Ib (GP Ib), KPB’ ın en geç ikinci saatinde azalır (40,41). Glikoprotein Ib’ deki azalma, trombosit aktivasyonunun büyüklüğü ile korelasyon gösterir(41,42). Fibrinojen bağlayan GP IIb/IIIa’ nın da azaldığı bildirilmiştir(41,43). Trombosit agregasyonu ile ilişkili olan GP IV’ de hipotermik KPB sırasında azalır. Ancak bu azalma diğerleri kadar belirgin değildir(36).
Trombositler aktiflendiğinde granüller hücre yüzeyine doğru hareket eder ve içlerindeki adezyon ve agregasyon için önemli çok sayıda maddeyi salıverir(26,34,44). α granüller, trombosit faktör 4 (PF4), β trombogflobulin ve vWF salıverir(26). Bypass yada hipotermi esnasında kanama zamanı ile artmış PF4 ve β tromboglobulin arasında ilişki olduğu gösterilmiştir(26).
3.3. Hipotermi
Birçok merkez genel organ koruması için KPB esnasında hipotermi kullanır. Ancak hipotermi hem trombositlerde hemde koagülasyon faktörlerinde disfonksiyon oluşturur(45-51). Normotermi ile karşılaştırıldığında hipotermi, trombosit sayısını ve agregasyonunu azaltır. Ayrıca hipotermi AT III’ ü artırır, FXa inhibitörünü artırır, koagülasyon faktörlerinin aktivasyonunu yavaşlatır, fibrinolizisi artırır, endotelyal TF salıverilmesini artırır ve protein C ve S seviyelerini azaltır(47-51).
3.4. Bypass hattının etkisi
Çeşitli komponentlerden oluşan bypass hattıda trombositlerin tahribine yol açar(52). Oksijenatörler gaz değişimi için geniş bir hava-kan yüzeyine sahiptir. Bypass’ ın bir saatten uzun sürmesi halinde membran oksijenatörler bubble oksijenatörlere göre, trombosit sayı ve fonksiyonu ile diğer kan komponentlerinin korunması açısından daha iyidirler(37,53). Cerrahi sahadaki kanın aspirasyonu esnasında oluşan türbülans ve travma sonucu trombositlerin sayısı ve yüzey proteinleri azalır(36).
4. TROMBOELASTOGRAFİ
Tromboelastografi (TEG) Hartert tarafından 1948’de geliştirilmiştir. Standart laboratuvar testlerine alternatif arayışlar nedeni ile 1970-80’lerde koagülasyon laboratuvarlarında kullanımı yaygınlaşmıştır. Son zamanlarda ameliyat sırasında kaogülasyon durumunun değerlendirilmesinde altın standart olarak kabul edilmektedir (54).
Klasik tromboelastografın çalışma prensibi, hareket eden bir küvet içerisine yerleştirilen kanın fizyolojik olmayan bir yüzey ile temasına bağlı aktive olan koagülasyonunun oluşturduğu elastisite değişikliğinin bir sensör aracılığı ile tespit edilmesine dayanır. Klasik TEG nispeten uzun sürede (30-60 dak) sonuç verir, potansiyel hemostaz bozukluklarını ayırt edemez, genel bir değerlendirme sağlar ve heparinize hastalarda iyi yanıt vermez. Oysa ki, akut ve birden fazla kanama problemi olan hastaların sonuçları hiçbir zaman izole bozukluklarda olduğu gibi spesifik reaksiyon paternleri göstermez. Hemostatik bozukluğun ayırıcı tanısına yönelik bir yaklaşımın, spesifik tedavi için kanıt ve uygulanan tedavinin değerlendirilmesini sağlayacağı düşüncesi ile modifiye edilmiş TEG yöntemleri geliştirilmiştir. Bu amaçla, aktivatör veya inhibitörlerin eklenmesi ile ayırıcı tanıda heparin etkisini (heparinaz eklenmesi ile), pıhtı güçlenmesinde platelet ve fibrinojen katkısını (ReoPro eklenmesi ile), ve hiperfibrinolizin tanısını (aprotinin eklenmesi ile) değerlendirmek mümkün olmuştur. Aynı zamanda reaksiyon süreleri kısaltılabilmiştir(54,55).
Rotasyon tromboelastografi (ROTEG®) pıhtılaşma bozukluklarının lokalizasyonunda ayırıcı tanı sağlayan bir yöntemdir. Temel çalışma prensibi ise, sabit bir küvet içerisindeki kanın pıhtılaşma veya lizisine bağlı olarak oluşturduğu tork değişikliğinin küvet içindeki rotasyon gösteren bir aks ve buna bağlı sensör tarafından algılanmasına dayanır. ROTEG® ile değerlendirilen parametreler Tablo 1’de sunulmuştur(54).
Tablo1. ROTEG® ile değerlendirilen parametreler
Test Prensip Tanısal bilgi
EXTEG Doku faktörü ile
aktivasyon
Tarama testi:
Platelet fonksiyonu ve plazmatik koagülasyon, fibrin polimerizasyon, heparine hassas değil
INTEG İntrinsik koagülasyon
aktivatörü ile aktivasyon
Tarama testi:
Platelet fonksiyonu ve plazmatik koagülasyon, fibrin polimerizasyonu. Heparin, LMWH ve hirudine hassas
APTEG Aprotinin varlığında
doku faktörü aktivasyonu
Hiperfibrinoliz teyidi:
EXTEG ile birlikte kullanılır. EXTEG ile
karşılaştırıldığında APTEG’in kısmi veya tam olarak normale dönmesi devam eden hiperfibrinolizi işaret eder.
HEPTEG Heparinaz varlığında
intrinsik aktivasyon
Heparinin teyid edilmesi:
INTEG ile birlikte kullanılır. INTEG ile
karşılaştırıldığında HEPTEG’in kısmi veya tam olarak normale dönmesi heparin (veya LMWH) varlığını işaret eder.
FIBTEG GP IIb/IIIa inhibitörü
varlığında doku faktörü aktivasyonu
Fibrinojen/ platelet ayırt edilmesi, fibrin polimerizasyon bozuklukları:
GP IIb/IIIa inhibitörü pıhtıda platelet katkısını bloke eder. Oluşan pıhtı sadece fibrinojen ile indüklenir.
ECATEG Ekarin aktivasyonu Hirudin veya diğer trombin inhibitörlerinin tayini:
Hirudin ve diğer direkt trombin inhibitörleri ile bozulma gösteren pıhtılaşmanın son fazına hassastır.
NATEG Genel değerlendirme
(sadece
rekalsifikasyon)
Tarama testi:
Platelet fonksiyonu ve plazmatik koagülasyon, fibrin polimerizasyon, heparine, LMWH veya hirudine hassas.
INTEG, genel tarama amacı ile, tedavi izleminde ve HEPTEG ile birlikte kullanılır. Normal dışı sonuçları, ciddi intrinsik koagülasyon faktör(ler) eksikliklerini; heparin, LMWH, hirudin ve diğer antikoagulanları; platelet fonksiyon defektlerini ve hiperfibrinolizi işaret eder. Kullanımını sınırlayan noktalar olarak, von Willebrand faktör ve/veya koagülasyon faktörlerinin hafif eksikliklerine; aspirin, tiklopidin, klopidogrel, veya GP Ib defektine bağlı gelişen hafif platelet fonksiyon defektlerine karşı hassas değildir.
EXTEG de, yine genel tarama amacı ile, tedavinin izleminde ve FIBTEG veya APTEG ile birlikte kullanılır. Normal dışı sonuçları, ciddi ekstrinsik koagülasyon faktör(ler) eksikliklerini; yüksek konsantrasyonda heparin, LMWH, hirudin ve diğer antikoagulanları; platelet fonksiyon defektlerini ve hiperfibrinolizi işaret eder. Koagülasyon faktörlerinin hafif eksikliklerine (ör. kumadine bağlı gelişen INR 2.5 sınırları) karşı hassas değildir.
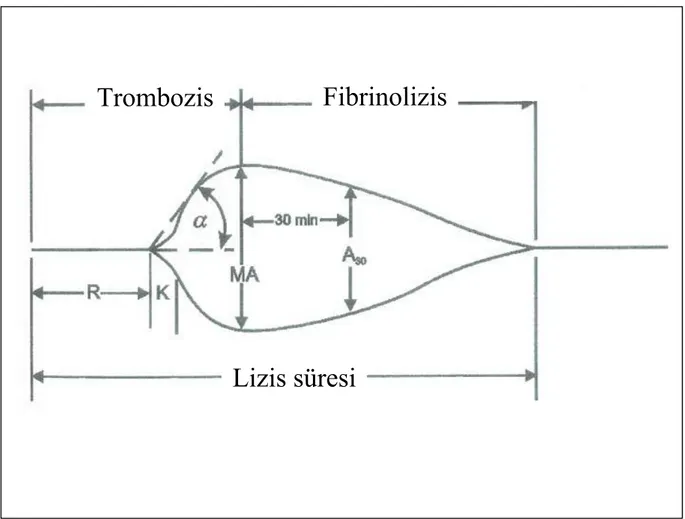
Şekil 3. Hemostaz kinetiğinin TEG ile değerlendirilmesi
R = İlk pıhtı başlangıcı: Kanın TEG içine yerleştirilmesinden ilk fibrin oluşumu gözlenene kadar geçen süreyi ölçer.
α = Alfa açısı: Fibrin oluşumunun hızını (kinetiğini) ölçer. Pıhtının kuvvetlenme süresini işaret eder.
K = Pıhtı oluşum zamanı: Belli bir kuvvette pıhtı oluşması için geçen süre.
MA = Maksimum amplitüd: Fibrinin maksimum dinamik özelliklerinin ve plateletlerin GPIIb/IIIa aracılığı ile bağlanmasının direkt fonksiyonudur; fibrin pıhtının en son kuvvetini yansıtır.
LY30 = Maksimum amplitüd’den 30 dakika sonra amplitüddeki azalma hızını ölçer. Bu ölçüm pıhtının stabilitesini işaret eder.
Fibrinolizis
Trombozis
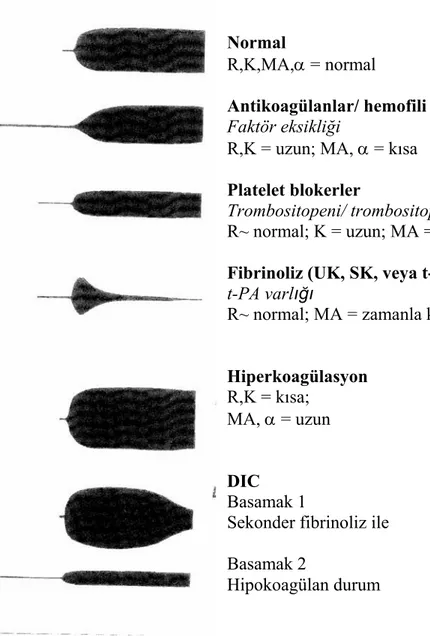
Tromboelastografinin uygulama alanları karaciğer transplantasyonu, kardiyovasküler cerrahi, kalp destek sistemleri, perkütan translüminal koroner anjiyoplasti (PTCA), travma, obstetrik, yoğun bakım ve ortopedik cerrahi olarak sayılabilir. TEG ölçümü ile koagülasyon basamaklarının ilişkisi Şekil 2’de gösterilmiştir. Sağlıklı bir hastada izlenen normal hemostaz sürecinin kinetiği TEG ölçümüne standart bir şekil olarak yansımaktadır (Şekil 3). Bu standart şekil, değişik koagülasyon bozuklukları varlığında farklı durumda kendini göstermektedir. Normal TEG şeklinin değişiklik gösterdiği noktası hemostaz sürecinin hangi basamağında bozukluk olduğunu işaret etmektedir (Şekil 4). Ancak, birden çok faktörün etkisine bağlı olarak gelişen koagülopati durumlarında bu şeklin yorumu ve dolayısıyle tanı koymak zorlaşabilmektedir(54,55,56).
Şekil 4. Tromboelastografide tanısal paternler Normal
R,K,MA,α = normal
Antikoagülanlar/ hemofili Faktör eksikliği
R,K = uzun; MA, α = kısa
Platelet blokerler
Trombositopeni/ trombositopati
R~ normal; K = uzun; MA = kısa
Fibrinoliz (UK, SK, veya t-PA) t-PA varlığı
R~ normal; MA = zamanla kısalır
Hiperkoagülasyon
R,K = kısa; MA, α = uzun
DIC
Basamak 1
Sekonder fibrinoliz ile Basamak 2
HASTALAR VE YÖNTEM
Başkent Üniversitesi Klinik Araştırma ve Etik Kurulu’nun 26.04.2005 tarih ve KA05/90 no’lu izni ve çocukların ailelerinden onay alındıktan sonra, açık kalp cerrahisi uygulanarak biventriküler düzeltme ameliyatı planlanan ve yaşları 3 ay ile 10 yıl arasında olan 24 çocuk prospektif düzende çalışmaya alındı. Ameliyat öncesi dönemde kritik durumda olan (mekanik ventilasyon veya inotrop ihtiyacı ile tanımlandı), son hafta içinde herhangi bir enfeksiyon nedeni ile antibiyotik tedavisi alan, önceden kardiyak cerrahi geçiren, antifibrinolitik ajan uygulanan, intraoperatif ultrafiltrasyon ve/veya sirkulatuvar arrest planlanan hastalar çalışmaya alınmadı ve ameliyat sonrası dönemde de cerrahi kanama nedeni ile revizyona alınan, yüksek inotrop ihtiyacı (> 10 mcg/kg/dk) gösteren hastalar çalışma dışında bırakıldı.
Ameliyattan önce hastalara 6 saat süreyle katı gıdalar ve 3 saat süreyle berrak sıvılar verilmedi. Premedikasyon için tüm hastalara ameliyattan bir saat önce midazolam (Dormicum) 0.5 mg/kg p.o. ve hidroksizin (Atarax®) 1 mg/kg p.o. verildi.
Hastalar ameliyathane odasına alındıktan sonra rutin iki kanallı EKG (DII, V5), nabız oksimetresi ve non-invaziv kan basıncı ölçümü ile monitörizasyon yapıldı. Tüm hastalarda anestezi indüksiyonu için intravenöz yolu önceden sağlanmış olan hastalarda IV ketamin 1 mg/kg ve fentanil 10 mµ/kg, damar yolu olmayan hastalarda ise %2-8 sevofluranı (Sevorane) takiben intravenöz yol sağlanarak aynı şekilde IV ketamin 1 mg/kg ve fentanil 10 mµ/kg uygulandı. Endotrakeal entübasyonun sağlanması için IV panküronyum (Pavulon) 0.15 mg/kg verildi ve ameliyat sırasında gerektiğinde tekrarlandı. Hastalar entübasyondan sonra ameliyat süresince O2/hava %40-100 karışımı ile end-tidal CO2
değerleri 32-40 mmHg olacak şekilde ventile edildi. Direkt kan basıncı monitörizasyonu için arteriyel kanülasyon ile santral venöz basınç takibi ve kan örneklerinin alınması için sağ internal juguler ven kanülasyonu gerçekleştirildi. İntraoperatif vücut sıcaklığı takibi rektal ve nazofaringeal problar aracılığı ile yapıldı. Anestezi idamesinde izofluran (Forane®) %0.5 ve IV fentanil 20 mµ/kg/saat infüzyonu uygulandı. Bütün hastalar intraoperatif dönemde renal dozda dopamin (2 mµ/kg/dakika) infüzyonu aldı. Hastaların
intraoperatif idame sıvı gereksinimleri, kan şekeri takipleri yapılarak Isolyte® ile karşılandı.
Tüm hastalarda kardiyopulmoner bypass ve cerrahi teknik standart tutuldu. Kardiyopulmoner bypass (KPB)’tan önce sistemik antikoagülasyon için heparin 3 mg/kg verilerek ACT (Activated coagulation time) > 400 saniye olacak şekilde ayarlandı. Pompa başlangıç solüsyonu hematokrit %28-30 olacak şekilde laktatlı ringer, taze tam kan ve/veya taze donmuş plazma (prime solüsyonu ≅ 700-800 mL) ve heparin, furosemid, potasyum ve sodyum bikarbonat kullanılarak hazırlandı. KPB başlangıcında tüm hastalara metilprednizolon 10 mg/kg, midazolam (Dormicum) ve panküronyum (Pavulon) 0.15 mg/kg uygulandı. Soğuma ve ısınma dönemlerinde nitroprussid sodyum (Nipruss®) infüzyonu uygulandı. Eksternal (su blanketi) ve internal (KPB) soğutma kullanılarak sistemik hipotermi sağlandı. Miyokard korunması için soğuk potasyumlu kardiyoplejik solüsyon (20 mL/kg) ve topikal soğutma yöntemleri uygulandı. Hiçbir hastada ultrafiltrasyon, cell-saver gibi kan koruyucu yöntemler, lökosit azaltıcı teknikler veya antifibrinolitik ajanlar kullanılmadı. KPB sırasında sistemik perfüzyonun yeterliliği idrar çıkışı ve arteriyel kan gazları ile takip edildi. KPB süresince hematokrit değerlerini %25-30 arasında korumak için gerektikçe kan eklendi. Cerrahi tamiri takiben, yeterli vücut sıcaklığı (36-370C), hemodinamik stabilite ve hemostaz sağlandıktan sonra KPB’a son verildi ve heparinin etkisi protamin kullanılarak antagonize edildi. Protamin dozu KPB süresince uygulanan toplam heparin dozunun 2 katı olacak şekilde ayarlandı. Kontrol ACT değeri, başlangıç değerinin %10 üzerinde gelirse verilen toplam protamin dozunun 1/5’i tekrarlanması planlandı. Ameliyatın sonunda hastalar pediyatrik kardiyovasküler yoğun bakım ünitesine nakledildi.
İntraoperatif sıvı ve kan gereksinimi santral venöz basıncın takibi, arteriyel kan gazı değerleri ve kanama miktarına göre anesteziyolog tarafından düzenlendi. Kan ürünleri tranfüzyonu için tam kan ve/veya taze donmuş plazma tercih edildi.
Ameliyat sonrası yoğun bakıma alınan tüm hastalar pediyatrik kardiyolog, kardiyovasküler cerrah ve hemşirelerden oluşan bir ekip tarafından takip edildi. Hastaların sıvı takibi ve kan ürünlerinin uygulanması aynı ekip tarafından belirlendi; rutin yoğun bakım protokolleri, klinik durum, arteriyel kan gazları ve laboratuvar tetkik sonuçlarına göre karar verildi.
Analjezi/sedasyon, ventilatör ayarları ve ekstübasyon kararı da aynı şekilde yoğun bakım ekibinin takibine ve sorumluluğuna bırakıldı.
Çalışmanın amacı olan koagülasyon durumunun değerlendirilmesi santral venöz kateterden 3 zaman diliminde alınan kan örnekleri ile yapıldı:
1. İndüksiyondan hemen sonra, cerrahi başlamadan önce (t1),
2. Ameliyatın sonunda yoğun bakıma çıkmadan önce (t2),
3. Yoğun bakımda 24’üncü saat (t3)
Standart laboratuvar tetkikleri olarak protrombin zamanı (PTZ), aktive parsiyel tromboplastin zamanı (aPTT), platelet sayısı, fibrinojen ve d-dimer değerleri takip edildi. Tromboelastografi için Roteg (Pentapharm GmbH, Muenchen) kullanıldı. Tromboelastograf değerleri olarak ilk pıhtı başlangıcı (R), pıhtı oluşum zamanı (K), alfa açısı (α), ve maksimum pıhtılaşma (maksimum amplitüd, MA) ölçüldü. Eş zamanlı olarak arteriyel kan gazı değerlendirmeleri yapıldı. Ameliyat süresince ve ameliyat sonrası ilk 24 saat yoğun bakımda sıvı takibi, kanama miktarı, verilen kan ve kan ürünlerinin miktarı kaydedildi. İnotropik destek, ekstübasyon, yoğun bakım ve taburculuk süreleri not edildi. İstatistiksel değerlendirmelerde Windows için SPSS 10.0 programı (SPSS Inc., Chicago, IL) kullanıldı. Gruplar arası karşılaştırmada Mann Whitney-U test, ölçüm zamanları arasındaki karşılaştırmalarda Friedman ve Wilcoxon testleri, oranların karşılaştırılması için de ki-kare testi kullanıldı. Standart laboratuvar tetkiklerinin TEG ölçümleri ile ilişkisi Pearson korelasyon testi ile değerlendirildi. Veriler ortalama ± SD olarak sunuldu. p < 0.05 değerleri istatistiksel olarak anlamlı kabul edildi.
BULGULAR
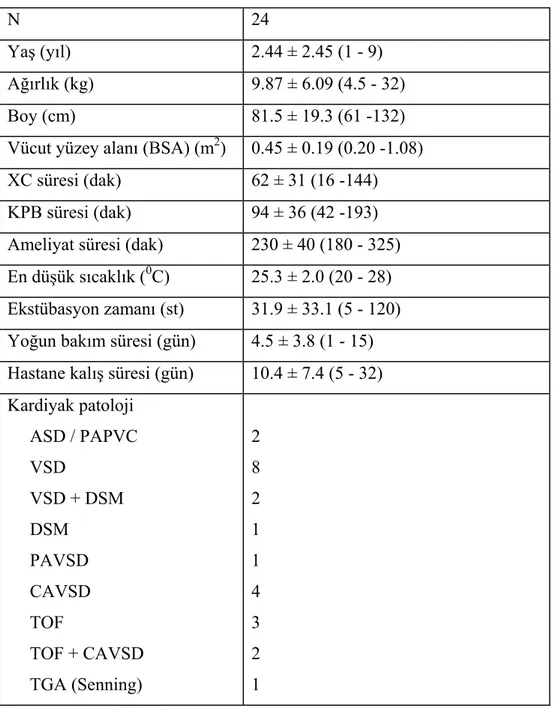
Tüm hastaların demografik özellikleri Tablo 2’de sunulmuştur. Kardiyak patolojiye göre karşılaştırıldığında altı siyanotik ve 18 asiyanotik çocuk çalışma dahilinde idi. Eşlik eden hastalıklar bakımından, komplet atriyoventriküler defekt (CAVSD) tanısı olan bir hastada Down sendromu ve Morgagni hernisi birlikte mevcuttu. Demografik özellikler bakımından siyanotik ve asiyanotik hastalarıda fark bulunmadı. Sadece KPB sırasındaki en düşük sıcaklık siyanotik grupta daha düşüktü (23.3 ± 2.0 vs. 26.1 ± 1.3, p= 0.006).
Ameliyat sırasında ve sonrasında alınan rutin laboratuvar tetkiklerinin sonuçları Tablo 3’de verilmiştir. Zaman içerisinde platelet sayısında hafif bir düşme, PTZ değerlerinde ise normal üzerinde hafif bir artış tespit edildi. Fibrinojen ve aPTT değerlerinde ise önemli bir değişiklik kaydedilmedi. ACT değerleri her iki grupta da normal sınırlarda olmak üzere siyanotik grupta anlamlı şekilde daha düşüktü (p= 0.015). Hemoglobin ve hematokrit değerleri de siyanotik grupta daha yüksekti (p=0.001 ve p<0.001, sırası ile).
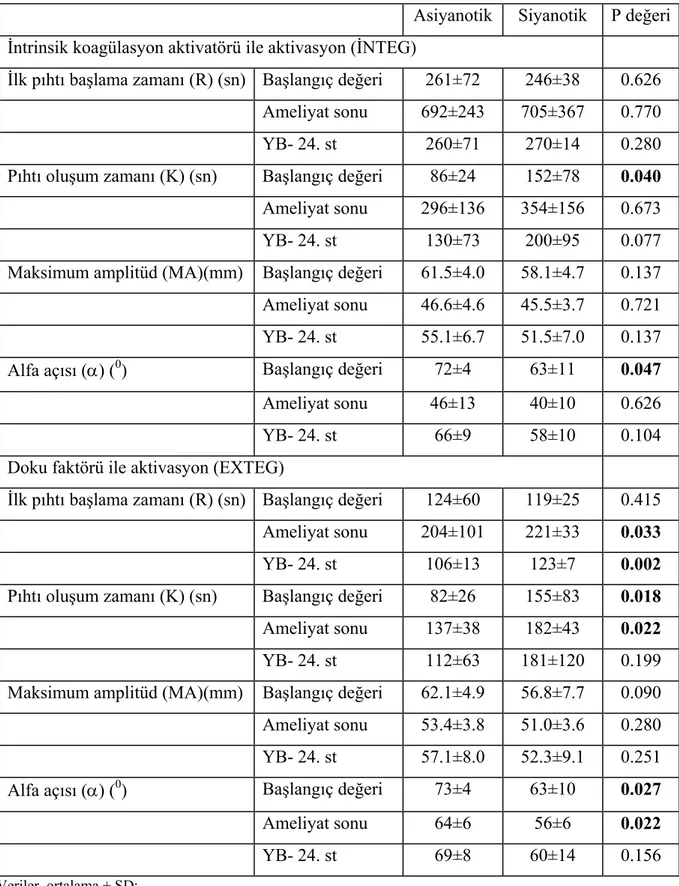
Ameliyat sırasında ve sonrasında hastaların tamamı için TEG değerlendirmesinde kaydedilen değişiklikler Şekil 5 ve 6’da gösterilmiştir. İlk pıhtı başlangıcı, hem INTEG hem de EXTEG’de tüm ölçüm zamanlarında uzun bulundu. Pıhtı oluşum zamanı, maksimum amplitüd ve alfa açısı, EXTEG’in tüm ölçümlerinde ve INTEG’in yoğun bakımdaki 24-st ölçümünde normal sınırlarda iken, INTEG’in ameliyat sonu ölçümü yüksek pıhtı oluşum zamanı ile düşük maksimum amplitüd ve alfa açısı gösterdi. TEG değerlerinin siyanotik ve asiyanotik hastalardaki karşılaştırmaları ise Tablo 4’da sunulmuştur.
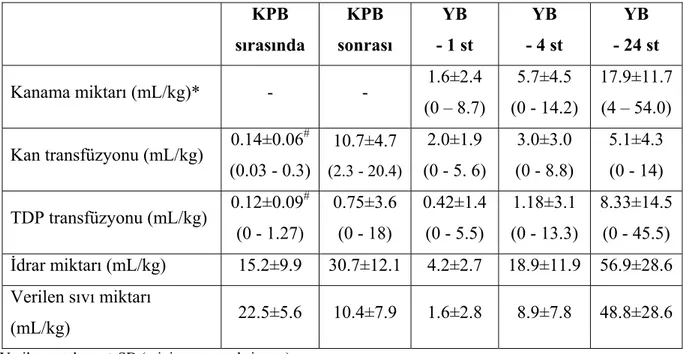
Hastaların ameliyat sonrası yoğun bakımda ilk 24 saat kaydedilen kanama miktarı ve uygulanan kan ve TDP transfüzyon miktarları ile birlikte Tablo 5’de, kardiyak patolojilerine göre (asiyanotik vs. siyanotik) karşılaştırmaları ise Tablo 6’da gösterilmiştir. Kanama miktarı asiyanotik ve siyanotik hastalarda hiçbir dönemde farklı bulunmadı. Tüm hastalara pompaya uygulanan ortalama kan miktarı 0.14±0.06 ünite ve TDP miktarı ise 0.12±0.09 ünite idi. Pompaya uygulanan TDP miktarı siyanotik grupta anlamlı olarak daha fazla idi (p=0.015). Ameliyat sırasında KPB’dan çıktıktan sonra uygulanan ortalama kan transfüzyonu miktarı 10.7±4.7 mL/kg idi ve asiyanotik/siyanotik grupta bu miktar farklı bulunmadı (p>0.05). Hiçbir hastaya perioperatif platelet solüsyonu verilmedi. Ameliyat
sonrası yoğun bakım izleminde asiyanotik ve siyanotik gruplar arasında 24 saatlik kan transfüzyonu miktarı (p=0.04) ve 24 saatlik TDP transfüzyon miktarı (p<0.001) bakımından fark bulundu.
Tablo 2. Hastaların demografik ve cerrahi özellikleri
N 24
Yaş (yıl) 2.44 ± 2.45 (1 - 9)
Ağırlık (kg) 9.87 ± 6.09 (4.5 - 32)
Boy (cm) 81.5 ± 19.3 (61 -132)
Vücut yüzey alanı (BSA) (m2) 0.45 ± 0.19 (0.20 -1.08)
XC süresi (dak) 62 ± 31 (16 -144)
KPB süresi (dak) 94 ± 36 (42 -193) Ameliyat süresi (dak) 230 ± 40 (180 - 325) En düşük sıcaklık (0C) 25.3 ± 2.0 (20 - 28) Ekstübasyon zamanı (st) 31.9 ± 33.1 (5 - 120) Yoğun bakım süresi (gün) 4.5 ± 3.8 (1 - 15) Hastane kalış süresi (gün) 10.4 ± 7.4 (5 - 32) Kardiyak patoloji ASD / PAPVC VSD VSD + DSM DSM PAVSD CAVSD TOF TOF + CAVSD TGA (Senning) 2 8 2 1 1 4 3 2 1
Veriler, ortalama ± SD (minimum- maksimum).
BSA = Body surface area; XC = Aorta klempi; KPB = Kardiyopulmoner bypass; ASD = Atriyal septal defekt; PAPVC = Parsiyel anormal pulmoner venöz dönüş; VSD = Ventriküler septal defekt; DSM =
Discrete subaortik membran; PAVSD = Parsiyel atrioventriküler septal defekt; CAVSD = Komplet
atrioventriküler septal defekt; TOF = Fallot Tetralojisi; TGA = Büyük arterlerin transpozisyonu (Transposition of the great arteries).
Tablo 3. Rutin laboratuvar tetkikleri ile değerlendirilen koagülasyon durumu
Asiyanotik Siyanotik P değeri
ACT (sn) Başlangıç değeri 112 ± 17 94 ± 7 0.015
Ameliyat sonu 137 ± 14 137 ± 16 0.919
PTZ (sn) Başlangıç değeri 15.5 ± 3.6 15.1 ± 1.4 0.759
Ameliyat sonu 17.3 ± 1.1 16.4 ± 1.3 0.177
YB- 24 st 16.8 ± 2.3 16.4 ± 1.9 0.974
aPTT (sn) Başlangıç değeri 38.4 ± 17.2 35.5 ± 8.3 0.431
Ameliyat sonu 33.4 ± 4.5 34.0 ± 4.8 0.871
YB- 24 st 31.6 ± 2.9 30.8 ± 3.0 0.494
INR Başlangıç değeri 1.3 ± 0.5 1.2 ± 0.2 0.859
Ameliyat sonu 1.5 ± 0.1 1.3 ± 0.1 0.052
YB- 24 st 1.3 ± 0.1 1.3 ± 0.2 0.768
Platelet sayısı (K/µL) Başlangıç değeri 296 ± 69 209 ± 100 0.087
Ameliyat sonu 122 ± 22 203 ± 214 0.923
YB- 24 st 138 ± 50 96 ± 61 0.251
Fibrinojen (mg/dL) Başlangıç değeri 217 ± 54 257 ± 71 0.117
Ameliyat sonu 227 ± 128 214 ± 28 0.343
YB- 24 st 352 ± 93 320 ± 64 0.454
D-dimer (µg/mL) Başlangıç değeri 0.46 ± 0.37 1.2 ± 1.0 0.052
Ameliyat sonu 1.41 ± 0.99 1.2 ± 0.9 0.494
YB- 24 st 3.65 ± 3.35 4.4 ± 5.6 1.000
Hb (g/dL) Başlangıç değeri 10.4 ± 1.1 14.7 ± 2.8 0.001
Ameliyat sonu 12.1 ± 1.1 12.4 ± 1.1 0.673
YB- 24 st 12.3 ± 1.1 14.1 ±1.3 0.015
Hematokrit (%) Başlangıç değeri 31.4 ± 3.4 47.0 ± 8.4 0.022
Ameliyat sonu 36.4 ± 3.4 37.9 ± 4.5 0.415
YB- 24 st 36.9 ± 3.4 43.1 ± 4.2 0.002
Veriler, ortalama ± SD.
ACT = Activated coagulation time; PTZ = Protrombin zamanı; aPTT = Aktive parsiyel tromboplastin zamanı; Hb = Hemoglobin; INR = International normalization ratio
İlk pıhtı başlangıcı (R) T3 T2 T1 1400 1200 1000 800 600 400 200 0 5 17 21 Pıhtı oluşum zamanı (K) T3 T2 T1 700 600 500 400 300 200 100 0 18 21 3 4 Alfa Açısı T3 T2 T1 90 80 70 60 50 40 30 20 18 21 4
Maksimum amplitüd (MA)
T3 T2 T1 80 70 60 50 40 30 18 21 17 4
İlk pıhtı başlangıcı (R) T3 T2 T1 700 600 500 400 300 200 100 0 14 5 14 15 Pıhtı oluşum zamanı (K) T3 T2 T1 500 400 300 200 100 0 17 21 18 17 3 4 Alfa açısı T3 T2 T1 90 80 70 60 50 40 30 17 21 18 3 4
Maksimum amplitüd (MA)
T3 T2 T1 80 70 60 50 40 30 18 21 17 4
Tablo 4. Tromboelastografi ile elde edilen koagülasyon parametreleri
Asiyanotik Siyanotik P değeri
İntrinsik koagülasyon aktivatörü ile aktivasyon (İNTEG) İlk pıhtı başlama zamanı (R) (sn) Başlangıç değeri 261±72 246±38 0.626
Ameliyat sonu 692±243 705±367 0.770
YB- 24. st 260±71 270±14 0.280
Pıhtı oluşum zamanı (K) (sn) Başlangıç değeri 86±24 152±78 0.040
Ameliyat sonu 296±136 354±156 0.673
YB- 24. st 130±73 200±95 0.077
Maksimum amplitüd (MA)(mm) Başlangıç değeri 61.5±4.0 58.1±4.7 0.137
Ameliyat sonu 46.6±4.6 45.5±3.7 0.721
YB- 24. st 55.1±6.7 51.5±7.0 0.137
Alfa açısı (α) (0) Başlangıç değeri 72±4 63±11 0.047
Ameliyat sonu 46±13 40±10 0.626
YB- 24. st 66±9 58±10 0.104
Doku faktörü ile aktivasyon (EXTEG)
İlk pıhtı başlama zamanı (R) (sn) Başlangıç değeri 124±60 119±25 0.415
Ameliyat sonu 204±101 221±33 0.033
YB- 24. st 106±13 123±7 0.002
Pıhtı oluşum zamanı (K) (sn) Başlangıç değeri 82±26 155±83 0.018
Ameliyat sonu 137±38 182±43 0.022
YB- 24. st 112±63 181±120 0.199
Maksimum amplitüd (MA)(mm) Başlangıç değeri 62.1±4.9 56.8±7.7 0.090
Ameliyat sonu 53.4±3.8 51.0±3.6 0.280
YB- 24. st 57.1±8.0 52.3±9.1 0.251
Alfa açısı (α) (0) Başlangıç değeri 73±4 63±10 0.027
Ameliyat sonu 64±6 56±6 0.022
YB- 24. st 69±8 60±14 0.156
Veriler, ortalama ± SD; YB = Yoğun bakım
Tablo 5. Hastaların KPB sonrası kanama miktarı ve kan ve TDP transfüzyonu ihtiyaçları KPB sırasında KPB sonrası YB - 1 st YB - 4 st YB - 24 st Kanama miktarı (mL/kg)* - - 1.6±2.4 (0 – 8.7) 5.7±4.5 (0 - 14.2) 17.9±11.7 (4 – 54.0) Kan transfüzyonu (mL/kg) 0.14±0.06 # (0.03 - 0.3) 10.7±4.7 (2.3 - 20.4) 2.0±1.9 (0 - 5. 6) 3.0±3.0 (0 - 8.8) 5.1±4.3 (0 - 14) TDP transfüzyonu (mL/kg) 0.12±0.09 # (0 - 1.27) 0.75±3.6 (0 - 18) 0.42±1.4 (0 - 5.5) 1.18±3.1 (0 - 13.3) 8.33±14.5 (0 - 45.5) İdrar miktarı (mL/kg) 15.2±9.9 30.7±12.1 4.2±2.7 18.9±11.9 56.9±28.6 Verilen sıvı miktarı (mL/kg) 22.5±5.6 10.4±7.9 1.6±2.8 8.9±7.8 48.8±28.6
Veriler, ortalama ± SD (minimum – maksimum).
KPB = Kardiyopulmoner bypass; YB = Yoğun bakım; TDP = Taze donmuş plazma. * KPB sırasında ve ameliyat sırasında kanama miktarı hesaplanmadı
# KPB sırasında kan ürünleri transfüzyonu ünite/kg olarak hesaplandı
TEG ve standart laboratuvar parametrelerinin hiçbirisinin yoğun bakımda ilk 24 saatlik kanama miktarı ile ilişkileri anlamlı bulunmadı. TEG ölçümleri ile standart laboratuvar tetkiklerinin karşılaştırılmasında, başlangıç platelet sayılarının hem INTEG hem de EXTEG ölçümlerindeki ilk pıhtı başlangıcı (R), pıhtı oluşumu (K), ve maksimum amplitüd (MA) başlangıç değerleri ile korelasyonu bulundu (p<0.05, hepsi için). Protrombin zamanı başlangıç değeri ise sadece ilk pıhtı başlangıcı ile ilişkili bulundu. Başlangıç aPTT değerinin hiçbir TEG ölçümü ile korelasyonu bulunmadı. Ameliyat sonundaki ölçümlerin değerlendirmesinde, hiçbir laboratuvar tetkiki ile TEG ölçümleri ilişkili bulunmadı.
Hastaların arteriyel kan gazı değerleri ve sıvı/elektrolit takipleri de Tablo 7’de gösterilmiştir. Siyanotik ve asiyanotik hastalar karşılaştırıldığında, siyanotik grupta başlangıç ölçümlerindeki pH (7.30±0.10 vs. 7.45±0.05, p=0.009), pO2 (48±14 vs. 190±25 mmHg, p= 0.000), baz açığı (-7.1±2.2 vs. -1.5±2.6, p=0.001) ve oksijen satürasyonu (% 75±12 vs. 98±1, p=0.000) değerlerinin düşük olduğu gözlendi. Hiçbir hastada ameliyat sırasında ve sonrasında elektrolit bozukluğu, idrar problemi ve/veya diyaliz ihtiyacı olmadı. Hiçbir hastada ultrafiltrasyon ve diğer kan koruyucu yöntemler kullanılmadı.
Ameliyat sırasındaki kritik olaylar olarak, bir hastada ritm bozukluğu nedeni ile kardiyoversiyon ihtiyacı ve başka bir hasta da KPB’a başlamadan hemen önce desatürasyon kaydedildi, takiplerinde hemodinamik ve ek sorun gelişmedi. Ameliyattan sonra, 3 hasta ekstübasyon sonrasında değişik nedenler ile solunum arresti olup reentübasyon ihtiyacı gösterdi, takiplerinde ek sorun olmadı ve taburcu edildiler. Cerrahi sebep veya kanamaya bağlı re-eksplorasyona alınan hasta olmadı. Çalışma süresince VSD tanısı ile ameliyata alınan bir hasta (%2.5) pulmoner hipertansif kriz nedeni ile kaybedildi.
Tablo 6. Hastaların kanama miktarı ve kan transfüzyonu ihtiyaçlarının asiyanotik ve
siyanotik hastalarda karşılaştırması
Asiyanotik Siyanotik P değeri
Kanama miktarı (mL/kg) YB- 1 st 1.7±2.3 1.5±2.6 0.444
YB- 4 st 5.4±4.0 6.3±5.8 0.968
YB- 24 st 18.7±12.2 15.9±11.1 0.519
Kan transfüzyonu (mL/kg) YB- 1 st 1.7±1.9 2.8±1.6 0.251
YB- 4 st 2.2±2.9 5.3±2.1 0.040 YB- 24 st 4.5±4.6 6.7±3.0 0.343 TDP transfüzyonu (mL/kg) YB- 1 st 0.5±1.6 0 0.708 YB- 4 st 0.8±1.9 2.2±5.4 0.923 YB- 24 st 3.3±10.7 23.4±14.9 <0.001 Hb (g/dL) YB- 1 st 10.4 ± 1.1 14.7 ± 2.8 0.001 YB- 4 st 12.1 ± 1.1 12.4 ± 1.1 0.673 YB- 24 st 12.3 ± 1.1 14.1 ±1.3 0.015 Hematokrit (%) YB- 1 st 31.4 ± 3.4 47.0 ± 8.4 <0.001 YB- 4 st 36.4 ± 3.4 37.9 ± 4.5 0.415 YB- 24 st 36.9 ± 3.4 43.1 ± 4.2 0.002 Veriler, ortalama ± SD.
Tablo 7. Hastaların arteriyel kan gazı değerleri, sıvı ve elektrolit takibi
KPB öncesi KPB sonrası YB- 24 st
pH 7.41±0.09 7.44±0.09 7.44±0.11
pCO2(mmHg) 33.6±9.4 41.6±9.4 35.9±8.7
pO2 (mmHg) 159.2±125.4 119.9±92.4 109.6±75.7
Baz açığı -2.7±3.4 4.6±3.6 0.8±4.8
Serum bikarbonat (mmol/L) 21±3 28±4 24±4
Serum sodyum (mmol/L) 140±2 146±2 145±5
Serum potasyum (mmol/L) 3.9±0.4 3.9±0.3 3.6±0.5
İyonize kalsiyum (mmol/L) 1.2±0.1 1.3±0.2 1.1±0.1
İdrar miktarı (mL/kg) 3.8±3.5 30.7±12.1 56.9±28.6
Verilen sıvı miktarı (mL/kg) 16.6±7.7 10.4±7.9 48.8±28.6
Veriler, ortalama ± SD. =
pCO2 = Parsiyel karbondioksit basıncı; pO2 = Parsiyel oksijen basıncı; KPB = Kardiyopulmoner bypass;
TARTIŞMA
Son yıllarda masif kanama ve transfüzyonla sonuçlanabilen kompleks cerrahilerin daha fazla uygulanır olmasıyla koagülopatiye daha sık rastlanır olmuştur. Kan ve kan ürünlerinin transfüzyonu, kendilerine ait komplikasyonlar dışında enfeksiyon riski de taşır (57,58). Bu ve benzeri komplikasyonlardan dolayı transfüzyon mümkün olduğunca azaltılmalıdır. Tromboelastograf kullanımı klinisyene hemostatik süreçteki anormalliği daha erken fark etme, erken müdahale şansı ve daha iyi sonuç alma imkanı verir (54). Tromboelastograf, koagülasyon sistemini değerlendirmek, kan ve kan ürünü transfüzyonu ihtiyacını değerlendirmek, çeşitli hematolojik hastalıklarda hastayı daha yakından izlemek, kristalloidlerin ve kolloidlerin koagülasyona etkilerini incelemek, postoperatif sonuçları iyileştirmek gibi genel amaçlar yanında, KVC ameliyatları, organ transplantasyonları ve peroperatif dönemde ciddi kanama beklenen ameliyatlar gibi özel durumlarda olmak üzere kanama ve koagülasyonla ilişkilendirilebilecek pek çok durumda kullanılmıştır (54,59-68). Oldukça yoğun bir şekilde kullanılıyor olmasına karşın siyanotik ve asiyanotik çocuklarda tromboelastograf verileri açısından karşılaştırmalı bir çalışmaya rastlanmamıştır.
Yaptığımız çalışmada ortaya çıkan sonuçlardan biri K değerinin ameliyat başında yapılan INTEG ölçümünde, siyanotik çocuklarda asiyanotik çocuklara göre anlamlı olarak uzun bulunmasıdır. INTEG’ deki diğer anormal bulgu da siyanotik çocuklarda asiyanotiklere göre α açısının anlamlı olarak küçük olduğudur. Bu iki anormal değere karşın pıhtılaşmanın ilk başladığı ana kadar geçen süre yani R değeri ve oluşan pıhtının gücünü gösteren maksimum amplitüd yani MA değerinde anlamlı fark bulunmamıştır.
INTEG ölçümlerindeki bu sonuçlar, daha önce de belirtildiği gibi, intrinsik yolun koagülasyon faktörlerinde bir sorun olduğunu veya heparin, hirudin gibi bir antikoagülan kullanıldığını yada trombosit sayısında veya fonksiyonunda bir bozukluk olduğunu gösterir.
Siyanotik konjenital kalp hastalığı bulunması halinde trombosit sayısının hafif derecede azaldığı sıkça yazılmıştır (69-72). Ayrıca ciddi trombosit sayı düşüklüğünün
(<50000/mm³) polistemiyle ilişkili olduğu da bildirilmiştir (73).Yine trombosit sayısındaki bu etkilenmenin yanında, trombosit fonksiyon anormallikleri (71,74) ve bu anormalliklerin düzeltici ameliyatlardan sonra düzeldiği bildirilmiştir (75).
Siyanotik konjenital kalp hastalığı varlığında, düşük sistemik arteriyel oksijen satürasyonuna bir cevap olarak ortaya çıkan polistemi, kanda viskozite artışına, bu da akımın ve doku perfüzyonunun etkilenmesine sebep olur (76). Bu vasküler stazın sonucu, trombositlerin ve koagülasyon faktörlerinin tüketimine yol açan DIC’ tir (3). Bu hastalarda viskozite artışına ve akım yavaşlamasına bağlı koagülasyona eğilim, trombosit sayısının azalması, trombosit fonksiyonundaki bozulma ve plazmadaki koagülasyon faktörlerinin tüketilmesine bağlı kanamaya eğilim görülür.
Tromboelastograf ölçümleriyle eş zamanlı yaptığımız laboratuvar tetkiklerinde, siyanotik ve asiyanotik çocuklar arasında, sadece üç parametrede, ACT, Hb ve Htc de istatistiki anlam ifade eden farklılık tespit edilmiştir. Siyanotik çocukların giriş ACT’ si asiyanotiklere göre anlamlı olarak daha düşüktür. Hb ve Htc değerlerinde ise siyanotik çocuklarda asiyanotiklere göre giriş kanı ve YB’ daki 24. saatlerdeki kanda anlamlı bir yükseklik olduğu görülmüştür. Diğer laboratuar testleri arasında anlamlı bir farklılık bulunamamıştır.
Trombosit sayısının normal sınırlarda olması, trombosit sayısı açısından siyanotik ve asiyanotik çocuklar arasında istatistiki anlam ifade eden bir farklılık olmaması, PTZ, fibrinojen ve D-Dimer değerlerinde de istatistiki anlam ifade eden bir farklılık bulunmaması INTEG ölçümlerindeki anormalliğin trombosit fonksiyon bozukluğuna bağlı olabileceğini düşündürmektedir.
EXTEG ölçümlerinde ise; siyanotik çocuklarda R değeri ameliyat sonu ve YB 24. saat ölçümlerinde, K değeri ameliyata giriş ve ameliyat sonu ölçümlerinde anlamlı olarak yüksek; α açısı ise ameliyata giriş ve ameliyat sonu ölçümlerde anlamlı olarak düşük bulunmuştur.
Yine daha önce ifade edildiği gibi EXTEG ile trombosit fonksiyonları, plazmatik koagülasyon ve fibrin polimerizasyonu ölçülür.
EXTEG ölçümlerini değerlendirmek için kullanabileceğimiz laboratuar tetkiklerinde, yani PTZ, trombosit sayısı, fibrinojen ve D-Dimer değerleride her iki grup arasında anlamlı bir fark göstermemiştir. Siyanotik çocuklarda Hb ve Htc değerlerinin asiyanotiklere göre anlamlı olarak yüksek olduğu ve ACT değerininde bununla ilşkili olabilecek bir biçimde anlamlı olarak düşük olduğu daha önce ifade edilmişti.
Bu sonuçlara göre siyanotik çocuklarda pıhtı oluşmaya başlaması, pıhtının belirli bir güce erişmesi ve pıhtının maksimum güce erişmesi (sırasıyla R;K ve α) ölçümleri yaptığımız dönemlerde asiyanotik çocuklara kıyasla anlamlı olarak uzun bulunmuştur. INTEG ölçümleri için söylenenler EXTEG ölçümlerinin sonuçları için de söylenebilir: bu sonuçlardan trombosit fonksiyonlarındaki bozukluk sorumlu olabilir.
SONUÇ
Sonuç olarak, açık kalp cerrahisi uygulanan çocukların ameliyat sırasında ve sonrasında yapılan koagülasyon sistem değerlendirmesinde,
1. Tromboelastograf ölçümleri ile standart laboratuvar tetkiklerinin karşılaştırılmasında, platelet sayısının bazı TEG ölçümleri ile ilişkili olduğu bulunmuştur.
2. Siyanotik ve asiyanotik çocukların TEG ölçümlerinde, standart laboratuvar tetkikleri ile gösterilemeyen anlamlı değişiklikler kaydedilmiştir.
3. Ameliyat sırasında ve sonrasındaki TEG ölçümleri ve laboratuvar tetkikleri ile 24 saatlik kanama miktarı ve kan transfüzyonu miktarı arasında anlamlı bir ilişki bulunmamıştır.
Bu bulgular, pediyatrik kalp cerrahisinde TEG kullanımının standart laboratuvar tetkiklerine göre daha hassas olduğunu düşündürmektedir. Ancak, bu hassasiyetin ameliyat sonrası kanama ve kan transfüzyonu miktarları üzerine etkisinin olmaması nedeniyle koagülasyon sisteminin değerlendirilmesi için rutin TEG kullanımının değeri ve klinik öneminin açıklanabilmesi için daha büyük hasta sayısı içeren çalışmalara ihtiyaç olduğu düşünülmektedir.
KAYNAKLAR
1- Hans-Jürgen Kolda. Haemostasis. Basel, Pentapharm Ltd.; 2001: 1.
2- Maslow A, Schwartz C. Cardiopulmonary bypass-associated coagulopathies and prophylactic therapy. Int Anesthesiol Clin 2004; 42: 103-33.
3- Tempe DK, Virmani S. Coagulation abnormalities in patients with cyanotic congenital heart disease. JCardiothorac Vasc Anesth 2002; 16: 752-65.
4- Horigome H, Hiramatsu Y, Shigeta O, Nagasawa T, Matsui A. Overproduction of microparticles in cyanotic congenital heart disease with polycythemia. J Am Coll Cardiol 2002; 39: 1072-7.
5- Weiss HJ. Platelet phisiology and abnormalities of platelet function (part 1). N Engl J Med 1975; 293; 531-41.
6- Weiss HJ. Platelet phisiology and abnormalities of platelet function (part 1). N Engl J Med 1975; 293; 580-88.
7- Furie B, Furie BC. Moleculer and cellular biology of blood coagulation. N Engl J Med 1992; 326: 800-6.
8- Rao LV, Pendurthi UR. Tissue factor-factor VIIa signaling. Arterioscler Thromb Vasc Biol 2005; 25: 47-56.
9- Paperella D, Brister SJ, Buchanan MR. Coagulation disorders of cardiopulmonary
bypass : a review. I Care Med 2004; 30: 1873-81.
10- Vassalli JD, Seppina AP, Belin D. The plasminogen activator/plasmin system. J Clin Invest 1991; 88: 1067-72.
11- Levin EG, Marzec U, Anderson J, et al. Thrombin stimulates tissue plasminogen activator release from cultured human endothelial cell. J Clin Invest 1984; 74: 1988-95.
12- Skubas NJ, Despotis GJ. Optimal management of bleeding complications after cardiac surgery. Semin Cardiothorac Vasc Anesth 2001; 5: 217-8.
13- Spiess BD. Maintenence of homeostasis in coagulation during cardiopulmonary
bypass. J Cardiothorac Anesth Vasc 1999; 13(suppl): 2-5.
14- Sellman M, Intonti MA, Ivert T. Reoperations for bleeding after coronary artery