1
HAŞHAŞ (Papaver somniferum L.) TOHUMUNDAN LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Merve ŞAHAN Yüksek Lisans Tezi Biyokimya Anabilim Dalı
2
HAŞHAŞ (Papaver somniferum L.) TOHUMUNDAN LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Merve ŞAHAN
Dumlupınar Üniversitesi
Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliği Uyarınca Fen Bilimleri Enstitüsü Biyokimya Anabilim Dalında
YÜKSEK LİSANS TEZİ Olarak Hazırlanmıştır.
Danışman: Prof. Dr. Metin BÜLBÜL
KABUL VE ONAY SAYFASI
Merve ŞAHAN’ın YÜKSEK LİSANS tezi olarak hazırladığı “HAŞHAŞ (Papaver somniferum L.) TOHUMUNDAN LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU” başlıklı bu çalışma, jürimizce Dumlupınar Üniversitesi Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliğinin ilgili maddeleri uyarınca değerlendirilerek kabul edilmiştir.
23/03/2018
Prof. Dr. Önder UYSAL
Enstitü Müdürü, Fen Bilimleri Enstitüsü
---Prof. Dr. Metin BÜLBÜL
Bölüm Başkanı, Biyokimya Bölümü ---
Yrd. Doç Dr. Metin BÜLBÜL
Danışman, Biyokimya Bölümü, Dumlupınar Üniversitesi
---
Sınav Komitesi Üyeleri
Prof. Dr. Metin BÜLBÜL
Biyokimya Bölümü, Dumlupınar Üniversitesi ---
Doç. Dr. Derya KOYUNCU ZEYBEK
Biyokimya Bölümü, Dumlupınar Üüniversitesi Üniversitesi ---
Dr. Öğr. Üyesi Zerrin PAT
ETİK İLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında Akademik kurallara riayet ettiğimizi, özgün bir çalışma olduğunu ve yapılan tez çalışmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalışma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan İntihal Programı ile tarandığını ve benzerlik oranının % 26 çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı takdirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
HAŞHAŞ (Papaver somniferum L.) TOHUMUNDAN LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Merve ŞAHAN
Biyokimya, Yüksek Lisans Tezi, 2018 Tez Danışmanı: Prof. Dr. Metin BÜLBÜL
ÖZET
Lipazlar trigliseritlerin hidrolizini sağlayan enzimlerdir. Teknolojinin gelişmesiyle lipazların kullanım alanları artmış olup, lipaz saflaştırma büyük önem kazanmıştır. Bunula birlikte saflaştırma çalışmaları da artmıştır. Bu çalışmada haşhaş (Papaver somniferum L.) tohumu lipaz enziminin saflaştırılması ve karakterizasyonu amaçlanmıştır. İlk defa haşhaş tohumundan lipaz elde edilmiştir.
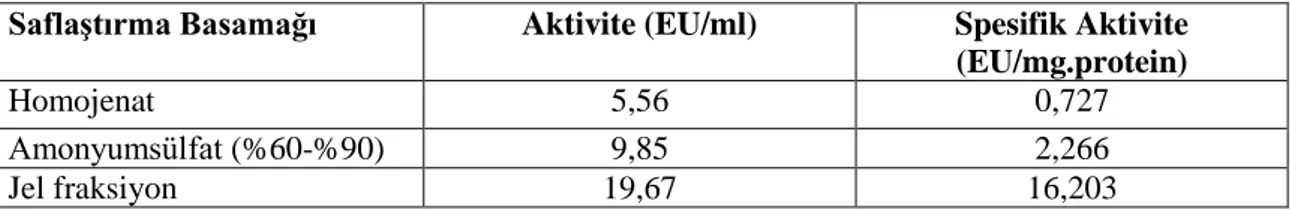
Haşhaş tohumu proteinlerinde yağsızlaştırma işlemiyle yağların uzaklaştırılmasından sonra amonyum sülfat çöktürmesi ve jel filtrasyon kromatografisi yöntemlerinin kullanılmasıyla lipaz saflaştırılmıştır. Bu çalışmaların sonunda haşhaş tohumu lipazı 16,203 EU/mg protein, spesifik aktivite % 5,30 verim ile 22,29 kat saflaştırıldığı gözlenmiştir.
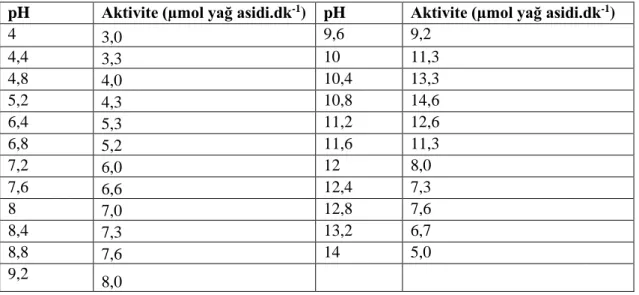
Saflaştırılmış olan lipaz enziminde optimum pH 13,2 optimum sıcaklığı 60 ºC olarak tespit edilmiştir. Stabil pH 7,2 ve stabil sıcaklık 4 °C olarak belirlenmiştir.
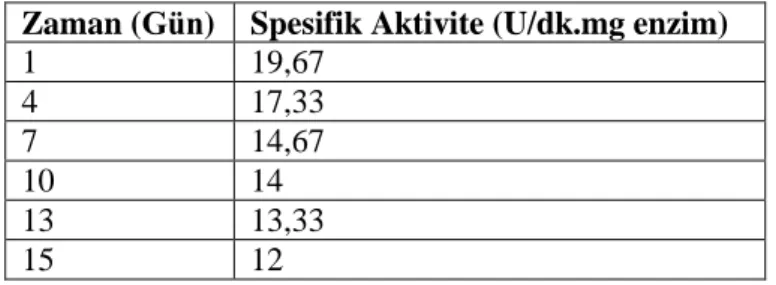
Haşhaş tohumu lipazının iki hafta süresince aktivite ölçümleri yapılarak depo kararlılığı belirlenmiştir. İki haftanın sonunda 4 °C’de enzimin aktivitesinin % 61 oranında korunduğu gözlenmiştir.
Haşhaş tohumu lipazında substrat olarak triolein kullanılmış olup, Km ve Vmax değerleri hesaplanmıştır. Bu hesaplamanın sonucunda Km 0,678 mM ve Vmax 16,949 U/dk.mg enzim olarak bulunmuştur.
PURIFICATION AND CHARACTERIZATION OF LIPASE ENZYME FROM POPPY SEED (Papaver somniferum L.)
Merve ŞAHAN
Biochemistry, MSc. Thesis, 2018 Thesis Supervisor: Prof. Dr. Metin BÜLBÜL
SUMMARY
Lipases are enzymes which provide the hydrolysis of triglycerides. With the technological progress the use of lipases is increased and the lipase isolation and purification got more important. Therefore purification studies are increased also. In this study it was aimed to purify and characterize the lipase enzyme from poppy seed. It is received lipase from poppy seed for the first time.
Lipase enzyme from poppy seed was purified by ammonium sulphate precipitation and gel filtration chromatography. At the end of this study, lipase of poppy seed including 16,203 EU/mg protein, yield specific activity of 5,3 % and it is 22,29 times purified.
For purified lipase from poppy seed expihibited the highest activity at optimum pH 13,2 and temperature 60 °C. The maximum activity stability is pH 7,2 and 4 °C.
In order to determine the storage stability of lipase from poppy seed, the activity assays were performed for a period of two weeks. At the end of these two weeks it was observed that its activity of 61 % was retained at 4 °C.
As the substrate of poppy seed lipase, triolein was used and Km and Vmax values were calculated. Consequenly Km 06,78 mM and Vmax 16,949 U/ dk.mg as enzyme were found. Key Words: Characterization, lipase, poppy seed, purification.
TEŞEKKÜR
Yüksek lisansım boyunca her konuda beni destekleyen bilgi ve tecrübelerini eksik etmeyen çok kıymetli saygı değer danışman hocam Prof. Dr. Metin BÜLBÜL’e sonsuz teşekkür ederim.
Tez çalışmam sürecinde yardımlarını esirgemeyen Araş. Gör. Ekrem TUNCA’ya ve Yasemin TUNCA’ya sonsuz teşekkür ederim.
Yüksek lisansım boyunca her zaman yanımda olan beni her zaman destekleyen kıymetli dostlarım Meliha ALTINAY’a ve Mehtap TUNÇEL’e sonsuz teşekkür ederim.
Bugünlere gelmemi sağlayan, maddi ve manevi desteklerini hiç esirgemeyen, her zaman yanımda olan değerli annem Fatma ŞAHAN’a, babam Halil ŞAHAN’a, dayım Halil KANDİL’e, halam Bahriye KANDİL’e, Emine KANDİL’e ve Sefa KANDİL’e sonsuz teşekkür ederim.
İÇİNDEKİLER
Sayfa ÖZET ... v SUMMARY ... vi ŞEKİLLER DİZİNİ ... xi ÇİZELGELER DİZİNİ ... xiiSİMGELER VE KISALTMALAR DİZİNİ ... xiii
1. GİRİŞ ... 1 1.1. Enzimlerin Sınıflandırılması ... 2
1.1.1. Oksidorektüktazlar ... 2
1.1.2. Transferazlar ... 2
1.1.3. Hidrolazlar ... 2
1.1.4. Liyazlar ... 2
1.1.5. İzomerazlar ... 3
1.1.6. Ligazlar ... 3
1.2. Enzimlerin Lipitlere Etkisi ... 3
1.3. Enzim Aktivitesi ve Üzerine Etki Eden Faktörler ... 3
1.3.1. pH ... 3
1.3.2. Sıcaklık... 4
1.3.3. Enzim derişiminin etkisi ... 4
1.3.4. Substrat derişiminin etkisi ... 4
1.3.5. Ürün derişiminin etkisi ... 4
1.3.6. Zamanın etkisi ... 4
1.4. Enzim Kinetiği ... 5
1.4.1. Km ve Vmax değerlerinin önemi ... 6
1.5. Enzim Kullanmanın Avantajları ... 7
1.6. Enzimlerin Kullanım Alanları ... 7
İÇİNDEKİLER (devam)
Sayfa 2.1. Lipaz Üretimi ... 10 2.2. Lipaz Kaynakları... 102.2.1. Hayvansal lipazlar ... 11
2.2.2. Bitkisel lipazlar ... 11
2.2.3. Mikrobiyal lipazlar ... 11
2.3. Lipazların Uygulama Alanları ... 12
2.3.1. Deterjan endüstrisinde lipazlar ... 13
2.3.2. Gıda endüstrisinde lipazlar ... 14
2.3.3. Kağıt endüstrisinde lipazlar... 15
2.3.4. Tekstil endüstrisinde lipazlar ... 15
2.3.5. Kozmetik ve parfüm endüstrisinde lipazlar ... 15
2.3.6. Biyodizel endüstrisi ... 16
2.3.7. Organik madde sentezinde lipazlar ... 16
2.3.8. Oleokimyasal endüstrisinde lipazlar ... 16
2.3.9. Biyosensör olarak lipazlar ... 17
2.4. Lipaz Saflaştırma ... 17
3. HAŞHAŞ ... 19
3.1. Haşhaş Bitkisi ve Haşhaş Tohumu ... 20
3.2. Haşhaş Yağı ... 22
3.3. Haşhaşta Bulunan Afyon ... 23
3.4. Haşhaşın Kullanım Alanları ... 24
4. MATERYAL VE METOT ... 26
4.1. Materyal ... 26
4.1.1. Kullanılan kimyasal malzemeler ... 26
İÇİNDEKİLER (devam)
Sayfa
4.1.3. Kullanılan çözeltilerin hazırlanması ... 27
4.2. Metotlar ... 28
4.2.1. Homojenat hazırlanması... 28
4.2.2. Amonyum sülfat çöktürmesi ... 28
4.2.3. Aktivite tayin yöntemleri ... 29
4.2.4. Sephadex jel hazırlanması ... 29
4.2.5. Saflaştırılan proteinlerin SDS-PAGE ile karakterizasyonu ... 29
4.2.6. Optimum pH çalışmaları ... 29
4.2.7. Optimum sıcaklık çalışmaları ... 29
4.2.8. Depo kararlılığı tayini ... 30
4.2.9. Stabil-pH çalışmaları ... 30
4.2.10. Stabil-sıcaklık çalışmaları ... 30
4.2.11. Km ve Vmax değerlerinin belirlenmesi ... 30
5. SONUÇ VE TARTIŞMA ... 31
5.1. Sonuç ... 31
5.1.1. Haşhaş tohumu lipazının hidrolitik aktivite tayini ... 31
5.1.2. Haşhaş tohumu lipazının saflaştırma basamakları ... 31
5.1.3. Haşhaş tohumunun optimum pH hesaplanması ... 32
5.1.4. Haşhaş tohumu lipazının optimum sıcaklığının belirlenmesi ... 33
5.1.5. Haşhaş tohumu lipazının enzimin depo kararlılığının belirlenmesi ... 34
5.1.6. Haşhaş tohumu lipazının stabil pH aktivitesi ... 35
5.1.7. Haşhaş tohumu lipazının stabil sıcaklığının belirlenmesi ... 36
5.1.8. Lipaz enziminin Km ve Vmax değerlerinin belirlenmesi ... 37
5.1.8. SDS-PAGE ile enzimin karakterizasyonu... 39
5.2. Tartışma ... 39
KAYNAKLAR DİZİNİ ... 433 ÖZGEÇMİŞ
ŞEKİLLER DİZİNİ
Şekil Sayfa
2.1. Yağların hidroliz reaksiyonu. ... 9
2.2. Lipaz katalizli reaksiyonların şematik gösterimi . ... 10
3.1. Haşhaş (Papaver somniferum L.) bitkisin çiçek renkleri. ... 21
3.2. Papaver somniferum L. ... 22
5.1. Haşhaş tohumu lipazına optimum pH’ın etkisi. ... 33
5.2. Sıcaklığın haşhaş tohumu lipazına etkisi. ... 34
5.3. Haşhaş tohumu lipazının depo kararlılığı. ... 35
5.4. Haşhaş tohumu lipazının stabil pH aktivitesi. ... 36
5.5. Haşhaş tohumu lipazının stabil sıcaklık aktivitesi. ... 37
5.6. Haşhaş tohumu lipazının Michaelis-Menten grafiği ... 38
5.7. Haşhaş tohumu lipazının Lineweaver-Burk grafiği. ... 38
ÇİZELGELER DİZİNİ
Çizelge Sayfa
1.1. Bazı enzimlerin endüstrideki görevleri. ... 8
2.1. Lipazların endüstriyel uygulamaları ... 13
5.1. Haşhaş tohumu lipazının saflaştırma basamaklarında aktivite değişimi. ... 31
5.2. Haşhaş tohumu lipazının saflaştırma basamakları. ... 31
5.3. Haşhaş tohumu lipazının optimum pH değerleri... 32
5.4. Haşhaş tohumu lipazının optimum sıcaklık değerleri. ... 33
5.5. Haşhaş tohumu lipazının depo kararlılığı. ... 34
5.6. Haşhaş tohumu lipazının stabil pH aktivitesi ... 35
5.7. Haşhaş tohumu lipazının stabil sıcaklık aktivitesi. ... 36
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklamalar
Km Michaelis Menten sabiti
Vmax Doygun substrat konsantrasyonunda enzimin ulaşabileceği max hız mg miligram mL mililitre mM milimolar nm nanometre dk dakika µg mikrogram
1. GİRİŞ
Bir reaksiyona girdiğinde o reaksiyonu hızlandıran, ancak reaksiyon sonunda kendisi aynı kalan maddeler katalizör olarak adlandırılırlar. Enzimler de organik yapıda olan, ısı direnci düşük katalizörlerdir. Bu katalizörlerin üretimi canlı hücreler ile gerçekleştirilir, ancak çalışmaları için bu hücrelere ihtiyaçları yoktur (Bayşu ve Sözbilir, 2008).
Pasteur, 1850’lerde şekerin mayayla alkole fermentasyonunun fermentler yardımıyla katalizlendiğini gözlemlemiş olup, fermantasyonun canlı hücrelerde gerçekleşeceğini savunmuştur. Liebig bu görüşün aksine, fermantasyonun sadece canlı hücrelerde gerçekleşmeyeceğini, cansız ortamda da olabileceğini savunmuştur (Hammamchi, 2014).
1878’de Frederick W. Kühne bu fermentleri ‘enzim’ olarak adlandırdı. 1897’de Eduard Buchner maya hücrelerini kullanarak enzim izole etmiştir. Enzimin cansız ortamda da aynı işleve sahip olduğunu gözlemlemiştir. Karışık enzimlerden saf enzim elde etme çalışmaları 1920’li yıllarda artmıştır (Hammamchi, 2014).
1926 yılında James Summer, üreaz enzimini izole ve kristalize edilme çalışmaları yapmıştır. Böylelikle enzim ile bilgiler artmış olup, enzim ile yeni gelişmelerin olmasına kapılar açmıştır. 1930’larda John Northrop ve Moses Kunitz pepsin ve tripsinin protein yapıda olduklarını bulmuştur. Böylelikle Summer’ın fikri kabul görmüştür. Fischer, 1894 yılında, “anahtar-kilit” modelini, Koshland ise 1959 yılında “uyum meydana getirme” modelini kullanarak enzimlerin özgünlüğünü açıklamışlardır. Enzim kinetiği konusu, Michaelis ve Menten tarafından 1913 yılından bugüne geçerliliğini koruyan temeller üzerine oturtulmuştur (Nelson vd., 2004).
Enzimle ilgili çalışmalar yirminci yüzyılın sonlarına doğru hız kazanmış olup, birçok enzim saflaştırılarak saf enzimler elde edilmiştir. Çoğu enzimin de kimyasal mekanizması ve yapısı açıklanmıştır. Enzimlerin nasıl çalıştığı konusuna da açıklık getirilmiştir (Nelson vd., 2004).
Enzimler metabolik reaksiyonların kontrolünü sağlayarak, reaksiyonların daha hızlı bir şekilde oluşmasını sağlarlar. Örnek verecek olursak, enzimler dakikada 36 milyon molekülü hızlı bir şekilde değişikliğe uğratabilmektedir. Enzimlerin etki ettiği maddeye substrat, reaksiyon tamamladığında miktarında artış gözlenen ve oluşan yeni maddeye ürün denilmektedir. Enzim subsrata etki etmeye dış yüzeyden başlayarak şeklini değiştirir ve böylelikle ürün açığa çıkarır.
Enzimler tekrar tekrar kullanılabildikleri için reaksiyon bittikten sonra başka bir maddeye etki etmek için hazırlanırlar. Ayrıca enzimler protein yapıdadırlar. Yüksek sıcaklıklarda denatüre olurlar ve etkinliklerini kaybederler (Bhat, 2000; Tatar, 2007).
Bazı enzimler sadece protein yapıda olup bunlar; pepsin, tripsin, hidrolaz ve üreazlardır. Enzimlerin bazıları ise sadece proteinden meydana gelmeyip bunun yanında metal iyonu da taşırlar. Metal iyonu taşıyan enzimlere metaloenzim adı verilir. Ca²+, Mg²+, Zn²+, K+, Na+, Cu²+, Fe²+ gibi metal iyonları birçok enzimde kofaktör olarak iş görür. Koenzimler ise enzimlerin kopardığı ya da eklediği kimyasal grupların taşıyıcısı olan organik moleküllerdir. Enzimlerin pasif şekliden aktif şekle dönüşümü aktivatörle olur. Enzim koenzim ya da kofaktörle beraber aktif durumda ise bu enzime holoenzim denilmektedir. Enzimde koenzim ve kofaktörün ayrılmasıyla enzim inaktif duruma dönüşür. Enzimin bu durumuna apoenzim denir. Apoenzim protein yapıda olup, aktif olması için koenzime ve kofaktöre ihtiyacı vardır. Koenzimler enzime gevşek bağlanırlar. Eğer koenzimler enzime sıkı bir şekilde bağlanırlarsa prostetik grubu oluştururlar (Ası, 1999).
1.1. Enzimlerin Sınıflandırılması
1.1.1. Oksidorektüktazlar
Bir elektronun bir molekülden bir diğerine aktarılmasını katalizleyen enzimdir. Yani iki subsrat arasında redoks raeksiyonlarını katalizlerler (Yıldız, 2007).
1.1.2. Transferazlar
Fonksiyonel grupları iki substrat arasında taşıyan tepkimeleri katalizlerler (Yıldız, 2007).
1.1.3. Hidrolazlar
Çeşitli bağlara su eklenerek bu bağların parçalanmasına sebep olan hidroliz tepkimlerini katalizlerler (Yıldız, 2007).
1.1.4. Liyazlar
Hidroliz ve oksidasyon haricindeki yöntemlerle bağ kıran tepkimeleri katalizleyen ve sonucunda çift bağ oluşturan enzimlerdir (Yıldız, 2007).
1.1.5. İzomerazlar
Bir moleküldeki geometrik ve yapısal izomerlerin birbiri içindeki değişikliklerini kontrol ederler (Yıldız, 2007).
1.1.6. Ligazlar
Diğer adı sentetazlar olan ve iki molekülü birbirine bağlanmasını katalize etmek için ATP enerjisini kullanan enzimlerdir (Yıldız, 2007).
1.2. Enzimlerin Lipitlere Etkisi
Lipazlar doğal olarak yağlı tohumlarda, tahıl, süt, meyve ve sebzelerde bulunurlar. Düşük sıcaklıklarda aktif şekilde durabilirler. Lipidlerin hidroliz edilmesi lipazlar tarafından katalizlenir. Tepkime hızı lipazlar tarafından katalizlendiğinde gliserit tipine ve bunda bulunan yağ asidine göre değişiklik gösterir. Küçük moleküle sahip yağ asitlerinde hidroliz hızlıdır. Lipidlerin hidrolizlenmesi sonucu yağın tadında ve kokusunda olumsuz yönde değişme vardır (Milli Eğitim Bakanlığı [MEB], 2011).
1.3. Enzim Aktivitesi ve Üzerine Etki Eden Faktörler
Enzim aktivitesi, birim zaman başına dönüştürülen substrat mol sayısına eşittir.
Proteinin bir miligramında bulunan enzim ünite sayısı spesifik aktiviteyi verir yani ünite/ mg proteindir (Bülbül, 2014).
Enzim aktivesi üzerine etki eden faktörler şunlardır:
pH
Sıcaklık
Enzim derişiminin etkisi
Substrat derişiminin etkisi
Ürün derişimin etkisi
Zaman 1.3.1. pH
Her enzimin kendine özgü maksimum etki gösterdiği bir pH değeri vardır. Buna, ilgili enzimin optimum pH değeri denilmektedir.
pH değeri enzimlerin aktivitelerinde rol oynarlar. Çünkü substratlar ve enzimlerin aktif bölgeleri asidiklik ve baziklik içerir. Enzimlerin genellikle optimum pH değeri 5-7 arasında değer göstermektedir. Tripsin gibi optimum pH değeri 8 olan enzimler de mevcuttur (Bayşu ve Sözbilir, 2008).
1.3.2. Sıcaklık
Enzimler yapıları gereği yüksek sıcaklığa karşı dayanıklı değillerdir. Bazı enzimler 50-60 ºC gibi sıcaklıklarda denaturasyona uğrarlar.
Enzim hızlarında sıcaklıklığın etkisi vardır. Kimyasal reaksiyonların hızı her 10 °C’lik sıcaklık artışında iki kat artmaktadır. Sıcaklık değeri belirli bir değere yükselinceye kadar artar ve maksimum seviyeye ulaşır ancak belirli bir değerden sonra ters etki yapmasına sebep olur. Hızın maksimum olduğu değer optimum sıcaklık değeridir. Sıcaklık, yüksek değerlerde kimyasal moleküllerin yapısında değişiklikler yaparak tepkimenin hızını giderek yavaşlatır hatta bazen de durmasına neden olur. Enzimlerin de yapıları protein olduğundan, sıcaklıklardaki aşırı yükselme bozulmalarına neden olur (Bayşu ve Sözbilir, 2008).
1.3.3. Enzim derişiminin etkisi
Enzim derişimi, tepkimenin hızını doğru orantılı olarak artırır. Ancak devam eden tepkimede substratın tükenmesi gibi olumsuz şartlardan dolayı hız azalır (Bayşu ve Sözbilir, 2008).
1.3.4. Substrat derişiminin etkisi
Enzimin hızı, ilk başta artan substrat derişimine bağlı olarak artar ancak, belirli bir süre sonra enzim substrat karşısında doygun hale gelir. Doygun hale gelen enzimin hızı maksimum hale gelir ve bu hızda çalışmaya devam eder. Bu hıza Vmax denir (Bayşu ve Sözbilir, 2008). 1.3.5. Ürün derişiminin etkisi
Hız, ürün derişiminin artmasıyla zaman içinde azalır. Çünkü reaksiyon geri dönüşümlü olduğu için feed-back mekanizmasıyla geriye dönük yapım işlemi durdurulduğu için tepkime hızında azalma olur (Bayşu ve Sözbilir, 2008).
1.3.6. Zamanın etkisi
Ürünler zamanla kendi aralarında birleşerek aksi yönde bir reaksiyon gerçekleştirir. Bu da enzimlerin aktivitelerini kaybetmesine, substratın kalmamasına neden olur ve reaksiyon hızını düşürür (Bayşu ve Sözbilir, 2008).
1.4. Enzim Kinetiği
Enzim kinetiği, enzim reaksiyonlarında tepkime hızını ve çalışma mekanizmasını inceler.
Leonor Michaelis ve Maud Menten, enzimatik tepkimelerde kullanılmak üzere yeni bir model oluşturmuşlardır. Bu model enzimin kinetik özelliklerinin açıklanmasında kullanılmıştır. Enzimli tepkimelerin ilk aşamasında enzim substrat kompleksi oluşur. Bu kompleksin oluşumundan ve enzimlerin doygunluk özellik göstermelerinden yararlanılarak bu model geliştirilmiştir. Enzimin derişimini sabit tutup, subtrat derişimi değiştirilmiştir. Tepkime hızının substrat derişimine göre değişiminin incelemesi yapılmıştır (Tüzün, 1997; Malyemez, 2015). Michaelis- Menten enzimli bir reaksiyonu aşağıdaki denklem ile gösterir.
Buna göre E, enzimi; S, substratı, k, hız sabitini ve ES, enzim-substrat kompleksini, P ise ürünü ifade eder.
Denkleme baktığımızda k1 hız sabitiyle enzim subrat kompleksi oluşmuştur. k2 hız sabitiyle ise enzim ve substrat tekrar ayrılmıştır. Reaksiyon çift yönlü gerçekleşir. k3 hız sabitiyle de enzim ve substrat kompleksi ürüne dönüştürülür. Enzim reaksiyondan etkilenmeden aynen çıkar ve tekrar başka bir reaksiyon için hazırlanır. Michaelis-Menten denklemiyle substrat konsantrasyonuna göre reaksiyon hızının değişimi gözlenir.
𝑉₀ =𝑉𝑚𝑎𝑥. [𝑆] 𝐾𝑚 + [𝑆] V0 = ilk hız Vmax = maksimum hız Km = Michaelis-Menten sabiti = (k2+k3)/k1 [S] = substrat konsantrasyonu
Michaelis-Menten hız denklemi kurulurken;
i. E ve S’in konsantrasyonları: Sustrat konsantrasyonu [S], enzim konsantrasyonundan [E], oldukça yüksektir, böylelikle enzimin bağlandığı substrat miktarı azdır.
ii. Denge durumu : [ES] değişimez sabittir, yani ES oluşum hızı, ES yıkım hızına (E+S ve E+P) eşittir. Reaksiyonda bir ara ürünün sentezlenme hızı, yıkım hızına eşit olduğu durumlarda ara ürün dengededir. Bu bir genel kuraldır.
iii. İlk hız: Enzim reaksiyonlarında hız olarak ilk hız kullanılır. Ürün konsantrasyonunun küçük olmasından dolayı üründen substrata giden reaksiyonun hızı ihmal edilebilir. Bu yüzden reaksiyon hızı, enzimin ve substarın karıştırılmasından hemen sonra ölçülür (Nelson ve Cox, 2005; Güller, 2014).
1.4.1. Km ve Vmax değerlerinin önemi
Enzimlerin Km değerleri kendilerine özgüdür. Çoğu enzim için bu değer 10-1 ile 10-6 M arasında bir değere sahiptir. Km değeri enzimin konsantrasyonuna bağlı olmayıp substratın yapısı, pH, sıcaklık ve iyonik şiddete bağlı olarak değişebilir (Güller, 2014).
Km değeri iki anlama gelir:
1) Km değeri enzimlerin aktif olan bölgelerinin yarısının dolu olduğu substrat konsantrasyonudur.
2) Km değeri
denklemi ile gösterilen katalizleme mekanizması hız sabitleriyle ilişkilidir. Denklemde Km =k2 + k3 / k1 eşitliği ile gösterilir.
k2>>k3 olduğunda Km, ES’nin ayrışma sabitine eşittir. Yani ES’nin sağlamlık ölçüsü Km dir. Yüksek Km değeri enziminin substarına ilgisini düşük olduğundan dolayı zayıf bağlanmayı, düşük bir Km enzimin substratına karşı ilgisini yüksek olduğundan dolayı kuvvetli bağlanmayı ifade eder (Güller, 2014).
Vmax enzimin katalitik aktivitesini ifade eder. Vmax, ürüne çevrilmiş olan substratın mol sayısı/birim zaman’dır. Enzimlerin Vmax değerleri kendine özgüdür. Aynı zamanda substratların yapısı, pH, sıcaklık ve iyonik şiddete bağlı olarak değişiklik gösterir. Çünkü Vmax = k3 [ET] konsantrasyondaki enzim ile o enzimin substratının doygunluğundaki gibidir. Doygunluk oranının epeyce üzerindeki substrat konstrasyonlarında hız, enzim miktarı ile doğru orantılıdır (Güller, 2014).
1.5. Enzim Kullanmanın Avantajları
Substrata ve reaksiyonun tipine özgüdür. Enzimatik reaksiyonlarda yan ürün oluşmaz. Verim %100’dür. Reaksiyonları kimyasal katalizörlerden çok hızlıdır. Doğal kontrol mekanizmaları oldukça çeşitlidir. Ortamda bulunan denetleyici küçük moleküllere göre enzim aktivitesi artar ya da azalır, yani içinde bulundukları duruma göre davranırlar. Reaksiyondan zarar almadan çıkar ve tekrar tekrar kullanılabilirler (Tutar, 2009).
Fizyolojik pH, sıcaklık ve basınçta çalışırlar. Başka bir özelliği ise reaksiyonu az enerjiyle ve düşük sıcaklıkta gerçekleştirmeleridir. Bunu reaksiyonun aktivasyon enerjisini düşürerek yaparlar (Wiseman, 1986; Tutar, 2009).
1.6. Enzimlerin Kullanım Alanları
Enzim teknolojisi, Ekonomik İşbirliği ve Kalkınma Örgütü (OECD) tarafından tanınan bir alandır. Endüstrinin çeşitli alanında kullanılan enzimler genellikle mikroorganizmalar, bitkiler ve hayvanlardan elde edilir. Enzimlerin günümüzde gıda, tekstil, temizlik malzemeleri, hayvan yemi sanayisi gibi çeşitli kullanım alanları vardır. Bu kullanım alanlarından % 7 tekstil, % 18 etanol ve tahıl işlemi, % 18 hayvan yem endüstrisi, % 25 temizlik endüstrisi ve en çok kullanım alanı olarak %32 ile yiyecek endüstrisi başı çekmektedir (Akyıl, 2014). Enzimlerin bazılarının endüstrideki görevleri çizelge 1.1. gösterilmiştir.
Çizelge 1.1. Bazı enzimlerin endüstrideki görevleri (Akyıl, 2014).
Enzim sınıfı Enzim Görevi
Oksidoredüktazlar
Glukozoksidaz Hamur güçlendirme Laktaz Aroma artırıcı
Lipoksigenaz Hamur güçlendirilmesi, ekmek beyazlatma
Transferazlar
Siklodekstrin Siklodekstrin üretimi
Fruktoziltransferaz Fruktoz oligomerlerinin transferi
Transglutaminaz Viskoelastik özelliklerinin modifikasyonu, hamur işleme, et işleme
Hidrolazlar
Amilaz
Nişasta sıvılaştırma
Ekmeğe yumuşaklık ve hacim katılması, un ayarı
Suyu arıtma Galaktosidaz
Hayvani yem olarak kullanılır
Lipaz Peynire tat, hamurun havalandırılması için emülsiyon, aromatik moleküllerin sentezi Proteaz Proteinin hidrolizi, sütün pıhtılaşması,
düşük alerjenik bebek gıdası
Liyazlar Asetoasetat
Dekarboksilaz
Biranın olgunlaşması
2. LİPAZLAR
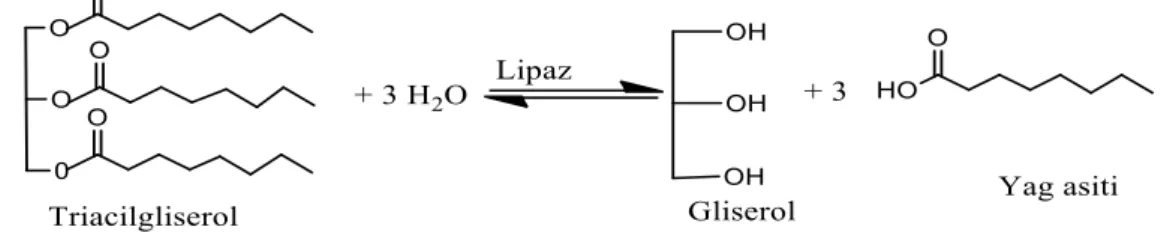
Lipazlar, hidrolazlar sınıfında yer almış olup, sulu ortamda trigliseritlerin hidrolizini sağlayan enzimlerdir. Diaçilgliserin, monoaçilgliserin, gliserin ve serbest yağ asitleri lipazların hidrolizi sonucunda oluşur. Bu enzimatik reaksiyonlar genellikle tersinir olarak gerçekleşir (Telefoncu 1997).
Şekil 2.1. Yağların hidroliz reaksiyonu.
Bazı esterlerin transesterifikasyonu gibi esterlerin sentezini katalizleyen lipazlar seçicilik özellik gösterirler. Sadece sulu ortamda reaksiyona girmeyip aynı zamanda organik çözücülerde de birçok reaksiyonu katalizleyen biyokatalizörlerdir. Aynı zamanda lipazların, substrat aralığının ortalamayı aşması, çok yüksek sıcaklıklara, pH ve organik çözücülere ve enantiyoselektiviteye karşı istikrarlı olması gibi özelliklerinden dolayı oldukça önemli biyokatalizörler arasında yer alırlar (Çakar, 2016).
Lipazlara genel olarak baktığımızda karboksilesterazlar ve gerçek lipazlar olmak üzere ikiye ayrılarlar. Karboksilesterazlar, kısa zincirli karboksilik asit esterlerini parçalayan suda kısmen çözünebilen lipazlar olarak bilinirken, gerçek lipazlar ise suda çözünmeyen uzun zincirli açilgliserolleri hidroliz eden lipazlardır. Triaçilgliserollerin hidrolizini yapan lipazlar, lipit su ara yüzeyinde aktiftirler ve suda çözünmeyen uzun zincirli trigliseritlere karşı aktiviteleri maksimum düzeydedir (Hammamchi, 2014; Akyıl, 2014).
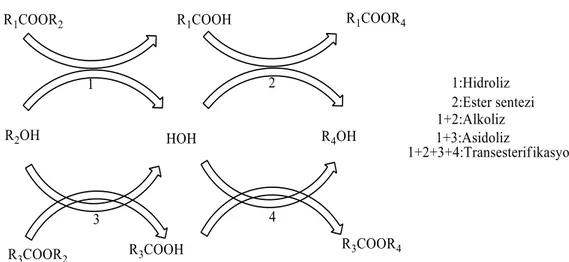
Optimum reaksiyon koşulları altında çalışan ve katalitik potansiyelleri çok yüksek olan lipazlar, hidroliz, aminoliz, oksimoliz, tiotransesterifikasyon, esterifikasyon, iki açilgliserol arasında açil gruplarının değişimi olan transesterifikasyon, bir açil grubunun, bir açil gliserol ve bir alkol arasında yer değiştirmesi ile oluşan alkoliz ve bir açil grubunun, bir açil gliserol ve bir karboksilik asit arasında yer değiştirmesi sonucunda olan asidoliz gibi pek çok reaksiyonu kataliz ederler (Basım, 2009). Kataliz reaksiyonlarının bazıları aşağıdaki Şekil 2.2 de gösterilmiştir.
Şekil 2.2. Lipaz katalizli reaksiyonların şematik gösterimi (Öztürk, 2002).
2.1. Lipaz Üretimi
1994 yılında Novo Nordisk firması tarafından ticari anlamda ilk lipaz üretimi yapılmıştır. Aspergillus oryzae üretilen ilk rekombinant lipazdır. 1995 senesinde Genencor International aracılığıyla Pseudomonas mendocina’dan ‘Lumafast’ ve Pseudomonas alcaligenes’den ‘Lipomax’ adı verilen iki bakteriyel lipaz üretimi gerçekleşmiştir (Sharma vd., 2001; Marul, 2007). Lipaz üretiminde trigliseridlerin varlığına bağlı olmakla beraber serbest yağ asitleri, hidrolizlebilen esterler, safra tuzları ve gliserol gibi maddeler indükleyici olarak işlev görmektedir.
Sıcaklık, karbon ve azot kaynaklarının türü ve derişimi, pH, inorganik tuzların konsantrasyonu ve oksijen varlığı gibi çeşitli faktörler lipaz üretimi için önemli olup lipaz seviyesinde değişime neden olmaktadırlar (Sharma vd., 2001; Chen vd., 2003).
Karbon kaynağı olarak çoğunlukla zeytin yağı, ayçiçek yağı, soya fasulyesi yağı, susam yağı, pamuk yağı, mısır yağı, yer fıstığı yağı ve palmiye yağı gibi bitkisel yağlar ve glikoz gibi basit şekerlerde kullanılmıştır. Mısır unu özütü, maya özütü gibi azot kaynaklarının mikroorganizmalar tarafından kullanılması sonucunda da yüksek miktarda lipaz üretimi yapılmıştır. Lipaz sentezini inhibe edici ve hızlandırıcı etki gösteren maddeler de vardır. Lipaz sentezini üre ve amonyum sülfat kullanımı genellikle engellerken, oleik asit ve Tween 80, lipaz üretimi için hızlandırıcı etki göstermektedir (Sharma vd., 2001).
2.2. Lipaz Kaynakları
Lipaz enzimi ilk kez 1856 yılında lipaz Claude Bernard tarafından pankreas salgısında keşfedilmiştir.
Lipazların ticari uygulamalarında hayvan pankreas özütleri kullanılırken, lipazın endüstriyel potansiyelinin büyümesiyle ve ihtiyacın hayvansal kaynaklardan karşılanamamasından dolayı, lipazın bitkisel ve mikrobiyal kaynakları keşfedilmiştir. Lipazların mikroorganizmalardan kolay bir şekilde izole edilmeleri lipaz kaynağı olarak bakteri ve mantarların baskın olarak kullanılmalarına neden olmuştur (Tekiner, 2011). Lipazlar doğada bitkisel, hayvansal ve mikrobiyal kaynaklar gibi kaynaklardan elde edilirler.
2.2.1. Hayvansal lipazlar
Hayvansal lipazlara baktığımızda doku, sindirim sistemi ve süt lipazları şeklinde ayrılırlar. Doku lipazları, karaciğer, lipoprotein ve adipoz dokusu lipazıdır. Sindirim sistemi lipazları ise pankreas ve incebağırsak lipazları şeklindedirler.
Balıklardan da lipaz elde edilmiştir. Kefal, atlantik morinası, leopar köpek balığı, gök kuşağı alabalığı, sardunya, çizgili levrek, somon balığı gibi balıkların sindirim bezleri, sindirim organları, karaciğer ve yağlı dokularından lipaz elde edilmiştir (Aryee vd., 2007). Yengeçler canlı bir şekilde yakalanarak pankresı çıkarılmış ve -20 °C’de saklanıp lipaz eldesi için kullanılmıştır (Cherif vd., 2007).
2.2.2. Bitkisel lipazlar
Bitkisel lipazlar, endüstriyel alanda kullanılanım alanı oldukça fazladır. Enerji rezerv dokularda bitkisel lipazlar bulunmaktadır (Balashev vd., 2001). Buğday, yulaf, mısır lipazları bitkisel lipazlardır. Kene otu tohumu (Ricinus communis) ve kolza tohumu (Brassica napus) gibi yüksek yapılı bitkilerde de lipaz enzimi mevcuttur (Pandey vd.,1999). Ağaçların bazı türlerinde de lipaz enzimi bulunur. Teksas’dan Kuzey Kalifornia’ya kadar uzanan kıyı şeridinde yetişen Çin don yağı ağacı olan Sapium sebiferum L.’den lipaz elde edilmiştir (Gao vd., 2008).
Pamuk tohumu (Akbulut, 2014), çam fıstığı tohumu (Kılar,2015), ceviz tohunu (Demirkan,2008), badem tohumu (Başkurt, 2005), fındık tohumu (Kılıç, 2003) gibi yağlı tohumlarda lipaz enzimi vardır. Ayrıca buğday tohumu (Kapranchikov vd., 2004) ve menengiç meyvesinde (Altundaş, 2016) lipaz enzimi bulunur.
2.2.3. Mikrobiyal lipazlar
Mikroorganizmadan elde edilen enzimlerden yüksek verim elde edilir, katalitik aktivitelerin oldukça yüksek, genetik manipülasyonların kolay, mevsimler değişimlerinin olmaması nedeniyle düzenli kaynağa sahiptirler ve ucuz ortamlarda gelişimleri kolaydır (Wiseman, 1995).
Küçük hacimlere sahip olan mikrobiyal lipazlar büyük miktarlarda (Jaeger ve Eggert, 2002) üretilebilirler bu yüzden hayvansal lipazlardan ensdüstriyel açıdan daha çok öneme sahiptirler (Gill ve Parish, 1997). Bakteriyel ve mantarlardan elde edilen lipazlar, mikrobiyal lipazlar içinde yer alır.
Fungal lipazlar
Fungal lipazların teknolojide tercih edilmesinin sebebi, grup fermentasyonunda kullanılmaları ve düşük maliyette ekstraksiyon metotlarından dolayıdır. Bazı temel lipaz üreticisi olan funguslar, Mucor, Rhizopus, Geotrichum, Rhizomucor, Aspergillus, Humicola, Candida ve Penicillium’dur (Çakar, 2016).
Bakteriyel lipazlar
Achromobacter, Alcaligenes, Arthrobacter, Bacillus, Geobacillus, Burkholderia, Chromobacterium ve Pseudomonas cinsleri önemli bakteriyel lipaz kaynaklarıdır.
2.3. Lipazların Uygulama Alanları
Lipazlar, sterospesifiklik ve substrat seçimliliği gibi özelliklerinden dolayı kaliteli ürün üretmesi, düşük aktivasyon enerjisine ihtiyaç duymalarından, düşük ısı ve pH’larda reaksiyon verdikleri için reaksiyonda ihtiyaç duyulan enerjinin azalması ve reaksiyon ürünlerinin ortamın ısısından dolayı görecekleri zararın azalması (Seren, 2013) gibi daha birçok özelliği sayesinde günümüzde organik kimyacılar, eczacılar, biyofizikçiler, biyokimyacılar, biyomühendisler, biyoteknologlar ve mikrobiyologlar tarafından tercih edilen bir enzimdir (Çakar, 2016).
Saflaştırılmış ticari enzimler, lipazlarla yapılan endüstriyel uygulamalarda kullanılmaktadır (Gupta vd., 2004). Enzimlerin ticari olarak kullanılmasında %59’unu proteazlar, %28’ini karbohidrazlar, %3’unu lipazlar ve %10’unu ise diğer enzimler oluşturmaktadır (Wiseman, 1995; Seren, 2013 ). Lipaz 1960’ların sonlarında tıpta sindirim yardımcısı olarak kullanılırken teknolojinin gelişmesiyle birlikte lipazın kullanım alanı da artmaya başlamıştır. Hayvansal, bitkisel ve mikrobiyal lipazlar endüstriyel alanda kullanılmaktadır (Seren, 2013).
Lipazlar biyoremediasyon işleminde de kullanılmaktadır. Ayrıca atık suların arıtılmasında geniş bir kullanım alanına sahiptir. Fabrika atık sularının arıtımında oluşan tortullardan biyogaz elde edilirken, enzim karışımları kullanılmaktadır. Bu enzim karışımlarında lipaz enzimi de bulunmaktadır. Kullanışlı ürünler içindeki poliester atıkları indirgenerek, laktonların ve esterifiye olmamış yağ asitlerinin üretimi sağlanan uygulamalar da lipazların
kullanıldığı diğer uygulamalarıdır. Lipazların su soğutma sistemlerinde oluşan biyofilm tortularının kaldırılmasında, atık yağların değerlendirilmesi ve fabrikalardan çıkan atık gazların saflaştırılmasında, yağ fabrikalarının atık sularına karışan zeytinyağı gibi yağların yok edilmesinde kullanılan başka uygulamaları da bulunmaktadır (Pandey vd.,1999).
Lipazlar deterjan, gıda, kağıt imalatı, kozmetik, tekstil, organik madde sentezi, olekimya endüstrisi, biyodizel üretimi ve biyosensör olarak pek çok endüstride kullanılmaktadır. Lipazların en önemli uygulamaları Çizelge 2.1 de görülmektedir.
Çizelge 2.1. Lipazların endüstriyel uygulamaları (Hammamchi, 2014).
Endüstri Görevi Ürün ya da Uygulama
Deterjan Yağların Hirolizi Yağ pisliklerini kumaşlardan
uzaklaştırmak
Kozmetik Sentez Emülsifiye ediciler,
nemlendiriciler
Kağıt Hidroliz Geliştirilmiş kalitede kağıt
Deri Hidroliz Deri ürünleri
İlaç Transesterifikasyon Sindirimi kolaylaştırıcı
düzenleyiciler
Hidroliz Özel lipidler
Yağ Transesterifikasyon Kakao yağı, margarin, yağ
asitleri, gliserol
Hidroliz Mono ve diaçil gliseroller
İçecek Aroma geliştirilmesi İçecekler
Ekmek Tat geliştirilmesi Raf ömrünün uzatmak
Temizlik Hidroliz Yağların uzaklaştırmak
2.3.1. Deterjan endüstrisinde lipazlar
Deterjanlardaki kimyasalların azaltılması, deterjan endüstrisinde kullanılan enzimler ile olmaktadır. Böylelikle de çevrenin ve canlıların daha az zarar görmesi sağlanır. Ayrıca düşük sıcaklıklarda çalışarak enerji tasarrufu da sağlarlar (Hasan vd., 2006). Yağ lekelerini oluşturan trigliseritlerdeki çeşitlilikden dolayı substrata spesifik olması, 30-60 ºC sıcaklık, pH 10-11 gibi koşulları da enzim stabilitesinin devamlılığı, sürfaktan ve proteazlar gibi katkı maddelerinin neden olduğu proteolitik degredasyondan etkilenmemelerinden dolayı lipazlar deterjan endüstrisinde aranan unsurların başında gelir. Deterjan enzimleri, toplam lipaz satışlarının yaklaşık %32’sini oluşturmaktadır. On üç milyon ton deterjan üretiminde yaklaşık olarak bin ton lipaz her yıl kullanılmaktadır (Sharma vd., 2002).
Lipaz enzimi, sanayide ve ev çamaşırlarının yıkanmasında kullanılan deterjanlarda, ayrıca bulaşık deterjanlarında içerik olarak kullanılan enzimlerden biridir. Enzimlerin deterjanlarda kullanılması lekelerin daha basit forma dönüşmesini sağlar ve böylelikle lekelerin temizleyiciler tarafından uzaklaştırılması kolaylaşır (Hasan vd., 2006).
1998 yılında Pseudomonas alcaligenes M–1 tarafından üretilen alkalen lipazının yağlı lekeleri iyi bir şekilde çıkardığı bildirilmiştir (Sharma vd., 2001). Japonya'da yer alan Miyoshi Yushi fabrikasında Candida rugosa lipazı, katı ve sıvı yağların hidroliz edilmesiyle sabun üretmek için kullanılınır (Schmid vd., 1998).
Lipazlar temizleyici olarak kullanılır aynı zamanda da kireçlenmeyi de önlemektedir. Lipazlar, ağartma bileşeni olarak, kuru temizleme çözücülerindeki yağ bileşenlerini parçalamada, deri endüstrisinde temizleyici olarak, lensler üzerindeki tortuları temizlemede kullanılan bir kontak lens temizleme bileşeni olarak, yağlarla tıkanmış olukların temizlenmesinde, boşaltma borularının, lağım borularının yüzeyindeki organik atıkların parçalanmasında ve hayvan gübrelerinin temizlenmesinde selülazlarla birlikte kullanılması gibi uygulamalar lipazların temizlikle ilgili diğer uygulamaları arasında yer alırlar (Gandhi, 1997). 2.3.2. Gıda endüstrisinde lipazlar
Besin sanayisinde, gıda üretiminde, biyolojik malzemelerde lipazlar kullanılır. Peynirin tatlandırılması, süt ve süt ürünleri, meyveler, bira, sebzeler gibi pek çok gıdada lezzet artırıcı olarak lipazlar kullanılmaktadır (Çakar, 2016). Aynı zamanda, et ve balık ürünlerinde yağların uzaklaştırılmasıda lipazlarında etkiside vardır (Kazlauskas ve Bornscheuer,1998).
Tereyağı, lipazla kısmi olarak hidroliz edilerek patlamış mısır, sıvı yağlar, katı yağlar, tahıllar, şekerlemeler, tüketime hazır gıdalar ve unlu mamüller gibi birçok gıda maddelerine lipazlar ilave edilmektedir. Süt tadı katması için kahve beyazlatıcılarına, şekerlemelere, hamurlara, çorbalara ve unlu mamüllere lipazla modifiye edilmiş olan kremalar eklenmektedir. Ayrıca lipazlar süt yağların hidrolizini de kontrol etmektedir (Seren, 2013).
Bazı mikroorganizmalar, gıdalarda bozulmaya neden olurlar. Bozulmaya yol açan mikroorganizmaları ve gıda toksinlerini tespit etmek için lipazların indeks olarak kullanılabileceği bulunmuştur. Lipazların gıdaların çürümesine yol açan psikotrof organizmaların üzerinde etkisi olduğunu ve bunların kontrolünde kullanılabilirliği bir başka çalışmada rapor edilmiştir (Kuo, 2002).
Lipazlar, lipidlerin özelliklerinin değiştirilimesini gliseritdeki yağ asidi zincirlerinin konumunu yeni yağ asitleriyle bir veya daha fazla yağ asidinin yer değiştirmesini sağlayarak
yaparlar. Böylelikle daha ucuz olan bu yöntemle de lipidin az miktarda olması sağlanarak daha değerli bir yağa dönüşmesi sağlanır (Colman ve Macrae, 1980; Pabai vd., 1995a,1995b; Undurraga vd., 2001).
2.3.3. Kağıt endüstrisinde lipazlar
Katran veya balmumu ağaçların tirigilseritler gibi hidrofobik bileşenleri kağıt hamuru ve kağıt üretiminin yapım aşamasında problemlere ve kağıdın kalitesinin düşmesine neden olmaktadırlar. Lipazlar, kağıt hamurundan katranın çıkarılması gibi olumsuzlukları giderdiği için kağıt imalatında kullanılmaktadır. Bunun gibi sorunları çözmek amacıyla trigliseritlerin % 90 oranında hidrolizini sağlayan Candida rugosa fungal lipazinin kullanıldığı bir metod Japonya’da, Nippon Kağıt Endüstrisi tarafından geliştirilmiştir (Sharma vd., 2001). Kağıt beyazlatma çalışmalarında fungal lipaz enzimi kullanılır. Pseudomonas türleri bu sanayide kullanılan funguslar arasında bulunan türlerdir (Jaeger vd., 1998; Sharma vd., 2001).
2.3.4. Tekstil endüstrisinde lipazlar
Lipaz enziminin tekstil endüstrisinde yeri büyüktür. Lipaz, boyadan kaynaklı yağları uzaklaştırarak kumaşların iyi bir şekilde boyanmasını sağlamaktadır. Derinin aşınmasından dolayı oluşan çatlakların yok edilmesinde lipaz kullanılmaktadır. Kot ve pamuklu kumaşların şekillenmesi için kullanılan ticari preparatlarda lipaz enzimi bulunmaktadır. Ayrıca tekstil ürünlerinde dayanıklılık, yumuşak yapıya sahip olma, leke tutmama, esneklik, makine aşınması gibi birçok önemli özellikleri sağlamak için lipazlar kullanılmaktadır (Çakar, 2016).
2.3.5. Kozmetik ve parfüm endüstrisinde lipazlar
Sürfaktanlar, kozmetik endüstrisinin bileşeni olmakla beraber bunların üretiminde lipazlar kullanılmaktadır. Kozmetikte kullanılan sürfaktan, monoaçilgliseroller ve diaçilgliseroller, gliserolün lipazlar tarafından katalize edilen esterifikasyon reaksiyonları sonucu oluşmaktadır (Pandey vd., 1999).
Kozmetik ve parfüm endüstrisinde kokuların transesterifikasyon ile üretimi ve rasemik ara ürünlerin ayrıştırılması için lipazlardan faydalanılmaktadır. Lipaz, Pseudomonas cepacia tarafından üretilmiş olup, sitronelolün bromometoksilasyonu sonucu elde edilen rasemik gül oksitlerinin ayrıştırılmasında kullanılmaktadır (Taneja vd., 2005).
Pseudomonas cepacia‘dan üretilen lipazla hidrosinamik asit esterlerinin sentezi yapılır ve sentezi yapılan bu hidrosinamik asit esterlerinin, parfüm ve güneş kremlerinde kullanım alanı vardır.
Gargara sıvıları ve tıraş kremleri de serinleme hissi vermek için mentol bulundururlar. Esterifikasyon işlemiyle mentol yapay olarak üretilebilmektedir. Bu işlem doğal mentolün yetersizliğinde yapılmaktadır. Pseudomonas cepacia ve Pseudomonas fluorescens‘den lipazlar elde edilmiştir. Elde edilen lipazdan faydalanılarak mentol esterleri ve benzer bileşikleri ürettiklerine dahil patent almışlardır (Chaplin vd., 2006; Tekiner, 2011).
2.3.6. Biyodizel endüstrisi
Alternatif enerji kaynağımız olan biyodizel, biyolojik olarak parçalanabilen ve yenilenebilen bir yakıt olarak karşımıza çıkmaktadır. Soya fasulyesi yağı, pirinç kepeği yağı, ayçiçek yağı, hurma yağı gibi sebze yağlarından, pamuk yağı, jatrofa (tropikal bir bitki) yağı, hayvan yağı, su yosunları, atık sıvı yağlar ve endüstriyel asit yağlarından biyodizel üretimi yapılmaktadır (Tekiner, 2011). Fosil yakıtlardan biyodizel elde etmek zor ve pahalı olduğu için enzimatik transesterifikasyon ile bitkisel yağlardan biyodizel üretimi yapılmaktadır (Çakar, 2016).
Kemokatalitik, termokatalitik ve biyokatalitik yaklaşımlarla biyodizel sentezi yapılmaktadır. Bu yaklaşımlardan olan biyokatalitik yaklaşımlar biyokatalizör olarak lipazları kullanmaktadır (Chen vd., 2009; Dizge vd., 2009; Raita vd., 2010).
2.3.7. Organik madde sentezinde lipazlar
Lipazlar son zamanlarda organik madde sentezinde kullanılmışlardır. Bu enzimler lipofilik ve hidrofilik yüzeyler arasında çalışarak reaksiyon karışımındaki organik çözünenleri tolere eder. Reaksiyonda suyun ne kadar olduğu lipazların reaksiyon yönünü belirlemektedir. Suyun olduğu reaksiyonlarda hidroliz tepkimesi meydana gelirken suyun az olduğu veya hiç olmadığı reaksiyonlarda esterifikasyon ve transesterifikasyon tepkimesi gerçekleşmektedir (Sharma vd., 2001).
Lipazın bir başka kullanım alanı ise sulu ve organik ortamda biyodönüşümlerde, rasemik asit ve alkollerin rezolüsyonunda, bölge seçimli açillemelerde ve ester sentezinde kullanılmaktadır (Hasan vd., 2006). Ekstrem koşullarda kararlılık gösterir bu yüzden lipazlar önemli biyokatalizörlerdir.
2.3.8. Oleokimyasal endüstrisinde lipazlar
Lipazlar oleokimyasal işlemlerde, alkoliz, hidroliz ve gliseroliz esnasında enerjiyi korumak ve termal dereceyi en aza indirmek amacıyla kullanılmaktadır (Vulfson, 1994; Bornscheuer, 2000). Bu yüzden olekimyasal endüstrideki kullanımları büyüktür.
Hidroliz, alkoliz ve gliseroliz reaksiyonlarını içeren çeşitli reaksiyonlar, doğrudan karışık substratlar üzerinde bir dizi immobilize olmuş lipazların kullanımıyla gerçekleştirilmektedir. Böylelikle proses devamlı işlenmiş olur ve yüksek verim elde edilir. Organik çözücüler ve emülsifiyerlerin kullanımını oleokimyasal endüstride azalmıştır (Seren, 2013).
2.3.9. Biyosensör olarak lipazlar
Biyolojik, kimyasal, biyokimyasal ve elektronik bileşenlerden biyosensörler oluşur. Enzimler, antikorlar, proteinler, hücreler, hücre özütleri, immobilize ya da bağlı konumda uygun sinyal üreticileri biyosensör bileşenleri arasında yer alabilir. Bakteriyel “biyolüminesanslı” biyosensörler uygulamalı tıpta geliştirilmiştir. Lipazların en önemli analitik kullanımları klinik amaçlar için lipitlerin belirlenmesidir. Triaçilgliserollerden gliserol eldesinde lipazlar kullanılmakta, kimyasal ve enzimatik yöntemlerle ayrılmış olan gliserol miktarı hesaplanabilmektedir (Tutar, 2009). Biyosensör bileşini olan lipazlar aynı zamanda da gıda ve içecek endüstrisinde, kirlilik analizinde, pestisit kontaminasyonu izlenmesinde ve ilaç endüstrisinde de kullanılırlar (Pandey vd., 1999).
2.4. Lipaz Saflaştırma
Enzimin verimi ve iyi kullanım alanı için enzimlerin saflaştırılması önem kazanmıştır. Enzimin üç boyutlu yapısını ve temel aminoasit dizininin belirlenmesinde saflaştırma yapılmaktadır. Saflaştırılmış lipazın X ışını çalışmaları, yapı-fonksiyon ilişkisinin saptanmasına ve lipazın kinetik mekanizmasının güzel bir şekilde anlaşılmasını sağlamaktadır (Şengel, 2007).
Bir enzimi yüksek saflıkta elde etmek için tek bir kromatografik yöntem yeterli değildir (Saxena vd., 2003). İyon Değiştirme (IEC), jel filtrasyon (GFC) ve hidrofobik etkileşim kromatografisi (HIC) gibi yöntemler lipaz saflaştırmak için çoğunlukla kullanılan kromatografik yöntemlerdir.
Genellikle kullanılan iyon değiştiriciler; Q-sefaroz (Nawani ve ark., 2006), Amberlite IRA 410 (Cl-1 formu) (Chakraborty ve Raj, 2008), DEAE-selüloz (Kambourova vd., 2003; Kanwar vd., 2006; Ghori vd., 2011), DEAE-sefaroz (Kumar vd., 2005), CM-sefaroz (Lianghua ve Liming, 2005) ve CM-selüloz (Vujaklija vd., 2003)’dur.
İyon değiştirme kromatografisi gibi benimsenen diğer bir yöntem ise jel filtrasyon kromatografisidir. Bu yöntemde, sefakril (Sharma vd., 2002; Lianghua ve Liming, 2005), sefadeks (Lee vd., 2001; Ghori vd., 2011), sefaroz (Nawani vd., 2006), süperdeks (Kojima ve Shimizu, 2003; Kim vd., 2005) ve sephadex gibi matriksler kullanılmaktadır.
Hidrofobik etkileşim kromatografisinde de oktil veya fenil adsorbanlarını kullanmaktadır (Saxena vd., 2003; Kanwar vd., 2006; Ahmed vd., 2010).
Pauwels ve Gelder (2008) lipaz salgı mekanizmasından yararlanılarak lipaz saflaştırmada yeni bir strateji geliştirilmiştir. İmmobilize edilmiş His-işaretli Lif kullanılarak lipazın saflaştırılması gerçekleştirilmiştir. Pseudomonas cepacia‘dan alkalen bir lipaz saflaştırırken ‘Amberlit’ iyon değiştirme reçinesi üzerinde ‘Genişletilmiş Tabaka Absorpsiyonu’ (Expanded Bed Absorption, EBA) kullanarak saflaştırmıştır (Padilha vd., 2009). EBA yeni bir teknik olup ham enzim numunesini ön hazırlık saflaştırma proseslerine maruz bırakılmadan saflaştırma yapılan tekniktir. Ters miseller yöntemi ise lipaz saflaştırmada kullanılan modern yaklaşımların bir diğeridir (Gupta vd., 2004; Lima vd., 2004).
3. HAŞHAŞ
Eski bir kültür bitkisi olan haşhaşı Mezopotamya’da, Sümerler ve Asurlar bilmektedir. Sümerlerin kullandığı dilde bazı kelimelerinin afyona ait olduğu bilinmektedir (İncekara, 1979; İpek, 2011). Ayrıca Sümerler haşhaşı “Neşe bitkisi” olarak da isimlendirmişlerdir. Afyonun teröpatik etkisi Çinliler tarafından da belirlenmiştir (Anonim, 2007). Haşhaş resimlerine MÖ Mezopotamya’da yaşayan Asurlara ait olan bazı kabartmalarda rastlanılmış olup, Asurilere ait olan bir kabartmada kralın elinde lotus ve haşhaş demetleri tuttuğu görülmüştür. Kabartmada gözlenen bitki daha o zamanlarda haşhaşın bilindiğinin göstergesi olur (İncekara, 1979; İpek, 2011).
Türkiye’de ise haşhaş yetiştiriciliği ve haşhaş ticareti 1933 yılına kadar serbest biçimde yapılmış olup Uyuşturucu Maddeler İnhisar İdaresi kurulmasından sonra bakanlar kurulu kararı dâhinde, haşhaş ekimi on yedi ilde sınırlandırılarak kontrollü üretim yapılması sağlanmıştır. 1938 senesinde ise Toprak Mahsulleri Ofisi (TMO) kurulduğundan uyuşturucu maddelerin kontrolünü TMO üstlenmiştir (İpek, 2011). Uluslararası TEK (Single Convation on Narcotic) sözleşmesince 1961 yılı da dahil olmak üzere Türkiye sınırlı üretime geçerek haşhaş ekimi için ayırdığı arazilerini daraltmaya başlamıştır. 1962-63 yıllarında ise haşhaş üretimi için 42 ile izin verilmiştir (Arslan vd., 1986; İpek, 2011).
1971 yılına kadar haşhaştan afyon üretimi yapılmış olup bu yıldan sonra haşhaş ekimi Türkiye'de yasaklanmıştır. 01/07/1974 tarih ve 7/8522 sayılı Bakanlar Kurulu Kararı ile 1974 yılından itibaren ilaç için hammadde gereksiniminin karşılanması ve haşhaş yetiştiriciliği ile geçimini sağlayan çiftçilerin hayat koşullarının düzelmesi için haşhaş ekimi ve ham afyonun üretimine yedi şehrimizde serbest hale getirilmiştir. Serbest hale getirilen iller şunlardır; Afyon, Burdur, Isparta, Denizli, Kütahya ve Uşak illerinin tamamı ile Konya’nın Akşehir, Beyşehir, Doğanhisar ve Ilgın ilçeleridir. Sonrasında 06/12/1974 tarih ve 7/9204 sayılı kararnamesi ile afyon üretiminde kullanılan haşhaş kapsülünün çizilmesi yöntemi riskli olduğu için yasaklanıp çizilmemiş haşhaş kapsülü üretimine geçilerek daha güvenli üretim yapılmaya çalışılmıştır. Morfin elde edilmeye Bolvadin Afyon Alkaloidleri Fabrikası tarafından 1981 senesinde başlanmıştır. Türkiye’de haşhaş tarımı 03/06/1986 tarih ve 3298 sayılı Uyuşturucu Maddelerle ilgili Kanun ve 18/04/1988 tarih ve 88/12850 sayılı Yönetmeliğe göre uygulanmaya devam etmektedir (İpek, 2011).
Ülkemizde haşhaş ekim alanları %48'lik bir paya sahip olmasına rağmen bu oran morfin üretiminde %18’dir.
Böyle bir durumun olması haşhaşın kapsülündeki dekar başına düşen üretimde verimin ve içeriğindeki morfin oranının başka ülkelere oranla düşük olmasından kaynaklanmış olmaktadır (Anonim, 2010).
Dünyada haşhaş bitkisinin tarımı yasal ve yasal olmayan şekilde Avrupa’da Bulgaristan, Macaristan, Yunanistan, Polonya, Çek Cumhuriyeti, Slovakya, Avusturya, Almanya, Belçika, Fransa, Hollanda ve Rusya’da; Asya’da Türkiye’den başka Hindistan, İran, Türkistan, Pakistan, Tayland, Çin, Japonya; Afrika’da Tunus; Amerika’da bazı Güney Amerika ülkelerinde ve Meksika’da yapılmaktadır (Ehleringer vd., 1999).
Dünyada yasal olarak haşhaş ekimi BM Teşkilatı kontrolünde gerçekleşmektedir. Kontrollü haşhaş ekiminin olması bazı ülkelerde bazı zamanlarda yasaklanmaktadır. Türkiye, Hindistan, Avustralya, Fransa, İspanya, Macaristan ve diğer ülkelerden Çek Cumhuriyeti ile Çin yasal üreticiler arasında yer almaktadır. Türkiye ve Hindistan BM tarafından geleneksel haşhaş üreticisi ülke konumundadırlar. Türkiye, hala dünyanın en önemli yasal haşhaş ekim alanlarının yaklaşık olarak yarısını elinde bulunduran ve afyon alkaloidleri üreticisi olan ülkelerin başında yer almaktadır (İpek, 2011).
3.1. Haşhaş Bitkisi ve Haşhaş Tohumu
Haşhaş (Papaver somniferum L.); Rhoedales takımından, Papaveraceae familyasından ve Papaver cinsindendir. Ülkemiz Papaver türleri açısından zengin bir ülke sayılmaktadır (Kapoor,1997; Davis vd., 1988). Papaveraceae familyasındaki bitkiler dünyada kuzey yarım küredeki ılıman ve subtropik bölgelerinde yetişmektedir (Seçmen vd., 1995).
Ülkemizde bulunan Papaver L. türleri bir yıllık ya da çok yıllık otsu bitkiler olup, bir yıllık olan türlerin kökleri zayıftır. Çok yıllık otsu olan türlerde ise kök sistemi gelişmiştir. Türler içinde boyu 120 cm olanları da vardır. Papaver L. cinsinin çiçekleri genellikle gösterişli çiçeklerdir. Beyaz, eflatun, pembe, veya kırmızı çiçek renklerine sahiptirler. Meyve olarak kapsül şekline sahip olup çaplarının 5-7 cm olanları bulunmaktadır (Arslan vd., 2008).
P. somniferum ssp. spomtaneum ve P. somniferum spp. anatolicum olmak üzere Papaver somniferum’ da iki alt tür mevcuttur. P. somniferum ssp. spomtaneum alt türünün olgunlaştığı zaman üstten delikler açılır ve tohumlarını döker. Bu alt türe ülkemizde “açık haşhaş”denilmektedir. P. somniferum spp. anatolicum alt türünde ise kapsülleri olgunlaştığında açılmayıp tohumlarının dökmezler ülkemizde bu alt tür ise “kör haşhaş” olarak adlandırılmaktadır. Türkiyede ağırlıklı olarak P. Somniferum ssp. anatollicum alt türü beyaz ve mor renkli çiçekli varyeteleri tarımsal amaçla kullanılır (Tanker, 2003).
Şekil 3.1. Haşhaş (Papaver somniferum L.) bitkisin çiçek renkleri.
Haşhaş (Papaver somniferum L.) bitkisi, kapsüllerindeki alkolidler, tohumlarında bulunan yağdan dolayı önemli bitkidir. Özellikle alkolidleri için yetiştirilen kültür bitkisi olan haşhaş aynı zamanda tıbbi bir bitki olarak da kullanılmaktadır (İpek, 2011). Islah çalışmaları yapılmış haşhaş çeşitlerindeki kapsüllerde % 1 alkolid bulunmaktadır (Koç vd., 2006). Kapsüllerinin içinde çok sayıda tohum bulunur. Bu tohumlar içerisinde de farklı renklerde tohumlarda bulunmaktadır. Tohumlardaki farklı renkler çiçek renginin farklılığından kaynaklanmaktadır. Beyaz renkli çiçeği olanlarda beyaz ve sarı tohumlar, mor renkli çiçeği olan bitkide ise pembe ve kahverengi tohumlar olmaktadır (Arslan vd., 2008).
Haşhaş tohumlarının çimlenebilmesi için toprağın yeterince rutubetli olması ve toprak sıcaklığının +4 °C’de olması gerekmektedir. Eğer toprak sıcaklığı +4 °C’den düşük olursa tohum çimlenememektedir. Sonbaharda +4 °C’den daha yüksek sıcaklıklarda oldukça iyi gelişmektedir. Normal kış aylarında bitkilerin zarara uğramaması için kök sisteminin iyi gelişmesi ve 6-8 adet rozet yapağa sahip olması gerekmektedir. Sıcaklığı ve güneşi seven bir bitki olup ışıklanma süresinin uzun olduğu yerlerde de kapsülünde bulunan morfin oranı da artış göstermektedir (Çapur, 2006).
Şekil 3.2. Papaver somniferum L.
Haşhaş tohumlarının genellikle % 44-50 sabit yağ, % 4,3-5,2 nem, % 22,3-24,4 protein, % 4,8-5,8 ham lif ve % 5,6-6,0 kül içerdiği belirlenmiştir (Küçük, 1996; Önmez, 2007). Haşhaş tohumunda bulunan Ca, K, Mg, P, S, Fe gibi elementler ana mineral maddeler olup, kadmiyum (Cd) ve kurşun (Pb) gibi ağır metalleri içermemektedir. Otuz iki tür arasında bir çalışma yapılmıştır. Bu çalışmada en fazla fosfor (P) içeriği haşhaş bitkisine (5795 mg/kg) ait olduğu belirlenmiştir. Bu durum haşhaşı daha değerli hale getirmektedir (Özcan, 2004). Tohumları oleik ve linoleik asit bakımından zengin, soluk sarı veya altın sarısı rengine sahip oldukça kaliteli olan yemeklik yağ elde edilmektedir. Çok fazla çift bağ içeren yağı kuruyucu özellikte olduğundan boya sanayisinde kullanılabilecek potansiyeldedir (Arslan vd., 2008).
Ülkemizde birçok yağlı tohumlu bitki mevcuttur. Bu yağlı tohumlu bitkilere bakacak olursak; soya, ayçiçeği, yerfıstığı, susam, kanola, haşhaş, pamuk, aspir ve keten-kenevirdir Bu bitkilerdeki tohumların veya meyvelerin işlenmesiyle ham yağ eldesi yapılmaktadır. Tüketimi yapılan yağlardan Ayçiçek yağından %39,4, pamuk yağından %29,2, soya yağından %13,4, zeytin yağından %8,2, mısır yağından %4,8, haşhaş, kolza, palm gibi diğer yağlardan %5 oranlarında yağ eldesi yapılmaktadır (Anonim, 2004).
3.2. Haşhaş Yağı
Haşhaş bitkisinin tohumlarından sıcak usulle preslenme yapılarak haşhaş yağı elde edilmektedir (Çapur, 2006). Haşhaş yağı yüksek besleyici değeri olan gıda ve yemeklik yağ kaynağı olarak kullanılan yağlardan olup çoklu doymamış yağ asitlerince zengin bir kaynaktır (Hlinkova vd., 2012). Haşhaş yağının %88,2’sini doymamış yağ asitleri oluşturmaktadır. Doymamış yağ asitlerinde bulanan linoleik asit (C18:2) toplam yağ asitlerinin %74,5’ini oluşturmuş olup palmitik asit (C16:0) ise doymuş yağ asitlerinin %84’ünü oluşturmaktadır
(Bozan ve Temelli 2008). Palmitik asit ve linoleik asitlerin dışında %0,4 palmitoleik, %1,9 stearik, %15,0 oleik, ve %0,6 linolenik gibi birçok yağ asitlerini içermektedir (Atakişi, 1999).
Haşhaş yağı ayrıca diyet ürünlerde ayçiçeği yağı için uygun bir alternatif olarak düşünülmektedir (Küsmenoğlu vd., 2002). Eskişehir ve Konya civarında bir çalışma yapılmıştır. Bu çalışmada keten, aspir ve haşhaş tohumlarından alınarak kimyasal özellikleri incelenmiştir. Bu yağlı tohumlardan en fazla yağa sahip bitkinin haşhaş tohumu olduğu belirlenmiştir. Aynı zamanda haşhaş tohumlarınnn % 49,9 oranında yağ, %21,6 oranında protein, %5,3 oranında nem, %5,9 oranında kül ve %18,3 oranında karbonhidrat ve lif içerdiği bu çalışmada tespiti yapılmıştır (Bozan ve Temelli, 2008).
3.3. Haşhaşta Bulunan Afyon
Afyon, Papaver somniferum türlerinin kapsülünde yüksek oranda bulunmaktadır. Kapsülün mezokarpında bulunan süt borularında özel bir salgı (lateks) içermektedir. Kapsülün enine olarak çizilmesiyle süt borularındaki lateks akar ve bu lateksin havada kurumuş şekline afyon denilmektedir. Kurumadan önce elastikli yapıda kuruyunca da sertleşen bir kütleye dönüşen yapıdadır. Kahverengi ve siyaha kadar değişen ham afyonun rengini oluşturur (Baytop, 1974).
Afyonda alkaloidler toplam olarak % 10-25 arasında bulunmaktadır (United Nations, 1987). Afyondan yaklaşık yirmi beş alkaloid izole edilmektedir. Bu alkaloidlerin eczacılıkta kullanılanları şunlardır: morfin, kodein, tebain, papaverin, laudanin, narkotin (=noskapin) ve narsein’dir. Afyonda aynı zamanda mekonik asit, laktik asit, bazı organik ve inorganik asitler, reçineler, proteinler, lipidler, şeker ve % 12-15 su bulunmaktadır (Çapur, 2006).
Aklaloidler içerisinde miktarca en fazla ham afyonda bulunan morfindir. Morfinin derişimi % 4’den % 21’e kadar değişmektedir. Moleküler olarak baktığımızda biri fenolik iki hidroksil grubu taşıyıp beş halkadan meydana gelmektedir. Bu halkalardan ikisi heterosikliktir; diğer üçü, bir fenantren halkası meydana getirmek üzere birleşmiştir (Tanker, 1990).
Afyonun ne kadar miktarlarda verildiği önemlidir. Az miktarda verilen afyonda solunum hızlandırır ve ağrı kesici özellikte olmaktadır. Eğer afyonu çok miktarda verilirse solunumu durdurur ve sarhoşluk yapmaktadır. Uykusuzluğu gidermek, öksürük kesmek, ishali durdurmak, nefes darlığını önlemek ve çizgisiz adale spazmlarından doğan sancıları gidermek gibi başka görevleri de vardır (Çapur, 2006).
3.4. Haşhaşın Kullanım Alanları
Haşhaşın çok uzun zamanlara dayanan kullanımı vardır. Romalılar ve Yunanlılar haşhaş tohumlarını gıda ve tıbbi amaçlı kullanmışlardır. Mısırlılar haşhaş tohumlarını çeşni gibi kullanmışlardır. Eski Yunanlılar haşhaş tohumlarını birçok alanda kullanmışlardır. Haşhaş tohumları ballı keklerin içine karıştırıp olimpik atletler tarafından tüketilmiştir. Romalılar zamanında haşhaş süs olarak kullanılmıştır. Ekmeklerin üstünü süslemişlerdir (Charles, 2013).
Haşhaş bitkisinin kapsüllerinde bulunan alkolidlerden ilaç yapımında kullanılırken, tohumlarından elde edilen yağ genellikle yemeklik yağ olarak, boyacılıkta, sabun sanayisinde ve endüstrinin daha birçok alanında kullanıma sahiptir. Presleme yöntemiyle yağı elde edilen haşhaş küspesinin içinde ortalama % 36 ham protein ve % 12 civarında ham yağ vardır. Küspesi hayvan yemi olarak kullanıldığı zaman bu oranlar ineklerin süt verimini olumlu sonuçlar oluşturur (İpek, 2011).
Haşhaş bitkisinin yaprakları, ilk gelişme zamanlarında salata olarak yenilebilmektedir. Ayrıca tohumları pastalarda süs amaçla kullanılır ya da kavrulup çerez olarak yenilmektedir. Tohumlarının kavrulup ezilmesiyle çöreklerde katkı maddesi olarak da kullanılabilmektedir. Bazı yöreler haşhaşın saplarını yakacak olarak kullanmaktadır (İpek, 2011).
Haşhaşta morfin, tebain, kodein, papaverin, narkotin ve narsein gibi etken maddeler bulunmaktadır. Bu etken maddelerden olan morfin kuvvetli bir analjezik ve narkotiktir. Şiddetli ağrılarda tedavi amaçlı olarak ve hastaların ameliyat için hazırlanmasında kullanılmaktadır. Kodein ise hafif ağrılarda ve öksürük giderici gibi kullanım alanları vardır (Gürkan vd., 2003).
Haşhaş bitkisinin öz suyunu bebek mamalarına karıştırılarak bebeklerin uyumalarında kullanmışlardır (İncekara, 1964). Haşhaş ezmesi ekmeklerde hacim ve proteinin artmasını sağladığı görülmüştür (Çelik, 2008). Köftede dana eti ile beraber haşhaş tohumu ezmesi kullanıldığında doymuş yağ asidi oranını ve kolesterolü düşürürken çoklu doymamış yağ asidini artırmıştır. Bu değişikler kardiovasküler hastalıkları önlenmesine yardımcı olup insan sağlığını önemli derecede etkilemektedir. Gıda sanayisinde hayvansal yağlar yerine bitkisel yağ olan haşhaş tohumu ezmesi kullanımı daha verimli olmakta ve yenilikçi bir et ürününün yolunu açmaktadır (Gök vd., 2011).
Badem tohumu (Başkurt, 2005), fındık tohumu (Kılıç, 2003), pamuk tohumu (Akbulut, 2014), ceviz tohumu (Demirkan, 2008) ve yer fıstığı tohumu (Kılar, 2015) gibi yağlı tohumlardan lipaz saflaştırma çalışmaları yapılmıştır. Bu tohumlarda pamuk % 30-40, badem %83,3, fındık %62, ceviz % 45-50 ve yer fıstığı % 44 yağ oranlarına sahiptir.
Haşhaşda ise % 44-50 yağ vardır. Bu çalışmalardan yola çıkılarak yağlı tohum olan haşhaşda lipaz enziminin bulunabilceği düşünülmüştür. Bu nedenle çalışmamızda haşhaş tohumu kullanılmıştır. Haşhaşdaki lipaz enzimi saflaştırılarak opimum pH, opimum sıcaklık, depo kararlılığı, enzimin stabil olduğu pH ve sıcaklıklığı, Km ve Vmax değerleri bulunması amaçlanmıştır.
4. MATERYAL VE METOT
4.1. Materyal4.1.1. Kullanılan kimyasal malzemeler
Metanol, asetik asit, aseton, amonyum sülfat, gum arabik, sodyumdeoksikolat, NaHCO3 (sodyumhidrojenkarbonat), NaH2PO4,2H2O (sodyumdihidrojenfosfat), Na2HPO4 (sodyumhidrojenfosfat), SDS (sodyumdodesilsülfat), gliserol, Tris (tris (hidroksimetil) aminometan), N,N-metilenbisakrilamit, N,N,Nʹ,Nʹ-tetrametiletilendiamin (TEMED), bromfenolblue, glisin, 2-merkaptoetanol, Sephadex G-100, Coomassie Brilliant Blue R250, Coomassie Brilliant Blue G250, Marker, Sigma-Aldrich, Merck ve Fluka firmalarından temin edilmiştir. Çalışmalarda kullanılan haşhaş tohumu ve zeytinyağı ise piyasadan temin edilmiştir. 4.1.2. Kullanılan alet ve cihazlar
Öğütücü: Ev tipi
Soğutmalı Santrifüj: Sigma K30
Vortex: Heidolp ReaxTop
Peristaltik Pompa: Ismatec RegloDigital
Su Banyosu: DAIHAN WB-11
pH Metre: SCHOTT Lab850
Mikropipetler: BIOHIT Proline
Isıtıcılı Manyetik Karıştırıcı: DAIHAN MSH-20A
Saf Su Cihazı: Merck Millipore
Analitik Terazi: SHIMADZU ATX220
Etüv: BINDER
Spektorofotometre: SHIMADZU UV1700 PharmaSpec
Buzdolabı: Ev tipi
Elektroforez Tankı: HEALTEC MiniGES Elite300
4.1.3. Kullanılan çözeltilerin hazırlanması
1. 0,1 M pH 7,0 fosfat tamponu hazırlamak için; 7,8005 g NaH2PO4.2H2O (sodyumdihidrojenfosfat) tartıldı. pH’ı 1,0 M NaOH ile 7,0 ye ayarlandı. Hacmi 350 mL tamamlandı.
2. %10’luk gum arabik çözeltisini hazırlamak için; 18 g gum arabik tartımı yapılarak 180 mL suda çözüldü. Üzerine 21 mL zeytinyağı ve 15 g buz ilave edildi.
3. Sodyumdeoksikolatı hazırlamak için; 0,8 g sodyumdeoksikolat tartım işlemi yapılarak 50 mL saf suda çözüldü.
4. Tris çözeltisi için; 0,6058 g Tris tartıldı. pH’ı 7,0 olarak 1 M HCl ile ayarlanıp hacmi 100 mL’ye tamamlandı.
5. 0,05 M NaH2PO4 tamponu hazırlamak için; 15,601 g NaH2PO4 tartıldı ve 1,0 M NaOH ile pH 7,0 ayarlanıp hacmi 2000 mL’ye ayarlandı.
6. 1,0 M Tris-HCl pH 8,8 çözeltisini hazırlamak için; 12,114 g tartılıp yaklaşık 60 mL de çözüldükten sonra pH 8,8’e 1,0 M HCl ile ayarlandı. Son hacim 100 mL’ye ayarlanarak 4 ºC’de saklandı.
7. 1,0 M Tris-HCl pH 6,8 çözeltisini hazırlamak için; 12,114 g tartılıp yaklaşık 60 mL de çözüldükten sonra pH 6,8’e 1,0 M HCl ile ayarlandı. Son hacim 100 mL’ye ayarlanarak 4 ºC’de muhafaza edildi.
8. 6X Numune yükleme çözeltisi hazırlamak için; %60 griserol, 300 mM Tris-HCl pH 6,8, 12 mM EDTA, %12 SDS, 864 mmM β-merkaptoetenol ve %0,05 bromofenol blue. 10 ml hazırlamakiçin; 6 mL griserol, 3 mL1 M Tris-HCl pH 6,8, 0,035 g EDTA 1,2 g SDS, 60 ml β-merkaptoetenol, 0,05 g bromofenol blue birbirine ilave edilerek 6X numesi hazırlandı.
9. %40 Akrilamid hazırlamak için; 19,48 g akrilamid, 0,52 g bis-akrilamid 50 ml hacimde çözüldü
10. %10 Amonyum persülfat hazırlamak için; 0,1 g amonyum persülfat 1 mL dH2O’da çözüldü.