T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
KADIN HASTALIKLARI VE DOĞUM ANABİLİM DALI
HİPERTANSİF GEBELİKLERDE PAİ-1 GEN
POLİMORFİZMİN ROLÜ
UZMANLIK TEZİ
Dr. Önder TOSUN
TEZ DANIŞMANI
Doç. Dr. Mahmut ERDEMOĞLU
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
KADIN HASTALIKLARI VE DOĞUM ANABİLİM DALI
HİPERTANSİF GEBELİKLERDE PAİ-1 GEN
POLİMORFİZMİN ROLÜ
UZMANLIK TEZİ
Dr. Önder TOSUN
TEZ DANIŞMANI
Doç. Dr. Mahmut ERDEMOĞLU
i TEŞEKKÜR
Bana meslek yaşamımda yepyeni ufuklar açıp, bilimsel düşünmeyi ve yaşamayı öğreten, asistanlık eğitimim boyunca bilgi ve tecrübeleri ile yetişmemde emeği geçen, her türlü konuda yardımlarını esirgemeyen başta Anabilim Dalı Başkanımız Prof.Dr.Mehmet Zeki TANER olmak üzere, bu tez çalışmam ve asistanlık eğitimim süresince sahip olduğu bilgi birikimi ve görüşleriyle beni yönlendiren, her zaman desteğini hissettiğim değerli hocam Doç.Dr. Mahmut ERDEMOĞLU’na, Kadın Doğum eğitimim süresince yetişmemde emeği olan Prof.Dr. Talip GÜL’e, Doç.Dr. Ahmet YALINKAYA’ya, Yrd.Doç.Dr. M.Sıddık EVSEN’e, Yrd.Doç.Dr. H.Ender SOYDİNÇ’e, Yrd.Doç.Dr. M.Erdal SAK’a, Yrd.Doç.Dr. Ali ÖZLER’e; verilerin istatistik analizinde yardımcı olan Prof.Dr. Ömer SATICIYA
Eğitimim süresince aynı çalışma ortamını paylaştığım, ilgi ve dostluklarını her zaman hissettiğim asistan arkadaşlarıma, hemşire ve personelimize; Hematoloji Labaratuvarı çalışanlarına, ve sevgili eşime ve emeklerini asla ödeyemeyeceğim Anneme ve Babama teşekkürlerimi bir borç bilirim
ii ÖZET
Hipertansif gebelikler (Preeklampsi, Eklampsi, HELLP sendromu) gelişmiş ve gelişmekte olan ülkelerin en önemli maternal ve perinatal morbidite ve mortalite nedenlerinden birisidir. Henüz etyopatogenezi tam aydınlatılamamıştır ve tanısında spesifik bir belirteç yoktur. Preeklampsinin erken tanısı ve uygun tedavisinin yapılabilmesi, böylece maternal ve fetal mortalitenin azaltılması oldukça önemlidir.
Son yıllarda preeklampsi etyopatogenezinde rolü olduğu düşünülen antikoagülan faktörler ile prokoagülan faktörler arasındaki dengenin bozukluğuna yönelik olarak yapılan birçok çalışmada, normal gebelikte hemostatik sistemde koagülasyona artmış bir eğilim ve fibrinoliziste azalma meydana geldiği görülmüştür.
Bu çalışmanın amacı, fibrinolitik sistemin inhibisyonunda önemli bir rol oynayan PAİ-1 (plazminojen aktivatör inhibitör) gen polimorfizminin hipertansif gebeliklerde (preeklampsi, eklampsi, hellp hastalarında) risk faktörü olarak kullanılıp kullanılamayacağının saptanmasını amaçlanmıştır.
Dicle Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum Bölümü’ne Ocak 2010 ile Aralık 2010 tarihleri arasında başvuran, 20-40 hafta arası 83 preeklampsi, eklampsi, hellp sendromlu gebe ile herhangi bir medikal problemi olmayan 20-40 hafta arası 20 normal gebe dahil edildi
Gruplar arası demografik özellikler karşılaştırıldığında istatistiksel olarak anlamlı bir fark olmadığı tespit edilmiştir. Hipertansif ve normotansif gebe grubu karsılaştırıldığında; hipertansif gebe grubunda SKB ve DKB yüksek olduğu ve gruplar arasında istatistiksel olarak anlamlı fark olduğu saptanmıştır. Hasta grubunda (Preeklampsi, eklampsi, HELLP sendromunda), kontrol grubuna göre PAİ genotiplendirme (4G/4G, 4G/5G, 5G/5G) çalışmamızda gruplar arasında istatistiksel olarak anlamlı düzeyde fark saptanmamıştır. Bu tür hastalarda etyolojiyi belirlemede PAİ genotipinin rolu olmadığını düşünmekteyiz. Bu konuda daha kontrollu çalışmalar yapılabilir.
iii SUMMARY
Hypertensive pregnancies (Preeclampsia, Eclampsia, HELLP sendrom) is a disease of one of the most important cause of maternal and perinatal mortality and morbidity in developing and developed countries. İts etiopathogenesis hasn’t been understood clearly yet and no specific marker in its diagnosis has been found. It is important to diagnose and treat the preeclampsia so the fetal and maternal mortality may be decreased.
In recent years, the anticoagulant factors thought to be involved in the etiopathogenesis of preeclampsia and impaired balance between procoagulant factors, as for many studies, a normal pregnancy the hemostatic system and a tendency to increased coagulation, decreased fibrinoliziste is deemed to occur.
The purpose of this study, the inhibition of fibrinolytic system plays an important role in the PAI (plasminogen activator inhibitor) gene polymorphism and hypertensive pregnancies (preeclampsia, eclampsia, HELLP patients) could be used as a risk factor is intended to detect.
The study was performed at Dicle University, School of Medicine, Department of Obstetrics and Gynecology, from January 2010 to December 2010. 83 Hypertensive pregnancies 30-40 gestational weeks of pregnant and 20 normal 30-40 gestational weeks of pregnant women included to the study.
When we compared the demographic characteristics of the cases, there was not statistically significant difference. The SBP and DBP was found to be statistically significant higher in preeclampsia group when compared with normal group. Patient group (preeclampsia, eclampsia, HELLP syndrome), PAI genotyping in the control group (4G/4G, 4G/5G, 5G/5G) were statistically significant differences were found between study groups. We think that the etiology in patients with this type of role in determining the genotype of PAI. More controlled studies can be done about this.
iv
İÇİNDEKİLER
Sayfa No:
TEŞEKKÜR ... i ÖZET ... ii SUMMARY ... iii İÇİNDEKİLER ... iv 1.GİRİŞ ... 1 2. GENEL BİLGİLER ... 2 2.2. Preeklampsi Patofizyolojisi ... 8
2.2.1. Preeklampsinin Plasentasyon ve Anormal Trofoblastik İnvazyon Teorisi ... 8
2.2.3. Endotelyal Hücre Disfonksiyonu ve İnflamasyon Teorisi ... 9
2.2.4. Koagülasyonun Aktivasyonu ... 10
2.2.5. Genetik Predispozisyon ... 10
2.3. Normal Koagülasyon ve Antikoagülasyon Sistemi ... 10
2.3.1. Ekstrinsik Yol (Doku Faktörü Yolu) ... 12
2.3.2. İntrinsik Yol (Kontakt Yolu) ... 13
2.3.3. Koagülasyonun Sınırlandırılması: Antikoagülan Yol ... 14
2.3.4. Fibrinolitik Sistem ... 14
2.3.5. Fibrinoliz inhibitörleri ... 15
2.4. Gebelikte Koagülasyon Sistem Değişiklikleri ... 15
2.5. Plazminojen ... 16
2.5.1. Plazminojen Aktivatörleri ... 16
2.5.2. Plazminojen Aktivatör İnhibitörleri ... 16
2.5.3.Plazminojen Aktivatör İnhibitör-1 ... 17
3. GEREÇ VE YÖNTEM ... 20 3.1. Verilerin yorumlanması ... 21 3.2. İstatistiksel Yöntemler ... 21 4. BULGULAR ... 22 5.TARTIŞMA ... 28 6. SONUÇ ... 34 7. KAYNAKLAR ... 35
v
SİMGELER VE KISALTMALAR
ACE: Angiotensin Converting EnzymeACOG: American College of Obstetricians and Gynecologist ACTH: Adreno Cortico Tropik Hormon
ALT: Alanin Amino Transferase Arg: Arginine
AST: Aspartate Amino Transferase CAT: Cloramfenikol Asetil Transferase COX: Siklooksigenase
DKB: Diyastolik Kan Basıncı
DIC/DIK: Disseminetad Intravascular Coagulation DM: Diabetes Mellitus
GW: Gestasyonel Week (gestasyonel hafta) Glu: Glutamik Acid
HELLP: Hemolysis, Elevated Liver, Low Platelet HLA: Human Leukocyte Antigen
HT: Hipertansiyon IL: İnterlökin
IUGR: Intra uterine growht restriction (İntrauterin Gelişme Geriliği) LDH: Lactat Dehidrogenase
Lp-a: Lipoprotein a Lys: Lysin
MTHFR: Methylene Tetra Hydro Folate Reductase mRNA: Mesenger RNA
µm: Mikrometre NO: Nitrik Oksit
PAI: Plasminogen activator inhibitor-1 PAI-2: Plasminogen activator inhibitor-2 PGE: Prostoglandin E
PGI2: Prostasiklin PS: Phosphatidyl Serin SKB: Sistolik Kan Basıncı
vi TF: Doku Faktörü (Tissue Factor)
TFPI: Tissue Factor Pathway Inhibitör (Doku faktör yolu inhibitörü) tPA: Tissue type plazminojen activator
TXA2: Tromboksan A2
TNFα: Tumor Nekrosis Factor-Alfa
u-PA: Urokinaz Type plazminogen activator Val: Valin
vWF: Von Willebrand faktör
VLDL: very low density lipoproteins (Çok Düsük Dansiteli Lipoprotein) FI: Fibrinogene FII: Protrombin FIII: Tromboplastin FIV: Ca++ FV: Labil Factor FVII: Prokonvertin FVIII: vWF
FIX: Cristmas Faktör FX: Stuart Prower Faktör FXI: Plazma Tromboplastin FXII: Hageman factor
vii
TABLOLAR
Tablo 1. Ağır ve hafif preeklampsinin ayırım kriterleri Tablo 2: Preeklampsinin komplikasyonları
Tablo 3:hasta grubu ve kontrol grubu dağılımı
Tablo 4: Gruplar arası demografik özelliklerin karşılaştırılması
Tablo 5: Hastaların tanı anındaki kan basıncı değerlerinin karşılaştırılması Tablo 6:hasta ve kontrol grubu laboratuvar değerleri
Tablo 7:hasta grubu ve kontrol grubunun gestasyonel haftaları Tablo 8:hasta ve kontrol grubu doğum şekli
Tablo 9:grupların doğum sonrası yenidoğan klinik özellikleri Tablo 10:grupların PAİ mutasyonu yönünden değerlendirilmeleri
viii
ŞEKİLLER
Şekil 1. Ekstrinsik yol (doku faktörü yolu) Şekil 2. İntrinsik yol (kontakt yolu
Şekil 3: Fibrinoliz mekanizması
Şekil 4: Fibrinolitik yolların aktivasyonu ve inhibisyonu Şekil 5: Plazminojen aktivatör inhibitörü -1 in yapısı Grafik 1 :hasta grubu yaş dağılımı Grafik 2 :kontrol grubu yaş dağılımı
1 1.GİRİŞ
Preeklampsi, proteinüri, ödem ve sıklıkla diğer organ sistemi bozukluklarının eşlik ettiği, gebelikle oluşan bir hipertansiyon hastalığıdır. İnsidansı %6–8 olan, bilinmeyen etyolojiler kompleksi olarak tanımlanması mümkün olan bir gebelik patolojisidir(1). Preeklampsi gelişmiş ülkelerde maternal, fetal morbidite ve mortalitenin önde gelen nedenlerinden biridir. Bu durum gebe kadına özgüdür ve en çok primigravidalarda görülür(2). Preeklampsinin erken tanısı ve uygun tedavisinin yapılabilmesi, böylece maternal ve fetal mortalitenin azaltılması oldukça önemlidir. Preeklampsinin klinik belirtilerinin ilk saptandığı zaman bile maternal ve fetal birçok fizyopatolojik değişiklikler ortaya çıkmaktadır. Bu yüzden son yıllarda çalışmalar preeklampsinin klinik belirtileri ortaya çıkmadan hastalığa tanı koyabilme amacına yönelmiştir.
Preeklampsinin patofizyolojisini açıklamaya çalışan teoriler aşağıdaki başlıklar altında toplanabilir.
-Preeklampsinin plasentasyon ve anormal trofoblastik invazyon teorisi -İmmünolojik teori
-Endotelyal hücre disfonksiyonu ve inflamasyon teorisi -Aktive olmuş koagulasyon
-Genetik predispozisyon
Preeklampside doğal antikoagülan yolda bir yetmezlik olduğu düşünülmektedir. Biz çalışmamızda; fibrinolitik sistemin inhibisyonunda önemli bir rol oynayan plazminojen aktivatör inhibitör-1’in, gen mutasyonunun hipertansif gebeliklerde (preeklampsi, eklampsi, hellp hastalarında) ve sağlıklı gebelerdeki rolünü araştırdık.
2 2. GENEL BİLGİLER
Hipertansiyona tüm gebeliklerin %6-20’sinde rastlanıp, dünyadaki hem maternal hem de perinatal mortalitenin en sık rastlanan dört sebebi arasında yer alır. Preeklampsi, nulliparlarda daha sık görülür. 20. gebelik haftasından sonra ortaya çıkan hipertansiyon, proteinüri ve/veya ödem birlikteligi ile seyreder. İnsidansı %6–8 olan, bilinmeyen etyolojiler kompleksi olarak tanımlanması mümkün olan bir gebelik patolojisidir(1). Progresif olarak ilerler ve ancak doğumda plasenta ve eklerinin vücuttan ayrılması ile son bulur. Bu durum gebe insana özgüdür ve en çok primigravidlerde görülür(2)
2.1 Sınıflama
National High Blood Pressure Education Program Working Group 2000 (NHBPEP), gebelikte hipertansiyon tanısı konusunda uzun süredir var olan karmaşık terminolojiyi belli bir düzene sokmak için, yeni bir sınıflandırma sistemi önerdi. Bu sınıflandırma sistemine göre, gebelikle ilişkili hipertansif hastalıklar 5 gruba ayırlmıştır(3).
a) Gestasyonel hipertansiyon b) Kronik hipertansiyon
c) Kronik hipertansiyon zemininde süperempoze preeklampsi d) Preeklampsi
e) Eklampsi
Bu sınıflamadaki temel amaç, gebelikten önce var olan hipertansiyon ile çok kötü prognoza sahip olabilen preeklampsinin ayrımını yapabilmektir.
A-Gestasyonel Hipertansiyon
Gebelikte en sık rastlanılan hipertansiyon sebebi gestasyonel hipertansiyondur. Gestasyonel hipertansiyon tüm doğumların %5-10’unda görülmektedir. Sağlıklı nullipar kadınlarda sıklığı %6-17, sağlıklı multipar kadınlarda ise %2-4’tür(4). Gestasyonel hipertansiyon, gebelik öncesi ve gebeliğin 20. haftasından önce tansiyon değerleri normal olduğu bilinen gebelerde, en az 6 saat ara ile yapılan iki ölçümde sistolik kan basıncının ≥ 140 mmHg ve /veya diastolik kan basıncının ≥ 90 mmHg olması ve beraberinde proteinüri yokluğu olarak tanımlanmaktadır. Kan basıncı en geç postpartum 12. haftada normale döner. Kesin tanı postpartum konulabilir. Gestasyonel hipertansiyonda preeklampsinin başağrısı, trombositopeni, epigastrik hassasiyet gibi bulguları görülebilir. Bu bulguların eşlik ettiği hastalarda preeklampsi gelişme riski daha yüksektir(5).
3 B-Kronik Hipertansiyon
Kronik hipertansiyon tanısı koyabilmek için;
• Gebelikten önce de kan basıncının 140/90 mmHg üzerinde olması
• 20. gebelik haftasından önce kan basıncının 140/90 mmHg üzerinde ölçülmesi (gestasyonel trofoblastik hastalık yokluğunda)
• Postpartum 12. hafta sonrasında da kan basıncının 140/90 mmHg üzerinde devam etmesi gerekmektedir(5).
Etyolojisi multifaktöriyel olmasına karşın hastaların büyük bir kısmında hipertansiyonun sebebi bilinmemektedir. Kronik hipertansiyon genellikle 30 yaş üstü, obez, multigravid ve diğer organ patolojileri olan hastalarda sıktır, güçlü bir aile hikayesi mevcuttur. Hasta gebe olsun veya olmasın kronik hipertansiyon kalpte ventriküler hipertrofi ve buna bağlı kardiovasküler yetersizlik, serebrovasküler olay ve böbrek hasarına neden olup önemli bir morbidite nedenidir. Gebelikte kronik hipertansiyonu olan kadınlarda süperempoze preeklampsi, dekolman plasenta, fetal gelişme geriliği ve prematürite riski artmıştır(5).
C-Kronik Hipertansiyon Zemininde Gelişen Preeklampsi
Kronik hipertansiyon tanısı konmuş bir gebede 20. gebelik haftasından sonra kan basıncının yükselmesi ve buna proteinüri eklenmesidir. Kronik hipertansif bir gebede preeklampsi gelişmesi, gebe için önemli bir tehlikedir. Kronik hipertansiyonun hafif şeklinde preeklampsi oranı %5.2–18.8 arasında iken şiddetli seklinde bu oran %54–100 olarak değişmektedir. Bu hastalarda kullanılan antihipertansif tedavi preeklampsi gelişmesini engellemede yetersiz kalabilmektedir(6).
Kronik hipertansiyonu olan gebeler tipik olarak 24. gebelik haftasından sonra daha da kötüleşir ve kronik hipertansiyon olmadan preeklampsi gelişen gebelere göre daha ağır seyreder(5). 20. gebelik haftasından önce hipertansiyon ve proteinürisi olan gebe kadında, 20. gebelik haftasından sonra kan basıncında ani artış (sistolik kan basıncı ≥160mmHg ve/veya diastolik kan basıncı ≥110mmHg) olması ve epigastrik ağrı, baş ağrısı, görme bozuklugu gibi semptomlar ve/veya trombositopeni, karaciğer enzimlerinde yükselme gibi laboratuar bulguları eşlik etmesi, süperempoze preeklampsiyi akla getirmelidir(7).
D-Preeklampsi.
Preeklampsi, 20. gebelik haftasından sonra hipertansiyona eşlik eden proteinüri ve/veya ödemin olmasıdır. Genel populasyonda ortalama insidans %6-8 olarak kabul
4
edilmektedir. Geçirilmiş preeklampsi öyküsü olanlarda insidans %18 dir. İkiz gebelerde tek gebeliği olanlara oranla preeklampsinin şiddeti de artmaktadır.
Gelişmekte olan ülkelerde preeklampsi ve eklampsi, gebelikte anne ölümlerinin %30’undan sorumlu tutulmaktadır. Preeklampsi; gestasyonel trofoblastik hastalıklar, çoğul gebelik ve hidrops fetalis gibi durumlarda 20. gebelik haftasından önce de görülebilir(8,9). Kan basıncı yüksekliği, preeklampsi tanısı için en önemli parametredir. Hipertansiyon, preeklampsinin genellikle en erken ve en sık görülen klinik bulgusudur. Hipertansiyon tanısı, gebeliğin başlangıcında kan basıncı normal olan bir hastada 20. gebelik haftasından sonra en az 6 saat aralıklarla (7 günü geçmemeli), en az iki kez yapılan ölçümlerde sistolik kan basıncının 140 mmHg veya üzerinde ve diastolik kan basıncının 90 mmHg veya üzerinde olmasıyla konulur. Kan basıncı ölçümü öncesi hasta en az 10 dakika dinlendirilmeli ve son 30 dakika içinde kafein almamış ve sigara içmemiş olmalıdır(10). Proteinüri ise 300mg/24 saat olarak tarif edilir. 24 saat idrar toplama imkanı yoksa proteinüri en az 6 saat arayla yapılan iki ölçümde idrarda 30mg/dl protein (en az +1, dipstik ile) olarak tanımlanmaktadır(11). Yapılan bir çalışmada, stik testindeki proteinin 24 saatlik idrardaki protein oranı ile zayıf korelasyon gösterdiği bulunmuştur. Bu nedenle, 24 saatlik idrarda protein ölçümü, proteinüri kesin tanısı için gerekli görülmektedir. Şiddetli proteinüri, 24 saatlik idrarda en az 5gr/24h protein varlığı olarak tanımlanmıştır. İdrar dipstik testi şiddetli proteinüri tanısında kullanılmamalıdır(12). Proteinüri yokluğunda preeklampsi tanısı, gestasyonel hipertansiyona baş ağnsı, görme bulanıklığı, bulantı ve kusmaya eşlik eden sağ üst kadran veya epigastrik ağrı, intrauterin gelişme geriliği, trombositopeni ve karaciğer enzim yüksekliği gibi bulguların eşlik etmesiyle konulabilmektedir.
5
Ödem, serum kolloid onkotik basıncının düşmesi ve kapiller permeabilitenin artmasıyla oluşur. Ödem, birçok normal gebe kadında görüldüğü için günümüzde tanısal kriter olmaktan çıkmıştır. Preeklampsinin ödemi patolojiktir ve elleri, yüzü, tüm vücudu içerir. Özellikle sabahları görülür ancak preeklampside ödem bulunmayabilir. Karaciğerde iskemi sonucu infarkt hatta subkapsüler kanama oluşarak şiddetli ağrıya yol açabilir ve nadir de olsa karaciğer rüptürü izlenebilir. Renal tutulum ağır olduğu zaman, renal damar vazospazmı ve glomerüler filtrasyondaki azalmaya bağlı olarak plazma kreatinin seviyesi artar. Preeklamptik hastalarda glomerüler lezyonlara bağlı geç dönemde proteinüri ortaya çıkar. Hipertansiyonun proteinüri ile birlikteliğinin perinatal mortalite ve morbidite riskini artırdığı gösterilmiştir. Preeklampside retinal arter vazospazmı ve retina dekolmanına bağlı olarak görme bozukluğu izlenebilir. Preeklampside mikroanjiopatik hemoliz nedeniyle trombositopeni ortaya çıkabilir(5).
Preeklampsi İçin Risk Faktörleri • Yaş (<18 veya >40)
• Primigravid
• Daha önceden preeklampsi geçirmiş olmak • Ailesel preeklampsi öyküsü
• Önceden varolan medikal-genetik durumlar -Kronik hipertansiyon
-Renal hastalık
-Diabetes mellitus, insülin rezistansı -Vasküler hastalıklar -Trombofililer - Otoimmün hastalıklar(SLE) • Obezite • Çoğul gebelik • Mol hidatiform
• Daha önceki gebeliğinde preeklampsi gelişen kadının kocası ile evli olmak • Sınırlı sperm maruziyeti
• Donör gametlerin kullanılması
Preeklampsi ağır ve hafif olarak ikiye ayrılmaktadır.
ACOG (American College of Obstetricians and Gynecologists), aşağıdaki kriterlerden bir veya birden fazlasının bulunuşunu şiddetli preeklampsi olarak tanımlamıştır(11).
6
• Yatak istirahatı esnasında, en az 6 saat ara ile yapılan kan basıncı ölçümlerinde sistolik kan basıncı ≥160 mmHg ve diastolik kan basıncının ≥110 mmHg ölçülmesi
• 24 saatlik idrar örneğinde 5 gr veya daha fazla veya en az 4 saat aralıklarla rastgele toplanmış 2 idrar örneğinde 3+ veya daha fazla proteinüri
• Oligüri (<500 ml/24 saat) • Serebral ve görsel rahatsızlık • Epigastrik ağrı, bulantı ve kusma • Pulmoner ödem veya siyanoz
• Karaciğer fonksiyonlarında bozulma • Trombositopeni
• İntrauterin gelişme geriliği (IUGR)
Preeklampsinin klinik olarak ağır ve hafif olarak ayırımının yapılması önemlidir. Bu ayırım kriterleri tabloda gösterilmiştir.
7
Ağır preeklampsilerin %4-12’sinde görülen HELLP (hemolysis, elevated liver, low platelet) sendromu, mikroanjiopatik hemolitik anemi, karaciğer enzimlerinde artış ve trombositopeni ile karakterize multisistemik bir hastalıktır(13,14). Beyin ve böbrekler başta olmak üzere pek çok organ tutulumu olabilir bu duruma yaygın damar içi pıhtılaşma sendromu (DİK) eşlik edebilir(15). Olguların yalnızca %50’sinde şiddetli hipertansiyon vardır, %15’inde ise hipertansiyon ve proteinüri görülmez(16). HELLP sendromu gelişen hastalarda intrauterin ölüm oranı %19.3, yenidoğan dönemindeki ölüm oranı %17.4, IUGR oranı %31.6 olarak bildirlmiştir(17).
Tablo 2: Preeklampsinin komplikasyonları
E-Eklampsi
Preeklampsi tedavi edilmezse komplike olarak eklampsiye dönüşebilmektedir. Eklampsi, preeklampsi tablosuna başka bir nedene bağlanamayan konvülziyonların eklenmesidir(18). Bu konvülziyonlar grand-mall’dır. Doğumdan önce, sonra veya doğum sırasında ortaya çıkabilirler. Postpartum konvülziyonların %50’si doğumdan sonraki ilk 48 saatte ortaya çıkar; ancak postpartum 6. haftaya kadar görülebilmektedir(19). Konvülziyonlar ve mental durum değişikliklerinin en önemli nedeni hipertansif ensefalopatidir.
Eklampsi, preeeklamptik hastaların %1‘inde ve tüm doğumların %0.1-0.5’inde görülür(16,20). Eklampsinin major komplikasyonları; %10 dekolman plasenta, %7
8
nörolojik defekt, %7 aspirasyon pnömonisi, %5 pulmoner ödem, %4 kardiovasküler arrest, %4 akut böbrek yetmezliği, %1 maternal ölüm olarak tespit edimiştir(5).
2.2. Preeklampsi Patofizyolojisi
Preeklampsi, plasentanın varlığı ile ilgili sistemik bir bozukluktur. Etyolojisi henüz tam olarak anlaşılamamakla birlikte birçok teoriler öne sürülmüştür. Preeklampsinin patofizyolojisini açıklamaya çalışan teoriler aşağıdaki başlıklar altında toplanabilir.
o Preeklampsinin plasentasyon ve anormal trofoblastik invazyon teorisi o İmmünolojik teori
o Endotelyal hücre disfonksiyonu ve inflamasyon teorisi o Aktive olmuş koagulasyon
o Genetik predispozisyon
2.2.1. Preeklampsinin Plasentasyon ve Anormal Trofoblastik İnvazyon Teorisi
Bu teoride, trofoblastların maternal desidua ve myometriyumdaki arteriollere invazyonunda yetersizlik olduğu ve bunda da immünolojik faktörlerin rol oynadığı düşünülmektedir(21,22).
Fetus, genlerinin yarısını babadan alır ve bu paternal allograft ile ilk karşılaşma implantasyon sırasında maternal desiduanın trofoblastlar tarafından invazyonu ile olmaktadır. Trofoblastların invazyonu iki aşamada gerçekleşır. Birinci aşama spiral arteriollerin desidual segmentindeki endovasküler alana trofoblast invazyonudur ki bu olay birinci trimesterde gerçekleşir. İkinci aşama ise, myometriyumun iç 1/3’ündeki arteriollerin invazyonudur ve bu da ikinci trimesterde gerçekleşir. Trofoblastik invazyon ile ekstravillöz sitotrofoblastlar, maternal spiral arterlerdeki düz kas hücrelerinin yerini alır. Bu yapı değişikliği ile spiral arterler; düşük dirençli, düşük basınçlı, yüksek akımlı damar yapısına dönüşür(23,24,25).
Preeklampsi ve fetal büyüme geriliği ile komplike gebelerde plasentasyona maternal vasküler yanıtın yetersiz olduğu gösterilmiştir. Bu gebelerde, vasküler değişiklikler sadece uteroplasental arterlerin desidual segmentinde görülür. Dolayısıyla spiral arteriollerin myometriyal segmenti muskuloelastik yapısını sürdürür. Plasentasyonun bu defektli vasküler cevabı, endovasküler trofoblast migrasyonunun 2. aşamasının inhibisyonu sonucunda ortaya çıkar. Bu patolojik değişiklikler, fetoplasental
9
ünitenin artmış kan miktarına ihtiyacının olacağı gebeliğin ileri evrelerinde yetersizliğe yol açar ve uteroplasental kan akımında azalmayla birlikte seyreder.
2.2.2. İmmünolojik Teori
Plasental yetersizliğin, trofoblastların spiral arterlere invazyonunu engelleyen immünolojik bir problem nedeniyle olduğu düşünülmektedir(26,27). Bu durum ilk gebelikte olduğu gibi bir önceki gebeliğin elektif bir immünizasyon gerçekleştirmede yetersiz kaldığı durumlarda da ortaya çıkabilir veya çoğul gebeliklerde olduğu gibi plasenta tarafından sunulan antijenik alanların antikor miktarıyla karşılaştırıldığında bazen oldukça fazla olabildiği koşulda görülebilir. Preeklampsinin yaygın olarak ilk gebeliklerde olması, multiparlarda ise yeni eşinden veya donör inseminasyon sonucu gebe kalmasıyla preeklampsi riskinin artması immünolojik teoriyi desteklemektedir.
2.2.3. Endotelyal Hücre Disfonksiyonu ve İnflamasyon Teorisi
Preeklampside meydana gelen yetersiz trofoblast invazyonu sonucunda desidual dokuda serbest oksijen radikalleri ve lipid peroksidazın üretimi artar. Bunlar maternal dolaşıma geçer ve endotel hasarına sebep olur. Lipid peroksidaz, siklooksijenaz (COX) enzimini aktive ederek endotelyal prostasiklin (PGI2) sentezini bozar, serbest radikaller ise vazokonstriktör olan endotelinleri arttırır.
Desidua aktive olduğunda bol miktarda inflamatuar hücre içerir ve immünolojik mekanizmaya sekonder olarak nötrofil aktivasyonu başlar. Özellikle tümör nekrozis faktör alfa (TNF α) ve interlökinler (IL) gibi sitokinler oksidatif strese katkıda bulunurlar. Preeklamptik gebeler, normal gebelere göre vazokonstriktörlere daha duyarlıdırlar. Bu durumun endotel hasarına sekonder olarak prostasiklin gibi vazodilatatörlerin rölatif eksikliğinden dolayı olduğu düşünülmektedir. Artmış hassasiyetin sonucunda arteryel ve venöz vazokonstriksiyon oluşmakta bu da hipertansiyon, plazma volümünde azalma ve periferik ödemle sonuçlanmaktadır. Damar endotelinin hem endokrin hem de metabolik fonksiyonları vardır. Damar endoteli vasküler bütünlüğü sağlar, intravasküler koagülasyonu önler ayrıca vazodilatör maddelerin sekresyonunu sağlar. Endotelden salgılanan PGI2, NO, PGE gibi vazodilatatör maddelerin vazodilatasyon etkilerinin dışında başka fonksiyonlarıda vardır, örneğin PGI2’nin trombosit agregasyon inhibisyonu ve trombolizis, NO’nun de trombosit adezyon ve agregasyon inhibisyonu gibi etkileri vardır. Preklampside vazodilatatör ve vazokonstriktör (Tx A2, Anjiotensin II) maddeler arasındaki denge bozulmuştur. Tx A2/ PGI2 oranının tromboksan lehine bozulması, vazokonstriksiyona,
10
trombosit agregasyonunda artmaya ve plasental perfüzyonda azalmaya yol açar(28,29,30).
Hasar görmüş endotelde ayrıca endotelin ve trombosit kaynaklı büyüme faktörü gibi vazokonstriktör ve mitojen maddelerin üretilmesi başlar. Endotel hücreleri damar bütünlüğünü de sağlar. Endotel hücre harabiyeti, hücre membran bütünlüğünün bozulmasına ve bunun sonucu olarak da protein kaybına yol açar. Sonuçta preeklamptik gebelerde ödem gelişir.
2.2.4. Koagülasyonun Aktivasyonu
Gebeliğin sağlıklı devamı ve başarıyla sonuçlanması plasental dolaşımın yeterli gelişmesini gerektirir. Plasental dolaşımda meydana gelen trombüsler, preeklampside intrauterin gelişme geriliği ve intrauterin ölümle sonuçlanabilir(33). Endotel hücrelerinin fonksiyonlarından biri olan intravasküler koagulasyonun önlenmesi endotel hasarıyla birlikte bozulur. Endotel hasarıyla trombosit adezyon ve agregasyonu oluşur, tromboksan ve serotonin salgılanmasıyla bu durum daha da hızlanır. Sonuçta koagülasyon sisteminin aktivasyonu ile lokal trombüsler gelişir. Hiperkoagülasyon ve vazokonstriksiyon sonucu hipoperfüzyon ve onun da sonucu olarak organlarda ve plasentada iskemi ve nekrozlar meydana gelir. Endotel ile örtülmüş damarlarda yeterli kan akımının sağlanması ve damar onarımı için prokoagülanlarla antikoagülanlar arasındaki denge önemlidir. Preeklampside doğal antikoagülan yolda bir yetmezlik olduğu düşünülmektedir(34). Gebelikte zaten varolan hiperkoagülobilite durumuna kazanılmış veya herediter koagülopatilerin eklenmesi preeklampsi ve preeklampsi komplikasyonlarına yatkınlığı arttırır.
2.2.5. Genetik Predispozisyon
Preeklampsi ve eklampsiye kalıtsal eğilimin olabileceği yönünde çalışmalar mevcuttur. Anne ya da kız kardeşte preeklampsi öyküsünün olması, riski arttırır. Kilpatrick ve arkadaşları (1989) multifaktöryel kalıtımın rolü ile ilgili HLA-DR4 ile preeklampsi arasında ilişki bildirirken, Hayward ve arkadaşları(1992) kendi çalışmalarında böyle bir ilişki bulamamışlardır(31).
2.3. Normal Koagülasyon ve Antikoagülasyon Sistemi
Hemostaz, kanın dolaşımda sıvı halde kalmasını sağlayan fizyolojik mekanizmadır. Fizyolojik mekanizma, kanın sıvı halde kalmasını sağlar ayrıca kan damarlarında herhangi bir travma sonucu oluşan kanamayı durdurup daha sonra aynı
11
damarın fonksiyonunu devam ettirmesi için damarın pıhtıdan temizlenerek açılmasını da sağlar. Koagülasyon, hemostazın sadece bir fazıdır. Hemostaz sisteminin 3 önemli komponeneti vardır. Bunlar; vasküler yapılar, trombositler ve koagülasyon sistemi ve fibrinolitik sistemdir(32).
Travmadan sonra refleks olarak zedelenen dokuda oluşan vazokonstriksiyon o damarda akımın yavaşlamasına neden olur. Dolaşımdaki trombositler endoteldeki hasarı reseptörleri aracılığı ile fark eder ve zedelenen endotele yapışırlar. Adezyonu trombosit agregasyonu takip eder. Hemostazın sağlanmasında trombosit aktivasyonu ile koagülasyon birbirinden ayrılmaz bir bütündür.
12
2.3.1. Ekstrinsik Yol (Doku Faktörü Yolu)
Koagülasyon mekanizması transmembran bir protein olup hücre bütünlüğü bozulunca kanla temas eden doku faktörünün (TF[Tissue Factor], diğer adı tromboplastin) FVII’yi aktive etmesiyle başlar. FVII, plazmada inaktif olarak dolaşırken sadece % 1’i aktif formda (FVIIa) bulunmaktadır. TF’e bağlandığı zaman sınırlı proteoliz ile FVII→FVIIa’ya dönüşür ve enzimatik aktivitesi çok belirgin olarak artar. TF + FVIIa kompleksi membran yüzeyine yapışır. Bu şekilde koagülasyon mekanizması sadece lokal olarak gerektiği yerde aktive olur. Bunun sonucunda FIX→FIXa’ya dönüşürken, diğer bir yoldan da FX→FXa’ya dönüştürülür. FXa+ FVa+ FII (protrombin)+ fosfatidil serin (PS) hep birlikte protrombinaz kompleksini oluşturur ve protrombinin→trombine (FIIa) dönüşümü sağlanır. Trombin daha sonra hem fibrinojenden (FI) fibrin oluşmasını hem de FXIII’ü (fibrin stabilize eden faktör) aktive ederek güçlü fibrin pıhtısının meydana gelmesini sağlar.
13 2.3.2. İntrinsik Yol (Kontakt Yolu)
İntrinsik yolda FXII, negatif yüklü yüzeylere bağlandığında aktive olur. Daha sonra sırasıyla FXI ve FIX aktive olur. FIXa+ Kofaktör olarak bulunan FVIII+ FX+ trombosit PS (fosfatidil serin), tenaz kompleksini oluşturarak FX’u, FXa’ya dönüşür. Bundan sonraki aşama protrombinaz kompleksi aracılığıyla protrombinin trombine ve fibrinojenden de fibrin oluşumu ile pıhtılaşma sağlanır.
14
2.3.3. Koagülasyonun Sınırlandırılması: Antikoagülan Yol
Koagülasyonu aktive eden her yol aynı seviyede bir inhibitör sistemle kontrol altında tutulmakta bu şekilde hemostatik mekanizmanın sadece hasar bölgesinde aktive olması ve tamir süreci tamamlanır tamamlanmaz zarar gören vasküler yapının dolaşıma açılması mümkün hale gelmektedir.
İnhibitör mekanizmalar:
• TFPI(Doku faktör yolu inhibitörü) • Antitrombin III
• Protein Z’ye bağlı inhibitör kompleksi • Protein C antikoagülan sistemi
• Prostasiklin ve Tromboksan • Nitrik oksit
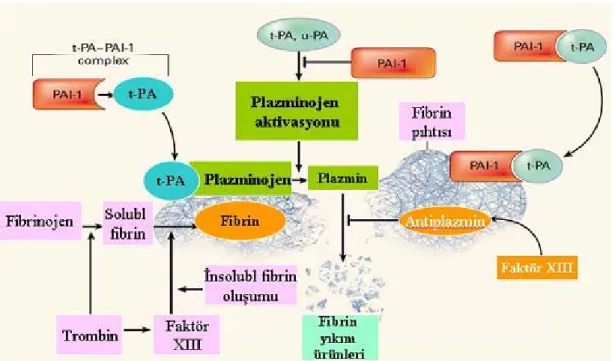
2.3.4. Fibrinolitik Sistem
Fibrinoliz, pıhtı büyümesini kontrol eden son mekanizmadır. Fibrin oluştuktan sonra yıkılır ve fibrin yıkım ürünleri oluşur. Fibrin yıkımını gerçekleştiren enzim plazmindir. İnaktif formu olan plazminojen olarak plazmada bulunur. Plazminojenin trombüs içindeki fibrine bağlanmasının ardından, plazminojen aktivatörüyle plazminojen plazmine dönüşür. Plazminojen aktivatörü olarak görev yapan birçok faktör vardır. En önemlisi doku plazminojen aktivatörüdür (tPA). Daha zayıf aktivatörler ise kallikrein, FXIIa, FXIa’dır.
15 Şekil 3: Fibrinoliz mekanizması
Şekil 4: Fibrinolitik yolların aktivasyonu ve inhibisyonu
2.3.5. Fibrinoliz inhibitörleri
Plazminin ana inhibitörü a2-antiplazmin’dir. Diğer inhibitörler ise Antitrombin III ve plazminogen aktivatör inhibitörleri (PAI-1,2)’dir. PAI-1, endotel hücreleri ve trombositlerden salınır; PAI-2 ise sadece gebe kadınlarda bulunup plasentada sentezlenir.
2.4. Gebelikte Koagülasyon Sistem Değişiklikleri
Gebelikte hemostatik ve fibrinolitik sistemde görülen değişiklikler, koagülasyona yatkınlık durumunu ortaya çıkarır. Gebelikte prokoagülan faktörlerden; fibrinojen, faktörII (Protrombin), faktör VII, faktör VIII, faktör X, faktör XII, vWF (von Willebrand faktör) düzeylerinde artış, faktör V ve IX’da da hafif bir artış gözlenirken faktör XI ve XIII düzeyleri aynı kalır(35,36,37). Antitrombin III ile protein C stabil seyrederken, protein S aktivitesinde düşme görülür(35). Gebelik sırasında fibrinolitik aktivite azalırken, doğumu takiben hızlıca normale döner(35,38).
Plasental kaynaklı PAI-2 ile endotel kaynaklı PAI-1 seviyelerinde artma meydana gelir. Doğumla birlikte plasentanın ayrılmasını takiben PAI-2’nin ortadan kalkmasıyla fibrinolitik sistem tekrar artar. Gebelikte ayrıca plazminojen, antiplazmin, doku plazminojen aktivatörü ve D-Dimer’de artış meydana gelir(38,39).
16 2.5. Plazminojen
İnsan plazminojeni 92000 dalton molekül ağırlığında tek zincirli bir glikoprotendir. Molekül 24 disülfîd köprüsü ile 790 aminoasitten oluşur(39). Plazma konsantrasyonu 2,4 fiM (0,2/*g/miy) dür. Fibrin bağlanması, plazmine aktivasyonu ve proteaz aktivitesi için fonksiyonel domainler içerir. Doğal plazminojenin aminoterminalinde glutamik asid vardır(Glu-plazminojen), parçalanma ile fibrin affinitesi daha fazla olan, aminoterminalinde lizin bulunan lys-piazminojene dönüştürülür. Glu-plazminojenin plazma yarı ömrü 2,2 gün iken, lys-plazminojenin 0,8 gündür. Plazminojen aktivatörleri ile Arg^-Val561 peptid bağının parçalanması ile plazminojen plazmine dönüştürülür. İki zincirli endopeptidaz olan plazmin molekülleri fibrinojen ve fibrine ilave olarak plazma koagülasyon faktörleri V ve VIII, kompleman komponentleri, ACTH, büyüme hormonu ve glukagonu da hidrolize ederler(39,40,41).
Sistemik bir fibrinolitik durum olmaksızın fibrinolizisin fibrin birikim bölgesinde aktivasyonu, plazminin inhibitörleri ile etkileşimi sonucu sağlanır. Plazminin başlıca fizyolojik inhibitörü, trombositlerde ve plazmada bulunan alfa- 2 antiplazmin 'dir(41).
2.5.1. Plazminojen Aktivatörleri
Fibrinolizis plazmada bulunan plazminojen aktivatörlerinin zimojen plazminojeni fibrinolitik enzim plazmine dönüştürmesi ile başlar. İnsan plazmasında plazminojeni aktive etme yeteneğinde olduğu gösterilen t-PA, ürokinaz ve faktör Xll/kallikreini içeren birkaç plazma proteini saptanmasına karşın, plazma ortamında fibrinolizisin asıl başlatıcısının t-PA olduğu düşünülmektedir. Yapılan çalışmalarda t-PA deplesyonu yapılan plazmanın hiçbir fibrinolitik aktivite göstermediği saptanmıştır(42,43,44).
t-PA: t-PA yaklaşık 70000 dalton moleküler ağırlıkta, 527 aminoasitten oluşan tek zincirli bir serin proteazdır(95). t-PA plazmin ile kolaylıkla Arg275-lle276 peptid bağının hidrolizi ile iki zincirli forma dönüştürülür(39). t-PA, dolaşımdan karaciğer yolu ile uzaklaştırılır. Yarı ömrü yaklaşık 6 dakikadır(16,82). Plazmada serbest aktif formda ve başlıca PAI-1 ve C1-inhibitör ile kompleksler halinde bulunur(45,46).
Dolaşıma serbest formda salınan t-PA, fibrin oluşumu varlığında plazminojen ile birlikte fibrin içine absorbe edilir. Fibrine bağlı t-PA plazminojeni plazmine dönüştürür ve plazmin inhibitörleri etkisini göstermeden önce fibrini fibrin yıkım ürünlerine parçalar. Fibrin yokluğunda salınan t-PA inhibitörleri ile (özellikle PAI-1 ile) kademeli olarak inhibisyona uğrar(43).
2.5.2. Plazminojen Aktivatör İnhibitörleri
Plazminojen aktivatörlerinin (t-PA ve ürokinaz) aktivitesi plazminojen aktivatör inhibitörleri tarafından düzenlenir. Plazminojen aktivatör inhibitör aktivitesi tanımlananlar arasında
17
PAI-1 in vivo en önemli inhibitördür. Normal plazmada t-PA ile PAI-1 110 kilo daltonluk kompleks formunda bulunur(45,47). PAI-1 tek ve iki zincirli t-PA ve iki zincirli ürokinazı inhibe eder, fakat tek zincirli ürokinazı inhibe etmez(41).
PAI-1' den immünolojik olarak farklı olan plazminojen aktivatör inhibitör-2 (PAI-2); plasenta, gebe plazması, lökosit ve histiositik lenfoma hücre kültürlerinde saptanmıştır. 48000 dalton molekül ağırlığında olan PAI-2 gebe olmayan kişilerin plazmasında bulunmaz(48,49). Plasentadan köken alan PAI-2 gebeliğin 3. trimestrında yüksek konsantrasyonlarda bulunur. PAI-2 iki zincirli t-PA ve ürokinazı inhibe eder, ancak her ikisinin tek zincirli formları ile zayıf reaksiyon verir(41).
Tanımlanan diğer plazminojen aktivatör inhibitörleri proteaz neksin, alfa-2 plazmin inhibitör, alfa-1 antitripsin, C1 inhibitörün plazminojen aktivatörlerine karşı fizyolojik rolleri önemsiz görünür (41).
2.5.3.Plazminojen Aktivatör İnhibitör-1
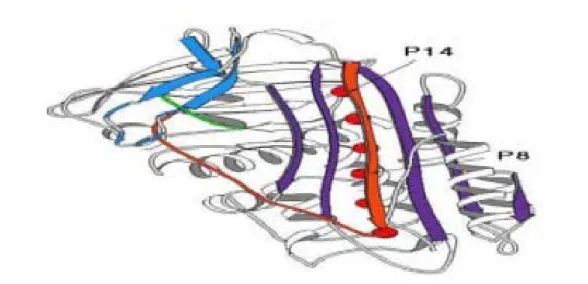
Plazminojen Aktivatör İnhibitör–1 serin proteaz inhibitör ailesi üyesidir, doku tipi ve ürokinaz tipi plazminojen aktivatörleri (t-PA ve u-PA)’nin majör inhibitörüdür. PAI-1 sadece fibrinolizisi inhibe etmekle kalmaz aynı zamanda sellüler matriks ile kompleks interaksiyonlar yaparak proteolizisi de inhibe etme özelligindedir(50). İn vivo primer görevi doku tipi plazminojen aktivatörünün hızlı bir şekilde inhibisyonudur, yani t-PA’nın ve u-t-PA’nın fizyolojik inhibitörüdür. Plazminojenin proteolitik aktivatörüdür. Glikoprotein yapısındaki latent formu ve vitronektinle birlikte aktif form halinde bulunur(51). PAI-1 geni 7. kromozomun kısa kolunda q21.23-q22’de lokalize olmuştur, 9 ekzon ve 8 introndan oluşur ve yaklaşik 12.3 kb’lik bir alana yayılmıştir. Ilk kez 1986 yılında Ny ve ark. tarafından klonlanmış tüm genin dizi analizi yapılmış ve genin 379 amino asit kodladığı gösterilmiştir(53).
Karaciğer hücrelerinden, endotel hücrelerinden, trombositlerden, düz kas hücrelerinden, makrofaj ve adiposit hücrelerden salınır(54,55). Özellikle endotel ve trombositlerden elde edilen PAI-1 lokalizasyonu yalnızca normal koagülasyon ve fibrinolizis için değil arteriosklerotik plaklar civarındaki trombotik olaylarda da önemlidir. Plazma PAI-1 konsantrasyonu fibrinolitik aktivitenin önemli belirleyicilerindendir. Doku tipi ve ürokinaz tipi doku faktörlerinin inhibisyonunun hızlı bir şekilde gerçekleştirilmesi PAI-1 tarafından sağlanır. Reaktif peptid bağlanma bölgesi Arg346- Met347’dir(56).
18
PAI-1; TNF, IL-1, Transforming Growth Faktör b, Lipopolisakkaritler, Glukokortikoid hormonlar, VLDL, İnsülin gibi bazı ajanlar tarafından regüle edilir. Bu regülatör genlerin çoğu posttranskripsiyonel düzeyde etki etmektedirler. Örneğin insülin mRNA stabilitesini artırır. Sitokinlerin daha az düzeydeki etkileri sonucu PAI-1 gen transkripsiyonu düzenlenir(57,58,59,60). Dolayısıyla PAI-1, vasküler hastalıklar ile ilişkisinin yani sıra pediatrik yaş grubunda ilk olarak gerçekleştirilen 4G/5G polimorfizim çalışmasında da gösterildiği gibi inflamasyon ve obezite ile de ilişkili bir gendir (55).
PAI-1 geninin promotor bölgesinde tek nükleotid ekleme / silme (4G/5G) polimorfizmi Dawson ve ark. tarafından tespit edilmiştir. -675 4G/5G polimorfizmi eklenen veya çıkan bir guanin nükleotidi ile promoter bölgede -675 de lokalize 4G veya 5G genotipinin ortaya çıkmasını sağlar. PAI-1 geni promotorunda –675 pozisyonundaki transkripsiyon başlangıç noktasındaki aktivatör ve represör bağlanma bölgesidir. İnsan karaciğer hücre kültürü çalışmalarında elde edilen çekirdek proteinlerinin, genin promotor bölgesindeki bağlanmaları incelendiğinde, bu iki allelden 5G allelinin ek bir protein bağlanma bölgesi içerdiği gösterilmiştir. Bu bölge 4G allelinde ortadan kalkmıştır(61). 4G/5G polimorfizminin transkripsiyondaki etkisi araştırıldığında, Hep G2 insan hepatoma hücrelerinin kısa süreli transfeksiyonunda oluşturulan kimerik yapıda PAI-1 promotoru ile bakteriyel kloramfenikol asetiltransferaz (CAT) gen ürünü her iki alelik sekansta farklı miktarlarda oluşmustur. Oluşturulan bu yapıda IL-1 stimülasyonu sonucu üretilen CAT mRNA miktarı ölçüldüğünde 4G allelinin 5G aleline oranla 6 kat fazla mRNA oluşturduğu görülmüştür(62).
4G/4G (homozigot mutant) genotipli bireylerdeki plazma PAI-1 seviyesi 5G/5G (homozigot normal) genotipli bireylerdekinden yaklaşık olarak %25 daha fazladır(63). Yapılan in vitro çalışmalar ile bu bölgede transkripsiyon regülatör proteinlerinin farklı bağlanma özellikleri belirlenmiştir. Artan gen transkripsiyonu 4G alleli ile ilişkilidir ve yalnızca transkripsiyon aktivatörünün bağlanması ile sonuçlanır. 5G alleli ise, represör proteine bağlanarak aktivatörün bağlanma özelliğini azaltır(61). 4G alleli yüksek plazma PAI-1 seviyesinden sorumludur(64). Yüksek 4G alleli ile plazma PAI-1 seviyeleri ile açık bir şekilde gösterilememesine rağmen hem arteriyel hem de venöz tromboz riskinde artış görülebilmektedir(65).
PAI-1 tromboembolik olaylarla ilişkili olan diğer sitokin ve hormonlarla benzerlik göstermektedir, bir sirkadiyen ritme sahiptir ve sabah erken saatlerde pik yapıp ilerleyen saatlerde tekrar düşer(66). Diğer özelliklerinin yanında PAI-1 bir akut faz reaktanı olarak tanımlanmaktadır. Miyokard enfarktüsü, cerrahi sonrası, endotoksemi ve septisemi gibi durumlarda artmış PAI-1 aktivitesi tespit edilmiştir. PAI-1 ölümle sonuçlanan septisemi vakalarında iyi bir prognostik faktör olabileceği ileri sürülmüştür çünkü PAI-1’in
19
endotoksin, lipopolisakkarit ve IL-1 yüksekliğine yanıt olarak beş kata kadar yükseldiği gösterilmiştir(67).
PAI-1 şiddetli hipertansiyon miyokardial hastalık, derin ven trombozu, malignensiler, myeloproliferatif hastalıklar, lipid ve glukoz metabolizma bozuklukları obesite, artmış lipoprotein a(Lp a), sendrom X, tip 2 diabettes mellitus, polikistik over sendromu, sigara içiciliği, alkol alışkanlığı ve akut enfeksiyon gibi bir çok durum ile pozitif korelasyon göstermektedir(68,69,70,71,72,73,).
Fizyolojik şartlarda (pH:7.3, 37C) aktif formdan latent hale geçmesi için PAI-1 yarı ömrü 4 saaten azdır ve muhtemeldir ki vitronektin yokluğunda 2 saat kadar kısa bir yarı ömrüne sahiptir. Vitronektin PAI-1 kofaktorü gibi hareket eder ve yarı ömrünü yaklaşık on dakika içinde iki ile üç kat arttırarak PAI-1 i aktif formda stabilize eder (66, 67,68,74).
Şekil 5: Plazminojen aktivatör inhibitörü -1’in yapısı
20 3. GEREÇ VE YÖNTEM
Çalışmaya Dicle Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum Bölümü’ne Ocak 2010 ile Aralık 2010 tarihleri arasında başvuran, 20-40 hafta arası 83 preeklampsi, eklampsi, hellp sendromlu gebe ile herhangi bir medikal problemi olmayan 20-40 hafta arası 20 normal gebe dahil edildi. Hasta seçimi ve sınıflandırılması ACOG kriterlerine göre yapıldı(11). Buna göre preeklampsi tanısı; gebelikten önce normotansif olan 20. gestasyonel haftadan büyük olan gebelerde en az 6 saat ara ile yapılan 2 ölçümde, kan basıncının 140/90 mmHg ve idrarda 300mg/L protein (en az +1, dipstik ile) olması ile konuldu. Diabetus mellitus, çoğul gebelik, kronik hipertansiyon, erken memran rüptürü, polihidramnios ve renal hastalık gibi gebelik öncesi herhangi medikal problemi olanlar çalışmaya dahil edilmedi.
Kontrol grubuna mevcut gebeliklerini komplike eden herhangi bir sistemik hastalığı bulunan kronik hipertansiyon, otoimmun hastalıklar ya da diyabet gibi maternal vasküler hastalığa yol açabilecek patolojileri olanlar, sigara içen anneler dahil edilmedi.
Her iki grupta hastaların demografik, klinik özellikleri, kan basınçları, laboratuvar değerleri, başvuru anındaki gestasyonel haftaları, doğum şekli, hastaların doğum sonrası bebeğin 1. dakika ve 5. dakika Apgar skorları, bebeğin boyu, kilosu, ortalama doğum ağırlığı, PAİ gen polimorfizmi yönünden karşılaştırıldı. Her iki grupta hastaların anamnezleri, muayeneleri ve laboratuvar bilgileri, hasta takip formlarına kaydedildi Hasta grubu, erken başlangıçlı gebeliğin hipertansif hastalığı (24-32w) ve geç başlangıçlı gebeliğin hipertansif hastalığı (35-42w) şeklinde 2 gruba ayırıp PAİ gen polimorfizmi yönünden karşılaştırıldı. Ayrıca hasta grubu ön tanısına göre (preeklampsi, eklampsi, hellp sendromu) PAİ gen polimorfizmi yönünden karşılaştırıldı. Her iki grupta hastaların anamnezleri, muayeneleri ve laboratuvar bilgileri, hasta takip formlarına kaydedildi.
Hemogram Cell –dyn 3700 cihazında çalışıldı, LYSE kiti kullanıldı. Biokimya tetkikleri ARCHİTECT C 1600 cihazında enzimatik yöntem kullanılarak ABBOTT kiti kullanılarak çalışıldı. Proteinüri spot idrar örneklerinde Combur 10 Test S stripleri kullanılarak Roche Urisys1800 cihazında ölçüldü
Genetik polimorfizm tespit amaçlı EDTA’lı tüpe 2ml venöz kan örneği alındı. EDTA’lı tüplere alınan kan örneği, Roche-Magna Pure Compact otomatik DNA izolasyon cihazında hazır izolasyon kiti ile DNA izolasyonu yapıldı.
21 Real Time PCR Aşaması:
PCR miksinin hazırlanması:
1. H2O 7,4μL 2. MgCl2 1,6 μL 3. Reaktif miks(prob ve primer karışımı) 4 μL 4. Roche Master hibridizasyon probu 2 μL
Toplam 15 μL
15 μL miks, kapiller tüpe alındı ve üzerine daha önceden elde edilen 5 μL DNA solüsyonu eklendi. Master miks ve DNA karışımının kapiller tüpün dibine çökmesi için santrifüj işlemi yapıldı. Örnekler Light Cycler 2.0 cihazında yürütüldü. 4G ve 5G polimorfizmleri daha önce tanımlanmış primerler kullanılarak amplifiye edildi. Elde edilen amplifikasyon ürünleri TIB Molbiol Light-Mix Kit Human kullanılarak değerlendirildi.
3.1. Verilerin yorumlanması
Melting curve (erime eğrisi) kullanılarak örnekler pik yaptıkları sıcaklık derecelerine göre adlandırıldı. 54.5 derecede pik yapan örnekler 4G/4G; 54.5 ve 62.0 derecede pik yapan örnekler 4G/5G; 62.0 derecede pik yapan örnekler 5G/5G olarak adlandırıldı. Homozigot örneklerde tek pik heterozigot örneklerde ise iki pik gözlenmiş oldu.
3.2. İstatistiksel Yöntemler
Sürekli değişkenlerin tanımlayıcı istatikleri ortalama ve SD değerleri ile gösterildi. Hasta ve kontrol grubu olmak üzere iki grupta ölçülen değişkenlerin ortalama değerleri bağımsız iki grup ortalamalarını karşılaştıran Student’s t testi ile karşılaştırıldı.
22 4. BULGULAR
Dicle Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum Anabilim dalı’nda takip edilen ve preeklampsi, eklampsi, hellp sendromu tanısı alan 83 hasta çalışmaya dahil edilmiştir. Hasta grubunda preeklampsi 64(%77.1) kişi, hellp sendromu 12(%14.5) kişi, eklampsi 7(%8.4) kişi alınmıştır. Kontrol grubu olarak da herhangi bir kronik hastalığı olmayan 20 hasta seçilmiştir(Tablo3).
Tablo 3:Hasta grubu ve kontrol grubu dağılımı Kontrol Grubu (n:20) Hasta Grubu (n:83) Total Kontrol grubu 20(%100) 0 20(%19,4) Preeklampsi 0 64(%77,1) 64(%62,1) Hellp 0 12(%14,5) 12(%11,7) Eklampsi 0 7(%8,4) 7(%6,8) Total 20(%100) 83(%100) 103(%100)
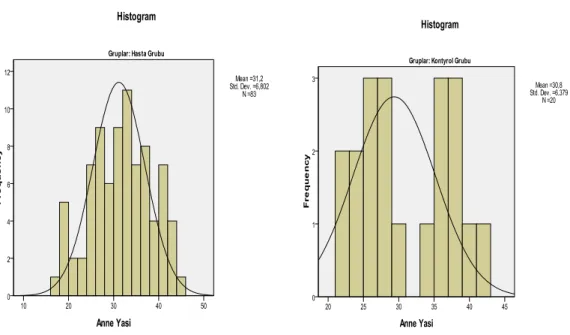
Hastaların demografik özelliklerinin karşılaştırılması yapıldığında, hasta grubu ile kontrol grubu arasında yaş, gravide, parite değerleri arasında istatistiksel olarak anlamlı bir fark saptanmadı(tablo 4).
Tablo 4: Gruplar arası demografik özelliklerin karşılaştırılması Hasta grubu (n:83) Kontrol Grubu (n:20) P ve t
Gravide
4,40±3,268 4,15±2,943 t=-0,30 P=0,75Anne Yaşı
31,20±6,802 30,80±6,37 t= -0,24 P=0,81Parite
2,98±3,044 2,80±2,64 t=-0,24 P=0,8123
Grafik 1: Hasta grubu yaş dağılımı Grafik 2: Kontrol grubu yaş dağılımı
Hastaların kan basınçları ( sistolik 1 ve diastolik 1) altı saat ararayla iki defa ölçüldü. Gruplar arasında sistolik ve diyastolik kan basınçları arasında istatistiksel olarak önemli derecede anlamlı fark saptanmıştır (Tablo 5).
Tablo 5: Hastaların tanı anındaki kan basıncı değerlerinin karşılaştırılması Kan basıncı Hasta grubu(n=83) Kontrol grubu(n=20) P SKB 1 (mm/Hg) 143,27±12,17 116,21±14,11 <.001
DKB 1 (mm/Hg) 94,87±9,32 70,25±10,19 <.001
SKB 2 (mm/Hg) 152,57±14,21 118,07±13,43 <.001
DKB 2(mm/Hg) 92,21±11,71 70,22±10,79 <.001
24
Hasta grubu ve kontrol grubunun laboratuvar değerleri karşılaştırıldığında hastaların istatistiksek olarak anlamlı fark saptanmamıştır. (Tablo 6).
Tablo 6: Hasta ve kontrol grubu laboratuvar değerleri
ALT: Alanin aminotransferase, AST: Aspartate aminotransferase, LDH: Lactic dehydrogenase
Kontrol Grubu (n:20) Hasta Grubu (n:20) Student’s t ve P Hemotokrit 36,20±4,29 36,81±5,07 t=-0,49 ve P=0,62 Beyaz Küre 11,65±3,78 12,78 ±5,94 t=-0,81 ve P=0,42 Trombosit Sayisi 234,35±84,63 216,39 ±97,20 t=0,75 ve P=0,44 ALT 71,35±267,82 52,48 ±108,43 t= P>0,05 AST 78,25±269,76 85,66±183,75 t= P>0,05 LDH 239,10±380,48 271,82 ±238,89 t=P>0,05 Glukoz 93,65±42,07 101,90±49,99 t=P>0,05 Kreatinin 0,535±0,08 1,446±7,06 t= P>0,05 Total Bilirubin 0,850±2,20 0,611±1,10 t= P>0,05 Total Protein 6,51±0,52 6,46±0,77 t= P>0,05 Üre 20,55±14,21 24,53 ±9,92 t= P>0,05
25
Başvuru anındaki gestasyonel haftalar açısından değerlendirildiğinde hasta grubu ve kontrol grubu arasında istatistiksel olarak anlamlı fark saptanmadı. Hasta grubundan 4 hasta postpartum dönemde görülmüş olduğundan gestasyonel haftaları bilinmiyordu(tablo 7).
Tablo 7: Hasta grubu ve kontrol grubunun gestasyonel haftaları
Hasta grubu ve kontrol grubu doğum şekli açısından karşılaştırıldığında hasta grubunda sezeryan ile doğum 54, normal vajinal yol ile doğum 29 saptandı. İstatistiksel olarak iki grup arasında doğum şekli açısından anlamlı fark saptandı(tablo 8).
Tablo 8: Hasta grubunun ve kontrol grubunun doğum şekli Doğum Şekli Kontrol Grubu
(n:20) Hasta Grubu (n:83) Total Doğurmamış 2( %10) 0(%0) 2(%1,9) Normal Doğum 10(%50) 25(%30,1) 35(%34,0) Sezaryen 8(%40) 54(%65,1) 62(%60,2)
Hariçte Normal Doğum 0(%0) 4(%4,8) 4(%3,9)
Toplam 20(%100) 83(%100) 103(%100)
Ki-Kare=12,82 P=0,005 Gruplar farklıdır.
Hastaların doğum sonrası bebeğin 1. dakika ve 5. dakika Apgar skorları, bebeğin boyu, kilosu, ortalama doğum ağırlığı karşılaştırıldığında istatistiksel olarak anlamlı farklılıklar saptandı. Hasta grubunun 1. dakika ve 5. dakika Apgar skoru, kontrol grubunun 1. dakika ve 5. dakika Apgar skoruna göre daha düşük izlendi. Hasta grubunda bebeğin ortalama doğum ağırlığı ve bebeğin doğum boyu, kontrol grubunun bebeğin ortalama doğum ağırlığı ve bebeğin doğum boyundan daha düşük izlendi ( tablo 9).
Kontrol Grubu Hasta Grubu Students’t ve P GestasyonelHafta
(USG ye göre)
34,05±4,718 33,06±4,759 t=0,83
26
Tablo 9: Hasta grubunun ve kontrol grubunun doğum sonrası yenidoğan klinik özellikleri
Hasta grubu ve kontrol grubu PAİ yönünden karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmadı. Gruplar benzer bulundu(tablo 10).
Tablo 10: Hasta grubunun ve kontrol grubunun PAİ genotipi yönünden
değerlendirilmeleri
Ki-Kare=1.67 P=0,43
Hasta grubunu ön tanılarına göre PAİ yönünden karşılaştırdığımızda verilerin gruplara farklı dağıldığı gözlendi (P=0.005). 64 Preeklampsi vakasından 17(%26.6) si 4G-4G Mutasyonunda iken, 32 (%50) si de 4G-5G Mutasyonuna dağıldı).
Eklampsi nin 5/7 si %71 i 5G-5G genotipinde idi(tablo 11).
Tablo 11: Hasta grubunun ön tanılarına göre kendi arasında PAİ genotipi yönünden karşılaştırılmaları
Ön Tanı Plazminojen aktivatör inhibitörü Total 4G-4G Genotipi 4G-5G Genotipi 5G-5G Genotipi
Preeklampsi 17(%26,6) 32(%50,0) 15(%23,4) 64(%100,0) Hellp 1(%8,3) 8(%66,7) 3(%25,0) 12(%100,0)
Eklampsi 0(%0) 2(%28,6) 5(%71,4) 7(%100,0) Toplam 18(%21,7) 42(%50,6) 23(%27,7) 83(%100,0)
Ki-Kare=9,76 P=0,04 Hasta Grubu
Kontrol Grubu Hasta Grubu Students’t ve P Doğum Ağırlığı 2916,66±757,12 2200,53±1069,94 t=2,69 ve P=0,009 Bebeğin Boyu 47,94±3,91 44,62±6,07 t=2,89 ve P=0,006 I. Dakika Apgar Skoru 5,61±1,14 4,06±1,69 t=3,68 ve P=0,001 V. Dakika Apgar Skoru 7,72±1,52 6,73±2,37 t=2,20 ve P=0,03
Plazminojen aktivatör inhibitörü
Kontrol Grubu Hasta Grubu Total
4G-4G Genotipi 4(%20,0) 18(%21,7) 22(%21,4) 4G-5G Genotipi 13(%65,0) 42(%50,6) 55(%53,4) 5G-5G Genotipi 3(%15,0) 23(%27,7) 26(%25,2) Toplam 20(%100,0) 83(%100,0) 103(%100,0)
27
Hasta grubu, erken başlangıçlı gebeliğin hipertansif hastalığı (24-32w) ve geç başlangıçlı gebeliğin hipertansif hastalığı (35-42w) şeklinde 2 gruba ayırıp PAİ gen polimorfizmi yönünden karşılaştırıldı. Hasta grubundan 4 hasta postpartum dönemde görülmüş olduğundan gestasyonel haftaları bilinmiyordu. Gruplar arasında istatistiksel olarak anlamlı fark saptanmadı.
Tablo 11: Hasta grubunun erken başlangıçlı ve geç başlangıçlı oluşuna göre PAİ genotipi yönünden karşılaştırılmaları
Ki-Kare =2,52 P=0,28 Erken Başlangıçlı Hipertansif Hastalık Geç başlangıçlı Hipertansif hastalık Total 4G-4G Genotipi 6(%15,4) 12(%30,0) 18(%22,8) 4G-5G Genotipi 21(%53,8) 19(%47,5) 40(%50,6) 5G-5G Genotipi 12(%30,8) 9(%22,5) 21(%26,6) Toplam 39(%100,0) 40(%100,0) 79(%100,0)
28 5.TARTIŞMA
Bizim gibi gelişmekte olan ülkeler araştırıldığında; maternal morbidite ve mortalitenin en sık nedeni gebelikte görülen hipertansiyon olarak bildirilmektedir(3).
Yoğun çalışmalara rağmen preeklampsinin patofizyolojisi henüz net olarak bilinmemektedir, bu yüzden preeklampsiden ‘teoriler hastalığı’ olarak söz edilir(75).
Preeklampsinin patofizyolojisini açıklamaya çalışan teoriler aşağıdaki başlıklar altında toplanabilir.
-Preeklampsinin plasentasyon ve anormal trofoblastik invazyon teorisi -İmmünolojik teori
-Endotelyal hücre disfonksiyonu ve inflamasyon teorisi -Aktive olmuş koagülasyon
-Genetik predispozisyon
Plasenta, preeklampsinin patogenezinde ana noktadır çünkü preeklampsi plasentanın varlığından veya plasentasyona olan maternal cevaptan dolayı oluşur(76). Bu sebepledir ki günümüzde preeklampsinin kesin tedavisi doğumdur.
Gebelik sırasında meydana gelen hemostatik değişiklikler hiperkoagülabiliteye yol açar ve trombotik sonuçlar oluşturabilir. Bu durum, kalıtsal trombofilisi olan kadınlarda belirgin olabilir. Tromboza eğilim, uteroplasental dolaşımı içeren plasentada trombotik lezyonlar olarak görülür. Sonuçta preeklampsi, abortus, intrauterin gelişme geriliği, ablasyo plasenta gibi obstetrik komplikasyonlar şeklinde karşımıza çıkar(77).
Preeklampside doğal antikoagülan yolda bir yetmezlik olduğu düşünülmektedir(34). Preeklampsi ve eklampside koagülasyona eğilim oluşturan bir durumun varlığı ilk kez doku örneklerinin patolojik incelemesinde mikrovasküler alanda fibrin birikiminin saptanması ile düşünülmüştür(78).
Son yıllarda preeklampsi etyopatogenezinde rolü olduğu düşünülen antikoagülan faktörler ile prokoagülan faktörler arasındaki dengenin bozukluğuna yönelik olarak yapılan birçok çalışmada, normal gebelikte hemostatik sistemde koagülasyona artmış bir eğilim ve fibrinoliziste azalma meydana geldiği görülmüştür. Gebelerde koagülasyon faktörlerinin artmış seviyesi ve fibrinolitik aktivitenin baskılanması daha çok üçüncü trimester sırasında belirgindir(79,82).
29
Biz çalışmamızda; fibrinolitik sistemin inhibisyonunda önemli bir rol oynayan ‘plazminojen aktivatör inhibitörü’ gen polimorfizminin preeklampsi, eklampsi, hellp hastalarında ve sağlıklı gebelerdeki rolünü araştırdık.
675 4G/5G polimorfizmi eklenen veya çıkan bir Guanin nükleoti ile promoter bölgede -675 de lokalize 4G veya 5G genotipinin ortaya çıkmasını sağlar. PAI-1 geni promotorunda –-675 pozisyonundaki transkripsiyon başlangıç noktasındaki aktivatör ve represör bağlanma bölgesidir. İnsan karaciğer hücre kültürü çalışmalarında elde edilen çekirdek proteinlerinin genin promotor bölgesindeki bağlanmaları incelendiğinde, bu iki allelden 5G allelinin ek bir protein bağlanma bölgesi içerdiği gösterilmiştir. Bu bölge 4G allelinde ortadan kalkmıştır(61). 4G/5G polimorfizminin transkripsiyondaki etkisi arastırıldığında, oluşturulan bu yapıda IL-1 stimülasyonu sonucu üretilen CAT(bakteriel kloramfenikol asetil transferaz) mRNA miktarı ölçüldüğünde 4G allelinin 5G aleline oranla 6 kat fazla mRNA olusturduğu görülmüştür(62).
4G/4G (homozigot mutant) genotipli bireylerdeki plazma PAI-1 seviyesi 5G/5G (homozigot normal) genotipli bireylerdekinden yaklaşık olarak %25 daha fazladır. Yapılan in vitro çalışmalar ile bu bölgede transkripsiyon regülatör proteinlerinin farklı bağlanma özellikleri belirlenmiştir. Artan gen transkripsiyonu 4G alleli ile ilişkilidir ve yalnızca transkripsiyon aktivatörün bağlanması ile sonuçlanır. 5G alleli ise, represör proteine bağlanarak aktivatörün bağlanma özelliğini azaltır(61). 4G alleli yüksek plazma PAI-1 seviyesinden sorumludur(64). Yüksek 4G alleli ile plazma PAI-1 seviyeleri ile açık bir şekilde gösterilememesine rağmen hem arteriyel hem de venöz tromboz riskinde artış görülebilmektedir(65).
Hipoksi esnasında plasental doku interlökin-1 üretir(83). Ayrıca, hücresel transfeksiyon çalışmaları ile, PAI1 promotör 675 4G aleli içerende interlökin1 e yanıt -675 5G alleli içerene oranla altı kat daha aktif olduğu gösterilmiştir(84). Böylece, interlökin-1 plasental üretim, PAI-1 4G allel tarafından daha fazla sistemik üretimi teşvik edebilir. Artan PAI-1 düzeyleri, plasental dokuların fibrinolizini bozar. Bu nedenle preeklampside patojenik mekanizma, interlökin-1 e PAI-1 promotör -675 4G allel aşırı sistemik üretim mekanizması olabilir. PAI-1 geninin mRNA düzeyleri preeklamptik plasentada artmış olduğu bilinmektedir(85). Preeklampsi arteroskleroz ile bazı benzerlikler paylaşır. Preeklampside endotel lezyonlar aterosklerozun başlangıcını anımsatır(87). Ayrıca, her iki hastalığın patofizyolojisindeki benzerlikler, oksidatif stres ve endotel disfonksiyonun varlığıdır(87,88). Preeklamptik kadınlarda muhtemel altta yatan endotel disfonksiyonun sonucunda anlamlı olarak daha yüksek t-PA ve PAI-1 düzeyleri mevcuttur(86,89,90,9PAI-1).
30
Çalışmamızda 83 preeklampsi, eklampsi, hellp sendromlu hasta ile 20 sağlıklı gebe kadının demografik, klinik özellikleri ve PAİ mutasyonu yönünden karşılaştırılmıştır. Grupların demografik özellikleri arasında fark saptanmamıştır. Çalışmamızda hasta ve kontrol grubunun yaş ortalamaları, gravide, pariteleri benzerdi(Tablo 4). Hipertansif ve normotansif gebe grubu karşılaştırıldığında; hipertansif gebe grubunda SKB ve DKB yüksek olduğu ve gruplar arasında istatistiksel olarak anlamlı fark olduğu saptanmıştır. Borghi ve ark, Simmons ve ark çalışmasında da çalışma bulgusuna benzer sonuçlar görülmüştür(92,93). Bu sonuç, preeklampsinin tanı kriterlerinden biri olan hipertansiyon ile uyum göstermektedir. Hasta ve kontrol grubunun laboratuvar değerleri karşılaştırıldığında istatistiksel olarak anlamlı bir fark saptanmamıştır. Başvuru anındaki gestasyonel hafta yönünden hasta ve kontrol grubu benzerdir. Hasta ve kontrol grubunun doğum şekli açısından değerlendirildiğinde hasta grubunda sezeryanla doğum 54(%65,1), normal doğum 29(%34,9) kontrol grubunda sezeryanla doğum 8(%40), normal doğum 10(%50), doğurmamış hasta 2(%10) tespit edildi. İstatistiksel olarak 2 grup arasında anlamlı fark tespit edildi.(p=0.005). Hastaların doğum sonrası bebeğin 1. dakika ve 5. dakika Apgar skorları, bebeğin boyu, kilosu, ortalama doğum ağırlığı karşılaştırıldığında istatistiksel olarak anlamlı farklılıklar saptandı.
Hasta grubu ve kontrol grubu PAİ yönünden karşılaştırıldığında hasta grubunda PAİ genotipi 4G/4G olan 18(%21,7), 4G/5G olan 42(%50,6), 5G/5G olan 23(%27,7) ve kontrol grubunda 4G/4G olan 4(%20,0), 4G/5G olan 13(%65,0) ve 5G/5G olan 3(%15,0) saptandı. İstatistiksel olarak anlamlı fark saptanmadı. Gruplar benzer bulundu.
Yamada ve arkadaşlarının 115 preeklamptik (yaş 20-43), 210 sağlıklı gebe (yaş 20-43) ve 298 sağlıklı gönüllü (%79 erkek, 51,4±7,7 yaş) grubu ile yaptığı çalışmada preeklamptik kadınların plasenta ve plazmasında mRNA expresyonunda artışa bağlı olarak, PAI-1(Plazminojen aktivator inhibitor tip 1) miktarında artış olduğu tespit edilmiştir. Japon populasyonunda PAI-1 geninin 4G/4G genotipinin preeklampsi için bir risk faktörü olabileceği rapor edilmiştir(94).
Fabbro ve arkadaşlarının 52 preeklamptik ve 80 sağlıklı gebe grubu ile İtalya’da yaptığı çalışmada hafif preeklampsi olan kadınlar arasında, PAI-1 geninin -675 4G/5G genotip polimorfizmleri ile yapılan bir çalışmada; -675 4G/5G allel dağılımı anlamlı olarak farklı saptanmıştır. Ayrıca hipofibrinolitik genotiplerin (4G/4G ve A/A); MTHFR, protrombin ve FV’in bulunduğu trombofilik mutasyonlardan bağımsız olarak hafif preeklampsi ile birliktelik gösterdiği bildirilmiştir(95).
31
İskoçya'da yapılan büyük nüfus tabanlı bir vaka-kontrol çalışmasında, -675 4G allel ve preeklampsi arasında bir ilişki tespit edilmiştir(96).
Hakli ve arkadaşlarının 133 preeklamptik ve 115 sağlıklı gebe ile Doğu Finlandiya populasyonundan yaptığı çalışmada alınan preeklampsi ve kontrol grupları arasında polimorfik allel dağılımı (4G/5G) açısından bir farka rastlanmamıştır. Elde edilen sonuçlar bu populasyonda, PAI-1 polimorfizminin preeklampsinin patogenetiğinde önemli bir katkısının olup olmadığını net olarak gösterememiştir(97). Bu çalışma bizim çalışmamızı desteklemektedir.
Viroj wiwanitki PAI-1 4G/5G polimorfizmi ve preeklampsi arasındaki ilişkiyi araştırmak için bir Metaanaliz çalışması gerçekleştirmiştir. Mevcut 6 farklı ülke (Finlandiya, Japonya, Güney Africa, Almanya, İskoçya, İtalya,) vaka kontrol çalışmasının metaanalizini yapmış 880 preeklamptik gebe ve 810 sağlıklı gebe grubunda PAİ-1 4G alel frekansları sırasıyla 49.9 ve 44.4 saptanmış preeklamptik gebelerde 4G alel frekansı 1.12 kat artmış bulunmuştur. Hastalarda kontrol grubuna göre artmış görülme sıklığı (1.12 kat) önemli ölçüde olmayan biraz yüksekliktir(p>0.05). Bu çalışmada preeklampsi için genel 4G allel frekansları, kontrollerle önemli ölçüde farklı olmadığı bulundu. Bununla birlikte hastalarda daima yüksek 4G allel sıklığı gözlenir. Bu çalışma da bizim çalışmamızı desteklemektedir.
Maat ve arkadaşları 157 preeklamptik gebe ve 157 sağlıklı gebeyi karşılaştırılmış 4G/4G alel frekansları preeklampside %33,8 kontrol grubunda %28,0, 5G/4G alel frekansları preeklampside %51,0 kontrol grubunda %54,8 , 5G/5G alel frekansı preeklampside %15,3 kontrol grubunda %17,2 saptanmıştır. Kontrol grubunda PAI-1 4G allel frekansı, daha önce Avrupa ve Amerikan popülasyonlarında da benzer saptanmıştır. 4G allel sıklığı, kontrol grubu ile preeklampsi ya da şiddetli preeklampsi grubu arasında farklılık saptanmamıştır(99).
PAI(plasminogen aktivatör inhibitor aktivitesi) ve tPA arası dengesizlik uteroplasental damarlar ve renal mikrosirkülasyonda fibrin mevcudiyetinin devamına katkıda bulunur (102). Preeklamptiklerde azalmış fibrinolitik aktivite PAI-I ve PAI-2'nin artmış düzeylerine bağlanmaktadır. Normalde PAI-1 düzeyi 20.nci haftadan itibaren artar. Bu artış preeklampside ise daha erken ve daha fazladır(100,101,102). Kötü fetal sonuçlanan gebelikler ile düşük doğum ağırlıklı bebek ve plasentaların bulunduğu gebeler ile PAI-2 düzeyleri korelasyon göstermektedir.
Glueck ve arkadaşları kontrol grubu ile karşılaştırıldığında şiddetli preeklampsi ve diğer obstetrik komplikasyon (ölü doğum, fetal büyüme geriliği, dekolman plasenta)
32
muzdarip kadınların PAI-1 geninin, 4G/4G genotipinde görülme sıklığının yüksek olduğunu tespit etti(103).
Parra ve arkadaşları 14 preeklamptik gebe ve 8 sağlıklı gebenin karşılaştırıldığı çalışmada; preeklampsi anne serum PAI-1/PAI-2 oranı artışı, serumda vWf artışı oluşur, plasental sinsityotrofoblasttaki vWf azaldığı ve plasental intervillöz alanın artış olduğu saptandı. Diğer bir değişle, preeklampside; plasenta ve endotel hasarı oluşur. Oksidatif stres bu hasardan sorumlu olabilir.(104)
Wikström ve arkadaşları 17 erken başlangıçlı preeklampsi (24-32w), 22 erken gebelik haftalı (24-32w) sağlıklı gebe, 20 geç başlangıçlı preeklampsi (35-42w) ve 18 geç haftalı(35-42w) kontrol grubunu karşılaştırmış; bu çalışmada erken başlangıçlı preeklampsi (24-32w) artmış plasental oksidatif stres, buna bağlı PAI -2 konsantrasyonunda azalma, artan PAI -1 /PAI -2 oranı saptanmış. Ayrıca geç başlangıçlı preeklampsiye (35-42w) göre gebelik yaşı küçük bebek doğurma oranı artmış saptanmıştır(105).
Bizim çalışmamızda hasta grubu, erken başlangıçlı gebeliğin hipertansif hastalığı (24-32w) ve geç başlangıçlı gebeliğin hipertansif hastalığı (35-42w) şeklinde 2 gruba ayırıp PAİ gen polimorfizmi yönünden karşılaştırıldı. Gruplar arasında istatistiksel olarak anlamlı fark saptanmadı.
Muetze ve arkadaşları HELLP sendromlu 102 Kafkas kadın ile komplikasyonsuz gebeliği olan 102 Kafkas kadınını PAI-1 gen polimorfizmi yönünden karşılaştırdı. 4G/4G genotipi; HELLP sendromlu hastalarda görülme sıklığı %35,3 kontrol grubunda görülme sıklığı %22,5 saptandı. Bu veriler sonucunda 4G/4G genotipi HELLP sendromlu kadınlarda daha sık, ancak bu fark anlamlı derecede farklı değildi(p = 0,129). 4G allel sıklığı hastalarda 0,588 ve kontrollerde 0,515 idi. Bu HELLP hastaların çok sayıda PAI-1 4G/5G gen polimorfizmi ve homojen bir etnik nüfus rolünü araştıran ilk çalışmadır. Bu sonuçlar HELLP sendromu ile bu polimorfizm arasında önemli bir ilişki olduğunu göstermez(106).
Bizim çalışmamızda hasta grubunu ön tanılarına göre PAİ yönünden karşılaştırdığımızda verilerin gruplara farklı dağıldığı gözlendi(p=0.005). 64 Preeklamptik hastanın 17(%26,6) si PAİ 4G/4G genotipinde iken, 32(%50 )’si 4G/5G genotipinde, 15(%23,4)’i 5G/5G genotipinde saptandı. 12 HELLP hastanın 1(%8,3)’i 4G/4G genotipinde iken, 8(%66,7)’i 4G/5G genotipinde, 3(%25,0)’ü 5G/5G genotipinde saptandı. 7 Eklampsi hastalarının 0(%0)’ı 4G/4G genotipinde iken, 2(%28,6)’si 4G/5G genotipinde, 5(%71,4)’i 5G/5G genotipinde saptandı. Verilerin gruplara farklı dağıldığı
33
gözlendi. Hasta grubu ön tanılarına göre değerlendirildiğinde istatistiksel farklılık grupların yeterli sayıda olmadığı düşünüldüğünden bu konuda yorum yapabilmek için daha geniş çalışmalara ihtiyaç olduğu düşünüldü.
34 6. SONUÇ
Hasta grubunda (Preeklampsi, eklampsi, hellp sendromunda), kontrol grubuna göre PAİ genotiplendirme (4G/4G, 4G/5G, 5G/5G) çalışmamızda gruplar arasında istatistiksel olarak anlamlı düzeyde fark saptanmamıştır. Bu tür hastalarda etyolojiyi belirlemede PAİ genotipinin rolu olmadığını düşünmekteyiz. Bu konuda daha çok çalışma yapılabilir.