T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
FRUKTOZUN PANKREAS KANSERİ VE PANKREATİK
İNFLAMASYONA ETKİSİ: İN VİTRO
KARŞILAŞTIRMALI ÇALIŞMA
UZMANLIK TEZİ
Dr. F. Kübra URHAN GÜLPINAR
TEZ DANIŞMANI
Prof. Dr. Nevin ORUÇ
İZMİR
2019
ÖZET
FRUKTOZUN PANKREAS KANSERİ VE PANKREATİK İNFLAMASYONA ETKİSİ: İN VİTRO KARŞILAŞTIRMALI ÇALIŞMA
AMAÇ: Çalışmamızın amacı fruktozun pankreas kanseri hücrelerindeki etkilerinin araştırılmasıdır.
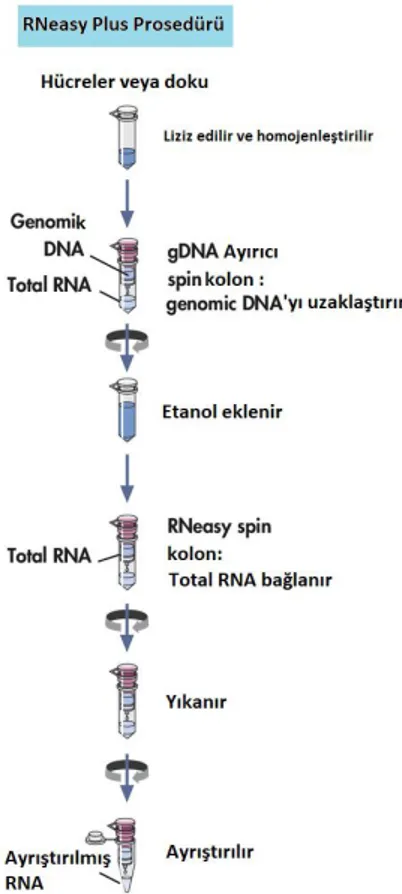
GEREÇ VE YÖNTEM: Çalışmamızda insan pankreas kanseri hücre hattı (PANC-1) kullanılmıştır. Gerçekleştirilen hücre kültürü çalışmasında, hücrelerin in vitro koşullar altında uygun besiyeri (kültür ortamı) kullanılarak flasklar içerisine ekilip bakımları yapılmıştır. Hücrelerin proliferasyonu, pasajları ve takip işlemleri Inverted Mikroskop kullanılarak düzenli olarak incelendi. PANC-1 hücrelerine low glikoz DMEM’de çözülmüş fruktoz ve glikoz ayrı ayrı eklenmiştir. Fruktoz ve glikoz uygulanmayan hücreler kontrol olarak kabul edilmiştir. Etken maddelerin maksimum proliferatif etki değerleri GraphPad Prism v5.0 Software yazılımında hesaplanmıştır. Aynı zamanda fruktoz ve glikozun birlikte etkisini görmek için kombinasyon deneyleri yapılmıştır. Fruktoz, glikoz ve fruktoz+glikoz kombinasyonunun verildiği hücrelerden ve fruktoz, glikoz uygulanmayan kontrol hücrelerini içeren her bir gruptan total RNA izolasyonu için RNeasy Plus Kiti (Qiagen) kullanılmıştır. İzole edilen uygun kalitedeki total RNA’lardan, cDNA sentezi “All-in-OneTM First-Strand cDNA Synthesis Kit” (Genecopoeia) kullanılarak gerçekleştirilmiştir. cDNA örnekleri kullanılarak genlerin ekspresyon seviyelerini belirmek için “All-in-OneTM qPCR Mix” (Genecopoeia) ile qPCR Array çalışması gerçekleştirilmiştir. Hedef genlerimize (KRAS, NFKB, ERK2) özgül olarak dizayn edilmiş olan primerler kullanılmıştır. Real-time PCR verileri, LightCycler 480 software (Roche) Cycle Threshold (Ct) değerleri kullanılarak web bazlı RT2 Profiller PCR Array
Data Analysis version 3.5
BULGULAR: 72. saatte fruktozun ve glikozun hücre hattında proliferasyonu en çok arttıran değeri her iki madde için de 20 mM olarak belirlenmiştir. Her iki maddenin birlikte etkisini değerlendirmek için yapılan izobologram analizine göre, fruktoz ve glikoz kombinasyonunun hücre proliferasyonunu maksimum arttırdığı doz 15 mM olarak bulunmuştur. HGK-DMEM uygulanan hücrelere oranlandığında fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerde sırasıyla 4,46, 3,29 ve 6,52 kat daha fazla NFKB1 ekspresyonu olduğu saptanmıştır. LGK-DMEM uygulanan hücrelere oranlandığında ise fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerde sırasıyla 4,65, 3,43 ve 7,87 kat daha fazla NFKB1 ekspresyonu olduğu saptanmıştır. HGK-DMEM uygulanan hücrelere oranlandığında fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerde sırasıyla 11,47, 7,51 ve 11,93 kat daha fazla NFKB1 ekspresyonu olduğu saptanmıştır. LGK-DMEM uygulanan hücrelere oranlandığında ise fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerde sırasıyla 7,56, 4,95 ve 7,87 kat daha fazla KRAS ekspresyonu olduğu saptanmıştır. HGK-DMEM uygulanan hücrelere oranla fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerde sırasıyla 5,69, 1,4 ve 4,45 kat daha fazla ERK2 geni eksprese edildiği saptanmıştır. LGK-DMEM uygulanan hücrelere oranlandığında ise fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerde sırasıyla 4,5, 1,1 ve 3,52 kat daha fazla ERK2 geni eksprese edildiği saptanmıştır. SONUÇ: Çalışmamız gösterdi ki fruktoz pankreas kanseri hücrelerinde KRAS, ERK2 ve NFKB1 gen ekspresyonunu glikozdan daha fazla arttırmaktadır, fruktoz glikoz ile kombine halde uygulandığında NFKB1 ve KRAS ekspresyonu üzerinde sinerjik etki göstermektedir. Bu genler pankreas kanseri patogenezindeki anahtar yolaklardaki proteinleri kodlamaktadır. Fruktozun kanser metabolizmasında glikozdan farklı metabolize edilmesiyle birlikte bu genlerin ekspresyonunu da arttırması daha sonra yapılacak çalışmalar ile daha iyi anlaşılacaktır. Patogenezdeki yerini aydınlatmak ve fruktoz metabolizmasındaki yolakların tedavi hedefi olarak kullanılıp kullanılamayacağını araştırmak amacıyla yeni çalışmalar yapılmalıdır.
ABSTRACT
THE EFFECT OF FRUCTOSE ON PANCREATIC CANCER, PANCREATIC INFLAMMATION: IN VITRO COMPERATIVE STUDY
OBJECTIVE: The aim of our study was to investigate the effects of fructose on pancreatic cancer.
MATERIALS AND METHODS: The human pancreatic cancer cell line (PANC-1) was used in our study.In the cell culture study performed, the cells were planted in the flask using the appropriate medium (culture medium) under vitrocial conditions.The proliferation, passages and follow-up of the cells were examined regularly using Inverted Microscope.Fructose and glucose dissolved in low glucose DMEM were added to PANC-1 cells separately.Fructose and glucose-free cells were accepted as controls.The maximum proliferative effect values of the active substances were calculated in GraphPad Prism v5.0 Software.Combination experiments were also performed to see the effect of fructose and glucose together.The RNeasy Plus Kit (Qiagen) was used for the isolation of total RNA from the cells in which the combination of fructose, glucose and fructose + glucose, and the control cells containing fructose and glucose were not administered.CDNA synthesis was performed using the-All-in-OneTMFirst-Strand cDNA Synthesis Kit ’(Genecopoeia) from appropriate isolated total RNAs.qPCR Array study was performed with ”All-in-OneTM qPCR Mix“ (Genecopoeia) to determine the expression levels of genes using cDNA samples.Primers designed specifically for our target genes (KRAS, NFKB, ERK2) were used.Real-time PCR data were analyzed by web-based RT2Profiller PCR Array Data Analysis version 3.5 (http://pcrdataanalysis.sabiosciences.com/pcr/arrayanalysis.php) using LightCycler 480 software (Roche) Cycle Threshold (Ct) values.
RESULTS: At 72 hours, the value of fructose and glucose that increased the proliferation in the cell line was determined to be 20 mM for both substances.According to the isobologram analysis to evaluate the co-efficacy of both agents, the dose where fructose and glucose combination increased cell proliferation was found to be 15 mM.When HGK-DMEM was applied to the treated cells, it was determined that NFKB1 expression was 4.46, 3.29 and 6.52 times more in the cells which were applied fructose, glucose and fructose-glucose combination, respectively.The ratio of NFKB1 was found to be 4,65, 3,43 and 7,87 times, respectively, in the cells treated with fructose, glucose and fructose-glucose when compared to LGK-DMEM-treated cells.When HGK-DMEM was applied to the LGK-DMEM-treated cells, it was found that NFKB1 expression was 11.47, 7.51 and 11.93 times, respectively. When cells treated with fructose , glucose and fructose-glucose combination compared to LGK-DMEM-treated cells CRAS expression was found to be 7.56, 4.95 and 7.87 times, respectively.Cells treated with fructose, glucose, and fructose-glucose combination compared to the HGK-DMEM cells were found to express 5,69, 1,4 and 4,45 times more ERK2 genes, respectively.When compared with HGK-DMEM cells the ratio of 4.5, 1.1 and 3.52 times more ERK2 gene was determined in the cells which were applied fructose, glucose and fructose-glucose combination, respectively.
CONCLUSION: Our study showed that KRAS, ERK2 and NFKB1 gene expression increased in the pancreatic cancer cells more than glucose,shows synergistic effect on NFKB1 and KRAS expression when combined with fructose glucose.These genes encode proteins in key pathways in pancreatic cancer pathogenesis.The metabolism of fructose different from glucose in the metabolism of the metabolism will increase the expression of these genes and will be better understood by later studies.New studies should be conducted to elucidate its role in pathogenesis and to determine whether pathways in fructose metabolism can be used as a therapeutic target.
İÇİNDEKİLER ÖZET ………ii ABTRACT ……….iv İÇİNDEKİLER ……….vii GRAFİKLER DİZİNİ ……….ix ŞEKİLLER DİZİNİ ……….xi TABLOLAR DİZİNİ ………..xii KISALTMALAR ………..xiii 1. GİRİŞ ………..1 2. GENEL BİLGİLER ………2 2.1. Pankreas ………..2 2.2. Akut Pankreatit ………4 2.3. Kronik Pankreatit ………8 2.4. Pankreas Kanseri ………12 2.5. Fruktoz ………25
2.6. Fruktozun Pankreas Kanseri ve Pankreatik İnflamasyon ile İlişkisi ……….27
2.7. KRAS, ERK2, NFKB1 ve Pankreas Kanseri ………28
3. GEREÇ VE YÖNTEM ………..29
3.1. Hücre Kültürü ……….29
3.2. Hücre Hatlarının Bakımı ve Kültür Kaplarına Ekimi ……….30
3.3. Hücre Hatlarının Pasajlanması ……….30
3.4. Hücre Hatlarının Dondurulması (Kriyoprezervasyon) ………..31
3.5. Dondurulmuş Hücre Hatlarının Çözdürülmesi ……….31
3.6. Hücre Hatlarının Canlılık Testi ………..32
3.7. Hücre proliferasyon ve sitotoksisiste testi (WST-1) ………33
3.8. Total RNA izolasyonu ………..34
3.9. Total RNA öerneklerinden cDNA Sentezi ……….36
3.10. qPCR Array Array Analiz ………..38
3.11. İstatistiksel Analiz Yöntemleri ………..39
4. BULGULAR ………40
4.1. Fruktoz, Glikoz Ve Fruktoz-Glikoz Kombinasyonunun PANC-1 Hücrelerinin Canlılığı Üzerine Etkilerinin Değerlendirilmesi ………..40
4.2. Fruktoz, Glikoz Ve Fruktoz-Glikoz Kombinasyonunun PANC-1 Hücrelerinde ERK2, NFKB1 Ve KRAS Genlerinin Ekspresyonuna
Etkilerinin qPCR İle İncelenmesi ………..41
5. TARTIŞMA ………48
6. SONUÇ ………52
GRAFİKLER DİZİNİ
Grafik 1: Fruktoz, Glikoz Ve Fruktoz-Glikoz Kombinasyonunun PANC-1 Hücrelerinin Canlılığı Üzerine Etkilerinin Değerlendirilmesi ... 40 Grafik 2: ERK2 geninin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun LGK-DMEM uygulanan
hücrelerdeki ekspresyonu ile karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu LGK: Low glikoz konsantrasyonu içeren DMEM ... 41 Grafik 3: ERK2 geninin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun HGK-DMEM uygulanan
hücrelerdeki ekspresyonu ile karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu HGK: high glikoz konsantrasyonu içeren DMEM ... 42 Grafik 4: KRAS geninin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun LGK-DMEM uygulanan
hücrelerdeki ekspresyonu ile karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu LGK: Low glikoz konsantrasyonu içeren DMEM ... 43 Grafik 5: KRAS geninin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun HGK-DMEM uygulanan
hücrelerdeki ekspresyonu ile karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu HGK: high glikoz konsantrasyonu içeren DMEM ... 43 Grafik 6: NFKB1 geninin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun LGK-DMEM uygulanan
hücrelerdeki ekspresyonu ile karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu LGK: Low glikoz konsantrasyonu içeren DMEM ... 44 Grafik 7: NFKB1 geninin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun HGK-DMEM uygulanan
hücrelerdeki ekspresyonu ile karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu HGK: high glikoz konsantrasyonu
Grafik 8: ERK2, KRAS ve NFKB1 genlerinin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun LGK-DMEM uygulanan hücrelerdeki ekspresyonlarına kıyasla değişimlerinin
karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz LGK: low glikoz konsantrasyonu içeren DMEM ERK2: ERK2 genindeki ekspresyon değişimi KRAS: KRAS genindeki ekspresyon değişimi NFKB1: NFKB1 genindeki ekspresyon değişimi ... 46 Grafik 9: ERK2, KRAS ve NFKB1 genlerinin fruktoz, glikoz ve fruktoz-glikoz kombinasyonu uygulanan hücrelerdeki eskpresyonunun HGK-DMEM uygulanan hücrelerdeki ekspresyonlarına kıyasla değişimlerinin
karşılaştırılması FRU: fruktoz GLU: glikoz F+G: fruktoz ve glikoz kombinasyonu HGK: high glikoz konsantrasyonu içeren DMEM ERK2: ERK2 genindeki ekspresyon değişimi KRAS: KRAS genindeki ekspresyon değişimi NFKB1: NFKB1 genindeki ekspresyon değişimi ... 47
ŞEKİLLER DİZİNİ
Şekil 1: American Cancer Society verilerine göre kadınlarda pankreas kanseri ve diğer kanser tiplerinin mortalite oranlarının yıllar içindeki
değişimi [55] ... 13
Şekil 2: American Cancer Society verilerine göre erkeklerde pankreas kanseri ve diğer kanser tiplerinin mortalite oranlarının yıllar içindeki değişimi [55] ... 13
Şekil 3: Pankreas adenokarsinom karsinogenezi [116] ... 20
Şekil 4: Fruktoz ve glikozun hücre içi metabolizması [4] ... 26
Şekil 5: PANC-1 hücre hattı mikroskop görüntüsü ... 30
Şekil 6: Neubauer hemositometresi ... 33
TABLOLAR DİZİNİ
Tablo 1: TIGAR-O sınıflandırması [44] ... 9
Tablo 2: Pankreas kanseri ile ilişkili kalıtsal sendromlar (HMOK: herediter meme-over kanser sendromu FAMMM: Familyal atipik multipl mole melanom sendromu) [59-66] ... 14
Tablo 3: Pankreas kanserinde TNM evrelemesi ... 23
Tablo 4: RNA-Primer karışımı hazırlanması ... 36
Tablo 5: Ters transkriptaz reaksiyon karışımı hazırlanışı ... 37
Tablo 6: PCR reaksiyon karışımı ... 38
KISALTMALAR DİZİNİ
PANC-1: İnsan pankreas kanseri hücre hattı qPCR: Real Time polimerase chain reaction NFKB: Nükleer Faktör kappa B
ERK2: Extracellular signal-Regulated Kinase 2 MAPK: Mitojen-activated Protein Kinase
DMEM: dulbecco’s modified eagle medium
LGK-DMEM: Düşük glukoz konsantrasyonu içeren DMEM HGK-DMEM: Yüksek glukoz konsantrasyonu içeren DMEM PP: Pankreatik polipeptit
VIP: Vazoaktif intestinal peptit ABD: Amerika Birleşik Devletleri
ERCP: Endoskopik retrograd kolanjiyopankreatografi IgG4: İmmunoglobulin G4
PRSS1: Tripsin-1’i kodlayan serin proteaz 1 geni SPINK1: Serine proteaz inhibitor Kazal tip 1 geni
CFTR: Kistik fibrozis transmembran konduktans regülatör gen HBV: Hepatit B virüsü
HSV: Herpes Simpleks Virüsü VZV: Varisella zoster virüsü CMV: Sitomegalovirüs
HIV: human immundeficiency virus PMNL: polimorfonükleer lökosit TNFα: Tümör nekroz faktör alfa IL1: İnterlökin1
IL6: İnterlökin6
PAF: platelet aktive edici faktör USG: Ultrasonografi
MRCP: Magnetik rezonans kolanjiopankreatografi EUS: Endoskopik US
CRP: C-reaktif protein
AST: aspartat aminotransferaz ALT: alanin aminotransferaz IV: İntravenöz
NSAİ: Non Steroidal Antienflamatuar İlaçlar DM: Diabetes mellitus
ACS: American Cancer Society
HMOK: Herediter meme-over kanser sendromu
FAMMM: Familyal atipik multipl mole melanom sendromu HCA: Heterosiklik amin
PanIN: Pankreatik intraepitelyal neoplaziler IPMN: İntraduktal papiller musinöz neoplaziler İİAB: İnce iğne aspirasyon biyopsisi
PET: Pozitron emisyon tomografisi ALP: Alkalen fosfataz
GGT: Gamma glutamil transpeptidaz
AJCC: The American Joint Commity on Cancer 5FU: 5-florourasil
ATP: Adenozin trifosfat
VLDL: Çok düşük yoğunluklu lipoprotein HMP: heksoz monofosfat
NADPH: Nikotinamid adenin dinükleotid fosfat Pi: inorganik fosfat
DNA: Deoksiribo Nükleik Asit RNA: Ribonükleik Asit
ROS: Reaktif oksijen radikalleri NFκB: Nükleer faktör kappa B TKT: transketolaz
DMSO: Dimetilsülfoksit
ELISA: Enzyme-Linked ImmunoSorbent Assay cDNA: Komplementer DNA
1. GİRİŞ
Pankreas, salgıladığı enzimler ve hormonlar sayesinde vücutta enerji dengesini sağlamada oldukça önemlidir. Pankreasın akut ve kronik inflamasyonu ile seyreden pankreatit tablosu önemli bir mortalite ve morbidite nedeni iken pankreas kanseri ne yazık ki etkin bir tedavisi olmayan, prognozu en kötü kanser türlerinden biridir [1-3].
Vücutta pek çok kanser tipinin glikozla beslendiği ve insüline ihtiyaç duymadan glikozu alıp kullanılabildiği bilinmektedir. Son çalışmalar pankreas kanser hücrelerinin besin şekerlerinden özellikle fruktozu kullandığını ve fruktozun pankreas kanserinde proliferasyonu indüklediğini göstermiştir. Ancak fruktoz aşırı alımı ile pankreas kanseri arasındaki ilişki net olarak bilinmemektedir. Fruktozun akut veya kronik pankreatit geçirmiş, aşırı sitokin yüküne maruz kalmış bir pankreasta bu etkilerinin nasıl seyredeceği ise hiç araştırılmamıştır [4].
Bu çalışmanın amacı fruktozun pankreas hücrelerinde yaptığı etkileri incelemektir. Zira fruktoz normal pankreas hücrelerinde proliferasyonu indükleyebilir, pankreas kanserini tetikleyebilir veya mevcut kanserin daha hızlı ilerlemesine neden olabilir. Fruktozun zaten tek başına metabolik sendroma yol açabildiği, deneysel çalışmalarda pankreasta hafif bir inflamasyonu başlatabildiği gösterilmiştir [5, 6]. İnflamatuvar yanıt, fruktoz ve kanser arkasındaki moleküler mekanizmaların daha iyi bir şekilde anlaşılması ile yeni terapötik stratejiler ortaya çıkabilecektir. Bu nedenle çalışmamızda fruktozun inflamasyona etkilerinin de araştırılması planlanmıştır. Bizim çalışmamızın literatürdeki bu boşluğu dolduracağını ve pankreas kanseri patogenezindeki yolakların aydınlatılmasına önemli katkıda bulunacağımızı düşünüyoruz.
2. GENEL BİLGİLER
2.1. PANKREAS
Pankreas hem endokrin hem ekzokrin fonksiyonu olan bir salgı bezidir. Karın arka duvarında 2. lomber vertebra seviyesinde yer alan retroperitoneal bir organdır. Midenin arkasında, omental bursanın solunda yer alır, duodenum ile dalak arasında transvers olarak uzanır. Yaklaşık 12-15 cm uzunluğunda, 70-100 gr ağırlığında yumuşak kıvamda pembe-sarı renklidir [7].
Pankreas histolojik olarak endokrin ve ekzokrin özellikte farklı yapılar içermektedir. Yapısının %90’ınını ekzokrin özellikteki asiner hücreler ve duktuslar oluşturur, %10’u ise endokrin fonksiyon gösteren langerhans adacıklarından oluşur. Langerhans adacık hücrelerinden insülin, glukagon, somatostatin ve diğer başka hormonlar salgılanır. Asiner hücreler sindirim enzimlerini sentezlerken duktal hücreler bol bikarbonat içeren sıvı salgısı yapar [8].
2.1.1. Ekzokrin Fonksiyon
Pankreas saf seröz yapıda ekzokrin fonksiyona sahiptir. Bikarbonattan zengin, çoğu inaktif halde birçok sindirim enzimi içeren bir sıvı salgılar. Günlük 1500-2500 ml kadar üretilen bu salgının temel fonksiyonu sindirimi kolaylaştırmak ve sindirim kanalını korumaktır [9].
Pankreasın ekzokrin salgısı hormonal ve sinirsel olarak düzenlenmektetir. Sindirimin sefalik ve gastrik fazında vagus yolu ile pankreas uyarılır. Hormonal yol ise kimusun duodenuma geçişi sonucu intestinal duvar gerilmesi ile salgılanan sekretin ve kolesistokinin aracılığı ile başlar. Sekretin, pankreastan bol miktarda bikarbonat ve su salgılanır, kolesistokinin sindirim enzimlerinin salgılanmasını uyarır [10].
Ekzokrin pankreas salgısındaki temel katyonik iyonlar sodyum ve potasyum, anyonik iyonlar bikarbonat ve klordur. Pankreas salgısı plazma
bikarbonat ve klor konsantrasyonu açlık ve toklukta değişkenlik gösterir. Salgılama uyarısının düşük olduğu yemek arası dönemde pankreatik salgının HCO3-içeriği 50 meq/L, Cl- içeriği 110 meq/L’dir. Yemek esnasında midedeki asidik kimus duodenuma geçtiğinde bikarbonat içeriği 140 meq/L’ye yükselir ve klor içeriği 20 meq/L’ye düşer ve artan alkali pH’ı sayesinde pankreatik sıvı, mideden duodenuma geçen asit kimusu nötralize eder ve pankreatik enzimlerin aktive olması için optimal pH sağlanmış olur. Ekzokrin salgı hızı yemekler arası dönemde 0.2-0.3 ml/dk iken yemek ve sekretin stimulasyonu ile 4 ml/dk’ya kadar artar [11]. Pankreatik enzimler kimüs içeriğindeki protein, lipit ve karbonhidratları daha küçük alt birimlerine ayrıştırır. Başlıca enzimler aşağıda listelenmiştir. Amilaz: Karbonhidratları disakkarit ve trisakkaritlere parçalar.
Lipaz: Nötral yağları, yağ asitleri ve monogliseritlere parçalar.
Tripsin: Proteinlerin peptitlere parçalanmasını ve diğer enzimlerin akivasyonunu sağlar.
Kimotripsin: Proteinlerin peptitlere parçalanmasını sağlar. Karboksipeptidaz: Peptitleri aminoasitlere parçalar.
Pankreatik kolesterol ester hidrolaz: Diyetteki kolesterol esterlerini kolesterol ve serbest yağ asitlerine hidrolize eder.
Fosfolipaz A2: Fosfolipitlerden yağ asitlerinin hidrolizini sağlar.
Pankreasın salgıladığı enzimler amilaz ve lipaz hariç proenzimdir. Tripsinojenin tripsine aktivasyonu, duodenal enzim enterokinaz tarafından gerçekleştirilir. Daha sonra tripsin diğer zimojenlerin aktif forma dönüştürür [9-11].
2.1.2. Endokrin Fonksiyon
Langerhans adacıkları, kaplillerler etrafına yerleşmiş, salgıladıkları hormonları doğrudan kana veren hücre gruplarından oluşur ve pankreasın endokrin fonksiyon gören kısmını oluşturur. Adacık hücrelerinin %25’ini oluşturan Alfa hücrelerinden glukagon salgılanır. Beta hücreleri adacığın %60’ını oluşturur ve insülin, proinsülin, C peptit, amilin salgılar. Delta
hücreleri somatostatin salgılar, adacıktaki hücrelerin %10’unu oluşturur. Bunlara ek olarak bazı adacıklarda pankreatik polipeptit salgılayan PP (F) hücreleri bulunur. Ayrıca D1 hücrelerinden VIP (vazoaktif intestinal peptit), enterokromafin hücrelerden seotonin, Epsilon hücrelerinden ghrelin salgılanır. Pankreasın endokrin salgısı hem sistemik dolaşıma katılır hem de ekzokrin salgıyı kontrol etmek üzere parakrin etki gösterir [9, 11].
2.2. AKUT PANKREATİT
Akut pankreatit, normalde pankreasta inaktif halde bulunan sindirim enzimlerinin herhangi bir etiyolojik faktörle aktifleşerek pankreas dokusunu ve çevre dokuları sindirmesi ve inflamasyon gelişmesi ile karakterize bir hastalıktır. Bu inflamasyon, ödemden nekroza kadar farklı patolojik tablolarla seyredebilir [1].
2.2.1. EPİDEMİYOLOJİ
Akut pankreatitin insidansı 100.000’de 4,9 ile 35 arasında değişmektedir. Amerika Birleşik Devletlerinde (ABD) her yıl 300.000’den fazla hasta akut pankreatit tanısıyla hastaneye yattığı ve yaklaşık 20,000 olgunun ölümle sonuçlandığı bildirilmiştir[12]. Vakaların %80’inde kendini sınırlayan hafif hastalık görülür ve ciddi morbidite olmaksızın iyileşir. %20 vakada pankreatit şiddetli seyreder ve abartılı sistemik inflamatuvar yanıt ile buna bağlı çoklu organ yetmezliğinin neden olduğu yüksek morbidite ve mortalite söz konusudur [13].
2.2.2. RİSK FAKTÖRLERİ
Akut pankreatit olgularının yaklaşık %80’inin etiyolojisinde safra taşları ve alkol kullanımı vardır. Birçok risk faktörü bilinmekle beraber olguların %16’sının idiyopatik olduğu bildirilmiştir [14].
Akut pakreatitin en sık nedeni safra taşlarıdır. Safra taşlarının ortak kanalı tıkayarak pankreatik kanal basıncında artışa ya da pankreatik kanala safra reflüsüne yol açarak pankreatite neden olduğu düşünülmektedir [15, 16]. 2.2.2.2. Alkol
Alkol vakaların %35’inden sorumludur ve ikinci en sık nedendir. Mekanizma tam olarak bilinmemekle birlikte alkolün asiner hücreleri duyarlı hale getirdiği, proteinden zengin salgıların pankreatik kanalda tıkaç oluşturduğu öne sürülmektedir. Sigara, alkolik pankreatit rölatif riskini içmeyenlere göre 4,9 kat artırır [17, 18].
2.2.2.3. Hipertrigliseridemi
Akut pankreatitin %1,3-3,8’inden hipertrigliserideminin sorumlu olduğu saptanmıştır. Serum trigliserid düzeyi 1000 mg/dl üzerine çıkınca akut pankreatiti tetikleyebilir. Mekanizma tam olarak anlaşılmamamış olsa da açığa çıkan serbest yağ asitlerinin pankreatotoksik olduğu düşünülmektedir. [19]
2.2.2.4. İlaçlar
Pankreatit vakalarının %2’sinden ilaçlar sorumludur. Genellikle hafif seyirli, kendini sınırlayıcı bir klinik tablo görülür [20]. İlaçların immünolojik reaksiyon (6-merkaptopürin, aminosalisilatlar, sulfonamidler), direkt toksik etki (diüretikler, sülfonamidler), toksik metabolit birikimi (valproat, didanozin, pentamidin, tetrasiklinler), iskemi (diüretikler, azatiyopürin), tromboz (östrojen) ve pankreatik sıvının yoğunlaşması (diüretikler, steroidler) gibi mekanizmalar ile pankreatit yaptığı bilinmektedir [21, 22]. 2.2.2.5. Endoskopik retrograd kolanjiyopankreatografi
Endoskopik retrograd kolanjiyopankreatografi (ERCP) sonrası pankreatit, akut pankreatit olgularının %2’sini oluşturur. ERCP yapılan olguların ise %5’inde pankreatit görülmektedir [13, 23].
2.2.2.6. Hiperkalsemi ve Hiperparatiroidi
Tüm pankreatitlerin %0,5’inin nedeni hiperkalsemi ve hiperparatiroididir. Pankreatik kanalda kalsiyum depozisyonu veya tripsinojen aktivasyonu sonucu pankreatite neden olduğu düşünülmektedir [24].
2.2.2.7. Otoimmun Pankreatit
Pankreasta ödem, lokal kitle, pankreatik kanalın proksimalinde düzensiz daralma, IgG4 içeren lenfoplasmositik hücre infiltrasyonu ve serumda IgG4 artışı ile karakterizedir [25].
2.2.2.8. Genetik
Otozomal dominant, otozomal resesif ya da kompleks genetik özellikte kalıtılan mutasyonlar pankreatitten sorumlu olabilir. PRSS1 (tripsin-1’i kodlayan serin proteaz 1 geni), SPINK1 (serine proteaz inhibitor Kazal tip 1 geni), CFTR (kistik fibrozis transmembran konduktans regülatör gen) mutasyonları örnek olarak sayılabilir. Genetik nedenler, tripsinin prematür aktivasyonu ya da inaktive edilememesi veya pankreatik salgının yoğunlaşması yoluyla pankreatite neden olur [26].
2.2.2.9. Abdominal Travma[27] 2.2.2.10. Enfeksiyonlar ve Toksinler
Virüslerden kabakulak, coxsackie, HBV, HSV, VZV, CMV, HIV, bakteriyel patojenlerden mycoplasma, legionella, leptospira, salmonella, mantarlardan aspergillus parazitlerden toxoplasma, cryptosporidium, ascarisin pankreatite neden olabileceği bildirilmiştir. Akrep zehiri ve organofosfat insektsitler pankreatite neden olur [28]
2.2.2.11. Postoperatif dönem (kardiyopulmoner bypass), pankreas divisium, oddi sfikter disfonksiyonu ve vasküler patolojiler pankreatit etyolojisinde rol alabilir [29-31]
2.2.2.12. İdiyopatik 2.2.3. PATOLOJİ
Asiner hücrelerin içerisinde sindirim zimojenlerinin aktivasyonu ile doku hasarının tetiklenmesi sonucu akut pankreatit geliştiği düşünülmektedir. İnflamatuar hücre aktivasyonu (PMNL, makrofaj), sitokin üretimi ve salınımı (TNFα, IL1, IL6), diğer mediatorlerin (PAF, lökotrienler, oksijen radikalleri ve diğerleri) ortaya çıkması ve asiner hücrelerin zedelenmesi inflmasyonun şiddetini belirlemektedir. Bu inflamatuvar süreç, akut pankreatitin morbite ve mortalitesinden sorumlu çoklu organ yetmezliği ile
sonuçlanan, sistemik inflamatuvar cevap sendromuna kadar ilerleyebilir [32].
2.2.4. KLİNİK
Akut pankreatit olgularında en önemli semptom karın ağrısıdır. Kuşak tarzında epigastrik veya üst abdominal ağrı görülür, sırta ve bazen de sol omuza yayılabilir. Çoğunlukla ağır bir yemeği veya alkol alımını takiben ortaya çıkar ve bulantı, kusma eşlik eder. Fizik muayenede epigastrik bölgede ve üst kadranlarda hassasiyet vardır. Defans ve rebound %30-40 olguda görülür. Ateş, taşikardi, hipotansiyon ve şok görülebilir. Sarılık ve %1 olguda ciltte, karın yan kadranlarında Gray-Turner veya göbek çevresinde Cullen belirtisi olabilir. Oskültasyonda barsak sesleri azalmış duyulabilir, özellikle sol akciğer bazalinde daha fazla olmak üzere konsolidasyon veya plevral efüzyona sekonder solunum seslerinde azalma olabilir [33, 34].
2.2.5. TANI
2.2.5.1. GÖRÜNTÜLEME YÖNTEMLERİ
Biliyer pankreatitli hastalarda safra taşlarını göstermede ultrasonografi (USG) kolay uygulanabilen bir yöntemdir. Kolesistolitiyazisi göstermede sensitivite %95 iken, koledokolitiyaziste bu oran %50’ye düşmektedir. USG aynı zamanda pankreastaki ödemi gösterebilir ancak vakaların %30’unda intestinal gaz nedeniyle yeterli görüntü kalitesi elde edilemez [35].
Bilgisayarlı tomografi (BT) pankreatit tanısında daha sık kullanılmaktadır. Kontrastlı BT pankreatitin şiddetini ve komplikasyonlarını tanımlamada oldukça kullanışlı bir yöntemdir [36].
Magnetik rezonans (MR) görüntüleme kontrast alerjisi ve nefropatisi durumlarında ya da gebelerde tercih edilebilir. MR kolanjiopankreatografi (MRCP) biliyer pankreatitli hastalarda koledokolitiyazisi %90 sensitivite, %95 spesifite ile gösterebilir. Endoskopik USG (EUS) koledokolitiyazisi göstermede MRCP’den daha hassastır. ERCP ise daha çok terapötik amaçlı kullanılmaktadır [37, 38].
Lökositoz ve C-reaktif protein (CRP) artışı inflamasyon nedeniyle genellikle vardır. Amilaz ve lipaz düzeyi tanıda geleneksel olarak kullanılan testtir. Amilazın tanıda sensitivitesi yüksek olmasına rağmen spesifitesi düşüktür. Serum lipaz düzeyi yüksek sensitivite ve spesifitesiye sahiptir, erken dönemde yükselir ve birkaç gün yüksek kalır. AST, ALT hafif yükselebilir. ALT düzeyinin 150 IU/L üzerinde olması %95 olasılıkla biliyer pankreatiti düşündürür [39].
2.2.6. TEDAVİ
Akut pankreatitli hastalar spesifik nedenin saptanması, destek tedavisinin verilmesi ve hastalığın yönetimi için hastaneye yatırılır, organ yetmezliği bulguları olan hastalar yoğun bakımda izlenmelidir.
Akut pankreatitli hastalarda inflamatuar yanıtın etkisiyle intravasküler mesafeden sıvı üçüncü boşluğa geçer, bu nedenle kalp yetmezliği olan hastalar hariç, IV olarak hastalar 250-300 cc/saat hızda kristaloid solüsyonlarla agresif hidrasyon ile tedaviye başlanmalıdır. Hastalar başlangıçta pankreası dinlendirmek amacıyla ağızdan beslenmemelidir. Hafif ve orta şiddetli hastalar parenteral besleme yapmaksızın birkaç gün IV hidrasyonla izlenebilirler. Şiddetli pankreatitlerde spesifik bir infeksiyonun yokluğunda proflaktik antibiyotik verilmesi tartışmalı bir konudur. Amerikan Gastroenteroloji Derneği’nin kılavuzuna göre pankreatik enfeksiyondan korunmak için proflaktik antibiyotik önerilmemektedir. Ancak pankreatik nekroz %30 ve daha fazla ise antibiyotik proflaksisi göz önünde bulundurulmalıdır. Seçilecek antibiyotikler pankreatik dokuya penetrasyonu iyi olan imipenem, 3. kuşak sefalosporinler ve piperasilin grubundan olmalıdır [33, 40].
2.3. KRONİK PANKREATİT
Kronik pankreatit, endokrin ve ekzokrin fonksiyon bozukluğu ile giden, pankreasta kalıcı fibrozis ve yıkım sonucu morfolojik değişikliklerin olduğu inflamatuar bir durumdur [41].
Dünyanın birçok yerinde yapılan çalışmalarda erişkinlerde kronik pankreatit prevelansının 100.000’de 3-10 aralığında olduğu bildirilmiştir. Tanı genellikle 35-55 yaşlar arasında konur [42].
2.3.2. RİSK FAKTÖRLERİ
Kronik pankreatite neden olan başlıca etiyolojik faktörler TIGAR-O sınıflandırması ile özetlenmiştir (Tablo 1) [43].
Tablo 1: TIGAR-O sınıflandırması [44]
Toksik-metabolik Otoimmun • Alkol • Sigara • Hiperkalsemi • İlaçlar • Toksinler
• Otoimmün pakreatit (IgG4) • Otoimmun hastalık ilişkili
pakreatit (Sjögren sendromu, inflamatuar barsak hastalığı ve primer biliyer siroz ilişlkili kronik pankreatit)
İdiyopatik Rekürren ve ciddi akut pankreatit
• Erken başlangıçlı • Geç başlangıçlı • Tropikal
• Diğer
• Postnekrotik
• Rekürren Akut Pankreatit • Vasküler/İskemik • Postradyoterapi Genetik Diğer/Tıkayıcı • Otozomal dominant (Katyonik tripsinojen mutasyonu, kodon 29 ve kodon 122 mutasyonu) • Otozomal resesif (CFTR, SPINK1, katyonik tripsinojen (kodon 16, 22, 23) ve muhtemelen alfa-1 antitripsinojen mutasyonları) • Pankreas divisum • Pankreatik kanal obsrüksiyonu
• Periampuller duodenal duvar kistleri
• Posttravmatik pankreatik kanal skarı
2.3.3. PATOLOJİ
Kronik pankreatite neden olan patofizyoloji net olarak belirlenememiştir. Teoriler arasında taş ve duktal tıkanma, nekroz-fibroz, toksik metabolitler ve oksidatif stres yer alır. Bu dört modelin her biri bilimsel öneme sahiptir ancak kronik pankreatit olgularının tümünün tek bir teori ile açıklanması mümkün görünmemektedir. Taş ve duktal tıkanma teorisi tıkanmanın hayvan modellerinde pankreatik proteinlerin bazal sekresyon artışı ve tripsin inhibitörünün azalması gözlemlerinden yola çıkılarak geliştirilmiştir. Kalsiyum karbonat taşı oluşumunu engelleyen litostatin eksikliğinin de taş oluşumu ve kronik panreatit ile sonuçlandığı düşünülmektedir. Nekroz-Fibroz hipotezinde tekrarlayan akut pankreatit ataklarının hücre nekrozuna yol açtığı ve iyileşmeler sırasında nekrozun yerini fibrozisin alması ile kronik değişikliklerin geliştiği öngörülür. Toksik–Metabolik teorisi, alkolün asiner hücrelerde sitoplazmik lipid birikimine neden olarak yağlı dejenerasyon, hücresel nekroz ve sonuçta fibroza yol açtığını ileri sürer. Oksidatif stres teorisi, pankreatitin asıl nedeninin oksidatif hasara yol açan reaktif moleküllerin aşırı aktivasyonu olduğunu ifade eder [45].
2.3.4. KLİNİK
Kronik pankreatitli hastaların %50-80’inde karın ağrısı görülür. Karın ağrısı genellikle yemek sonrası oluşur ve epigastriumdan başlayıp sırta doğru yayılır, öne eğilmekle hafifler. Olguların %30’unda steatore görülebilir. Bozulmuş glikoz toleransı ve ileri vakalarda pankreatik diyabet ve kilo kaybı görülebilir [46].
2.3.5. TANI
2.3.5.1. GÖRÜNTÜLEME YÖNTEMLERİ
USG ve bilgisayarlı tomografi (BT) gibi görüntüleme yöntemleri vakaların %70-90’ında tanısaldır. ERCP, eğer bu testlerde belirsizlik varsa ya da negatif sonuç çıkarsa, diğer görüntüleme teknikleri ile görülemeyen pankreatik kanal anormalliklerini ortaya koymakta kullanılabilir. ERCP yerine daha az girişimsel olan EUS kullanılabilir. Eğer USG, BT, ERCP veya EUS normal çıkarsa bazı seçilmiş vakalarda özellikle küçük kanal hastalığı olan hafif kronik pankreatit kanıtını ortaya çıkartabilecek olan
olduğunda veya teknik güçlükler nedeniyle yapılamadığında MRCP, ERCP’ye iyi bir alternatiftir. Düz karın grafisinde pankreasda yaygın kalsifiye alanların görülmesi tanısaldır ama bu bulgunun duyarlılığı sadece %30-40 arasındadır [47].
2.3.5.2. LABORATUAR
Akut pankreatit atakları sırasında pankreatik enzim seviyeleri tipik olarak normalin üst sınırının 3 katı veya daha fazla artmaktadır [48, 49]. Ancak ataklar arasında olguların çoğunda serum amilaz ve lipaz seviyeleri normal ya da hafif yükselmiş olarak bulunur [50]. Biliyer obstrüksiyon meydana gelen hastalarda sarılık, serum alkalen fosfataz ve transaminaz seviyelerinde artış saptanabilir [49]. Genetik araştırma amacıyla kistik fibrozisten sorumlu olan CFTR geni, tripsin inhibitörünü kodlayan SPINK-1 geni, herediter pankreatit ile ilişkili olan PRSS-1 geni bakılabilir [44]. 2.3.6. TEDAVİ
Sigara ve alkolün bırakılması, küçük öğünler ile beslenilmesi ve hidrasyon yaşam tarzında yapılacak önemli değişikliklerdir. Tıbbi tedavi tam olarak ağrı kontrolü ve yeterli enzim desteği ile birlikte malabsorbsiyonu ortadan kaldırmayı hedefler. Otoimmun kronik pankreatit olgularının çoğu steroid tedavisine dramatik yanıt verir. Medikal ağrı kontrolü için başlangıçta asetominofen ve NSAİ ilaçlar tercih edilebilir, fakat bazı durumlarda narkotik analjeziklere gereksinim duyulabilir. Somatostatin analoğu oktreotit, pankreatik salgıyı baskılar ve visseral analjezik etkilere sahiptir. Eğer tüm önlemler ağrıyı gidermede başarısız olursa, endoskopik drenaj ya da bundan daha üstün olan cerrahi müdahale düşünülebilir. Yağlı ishal pankreatik enzim replasmanıyla tedavi edilir (öğün başına 25.000-30.000 ünite lipaz). Besinlerden alınan yağ oranının düşürülmesi de semptomları azaltır, yeterli rahatlama elde edilemeyen hastalarda H2 reseptör antagonisti ya da proton pompa inhibitörü kullanılması önerilir. Pankreatik yetmezliğe sekonder DM, insülin ve diyet ile tedavi edilir. Bu tip DM oral antidiyabetiklere çok az cevap verir veya hiç vermez [45, 51].
2.4. PANKREAS KANSERİ
Pankreasın en sık görülen ve pankreas kanseri denince akla gelen malignitesi duktus epitelinden köken alan adenokarsinomdur. Daha nadir olarak periampuller bölge tümörleri, kist adenokarsinom ve daha nadir olarak da endokrin tümörler gelişmektedir [52].
2.4.1. EPİDEMİYOLOJİ
İnsidansı 8-14/100.000 olan pankreas kanseri tüm dünyada kanser ölümlerinde erkekte sekizinci kadında dokuzuncu sırada yer almaktadır. 40 yaşından önce nadiren görülmesi ile birlikte sıklığı 70-80 yaşlar arasında pik yapar. Pankreas kanserinin görülme sıklığının, ölüme neden olma sıklığına oranı 0.9’dur ve hem dünyada hem de Türkiye'de mortalite/insidans oranı en yüksek kanser tipidir. Pankreas kanserinin 5 yıllık sağkalım oranı %5’in altındadır ve bu oran tüm kanserler arasında en düşük oranlardan biridir [3, 53, 54]. Pankreas kanserinin görülme sıklığı ve mortaliteye neden olma sıklığı son yıllarda birçok tümör tipinin aksine hafifçe artma eğilimindedir American Cancer Society (ACS) verileri Şekil-1 ve Şekil-2’de gösterilmiştir. Yine ACS verilerine göre 2018 yılında ABD’de 55.440 yeni pankreas kanseri olgusu ve 44.330 pankreas kanseri nedenli ölüm olacağı tahmin edilmektedir [55].
Şekil 1: American Cancer Society verilerine göre kadınlarda pankreas kanseri ve diğer kanser tiplerinin mortalite oranlarının yıllar içindeki değişimi [55]
Şekil 2: American Cancer Society verilerine göre erkeklerde pankreas kanseri ve diğer kanser tiplerinin mortalite oranlarının yıllar içindeki değişimi [55]
2.4.2. RİSK FAKTÖRLERİ
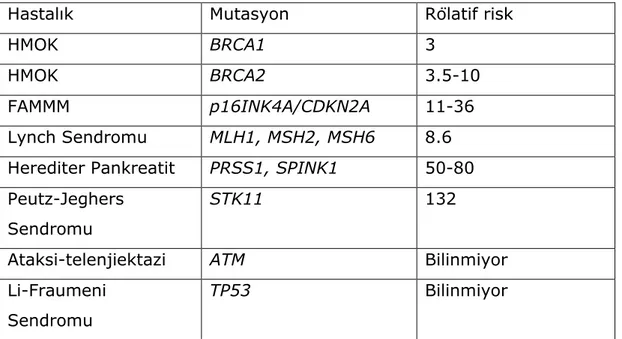
2.4.2.1. KALITSAL SENDROMLAR VE GENETİK RİSK FAKTÖRLERİ Pankreas kanserlerinin çoğu sporadik olmasına rağmen, %10’u ailesel temellidir [56]. Kalıtsal sendrom olmaksızın ailesinde 1 pankreas kanserli 1. dereceden akrabası olan bireyler, normal popülasyona göre 2 kat daha fazla risk taşımakla birlikte, pankreas kanserli 1. dereceden akraba sayısı arttıkça risk de o denli artış göstermektedir [57]. Ayrıca 0 kan grubu kişilere kıyasla diğer kan gruplarından birine sahip kişilerde ( A, B, AB) pankreas kanseri görülme oranının daha fazla olduğu bilinmektedir [58]. Pankreas kanseri riskini arttıran kalıtsal sendromlar Tablo 2’de özetlenmiştir.
Tablo 2: Pankreas kanseri ile ilişkili kalıtsal sendromlar (HMOK: herediter
meme-over kanser sendromu FAMMM: Familyal atipik multipl mole melanom sendromu) [59-66]
Hastalık Mutasyon Rölatif risk
HMOK BRCA1 3
HMOK BRCA2 3.5-10
FAMMM p16INK4A/CDKN2A 11-36
Lynch Sendromu MLH1, MSH2, MSH6 8.6 Herediter Pankreatit PRSS1, SPINK1 50-80 Peutz-Jeghers
Sendromu
STK11 132
Ataksi-telenjiektazi ATM Bilinmiyor
Li-Fraumeni Sendromu
TP53 Bilinmiyor
2.4.2.2. ÇEVRESEL RİSK FAKTÖRLERİ
Pankreas kanserinin önemli çevresel risk faktörlerinin sigara kullanımı, doymuş yağdan zengin diyet, obezite ve inaktif yaşam tarzı olduğunu gösteren birçok çalışma bulunmaktadır, sigara kullanımı tek başına pankreas kanseri olgularının %25’inden sorumlu tutulmaktadır [67]. Düşük
gr ya da daha fazla olmak üzere ağır alkol tüketiminin yaklaşık %22 oranında pankreas kanseri risk artışına yol açabileceği belirtilmiştir [68]. Diyabetes mellitus ve nonherediter kronik pankreatitin özellikle uzun dönem takipte pankreas kanseri için öncü hastalıklar olduğu gösterilmiştir. Pankreatik kistlerin malign dönüşümü sonucu pankreas kanseri gelişebilir [69-71].
Benzidin, beta-naftilamin, nitrozamin ve azaserin uzun dönem maruziyet ile pankreas kanseri riskini arttırdığı bilinen çevresel karsninojenlerdir [72]. Enfeksiyöz patojenlerden HBV, HCV, Helicobacter pylori enfeksiyonlarının pankreas kanseri riskini arttırdığı saptanmıştır [73, 74].
2.4.2.3. PANKREAS KANSERİ VE BESLENME
Beslenme paterni ve pankreas kanseri ilişkisini inceleyen olgu-kontrol çalışmaları yapılmıştır. Bu çalışmalardan birinde beslenme alışkanlığına göre üç grup belirlenmiştir. Batı tipi: işlenmiş et, tatlı ve şekerden zengin gıdalar, rafine tahıllar ve patates ağırlıklı besinler; meyve-sebze: bol miktarda taze meyve-sebze içeren beslenme; alkolik: likör, şarap, bira tüketiminin fazla olduğu grup. Meyve-sebze ağırlıklı beslenenlerin diğer gruplara göre pankreas kanseri riskinin %49 daha az olduğu görülmüştür. Bir diğer çalışmada ise meyve-sebze, balık, kümes hayvanları, az yağlı süt ürünlerinin daha fazla alımını içeren beslenme biçiminin pankreas kanseri riskini %50 azalttığı görülmüştür [75, 76]. Diyetteki bileşenlerin pankreas kanseri ile ilişkisini ayrı ayrı inceleyen bazı çalışmaların sonuçları aşağıda sunulmuştur.
2.4.2.3.1. Karbonhidrat Tüketimi ve Pankreas Kanseri
Karbonhidrat tüketimi ve pankreas kanseri ilişkisini inceleyen birçok toplum tabanlı çalışma yapılmıştır. Diyetteki toplam karbonhidrat miktarı, glisemik inseksi yüksek gıda tüketimi ile ilgili farklı veriler bulunmakla birlikte diyetteki yüksek miktarda fruktozun ılımlı bir rölatif risk artışı ile ilişkili olduğu üzerinde durulmaktadır [77-80].
2007 yılında çok sayıda etnik grubun incelendiği bir kohort çalışmada diyetteki glisemik yükün pankreas kanseri oluşturma riski araştırılmıştır. Hawai- Los Angeles bölgesinde yaşayanlardan 162.150 kişinin katıldığı bu
araştırma, glisemik yük, diyetle alınan karbonhidratlar, sükroz ve fruktozun pankreas kanseri ile ilişkisi değerlendirilmiştir. Sekiz yıl izlem sonucunda gruptaki 434 kişide pankreas kanseri ortaya çıkmıştır. Yüksek miktarda fruktoz alımının pankreas kanseri ile istatistiksel olarak anlamlı derecede ilişkili olduğu gösterilmiştir. Bu çalışmaya göre kilo fazlası olanlarda şeker alımı özellikle daha fazla risk oluşturmaktadır [78].
ABD’de yapılan başka bir kohort çalışmada 124.907 kişi 9 yıl boyunca takip edilerek gerçekleştirilmiş, yüksek glisemik yük, yüksek glisemik indeks ve fazla karbonhidrat alımı ile ilişkili olarak pankreas kanseri riskinde artış saptanmamıştır. Bu çalışmada karbonhidratlar fruktoz, glikoz olarak ayrı ayrı incelenmemiştir [79].
Diyetteki fruktoz, karbonhidrat, glisemik indeks ve glisemik yükün pankreas kanseri gelişimine etkisini inceleyen 6 büyük kohort çalışmanın 2012 yaılında yayınlanan bir meta-analizinde yüksek miktarda fruktoz içeren diyetin pankreas kanseri gelişme riskini arttırdığı (35 gram/gün fruktoz içeren diyet ile Rölatif Risk 1.22 (Cl%95, 1.08-1.37) ancak diyetteki fruktoz miktarı ile pankreas kanseri gelişim riski arasındaki ilişkinin lineer olmadığı saptanmıştır [80].
Şekerle tatlandırılmış alkolsüz içecek tüketiminin değerlendirildiği prospektif bir çalışmada haftada üç şekerli meşrubat tüketen bireylerin tüketmeyenlerle kıyaslandığında 1.13 kat -obez kadınlarda 1.57- rölatif riske sahip olduğu görülmüştür [77].
2.4.2.3.2. Et Tüketimi ve Pankreas Kanseri
Kırmızı et tüketimi ile pankreas kanseri ilişkisini inceleyen 11 prospektif çalışmanın dahil edildiği bir meta-analizde günde 120 gramın üzerinde kırmızı et tüketimi incelenmiştir. Fazla kırmızı et tüketimi erkeklerde pankreas kanseri riski artışı ile ilişkiliyken kadınlarda ilişkili bulunmamıştır. Bu çalışmada işlenmiş et tüketiminde 50 gramlık artışında pankreas kanseri rölatif riskinin 1.19 olduğu gösterilmiştir [81]. Çin’de yapılan çok merkezli bir olgu-kontrol çalışmasında haftada 3 defadan fazla et tüketenlerin hafta 1-2 kez et tüketenlere göre daha fazla pankreas kanseri riskine sahip olduğu saptanmıştır [82].
Beslenme alışkanlıkları ve pankreas kanserinin incelendiği bir olgu-kontrol çalışmasında tütsülenmiş et tüketiminin pankreas kanseri riskinde 4.68 kat artışa neden olduğu saptanmıştır [83]. Bir diğer olgu-kontrol çalışmasında ise yağla işlenmiş et ürünleri tüketimi (sosis, salam vb) ile pankreas kanseri riski arttığı ve tavuk ve hindi eti tüketimi ile risk arasında ters ilişki olduğu görülmüştür [84]. Epidemiyolojik çalışmalar, pankreas kanserini fazla pişmiş kırmızı et ve tavukta bulunan heterosiklik amin (HCA) alımını ilişkilendirmiştir. Bu çalışmalardan birinde bu ilişkinin yalnızca erkeklerde olduğu saptanmıştır [85, 86]. Beyaz et tüketimi ile pankreas kanseri arasında ilişki olmadığını gösteren başka yayınlar mevcuttur [87-89]. Birkaç kohort çalışmada, pankreas kanserinin insidansı ve mortalitesi ile balık tüketiminin ilişkisi incelemiş ve bu çalışmalarda bir ilişki gösterilmemiştir [90-92]
2.4.2.3.3. Yağlı Gıda Tüketimi ve Pankreas Kanseri
Olgu-kontrol çalışmalarının büyük bir kısmı doymuş yağa sitleri, tekli doymamış yağ asitleri ve çoklu doymamış yağ asitlerinin pankreas kanseri ile pozitif bir ilişkisi olduğunu göstermiştir. Ancak bir çalışmada çoklu doymamış yağ asitinden zengin diyetin pankreas kanseri riskini azaltabileceği gösterilmiştir. Çeşitli kohort çalışmalarda toplam yağ tüketimi, tereyağı ve krema gibi doymuş yağlar ve tekli doymamış yağlar ile pankreas kanseri riski artışı saptanmıştır ancak prospektif çalışmalarda bu ilişki gösterilmemiştir [84, 93-96].
Prospektif kohort ve olgu-kontrol çalışmaları içeren bir meta-analizde, uzun zincirli çoklu doymamış yağ asitleri tüketiminin pankreatik kanser riskiyle ters orantılı bir ilişkisi bulunamamıştır ve uzun zincirli çoklu doymamış yağ asitleri ile pankreas kanseri riskinin azalmasını araştıran başka yayınlarda bu sonuçla uyumludur [88, 91, 97, 98].
2.4.2.3.4. Sebze-Meyve Tüketimi ve Pankreas Kanseri
Epidemiyolojik çalışmalar, meyve ve sebze tüketiminin pankreas kanseri geliştirme riski ile ters orantılı olduğunu göstermiştir. Bu ters ilişki, narenciye, kavun, çilek, koyu yeşil sebzeler, domates, fasulye, bezelye, koyu sarı sebze, lif ve bütün tahıl gibi meyve ve sebzelerin tüketiminde
önemli yararların gösterildiği vaka kontrol çalışmalarında da doğrulanmıştır. Meyveler, özellikle turunçgiller, hesperidin, rutin ve diosmin gibi flavonoidler bakımından zengindir. Flavonoidlerin antitümör, anti-proliferatif ve pro-apoptotik özelliklere sahip olduğu gösterilmiştir. Turunçgiller de beta-karoten ve lutein gibi karotenoidler açısından zengindir ve bu bileşikler ayrıca kanser riskini de azaltabilir. Limonin ve nomilin gibi narenciye limonoidler, turunçgillerde bulunan bileşiklerdir ve anti-oksidan ve antikanser özelliklere sahip oldukları bulunmuştur [99-105].
2.4.2.3.5. Alkol Tüketimi ve Pankreas Kanseri
Alkolün pankreas kanseri için bağımsız bir risk faktörü olduğu gösterilmiştir, ancak sadece ağır alkol tüketimi ile ilişkilidir. Bu veri yapılan 14 kohort çalışmanın meta-analizinde günde 30 gramdan fazla alkol tüketen kadınlarda da doğrulanmıştır; erkeklerde ilişki istatisksel anlamlı bulunmamıştır. Bununla birlikte, büyük bir kohort çalışma olan kanser ve beslenme ilgili Avrupa prospektif çalışması olan EPIC çalışması, alkol tüketimi ile pankreas kanseri geliştirme riski arasında bir ilişki olmadığını göstermiştir. Çoğu istatistiksel analizde sigara içmenin güçlü bir karıştırıcı faktörü olduğu görülmektedir [106, 107].
2.4.2.3.6. Kahve ve Pankreas Kanseri
1980'lerin başından itibaren yapılan çalışmalar, kahve tüketimi ile pankreatik kanser gelişimi arasında bir ilişki olabileceğini düşündürmektedir. Bununla birlikte, daha yeni meta-analizler kahve alımı ve pankreas kanseri riski arasında bir ilişki olmadığını veya ters bir ilişki olduğunu göstermiştir [108-111].
2.4.2.3.7. Tahıllar ve Pankreas Kanseri
Olgu-kontrol çalışmaları, tam tahılların ve yüksek lifli gıdaların tüketiminin pankreas kanseri riskini azaltabileceği ve rafine tahılların riskle ilişkili olmadığını kanıtlamıştır. Dört çalışmanın bir meta-analizi, tam tahıllar ve pankreas kanseri arasında ters bir ilişki olduğunu doğrulamıştır [101, 112].
Pankreas kanseri en sık ekzokrin hücrelerden (asiner ve duktal) gelişir. Endokrin neoplaziler pankreas tümörlerinin %5’inden azını oluştururken nonepitelyal kökenli tümörler nadirdir [113]. Duktal adenokarsinom pankreas tümörlerinin %85-90’ını oluşturur. Tümörlerin %60-70’i pankreas başı, %5-10’u gövde ve %10-15’i kuyruk bölgesinden gelişir [114]. Duktal adenokarsinom için prekürsör lezyonlar, pankreatik intraepitelyal neoplaziler (PanIN), intraduktal papiller musinöz neoplaziler (IPMN) ve musinöz kistik neoplazilerdir [115].
2.4.4. MOLEKÜLER PATOLOJİ ve GENETİK
Pankreas duktal adenokarsinomların karsinogenezinde, pankreatik intraepitelyal neoplaziler (PanINs) olarak da adlandırılan neoplastik non-invasiv lezyonlardan, non-invasiv karsinomaya geçiş görülmektedir [1].
Pankreatik intraepitelyal neoplazilerin erken evrelerinde (PanIN-1A, 1B), telomer kısalması ve onkogen K-RAS mutasyonları izlenir. Sonraki evrede (PanIN-2) p16 tümör baskılayıcı genin inaktivasyonu ve geç evrede (PanIN-3) ise p53, SMAD4 (DPC4) ve BRCA2 tümör baskılayıcı genlerin inaktivasyonu görülür (Şekil 3).
Şekil 3: Pankreas adenokarsinom karsinogenezi [116]
2.4.5. KLİNİK
Erken evredeki pankreas kanseri genellikle klinik olarak sessizdir ve hastalık yalnızca tümörün çevre dokulara yayılması ya da uzak organlara metastazı sonrası belirgin hale gelir; semptomatik olgular çoğunlukla ileri evre hastalığa sahiptir [117].
Klinikte en sık rastlanan belirtiler ilerleyici sarılık epigastrik ağrı ve kilo kaybıdır. Diğer nonspesifik semptomlar bulantı, yorgunluk ve anoreksidir. Daha az olarak diyabet ve pankreatit görülür.
Klinik bulgular tümörün yerleşimine göre değişkenlik gösterir. Tümörün pankreasın baş kesiminde yerleşmesi koledoğa bası yaparak kliniğe çoğu kez sarılık olarak yansır. Sarılığın yanı sıra, karın ağrısı, idrar renginde
sarılığa eşlik eden diğer bulgulardır. Hastaların bir kısmında da pankreatik kanalın tıkanmasına bağlı olarak ekzokrin yetersizlik nedeniyle steatore ve malabsorbsiyon bulguları vardır.
Ağrı, tümörün çölyak ve superior mezenterik pleksusa invazyon yapması nedeniyledir, daha çok düşük yoğunlukta ve künt olup epigastrik bölgede hissedilir. İlerlemiş vakalarda ağrı sırta lokalize olabilir [118, 119].
2.4.6. TANI
2.4.6.1. GÖRÜNTÜLEME
US, pankreatik kitlelerin boyutu, yerleşimi, safra ve pankreatik kanal dilatasyonu, tümörün vasküler yapılara yakınlığı, asit, lenf nodu tutulumu ve karaciğer metastazı hakkında bilgi sağlayabilir [120]. Genellikle pankreas kanseri şüphesi olan kişilerde yapılan ilk görüntüleme olmakla birlikte sensitivitesi yapan kişiye göre değişkendir, değerlendirme obeziteden ve gazdan etkilenir ve 3 cm’den küçük kitleleri saptamada duyarlılığı daha düşüktür [121]. Bu kısıtlayıcı nedenlerden dolayı tanı ve evreleme için BT ile değerlendirme gerekir. Kontrastlı BT ile tümör büyüklüğü ve lokalizasyonu, lokal yayılımı, bölgesel damar tutulumu, lenf nodu tutulumu ve uzak metastazlar değerlendirilebilir [122].
MR, pankreas kanseri şüphesi olan olguların değerlendirmesinde BT’ye üstün olmamakla birlikte pankreatik kanal ve safra yollarının anatomisinin görüntülenmesinde BT’den üstündür. MRCP pankreatik ve biliyer tıkanmaların ve kistik lezyonların değerlendirmesinde yaygın olarak kullanılır [123].
EUS pankreas kanserinin teşhisinde en duyarlı görüntüleme yöntemidir ve sensitivitesi %93-100 arasındadır. Öellikle 5 mm‘den küçük lezyonlarda duyarlılığı BT’den üstün bulunmuştur. EUS eşliğinde yapılan İİAB (ince iğne aspirasyon biyopsisi)‘leri tanısal sensitiviteyi %85-95‘e, spesifiteyi %100‘e çıkartmaktadır [124].
ERCP safra yollarının değerlendirmesine, biyopsi yapılabilmesine, genetik analizler için pankreatik sıvı alınmasına olanak sağlar. Tanısal rolü düşük olmakla birlikte, pankreas kanseri nedeniyle safra yollarında oluşan darlığa
stent yerleştirilmesi gibi tedavi yaklaşımları için önemli bir yöntemdir [125, 126].
PET (Pozitron emisyon tomografisi) fonksiyonel değerlendirme amacıyla kullanılan görüntüleme yöntemidir. Cerrahi uygulanacak lokalize hastalığı olanlarda gizli metastazları dışlamada, pankreas rezeksiyonu sonrası tümör rekürrensini değerlendirmede ve tedaviye tümör cevabının değerlendirmesinde kullanılabilir [127].
2.4.6.2. SİTOLOJİ
Görüntülemede yüksek şüpheli lezyon saptanan ve cerrahi rezeksiyon ile potansiyel olarak küratif olanlarda biyopsi ile örnekleme yapılmadan sıklıkla direkt cerrahi yapılır. Sitolojik tanı genellikle EUS veya BT eşliğinde İİAB veya ERCP yardımıya fırça biyopsi ile yapılır, negatif sonuç maligniteyi ekarte etmez [114].
2.4.6.3. LABORATUAR
Bazı tümör belirteçlerinin serum düzeyleri teşhis için önemlidir. Özellikle glikoprotein karbonhidrat antijen 19-9 (CA 19-9), pankreas kanseri için sensitivitesi (%70-92) ve spesifitesi (%68-92) yüksek olan bir tümör belirtecidir [120]. Normal pankreas ve safra kanalı hücrelerinde ifade edilen ve pankreatit, siroz ve kolanjit gibi hastalıklarda serum düzeyi yükselebilen CA 19-9, pankreas kanserinde tedaviye yanıtın değerlendirilmesinde de kullanılır [128]. Pankreas kanserinde kullanılan diğer karbonhidrat antijen tümör belirteçler C50, CA 72-4 ve CA 242’dir [129].
Hastalarda, özellikle tümörün kuyruk kısmına yerleştiği olgularda laboratuvar bulguları normal olabilmektedir. Pankreas başı tümörleri kolestaz kliniği ile geldiğinden laboratuarda direkt hakimiyetinde hiperbilirubinemi, alkalen fosfataz (ALP) ve gamma glutamil transpeptidaz (GGT) düzeylerinde orta derecede, aminotransferazlarda ise hafif düzeyde bir artış görülebilir. Normokrom anemi ve hafif hipoalbuminemi, neoplastik sürecin ve onun nutrisyonel sonuçları ile ilişkili olabilir. Bu durumda tipik olarak hepatit göstergeleri negatiftir. Daha sık IPMN’lerde görülmekle
yükselebilmektedir. Protrombin zamanında uzama ancak derin sarılıklı ve yağda eriyen vitaminlerin emilemediği hastalarda görülür [119].
2.4.7. EVRELEME
The American Joint Commity on Cancer (AJCC) 2017 evreleme sistemine göre TNM evrelemesi Tablo 3’teki gibidir.
Tablo 3: Pankreas kanserinde TNM evrelemesi Tümör (T)
TX Primer tümör değerlendirilemez T0 Primer tümör kanıtı yok
Tis Karsinoma in situ (Pan-IN3 dahil) T1 Tümör ≤2 cm • T1a ≤5 mm • T1b >5mm, ≤1cm • T1c >1 cm, ≤2 cm T2 Tümör >2 cm, ≤4 cm T3 Tümör >4 cm
T4 Tümör çölyak aks, superior mezenterik arteri ve/ya hepatik arteri sarar, boyutu ne olursa olsun (anrezektabl tümör)
Lenf nodu metastazı (N)
Nx Bölgesel lenf nodu değerlendirilemez N0 Bölgesel lenf nodu metastazı yok N1 1-3 bölgesel lenf nodu metastazı var N2 ≥4 bölgesel lenf nodu metastazı var
Metastaz (M)
Mx Uzak metastaz değerlendirilemez M0 Uzak metastaz yok
M1 Uzak metastaz var
AJCC Evrelemesi T N M Evre Tis T1 T1 T1 N0 N0 N1 N2 M0 M0 M0 M0 0 IA IIB III
T2 T2 T2 T3 T3 T3 T4 Herhangi bir T N0 N1 N2 N0 N1 N2 Herhangi bir N Herhangi bir N M0 M0 M0 M0 M0 M0 M0 M1 IB IIB III IIA IIB III III IV 2.4.8. TEDAVİ
Rezektabl tümörü olan olgularda cerrahi rezeksiyon tek potansiyel küratif tedavidir. En sık uygulanan cerrahi yöntemi Whipple operasyonudur, uygun vakalarda sol pankreatektomi yapılabilir. Küratif cerrahi sonrası bile prognoz kötü olduğundan rezeksiyon sonrası adjuvan kemoradyoterapi yapılmalıdır. Günümüzde adjuvan tedavi olarak tek başına gemsitabin, tek başına 5-florourasil (5FU) veya 5-FU temelli kemoradyoterapi önerilmektedir [114, 130].
Lokal ileri tümörü olan hastalarda performans skoru iyiyse kemoterapi (FOLFIRINOX, gemsitabin, gemsitabin+ paklitaksel ya da diğer gemsitabin temelli tedaviler, kapesitabin, 5-florourasilin sürekli infüzyonu, 5-FU+ okzaliplatin) ya da kemoradyoterapi uygulanır [131].
Metastatik olgularda kemoterapi yapılır ancak küratif değildir ve palyatif faydaları ile potansiyel toksik yan etkileri göz önüne alınarak uygulanmalıdır. Metastatik hastalıkta performans skoru düşükse tek ajan gemsitabin ya da palyatif ve maksimum destek tedavisi uygulanır. Performans skoru yüksekse FOLFIRINOX ya da gemsitabin+paklitaksel tercih edilir [114].
Palyatif tedavi sıklıkla ağrı ve sarılık tedavisini içerir. Ağrıya yönelik tedavi uygun dozlarda etkili analjezik kullanımı ve gerekli hastalarda çölyak pleksus ablasyonunu içerir. Sarılık perkutan veya endoskopik biliyer stent uygulaması ile giderilebilir. Pankreas kanserinde sık venöz tromboemboli geliştiğinden profilaksi amacıyla düşük molekül ağırlıklı heparin önerilir.
Pankreasın ekzokrin yetmezliğinde enzim replasmanı gerekir. DM uygun diyet ve medikal tedavi ile yönetilir [114, 131-133].
2.5. FRUKTOZ
Fruktoz, diyette meyveler ve bal içinde doğal olarak bulunan ve tatlandırıcıların içeriğinde çok daha fazla oranlarda yer alan bir monosakkarittir. Gıda sektöründe tatlandırıcı olarak son 50 yılda giderek daha fazla kullanılan yüksek fruktozlu mısır şurubu diyetteki en önemli fruktoz kaynağı haline gelmiştir [134, 135]. Artmış fruktoz tüketimi başta metabolik sendrom ve obezite olmak üzere bir çok hastalığın görülme sıklığının artışından sorumlu tutulmaktadır [135, 136].
Fruktoz, glikoz gibi altı karbonlu bir monosakkarit olup (C6H12O6), glikozdan moleküler farkı birinci karbondaki aldehid grubu yerine ikinci karbonunda keto grubu bulundurmasıdır. Fruktoz metabolizması da glikozdan farklılıklar göstermektedir.
Diyetle alınan fruktoz, spesifik bir fruktoz taşıyıcısı olan GLUT5 yolu ile barsak hücresine alınır (kolaylaştırılmış difüzyon). Bir sodyum kotransporter olan SGLT-1 ile emilen glikozun aksine bu işlem sodyum bağımlı değildir ve enerji gerektirmez. Barsak hücresine alınan fruktoz ve glikoz daha sonra enterositin basolateralindeki GLUT2 taşıyıcıları üzerinden kana verilir. Kana geçen fruktoz portal dolaşım ile metabolize edildiği temel yer olan karaciğere ulaşır [137].
Karaciğerde fruktoz, fruktokinaz ile fruktoz 1- fosfata ve devamında aldolaz B ile trioz fosfata çevrilir. Glikozu metabolize eden glukoninazın aksine bu enzimler ne insulinle aktive olur ne de ATP veya sitratla inhibe olur. Fruktoz 1-fosfat aldolaz B ile trioz fosfata çevrildikten sonra glikolizin temel düzenleyici basamağı olan fosfofruktokinaz basamağını atlayarak glikolitik yola girer. Glikozun karaciğerdeki metabolize edilme sürecine ters olarak, fruktozun trioz-fosfata dönüşümü insülinden bağımsız olarak gerçekleşen hızlı bir süreçtir ve devam eden glikoliz basamakları sonucunda fruktozun büyük bir kısmı (> %70) asetil coA’ya çevrilir ve sonuç olarak karaciğerde yüksek miktarda asetil coA oluşur. Ölçüsüz miktarda asetil koenzimA,
gliserol-3-fosfat ve diğer lipojenik ürünlerin oluşması hepatik lipogeneze neden olur, VLDL ve trigliserit sentezi ile sonuçlanır. Oluşan trioz-fosfat miktarı oksidatif kapasiteyi aştığında glikoneogenez, laktat üretimi ve glikojen sentezi olur.
Fruktoz ve glikozun katıldığı diğer bir metabolik yolak heksoz monofosfat yolağıdır. HMP yolağı nükleik asitlerin yapısında bulunan ribozların üretildiği transketolaz enzimi ile düzenlenen nonoksidatif basamaklardan ve reaktif oksijen radikallerinin indirgenmesinde glutatyon ile birlikte çalışan, yağ asidi ve kolesterol sentezinde indirgeyici olarak görev alan NADPH (nikotinamid adenin dinükleotid fosfat) üretiminin gerçekleştiği oksidatif basamaklardan oluşmaktadır. Fruktoz glikozdan farklı olarak bu yolakta daha çok nükleik asit sentezi basamaklarında kullanılır (Şekil 4) [6, 138].
Şekil 4: Fruktoz ve glikozun hücre içi metabolizması [4]
hücre içi inorganik fosfat (Pi) azalması eşlik eder. İnorganik fosfattaki azalma karaciğerde ADP+Pi‘den ATP oluşumunu sınırlar, ATP’nin azalması, AMP ve ürik asitin artmasına neden olur [139]. Fruktozun glikolitik ürünü olan gliseraldehitten aldehit dehidrogenaz, laktat dehidrogenaz ve dekarboksilaz aktivitesi ile DNA çapraz bağlarına neden olan ve mutajen özellikte olan glikoaldehit ve CO2 oluşur. Glikolaldehitin süperoksit radikaller ile okside olması sonucu mitokondriyal solunumu baskılayan ve hücre hasarına yol açan glyoxal oluşabilmektedir [140].
2.6. FRUKTOZUN PANKREAS KANSERİ VE PANKREATİK İNFLAMASYON İLE İLİŞKİSİ
Fruktoz, normal hücrelerde serbest oksijen radikallerinde artış ve toksik metabolitlerin oluşumu arttırabilir. Reaktif oksijen radikallerinin (ROS) hücre içinde artması DNA ve hücre hasarına neden olan oksidatif strese katkıda bulunmaktadır. Fizyolojik pH’da maillard reaksiyonu ile fruktozilasyon glikozilasyondan yedi kat daha hızlı gerçekleşir ve 100 kat daha fazla ROS meydana gelir. Fruktozun metabolizması sonucu oluşan glikolaldehit DNA çapraz bağları oluşumuna neden olur ve mutajendir. Ayrıca süperoksit radikalleri tarafından okside edilmesiyle oluşabilen glyoxal, mitokondriyal solunumu baskılayarak hücre hasarına neden olur. Fruktoz, antioksidan enzimler olan akonitaz ve süperoksit dimutaz aktivitesinin azalması aracılığı ile de oksidatif stresi arttırarak mitokondriyal hasara neden olur. Ayrıca fruktozun NADPH’ın bol miktarda kullanıldığı de novo lipogenezi arttırması hücrenin antioksidatif kapasitesinde azalma ile sonuçlanır [140-143].
Fruktozdan zengin beslenen ratlarda karaciğerde inflamasyon artmaktadır ancak pankreatik inflamasyon ile ilişkisi tam olarak aydınlatılmamıştır. Hepatik inflamasyon ile ilgili yapılan çalışmalarda früktozdan zengin beslenen ratların karaciğerinde tümör nekroz faktör alfa (TNFα) ve nükleer faktör kappa B (NFκB)’nın ve başka diğer proinflamatuar sitokinlerin arttığı saptanmıştır. Geçtiğimiz yıllarda yapılan bir çalışmada sıçanlara sükrozlu diyet uygulandığında pankreas dokusunda inflamasyon odakları ile hyalinizasyon görülmüş ve makrofaj artışı tespit edilmiştir. Aynı çalışmada
fruktozun karaciğer ve duodenumda, fruktozun hücre içine alımında ve metabolize edilmesinde iki önemli molekül olan fruktokinaz ve GLUT5 ekpresyonunu indüklediği gözlenmiştir [5, 144-147].
Vücutta pek çok kanser tipinin glikozla beslendiği ve insüline ihtiyaç duymadan glikozu alıp kullanılabildiği bilinmektedir [148]. Kanser hücrelerinin proliferasyon için hem glikoz hem de fruktozu kullanabildiği son zamanlarda bildirilmeye başlanmıştır [4, 143].
Fruktoz, pankreas kanser hücrelerinde nonoksidatif pentoz fosfat yolağındaki transketolaz enzimlerini indüklemektedir. Bu da fruktozun enerji kaynağı olmakla kalmayıp daha çok pentoz fosfat yolağında kullanıldığını ve proliferasyona geçen hücrelere bol miktarda DNA ve RNA sentezleme kapasitesi kazandıracağını düşündürmektedir. Pankreas kanseri hücre hattında fruktoz ve glikozun etkileri kıyaslanmış, transketolaz tarafından fruktozun, glikozdan 2.5 kat daha fazla metabolize edildiği, TKT aktivitesinin ise 2.8 arttığı, fruktozun nükleik asit sentezini daha fazla arttırdığının göstergesi olarak ürik asit sentezinin 1.4 kat fazla olduğu görülmüştür [149]. Bununla uyumlu olarak diyetteki karbonhidrat miktarı ve fruktoz miktarının pankreas kanseri ile ilişkisini inceleyen bir meta-analizde diğer karbonhidratların ilişkisi saptanmamış ancak fruktozun artmış pankreas kanseri riski ile ilşkili olduğu saptanmıştır [80]. Yapılan başka bir prospektif kohort çalışmada glisemik yükü ve glisemik indeksi yüksek gıdalarla beslenme ile pankreas kanseri arasında ilişki saptanmamış ancak serbest glikoz ve serbest fruktozdan zengin diyetin pankreas kanseri riskini arttırdığı saptanmıştır [150].
2.7. KRAS, ERK2, NFKB1 ve Pankreas Kanseri
K-Ras ve ERK2 (Extracellular signal-Regulated Kinase veya diğer adıyla MAPK, Mitojen-activated Protein Kinase), nukleusta hedef genlerin aktiflenmesi ile profliresyonun uyarılmasını sağlayan Ras/Raf/MEK/MAPK hücre içi sinyal yolağında aktivite gösteren proteinlerdir [151]. Pankreas kanseri patogenezinin erken aşamalarında K-Ras aktivasyonunun başrolde olduğu bilinmektedir. Sinyal yolağının başlangıcında yer alan Ras’ın aktivasyonu sonucu yolağın diğer elemenlarının -dolayısı ile MAPK’ın- da
NFKB1’nin kodladığı bir transkripsiyon faktörü olan Nükleer Faktör B (NF-B veya NFKB), inflamasyon, proliferasyon ve diferansiasyon, immun yanıt ve kanser patogenezinde kritik öneme sahiptir. Hücre çoğalmasının konstitutif bir parçası olmakla birlikte apoptozun engellenmesi, anjiyogenez, invazyon ve metastaz rol aldığı diğer onkojenik süreçlerdir [152]. Tümörlerin çoğunluğunda karsinogenez yolaklarının temel bir elemanı olan NFKB’nin ekspresyonu artmaktadır. Karsinogenezdeki rolüne ek olarak, NFKB’nın pankreas kanserinde metastaz ve kemorezistans ile ilişkili olduğu gösterilmiştir [153-156].
3. GEREÇ VE YÖNTEM
3.1. Hücre Kültürü
Hücre ve doku kültürü; çeşitli enzimlerin ve hormonların üretimi, DNA ve RNA replikasyonunun araştırılması, enerji metabolizmasının araştırılması, protein sentezi, çeşitli ilaçların hücre döngüsünde etkisi, sinyal iletim mekanizması, hücrenin beslenme özellikleri, enfeksiyon, viral ve kimyasal transformasyon, özel ürünlerin sentezletilip salgılatılması, sitogenetik analiz gibi çeşitli amaçlarla yapılmaktadır.
Sağladığı avantajlar nedeniyle in vitro kanser araştırmalarında sıklıkla tümör hücrelerinden elde edilen hücre hatları kullanılmaktadır. Uygun olmayan koşullarda korudukları limitsiz üreme yetenekleri, kolay uygulanabilir olmaları, ticari olarak elde edilip etik kurul belgesi gerektirmemeleri, yüksek derecede homojenite göstermeleri ve donmuş stoklardan kolaylıkla kullanılır hale gelebilmeleri gibi avantajları hücre hatlarını kanser çalışmalarında önemli bir model haline getirmektedir. 3.2. Hücre Hatlarının Bakımı ve Kültür Kaplarına Ekimi
Çalışmamızda kullanılan insan pankreas kanseri hücre hattı (PANC-1) ATCC firmasından (CRL-1469™) ticari olarak satın alınmıştır. Epitelioid karsinomalı 56 yaşındaki erkek bir hastanın pankreatik kanal dokusundan elde edilen bu PANC-1 hücre hattı adherent olup, hücrelerin iki katına çıkma süresi 52 saattir (Şekil 4).
![Tablo 1: TIGAR-O sınıflandırması [44]](https://thumb-eu.123doks.com/thumbv2/9libnet/3026988.2322/25.892.168.791.343.1093/tablo-tigar-o-siniflandirmasi.webp)
![Şekil 1: American Cancer Society verilerine göre kadınlarda pankreas kanseri ve diğer kanser tiplerinin mortalite oranlarının yıllar içindeki değişimi [55]](https://thumb-eu.123doks.com/thumbv2/9libnet/3026988.2322/29.892.183.827.184.503/american-verilerine-kadinlarda-tiplerinin-mortalite-oranlarinin-icindeki-degisimi.webp)
![Şekil 3: Pankreas adenokarsinom karsinogenezi [116]](https://thumb-eu.123doks.com/thumbv2/9libnet/3026988.2322/36.892.186.843.112.693/sekil-pankreas-adenokarsinom-karsinogenezi.webp)

![Şekil 4: Fruktoz ve glikozun hücre içi metabolizması [4]](https://thumb-eu.123doks.com/thumbv2/9libnet/3026988.2322/42.892.174.848.496.1030/sekil-fruktoz-glikozun-hucre-ici-metabolizmasi.webp)