T.C.
SELÇUK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
NANOPARÇAÇIK TEMELLİ HİDROJEN ÜRETİMİ
Emre ASLAN YÜKSEK LİSANS TEZİ
Kimya Anabilim Dalı
Aralık-2014 KONYA Her Hakkı Saklıdır
TEZ BİLDİRİMİ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Emre ASLAN Tarih: 29/12/2014
iv ÖZET
YÜKSEK LİSANS TEZİ
NANOPARÇACIK TEMELLİ HİDROJEN ÜRETİMİ
Emre ASLAN
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
Danışman: Prof. Dr. Mustafa ERSÖZ İkinci Danışman: Doç. Dr. İmren HATAY PATIR
2014, 115 Sayfa Jüri
Danışman: Prof. Dr. Mustafa ERSÖZ Prof Dr. Şefik SÜZER
Doç. Dr. İlkay Hilal GÜBBÜK
21. yüzyılın en büyük bilimsel ve teknolojik çabalarından birisi de şüphesiz yenilenebilir enerjilerin üretimi ve depolanması için yeni yollar geliştirmektir. Hidrojen gazı; yenilenebilir olması, yanması sonucunda sera etkisi oluşturabilecek CO2 gazı açığa çıkarmaması ve yakıt hücrelerinde
kolaylıkla elektriğe dönüştürülebilmesinden dolayı geleceğin enerji taşıyıcısı olarak görülmektedir. Hidrojen çeşitli kaynaklardan üretilebilmektedir (fosil yakıtları, su, biyokütle vb..). Günümüzde, hidrojen başlıca fosil yakıtlarından üretilmekte, buda çevreye sera gazı ve diğer iklim değiştirici emisyonların yayılmasına neden olmaktadır. Diğer yandan fosil yakıtlarının tükenebileceği de göz önüne alındığında, hidrojenin güneş ışığı gibi doğal enerjiler kullanılarak sudan üretilmesi en çok gelecek vaat eden proseslerden birisidir. Güneş enerjisinden hidrojen üretimi için birkaç farklı yol vardır. Bunlardan birisi de fotokatalitik olarak suyun ayrışması yani yapay fotosentezdir. Doğada, fotosentez biyolojik membranlarda gerçekleşmektedir. Birbiriyle karışmayan iki elektrolit çözelti arasındaki arayüzeylerin biyomembranlar ile benzerliği oldukça ilgi çekmektedir. Bu nedenlerden dolayı bu çalışmada katı/sıvı ve sıvı/sıvı arayüzeyleri fotokatalitik ve katalitik hidrojen üretimi için model sistem olarak kullanılmıştır.
Katı/sıvı arayüzeylerinde fotokatalitik hidrojen üretimi için oleik asit kaplanmış CdS, CdSe ve CdSxSe1-x alaşım nanokristalleri çift faz yaklaşımı ile sentezlenmiştir. Bu nanokristaller UV-Vis
spektroskopisi, Flüoresans spektroskopisi, X-ışınları kırınımı (XRD), enerji ayırımlı X ışınları spektroskopisi (EDX), küçük açı X ışınları dağılımı (SAXS) ve döngüsel voltametri (CV) metotları ile karakterize edilmiştir. Sentezlenen ve karakterizasyonu yapılan bu nanokristaller hidrojen üretim reaksiyonu için Na2S/Na2SO3 elektron verici çözeltisi ortamında fotokatalizör olarak kullanılmıştır. Bu
nanokristallerin hidrojen üretiminde görünür ışık altında 24 saatten daha uzun bir süre kararlılık gösterdiği ve CdS075Se0,25 alaşım nanokristalinin hidrojen üretim aktivitesinin CdS ve CdSe
nanokristallerinden daha yüksek olduğu gözlenmiştir.
Sıvı/sıvı arayüzeylerde katalitik hidrojen üretimi için, su/1,2-dikloroetan arayüzeyi model sistem olarak seçilmiştir. Burada DCE fazında elektron verici olarak dekametilferrosenin (DMFc) ve su fazında asidik protonların kullanılmasıyla iki fazlı sistemlerde WS2, WC mikroparçacıklarının hidrojen üretim
reaksiyonunu katalizlediği rapor edilmiştir. Diğer bir çalışmada ise, su fazında CuCl2 tuzunun ve DCE
fazında DMFc elektron vericisinin kullanılmasıyla Cu nanoparçacıkları su/DCE arayüzeyinde elde edilmiş ve bu nanoparçacıklar hidrojen üretim reaksiyonu için çok iyi bir katalitik aktivite gösterdiği gözlenmiştir. Su/DCE arayüzeyinde elektrobirikme ile oluşan Cu nanoparçacıkları XRD, geçirimli elektron mikroskobu (TEM), seçilmiş alan elektron kırınımı (SAED), taramalı elektron mikroskobu (SEM), EDX, parçacık boyut analizörü ve CV ile karakterize edilmiştir.
Anahtar Kelimeler: alaşım nanokristaller, bakır nanoparçacık, elektrokimya, elektron transferi, fotokatalizör, fotokararlılık, hidrojen üretimi, sıvı/sıvı arayüzeyler
v ABSTRACT
MS THESIS
HYDROGEN PRODUCTION BASED ON NANOPARTICLES Emre ASLAN
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN CHEMISTRY
Advisor: Prof. Dr. Mustafa ERSÖZ
Second Advisor: Assoc. Prof. Dr. İmren HATAY PATIR
2014, 115 Pages Jury
Advisor Prof. Dr. Mustafa ERSÖZ Prof. Dr. Şefik SÜZER
Assoc. Prof. Dr. İlkay Hilal GÜBBÜK
One of the greatest scientific and technological endeavours of 21st century is undoubtedly to develop new routes for the production and storage of renewable energies. Hydrogen gas is seen as a future energy carrier by virtue of the fact that it is renewable, does not evolve the "greenhouse gas" CO2
in combustion and is easily converted to electricity by fuel cells. Hydrogen can be produced from a variety of resources. At present, hydrogen is mainly produced from fossil fuels which release greenhouse gases and other climate-changing emissions. On the other hand, considering the depletion of fossil fuels hydrogen produced from water using natural energies such as sunlight is one of the most promising processes. There are several ways for the solar hydrogen production. One of these is photocatalytic water splitting (artificial photosynthesis). In nature, photosynthesis occurs in biological membranes. The analogy with biomembranes of an interface between two immiscible electrolyte solutions (ITIES) has attracted a great deal of attention. For this reason, in this study, solid/liquid and liquid/liquid interfaces were used as a model system for the photocatalytic and catalytic hydrogen production.
Oleic acid coated CdS, CdSe and CdSxSe1-x nanocrystals were synthesized by two-phase
approach for photocatalytic hydrogen production at solid/liquid interfaces. These nanocrystals were characterized by UV-Vis spectroscopy, fluorescence spectroscopy, X-ray diffraction (XRD), energy dispersive X-ray spectroscopy (EDX), small angle X-ray diffraction (SAXS) and cyclic voltammetry methods. These nanocrystals were used as the photocatalyst for hydrogen production reaction in the Na2S
/ Na2SO3 electron donor solution medium. These nanocrystals exhibit a good stability in the hydrogen
production more than 24 hour under visible light irradiation and hydrogen production activity of alloyed CdS075Se0,25 nanocrystal is higher than the CdS and CdSe nanocrystals.
The water/1,2-dichloroethane interface was selected as a model system for the catalytic hydrogen production at liquid/liquid interfaces. We report that WS2, WC microparticles and Cu nanoparticles
catalyzes the HER in biphasic systems where the aqueous phase is acidic and the organic phase is 1,2-dichloroethane (DCE) containing DMFc as an electron donor. In another study, Cu nanoparticles were obtained at the water/DCE interface by using CuCl2 salt in the water phase and the electron donor DMFc
in DCE phase and these nanoparticles display excellent catalytic activity for the hydrogen evolution reaction. The electrodeposited Cu nanoparticles at water/DCE interface were characterized by XRD, transmission electron microscopy (TEM), selected area electron diffraction (SAED), scanning electron microscopy (SEM), EDX, CV and particle size analyzer.
Keywords: alloy nanocrystals, copper nanoparticle, electrochemistry, electron transfer, hydrogen production, liquid/liquid interfaces, photocatalyst, photostability
vi ÖNSÖZ
Bu çalışma, Selçuk Üniversitesi Fen Fakültesi Kimya Bölümü Öğretim Üyeleri Prof. Dr. Mustafa ERSÖZ ve Doç. Dr. İmren HATAY PATIR danışmanlıklarında hazırlanmış ve Selçuk Üniversitesi Fen Bilimleri Enstitüsü’ne Yüksek Lisans Tezi olarak sunulmuştur.
Öncelikle lisansüstü çalışmalarım süresince bilimsel katkıları ve yardımları ile beni her zaman destekleyen tez danışmanım Prof. Dr. Mustafa ERSÖZ’e sonsuz saygı ve teşekkürlerimi sunarım. Tez çalışmamın planlanmasında, yürütülmesinde ve değerlendirilmesinde maddi ve manevi çok büyük yardımlarını gördüğüm, engin bilgi ve tecrübeleriyle bana yol gösteren, kendimi geliştirmemde en büyük pay sahibi olan ikinci danışmanım sayın Doç. Dr. İmren HATAY PATIR hocama teşekkürü bir borç bilirim.
Tez çalışmamda kullanmış olduğum nanokristallerin sentezi ve karakterizasyonu konusunda tecrübelerinden yararlandığım Selçuk Üniversitesi Kimya Mühendisiliği Bölümü Öğretim Üyesi Doç. Dr. Mahmut KUŞ başta olmak üzere, Yrd. Doç. Dr. Faruk ÖZEL ve yüksek lisans öğrencisi Osman Okan BİRİNCİ’ye teşekkür ederim.
Tez çalışmam boyunca manevi desteğini ve yardımlarını esirgemeyen Uzman İlker AKIN’a çok teşekkür ederim.
Bu çalışmanın gerçekleştirilmesinde maddi destek sağlayan Selçuk Üniversitesi Bilimsel Araştırmalar Koordinatörlüğü’ne (BAP-14201001 nolu proje) ve TÜBİTAK’a (211T185 nolu proje ve 2210-C Öncelikli Alanlara Yönelik Yurt Içi Yüksek Lisans Burs Programı) katkılarından dolayı teşekkür ederim.
Beni bugünlere getiren, eğitim hayatım boyunca ve hayatımın her aşamasında benden bir an bile destek ve teşviklerini esirgemeyen, çok sevdiğim aileme sonsuz teşekkürlerimi sunar, bu çalışmamı onlara ithaf ederim.
Emre ASLAN KONYA-2014
vii İÇİNDEKİLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi İÇİNDEKİLER ... vii SİMGELER VE KISALTMALAR ... ix 1. GİRİŞ ... 1
1.1. Fotokatalitik Hidrojen Üretimi ... 3
1.1.1. Fotokatalizörler ... 3
1.1.2. Kuantum Nokta Yapılı Nanokristaller ... 4
1.1.3. Fotokatalitik Hidrojen Üretimi Mekanizması ... 7
1.1.4. Fotokatalitik Olarak Suyun Ayrışma Süreci ... 9
1.2. Sıvı/sıvı Arayüzeylerde Hidrojen Üretimi ... 11
1.2.1. Sıvı/sıvı Arayüzeylerde Elektrokimyaya Giriş ... 11
1.2.2. ITIES’in Termodinamiği ... 15
1.2.3. ITIES’te Nernst Eşitliği ... 17
1.2.4. ITIES’in Polarizasyonu ... 19
1.2.5. ITIES’te Yük Transferini Çalışmak için Kullanılan Metotlar ... 25
1.2.6. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 32
2. KAYNAK ARAŞTIRMASI ... 33
2.1. Fotokatalitik Hidrojen Üretimi ... 33
2.1. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 38
3. MATERYAL VE YÖNTEM ... 42 3.1. Kullanılan Kimyasallar ... 42 3.2. Kullanılan Cihazlar ... 42 3.3. Analiz Yöntemleri ... 43 3.3.1. UV-Vis Spektroskopisi ... 43 3.3.2. Floresans Spektroskopisi ... 43 3.3.3. X Işınları Saçılımı (XRD) ... 43
3.3.4. Taramalı Elektron Mikroskobu (SEM/EDX) ... 43
3.3.5. Geçirimli Elektron Mikroskobu (TEM) ... 43
3.3.6. Dönüşümlü Voltametri Yöntemi ... 43
3.3.7. Gaz Kromatografisi Yöntemi ... 44
3.4. Nanokristallerin Sentezlenmesi ... 44
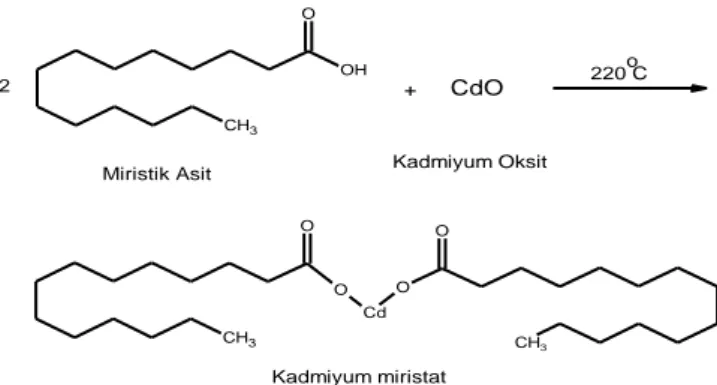
3.4.1. Kadmiyum Miristatın Sentezlenmesi ... 44
3.4.2. NaHSe ’ün Sentezlenmesi ... 44
3.4.3. CdS Nanokristallerinin Sentezlenmesi ... 45
3.4.4. CdSe Nanokristalinin Sentezlenmesi ... 45
viii
3.5. Hidrojen Üretimi ... 46
3.5.1. Suda Fotokatalitik Hidrojen Üretimi ... 46
3.5.2. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 48
4. ARAŞTIRMA SONUÇLARI VE TARTIŞMA ... 54
4.1. Fotokatalitik Hidrojen Üretimi ... 54
4.1.1. CdS, CdSe ve CdSxSe1-x Alaşım Nanokristallerin Yapısal Analizleri ... 54
4.1.2. CdS, CdSe ve CdSxSe1-x Alaşım Nanokristalleri Kullanılarak Hidrojen Üretimi ... 60
4.1.3. Fotokatalitik Hidrojen Üretiminin Mekanizması ... 65
4.2. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 66
4.2.1. CdS, CdSe ve CdSxSe1-x Alaşım Nanokristalleri Tarafından Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 67
4.2.2. WS2 ve WC Katalizörlüğünde Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi .. 68
4.2.3. Bakır Nanoparçacıkları Katalizörlüğünde Sıvı/Sıvı Arayüzeylerde Hidrojen Üretimi ... 80
4.2.4. Sıvı/Sıvı Arayüzeylerde Hidrojen Üretiminin Mekanizması ... 89
5. SONUÇLAR VE ÖNERİLER ... 90
5.1. Sonuçlar ... 90
5.2. Öneriler ... 93
KAYNAKLAR ... 94
ix
SİMGELER VE KISALTMALAR
Ag2SO4 : Gümüş sülfat
AgCl : Gümüş klorür
BACl : Bis(trifenilfosforanilidin)amonyum klorür
BATB : Bis(trifenilfosforanilidin)amonyum tetrakis(pentaflorofenil)-borat CB : İletkenlik bandı (conduction band)
CdMA : Kadmiyum miritat
CdO : Kadmiyum oksit
CdS : Kadmiyum sülfür
CdSe : Kadmiyum selenür
CdSxSe1-x : Kadmiyum sülfür selenür alaşımı CdTe : Kadmiyuum tellür
CE : Karşıt elektrot
CO : Karbonmonoksit
CO2 : Karbondioksit
CV : Döngüsel voltametri (cyclic voltammetry) DCE : 1,2-dikloroetan DMFc : Dekametilferrosen e- : Elektron eV : Elektronvolt GC : Gaz kromatografisi h+ : Boşluk (hole) H+ : Proton H2 : Hidrojen gazı H2SO4 : Sülfirik asit HCl : Hidroklorik asit hν : Işık (foton)
ITIES : Birbirine karışmayan iki elektrolit çözelti arasındaki arayüzü simgeleyen (an interface between two immiscible electrolyte solutions)
LiTB : Lityum tetrakis(pentaflorofenil)-borat MPA : 3-merkaptopropiyonik asit
Na2S : Sodyum sülfür Na2SO3 : Sodyum sülfit
NaBH4 : Sodyum bor hidrür NaHSe : Sodyum hidrojen selenür
NB : Nitrobenzen
O2 : Oksijen gazı
OA : Oleik asit
oC : Sıcaklık ölçüsü birimi
PCET : Protonla birleştirilmiş elektron transferi QD : Kuantum nokta yapılar (quantum dots)
RE : Referans elektrot
SAED : Seçilmiş alan elektron kırınımı (Selected area electron diffraction) SAXS : Küçük açı x ışınları spektroskopisi
SEM : Taramalı elektron mikroskopu (Transmition electron microscopy) TEM : Geçirimli elektron mikroskopu (Scanning electron microscopy) TiO2 : Titanyumdioksit
x TOPO : Trioktilfosfinoksit
UV : Ultraviyole
V : Potansiyel fark (volt)
VB : Değerlik bandı (valance band)
WC : Tungsten karbit
WS2 : Tungsten (IV) sülfür XRD : X-ray difraktometresi YPT : Yardımlı proton transferi
1. GİRİŞ
Enerji, insanlığın varoluşundan beri toplumların gelişmesi, sanayileşme ve üretim gereksinimlerini karşılamada ihtiyaç duyduğu en önemli olgudur. Ülkelerin ve toplumların küresel anlamda rekabet sağlamalarında ve rekabetçi piyasa koşullarında varlıklarını sürdürebilmeleri için enerji oldukça önemlidir. Enerji bu yönleriyle, toplum ve doğa arasındaki etkileşimde vazgeçilmez bir unsurdur. Toplumsal yaşamın merkezinde yer alan enerjiye yönelik ihtiyacın belirlenmesi, karşılanması, iletilmesi kısacası enerjide planlama bir zorunluluktur. İşte bu zorunluluğun sonucu olarak da tüm ülkeler, özellikle gelişmiş ülkeler, yaşam standartlarını arttırmak için enerji üretimlerini arttırmaya çalışmaktadır. 1950’den beri dünya nüfusu 2,5 kat artarken, enerji talebi 7 kat artmıştır. Enerji ihtiyacı günümüze kadar farklı kaynaklardan karşılanmıştır. Enerji kaynakları genellikle yenilenebilir ve yenilenemez enerji kaynakları olmak üzere ikiye ayrılır. Yenilenemeyen enerji kaynakları, çok uzun zaman önce depolanmış kaynaklardır. Bu kaynakların içine milyonlarca yılda oluşan fosil yakıtlar ile dünyanın oluşumuyla yaşıt uranyum ve toryum elementleri girer.
Fosil yakıtlar, hidrokarbon içeren kömür, petrol ve doğal gaz gibi doğal enerji kaynaklarıdır. Fosil yakıtlar dünya enerji kaynaklarından en yaygın kullanılanıdır. Enerji ihtiyacımızın büyük çoğunluğu fosil yakıtlardan sağlanmakta ve bu nedenle bu kaynaklar hızla tükenmektedir. Bilindiği gibi kömür, petrol, doğal gaz gibi yakıtlar kullanıldığında, çevreye başlıca CO2 ve CO olmak üzere çeşitli gazlarla birlikte; bazı toz parçacıkları yayılmaktadır. Hava kirliliğinin çevre üzerindeki etkileri küresel, bölgesel ve yerel ölçekte ortaya çıkmaktadır. Küresel ölçekte, başta karbondioksit olmak üzere, sera gazlarının yol açtığı küresel ısınma ve ozon tabakasının delinmesi sayılabilir. Bölgesel ölçekte asit yağmurları, ormanların tahribi göllerin asitlik değerinin artması sonucunda ekolojik dengenin bozulması en önemli belirtilerdir. Bu nedenle giderek azalan fosil kaynaklı yakıtlar ve yarattığı çevresel sorunlar, alternatif kaynakların araştırılmasını gündeme getirmiştir. Bu alternatif yakıt, doğanın kendi döngüsü içerisinde bir sonraki gün aynen mevcut olabilen yenilenebilir enerji kaynakları olmalıdır. Yenilenebilir enerji, doğada var olan ve sürekli kendini yenileyen enerji kaynağı demektir. Yenilenebilir enerji kaynakları olarak başlıca güneş, rüzgâr, biyokütle, hidroelektrik, jeotermal ve hidrojen enerjisi sayılabilir. 21. yüzyılın en büyük bilimsel ve teknolojik çabalarından birisi de hiç şüphesiz yenilenebilir enerjilerin
üretimi ve depolanması için yeni yollar geliştirmektir. Yenilenebilir enerji kaynaklarının kullanılmasıyla:
• İthal edilen yakıtlara olan bağımlılık azalacak, • Yerli öz kaynaklara öncelik verilmesi sağlanacak, • Yerli üretim sonucu istihdam artacak,
• Sürdürülebilir ekonomik büyüme ve gelişmeye imkân sağlanacak, • Enerji arz güvenliği artacak,
• Üretimde ve tüketimde sağlanan güven ortamı ile istikrar artacak, • Sosyal ekonomik hayatta refah, istikrar da artacaktır.
Yakıt olarak bütün bu özellikleri taşıyan hidrojen, yenilenebilir enerji kaynakları arasında oldukça önemli bir yere sahiptir. Hidrojenin yakıt olarak kullanımının yanı sıra yakıt üretim metotları için taşıyıcı ve kaynak materyal olarak kullanımı da söz konusudur. Gelecekte hidrojen günümüzde olduğundan çok daha önemli bir role sahip olacaktır. Bu nedenle hidrojen üretimi önemli ve desteklenen araştırmalar arasında değerlendirilmektedir. Günümüzde çok çeşitli hidrojen üretim metotları mevcut olup; daha yüksek verime, daha düşük maliyete, daha çevreci yöntemlerin kullanılmasıyla hidrojen üretimi için araştırmalar devam etmektedir.
Hidrojen Enerjisi
Normal sıcaklık ve basınç altında kokusuz ve renksiz olan hidrojen gazı (H2) oksijenle birleştiğinde yaşam için en önemli madde olan su elde edilmektedir. Hidrojen çok hafif bir gaz olup, yoğunluğu havanın 1/14’ü, doğal gazın ise 1/9’u kadardır. Atmosfer basıncında –253 oC’ye soğutulduğunda sıvı hale gelen hidrojenin yoğunluğu ise benzinin 1/10’u kadar olmaktadır (Aydemir, 1998). Hidrojen gazı; yenilenebilir olması, yanması sonucunda sera etkisi oluşturabilecek CO2 gazı açığa çıkarmaması ve yakıt hücrelerinde kolaylıkla elektriğe dönüştürülebilmesi nedeniyle oldukça verimli bir yakıttır. Doğada bileşikler halinde bol miktarda bulunan hidrojen, serbest olarak bulunmadığından doğal bir enerji kaynağı değildir ve birincil enerji kaynakları kullanılarak üretilir bu nedenle hidrojen; ‘ikincil bir enerji kaynağı’ olarak bilinmektedir. Birincil enerji kaynaklarının, fiziksel durum değişimi içeren biçimde dönüştürülmesi ile elde edilen ikincil enerji kaynaklarına, "enerji taşıyıcısı" denir. Elektrik 20. yüzyıla damgasını vuran bir enerji taşıyıcısıdır. Hidrojenin ise 21. yüzyıla damgasını vuracak bir diğer enerji taşıyıcısı olacağı düşünülmektedir.
Hidrojen yerel olarak üretimi mümkün, kolayca ve güvenli olarak her yere taşınabilen, taşınması sırasında az enerji kaybı olan, ulaşım araçlarından ısınmaya, sanayiden mutfaklarımıza kadar her alanda yararlanacağımız bir enerjidir. Hidrojen, kömür, doğalgaz gibi fosil kaynakların yanı sıra sudan ve biyokütleden de elde edilmektedir. Günümüzde, hidrojen genellikle doğalgaz ve diğer hafif hidrokarbonlar gibi fosil yakıtlar kullanılarak üretilebilmekte, bu da çevreye sera gazı yayılmasına neden olmaktadır. Diğer yandan fosil yakıtların tükenebileceği ve fiyatlarının sürekli yükselebileceği de göz önüne alındığında, hidrojenin güneş ışığı gibi doğal enerjiler kullanılarak sudan üretilmesi en çok gelecek vaat eden işlemlerden birisidir. Güneş enerjisi ve su kullanılarak elde edilebilecek olan hidrojen, ucuz, çevre dostu ve sonsuza kadar temiz enerji sağlayabilecek bir yakıt olarak kullanılabilecektir.
Hidrojen gazı yenilenebilir enerji kaynaklarından üretilebilirse tamamen temiz bir enerji kaynağı olacaktır. Bu yüzden, sudan güneş ışığı vasıtasıyla hidrojen üretimi teşvik edilmelidir. Güneş enerjisinden hidrojen üretimi için birkaç farklı yol vardır. Bunlardan birisi de fotokatalitik olarak suyun ayrışması yani yapay fotosentezdir. Doğada, fotosentez biyolojik membranlarda gerçekleşmektedir. Birbiriyle karışmayan iki elektrolit çözelti arasındaki arayüzeylerin biyomembranlar ile benzerliği oldukça ilgi çekmektedir. Bu nedenlerden dolayı bu çalışmada katı/sıvı (fotokatalitik hidrojen üretimi; fotokatalizör/elektron verici çözelti) ve sıvı/sıvı arayüzeylerin (katalitik hidrojen üretimi; su/1,2-Dikloretan (DCE)) hidrojen üretimi için model sistem olarak kullanılması amaçlanmıştır.
1.1. Fotokatalitik Hidrojen Üretimi
1.1.1. Fotokatalizörler
Katalizör, tepkime hızını arttırarak tepkimenin kısa zamanda dengeye gelmesini sağlayan ve tepkime sonucunda kendisi değişime uğramayan maddedir. Fotokatalizör ise ışığın etkisiyle kimyasal reaksiyonları etkinleştiren veya reaksiyon hızını artıran yarı iletken maddelere denilir. Fotokatalizör ışığı absorbe ederek daha yüksek enerjili bir hale gelir ve bu enerjiyi reaktif maddelere transfer ederek kimyasal tepkimeyi başlatır. Yarıiletkenler (ZnO, TiO2, Fe2O3, ZnS, CdS, CdSe vb.), elektronik yapılarına bağlı olarak, fotokatalitik aktivite uygulamalarında hassaslaştırıcı olarak davranabilirler (Hoffmann ve ark., 1995).
İdeal bir fotokatalizörün şu özellikleri taşıması gereklidir: Ucuz olmalı,
Görünür ışık veya yakın ultraviyole ışınları ile aktif hale geçebilmeli (ekonomik anlamda önemli),
Kimyasallardan, dış etkilerden etkilenmemeli, Kolay sentezlenebilmeli ve kolay elde edilebilmeli, Yüksek fotoaktiviteye sahip olmalı,
Toksik olmamalı,
Oldukça geniş yüzey alanı, saf ve nano boyutta kristal yapısına sahip olmalı.
Bu çalışmada fotokatalizör olarak kuantum nokta yapılı nanokristallerin kullanılması amaçlanmaktadır.
1.1.2. Kuantum Nokta Yapılı Nanokristaller
Kuantum nokta yapılı nanokristaller (Quantum Dot) adını ilk kez şu anda Yale Üniversitesi’nde uygulamalı fizik profesörü olan Mark Reed’den almış olmakla beraber, ilk kez Bell Laboratuvarı’nda çalışırken Louis E.Brus tarafından keşfedilmiştir (Brus, 1984). Kuantum nanokristalleri yarı iletkenler olarak bilinen malzeme sınıfının çok özel ve de benzersiz bir alt sınıfını oluştururlar. Kuantum nokta yapılı nanokristaller, II–VI (örneğin; InAs, InSb, GaAs) veya III–V. Grup (örneğin; CdS, CdSe, ZnO) elementlerinden oluşan ve kristal çapları 1-10 nm arasında olan optik özellikleri kristal çapına bağlı olarak değişen nanoparçacıklardır (Jamieson ve ark., 2007). Yarıiletken kuantum nanokristallerin en çarpıcı özellikleri boyutlarının kontrolüyle optik özelliklerinin değişebilmesidir. Yarı iletken kuantum nokta yapılı nanokristaller, parçacık büyüklüğüne bağlı olarak gösterdikleri farklı optik ve enerjik özelliklerden dolayı nanobiyoteknoloji, nanoelektronikler, lazer sistemleri, optik devreler ve işaretleme gibi çok geniş uygulama alanlarına sahiptirler (Mansur, 2010).
Kuantum nanokristallerin boyutlarının deneysel olarak ayarlanabilmesi mümkündür. Bu sayede uygulamaya özgü optik özellikler taşıyan kuantum nanokristaller sentezlenebilir. Kuantum nanokristaller parçacık boyutuna bağlı olarak değişen, oldukça geniş absorpsiyon bandına sahiptirler (UV’den görünür bölgeye kadar). Geniş absorpsiyon, dar ve boyuta bağlı olarak ayarlanabilir emisyon
spektrumları (20-70 nm bant genişliği), yüksek fotokimyasal kararlılık, farklı fonksiyonel gruplar içeren ligandlar bağlanarak polaritenin ayarlanabilmesi, kuantum nanokristallerin güncel bir araştırma konusu olan önemli özelliklerindendir (Tülay Oymak, Doktora Tezi, Gazi Üniversitesi, Sağlık Bilimleri Enstitüsü, 2011).
İletkenler (metaller), yarıiletkenler ve yalıtkanlar olarak 3 gruba ayrılan inorganik katılarda yarıiletkenler dolu bir bant olan valans (değerlik) bandı ve boş olarak bilinen iletim bandına sahiptir (Murray ve ark., 1993).
Bir yarıiletkene ışık yollandığında değerlik bandındaki bir elektronu uyarır. Bu elektronun uyarılması için gereken enerji, enerji bant aralığı tarafından gösterilir. Yarıiletkenin enerji aralığından (Eg) daha büyük bir enerji yollandığında ise bir elektron değerlik bandından iletim bandına geçer ve bu geçiş boyunca değerlik bandına bir elektron yoksunluğu yani bir boşluk (hole) bırakır. Elektronun oluşan boşluk boyunca hareket ettiği düşünülür. Oluşan boşluğun ise pozitif yükü ve etkili kütlesi olan bir partikül olarak davrandığı varsayılır. Elektron-boşluk çiftinin birbirine elektriksel olarak bağlı olduğu bu yapı eksiton olarak adlandırılır. Uyarılmış elektron enerjisinin fazlasını iletim bandında kaybettiğinden değerlik bandına geri dönerken yaptığı ışıma elektron-boşluk çiftinin (eksiton) birleşimi sayesinde olur (Brus, 1984).
Elektron-boşluk çiftinin birbirine elektriksel olarak bağlı olduğu bu yapı eksiton olarak adlandırılır. Eksiton yapısı bir yarıiletken kuantum nokta yapılı kristalin enerji bandı aralığı için partikül boyutuna bağlı çalışmaların gelişiminde öncülük yapar. Bir eksiton, küçük boyutlu bir kristalde daha dar bir bölgede oluşacağı için eksitonu sınırlamak için daha fazla enerjiye ihtiyaç duyar ve böylece kuantum nokta yapılı nanokristalin enerji bant aralığı artar. Elektron-boşluk çiftinin enerji kaybından dolayı ışık daha yüksek enerjili olan daha kısa dalga boyunda oluşur. Böylece maviye kayma meydana gelir. Bu da gösterir ki kuantum nokta yapılı nanokristalin boyutu azaldıkça absorpsiyon ve emisyon maviye kayar. Yığın halindeki bir yarıiletken kristalin boyutu azaldığında yüzey alanı/hacim oranı artar ve yüzey yapısındaki bu değişiklik optik ve elektronik özellikleri güçlü bir şekilde etkiler. Kuantum nanokristallerin kristal çapları arttıkça floresans emisyonu kırmızı bölgeye kaymaktadır. Bu kayma değerlik bandı ile iletkenlik bandı arasında kalan ve bant boşluğu olarak adlandırılan aralığın daralması nedeni ile olmaktadır. Bu daralmanın nedeni parçacığın büyümesi ile daha fazla enerji bandının iç içe girmesidir. Ancak bu daralma belli bir parçacık büyüklüğüne kadar devam eder ve sonrasında parçacık büyüklüğüne bağlı olarak değişmez. Bu noktadan sonra enerji bantları artık tamamen iç içe girdiğinden bu noktadan sonra optik özellikte
bir değişme olmaz. Bir noktadan sonra boyutun yeterince azalmasıyla kristalin elektronik özellikleri yığın bir yapı gibi davranmayı keser. Bu davranış, uzaysal sınırlamalardan dolayı bir partikül içindeki elektronların davranışı olan kuantum sınırlaması etkisinin (Quantum Confinement Effect) bir sonucudur (Murray ve ark., 2000;).
Şekil 1.1. Bir UV lamba altında boyutları 2nm’den 8nm’ye değişen CdSe kuantum nanokristallerinin optik özelliklerinin değişimi (Dabbousi, et al. 1997)
Şekil 1.1'de görüldüğü gibi kuantum nokta yapılı nanokristaller mor ötesi ışınlar altında kuantum sınırlama etkisinden dolayı boyutlarına bağlı olarak farklı renkte ışıma yaparlar. Boyut büyüdükçe kırmızıya kayma olduğu gözlenir.
Ancak bant yapıları; yüzeydeki kusurlar ve gevşeyen bağlar sonucu gerçek kuantum nokta yapılı nanokristal sistemlerinde bu şekilde değildir. Yüzeydeki atom boşluklarından kaynaklı yüzey tuzak bölgeleri, kuantum nokta yapılı nanokristal bant aralığında yer alan elektronik enerji seviyelerinin görülmesine neden olur (Şekil 1.2).
Şekil 1.2. QD’lerin bant aralıkları içinde yer alan enerji durumlarını gösteren yüzey tuzak bölgeleri (Mansur, 2010)
Yüzeydeki tuzak yapıların fazlalığı, kuantum noktaları içeren aygıtların performansını; düşük floresans kuantum verimi, dar floresans aralığı ve yüklerin yeniden birleşmesi sırasında yanıp sönme gibi durumlarla azaltır. Kolloidal kuantum nokta yapıların bu tuzak durumunun yapısı ilk olarak 1997 yılında Efros ve Rosen
tarafından önerilmiştir. Corrillo-Corrion ve ark. 2009’da yayınladıkları kapsamlı çalışmada ise kuantum nokta yapılı nanokristallerin lüminesans ve fotoaktivasyonunu etkileyen parametreleri incelediklerinde yüzeydeki bu kusurlu yapıların emisyon sırasında ışımasız bir dönüşüme yol açarak kuantum verimini azalttığını bulmuşlardır ve yüzeyin kusurlu olmasından kaynaklı bu kararsızlığı minimize etmek veya ortadan kaldırmak için iki veya daha fazla yarıiletkenden oluşan heteroeklemli yapıların kullanıldığını açıklamışlardır (Esma Yenel, Yüksek Lisans Tezi, Selçuk Üniversitesi Fen Bilimleri Enstitüsü, 2012).
1.1.3. Fotokatalitik Hidrojen Üretimi Mekanizması
Fotokatalitik hidrojen üretimi, güneş enerjisinden hidrojen üretimi için verimli bir yöntem olarak kabul edilmekte olup, yenilenebilir kaynaklardan hidrojen üretimi ve hidrojen ekonomisine geçiş için büyük önem taşımaktadır. Hidrojen gazı; güneş ışığından yararlanılarak fotokatalizör varlığında suyun bileşenlerine ayrılması sonucu üretilir. Fotokatalizör olarak yarıiletken malzemeler kullanılmakta olup bu malzemelerin güneşten gelen fotonları absorplaması gerekmektedir. Suyun fotokatalitik olarak ayrışabilmesi için fotokatalizör olarak kullanılan maddenin gelen fotonu absorplanması gerekmektedir. Absorpsiyon olayının gerçekleşebilmesi için fotonun enerji seviyesi yarıiletken maddenin bant aralığıyla uyumlu olması gerekmektedir. Gelen foton, katalizörün değerlik bandındaki elektronları uyarır ve uyarılmış elektronlar yarıiletken iletkenlik bandına aktarılır. Uyarılmış elektronlar suyu hidrojen gazına indirgenmesini sağlarken, yarıiletkenin değerlik bandında geride kalan orbital boşlukları da elektron verici madde tarafından doldurularak hidrojen gazı üretimi tamamlanmış olur (Münevver Zeynep Selçuk, Yüksek Lisans Tezi, İstanbul Üniversitesi Fen Bilimleri Enstitüsü, 2011).
Foton enerjisi suyun ayrışması sırasında büyük bir pozitif Gibbs serbest enerji dönüşümü eşliğinde kimyasal enerjiye dönüştürülür. Bu reaksiyon şekil 1.3’de görüldüğü üzere yeşil bitkiler tarafından gerçekleştirilen fotosenteze benzer. Bu yüzden suyun ayrışması reaksiyonuna yapay fotosenez de denmektedir. Fotokatalitik hidrojen üretimi kendiliğinden gerçekleşmeyeceği için katalizörlere ihtiyaç duyulmaktadır.
Şekil 1.3. Yeşil bitkiler tarafından fotosentez ve fotokatalizör tarafından yapılan suyun fotokatalitik ayrışması (yapay fotosentez) (Kudo, 2008)
İlk defa 1970’lerin başlarında Honda-Fujishima TiO2 elektrot kullanarak suyun ayrışmasına ışığın etkisini rapor etmişlerdir. Burada TiO2 elektrot üzerine UV ışığı düşürüldüğünde, şekil 1.4’de görüldüğü gibi elektronlar ve orbital boşlukları oluşmaktadır.
Şekil 1.4. TiO2 foto-elektrot kullanarak suyun ayrışması (Fujishima, 1972)
Bu işlem sonucunda TiO2 fotoeletrot üzerinde oluşan orbital boşlukları suyu oksitleyerek O2 gazı oluşturmaktadır. Fotouyarılmış elektronların ise Pt elektrota aktarılarak suyu H2 gazına indirgediği gözlenmektedir. Yarı iletken fotoelektrot ve fotokatalizörler kullanılarak UV ışığı altında suyun ayrışması üzerine çok sayıda çalışmalar yapılmasına rağmen suyun görünür bölge ışığı altında ayrışması için sınırlı sayıda çalışmalara rastlanmaktadır (Kudo ve ark., 2008; Chen ve ark., 2010).
1.1.4. Fotokatalitik Olarak Suyun Ayrışma Süreci
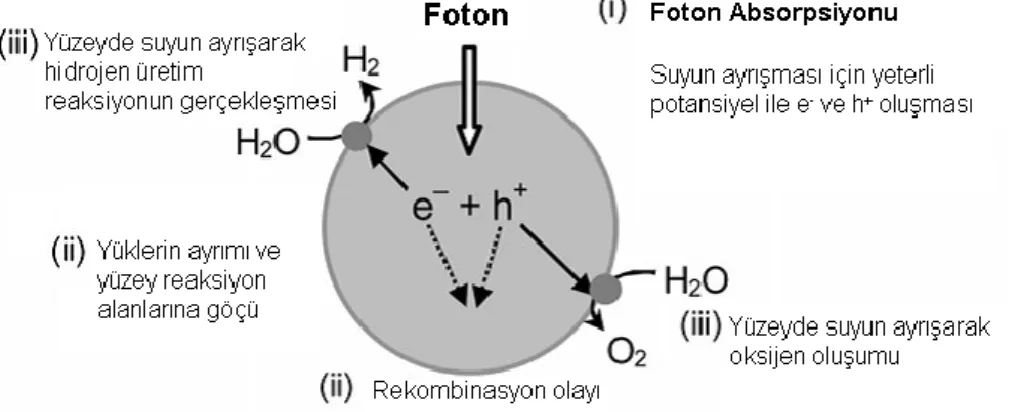
Şekil 1.5’de fotokatalitik olarak suyun ayrışması reaksiyonun basamakları gösterilmektedir.
Şekil 1.5. Fotokatalitik olarak suyun ayrışması süreci (Kudo, 2008)
İlk basamak (i) katalizör üzerine gönderilen fotonların katalizörde bulunan elektron-boşluk çiftince absorplanmasıdır. Çoğu heterojen fotokatalizör yarıiletken özelliğe sahiptir. Yarıiletken materyal üzerindeki fotokatalitik süreç Şekil 1.6’da şematik olarak gösterilmiştir.
Şekil 1.6. Yarıiletken fotokatalizör kullanarak gerçekleştirilen suyun ayrışmasından hidrojen üretiminin şematik gösterimi (Chen, 2010)
Yarıiletkenler iletkenlik bandının değerlik bandından uygun bir band boşluğu ile ayrılmasıyla oluşan bir band yapısına sahiptir. Yarıiletken üzerine gönderilen ışığın enerjisi band boşluğundan daha büyük olduğunda elektron ve orbital boşluğu sırasıyla iletkenlik bandı ve değerlik bandında oluşur. Fotouyarılmış elektron ve orbital boşlukları elektrolize benzer bir şekilde redoks reaksiyonuna neden olur. Su molekülleri
elektronlar tarafından indirgenerek H2 gazı ve orbital boşlukları tarafından yükseltgenerek O2 gazı oluştururlar. Suyun ayrışmasında kullanılacak olan yarıiletken fotokatalizör materyallerdeki önemli noktalardan biri de band genişliğinin ve band seviyelerinin uygun seviyede olmasıdır. İletkenlik bandının en üst seviyesinin H+/H
2 redoks potansiyeli olan 0 V’tan daha negatif olması gerekmektedir. Değerlik bandı seviyesi ise O2/H2O redoks potansiyeli olan 1,23 V’tan daha pozitif olması gerekir. Bu yüzden suyun ayrışması için teorik olarak minimum band genişliği 1,23 eV olmalıdır, bu da yarıiletkenin uyarılması için gönderilecek ışığın dalga boyunun en fazla 1100 nm olması demektir. Görünür bölgedeki bir dalga boyuna sahip ışıkta çalışabilecek bir fotokatalizör için band genişliği ise 3 eV (λ > 415 nm)’ dan daha dar olmalıdır. Bu band aralığı absorpsiyon spektrumundan eşitlik 1.1 kullanılarak hesaplanabilmektedir.
Band genişliği (eV) = 1240/ λ (nm) (1.1)
Band aralığı ve band seviyesi yalnız termodinamik gereksinimdir fakat yeterli koşul değildir. Örneğin, CdS görünür ışık ile etkileşebilecek uygun band genişliği ve band seviyelerine sahip gibi görünmesine rağmen suyun H2 ve O2’e ayrışmasında aktif değildir. Sudan ziyade CdS içerisindeki S-2 fotouyarılmış orbital boşlukları tarafından oksitlenerek ortaya Cd+2 çıkarır.
CdS + 2h+ Cd+2 + S (1.2)
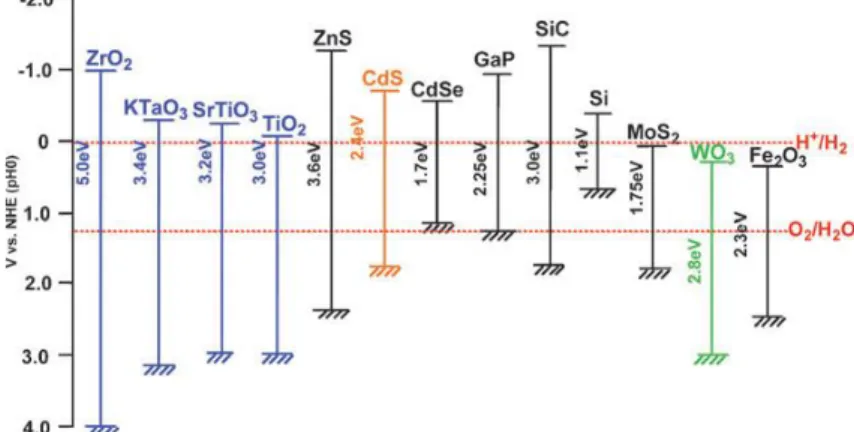
Ancak ortamda orbital boşluklarına elektron aktarabilecek bir elektron verici bulunduğunda CdS görünür ışık altında hidrojen üretimi için iyi bir fotokatalizördür. Şekil 1.7’ de bazı yarıiletken tabanlı fotokatalizörlerin band aralıkları görülmektedir.
Şekil 1.7. Yarıiletkenlerin band aralıkları arasındaki ilişki (Kudo, 2008)
Şekil 1.5’te ilk basamak (i) olan fotonların katalizörün elektron-boşluk çiftince absorplanmasının ardından, ikinci basamak (ii) fotouyarılma ile yüklerin ayrılması ve göçüdür. Kristal yapısı, kristalin düzgünlüğü ve parçacık boyutunun etkisi şekil 1.8’de gösterilmiştir. Kristal yapısının daha iyi olması kristal bozukluklarının miktarını azaltır.
Kristal bozuklukları uyarılmış elektronlar ve orbital boşlukları arasında tuzaklar ve yüklerin yeniden birleştiği (rekombinasyon) merkezleri oluşturur. Bu da fotokatalitik aktivitenin azalmasına sebep olur. Eğer kristal boyutu küçülürse elektron ve orbital boşluklarının reaksiyonun gerçekleşeceği alana göçmesi için yolu kısalır yani yüzey yüklerin ayrıldığı yere yakın mesafede olur. Bu da rekombinasyon olasılığını düşürerek fotokatalitik aktiviteyi artırır.
Şekil 1.8. Fotokatalitik aktivitede parçacık boyutu ve kristal kusurlarının etkisi (Kudo, 2008)
Şekil 1.5’teki son basamak ise (iii) yüzeydeki kimyasal reaksiyonlardır. Bu adımdaki en önemli nokta yüzeyin karakteri (aktif bölgeleri) ve miktarıdır (yüzey alanı). Fotouyarılmış elektron ve orbital boşlukları termodinamik olarak suyun ayrışması için yeterli potansiyele sahip olsalar bile, yüzeyde reaksiyonun gerçekleşeceği aktif bölgeler yoksa bu elektron ve orbital boşlukları rekombinasyona uğrayacaktır. Pt, NiO ve RuO2 gibi kokatalizörler fotokatalizör üzerine yüklenerek hidrojen üretimi için aktif bölge oluşturulabilir.
1.2. Sıvı/sıvı Arayüzeylerde Hidrojen Üretimi
1.2.1. Sıvı/sıvı Arayüzeylerde Elektrokimyaya Giriş
Birbiriyle karışmayan veya oldukça az (ideal olarak sıfır) karışabilen ve her biri bir elektrolit içeren iki sıvı çözücü temas ettirildiğinde bir arayüzey oluşur, oluşan bu arayüzey ITIES (an Interface between Two Immiscible Electrolyte Solutions) olarak tanımlanır. Burada, çözücülerden biri genellikle su, diğer faz ise su ile ideal olarak karışmayan polar organik bir çözücüdür. Bunlardan en yaygın kullanılanları nitrobenzen (NB), 1,2-dikloroetan (DCE) ve oktanoldür. Kullanılan organik çözücülerde bulunması gereken diğer bir özellik de bu çözücülerin orta veya yüksek dielektrik geçirgenliğe sahip olmalarıdır (Samec 2004).
ITIES’de elektrokimyasal işlemler kimya ve biyolojide birçok uygulama alanına sahiptir. ITIES ile ilgili elektrokimyasal çalışmaların büyük ilgi görmesinin başlıca iki nedeni vardır. Birincisi, iyon seçici elektrot (Samec ve ark. 1977; Dwyer ve Cunnane, 2005), amperometrik sensör (Senda ve ark. 1991), elektrokimyasal ekstraksiyon (Mousavi ve ark. 2000), kataliz (Samec ve ark. 2004), güneş enerjisi dönüşümleri (Itagaki ve ark. 1999) ve monolayer oluşumu (Su ve ark. 2004) gibi birçok pratik uygulamalara imkân vermesidir. Son yıllarda büyük bir ilgi uyandıran ve farmakolojide önemli bir yeri olan ikinci neden ise oluşturulan arayüzeyin biyomimetik özellik gösterebilmesidir. Yani, özellikle ilaçlardaki aktif maddelerin hücre zarından transferlerinin, ITIES’deki transferleriyle oldukça yakın karakteristik özellik taşımasıdır (Starks ve ark. 1994, Kong ve Kakuichi 2000, Beni ve ark. 2005). Bu özelliğinden dolayı, β-lactam antibiyotikler (Basaez ve Vanysek 1999), anyonik ilaçlar (Bouchard ve ark. 2002), lokal anestetikler (Kubota ve ark. 2001) gibi ilaç yapımında kullanılan birçok farmakolojik maddenin ITIES sistemindeki transferleri çalışılmıştır.
Ayrıca, yapılan çalışmalarla ilaçların lipofilisiteleri ile elektrokimyasal ölçümler arasında doğrudan bir ilişki sağlayan eşitlikler türetilmiştir. Böylece, ITIES iyonlaşabilen bileşiklerin dağılma katsayılarını ölçmek için etkili bir metot olarak elektrokimyadaki yerini almıştır (Reymond 1997).
ITIES üzerine ilk teorik çalışma ise 1939 yılında Verwey ve Niessen tarafından yapılmıştır. Bu çalışmada, ITIES’deki potansiyel dağılımını ve elektriksel çift tabakayı açıklayan fiziksel bir model önerilmiştir. Bu model sıvı/sıvı arayüzeyin, merkezleri temas tabakası olan iki bitişik Gouy-Chapman difüzyon tabakasından oluştuğunu ileri sürmüştür (Verwey ve Niessen 1939). Ancak, arayüzey yapısı ve potansiyel dağılımı hakkındaki bilgi yetersizliğinden dolayı, ITIES’deki çalışmalar oldukça yavaş gelişme göstermiştir. Yük transfer (iyon veya elektron transferi) mekanizmalarını anlamaya yönelik yapılan çalışmaların bir süre duraksamasının ardından, 1970’lerin başında Gavach ve arkadaşları tarafından tekrar konu üzerine çalışmalar başlamıştır. Bu çalışmalarda ITIES’in polarizlenebileceği gösterilmiş ve yük transfer reaksiyonları için yürütücü kuvvet olarak iki faz arasındaki Galvani potansiyel farkının kullanılabileceği ispatlanmıştır. Daha sonraki yıllarda yapılan çalışmalarda ise, ITIES’de iyon transfer reaksiyonlarını incelemek için kontrollü akım tekniklerine dayanan kronopotansiyometri gibi elektrokimyasal teknikler kullanılmıştır (Gavach ve Henry 1974, Gavach ve ark. 1978; İmren Hatay, Doktora Tezi, Selçuk Üniversitesi Fen Bilimleri Enstitüsü, 2010).
1.2.1.1. ITIES’ in Yapısı ve Elektriksel Çift Tabaka
Sıvı/sıvı arayüzey homojen olmayan ve dinamik özelliği olan moleküler bir yapıya sahiptir. Arayüzey yapısı zamana bağlı olarak değiştiğinden, arayüzeyin keskin bir sınır halinde mi yoksa dağınık bir yapıdamı olduğunu tanımlamak zordur. Arayüzey yapısı hakkındaki bilgiler, başlıca, moleküler dinamik hesaplamalar, kapasitans, yüzey gerilim ölçümleri ve bazı deneysel spektroskopik araştırmalardan elde edilmiştir. Yapılan çalışmalar sonucunda, sıvı/sıvı arayüzeylerin metal/elektrolit çözelti arayüzeyleri ile benzer özellikler gösterdiği bulunmuştur.
Bir elektrolit çözeltisine bir metal elektrodun daldırılması ve metalin negatif (veya pozitif) bir yükle yüklenmesi sonucu, çözeltideki pozitif (veya negatif) yüklü iyonlar elektroda doğru çekilir, böylece arayüzeyde bir potansiyel farkı oluşur. Ters işaretli yüklerin arayüzeyin iki tarafında birikmesi ile bu bölgede bir elektriksel çift tabaka oluşur. Elektriksel çift tabaka başlıca iki bölgeye ayrılır:
Elektroda yakın olan bölgede çözücü molekülleri ile seçimli olarak yüzeye adsorplanmış iyonları bulunduran İç Helmholtz Tabakası (İç Helmholtz Düzlemi, İHP)
Arayüzeyin çözeltiye doğru olan iç kısmında ise çözücü molekülleri ile sarılmış ve elektrot yüzeyinde biriken yükün tersi olan anyon ya da katyonların yer aldığı Dış Helmholtz Tabakası (Dış Helmholtz Düzlemi, OHP)
Difüzyon tabakası ise, bu tabakaların ardından gelen ve iyonların elektrot yüzeyine doğru belirli bir kuvvetle hareket ettiği varsayılan tabaka olarak düşünülür. Buradaki yük dağılımından dolayı, potansiyel-uzaklık değişimi tabakalara göre farklılık gösterir. Gouy-Chapman-Stern modeline göre potansiyel değişimi, Helmholtz tabakalarında büyük ölçüde ve doğrusal olarak azalırken, difüzyon tabakasında üstel olarak azalma gösterir (Şekil 1.9) (Bard ve Faulkner 2001).
Şekil 1.9. Metal/elektrolit çözelti arayüzeyinde bulunan elektriksel çift tabaka ve potansiyel farkın uzaklıkla değişimi
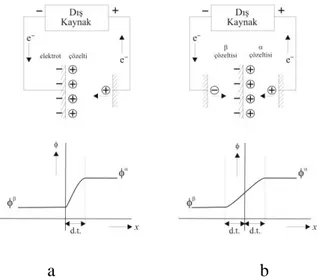
Sıvı/sıvı arayüzeyde ise, iki iyonik veya elektriksel olarak iletken sıvı fazlar arasındaki sınırda elektriksel çift tabaka oluşmaktadır. Sıvı/sıvı arayüzeylerin metal/elektrolit arayüzeyler ile birçok benzer özellik göstermesine rağmen, oldukça farklı özellikleri de vardır. Bunlardan en önemlisi iki arayüzey arasındaki aşırı yük dağılımları arasındaki farktır. Şekil 1.10’de görüldüğü gibi, her iki arayüzey de aşırı yük özelliği taşıyabilmektedir. Ancak, katı elektrotlarda metalik taraftaki aşırı yük tamamen elektronik işlemlerden kaynaklanır ve metal yüzeyi boyunca dağılır. Elektrolit tarafında ise, metaldeki aşırı yükü karşılayacak şekilde zıt yüklü iyonlar birikir ve potansiyel düşüşü bu tabakada gerçekleşir (Şekil 1.10a). Bunun aksine, sıvı/sıvı arayüzeylerde her iki tarafta oluşan aşırı yük bölgesi iyonlar içerdiğinden, polarizasyon tamamen iyonik bir olaydır (Şekil 1.10b). Bu durumda potansiyel düşüşü, bitişik iki difüzyon tabakasında meydana gelen potansiyel değişimlerine göre tanımlanır ve bu özellik birçok farklılığın ortaya çıkmasına neden olur (Koryta 1979). Bu farklılığı açıklamak için araştırmacılar tarafından çeşitli modeller önerilmiştir.
a b
Şekil 1.10. Arayüzeylerdeki aşırı yük dağılımları a) Metal/elektrolit arayüzeyi b) Elektrolit sıvı/sıvı arayüzeyi, d.t.; difüzyon tabakası kalınlığı (Tomaszewski 2000)
1.2.2. ITIES’in Termodinamiği
1.2.2.1. Galvani Potansiyel Farkı
Termodinamik açıdan vakumdaki (boşluktaki) bir mol yüklü i iyonunu bir sıvı fazın içerisine getirildiği kabul edilirse; bu transferi gerçekleştirmek için gerekli olan işi, elektrokimyasal potansiyel (i
~ ) olarak tanımlayabiliriz: i ~ = i + ziF (1.3) i
z ; iyonun değerlik sayısı, F; Faraday sabiti ve
; iç potansiyeli (galvani potansiyeli) göstermektedir. i (kimyasal potansiyel) ise iyon-dipol etkileşimleri,dağılım kuvvetleri gibi iyon ve çevresi arasındaki tüm kısa mesafeli etkileşimleri gösterir ve genellikle elektrokimyasal potansiyelin kimyasal katkısı olarak isimlendirilir. İdeal bir çözeltide i aşağıdaki gibi yazılır:
i
=
io+ RT lnai (1.4)o i
; standart kimyasal potansiyel ai ; i iyonunun aktivitesi olmak üzere Eşitlik1.3 yeniden düzenlenirse: i ~ = o i
+ RT lnai+ ziF (1.5) Fzi ; bir yükü transfer etmek için gerekli olan elektriksel işle ilgilidir. Temel elektrostatiğe göre elektriksel iş ziF iki terimi kapsar:
Yüzey tabakanın geçilmesiyle ilgili elektrostatik terim: ziF Fazın yüküyle ilgili elektrostatik terim: ziF
: Sıvı fazın yüzey potansiyelidir ve moleküler dipollerin yüzeyde seçimli
yönelimlerinden kaynaklanır.
: Dış potansiyel olarak isimlendirilir ve yüklü nesnenin yüzeyi ve vakum
arasındaki potansiyel farktır. Bu yüzden iç potansiyel ya da Galvani potansiyeli yüzey ve dış potansiyelinin toplamı olarak tanımlanır.
Şekil 1.11. Temas halinde bulunan iki faz arasındaki Yüzey potansiyeli, Dış potansiyel (Volta potansiyeli) ve Galvani potansiyel farkları (Girault 2004)
Şekil 1.11’de görüldüğü gibi elektriksel olarak iletken fazlar “α” ve “β” temas ettirildiği zaman, her iki fazdaki yük taşıyıcılar (iyon veya elektronlar) solvasyon Gibbs enerjilerindeki farktan dolayı iki faz arasında dağılırlar. Bu istemli davranış, arayüzey boyunca Galvani potansiyel farkın kurulması için elektriksel alan kuvveti sıfırdan farklı olan bir arayüzey oluşturur ve bu durumda aşağıdaki eşitlikler yazılabilir.
- = ( - ) + ( - ) (1.7) = + (1.8)
iki faz arasındaki Galvani potansiyel farkını ifade etmektedir.
ITIES’de arayüzey sınırında iyonların ve dipollerin dağılımı, ilke olarak serbest yüzeylerdekinden farklıdır. Ayrıca arayüzeyde spesifik adsorpsiyonun olmadığı durumda, , iyonik ( (iyon) ) ve dipolar ( (dip)) katkıların toplamı olarak yazılabilir.
= (iyon) + (dip) (1.9)
Çözücü moleküllerinin seçimli yönelimlerinin bir sonucu olarak ara yüzey bölgede (dip) kurulur. Ancak Eşitlik 1.8 ve 1.9 arasında büyük bir farklılık vardır ki buda, (dip)’nın ’a eşit olmadığıdır. (dip), sadece, ara yüzey sıfır yüklü olduğu zaman ölçülebilir. Bu şartlar altında Galvani potansiyel farkı dipolar terime eşittir.
= (dip) (1.10)
Galvani potansiyel farkı bu noktada sıfır yükteki potansiyel (pzc: point of zero charge) olarak isimlendirilir. pzc’deki potansiyel spesifik adsorpsiyonla değiştirilebilir ve deneysel olarak damlayan civa elektrotla ölçülebilir (Su 2006).
1.2.3. ITIES’te Nernst Eşitliği
1.2.3.1. İyon transferi için Nernst eşitliği
Bölüm 1.2.2.1’de, bir mol yüklü i iyonu vakumdan bir sıvı fazın içerisine getirildiği zaman, bu transferi gerçekleştirmek için gerekli olan işi elektrokimyasal potansiyel ( i ~ ) olarak Eşitlik 1.5 ( i ~= o i
+ RT lnai+ ziF) ile tanımlamıştık.Şekil 1.12. “i” iyonu organik fazda sulu fazdakinden daha negatif kimyasal potansiyele sahiptir. İki faz temas ettirildiği zaman, iyon sulu fazdan organik faza transfer olmaya eğilimlidir (Girault 2004)
Şekil 1.12’de gösterildiği gibi “i” iyonik türünü içeren iki karışmayan sıvı olarak su (w) ve organik (o) fazlarının temas ettirildiğini düşünelim. Sulu fazdan organik faza i türünün transferi için gerekli olan enerji aşağıdaki gibi yazılabilir:
w o o w tr,i i i G
(1.11) Bu eşitlikte w i ve o i , sırasıyla w ve o fazlarındaki i iyonunun elektrokimyasal potansiyelini temsil etmektedir. Her iki fazdaki i iyonunun molar Gibbs enerjsi (elektrokimyasal potansiyel) birbirine eşit olduğu zaman termodinamik dengeye ulaşılır ve aşağıdaki eşitlikler ile ifade edilebilir.
w i = o i (1.12) w o i ,
+ RT ln w i a + ziFw = o i , 0
+ RT ln o i a + ziFo (1.13)Eşitlik 1.13’ün yeniden düzenlenmesi ile Galvani potansiyel farkı elde edilir ve aşağıdaki gibi yazılabilir.
w o = w- o= o i w o + F z RT i ln w i o i a a (1.14) w 0 o
i i iyonun standart galvani transfer potansiyelidir ve aşağıdaki gibi
0,w o tr, w 0 o i i i G z F (1.15)
Eşitlik 1.14 metal/elektrolit çözelti arayüzeyinde elektron transfer reaksiyonlarına uygulanan klasik Nernst eşitliğine benzemektedir. Bu nedenle, bu eşitlik genel olarak ITIES sistemlerinde iyon transfer reaksiyonu için Nernst eşitliği olarak da adlandırılır (Samec 2004, Tomaszewski 2000). Burada en önemli fark, bu eşitliğin genel Nernst eşitliği gibi herhangi bir redoks reaksiyonu içermemesidir.
Aktivite yerine analitik konsantrasyonu tercih etmek daha pratik olduğu için, standart Galvani transfer potansiyeli yerine formal Galvani transfer potansiyelinin 0'
i w
o
kullanılması tercih edilir. türlerin aktiflik katsayısını ifade etmek üzere formal transfer potansiyeli için, ' 0 i w o = 0 i w o + F z RT i ln w i o i (1.16)
eşitliği düşünüldüğü zaman, Eşitlik 1.14 analitik konsantrasyon cinsinden aşağıdaki gibi yazılabilir.
w o = 0' i w o + F z RT i ln w i o i c c (1.17)
1.2.3.2. Elektron Transferi için Nernst Eşitliği
Şekil 1.13. Sıvı/sıvı arayüzeyde heterojen elektron transferi
Şekil 1.13’de gösterilen su fazındaki w
O1 ile organik fazdaki R2oarasında gerçekleşen heterojen elektron transfer reaksiyonu aşağıdaki gibi yazılabilir:
w O1 + o R2 w R1 + o O2 (1.18) Dengede: G =
~ ~
~ ~
0 2 1 2 1 o w o w R O O R (1.19)Eşitlik 1.19 elektrokimyasal potansiyel terimi içerisinde genişletilirse; o R w O o O w R et w o w o a a a a nF RT 2 1 2 1 ln 0 (1.20) o et w o
; standart elektron transfer potansiyelidir ve Eşitlik 1.21 ile ifade edilebilir. nF o R O o O R w w et w o , 0 2 0 1 0 2 0 1 ~ ~ ~ ~ , , , 0 ow R O O o R O E E ,/ , / 2 1 1 2 (1.21) Gerçek analizde oO R O E ,/ 2 2 ve w o R O E ,/ 1
1 sudaki standart hidrojen elektrot (SHE) skalası
gibi aynı potansiyel skalasında ifade edilmelidir. Bu durumda oO R O E ,/
2
2 ara yüzeydeki O2
ve R2 transferini içeren bir termodinamik çevrim açısından ifade edilebilir:
ow R O O o R O E E ,/ , / 2 2 2 2 nF G G ow O R tr O w o O tr , , , , 2 2 (1.22) O w o O tr G , , 2 , O w o R tr G ,
, 2 sudan organik faza sırasıyla O2 ve R2 türlerinin Standart
Gibbs transfer enerjileridir (Su, 2006). 1.2.4. ITIES’in Polarizasyonu
Sıvı/sıvı arayüzlerden akım geçtiği veya buraya potansiyel uygulandığı zaman, polarizlenemeyen ve ideal polarizlenebilen arayüz olmak üzere başlıca iki farklı davranış gözlenir (Jay ve Cantley 1986, Seydel ve ark. 1994). Bu davranış farkı, metal/elektrolit çözelti arayüzlerinde görülen özelliklerle benzerlik gösterir. İdeal polarizlenebilen ITIES’de, potansiyel farktaki büyük değişimler arayüzden küçük akımların geçişiyle sonuçlanır; bunun terside geçerlidir. Buna karşın, polarizlenemeyen arayüzlerde potansiyeldeki küçük değişimler nispeten daha yüksek akım geçişiyle sonuçlanabilir. Metal/elektrolit çözelti arayüzlerinde gözlenen bu farklılık, arayüzde gerçekleşen elektrokimyasal reaksiyonun spesifik hız sabitine bağlıdır. Sıvı/sıvı arayüzlerde ise polarizlenme iyon aktiviteleriyle belirlenir (Ulmeanu 2004).
1.2.4.1. İdeal Olarak Polarizlenemeyen Arayüzeyler
Hücre 1.1’de gösterildiği gibi organik (o) ve sulu fazda (w) 1:1 oranında A1+ katyonu B1 anyonuna ayrışabilen A1B1 elektrolitinin varlığında, ideal olarak polarizlenemeyen bir arayüzey oluşacaktır.
Hücre 1.1. Polarizlenemeyen arayüzey
ITIES sistemlerde Nernst eşitliği olarak adlandırılan Eşitlik 1.14, bu arayüzeyde her iki iyonik tür için de yazılırsa, aşağıdaki eşitlikler elde edilir.
1 1 1 0 ln o A w w o o A w A a RT F a (1.23) 1 1 1 0 ln o B w w o o B w B a RT F a (1.24)
Hücre 1.1’de hem katyon hem de anyon her iki fazda da bulunabildiğinden, arayüzeydeki elektriksel potansiyel farkına her iki iyonunda katkısı olacaktır. Ayrıca, katyon ve anyonun konsantrasyonları eşit olduğu için oluşan Galvani potansiyel fark aşağıdaki şekilde yazılabilir.
1 1 1 1 1 1 0 0 ln 2 2 w w o w o A o B A B w o w o A B RT F (1.25)
Buradaki wo
, elektrolit konsantrasyonlarından bağımsız ve tamamen bir fazdan diğer faza A1 ve B1 iyonlarının transfer yeteneklerine bağlıdır ve tuzun dağılımı ile belirlenir. Bu potansiyel fark ayrıca dağılım potansiyeli olarak da isimlendirilir. Bu şekildeki ITIES yapısı, elektrokimyasal olarak polarizlenemeyen arayüzey (non-polarisable interface) olarak ifade edilir (Samec 1988). Bu tip arayüzeydeki Galvani potansiyel farkının potansiyostatik olarak kontrolü mümkün olmamaktadır.1.2.4.2. Potansiyostatik Polarizasyon
Deneysel olarak, belli bir Galvani potansiyel farkında elektrokimyasal reaksiyonları çalışmak için sıvı/sıvı arayüzeyin potansiyostatik polarizasyonu gereklidir Potansiyostatik polarizasyonu gerçekleştirmek için iki yol kullanılabilir. Bunlardan ilki, Hücre 1.2’de gösterildiği gibi sadece bir ortak iyon içeren iki sıvı fazın kullanılmasıyla oluşan polarizlenemeyen bir arayüzey kullanmaktır.
Hücre 1.2. Galvani potansiyel farkının ortak bir iyon tarafından kontrol edildiği arayüzeyler
Hücre 1.2’de gösterilen ITIES sisteminde her iki faz ortak A3 iyonunu içerir;
1
B hidrofobik bir anyon iken B2 hidrofilik bir anyondur. Bundan dolayı A3 iyonu arayüzeyden transfer olabilen tek iyondur. Arayüzeydeki elektriksel potansiyel farkı sadece her iki fazdaki A3 iyonunun aktivitesiyle belirlenir ve Nernst eşitliğine göre,
3 3 3 3 0 ln o A w w o o A w A A a RT z F a (1.26)
ifadesi elde edilir. Her iki fazdaki A3 konsantrasyonları eşit olduğu takdirde aşağıdaki eşitlik elde edilir.
3 3 3 3 0 ln o A w w o o A w A A RT z F (1.27)
Organik iyonlar için iyon seçici elektrot (ISEs) olarak görev yapabilen bu türlü sıvı/sıvı arayüzeyler, genellikle organik referans elektrot olarak kullanılırlar (Volkov ve Deamer 1996).
Potansiyostatik polarizasyonu gerçekleştirmenin diğer bir yolu ise ideal olarak polarizlenebilen bir arayüzey kullanmaktır. Burada Galvani potansiyel farkı dış bir voltaj kaynağından sağlanmaktadır (İmren Hatay, Doktora Tezi, Selçuk Üniversitesi Fen Bilimleri Enstitüsü, 2010).
1.2.4.3. İdeal Olarak Polarizlenebilen Arayüzeyler ve Polarizasyon Aralığı
Hücre 1.3’de gösterildiği gibi organik fazda çözünmüş oldukça hidrofobik A1B1 elektroliti, su fazında ise oldukça hidrofilik A2B2 elektrolitini içeren sıvı/sıvı arayüzeyler ideal polarizlenebilen arayüzey (ideal polarisable interface) olarak ifade edilir (Koryta 1979). Burada önceki sistemlerin aksine Galvani potansiyel farkı iyon aktivitelerinin yerine elektriksel çift tabakadaki elektrik yükü ile kontrol edilmektedir.
Hücre 1.3. Polarizlenebilen Arayüzey
Arayüzey polarizlenebilir olduğu zaman, dışarıdan bir voltaj kaynağı ile iki faz arasında uygulanan potansiyel fark kimyasal dengeye ulaşmak için elektriksel akım gerektirir. İki faz arasında uygulanan potansiyel fark sonucunda oluşacak elektriksel akım ihmal edilebilecek kadar düşük ise, bu arayüzey polarizlenebilir olarak adlandırılır. Düşük akımın elde edildiği bu potansiyel aralığı potansiyel pencere veya polarizasyon aralığı olarak adlandırılır.
Polarizasyon aralığında herhangi bir iyonun diğer faza transferi söz konusu değildir. İdeal olarak polarizlenmiş bu arayüzey daha yüksek veya daha düşük potansiyellere maruz bırakıldığı zaman, fazlarda bulunan elektrolit iyonlar diğer fazlara transfer olmaya başlar ve arayüzey ideal olmayan polarizlenebilir arayüzey haline gelir. Örneğin, uygulanan potansiyel yeterince yüksek değerlere getirildiği zaman, su fazındaki katyon (A2+) veya organik fazdaki anyon (B1-) bitişik faza transfer olur. Potansiyelin ters yönde uygulanması ile yeterince negatif potansiyellere ulaştığında ise su fazındaki anyon (B2-) veya organik fazdaki katyon (A1+) bitişik faza transfer olur. Sonuç olarak, her iki tarafı sistemin içerdiği iyonların transferine göre sınırlandırılmış olan potansiyel aralığı elde edilir. Potansiyel penceresi olarak adlandırılan bu potansiyel aralığı boyunca arayüzey davranışları şematik olarak Şekil 1.14’de verilmiştir (Samec 1988).
Şekil 1.14. Polarizlenebilen arayüzeylerdeki potansiyel penceresinde arayüzey
reaksiyonlarının şematik gösterilişi (Tomaszewski 2000).
Metal/elektrolit arayüzeylerinde olduğu gibi, Faradayik işlemler sadece polarizasyon içerisinde potansiyostatik kontrol ile sağlanabilir. Polarizasyon penceresi
organik ve su fazları içerisinde sırasıyla daha hidrofobik ve daha hidrofilik destek maddelerin kullanılmasıyla genişletilebilir. Bu şekilde tuzların bitişik faza transferi için daha yüksek enerji gereksinimi sağlanabilir. Bu yüksek enerji gerekliliği polarizasyon aralığımızın geniş olmasına neden olur. Su fazı için kullanılan en yaygın destek elektrolit maddeleri, LiCl, Li2SO4 ve MgCl2 gibi alkali ve toprak alkali metal tuzlarıdır. Organik faz için kullanılan destek elektrolit maddeleri de oldukça çeşitlidir. Şekil 1.15’te organik faz için kullanılan destek elektrolitlere örnekler verilmiştir.
Şekil 1.15. Organik faz için kullanılan destek elektrolitlere örnekler
Bu destek elektrolitlerin kullanıldığı ITIES sistemlerinin şematik ifadeleri Hücre 1.4’de verilmiş ve bunlara ait polarizasyon aralıkları da Şekil 1.16’da gösterilmiştir.
Şekil 1.16. Hücre 1.4’de verilen arayüzeylere ait polarizasyon aralıkları. Su fazının destek elektroliti olarak Li2SO4, organik fazın (DCE) destek elektroliti olarak TBATPB
(tetrabutilamonyumtetrafenilborat) veya BATB (bis(trifenilfosforanilidin) amonyumtetrakis(pentaflorofenil)borat) kullanıldığı durumlardaki potansiyel aralıkları
Organik destek elektroliti olarak TBATPB ve BATB kullanıldığı zaman elde edilen potansiyel pencereleri, aşağıdaki eşitliklerle ifade edilmektedir (Shao ve ark. 1991a); 0 0 0 < < TB Li TPB w o w o w o (1.28) 0 0 2 4 0 < < BA SO TBA w o w o w o (1.29)
Bu iki eşitlik, sulu fazın destek elektrolitinin içerdiği iyonların hidrofilikliğine, organik destek elektrolitinin içerdiği iyonların hidrofobikliğine göre direk karşılaştırmayı sağlar. Örneğin, TPB-’nin hidrofobikliği Li+’nın hidrofilikliğinden daha azdır ve diğer faza transfer için daha az enerji gerektirir ( 0, wTPBDCE
= +363 mV, 0, w DCE Li
= +576 mV). Buradan yola çıkılarak, Şekil 1.16’da gösterildiği gibi Hücre 1.4’de gösterilen hücrelerden birincisinin kullanılmasıyla elde edilen potansiyel penceresinin sınırları, organik fazdan sulu faza TPB- ve TBA+’ nın transferleri ile belirlenirken, ikinci hücrenin kullanılmasıyla potansiyel penceresinin sınırları sulu fazdan organik faza Li+ ve SO4-2 iyonlarının transferleri ile belirlenecektir (İmren Hatay, Doktora Tezi, Selçuk Üniversitesi Fen Bilimleri Enstitüsü, 2010).
İyon transfer reaksiyonlarına ait çalışmalarda Li2SO4/BATB destek elektrolit çifti deneysel olarak elde edilen en geniş aralıklı potansiyel penceresine sahiptir (yaklaşık 800 mV). İyon transferlerine ait Gibbs enerjileri tablo halinde birçok
araştırmacı tarafından verilmiştir (Samec ve ark. 1982, Taylor ve Girault 1986, Campbell ve Girault 1989).
1.2.5. ITIES’te Yük Transferini Çalışmak için Kullanılan Metotlar
Sıvı/sıvı arayüzeylerde yük transfer reaksiyonları hem galvanostatik hem de potansiyostatik metotlar kullanılarak çalışılmıştır. Bu çalışmalarda en çok kullanılan teknikler, kronopotansiyometri, kronokulometri, kronoamperometri, dönüşümlü voltametri, puls voltametrisi (normal ve diferansiyel), alternatif akım voltametrisi, impedans spektroskopisi ve damlayan civa elektrotlu potansiyel ve akım tarama polarografisi olarak sıralanabilir (Samec 2004). Ancak, yük transfer reaksiyonu hakkında oldukça detaylı bilgi edinmemizi sağlayan dönüşümlü voltametri en yaygın olarak kullanılan metot olmuştur. Burada kısaca dönüşümlü voltametri ve bu metodun ITIES’e uygulanmasından bahsedilecektir.
1.2.5.1. Dönüşümlü Voltametri
Dönüşümlü voltametri, karıştırılmayan bir çözelti içerisinde çalışma elektroduna uygulanan üçgen şeklindeki uyarıcı dalga potansiyeline karşı elde edilen akımı ölçer. Elektrokimyasal deneylerde en çok kullanılan potansiyel değişimi doğrusal dalga formudur. Burada, potansiyel zamanın fonksiyonu olarak sürekli değişir. Potansiyelin zamanla değişme hızı tarama hızı (v) olarak ifade edilir. Bu dalga formunun kullanıldığı en basit teknik lineer tarama voltametrisidir. Potansiyel aralığı tek yönde taranır; başlangıç potansiyelinde başlar, bitiş potansiyelinde sonlandırılır. Bu nedenle, zamanla lineer olarak artan akım-potansiyel eğrisi elde edilir (Gosser 1993).
Dönüşümlü voltametride ise, buna ek olarak, potansiyel belirli bir değere ulaştıktan sonra tarama yönü ters çevrilir ve başlangıç veya daha ötede bir potansiyele kadar sürdürülür. Bu işlemler sonucunda, dalga formu genellikle eşkenar üçgen olarak ortaya çıkar. Genel olarak, bu tarama başlangıç potansiyeli (Ei), değiştirme potansiyeli (Esw), bitiş potansiyeli (Ef) ve tarama hızıyla (v, V/s) tanımlanır (Şekil 1.17a). Zamanın fonksiyonu olarak potansiyel,
i EE v t (ileri tarama) (1.30) sw E E v t (geri tarama) (1.31)
olarak ifade edilebilir. İkinci bir potansiyelin olduğu daha karmaşık taramalarda mümkündür.