MALİGN ASTROSİTER TÜMÖRLÜ HASTALARDA YAŞAM
SÜRESİNİ ETKİLEYEN FAKTÖRLER VE Ki-67 (MIB I)
PROLİFERASYON İNDEKSİNİN PROGNOZ ÜZERİNE
ETKİSİ
(UZMANLIK TEZİ)
Dr. Bekir TUĞCU
İÇİNDEKİLER Tarihçe ………. 1 Genel bilgilerBeyin tümörleri sınıflandırması ……….. 2-8
Epidemiyoloji ………..……… 8-10
Pilositik astrositom (WHO grad I) ……….. 10-11
Astrositom (WHO grad II) ……….……….. 11-13 Glioblastoma multiforme ve Anaplastik astrositom ……… 13-23 Yöntem ……… 24-26 Bulgular ……… 27-41 Tartışma ……… 42-51 Sonuç ……… 52 Özet ……… 53-54 Kaynaklar ……… 55-63
TARİHÇE
Beyin tümörleri, tüm hastalıklar içinde en dramatik türlerden birini oluşturmaktadır. Çocukluk çağının en sık rastlanan ikinci malinitesini oluşturmaktadır. Erişkinlerde primer beyin tümörleri en sık 6. malinite olarak karşımıza çıkmaktadır. Amerika Birleşik Devletlerinde tüm kanser ölümlerinin ise % 2’si primer beyin tümörlerinden kaynaklanmaktadır.
Son dönemlerde beyin tümörlerinin özellikle tanısında sağlanan gelişmeler beyin tümörlerinin sıklığının artmasında öneli rol oynamıştır. Aynı zamanda cerrahi tecrübelerin ve teknik gelişmelerin ilerlemesi de son dönemlerde primer beyin tümörlerinin giderek tedavi edilebilir veya önlenebilir olmasını sağlamaktadır.
Modern beyin tümör cerrahisi 1884’de Rickman Godlee tarafından yapılan operasyon ile başlamıştır. Her ne kadar mezolitik çağlarda dahi kraniumda operasyon kanıtları mevcut ise de ya da 19. yüzyıldan önce beyin tümörlerinin çıkarıldığına dair bilgiler mevcut ise de, nörolojik metodlar ile lokalizasyonun yapıldığı ve modern antiseptik cerrahi tekniklerinin uygulandığı ilk modern cerrahi Rickman Godlee tarafından İngiltere’de yapılmıştır [1].
Modern nöroloji ve nöroanatominin gelişimi ilk olarak Galen tarafından başlatılmış ardından gelen ana gelişmeler ise Andreas Vesalius ve ardından Thomas Willis tarafından sağlanmıştır. 19. yüzyıl boyunca tüm cerrahların korkulu rüyası olan süpurasyon, pütrefikasyon ve infeksiyon ise 1850’li yıllarda Lord Joseph Lister tarafından geliştirilen modern antiseptik metodlar sayesinde minimuma indirgenmiştir.
1884’deki Godlee’nin operasyonundan sonraki beyin tümörleri gelişmeleri ise daha çok cerrahi teknikler ile ilişkilidir.
BEYİN TÜMÖRLERİ SINIFLANDIRILMASI
Santral sinir sistemi tümörlerinin belirign çeşitlilik göstermesi nedeni ile herkes tarafından kabul görmüş bir sınıflama gerçekleştirmek zordur. Günümüzde hemen hemen tamamen sınıflama patolojiye dayanmaktadır.
Beyin tümörleri ilk olarak 1829’da Cruveilhier tarafından makroskobik olarak tanımlanmış 1836’da ise Bressler tarafından makroskobik olarak sınıflandırılmışlardır. Ancak beyin tümörlerinin bugünkü sınıflamanın temelini Wirchow atmıştır. 1860’da beynin hücrelerarası matriksi olarak nörogliayı tariflemiştir. Yine Wirchow tarafından tümörlerin makroskobik ve mikroskobik özellikleri arasında bağlantı kurulmasını sağlamış ve “glioma” tarifini de ilk kez yapmıştır.
Bailey ve Cushing 1926 yılında gliomaların bir sınıflamasını yaptılar [2]. Yapmış oldukları şema tam 14 tümör tipini içermekte idi. Ancak sınıflama karmaşıklığı dolayısı ile geniş bir kabul görmedi. Yirminci yüzyılın ortasında Kernohan yeni ve basit bir sınıflama geliştirdi [3]. Daha önce tanımlanmış olan karmaşık histogenetik sınıflama basit 5 glial tümör kategorisine indirgendi. Astrositoma, Ependimoma, Nöroastrositoma, medulloblastoma ve oligodendroglioma. Ancak daha önemlisi, glial tümörleri 4 grade şeklinde kendi içinde gruplandırma sistemini geliştirdi. Bu sistem artan anaplazi ve azalan farklılaşmayı göstermekte idi. Ancak Grade I ve II arasında, Grade II ve IV arasında bir benzerlik olmasına karşılık, bu iki grup arasında belirgin bir biyolojik davranış farkı mevcut değildi. Bu nedenler ile Ringertz 1950’de 3 grade’li bir sistem ortaya koydu [4]. Yine 1980’lerde Doumas ve Duport şimdi St Anne-Mayo diye anılan hücre morfolojik özelliklerine dayanan bir 4 basamaklı grade sistemini ileri sürdü [5].
Bindokuzyüzdoksanüç’de WHO (World Health Organisation) tümörlerin sınıflandırmasını yayınlamış ve Grade I-IV arasında tümörler benign’den malign’e doğru sınıflanmıştır [6]. Bu sınıflama histopatolojik özellikler kadar yaşam süresi verilerine de dayanmakta idi.
Bugün için en sık kullanılan sistem ise 2000 yılında yeniden gözden geçirilerek düzenlemeler yapılan 1993’deki WHO sınıflandırmasıdır (tablo 1) [7].
Tablo 1: WHO santral sinir sistemi tümörleri histolojik sınıflandırması NÖROEPİTELYAL DOKU TÜMÖRLERİ
1. Astrositik tümörler a. Diffüz astrositoma
1. Fibriler astrositoma 2. Protoplazmik astrositoma 3. Gemiositik astrositoma b. Anaplastik astrositoma
c. Glioblastoma multiforme
1. Dev hücreli glioblastoma 2. gliosarkom
d. Pilositik astrositoma
e. Pleomorfik ksantroastrositom
f. Subependimal dev hücreli astrositom 2. Oligodendroglial tümörler a. Oligodendrogliom b. Anaplastik oligodendrogliom 3. Mixed gliomalar a. Oligoastrositom b. Anaplastik oligoastrositom 4. Ependimal tümörler a. Ependimoma 1. Sellüler 2. Papiller 3. Clear cell 4. tanisitik b. Anaplastik ependimoma c. Miksopapiller ependimoma d. subependimoma
5. Koroid plexus tümörleri
a. Koroid pleksus papillomu b. Koroid pleksus karsinomu 6. Nöronal ve mixt nöroglial tümörler
a. Gangliositom
b. Serebellumun displastik gangliositomu c. Desmoplastik infantil astrositomu d. Disembriyoblastik nöroepitelyal tümör e. Gangliogliom
f. Anaplastik gangliogliom g. Santral nörositom h. Serebellar liponörositom
i. Filum terminalenin paragangliomu 7. Nöroblastik tümörler
a. Olfaktor nöroblastom (estesionöroblastom) b. Olfaktor nöroepitelyom
c. Adrenal gland ve sempatik sinir sistemi nöroblastomu 8. Pineal parenkimal tümörler
a. Pineasitom b. Pineablastom
c. Orta derecede diferansiasyon gösteren pneal parenkimal tümör 9. Embriyonal tümörler
a. Medullaepitelyom b. Ependimoblastom c. Medullablastom
2. Large cell medulloblastom 3. Medullomyoblastom
4. Melanositik medulloblastom d. Supratentoryel primitif nöroektdermal tümörler
1. Nöroblastom 2. ganglionöroblastom e. Atipik teratoid/rabdoid tümör 10. Orijini belirsiz glial tümörler
a. Astroblastom b. Gliamatosis serebri
c. 3. ventrikül koroid gliomu
MENİNGEAL TÜMÖRLER
1. Meningotelyal hücre tümörleri a. Meningioma b. Meningotelyal c. Fibröz d. Transisyonal e. Psammatöz f. Anjiyomatöz g. Mikrokistik h. Sekretuar i. Metaplastik j. Lenfoplazmasit zengin k. Clear cell l. Kordoid m. Atipik n. Papiller o. Rabdoid p. Anaplastik meningiom
2. Mezenkimal meningotelyal hücre kökenli olmayan tümörler a. Lipom b. Anjiolipom c. Hibernom d. Liposarkom e. Soliter fibröz tümör f. Fibrosarkom
g. Malign fibröz histiositom h. Leiyomyom i. Leiyomyosarkom j. Rabdomyom k. Rabdomyosarkom l. Kondrom m. Kondrosarkom n. Osteom o. Osteosarkom p. Osteokondrom q. Hemanjiyom r. Epiteloid hemanjiyoendotelyom s. Hemanjiyoperisitom
t. Anjiyosarkom u. Kaposi sarkomu 3. Primer melanositik doku
a. Diffüz melanositosis b. Melanositom
c. Malign melanom
d. Meningeal melanomatosis 4. Belirsiz histogenez tümörleri
a. Hemanjiblastom PERİFERİK SİNİR TÜMÖRLERİ 1. Schwannoma a. Sellüler b. Pleksiform c. melanositik 2. Nörofibrom a. pleksiform 3. Perinörom a. İntranöral perinörom b. Yumuşak doku perinöromu
4. Malign periferik sinir kılıfı tümörleri (MPSNT) a. Epiteloid
b. Diverjant mezenkimal ve / veya epiteloid farklılaşma gösteren MPSNT c. Melanotik
d. Melanotik psammomatöz
LENFOMALAR VE HEMOPOETİK TÜMÖRLER 1. Malign lenfoma
2. Plazmositom
3. Granülositik sarkom GERM HÜCRELİ TÜMÖRLER
1. Germinom 2. Embriyonal karsinom 3. Yolk sac tümör 4. Koriyokarsinom 5. Teratom a. Matür b. İmmatür
c. Malign transformasyon gösteren teratom 6. Mixt germ hücreli tümör
SELLAR BÖLGE TÜMÖRLERİ 1. Kraniofaringeom
a. Adamantinomatöz b. Papiller
2. Granüler hücreli tümör
EPİDEMİYOLOJİ
Santral sinir sistemi tümörleri yeni tanı konulan tüm malinitelerin %2’sini oluştururken çocukluk çağı malinitelerinin ise %20’sini oluştururlar.
Santral sinir sistemi tümörleri içinde, ilk 15 yaşındaki primer tümörlerin yaklaşık % 40-45’i erişkin yaş grubunda ise %50-60’ı astrositer kökenli tümörlerdir .
Santral sinir sistemi tümörleri yaş dağılımı incelendiğinde çocukluk çağında pik yaptığı gözlenir. Yirmi yaşlarından 70 yaşına kadar giderek artan bir sıklık göstererek 70 yaşından sonra tekrar sıklığında azalma saptanır. Hemen tüm yaş gruplarında erkeklerde kadınlara göre hafif bir fazlalık saptanmaktadır.
Histolojik tiplerine göre insidens incelemelerinde ise çocukluk çağı ile erişkinlerde belirgin farklılık gözlenmiştir. Çocukluk çağında astrositoma ve medulloblastomalar diğer tümörlerden daha sık saptanırken erişkin yaş grubunda ise glial tümörler ve meningiomalar belirgin olarak sık gözlenirler [8].
İnsidens çalışmaları, yıllar içinde santral sinir sistemi tümörlerinin sıklığında hafif bir artış olduğunu göstermektedir. Bunun oluşumunda çevresel etkenlerin derecesinin ne olduğu tartışmalı olmakla beraber bilgisayarlı tomografi ve manyetik rezonans incelemelerin yaygın olarak kullanılmaya başlanmasının tanıyı kolaylaştırması açısından bu durumu açıklayabileceği düşünülmüştür.
Santral sinir sistemi tümörleri yaş cins ve zaman içinde insidens oranlarında değişkenlik göstermekle birlikte popülasyonlar arasında da farklılık göstermektedir. Genetik ve çevresel etkenlerin önemli rol oynadığını gösteren kanıtlardan biri teknolojik olarak gelişmiş bir ülke olan Japonya’da, Amerika Birleşik Devletlerinden yaklaşı 3 kat daha az primer beyin tümörü saptanmasıdır [9]. Aynı zamanda tüm Asya’da da SSS tümör sıklığı azdır. Yine aynı ülkede yaşayanlar arasında da beyaz ırkda SSS tümörü sıklığı siyah ırka göre belirgin olarak daha fazladır.
Genetik ve alevi yatkınlık: Ailevi tümör sendromlarında belli herediter ve konjenital
hastalıklar artmış bir SSS tümörü sıklığı ile birliktelik gösterir (Nörofibromatoz, Ataksiya Teleanjiektezi, Turcot sendromu gibi). Yine genetik çalışmalarda meningiomalarda kromozom 22’de kromozom 9 ve 10’da kayıplar gliomalarda saptanabilir.
Çevresel faktörler: Literatürde çok sayıda çevresel ajanlarla SSS tümörleri sıklığı
arasında ilişki kuran yayınlar mevcuttur. Çevresel faktörler içinde en iyi ortaya konulan faktör radyasyondur. İn utero dönemde, çocukluk çağında ya da erişkin çağda radyasyona tedavi veya tanısal amaç ile maruz kalma, artmış SSS tümörleri sıklığı ile birliktedir [10]. Erişkinlerde yüksek doz radyasyon ile özellikle meningiom sıklığında artış gösterilmiştir. Hayvan deneylerinde ise yüksek doz radyasyon ile Glioblastoma multiforme yapılabilmiştir [11].
İnfeksiyon için de herhangi bir kesin kanıt olmasa da tüberküloz ve toksoplazma gondii ile yüksek grad glial tümörler arasında ilişki gösteren tek tek yayınlar mevcuttur.
Sigaranın pasif ya da aktif içiciliği ile SSS tümörlerinde artış gösteren çalışmalar olmakla birlikte kanıtlanmış bir birliktelik mevcut değildir.
ASTROSİTER TÜMÖRLER
WHO klasifikasyonu astrositik tümörleri iki ana kategoriye ayırır. 1) diffüz infiltran astrositer tümörler
Birinci grup astrositer tümörler, makroskobik görünenin ötesinde bir diffüz infiltrasyon gösterirler. Belirgin oranda da anaplastik progresyon gösterirler. İkinci grup ise genellikle iyi sınırlıdır ve komşu beyin dokusuna genellikle sınırlı infiltrasyon gösterirler. Genellikle anaplastik progresyona sahip değildirler. Diffuz tipteki astrositomlar artan anaplazi oranına göre sınıflandırılırlar. WHO grad sistemine göre; WHO grad II (astrositom), WHO grad III ( anaplastik astrositom), WHO grad IV ( Glioblastoma multiforme).
PİLOSİTİK ASTROSİTOM (WHO GRAD I)
Düşük grad glial tümörlerin sık bir varyantıdır. Tipik olarak çocuk ve genç yaştaki erişkinleri etkiler. 1993 WHO sınıflamasında spesifik tip astrositer tümörler içinde yer almaktadır. Tüm intrakranyal glial tümörler içinde % 4-5 civarında saptanır. Çocukluk çağı beyin tümörleri içinde ise %15’lik bir kısmı oluşturur. Serebellar pilositik astrositomlar tipik olarak 9-10 yaşlarda, serebral astrositomlar ise 20’li yaşlarda saptanır. Pilositik astrositomlar orta hat yapılarında yerleşim gösterirler. Serebellum, 3. ventrikül çevresi ve optik yollar sık yerleşim yerleridir. Tanı öncesi klinik semptomların ortalama süresi 1 yıl civarındadır. Klinik semptomlar diğer glial tümörlerdekinden farklılık göstermezler. Görüntüleme yöntemlerinde iyi sınırlı, oval veya yuvarlak şekilli tümörlerdir. Bilgisayarlı tomografide hipodens veya izodens, yoğun kontrast tutumu gösterir. Kistik olanlarda ise mural nodul yoğun kontrast tutar. Manyetik rezonans incelemede tipik olarak iyi sınırlı etraf normal dokuya invazyon göstermeyen, T1’de hipointens, T2 de ise hiperintens lezyonlar olarak gözlenirler. Yoğun kontrast tutumu MR’da da izlenir.
Histopatolojik olarak ise juvenil ve erişkin tip olarak iki tip ayrılabilir.
Pilositik astrositomlu hastalarda, total rezeksiyon veya radikal subtotal rezeksiyon sonrası beklenen 10 yıllık yaşam süresi % 100’e ulaşmaktadır. Subtotal rezeksiyon sonrası ise beklenen yaşam süresi 10 yıllık % 85’e düşmektedir [12]. Yalnız biopsi alınan hastalarda ise
10 yıllık beklenen yaşam süresi ise % 44’dür. Pilositik astrositomlarda malign dejenerasyon beklenmez ve rekürrens olduğunda histolojik tip yine her zaman aynıdır.
ASTROSİTOM (WHO GRAD II)
Diffüz düşük gradlı glial tümörler, astrositomaların yaklaşık olarak %10-15’ini oluştururlar. Genellikle daha genç yaşları etkilerler ve ortalama etkilenen hastaların yaşları 35 dolayındadır. Hafif bir erkek predominansı mevcuttur. Sıklıkla nöbet, başağrısı ve yavaş ilerleyici nörolojik defisitlerle prezente olurlar. Genellikle yıllar ile ölçülebilen bir periyod içinde semptomlar gelişir. Karakteristik yerleşim bölgeleri subkortikal akmaddede ve tercihan frontal bölgededir. Bilgisayarlı tomografide karakteristik olarak iyi sınırlı, kontrast tutmayan, izodens veya hipodens, etrafında az miktarda ödem alanı bulunan tümörler olarak izlenirler. Manyetik rezonans incelemede ise T2 sekanslarda hiperintens, T1’de ise hipointens alanlar olarak görülürler. Genellikle MR incelemesinde BT incelemesine göre daha geniş bir lezyon alanı gözlenmektedir.
Makroskobik morfolojileri tümör tipine göre değişkenlik göstermektedir. Protoplazmik tipte, tümör süperfisyal gri maddede kortikal genişleme alanı olarak gözlenirken, tümör sınırları net olarak izlenemez. Kist formasyonu ise sıktır. Yumuşak ve homojen bir tümördür. Fibriler tümörler ise daha sert lastik kıvamındadır.
Diffuz infiltran astrositer tümörlerde tanımlanan histopatolojik tipler şunlardır. 1) fibriler astrositom
2) gemisitositik astrositom 3) protoplazmik astrositom
Bir grad II astrositer tümör içinde her 3 hücre tipi de belli oranlar içinde bulunurken, önde gelen hücre tipine göre o tümör sınıflandırılır. Bunların içinde en sık görülen fibriler tümörlerdir. Gemisitositik astrositom grad II astrositer tümörlerin %20’sini oluşturur, sıklık açısından 2. sıradadır. Gemisitositik astrositomların prognozu diğerlerine göre daha kötüdür.
Protoplazmik astrositer tümörler ise oldukça nadir olup tüm infiltran astrositomların %1’ini oluşturur. Fibriler astrositomlar değişken miktarda gliofibriler matriks içerirler. Astrositer tümör hücrelerininn sitoplazması perinükleer halka, fuziform veya belirgin elonge sitoplazma içerir. Gemisitotik astrositomlarda ise yuvarlak veya hafif angüle hücreler, eosinofilik sitoplazma ve ekzantrik nükleus mevcuttur. Protoplazmik astrositomlarda zayıf fibriller matriks mevcut olup, hücreler yıldızsal şekillidir. Bu hücre tiplerinin hepsinde hafif düzeyde atipi özellikleri mevcuttur. Hücresel yapısal değişkenlik derecesi minimal düzeyden belirgine kadar farklılık gösterebilir. Mitoz, endotelyal hiperplazi ve nekroz ise yoktur.
Tüm diffüz infiltran astrositomların anaplastik astrositomaya progresyon riski mevcuttur. Özellikle fibriler astrositik tümörlerde bu oran %80’e kadar çıkmaktadır. Ancak bu diferansiasyon farklılığının ne kadar bir latent perioddan sonra geliştiği konusu tartışmalıdır.
Düşük grad glial tümörlerde prognozun iyi olabileceğine işaret eden faktörler şöyle sıralanabilir. Genç yaş; gros total veya radikal subtotal rezeksiyon uygulanmış olması; Karnofsky performans skalasının yüksek olması; BT veya MR’da kontrast tutumu; Operasyon öncesi semptomların süresinin uzun olması.
Düşük grad glial tümörlerde ortalama yaşam süresi 7,5 yıl kadar olup, beklenen 5 yıllık yaşam süresi % 60, 10 yıllık ise % 40 dolayındadır.
GLİOBLASTOMA MULTİFORME (GBM) VE ANAPLASTİK ASTROSİTOMA (AA) (WHO GRAD III ve IV)
Erişkin yaş grubundaki en sık primer beyin tümörüdür. Primer beyin tümörlerinin dağılımı büyük oranda yaşla ilintilidir. Gioblastoma ve astrositomanın insidensi 14 yaş altında 100,000’de 0,2-0,5 iken 45 yaş üzerinde ise 100,000’de 4,5’a çıkmaktadır [13].
Aynı şekilde astrositomaların yaş ile yerleşim alanları da değişkenlik göstermektedir. Yirmibeş yaş altında astrositomaların 2/3’ü infratentoryel iken 25 yaş üzerinde ise %90 supratentoryel yerleşim gösterirler.
GBM ve AA’nın tüm primer beyin tümörleri içindeki oranı değişik yayınlarda % 20’den %50’e kadar değişmektedir [13-16]. Sadece erişkin yaş grubu ele alınınca primer beyin tümörlerinin hemen hemen yarısından fazlasını GBM oluşturur. ABD’de GBM için ortalama yaş 60 dolayında iken AA veya diğer astrositomalarda ortalama yaş 50 dolayındadır [17].
GBM primer olarak gelişebilmekle birlikte daha düşük gradlı glial tümörlerden de progresyon ile gelişebilmektedir. Bu iki tip GBM, primer ve sekonder GBM olarak anılmaktadır. Primer GBM daha yaşlı insanlarda ve daha kısa bir klinik tablo ile karşımıza çıkarken, sekonder GBM, daha genç hastalarda ve genellikle aylar veya yıllar süren klinik tablolar ile kliniklere başvururlar.
Yıllar içinde de glioblastoma sıklığı artmıştır. Özellikle gelişmiş ülkelerde yapılan çalışmalarda ABD ve Kanada’da yetmişli yıllardan seksenli yılları ortalarına kadar tespit edilen glioblastom olguları yaklaşık 2 kat kadar artış göstermiştir. Bunun nedeninin ise teknolojik gelişmeler ile tespit edilme oranının artması olarak ortaya konmuştur [18,19]. Yüksek grad glial tümörlerde buna benzer bir artış, son 7 yıl içinde %5’lik bir artış ile Fransa’da tespit edilmiştir [20].
AA ve GBM erkeklerde kadınlara göre, beyaz ırkda da siyah ırka göre bir miktar daha sıktır.
GBM ve AA genellikle herhangi bir ailevi yatkınlık ya da tanımlanabilir bir çevresel etken olmaksızın sporadik olarak ortaya çıkarlar. Yakın zamanda yapılan çalışmalarda ortaya
atılan hipotezlere göre düşük grad astrositomlardan basamak basamak GBM’e ilerleyiş kromozom 10 ve 17’de yerleşim gösteren supresör genlerin kademeli kayıplarından ileri gelmektedir [21,22]. Bu kayıplar tümör büyümesini ve heterojenitesini artıran dominant onkojenlerin aktivasyonuna yol açmaktadır. Kromozom 10 ve 17’de kayıplar gliomalı hastalarda sıklıkla saptanmaktadır. Yine son zamanlarda primer ve sekonder GBM’lerde genetik profiller de farklılık göstermektedir. Primer GBM’lerde PTEN mutasyon veya delesyonları saptanırken sekonder GBM’lerde ise sıklıkls p 53 mutasyonları gözlenmektedir. Tüm bu bulgular glial tümörlerde bir genetik köken olduğunu göstermektedir.
Glioblastoma multiforme ve Anaplastik astrositomların yerleşim bölgeleri:
GBM ve AA genellikle serebral hemisferlerin derin beyaz maddesinde yerleşirler. Bu tümörlerin büyük çoğunluğu hemisferlerde geniş dağılım göstermekle birlikte en sık olarak frontal lob ve oksipital lob parietal lob sınırlarında gözlenirler. Genellikle dağınık yerleşim gösterme özellikleri ve derin yerleşimleri nedenleri ile birden fazla fonksiyonel beyin bölgesini işgal ederler ki bu da cerrahilerini zorlaştıran ana etkenlerdendir. Hemisferler dışında da yerleşim gösterebilirler. Örneğin beyin sapı glial tümörlerinin de hemen hemen
yarısı yüksek malinite özellikleri gösterirler. Ayrıca GBM’lerin yaklaşık %10’u derin yerleşimli değildir, beyaz-gri madde sınırında yerleşerek metastazları taklit edebilirler.
Klinik tablo:
AA ve GBM’de de diğer intraserebral yer kaplayıcı lezyonlarda olduğu gibi klinik tablo ve başvuru yakınmaları, histolojik tipten ziyade daha çok tümörün topografik yerleşimi ile bağlantılıdır. Klasik intrakranyal basınç artışı semptomları (Başağrısı, kusma, bilinç bozuklukları, 3 ve 6. sinir tutulumları) en sık rastlanmaktadır. Yüksek gradlı astrositer tümörler genellikle ventrikül sistemini tutmazlar. Bu nedenle genellikle hidrosefaliye yol açmazlar. Yerleşim bölgesine bağlı olarak nörolojik defisitler meydana gelmektedir. İrritatif etkiye bağlı olarak epileptik bulguların ortaya çıkması frontal ve temporal yerleşimli tümörlerde sıktır. Klasik olarak; başağrısı, epileptik nöbet ve hemiparezi triadı olguların yarısından fazlasında saptanır. Klinik hikayede uzun süreli epileptik nöbet ve/veya diğer nörolojik defisit varlığı genellikle daha düşük gradlı bir astrositer tümörden progresyonu gösterdiği için daha iyi prognozun göstergesidir.
Olguların büyük çoğunluğunda ilk klinik yakınma ile hekime başvuru arası süre 1 ay ile 1 yıl arasında değişmektedir. Nadir olarak hemorajik transformasyona bağlı, inmeye benzer şekilde ani başlangıçlı olarak ortaya çıkabilmektedir.
Radyolojik görünüm:
Malign astrositomalar değişken radyografik göörünüme sahiptirler. Bilgisayarlı tomografide hipodens veya izodens görülürler. Kontrast tutulumu değişkendir. Santralde nekroz alanını gösteren hipodens bir alan ve etrafında kalın kontrast tutan bir alan gözlenir. Etrafında geniş bir ödem alanı ile çevrilidir.
Manyetik rezonans incelemede ise T1 ağırlıklı kesitlerde karakteristik olarak düşük sinyal intensitesi T2 ağırlıklı kesitlerde ise yüksek sinyal intensitesi gözlenir. Kalsifikasyon, eğer düşük grad bir astrositer tümörden gelişmemişse beklenmedik bir bulgudur. Tümör
dokusu derin ak maddededir. Ak madde yolaklarını kullanarak infiltrasyon yapmaya ve sıklıkla korpus kallozumu kullanarak karşı hemisfere yayılım göstermeye yatkınlık gösterir. Uniform veya halkasal tarzda kontrast tutulumu saptanır. GBM’lerin %10’u, AA’ların ise % 20-30 kadarında kontrast tutulumu gözlenmeyebilir. Erişkin bir insanda, hemisferik ak maddede tek bir halkasal kontrast tutan lezyon aksi ispatlanıncaya kadar malign astrositer bir tümör olarak ele alınmalıdır.
AA ve GBM olgularında genellikle tümörün kendi çapı kadar ödem bulunur. Hemoraji GBM’lerde gözlenebilir. Cerrahi sonrası gelişen rekürrenslerde kontrast tutan lezyonun radyasyon nekrozundan ayrılması sorunu sık karşılaşılan bir sorundur. MR ve BT bu ayırımda yetersiz kalabilir. Bu durumda MR spektroskopi bu ayırımın yapılmasında kolin seviyesinin radyoterapi sonrası artması dolayısı ile kullanılabilir.
PATOLOJİ Gros morfoloji:
AA ve GBM otopsi sırasında veya cerrahi sırasında karşılaşılan en dramatik lezyonlardır. Tümör genellikle soliddir. Santral bölgede likefaksiyon, nekroz ve mikrokistik yapılar gözlenebilir. Genellikle geniş kist yapısı içermez. Bazen kırmızıya çalan gri-kahve renktedir. Kapsül içermez, normal dokuya diffüz infiltrasyon gösterir. Pia veya araknoid alana yayılabilir.Tümörün infiltrasyon alanını sınırlamada dura iyi bir bariyer oluşturur. Çevre doku parlak ve ödemlidir. Kalsifikasyon genellikle yoktur.
GBM’de hücre morfolojisi ve doku yapılanmasındaki ileri derecede değişkenlik Hemotoxylin-Eosin gibi rutin boyalarda ışık mikroskobisinde gözlenir. Hücrelerde hiperkromatik farklı büyüklüklerde nükleuslar izlenir. Pembe sitoplazma adeta ayakçıklar gibi multiple fibriler uzantılar içerir. Mitotik figürler her zaman mevcuttur. GBM’lerde endotelyal hiperplazi ve nekroz alanları mevcuttur. Bu iki değişiklik olmaksızın GBM tanısının konulmamalıdır.
AA’da ise artmış hücre yoğunluğu, sık mitotik figürler, atipik nükleer ve sitoplazmik morfoloji gözlenir ancak nekroz alanları mevcut değildir.
Histolojik özelliklerin bazılarının; nükleer değişkenlik, hücre dansitesi, endotelyal hiperplazi ve nekroz yaşam süresi üzerine anlamlı derecede etken olduğu gösterilmiştir.
Astrositlerin sitoplazmalarında bulunan glial fibriler asidik protein (GFAP), doğal olarak da astrositer tümörlerde de yüksek oranda saptanırlar. Ancak ileri derecede yüksek gradlı astrositer tümörlerde GFAP saptanmayabilir.
Son zamanlarda, “nükleolar organizer regions” (NOR’s)’ı gösteren gümüş boyaları ve Ki-67 proliferasyon indeksi histopatolojik incelemelerde rutin tetkikler haline gelmeye başlamışlardır. NOR’s nukleolusda bulunur ve genlerin transkripsiyonunun bir göstergesidir. Dolayısı ile AgNOR astrositik tümörlerde histolojik grad ile korelasyon gösterir.
Beyin tümörleri proliferasyon potansiyeli
Bazı proliferasyon göstergeleri, tümörün agresif davranışını öngörmede, alışılagelmiş histopatolojik tanı ve gradlama sisteminden daha çok bilgi vermektedir. Bugün için bu konuda ilgi daha çok düşük gradlı tümörler üzerinde yoğunlaşmıştır. Hoshino ve ark. tümörlerin histopatolojik olarak aynı olmasına karşın farklı proliferatif potansiyelleri olabileceğini ortaya koymuştur [23].
Bu amaç ile kullanılan tümör proliferasyon göstergeleri aşağıda özellikleri ile tartışılmıştır.
Mitotik figür sayısı
Mitotik indeks olarak da tanımlanan bu ölçüm, doku kesitlerinde rutin Hemotoksilin-Eosin boyası ile mitotik figürlerin basitçe sayımına dayanır. Bir mikroskobik alanda sayılabilen mitotik figür sayısı “mitotik indeks” olarak tanımlanır. Çoğu tümör ve glial tümörler dahil tümörlerde gradlama şemasını belirleyen en önemli özellik tanımlanabilir mitotik figürlerdir. Mitotik figürlerin apoptotik hücrelerden ve parçalanmış nükleuslarda tanımlanması kısmen subjektiftir. Aynı zamanda en malign tümörlerde bile mitotik figürler durmuş olabilir. Mitotik figür sayılması ile hücre siklusunda sadece M fazı tanımlanabilir.
H timidin
Bu yöntem, cerrahi öncesi tritium ile işaretlenmiş timidin’inhastaya sistemik yolla verilmesi ve radyoaktif pirimidin’in replike olan DNA’ya girmesi ile işaretlenmiş DNA’nın biopsi materyallerinde saptanması. Radyoaktif madde kullanımı bu tetkiki sınırlandıran en önemli etkendir.
Bromodeoksiüridin Iododeoksiüridin (BUdR-IUdR)
5 Bromodeoksiüridin halojene edilmiş timidin anloğudur. Hücre siklusunun S fazında DNA’a integre olur. Tıpkı H timidin gibi cerrahi öncesi hastaya BUdR’nin verilmesini gerektirir. Biopsi materyalinde. BUdR’e karşı monoklonal antikorlar standart immunuhistokimyasal metodlarla saptanır. BUdR işaretli indeksler tümör büyümesi, rekürens oranı, hasta yaşam sürei ile korelasyon gösterir. Direkt sistemik uygulama gerektirmesi yaygın kullanımını sınırlamaktadır. Gerekli olan doku miktarının fazla olması, suboptimal doku elde edilebilmesi de yine yaygın kullanımını engellemektedir.
Nükleolar organize edici bölgeler (NOR’s), ribozomal RNA genlerini enkode eden nükleolusda bulunan DNA loop’larıdır. NOR’s 13, 14, 15, 21 ve 22. kromozomların kısa kollarında lokalizedir. NOR’s ile birliktelik gösteren arginofilik nonhiston proteinler mevcuttur. Bu NOR’s ile birlikte olan proteinleri, interfaz nükleus da gösterebilen gümüş kolloid histolojik teknikler mevcuttur (AgNOR’s). Bu şekilde ortaya konulabilen proteinler RNA polimeraz 1, C 23 ve B 23 proteinleridir. AgNOR diğer göstergelerden farklı olarak hücre siklusunda 1 veya daha fazla faza sıkı bir şekilde bağımlı olan bir tetkik değildir. Tümör büyüme potansiyelini indirekt bir ölçümünü gösterir.
AgNOR smear örneklerinde, frozen kesitlerinde ve parafin kesitlerde kolaylıkla ve çabukça uygulanabilir. AgNOR sayısı ile glial tümörlerde histolojik grad arasında pozitif bir korelasyon gösterilmiştir. AgNOR tekniğinin standardizasyonunun çok kötü olması ve gözlemciler arası uyumsuzluk bu tetkiki sınılamaktadır.
Ki-67 / MIB 1
İlk defa 1983 tarihinde Hodgkin lenfoma hücre kültüründen derive edilen nükleer fraksiyon ile immünize edilmiş olan farelerde üretilmiş olan monoklonal bir antikordur. 395 kilodalton ağırlığında non-histon bir proteindir. Siklusun G1, S, G2 ve M fazlarındaki hücrelerinde bulunan nonhiston nükleer proteinde lokalize bir antijen olan Ki-67 epitopuna karşı gelişir. Bu proteinin tam olarak fonksiyonu bilinmemektedir. Ki-67 “labeling indeks” diğer proliferasyon indeksleri ile ve bir çok primer beyin tümöründe grad ile doğru korelasyon gösterir. Ki-67 düzeyine bakabilmek için mutlaka donmuş kesitler üzerinde çalışmak gerekmektedir. Bu kullanımını sınırlayıcı bir neden olarak karşımıza çıkmaktadır. Çünkü genellikle arşivlerde biopsi materyalleri parafin kesitlerde saklanmaktadır. Ancak son 10 yılda Ki-67 indeksini gösteren monoklonal antikorların (MIB I gibi) kullanılması bu dezavantajı ortadan kaldırmıştır. Monoklonal antikorlar rutin parafin bloklardan elde edilen kesitlerde
uygulanabilmektedir. MIB I labeling indeks de yine yapılan çalışmalarda beyin tümörlerinde yüksek grad ile korelasyon göstermiştir.
Beyin tümörlerinde malinite potansiyeli
Primer beyin tümörlerinde, lezyon lokalizasyonu, herhangi bir histolojik özellikden daha önemlidir. Sistemik kanserlerde tipik olan sistemik bulgular, kaşeksi, metastatik yayılımdan ziyade ölüm nedeni genellikle lokal rekürrensdir. Bu nedenlerden dolayı anaplastik astrositom ve glioblastoma multiforme sistemik kanser bulgularından yoksun olmakla birlikte, gerçek anlamda malign tümörlerdir.
Yakın zamana kadar 3 yıllık yaşam süresi GBM için %3, 5 yıllık yaşam süresi ise %0 olarak bildirilmekte idi. Ancak şimdi iyi dökümente edilmiş 10 yıllık yaşam süresi olan hastalar bile bildirilmiştir.
Malign astrositomlar hemen her zaman rekürrens gösterir. Genellikle de rekürrens, ilk lezyonun lokalizasyon yerinde olur ve ilk görüntüden daha yaygın bir patern gösterir. Araştırmalar göstermiştir ki rekürrenslerin büyük çoğunluğu orjinal lezyonun 2 cm’lik sınırları içinde meydana gelmektedir [24].
Malign astrositomların en sevdiği yayılım metodu, derin ak madde yolaklarının kullanılmasıdır. Özellikle de Korpus kallosumu kullanarak bir hemisferden diğerine yayılım gösterir ki bu da klasik “kelebek tarzı gliom” olarak tanımlanır.
Malin astrositomlarda metastatik yayılım alışılmamış bir durum olup olguların % 5’inde daha azında saptanır [25]. Bu metastatik yayılımı için klasik yayılım yolu ise serebrospinal sıvı iledir. Beyin sapı ve spinal kord sıklıkla metastatik yayılım bölgeleridir.
Ekstranöral metastazlar ise çok alışılmadık bir durum olup malin astrositer tümörlerde %1’den daha az sıklıktadır [26]. Tanımlanan bölgeler ise akciğerler, plevra, lenf nodları, kemik iliği ve karaciğerdir.
TEDAVİ
Cerrahi: Bennett ve Godlee tarafından 1884’de yapılan ilk başarılı beyin tümörü
tedavisinden bu yana malin astrositomaların tedavisinde cerrahi yöntemler halen ana tedavi modalitesidir. Ana amaç, beynin yapısal ve fonksiyonel bütünlüğüne mümkün olduğu kadar sağlayarak, mümkün olan en fazla beyin tümörü kitlesinin uzaklaştırılmasıdır.
Cerrahi aynı zamanda prognostik anlam kazanan dört ana unsurdan biri olarak saptanmıştır. Geniş rezeksiyon, hem pratikte hem de teorik olarak biopsiye oranla avantaj sağlamaktadır. Cerrahi ile mekanik olarak hücre azaltılması kemoterapiye veya radyoterapiye potansiyel dirençli tümör hücrelerinin de sayısının azaltılmasını sağlayacaktır.
Dikkatli preoperatif planlama ve ölçümler ile tümör lokalizasyonun tam yapılması, önemli anatomik yapılara komşuluğun hesaplanarak, minimal kortikal insizyon hattının seçilmesi şarttır.
Sterotaktik kraniotomi, intraoperatif elektrofizyolojik haritalama, intraoperatif Manyetik rezonans, son yıllarda özellikle sesli beyin bölgelerinde tümör sınırlarının
belirlenmesinde giderek daha yaygın olarak kullanılmaktadır. Rezeksiyon her yönde ödemli ak madde izleninceye kadar devam edilmelidir.
Malin astrositer tümörlerde, cerrahi sonrası morbidite ve mortalite oranlarında modern anestezi, mikroşirurjikal tekniklerin gelişimi, pre ve postoperatif steroid kullanımı ile belirgin azalma saptanmıştır. Morbidite oranı %5-10, otuz günlük mortalite ise %2-3 civarındadır [27].
Radyoterapi:
İyonize radyoterapi: serbest radikaller ve elektronlar vasıtası ile DNA heliksinde hasara yol açarak etkisini gösterir. DNA’da tek veya çift sarmalde kırıklara yol açar ki bunların bir kısmı endojen yollar ile tamire uğrar. Genel bir kural olarak, oksijenin moleküler düzeyde düşük olmasırelatif olarak iyonize radyasyona dirence yol açar. Astrositer tümörlerde özellikle santral bölgelerde oksijen basıncı düşüklüğü nedeni ile radyoterapiye direnç söz konusudur. Bununla birlikte malign astrositer tümörlerde cerrahiye eklenen adjuvant radyoterapinin beklenen yaşam süresinde yaklaşık 5 aylık bir uzama sağlamaktadır.
Brakiterapi: Son yıllarda, yüksek doz radyasyonun etraf dokuyu koruyarak, tümöre sınırlı bölgede radyasyon terapisinin uygulandığı bu metoda ilgi belirgin artmıştır. 40-100 radlık günler süren devamlı radyasyon terapisi reoksijenasyona ve dolayısı ile daha çok hücrede etki yapar. Özellikle rekürren lezyonlarda uygulanan bu tedavi en etkili radyoterapi şeklidir. Beklenen ortalama yaşam süresi 1 yılın üzerine çıkmaktadır.
Kemoterapi: Malign astrositer tümörlerde hücresel polimorfizmin çok olması ve
ilaçların artan dozlarında nörotoksite ortaya çıkması kemoterapinin etkinliğini sınırlar. BCNU ve CCNU gibi nitrozüre ilaçlar en çok denenen ancak anlamlı derecede yaşam süresini uzatmayan ilaçlardır.
Rekürren malign astrositer tümörlerde tedavi:
Rekürren malign astrositer tümörlerde bugün için en etkili tedavi yaklaşımları reoperasyon ya da interstisyel brakiterapidir. Yapılan çalışmalar göstermiştir ki her iki
tedavide de hastalara ek olarak yaklaşık 8-9 aylık bir yaşam süresi sağlanmaktadır. Genel yaklaşım olarak çoğu hastaya ek tadavi yapılmaksızın reoperasyon yaygın olarak tercih edilmektedir. Kötü prognostik beklentinin olduğu, bihemisferik yayılımın olduğu, intraventriküler yayılımı olan ya da BOS vasıtası ile uzak yayılımı olan malign astrositer tümörlerde ise ek tedavinin yaşam süresine etkisi belirgin değildir.
MATERYAL VE METOD
1998 Ocak- Mart 2004 tarihleri arasında Bakırköy Ruh ve Sinir Hastalıkları hastanesi 2. Nöroşirurji Kliniğinde cerrahi olarak tedavi edilen intrakranyal yerleşimli glial tümörlü tüm hastalar retrospektif olarak değerlendirildi. Bu süre içinde kliniğimizde 84 hasta astrositer kökenli glial tümör tanısı ile opere edildi. Seksen dört olgunun 68 tanesi patoloji sonucuna göre WHO grad III ve IV (anaplastik astrositom ve glioblastoma multiforme) olarak sınıflandırıldı. Onaltı olgu ise düşük gradlı astrositer tümör olarak takibe alındı ve bu çalışma dışında bırakıldı. 68 malign astrositer tümörlü hastanın 48’inin patolojisine ulaşıldı. Patolojik değerlendirmelerin tekrar yapılamadığı 20 malign astrositer tümörlü hasta çalışmadan çıkarıldı.
Kırk-sekiz yüksek grad astrositer tümörlü hastanın tümüne ait dosyalar retrospektif olarak değerlendirildi. Hastalara ilişkin demografik özellikler, kliniğe başvuru yakınması, başvuru öncesi klinik yakınmaların süresi, başvuru sırasındaki Karnofsky Performans Skalası her hasta için kayıtlandı.
Hastaların klinik yakınmaların başlangıcından hastaneye başvuruncaya kadar geçen süre 0-1 ay; 1-2 ay; 2-6 ay; 6-12 ay ve 12-24 ay olarak sınıflandırıldı.
Klinik başvuru yakınması; nöbet geçirme, nörolojik defisit, kafa içi basıncı artışı sendromu (KİBAS), veya KİBAS’a eşlik eden nörolojik defisit olarak sınıflandırıldı.
Hastaneye başvuru sırasındaki günlük yaşam aktivitesi için performans ölçümü için Karnofsky Performans Skalası kullanıldı. Karnofsky Performans Skalasına göre hastalar bağımlılık oranını gösteren “cut-off” değeri olan 70’in altı ve üstü olarak iki gruba ayrıldılar.
Tüm hastalara ait radyolojik tetkikler yeniden değerlendirilerek manyetik rezonanas veya Bilgisayarlı tomografi kesitlerinde ölçülebilen en geniş tümör çapı, kist mevcudiyeti, tümör etrafından ödem mevcudiyeti, orta hatta shift varlığı, tümörün kontrast tutumu her hasta için ayrı ayrı kayıtlandı.
Tüm hastalara uygulanmış olan tedavi modalitesi, cerrahi tedavi sonrası uygulanmış olan adjuvant tedaviler şu şekilde sınıflandırıldı: sterotaksi; sterotaksi + radyoterapi; cerrahi rezeksiyon; cerrahi rezeksiyon + radyoterapi. Rezeksiyon miktarını belirlemek için tüm hastalara erken dönemde Gd-DTPA’lı manyetik rezonans inceleme yapıldı. Rezeksiyon miktarı total rezeksiyon, subtotal rezeksiyon ve parsiyel eksizyon olarak gruplara ayrıldı. Bu sınıflama şu şekilde yapıldı.
Total gross-total rezeksiyon (tespit edilebilen rezidü tümör dokusu yok) Subtotal (başlangıçtaki tümör kitlesinden %10’undan daha az rezidü)
Parsiyel rezeksiyon (başlangıçtaki tümör kitlesinden %10’undan daha az rezidü) olarak tanımlandı.
Her hasta için hastaneden çıkarıldığı andaki klinik tablosu Glasgow Outcome Skalası kullanılarak belirlendi.
Grade 1: Ölüm
Grade 2: Persistan vejetatif durumda
Grade 4: Orta derecede dizabilite, günlük yaşam aktiviteleri için bağımsız durumda olma Grade 5: İyi derecede düzelme, minör defisite rağmen normal yaşamını sürdürebilir durumda olma.
Aynı şekilde hastaneden çıkış sırasındaki klinik tablo Karnofsky Performans Skalasına göre bağımlılığı gösteren 70 değeri altı ve üstü olarak tüm hastalar için kayıtlandı.
İlk yapılan cerrahi sonrası tekrarlanan operasyonlar kaydedildi. Tüm hastalara telefon ile ulaşılarak son durumları yakınlarından öğrenildi. Yaşayan hastaların son durumları Karnofsky skalasına göre 70 üstü ve altı olarak gruplandırılırken, ölüm gerçekleşmiş ise ilk operasyon sonrası yaşam süresi not edildi.
Patolojik değerlendirmeler için tüm hastaların retrospektif olarak patoloji piyeslerine ulaşılmaya çalışıldı. Toplam 48 olgunun patoloji piyeslerine ulaşıldı. 4-5 ‘luk parafin kesitler %3’lük hidrojen peroksit ile 15 dk yıkandı ve sonra PBS ile 5 dk. yıkandı. Primer antikorda (Ki 67 –Clone MIB I- Rabbit monoclonal antibody), Ki-67 (MIB I)’de 1 dk bekletildikten sonra PBS ile 10 dk., Biotinli Linkde 10 dk bekletildikten sonra PBS ile 5 dk, Streptavidin HRP’de 1 dk beklettikten sonra PBS ile 5 dk yıkandı. AEC/DAB solüsyonunda 5 dk beklettikten sonra 3 ayrı distile su kabında 5’er dk yıkandıktan sonra Mayer hemotoksilende 5 dk. bekletildikten sonra distile suda yıkandı. Amonyaklı su iardından distile su ile yıkandı ve gliserin jeli ile kapatıldı. Aynı patolog tarafından ortalama Ki-67 proliferasyon indeksi değerlendirildi.
İstatiksel hesaplamalar için yaygın olarak kullanılan ve bulunabilen SPSS programı (SPSS for Windows; version 10.0; SPSS, Inc., Chicago, IL) kullanıldı. Tüm hastalar için median yaşam süresi Kaplan Meier metodu kullanılarak elde edildi. Yaşam süresi; ölen hastalarda histolojik tanı anı ile ölüm arasında geçen süre hafta olarak, hasta halen yaşıyor ise histolojik tanı ile telefonla bilgi alıdığı süre arasında geçen süre hafta olarak hesaplandı. Her bir değişkenin yaşam süresi üzerine olan olası etkisi log-rank testi ile değerlendirildi. Multivariate analiz için basamaklı Cox regresyon analizi uygulandı. Araştırılan değişkenler şu
şekilde sıralanmıştır. 1) hastanın yaşı; 2) cins; 3) cerrahi öncesi ve sonrası Karnofsky performans skalası; 4) cerrahi rezeksiyon miktarı; 5) tümör lokalizasyonu; 6) tümör radyolojik özellikleri; 6) uygulanan tedavi modalitesi; 7) reoperasyon; 8) Ki-67 proliferasyon indeksi. Nümerik değişkenler için ANOVA, nominal ve ordinal değişkenler için Pearson 2 testi kullanılarak hesaplandı. P değeri 0.05’den düşük değerler istatistiksel olarak anlamlı olarak kabul edildi.
BULGULAR Klinik veriler:
Beş yıllık süre içinde toplam 48 hastanın tüm klinik bulguları, radyolojik incelemeleri, prognostik inceleme sonuçları ve patolojik piyeslerine ulaşıldı.
Olguların 21’i (%43,8) kadın ve 27’si (%56,2)si ise erkekti. Yaş ortalaması tüm hastalarda 54,12 (±15,18) olup hastaların yaşı 9 ila 79 arasında değişmektedir. Yaş ortalaması kadınlarda 51,52 (9-74 arasında), erkeklerde ise 56,15 (32-79 arasında) idi (Şekil 1).
Şekil 1: cinsiyete göre yaş dağılımı.
27 21 N = cinsiyet erkek kadin Y A S 100 80 60 40 20 0 19
Hastaların ilk klinik şikayetlerinden hastaneye başvuruya kadar geçen süre olguların yarısından fazlasında 2 ay gibi kısa bir süre iken , %90’nında ise sadece 8 aydı. Başvuruya değin geçen süre tablo 1 de gösterilmiştir.
Tablo1: ilk klinik şikayet ile başvuru arasında geçen süre Süre n % 0-1 ay 13 27,1 1-2 ay 14 29,2 2-6 ay 12 25 6-12 ay 8 16,7 12-24 ay 1 2,1
Başvuru şikayetleri incelendiğinde en sık başvuru şikayetinin KİBAS olduğu dikkati çekmiştir. Olguların 1/3’ünde tek şikayet KİBAS bulguları iken ¼’ünde ise KİBAS bulguları nörolojik defisite eşlik etmekte idi. Başvuru klinik bulgusu tablo 2’de özetlendi.
Tablo 2: Başvuru yakınması
Şikayet n %
KİBAS 15 31,3
KİBAS + nörolojik defisit 12 25
Nörolojik defisit 13 27,2
Epileptik nöbet 8 16,7
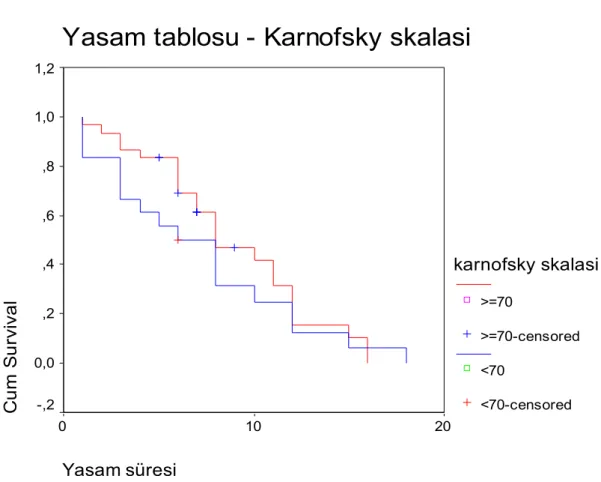
Hastaneye başvuru sırasındaki klinik durum ağırlığı Karnofsky skalasına göre olguların 18’inde (%37,5) 70’in altında olarak bağımlılık göstermekte idi. 30 olguda ise (% 62,5) Karnofsky skalası 70 veya üzerinde idi.
Radyolojik incelemede tümör dokusunun lokalizasyon, boyutu, kistik yapı, orta hatta şift, ödem varlığı, kontrast tutum mevcudiyetine ilişkin bulgular tablo 3’de özetlendi.
Tablo 3: Radyolojik özellikler
n % Lokalizasyon Sesli bölge 19 39,6 Sessiz bölge 29 60,4 Kontrast tutumu Var 46 95,8
Yok 2 4,2
Orta hatta şift
Var 33 68,8
Yok 15 31,2
Kistik yapı
Var 13 27,1
Yok 35 72,9
Tablo 3 radyolojik özellikler (devamı) Ödem varlığı
Var 48 100
Yok 0 0
Kitle en geniş çapı ortalama 4,2 cm (1-10 cm arası)
Olguların 4’ü (%8,3) sterotaksik biopsi yapıldıktan sonra gözleme alındı. Biri sterotaksik biopsi sonrası radyoterapi, 13’ünde cerrahi tedavi sonrası gözlem, 30’unda ise (% 62,5) cerrahi tedavi ve adjuvant tedavi olarak da radyoterapi uygulandı.
Postoperatif dönemde yapılan BT veya MR incelemesinde olguların 27 sinde (% 56.3) total rezeksiyon, 15 inde (%31.3) subtotal rezeksiyon, 1 inde ise parsiyel rezeksiyon uygulanırken, 5 inde (%10.4) sadece sterotaksi uygulanmıştı.
Hastaların hastaneden taburcu edildiklerindeki klinik durumlarını gösteren Glaskow Outcome Skalasına göre tablo 4’de özetlendi.
Tablo 4: Hastaneden çıkış sırasında Glasgow Outcome Skalası
GOS n % 1 1 2,1 2 1 2,1 3 6 12,5 4 13 27,1 5 27 56,3
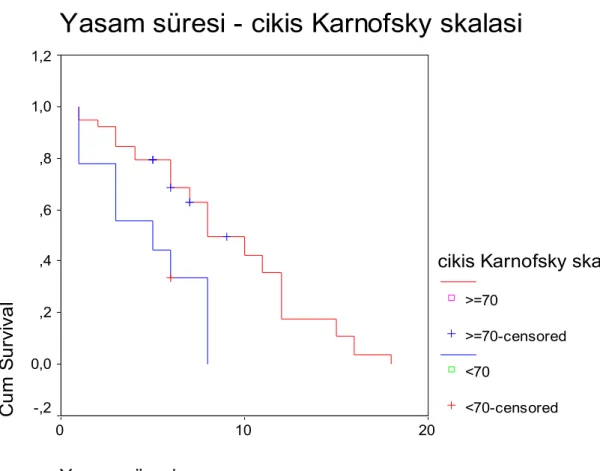
Hastaneden çıkış esnasında, Hastaların bağımlılık düzeyini gösteren Karnofsky skalasına göre, 9 u (%18,8) 70 in altında iken, 39 u ise (%81,2) 70 veya üzerinde olarak bağımsızdı.
Hastaların 11 ine (%22,9) en az bir kez daha operasyon uygulandı.
Hastaların 31 i (%64,4) yapılan girişim sonrası –cerrahi rezeksiyon veya sterotaksi-radyoterapi tedavisi almıştı. Geri kalan hastalarda ise girişim sonrası hasta adjuvant tedavi almaksızın takibe alınmıştı.
Patolojik piyeslerin incelenmesinde Ki-67 indeksi ortalaması 22.98 (± 9.46) olarak hesaplandı. Ki-67 endeks değerleri minimum 8 ve maksimum 50 arasında değişmekte idi.
Ortalama izlem süresi ilk hastanın çalışmaya alınmasından itibaren geçen süre 65 ay, son hastanın izlem süresi ise 5 aydı. Olguların 40’ı (%83.3) çalışma süresi içinde ölmüştü. 8 hasta ise halen yaşamakta idi.
Tüm hastalarda yaşam eğrisi şekil 2 de gösterildi. Ortalama yaşam süresi 7.5 ay’dı.
Şekil 2: Tüm hastalarda yaşam eğrisi
Yasam süresi
Yasam süresi 20 10 0 C u m S u rvi va l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2 Yasam egrisi Censored Univariate analizler:Univariate analiz sonuçları tablo 5 de özetlendi.
Tablo 5: Faktörlerin yaşam süresine etkileri; Univariate analiz sonuçları Ortalama yaşam süresi p
Cins
kadın 5,67 (± 3,45) 0,01*
erkek 8,93 (± 4,41)
Yaş 0,05*
Başvuruya kadar geçen süre 0,27
Karnofsky skalası
<70 6,89 (± 4,96) 0,41
Lokalizasyon sesli bölge 7,42 (± 5,11) 0,37 sessiz bölge 7,55 (± 3,78) Kist var 7,92 (± 5,41) 0,64 yok 7,34 (± 3,90) Şift var 8,03 (± 4,39) 0,12 yok 6,33 (± 3,99) Kontrast tutulumu var 7,41 (± 4,22) 0,82 yok 9,50 (± 7,78) Kitle boyutu 0,16 Tedavi gruplar sterotaksi 3,60 (± 1,52) 0,004* cerrahi 7,95 (± 3,95) Total rezeksiyon 8,50 (± 2,69) 0,03* Subtotal/parsiyel rez. 6,33 (± 3,65) Tablo 5 devamı Cerrahi 5,85 (± 4,45) 0,04* Cerrahi + RT 8,87 (± 3,96) Çıkış Karnofsky skalası <70 4,56 (± 2,70) 0,005* >70 8,18 (± 4,34) Reoperasyon var 9,64 (± 3,64) 0,05* yok 6,86 (± 4,32) Ki-67 ≤ 20 7,38 (± 3,88) > 20 7,58 (± 4,68) 0,63
* İstatistiksel olarak anlamlı
Cins: Univariate analizlerde erkek cinsde yaşam süresi ortalaması 8.93 ay olarak, kadınların
ortalama yaşam süresine oranla (5.67 ay) istatistiksel olarak anlamlı bir şekilde daha uzundu (p=0.01). Her iki cins için yaşam eğrileri şekil 3 de gösterildi.
Şekil 3: Cinse göre hastaların yaşam eğrisi
Yasam tablosu - cins
Yasam süresi 20 10 0 C u m S u rvi va l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2 cinsiyet erkek erkek-censored kadýn kadýn-censored
Yaş: Hastaların yaşları arttıkça ortalama yaşam süresinin azaldığı dikkati çekiyordu. Bu
durum istatistiksel olarak da anlamlılık kazanmakta idi n (p=0.05).
Kliniğe başvuru süresive başvuru yakınması: Başvuruya kadar geçen sürenin ve başvuru
yakınmasının yaşam süresi üzerine etkisi olmadığı izlendi.
Başvuru sırasındaki Karnofsky performans skalası
: Hastaneye başvuru sırasında hastaların
gözlenmiştir (sırası ile 6.89 ay, 7.87 ay, p=0.41). Karnofsky skalasına göre yaşam eğrileri şekil 4 de gösterilmiştir.
Şekil 4: Hastaneye başvuru sırasında Karnofsky skalasına göre yaşam eğrisi
Yasam tablosu - Karnofsky skalasi
Yasam süresi 20 10 0 C u m S u rviva l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2 karnofsky skalasi >=70 >=70-censored <70 <70-censored
Radyolojik özellikler: Radyolojik olarak tümörün yerleşim yerinin sesli ya da sessiz olması,
kist olup olmaması, radyolojik şift varlığı, tümörün kontrast tutup tutmadığı ve kitle boyunun yaşam süresi üzerine univariate analizlerde etkisi olmadığı izlendi.
Tedavi protokolleri: Uygulanan tedaviye göre yaşam süreleri incelemesinde steotaksi
uygulanan hastalarda yaşam süresi ortalama 3.6 aydı. Bu süre cerrahi uygulanan hastalarda ise ortalama 7.95 aydı ve istatistiksel olarak strotaksi uygulanan hastalara göre anlamlı derecede daha uzundu (p=0.004). bu iki grup için yaşam eğrileri şekil 5 de gösterilmiştir.
Şekil 5: Uygulanan tedaviye göre hastaların yaşam eğrisi (sterotaksi-cerrahi)
Yasam tablosu - tedavi grubu
Yasam süresi 20 10 0 C u m S u rv iv a l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2 TEDAVIGR cerrahi cerrahi-censored stx stx-censored
Postoperatif değerlendirmeler ile total rezeksiyon yapıldığı saptanan hastalardaki yaşam süresi daha az rezeksiyon yapılan hastalara oranla anlamlı derecede uzundu (p=0,03)
Sterotaksi uygulanan hastalar değerlendirme dışı bırakılarak sadece cerrahi uygulanan hastalarda cerrahi sonrası adjuvant tedavi uygulanmasının yaşam süresini etkileyip etkilemediği değerlendirildi. Adjuvant tedavi olarak hastaların 30’u (% 69.8) cerrahi sonrası radyoterapi alırken, 13 ü ise (% 30.2) cerrahi sonrası takibe alınmıştı. Bu iki grup arasında
istatistiksel olarak anlamlı bir şekilde yaşam süresi farklı idi (sırası ile 8.87 ay ve 5.85 ay, p=0.04). (Şekil 6)
Şekil 6: Radyoterapi uygulanan ve uygulanmayan hastaların yaşam eğrisi
Yasam süresi - ek adjuvant tedavi
Yasam süresi 20 10 0 C u m S u rviva l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2 ek adjuvant tedavi cerrahi+radyoterapi cerrahi+radyoterapi -censored cerrahi cerrahi-censored
Hastaneden çıkış sırasındaki Karnofsky performans skalası: Hastaneden çıkış sırasında
Karnofsky skalasına göre bağımlı olan hastaların ortalama yaşam süresi 4.56 ay iken bağımsız yaşayanların ortalama yaşam süresi ise 8.18 aydı. Bu fark istatistiksel olarak anlamlı idi (p=0.005) [şekil 7].
Şekil 7: Hastaneden taburculuk sırasında Karnofsky skalasına göre yaşam eğrisi
Yasam süresi - cikis Karnofsky skalasi
Yasam süresi 20 10 0 C u m S u rvi va l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2
cikis Karnofsky skal
>=70
>=70-censored <70
Reoperasyon: Yeniden opere edilen hastaların ortalama beklenen yaşam süresi 1 kez opere
edilenlere göre istatistiksel olarak anlamlı derecede uzundu (p=0.05). Birden fazla sayıda operasyon geçiren hastalarda beklenen yaşam süresi diğer hastalara oranla yaklaşık 3 ay daha uzundu. [şekil 8].
Şekil 8: Reoperasyon uygulanan hastalarda, bir kez opere edilen hastalara göre yaşam eğrisi
Yasam tablosu - reoperasyon
Yasam süresi 20 10 0 C u m S u rv iv a l 1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2 reoperasyon yok yok-censored var var-censoredKi-67 (MIB I indeks): Olguların 21 inde (%43,8) Ki-67 proliferasyon indeksi 20 ya da
altında iken 27 sinde (%56,2) ise %20’nin üzerinde idi. Patolojik inceleme sonrası ortaya konulan Ki-67 proliferasyon indeksi değerleri ile yaşam süresi arasında ilişki saptanamadı (p=0.63).
Ki-67 (MIB I indeks - yasam egrisi)
Yasam süresi
20 10 0C
um
S
ur
vi
va
l
1,2 1,0 ,8 ,6 ,4 ,2 0,0 -,2Ki-67 (MIB I indeks)
21-50
Şekil 10: Ki-67 (MIB I) ile boyanmış patoloji görüntüsü. (x125 büyütme)
Şekil 11: Ki-67 (MIB I) ile boyanmış patoloji görüntüsü. (x310 büyütme)
Multivariate analiz (çok yönlü analizler):
Multivariate analizler ile faktörlerin birbirleri üzerine olan muhtemel etkileri ortadan kaldırıldığında, cinsiyet, yaş ve uygulanan tedavi prosedürünün yaşam süresi üzerine etkili olduğu saptandı.
Çoklu değişken analizleri sonucunda da kadın cinsde beklenen yaşam süresinin istatistiksel olarak anlamlı bir şekilde daha kısa olduğu izlendi (p=0,05).
Hasta grubumuzda yaş arttıkça hastaların yaşam süresinin kısaldığı ortaya konuldu (p=0,05)
Son olarak da cerrahi uygulana hastalarda sterotaksi uygulanan hastalara göre yaşam süresi istatistiksel olarak anlamlı bir şekilde daha uzundu (p=0,006).
Diğer faktörlerin ise multivariate analiz sonuçlarına göre yaşam süresi üzerine etkili olmadığı saptandı. Multivariate analiz sonuçları tablo 6’da gösterildi.
Tablo 6: Faktörlerin yaşam süresine etkileri; Multivariate analiz sonuçları
p %95 CI Cins 0,05* 1 - 4,46 Yaş 0,05* 1 - 1,05 Uygulanan tedavi 0,006* 2,67 - 33,20 (sterotaksi-cerrahi) Rezeksiyon miktarı 0,08 0,7 - 4,06 Çıkış Karnofsky skalası 0,17 0,69 - 7,73 Adjuvant tedavi 0,52 0,53 - 3,45 (cerrahi-cerrahi+RT) Reoperasyon 0,76 0,39 - 2,00 Ki-67 0,32 0,98 - 1,06
*istatistiksel olarak anlamlı
TARTIŞMA
Anaplastik astrositoma ve glioblastoma multiforme erişkin yaş grubunda en sık saptanan ve hemen her zaman fatal seyirli primer beyin tümörleridir. Malign astrositer tümörler özellikle 50-60 yaşlarında pik yapar ve bu dönemde saptanan tüm primer beyin tümörlerinin de yarısını oluştururlar. 1970’li yıllar ile 1990’lı yıllarda yapılan insidens çalışmaları gözden geçirildiğinde ABD ve Kanada’da özellikle yaşlı populasyonda insidensin arttığı ve malign astrositer tümörlerin ciddi bir sorun olduğu izlenir. Mao ve arkadaşlarının
yaptığı bir çalışmada 1969’dan 1985’e kadar Kanadalı yaşlı nüfusda GBM sıklığının %100’e yakın artış gösterdiği izlenmiştir ki bu durum görüntüleme yöntemlerinin gelişmesi ile tümör saptanabilme oranının artışı ile açıklanamayacak kadar yüksektir [16].
İnsidensi artış gösteren her zaman fatal seyirli bir hastalık olarak, tüm modern tedavi modalitelerine karşın ortalama beklenen yaşam süresi konvansiyonel cerrahi ve radyoterapi sonrası 1 yıl civarındadır [19,28-34]. Bizim çalışmamızda da ortalama yaşam süresi 7,5 ay olarak hesaplanmıştır. Serimizde sadece sterotaksi uygulanan hastalar olması ve radyoterapinin adjuvant tedavi olarak verilmediği, yalnız cerrahinin uygulandığı olgular olması dolayısı ile yaşam süresinin kısmen daha az olduğunu düşünüyoruz. Ortalama yaşam sürelerinin, malign astrositer tümörlerde son 20 yılda belirgin derecede artış gösterdiği izlenmektedir. Salcman tarfından yapılan bir derlemede, 1980 öncesi literatürden toplanan 1561 olgunun yaşam eğrisi ile 1980 sonrası toplanan 1558 olgunun yaşam eğrisi karşılaştırıldığında, yaşam eğrisinin “curve”’inde bir farklılık izlenmez iken yaşam sürelerinin uzadığı gözlenmiştir [33,35]. Buna karşılık bazı hastalarda median yaşam süresinin uzun bazılarında ise daha kısa olmasının altında yatan nedenlerin araştırılması ve yaşam süresi üzerine etki eden faktörlerin ortaya konulması, bu fatal seyirli hastalığın doğasını ve biyolojik davranışının anlaşılmasını sağlamaya hizmet edecektir.
Son 10 yılda, gerek klinik, radyolojik özellikler gerekse tedavi modalitelerinin prognoz üzerine bağımsız etkisi çok sayıda çalışmada incelenmiş ve ortaya konulmaya çalışılmıştır. Günümüze kadar yapılan çalışmalarda en önemli prognostik gösterge tanı anındaki yaşdır. Tanı anındaki yaş ne kadar düşük ise prognoz da o kadar iyidir. Aynı zamanda tanı anındaki performans durumu, tümör lokalizasyonu, tümör boyutları, tümör histolojik tipi, cerrahi rezeksiyon miktarı, reoperasyon, cerrahi tedaviye ek olarak verilen adjuvant tedavinin de prognozu direkt olarak etkilediğine dair çok sayıda literatür mevcuttur [19,28,36-49]. Tüm bunlar birbirleri ile de direkt ilişkili olduğundan bağımsız etkilerinin ortaya çıkarılabilmesi için multivariate (çok yönlü) analiz yapılması şarttır.
Son yıllarda ise dikkat, klinik ve radyolojik özelliklerden çok moleküler genetik ve moleküler biyoloji üzerine yoğunlaşmıştır. Bir çok moleküler değişken prognostik anlam taşıma açısından incelenmiş ancak moleküler genetik üzerine üzerinde konsensus oluşmuş bir sonuç elde edilememiştir. Anneksin 7 ekspresyonu, p 53 ekspresyonu, MIB I labeling indeks ile yapılan çalışmalardaki sonuçlar da çelişkilidir.
Cins: Malign astrositer tümörler ile yapılan hemen her insidens çalışmasında erkek
cins lehine bir baskınlık söz konusudur [50,16]. Fransa’dan Trouillas ve ark. nın yaptığı bir çalışmada Glioblastoma multiforme için bu oran erkek lehine 1.66 olarak saptanmıştır [50]. Bizim çalışmamızda da erkek/kadın oranı 1.29 olarak literatür ile uyumludur. Cinsin prognoz üzerine etkisi çok üzerinde durulmayan bir durumdur ve genellikle yaşam süresini değiştirmediği ifade edilir [29]. Çalışmamızda erkek cins hakimiyeti olmasına karşılık yaşam süresi kadın cinsde istatistiksel olarak anlamlı bir şekilde daha kısa idi. Erkek cins oratalama 3 ay daha uzun yaşamakta idi (p=0,01). Bu bulgu çok değişkenli analizde bile devam etmekte idi. Yine ASCO 2004 yılı yıllık toplantısında Gorlia ve ark. Erkek cins ile kötü prognoz arasında ilişki göstermişler ancak bu durumun serilerinde erkeklerde tümörün daha fazla multiple olması ile açıklamışlardır [38]. Yine erkek cins ile kötü prognoz arasında ilişki saptayan çalışmalar literatürde saptanmıştır [51,52]. Johns Hopkins hastenesinden Reavey-Cantwell ve ark.nın bir yayınında ise kadın cinsde anlamlı derecede yaşam süresinin daha kısa olduğu ifade edilmiştir [53]. Bizim serimizde de saptanan bu durumu açıklayacak bir neden saptayamadık.
Yaş: Hemen tüm literatürde ortak nokta malign glial tümörlü hastalarda yaşın en
önemli prognostik faktör olduğudur [19,28-30,32,33,51,54,55]. Genç hastalarda yaşam süresi daha uzun olarak saptanmaktadır. Bizim çalışmamızda da yaş önemli bir prognostik göstergedir (p=0,05). Hastalarımzdaki yaş ortalaması 54 olup genel literatür ile uyum göstermektedir. Yaşlı nüfusda immun kompetansın düşük olması ve genel olarak da cerrahiye eklenen adjuvant tedaviye direnç gelişmesi muhtemel nedenler olarak sayılabilir.
Başvuru yakınması ve başvuruya kadar geçen süre: Olgularımızın yaklaşık 1/3’ü ilk
yakınmadan sonra 2 ay içinde hastanemize başvurmuştu. Biri hariç tümünde ise bu süre 1 yılı aşmıyordu. Hastalarımızın %17’sinde epileptik nöbet saptanırken yarısından fazlasında KİBAS bulguları vardı. Genel literatürde belirtildiği gibi tümör tarafından oluşturulan volümetrik genişlemenin beyin kompansatuar mekanizmasını aşması ile oluşan başağrısı en sık semptom olarak ortaya çıkmaktadır [56]. 1-2 ay süre içinde hızlı nörolojik kötüleşme, agresif gidişli bir primer beyin tümörünü işaret ederken, 1 yılı aşkın süre ile oluşan ve nöbet öyküsünün tek yakınma olarak saptandığı hastalarda ise düşük grad astrositer tümörlerden sekonder gelişen GBM’i işaret eder ki bu da iyi prognostik olarak izlenmiştir [32,56-58]. Bizim çalışmamızda ise ne sürenin ne de klinik tablonun yaşam süresi üzerine etkisi saptanmadı.
Performans durumu: Çalışmamızda hastaların performansı Karnofsky performans
Skalasına (KPS) göre ölçütlendi. KPS’de 70 değeri “cut off” değeri olarak hastaların başkalarına bağımlılığını göstermektedir. Literatür çalışmaları çoğunlukla bu değeri sınır olarak ele alırken az sayıda çalışmada ise bu sınır 80 olarak alınmıştır. Değerlendirmeler genellikle pre ya da postoperatif olarak değerlendirilirken biz çalışmamızda hem operasyon öncesi hem de operasyon sonrası KPS kayıtlanmıştır. Hastalarımızın küçük bir kısmı postoperatif dönemde bağımlı yaşarken bu hastalarda yaşam süresinin anlamlı derecede kısa olduğu izlendi (p=0,005). Bu anlamlılık multivariate analizde de devam etmekte idi. Preoperatif performans skalasının ise prognoz üzerine etkisi yoktu. Genel literatürde de KPS’nin prognozu kötü yönde etkilediği yönde çok sayıda çalışma mevcuttur [19,29,37,39,40,52,59-62]. Malign astrositer tümörlü hastalarda primer ölüm nedeni herniasyon olmakla beraber, bağımlı olan hastalarda pulmoner emboli, infeksiyon gibi sekonder ölüm nedenlerinin de sık olacağı beklenmelidir.
Lokalizasyon: sesli ve sessiz beyin bölgelerinden kaynaklanan beyin tümörlerinde
çalışmada parenkimal tümör nedeni ile kraniotomi yapılan 400 hasta incelenmiş ve operasyon sonrası hastada tespit edilen yeni nörolojik defisit için en önemli risk faktörünün tümörün gradı olduğunu göstermiştir [63]. Bu nedenledir ki sessiz beyin bölgelerinde daha agresif rezeksiyon gerçekleştirilir. Sesli beyin bölgelerinde ise sınırlı rezeksiyona gidilmektedir. Lacroix ve ark.’nın yaptığı ve yalnız GBM tanısı alan 416 hastayı içeren bir çalışmada ise sesli beyin bölgelerinin tutulmasının prognozu kötü yönde etkilediği univariate analizlerde gösterilmiş ancak bağımsız bir faktör olarak ortaya konulamamıştır [19]. Bizim çalışmamızda sesli ve sessiz beyin bölgelerini tutan malign astrositer tümörler için yaşam süresinde bir farklılık izlenmedi.
Radyolojik özellikler: Yaşam süresi üzerine iyi tanımlanmış klinik değişkenler
yanında radyolojik özellikler de son dönemlerde sıklıkla prognostik olarak tanımlanmıştır. Glial tümörlü tüm hastalarda bugün için preoperatif MR çekimi yapıldığından radyolojik değerlendirmelerde MR bulguları kriter olarak alınmaktadır. MR incelemede tümörde kontrast tutulumu hastaların 46’sında (%95,6) saptanmış olup bu nedenle prognostik anlamlılık için istatistiksel çalışma yapılamamıştır. Tümör kitlesinin kontrast tutulumu göstermesi ve kontrast tutulum yoğunluğu, kan beyin bariyerinin yıkımını gösterir. Aynı zamanda patolojik neovaskülarizasyon ve endotelyal proliferasyon oranı da kontrast tutulumu ile ilintilidir [64]. Bu nedenle kontrast tutulumunun kötü prognoz ile ilişkisi olması beklenebilir ve direkt tümör anjiogenezisi ile alakalıdır. Hammoud ve ark. GBM’de tümör nodülünün kontrast tutum oranının kötü prognostik olduğunu ortaya koymuştur [47]. Yine literatürde kontrast tutma paterni olarak halkasal kontrast tutumunun prognoz üzerine etkisi kötü olarak ortaya konulmuştur [44].
Malign astrositer tümörlerde MR’da tümör etrafında T2 ağırlıklı kesitlerde değişken miktarda hiperintens alan tespit edilir ki bu peritümöral ödem alanı olarak adlandırılır. Bu ödem miktarının volumüne göre sınıflandıran çalışmalarda, ödem miktarının azlığını gösteren düşük grad ödemli hastalarda prognozun daha iyi olduğu söylenmiştir. Lacroix ve arkadaşları
da bunu ortaya koymuştur [19]. Yaptığımız çalışmada ödem tüm olgularda değişken miktarlarda mevcut olarak saptanmış olmakla beraber bunun volumetrik incelemesi yapılmamış ve bu nedenle değerlendirmek mümkün olmamıştır.
Tümör büyüklüğünün çalışmamızda, yaşam süresi üzerine etkisi olmadığı gözlenmiştir (p= 0,16). Bu konudaki beklenti tümör volumünün yüksek olması ile klinik tablonun kötülüğü arasında ilinti olması dolayısı ile yaşam süresinin daha kısa olmasıdır. Ancak çalışmalar göstermiştir ki genellikle tümör volumü ile yaşam süresi arasında ilişki yoktur [19]. Bu hastalarda Karnofsky performans skalasının iyi prognostik olmasına karşılık tümör volumünün etkisi yoktu.
Orta hat şifti, tümör volüm ve ödem miktarı ile doğrudan ilişkili olarak meydana gelir ve kötü prognostik olarak tahmin edilir. Buna karşılık bu konuda literatür yetersizdir. Muacevic ve ark. orta hatta şift etkisi olan hastalarda cerrahi rezeksiyon sonrası hem yaşam süresinde hem de kaliteli yaşam süresinde iyileşme gözlemlemişlerdir [59]. Olgularımızın 33’ünde (%69) orta hatta şift vardı ve orta hat şifti ile yaşam süresi arasında ilişki gözlenmedi. Lacroix ve ark. kitle etkisi ile prognoz arasında ilişki saptamamış ancak Gamburg ve ark 2000 yılında orta hat şiftinin prognoz üzerine etkisini incelemiş ve 219 hastada şift mevcudiyetinde yaşam süresinin azaldığını göstermişlerdir. Bu olgularda şift varlığı olan %80 hastaya dekompresif tümör operasyonu uygulanmasına karşılık kötü prognostik özellik devam etmiştir [37].
Tedavi modalitesi: Malign astrositer tümörlü hastalarda, ilk beyin tümör
cerrahisinden bu yana primer tedavi yöntemi cerrahidir. Mekanik olarak tümör hücre kitlesinin azaltılması hücre sayı azaltmakta en çabuk ve en etkili yöntemdir. Bu aynı zamanda, postoperatif dönemde radyoterapi veya kemoterapiye hassas hücre sayısında da artışa neden olur. Hoshino ve ark. nın bir çalışmasında basının ortadan kalkması ile tümör merkezinde ki hücrelerde kemoterapi ve radyoterapiye hassasiyet artmıştır [23]. Bu nedenler ile sitoredüksiyonun en az gerçekleştiği sterotaksik biopsi yapılan hastalarda beklenen yaşam