YENİLEBİLİR BAZI MAKROMANTAR TÜRLERİNİN İN VİTRO SİTOTOKSİK ÖZELLİKLERİNİN İNCELENMESİ
Sevim KOL Yüksek Lisans Tezi Biyoloji Anabilim Dalı
Moleküler Biyoloji ve Genetik Programı Yrd. Doç. Dr. Gökhan SADİ
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
YENİLEBİLİR BAZI MAKROMANTAR TÜRLERİNİN İN VİTRO SİTOTOKSİK ÖZELLİKLERİNİN İNCELENMESİ
YÜKSEK LİSANS TEZİ Sevim KOL
Anabilim Dalı: Biyoloji
Programı: Moleküler Biyoloji ve Genetik Programı
Tez Danışmanı: Yrd. Doç. Dr. Gökhan SADİ
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i ÖZET
Yüksek Lisans Tezi
YENİLEBİLİR BAZI MAKROMANTAR TÜRLERİNİN İN VİTRO SİTOTOKSİK ÖZELLİKLERİNİN İNCELENMESİ
Sevim KOL
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyoloji Anabilim Dalı
Danışman: Yrd. Doç. Dr. Gökhan SADİ Nisan, 2016, 99 Sayfa
Bu çalışmada, Lepista nuda, Lycoperdon molle, Craterellus cornucopioides, Leucoagaricus
leucothites, Laccaria laccata ve Armillaria mellea'nın in vitro sitotoksik, antioksidan ve
antimikrobiyal aktiviteleri araştırılmıştır. Mantarların biyoaktif içerikleri (toplam fenolik, toplam flavonoid, β-karoten ve likopen içeriği), DPPH serbest radikal yakalama ve indirgeme gücü aktiviteleri test edilmiştir. En yüksek toplam fenolik asit miktarı her iki ekstrede de L.
molle (Su; 57,12 µg/mg, metanol; 59,52 µg/mg) olarak belirlenmiştir. En yüksek β-karoten
içeriğini su ekstresinde L. molle (3,990±0,091 µg/mg) ve metanol ekstresinde L. nuda (7,697±0,164 µg/mg) göstermiştir. En yüksek likopen içeriği ise su ekstresinde C.
cornucopioides (2,492±0,009 µg/mg), metanol ekstresin de L. nuda'da (6,643±0,135 µg/mg)
belirlenmiştir. Flavonoid miktarının en fazla olduğu tür metanol ekstresinde C. cornucopioides (1,83 µg/mg), su ekstresinde ise L. molle (4,061 µg/mg)’dir. DPPH yakalama aktivitelerine göre en yüksek etkiyi L. molle'nın metanol ekstresi göstermiştir. Antimikrobiyal test sonuçlarına göre en fazla etki L. nuda'nın su ekstresinde, HepG2 hücre canlılığı üzerine en yüksek etkiyi ise L.
laccata türünün su ekstresi göstermiştir. Sonuç olarak çalışılan türlerin tamamının belirli
oranlarda antioksidan özelliğe sahip olduğu, L nuda'nın su ekstresinin bütün mikroorganizmalar üzerinde olmamakla beraber en yüksek antimikrobiyal etkiyi gösterdiği ortaya çıkarılmıştır. HPLC ile gerçekleştirilen analizlerde mantar türlerinin hepsinde en yüksek oranda bulunan fenolik asitlerin kumarik asit ve gallik asit oldukları, L. molle metanol ve su ekstresinde p-kumarik asit, L. leucothites ekstrelerinde ise gallik asit yüksek oranda tespit edilmiştir. Sonuç olarak bu çalışmada incelenen mantar türlerinin insan vücudunda çeşitli metabolik faaliyetler sonucu meydana gelen hücre hasarını azaltabilecekleri ve zararlı mikroorganizmaları inhibe edebilecekleri belirli oranlarda HepG2 ve MCF-7 gibi hücrelere karşı sitotoksik etkiye sahip oldukları belirlenmiştir.
Anahtar Kelimeler: Makromantar, Sitotoksite, Antioksidan, Antimikrobiyal, HepG2
ii ABSTRACT
Ms Thesis
EVALUATION OF IN VITRO CYTOTOXIC PROPERTIES OF SOME EDIBLE MACROFUNGI
Sevim KOL
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Biology
Supervisor: Assist. Prof. Dr. Gökhan SADİ April, 2016, 99 pages
Antioxidant, antibacterial and in vitro cytotoxic protperties of Lepista nuda, Lycoperdon molle,
Craterellus cornucopioides, Leucoagaricus leucothites, Laccaria laccata and Armillaria mellea
was evaluated in this study. Bioactive ingredients of macrofungi (total phenolics, total flavonoids, β-carotene and lycopene), DPPH radical scavenging activities and reducing powers were determined. L. molle (water; 57,12 µg/mg, methanol; 59,52 µg/mg) were determined to have highest phenolic contents. Highest β-caroten contents were present in the aqueous extracts of L. molle (3,990±0,091 µg/mg) and methanolic extracts of L. nuda (7,697±0,164 µg/mg). Water extracts of C. cornucopioides (2,492±0,009 µg/mg) and methanolic extratcs of L. nuda (6,643±0,135 µg/mg) contains the top levels of lycopene contents among the others.Water extracts of C. cornucopioides (1,83 µg/mg) and methanolic extracts of L. molle (4,061 µg/mg) contains the largest amount of flavonoid as compared to other macrofungi. L. molle methanol extracts revealed the highest DPPH radical scavenging activities. Water extracts of L. nuda was the most effective agaist microorganisms and L. laccata was the most cytotocic macrofungi against HepG2 cell growth. As a result, all the studied macrofungi has some degree of antioxidant potential and antibacterial activities of L. nuda was superior over the other species. HPLC analysis revealed that p-coumaric acid and gallic acid were the most predominatig phenolics in studied macrofungi and both aqueous and methanolic extracts of L. molle contains very high p-coumeric acid levels. Besides, high amount of gallic acid were determined in both extracts of L. leucothites. In summary, this study revealed that aforementioned macrofungi species would reduce the cellular damages as a result of free radicals, inhibit the growth of pathogen microrganisms and have some degree of cell growth inhibitory potential at least to the certain cell lines such as HepG2 and MCF-7.
Keywords: Macrofungi, Cytotoxicity, Antioxidant, Antimicrobial, HepG2, MCF- 7
iii ÖN SÖZ
Yüksek lisans öğrenimim boyunca, tez konusunun planlanması ve değerlendirilmesi aşamasında ilgi ve desteğini esirgemeyen danışmanım Yrd. Doç. Dr. Gökhan SADİ'ye ve çalışmalarım sırasında mikrobiyoloji alanındaki bilgilerinden yararlandığım Yrd. Doç. Dr. Aytaç KOCABAŞ'a teşekkürlerimi sunarım.
Mantar örneklerinin toplanmasında, teşhisinde ve deneylerde kullanılmasında desteğini hiçbir zaman esirgemeyen sayın Prof. Dr. Abdullah KAYA'ya teşekkürü borç bilirim. Sitotoksite çalışmamda bana yardımcı olan Arş. Gör. Dr. Ahmet ALTAY'a ve Arş. Gör. Dr. Deniz İRTEM KARTAL’a teşekkür ederim.
Mevcut çalışmaya maddi destek sağlayan Karamanoğlu Mehmetbey Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimine (10-YL-15) teşekkürlerimi sunarım.
Yüksek lisans eğitimim süresince aynı laboratuvarı paylaştığım çalışma arkadaşlarıma teşekkür ederim.
Hayatım boyunca maddi manevi her türlü konuda yanımda olup desteğini esirgemeyen
aileme sonsuz teşekkür ederim.
Sevim KOL Nisan, 2016
iv İÇİNDEKİLER Sayfa ÖZET... i ABSTRACT... ii ÖN SÖZ... iii ÇİZELGELER DİZİNİ... vi ŞEKİLLER DİZİNİ... vii SİMGELER VE KISALTMALAR DİZİNİ... x 1. GİRİŞ... 1 2. GENEL BİLGİLER... 2 2.1. Serbest radikaller ... 2
2.1.1. Serbest radikallerin lipitlere etkisi ... 3
2.1.2. Serbest radikallerin proteinlere etkisi ... 3
2.1.3. Serbest radikallerin DNA’ya etkisi ... 4
2.2. Antioksidanlar... 4
2.2.1. Enzimatik antioksidanlar ... 5
2.2.2. Enzimatik olmayan antioksidanlar ... 6
2.3. Kanser ... 10 3. TEZİN AMACI... 13 4. MATERYAL ve METOT... 14 4.1. Kullanılan cihazlar ... 14 4.2. Kullanılan kimyasallar ... 14 4.3. Mantar örnekleri ... 14
4.3.1. Armillaria mellea (Vahl) P. Kumm. ... 14
4.3.2. Craterellus cornucopioides (L.) Pers. ... 15
4.3.3. Laccaria laccata (Scop) Cooke. ... 16
4.3.4. Lepista nuda (Bull.: Fr.) Cooke ... 17
4.3.5. Leucoagaricus leucothites (Vittad.) Wasser ... 18
4.3.6. Lycoperdon molle Pers.: Pers. ... 19
4.4. Mantar ekstrelerinin hazırlanması ... 19
4.5. Biyoaktif içeriklerin belirlenmesi... 20
v
4.5.2. Toplam flavonoid içeriği ... 21
4.5.3. β-Karoten ve Likopen içeriği ... 21
4.6. Antioksidan aktivitesi tayin yöntemleri... 22
4.6.1. DPPH serbest radikal yakalama aktivitelerinin belirlenmesi ... 22
4.6.2. İndirgeme gücü aktivitesi ... 23
4.7. Mantarların antimikrobiyal etkilerinin belirlenmesi... 24
4.7.1. Çalışmada kullanılan mikroorganizmalar ... 24
4.7.2. Antimikrobiyal aktivite belirlenme yöntemleri ... 24
4.8. Mantarların sitotoksik etkisinin belirlenmesi... 26
4.8.1. Hücre kültürü çalışmaları ... 26
4.8.2. XTT sitotoksisite testi ... 28
4.9. HPLC (Yüksek basınçlı sıvı kromatografisi) yöntemi ile fenolik madde tayini... 29
5. BULGULAR... 31
5.1. Soxhlet cihazı ile gerçekleştirilen ekstraksiyonun verimi ... 31
5.2. DPPH üzerinden serbest radikal yakalama etkileri ... 31
5.3. Biyoaktif içerikler ... 35
5.4. İndirgeme gücü aktivitesi ... 37
5.5. Antimikrobiyal etki ... 40
5.6. Mantar ekstrelerinin HepG2 ve MCF-7 hücrelerine sitotoksik etkisi... 45
5.7. Yüksek basınçlı sıvı kromatografisi (HPLC) ile fenolik asitlerin belirlenmesi ... 48
6. TARTIŞMA ve SONUÇ... 51
7. KAYNAKLAR... 54
EKLER... 64
vi
ÇİZELGELER DİZİNİ
Çizelge Sayfa
Çizelge 5.1 : Mantarların ekstraksiyon işleminden sonra elde edilen miktarları ... 31 Çizelge 5.2 : Mantarlardan elde edilen su ve metanol ekstrelerinin DPPH serbest radikal
yakalama aktiviteleri (EC50 değerleri) ... 33
Çizelge 5.3 : Mantar ekstrelerinin toplam fenolik (gallik asit eşleniği) içerik miktarları
(µg/mg) ... 36
Çizelge 5.4 : Mantar ekstrelerinin β-karoten, likopen ve flavonoid içerikleri (µg/mg) . 37 Çizelge 5.5 : Mantar ekstrelerinin indirgeme gücü etkinlikleri (EC50 değerleri) ... 38
Çizelge 5.6 : Altı mantar türünün farklı ekstrelerinin disk difüzyon yöntemi ile
belirlenen antibiyogram sonuçları (İZ: mm) ... 40
Çizelge 5.7 : Altı mantar türünün su ekstrelerinin farklı konsantrasyonlarının
mikroorganizmalar üzerine etkilerinin MİK deneyi sonuçları ... 42
Çizelge 5.8 : Altı mantar türünün metanol ekstrelerinin farklı konsantrasyonlarının
mikroorganizmalar üzerine etkilerinin MİK deneyi sonuçları ... 43
Çizelge 5.9 : Altı mantar türünün mikroorganizmalar için belirlenen minimal inhibitör
konsantrasyon (MİK) değerleri ... 44
Çizelge 5.10: Mantar ekstrelerinin sitotoksik etkileri (EC50 değerleri, mg/mL) ... 46
Çizelge 5.11: Altı mantar türünün metanol ve su ekstrelerinin HPLC ile belirlenen
vii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2.1 : Lipid peroksidasyonunun temel reaksiyonları ... 3
Şekil 2.2 : Glutatyonun (GSH) molekül şekli ... 6
Şekil 2.3 : α-tokoferol yapısı ... 7
Şekil 2.4 : Askorbik asidin dehidro askorbik asite oksitlenmesi ... 8
Şekil 2.5 : β-Karotenin yapısı (a), Likopenin yapısı (b). ... 8
Şekil 2.6 : Flavonoidlerin C6-C3-C6 iskelet yapısı ... 9
Şekil 4.1 : Armillaria mellea'nın bazidiyokarpları (Foto: A. KAYA)... 15
Şekil 4.2 : Craterellus cornucopioides'ın bazidiyokarpları (Foto: Y. UZUN) ... 16
Şekil 4.3 : Laccaria laccata'nın bazidiyokarpları (Foto: A. KAYA) ... 16
Şekil 4.4 : Lepista nuda'nın bazidiyokarpları (Foto: A. KAYA) ... 17
Şekil 4.5 : Leucoagaricus leucothites'ın bazidiyokarpları (Foto: Y. UZUN) ... 18
Şekil 4.6 : Lycoperdon molle'nin bazidiyokarpları (Foto: Y. UZUN)... 19
Şekil 4.7 : Soxhlet Ekstraktörü (a), Rotary Evaporatör (b) ... 20
Şekil 4.8 : DPPH radikalinin kimyasal yapısı ... 22
Şekil 4.9 : Difenilpikrilhidrazil (DPPH) radikali ... 23
Şekil 4.10: MCF-7 hücrelerinin mikroskopik görüntüsü (Faz kontrast, 10X): Ekimden 2 gün sonraki görüntü (a), ekimden 4 gün sonraki görüntü (b), ekimden 6 gün sonraki görüntü (c), ekimden 8 gün sonraki görüntü (d) ... 27
Şekil 4.11: HepG2 hücrelerinin mikroskopik görüntüsü (Faz kontrast, 10X): Ekimden 2 gün sonraki görüntü (a), ekimden 4 gün sonraki görüntü (b), ekimden 6 gün sonraki görüntü (c), ekimden 8 gün sonraki görüntü (d) ... 27
viii
Şekil 4.13: 96'lık mikro plaka içerisinde gerçekleştirilen XTT deneyinin organizasyonu:
İki sütun hücresiz, üç sütün HepG2 hücreleri ile inkübe edilmiştir. Her bir satırda, yukarıda belirtildiği gibi farklı konsantrasyonda ekstreler uygulanmıştır. Kontrol grubu olarak % 0,2 DMSO kontrol kullanılmıştır. . 29
Şekil 5.1 : DPPH radikalinin difenil-pikrilhidrazine dönüşümü ... 32
Şekil 5.2 : DPPH radikal yakalama aktivitesi gallik asit kalibrasyon eğrisi ... 32
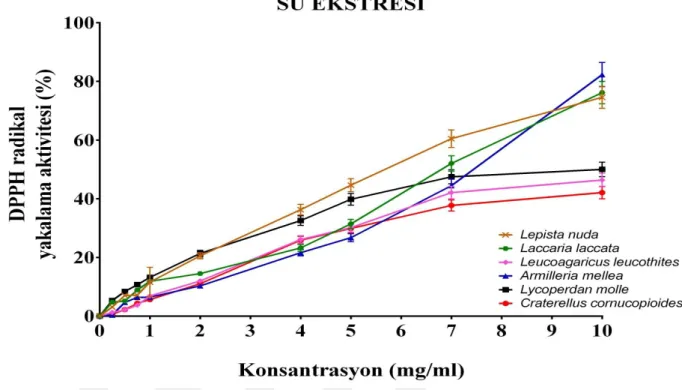
Şekil 5.3 : Altı mantar türünün farklı konsantrasyonlardaki su ekstrelerinin DPPH
radikallerini yakalama aktiviteleri. ... 34
Şekil 5.4 : Altı mantar türünün farklı konsantrasyonlardaki metanol ekstrelerinin DPPH
radikallerini yakalama aktiviteleri. ... 34
Şekil 5.5 : Gallik asit standart kalibrasyon eğrisi ... 35
Şekil 5.6: Altı mantar türünün farklı konsantrasyonlardaki su ekstrelerinin indirgeme
güçlerinin karşılaştırılması. ... 39
Şekil 5.7: Altı mantar türünün farklı konsantrasyonlardaki metanol ekstrelerini
indirgeme güçlerinin karşılaştırılması. ... 39
Şekil 5.8 : L. nuda ve L. leucathites'ın su ektrelerinin A.tumefaciens (a), S. aureus
ATCC 2921 (b), B. subtilis (c), E. Coli 0157:H7 ATCC 43895 (d), E.
faecalis (e), B. licheniformis (f), üzerine antimikrobiyal etkisi ... 41
Şekil 5.9 : Altı mantar türünün farklı konsantrasyonlardaki su ekstrelerinin 48 saat
sonundaki MCF-7 hücre canlılıkları üzerine etkileri ... 46
Şekil 5.10: Altı mantar türünün farklı konsantrasyonlardaki su ekstrelerinin 48 saat
sonundaki HepG2 hücre canlılıkları üzerine etkileri ... 47
Şekil 5.11: Altı mantar türünün farklı konsantrasyonlardaki metanol ekstrelerinin 48
saat sonundaki HepG2 hücre canlılıkları üzerine etkileri ... 47
Şekil 5.12: a, gallik asit, b; (+) kateşin, C (-) epikateçin d, epigallokateşin gallat, E ,
siringik asit, f, p - kumarik asit, g rosmarinik asit, h, t- resveratrol, k; kuersetinin tutma süreleri ile 280 nm'de fenolik standartları HPLC kromatogramı ... 48
Şekil 5.13: 271 nm 'de mantar özü HPLC kromatogramı. 3,73 dakikalık tutma süresi ile
ix
Şekil 5.14: 309 nm 'de mantar özü HPLC kromatogramı. 9,6 dakikalık tutma süresi ile
x SİMGELER VE KISALTMALAR DİZİNİ Simgeler Açıklama ° C Santigrat derece mg Miligram mm Milimetre nm Nanometre g Gram µ Mikro cm Santimetre mL Mililitre mM Milimolar % Yüzde µL Mikrolitre dH2O Distile su β Beta V Hacim
R. Karbon merkezli radikaller
α Alfa γ Gama δ Sigma OH- Hidroksil radikali O2 .- Süperoksit radikali CO2 Karbondioksit
xi
Kısaltma Açıklama
DPPH 2,2-difenil-1-pikrilhidrazil
TCA Trikloroasetik asit
K
3Fe(CN)6 Potasyum ferrisiyanür
SEM Standart hata
DNA Deoksiribo nükleik asit
ROS Reaktif oksijen türleri
LOOH Lipid hidroperoksit
SOD Süperoksit dismutaz
GPx Glutatyon peroksidaz
GR Glutatyon redüktaz
NADPH Nikotinamid adenindinükleotid fosfat
CAT Katalaz
GSH Glutatyon
GSSG Okside glutatyon
UV Ultraviyole
ATCC American type culture collection
DMSO Dimetil sülfoksit
FBS Fetal bovin serum
EC50 Etkin konsantrasyon
PBS Buffer phosphate saline
DDM Disk difüzyon metodu
MİK Minimum inhibisyon konsantrasyonu
MHA Mueller Hinton Agar
xii
NB Nutrient broth
GA Gallik asit
kDa Kilodalton
rpm Santrifüj rotorunun dakikadaki devir hızı
pH Asitlik derecesi
RPMI Roswell Park Memorial Enstitüsü
RH Çoklu doymamış yağ asidi
XXT 2,3-Bis-(2-Methoxy-4-Nitro-5-Sulfophenyl)-2
1 1. GİRİŞ
Mantarlar klorofil içermeyen, tüp şeklinde ipliksi hücrelerden oluşan, spor oluşturan, heterotrof yaşayan ökaryotik, organizma grubudur. Mantarlar kendi besinlerini üretemedikleri için saprofit, parazit ya da mikorizal olarak yaşarlar. Mantarların fruktifikasyon organları gözle görülemeyecek kadar küçük türleri (mikromantarlar) olabildiği gibi fruktifikasyon organları gözle görülebilen kısımlardan oluşan türleri de (makromantarlar) vardır (Kurt, 2013). Makromantarlar; fungi âleminde bulunan Basidiomycetes ve Ascomycetes sınıflarında bulunurlar (Üstün, 2011). Mevcut literatür verilerine göre ülkemizde yaklaşık 2400 civarında makromantar taksonu belirlenmiştir (Sesli ve Denchev., 2014). Belirlenen bu mantarların yaklaşık %50’si yenilebilir nitelikte olmasına karşın, yöresel tüketim oranları genel olarak %24 civarındadır (Kaya, 2000).
Biyolojik olarak ayrıştırıcı özelliklerinden dolayı ekosistemde oldukça önemli yer tutan mantarlar, hem gıda hem de tıbbi değeri olan biyolojik aktif bileşenleri içeren önemli bir kaynak olarak bilinmektedirler (Sarıkürkçü ve ark., 2004). Mantarların antikanser,
antioksidan, antihipertensif, karaciğer koruyucu, immünolojik antifibriotik,
antiinflamasyon, kolesterol düşürücü, antidiyabetik, antiviral ve antimikrobiyal etkileri olduğu yapılan araştırmalar ile saptanmıştır (Demirhan ve ark., 2007). Antimikrobiyal etkileri; fungal yapıda sentezlenen ve genellikle organizmaya özgü bazı fenolik bileşikler, kinonlar, pürinler, primidinler, terpenoidler ve fenil proponoid türevi gibi antagonistik maddelerden ileri gelmektedir (Benedict ve Brady, 1972; Alsheik ve Trappe, 1983). İnsanlık için faydalı olabilen bu antagonistik bileşiklerin; Clitocybe,
Coprinus, Daedalea, Merulius, Marasmius, Pleurotus, Polyporus, Psathyrella, Tricholoma ve Schizophyllum, mantar cinslerinin bir veya birkaç türünde bulunduğu
tespit edilmiştir (Benedict ve Brady, 1972; Karacsonyi ve ark., 1994; Gao ve ark., 2005; Lindequist ve ark., 2005). Bu bileşikler oldukça zengin doğal antibiyotik kaynaklarıdır ve geleneksel tıpta birçok hastalığın tedavisinde kullanılagelmiştir (Akyüz ve ark., 2010).
Antitümoral etki sağlayan önemli maddeler; volvotoksin, flammutoksin, kalvasin lentinan ve porisin mantarlardan izole edilebilen maddelerdir. Bu bileşikler antiviral özellik de taşımaktadır (Benedict ve Brady, 1972; Conchran, 1978). Funguslardan elde
2
edilen ekzopolisakkaritlerin antitümör aktivitesinin olduğu da bilinmektedir. Bunların arasından fungal glukanlar en bilinenlerdir. Verildikleri konakçıda spesifik tepkimelere neden olurlar, nötrofilleri, monositleri, makrofajları ve dentritik hücreleri uyararak bağışıklık sistemini aktive ederler ve sitokinler, interlokin, interferonlar, koloni uyarıcı faktörler gibi kimyasal habercilerin salgılanmasını sağlayarak akut faz tepkimelerinin oluşmasını sağlarlar (Smith ve ark., 2002).
Bu proje kapsamında doğal ortamından toplanan Armillaria mellea (Vahl) P. Kumm.,
Craterellus cornucopioides (L.) Pers., Laccaria laccata (Scop) Cooke., Lepista nuda
(Bull.: Fr.) Cooke., Leucoagaricus leucothites (Vittad.) Wasser. ve Lycoperdon molle Pers.: Pers. makromantar türlerinin antioksidan, antimikrobiyal ve sitotoksik etkileri incelenmiş, yüksek antioksidan, antimikrobiyal ve sitotoksik etkiye sahip olanlar belirlenerek bu alanda yapılmış çalışmalara katkı sağlanmıştır.
2. GENEL BİLGİLER
2.1. Serbest radikaller
Dış orbitallerinde bir veya daha fazla eşleşmemiş elektron bulunduran reaktif atom veya moleküller serbest radikal olarak tanımlanmaktadır (Mercan, 2004). Biyolojik sistemlerde serbest radikaller normal metabolik olaylarla meydana geldiği gibi organizmanın çesitli dış etkenlere maruz kalmasıyla da meydana gelebilir. Bu nedenle serbest radikal kaynakları endojen (organizma tarafından sentezlenen) ve ekzojen (dışarıdan besinlerle alınan) olarak iki ana sınıfa ayrılmaktadır (Arkan, 2011). Vücutta serbest radikal meydana getiren mitokondrial sızıntı, solunumsal patlama, enzim reaksiyonları, otooksidasyon reaksiyonları endojen kaynakları oluştururken, sigara dumanı, alkol, UV ışını, iyonize radyasyon, çevresel kirlenme, ilaçlar, diyet faktörleri eksojen kaynakları oluşturmaktadır.
Aerobik canlılar için (örneğin memeliler), serbest radikallerin ana kaynaklarından biri oksijendir (Halliwell ve ark., 1993). Birçok radikal türü olmasına karşın, biyolojik sistemlerde en çok görüleni oksijenden oluşan ve reaktif oksijen türleri (ROS) olarak adlandırılan radikallerdir (Harman, 1956; Boğa, 2007). Serbest radikaller içinde reaktif oksijen radikalleri, reaktif nitrojen radikalleri, reaktif sülfür radikalleri gibi aileler vardır (Dağdelen, 2010). Önemli bir serbest radikal türü olan reaktif oksijen türleri
3
etkisizleştirilmezlerse proteinlerin, lipitlerin ve nükleik asitlerin oksidatif hasarlarına sebep olabilirler (Arkan, 2011).
2.1.1. Serbest radikallerin lipitlere etkisi
Serbest radikallerin neden olduğu zararlardan en çok etkilenen yapı membran lipidleridir (Cheesman ve Slater, 1993). Hücre membran yapısındaki kolesterol ve yağ asitlerinin doymamış bağları serbest radikellerle kolayca reaksiyona girer ve lipit peroksidasyonuna sebep olurlar (Weiss ve Lobuglio, 1982; Freeman ve Crapo, 1982; Halliwell ve Gutteridge, 1999). Lipid peroksidasyonu membran fosfolipidlerindeki doymamış yağ asitlerinin oksidasyonlarına sebep olan (Şekil 2.1) ve bunun sonucunda membran lipid yapısını değiştirerek hücre yapı ve fonksiyonlarını bozan bir olaydır (Kıral, 2012).
LH + R. L. + RH L. + O2 LOO. (Lipid peroksit radikali)
LOO. + LH LOOH + L.
LOOH LOO. ; LO. (aldehitler)
Şekil 2.1.Lipid peroksidasyonunun temel reaksiyonları
Lipid peroksidasyonunu; süperoksit, hidroksil, peroksil ve alkoksil radikali gibi oldukça kuvvetli radikaller ile başlatılabilir (Karabiga, 2006) ve lipit hidroperoksitlerinin aldehid ve diğer karbonil bileşiklere dönüştüğü noktada sonlanır. Bu ürünlerin önemlileri olan hidroksinonenal ve MDA, proteinlere ve DNA’ya bağlanarak kalıcı değişikliklere neden olur (Karadağ, 2013). Daha önce yapılan çalışmalarda, kanser, alzheimer, diyabet gibi önemli bir çok hastalıkta plazma ve doku lipid peroksidasyon ürünlerinde artış meydana geldiği belirlenmiştir (Halifeoğlu ve ark., 2005).
2.1.2. Serbest radikallerin proteinlere etkisi
Proteinler, serbest radikallerden poliansatüre yağ asitlerine göre daha az etkilenirler. Proteinlerin serbest radikal hasarından etkilenme derecesi, onların amino asit kompozisyonlarıyla ilgilidir (Özenç, 2011). Doymamış bağ ve sülfür içeren moleküllerin serbest radikallerle reaktivitesi daha yüksek olduğu için tirozin, fenilalanin, metionin triptofan, sistein ve histidin gibi aminoasitleri içeren proteinler
4
serbest radikallerden daha kolay etkilenmektedirler (Nordberg ve Arner, 2001; Netto ve ark., 2002). Böylece proteinlerde fragmantasyon ve çapraz bağlanmalar oluşur. Protein fonksiyonlarında (kataliz, transport, reseptör gibi) bozulmalar ve immun sistemi uyarabilecek antijenik değişiklikler meydana gelir (İbadova, 2006).
2.1.3. Serbest radikallerin DNA’ ya etkisi
İyonize edici radyasyon nedeniyle oluşan serbest radikallerin mutajenik etkilerinden dolayı DNA üzerinde önemli hasarlara neden olduğu belirlenmiştir (Kayış, 2010).
Aktive olmuş nötrofillerden kaynaklanan hidrojen peroksit (H2O2) membranlardan
geçerek hücre çekirdeğine ulaşır. DNA hasarına, hücre disfonksiyonuna ve hücre ölümüne neden olabilir (Özenç, 2011).
Oksidatif hasar dal kırıkları, baz çifti değişimleri, yeniden düzenlenme gibi yapısal değişimlerle ortaya çıkmaktadır. DNA, serbest radikallerden çok kolay etkilenen önemli bir hedeftir (Shahıdı ve Wanasundara, 1992; Winrow ve ark., 1993; Simonian ve Coyle., 1996). Monosakkaritlerin otooksidasyonu sonucunda peroksitler, hidrojen peroksit, glioksal ve okzoaldehitler oluşur. Okzoaldehitler DNA, RNA ve proteinlere bağlanarak antimitotik etkiye neden olurlar. Böylece kanser ve yaşlanma gibi olaylara temel hazırlamış olurlar (Shahıdı ve Wanasundara, 1992; Dağdelen, 2010).
2.2. Antioksidanlar
Antioksidanlar, serbest radikallerin oluşumunu engelleyebilen veya mevcut radikalleri süpürerek hücreleri zarardan koruyan ve yapısında çoğunlukla fenolik fonksiyon taşıyan moleküllerdir (Kahkönen, 1999; Somogyı, 2007). Antioksidanlar kompleks bir içeriğe sahiptirler ve iki farklı mekanizma ile etkilerini gösterirler. Bunlar, direkt antioksidanlar ve indirekt antioksidanlar olarak bilinmektedir. Direkt antioksidanlar (glutatyon, tokoferoller, fenolik bileşikler, askorbik asit ve karotenoidler gibi) fizyolojik, biyokimyasal veya hücresel süreçlerde bulunarak serbest radikalleri inaktive ederler veya serbet radikaller tarafından başlatılan kimyasal reaksiyonları engellerler. İndirekt antioksidanlar hücrenin antioksidan kapasitesini güçlendirirler (Erciyes, 2014).
Antioksidanlar yükseltgenebilen maddeler olduğu için zincir reaksiyonlarını (örneğin lipidlerin oksidatif parçalanmasına yol açan radikalik zincir reaksiyonunu) koparmaları esnasında kendileri yükseltgenerek bozunmaya uğrarlar. Bundan dolayı antioksidanlar
5
yükseltgenebilen maddeyi (örneğin biyolojik makromolekülleri) sadece sınırlı bir zaman için koruyabilir ve bir noktadan sonra madde ortamda hiç antioksidan yokmuş gibi algılayıp yükseltgenmeye devam eder. Antioksidanların kimyasal aktiviteleri, yani hidrojen veya elektron donör araçları olarak indirgeme potansiyelleri çoğunlukla onların serbest radikal tutucu olarak göstermiş oldukları potansiyel ile gösterilir (Papetti ve ark., 2006).
2.2.1. Enzimatik antioksidanlar
Süperoksit Dismutaz (SOD) (EC.1.15.1.1)
Süperoksit dismutazı ilk kez McCord ve Fridovich 1968'de tanımlamıştır ve bu enzim süperoksit radikallerinin katalitik olarak hidrojen peroksit, moleküler oksijene dönüşümünü katalizleyen ve lipit peroksidasyonu inhibe eden metalloenzimdir (McCord ve Fridovich, 1969; Moscone, 1988; Murray ve ark., 1993).
2O2•- + 2H+ + SOD → H2O2 + O2
Katalaz (CAT) (EC: 1.11.1.6)
Katalaz, Sumner ve Dounce tarafından 1937 yılında sığır karaciğerinden izole edilmiştir. Molekül ağırlığı yaklaşık 240 kDa olup, aktif kısmında dört tane ferrihem
grubu (Fe3+-protoforfilin) içeren bir hemoproteindir. Her alt ünitede enzimi kendi
substratı H2O2 ye karşı koruyan ve etkinliğini artıran NADPH bulunur (Halliwell ve
Gutteridge, 1999; Aydın ve ark., 2001; Nordberg ve Arner, 2001). Her aerobik hücrede bu enzim vardır. Karaciğer, böbrek, miyokard, çizgili kaslar ve eritrositler katalazın en fazla etki gösterdiği dokulardır. CAT, %80 oranında peroksizomlarda ve %20 oranında sitozolde bulunur (Chaudiere, 1999). Katalaz hidrojen peroksiti su ve moleküler oksijene parçalar.
2H2O2 + CAT → H2O + O2
Glutatyon peroksidaz (GSH-Px): (EC: 1.11.1.9)
Glutatyon peroksidaz enzimi ilk olarak hayvan eritrositlerinden izole edilmiştir (Arteel ve Sies, 2001). Genel olarak yüksek yapılı bitkilerde ve bakterilerde bulunmaz fakat bazı alg ve mantarlarda bulunduğu bildirilmiştir (Mills, 1957; Halliwell ve Gutteridge, 1999). Glutatyon peroksidaz, elektron kaynağı olarak glutatyonu kullanarak hidrojen
6
peroksit ve organik hiperoksitlerin indirgenmesinden sorumludur. Mitokondri, sitozol ve hücre membranlarında bulunur (Deaton ve Marlin, 2003).
Glutatyon Redüktaz (GR): (EC: 1.8.1.7)
Glutatyon redüktaz, GPx yardımıyla hidroperoksitlerin indirgenmesi sonucu oluşan okside glutatyonun (GSSG) tekrar indirgenmiş glutatyona (GSH) dönüşümünü katalizler (Karadağ, 2013). Hidrojen peroksitin detoksifikasyonu reaksiyonunda okside forma dönüşen glutatyonun yeniden kullanılabilmesi için, redükte GSH'a dönüşen glutatyonun yeniden indirge GSH'a dönüştürülmesi gerekir. GR, NADPH varlığında glutatyon disülfiti tekrar indirge glutatyona (GSH) çeviririr (Hermes-Lima ve ark., 2001). GR bitki dokularında kloroplast, mitokondri ve sitosolde bulunur (Cicerali, 2004).
GSSG + NADPH + H→ 2GSH + NADP+
2.2.2. Enzimatik olmayan antioksidanlar Glutatyon (GSH)
Önemli bir antioksidan olan glutatyon; glutamik asit, sistein ve glisinden oluşan düşük molekül ağırlığına sabip bir tripeptiddir (Şekil 2.2) (Akkuş, 1995; Halliwell ve Guttreidge, 1999). Hücrede en fazla sitozol, mitokondri ve nükleusta vardır. Hücre içi glutatyonun önemli bir kısmı indirgenmiş olarak az bir kısmı da okside glutatyon (GSSG) halinde bulunur (Halliwell ve Gutteridge, 1999; Dickinson ve Forman, 2002; Mytilineou ve ark., 2002). Tiyol grubu, GSH'a antioksidan özelliğini katmaktadır. Glutatyon hem hidroksil ve singlet oksijen gibi reaktif oksijen türlerinin temizleyicisi hem de diğer serbest radikaller ve peroksitlerle reaksiyona girerek hücreyi oksidatif hasarlara karşı koruyan bir enzimdir. Buna ek olarak proteinlerdeki –SH gruplarını redükte halde tutarak protein ve enzimlerin inaktivasyonunu engeller (Murray ve ark., 1993; Burton, 1994).
7 Vitamin E (Tokoferol)
İlk kez 1922 yılında izole edilen E vitamini, α, β, γ, δ-tokoferol olarak adlandırılan bileşiklere verilen genel bir isimdir. Bu bileşikler arasında en aktif olanı α-tokoferoldür (Şekil 2.3). Yapısında bulunan fenolik hidroksil grubu içeren aromatik halka, vitaminin aktif kısmını meydana getirir. Membranca zengin olan mitokondri ve mikrozom gibi yapılarda çok fazla bulunmaktadır. E vitamini bakımından bitkisel yağlar ve tohumlar oldukça zengindirler (Halliwell ve Gutteridge, 1999; Packer ve ark., 2001). α-Tokoferol, süperoksit, hidroksil, singlet oksijen, lipid peroksil radikalleri ve diğer bazı serbest radikallerin temizlenmesinde görev alır (Chow, 1991; Blokhina ve ark., 2003). E vitamini, yağda çözünen, esansiyel bir antioksidan olup epidemiyolojik çalışmalar E vitamini ve diğer bazı antioksidanların düşük dozlarda bile, kanser, parkinson hastalığı ve kalp hastalıklarına karşı yüksek düzeyde işlev gördüğünü belirlemiştir. Sadece bitkiler tarafından sentezlenebilen E vitamini hayvanlar ve insanlar için esansiyel olup biyolojik sistemlerde güçlü antioksidan özellik göstermektedir (Gönenç ve ark., 2014).
Şekil 2.3. α-tokoferol yapısı
Vitamin C (Askorbik asit)
Askorbik asit organizmada birçok hidroksilasyon reaksiyonunda indirgeyici olarak işlev görür (Halliwell ve Gutteridge, 1999). Oldukça güçlü bir indirgeyici olan vitamin C, semihidroaskorbat radikal ara ürünü sayesinde kolaylıkla dehidroaskorbik aside okside olur (Şekil 2.4).
8
Şekil 2.4. Askorbik asidin dehidro askorbik asite oksitlenmesi
Vitamin A (Karotenoid)
A vitamini, normal görmede, hücre çoğalmasında, immun yanıtta, epitel bütünlüğün sağlanmasında önemli rol oynar (Kasapçopur Özel, 2014). A vitaminin metabolik ön maddesi konumundaki β-karoten (Şekil 2.5a), oldukça güçlü bir singlet oksijen temizleyicisi olarak işlev görür. Hidroksil, peroksil ve alkoksil radikalleri ile direk reaksiyona girerek lipit peroksidasyonu zincir reaksiyonunun önlenmesinde görev alır (Kayış, 2010). Likopen ise kırmızı renkte bir karotenoiddir (Şekil 2.5b). Yapısındaki çift bağların fazla olmasından dolayı diğer karotenoidlere oranla çok daha fazla singlet oksijen yakalar.
a. b.
Şekil 2.5.β-Karotenin yapısı (a),Likopenin yapısı (b). Fenolik bileşikler
Fenolik bileşikler; bir veya birden fazla hidroksil grup taşıyan aromatik halkaya sahip, buna bağlı olarak farklı yapı ve fonksiyonları bulunan metabolitlerdir (Naczk ve Shahidi, 2004; Robards ve ark., 1999). Fenolikler, en aktif doğal antioksidanlardır ve antioksidan etkilerini serbest radikalleri bağlamaları, metallerle şelat oluşturmaları ve lipoksijenaz enzimini inaktive etmeleri şeklinde gerçekleştirler (Gök ve Serteser, 2003; Nichenametla ve ark., 2006). Polifenoller, bitkilerde çeşitli meyve, sebze, kuruyemiş, tohum, çiçek, kök ve gövde kısımlarında doğal olarak sentezlenmektedir (Wollgast ve Anklam, 2000).
9
Karadeniz ve ark. (2004) farklı meyve (elma, ayva, üzüm, armut ve nar) ve sebzelerin (patates, soğan, taze soğan, kırmızıturp ve kırmızılahana) antioksidan aktivitesini, toplam fenolik ve flavanoid içeriklerini belirlemişlerdir. Meyveler arasında nar %62,7 ile en yüksek antioksidan aktiviteye sahip olup bunu ayva (%60,4), üzüm (%26,6), elma (%25,7) ve armut (%13,7) izlemiştir. Toplam fenolik madde içeriğinin meyve ve sebzelerin antioksidan içeriğine önemli etkisinin olduğu gözlenmiştir (Tokbaş, 2009). Genellikle toplam fenol içeriği ve antioksidan aktivitesi arasında oldukça iyi bir ilişki görülmektedir (Huang ve ark., 2005; Prior ve ark., 2005).
Flavonoidler
Sarı renkli olmalarından dolayı latince flavus sözcügünden türetilerek flavonoid adını almışlardır. 15 karbonlu 2-fenil benzopiron 2-fenilbenzopiran (difenil propan) yapısı (C6-C3-C6) gösterirler (Şekil 2.6) (Kahraman ve ark., 2002). Bu yapıları sayesinde
polifenolik bileşikler grubuna dâhil edilmişlerdir. Doğal olarak bitkilerin yapraklarında, kabuklarında, gövdelerinde, çiçeklerinde ve köklerinde bulunurlar (Atlan, 2012). Flavonoid iskelet yapılarının farklı olmasına bağlı flavon, flavonol, flavonon biflavonoid kalkon gibi çeşitleri vardır (Kahraman ve ark., 2002). Flavonoidler başlıca üzüm çekirdeğinde (Vitis vinifera) bulunan proantosiyanidinler, turunçgillerde (citrus) bulunan flavanonlar (örneğin naringenin), soğan (Basaliye allium cepaonionoiqnon) ve diğer sebzelerde bulunan flavonoller (örneğin quercetin), yeşil çayda (Camellia
sinensis) bulunan kateşinler, yaban mersininde (Vaccinium myrtillus) bulunan
antosiyanosidler ve soya fasülyesinde (Soja phaseolus vulgaris) bulunan isoflavonlerdir (Ergüzel, 2006).
Şekil 2.6.Flavonoidlerin C6-C3-C6 iskelet yapısı
Flavonoidlerin, bitkide antioksidan, enzim inhibitörü, ışıktan koruma gibi farklı görevleri olduğu gibi (Harborne ve Mabry, 1982) enerjinin dönüşümüne ve büyüme hormonları üzerinde de etkisi vardır. Flavonoidlerin solunumu ve fotosentezi düzenleme
10
ve bulaşıcı hastalıklara karşı savunma gibi fonksiyonları da vardır (Smith ve Banks, 1986). Bitkilerde azotun tutulmasını sağlayan bakteriyel genlerin aktifleştirilmesinde yer aldıklarını gösteren çalışmalar, flavonoidlerle genler arasında çok önemli bir bağ olduğunu göstermektedir (Firmin ve ark., 1986; Peters ve ark., 1986).
Flavonoidlerin antioksidan (Bors ve Saran, 1987; Larson, 1988), antimikrobiyal (Pratt ve Hudson, 1990), antiviral, antiülserojenik, hipolidemik, hepatoprotektif, (Wagner, 1989; Wagner ve ark., 1991; Hikino ve Kiso, 1988) etkisi, iltihab üzerine etkisi (Moroney ve ark., 1988) yapılan çalışmalarla ortaya çıkarılmıştır. Flavonoidlerin (kersetin ve kamferolun) antimutajenetik ve antikarsinojenik fonksiyonlarının olduğu in
vitro ve in vivo ortamlarda tespit edilmiştir (Kato ve ark., 1983; Huang ve ark., 1983;
Verma ve ark., 1988; Deschner ve ark., 1991).
2.3. Kanser
Hücrelerin kontrolsüz büyüme ve anormal şekilde yayılımını tanımlamak için için kanser terimi kullanılmaktadır (Gedikli, 2013). Kanser, hücrelerin çoğalmasını (proliferasyonunu), farklılaşmasını (differansiyasyonunu) ve oluşumunu kontrol eden genlerin hastalığı sonucunda meydana gelir (Çığlıdağ Düngül, 2011). Özellikle kalp hastalıklarından sonra ikinci sırada ölüme neden olmasından dolayı patolojik bozukluklar arasında en önemlilerindendir (Babat, 2014). Çevresel faktörler, diyet, somatik mutasyonlar ve kalıtılan mutasyonlar gibi etkenler kanser oluşumuna neden olmaktadır (Çığlıdağ Düngül, 2011).
Dünya' da kadınlar arasında en sık görülen kanser türü olan meme kanseri, kansere bağlı ölümlerde akciğer kanserinden sonra ikinci sırada bulunmaktadır (Somunoğlu, 2009; Saip ve ark., 2011). Hayat boyunca yaklaşık her 10 kadından birinin meme kanseri olma riskinin ve yakalananların üçte birinin de hayatlarını bu hastalıktan dolayı kaybetme risklerinin olduğu bildirilmektedir (Gölbaşı ve ark., 2010). Dünya Sağlık Örgütü'ne bağlı IARC'nin (International Agency for Research on Cancer Uluslararası Kanser Araştırmaları Ajansı) 2002'de yaptığı değerlendirmede dünyada 1.150.000 yeni tanı konulmuş meme kanseri olgusu belirlenmiştir.
11 Antikanserojen olarak mantarların kullanımı
Pleurotus türleri, çeşitli ülkelerde farklı hastalıkların tedavisi için kullanılmaktadır
(Cohen ve ark., 2002). Pleurotus spp.’nin fazla miktarda β-glukan ihtiva etmesinden dolayı tıbbi özelliği olan bir mantar olarak dikkat çekmektedirler (Kurt, 2008). Mantardaki β-glukanlar bağışıklık sistemini güçlendirerek ve/veya harekete geçirerek, kanser hücrelerinin gelişimini engellemekte ve sonuçta bağışıklık sistemi hastalığında, kanser tedavisinde ve ilaç tedavisinden sonra bağışıklık sisteminin yeniden oluşumunda uyarıcı etki yapmaktadırlar (Daba ve Ezeronye, 2003).
P. ostreatus mantarının misellerinden elde edilen üç nötral proteoglikanların
immünomodülatör ve anti-kanser etkeni olarak kullanılabileceği bu bileşiklerin, sarkoma-180 denilen katı tümörlerin gelişmesini azalttığı saptanmıştır (Sarangi ve ark., 2006). Bu mantarların içeriğinde ergothionin denilen aminoasitten yüksek miktarda bulunduğu ve ergothioninin antioksidant yeteneğine sahip olduğu belirtilmiştir (Joy Dubost ve ark., 2007).
Ganoderma lucidum’dan ganoderik asit-A ve B triterpenleri ilk kez Kubato ve ark.
tarafından izole edilmiştir (Kubato, ve ark., 1982). G. lucidum’da, medikal aktivitelerini, yapısal benzerliklerine ve biyolojik özelliklerini göre 150’den fazla lanostane tipi triterpen, bulunmuş ve bu triterpenler farklı 10 grupta toplanarak toplanarak belirlenmiştir. Triterpenler sitotoksik, hepatoprotektiv ve hipolipidemik etki gösterebilen maddelerdir (Kim ve Kim., 2002).
Antimikrobiyal maddeler
Antimikrobiyal madde, mikroorganizmaların üremesini engelleyen, öldürücü etki yapan doğal veya sentetik kimyasal maddelerdir. Organizmaları öldüren maddeler sidal maddeler olarak tanımlanırken aldığı ön ek öldürülen organizmanın türünü ifade eder. Bakteriler, funguslar ve virüsleri öldüren maddeler sırasıyla bakteriyosidal, fungusidal ve virisidal maddeler olarak adlandırılır (Karankı, 2013). Antimikrobiyal maddeler dezenfeksiyon ve antisepsi yaratmak için veya enfeksiyon hastalıklarının tedavisinde ilaç (antibiyotik) olarak veya gıdalarda koruyucu katkı maddesi olarak kullanılmaktadırlar (Dündar, 2011).
12 Antibiyotik olarak mantarların kullanımı
Bakteriyologlar ve mikologlar yıllar boyunca, mikroorganizmaları kültürde yetiştirme çalışmaları sırasında, Penicillium, Aspergillus ve başka küf mantarları gibi kültürleri kirletici organizmaların, kültür ortamında komşu olarak gelişen bazı bakterileri ve mantarları tahrip edip durdurduklarını gözlemlemişlerdir. Penicillium notatum (P.
chrysogenum) mantarından elde edilen penisilin gram negatif ve gram pozitif
bakterilere karşı oldukça etkili kuvvetli bir antibiyotiktir. Penisilin daha sonra
Aspergillus ve Cephalosporium cinsi mantarların türlerinden de elde edilmiştir.
Günümüzde, Penicillium chrysogenum isimli bir Penicillium notatum mutantından elde edilmektedir (Sümer, 2006).
Actinomyces ve Streptomyces’in bazı formlarının ürettiği streptomisin isimli maddenin
de kuvvetli atimikrobiyal etkiye sahip olduğu belirlenmiştir. Bu madde tıpta büyük değer taşırmaktadır. Çünkü penisilinin etkilemediği birçok organizmayı vücut içinde tahrip etmektedir (Sümer, 2006). Penicillium griseofulvum ve Penicillium nigricans tarafından oluşturulan griseofulvin isimli antibiyotik saç, deri ve tırnaktaki sadece küf mantarlarına karşı etkilidir. Griseofulvin günümüzde, Penicillium patulum’dan elde edilmektedir. Ayrıca Khuskia oryzae'de griseofulvin üretiminde kullanılmaktadır (Sümer, 2006).
Sefalosporin isimli antibiyotik, Cephalosporium acremonium adlı küf mantarı tarafından üretilir. Fusidik asit, penisiline dirençli olan stafilokok bakteriler tarafından sebep olunan hastalıklara karşı kullanılan bir antibiyotiktir. Bu antibiyotik
Cephalosporium türleri, Mucor ramannianus ve Fusidium coccineum mantarlarından
ayıklanarak elde edilmektedir (Sümer, 2006).
Oyetayo ve ark. (2009)’nın yaptıkları çalışmada Dictyophora indusiata mantarının su ekstraktının farklı mikroorganizmalar üzerindeki etkileri araştırılmış ve yüksek oranda antimikrobiyal etki gösterdiği ortaya çıkarılmıştır. Bir diğer çalışmada test edilen
Lentinus subnudus ve Lenzites sp. türlerinin yine farklı mikroorganizmaların çoğu
üzerinde inhibisyon etki gösterdikleri belirlenmiştir (Oyetayo, 2009). Demirhan ve ark. (2007) bazı makrofungusların antimikrobiyal aktiviteleri üzerine bir araştırma yapmışlardır. Yapılan çalışmada Schizophyllum commune’nin etil asetat çözgeninde S.
13
gözlenmiştir. Türkoğlu ve ark. (2006), Morchella conica’nın etanol ekstraktının antimikrobiyal etkisini, gram-pozitif bakteri, gram-negatif bakteri türlerine karşı test etmişler ve antimikrobiyal etki gösterdiklerini tespit etmişlerdir.
Yamaç ve Bilgili yaptığı bir çalışmada farklı on mantar türüne ait misellerin antimikrobiyal aktivitelerini araştırmışlar elde ettiği verilerde Clavariadelphus
truncatus ve Trametes versicolor’un yüksek antibakteriyal aktiviteye sahip olduklarını
saptamışlardır. (Yamaç ve Bilgili, 2006).
Kalyoncu ve ark. (2010) bazı yabani makromantarın misellerini kullanarak yaptıkları çalışmada, çalışılan 21 mantarın çoğunun antimikrobiyal etki göstermediğini veya zayıf aktivite gösterdiği belirlemişlerdir. En yüksek antimikrobiyal aktiviteye sahip mantar türü olarak Ganoderma lucidum (Curtis) P. Karst tespit etmişşlerdir. G. lucidum'un çalışılan test mikroorganizmaları üzerinde farklı düzeylerde inhibisyon etki gösterdiği belirlenmiştir. İnhibisyon gösterdiği test mikroorganizmalarına etkisi, standart antibiyotiklerin bazılarına göre daha iyi veya bazılarına yakın boyuttadır (Kalyoncu ve ark., 2010).
3. TEZİN AMACI
Günümüzde mantarlar besin olarak tüketilmekle birlikte sahip oldukları aktioksidan, antimikrobiyal ve sitotoksik özelliklerden dolayı kullanım alanları yaygınlaşmıştır. On binlerce çeşidi bulunan mantarlar, protein ve demir bakımından oldukça zengindir ve bağışıklık sistemini güçlendirerek hastalıklara karşı koruyucu etki yaparlar. Yabani ve yenilebilir mantarlar sağlık için yenilebildiği gibi içerdiği değişik biyoaktif bileşenlerden dolayı da sinerji oluşturarak sağlıklı yaşamın devam etmesinde önemli rol
oynamaktadır. Makromantarlar önemli bir doğal besin kaynağı olmakla birlikte uzak
doğu kültüründe halk hekimliğinde oldukça fazla kullanılmaktadır. Makromantarların taşımış oldukları tıbbi özellikleri üzerine yapılan çalışmalar, antitümör özelliği, antimikrobiyal etki, antibiyotik etkisi, antioksidan özelliği gibi başlıklar altında toplanılabilmektedir. Bu nedenlerden dolayı; bu çalışmada bazı yenilebilen mantar türlerinin Armillaria mellea, Craterellus cornucopioides, Laccaria laccata, Lepista
nuda, Leucoagaricus leucothites ve Lycoperdon molle'nın antioksidan kapasiteleri,
antimikrobiyal ve HepG2 ve MCF-7 hücrelerine karşı sitotoksik etkileri analiz edilmiştir.
14 4. MATERYAL ve METOT
4.1. Kullanılan cihazlar
Tez Çalışmasında; Thermo MultiScanGO marka mikroplaka spektrofotometre, Thermal marka Soxhlet Ekstraktörü, IKA RV 10 marka Rotary Evaporatör, Nüve marka Otoklav ve Etüv kullanılmıştır. İlave olarak Dry Black marka Thermostat, Leica DM IL-Led marka invert hücre mikroskobu, Metisafe marka Class 2 Biyogüvenlik kabini, Sanyo
marka CO2 inkübatörü, Sigma marka Santrifüj, Bio-Rad (TC10) marka hücre sayım
cihazı kullanılmıştır.
4.2. Kullanılan kimyasallar
Deneylerde kullanılan kimyasallar ise şu şekildedir: AppliChem marka DPPH (2,2-difenil-1-pikril hidraliz); Sigma marka TCA (Trichloro acetic acid), K
3Fe(CN)6
(Potasyum ferrisiyanür), FeCI
3(Demir (III) klorür), Sodyum Asetat. Merck marka
Gallik asid, Folin reaktifi, Sodyum karbonat (Na
2CO3), Aseton, Hekzan, Metanol,
Mueller Hinton Agar, Mueller Hinton Broth; Lonza marka RPMI-1640, Sodyum piruvat ve PBS. Lonza marka FBS ve Trypsin.
4.3. Mantar örnekleri
Karadeniz bölgesinin farklı bölgelerinde yetişen ve doğal yaşam alanlarından toplanan mantar örnekleri çalışmada kullanılmıştır. Kullanılan mantar örnekleri Prof. Dr. Abdullah KAYA’nın koleksiyonundan temin edilmiştir. Çalışmada kullanılan örnekler;
Armillaria mellea, Craterellus cornucopioides, Laccaria laccata, Lepista nuda, Leucoagaricus leucothites ve Lycoperdon molle Karamanoğlu Mehmetbey Üniversitesi
Kamil Özdağ Fen Fakültesi, Biyoloji Bölümünde saklanmaktadır. Mantarlara ait genel özellikler aşağıdaki gibi özetlenebilir (Atila, 2013).
4.3.1. Armillaria mellea (Vahl) P. Kumm.
Şapka, 5-12 cm çapında, gençlerde konveks, ileriki aşamalarda yarıküreden düzleşerek ortası hafifçe içe çökerek çukurlaşır (Şekil 4.1). Rengi sarımsıdan koyu kahverengiye kadar değişir. Üzerinde özellikle merkezinde yoğunlaşan yeşilimsi kahverengi pullar bulunmaktadır. Lameller, gelişmenin ilk dönemlerinde beyaz, sonra sarımsı, olgunlaşınca pembemsi kahverengiye döner ve üzerinde koyu lekeler bulunur. Sapa
15
genişce girinti yaparak birleşir ve kenarları çentikli haldedir. Etli kısım, beyazımsı bir renkte, kalın, sulu, tadı acımsı ve DDT kokusunu andırmaktadır. Sap, 5-15×0,5-1,5 cm boyutlarında, silindirik, içi dolu, fibrilli, oldukça dayanıklı, kırmızımsı kahverengi renktedir yuvarlak ve belirgin beyaz annulus bulunmaktadır. Sporlar, 7-9×5,5-6,5 µm boyutlarında, geniş eliptik, düz, hiyalin, yağ damlalıdır ve spor tozları krem renklidir.
Armillaria mellea hem geniş yapraklı ağaçlarda, hem de ibrelilerde parazit olarak
yaşamaktadır (Moser, 1983). Literatüre göre yenir (Phillips, 1981; Moser, 1983).
Şekil 4. 1. Armillaria mellea'nın bazidiyokarpları (Foto: A. KAYA) 4.3.2. Craterellus cornucopioides (L.) Pers.
Fruktifikasyon organı 6-10×3-7 cm boyutlarında olup şapka ve sap şeklinde belirgin ayrım yoktur (Şekil 4.2). Genellikle üstte genişleyen bir huni görünümündedir. Huninin iç yüzeyinde kalan üst yüzey siyah veya koyu gri renktedir. Altta kalan himeniyal yüzey ise genellikle düz veya bazen kırışık yapıda ve gri veya açık gri renklerdedir. Sporlar
10-17×6-11 m boyutlarında, elips şeklinde ve düz yüzeylidir. Craterellus
cornucopioides genellikle yayvan yapraklı ağaçlar altında tek tek veya gruplar halinde
16
Şekil 4. 2. Craterellus cornucopioides'ın bazidiyokarpları (Foto: Y. UZUN)
4.3.3. Laccaria laccata (Scop) Cooke.
Şapka 2-4 (6) cm çapında, gençlerde konveks, olgunlarda düz ve genellikle orta kısım
basıktır (Şekil 4.3). Islak halde iken portakal, tuğla kırmızısı veya kahverengi, kuru iken
ise daha soluk renktedir. Lameller şapka rengine yakın renkte düzensiz ve aralıklı olup sapa dekurrent veya adnexed tarzda bağlıdır. Sap 5-10×0,6-1 cm boyutlarında ve yüzeyi fibrillidir. Sporlar 7-10 μm çapında, küresel yapıda ve yüzeyi dikenli süslerle kaplıdır.
Laccaria laccata çoğunlukla ormanlık alanlarda ve gruplar halinde yetişir. Küçük
Boyutları küçük olmasına rağmen literatüre göre yenir niteliktedir (Arora, 1986).
17 4.3.4. Lepista nuda (Bull.: Fr.) Cooke
Şapka, 5-10 cm çapında, gençlerde yarım küre, mantarın gelişmesiyle açılarak dalgalı bir görünümdedir (Şekil 4.4). Merkezi hafifçe çukur halde, yüzeyi düz yapıda ve nemli iken yapışkandır. Gençken açık mavi, daha sonraki evrelerde, menekşe mavi veya kahverengiye dönüşür. Lameller, leylaktan gri-leylağa kadar değişen renklerde bazen mavimsi tonlardadır. Sap kısmına doğru çentik yaparak genişler ve çok sıkıdır. Etli kısım, açık renkte, yumuşak, sulu, kenarlarda ince, merkezde kalın ve sapta lifsi özellik gösterir. Tadı hoş ve aromatik bir meyve kokusundadır. Sap, 4-9×1-3 cm boyutlarında, silindirik, tabanı şişkin, içi doludur. Şapka renginde ya da daha açık renkli ve boyuna fibrilli yapıdadır. Sporlar, 6,8-7×4-5 μm boyutlarında, eliptik şekilde, dikenli, renksiz, saydam ve spor tozları pembemsi beyaz renktedir.
Lepista nuda çam ormanlarında, park bahçelerde yol ve patika kenarlarında, çimler
arasında, yaz sonu veya sonbaharda bol miktarda, nadiren de ilkbahar aylarında yetişmektedir (Breitenbach ve Kränzlin, 1991). Literatüre göre yenir (Moser, 1983; Breitenbach ve Kränzlin, 1991; Gerhardt, 1997). Bolu yöresinde “mavi cincile”, “büyük cincile”, olarak (Öder, 1972) adlandırılır. Manisa yöresinde isim verilmeksizin tanınıp yenir (Gücin ve Öner, 1982).
18 4.3.5. Leucoagaricus leucothites (Vittad.) Wasser
Şapka, 4-6 cm çapında, gençlerde silindirik çan şeklinde, gelişme ilerleyince konik konveksten şemsiye şeklini alır (Şekil 4.5). Ortası şişkin, gençken şapka merkezinde ince küçük tüyler bulunur, gelişme ilerleyince yüzey düzgünleşir. Başlarda beyazımsı renkte, gelişme ilerleyince merkezi kısım daha koyulaşarak sarımsı kahverengi veya pembemsi kahverengiye döner, kenarlar ise kirli krem rengindedir. Lameller, başlarda gri krem renktedir, gelişme ilerleyince krem beyazdan pembe veya gri pembeye döner ve sapa birleşmezler. Etli kısım, beyaz renkte, şapka merkezinde kalın, kenarlara doğru incelmektedir. Tadı ve kokusu belirgin değildir. Sap, 5-8(10)×1-2 cm boyutlarında, silindirik, tabanında küçük yumru şeklinde şiskinlik bulunur. İçi boş, krem beyaz renktedir, yüzeyi düz ve beyaz renkte annulus bulunur. Sporlar 7,5-10,5×4,5-6,5 µm boyutlarında, eliptik şekilde, düz, hiyalin, dextrinoid, kalın duvarlıdır ve spor tozları krem renklidir.
Leucoagaricus leucothites parklarda, çayırlarda, bahçe kenarlarında, tek tek veya toplu
halde yaz aylarında yetişmektedir (Moser, 1983; Breitenbach ve Kränzlin, 1991, Gerhardt, 1997). Literatüre göre yenmektedir (Moser, 1983; Dahncke, 1993; Breitenbach ve Kränzlin 1991, Gerhardt 1997).
19 4.3.6. Lycoperdon molle Pers.: Pers.
Fruktifikasyon organı 20-40 mm çapında ve armut veya topaç şeklinde, dış yüzeyi beyazımsı veya krem zemin üzerine, kısa, basit, yumuşak ve gri kahverengi renkte dikenlerle kaplıdır. Bazen bu dikenlerin birkaçının uçlarının birleşmesiyle piramidal görünümlü yapılar oluşur (Şekil 4.6). Mantarın olgunlaşmasıyla fruktifikasyonun üst orta kısmında meydana gelen parçalanma ile düzensiz yapılı bir açıklık oluşur ve spor kütlesi toz halinde buradan atılır. Etli kısım gençlerde beyaz ve süngerimsi yapıda olup, mantarın gelişim sürecinde önce sararır sonra da kahverengiye döner. Tadı ve kokusu belirgin değildir. Sporlar 4,5-6 m boyutlarında, küresel yapıda ve yüzeyi siğillidir.
Lycoperdon molle konifer ormanlarında veya yayvan yapraklı ağaçların oluşturduğu
ormanlarda yetişir (Breitenbach ve Kränzlin, 1986). Etinin beyaz olduğu evrede yenebilir özelliktedir (Buczacki, 1992).
Şekil 4. 6. Lycoperdon molle'nin bazidiyokarpları (Foto: Y. UZUN)
4.4. Mantar ekstrelerinin hazırlanması
Çalışmada kullanılan mantar örnekleri: Armillaria mellea, Craterellus cornucopioides,
Laccaria laccata, Lepista nuda, Leucagaricus leucothites ve Lycoperdon molle
Karamanoğlu Mehmetbey Üniversitesi, Fen Fakültesi, Biyoloji Bölümü, Botanik Anabilim dalı mantar koleksiyonundan sorumlu öğretim üyesi Prof. Dr. Abdullah KAYA tarafından temin edilmiştir. Mantarların sitotoksik, antioksidan ve antimikrobiyal etkilerinin incelenmesi amacıyla su ve metanol ekstreleri hazırlanmıştır. Bunun için mantar örnekleri ilk önce havanda sıvı azot kullanılarak toz haline
20
getirilmiştir. Her mantar 10 g olacak şekilde tartılıp, 300 mL distile su veya 300 mL metanol içerisinde soxhlet ekstraksiyon (Şekil 4.7a) cihazında ekstraksiyona tabi edilmiştir. Ekstreler rotary evapotör cihazında konsantre edilip (Şekil 4.7b) liyofilizatör ile kurutularak toz haline getirilmiş, çalışmalarda kullanılmak üzere +4ºC de saklanmıştır.
Şekil 4. 7.Soxhlet Ekstraktörü (a), Rotary Evaporatör (b) 4.5. Biyoaktif içeriklerin belirlenmesi
4.5.1. Toplam fenolik içeriği Folin-Ciocalteu yöntemiyle belirlenmesi
Bu yöntem; Slinkard ve Singleton tarafından antioksidanların toplam fenol miktarını belirlemek amacıyla geliştirilmiştir. Yöntem suda ve diğer organik çözücülerde çözünmüş olan fenolik bileşiklerin Folin reaktifi ile alkali ortamda renkli kompleks oluşturması temeline dayanır (Slinkard ve Singleton, 1977). Bu yöntemde kullanılan CuSO4 (bakır(II) sülfat), alkali ortamda protein veya antioksidanlarla kompleks yapar.
Folin fenol reaktifi (fosfomolibdik fosfotungstik asit) eklendiğinde ise folin reaktifi proteinlere bağlanır. Protein veya antioksidanla Cu(II)’nin reaksiyonundan açığa çıkan Cu(I), molibdatotungstat ayıracını mavi renge indirger (Dağdelen, 2010). Reaksiyon tamamlanınca 750 nm’de örnek absorbansları ölçülür (Somogyı ve ark., 2007).
Makromantar ekstrelerindeki toplam fenolik madde miktarı Singleton ve Rossi (1965)’nin kullandığı yönteme göre belirlenmiştir. Yöntemde standart olarak gallik asit (0,02-0,05-0,10-0,20-0,50-0,75-1,00 mM) kullanılmıştır. 10 mg/mL konsantrasyondaki mantar ekstresi ve standartlardan (0,02-1,00 mM) 20 µL mikro plaka kuyucuklarına koyulmuştur. Üzerlerine 20 µL Folin reaktifi (2N) eklenmiş ve pipetajlama ile
21
karıştırılan örnekler karanlıkta 3 dk inkübe edilmiştir. Sonra üzerlerine 20 µL %35’lik
(w/v) sodyum karbonat ve 140 µL dH2O eklenerek 10 dk karanlık ortamda
bekletilmiştir. 725 nm’de kör tüpüne karşı absorbans değerleri okunmuş, gallik asit ile oluşturulmuş standart kalibrasyon eğrisi kullanılarak her 1 mg ekstre içinde bulunan toplam fenolik içerik miktarları hesaplanmıştır.
4.5.2. Toplam flavonoid içeriği
Bitkilerde bulunan flavonoidler bitki sekonder metaboliti olan ve antioksidan kapasiteye katkı sağlayan önemli bileşiklerdendir. Flavonoid tayini bitkisel ekstraktların toplam flavonoid madde içeriğini ortaya çıkarmaktadır. Kullanılan bu yöntem, flavonoid alüminyum kompleksinin oluşumu esasına dayanmaktadır ve bu kompleks 415 nm’de spektrofotometrede maksimum absorbansa sahiptir (Arkan, 2011).
Barros ve arkadaşlarının (2008) yöntemine göre mantarların saf su ve metanol ekstrelerı içerisindeki toplam flavonoid miktarları belirlenmiştir. Yönteme göre 50 µL mantar ekstreleri (10 mg/mL) mikroplaka kuyucuklarına konulmuştur. Üzerlerine sırasıyla 215
µL %80’lik (v/v) etanol, 5 µL AlNO3 (%10 w/v) ve 5 µL potasyum asetat (1M)
eklenmiştir. 40 dk oda sıcaklığında bekletildikten sonra spektrofotometrede 415 nm dalga boyunda absorbans değerleri kör tüpüne karşı okunmuş, toplam flavanoid içeriği 1 mg ekstre içerisindeki flavanoid miktarı olarak aşağıdaki formüle göre hesaplanmıştır (Pal ve ark., 2010).
Toplam Flavonoid içeriği (µg/mg ekstre)= (A415+ 0,01089) / 0,002108
4.5.3. β-Karoten ve Likopen içeriği
β-Karoten-linoleik asit test sistemi, yüksek sıcaklıkta linoleik asit oksidasyonundan kaynaklanan konjuge dien hidroperoksitlerin inhibisyonunun ölçülmesine ve β-Karoten molekülünde renk açılması esasına dayanır (Arkan, 2011). Ölçümler sonucunda linoleik asidin oksidayonunu inhibe etme oranının yüksek olması bu numunenin güçlü bir antioksidan kapasitesi olduğunu gösterir (Apak ve ark., 2007).
Mantarların metanol ve saf su ekstrelerinin içinde bulunan β karoten ve likopen miktarlarının belirlenmesi için, 1mL ekstre, 1 mL aseton:hekzan (4:6) ile karıştırılıp vortekslendikten sonra filtre yardımı ile süzülmüştür. Sonra 453, 505 ve 663 nm dalga
22
boylarındaki absorbans değerleri kullanılarak β karoten ve likopen miktarları aşağıda yer alan formüle göre hesaplanmıştır (Pal ve ark., 2010).
β-karoten içeriği (mg/100 mg) = 0,216 A663– 0,304 A505+ 0,452 A453
Likopen içeriği (mg/100 mg) = -0,0458 A663 + 0,372 A505 – 0,0806 A453
4.6. Antioksidan aktivitesi tayin yöntemleri
Örneklerin antioksidan aktivitesinin belirlenmesi için DPPH radikali yakalama aktivitesi ve indirgeme gücü aktivitesi yöntemleri kullanılmıştır.
4.6.1. DPPH serbest radikal yakalama aktivitelerinin belirlenmesi
Bu yöntem ilk kez Blois (1958), tarafından 1,1-difenil-2-pikril hidrazil (DPPH) (Şekil 4.8) radikallerinin antioksidan moleküllerin tayininde kullanılabileceğinin önerilmesi ile ortaya çıkmıştır. Antioksidan aktivite ölçümlerinin çoğaldığı yıllarda Brand-Williams ve arkadaşları yöntemi geliştirmiş ve pek çok araştırıcı tarafından referans olarak kabul edilmiştir (Metin, 2012).
Şekil 4. 8.DPPH radikalinin kimyasal yapısı
Yöntemde antioksidan kapasitesi belirlenecek maddelere DPPH çözeltisi ilave edilir. DPPH antioksidan madde ile reaksiyona girdiği zaman indirgenerek koyu menekşe olan rengi sarı renkli difenilpikrilhidrazine (Şekil 4.9) dönüşmekte ve bu renk değişimi 517 nm’de spektrofotometrik olarak belirlenebilmektedir (Molyneux, 2004). Sonuçta IC50 adı verilen ve ekstrakın DPPH radikalinin yarısını süpürebildiği konsantrasyon
belirlenir. Bu IC50 değeri ekstrakların serbest radikal süpürme etkinliğini verir. IC50
değerinin düşük olması antioksidan kapasitenin oldukça güçlü olduğunu anlamına gelir (Arkan, 2011).
23 Şekil 4.9.Difenilpikrilhidrazil (DPPH) radikali
Mantar ekstrelerinin antioksidan aktivitesi DPPH radikalini yakalama kabiliyetine dayanılarak ölçülmüştür. DPPH serbest radikal giderme Blois metoduna (1958) göre yapılmıştır. Mantar ekstrelerinin serbest radikal (DPPH:2,2-difenil-1-pikril hidrazil) giderme aktivitesinin ölçümünde standart olarak gallik asit (0,005-0,01-0,02-0,04-0,06-0,08-0,1-0,2 mM) ve değişik konsantrasyonlarda mantar ekstreleri (0,25- 0,5- 0,75,- 1- 2- 4- 5- 7- 10 mg/mL) hazırlanmıştır. Yönteme göre mantar ekstreleri ve standartlardan, her bir mikro plaka kuyucuğuna 20 µL koyulmuş ve üzerlerine 180 µL DPPH (metanol içerisinde 0,06 mM) eklenmiştir. Karanlık ortamda 60 dk bekletildikten sonra 517 nm’de absorbans değerleri ölçülerek DPPH radikalinin indirgenmesi belirlenmiştir. Serbest radikal yakalama aktiviteleri aşağıda bulunan formülle göre hesaplanmıştır.
DPPH radikal yakalama aktivitesi her örnek için EC50 değerleri hesaplanarak
karşılaştırılmıştır (Türkoğlu ve ark., 2007).
’ ğ ğ ’ ğ
4.6.2. İndirgeme gücü aktivitesi
Bu yöntemde antioksidan maddenin indirgeme gücüne bağlı olarak antioksidan aktivite belirlenir. Serbest radikalleri yakalama aktivitesi esasına dayanan yöntemlerden biri olan indirgeme potansiyeli metodunda yüksek absorbans, yüksek indirgeme potansiyelini göstermektedir. Potasyum ferrisiyanid [K3Fe(CN)6] içerisindeki Fe(III)
iyonlarının antioksidan reaksiyon sistemi içersinde Fe(II) iyonlarına indirgenmesi ile antioksidan aktivite belirlenir (Mathew ve Abraham, 2006 ).
Antioksidan aktivite belirleme yöntemlerinden biri olan indirgeme gücü Oyaizu metodu kullanılarak belirlenmiştir (Yen ve Chen, 1995). Mantar ekstrelerinin total indirgeme gücünün belirlenmesinde standart olarak gallik asit kullanılmıştır. Değişik konsantrasyonlarda (0,05- 0,1- 0,2- 0,4- 0,8- 1 mM) gallik asit ve mantar ekstreleri
(1-2-24
4-6-8-10-20-40 mg/mL) hazırlanmış, 50 µL mikro plaka kuyucuklarına konulmuştur.
Üzerlerine 75 µL fosfat tamponu (0,2 M pH:6:6) ve 75 µL K3Fe(CN)6 (%1 w/v)
çözeltileri ilave edilmiş ve vortekslenmiştir. Ardından 20 dakika 50°C’lik inkübe edilen
örneklerin üzerine 75 µL trikloroasetik asit (%10 w/v) çözeltisi eklenmiş ve 10 dakika 1000 g’de sanrifüjlenmiştir. Santrifüjlenen karışımdan 75 µL alınıp başka bir mikro
plakaya konulmuştur ve üzerine 75 µL distile su ve 15 µL FeCI3 (0,1% w/v) çözeltisi
eklenerek pipetejlama yapılmıştır. Ardından spektrometrede 700 nm’de köre karşı absorbansları okunmuş ve indirgeme gücü aktivitesi hesaplanmıştır. Kör için mikro plaka kuyucuklara sadece distile su ve kontrol için ise numune yerine su kullanılmıştır (Karamac ve ark., 2002).
4.7. Mantarların antimikrobiyal etkilerinin belirlenmesi 4.7.1. Çalışmada kullanılan mikroorganizmalar
Antimikrobiyal aktivite çalışmasında kullanılan test mikroorganizmaları Karamanoğlu Mehmetbey Üniversitesi, Fen Fakültesi, Biyoloji Bölümü, Temel ve Endüstriyel Mikrobiyoloji Anabilim dalı kültür kolleksiyonundan Yrd. Doç. Dr. Aytaç KOCABAŞ tarafından temin edilmiştir. Bu mikroorganizmalar Bacillus subtilis, Enterococcus
faecalis, Bacillus licheniformis, Agrobacterium tumefaciens, Escherichia coli 0157:H7
ATCC 43895, Staphylococcus aureus ATCC 2921 suşlarıdır.
4.7.2. Antimikrobiyal aktivite belirlenme yöntemleri
Antimikrobiyal aktivitenin belirlenmesi amacıyla farklı yöntemler kullanılmaktadır. Bu yöntemlerden disk difüzyon metodu (DDM) ve minimum inhibisyon konsantrasyonu (MİK) belirlenmesi en çok kullanılan iki yöntemdir.
Mikroorganizmaların kültüre edilmesi ve disk difüzyon yöntemi ile inhibisyon zonu belirlenmesi
Antimikrobiyal aktivitenin belirlenmesi amacıyla kullanılan en yaygın yöntem disk difüzyon metodudur (Karankı, 2013). Bu yöntemde bakteriler katı besiyerine ekilir ve istenilen konsantrasyonlarda hazırlanan ekstrelerin emdirildiği kâğıt diskler ve standart antibiyotikler besiyerine yerleştirilir. Bellirli bir süre ve sıcaklıkta inkübasyondan sonra besiyerlerinde oluşan inhibisyon zon çapları ölçülerek karşılaştırma yapılır. Bu yöntem patojenlerde antibiyotik hassasiyetini test etmek için oldukça sık kullanılan bir yöntemdir (Tekerlek, 2013).
25
Çalışmada kullanılan altı adet test bakterisi (Bacillus subtilis, Enterococcus faecalis,
Bacillus licheniformis, Agrobacterium tumefaciens, Escherichia coli 0157:H7 ATCC
43895, Staphylococcus aureus ATCC 2921) Mueller Hinton Broth (MHB) sıvı besiyeri ortamında çalkalayıcılı inkübatörde bir gece inkübe edilmiştir. Test edilen mikroorganizmalardan B. subtilis, B. licheniformis ve S. aureus ATCC 2921, E. faecalis gram pozitif bakteri iken E. coli 0157:H7 ATCC 43895 ve A. tumefaciens gram negatif bakteridir. Sıvı kültürde inkübasyon ile çoğaltılan mikroorganizmaların yoğunlukları
0,5 Mc Farland (1.5x108 CFU/mL) standardına eşit olacak şekilde ayarlanarak
antibiyogramların yapılacağı Mueller Hinton Agar besi yerlerine 100 µL yayma ekim yöntemiyle ekimleri yapılmıştır. Disk difüzyon yöntemi için mantar ekstratları 200 mg/mL olarak stok hazırlanmıştır. Disklere hazırlanan mantar ekstraktlarından 20 µL olacak şekilde emdirilmiş ve petri plakları üzerine yerleştirilmiştir. Standart antibiyotik olarak gentamisin kullanılmıştır. Daha sonra petri plakları antimikrobiyal etkilerin incelenebilmesi için A. tumefaciens (28°C) ve diğer mikroorganizmalar (35°C) bir gece boyunca inkübe edilmiştir. Bu süre sonunda disklerin çevresinde meydana gelen inhibisyon zonları cetvel yardımıyla mm olarak ölçülmüştür. Elde edilen sonuçlar antimikrobiyal etkinlikleri bakımından karşılaştırılmıştır.
Minimum inhibasyon konsantrasyonu belirleme yöntemi hazırlanması ve ekimi
Farklı konsantrasyonlarda test edilen antimikrobiyal maddelerin, mikrobiyal gelişimi tamamen durdurduğu veya engellediği en düşük derişim Minimum İnhibisyon Konsantrasyonu (MİK) olarak ifade edilmektedir.
MİK değerlerini belirlemek amacıyla sıvı besiyerlerinde veya katı besiyerlerinde antimikrobiyal etkisi olan bileşiklerin seyreltik olarak belirli oranlarda eklenmesiyle hazırlanan besi ortamları kullanılmaktadır. Bir antimikrobiyal madde için MİK değeri mikroorganizma, inkübasyon sıcaklığı ve inokulum miktarı gibi analiz koşullarına bağlı olarak farklılık gösterebilir (Tekerlek, 2013).
Mantar örneklerinin çeşitli mikroorganizmalar üzerine MİK değerlerinin belirlenmesi için çalışılacak konsantrasyonların iki katı örnek hazırlanmıştır. Optimizasyon çalışmasında belirlenen aralıklardan dolayı bazı mantar ekstreleri için farklı seyretme konsantrasyonları kullanılmıştır. Lepista nuda'nın su ekstresi