TC.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
HIV POZİTİF HASTALARDA PROTEAZ, REVERS TRANSKRİPTAZ VE
İNTEGRAZ İNHİBİTÖRLERİNE KARŞI GELİŞEN İLAÇ
DİRENÇLERİNİN YENİ NESİL DİZİLEME (YND-NGS) İLE
ARAŞTIRILMASI
UZMANLIK TEZİ
Dr. Duygu Tekin
DANIŞMAN:
Prof. Dr. RÜÇHAN SERTÖZ
TC.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
HIV POZİTİF HASTALARDA PROTEAZ, REVERS TRANSKRİPTAZ VE
İNTEGRAZ İNHİBİTÖRLERİNE KARŞI GELİŞEN İLAÇ
DİRENÇLERİNİN YENİ NESİL DİZİLEME (YND-NGS) İLE
ARAŞTIRILMASI
UZMANLIK TEZİ
Dr. Duygu Tekin
DANIŞMAN:
Prof. Dr. RÜÇHAN SERTÖZ
DEĞERLENDİRME KURULU ÜYELERİ
(Adı Soyadı) (İmza)
Başkan : Prof.Dr. ………. ... (Danışman) Üye : Prof.Dr. ………. ... Üye : Prof.Dr. ………. ...
Üye : Prof.Dr. ………. ... Üye : Prof.Dr. ………. ...
ÖNSÖZ
Uzmanlık eğitimi süresi ve tez çalışmalarım sırasında desteklerini
esirgemeyen başta tez danışmanım Prof. Dr. Rüçhan Sertöz olmak üzere değerli
hocalarımız Prof. Dr. Selda Erensoy, Prof. Dr. Ayşın Zeytinoğlu, Prof. Dr. İmre
Altuğlu, Prof. Dr. Alper Tünger, Prof. Dr. Cengiz Çavuşoğlu, Prof. Dr. Feriha Çilli,
Prof. Dr. Şöhret Aydemir, Prof. Dr. Candan Çiçek, Prof. Dr. Dilek Yeşim Metin, Prof.
Dr. Süleyha Hilmioğlu Polat ve Prof Dr. Ramazan İnci’ ye minnetlerimi sunmayı bir
borç bilirim.
Çalışma süresi boyunca teknik desteklerini esirgemeyen ve çalışmanın
eğlenceli hale gelmesini sağlayan Sağlık teknikeri Ergül Utkun’a çok teşekkür eder,
bilgi ve deneyimlerini daima benimle paylaşan hekim ve çalışma arkadaşlarıma,
her zaman yanımda olan aileme sonsuz şükranlarımı sunarım.
I
ÖZET
AMAÇ: Human Immunodeficiency Virus (HIV) infeksiyonu, antiretroviral ilaçların uygun kombinasyonlarda (highly active antiretroviral therapy-HAART) kullanılmasıyla ölümcül bir hastalıktan kontrol altına alınabilen kronik bir hastalığa dönüşmüştür. Uzun ve etkili HIV enfeksiyonu tedavisinin önündeki en büyük engellerden biri antiretroviral ilaç direncidir. En uygun tedavi rejiminin belirlenmesi için tanıdan sonra mümkün olan en kısa zamanda ilaç duyarlılık testinin yapılması önerilir. Sanger zincir sonlandırma reaksiyonu HIV ilaç direnç mutasyonlarının saptanmasında altın standarttır. Ama %20’nın altında bulunan direnç mutasyonlarını saptayamaması dezavantajıdır. Ayrıca Sanger temelli ticari kitler esas olarak proteaz ve revers transkriptaz gen bölge mutasyonlarını tespit etmektedir. Yeni nesil dizileme (YND) ile >%1 mutasyonların saptanması mümkün hale gelmiştir. İntegraz inhibitörlerinin ilk tedavi seçeneği olarak artan kullanımı ile bu ilaçlara karşı gelişen direnç mutasyonlarının da izlenmesi gerekliliği gündeme gelmiştir. Çalışmamızda YND ile proteaz, revers transkriptaz ile birlikte integraz bölge direnç mutasyonlarını tek bir amplikon kullanılarak saptanması amaçlanmıştır.
GEREÇ ve YÖNTEM: Ege Üniversitesi Tıp Fakültesi Tıbbı Mikrobiyoloji Anabilim Dalı Moleküler Viroloji Laboratuvarı’nda HIV pozitif hasta örneklerinden 2008 yılı itibariyle Sanger zincir sonlandırma reaksiyonu temelli Viroseq (Abbott, ABD) ile proteaz, revers transkriptaz inhibitörlerine karşı gelişen ilaç dirençleri rutin olarak çalışılmaktadır. Çalışmamıza arşivlenmiş olan örneklerden farklı direnç profiline sahip 40 HIV pozitif hasta örneği dahil edilmiştir. HIV pol gen bölgesinin dizilenmesi ve subtiplerin belirlenmesi için hasta örneklerinden viral RNA ekstraksiyonu, tek basamak RT (Reverse-Transcription) polimeraz zincir reaksiyonu (PCR) ve nested PCR sonrası elde edilen ürünler YND teknolojisi ile dizilendi. Sekans verileri, HXB2 referans sekansı (GenBank accession # NC_001802) CLC Genomics Workbench versiyon 8.1 ile %1 ve %5 cut off kullanılarak analiz edildi. Mutasyon belirlenmesi ve subtiplendirme Stanford Üniversitesi HIV-1 ilaç Direnci Veri Bankası versiyon 8.4 (http://hivdb.stanford.edu) kullanılarak yapıldı.
BULGULAR: 40 hastanın 27’si alttip B (%67,5), altısı B+CRF 02_AG (%15), üçü alttip A (%7,5), ikisi G+J (%5), biri CRF07_BC (%2,5) ve biri B+F (%2,5) şeklinde saptanmıştır. Örneklerin yedisinde (%17,5) en az bir antiretroviral ilaca olası düşük seviyeden yüksek seviyeye kadar değişen direnç tespit edilmiştir; nükleotid revers transkriptaz inhibitörleri (NRTI) ve non-nükleozid revers transkriptaz inhibitörleri (NNRTI) direnç mutasyonları oranı sırasıyla %5, %12,5 olarak bulunmuştur. Proteaz inhibitörü (PI) ve integraz inhibitörü (INSTI) direnç mutasyonu ise saptanmamıştır.
II Bir örnekte K103N majör NNRTI mutasyonu, iki örnekte M41L ve T215D/S mutasyonu, iki örnekte E138A mutasyonu, iki örnekte E138G mutasyonu tespitedilmiştir.
Proteaz ve revers transkriptaz inhibitörlerine karşı gelişen direnç ve genotip açıdan 40 örneğin sonuçları Sanger zincir sonlandırma reaksiyonu ile uyumlu (%100) bulunmuştur. %1 ve %5 cut off arasında fark saptanmamıştır.
SONUÇ: Çalışmamızda 40 hasta örneğinin YND ile PI, NRTI, NNRTI İle birlikte INSTI’ne karşı gelişen ilaç dirençleri tek bir amplikon kullanılarak tespit edilmiştir. Bu yöntemle hem integraz gen bölgesi dizi analizi yapılmış hem de örneklerin havuzlanması ve “multiplekslenmesi” (tek seferde birçok testin birlikte çalışılması) ile ̴%90 oranında maliyet düşmüştür. Ayrıca >%1 ilaç dirençli mutasyonların tespit edilmesi hastaların tedavisininin yönlendirilmesinde yol gösterici olacaktır.
Anahtar Kelimeler: HIV İlaç Direnci, Yeni Nesil Dizileme, İntegraz gen bölge dizi analizi
III
ABSTRACT
OBJECTIVE: HIV (Human Immunodeficiency Virus) infection has transformed, by using antiretroviral drugs in appropriate combinations (highly active antiretroviral therapy-HAART); from a fatal disease to a chronic disease that can be controlled. One of the biggest patient management problem is antiretroviral drug resistance. To determine the most appropriate treatment regimen, it is recommended that the drug susceptibility test be performed as soon as possible after diagnosis. The Sanger chain termination reaction is the gold standard for HIV drug resistance mutation detection. But the disadvantage is that it can not detect resistance mutations below 20%. In addition, Sanger-based commercial kits mainly detect protease and reverse transcriptase gene region mutations. It has become possible to detect >1% mutations with the new generation sequencing (NGS). Increasing use of integrase inhibitors as an initial treatment option has necessitated the monitoring of resistance mutations against these drugs. In our study, it was aimed to detect the protease, reverse transcriptase and integrase resistance mutations with NGS using a single amplicon.
MATERIALS AND METHODS: In the Department of Medical Microbiology Laboratory of Ege University; drug resistance to protease, reverse transcriptase inhibitors has been routinely studied in HIV positive patient samples with Viroseq (Abbott, USA) based on the Sanger chain termination reaction since 2008. Forty samples of HIV positive patients with different resistance profiles were included from the archived samples. After viral RNA extraction, one step reverse transcription and nested PCR were performed. HIV pol gene region were sequenced by NGS technology. Sequence data were analyzed using 1% and 5% cut off with the CLC Genomics Workbench version 8.1 with the HXB2 reference sequence (GenBank accession # NC_001802). Mutation detection and subtyping was performed using Stanford University HIV-1 Drug Resistance Data Bank version 8.4 (http://hivdb.stanford.edu).
RESULTS: Of the 40 patients, 27 were subtype B (67.5%), six were B + CRF 02_AG (15%), three were subtype A (7.5%), two were G + J (5%), one was CRF07_BC (%2,5) and one was B + F (2.5%). Seven of the samples (17.5%) had a resistance to at least one antiretroviral drug, ranging from a possible low to high level of resistance; the rate of resistance mutations of nucleotide reverse transcriptase inhibitors (NRTI) and non-nucleoside reverse transcriptase inhibitors (NNRTI) were found to be 5%, 12.5% respectively. Protease inhibitor (PI) and integrase inhibitor (INSTI) resistance mutations were not detected. In one sample major K103N NNRTI mutation, in two samples M41L and T215D / S NRTI mutations, in two samples E138A NNRTI mutation, in two samples E138G NNRTI mutation were detected. Forty sample results in terms of genotype and resistance to
IV protease and reverse transcriptase inhibitors were found to be concordant with the Sanger chain termination reaction (100%). There was no difference between 1% and 5% cut off.
CONCLUSION: In our study, drug resistances to INSTI in addition to PI, NRTI, and NNRTI were detected using a single amplicon in 40 patients with NGS. In this method, integrase gene region sequence analysis has been made and 90% cost reduction was achieved by pooling and "multiplexing" of samples. Furthermore, detection of >1% drug resistant mutations will guide the treatment of patients.
Keywords: HIV Drug Resıstance, Next Generatıon Sequencıng, Integrase gene region sequence.
V
İÇİNDEKİLER
ABSTRACT ... III İÇİNDEKİLER ... V ŞEKİLLER ... VIII TABLOLAR ... IX KISALTMALAR ... IX 1.GİRİŞ VE AMAÇ ... 1 2.GENEL BİLGİLER ... 2 2.1 Tarihçe ve Köken... 22.2.Epidemiyoloji ve Bulaşma Yolları ... 3
2.2.1.Epidemiyoloji ... 3
2.2.2.Bulaşma Yolları ... 4
2.3.Genel Mikrobiyolojik Özellikleri... 5
2.3.1.Yapı ve Genomik Organizasyon ... 5
2.3.1.1.Yapısal Proteinler ... 5 2.3.1.1.1.Gag-Pol öncülü (Pr160GagPol) ... 5 2.3.1.1.2.Gag (Pr55Gag) ... 5 2.3.1.1.3.Pol ... 5 2.3.1.1.4.Env ... 5 2.3.1.2. Düzenleyici Proteinler ... 6 2.3.1.2.1.Tat ... 6 2.3.1.2.2.Rev ... 6 2.3.1.3. Aksesuar Proteinler ... 6 2.3.1.3.1.Nef... 6 2.3.1.3.2.Vpr... 6 2.3.1.3.3.Vpu ... 6 2.3.1.3.4.Vif ... 6
VI
2.3.2. Replikasyon döngüsü ... 6
2.4. Klinik Tablolar ... 7
2.4.1. Doğal Seyir ... 7
2.4.2.Klinik Tablolar ... 7
2.5.Laboratuvar testleri ve tanı ...10
2.5.1.HIV tanısında kullanılan testler ...10
2.5.1.1.Serolojik yöntemler ...10
2.5.1.1.1.Tarama testleri ...10
2.5.1.1.2.Doğrulama testleri...11
2.5.1.2.Hızlı testlerin tanıdaki yeri ...11
2.5.1.3. Moleküler Tanı ...11
2.5.1.4. İlaç Direnç Testleri ...12
2.5.1.4.1.Genotipik Direnç Testleri ...12
2.5.1.4.2.Fenotipik Direnç testleri ...13
2.6. Tedavi ve Antiretroviral İlaçlar ...14
2.6.1. ART’ye Başlama Zamanı ...14
2.6.2. Antiretroviral İlaçlar ve Direnç Mekanizmaları...15
2.6.3. HIV İnfeksiyonu Tedavisinde Önerilen ART Rejimleri ...17
2.6.4. Prognoz ...18
2.7. Önleme ve Kontrol ...18
2.7.1. Perinatal Geçişin Önlenmesi ...19
2.7.2. Temas Öncesi Profilaksi ...19
2.7.3. Temas Sonrası Profilaksi (TSP) ...19
2.8.Yeni Nesil Dizileme ...19
3.GEREÇ VE YÖNTEM ...25
3.1. RNA İzolasyonu: ...25
3.2.Tek Basamak RT PCR ...26
VII
3.4.Yeni nesil dizileme ...28
3.4.1.PCR ürünlerinin pürifikasyon işlemi ...28
3.4.2.DNA tegmentasyonu ve PCR amplifikasyonu ...28
3.4.3.PCR temizleme ...30
3.4.4.MiSeq Cihaza Yükleme ...30
3.4.5.Veri Analizi ...31
4.BULGULAR ...31
5.TARTIŞMA...34
6.SONUÇ ...39
VIII
ŞEKİLLER
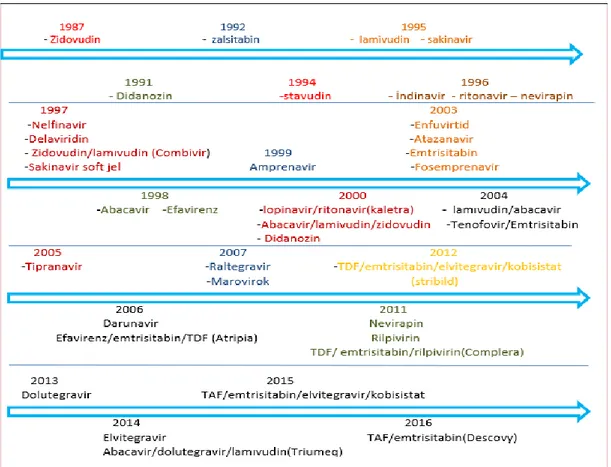
Şekil 1. FDA tarafından onaylı antiretroviral ilaçlar ve kombinasyonları ...16
Şekil 2. 454 dizileme teknolojisi ...21
Şekil 3. “Flow cell”’in görünümü...22
Şekil 4. DNA’nın kümeleştirilmesi ...23
Şekil 5. Dizileme işlemi sırasında 3’OH ucun aktive hale gelmesi...23
Şekil 6. MiSeq sistemi ile dizileme işlemi ...24
Şekil 7.Tek basamak RT PCR ...27
IX
TABLOLAR
Tablo 1. HIV tarama testi EIA yalancı negatif ve pozitif sonuçları (42) ...11
Tablo 2. Antiretroviral ilaçların etki mekanizmalarına göre sınıflandırılması ...15
Tablo 3. DHHS, EACS, DSÖ ve BHIVA Rehberlerinin ART Önerileri (49,50,51) ...18
Tablo 4. Yeni Nesil Dizileme platformların genel özellikleri (56) ...21
Tablo 5.Bir reaksiyon için amplifikasyon karışım miktarlar...26
Tablo 6.Tek basamak RT PCR amplifikasyon profili ...26
Tablo 7.Her bir amplifikasyon ürünü için amplifikasyon karışımı ...27
Tablo 8. Nested PCR amplifikasyon profili ...27
Tablo 9.YND Dizileme İlaç Direnç ve Genotip Sonuçları ...32
Tablo 10. YND Dizileme İlaç Direnç ve Genotip Sonuçları ...33
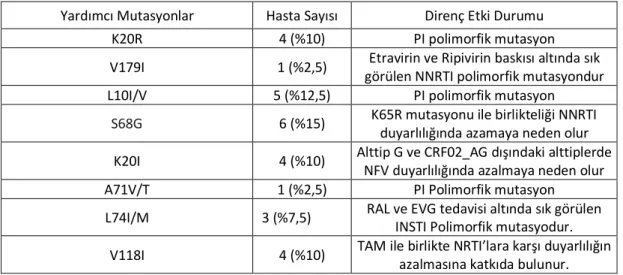
Tablo 11. Yardımcı mutasyonlar ve Direnç Etki Durumu ...34
KISALTMALAR
X
AZT: Zidovudin
HAART: Highly active antiretroviral therapy
UNAIDS: United Nations Programme on HIV and AIDS
ART: Antiretroviral tedavi
NRTI: Nükleozid ve nükleotid revers transkriptaz inhibitörü
PI: Proteaz inhibitörleri
NNRTI: Non-nükleozid revers transkriptaz inhibitörleri
INSTI: İntegraz inhibitörü
YND: Yeni nesil dizileme
RT: Revers transkriptaz
PJP: Pneumocystis jirovecii pnömonisi
HTLV: İnsan T-lenfotropik virüs
EIA: Enzim immünoassay
FDA: Amerikan Gıda ve İlaç Dairesi (Food and Drug Administration)
ddI: Didanozin
ddC: Zalsitabin
d4T: Stavudin
3TC: Lamivudin
IDV: İndinavirin
SIV: Simian immunodeficiency virus
RNA: Ribonükleik Asit
Tat: Transkripsiyonel aktivatör
Rev: Viral ekspresyon düzenleyicisi
Vif: Viral infektivite faktör
Vpr: Viral protein R
Vpu: Viral protein U
Nef: Negatif düzenleyici faktör
LTR: Uzun tekrarlayan diziler (long terminal repeat)
MHC 1: Majör Histokompatibilite sınıf 1
CDC: ABD Hastalık Kontrol ve Korunma Merkezi
HLA: Human Leukocyte Antigen
XI
WB: Western blot
LIA: Line immunoassay
IAS-USA: ABD Uluslararası AIDS Derneği
PR: Proteaz
AST: Aspartat aminotransferaz
ALT: Alanin aminotransferaz
DHHS: ABD Sağlık Bakanlığı
EACS: Avrupa Klinik AIDS Derneği
BHIVA: İngiliz HIV Derneği
DSÖ: Dünya Sağlık Örgütü
ABC: Abakavir
FTC: Emtrisitabin
TAF: Tenofovir alefanamid fumarat
TDF: Tenofovir disproksil fumarat
EFV: Efavirenz
DLV: Delavirdin
ETR: Etravirin
NVP: Nevirapin
RPV: Rilpivirin
ATV: Atazanavir
DRV: Darunavir
FPV: Fosamprenavir
NFV: Nelfinavir
LPV: Lopinavir
SQV: Sakinavir
TPV: Tipranavir
RTV: Ritonavir
RAL: Raltegravir
EVG: Elvitegravir
DTG: Dolutegravir
MVC: Maravirok
ENF: Enfuvirtid
1
1.GİRİŞ VE AMAÇ
Etiyolojisinde Human Immunodeficiency Virus’in rol aldığı ‘Acquired Immune Deficiency Syndrome’ (AIDS) ilk defa 1981’de tanımlanmıştır (1). İlk antiretroviral ilaç olan zidovudin (AZT) 1987 yılında tedavi onayı almıştır, ilerleyen yıllarda yeni antiretroviraller kullanıma girmiştir (2). Antiretroviral ilaçların uygun kombinasyonlar oluşturmak üzere bir arada kullanıldığı tedavi rejimiyle (highly active antiretroviral therapy-HAART) HIV/AIDS ölümcül bir hastalıktan, tedaviyle kontrol altına alınabilen kronik bir hastalığa dönüşmüştür. HAART ile AIDS olgularında 1996’dan bu yana hastaneye yatışlarda ve ölümlerde %60-80 oranında azalma sağlanmıştır (3, 4). United Nations Programme on HIV and AIDS (UNAIDS) 2016 verilerine göre 2010 yılıyla kıyaslandığında hastaların antiretroviral tedaviye (ART) erişiminde %84 artış görülmüştür (5).
Günümüzde HIV tedavisinin temelini nükleozid ve nükleotid revers transkriptaz inhibitörleri (NRTI) grubundan iki ilaç oluşturmaktadır. Bu iki ilacın yanına proteaz inhibitörleri (PI), non-nükleozid revers transkriptaz inhibitörleri (NNRTI), integraz inhibitörleri (INSTI) gruplarından ya da CCR5 antagonisti bir ilaç eklenerek kombinasyon tamamlanır. Antiretroviral tedavinin temel hedefi viral replikasyonun inhibisyonu, immünolojik ve klinik yanıt oluşturmak ve mümkün olan en iyi sağlık ve yaşam kalitesine ulaştırarak hastanın yaşam süresini uzatmaktır. Tedavinin belirlenmesinde alınması gereken tablet sayısı, doz uygulama sıklığı, ilacın tolere edilebilme potansiyeli, ilacın istenmeyen yan etkileri, HIV infeksiyonuna eşlik eden hastalıkların varlığı, gebelik isteğinin bulunup bulunmadığı, almakta olduğu diğer ilaçlarla etkileşimi ve tedavi maliyetleri önemli faktörlerdir (6).
Kombine ART, HIV infeksiyon morbidite ve mortalite hızını önemli oranda azaltmaktadır. Uzun süreli ve etkin HIV tedavisinin önündeki en büyük engellerden birisi antiretroviral ilaç direncidir. Tedavi başarısı için antiviral ilaç duyarlılıklarının yakından izlenmesi gereklidir (7).
Günümüzde HIV ilaç direnç mutasyonlarını saptamak için genotipik ve fenotipik yöntemler kullanılmakla birlikte özellikle HIV-1’in genetik çeşitliliği ilaç direnci genotipleme deneylerinin performansını etkilemektedir (8). Genotipik direnç testleri otomatize sistemlerin kullanıma girmesi ile yaygın kullanım alanı bulmuştur. Bunlar içinde Sanger dizi analizi en az %20 viral popülasyondaki mevcut mutasyonları tespit etmedeki kısıtlı hassasiyetine rağmen, mutasyonların saptanmasında halen altın standarttır. Bu yöntemi temel alan ticari kitler esas olarak proteaz ve revers transkriptaz inhibitörlerine karşı gelişen direnç mutasyonlarını tespit edebilmektedir. İntegraz inhibitörlerinin ilk tedavi seçeneği
2 olarak artan kullanımı ile bu ilaçlara karşı gelişen direnç mutasyonlarının da izlenmesi gerekliliği gündeme gelmiştir.
Yapılan çalışmalar direnç ile ilişkili Sanger dizi analizi ile saptanamayan mutasyonların hem naiv hem de tedavi tecrübesi olan hastalarda tedavi başarısını olumsuz etkilediğini göstermiştir. Yeni nesil dizileme (YND) teknolojileri duyarlılıkları ile %1’in altında bulunan minör varyantların saptanmasını mümkün hale getirmiştir (9).
Ege Üniversitesi Tıp Fakültesi Tıbbı Mikrobiyoloji Anabilim Dalı Moleküler Viroloji Laboratuvarı’nda 2008 yılından beri Sanger zincir sonlandırma reaksiyonu ile proteaz, revers transkriptaz (RT) inhibitörlerine karşı gelişen ilaç dirençleri rutin olarak araştırılmakta ve her hasta örneği arşivlenmektedir. Arşivlenmiş farklı ilaç direnç profiline sahip 40 HIV pozitif hasta örneği çalışmamıza dahil edilmiştir. Ülkemizde integraz inhibitörlerinin antiretroviral tedavide kullanılmaya başlaması ile birlikte ilaç dirençlerinin de araştırılması gerekli hale gelmiştir. Bu nedenle bu çalışmada; arşivlenmiş, farklı ilaç direnç profilleri olan 40 hasta örneğinin YND ile PI, NRTI, NNRTI İle birlikte INSTI’ne karşı gelişen ilaç dirençlerini tek bir amplikon kullanılarak saptanması amaçlanmaktadır.
2.GENEL BİLGİLER
2.1 Tarihçe ve KökenRetroviridae ailesinin Lentivirus cinsinde yer alan HIV AIDS’e neden olur. AIDS ilk kez 1981 yılında Amerika Birleşik Devletleri’nde yaşayan eşcinsel erkeklerde tanımlanmıştır. Periferik kanda belirgin CD4+ T lenfositlerin eksikliği olan bu sendrom daha önceleri fırsatçı infeksiyonlar, lenfadenomegali ve çeşitli kanser türleriyle ilişkilendirilmiştir (1). İlk olgular eşcinsel erkeklerde Pneumocystis jirovecii pnömonisi (PJP) ve Kaposi sarkomu görülme sıklığının artmasıyla fark edilmiştir (10, 11). İlk zamanlarda yaşam biçimiyle ilişkili bulunmasına rağmen ilerleyen zamanlarda heteroseksüellerde, intravenöz ilaç bağımlılarında, hemofili hastalarında da görülmüştür (12, 13).
1983 yılında servikal lenfadenomegalisi olan bir hastanın lenf bezinden insan T-lenfotropik virüs (HTLV) ailesinden olan ancak diğer HTLV’lerden farklı yeni bir virüs izole edilmiş ve AIDS’in etkeni olabileceği bildirilmiştir. Daha sonra araştırmacılar bu virüsten ‘lenfadenomegaliyle ilişkili virüs’ olarak söz etmişlerdir (14). Gallo ve arkadaşları AIDS hastalarından izole ettikleri virüsün T lenfositlerine yatkınlığı olduğunu göstermiş 1984 yılında HTLV-III olarak adlandırmışlardır (15). Aynı zamanlarda San Francisco'da bir grup AIDS hastasından izole edilen virüs AIDS'le ilişkili retrovirüs olarak tanımlanmıştır (16). Araştırmacılar tarafından tanımlanan üç virüsün de aynı olduğu anlaşıldıktan sonra virüs önce HIV, sonra HIV-1 olarak adlandırılmıştır. Batı Afrika ülkelerinde etken olan, HIV-1’den
3 immünolojik olarak farklı olan HIV-2 1986 yılında tanımlanmıştır (17). Yapılan bu çalışmalar nedeniyle 2008 yılında Fransız Luc Montagnier ve Françoise Barré-Sinoussi tıp alanında Nobel ödülüne layık görülmüştür (18).
HIV antikorlarının saptanması için geliştirilen enzim immünoassay (EIA) testi 1985 yılında Amerikan Gıda ve İlaç Dairesi (Food and Drug Administration, FDA) tarafından onaylanmış, 1987'de de ilk antiretroviral ilaç olan AZT tedavi onayı almıştır. Yıllar içerisinde didanozin (ddI), zalsitabin (ddC), stavudin (d4T) ve lamivudin (3TC) gibi diğer NRTI’ları piyasaya sunulmuş, 1996 yılında PI’ların keşfiyle HAART gündeme gelmiştir (2). NRTI sınıfından iki ilaçla PI temsilcisi indinavirin (IDV) kombine kullanımı ile AIDS olgularında, buna bağlı hastaneye yatışlarda ve ölümlerde %60-80 azalma görülmüştür (3,4). İntegraz inhibitörleri 2007 yılında FDA tarafından tedavi onayı almıştır. Günümüzde integraz inhibitörü ilaçların iki NRTI (tenofovir/emtrisitabin veya abakavir/lamivudin) ile kombinasyonunun ilk tedavi seçeneği olarak kullanılması ile etkin bir klinik yanıt elde edilmiştir (19).
2.2.Epidemiyoloji ve Bulaşma Yolları
2.2.1.Epidemiyoloji
UNAIDS verilerine göre dünyada şimdiye kadar yaklaşık 65 milyon kişi HIV pozitif saptanmış ve 29 milyon kişi AIDS nedeniyle hayatını kaybetmiştir. Salgın hız kesmeye başlamakla birlikte bu infeksiyon günümüzde hala önemini korumaktadır (20).
Moleküler filogenetik çalışmalar sonucunda HIV’le ilişkisi belirlenen farklı primat lentivirüsleri keşfedilmiştir. Maymunlarda hastalık yapan bu virüsler “simian immunodeficiency virus (SIV)” olarak adlandırılmıştır. Şempanzelerden HIV-1’in, gri mangabey maymunlarından HIV-2’nin insanlara zoonotik olarak geçtiği düşünülmüştür. Ayrıca Afrika genelinde maymunları infekte eden tüm SIV suşlarının aynı atadan ayrıldıklarına inanılmaktadır. HIV-2 en sık Batı Afrika’da görülmektedir ve HIV infeksiyonlarının %5'ini oluşturmaktadır. HIV-1 daha virülan olup dünya çapındaki AIDS pandemisinden sorumludur. Mutasyon ve rekombinasyon eğilimi nedeni ile HIV, genetik değişken bir virüstür. HIV-1 gag ve env genlerindeki dizi farklılıklarına göre M, O, N ve P olmak üzere dört genetik gruba ayrılmıştır. En geniş yayılıma sahip olan M grubunun dokuz alt grubu (A, B, C, D, F, G, H, J ve K) ve günümüzde tanımlanmış 49 rekombinant formu vardır. 1980’li yıllarda Kuzey Amerika ve Avrupa’daki ilk epidemi M grup HIV-1’in B alttipine aittir. C alttip HIV-1 infeksiyonlarının yarısını oluşturup en sık Afrika’nın güneyinde ve Hindistan’da görülürken, B alttip Amerika, Avrupa ve Avustralya'da sık görülmektedir (21). Ülkemizde en sık görülen B alttipidir (22).
4 UNAIDS 2016 verilerine göre (5):
- Günümüzde 36.9 milyon HIV-pozitif hasta (34.3 milyon erişkin, 2.6 milyon çocuk) yaşamaktadır.
- 17 milyon HIV-pozitif hasta ART almaktadır.
- 17.1 milyon insan HIV infeksiyonu olduğunubilmemekte, yaklaşık 22 milyon insan ART'ye erişememektedir.
- 2014 yılında yaklaşık 2.1 milyon yeni HIV infeksiyonu, 1.2 milyon AIDS'le ilişkili ölüm görülmüştür.
- 2000 yılından bu yana yeni HIV infeksiyonlarında %35 azalma vardır. - Pik yaptığı 2004 yılıyla kıyaslandığında, ölümlerde %43 azalma vardır. - 2010 yılıyla karşılaştırıldığında ART'ye erişimde %84 artış vardır. - 2030 yılında AIDS epidemisinin sonlandırılması hedeflenmektedir.
Türkiye’de ilk olgu 1985 yılında görülmüş, sonraki yıllarda olgu sayıları artmıştır. Türkiye Halk Sağlığı Kurumu (THSK), Haziran 2015 verilerine göre ülkemizde 12.541 HIV pozitif hasta bildirilmiştir. Bu olgularda bulaşma yolu; %42 heteroseksüel ilişki, %11.4 homoseksüel ilişki, %2 intravenöz ilaç kullanımı, %0.6 nozokomiyal bulaşma olarak belirtilmiş olup %42’sinin bulaşma yolu bilinmemektedir. Olguların %70’i 20-50 yaş aralığında olup, %83’ünü erkekler oluşturmaktadır (23).
2.2.2.Bulaşma Yolları
HIV dış ortam koşullarına oldukça duyarlıdır ve bulaşması için vücut sıvılarının doğrudan teması gerekir.
- Cinsel ilişki: Vaginal, anal ya da oral seks sırasında gerçekleşebilir. Dünyadaki HIV infeksiyonlarının %80’inden fazlası heteroseksüel temasla bulaşmıştır; hastaların %50’sini de kadınlar oluşturmaktadır. Korunmasız anal ilişki sırasında HIV bulaşma riski, korunmasız vaginal ilişkiden daha yüksektir.
-Kan ve kan ürünleri inokülasyonu: Kan ve kan ürünleri transfüzyonu, intravenöz ilaç kullananlarda ortak şırınga kullanımı, sağlık çalışanlarında perkutan ,mukozal veya açık yara teması HIV’in bulaşabileceği potansiyel yollardır.
- Anne sütü ve plasenta: HIV, plasenta ya da anne sütü yoluyla virüsü taşıyan anneden bebeğine bulaşır. Günümüzde doğuma yakın dönemlerde anneye ve bebeğe uygulanan ART’yle bebeğin infeksiyona yakalanma riski azaltılmaktadır.
Sifilis, yumuşak şankr, genital herpes, gonore ve klamidya infeksiyonları gibi cinsel yolla bulaşan hastalıkların yol açtığı ülserler ve doku bozuklukları HIV bulaşma riskini arttırır. Sünnetsiz olmak da HIV bulaşma riskini arttıran durumlardandır (1).
5 2.3.Genel Mikrobiyolojik Özellikleri
Retroviridae ailesinin Lentivirus cinsinde sınıflandırılmaktadır. 2.3.1.Yapı ve Genomik Organizasyon
Pozitif polariteli, zarflı, sferik bir RNA (Ribonükleik Asit) virüsüdür. Olgun viral partiküllerin çapı 100-150 nm’dir. Genomu içeren koni şeklindeki nükleokapsid lipid membranla çevrilidir. Yapısal proteinlerle çevrili olan nükleokapsidde 10 kb uzunluğunda birbirinin eşi iki adet pozitif iplikli RNA bulunur. Kapsid içerisinde RT ve integraz enzimi ve iki hücresel taşıyıcı RNA (tRNA) bulunur. Genom yapısal proteinleri, viral enzimleri ve zarf glikoproteinlerini kodlayan gag, pol ve env olmak üzere üç majör genden oluşur. Bunlara ek olarak transkripsiyonel aktivatör (tat), viral ekspresyon düzenleyicisi (rev) ve viral infektivite faktör (vif), viral protein R (vpr), viral protein U (vpu) ve negatif düzenleyici faktör (nef) aksesuar gen bölgelerini içerir. Genomun her iki ucunda uzun tekrarlayan (long terminal repeat/ LTR) diziler yer alır. LTR dizileri, farklı hücresel transkripsiyon faktörlerinin bağlanması için kullanılan promoter ve hızlandırıcı gen dizilerini içerir.
2.3.1.1.Yapısal Proteinler
2.3.1.1.1.Gag-Pol öncülü (Pr160GagPol)
Gag-Pol öncülü, viral olgunlaşma sürecinde virüse ait proteaz enzimi ile pol ve gag ünitelerini oluşturur.
2.3.1.1.2.Gag (Pr55Gag)
Gag proteininin proteolizi sonucu matriks antijen (MA, p17), kapsid antijen (CA, p24) ve nükleokapsid (NC, P7), p6 ve iki küçük ara peptit (P1 ve P2) oluşur (24).
2.3.1.1.3.Pol
Pol gen bölgesinden RT, integraz ve proteaz enzimleri kodlanır.
RT; RNA-bağımlı DNA polimeraz , DNA-bağımlı DNA polimeraz ve Ribonükleaz H aktivitelerine sahiptir. RT düzeltici aktivitesi olmadığından hataya eğilimlidir ve viral genomun her yeni kopyasında birkaç nokta mutasyon oluşturur. Bu genetik değişkenliği bir hastanın infeksiyonu sırasında virüsün bağışık yanıttan kaçışına neden olur (25).
İntegraz enzimi cDNA’nın konak hücre DNA’sına integre olmasını sağlar (26). 2.3.1.1.4.Env
Prekürsör bir glikoprotein olan env, proteaz enzimi ile gp41 ve gp120’ye parçalanır. HIV-1 gp120 aracılığıyla CD4+ T lenfositlerine ve koreseptörlere bağlanır. Gp41 viral zarf ile konak hücre membranının füzyonunu sağlar.
6 2.3.1.2. Düzenleyici Proteinler
2.3.1.2.1.Tat
Tat proteini; kromatin yeniden şekillenmesi, RNA polimerazın fosforilasyonu ve viral genlerin transaktivasyonundan sorumludur (27, 28).
2.3.1.2.2.Rev
Rev viral mRNA'ların çekirdekten sitoplazmaya taşınmasını sağlar. 2.3.1.3. Aksesuar Proteinler
2.3.1.3.1.Nef
Nef, hücre yüzeyindeki CD4 reseptörünün ve Majör Histokompatibilite sınıf 1 (MHC 1)'in ekspresyonunu azaltarak HIV ile enfekte hücrelerin sitotoksik T lenfositleri tarafından öldürülme etkinliğini azaltır (29).
2.3.1.3.2.Vpr
Vpr, cDNA’nın nükleusa transferinden sorumludur ve makrofajlar gibi bölünmeyen hücrelerdeki virüs replikasyonu için gereklidir. Vpr, ayrıca çoğalan hücrelerin hücre döngüsünün G2 fazında durdurmasıyla apoptozunu indükler bunun sonucunda immün fonksiyonların bozulmasına neden olur (30, 31).
2.3.1.3.3.Vpu
Vpu, env-CD4 komplekslerindeki CD4 moleküllerini ubiqutin bağımlı yolla parçalayarak virüsün tomurcuklanarak ayrılmasını sağlar (32).
2.3.1.3.4.Vif
Vif ElonginB, ElonginC, Cullin5 ve Rbx2 oluşan hücresel bir E3 ubikuitin ligaz ile insan antiviral proteini olan APOBEC3G 'nin bağlanmasını ve APOBEC 3G'nin proteazom aracılığı ile parçalanmasına yol açar (33, 34).
HIV-1 ve HIV-2’nin genomik organizasyonu benzerdir. Analizler HIV-1’in ayırt edici vpu geni, HIV-2’nin ise vpx geni taşıdığını göstermiştir. HIV-1’in dış zarf ve transmembran glikoproteinleri gp120 ve gp41 yerine HIV-2’de gp125 ve gp36, HIV-1’in kapsid ve matriks proteinleri p24 ve p17 yerine HIV-2’de p26 ve p16’nın bulunmasıdır.
2.3.2. Replikasyon döngüsü
Replikasyon virüsün gp120 ile duyarlı hücrelerin yüzeyindeki CD4 reseptörüne tutunmasıyla başlar. Bu bağlanma gp120’de yapısal değişikliğe neden olarak virüsün diğer hücresel koreseptörler (kemokin reseptörler) olan CXCR4 ve CCR5’le etkileşimini sağlar. Bu etkileşim membran füzyonu ve hücreye virüsün girmesi için gereklidir. HIV füzyon testlerinde kullandıkları kemokin reseptörlerine göre sınıflandırılmıştır. CXCR4 reseptörlerini kullanan X4 olarak adlandırılan virüsler sıklıkla T-hücre tropiktirler. Sinsisyum oluşturarak
7 sitopatik etki gösterirler, replikasyon hızları yüksektir. CCR5 reseptörlerini kullanan izolatlar makrofaj tropiktirler. R5 olarak adlandırılan bu suşlar sinsisyum oluşturmazlar ve replikasyon hızları yavaştır. Hem T hücresi hem de makrofaj tropik suşlar da vardır. Genom sitoplazmaya salınınca replikasyonun erken fazı başlar. Viriondaki tRNA’ları primer olarak kullanarak RT aracılığıyla cDNA sentezlenir. RT ribonükleaz H gibi davranır ve bu etkisiyle RNA genomunu parçalar sonra pozitif polariteli DNA ipliğini sentezler. Daha sonra çift iplikli DNA vpr ile nükleusa aktarılır. Burada viral integraz enzimiyle konak DNA’sına integre olur ve geç faz başlar. Bu integre olmuş retroviral DNA genomu provirüs olarak adlandırılır ve konak RNA polimeraz II ile hücresel genlerle birlikte transkripsiyona uğrar. Genomun transkripsiyonu tüm uzunluktaki RNA’yı oluşturur ve çeşitli mRNA’lar oluşturmak için işlenir. HIV transkripsiyonu ve gen ekspresyonunun aktive edilmesi, hücre transkripsiyon faktörleri ve tat, rev, nef ve vpr’yi içeren viral düzenleyici genler tarafından düzenlenir. Replikasyon siklusunun sonunda, yeni hedef hücreleri infekte edecek olan virion bir araya getirilir ve hücre membranından tomurcuklanarak salınır (21).
2.4. Klinik Tablolar
2.4.1. Doğal Seyir
HIV immün sistem hücrelerini infekte eden kronik seyirli bir hastalığa neden olur. Tedavi almayan olguların çoğu immün yetmezliğe bağlı gelişen infeksiyon ve malignite nedeniyle hayatını kaybetmektedir. Bazı hastalarda ‘akut retroviral sendrom’ olarak adlandırılan bir tablo görülebilir. Bu sendrom başlıca lenfadenomegali, ateş, makülopapüler döküntü ve miyaljiyle seyreder ve genelde dört haftadan uzun sürmez. Bu tablodan sonra hastalık birkaç yıl asemptomatik seyreder. Tedavi almayan hastalarda ortalama 8-10 yıl içinde AIDS’i tanımlayıcı durumlar gelişir ve hastalar kaybedilir (2). HIV RNA düzeyleri virüsün bulaşmasından kısa süre sonra oldukça yüksek değerlere ulaşır; genellikle de HIV'e karşı gelişen antikorlardan sonra maksimum değerinin %1'inin de altına düşer ve yıllarca stabil olarak seyredebilir. Bu düzey viral ayar noktası ('viral set point') olarak adlandırılır. Viral ayar noktasının düzeyi hastalığın ilerleme hızını belirler; yüksek olması CD4+ T lenfositi sayısında hızla düşüşe neden olur. HIV RNA düzeyi 1000 kopya/mL’nin altında olan çoğu hastada primer infeksiyondan neredeyse 12 yıl sonra bile AIDS tablosu gelişmezken, viral yükü 100.000 kopya/mL’nin üzerinde olan hastaların %80'inden fazlasında iki yıl içinde AIDS gelişmektedir (2).
2.4.2.Klinik Tablolar
HIV'in bulaşmasıyla oluşan infeksiyon, asemptomatik tablodan, fırsatçı hastalıkların yaşamı tehdit ettiği ağır klinik tablolara kadar geniş bir yelpaze göstermektedir. AIDS
8 tablosu virüsün alınmasından sonra viral replikasyonun sürekliliği nedeniyle hücresel immünitenin progresif olarak baskılanmasından oluşur. Klinik tabloların seyri yaş, cinsiyet, ırk, coğrafi özellikler ve kişisel alışkanlıklar gibi faktörlere bağlı olarak farklılık gösterebilmektedir. İnfeksiyon başlıca üç evrede incelenir:
- Viral bulaşma - Akut HIV infeksiyonu - Kronik HIV infeksiyonu *Asemptomatik dönem
*Erken semptomatik HIV infeksiyonu
*AIDS (CD4+ T lenfositi sayısı <200 hücre/μl ya da AIDS’i tanımlayıcı durum) *İleri HIV infeksiyonu (CD4+ T lenfositi sayısı <50 hücre/μl)
-Viral bulaşma:
Virüs cinsel temasla, parenteral yolla ya da perinatal olarak bulaşır. ABD Hastalık Kontrol ve Korunma Merkezi (Centers for Disease Control and Prevention, CDC)'ne bildirilen olguların %4'ünde bulaşma yolu belirlenememiştir. HIV bulaşmasında tanımlanan risk faktörleri, viral yükün fazla olması (örneğin akut infeksiyon), riskli cinsel davranışlar (anal seks, çok sayıda cinsel partner…), cinsel yolla bulaşan hastalıklar, sünnetsiz olmak ve kişinin partneriyle benzer Human Leukocyte Antigen (HLA) sınıfına sahip olmasıdır (1).
-Akut HIV infeksiyonu:
Akut retroviral sendrom, primer HIV infeksiyonu ya da erken HIV infeksiyonu olarak da bilinir. Bu dönem virüs bulaşı sonrası ortalama 6 ay sürer. Hastaların bir kısmı asemptomatikdir. Bir kısmında akut dönemde mononükleoz benzeri bir tabloyla karşılaşılabilir. Ateş, lenfadenomegali, boğaz ağrısı, döküntü, miyalji, artralji, ishal, baş ağrısı, lökopeni ve trombositopeni sık görülen belirti ve bulgulardır. Bu dönemin sonunda immün sisteminin etkisiyle viral yük azalmaya başlar ve altı aydan sonra düşük düzeyde, bir logdan az oynamalarla uzunca bir dönem dengede kalır. CD4+ T lenfositi sayısında geçici bir düşme vardır; sonrasında normale yakın düzeylere ulaşır. Erken HIV infeksiyonunun semptomatik olması ve semptomların 14 günden fazla sürmesi daha hızlı AIDS’e gidişi gösterir (35, 36). Hastaların çoğunda kullanılan test ile ilişkili olarak temastan 4-6 hafta sonra serokonversiyon gelişmektedir.
-Kronik HIV infeksiyonu:
Viral yükün stabil olduğu, CD4+ T lenfositi sayısında ilerleyici azalmanın görüldüğü dönemdir. Asemptomatik dönem, erken semptomatik dönem, AIDS ve ileri HIV infeksiyonu bu dönemde görülür. HIV bulaşmasından AIDS tablosuna ilerleme için geçen süre ortalama
9 8-10 yıldır (35). Bir grup HIV pozitif hastada tedavi altında tutularak çok uzun süre herhangi bir klinik bozulma göstermez; bunlarda CD4+ T lenfositi sayıları sabit kalırken viral yüklerinin de düşük düzeyde (<10.000 kopya/mL) olduğu gözlenir (‘long-term nonprogressors’). Tüm hasta popülasyonunun %0.5’ini oluşturan bu grupta 20 yıl geçmesine karşın AIDS tablosu görülmemiştir. Bir grup hasta da ise HIV seropozitif olmasına karşın viremi saptanmaz (‘elite controllers’) (37, 38).
- Asemptomatik dönem:
Bu dönem boyunca hastaların büyük çoğunluğunun herhangi bir semptomu yokken fizik muayenelerinde vücutta yaygın lenfadenopatiler dikkat çeker. İnguinal bölge dışında iki ya da daha fazla bölgede en az 3-6 aydır süren ve başka bir nedenle açıklanamayan lenfadenopatiler, dirençli yaygın lenfadenopati (LAP) olarak tanımlanır. Fizik muayenede genellikle 0.5-2 cm çapında, simetrik, hareketli, ağrısız ve lastik kıvamında olan lenfadenopatiler daha çok anterior ve posterior servikal, submandibuler, oksipital ve aksiller zincirde saptanır. Ciddi immünosüpresyonu olmayan ya da başka klinik semptomların olmadığı HIV-pozitif hastalarda simetrik LAP’lerin ileri incelemesine gerek yoktur (35). - Erken semptomatik HIV infeksiyonu:
Çoğu hasta CD4+ T lenfositi sayıları 200/mm3’nin altına inene kadar klinik olarak
iyilik halini sürdürse de, bazı hastalarda daha erken dönemde HIV infeksiyonuyla ilişkilendirilen semptom ve bulgular gelişir. Bulguların çoğu deri ve mukozalarda ortaya çıkar. Yineleyen ve sürmekte olan oral ve vaginal kandidiyaz, oral tüylü lökoplaki, zona, folikülit, seboreik dermatit, erken semptomatik dönemde görülen tablolardandır. Bu hastalarda pnömokoksik pnömoni ve diğer bakteriyel infeksiyonların da sıklığı artmıştır. Çoğu hastada subfebril ateş, halsizlik, gece terlemesi gibi spesifik olmayan semptomlar görülebilir. Yine bu dönemde HIV infeksiyonunun infeksiyöz olmayan kardiyovasküler, nöropsikiyatrik, hematolojik, onkolojik ve endokrinolojik komplikasyonlarına bağlı yakınma ve bulgular görülür (35).
- AIDS ve ileri HIV infeksiyonu:
AIDS kronik HIV infeksiyonunda CD4+ T lenfositi sayısındaki düşüşün bir sonucudur. CD4+ T lenfositi sayısının <200/mm3 olmasıyla ya da CD4+ T lenfositi sayısından bağımsız
olarak AIDS’i tanımlayıcı fırsatçı infeksiyonlar, kanserler gibi klinik durumların görülmesiyle nitelenir (38). CD4+ T lenfositi sayısının 50/mm3’nin altına indiği evre ileri HIV infeksiyonu
olarak kabul edilebilir. Yapılan bir çalışmada AIDS’i tanımlayıcı durumların CD4+ T lenfositi sayısı ortalama 67/mm3 iken geliştiği gözlemlenmiştir. Aynı hasta grubunun %10’unda ise
CD4+ T lenfositi sayısı 200/mm3’nin üzerindeyken AIDS’i tanımlayıcı durumlar gelişmiştir.
10 gibi fırsatçı infeksiyonlar genellikle CD4+ T lenfositi sayısı <50/mm3 olduğunda gelişir (21).
PJP en sık karşılaşılan AIDS’i tanımlayıcı fırsatçı infeksiyondur. HAART öncesi yapılan bir çalışmada AIDS’i tanımlayıcı fırsatçı durumun eşlik ettiği 12.982 hastada %35.9 oranla PjP en sık görülen fırsatçı infeksiyonken, bunu sırasıyla özofageal kandidiyaz, Kaposi sarkomu, yaygın MAC infeksiyonu (sırasıyla %12.4, %11.6, ,%6.4) izlemiştir (39). M.tuberculosis infeksiyonları HIV infeksiyonunun her döneminde görülebilse de bu dönemde sıklığı artar. 2.5.Laboratuvar testleri ve tanı
Virüse ait RNA, amplifikasyon teknikleri ile (genellikle 10-12 güne kadar) 2 hafta içinde saptanabilen ilk laboratuvar bulgusudur. Bu dönemde HIV antikorları henüz ölçülebilir düzeye ulaşmadığı için, HIV p24 antijeni bakılması taramada erken tanı olanağı sağlamaktadır. P24 antijeni virüs bulaşmasından sonra 2-6 hafta içinde yüksek düzeyde kanda bulunmakta, daha sonra düzeyi düşmektedir. Antikorlar infeksiyondan yaklaşık 3-4 hafta sonra serumda saptanabilmektedir (ortalama 22 gün); 10-12 hafta sonunda pik konsantrasyona ulaşır (40). Antikorların ortaya çıkmasını takiben viremi düzeyi azalır ve immünkomplekslerin bir sonucu olarak p24 antijeni kaybolur (41). HIV infeksiyonu doğrulandıktan sonra viral yük ve direnç testleri antiretroviral tedavinin etkinliğini değerlendirmek ve tedavi başarısızlığı olan hastalarda yeni tedavi rejimlerini uygulamak için kullanılır.
2.5.1.HIV tanısında kullanılan testler 2.5.1.1.Serolojik yöntemler
Tarama testleri ve doğrulama testleri olmak üzere iki grupta toplanır. Tarama testleri ile pozitif sonuç alındığında reaktif sonuç olarak yorumlanır, test tekrarlanır yine pozitifse doğrulama testi uygulanır.
2.5.1.1.1.Tarama testleri
Günümüzde tarama testi olarak HIV-1 ve HIV-2 antikorlarını ve p24 antijeni tayin eden dördüncü jenerasyon EIA kitleri tercih edilmektedir. EIA kitlerinin özgüllük ve duyarlılıkları çok yüksektir. Ancak çeşitli nedenlere bağlı yalancı pozitiflik ve negatiflikler görülebilir (Tablo 1).
11 Tablo 1.HIV tarama testi EIA yalancı negatif ve pozitif sonuçları (42)
2.5.1.1.2.Doğrulama testleri
Doğrulama testleri olarak en sık kullanılan testler Western blot (WB) ve Line immunoassay’dır (LIA). Bu yöntemlerde virüse ait antijenler bantlar halinde kağıt membrana emdirilir ve strip şeklinde hazırlanır. Stripler üzerine hasta serumu dilüsyonu eklenir ve inkübe edilir. Hasta serumunda bu antjenlere karşı özgül antikor varlığı enzimle işaretli anti-insan antikorlarının ve enzime ait substratın eklenmesi ile gösterilir. Kontrol bantları değerlendirildikten sonra koyu renkli bantlar değerlendirmeye alınır. Western blot yöntemi EIA ve hızlı testlere göre daha özgül fakat daha az duyarlıdır. Line immunoassay HIV-1 ve HIV-2 rekombinant antijenleri içeren bir yöntem olup WB’nin yerini almış bulunmaktadır (43).
2.5.1.2.Hızlı testlerin tanıdaki yeri
Yapılan çalışmalarda HIV-1+2 antikor ve p24 antijenini içeren hızlı HIV tarama testlerinin duyarlılıkları EIA’lar kadar yüksek olduğu gösterilmiştir (44, 45).
2.5.1.3. Moleküler Tanı
PCR, örnekteki nükleik asit miktarını çoğaltarak saptanabilecek düzeye getirme tekniğidir. Periferik kan mononükleer hücrelerinde HIV-1 proviral DNA’sı ve HIV-1 RNA’sını saptamada ve miktarını belirlemede duyarlı ve özgül yöntemdir (42).
HIV RNA’nın duyarlı bir şekilde tayini ve miktarının belirlenmesinde FDA onaylı pekçok ticari kit bulunmaktadır. Bunların başlıcaları:
-AMPLICOR HIV Monitor Test (Roche Diagnostics) -Versant HIV-1 RNA 3.0 assay (Bayer Diagnostics) -NucliSens HIV RNA QT (BioMerieux)
Yalancı negatif EIA sonuçları Yalancı Pozitif EIA sonuçları
1.Antikor yanıtı oluşmadan örnek alımı 2.Malignite
3.Yoğun ve uzun süreli immünsupresif tedavi
4.Organ nakli
5.Kemik iliği transplantasyonu 6.B hücre disfonksiyonu 7.Romatoid faktör pozitifliği
1.Primer biliyer siroz 2.Sklerozan kolanjit
3.Serumun ısı ile inaktivasyonu 4.Rapid plasma reagin pozitifliği 5.Renal transplantasyon 6.Kronik renal yetersizlik 7.Stevens- Johnson sendromu
8.Anti-HAV IgM, anti-HBcIgM pozitifliği 9.Hematolojik malignite
10.DNA virüsleri ile akut infeksiyonlar 11.İnfluenza aşılaması
12 -COBAS AmpliPrep/COBAS TaqMan HIV- 1 Test (Roche Diagnostics)
-RealTime HIV-1 (Abbott Molecular) - QS-RGQ HIV-1 test (Qiagen) 2.5.1.4. İlaç Direnç Testleri
İlaç direnci genotipik ya da fenotipik testlerle incelenebilir. Genotipik testlerde, ilaç direnci ile ilişkili mutasyonlar araştırılırken, fenotipik testler ile sadece ilaç duyarlılığı belirlenir. Genotipik direnç testleri fenotipik testlere göre hızlı, ucuz ve kolay uygulanabilir olması nedeniyle daha yaygın kullanılır.
2.5.1.4.1.Genotipik Direnç Testleri
Genotipik direnç testleri ilgili viral genlerdeki dirençle ilişkili mutasyonları tespit eder. Dirençle ilişkili mutasyonlar hibridizasyona dayalı yöntemler, RFLP (Restriction Fragment Length Polymorphism) ve DNA dizi analizi ile saptanabilir. Hibridizasyona dayalı yöntemler için çeşitli ticari kitler mevcuttur. Tersine hibridizasyon yönteminde ilaçla ilişkili mutasyonları içeren problar, nitroselüloz membranlar üzerine sabitlenmiştir. Bu yöntemde izole edilen virüs RNA’sı biyotinle işaretlenmiş primerler kullanarak çoğaltılır. Biyotinle işaretlenmiş amplikonlar membrana bağlanmış proplara hibridize olur. Nitrosellülöz membran üzerine alkalen fosfatazla konjuge edilmiş streptavidin ilave edilir. Daha sonra alkalen fosfatazın substratı eklenir. PCR ürünlerinin özgül proplarla hibridize olduğu bölgelerde kromojen substratın oluşturduğu koyu bantlar oluşur. Oluşan bant paternlerine göre testin sonucu değerlendirilir. Bu yöntem fazla teknik donanım gerektirmemesi nedeniyle uygulanması kolaydır. Ancak sadece bilinen mutasyonları saptayabilmesi ve hastaya ait dizideki mutasyonlara bağlı mutant ya da wild kodonlara bağlanama dezavantajlarındandır. HIV’in değişkenlik hızı bu yöntemin rutin kullanımına çok uygun değildir.
Günümüzde HIV ilaç direnç mutasyonlarını saptamak için Sanger zincir sonlandırma reaksiyonu altın standarttır.
Sanger zincir sonlandırma reaksiyonunda manuel ve otomatize sistemler kullanılabilmektedir. Zincir sonlandırma yöntemine dayanan otomatize DNA dizi analizinde ilk aşamada PCR ile çoğaltılan hedef DNA, DNA kalıbına tutunacak primer, DNA polimeraz, deoksinükleotid trifosfatlar (dATP, dCTP, dGTP ve dTTP) ve floresan boyalarla işaretlenmiş 3' hidroksil grubu bulunmayan dideoksinükleotid trifosfatlardan (ddATP, ddCTP, ddGTP ve ddTTP) oluşan reaksiyon karışımı hazırlanır. Karışım ısı döngü cihazına konur. Sıcaklık 950C’ye çıkarıldığında kalıp DNA denatüre olarak iplikçikleri ayrılır. Daha sonra sıcaklık
500C’ye düşürülerek primerin kalıp DNA’ya tutunması sağlanır. Sıcaklık 600C’ye
13 eklenir. Uygun dNTP’lerin eklendiği kalıp DNA’larda bir sonraki döngüde zincirin uzaması devam eder. Dideoksinükleotid trifosfatlar DNA polimeraz etkisiyle uzayan DNA zincirine katılırlar fakat 3' uçlarında hidroksil grubu bulunmadığı için 5'-3' fosfat bağlanmasını engelleyerek zinciri sonlandırırlar. Böylece DNA zinciri daha fazla uzamaz. Sonuç olarak reaksiyon tamamlandığında sekans-spesifik olarak sonlandırılmış DNA dizileri elde edilir. Daha sonra sekans-spesifik olarak sonlandırılan DNA dizileri kapiller elektroforez ile yürütülür. Akrilamid jelde yapılan elektroforez sırasında floresanla işaretli DNA parçaları boylarına göre sıralanırlar. DNA parçaları jelin alt bölümlerinden geçerken bu bölgede bulunan bir lazer ışını jeli aralıksız olarak tarar. Lazer DNA fragmanlarındaki ddNTP’lerde bulunan floresan boyaları uyarır ve her bir floresan boya ışığı özgül bir dalga boyunda yayar. Yansıyan bu ışık demeti bir dedektör tarafından kaydedilir. Kaydedilen veriler bilgisayar programları ile değerlendirilerek sonuçlar grafiksel ya da matematiksel olarak bilgisayar ekranına aktarılır.
Sanger temelli ilaç direnç test sonuçlarının yorumlanması için ABD Uluslararası AIDS Derneği (IAS-USA) (bkz. http://www.iasusa.org/resistence_mutations) ve Stanford Üniversitesi HIV İlaç Direnci Veri Bankası (http://hivdb.stanford.edu) kullanışlı rehberler sunmaktadır.
HIV ilaç direnç mutasyonlarını saptamak için kendine özel değerlendirme programları bulunan ticari testler mevcuttur. Bunların başlıcaları (42):
-ViroSeqTM (Celera Diagnostics/Abbott Laboratories)
-HIV-1 Trugene TM (Bayer Healthcare/Siemens Diagnostics)
-Virco Type HIV-1 (Virco) -GenoSure (plus)TM (LabCorp)
-GeneSeq TM (Monogram Biosciences)’dir.
Mevcut ticari kitler Proteaz (PR) ve RT bölgelerini birlikte dizilerken yapılan çalışmalarda YND ile tek bir amplikon kullanılarak her 3 pol (RT, IN, PR) gen bölgesindeki ilaç direnç mutasyonlarını saptamak mümkün hale gelmiştir (19).
Genotipik direnç testlerinin en önemli dezavantajlarından biri, toplam virüs popülasyonu içinde %20 den düşük varyantların saptanamamasıdır. Yapılan çalışmalarda YND ile %0,1 – %1 minör varyantların tespit edilmiştir (8).
2.5.1.4.2.Fenotipik Direnç testleri
Fenotipik Direnç testleri ile virüsün farklı antiretroviral (ARV) ilaç konsantrasyonlarındaki çoğalma yeteneklerine göre antiviral duyarlılıkları belirlenir. Viral replikasyonun %50 oranında inhibe olmasını sağlayan ilaç konsantrasyonu (medyan
14 inhibitör konsantrasyon [IC50]) hesaplanır. IC50 değeri referans virüsün IC50’sine bölünerek
hesaplanır ve bu değer sınır değer ile kıyaslanır. Sınır değer virüsün baskılanması ya da duyarlı olarak sınıflandırılabilmesi için virüsün IC50 değerinin kaç kat arttırılması gerektiğini
gösterir. Bazı antiviral ilaçlar için hangi IC50 değerinin tedavi başarısızlığına yol açacağı
hususunda bilgilerin bulunmaması fenotopik direnç testinin yorumlanmasında sorunlara yol açmaktadır (6).
HIV çok değişken olması ve yüksek evrim hızı nedeniyle farklı genotipik ve fenotipik özelliklere sahip olan kökenlerin karışımı halinde “quasispecies” olarak bulunmaktadır. Bu kökenler birbirleri ile yarış halinde olup en iyi adapte olan köken zaman içerisinde baskın hale gelmektedir. Yüksek mutasyon hızından dolayı farklılaşan bu kökenlerden hızla dirençli varyantlar türemektedir. Tedavi altında baskın hale gelen dirençli varyantlar tedavi başarısızlığına yol açarlar (6).
2.6. Tedavi ve Antiretroviral İlaçlar
Antiretroviral tedavinin temel hedefleri; HIV’le ilişkili morbiditeyi azaltmak, immünolojik fonksiyonları iyileştirmek ve korumak, plazma HIV RNA düzeyini saptanamayacak düzeye getirip kaliteli yaşam süresini uzatmaktır.
HIV pozitif hastanın ilk değerlendirilmesinde yapılması gereken testler arasında anti-HIV, CD4+ T lenfositi sayısı, HIV RNA düzeyi, tam kan sayımı, açlık kan glukozu, kreatinin, AST (Aspartat aminotransferaz) ve ALT (Alanin aminotransferaz) düzeyleri, lipid profili, tam idrar tahlili, hepatit A, B, ve C serolojisinin yanı sıra genotipik direnç testi yer alır. Viral süpresyonun sağlanması en az iki, tercihen üç aktif antiviral ilaçla olur. Tedavi rejimi, hasta özelliklerine ve başlangıçtaki direnç testi sonuçlarına göre belirlenir.
2.6.1. ART’ye Başlama Zamanı
Yakın zamana kadar semptomatik ve bazı özel hasta grupları dışında asemptomatik hasta grubunda tedaviye başlama zamanı CD4+ T lenfositi sayısına göre belirlenmekteydi. 2015 yılında yapılan iki randomize kontrollü çalışmanın sonuçları birlikte değerlendirildiğinde CD4+ T lenfositi sayısı >500/mm3 olan hastalarda da ART’ye
başlanmasının tedaviyi ertelemeye üstün olduğu, erken tedavi başlanan grupta AIDS’le ilişkili ya da ilişkili olmayan ciddi hastalıkların anlamlı oranda daha düşük olarak saptandığı ve mortalite oranının da daha düşük olduğu görülmüştür (46,47). Bu sonuçlar doğrultusunda ABD Sağlık Bakanlığı (DHHS) başta olmak üzere Avrupa Klinik AIDS Derneği (EACS), İngiliz HIV Derneği (BHIVA) ve Dünya Sağlık Örgütü (DSÖ) dahil tüm kurumlar asemptomatik hastalarda da CD4+ T lenfositi sayısından bağımsız ART başlanması gerektiği önerisini yüksek kanıt düzeyinde rehberlerine eklemiştir (6).
15 2.6.2. Antiretroviral İlaçlar ve Direnç Mekanizmaları
Antiretroviral ilaçlar; NRTI, NNRTI, PI, giriş inhibitörleri (CCR5 antagonisti, füzyon inhibitörü) ve INSTI olarak sınıflandırılmıştır.
Günümüzde FDA onaylı toplam 28 ilaç ve bunların kombinasyonları (14 kombinasyon) kullanılmaktadır (Şekil 1). HIV ilaçlarının bileşiminde yer alan Kobisistat, sitokrom P450 inhibitörü olup birlikte kullanıldığı ilaçların antiviral etkisini artırır. Antiretroviral ilaçların etki mekanizmaları sınıflandırılması Tablo 2 ’de gösterilmiştir (48).
Tablo 2. Antiretroviral ilaçların etki mekanizmalarına göre sınıflandırılması
* TAF: Tenofovir alefanamid fumarat, TDF: Tenofovir disproksil fumarat
NRTI: NRTI’lar intrasellüler fosforilasyonla üç fosfatın eklenmesiyle aktif hale gelen ön ilaçlardır. 3’ hidroksil grubu bulunmayan bu ilaçlar RT enziminin alternatif bir substratı gibi davranıp, deoksinükleotid trifosfatlarla yarışır ve proviral DNA’ya integre olarak fosfodiester köprülerinin oluşmasını engelleyerek sentezi durdururlar.
NRTI ilaç direnci mutasyonu mekanizmaları:
1. RT enzimindeki baz değişiklikleri sonucunda NRTI’ların DNA zincirine eklenmesinin engellemesi.
NRTI NNRTI PI INSTI
Abakavir (ABC) Delavirdin (DLV) Atazanavir (ATV) Raltegravir (RAL)
Didanozin (ddI) Efavirenz (EFV) Darunavir (DRV) Elvitegravir (EVG)
Emtrisitabin (FTC) Etravirin (ETR) Fosamprenavir (FPV) Dolutegravir (DTG)
Lamivudin (3TC) Nevirapin (NVP) İndinavir (IDV)
Stavudin (d4T) Rilpivirin (RPV) Nelfinavir (NFV) Giriş inhibitörleri
TAF* Lopinavir (LPV) Füzyon inhibitörü
TDF* Sakinavir (SQV) -Enfuvirtid (ENF)
Zidovudin (AZT) Tipranavir (TPV) CCR-5 antagonisti
16 2. Viral DNA’nın sentezi sırasında 3’ ucundaki mutasyonlara bağlı olarak fosfopirolitik yolla, eklenmiş NRTI’ların zincirden uzaklaştırılması: Timidin analog mutasyonlar (TAM) olarak adlandırılan bu mutasyonlar ATP’nin RT’ye NRTI’ların bağlanmasıyla sonlanmış olan DNA zincirinin 3’ ucuna yakın bir yerden bağlanmasına olanak verirler. Bağlanan ATP, NRTI’yı viral DNA’dan ayırır. Böylelikle revers transkripsiyon işlemi kaldığı yerden devam eder.
Şekil 1. FDA tarafından onaylı antiretroviral ilaçlar ve kombinasyonları
NNRTI: NNRTI’lar RT’nin katalitik bölgesine yakın olan hidrofobik cebe yarışma olmaksızın bağlanır. Oluşan kompleks RT’nin katalizörle aktive edilmiş olan bağlanma bölgesini bloke ederek etki gösterir.
NNRTI’lara direnç en sık inhibitörlerin bağlanma bölgesinde meydana gelen mutasyonlardan kaynaklanır.
PI: PI’lar gag-pol poliproteininin proteaz enzimi ile kesilmesini engelleyerek infeksiyöz olmayan, immatür viral partiküllerin oluşmasına neden olur. Ritonavir en güçlü proteaz inhibitörüdür. Sitokrom p-450 enzimini inhibe ederek diğer PI’ların maksimum konsantrasyon, yarılanma süresi gibi önemli farmakokinetik özelliklerini artırır. Ritonavirle
17 diğer PI’lar arasındaki bu etkileşim, günlük alınması gereken ilaç sayısını ve doz sıklığını azaltarak kullanım kolaylığı sağlamaktadır.
PI’lara direnç en sık inhibitörün proteaza bağlanma bölgesindeki aminoasit değişikliklerinden kaynaklanır.
INSTI: INSTI’lar integrazın katalitik çekirdeğindeki katyonlara (Mg++) bağlanarak integraz ile konak DNA’sı arasında kovalent bağ oluşumunu engeller.
Katalitik çekirdekteki katyonlara bağlanan bölgelerdeki mutasyonlar direnç gelişimi ile ilişkilidir.
Giriş inhibitörleri:
Füzyon inhibitörleri (Enfuvirtid): Enfuvirtid, HR-1 kompleksine bağlanarak füzyonu engeller.
Ko-reseptör antagonistleri: CCR5 reseptörünün üç boyutlu yapısında değişikliğe yol açarak gp120’nin CCR5’e bağlanmasını engeller.
2.6.3. HIV İnfeksiyonu Tedavisinde Önerilen ART Rejimleri
Viral süpresyonun sağlanması en az iki, tercihen üç aktif antiviral ilaçla olur. Başlangıç direnç testi ve hasta özellikleri tedavi rejimini belirler. Daha önce tedavi görmemiş hastalarda NRTI sınıfından seçilecek iki ilacın yanına PI, NNRTI ya da INSTI sınıfından seçilecek bir ajanın birlikte kullanımı etkin ART rejimini oluşturur. Rehberlerin tedavi önerileri Tablo 3’de gösterilmiştir (49, 50, 51).
18 Tablo 3. DHHS, EACS, DSÖ ve BHIVA Rehberlerinin ART Önerileri (49,50,51)
2.6.4. Prognoz
CD4+ T lenfositi sayısı ve viral yük prognozu tahmin etmede kullanılan en önemli parametrelerdir. Tedaviye ne kadar geç başlanırsa prognoz o kadar kötüleşir. Tedavi almayan HIV pozitif hastaların ortalama yaşam süresi 9-11 yıldır. AIDS tanısından sonra beklenen yaşam süresi 6-18 ay arasında değişir.
HIV pozitif hastaların en sık ölüm nedeni fırsatçı infeksiyonlar ve kanserlerdir. Tüberküloz, HIV infeksiyonunda önde gelen mortalite ve morbidite nedenidir. Hepatit C sık görülen koinfeksiyonlardandır; birbirlerinin ilerlemesini hızlandırır. Kaposi sarkomu ve non-Hodgkin lenfoma ise en sık görülen kanserlerdendir. Etkin ART’ye rağmen bazı hastalarda nörokognitif hastalıklar, osteoporoz, nöropati, çeşitli kanser türleri ve kardiyovasküler hastalıklarla karşılaşılabilir. Lipodistrofi gibi bazı durumlar ise hem HIV infeksiyonu hem de ART’yle meydana gelebilir (52, 53).
2.7. Önleme ve Kontrol
Koruma amaçlı tedavi uygulaması, perinatal geçişin önlenmesi, temas öncesi profilaksi, temas sonrası profilaksi, mikrobisidler, sünnet, davranışsal değişiklikler (kondom kullanımı) başlıca önlemlerdir.
19 2.7.1. Perinatal Geçişin Önlenmesi
Perinatal geçişin önlenmesinde en önemli yol gebelerde viral yükün maksimum düzeyde baskılanmasıdır. Direnç testi sonuçları beklenmeden ART başlanmalı, gebelik öncesi başlanan ve viral baskılanma sağlanmış ART rejimleri (teratojenik olmayan) değiştirilmemelidir. HIV RNA >1000 kopya/mL olan gebelere sezaryenle doğum önerilmeli, doğum sırasında intravenöz AZT başlanmalı ve doğum gerçekleşene kadar sürdürülmelidir. Bebeğe en kısa sürede oral AZT başlanmalı ve en az altı hafta devam edilmelidir (42).
2.7.2. Temas Öncesi Profilaksi
Yapılan çalışmalar eşcinsel erkekler, partneri HIV-pozitif olan heteroseksüel erkek ve kadınlar, seks işçileri ve intravenöz ilaç kullanıcılarında günlük TDF/FTC kullanımının güvenli ve HIV bulaşmasını önlemede etkili olduğunu göstermiştir. Bu çalışmalar sonrasında FDA Temmuz 2012’de TDF/FTC’yi güvenli seks davranışlarıyla birlikte cinsel yolla HIV bulaşma riski olan bireylerin kullanımı için onaylamıştır. Rehberler profilaksi verilen hastalarda diğer koruma stratejilerinin de uygulanmasını, üç ayda bir HIV infeksiyonunun değerlendirilmesini ve yakın renal fonksiyon izlemini önermektedir (54).
2.7.3. Temas Sonrası Profilaksi (TSP)
Mesleki ve mesleki olmayan TSP uygulamaları olarak iki grupta incelenebilir;
- Mesleki TSP: Acil medikal değerlendirme gerektiren bir durumdur. Mukozalara, derinin bütünlüğünün bozulduğu yerlere HIV pozitif hastanın kanı ya da vücut sıvılarının teması sonrası birkaç saat içinde tedavi başlanmalıdır.
- Mesleki olmayan TSP: Cinsel yolla temas, intravenöz ilaç kullanımı ve diğer mesleki olmayan temaslarda mümkün olan en kısa zamanda başlanan ve 28 gün sürdürülen ART’nin HIV bulaşma riskini azalttığı gösterilmiştir (42).
Temastan 72 saat sonra başlanan profilaksinin yararlı olmadığı çalışmalarda gösterilmiş ve önerilmemektedir.
DHSS; TSP için 4 hafta tek doz TDF/FTC ile birlikte günde iki doz RAL veya günde tek doz DTG kullanımını önermektedir. EACS ise dört hafta günde tek doz TDF/FTC ile birlikte günde iki doz RAL veya günde tek doz DRV/r ya da günde iki doz LPV/r önermektedir. 2.8.Yeni Nesil Dizileme
Sanger zincir sonlandırma reaksiyonu ile birim zamanda dizilenen nükleotid sayısının az ve maliyetinin fazla olması YND teknolojilerinin geliştirilmesine yol açmıştır. YND, “ikinci jenerasyon”, “masif paralel dizileme” ya da “derin dizileme” şeklinde de adlandırılmaktadır. Bu teknolojiler sayesinde Sanger dizileme yöntemine göre daha fazla
20 veri üretilmekte, örneklerin havuzlanması ve “multiplekslenmesi” (tek seferde birçok testin birlikte çalışılması) ile maliyet düşmektedir (19).
Günümüzde kullanılan yeni nesil dizileme sistemlerinden bazıları Roche 454, Illumina Genome Analyzer, Applied Biosystems SOLID, Ion Torrent, Helicos ve Pacific Biosciences olup bu platformların genel özellikleri Tablo 4’da belirtilmiştir (56).
-Roche/454
İlk derin dizileme teknolojisi, Roche firması tarafından 2005 yılında piyasaya sürülen 454 pirosekanslama cihazıdır (57). Bu cihaz emülsiyon PCR ve pirodizileme teknolojisiyle çalışmaktadır.
Emülsiyon PCR yönteminde bir yağ solüsyonu içindeki su damlacıklarında yer alan kalıp DNA, PCR ile çoğaltılır ve her damlacıkta yer alan kalıp DNA'dan klonal bir koloni oluşturulur.
Pirosekanslama ise “sentezleyerek sekanslama” prensibine dayanmaktadır. Dizileme reaksiyonu tek iplikli DNA dizisinin üzerine tamamlayıcı dizinin sentezlenmesi ile gerçekleştirilir. Sanger zincir sonlandırma reaksiyonundan farkı, dideoksinükleotide zincir sonlanma tekniği yerine nükleotid birleşmesi sonucunda salınan pirofosfatın belirlenmesine dayanmasıdır. ATP sülfirilaz PPi'ı ATP'ye dönüştürür. ATP, lüsiferaz enzimi aracılığıyla lusiferinin oksilusiferine dönüşmesini sağlar ve bu reaksiyonda ışıma meydana gelir. Ortama salınan bu ışıma ile büyümekte olan DNA'ya eklenen her bir nükleotit tespit edilir. Bu ışığı yaratan kemilüminesan sinyalin hangi nükleotidin bağlanması sırasında oluştuğu tespit edilir. Ortaya çıkan bu ışık hassas kamera tarafından kaydedilir (Şekil 2)
21 Tablo 4. Yeni Nesil Dizileme platformların genel özellikleri (56)
Bu sistemin en büyük avantajı uzun okumalar yapmasıdır. En son piyasaya sürülen 454 GS FLX platformu uzunluğu 1000 baz çiftine kadar olan yaklaşık bir milyon okuma yapabiliyor. Bu avantajı sayesinde diğer YND platformları ile karşılaştırıldığında maliyeti daha yüksek olmasına rağmen en uygun kullanıldığı alanlar de novo assembly (birleştirme) ve metagenomiktir (58, 59).
Şekil 2. 454 dizileme teknolojisi (454 Sequencing, 2016 Roche Diagnostics, Kuzey Amerika).
-Illumina/Solexa
Şirket Platform Çoğaltma Sekanslama Okuma
Uzunluğu Çıktı hacmi/zaman (okuma başına) Baskın hata tipi Hata oranı Roche/454 Life Sciences GS FLX Titanium XL+ GS FLX Titanium XLR70 GS Junior Emülsiyon PCR Pirosekanslama 1 kb'a kadar 600 bp'a kadar ̴400 bp 700 Mb/23s 450 Mb/10s 35 Mb/10 s Indel %0.5 Illumina HiSeq 2000 Genome Analyzer IIx MiSeq Köprü PCR Reversible terminator kullanarak sentezleyerek dizileme 36–100 bp 35–150 bp 36–250 bp 105–600 Gb/ 2– 11 gün 10–95 Gb/ 2– 14 gün 540 Mb–8.5 Gb/ 4– 39 s Yerdeğiştirme %0.2 Life Technologies/ Applied Biosystems 5500xl SOLiD™ system SOLiD™ 4 system Emülsiyon PCR Ligasyon temelli dizileme 35–75 bp 25–50 bp 10–15 Gb/gün 25–100 Gb/3.5– 16 gün Yerdeğiştirme %0.1 Life Technologies/Ion Torrent Ion Proton™ sequencer (Proton I chip) Ion PGM™ sequencer (318 chip) Emülsiyon PCR Ion semiconductor dizileme 200 bp'a kadar 35–200 bp 10 Gb/2– 4 s 300 Mb–1 Gb/0.9– 4.5 Indel %.1
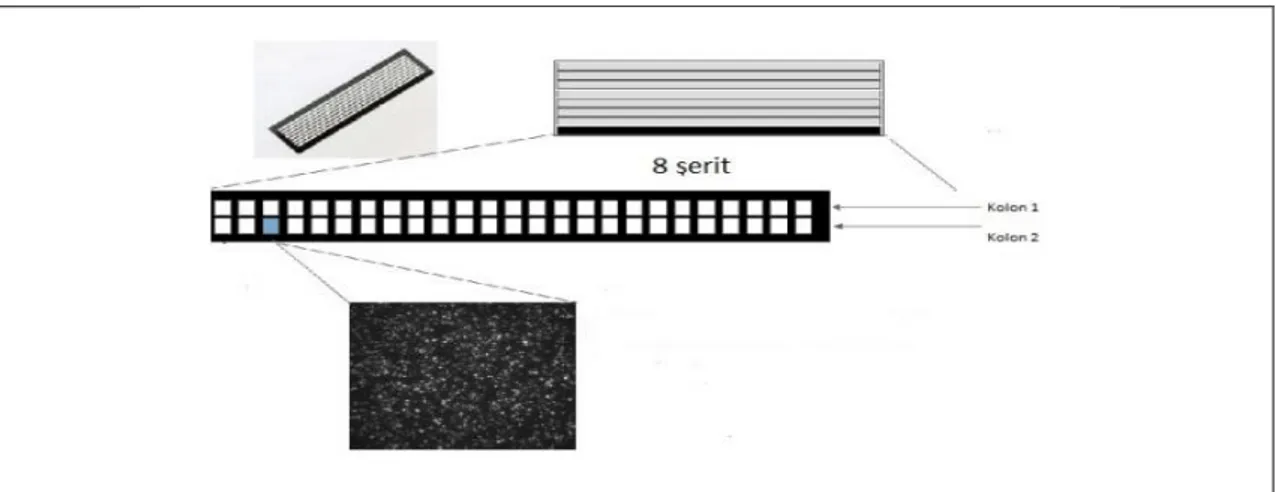
22 Illumina sistemleri array temelli sentezleyerek sekanslama ve köprü amplifikasyonu yöntemini kullanarak çalışmaktadır (60). Piyasaya sürülen ilk Illumina platformu Genome Analyzer 35 baz çifti uzunluğunda okuma yapar ve her yürütme 2-3 gün içerisinde 1 gigabazdan fazla yüksek veri verir. Genome Analyzer II, Miseq, Miniseq ve HiSeq 2000 gibi daha gelişmiş platformlar ile tek bir okumada 300 kilobazdan 1 terabaza kadar olan büyüklükte bir veri elde edilebilmektedir. Dizileme işlemleri için “flow cell” (Illumina Inc., ABD) adı verilen özel bir aparat kullanılmaktadır. Flow cell DNA parçalarının bağlandığı adaptör oligonükleotid dizilerinin olduğu, silika yapıda 8 şerite sahiptir. Her şeritte 2 kolon ve 50 hücre bulunmaktadır (Şekil 3). Dizileme işleminin büyüklüğüne göre kullanılacak hücre ve şerit sayısı seçilebilmektedir.
Şekil 3. “Flow cell”’in görünümü (Illumina Temmuz 2016, Miseq protokolünden değiştirilerek alınmıştır.)
Dizilemenin ilk basamağında genomik DNA parçalara ayrılır ve fragmanlara adaptörler bağlanarak kütüphaneler oluşturulur. DNA kütüphanesindeki parçalar adaptörler aracılığı flow cell aparatının yüzeyinde bulunan oligonükleotidlere hibridize olur. Daha sonra izotermal köprü amplifikasyon reaksiyonlarıyla çoğaltılılır. Yüzeye bağlanan DNA’lar en yakındaki adaptör dizilere bağlanarak bir “köprü” yapısı oluştururlar. Yüksek duyarlı DNA polimeraz bu parçaları oligonükleotidlerden başlayarak kopyalamakta ve çift sarmal yapıda DNA köprüleri oluşmaktadır. Oluşan bu çift sarmal köprü yapısı denatüre edilerek 2 adet tek sarmal DNA oluşturulur. 2 adet DNA tekrar “köprü” yapısı oluşturmakta ve reaksiyon bu şekilde çoğalarak devam etmektedir. Amplifikasyon aşamasından sonra çoğalan milyonlarca sayıda çift sarmal DNA köprüleri denatüre edilerek, ters sarmal, enzimatik kesim ile ayrılmaktadır. 5’ ucu flow cell yüzeyine bağlı tek sarmal DNA parçasının diğer ucunda (bağlı olmayan serbest uç) bulunan adaptör dizilere ise sekans primerleri bağlanarak, hedef