ANKARÂ" ON
İ
VERS
İ
TES
İ
ECZACILIK FAKÜLTESI
Cilt 4 Sayı : t 1974
ANKARA
ÜMVER
Şİ
TE0
ECZACILIK
±FAOurgst!
MECMUAS1
Journal of Faculty of Phartnacy of Ankara Ltniyeratti
Yayın Komisyonu
Kasmil KARAMANOĞLU Mustafa GÜLEY Gazanfer BİNGOL
Redaksiyon Heyeti
Nevin TANKER Seçkin OZDEN Eriş ASIL
Sahibi : Mekin TANKER Mes. Md. : K8mil KARAMANOĞLU
Adres : A. Ü, Eczacılık Fakültesi, Tandoğan Meydanı Ankara — Türkiye
4. (1974) 4. (1974Y
IÇ/NDEKILER
Say. Saadet ÜNERİ — İnci Ödün : Rutenyum Elektrotla Potansiyesta-
Yöntemle Bikromat İyonunun Redilksiyommun 'neden_ mesi Investigation Of Reduction Of Bichrornate Ion With Ruthenium Electrode By Potentiostatic Method . . . ' I
Şükran GEÇGİL — Günsel BAYRAKTAR — ALPMEN : Film Ccating of Tablets by Tragacanth — Kitre Zaınkı ile Tabletlerde Filim
Aynur ÜNAL : Zostera L. Hakkında — Studies on Zostera L. ... 24
Aynur ÜNAL : Alglerin Kimyasal Analizi — Chemical Aııalysis of the
Ningur NOYANALPAN : Long Chain Hydrocarbons from Petroleum Ether Fraction of Cestrum fasciculatum Endl. Miers. and Eriogonurn tomentosum »ele( Spectral Identification of n-Hentriacontane and n-Dotriacontane — Ces -trum fasciculatum Endl. Miers. ve Eriogonum tomentosum Michx.'un Petrol Eterı
Fraksiyonundan Uzun Zincirli Hidrokarbonlar.
n-Hentria-kontane ve n-Dotriakontan'ın Spektral Tammlartması. . 40 E. SHOTTON and Oya ALPAR : The Compression of Granulates —
Granüllerin Kornpresyonu ... 43
Enver IZGG — İlbeyi AĞABEYOĞLU : Merhera Sıvaglarmdan Etken
Maddenin In Vitro Diffüzyon Hızının Matematik.scl İ ncelen-mesi — Mathematical Investigation of In Vitro Diffusion
Rate of a Drug From Ointment Bases ... 65 Enver İZGÜ — Şükran GEÇGİL — Zehra ALPEREN — Hacer
YAL-VAÇ — Kitre Zanıkı Jellerinin Diftizyon Ortamı Olarak Kul-lanilması ve ılkeların Kitre Jellerinden Difüzyon
Diğer Merhem Sıvagları ile Mukayesesi Use of Tragacanth Gels as a Diffusion Medi= and Compardson Properties of Diffusion Properties of Drugs in Tragacanth Gels With Different
Mekin TANKER ve Erendiz SAYRON Styrax Liquidus Üzerinde Far-makognozik Araştırmalar — Phannacognosic Research on
Sayfa Kamil KARAMANOĞLU — Mehmet KOYUNCU : Türkiye Valeriana
(Kediotu) Türleri Üzerinde Sistematik Araştırmalar — The Systoma- tie Researehes on Valeriana species in Turkey 149 Urhan YUMUTRUĞ — Herman A. ELLENBERGER :
Triehloroethy-lene Çalışanların İdrarlarında Triehloroasetie asit ve Trich-loroethanorün Kantitatif Olarak Tayini Üzerinde Çalışmalar — Studies on Quantitative Determination of Triohloroacetie Acid and Trichloroethanol in Urine Who Expagsed to Trithloroety-
Gazanfer BINGÖL — Gülesi AYDIN : 1973 Uluslararası
Hemogloblno-ınetri Araştırması ve Bulgularumz — International Hernoglo-hinometry Trial of 1973 and Our Finchngs ... 189
4 1 (1974) 4. 1 (1974)
Rutenyum Elektrotla Potansiyostatik Yöntemle Bikromat
iyonunun Redüksiyonunun incelenmesi
Investigation Of Reduction Of Bichromate Ion With Ruthenium Electrode By Potentiostatic Method
Saadet UNERI,* Inci ODUN
Bundan önceki çalışmalarımızda (1) platin gurubu metallerin-den olan rutenyumun elektrokimyasal özellikleri araştırılarak ok-sit potansiyeli basamakları saptandıktan sonra bu çalışmada ruten-yum elektrodla bikromatların katodik redüksiyonu incelenmiştir. Metalik krom havanın ve birçok kimyasal maddenin etkilerin
kar-şı
dayanıklı olduğundan teknikte krom kaplamacılığının uygulama alanı geniştir. Kromla kaplamanın optimal koşullarını sağlayan çö-zeltiler sülfirik asit içeren kromik asit çöçö-zeltileridir. Literatürdeki çalışmalar (2, 3, 4,5)
genellikle bu bileşimdeki çözeltiler içerisin-de ve içerisin-değişik metal katotlar kullanılarak yapılmıştır. Olay hidrojen çıkışı potansiyelinde olduğundan çalışmaların çoğunda bu potansi-yel bölgesi incelenmiştir. Oysa eğer redüksiyon basamaklı ise Cr6 -4- iyonunun ara oksidasyon basamakların indirgenmesi olayını da in-celemek gerekir. Latimer (6).Cr207 = 14 H+ -I- 6 e < 2 Cr + 7 H20
reaksiyonu gereğince Cr6 + nin Cr3 + indirgenmesi olayında normal potansiyel olarak E° = 1,33 V değerini vermektedir. Deneylerde ise bu olaya karşı gelen potansiyel değeri çoğu zaman bu kadar büyük olmamaktadır. Buna neden olarak elektrod yüzeyinin bu bölgede olayı engelleyen kapatıcı bir tabaka ile örtülü olması gösterilmek-tedir. Literatürde (7,8) Pt, Rh ve Ir elektrodlarla kromat redüksi-
Redaksiyona verildiği tarih : 18 Mart 1973 (*) A. U. Fen Fakültesi Fizikokimya Kürsüsü (,.**) A. U. gczacilık Fakültesi Analitik Kimya Kürsüsü
2 S. ÖNERI, I ODUN
yonunun mekanizması incelenirken redüksiyona karşı gelen akım artmasının metalden metale değişen potansiyel bölgelerinde olduğu gözlenmiştir. Buna dayanılarak redüksiyon mekanizmasına metal oksitinin de katıldığı yolunda bir görüş öne sürülmüştür. Bu çalış -mada kromat redüksiyonu mekanizmasına rutenyumun nasıl katı -lacağını incelemek amacı ile sülfürik, perklorik asitler içerisine
de-ğişik konsantrasyonlarda bikromat ilave edilerek oksitlerımiş ve re,- düklenmiş rutenyum elektrodla potansiyostatik redüksiyon eğrileri elde edilmiştir.
MATERYAL VE METOT
a) Ölçme Yöntemi :
Potansiyostatik yöntemle deney elektrodu ile referans elektro-du arasına potansiyostattan belirli bir gerilim uygulanarak bu ge rilim 15 sn de 50 mV değiştirilmiş ve karşı gelen akım okunmuş -tur. Ölçme sırasında Wenking Breitband Model 61 RS elektronik potansiyostatı kullamlmıştır. Potansiyostatlar dış devreye akım ve-ren bir elektrik kaynağı ile, çalışma elektrodunun gerilimini belirli değerde tutmak için gereken -akım şickletini ayarlamak üzere bir akım düzenleyici organdan oluşurlar. Bu iş için referans ve çalış -ma elektrodundan başka bir karşı elektroda gerek vardır. çalış ma-mızda referans elektrod Pb02/PbSO4 veya kalomel, karşı elektrod Pt, çalışma elektrodu Ru dur. Deney kabı üç bölmeli bir pyrex hüc-reden oluşmuştur. Çalışmalarda iletkenlik suyu kullanılmıştır.
b) Elektrodtm ön işlemi :
Bu deneylerde oksitlenmiş ve redüklenmiş elektrodIarla çalı
-şılmıştır. Oksitleme ve redükleme işlemleri 1 N H2SO4 veya 1 N HC104 çözeltileri içerisinde, ayrı bir kabda yapılmıştır. Oksitlemek için elektroda, amaca göre 800, 1000, 1200, 1400 mV luk gerilimler uy-gulanmış ve elektrod bu gerilimi aldıktan sonra 15 dakika daha uy-gulamaya devam edilmiştir. Elektrodu 1600 mV da oksitlemek, için 1600 mV luk bir gerilim 15 dakika uygulanmıştır, Deney yapıldı k-tan sonra yeni bir ön işlem uygulamasına başlarken elektroda 45 saniye -- 20 mV luk bir gerilim uygulanarak yüzeyin oksitlerden ta-
Bikromat lyonunun Raduksıyonunurı Inceisnmesı
3
mamen kurtarılması sağlanmıştır. Redükleme işlemi için önce elek-trot 800 mV da oksiltenmiş sonra 300 veya 400 mV luk bir gerilim uygulanarak, elektrot bu gerilimi aldıktan sonra 15 dakika süre ile uygulamaya devam edilmiştir. Her eğri en az 3 deneyin sonucudur.
BULGULAR VE YORUMU
Deneylerde iletme elektroliti olarak 1N HC10 4 veya 1 N H2SO4 kullanılarak içerisine değişik konsantrasyonda bikromat ilave edil-miştir. Deney sırasında çözelti sürekli karıştırdmıştır. Böylece göç-le ve konveksiyonla madde taşınması önlenerek yalnız diffüzyonun reaksiyonda etkin olması sağlanmıştır. İyonlar elektrod yüzeyine ge-lir gelmez yüklerini nötrleştirebiliyorsa elektrod dolayında o iyonun birikimi söz konusu olmaz. Bu halde reaksiyonun hızı o iyonun elek-troda difüzlenme hızı ile sınırlanmış olur. Böylece akım bir limit değere ulaşır. Buna sınır akımı denir. İyonlar elektroda yalnız dif-füzyonla taşınıyarlarsa bu halde sınır akımı Fick'in I. kanunu ile
verilir.
Dn F C' 8
Burada; i L sınır akımı
D diffüzyon katsayısı
n redüksiyonda alınan elektron sayısı
F Faraday sahili
C° çözeltinin konsantrasyonu 8 diffüzyon tabakası kalınlığı
Aynı bir reaksiyon için D, n, F ve 8 sabit olduğundan i L = KC° ola-rak gösterilebilir.
Bikromat redüksiyonu incelenirken redüksiyon eğrileri üzerin-de belli potansiyel bölgelerinüzerin-deki sınır akımı değerleri konsantras-yona karşı grafiğe geçirilerek bu eşitliği sağlayıp sağlamadığı kont-rol edilnüştir. Bu eşitliğin sağlandığı potansiyel bölgelerinde bikro-Inat redüksiyonu cereyan ediyor demektir. Aynı bir reaksiyon orta-mında elde edilen *ilerde IÇ eğiminin değişmesi, n, alman elektron
S UNERİ, I ÖDÜN
sayısının değ'işmesinclen ileri geleceğinclen eğimin değiştiği bölge-lerde redüklenme derecesi de değişiyor demektir.
Şekil 1, 400 mV da redüklenmiş Rutenyum elektrodla 10-3-10-2 M K2Cr207 H- 1 N HC10 4 çözeltileri içerisinde elde edilmiş redüksi-yon eğrilerini göstermektedir. Yalnız 1 N HC104 içerisindeki polari-zasyon eğrisi (446) 530 mV dolayındaki sükünet potansiyeli değ erin-den başlamıştır. Bikrornat ilave edilmiş çözeltilere elektrot daldı -rıldığında bikromatm oksitleyici etkisinden dolayı okunan potansi-yel daha yüksek olmuştur. 10-2 M K2Cr207 kadar olan konsantras-yonlarda eğrilerin başlangıç potansiyelleri 725 - 830 mV dolayı nda-dır. 10-2 M K2Cr207 de elde edilen eğri (443) 830 mV dolayında bir potansiyel göstermektedir. Daha önceki•çalışmalarımızda (1) bu po-tansiyel bölgesinin Ru203. H20 ya karşı geldiği, bu oksitin redük-siyonımurı 600 - 400 mV arasındaki potansiyellerde sınır akımı gös-terdiği saptanmıştı. Şekil I deki 450, 480, 500 ve 600 mV daki sınır akımı değerleri konsantrasyona karşı grafiğe alınmıştır (Şekil 1-a). Burada görüldüğü gibi 6.10-3 M bikromat konsantrasyonuna kadar, sınır akımı konsantrasyonla çizgisel olarak değişmekte, sonra bir minimumdan geçip tekrar yükselmektedir. Belli bir bikromat kon-santrasyonundan sonraki bu azalış başka araştırmacılar tarafından diğer Pt gurubu metalleri ile yapılan çalışmalarda da (8,9) gözlen-miştir. Bu azalışın, belli bir konsantrasyondan sonra elektrod yüze-yindeki film tabakasının kalınlaşması ile redüksiyonu kısmen en gellemesinden ileri geldiği sanılmaktadır. Şekil 2, yine 1 N HC104 içeren 2.10-3 — 6.10-3 M K2Cr207 çözeltileri içerisinde ama bu kez 800 mV da oksitlenmiş elektrodla elde edilen redüksiyon eğrilerini göstermektedir. Eğrilerin tümünde çözeltiye daldırılır daldırılmaz 775 -825 mV dolayında ve Ru203 ün oluşmasına karşı gelen bir sü-künet değeri okunmaktadır. 500 mV dan daha düşük gerilimlerde bikromat konsantrasyonu arttıkça sınır akımında da bir artış görül-mektedir. Fakat bu artış konsantrasyona çizgisel bir bağlılık gös-termemektedir. Şekil 3 de 10-6 — 10-4 M K2Cr207 1 N HC10, içe-ren çözeltilerde 1350 mV da oksitlenmiş elektrodla elde edilmiş
akım potansiyel eğrileri görülmektedir. önceki çalışmalarımızda (1) 1350 mV da RuO4 ün oluşmağa başladığı saptanmıştı. Bu potan- siyelde
oksitler
ı
mi
ş
elektrod de
ğ
i
ş
ik
konsantrasyonda bikromat içe-Ikromet lyonunun Recllikslyonunun incelenmesi
S
ren çözeltilere daldınlmca sükünet potansiydi olarak bu değere ya-km bir gerilim okunmaktadır. Şekil 3 deki eğriler 1200 - 1000 mV da Ru02 nin indirgenme basamağım gösterdikten sonra 1000 - 800, 400 - 300 mV daki redüksiyon basamaklarını da oluşturmaktadır. Bura-da ilginç olan bir nokta Bura-da eğrilerin çoğunda
700 - 450 mV aras
ında geri gidişlerin bulunmasıchr. Bu durum diğer plâtin gurubu metal-leri ile yapılan araştırmalarda da (8) gözlemniş akını maksimum-larmın bikromat konsantrasyonu arttıkça daha soy potansiyellere kaydığı saptamnıştır.:1 N HC104 çözeltisi içerisinde rutenyumla elde edilmiş (1) polarizasyon eğrilerinde de aynı maksimumlar ve geri gidişlerin varlığı tarafımızdan saptandığmdan bunun oksit redüksi-yonu ile ilgili olduğu öne sürülebilir: Şekil 3 deki eğrilerin 580, 900 ve 1050 mV dolayındaki sınır akımı değerleri bikromat konsantras-yonuna karşı grafige alındığında 4.10-5 M bikromat konsantrasyo-nuna kadar dar bir konsantrasyon aralığında çizgisel bir gidiş göz-lenrnekte bundan sonra konsantrasyon arttıkça sınır akımı azalmak-tadır (Şekil 3-a).Şekil 4 de 10-3 — 4.10-5 M 1(2Cr207 1 N HC104 içerisinde 1600 mV da oksitlenmiş elektrodla elde edilmiş eğriler görülmektedir. 1600 mV da oksitleme sırasında elektrod yüzeyinde gözle görülebi-lir kahverengi bir tabaka meydana gelmiştir. Bu tabakanın 1600 mV da oluşan Rıı04 ün sulu ortamda bozulmasından meydana gel-miş Ru02 olabileceği daha önce öne sürülmüştür (1). Eğrilerin Ş e-kil 4 de de 1300 mV dolaymda.n başlaması bu tabakanın. başlıca Ru02 biraz da,Rn04 den oluşma olasılığını kuvvetlendirmektedir. Buradaki eğrilerde Şekil 3 de görülen maksimum ve onu izleyen
ak
ı
n
ı
azalışlan aynı potansiyel bölgelerinde göze çarpmaktadır. Maksimunıım bdirdiği potansiyel bölgesi bikromat konsantrasyonu arttıkça daha soy potansiyel değerlerine kaymaktadır. Burada ayrıcaşekil 1,2 ve 3 deki eğrilere oranla akım şiddetinin büyük olması dik-kati çekmektedir. Şekil 4 deki eğrilerin çeşitli potansiyel bölgele-rindeki sınır akımı değerlerinin konsantrasyonla değişimi şekil 4-a da görülmektedir. Burada oldukça geniş bir konsantrasyon bölge-sinde sınır akımı ile konsantrasyon çizgisel olarak değişmektedir.
Şekil 5 de .400 mV da redüklenmiş elektrodla 2.10-3 - 7.10--3 M K20t207 + 2 N HC10 4 çözeltileri içerisinde elde edilmiş • redüksiyon
ı
eğrileri görülmektedir. 630 nolu eğri yalnız 1 N HC104 içerisinde el-de edilmiş olup 500 mV dolayından başlamakta ve 200 mV yakı n-larına kadar bir basamak sonra diğer bir basamak göstermektedir. Bikromat ilave edilince başlangıç potansiyeli Ru203 bölgesine karşı
gelen 650 mV yakınlarına ulaşmaktadır. Eğrilerin hepsinde 450 - 575 mV arasında bir sınır akımı bölgesi belirmiştir. 480 mV daki sınır akımı değerleri konsantrasyona karşı grafiğe alınarak şekil 5-a elde edilmiştir. Burada sınır akımının 4.10-3 molara kadar, bikromat konsantrasyonu ile çizgisel değiştiği, doğrunun eğiminin çok küçük olduğu görülmektedir.
Şekil 6 da 800 mV oksitlenmiş elektrodla 2 N HCIO4 10-3 - 6.10-3 M K2Cr207 çözeltileri içerisinde elde edilmiş ak= - potansi-yel eğrileri izlenmektedir. Bikromat içermeyen 2 N HC104 içerisin-de eliçerisin-de edilmiş olan 637 nolu eğri 800 mV dolayından başladığı hal-de bikromatlı çözeltilerde başlangıç potansiyeli 850 - 875 mV a yük. selmiştir.
Şekil 6-a da 480 mV daki sınır akımı bölgesi için sınır akımı
konsantrasyon bağlılığı görülmektedir. Burada 5.10 -3 M bikromat konsantrasyonuna kadar çizgisel bir değişim gözlenmiştir.
Görüldü-ğü gibi çizgiselliğin gözlendiği konsantrasyon aralığı çok dar olup doğrunun eğimi de küçüktür.
1 N HC104 ve 2 N HC10 4 içeren bikromat çözeltilerinde elde edilmiş olan redüksiyon eğrilerinde belirgin bir ayrılık yoktur. Au elektrodla (10,11) yapılan araştırmalarda perklorik asit konsant-rasyonu 150 gr/lt yi geçtiğinde yabancı iyon etkisi göstereceği yani elektrod yüzeyinde oluşan filmin gözenekliliğini arttırarak sınır akı -mı konsantrasyon çizgisel değişiminin daha yüksek bikromat kon-santrasyonuna kadar uzarımasına olanak vereceği kaydedilmekte-dir. Oysa Rutenyum elektrodla böyle bir durum söz konusu değ il-dir.
Şekil 7, 1 N H2 SO4 -F 10-6 - 10-2 M K2Cr207 çözeltileri
içerisin-de 800 mV da oksitlenmiş Rutenyum elektrodla elde edilmiş redük-siyon eğrilerini gösteı ınektedir. Bikromat konsantrasyonu arttı k-ça eğrilerin başlangıç potansiyeli yükselmekte ve tüm egriler 830 -
Bikromat lyonunun RedUksiyonunun İncelenmest
7
rine karşı g.gen potansiyel bölgesinden başlamaktadır. Eğriler üze-rinde bu oksitlerin redüksiyonu ile ilgili basamaklar belirmiştir. Ş e-kil 7 deki eğrilerden yararlanarak 500 mV daki sınır akımı değ erle-rini konsantrasyona karşı gösteren şekil 7-a elde edilmiştir.
Görüldüğü gibi burada 2.10- 5 M bikromalt, konsantrasyonuna kadar konsantrasyonla sınır akımı arasında çizgisel bir değişim var dır.
Sonuç
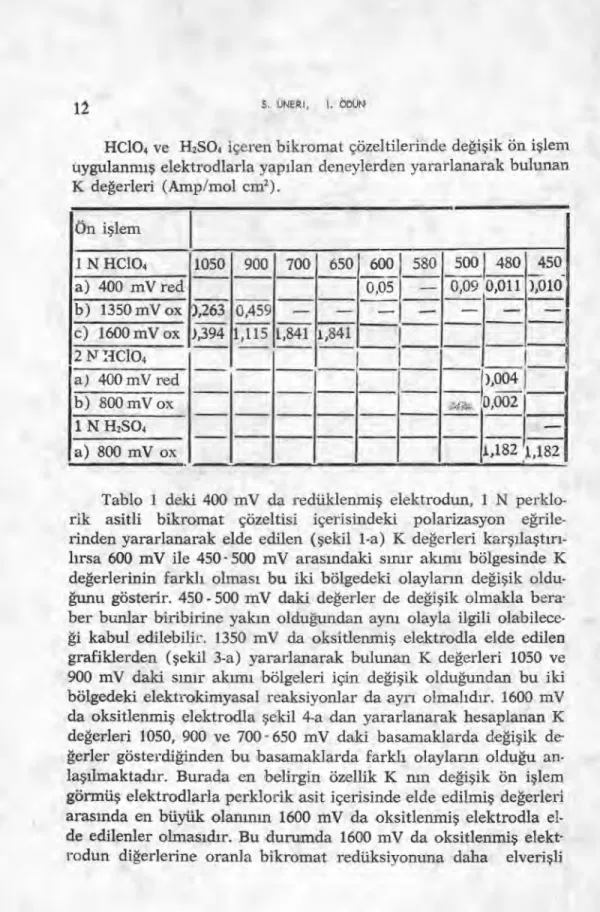
Şekil 1-a, 3-a, 4-a, 5-a, 6-a, 7-a daki doğruların eğimleri hesapla-narak Tablo 1 düzenlenmiştir.
Şekil : 1
1 N HC104 içerisinde ve buna A > 2.10-3 M,
❑ __--> 3.10-3 M, (1), ______> 4.10-3m, > 5.10-3 M,
6.10-3 M, Q,
>
7.10-3 m,■
> 8.10-3m, x > 10-2 M K2Cr20, ilave edilerek 400 mV da redüklenmiş elektrodla elde edilmiş pcloriza,;yon eğrileriŞekil : 2
X —__>. 1 N HC104 içerisinde ve buna II, > 2.10-3 M,
A > 3.10-3 M, 13 > 4.10-3 M, eı > 5.10-3 M,
A --> 6.10-3 M K2Cr207 ilave edilerek 800 mV da aksitlemniş elektrodla elde edilmiş redüksiyan eğrileri
Şekil : 3
1 N HC104 iç«risine • > 10-6 M, X > 10-5 M, 4.10-5 M, A > 6.10-5 M, El 10--4 M
K2Cr207 ilave edilerek 1350 mV da oksitlenmiş elektrodla elde edilmiş redük-siyasi eğrileri
İ3ikromat İyonunun ItedUksiyonunun incelenmesi I (AM -' ■ Şekil : 4 X > 2,5.10-6 M, A > 1,2.10-5 M, 10 > 4.10-4 M, Ii > 6.10-5 M, (I) > 10-4 M, 0 > 1,25.1G-3 M K,Cr207 ilave edilerek 1600 mV da oksitlenmiş elektrodla elde edilmiş redük-siyon eğrileri
Şekil : 5
X
>
2 N HC104 içerisinde ve buna 0 > 10-3 M,> 2.10-3 M, 1-3 > 3.10— M, cD > 4.10-3 M, > 5.10-3 M, 4) > 6.10-3m, ei > 7.10-3 M K2Cr207 ilavesiyle 400 mV da redüklenmiş elektrodla elde edilmiş aknn- po-tansiyel eğrileri
1000 900 800 700 600 500 40 IlıiA 0 60 70 300 S. UNERi, İ. ODUN Şekil': 6
X > 2 n HCIO, içerisinde ve buna O > 10-3 M, > 2.10-3m, ri > 3.10-3 M, 0 > 4.10-3M,
A
>
5.10-3 M, la > 610-3 M K2Cr20, ilave edilerek 800 mVda oksitlenmis elektrodla elde edilmiş redüksiyon eğrileri
?0 3 2.103 3:103 4:10-3 6.10-3 6103 C1molJltl Şekil : 6 - a 30 20 9 10 4.1G- ICS C(molitt 18.10-5 2.16's 40-soonw
kroma t iyollıiı5un Redüksiyonuııun incelenmesi
3of <20 114) lel Şekil. 3 - a 900 mV J:L2 mV 4A0-5 C («Int --P 6.10 10-6 10 -6 Şekil : 4 - a 20 i 101O>I4) ---0 480 mV C 3.102 4.10 530 3 540 7.10 cır.otıctı Şekil : 5 - a Şekil : 7 - a
Şekil : 1, 3, 4, 5, 6, 7'den yararlanilarak değişik potansiyel bölgelerindeki sinir akımı—konsantrasyon bağhliklan
12 S. UNERı, I. ODUN
HC104 ve H2SO4 içeren bikromat çözeltilerinde değişik ön işlem uygulanmış elektrodlarla yapılan deneylerden yararlanarak bulunan K değerleri (Amp/mol cm2 ). ön işlem 1 N HC104 1050 900 700 650 600 580 500 480 450 a) 400 mV red 0,05 -
0739
,
WIT. 5;1516
b) 1350 mV ox ),263 0,459 1,841 1,841 c) 1600 mV ox ),394 1,1151
2N HC104
a) 400 mV red—
1),0041 fes,0(11 b) 800 mV ox ---, 1 N H2SO41
1,182 a) 800 mV ox 1,182Tablo 1 deki 400 mV da redüklenmiş elektrodun, 1 N perklo-rik asitli bikromat çözeltisi içerisindeki polarizasyon eğ rile-rinden yararlanarak elde edilen (şekil 1-a) K değerleri karşılaştırı -lırsa 600 mV ile 450- 500 mV arasındaki sınır akımı bölgesinde K değerlerinin farklı olması bu iki bölgedeki olayların değişik
oldu-ğunu gösterir. 450 - 500 mV daki değerler de değişik olmakla bera-ber bunlar biribirine yakın olduğundan aynı olayla ilgili
olabilece-ği kabul edilebilir. 1350 mV da oksitlenmiş elektrodla elde edilen grafiklerden (şekil 3-a) yararlanarak bulunan K değerleri 1050 ve 900 mV daki sınır akımı bölgeleri için değişik olduğundan bu iki bölgedeki elektrokimyasal reaksiyonlar da ayrı olmalıdır. 1600 mV da oksitlenmiş elektrodla şekil 4-a dan yararlanarak hesaplanan K değerleri 1050, 900 ve 700- 650 mV daki basamaklarda değişik
de-ğerler gösterdiğinden bu basamaklarda farklı olayların olduğu an-laşılmaktadır. Burada en belirgin özellik K nın değişik ön işlem görmüş elektrodlarla perklorik asit içerisinde elde edilmiş değerleri arasında en büyük olanınm 1600 mV da oksitlenmiş elektrodla el-de edilenler olmasıdır. Bu durumda 1600 mV da oksitlenmiş elekt-rodun diğerlerine oranla bikromat redüksiyonuna daha elverişli
olduğu olasılığı ortaya çıkmaktadır. On işlem sırasında elektrod 1600 mV luk gerilim uygulandığında Ru04 meydana gelmekte ve bunun sulu çözeltide bozulması ile elektrod yüzeyinde Ru02 çök-mektedir. Bu tabakanın, yüzeye az yapışmış olması nedeniyle bik-romat redüksiyonunu daha az engelleyebileceği olasılığı vardır.
Tablo 1 de son olarak, 8C0 mV da oksitlenmiş elektrodla 1 N H2SO4 içeren bikromat çözeltileri içerisinde elde edilmiş olan şekil 7-a daki eğriden yararlanılarak 480 ve 450 mV daki K değerleri ve-rilmiştir. Görüldüğü gibi burada da eğim büyüktür. Literatürde (10) Au elektrodla, perklorik asit içeren bikromat çözeltilerinin redüksi-yonu incelenirken, elektrod yüzeyinde oluşan filmin bileşenleri ile kompleks verme olanağı olmadığından, perkloratın bikromat re-düksiyonunda kolaylaştırıcı bir etkisi (yabancı iyon etkisi) olma-dığı ancak 150 gr/lt den fazla perklorik asit konsantrasyonuna
ula-şılınca bu etkinin ortaya çıktığı kaydedilmektedir. Fakat Ruten-yumun perklorik asit konsantrasyonu 2 N alındığı halde bile, bu et-kiyi göstermediği saptanmıştır. Buna neden olarak 200 gr/lt perk-lorik asidin Au üzerinde oluşan tabakayı çözebilmesine karşılık Ru da bunun yeterli olmadığı düşünülebilir. Bu da bikromat redüksi-yonunda metal üzerinde oluşan filmin geniş ölçüde metalin cinsi-ne bağlı olduğu, dolayısıyle geniş ölçüde metal oksidinden oluştuğıı
görüşünü kuvvetlendirir.
Bikromat redüksiyonunda bütün koşullarda gözlediğimiz, kon-santrasyonla sınır akımının çizgisel artış potansiyelleri belirli ok-sitlerin redüksiyon bölgesine düşmektedir. O halde literatürde de (8,12) öne sürüldüğü gibi bikromat redüksiyonunun. soy metaller
aksitlerinın redüklendiği potansivellerde görüşü
ru-tenyum
elektrodla yapılan deneylerde de doğrulanmış olmaktadır.ÖZET
Bu çalışmada 800, 1000, 1200, 1350, 1600 mV da oksitlenmiş ve 100 mV da redüklenmiş rutenyum elektrodlarla 1 N HC104, 2 N HC1O4
ve 1 N H2 SO4 içeren değişik konsantrasyonda bikromat
çözeltileri-ıin redüksiyonu ile ilgili akım - potansiyel eğrileri elde edilmiştir.
rasyona karşı grafiğe geçirilerek 1. Fick kanununa göre i = KC° )agıntısınin geçerli olduğu konsantrasyon aralıkları ve elde edilen 1oğularm eğimleri saptanmıştır. Değişik koşullarda bu bağıntının geçerli olduğu, yani bikromatın redüklendiği potansiyel bölgeleri 550, 700, 9W, 1050 mV olarak bulunmuştur. Söz konusu potansiyel bölgeleri rutenymn oksitlerinin redüksiyonu ile ilgili olduğundan, bikromat redüksiyonunun metal oksidinin redüksiyonu potansiye-tinde yürüdüğü sonucu çıkarılmıştır. Ayrıca yüzeyin redüksiyona en elverişli olduğu ön işlem yöntemi de saptanmıştır.
SUMMARY
In this investigation current - potantial curves, due to the reduc-tion of bichromate solureduc-tions, which contained I N HC104, 2 N HC104, 1 N 1-12SO4, were obtained with the ruthenium electrodes which had been preoxidized at 800, 1000, 1200, 1350, 1600 mVs.
The values of limiting currents in these curves were plotted against concentrations of bichromate. From these plots the con+ centration regions which showed linear dependence on the limiting currents in accordance with Fick's first law = KC°), and the slopes of the lines were determined. Under various corıditions the potential regions, at which a linear dependence between limiting current and concentration was seen, were determined as 650, 700, 900, 1050 mVs. These potential regions correspond to the reduction of various ruthenium oxides. For fl -ı's reason it is acceptable that the reduction of bichromate takes place through the reduction of electrode metal oxide.
L İ TERATÜR
1 — Ödün, 1., Üneri, S.: Communacatiens de la Faculte Des Se4ences De
L'Universite D'Ankara Serie B: Chimine, Tome 20, B, 63 (1973). 2 — Silverman, L.: Metal Finishing, 48, 46 (1950).
3 — Sysoev, A., Drcbantseva, Platonina, O,A. J. Appl. Chem. U.S.S.R,
4 — Frei, M., Knorr, C.A.: Zeit. für Elek. Chem, 60, 1093 (1956). 5 — Cgburn, F., Brenner, A.: Trans. Elec. Chem. Soc., 96, 347 (1948). 6 — Latirner Oxidation potentials, Prentice Hall INC p. 228 (1952).
7 — Üneıri, S.: Cummunicatiens de la Faculte des S•:e:Les de L'Universite D'Ankara, Serie B. Chimie, TomeVI (1955).
8 — Kabasakaeğlu, M., Üneri, S.: Communications de la Faculte des Scien-ces L'Universite D'Ankara, Serie B. Chinne, Tane 15 B, 3 (1968). 9 — Feigl, H., Kandler, L., Reinhold, R. Metalloberffiehe (17), Beft; 8, 229
(1963).
10 — Lıopis, J., Vazquez, M.: Electrochimica Acta, 11, 633 (1966).
11 — Mitskus, MA., Matulis Y. Y.: Lietuvos T.S.R. 1\ılokslu Akad. Darbai, 2, 25 (1961).
12 —