T. C.
SELÇUK ÜNİVERSİTESİ TIP FAKÜLTESİ PATOLOJİ ANABİLİM DALI
PROSTAT ADENOKARSİNOMLARINDA İMMÜNOHİSTOKİMYASAL LC3A, NGEP VE HEPSİN EKSPRESYONLARININ KLİNİKOPATOLOJİK PROGNOSTİK
PARAMETRELERLE İLİŞKİSİ
Dr. Senem BAŞTOKLU TIPTA UZMANLIK TEZİ
TIBBİ PATOLOJİ ANABİLİM DALI
Danışman
T. C.
SELÇUK ÜNİVERSİTESİ TIP FAKÜLTESİ PATOLOJİ ANABİLİM DALI
PROSTAT ADENOKARSİNOMLARINDA İMMÜNOHİSTOKİMYASAL LC3A, NGEP VE HEPSİN EKSPRESYONLARININ KLİNİKOPATOLOJİK PROGNOSTİK
PARAMETRELERLE İLİŞKİSİ
Dr. Senem BAŞTOKLU
TIPTA UZMANLIK TEZİ
TIBBİ PATOLOJİ ANABİLİM DALI
DANIŞMAN
Yrd. Doç. Dr. Zeliha Esin ÇELİK
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından 14102038 Proje numarası ile desteklenmiştir.
TEŞEKKÜR
Patoloji uzmanlık eğitimim boyunca bilgi ve tecrübeleriyle eğitimime her türlü desteği veren değerli hocalarım başta Patoloji Anabilim Dalı Başkanı Sayın Yrd. Doç. Dr. Pınar Karabağlı olmak üzere Yrd. Doç. Dr. Zeliha Esin Çelik, Prof. Dr. Serdar Uğraş, Prof. Dr. Füsun Baba, Doç. Dr. Halil Kıyıcı ve Yrd. Doç. Dr. Ceyhan Uğurluoğlu’na şükranlarımı sunarım.
Tezimin hazırlanmasında bilgi ve deneyimleriyle bana yol gösteren ve destek olan tez danışmanım Sayın hocam Yrd. Doç. Dr. Zeliha Esin Çelik’e ayrıca teşekkür ederim.
Tez çalışmamı istatiksel olarak değerlendiren Halk Sağlığı Anabilim Dalı öğretim üyesi Sayın Yrd. Doç. Dr. Fatih Kara’ya teşekkür ederim.
Ayrıca eğitim süresince birlikte görev yaptığım asistan arkadaşlarıma, laboratuar teknisyenlerimize, bölüm sekreterlerimize ve personelimize teşekkürü borç bilirim.
Hayatımın her aşamasında olduğu gibi tezimin hazırlanmasında da bana büyük destek olan, kıymetli anne ve babama, değerli kardeşime, sabrından ötürü güzel kızım Deniz Kumsal’a ve Patoloji’yi seçmemde etkisi olan rahmetli eşim Ahmet Deniz Baştoklu’ya çok teşekkür ederim.
Dr. Senem BAŞTOKLU 2015-Konya
İÇİNDEKİLER Sayfa KISALTMALAR ... iv 1. GİRİŞ ... 1 1. 1. Prostatın Embriyolojisi ... 3 1. 2. Prostatın Anatomisi ... 3 1. 3. Prostatın Histolojisi ... 8 1. 4. Prostatın Fonksiyonu ... 10 1. 5. Prostatın Fizyolojisi ... 10
1. 6. Prostat Büyümesinin Kontrolü... 11
1. 7. Prostatik Salgı Proteinleri ... 11
1. 8. Prostat Kanseri ... 12 1. 8. 1. İnsidans ve Epidemiyolojisi ... 12 1. 8. 2. Risk Faktörleri ... 13 1. 8. 3. Semptomları ... 16 1. 8. 4. Tanısı... 18 1. 8. 5. Tedavisi... 20
1. 8. 6. Prostat Karsinomlarının Makroskopisi ... 20
1. 8. 7. Prostat Tümörlerinin Sınıflandırılması ... 22
1. 8. 8. Prostat Adenokarsinomu... 24
1. 8. 9. Prostat Adenokarsinomunun Histolojik Varyantları ... 27
1. 8. 10. Prostat Adenokarsinomlarında İmmünoprofil ... 29
1. 8. 11. Duktal Tip Adenokarsinom... 31
1. 8. 13. Skuamöz Karsinom... 32
1. 8. 14. Adenoid Kistik Karsinom / Bazal Hücreli Karsinom ... 32
1. 8. 15. Ürotelyal Karsinom... 32
1. 8. 16. Prostat Adenokarsinomu ile Karışabilen Lezyonlar ... 33
1. 8. 17. Prostat Karsinomlarında Derecelendirme ... 37
1. 8. 18. Prostat Karsinomlarında Evrelendirme ... 40
1. 8. 19. Prostat Karsinomunda Radikal Prostatektomi Raporlaması ... 44
1. 8. 20. Prognostik Faktörler... 47 1. 8. 21. NGEP ... 49 1. 8. 22. LC3A... 50 1. 8. 23. Hepsin ... 52 2. GEREÇ ve YÖNTEM... 54 3. BULGULAR ... 57 4. TARTIŞMA ... 70 5. SONUÇ ve ÖNERİLER ... 75 KAYNAKLAR ... 77 ÖZET... 92 SUMMARY ... 94 EKLER ... 95
A: Etik kurulu kararı... 95
B: Tezin dijital formatı (CD) ... 95
KISALTMALAR:
aa: Amino asit
ABD: Amerika Birleşik Devletleri. AMACR: α-Metil-CoA Rasemaz AR: Androjen reseptörü
ASAP: Atipik küçük asiner proliferasyon Atgs: Otofaji ilişkili genler
BHB: Bazal hücre belirteçleri BPH: Benign prostat hiperplazisi Ca: Kalsiyum
CK: Sitokeratin
DHT: Dihidrotestosteron EPU: Ekstraprostatik uzanım HE: Hematoksilen Eozin
HMWCK: Yüksek molekül ağırlıklı sitokeratin
HPIN: Yüksek dereceli prostatik intraepitelyal neoplazi İHK: İmmünohistokimya
LC3A: Mikrotübülle ilişkili protein 1 hafif zincir 3A LH: Lüteinizan hormon
LHRH: Lüteinizan hormon salgılayıcı hormon NGEP: Prostattan eksprese olan yeni gen PAF: Prostatik asit fosfataz
PAS: Periyodik asit shift PCa: Prostat kanseri
PIN: Prostatik intraepitelyal neoplazi PRM: Parmakla rektal muayene PSA: Prostata spesifik antijen pT: Patolojik tümör evresi RP: Radikal prostatektomi
tPSA: Total prostata spesifik antijen TRUS: Transrektal ultrasonografi
1. GİRİŞ:
Prostat kanseri (PCa) erkeklerde en sık görülen neoplazidir veakciğer kanserinden sonra ikinci sıklıkta kansere bağlı morbidite ve mortalitesebebidir. PCa yavaş büyüyen ve geç bulgu veren bir tümör olup heterojen bir yapıya sahip olduğu için tümörün seyri oldukça değişkendir (1).
Kliniğe başvuran hastaları değerlendirirken önce parmakla rektal muayene (PRM), transrektal ultrasonografi (TRUS), Prostata spesifik antijen (PSA) değerinin ölçümü ve hasta yaşı bilgilerinden faydalanılmaktadır. Normal olmayan PRM veya TRUS, PSA değerinin >4 ng/ml olması veya ileri yaş gibi durumlardan herhangi ikisi birlikte olduğunda iğne biyopsisi yapılması önerilir.Serum PSA seviyesi prostat hipertrofisi ve prostatit gibi benign durumlarda da artış göstermektedir fakat serum PSA seviyeleri yüksek olan hastalara prostat kanserini ekarte etmek için biyopsi yapılmalıdır. Bu nedenle PSA seviyesini destekleyen yeni serum ve doku belirteçlerine ihtiyaç vardır (1,2).
PCa sık görülmesine rağmenkarsinogenezin moleküler temelleri konusunda çok az bilgi bulunmaktadır. PCa olgu sayısı gitgide arttığı içinhastalığın nedeni ve önlenebilmesi için yapılan çalışmalar önemli hale gelmektedir. İmmün sistemin daha fazla anlaşılmaya başlanması ile birlikte tümör immünolojisi ve aşı teknolojileri daha etkili olmaya başlamıştır(1,2).
Lokalize PCa’nın standart tedavisi cerrahi, radyoterapi ve yakın takiptir. İlerlemiş ve metastatik kanserlerin mevcut tedavisi hormon terapisi ve kemoterapi’dir (3). Fakat bu tedaviler şimdilik metastatik PCa’da androjen baskılama tedavisi sonrası arta kalan androjenden bağımsız karsinom hücrelerini tamamıyla yok edememektedir. Androjenden bağımsız PCa’nın progresyonu ve metastazı PCa’dan ölümlerin esas sebebidir (4). Bu yüzden PCa’nın tedavisinde yeni yaklaşımlar zorunludur. Önceki çalışmalar aşı ve hedefe yönelik tedavinin bu tip kanserlerde
yönelik tedavi için PCa’daki spesifik tümör belirteçlerinin bulunması ve buna dayalı olarak erken teşhis ve yeni tedavi protokollerinin geliştirilmesi çok önemlidir (5).
Çalışılan bu moleküllerden biri, otofaji proteinlerinden Mikrotübülle ilişkili protein 1 hafif zincir 3A (LC3A) proteinidir. LC3A proteininin prostat adenokarsinomlarındaki ekspresyonunun, tümörün klinikopatolojik özellikleriyle ilişkisi üzerine literatürde yayınlanmış az sayıda çalışma mevcuttur. Bu çalışmalarda yüksek ekspresyonunun Gleason skoruyla ve agresif histolojik ve klinik davranışla ilişkili olduğu saptanmıştır. Bu bulguların tasdik edilmesi için daha geniş serilerle çalışılması ve daha uzun postoperatif takibi gerekmektedir.
Diğer molekül prostattan eksprese olan yeni gen (NGEP)’dir. Bu gen ürünü olan protein; hücre-hücre bileşkesinde yoğun olarak bulunan politopik membran proteinidir. Değişik yoğunlukta olmakla beraber sadece benign, HPIN ve kanserli prostat dokusunda eksprese edilir. Son zamanlarda antikora bağlı hedefe yönelik tedaviler prostat ve akciğer gibi solid tümörlere karşı modern tedavide vazgeçilmez olmaya başlamıştır. PCa’ya seçici olduğu ve hücre yüzeyinde yerleştiği için NGEP; PCa’da hedefe yönelik antikora dayalı tedavide ümit vericidir.
Çalışılan diğer molekül PCa’da en fazla regüle olan genlerden biri olan Hepsin’dir. Hepsin bir Tip 2 transmembran serin proteazdır. PCa’da hücre migrasyonu ve invazyonuyla ilişkilidir. Benign prostat dokusu ve Benign prostat hiperplazisi (BPH) ile kıyaslandığında Hepsin, lokalize ve metastatik PCa’larda yüksek ekspresyon göstermektedir. Ayrıca, yüksek dereceli prostatik intraepitelyal neoplazi (HPIN) olgularında da yüksek ekspresyonu gösterilmiş, erken evre PCa gelişiminde Hepsin disregülasyonu bildirilmiştir (2). Hepsinin yüksek ekspresyonu tümör progresyonu ve metastazı ile koreledir. Bu nedenle tanısal bir belirteç ve PCa’da hedefe yönelik tedavide kullanılabilecek bir molekül olarak önerilmektedir.
Bu çalışmada LC3A, NGEP ve Hepsin ekspresyonlarının klinikopatolojik parametreler (hastanın yaşı, operasyon öncesi serum PSA düzeyi, patolojik tümör evresi (pT), klinik evre, Gleason skoru, tümörün derecesi, lenfovasküler invazyon, perinöral invazyon, seminal vezikül invazyonu ve kapsül invazyonu) ile ilişkisi radikal prostatektomi (RP) örneklerinde araştırılmıştır. Buna göre benign prostat
dokusu, adenokarsinom ve HPIN odaklarında LC3A, NGEP ve Hepsin ekspresyonları immunohistokimyasal (İHK) yöntemle tespit edilerek, gruplar arasında elde edilen verilerde istatistiksel olarak anlamlı bir farklılık olup olmadığı araştırılmıştır.
1. 1. Prostatın Embriyolojisi:
Prostatik üretra epiteli, ürogenital sinüs endoderminden köken alır. Embriyonik gelişimin 3. ayında oluşmaya başlar. Çevre mezenkimal doku içine doğru bazı tomurcuklanmalar gösterir. Bu endodermal yapılardan prostatın glandüler bez epiteli gelişirken, mezenkimden ise, prostatın stroması ve düz kasları oluşmaktadır. Prostata açılan ejakülatuar duktuslar ve etrafındaki mezenkim dokusu, kökenini mezonefrik kanaldan almaktadır. Bu nedenle prostat embriyonik dönemde çift kökenli gelişim göstermektedir. Gebeliğin 4. ayında prostat iyice farklılaşır (8, 9). Neonatal dönemde prostatın çapı 1 cm’den küçüktür. Pubertedönemine kadar gelişerek 2 cm’den küçük çapa ulaşır. Puberteden sonra prostatın gelişimi hızlanır ve 20 yaşında erişkin hale gelir (1,10). Prostatın büyümesi ve gelişmesi, gestasyonun yaklaşık 8. haftasında başlayan fetal testislerden androjen üretimine bağlıdır. Wolf kanalından köken alan organların gelişimi sadece testosterona bağlı olduğu halde, ürogenital sinusun diferansiasyonu, 5 α redüktaz ile testosterondan üretilen dihidrotestosterona (DHT) bağımlıdır, Müller kanalından kaynaklanan prostatik utrikul ise östrojen stimülasyonu altında gelişir (11).
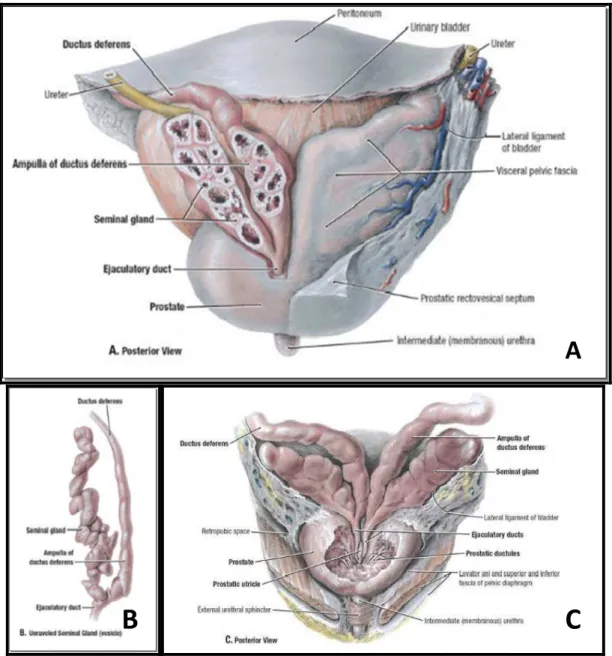
1. 2. Prostatın anatomisi:
Prostat erkek üreme sisteminin en büyük aksesuar bezidir. Fibromüsküler glandüler bir organdır. Şekli koniye benzeyen prostatın bazis adı verilen tabanı yukarıda, apeks adı verilen tepesi aşağıdadır. Ön yüzü facies anterior, arka yüzü facies posterior, sağ ve sol yan yüzleri ise facies inferolateralis olarak adlandırılmaktadır. Diafragma ürogenitalisin üstünde, mesanenin arka alt yüzü
doku nedeniyle, PRM ile rektum duvarı üzerinde rahatlıkla hareket ettirilebilir. PCa vakalarında bu duvar oynatılamadığı gibi arka yüzde bulunan oluk da hissedilemez.
Prostatın ağırlığı yetişkin erkeklerde ortalama 20-25 gramdır. Prostatın transvers çapı tabanda 4 cm, vertikal çapı 3 cm ve anteroposterior çapı 2 cm’dir (1, 12).
Arterleri: A. vesikalis inferior, rektalis media ve arteria pudenta interna’dır
Venleri: Plexus venosus vesicalis ve pleksus venosus prostaticus yolu ile v.
iliaca interna’ya dökülür (1,12). Bu pleksuslar presakral vertebral pleksuslarla (Batson venleri) anastomoz yapar ve bu da PCa’nın erken vertebral yayılımını açıklar.
Lenf drenajı: Bezin etrafında pleksus oluşturarak internal iliak ve sakral lenf
nodlarına dökülür (1,12).
Sinirleri: Parasempatik lifleri n.splanchnici pelvici’den (S 2-4) , sempatikleri
Şekil 1: Prostat bezinin anatomisi
(A,C: Posterior görüntüsü, B: Seminal vezikül) (13)
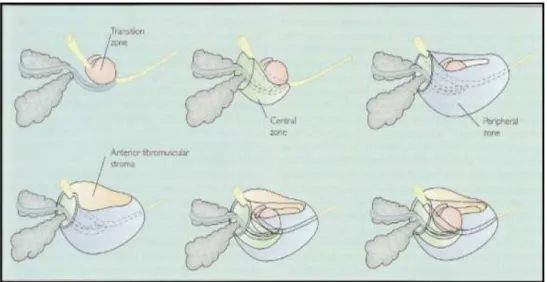
Zonal Anatomi:
Home’un 1906 yılında orta lobu tanımlamasına kadar prostatın 2 lateral loptan oluştuğu düşünülmekteydi. 1912’de Lowsley, embriyolojik bulgular doğrultusunda 2 yan, 1 arka ve 1 orta prostatik lobun olduğunu savunmuştur. Bu
A
ve periferal zondan oluşmaktadır (Şekil 2). BPH genelde iç zondan, karsinom ise dış zondan gelişmektedir. Ancak bazen tam tersi de görülebilir (1).
Şekil 2: Prostat bezinin zonal anatomisi (16)
TRUS olarak prostat glandüler ve nonglandüler olarak iki bölgeye ayrılabilir. Glandüler elementler McNeal’in anatomik modeline göre transizyonel, santral ve periferal zonlarda yer almaktadır.
A) Glandüler prostat dokusu:
Santral zon: Glandüler prostat dokusunun yaklaşık %25’ini oluşturur. Apeksi
verumontanumda, tabanı mesane boynunda, ejakülatuvar duktusları sarar ve lateral köşesi, proksimal periferal zon köşesi ile birleşir. Hem karsinoma, hem de inflamasyona dirençlidir.Burdan kökenli primer tümör oluşumu %10 civarındadır, ancak periferik zonda görülen tümörler sıklıkla santral zona yayılım gösterirler (1,12)
Periferik zon: Glandüler prostat dokusunun %70’ini oluşturur. Prostatın bazalinde
yerleşir. Santral ve transizyonel zonu çevreleyerek prostat dokusunu etrafından sınırlar. İnflamasyon, karsinom ve PIN’ın en sık görüldüğü zondur ve karsinomların %70-75’i buradangelişmektedir.
Preprostatik bölge: Periüretral duktusları ve transizyonel zonu içerir. Transizyonel
zon, proksimal prostatik üretra etrafında yerleşir. Normal prostat hacminin en küçük kısmını oluşturur ve yaklaşık %5 civarındadır. Fakat BPH’de anterior fibromusküler
stroma ile beraber büyüyerek masif hale gelebilir. Transizyonel zon, BPH’de en çok tutulan bölgedir. PCa’ların yaklaşık %15-20’si transizyonel zondan gelişmektedir (1, 12).
B) Nonglandüler prostat dokusu: Prostat dokusunun 1/3’ünü oluşturur.
Proksimal (preprostatik) sfinkter: Proksimal üretra segmenti etrafında, düz kas
liflerinden oluşan, manşon tarzında yapıdır. Ejakülasyon sırasında proksimal segmentin kapanmasını sağlayarak, seminal sıvının geri akmasını önler. Ayrıca istirahat tonisitesi ile de proksimal üretral segmentin kapanmasını sağlar.
Çizgili kastan oluşan sfinkter: Verumontanum ve prostat apeksi arasında yerleşir,
prostat apeksinin altında eksternal üretral sfinkter ile devam eder.
Anterior fibromusküler stroma: Anteromedial yüzeyde bulunur. Mesane boynundan aşağıya doğru genişleyen doku prostat apeksinde daralarak üretra ile birleşir.
Prostat kapsülü: Fibromusküler stromanın periferde yoğunlaşmasından oluşur ve
prostatın eksternal yüzeyinin çoğunu çevreler. İçte düz kas tabakası ile dışta kollajen örtüden meydana gelir. Apeksde glandüler yapılar seyrekleşir ve kapsül; fibröz bağ dokusu, düz kas ve çizgili kas karışımından oluşur. Benzer şekilde tabanda prostat düz kası ile mesane boynunun kasları birleşir ve ayırım yapılmasızorlaşır. Prostat kapsülü iyi sınırlı bir anatomik yapı olmadığından, apeks ile tabanda kanserin ekstraprostatik uzanımının (EPU) saptanması mümkün değildir (1,12).
Prostat anatomisi çalışmalarında üretra referans noktasıdır. Prostatı baştanbaşa geçen prostatik üretra santralde 35°’lik bir kavis yapar. Verumontanum;
1. 3. Prostatın Histolojisi:
Mikroskobik olarak prostat, glandüler epitel ve fibromüsküler stromadan meydana gelir. Duktuslar ve asinüslar kompleks yapılanma gösterir. Duktuslar uzun dallanan tübüllerdir ve yuvarlak asinüslarla kör sonlanırlar. Bezlerde iç yüzey papiller çıkıntılanmalarla kıvrıntılıdır (18). Duktus komponenti de iki bölümde ele alınır (1).
1-) Majör (primer, eksretuar) 2-) Minör (sekonder, periferal)
Epitelyal hücreler hem duktus hem de asinüs yapılarında bulunur.
A) Epitelyal Hücreler: 4 temel hücre grubu bulunmaktadır:
Sekretuar Hücreler: Epitelyal hücrelerin en önemli bölümünü oluştururlar.
Granüler veya homojen sitoplazmadan zengin, sınırları belirsiz, uzun kolumnar şekilli, seminal sıvının üretildiği hücrelerdir. Prostatik asit fosfataz (PAF) ve PSA sentezlerler. Sekretuar hücreler farklı olarak, keratin ve vimentin ortak boyanması gösterirler. Sitokeratin (CK) 8 ve 18 immünopozitiftir. Bu hücreler androjen reseptörü (AR) içermektedir (19). Prostatik sekresyon nötral mukosubstantlardan oluşur. Prostat adenokarsinomlarında sekresyon nötral ve asidik olmak üzere miksttir (1). Sadece prostat asinüslerinde değil prostatik kanallar ve prostatik üretrada da saptanırlar. Bir kısmında lipofuksin pigmenti izlenebilir (18).
Bazal Hücreler: Bazal membran ile sekretuar hücreler arasında yer alırlar. Uzun
eksenleri bazal membrana paraleldir. Bunlar sitoplazmaları dar, iyi sınırlı küboidal veya kısa kolumnar hücrelerdir. İHK boyamalarda bazal hücre sitoplazmaları yüksek molekül ağırlıklı sitokeratin (HMWCK)’ler 34βE12 ve CK903 ile veya nükleusları bir tümör süpresör gen ürünü olan p63 ile boyanarak işaretlenebilir (18). Sekretuar hücrelerden farklı olarak PAF ve PSA ile boyanma göstermezler. Fokal olarak AR ile güçlü boyandıkları gösterilmiştir (1). Lokal düzenleyici maddelerin salgılanmasından sorumlu oldukları düşünülmektedir (20). Bazal hücreler; sekretuar,
skuamöz, değişici ve müsinöz epitele dönüşebilmektedir. Bu sebeple prostat bezi içindeki kök hücreler olabilecekleri düşünülmektedir (18).
Değişici Epitel: Ekstretuar kanallarda ve üretrada bulunur.
Nöroendokrin hücreler: Normalde prostat bezlerinde az sayıdadırlar. Duktus ve
asinüslarda gelişigüzel dağılmışlardır, özel boyama teknikleri kullanılmadan tanınmaları zordur. Görevleri tam olarak bilinmemekle birlikte parakrin rol oynadıkları düşünülür (18). Kromogranin A ve B, Sekretogranin II, somatostatin, kalsitonin ve bombesin sekrete ederler. Ayrıca bu hücreler PSA ortak boyanması gösterirler. Bu da bize tarif edilen hücrelerin sekretuar hücrelerden orijin aldığını düşündürmektedir. Fakat bu hücreler AR yönünden negatiftirler (1, 21).
Stroma: Fibröz ve musküler dokudan oluşur. Tüm prostat dokusunun %30-70’ini
oluşturur. Belirgin olduğu yer anterior kısmıdır. Kapsül, glanda sıkı yapışmıştır ve kollikulis seminalis düzeyinin altında, krista üretralis içinde lateral kitleleri birbirinden ayıran median bir septum ile devam eder. Musküler doku esas olarak düz kastan yapılmıştır.
Üretranın ventralinde bir düz miyosit tabakası fibromusküler septum içindeki esas kas kitlesiyle birleşmek üzere kıvrım yapmaktadır. Ek olarak, bu yapının anteriorunda hilal şeklinde bir çizgili kas transvers olarak, derin perineal poşta inferiora doğru üretral sfinkter ile devam etmektedir. Buradan çıkan lifler, kollajen liflerle lateralde kapsüle yapışır. Diğer kollajen lifler ise posteromediale doğru geçerek prostatik fibromusküler septumlar ve krista üretralisin septumuyla birleşmektedir. Pudendal sinir tarafından inerve edilen bu kasın, krista üretralisi geriye, prostatik sinüsleri de ileri doğru çekerek genişletilebileceği düşünülmektedir. Glandüler içerik de aynı zamanda üretraya atılabilir ve dolayısıyla ejakülasyon öncesi dönemde bu bölge, seminal sıvıyı (3-5ml) içerecek şekilde genişleyebilir. Prostatik stromal hücreler AR içerirler (1, 22, 23).
1. 4. Prostatın Fonksiyonu:
Prostat bezi sitrat iyonları, kalsiyum (Ca), fosfat iyonları, bir pıhtılaşma enzimi ve fibrinolizin içeren ince, süte benzer bir sıvı salgılar. Emisyon sırasında, prostat bezinin kapsülü, vas deferensle eşzamanlı olarak kasılır. Böylece ince, sütümsü prostat sıvısı, semen kitlesine eklenir. Prostat sıvısının hafif alkalik özelliği, ovumun başarılı bir şekilde fertilizasyonunda önemlidir. Çünkü vas deferens sıvısı spermin metabolik ürünleri ve sitrik asit varlığında asidik özelliktedir. Bu nedenle, spermin fertilite özelliği baskılanabilir. Ayrıca, kadının vajinal salgıları da asidiktir Sonuç olarak, prostat sıvısının, diğer ejakülat sıvılarının asiditesini nötralize ettiği ve böylece spermin hareket ve fertilizasyon yeteneğini arttırdığı düşünülmektedir (24).
1. 5. Prostatın Fizyolojisi:
Prostatın ekzokrin sekresyonu, seminal sıvının önemli bir komponentidir (24, 26). Prostatik sıvı akışı ejakulasyon yokken de devam eder veüretraya dökülerek idrara karışır (24, 26). Prostatik sekresyon kısmen apokrin özelliktedir. Salgıyı oluşturan komponentler arasında PAF ve sitrik asid bulunur. Fibrinolizin, fibrinojenaz, aminopeptidaz gibi bir miktar proteolitik enzim de saptanmıştır. Bu enzimler semenin likefaksiyonunu sağlar. Ek olarak prostaglandin F2α, prostat epitelinde üretilir. Prostatik sekresyon, sempatik ve parasempatik uyarı ile kontrol edilir (25). Parasempatik uyarı sekresyonu arttırır (26).
Prostatik sekresyon, Hematoksilen Eozin (HE) kesitlerinde normal glandların lümenlerinde, açık eozinofilik renkte görülür. Periyodik asit shift (PAS) pozitif diastaz rezistant olması nötral mukopolisakkarid içerdiğini gösterir (27). Prostat glandlarının lümenlerinde Korpora amilosea adı verilen, yuvarlak veya oval şekilli, laminer yoğunlaşmalar izlenir.Bu cisimciklerin sıklığı yaşla birlikte artar. Epitelyal hücre döküntüleri ve dejenerasyonları ile ilgili olduğu varsayılmaktadır (25, 27, 28).
1. 6. Prostat Büyümesinin Kontrolü:
Prostat büyümesinin kontrolü endokrin faktörler, nöroendokrin sinyaller, apokrin faktörler, otokrin faktörler, intrakrin faktörler, ekstrasellüler matriks faktörleri ve hücreden hücreye etkileşim ile olur (29).
Prostatın büyüme ve gelişmesini, sekretuar fonksiyonunu uyaran hormon ve büyüme faktörlerinin başında testosteron gelmektedir. Testoteron 19 karbonlu steroid yapıda bir hormondur. Çoğunlukla testislerde olmakla birlikte overler ve adrenal bezler tarafından da sentezi sağlanmaktadır. Testis kökenli testosteron normal erkeklerde serum adrojenlerinin hemen hemen tamamını oluşturur. Testislerdeki Leydig hücrelerinde pregnenolondan sentezlenir ve prostatta 5α-redüktaz enzimi ile daha aktif bir androjen olan DHT’ye dönüştürülür. Testosteron periferde aromataz enzimi ile östrojenlere çevrilebilir. Testosterondan DHT ve östrojen üretimi geri dönüşümsüzdür. Üretimi hipotalomo-hipofizer aks tarafından sağlanır. Üretiminde en etkili hormon lüteinizan hormon (LH)’dur. Hipotalamus lüteinizan hormon salgılayıcı hormon (LHRH) salgılayarak hipofiz bezini uyarır ve LH salgılamasını sağlar. LH testis dokusundaki Leydig hücrelerine direkt olarak etki yaparak vücudun majör androjeni olan testosteronun salınımını sağlanır (30).
Erkekteki östrojenin çoğu, androjenlerin aromatizasyon yoluyla periferik dokularda östrojenlere dönüştürülmesiyle elde edilir. Adrenal bezler de zayıf bir androjen olan androstenedionu üretir. Bu majör bir yolak değildir ve normal prostat dokusunun büyümesi için adrenal androjenler tek başına yeterli değildir (30).
1. 7. Prostatik Salgı Proteinleri:
Prostatik salgı proteinlerinin en önemlileri PSA (human kallikrein 3), human kallikrein 2, human kallikrein 11, prostaz, PAF, prostat spesifik protein, prostat spesifik transglutaminaz, prostat spesifik membran antijeni, semenogelin I ve II,
çözülmesidir ancak günümüzde bu pıhtılaşma ve çözülmenin üreme fizyolojisi için önemi tam olarak bilinmemektedir. PSA’ya dair çalışmaların çoğu, PSA’nın yüksek konsantrasyonda bulunduğu seminal sıvıdan elde edilen saflaştırılmış proteine dayanmaktadır. PSA prostat hastalıkları ve özellikle PCa tanı ve takibinde rutin olarak kullanılan bir belirteçtir (30).
1. 8. Prostat Kanseri:
1. 8. 1. İnsidans ve Epidemiyolojisi:
PCa, erkeklerde en sık görülen neoplazidir. Erkeklerdeki tüm kanserlerin %9,7’sini oluşturmaktadır. Çoğu gelişmiş ülkede en yaygın nonkutanöz malign neoplazidir. Dünyada görülen en yaygın altıncı kanserdir (10). Erkeklerde kanserden ölümlerin akciğer kanserinden sonra en sık görülen ikinci nedenidir. 1992’lerin ortalarından beri ölüm oranları düşmektedir ancak kardiovasküler hastalıklara bağlı ölümlerdeki azalmalar ve ortalama yaşam süresinin artması nedeniyle daha etkili koruma ve tedavi yöntemleri bulunana kadar PCa önemli bir sağlık sorunu olmayı sürdürecektir (31). Bütün kanserler arasında PCa yaşla birlikte en hızlı artış gösteren kanser türüdür. İnsidansları belli bir yaşta pik yapan çoğu kanserin aksine yaşın ilerlemesiyle PCa insidansı da artmaya devam eder (32).
İnsidans ve mortalite açısından coğrafi farklılıklar, PCa’da belirgindir. Uzakdoğu’da düşük, Kuzey Avrupa ve Kuzey Amerika’da yüksek oranda görülmektedir. Amerika Birleşik Devletleri (ABD)’inde yapılan araştırmalarda Afrikalı Amerikan erkeklerinde PCa insidansı beyazlara daha yüksektir ve tanı konulduğunda daha ileri evrededir. Bu hastalıktan ölüm oranının da Afrikalı Amerikan erkeklerinde daha yüksek olduğunu bildiren veriler vardır. Asya kökenli Amerikan erkeklerinde ise en az görülmektedir. Ülkemizdeki insidansı ile ilgili net veriler bulunmamaktadır (10).
Epidemiyolojik çalışmalar PCa insidansındaki farklılıkların beslenme farklılıklarına bağlı olabileceğini düşündürmüştür (22). İnsanların esas olarak yağdan fakir, bitkisel kökenli besinler tükettiği dünyanın bazı bölgelerinde klinik açıdan önemli PCa insidansının çok daha düşük olduğu gösterilmiştir. Ayrıca göçmenlerde
yapılan çalışmalar düşük riskli ülkelerden ABD’e gelen ve batı tarzı beslenenlerde PCa oranlarının birkaç kez artarak konaklanan ülkedekine yaklaştığını göstermiştir. Japonlarda ve Amerikan beyaz popülasyonunda, PCa’nın histolojik formunun yaşla uyumlu insidansı hemen hemen aynı iken, Amerika’ya göçen Japonlarda artmakta fakat Amerika’da doğanların oranına hiçbir zaman ulaşamamaktadır. Ayrıca Asya’daki diyet batılılaştıkça PCa insidansı bu bölgede artış göstermektedir. Toplam katı yağ, hayvansal yağ ve kırmızı et alımı artan bir PCa riskiyle ilişkilendirilmiştir.
1. 8. 2. Risk faktörleri:
Yaş: PCa gelişiminde en önemli risk faktörü yaştır. %95’i 45-89 yaş arasındadır.
Yeni tanı alan hastaların %75’inden fazlası 65 yaşın üstündedir (34). 85 yaşında, PCa riski tüm dünyada %0,5-20 arasındadır. Otopsi çalışmalarında; 30 yaşındaki erkeklerin % 30’u, 50 yaşındaki erkeklerin %50’si ve 85 yaş üstündeki erkeklerin büyük çoğunluğu histolojik (latent) PCa’ya sahiptir. 50 yaşından küçük erkeklerde PCa teşhisi ‰1’den azdır.Genç yaşlarda görüldüğünde daha hızlı progresyon izlenmektedir (34).
Coğrafi Özellikler: PCa insidansı etnik popülasyonlar ve ülkeler arasında farklılık
sergilemektedir. Asya’da, özellikle Çinlilerde ve Japonlarda düşük orandayken; Kuzey Amerika ve İskandinav ülkelerinde yüksek oranda görülmektedir (34,35).
Irk: Siyah ırkta görülme oranı beyazların yaklaşık bir buçuk katıdır. Siyah
erkeklerde hastalık daha geç evrede teşhis edilmekte ve sağ kalım oranları daha düşük görülmektedir. Tüm evreler için 5 yıllık sağ kalım oranı siyah erkekler için %62, beyaz erkekler için ise %72’dir. (35, 36).
Heredite ve Genetik: PCa’ların yaklaşık %85’inden sorumlu olan sporadik
PCa’ların, genellikle düşük penetransa sahip gen polimorfizmlerinden ve çevresel faktörlerden dolayı ortaya çıktıkları söylenmektedir. PCa’ların %10’unun kalıtımsal
ilişkilidir. Birinci derece akrabaların birinde mevcutsa 2 kat, iki-üçünde mevcutsa 5-11 kat risk artmaktadır. PCa tanısı konan aile bireylerinde hastalığın başlangıç yaşı 70 ise 4 kat, 60 ise 5 kat ve 50 ise 7 kat artar.
Hormonal Faktörler: PCa gelişiminde seks hormonları önemli role sahiptir. Genç
siyah ırk erkeklerde dolaşımdaki testosteron düzeyi beyaz ırk yaşıtlarına göre %15 daha yüksektir ve bu fark da siyah ırkta PCa’ya yakalanma riskinin daha yüksek olmasını açıklamaktadır (35). Testesteron 5-alfa redüktaz enzimi ile metabolik olarak daha aktif olan DHT’ye dönüşür. DHT ve testesteron AR’ye bağlanır. Oluşan reseptör/ligand kompleksi DNA’ya bağlanarak ve androjene yanıt veren, kontrollü hücre bölünmesini sağlayan transaktivasyon genlerine transloke olur. Bu sebeple medikal veya cerrahi yolla kastrasyon yapılması ile testosteron kesilmesi sonucu tümör dokusu geriler (30).
İnsülin benzeri büyüme faktörü (IGF-I): Tümör hücrelerinin proliferasyon,
diferansiyasyon ve apopitozunu regüle eder. PCa riski, yüksek konsantrasyonu ile doğru orantılıdır.
Diyet: Diyetle fazla yağ alınmasının PCa’ya yakalanma riskini arttırdığına dair
görüşler tartışmalıdır. Diyetle alınan yağın, seksüel hormonların üretimini değiştirerek PCa oluşma riskini arttırabileceği öne sürülmektedir. Bu teoride yalnızca diyet yağına değil A, D, E vitaminlerine ve çinko gibi eser elementlere de değinmektedir. Çeşitli çalışmalarda diyetle alınan yağ miktarı ile yüksek ve düşük risk bölgeleri arasındaki ilişki incelenmiş ve total yağ alımının PCa dan ölüm oranıyla korelasyon gösterdiği ve aradaki ilişkinin de meme karsinomu ile yağ alımı ilişkisine benzediği görülmüştür (35,38). Örneğin; Japonların geleneksel yiyeceklerinde yağ oranı düşüktür, Japon erkeklerinde PCa görülme sıklığı oldukça düşüktür. Beslenme alışkanlıkları batılılaşan Japon erkeklerinde hastalığa yakalanma oranını yükseltmektedir. ABD’ye yerleşen Japonlarda PCa insidansı, Japonya’da yaşayanlara göre daha yüksektir (35). Yine bazı çalışmalarda yüksek yağ tüketimiyle PCa arasında ilişki olduğu iddia edilirken (39), bazılarında ise bu ilişkiyi destekleyecek bulgu saptanamamıştır (40). Hayvansal ürünlerin özellikle kırmızı etin tüketimi ile arasında güçlü ilişki bulunmaktadır. Yüksek ısıda pişirme, heterosiklik aminler gibi çok güçlü karsinojenlerin oluşmasına neden olur. Yüksek miktarlarda
α-linolenik asit ve Ca alımının PCa ile ilişkili olduğu bulunmuştur.Günlük fazla Ca alan kişilerde ilerlemiş ve metastatik kanser riski daha yüksektir. Asya ülkelerinde PCa’nın az görülmesi, diyetle yüksek oranda fitoöstrojen alımıyla açıklanabilir. Soya yüksek oranda fitoöstrojen içerir ve PCa riskini azaltır. Domates içeren ürünlerin sık alımı da PCa riskini düşürür. Domates karotenoid ve antioksidan olan likopen içerir. Likopen, prostatın oksidatif hasarında bir azalma sağlar (35).
Vitamin D Alımı: PCa güneşin çok az göründüğü Kuzey ülkelerinde, ekvatora yakın
olan bölgelerle karşılaştırıldığında çok daha sık görülmektedir. PCa mortalite hızı ABD’de ultraviyole radyasyonla ters orantılıdır ki, bu da vitamin D’nin sentezi için gereklidir. Vitamin D’nin laboratuar koşullarında kültürdeki PCa hücrelerinin büyümesini yavaşlatıcı etkisi vardır (35).
Selenyum: Antioksidan etkisi, immün sistemi uyarması, apopitozu indüklemesi ve
testosteron oluşumunu inhibe etmesiyle tümör gelişimini önler.
α-metil-CoA rasemaz (AMACR) geni: Diyetle alınan dallanmış yağ asitlerinin
peroksizomal oksidasyonunda önemli görev alır. Peroksizomal oksidasyon, karsinojen oluşumundaki oksidatif hasarın kaynağı olan hidrojen peroksiti meydana getirir. Sığır eti ve süt ürünleri diyetle alınan dallanmış yağ asitlerinin esas kaynağı olduğundan; AMACR’nin artışı ve etkisinin güçlenmesi, süt ürünleri ve PCa arasında ilişkiyi açıklayabilir. AMACR geni, normal prostat dokusunda bulunmaz.
BPH: Yeni bilimsel kanıtlar BPH ve PCa’nın birbirlerinden bağımsız olgular
olduğunu ileri sürmektedir. Her iki hastalığın yaşlanma ile birlikte sıklığı da artmaktadır. Her iki hastalık için de benzer çevresel etkilere maruziyet söz konusudur (36). Albarran ve Dossot’un ilk gözlemleri ve daha sonraları Armenian ve ark.’nın çalışmaları PCa’nın BPH’lilerde daha sık olduğunu akla getirmektedir. Armenian ve ark.’nın geniş bir seri üzerinde yaptıkları çalışmada 5 yıl boyunca izlenen BPH’li 345 hastada PCa oranının yaşıt hastalara göre 3,7 kez daha sık olduğunu bildirmişlerdir.
hiperplazi (AAH) ve prostatik intraepitelyal neoplazi (PIN) gibi preneoplastik olduğu düşünülen lezyonların, BPH ile PCa arasında bir bağ olabileceğine dair görüşler de mevcuttur (41).
Enfeksiyöz Ajanlar: Cinsel yolla bulaşan gonore gibi hastalıklarla PCa arasındaki
iliski de spekülatiftir. PCa doku örneklerinde virüslere ve virüs partiküllerine rastlanmıştır. HSV Tip II, SV-40, CMV gibi virüslerin etken olabileceği öne sürülmüştür. Yapılan bir çalışmada da HSV Tip II antikoru, PCa hastalarında %71, BPH’li hastalarda ise %66 pozitif bulunmuştur. RNA viral partikülleri de invitro koşullarda prostat doku kültürlerinde tespit edilmiştir. RNA virüslerinin PCa’da onkogen p21 H-ras ürettikleri gözlenmiştir (42).
Kadmiyum Alımı: Kadmiyum sigara dumanında ve alkalin pillerde bulunan bir eser
elementtir. Kaynak ve elektro kaplama işlerinde çalışanlar bu elemente yüksek seviyelerde maruz kalma riski taşırlar. 1967’de Kipling ve Waterhouse, 1976’da Lemen ve 1990’da Elghany’nin yaptıkları çalışmalarda PCa ile kadmiyum alımı arasında zayıf bir ilişki bulunmuştur. Kadmiyumun çinko ile etkileşerek PCa riskini arttırabileceği düşünülmektedir. Çinko multiple intrasellüler metabolik yollarda görevli bir eser elementtir ve prostat bezi dokusunda yüksek miktarlarda bulunur (35, 42).
Sigara: Sigaranın birçok kanser ile ilişkisi olmasına rağmen PCa ile ilişkisi kesin
olarak ortaya konulamamıştır (42).
1. 8. 3. Semptomları:
PSA’nın yaygın olarak kullanılmadığı 1987 ve daha öncesi dönemlerde PCa daha çok metastatik evrelerde teşhis edilirken, günümüzde daha çok lokalize evrede yakalanmaktadır. Bu nedenle de semptomlarda ve hastalık sıklığında zaman içinde farklılıklar olmuştur. Eski zamanlara kıyasla, günümüzde daha çok asemptomik hastalarda teşhis edilmektedir. Yapılan bir çalışmada, 1991’den beri metastatik hastalık sıklığının beyaz erkeklerde %17,9 azaldığı gösterilmiştir (43). 50 yaşındaki bir erkeğin yaşam boyunca latent veya otopsi sonucunda PCa görülme oranı %40, klinik belirti veren PCa görülme riski %9,5 ve bu kanserden ölme riski ise %2,9
olarak saptanmıştır (44). Bu da PCa’ların büyük çoğunluğunun oldukça yavaş seyirli olduğunu göstermektedir. PCa erken dönemlerde genellikle asemptomatik seyreder. Çünkü çoğunlukla prostatın üretradan uzak olan periferik bölgelerinde ortaya çıkar ve semptomatik olabilmesi içinde belli bir büyüklüğe ulaşması gerekmektedir.
Mikroskopik kanserler otopsilerde veya BPH gibi sebeplerle çıkarılan prostat dokusunda tesadüfen saptanırlar. Yani PCa genellikle lokal ileri ya da metastatik evrelere ulaşan hastalarda semptomatik hale gelir. PCa’nın üretra içine ya da mesane boyuna doğru büyümesi, idrara başlamada güçlük, idrar akım hızında azalma, idrarda kesiklik, idrar retansiyonu gibi obstrüktif veya pollaküri, noktüri, ani sıkışma, sıkışma inkontinansı gibi irritatif üriner semptomlara yol açabilir. PCa teşhis edilen hastalarda obstrüktif semptom varlığının prognozu olumsuz etkilediği rapor edilmiştir (45). Üreter obstrüksiyonu PCa’da ileri evre göstergesidir (46).
PCa’nın ejakülatör kanallar içine doğru yayılması hematospermi ve ejakülat hacminde azalmaya yol açabilir. Hematüri PCa’da %15’den az oranda görülen, özgül olmayan bir semptomdur. Hematospermi de PCa’da sık görülmeyen bir semptomdur. Ancak yaşlı erkeklerde ayrıcı tanıda PCa’yı akla getirmelidir (47). PCa’nın daha da büyüyerek ereksiyondan sorumlu nörovasküler demetleri tutması erektil disfonksiyona da yol açabilir (48). Lokal ileri evre tümörlerde rektum invazyonu ve priapizm görülebilir (49). Rektum invazyonu neticesinde kabızlık, karın ağrısı, rektal kanama ve aralıklı ishal gibi semptomlar ortaya çıkabilir (37).
PCa metastazları en sık lenf düğümlerine ve başta vertebral kemikler olmak üzere; kostalar, kemik pelvis, femur ve omuz gibi aksiyel iskelet sistemine olur (50). Bu nedenle sıklıkla sırt ve kalça ağrıları ortaya çıkar (51). Nadiren femur, humerus ve vertebral kemiklerde gelişen patolojik kemik kırıklarına bağlı olarak olabilir. Bununla beraber hastaların üçte birinden fazlası, bilinen kemik metastazları olmasına rağmen asemptomatik kalabilmektedir (52). Ayrıca, ağrıların şiddetinin sağkalım ile prognostik olarak doğru orantılı olduğu da rapor edilmiştir (53).
edilmiştir (54). Hemen hepsi osteoblastik olmak üzere, iskelet sistemi metastazları sonucunda kemik ağrıları ve lökoeritroblastik/myelofitizik anemi ortaya çıkabilir (55). Vertebra metastazları sonucu oluşan spinal kord baskısı nedeniyle paresteziler, bulbokavernöz refleks artışı, alt ekstremitelerde güçsüzlük ve idrar ya da dışkı inkontinansı gibi semptomlar ortaya çıkabilir (44). Pelvik lenf düğümlerinin tutulması ya da iliak damar basısı nedeniyle alt ekstremitelerde ödem gelişebilir. Bazı hastalarda dissemine intravasküler koagülopati gelişebilir (56).
1. 8. 4. Tanısı:
PCa genel olarak 5 farklı klinik tablo ile saptanmaktadır:
1. Toplum taraması 2. Semptom vermesiyle
3. İnsidental (cTla veya Tlb),
4. Metastatik kanserli hastaların primerinin araştırılması sırasında 5. Latent ya da otopsi sonucu
PRM, TRUS ve serum PSA düzeyi, PCa’nın saptanması için etkili tanı üçlüsüdür. Klinik olarak alkalen fosfataz seviyesinde yükselme, direkt grafide kemiklerde osteoblastik lezyonlar ve kemik sintigrafisinde aktivite artışı daşüphe oluşturabilir. Kesin tanısı biyopsi ile konulur.
PRM’de endürasyon, nodüller, yüzey düzensizlikleri, prostatın normal şeklinde bozulma ve asimetri PCa ile ilgili değişikliklerdir. PRM’nin bazı posterior lokalizasyonlu PCa’larda sensivite ve spesifitesi düşüktür. Erken karsinomun, nodüler hiperplazi, granülomatöz prostatit, tüberküloz, infarkt veya prostat taşından ayırımı için patolojik doğrulama gerekmektedir (57).
TRUS, PCa tanısındadiagnostik kullanımdan ziyade biyopsi alımında yol göstericidir (9). TRUS, 5 mm’ye kadar olan hipoekoik prostat tümörlerini saptayabilmesine rağmen, prostatik tümörlerin %30’u izoekoiktir bu yöntemle görülemeyebilir (57). Kesin tanı için transperineal veya transrektal tru-cut iğneleriyle biyopsi almakgereklidir (9).
PSA PCa’nın tarama, tanı ve takibinde yaygın olarak kullanılan bir tümör belirtecidir (58). Hem normal hem de tümöral prostat epitelinden üretilmektedir. Prostatik asinüslerin içine yüksek konsantrasyonda salgılanır ve seminal sıvıya geçip, seminal sekresyonların akışkan durumda kalmasını sağlayarak, spermlerin hareket yeteneğini artırır. Serum seviyesi normalde 4,0 ng/ml’den düşüktür fakat hastanın yaşına, ırkına ve diğer faktörlere göre değişir. Prostatın normal yapısını bozan herhangi bir durum PSA’nın salınmasınasebep olur (11). PSA yüksekliği prostatit, infarkt, hiperplazi, iğne biyopsisi veya TUR-P gibi travmalarda da görülebilir fakat bu yükselmeler geçicidir ve tedavi ile ortadan kalkar. PCa hastalarının nerdeyse yarısında PSA 10 ng/ml’den daha yüksektir. En önemli yükseklik PCa’da görülür (11, 57). Kanserli prostat dokusu, normal prostat dokusuna göre yaklaşık 10 kat daha fazla PSA üretebilmektedir (57).
PSA’nın evre ile ilişkisi de bulunmakta ve RP spesmenlerinde kanserin prostata sınırlı olma olasılığı total prostata spesifik antijen (tPSA) seviyesi arttıkça azalmaktadır (59). PCa olasılığı sadece PSA’ya bakarak reddedilemez. Thompson ve ark. yayınladıkları çalışmada, tPSA seviyesi 4,0 ng/ml’nin altında olan 2950 hastanın 449’unda (%15,2) PCa teşhis etmişler ve bunların 67’sinin yüksek dereceli olduğunu bulmuşlardır (60). tPSA 0,5 ng/ml’nin altında iken dahi %6,6 PCa saptanmış ve daha da önemli olarak bunların %12,5’inin yüksek dereceli olduğu görülmüştür.. Anlaşılan odur ki tPSA için yüzde yüz güvenli bir alt sınır değeri saptamak mümkün değildir. PCa şüphesi bulunan hastalarda ilk biyopsiler negatif geldiğinde ve özellikle de tPSA seviyesinin zamanla yükseldiği durumlarda, tekrarlayan biyopsiler yapmak gerekebilir.
PAF, PCa’da ilk serum belirleyicisi olarak kullanıldı. PSA gibi PAF da prostatik duktus ve asinüsleri döşeyen epitelyal hücrelerde üretilir. BPH, prostatit, infarkt ve PCa’da seviyesi artar (2). PAF’ın klinik önemi metastatik hastaların tanı ve takibinde kullanılmasıdır fakat günümüzde sınırlı role sahiptir. PCa için tarama testi olarak sensitivitesi ve spesitivitesi oldukça düşüktür (2,61).
1. 8. 5. Tedavisi:
PCa cerrahi, radyoterapi ve hormonal terapi ile tedavi edilir. Hastaların %90’ından fazlası bu methotlardan biri ile iyileşir.Sonrasında beklenen yaşam süresi 15yıl olarak bildirilmektedir. Son yıllarda klinik olarak lokalize PCa’nın en yaygın uygulan tedavisi RP’dir. Cerrahi tekniğindeki gelişmeler, intraoperatif kan kaybı ve postoperatif impotans ve inkontinans riskini azaltarak bu yöntemin daha çok tercih edilmesini sağlamıştır. RP’den sonra prognoz; pT, cerrahi sınırların durumu ve Gleason derecesi ile ilişkilidir. Lokalize PCa’da uygulanan alternatif tedavi yöntemi eksternal veya interstisyel radyoterapi olup diğer ismi brakiterapi’dir (62).
1. 8. 6. Prostat Karsinomlarının Makroskopisi:
İğne Biyopsisi: Biyopsiler prostatın farklı alanlarından alındığında, bunlar
farklı şişeler içinde patolojiye gönderilmelidir ve biyopsiler ayrı ayrı bloklanmalıdır. Bu şekilde dokulardan birinde atipik bir odak saptandığında lokalizasyonunu tayin etme ve tekrar biyopsilerde bu alanı ve çevresini daha fazla örnekleme şansı elde edilir (63). Tümör lokalizasyonunu bilmek, tedaviyi şekillendirir; mesane boynu veya sinir koruyucu tedavi alternatifleri veya radyoterapi sahasının belirlenmesine yardımcı olur; görüntüleme methotları ile korelasyonu sağlar. Önerilen mikroskobik inceleme için dokulardan en az 2, tercihen 3 seviyede kesit hazırlanmasıdır. Bazı merkezlerde seviyeler arasındaki kesitler lam üzerine alınıp korunmakta, ileride gerekebilecek İHK çalışmalar için saklanmaktadır.
Transüretral Rezeksiyon (TUR-P): Örneklenen prostat dokularının tümörle
tutulum yüzdesi Tla-Tlb ayrımında önemlidir ve eşik değer %5 olarak kabul görmüştür. Zaman zaman TUR-P sonrası patoloji laboratuvarlarına büyük hacimlerde doku gelmektedir. Bunların ne kadarı örneklenmelidir? 6-8 kaset takibe alındığında Tlb tümörlerin %90’ı saptanmaktadır. 8-10 kasetle ise Tlb lezyonların tümü, Tla’ların ise >%90’ı yakalanır (64, 65). Buna göre kurumlar mikroskobik inceleme için uygun örnekleme miktarını belirleyebilirler. Bugün için 65 yaş altındaki erkeklerde tüm prostat TUR materyalinin incelenmesi, 65 yaş üzerindekilerde ise 10 kasetin takibe alınması birçok merkezce tercih edilen yoldur. Örnekler içinde tümör saptanması halinde kalan materyal de parafin takibe
gönderilmelidir. Karsinomda Gleason skorunun 7 veya daha yüksek olması durumunda spesmen tutulum yüzdesi %5’in altında bile olsa evre Tlb olarak belirlenir (66).
Radikal Prostatektomi: Spesmen taze iken tartılır ve 3 boyut verilerek
ölçülür. Seminal veziküller ve duktus deferensler için ayrıca boyut verilir. Spesmenin tüm dış yüzeyi çini mürekkebi ile boyanarak cerrahi sınırları işaretlenir. Sağ ve sol taraf için ayrı renkler kullanılır. Fiksasyon için 10 cc lik bir enjektörle 15- 20 ayrı alandan bez içine formalin enjekte edilir ve organ 5-10 katı hacimde %10’luk nötral tamponlu formalin içinde 24 saat bekletilir. Fiksasyon sonrasında apeks ve basali 4-5 mm kalınlıkta ampute edilir. Çıkan konizasyonlar sağ ve sol oryantasyonları kaybedilmeden vertikal parasagittal düzlemde 3-4 mm kalınlıkta tekrar dilimlenir. Kalan spesmen prostatın uzun eksenine dik olarak yatay düzlemde apeksten seminal veziküllerin ucuna dek 3-5 mm kalınlıkta dilinir. Dilimlerin kesit yüzü tümör için gözden geçirilir. RP’lerin %75-85’inde multiple tümör odağı bulunur. PCa’yı makroskopik olarak belirlemek zor veya bazı olgularda imkânsız olabilir. Tanınabilen tümörler genellikle 5 mm üzerinde sarı-beyaz solid sert odaklardır, bazı kanserler etraf normal süngerimsi prostat parankimi ile kontrast teşkil eden sarı granüler kitlelerdir. Tümörler asimetriye yol açabilir. Kanama ve nekroz nadirdir. Makroskopide tanınan tümörler tanınamayanlara kıyasla genellikle büyük, daha ileri evre ve derecededir. Anterior ve apikal tümörlerin nodüler hiperplazi ile iç içe bulunabilmelerinden dolayı tanınmaları özellikle zordur. Tü-berküloz, granülomatöz prostatit, akut ve kronik prostatit tümörle karışabilir. Spesmenlerin parsiyel veya komplet örneklenmesi için pek çok metot kullanılmaktadır. Örnekleme patolojik evrelemeyi etkiler (67,68). Haggman ve ark. tümü takibe alınan prostatlarda cerrahi sınır pozitifliğini %59, parsiyel incelenenlerde ise %12 bulmuşlardır (69). Klinik evre T2 karsinomlarda EPU varlığı ve derecesi alınan doku bloklarının sayısı ile doğru orantılıdır (70).
1. 8. 7. Prostat Tümörlerinin Sınıflandırılması: ( DSÖ 2004) (2) A) Epitelial Tümörler: Glandülar Neoplazmlar: - Asiner adenokarsinom • Atrofik • Psödohiperplastik • Köpüksü hücreli • Kolloid
• Taşlı yüzük hücreli • Onkositik
• Lenfoepitelioma benzeri
• Karsinosarkom, sarkomatoid karsinom - Prostatik intraepitelyal neoplazi (PIN)
• Prostatik intraepitelyal neoplazi, derece III (PIN III) - Duktal adenokarsinom • Kribriform • Papiller • Solid Ürotelyal tümörler: - Ürotelyal karsinoma Skuamöz tümörler: - Adenoskuamöz karsinom - Skuamöz hücreli karsinom
Bazal hücre tümörleri:
- Bazal hücre adenomu - Bazal hücreli karsinom
- Adenokarsinom içerisinde endokrin diferansiasyon
- Karsinoid tümör
- Küçük hücreli karsinom - Paraganglioma
- Nöroblastoma
B) Prostatik Stromal Tümörler:
- Malignite potansiyeli belli olmayan stromal tümör - Stromal Sarkom
C) Mezenkimal Tümörler:
- Leiomyosarkom - Rabdomyosarkom - Kondrosarkom
- Malign fibröz histiositom
- Malign periferik sinir kılıfı tümörleri - Hemangiom - Kondrom - Leiomyom - Granular hücreli tümör - Hemangioperisitom - Soliter fibröz tümör D) Hematolenfoid Tümörler: - Lenfoma - Lösemi E) Diğer Tümörler: - Kistadenoma - Nefroblastoma
• Embriyonel karsinom • Teratom
• Koryokarsinom
- Berrak hücreli adenokarsinom - Melanom
F) Metastatik Tümörler
1. 8. 8. Prostat Adenokarsinomu:
Prostat neoplazmlarının çoğu adenokarsinomdur, diğer histolojik tipler olguların %2’sinden azını oluşturmaktadır. Prostat adenokarsinomunda heterojenite ve multifokalite sıktır. PCa’ların çoğu periferal lobüllerdeki multipl odaklardan kaynaklanır. Neoplastik glandların bazal hücreleri yoktur ve tek hücre sıralanmasıgösterirler. Arkitektürel yapılardaki farklılıklara rağmen, PCa’daki hücreler birbirlerine benzerler. İyi korunmuş dokularda hücreler; monoton, orta derecede iyi sınırlı ve sitoplazmaları amfofilikden bazofiliğe kadar değişkenlik gösterir. Çekirdekleri yuvarlak, sadece konturlarında hafif düzensizlik vardır. Kromatin ince granüler ve dağınıktır. Çoğu hücrede nükleol büyüktür. Sitolojik anaplazi, kribriform patern oluşturan glandlarda kolaylıkla görülür.
Klasik asiner adenokarsinomda; dezmoplastik veya miksoid stromal yanıt yoktur. Stromal inflamatuar yanıt oluşturmaz. Bu yüzden PCa’da stromanın değerlendirilmesinin pek yararı yoktur. PCa değerlendirilmesinde lüminal içerik yardımcı olabilir. Çoğu PCa bir veya daha fazla patern sergileyen asinüslardan oluşur. Işık mikroskopisi genellikle tanı için yeterlidir, fakat iyi diferansiye prostat adenokarsinomlarında, neoplastik bezleri normalden ayırmak güç olabilir. Bu olgularda İHK boyama gerekebilir. Kanserin histopatolojik olarak tanınması yapısal, sitolojik ve intralüminal özelliklerin toplamına dayanır (71).
Majör Bulgular:
• İnfiltratif büyüme paterni • Ekstraprostatik bölgede bez izlenmesi.
• Komşu normal bezlerden farklı özellikler taşıyan iri veya küçük bez grupları
• Bezde yan yana bir kaç hücrede iri nükleol ( >1,6 pm) • Kromatin granülaritesinde artmayla birlikte nükleer irileşme
• Hafif nükleer pleomorfizm ve bez içindeki nükleusların anormal dağılımı
• Bazal hücre yokluğu • Fibrokollajen nodüller • Perinöral invazyon • Glomerülasyonlar
Perinöral invazyona karar verirken benign prostatik bezlerin sinirlerle yakın anatomik komşulukta olabilecekleri ve sinirlerde buna bağlı indentasyon görülebileceği akılda tutulmalıdır. Benign bezler sadece bir kenarında yer alır, siniri çepeçevre sarmazlar.
Fibrokollajen nodüller fibroblastlarla birlikte ince gevşek bir fibröz dokudur. İntralüminal müsinin organizasyonunu temsil ettiği düşünülmektedir. BPH veya PIN’da görülmez. Prostat adenokarsinomlarının %13’ünde izlenir (72).
Yardımcı Bulgular:
• Mavi müsin
• Pembe amorf salgı • Kristaloidler
A) Yapısal Özellikler:
Küçük veya orta büyütmede değerlendirilir. Karsinom nodüllerinde bezler normalden daha kalabalıktır, infiltratif gelişigüzel dağılım gösterir ve birbirlerine dik açılarla yer alırlar Aralarında düzensiz stromal düz kas hücre grupları bulunur. Karakteristik özellik atipik küçük bezlerin daha büyük benign bezler arasında saptanmasıdır. Farklılaşma azaldıkça bezler birbirleriyle birleşir, kribriform yapılar, abortif lümenler ortaya çıkar. Andiferansiye tümörlerde hücreler solid tabakalar, kordonlar oluşturur veya stroma içinde tek tek yer alırlar. Bu yapısal özellikler Gleason dereceleme sisteminin temelidir.
B) Sitolojik Özellikler:
Nükleer Özellikler: Nükleer irileşme ve belirgin nükleol sık rastlanılan bulgudur, ancak her kanserde izlenmeyebilir. Bazen neoplastik nükleuslar büyük ve hiperkromatiktir, nükleol görülmeyebilir. Şiddetli nükleer pleomorfizm az diferansiye tümörlerde bile önde gelen bir özellik değildir. Mitoz sayısı, yüksek dereceli tümörlerde daha fazladır.
Sitoplazmik Özellikler: Neoplastik bezin lüminal yüzü karakteristik olarak düzgün ve keskindir, bezler normalde izlenen kıvrıntılanmalarını yitirirler. Amfofilik boyanan koyu sitoplazma kanser tanısında yardımcıdır. Düşük dereceli kanserlerde sitoplazma benign bezleri taklit eder nitelikte şeffaf ve soluktur. İnvaziv karsinomda intrasitoplazmik lipofuksin pigmenti beklenmez (73).
C) İntralüminal Özellikler:
Kristalloidler: Düşük dereceli kanserlerde sıktır. Bunlar değişik geometrik
şekillerde ortaya çıkan koyu eozinofilik kristal benzeri yapılardır. Karsinom için diagnostik değillerdir, ancak benign dokudan daha sık kanserde izlenirler. Lümen içinde pembe aselüler koyu salgı ve mavi müsin de patognomonik olmayan, ancak kanseri telkin eden diğer bulgulardır.
Lüminal asidik sülfatlı ve sülfatsız müsin: Alcian Blue ile boyanır. Normal
prostat müsini nötraldir ve PAS ile reaksiyon verir. Asidik müsin karsinom için spesifik değildir, zaman zaman adenozis, sklerozan adenozis, PIN ve BPH’de görülebilmektedir.
Korpora amilasea: Düzgün kontürlü yuvarlak ve oval konsantrik lameller
yapılar ise benign bezlerde sıktır, PCa’da çok nadir saptanmaktadır.
D) Stromal Özellikler:
Konvansiyonel PCA’larda stromada dezmoplazi veya mikzoid reaksiyon, inflamatuar yanıt beklenmez.
1. 8. 9. Prostat Adenokarsinomunun Histolojik Varyantları:
Biyopsilerde izlenen PCa’larının %99’u klasik tiptir, ayrıca "konvansiyonel", "asiner" veya "mikroasiner" şeklinde spesifiye etmeye gerek yoktur. Varyantlar nadirdir. Diğer organlardan kaynaklanabilecek tümör ve metastazlar ayırıcı tanıda düşünülmelidir. Varyantlarda prognoz klasik tip prostat adenokarsinomundan farklı olabilir. Bu tümörler genellikle konvansiyonel asiner karsinomla birlikte izlenirler, dolayısı ile tanıda önemli bir problem teşkil etmezler (73).
Atrofik Varyant: Çoğu prostat karsinomunda sitoplazma geniştir. Atrofik varyantta
ise neoplastik bezlerde hücre sitoplazmaları dardır, dolayısı ile mikroskopik görünüm benign atrofi ile ayırıcı tanıyı gerektirebilir. Genellikle de novo izlenirler, ancak klasik prostat asiner karsinomlarında da tedavi sonrası atrofik sitoplazma görülebilir.
Psödohiperplastik Varyant: Neoplastik bezler büyüktür, dallanma ve papiller
girintilerime sergiler, benign prostat bezlerini anımsatırlar. Nükleer atipi kanser tanısında yardımcıdır. Gerekli olduğunda İHK ile bazal hücrelerin bulunmadığı
Nükleuslar küçük ve hiperkromatiktir. İri nükleus ve belirgin nükleolün çoğunlukla izlenmeyişi tanıyı güçleştirir. Kalabalık ve infiltratif patern tanıya yardımcıdır. Çoğunlukla klasik tip asiner karsinomla birliktedir ve assosiye konvansiyonel karsinom köpüksü neoplastik hücrelerdeki benign görünümlü sitolojiye rağmen genellikle düşük dereceli değildir.
Kolloid (Müsinöz) Varyant: Diğer organlarda olduğu gibi prostatta da müsinöz
karsinom teşhisi için tümörün %25’inden fazlasında ekstrasellüler müsin bulunmalıdır. Kolloid karsinom en nadir prostat karsinom varyantlarındandır. Saptandığında prostatik orijin İHK yöntemleri ve klinik bulgularla desteklenmelidir. Diğer organ müsinöz karsinomlarından farklı olarak intrasitoplazmik müsin içeren taşlı yüzük hücreleri nadirdir. Ekstraglandüler müsin ve müsin gölcükleri izlenir, irregüler kribriform bezler müsinöz matriks içinde yüzer. Müsinöz prostat karsinomları agresif biyolojik davranım sergiler. Klasik tipe oranla daha az hormon sensitiftir, ancak bazıları androjen baskılama tedavisine yanıt verebilir. Gleason 4+4=8 şeklinde skorlanmalıdır. Nadiren ekstrasellüler müsin içinde tek tek iyi oluş-muş yuvarlak bezler gözlenir. Bu tip vakalarda ise skorlama tartışmalıdır, 3+3=6’yı tercih edenler vardır.
Taşlı Yüzük Hücreli Karsinom: Karsinom hücrelerinde taşlı yüzük hücrelerini
anımsatır nitelikte intrasitoplazmik vakuoller vardır. Ancak vakuoller genellikle müsin içermez. Tümör hücreleri PSA ve PSAP eksprese eder. Pür form çok nadirdir ve kötü prognoza sahiptir.
Onkositik Varyant: Nadirdir. Tümör hücre sitoplazmaları çok sayıda mitokondriye
bağlı olarak geniş eozinofilik granülerdir. Nükleuslar yuvarlak veya oval hiperkromatiktir. Hücreler PSA pozitiftir.
Lenfoepitelyoma Benzeri Varyant: Çok az sayıda vaka bildirilmiştir, prognostik
önemi bilinmemektedir. Bez formasyonu yerine neoplastik hücreler sinsityal paternde yer alırlar. İHK boyamalarda PSA eksprese ettikleri görülür. Tümöre yoğun lenfositik infiltrasyon eşlik eder. Epstein Barr virusu gösterilememiştir. Birlikteliğinde konvansiyonel tipte asiner prostat adenokarsinomu bulunabilir.
Sarkomatoid Varyant (Karsinosarkom): Nadir bir varyanttır. De novo olabilir
veya hormon ve/veya radyoterapi almış adenokarsinom zemininde gelişebilir. Malign epitelyal ve iğsi hücreli komponentlerden oluşur. Epitelyal komponent değişik Gleason paternler sergiler, PSA pozitiftir. Sarkomatöz komponent genellikle nonspesifik iğsi hücre proliferasyonundan oluşur, ancak kondrosarkom, osteosarkom, leiomyosarkom, rabdomyosarkom, anjiosarkom, liposarkom ve bunların farklı patemlerde kombinasyonları ile heterelog farklılaşma izlenebilir. İğsi hücrelerde CK ekspresyonu değişkendir, negatif veya fokal pozitif olabilir. Çoğu olguda serum PSA düşüktür. Hastalıkta prognoz kötüdür, beş yıllık yaşam %40’ın altındadır.
Fokal Nöroendokrin Farklılaşma: Klasik tip PCa’da %50-100 olguda ışık
mikroskopta belirlenemeyebilen, buna karşın çok sayıda nöroendokrin belirleyicilerle yapılacak immnunohistokimyasal çalışmalarla ortaya konabilecek nöroendokrin farklılaşma izlenir. Bu hücreler çoğu kez serotonin, zaman zaman kalsitonin veya somatostatin içerir. Ancak ektopik hormon üretimi büyük kısmında olmaz. Nöroendokrin farklılaşmanın tedavi almamış primer PCa’da prognostik önemi bugün için tartışmalıdır. Bazı çalışmalarda bağımsız bir olumsuz prognoz göstergesi olarak belirirken (74, 75), bazılarında anlamsız bulunmuştur (8, 62). Buna karşın ileri evre ve androjen-bağımsız kanserde kötü prognoz göstergesidir (76, 77).
1. 8. 10. Prostat Adenokarsinomlarında İmmünoprofil:
PSA: Prostatik diferansiasyon işaretleyicisidir. Benign bez sekretuar
hücrelerinde pozitiftir; bazal hücreler, ürotelyum, ejakulatuar duktus ve seminal vezikül negatiftir. Çoğu prostat adenokarsinomu PSA eksprese eder. Dolayısı ile dışardan gelerek prostatı invaze eden tümörlerde ve metastatik odaklarda prostatik orijinin saptanmasında faydalıdır. Yüksek dereceli PCa’nın ürotelyal karsinomdan, kolon kanserinden, granülomatöz prostatit ve lenfomadan ayrımında yardımcıdır. PSA ekspresyonu artan tümör derecesi ile azalır. Androjen baskılaması ve radyoterapi ardından PSA pozitifliği kaybolabilir.
Bazal Hücre Belirteçleri (CK 903, 34βE12, CK 5/6): Işık mikroskopiye
yardımcı olarak bazal hücreleri değerlendirmek için kullanılır. Prostat bezlerinde sadece bazal hücreler HMWCK eksprese eder (78). HMWCK için en sık kullanılan klon monoklonal 34βE12’dir. İnvaziv adenokarsinomlarda bazal hücre tabakasının üniform yokluğu taklitçi benign lezyonlardan ayrılmasında önemli bir tanısal özelliktir. Ancak sonuçların yorumlanmasında karsinomun diğer lezyonlardan ayrımı negatif boyanmaya dayandığından dikkatli olunmalıdır. Fiksasyon, optimal olmayan doku prezervasyonu, öncü enzimatik işlemlerin atlanması, pozitif reaksiyonu engelleyebilir. Atrofik ve inflame asinüslarda, adenoziste ve PIN’da boyanma segmental ve bazı bezlerde negatif olabilir. Ayrıca mikroinvaziv karsinomlarda ve invaziv karsinomun intraduktal yayılımında rezidüel bazal hücrelerin bulunabileceği hatırlanmalıdır.
P63: p53’e benzeyen, büyüme ve gelişmeyi kontrol eden nükleer bir
proteindir. Prostatik adenokarsinom teşhisinde HMWCK’ye benzer kullanımı vardır (79).
AMACR: Yakın zamanlarda tanımlanan Alfa-metil Açil-Coenzim A
Rasemaz ya da kısaca rasemaza karşı geliştirilmiş antikor (P504S) %80’den fazla olguda PCa bezlerini boyar. Ancak sadece karsinom için spesifik değildir, atrofik bezler, nodüler hiperplazi, adenozis ve PIN’da ve yanısıra kolon tümörleri ve ürotelyal karsinomlarda pozitif olabilmektedir. Ayrıca PCa’nın köpüksü hücre alt tipi, psödohiperplastik ve atrofik varyantları ve tedavi edilmiş kanser düşük ekspresyon sergilemektedir.
İHK bazı durumlarda çok yararlı olmakla birlikte HE bulgularından bağımsız olarak tanı koydurucu değildir. Gerek BHB, gerek rasemaz ile olsun genel prensip, İHK sonuçlarının dikkatle ve HE düzeyindeki değişiklikler ile birlikte yorumlanmasıdır. Örneğin küçük bir odakta az sayıdaki bezlerde BHB ile negatif sonuç alınsa bile, eğer bu odakta HE kesitlerinde karsinom çok kuvvetle düşünülmüyorsa, sadece İHK bulgularına dayanarak karsinom tanısı verilmemelidir. Böyle olgular ‘Atipik küçük asiner proliferasyon (ASAP)’ olarak raporlanmalı ve tekrar biyopsi gündeme gelmelidir. Bu durumlarda rasemaz kullanılması yararlı
olabilir. Zhou ve ark., HE ve bazal hücre belirteçleri (BHB) ile atipik tanısından öteye gidilemeyen olguların yaklaşık üçte birinde, rasemaz ile kesin karsinom tanısına ulaşmışlardır (60).
1. 8. 11. Duktal Tip Adenokarsinom:
Prostat adenokarsinomlarının %0,4-0,8’i prostatik duktuslardan gelişir (80). Bu tümörler geniş periüretral duktuslardan köken aldıklarında en sık verumontanum ve çevresinde izlenirler. Üretrada lümene doğru ekzofitik lezyon oluşturabilir ve obstrüktif semptomlara yol açabilirler. PRM’de saptanamayabilirler. Diğer duktal adenokarsinomlar ise prostatın periferinde yerleşir ve asiner tip prostat karsinomuyla bir arada mikst formda izlenir. Santralde yerleşmiş olanlara da periferal asiner adenokarsinomlar eşlik edebilir.
Duktal adenokarsinomlar genellikle papiller veya kribriform yapılardan oluşurlar, daha nadiren yüksek psödostratifiye kolumnar hücrelerle döşeli tek tek bezler izlenir. Sitoplazma çoğunlukla amfofilik, zaman zaman şeffaftır. Tümör hücreleri PSA ve PSAP eksprese eder. Çoğu olgu ileri evrede yakalanır ve agresif klinik seyir izler. Davranımı Gleason 4+4=8 asiner kansere benzer, bu nedenle Gleason skor 4+4=8 şeklinde derecelendirilmelidir (80).
1. 8. 12. Küçük Hücreli Karsinom:
Kendine özgü histolojik, İHK boyaması ve klinik özellikleri vardır, akciğerin küçük hücreli karsinomuna benzer. PSA ve PSAP negatiftir. Özellikleri Gleason patern 5 prostatik asiner karsinomdan farklıdır, bu nedenle küçük hücreli karsinomlarda Gleason sistemi kullanılmamalıdır. %50 olguda küçük hücreli karsinom klasik tip prostat adenokarsinomu ile birliktedir. Prognozu son derece kötüdür. Ortalama yaşam 2 yılın altındadır. Cushing, uygunsuz ADH salınımı gibi paraneoplastik sendromlar ortaya çıkabilmektedir (73)
1. 8. 13. Skuamöz Karsinom:
Prostat karsinomlarının %0,6’dan azı skuamöz morfolojidedir, adenoskuamöz karsinom daha da nadirdir. Skuamöz karsinomlar periüretral prostat asinüslerinden, adenoskuamöz karsinom ise daha ziyade transizyonel zondan köken alır. Üriner obstrüksiyon en sık başvuru şeklidir. Konvansiyonel adenokarsinomlardan hormon ve/veya radyoterapi sonrası gelişebilmektedirler. Skuamöz karsinomda pür skuamöz komponent varken adenoskuamöz karsinom sku-amöz ve glandüler komponentten oluşur. Skusku-amöz komponent genellikle PSA ve PSAP negatif, HMWCK pozitiftir.
Hem skuamöz, hem de adenoskuamöz karsinomda prognoz oldukça kötüdür. Skuamöz tümörler androjen baskılama tedavisine dirençlidir, adenoskuamöz tipte olanlarda hormon tedavisine ilk aşamada yanıt alınabilir (73).
1. 8. 14. Adenoid Kistik/Bazal Hücreli Karsinom
Prostat bazal hücrelerinden gelişir. Genellikle üriner obstrüksiyon ile gelen yaşlı hastalardır. Periferal palizatlanma gösterebilen bazaloid oval veya yuvarlak hücre yuvalarından meydana gelir. Sıklıkla kribriform patern sergilerler, eozinofilik bazal membran benzeri materyal izlenebilir. Neoplastik hücreler keratin 34βE12, BcI-2 ve %50 S-100 eksprese eder. İnfiltratif patern, EPU, perinöral invazyon, nekroz ve stromal dezmoplazi ile BPH’den ayrılır. Nadir, lokal agresif tümörlerdir. Uzak metastaz bildirilmiştir (73).
1. 8. 15. Ürotelyal Karsinom:
Primer prostatik ürotelyal karsinomlar prostatik üretra veya proksimal prostatik duktuslardan gelişirler. Sekonder tutulum ise mesane karsinomlarının üretra yolu ile prostata ilerlemesi ya da daha nadiren prostata direk invazyonu ile gerçekleşir. Primer ürotelyal karsinomların sıklığı tüm prostat tümörleri arasında %0,7-2,8’dir. Hastalar çoğu kez lokal ileri evrede üriner obstrüksiyon ve hematüri ile gelir. Tanı için mesane kanserinin sekonder prostat tutulumu ekarte edilmelidir. Ürotelyal neoplazilerin tüm histolojik tip ve dereceleri görülebilir, ancak çoğu
yüksek derecelidir ve in-situ komponentle birliktedir. Tümör hücreleri PSA ve PSAP negatif, çoğu kez CK7 ve 20, %50 olguda HMWCK ve p63 pozitiftir. Prostatik stroma invazyonu olduğunda prognoz olumsuzdur, anti-androjen tedaviye dirençli tümörlerdir (73).
1. 8. 16. Prostat Adenokarsinomu İle Karışabilen Lezyonlar:
Prostat adenokarsinomu ile karışabilen lezyonlar içinde en sık karşılaşılan glandüler atrofidir (61). Atrofik glandlar, çoğunlukla lobüler yapıda olduklarından, düşük büyütmelerde tanınmaları daha kolaydır. Büyük büyütmelerde sitolojik detay ön plana çıktığından ayırım zorlaşır. Tanıda zorluk daha çok lobüler yapının kaybolduğu ve hücresel atipinin eklendiği durumlarda yaşanır (81). Bu bezlerde normalde olduğu gibi lümene doğru girintili çıkıntılı bir epitel yüzeyi izlenmez. Sitoplazma hemen hücre çekirdeği yüksekliği seviyesinde olduğundan epitel hücre çekirdeklerinin boyanma özelliği dolayısı ile atrofik bezler hiperkromatik görülür. Karsinom atrofi ayırımında zorlanıldığı durumlarda İHK kullanımı yararlı olacaktır. Ancak bu durumlarda İHK sonuçları dikkatle yorumlanmalıdır. Çoğu zaman atrofi odağında BHB ile hiç değilse kısmen pozitif boyanma izlenecektir. Ancak, küçük bir odakta bazal hücre boyanması rastlantısal olarak görülmemiş olabilir. Dolayısı ile çok küçük odaklarda HE düzeyindeki bulgular kanser dışında açıklanmadıkça, BHB ile negatif İHK kanser tanısı için yeterli değildir. Atrofik bezlerin yanlış negatif tanıya neden olacağı durum ise atrofik karsinomdur. Atrofik karsinom tanısı için infiltratif patern, sitolojik atipi ve negatif İHK şarttır (82).
Diğer benign lezyonlar arasında yapısal olarak birbirine yakın kümeleşme gösteren benign prostat bezleri, seminal vezikül veya ejekülat kanalı dokusu, bazal hücre hiperplazisi, Cowper bezleri, radyasyon atipisi ve verumontanum bezleri hiperplazisi yer almaktadır. Bu lezyonların ortak yanı, histolojik olarak Gleason skor 6 PCa ile benzer yapısal özellikler göstermesidir. Bazen, sitolojik atipi yapısal değişikliklere eşlik edebilir. Örneğin, seminal vezikül dokusu belirgin hücresel