T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
PLASTİK, REKONSTRÜKTİF ve ESTETİK CERRAHİ ANABİLİM DALI BAŞKANLIĞI
RAT İNFERİOR EPİGASTRİK ADA FLEBİNDE
PROPOFOL KULLANIMININ
İSKEMİ REPERFÜZYON HASARI ÜZERİNE
ETKİLERİNİN ARAŞTIRILMASI
DR. TUNCAY EROĞLU TIPTA UZMANLIK TEZİ
T.C
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
PLASTİK REKONSTRÜKTİF VE ESTETİK CERRAHİ ANABİLİMDALI
RAT İNFERİOR EPİGASTRİK ADA FLEBİNDE
PROPOFOL KULLANIMININ
İSKEMİ REPERFÜZYON HASARI ÜZERİNE
ETKİLERİNİN ARAŞTIRILMASI
TIPTA UZMANLIK TEZİ DR.TUNCAY EROĞLU
DANIŞMAN
ÖNSÖZ
“Rat inferior epigastrik ada flebinde propofol kullanımının İskemi Reperfüzyon Hasarı Üzerine Etkilerinin Araştırılması” adlı uzmanlık tezi Dicle Üniversitesi Tıp Fakültesi, Plastik Rekonstrüktif ve Estetik Cerrahi Anabilim Dalı Başkanlığının 31 Mayıs 2010 tarih ve 2010/10 sayı ile etik kurul onayı alınıp çalışmaya başlanmıştır.
Post-iskemik hasar iki basamakta oluşmaktadır; kan akımının ve ATP’nin azaldığı iskemik dönem ve iskemiyi takip eden reperfüzyon dönemi. Yapılan çalışmalar iskemik hasarın önemli bir kısmının oksijen metabolitlerince reperfüzyon safhasında oluştuğunu göstermiştir. Günümüzde serbest oksijen radikalleri aracılığı ile olan hasara ilgi artmıştır. Serbest oksijen radikallerinin zararlı etkilerine karşı organizmada koruyucu enzimatik mekanizmalar vardır. SOD, Katalaz, GPX gibi endojen antioksidan özelliği olan bu enzimler radikal temizleyici özellikleriyle koruyucu etki gösterirler. Bu enzimlerin seviyelerinin ölçümü serbest radikal aracılı hasar konusunda indirekt bilgi verir. Bu çalışmada, aksiyel paternli cilt fleplerinde gelişen iskemi-reperfüzyon hasarı sonrası, propofol kullanımı sonucu ortaya çıkan değişiklikler araştırılacaktır. Literatürdeki çalışmalar incelendiğinde iskemi-reperefüzyon hasarını azaltmak amacıyla birçok ajan ve fiziksel yöntem kullanılmasına rağmen, anestezik tekniklerle ilgili yapılan çalışmaların çok az olduğu ve özellikle mikrocerrahi ve rekonstrüktif prosedürler amacıyla kullanılan bu yöntemlerle ilgili ayrıntılı çalışmalara ihtiyaç duyulduğu gözlendi.
Yapılacak bu çalışmanın, herhangi bir nedenle fasyokütan fleplerde oluşan iskemi ve reperfüzyon hasarını azaltmaya alternatif bir tedavi yöntemi olarak yer alacağı düşünülmektedir.
Uzmanlık eğitimim boyunca ve bu çalışmanın gerçekleştirilmesinde destek ve yardımlarını gördüğüm, Anabilim Dalı Başkanımız Doç.Dr. Mehmet Bozkurt’a, hocamız Yrd. Doç.Dr. C.Tayyar Selçuk’a biyokimyasal analizleri gerçekleştiren Prof. Dr. Fatma Birgül Işık’a, elde edilen bulguların yorumlanmasında ve istatiksel değerlendirmelerde yardımlarını esirgemeyen Prof Dr.Ömer Satıcı’ya, histopatolojik preparatların değerlendirilmesini ve incelenmesini üstlenen Yrd. Doç. Dr. Uğur Fırat’a, tüm asistan arkadaşlarıma, bugünlere gelmemde en fazla emeği olan sevgili anneme ve babama, kardeşlerime, her an ve her konuda yanımda olan sevgili eşim Ruken, oğlum Güney ve kızım Beril’e sonsuz sevgi, saygı ve teşekkürlerimi sunuyorum.
ÖZET
Giriş ve Amaç: Flep uygulamaları sonrasında en sık görülen dolaşım
problemleri, vasküler yetmezlik problemleridir. Vasküler yetmezliğe uğrayan dokuda iskemi gelişmeye başlar. İskeminin süresiyle ilişkili olarak dolaşım normale dönmesiyle, reperfüzyon başlar ve bununla birlikte iskemi-reperfüzyon hasarı tablosu ortaya çıkar. Bu deneysel çalışmanın amacı genel anestezi sırasında kullanılan propofolün cilt fleplerinde iskemi-reperfüzyon hasarı üzerindeki etkilerini göstermektir.
Materyal ve Metod: Çalışmada, ağırlıkları 250–300 gr. arasında değisen 30
adet, Sprague-Dawley albino erkek sıçan dâhil edildi. Denekler 3 gruba ayrıldı. 3 x 6 cm boyutlarında inferior epigastrik arter tabanlı ada flebi tüm deneklerde kaldırıldı. sham (I) grubuna flep kaldırılmasını takiben iskemi-reperfüzyon uygulanmadı. Kontrol (II) ve propofol (III) grubunda flep elevasyonundan sonra inferior epigastrik artere klemp yardımı ile 2 saat iskemi sonrasında 2 saat reperfüzyon uygulandı. II. gruba 1cc izotonik, III. gruba 5 mg/kg dozunda %1 propofol kuyruk veni kateterizasyonu ile i.v olarak uygulandı. Tüm grupların cerrahi işlem öncesi ve 2 saatlik reperfüzyon sonrası kalp atım sayısı, sistolik arter basıncı ve parsiyel oksijen basınçları ölçüldü. 7. gün tüm grupların flep yaşıyabilirliği hesaplandı. 14. gün tüm denekler sakrafiye edilerek alınan doku örnekleri histopatolojik değerlendirme ve biyokimyasal değerlendirmeye alındı. Biyokimyasal olarak MDA(malondialdehit), SOD (superoksit dismutaz), KAT (katalaz), TAK(total antioksidan kapasite), TOS(total oksidatif stres), PON(paraoksanaz) değerlerine bakıldı. Histopatolojik olarak ödem, inflamasyon, epitel, vaskülarizasyon ve fibrozis değerlendirildi
Bulgular: Flep yaşayabilirliğinde propofol grubu, kontrol grubu arasındaki
fark istatistiksel olarak anlamlı görüldü (p<0,0001) Hemodinamik parametreler karşılaştırıldığında kalp atım sayısı arasında bir fark görülmemekle beraber sistolik arter basıncı ve parsiyel oksijen basınçlarındaki fark anlamlı görüldü.
(p<0,0001) Biyokimyasal parametrelerden MDA (p=0,016) , TOS (p=0,000) değerleri anlamlı derece düşük SOD (p=0,000), TAK (p=0,000), KAT (p=0,03) anlamlı derecede yüksek bulundu. PON (p=0,862) değerinde fark görülmedi. Patolojik değerlendirmede İ/R+propofol grubunda, İ/R+izotonik grubuna göre inflamasyon, ödem ve fibrozis bulgularının anlamlı derecede azaldığı ve epitel rejenerasyonunun arttığı görüldü.
Sonuçlar: Sonuç olarak, propofolün uygun dozlarda uygulanması aksiyel
paternli cilt fleplerinde, iskemi-reperfüzyon hasarına karşı koruyucu etkinlik göstermiştir; bu nedenle bu ilaç iskemi-reperfüzyon riski olan ameliyatlarda tercih nedeni olabilir.
ABSTRACT
Background: Vascular insufficiency is the most frequently seen circulation
problem following flap surgery procedures. İschemia begins to develop in tissue which is exposed to vascular insufficiency. Reperfusion begins after circulation returns to normal level as related to the duration of ischemia. At the same time ischemia-reperfusion injury occurs. The purpose of the this experimental study is to demonstrate the effects of propofol on skin flap ischemia-reperfusion injury during general anaesthesia.
Material and Method: Thirty Sprague-Dawley male rats weighted between
250-300 gr are included in the study. Experiments were divided into three groups. The size of 3 x 6 cm island flap based on inferior epigastric artery was occured in all experiments. İschemia-reperfusion was not applied to rats in sham (I) group following flap elevation. In Control (II) and propofol (III) group, no flow ischemia for two hours and reperfusion for two hours was performed by clamping the inferior epigastric artery with a microclamp after flap elevation. 1 cc izotonic in group II and 5 mg/kg dose %1 propofol in group III was infused intravenously with the aim of tail vein catheterization. Heart rate, systolic artery pressure, partial oxygen pressure was measured in all experiments before surgical procedure and after reperfusion for two hours Flap survival rate of all groups was calculated on seventh day. On fourteenth day, samples taken from flap tissue were evaluated biochemically and histopathologically. MDA(malondialdehyde), SOD (superoxide dismutase), KAT (catalase), TAK(total antioxidant capacity, TOS (total oxidative stress), PON (paraoxonase) measurement was done for biochemical evaluation. Edema, inflammation, epithelial tissue, vascularisation and fibrosis was evaluated histopathologically.
Bulgular: In according to flap survival, There was statistically significant
difference between propofol and control group (p<0,0001). When hemodynamic parameters were compared, there was no significant difference between groups in terms of heart rate. However disticntion of systolic arterial pressure and partial
oxygen pressure between gorups was meaningful (p<0,0001). Biochemical investigastions showed that the values of MDA (p=0,016) and TOS (p=0,000) were found significantly low. Moreover values of SOD (p=0,000), TAC (p=0,000), CAT (p=0,03) was significantly high. There wasn’t significant difference between groups in terms of PON (p=0,862) value. In according to pathological evaluation, inflammation, edema and fibrozis signs were significantly decreased in I/R+propofol group when compared with I/R+izotonik. In the same way, epithelial regeneration was significantly increased in I/R+propofol group when compared with I/R+izotonik group.
Conclusion: As a result, application of propofol in appropriate dose showed
protective effect against ischemia-reperfusion damage in axial patterned skin flaps. For this reason, propofol may be preferred in operations which have risk of ischemia-reperfusion injury.
İÇİNDEKİLER
Önsöz………. i
Özet……… iii
İngilizce Özet (Abstract))………. v
Simgeler ve Kısaltmalar……… viii
1. Giriş ve Amaç……… 1
2. Genel Bilgiler……….. 5
2.1. Flep Tanımı ve Sınıflandırılması……… 5
2.2. Tarihçe………. 6 2.3. Flep Fizyolojisi……… 9 2.4. İskemi-Reperfüzyon………. 20 2.5. Propofol……… 26 3. Gereç ve Yöntem………. 36 4. Bulgular……… 52 5. Tartışma……… 74 6. Sonuç………. 85 7. Kaynaklar……….. 86 SiMGE VE KISALTMALAR
DNA: Deoksiribonükleik asit RNA: Ribonükleik asit
cAMP: Siklik adenozin monofosfat cGMP: Siklik guanozin monofosfat AMP: Adenozin monofosfat
ATP: Adenozin trifosfat
NAD: Nikotinamid Adenin Dinükleotid
NADPH: Nikotinamid Adanin Dinükleotit Fosfohidrojen Cl: Klor
Na: Sodyum K: Potasyum O2- : Süperoksit
H2O2 Hidrojen peroksit OH. : Hidroksil
NO2: Nitrit dioksit NO: Nitrik oksit PDE: Fosfodiesteraz
ROT: Reaktif Oksijen Türleri CO2: Karbon dioksit
GABA: Gamma Aminobütirik asit SOD: Süperoksit dismutaz
KAT: Katalaz
TOS: Total oksidatif stres PON: Paroksanaz
TAK: Total antioksidan kapasite MDA: Malondialdehid
GSH-Px: Glutatyon peroksidaz PMNL: Polimorfonükleer lokosit İ/R: İskemi reperfüzyon
1.GİRİŞ VE AMAÇ
Flepler plastik cerrahinin özünü oluşturur. Bir plastik cerrahı plastik cerrah yapan, flepleri başarılı bir şekilde kavrayabilme, tasarımlamak, uygulama ve takip etme becerisidir. Bir flebi greftten ayıran özelliği, flebin canlılığını sağlayan kendisine ait bir kan kaynağı olmasıdır. Kendinden kanlanma, üstün fleksibilite ve potansiyel anlamına gelir, bu da fleplere; kompleks defektlere vaskülarize örtü, form ve fonksiyonun yeniden sağlanmasında, neredeyse sınırsız olanak tanır. Bir flebin canlılığı kendi dolaşımına bağlı olduğundan, flebin vasküler fizyolojisinin tamamıyla anlaşılıp optimize edilebilmesi, başarı ile başarısızlık arasındaki farkı yaratır.
Flep nekrozu rekonstrüktif cerrahide büyük sorunlara neden olan ciddi bir durumdur. İskemi ve nekrozun patofizyolojisi arteriyel yetmezlik ve venöz konjesyonla birlikte karmaşık bir mekanizmaya sahiptir. Damarları etkileyen ajanlar tarafından oluşturulan arteriyel spazm, yüksek moleküllü fosfat bileşiklerinin oluşması ve yer değiştirmeleri, serbest oksijen radikallerinin açığa çıkması, sodyum ve potasyum pompalarının inaktive olması, endoteliyal hücrelerde ödem, arter ve venlerde trombüs oluşumu, flebin iyileşme döneminde meydana geldiğinde nekroz veya iskemiye yol açarlar. Fleplerin şekli ve büyüklüğü de iskemi açısından önem taşımaktadır.
İskemi reperfüzyon hasarı rekonstrüktif cerrahide, replantasyon cerrahisinde ve reeksplorasyon yapılan vakalarda önemli bir problemdir. Komatsu ve Tamai’nin 1965’de total ampute başparmakta replantasyonu gerçekleştirmelerinden sonra reperfüzyon hasarı güncelleşmiştir. Son yıllarda serbest doku aktarımına ait klinik tecrübe hızla artmaktadır. Gelişen cerrahi teknikler ve imkânlar ile operasyon süreleri kısalsa da iskemi reperfüzyon hasarı cerrahi başarıyı önemli ölçüde etkilemektedir. Toksik oksi ve hidroksi radikallerinin lipid peroksidasyonu veya diğer yollarla hücre membranlarını
hasara uğratabilecekleri ileri sürülmüş ve serbest radikallerin hem in vivo hem de in vitro ortamlarda proteinler, lipidler, karbonhidratlar ve DNA’yı hasara uğrattıkları deneysel olarak gösterilmiştir. Flep nekrozu oluştuğu zaman sekonder iyileşmeye yardımcı olmak amacı ile tekrarlayan pansumanlar ve hatta ikinci bir operasyon gerekebilmektedir. Bu durum hastanede yatış süresini, morbiditeyi ve maliyeti artırmaktadır.
iskemi ve ardından gelişen reperfüzyon hasarının zararlı etkilerini ortadan kaldırabilecek veya azaltabilecek pek çok endojen ya da eksojen ajan araştırılmıştır. Fleplerde iskemi ve reperfüzyon hasarını azaltmak için bir dizi kimyasal ilaçlar ve fiziksel yöntemler denenmiştir. İskemi reperfüzyon hasarının operasyon sırasında kullanılan anestezik ajanlarla azaltılıp azaltılmayacağı konusu son yıllarda araştırmacıların ilgi odağı haline gelmiştir.
Yaptığımız literatür incelemelerinde intravenöz anestezik bir ilaç olan propofolün yapısı itibarıyla fenol bazlı serbest radikalleri ortamdan uzaklaştırdığını ve antioksidan özelliklerinin bulunduğunu gördük, reperfüzyon hasarına uğramış aksiyel paternli ada fleplerinde propofolün etkisini araştıran bir çalışmaya rastlamadık ve çalısmamızda, reperfüzyon hasarına uğramış rat inferior epigastrik ada flebinde propofol kullanımının flep yaşayabilirliği ve hemodinamik parametreler üzerine etkilerinin araştırılmasını amaçladık.
2.GENEL BİLGİLER
2.1. FLEP TANIMI VE SINIFLANDIRMASI
Flepler, vasküler beslenmesi korunarak, bir bölgeden başka bir bölgeye taşınabilen doku parçalarıdır ve vücudun tüm bölgelerindeki defektlerde kullanılabildikleri için rekonstrüksyon cerrahisinde oldukça geniş bir bölümü oluşturmaktadırlar.(1,2) Aynı defekt birden çok yolla kapanabilir. Flebin kendi dolaşımı cerrahi sonrası başarıyı veya kaybı belirler.(3) Flebin beslenmesi random ya da belli bir arterden (aksiyel patern) kaynaklanabilir. Aksiyel paternli flepler sahip oldukları damar sistemiyle beslenmesinden dolayı daha güvenilir fleplerdir.
Flepler tüm dokularda makrosirkülasyon ve mikrosirkülasyona sahiptir. Makrosirkülasyonu flebin anatomisi ve dizaynı belirler. Makrosirkülasyon flebin arteryel girişi ve venöz drenajını gösterir. Mikrosirkülasyon flepte hücresel metabolizmayı gösterir. Mikrosirkülasyonla arterioller, venüller, arteriovenöz anastomozlar yoluyla flepte oksijen taşınımı, karbondioksit ve atık ürünlerin uzaklaştırılması sağlanır.(3)
Flepler, kanlanma kaynağı, flebi oluşturan dokuların kompozisyonu, aktarılma şekilleri ve yerlerine göre sınıflandırılabilirler.(3,4)
Kanlanma kaynağına göre
a) Random flep b) Aksiyel flep
Flebin doku içeriğine göre
a) Deri flepleri (kutanöz) b) Kas flepleri (muskuler) c) Fasya flepleri
Flep aktarımının şekline ve yerine göre
A) Lokal flepler
a) İlerletme flepleri (Advancement) b) Rotasyon flepleri c) Transpozisyon flepleri B) Uzak flepler a) Direkt flepler b) Tüp flepler c) Serbest flepler 2.2 TARİHÇE
“ Flep ” kelimesi, aslı Flemenkçe olan “ flappe ” kelimesinden türemiş olup, gevşek ve geniş bir şekilde asılmış, sadece bir tarafından tutan anlamına gelmektedir. Fleplerle yapılan doku onarımlarının tarihi milattan önce 600’lü yıllarda Sushruta Samita’nın gerçekleştirdiği yanak flebi ile burun onarımına kadar gitmektedir. En erken flepler baş-boyun ve alt ekstremite bölgelerinde muhtemelen random paternli diyebileceğimiz şekilde dizayn edilmiş fleplerdi. 1597’de Tagliacozzi’nin distal bazlı kol flebi ile burun rekonstrüksiyonu yapmasından sonra, 19. yüzyılda İngiliz cerrah Carpue başarılı alın flepleri uygulayana kadar rekonstrüksiyon cerrahisi duraklama dönemine girdi. Bundan sonra flep evrimi 1. ve 2. Dünya savaşlarının da katkısıyla oldukça hızlı bir şekilde gerçekleşti. Yirminci yüzyılın başlarında dikkatler random tüp flepler üzerine çevrildi ve bu fleplerin yaşayabilirliğini arttırmak için geciktirme işlemi uygulanmaya başlandı. Carl Manchot’un 1889’da belli damarlar tarafından beslenen anatomik deri bölgeleri kavramını yayınlamasından sonra 1919’da Davis aksiyel, pediküllü kas ve fasya fleplerini ve kompozit flepleri tanımlandı. Bundan sonra 1950 ve 1960’larda Owens, McGregor, Bakamjian, vb. araştırmacılar
tarafından saçlı deri, alın, boyun, göğüs önduvarı ve supraklavikuler bölgede pek çok aksiyel paternli flep tanımlandı. Orticochea’nın 1970’lerin başında aynı muskulokütan perforatör damarlar tarafından beslenen deri adası ve kas dokusu varlığını rapor etmesinden sonra kas ve muskulokütan flepler popülarize oldu ve 1980’lere doğru serbest doku aktarımı gündeme geldi. 1981’de Ponten’in belli bir deri adasının beslenmesini sağlayan septokütan perforatörleri fark etmesi fasyokütan flep kavramının gelişmesine yol açtı.(5,6) Taylor ve Palmer 1987’de “anjiozom (angiosome)” kavramını tanımlayarak flep cerrahisine büyük katkıda bulunmuşlardır. Anjiozom, tek bir kaynak arter tarafından beslenmesi sağlanan deri, deri altı ve derin doku kompozit (bileşik) ünitesidir. Vücudu oluşturan pek çok anjiozom arasında çapları değişebilen “choke” anastomotik damarları da bu araştırmacılar tarafından tanımlanmıştır.(7,8) Dhar ve Taylor’ın yaptığı deneysel çalışmada geciktirme işlemi sırasında “choke” damar dilatasyonunun kalıcı ve dönüşümsüz bir şekilde gerçekleşip, damar çapında artışla sonuçlandığı gösterilmiştir. Bu sonuçların elde edilmesinden sonra geciktirme işleminin sadece cerrahi olarak değil çeşitli farmakolojik ajanlarla (rezerpin, 6-OH dopamin, guanetidin, fenoksibenzamin, fentolamin) yapılabileceği düşüncesi ortaya çıkmıştır. Yapılan çalışmalarda, bu ilaçlarla flep canlılığının arttığı gösterilse de geciktirme için halen en kabul edilir sonuçlar cerrahi geciktirmeyle alınmaktadır. (9) Teknolojideki gelişmeler sayesinde mikrocerrahi gerektiren serbest doku aktarımlarının daha düşük başarısızlık oranlarıyla yapılır olması nedeniyle eskiden tercih edilen basitten karmaşığa doğru giden rekonstrüksiyon merdiveni kullanımı yerine, 1997’de rekonstrüksiyon üçgeni tanımlanarak, ideal form ve fonksiyona ulaşmak için cerrahın transpozisyon flebi, serbest doku aktarımı veya doku genişletme işlemlerinden istediği herhangi birini seçebileceği belirtildi.(5)
FLEPLERİN KANLANMASI
Derinin kan dolaşımı: Derinin makrodolaşımı
Deri kanlanmasının ana kaynağı aortadan çıkan segmenter damarlardır. Segmental damarlar, derin dokulardan yüzeyel dokulara doğru ilerlerken her biri vücudun belirli bölgesini besleyen damarlar verirler. Bu damarlar kaslar arasındaki fibröz septaları izleyerek, bazıları direkt olarak deriye, çogu ise kas
içine giden dallara ayrılırlar. Direkt olarak deriye giden dallara septokutan damarlar, kaslar içinden geçerek deriye ulasan damarlara ise muskulokutan damarlar adı verilir. Septokutan damarların bir kısmı deri altında yüzeyel olarak seyreder. Direkt olarak deriyi besleyen bu damarlar direkt kutanöz damarlar olarak da adlandırılmaktadır. Yüzeyel inferior epigastrik arter ve yüzeyel sirkumfleks iliak arter bu damarlara örnek olarak verilebilir. Bazı bölgelerde ise septokutan damarlar derinde seyreder ve yüzeye doğru küçük perforan dallar verirler. Bu tip damarlara örnek radiyal arterdir. Muskulokutan damarlar kaslar içerisindeki bağ dokularını takip ederek yüzeyelleşir ve üzerlerindeki deriyi beslerler. Deriye verdikleri perforan dalların çapları vücudun çeşitli bölgelerinde farklılıklar taşır. Örneğin rektus abdominis kasını besleyen derin inferior epigastrik arterin, göbek çevresinde perforan dalları nispeten kalın ve belirgindir. Buna karşın, gracilis kasının üzerindeki deriye verdiği damarlar daha küçük çapta ve çoğu zaman belirsizdir. Her biri vücudun belirli bir bölgesindeki deri ve derin dokuları besleyen ana arterler Ian Taylor tarafından kaynak arterler olarak adlandırılmıştır. Kaynak arterler tarafından beslenen her bir bölge bir anjiyozom olarak tanımlanmıştır. Bu anjiyozomları besleyen arterler muskulokutan veya septokutan orijinli olabilir. Venöz dolaşımda arteriyel dolaşıma benzer şekilde organize olmuştur ve bir ana ven tarafından drene edilen vücut bölgesine venozom denmektedir. Kan dolaşımının bu şekilde organize olmuş olması tek bir arter ve ven pedikülü üzerinde deri, kas ve kemik gibi çeşitli dokuları barındıran kompozit fleplerin hazırlanmasına olanak vermektedir. (10,11) Deri dolaşımı, fasya, subkutan yağ dokusu ve deri olmak üzere 3 anatomik seviyede ve fasyal, subkutanöz, subdermal, dermal, subepidermal olmak üzere beş vasküler pleksustan oluşur. (12,13)
Fasyal pleksus: Özellikle ekstremitelerde olmak üzere kas fasyası önemli
vasküler pleksusa sahiptir. Vasküler pleksuslar fasya altında (subfasyal) veya üstünde (prefasyal) yer almaktadır. Prefasyal pleksus baskın dağılım sistemidir ve fasyokutan, septokutan ve bitişikteki muskulokutan arterlerden beslenir.
Subkutanöz pleksus: Yüzeyel fasyada yer alan bir damar ağıdır. Subkutan yağ
dokusunu yüzeyel ve derin tabakalara ayırır. Bu pleksusu muskulokutan ve septokutan arterler besler.
Subdermal pleksus: Derinin primer kan akımını sağlar. Subkutan pleksustan
uzanan dallar retiküler dermisle alttaki subkutan yağ arasında bu pleksusu oluştururlar. Buradan çıkan dallar altta ve üstte uzanarak deri, adipoz doku ve deri eklerini besler.
Dermal ve subepidermal pleksuslar: Bu pleksuslar gerçek deri kan dolaşımını
sağlarlar. Arteriyel sistem gittikçe dallanır ve arterlerden (subdermal), arteriollere (dermal) ve kapillerlere (subepidermal) dönüşür. Subdermal pleksus damarları devamlı arteriyel kas duvarına sahiptir ve primer dağılım görevini üstlenirler. Dermal pleksusta yer alan arterioller izole kas alanlarına sahiptir ve primer olarak termoregulatör fonksiyonu vardır. Kapillerler subepidermal pleksusta yer alır ve primer besleyici fonksiyona sahiptir.( 12, 13, 14)
Muskulokutanöz vasküler sistemde üç tür damar bulunur:
Segmental arterler, perfüzyon basıncıyla bağlantılı olarak aortun devamı olarak
düşünülür, genellikle kasların diplerinde bulunur ve kaslara perforatör temin eder. Geniş bir damarla birlikte uzanır ve periferal sinirle bağlantısı vardır.
Perforatör damarlar, segmental damarlardan kutanöz dolaşıma doğru kanal
görevi görür.
Kutanöz damarlar, deri yüzeyine dikey olan muskulokutanöz arterler ve deriye
paralel olan direkt kutanöz damarlardan oluşur. Kutanöz sistem, fasyal, subkutanöz ve kutanöz olarak sıralanır.(12)
Gelişen büyük boyutlu kutanöz vasküler bölgelerin üç türü kavramlaştırılmıştır. a. Anatomik bölge, bir damarın dallarının başka damarların dallarıyla anastomoz yapmadan önceki beslediği alanı tanımlanır.
b. Dinamik bölge, çoğunlukla cerrahi bir müdahale ile orijinal anatomik bölgeden daha fazlasını beslemeyi ifade eder. Müdahalenin bir göstergesi olarak bitişik arteriolar anastomozların intravasküler basınç gradientinde ve kan akısında kararsız yön değişiklikleri gösterir.
c. Potansiyel bölgesi bitişik bir arter bölgesinin devamı olarak farklı bir bağımsız kutanöz segment izole edildiğinde oluşur.
Bu genellikle bir geciktirme işlemi ile başarılır. Bu işlemle potansiyel bölge, geciktirme ve flep kaldırılması arasındaki dönemde kökten değişikliğe uğrayan flebin bir random unsurunu içine alır.(12, 13, 14)
Dokulara kan temini konusunda iki teori öne sürülmüştür. Teorilerin ilki, kompozit deri birimi ve kendi kaynak arterinden temin edilen alttaki derin doku desteği olan angiozomu tanımlar. İkincisi, bu kaynak arterler tarafından derinin sağladığı seyirleri tanımlar.
1. Vücudun kan temini bağlantılı doku iskeletine bitişik ya da iskeletin içinde bulunur, bu kemik, septa ya da fasya olabilir.
2. Damarlar sabit noktalardan hareketli alanlara doğru yol alır.
3. Vasküler dış akım, azalan çaplı damarlar tarafından predominant olarak bağlanan devamlı arterler sistemidir. Örnek; arterler ve arterioller.
4. Vücut, adlandırılan kaynak arterler tarafından desteklenen kompozit doku bloklarından oluşan üç boyutlu bir yap-bozdur. Bu doku bloklarını temin eden arterler deri altı yapıların desteğinden sorumludur. Bu kompozit birimleri “angiozom” olarak adlandırılır.(5) Otörler, birçok durumda bitişik angiozomlar arasındaki bağlantıların dokuların arasında değil içinde gerçekleştiğini doğrulamışlardır. (11)
Derinin mikrodolasımı
Mikrodolaşım, çapları 300 mikrondan daha az olan arterioller ile başlar. Arterioller, direk kutanöz, fasyokutanöz ve muskulokutanöz sistemin terminal dallarından köken alırlar. Lümen içi çapları 30 mikrona kadar düşerek terminal arteriolleri olusturur. Terminal arteriollerin çapları 10 ile 30 mikron arasında olup, subdermal pleksusu oluşturur. Damar iç çapının 10 ile 30 mikron olduğu yerlerde, inerve düz kasların oluşturduğu prekapiller sfinkterler bulunur. Prekapiller sfinkterler kan akımı kontrolündeki son noktalardır. En uçta çapları 3-7 mikron arasında değişen kapillerler bulunur. Kapillerlerden sonra, çapları 8-30 mikron arasında degişen postkapiller venüller ile kanın geri dönüşü başlar. Kan, postkapiller venüllerden çapları 50 mikrona kadar genişleyen toplayıcı venüllere
akar. Toplayıcı venüller ile beraber damar çeperinde perisitler ve düz kas hücreleri görülmeye başlar.
ŞEKİL1:
derinin kan dolaşımı2.3.FLEP FİZYOLOJİSİ
Flep Kan Akımının Düzenlenmesi
Deri kan akımı esas arterioler seviyede düzenlenir. Sempatik etki, prekapiller sfinkter, arteriol ve arteriovenöz anastomozlarda kan akımını düzenler. Sempatik etki sonrası prekapiller sfinkterin kasılmasıyla kan doğrudan arteriovenöz anastomoza yönelir.(14,15) Deriye olan kan akımı yaklaşık olarak 100 gr doku için 20 ml. dir. Bu miktar artan metabolik aktivite nedeniyle kaslarda çok daha yüksektir. Deri kan akımı, lokal ve sistemik olmak üzere iki seviyede kontrol edilmektedir. Sistemik kontrol; nöral ve hormonal olabilmektedir.
a. Nöral dengeleme vazokonstrüksiyonu sağlayan sempatik lifler ile vazodilatasyon yapan beta adrenerjik reseptörler aracılığıyla gerçekleşir. Arteriyol ve arteriyovenöz anastomoz seviyesinde damar düz kas tonusunu düzenlerler.(5) b. Hormonal dengeleme, sistemik vazoaktif maddelerin kendilerine özgün reseptörlerdeki aktiviteleriyle sağlanmaktadır. Sistemik vazokonstriktörler; serotonin, tromboksan A2 ve prostaglandin F2α yı içerirken vazodilatatörler ise prostaglandin E1, prostaglandin I2 (prostasiklin), histamin, bradikinin ve lökotrien C4 ve D4 ten oluşur. Perfüzyon basıncı ve vazokonstriksiyon da fizyopatolojide etken olarak savunulmuştur.(24) Flep kaldırılmasını takiben flebin pedikülündeki akım korunsa bile, flebin ucundaki akım, ilk 6-12 saatte normalin %20’sinin altına düşer. İlk 12-18 saat süresince; ilerleyen lökosit aracılı endotel hasarı, sempatik vazokonstriktörlerin salınımı ve düşen perfüzyon basıncının kombinasyonu nedeniyle, özellikle flep distal kısımlarında akım dramatik olarak düşer. Uç kısmın yaşayabilmesi için yeterli akım, 6-12 saat devam etmelidir. Nörotransmitterlerin 12-24 saatte ortaya çıkması ve flep yatağından 2-3 gün inoskülasyonun gerçekleşmesiyle perfüzyon dereceli olarak düzelir. Uç kısımlar 6-12 saat süreyle ciddi seviyede iskemide kalırsa, akım geri dönmesi reperfüzyon hasarına yol açar, mikro damarlar iflas eder ve doku nekroze olur.(16,17)
Flep Kaybı
Flep kaldırıldıktan sonra distal kısımdaki lokal iskemi azami vazodilatasyona yol açar. Proksimal kısımdaki yetersiz perfüzyon basıncı flebin distalinde arteryel yetersizlik ve kaybına neden olur. (17) Random ve aksiyel kalıplı fleplerde hatalı flep planlaması, mikro dolaşımı etkileyen sistemik faktörler (hipotansiyon, sepsis, sigara kullanımı, vazokonstriktörler) veya flep üzerine fiziksel baskı (hatalı yerleştirme, pedikülde katlanma, hematom) nedeniyle mikrodolaşım düzeyinde düşük akımın gelişmesine ikincil olarak trombozis oluşur. (18,19) Hipoksinin neden olduğu iyon hemostaz bozukluğu, ATP/ADP oranının azalması ve mitokondriyal permeabilite bozulması gibi olumsuz değişikliklerle reaktif moleküllere karşı hücre savunmasını da zayıflatmaktadır. Bu durumda hipoksinin sadece reaktif oksijen üretimini arttırmak yoluyla dahi hücre hasarına yol açmaktadır. Anaerobik metabolizmayla birlikte toksik süperoksit radikallerin üretiminde artış olur. Süperoksit radikal, endotel ile doğrudan etkileşir ve lipit
peroksidasyonu, membran proteinlerinde ayrışma, hücre geçirgenliğinde artış, sitoplazmik şişme ve işlev bozukluğuna yol açar. (20)
Reperfüzyon ile birlikte primeri süperoksit radikali olan hidrojen peroksit ve hidroksil radikalleri oluşur. İnvitro ortamda oksijen radikalleri veya endotel hipoksisi nötrofillere etki eden kemoatraktanları artırır. Böylece inflamatuar nötrofil göçü artar. Hızlı olarak dolaşımda nötrofil artışı perfüzyonda ani azalmaya neden olmaktadır. Nötrofiller intravasküler yoğunlaşarak ya kümeler oluşturmakta ve mikrovasküler oklüzyona neden olmaktadır ya da direkt olarak endotele zarar vermektedirler. Endotel membranında bulunan lipidler perokside olurken membran proteinleri parçalanır. Sitoplâzma bütünlüğü bozulur. İkinci mekanizma da ise oksijen metabolitleri direk kendileri kemotaktandır. Reperfüze alana nötrofil göçü olur. Nötrofil bu alanda doku parçalanmasına neden olur. Dolaşımdaki PMNL’ler yok edilerek iskemi sonrası reperfüzyon hasarının azaltıldığı bilinmektedir.
Flep Geciktirmesi (Delay Fenomeni)
Flebin elevasyon ve transferinden önce ayrı bir seansta parsiyel olarak kan
akımı kesilerek flep yaşayabilirliğinin arttırılmasına "delay prosedürü" denir. Bu işlem sonrasında elde edilen kazanç "delay fenomeni" olarak adlandırılır.(21) Bu yöntem sayesinde, flebin damarsal pedikülünün uzunlamasına ulaşımını arttırılarak distalde daha fazla yaşayabilen random cilt adasının elde edilmesi sağlanır. Cerrahi flep geciktirmesi ilk kez 16. yüzyılda Tagliacozzi tarafından koldan kaldırılıp burun rekonstrüksiyonunda kullanılan deri flebinde kullanılmıştır. Blair, 1921' de bu girişimi "delay transferi "olarak tanımlamıştır. Braithwaite 1951 de delay işleminin flep damar sayısını artırmadını ancak özellikle subdermal venlerin çapında genişleme olduğunu savunmuştur.(22) Sağlanan bu genişleme geri dönüşümsüzdür ve operasyon sonrası meydana gelen vazokonstriksiyon 3 saate çözülmektedir. Milton; 1965'de flepte 4 farklı delay yöntemlerinin karşılaştırmalı çalışmasını yapmış ve en etkili yöntemin cilt insizyonları arasında "underminig" yapılarak uygulanan delay olduğunu belirtmiştir. Delay tanımlanması ise 1967 yılında Myers ve Chery tarafından yapılmıştır. Klasik cerrahi geciktirme tekniği flep kaldırılacak alana yapılan iki adet paralel insizyonla yapılır. Günümüzde genellikle uygulanan cerrahi
geciktirme tekniği ise kaldırılması planlanan flepin distal kısmının önceden kaldırılmasıyla yapılır. Flep geciktirme (delay) işlemi Callegari'nin 1992'de yaptığı çalışma sonucuna göre fleplerdeki cerrahi geciktirme uygulama esaslarını belirtmiştir.(25)
- Flebin yaşabilen uzunluğu perforatörler arasındaki uzunluğa bağlıdır.
- Nekroz bölgesi genellikle “choke” damarların komşu bölge ile yaptıkları anastomoz hattındadır.
- Geciktirme, mevcut damarlarda dilatasyona neden olur ve bu etki komşu anjiozomları birbirine bağlayan "choke arter" lerin bulunduğu bölgede maksimumdur.
- En etkin geciktirme işlemi flebin basamaklar halinde elevasyonu ile elde edilir. - Doku genişletme işlemi bir tür cerrahi geciktirmedir.
- Benzer değişiklikler kas delay işleminde de görülür.
Geciktirme yöntemi (delay fenomeni) birçok teoriyle açıklanmaya çalışılmıştır. İskemiye tolerans teorisinde random deri flebinin periferinde kan akımı kesildiğinde flep pedikülünün aksı boyunca kan akımının güçlendiği ve delay prosedürü sonrasında hücrelerin hipoksik ortama alışmış olduğu, böylece asıl operasyondan sonra doku nekrozu azaldığı belirtilmektedir.(2,26) Sempatektomiye bağlı vazodilatasyon teorisinde prosedür esnasında yapılan kesi sayesinde sempatik lifler flebin sınırından kesilmiş olduğundan vazodilatasyon oluştuğu ve kan desteğinin arttığı belirtilmektedir. Flep içine şant hipotezi insizyonlar sonrası oluşan sempatektominin A-V anastomozları prekapiller sfinkterlerden daha fazla dilate ettiği varsayımına dayanır. Kapiller yatak “bypass” edilerek sonuçta besleyici olmayan kan akımı artar. Böylece oluşan iskemik duruma doku alışır.(27) Hiperadrenerjik durum teorisine göre cerrahi sonrası adrenalin ve nöradrenalin gibi vazokonstriktör ajanların doku konsantrasyonları artar. Geciktirme prosedüründen sonra kan desteği azalır, fakat doku nekrozuna yol açacak ölçüde değildir. İkinci prosedür öncesine kadar vazokonstriktör maddelerin seviyesi normale döner. İkinci prosedürde vazokonstriktör maddelerdeki yükselme, geciktirmesiz kaldırılan fleplerdeki kadar
Delay edilmiş bir flepdeki dolaşım değişikliklerinin zamana göre saptanan bulguları şunlardır
İlk 24 saat: Arteriyel kan akımında azalma, arteriyel ve kapillerler de belirgin dilatasyon
1-3 gün: Longidutinal anastomozların genişlik ve sayısında artışla birlikte pedikül içindeki küçük damarların artması
3-7 gün: Fonksiyon gören damarların çapı ve sayısında artış. Flebin uzun ekseni boyunca damarların reoryantasyonu
7-14 gün: Flep ile yatak arasında dolaşımın sağlanması, vaskülarite artışının durması
14-21 gün: Vasküler sistemde ilerleyici regresyon. Flep ve yatak arasındaki anastomozların olgunlaşması
21 gün sonrası: Flep dolaşımı olması gerekenin % 90'nına ulaşmıştır. Yapılan araştırmalarda vasküler pedikülün ligasyonu veya embolizasyonu, flep alanı çevresine sütür atma, flep alanına çeşitli sistemik ve topikal kimyasa lajanlar uygulama, lazer, gibi çeşitli yöntemler denenmiştir.(22) Fakat gelişen flep teknikleri nedeniyle geciktirme yönteminin popülaritesi azalmıştır.
YARA İYİLEŞMESİ
Yara iyileşmesi esas olarak 4 ana evreden oluşmaktadır. Olaylar ardışık bir düzen içinde değil, birbiri içerisinde sınırları tam olarak ayırt edilemeyecek özelliktedir. Bu evreler:
1)Hemostaz 2)İnflamasyon 3)Proliferasyon
4)Skar maturasyonu fazı.(28,29)
Hemostaz
Cilt bütünlüğünü bozan bir travmadan sonra oluşan vasküler hasar, hemostaz için gerekli olan moleküler ve hücresel cevabı doğurur. İyileşme basamakları hemostaz olmadan başlamaz.
Birinci adım vazokonstrüksiyondur. Dermis bütünlüğü bozulduğu zaman periferik dolaşımdan gelen adrenalin ile sempatik aktivasyona bağlı salınan lokal
noradrenalin en önemli vazoaktif aminlerdir. Ayrıca yara yerinde bulunan hücrelerden salınan prostoglandinlerin de etkisi vardır. Bunu platalet aggregasyonu takip eder. Platalet agregasyonu hasarlanmış hücrelerden salınan doku faktörü ile uyarılır. Bu esnada platelet sitoplâzmalarında bulunan alfa granüller, yoğun cisimcikler ve lizozomlar, içlerinde bulundurdukları enzim, sitokin ve büyüme faktörlerini dokuya salarlar. Alfa granülleri albumin, fibrinojen, fibronektin, IgG, Faktör V ve VIII, Platelet kaynaklı büyüme faktörü (PDGF), dönüştürücü büyüme faktörü α ve β (TGF-α ve β), fibroblast büyüme faktörü2 (FGF-2), platelet kaynaklı epidermal büyüme faktörleri (EGF) ve endotelyal büyüme faktörleri içerir.(30,31) Yoğun cisimcikler ise pıhtılaşma mekanizması için gerekli kofaktörler içerirler. Bunlar kalsiyum, serotonin, adenozin difosfat ve trifosfattır (ADP ve ATP).(32,33,34)
Koagülasyon basamakları intrensek ve ekstrensek bileşenlerden oluşmuştur. İntrensek yol, normal yara iyileşmesi için şart değilken ekstrensek yol gereklidir. Ekstrensek yol doku faktörünün faktör VII veya VIIa ile birleşmesi ile başlar.(35) Doku faktörü damar dışı alanlarda, özelliklede adventisyal fibroblastlarda bulunur. Sonuçta trombin oluşur. Trombinde fibrinojeni fibrine çevirir Fibrin platelet tıkacının çevresini sararak sağlamlaştırır.(36) Fibrin ise vitronektin tarafından kaplanır. Bu sayede fibronektinlerin yapışması kolaylaşır. Fibrin ve fibronektin erken yara matriksini oluştururlar. Yetersiz fibrin oluşumu bozulmuş yara iyileşmesi ile sonuçlanır ve fibrini yaradan uzaklaştıracak herhangi bir olayda yara iyileşmesini geciktirir.
İnflamasyon
Yaralanmanın erken dönemlerinde gelişen vazokonstrüksiyon 10-15 dakika
içinde son bulur ve vazodilatasyon gelişir. Bu olay kendisini yara çevresinde kırmızı-kızıl bir hale şeklinde gösterir. Plateletlerden salınan faktörler, pıhtılaşma zincirinde açığa çıkan bradikinin gibi ürünler ve doku hasarı sonucu gelişen nekrozdan kaynaklanan faktörler, yaralanma çevresinde endotel geçirgenliğini değiştirerek damar dışı alana plazma geçişine ve ödeme neden olmaktadır. Vazodilatasyon endotel veya mast hücresi kaynaklı lökotrienler, prostoglandinler ve özellikle histamin kaynaklıdır. Trombin, kinin ve C3a/C5a da geçirgenliği artırıcı kuvvetli ajanlardır.(28,37)
Doku içine sistemik dolaşımdan ilk geçen hücre grubu nötrofillerdir. Nötrofil infiltrasyonunun esas görevi ortamda bulunan debris, bakteri ve yabancı cisim gibi materyallerin ortamdan uzaklaştırılmasıdır.14 Kollajen, elastin yıkım ürünleri, kompleman faktörleri, TGF-β, tümör nekroz faktörü-alfa (TNF-α), interlökin-1 (IL-1), PDGF, lökotrien B4 ve platelet faktör IV gibi immünmodülatörler, lökositler için güçlü kemoatraktan maddelerdir. Bu sayede lökositlerin sistemik dolaşımdan yara yerine geçişi kolaylaşır. İnflamasyonun ikinci ve üçüncü günlerinde, yara yerinde sistemik dolaşımdan gelen monositler görülmeye başlar. Monositler yara yerinde makrofajlara dönüşürler. Makrofajlar yara iyileşmesinin en önemli hücre grubunu oluştururlar. Sadece ortamda bulunan bakteri ve debrisin fagositozunu değil aynı zamanda ortama saldıkları vasküler endotelyal büyüme faktörü (VEGF), FGF, TNF-α EGF, PDGF, IL-1 ve nitrik oksit (NO) gibi enzim, sitokin ve büyüme faktörleri ile anjiogenez, fibroblast migrasyonu, proliferasyonu ile kollajen üretimi ve muhtemelen de yara kontraksiyonunu koordine eder. (30,31) T lenfositler de yara iyileşmesi için önemli hücre gruplarındandır. IL-2 ve diğer immünmodülatörlerin etkisiyle özellikle CD4+ ve CD8+ T lenfositler 5-7. günler arasında yara yerinde en yüksek sayısal değere ulaşırlar.(31)
Proliferasyon
Yara iyileşmesinin erken dönemlerinde fibrince zengin bir matriks içerisinde inflamatuar hücreler baskınken, temiz yaralarda üç-beşinci günden itibaren makrofajlar tarafından salınan PDGF, TGF-β gibi sitokinler tarafından fibroblastlar aktive edilir ve bölünerek çoğalmaya yönlendirilir. Bu dönemden itibaren, fibroblastlar yara ortamındaki baskın hücre haline gelmektedir.(28) Fibroblastların tek kaynağı çoğalma değildir. Bunun yanında çevre dokudaki fibroblastlar, PDGF, TGF-β, EGF ve fibronektin tarafından aktive edilerek erken yara matriksi içinde ilerlemesi sağlanır. Mezenşim kökenli kök hücrelerden ortam uyaranlarına bağlı olarak fibroblasta farklılaşma da diğer bir kaynaktır.
Fibroblastlar glukozaminoglikanlardan (GAG), fibriller kollajene kadar yara iyileşmesi için gerekli birçok molekül üretirler. GAG’lar protein çekirdek etrafında birbirini tekrarlayan disakkarit üniteleridir. GAG’lardan ilk olarak hyalüronik asit sentezlenir, bunu kondroitin-4 sülfat, dermatan sülfat ve heparan
sülfat takip eder. Fibroblastlar tarafından üretilen bu moleküller amorf jel içerisinde hidrate edilirler ve kollajen liflerinin agregasyonu için zemin oluştururlar.(37)
Kollajen yumuşak dokunun temel taşıdır. Vücudun total protein miktarının 1/3’ünü oluşturur. Aminoasitlerden glisin, prolin, hidroksilizin ve hidroksiprolin içerir. Karmaşık moleküler yapısı vardır. Polipeptid zinciri sol el heliks yönünde kendi üzerine dönen ve üç zincir bir araya gelerek sağ el yönünde dönerek temel kollajen ünitesini oluşturduğu, üç polipeptid zincirinden oluşmaktadır. Polipeptid zincirleri kovalan bağlarla birbirleri ile bağlanırlar. Bu yapıya tropokollajen denir. Tropokollajen molekülleri kollajen filamentlerini oluştururlar. Bu filamentler fibrilleri, fibrillerde demetleri meydana getirirler. Tespit edilmiş 30’a yakın kollajen tipi vardır. Her biri değişik özelliklere ve yerleşim yerine sahiptirler. Tip I kollajen özellikle deri, tendon ve kemikte bulunur. Bu dokular, tüm vücuttaki toplam kollajenin %90’ına sahiptirler. Normal deri dokusunda tip I/III kollajen oranı 4/1 iken, bu oran granülasyon dokusunda, hipertrofik skar ve immatür skar dokusunda 2/1’e kadar düşmektedir.(30) Anjiogenez, doku hasarından 2 gün sonra aktif hale gelir. Yara yeri pH’sının asidik olması, yüksek laktat seviyesi, düşük oksijen basıncı anjiogeneze katkıda bulunan yara yeri özellikleridir. Ayrıca anjiogenin, TGF-β, EGF, TGF-α, TGF-β, keratinosit büyüme faktörü (KGF), insülin benzeri büyüme faktörü-1 (IGF-1), FGF, PDGF, IL-1α, IL-6 gibi sitokin ve hormonlar da VEGF salınımını artırarak anjiogenezi artırırlar.(38,39) Anjiogenez sırasında endotelyal hücreler intakt kapillerlerden yaraya doğru göç etmeye ve çoğalmaya başlarlar. Bu göç esnasında hücreler belirli bir kavis çizerler ve böylece lümen yapısını oluştururlar. Bu tomurcuklanma başka kapiller tomurcuklar ile bir araya gelerek yeni kapiller ağ meydana getirirler. Yukarıda da belirtildiği üzere anjiogenez çeşitli sitokinler ile düzenlenir. En önemli iki faktör, FGF-2 ve VEGF’dir. Sitokin konsantrasyonları yara yeri revaskülarize olduktan sonra düşmeye başlar ve değişim vasküler sistemin olgunlaşmasını kolaylaştırır. Epitelizasyon akut yaralanmayı takiben derinin bariyer fonksiyonunun geri döndürülmesi açısından gereklidir. Yaralanan epitelyum dokusunun rekonstrüksiyonu yaralanmadan hemen sonra başlar. Cerrahi kesiler yaralanmadan 24-48 saat içerisinde epitelize olurken daha geniş yaraların epitelizasyonu günler, bazen aylar sürebilir. Yaralanmadan sonraki ilk
24 saatte epidermis bazal tabakasında bulunan hücreler yara yerine doğru hareketlenmeye ve göç etmeye başlarlar. Eğer mevcut yaralanma kıl follikülü ve ter bezleri gibi deri eklerine zarar vermemiş ise, bu yapılar epitelizasyon sürecinin hızlanmasına yardımcı olurlar. Bu hücreler yara bölgesine tek tabaka halinde göç ederler. Göçün başlangıcından yaklaşık 24 saat sonra yara kenarında ve deri eklerinde bulunan bazal hücreler çoğalmaya başlarlar ve bu tek katlı epitelyum tabakasına katkıda bulunurlar. Epitelyal hücrelerin göçü diğer yönlerden gelen epitelyum hücreleri ile karşı karşıya gelene kadar devam eder. Epitelizasyon aşaması EGF, TGF-α, platelet kaynaklı EGF ve KGF (FGF-7 olarak da bilinir) gibi çeşitli sitokinlerin kontrolü altındadır. Bu sitokinlerin bir kısmı inflamatuar hücreler tarafından, kalanı epitelyal hücrelerin kendisi tarafından üretilir. Eğer epidermal bazal membran sağlam ise hücreler kolayca bazal membran üzerinde ilerlerler. Ancak bazal membran hasarlanmışsa epitelyal hücrelerin fibrin-fibronektin matriksi üzerinde ilerlemesi gerekir. Bu göç esnasında epitelyal hücreler kendilerine yeni bazal membran tabakası oluştururlar. Göç eden epitelyal hücrelerin altında yeni bazal membran oluşumu tenasin, vitronektin, tip I ve tip V kollajen sekresyonu ile mümkündür. Değişik yönlerden epitelyal hücrelerin karşılaşması ile kontakt inhibisyon meydana gelir. Epitelyal hücreler ve bazal membran arasında bulunan hemi-desmozomlar yeniden oluşur. Tenasin ve vitronektin sekresyonu azalır. Hücreler daha bazaloid hale gelirler ve sonraki hücresel çoğalma, keratin ile kaplı çok katlı yeni epidermisi oluşturur. Yeni epidermis eskisi gibidir, ancak daha ince, bazal membranı düz ve rete pegler yoktur.(28)
Protein sentezi ve depolanması ile yara kontraksiyonu, yaranın oluşmasından dört-beş gün sonra baskın hale gelmeye başlar. İyileşmenin bu fazında depolanan matriksin kalitesi ve miktarı, skarın gerim kuvvetini etkilemektedir.(39,40) Kollajen skar dokusundaki toplam protein miktarının %50’sini oluşturur ve üretimi yara iyileşmesi için hayatidir. Fibroblastlar kollajen ve diğer proteinlerin sentezinden sorumlu hücredir. Kollajen sentezi TGF-β, PDGF, ve EGF tarafından stimüle edilir. Kollajen sentezi ayrıca hastanın yaşı, yaranın gerginliği, uygulanan basınç, stres ve yaraya ait özelliklerden de etkilenmektedir. Kollajen sentezi iki-dört hafta arasında maksimum düzeydedir, daha sonra kademeli olarak düşmeye başlar.
Yara kontraksiyonu da yaralanmadan dört-beş gün sonra başlar ve etkin olarak yaklaşık iki hafta devam eder. Eğer yara bu iki haftalık dönem sonunda kapanmamış ise kontraksiyon devam eder. Açık bir yarada yara kenarlarının birbirine doğru çekildiğini rahatlıkla görebiliriz. İnsizyonel bir yarada skar kontraksiyonu skarın boyunu kısaltır. Kontaksiyon oranı anatomik bölgeye göre değişmekle birlikte ortalama 0,6-0,7 mm/gündür. Skalp veya pretibial bölgede bulunan bir yaranın kontraksiyonu uyluk bölgesindeki bir yaradan daha az olmaktadır. Yaranın şeklide, kontraksiyon oranını etkilemektedir. Kare şeklindeki yaralar dairesel yaralardan daha kolay kontrakte olmaktadır. Yara kontraksiyonu yara çevresinde myofibroblastların baskın olması ile karakterizedir. Myofibroblastlar, yara yerinde bulunan fibroblastlardan dönüşerek meydana gelirler. Sitoplâzmalarında bulunan aktin-zengin mikroflamanlar (α-SMA, düz kas aktini) sayesinde kontraksiyonu gerçekleştirirler. Bu protein, gerim kuvvetinin oluşturulmasında önemli bir role sahiptir.(41) Myofibroblastlar ayrıca “SM-miyozin ağır zincir” ve demsin gibi diğer kontraktil proteinler içerir. Myofibroblastlar yarada ilk olarak dört-altıncı. Günler arasında görülürler ve takip eden iki-üç hafta boyunca yarada kalırlar. Myofibroblastlarca oluşturulan izometrik gerim, düz kas hücrelerindekinden farklıdır. Düz kas hücrelerinin kontraksiyonu geri dönüşümlü iken, miyofibroblastlarinki geri dönüşümsüzdür. (34,35)
SkarMaturasyonu fazı
Bu faz yaralanmayı takiben yaklaşık üç hafta sonra görülmeye başlar.(28,29) Klinik olarak en önemli fazdır. Histolojik olarak ana görüntü kollajenin organize şekilde depolanmasıdır. Eğer hastanın matriks oluşumunu engelleyen veya bozan bir hastalığı var ise (diyabet, diyet gibi), yara gerim kuvveti ciddi şekilde bozulur. Eğer aşırı kollajen sentezi var ise bu seferde hipertrofik skar veya keloid oluşumu meydana gelir. Yara gerim kuvveti %100’e ulaşamaz. Yara gerim kuvveti birinci haftada %3, üçüncü haftada %30, üçüncü ayda yaklaşık %80, altıncı ay sonunda en fazla %85 düzeyine erişebilir.
Kontraksiyon, yumuşak dokularda yara alanlarının kapatılması için gerekli, iyileşme sürecinin doğal bir parçası olan bir eylemdir. Yara kontraksiyonu 1971 yılında Gabbiani, Ryan ve Majno’nun çalışmaları sonucunda tanımlanmıştır. Myofibroblast, fibroblastik hücrelerden köken alan, stoplazmasında düz kas benzeri mikroflamanlar içeren bir hücredir. Myofibroblastlar, yara gerilim hattı boyunca kollajen liflerini beraberinde sürükleyerek yara alanını kapatmak üzere merkeze doğru hareket ederler. Yara iyileşme sürecinde bu süreç uzar ve kalıcı hale gelirse kontraktür meydana gelir.
Yara Direnci
Yaraya direnç kazandıran ana madde kollajendir. Yaranın erken evrelerinde direnç kazanma özelliği fibrin pıhtı sayesinde oluşur. İlk 24 saatte yaranın ölçülebilir miktarda gerilim direnci kazandığı, sonuç olarak bu direnci epitelizasyon ve fibrin pıhtı sayesinde kazandığı gösterilmiştir. PMNL’in kollajen formasyonunda yeri olmadığından, inflamasyon evresinde kollajen depozisyonu çok azdır. Ancak makrofajlardan salınan growth faktörler kollajen formasyonunu etkileyerek, indirek yoldan yara direncine katkıda bulundukları gösterilmiştir.
Yara İyileşmesini Bozan Faktörler
İyileşme proçesi bozulmuş bir yaranın karakteristik özellikleri; Yara kapanmasında gecikme
Yetersiz arteriel sirkülasyon Azalmış venöz dönüş Kapiller ağda vaskülit Yara enfeksiyonu
2.4. İSKEMİ- REPERFÜZYON
Hücresel fonksiyonların gerçekleşebilmesi ve aerobik hücre metabolizmasının düzgün şekilde çalışabilmesi için gerekli temel yakıt oksijendir. Normal hücre fonksiyonları için gerekli olan yüksek enerjili fosfat bağları aerobik metabolizma ile sağlanır. Dokulara oksijen sağlayan kan akımı kesildiğinde, o dokuya ait hücrelerin fonksiyon bozukluğu ile başlayan ve hücre ölümüne kadar ilerleyen bir dizi kimyasal olay gerçekleşir. Oksijen yetersizliği durumunda anaerobik metabolizma devreye girer. Bu da laktik asit ve toksik metabolitlerin birikimi ile sonuçlanır. Ortaya çıkan asidoz nedeniyle normal enzim kinetiği değişir ve yüksek enerjili fosfat bağlarının yapımı azalır. Bu durumda hücre kendi homeostazı için gerekli olan enerjiden yoksun kalır. (43,44,45)
Dokuların iskemiye dayanıklılığı birbirinden farklıdır. Kritik iskemi zamanı olarak adlandırılan bu süre, dolaşım tekrar sağlandığında dokunun sağlam kalabildiği maksimum total iskemi süresini ifade etmektedir. Örnek olarak iskelet kasları için oda sıcaklığında kritik iskemi süresi 2 saatten fazla iken jejunum epitelinde yaklaşık 30 dakika içerisinde histolojik değişiklikler oluşmaya başlamaktadır.(46,47) Hücresel homeostaz için gerekli olan enerji kaynaklarının, özellikle ATP’nin tüketimi, hücre membranında iyon dengesizliğine yol açar. Na+ ve Ca++ iyon dengesi bozulur. Bunu asidoz ve ozmotik şok gibi klinik bulgular ile kromatin kümelenmesi ve piknozis gibi histolojik bulgular takip eder.(43,45) İskeminin süresi doku hasarının ağırlığını belirlemektedir. İskemiye bağlı oluşan yapısal ve metabolik değişiklikler kapiller damarlarda daralma, lökosit birikimi, endotelyal hücrelerde metabolik disfonksiyon, hücre membranı disfonksiyonu ve inflamatuar mediatörleri üreten enzim sistemlerinin aktivasyonudur.(48) Doku oksijen seviyelerindeki azalma laktik asit birikimine neden olarak doku pH’sini düşürür. Düşük pH nedeniyle membran transport fonksiyonları bozulduğunda hücre içi kalsiyum konsantrasyonunda artış başlar. Hücre içi artmış kalsiyum miktarı çeşitli enzimlerin aktivasyonunu ve inflamatuar mediatörlerin birikimini tetikler.(49)
Reperfüzyon, iskemiye neden olan etkenin ortadan kaldırılarak dokuya kan akımının yeniden sağlanmasıdır. Organ transplantasyonu, serbest doku aktarımı, replantasyon gibi operasyonlarda damar anastomozları gerçekleştikten sonra veya myokard infarktüsü, mezenter arter trombozu gibi durumlarda kan akımı restore edildikten sonra oluşan reperfüzyonun, iskemik dokuda enerji ihtiyacının sağlanması ve toksik metabolitlerin uzaklaştırılması gibi iki olumlu etkisi vardır. Reperfüzyon iskemik hasarın düzeltilebilmesi için gerekli bir süreçtir. Ancak oksijenlenmiş kanın iskemik dokuya dönüşü reperfüzyon hasarı olarak adlandırılan ve dokuyu daha fazla zedeleyen bir reaksiyon sürecini başlatır.(48,50) REPERFÜZYON HASARI
Reperfüzyon hasarı ilk olarak 1960 yılında major bir arterin uzamış klemplenmesi sonrası kan akımının tekrar sağlanmasını takiben gelişen sistemik şok ve asidoz tablosu ile fark edilmiştir.(51) ‘Declamping shock’ olarak adlandırılan tablonun daha sonra iskemik dokularda biriken toksik metabolitlerin sisteme karışmasından kaynaklandığı anlaşılmıştır. Reperfüzyon yaralanması tanımı ilk olarak 1975 yılında Cerra ve ark. Tarafından yapılmıştır.(50) Köpeklerin myokardlarında yaptıkları çalışmalarda kan akımının yeniden sağlanmasının subendotelyal hemorajik nekroza neden olduğunu tesbit etmişlerdir. Bu durum plastik cerrahi literatüründe de yer almaktadır. Tablonun sorumlusu reperfüzyon sonrası ilerleyici damar hasarı ve yetersiz kan akımına sahip alanların genişlemesinden oluşmaktadır. 1987’de May ve arkadaşları bir serbest doku deneyinde reperfüzyon hasarının hücresel şişme, intravasküler agregasyon ve intravasküler sıvının interstisyel alana kaçışından kaynaklandığını öne sürdüler.(52) Son çalışmalar reperfüzyonun postkapiller venüllerde bir inflamatuar yanıtı provoke ettiğini göstermiştir.(53) Reperfüzyon; uzamış iskemi sonrası doku hasarının en önemli nedenidir. (53,54)
Parmakların ve ekstremitelerin replantasyonu reperfüzyon yaralanması için aday vakalardır. İskemik organın replantasyonu uzak organlarda disfonksiyonaneden olabilir. Başlangıçta büyük bir doku kitlesinin revaskülarizasyonu asidoz, hiperkalemi, myoglobinüri ve dissemine intravasküler koagülasyona neden olur. Bunun yanında renal vasküler yapılardaki mikro seviyede tıkanıklıklar ve hipotansiyona bağlı olarak renal yetmezlik görülebilir. Reaktif oksijen radikalleri ve özellikle tumor necrosis factor-α (TNFα) ve diğer sitokinlerin etkisiyle oluşan kapiller sızıntı ve pulmoner ödem akciğer disfonksiyonuna neden olmaktadır. Tüm bu etkilerin sonrasında sorunları çözmek için replante edilen ekstremiteler ampute edilmektedir.(55) Klinik açıdan bakıldığında parmak ve el replantasyonları sonrası iskemi reperfüzyon hasarının sistemik yan etkileri fazla görülmemekte birlikte yapılan replantasyon operasyonu iskemi- reperfüzyon hasarı nedeniyle başarısızlığa ve organ kaybına neden olmaktadır.
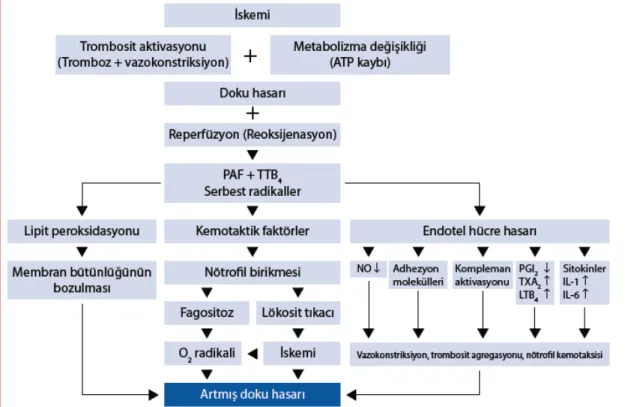
İSKEMİ REPERFÜZYON HASARININ MEKANİZMASI
İskemiye bağlı hücre hasarı insanlarda, deney hayvanlarında ve hücre kültürlerinde gösterilmiştir. Dokunun iskemiye toleransı dokuların tipine göre değişmektedir. Örnek olarak çizgili kas dokusunun normotermik ortamda kritik iskemi zamanı iki saatten fazla iken jejunum dokusunda 30 dakika içinde histolojik olarak iskemik değişiklikler gözlenmektedir. (49) İskeminin erken döneminde adenozin trifosfat glikolitik yoldan sağlanmaktadır. Bu süreç ortamda laktat ve diğer toksik metabolik ürünlerin birikimine neden olmaktadır. Bu durum fosfolipaz A2 ve lizozimlerin dahil olduğu kimyasal mediatörlerin ve enzimlerin aktiflenmesine neden olur. Fosfolipaz A2 hücre membran fosfolipitlerini lökotrienler ve prostoglandinler gibi inflamasyon mediatörleri için bir prekürsör olan araşidonik aside çevirir. Lizozimler patojenleri ve nekrotik hücreleri parçalayan proteolitik enzimlerdir
Şekil 2: İskemi- reperfüzyon hasarının mekanizması
Lökosit- Endotel İlişkisi
Salınan kimyasal mediatörler lökositler için kemotaktik etki gösterirler. Araşidonik metabolitleri, özellikle lökotrienler lökositlerin vasküler endotele yapışmasını artırırlar ve reperfüzyon hasarının işareti olan postkapiller venüllerde permeabilite artışına neden olurlar. (56) Endotele bağlanan lökositler lizozimleri salarlar, serbest oksijen radikallerini üretirler ve daha fazla lökosit çeken kemotaktik ajanları salarlar.
İSKEMİ -Hücre içi -ATP azalması -pH artışı -Kalsiyum artışı
REPERFÜZYON -Lökosit- endotel ilişkisi
-Kemotaktik ajanların salınması
-Serbest oksijen radikallerinin oluşumu -Kompleman aktivasyonu
-İmmün komplekslerin oluşumu
-Hücre içi fosfolipazların ve lizozimlerin aktivasyonu -Hücre nekrozu
-Daha fazla hücre hasarı
TEDAVİ ALTERNATİFLERİ
Cerrahi açıdan düşünüldüğünde doku hasarına engel olmak için en uygun yöntem dokuların iskemik kalmasının önüne geçmektir. Ancak bazı klinik durumlarda iskemi süresi istenmeden uzamakta ve reperfüzyon hasarı riski artmaktadır. Bu durumlarda da reperfüzyon hasarının engellenmesi ve oluştuğunda tedavisine yönelik tedavi alternatifleri öne sürülmüştür.
Hipotermi
Hipotermi ile reperfüzyon sonrası dokulara lökosit infiltrasyonu azaltılarakdolayısıyla reaktif oksijen türlerinin salınışını azaltarak reperfüzyon hasarının önüne geçilebilmektedir.(57) Hipotermi sayesinde ampute olan ekstremitelerin canlılık süreleri uzatılabilmekte ve replantasyon sonrası yaşama oranı artırılabilmektedir. (58,59)
İntraarteryel İnfüzyon Ve Yıkama
İntraarteryel infüzyon veya yıkama reperfüzyon hasarının tedavisindeki diğer bir yöntemdir. Çeşitli farmakolojik ajanlar ve solüsyonlar bu amaçla kullanılmıştır. Wisconsin Üniversitesi solüsyonu ve Euro- Collins solüsyonu en çok ilgi gören solüsyonlardır. Bu solüsyonlar ve modifiye edilmiş halleri ile yapılan çeşitli çalışmalarda etkinlikleri gösterilmiştir. 4°C’lik bir hipotermi ampute ekstremite ve parmakların taşınmasında ve saklanmasında uygun bir yöntemdir. Ancak soğukta saklanan kas dokusu iskemi reperfüzyon hasarı açısından halen risk taşımaktadır.
Antitrombotik Ajanlar
İskemi reperfüzyon hasarının önlenmesinde ve tedavisinde çeşitli antitrombotik ajanlar kullanılmıştır. Heparinle yapılan hayvan deneylerinde heparinin flap survisini artırdığı bildirilmiştir. (60) Heparin postkapiller venüllerde lökosit- endotel temasını azaltarak no reflow fenomeninini azalttığı, trombosit agregasyonunu ve mikrotrombüs oluşumunu azalttığı bilinmektedir. Khouri ve arkadaşları tarafından yapılan prospektif bir çalışmada 493 serbest flep uygulaması sonrası subkutan heparin uygulamasının postoperatif trombüs oluşumunu azalttığı bildirilmiştir. Ancak heparin uygulamasının intraoperatif ve postoperatif dönemde kanama ve hematom oluşumuna neden olduğu bilinmektedir. (61,62)
Trombolitik Ajanlar
Mikrovasküler trombüs oluşumunun iskemi reperfüzyon hasarının önemli bir komponenti olduğu bilinmektedir. (63) Kanın göllenmesi ve damar endotelinde oluşan iskemik hasar koagülasyonu aktive ederek fibrin oluşumuna ve pıhtılaşmaya neden olmaktadır. Streptokinaz ve ürokinaz mikrocerrahi uygulamalarında profilaktik olarak kullanılmaktadır. Benzer şekilde bu ilaçlar akut koroner trombüs, derin ven trombozu ve pulmoner tromboemboli gibi durumlarda iskemik hasarın azaltılmasında kullanılabilirler.(64,65) Serbest doku aktarımları ve replantasyon uygulamalarında canlılığın korunması üzerinde trombolitik ajanların rolü tam olarak ortaya konmamıştır. Farklı ilaçlar bu amaçla denenmiş olmakla birlikte çelişkili sonuçlar ortaya konmuştur. (66)
Serbest Oksijen Radikali Tutucuları- Önleyicileri
İskemi reperfüzyon hasarının mekanizması bahsinde tartışıldığı şekilde serbest oksijen radikalleri iskemi reperfüzyon hasarının oluşumunda önemli role sahiptirler. İskemiye maruz kalan dokularda ortaya çıkan serbest oksijen radikallerinin neden olabileceği hasarı önlemeye yönelik birçok ilaç tanımlanmıştır.
Süperoksit dismutaz, glutatyon peroksidaz, katalaz enzimleri hücre metabolizması içerisinde de yer alan primer antioksidanlardır. Serbest radikalleri, biyolojik önemi olan moleküllerle etkileşmeden önce daha zararsız bileşiklere
dönüştürerek veya başka moleküllerden radikal üretimini engelleyerek etkilerini gösterirler.(67)
Vitamin E, vitamin C, β-karoten, ürik asit, bilirubin, albümin bu gruptandır ve sekonder antioksidanlar olarak bilinir. Bunlar serbest radikalleri yakalayarak oluşabilecek zincir reaksiyonlarını engeller. (67,68) PAF antagonistleri ve 5-lipooksijenaz inhibitörleri kemotaksisi inhibe ederken Transforming Growth Faktör- α ise nötrofillerin endotele yapışmasını ve adenozin reseptör mekanizması yoluyla aktive nötrofillerden serbest radikal üretimini inhibe eder. (69) Allopurinol ve desferroksamin serbest radikal üretimini önleyen ajanlardır. α-tokoferol, propranolol, kalsiyum kanal blokerleri, kaptoril bilinen antioksidan ajanlardır
2.5. PROPOFOL
Propofol sık kullanılan intravenöz anestezik bir ajandır. Diğer hipnotik maddelerle yapısal benzerliği olmayan propofol, çabuk ve güvenilir hipnoz oluşturur. Gama amino bütirik asit (GABA) reseptörleri üzerinden etki gösteren bir ajandır. Propofol aynı zamanda benzodiazepinlerin bağlandıkları yerden daha uzak bir bölgede GABA ile düzenlenen geçişi arttırır.(70) Propofolün sentez çalışmaları 1970’de başlamıştırr. 1977’de ilk klinik deneme yapılmış ancak anaflaktik reaksiyon görülmüştür. Günümüzde kullanılan emülsiyon formül 1989’da elde edilmiştir.(71)
Propofolün Fizikokimyasal Özellikleri:
Propofolün kimyasal yapısı 2,6 di-izopropil fenoldür. Başlangıçta kullanılan Cremofor EL içindeki solüsyonu, allerjik reaksiyonlara ve enjeksiyon ağrısına neden olduğu için kullanımdan kaldırılmıştır.(72,73,74) Ampirik formülü C 12 H 18 O’ dur ve moleküler ağırlığı178.27’dir.(75)
Oda ısında sıvı halde bulunan alkilfenoller; aköz solüsyonda insolubl olup, yüksek oranda lipid solubldur. Mevcut yapılarında %1-2 (wt/vol) propofol, %10 soya yağı, %2.25 gliserol ve %1.2 purifiye yumurta fosfatı (lesitin) içerir. Bakteri ve mantar üremesini geciktirici koruyucu madde olarak %0.005’lik disodyum
Visköz, süt beyazı görünümde olup pH’ı 7’dir. Oda ısısında stabildir ve ışığa sensitif değildir. Propofolün dilüe edilmesi gerekiyorsa %5’lik dekstroz ile dilüsyon yapılmalıdır. (72,73)
Farmakokinetiği ve Farmakodinamiği:
Tek doz bolus ile uygulama sonrası kan propofol seviyesi redistrübisyon ve eliminasyon ile hızla düşer. Propofol etkisinin bağlangıcı ve sonlanması hızlı olup, aynı zamanda vücutta birikmemesi nedeniyle devamlı infüzyon şeklinde uygulanımı, sedasyon amacıyla uygun bir ajan olduğunu düşündürmektedir. (77,78) Merkezi sinir sistemine hızlı penetrasyonu ve kandan hızlı temizlenmesi etkisinin hızlı başlaması ve derlenme zamanının hızlı olması ilacın karakteristik özelliklerini oluşturur. (79) Derlenme zamanının kısa olması yoğunbakım hastalarında mekanik ventilatörden ayrılma ve cerrahi prosedür sonrası erken nörolojik muayene için gereklidir. (75)
Propofolün dağılımı en sık üç kompartmanlı model ile açıklanmaktadır ve bu model propofolün üç dominant farmakokinetik özelliğini tarif eder:
1) Propofolün kandan dokulara hızlı distribüsyonu. 2) Kandan propofolün benzer hızla temizlenmesi.
3) Derin kompartmanlardan kana propofolün yavaş geri dönüşü.
Bu model de ilk başlangıç yarı ömrü 1-8 dakika (ilacın vücut dokularına distribüsyonunu temsil eder), yavaş dağılım yarı ömrü 30-70 dakika (ilacın metabolizmasını temsil eder) eliminasyon yarı ömrü ise 4-23 saattir (zayıf olarak perfüze olan yağ dokusundan ilacın yavaş eliminasyonunu temsil eder). (73,74) Pik etki 90-100. saniyelerde ortaya çıkar. Perfüzyonu bozuk olan modellerde eliminasyon yarı ömrünün uzun olması, propofolün santral kompartmana geri dönüşünün yavaş olması ile ilişkilidir. Santral kompartmanda dağılım volümü 20-40 litre ve dinlenme arasında 150-700 litre olarak hesaplanmıştır. Propofolün klirensi oldukça yüksek olup 1.5-2 lt/dk dır. Bu hepatik kan akımını aşar. Propofol plazma proteinlerine %97-98 gibi yüksek bir oranda bağlanır.(80) Tahmin edilebileceği gibi yağda eriyen bir bileşik olduğundan çok geniş bir dağılım hacmi vardır. Propofolün farmakokinetiğini etkileyen bir takım faktörler mevcuttur.