BAZI BİTKİ TÜRLERİNİN SOĞAN SAK NEMATODU (Ditylenchus dipsaci) SOĞAN IRKINA KONUKÇULUK
DURUMLARININ BELİRLENMESİ
Gamze Çalış Yüksek Lisans Tezi Biyomühendislik Anabilim Dalı Doktor Öğretim Üyesi Elif Yavuzaslanoğlu
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
BAZI BİTKİ TÜRLERİNİN SOĞAN SAK NEMATODU (Ditylenchus dipsaci) SOĞAN IRKINA KONUKÇULUK DURUMLARININ BELİRLENMESİ
YÜKSEK LİSANS TEZİ GAMZE ÇALIŞ
Biyomühendislik Anabilim Dalı
Tez Danışmanı: Dr. Öğr. Üyesi Elif YAVUZASLANOĞLU
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i
ÖZET
Yüksek Lisans
BAZI BİTKİ TÜRLERİNİN SOĞAN SAK NEMATODU (Ditylenchus
dipsaci)
SOĞAN IRKINA KONUKÇULUK DURUMLARININ BELİRLENMESİ Gamze ÇALIŞ
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyomühendislik Anabilim Dalı
Danışman: Dr. Öğr. Üyesi Elif YAVUZASLANOĞLU Ekim, 2018, 113 sayfa
Soğan, günlük diyette sıkça tüketilir ve dünya da en çok yetiştirilen sebzeler arasında üçüncü sırada yer alır. Türkiye'de geniş bir üretim alanına sahiptir. Soğan yetiştiriciliğinde önemli oranda verim kaybına neden olan ve soğan sak nematodu olarak adlandırılan Ditylenchus dipsaci (Kühn), karantinaya tabi olan ve soğan dışında 500 bitki türünde 30’dan fazla ırk ile temsil edilen mikroskobik bir bitki paraziti nematoddur. Bu nematod ile mücadele için konukçu spektrumunun bilinmesi büyük bir öneme sahiptir.
Bu çalışmada 28 bitki çeşidinin 4 farklı araziden alınan soğan sak nematodu populasyonuna karşı konukçuluğu denenmiştir ve nematodun bitkiler üzerine etkileri kayıt altına alınmıştır. Ülkemizde çoğunlukla yetiştiriciliği yapılan fasulye, bezelye, çavdar, pırasa, sarımsak ve tütünün mükemmel konukçu, nohut, domates, biber, hıyar, kabak, kavun, marul, havuç, pancar, patates, soğan, lale, ıspanak, karalahana, çilek buğday, mısır, patlıcan, yonca ve yulafın orta konukçu olduğu belirlenmiştir. Bu çalışma soğan sak nematodu ile mücadelede konukçu olan bitkilerle konukçu olmayan bitkilerin rotasyona sokularak verim kaybının en aza indirilmesine ve üretim aşamalarında daha bilinçli ve etkin önlemlerin alınmasına yardımcı olacaktır.
Anahtar kelimeler: Ditylenchus dipsaci, soğan ırkı, konukçuluk, soğan sak
ii
ABSTRACT
Ms Thesis
DETERMINATION of HOSTING ABILITY of SOME PLANT SPECIES to STEM and BULB NEMATODE (Ditylenchus dipsaci) ONION RACE
Gamze ÇALIŞ
Karamanoğlu Mehmetbey University Graduate School of Naturel and Applied Sciences
Department of Bioengineering
Supervisor: Assist. Prof. Dr. Elif YAVUZASLANOĞLU October, 2018, 113 pages
Onion is consumed intensively by human and the third place among the mostly grown plant species. It has a wide production area in Turkey. Ditylenchus dipsaci (Kühn) named as stem and bulb nematode and causes significant yield losses on onion, is a plant parasitic nematode subject to quarantine regulations and has more than 30 races breeding on 500 plant species. Determination of host spectrum has a big impact on control applications.
In this study, 28 plant species were tested to stem and bulb nematode isolated from 4 different location and effect of the nematode on plant species were recorded. The plant species mostly grown in Turkey; bean, pea, rye, leek, garlic and tobacco were good host and chick pea, tomatoes, pepper, cucumber, zucchini, melon, lettuce, carrot, beet, potatoes, onion, spinach, Savoy cabbage, strawberry, wheat, maize, egg plant, medicago and oat was medium host to tested 4 populations of stem and bulb nematode. This study will provide useful information for control of the nematode using non host plants and reduce the yield loss. Therefore more effective and conscious control would be provided.
Keywords: Ditylenchus dipsaci, onion race, host, stem and bulb nematode.
iii
ÖN SÖZ
Yüksek lisans hayatım ve bu tez çalışmam boyunca benden her türlü yardımını esirgemeyen, maddi ve manevi her sıkıntımda bana her şekilde destek olan, beni yapamayacağım hiç bir şeyin olmadığı konusunda motive eden, vazgeçmek üzere olduğum zamanlarda bana moral verip zorluklarımı kolaylaştıran, her türlü bilgi, deneyim ve olanaklarını benimle paylaşan, gelecekteki akademik düşünce ve hayallerim için her türlü yardım ve maddi ve manevi desteğini esirgemeyen, gerek akademik hayatı gerekse insanî kişiliği ile sonsuz saygı duyduğum ve kendime örnek olarak seçtiğim değerli, saygıdeğer ve kıymetli danışman hocam Dr. Öğr. Üyesi Elif YAVUZASLANOĞLU'na sonsuz teşekkür ederim.
Benden emeğini ve desteğini esirgemeyen, her yerde ve her zaman arkamda olduklarını hissettiğim kıymetli ve sevgili annem Emine AKSAY'a, babam Ali AKSAY’a, kardeşlerim Ferhat, Hatice Nur, Emin ve Sümeyye AKSAY'a, Serap ve Hüseyin DEMİRCİ'ye teşekkür ederim.
Varlıkları ile beni mutlu eden, her türlü zorluğa karşı dik durmamı sağlayan, tez çalışmamı bir an önce bitirmem konusunda ısrarcı olan, deneme çalışmalarım sırasında yokluğum nedeniyle ağlayan ve beni özleyen, yaramazlıkları ile çalışmalarımda aksaklıklara sebep olsalar da bana yardım etmeye çalışan, enerji kaynaklarım ve yol arkadaşlarım olarak gördüğüm oğlum Yavuz ve kızım Miray' a sonsuz teşekkür ederim.
Yüksek Lisans eğitimim süresince 215O468 numaralı proje ile bana ve çalışmalarımı
gerçekleştirmem için verdiği mali destekten dolayı TÜBİTAK' a teşekkür ederim.
Gamze ÇALIŞ
iv İÇİNDEKLER Sayfa ÖZET ...i ABSTRACT ... ii ÖN SÖZ ... iii ÇİZELGELER DİZİNİ ... vii ŞEKİLLER DİZİNİ ... viii SİMGELER VE KISALTMALAR DİZİNİ ... x 1. GİRİŞ ... 1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 3
3. MATERYAL VE METOT ... 15
3. 1. Bitki Türleri ... 15
3. 2. Denemede Kullanılan Nematodların Elde Edilmesi ... 16
3. 2. 1. Bitki ve Toprak Örneklerinin Toplanması ... 16
3. 2. 2. Bitki ve Toprak Örneklerinden Nematodların Ayrılması ... 17
3. 2. 3. Nematodların Tür Teşhisi ... 18
3. 2. 3. 1. Nematodların Morfolojik Tür Teşhisi ... 18
3. 2. 3. 2. Nematodların Moleküler Tür Teşhisi ... 19
3. 2. 3. 2. 1. DNA İzolasyonu ... 19
3. 2. 3. 2. 2. PZR Reaksiyonu... 20
3. 2. 4. Havuç Kültürü Oluşturulması ... 22
3.3. Nematod İnokulümünün Hazırlanması ... 22
3. 4. Konukçu Testleme Denemesi ... 23
3. 5. Konukçu Testleme Denemesinin Değerlendirilmesi ... 25
3. 6. Verilerin İstatistikî Analizi ... 27
4. BULGULAR VE TARTIŞMA ... 28
4. 1. Havuç Kültüründe Çoğaltılan Nematodların Tür Teşhisi ... 28
4. 1. 1. Morfolojik Tür Teşhisi ... 28
4. 1. 2. Moleküler Tür Teşhisi ... 28
4. 2. Bitki Türlerinin Boyu, Ağırlığı, Nematod Zararı Belirtisi ve Nematod Sayıları ile Nematod Üreme Oranı ... 32
v 4. 2. 2. Biber Bitkisi ... 34 4. 2. 3. Buğday Bitkisi ... 35 4. 2. 4. Çavdar Bitkisi ... 36 4. 2. 5. Çilek Bitkisi ... 37 4. 2. 6. Domates Bitkisi ... 38 4. 2. 7. Fasulye Bitkisi ... 39 4. 2. 8. Havuç Bitkisi ... 41 4. 2. 9. Hıyar Bitkisi ... 42 4. 2. 10. Ispanak Bitkisi ... 43 4. 2. 11. Kabak Bitkisi ... 44 4. 2. 12. Karalahana Bitkisi ... 45 4. 2. 13. Kavun Bitkisi ... 46 4. 2. 14. Lale Bitkisi ... 47 4. 2. 15. Marul Bitkisi ... 48 4. 2. 16. Mısır Bitkisi ... 49 4. 2. 17. Nergis Bitkisi ... 50 4. 2. 18. Nohut Bitkisi ... 51 4. 2. 19. Pancar Bitkisi ... 52 4. 2. 20. Patates Bitkisi ... 53 4. 2. 21. Patlıcan Bitkisi ... 54 4. 2. 22. Pırasa Bitkisi ... 55 4. 2. 23. Sarımsak Bitkisi ... 56 4. 2. 24. Soğan Bitkisi ... 57 4. 2. 25. Sümbül Bitkisi ... 59 4. 2. 26. Tütün Bitkisi ... 60 4. 2. 27. Yonca Bitkisi ... 61 4. 2. 28. Yulaf Bitkisi ... 62 5. SONUÇ ... 65 KAYNAKLAR ... 66 EKLER ... 72
Ek 1. Bitki türlerinin 4 tekerrürlü olaraksoğan sak nematodunun 4 populasyonuna konukçuluk durumlarının belirlenmesinde birinci denemede bitki boyu, ağırlığı, nematod zarar belirtisi ve nematod üreme sonuçları ... 72
vi
Ek 2. Bitki türlerinin 4 tekerrürlü olarak soğan sak nematodunun 4 populasyonuna konukçuluk durumlarının belirlenmesinde ikinci denemede bitki boyu, ağırlığı, nematod zarar belirtisi ve nematod üreme sonuçları ... 85
vii
ÇİZELGELER DİZİNİ
Çizelge Sayfa
Çizelge 3-1 Nematoda karşı konukçuluk durumları belirlenen bitki türleri, çeşit ve
elde edildiği ticari firma bilgileri………...16
Çizelge 3-2 Nematod kültürlerinin oluşturulduğu coğrafi bölge, il, ilçe, GPS lokasyonu ve izolasyon materyali bilgisi………...…...17
Çizelge 3-3 Çalışmada kullanılan SCAR, SSR ve RFLP markörlerine ait primer dizisi, D. dipsaci için beklenen bant büyüklüğü, hedef bölge ve yayınlandığı kaynak makale bilgileri…....……….………...………20
Çizelge 3-4 Çalışmada kullanılan primerlere ait PZR ısı döngüsü ve PZR karışımı içeriği………..…….21
Çizelge 3-5Konukçu testleme deneme planının bir bitki türü için şematik gösterimi………..……23
Çizelge 4-1Nematod kültürlerine ait morfometrik teşhis kriterlerine ait ortalama ölçüm ve hesaplamalar………...28
Çizelge 4-2 Bezelye bitkisi………...……….….……33
Çizelge 4-3 Biber bitkisi ………..…………...…….…….34
Çizelge 4-4 Buğday bitkisi ………..………..35
Çizelge 4-5 Çavdar bitkisi………..………..….….36
Çizelge 4-6 Çilek bitkisi………..…………...……37
Çizelge 4-7 Domates bitkisi………...……….…38
Çizelge 4-8 Fasulye bitkisi………...…………..……….……...39
Çizelge 4-9 Havuç bitkisi……….…….…….…41
Çizelge 4-10 Hıyar bitkisi………...….………….….42
Çizelge 4-11 Ispanak bitkisi………..………..…...43
Çizelge 4-12 Kabak bitkisi……….……….…...44
Çizelge 4-13 Karalahana bitkisi……….….………...45
Çizelge 4-14 Kavun bitkisi……….………....46
Çizelge 4-15 Lale bitkisi……….………...47
Çizelge 4-16 Marul bitkisi………..………48
Çizelge 4-17 Mısır bitkisi………...………49
Çizelge 4-18 Nergis bitkisi……….………..…...50
Çizelge 4-19 Nohut bitkisi………..………..…..………...51
Çizelge 4-20 Pancar bitkisi………..…..…...52
Çizelge 4-21 Patates bitkisi………..…..………....53
Çizelge 4-22 Patlıcan bitkisi………..………..…..………….54
Çizelge 4-23 Pırasa bitkisi……….………..…..…...55
Çizelge 4-24 Sarımsak bitkisi………...…..…………56
Çizelge 4-25 Soğan bitkisi……….………...…..………...57
Çizelge 4-26 Sümbül bitkisi……….………....…..…………59
Çizelge 4-27 Tütün bitkisi……….………...…..…………60
Çizelge 4-28 Yonca bitkisi………...…..…………61
Çizelge 4-29 Yulaf bitkisi………...…..………...62
Çizelge 4-30 Nematodların üreme oranları (ÜO) ve üreme oranlarına göre konukçuluk derecesinin gösterimi………..……..…..…..……...………...….63
viii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2-1 Dünya’ da 1994-2016 yılları arasında toplam kuru soğan üretim miktarları
(FAO, 2018) ………..………..………….……….3
Şekil 2-2 Dünya’ da 2016 yılında en fazla kuru soğan üretiminin gerçekleştirildiği ülkelerde üretim miktarları (FAO, 2018). ………..………….…………..4
Şekil 2-3 Türkiye’ de 2016 yılında önemli oranda kuru soğan üretimi yapılan bazı illerimiz (TÜİK, 2018). ……….……5
Şekil 2-4 Ditylenchus dipsaci’ nin mikroskobik görünümünün şematik çizimi……..…7
Şekil 2-5 Soğan sak nematodunun soğan yumrusu üzerinde zarar belirtileri……….….8
Şekil 2-6 Ditylenchus dipsaci’ nin dünya haritası üzerinde bulaşık olduğu yerlerin gösterimi………..………..9
Şekil 3-1 Nematodların toprak örneklerinden ayrılması………18
Şekil 3-2 Havuç kültürlerinin hazırlanması ve alt kültür yapım aşamalarının gösterimi……….….22
Şekil 3-3 Bitkilere inokulasyon için nematodların havuç kültürlerinden ayrılması ve nematod süspansiyonunun hazırlanması……….………..………...23
Şekil 3-4 Tohum ekimi için deneme toprağının hazırlanması ve bitkilerin büyütme dolabına yerleştirilmesi………..………..24
Şekil 3-5 Bitki tohumlarının ön çimlendirilmesi ve saksılara ekimi………...24
Şekil 3-6 Nematodların bitkilere bulaştırılması………...…………..25
Şekil 3-7 Bitki ağırlığının tartılması ve boyunun ölçümü işlemleri………...…25
Şekil 3-8 Bitki ve toprak örneklerinden nematodların ayrılması………..….26
Şekil 4-1 PF1-PR1 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)…...29
Şekil 4-2 PF2-PR2 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)…….29
Şekil 4-3 DdpS1- rDNA2 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)…….30
Şekil 4-4 DİTNF1- rDNA2 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)….…30 Şekil 4-5 H05-H06 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)…...31
Şekil 4-6 DipU F- DipU R primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)…….31
Şekil 4-7 18S-26S primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür)…….32
Şekil 4-8 Nematod bulaştırılmış ve bulaştırılmamış bezelye bitkilerinin görünümü….33 Şekil 4-9 Nematod bulaştırılmış ve bulaştırılmamış biber bitkilerinin görünümü…….34
Şekil 4-10 Nematod bulaştırılmış ve bulaştırılmamış buğday bitkilerinin görünümü...35 Şekil 4-11 Nematod bulaştırılmış ve bulaştırılmamış çavdar bitkilerinin görünümü…36
ix
Şekil 4-12 Nematod bulaştırılmış ve bulaştırılmamış çilek bitkilerinin görünümü.…..37 Şekil 4-13 Nematod bulaştırılmış ve bulaştırılmamış domates bitkilerinin görünümü..38 Şekil 4-14 Nematod bulaştırılmış ve bulaştırılmamış fasulye bitkilerinin görünümü ..40 Şekil 4-15 Havuç bitkilerinin görünümü……….…..……….41 Şekil 4-6 Nematod bulaştırılmış ve bulaştırılmamış hıyar bitkilerinin görünümü…....42 Şekil 4-17 Nematod bulaştırılmış ve bulaştırılmamış ıspanak bitkilerinin görünümü..43 Şekil 4-18 Nematod bulaştırılmış ve bulaştırılmamış kabak bitkilerinin görünümü….44 Şekil 4-19 Nematod bulaştırılmış ve bulaştırılmamış karalahana bitkilerinin
görünümü……….……….45 Şekil 4-20 Nematod bulaştırılmış ve bulaştırılmamış kavun bitkilerinin görünümü….46 Şekil 4-21 Nematod bulaştırılmış ve bulaştırılmamış lale bitkilerinin görünümü ..….47 Şekil 4-22 Nematod bulaştırılmış ve bulaştırılmamış marul bitkilerinin görünümü…..48 Şekil 4-23 Nematod bulaştırılmış ve bulaştırılmamış mısır bitkilerinin görünümü …..…………..………….………..………….………..………....49 Şekil 4-24 Nematod bulaştırılmış ve bulaştırılmamış nergis bitkilerinin görünümü...50 Şekil 4-25 Nematod bulaştırılmış ve bulaştırılmamış nohut bitkilerinin görünümü
……….………..………..………….………..…………..51 Şekil 4-26 Nematod bulaştırılmış ve bulaştırılmamış pancar bitkilerinin görünümü ..52 Şekil 4-27 Nematod bulaştırılmış ve bulaştırılmamış patates bitkilerinin
görünümü………..………..………..53 Şekil 4-28 Nematod bulaştırılmış ve bulaştırılmamış patlıcan bitkilerinin görünümü………..………..………..………54 Şekil 4-29 Nematod bulaştırılmış ve bulaştırılmamış pırasa bitkilerinin görünümü ………..………..………..55 Şekil 4-30 Nematod bulaştırılmış ve bulaştırılmamış sarımsak bitkilerinin görünümü………..………..………..…………..…. 56 Şekil 4-31 Nematod bulaştırılmış ve bulaştırılmamış soğan bitkilerinin
görünümü………..………..……….58 Şekil 4-32 Nematod bulaştırılmış ve bulaştırılmamış sümbül bitkilerinin
görünümü………..……..………..……….………….….59 Şekil 4-33 Tütün bitkisinin görünümü………..……….…60 Şekil 4-34 Nematod bulaştırılmış ve bulaştırılmamış yonca bitkilerinin
görünümü………..………..………..61 Şekil 4-35 Nematod bulaştırılmış ve bulaştırılmamış yulaf bitkilerinin görünümü………..………..………..………..……..62
x SİMGELER VE KISALTMALAR DİZİNİ Simgeler Açıklama cm cm³ da ha hg ml µl mm °C Kısaltmalar Santimetre Santimetreküp Dekar alan Hektar alan Hektogram Mililitre Mikrolitre Milimietre Santigrat derece Açıklama
ABD Amerika Birleşik Devletleri
CMC Karboksi Metil Seliloz
DNA Deoksiribo Nükleik Asit
EPPO European Plant Protection
Organization
Avrupa Bitki Koruma
Organizasyonu
FAO Food and Agricultur Organization
Uluslar arası Gıda ve Tarım Organizasyonu
GPS Coğrafi Bilgi Sistemi
PZR Polimeraz Zincir Reaksiyonu
1
1. GİRİŞ
Dünyada ve ülkemizde önemli bir üretim payına sahip olan soğan; yemeklerde, salatalarda kullanılmakla birlikte içinde barındırdığı kuvvetli antibiyotikler sayesinde sağlık konusunda da oldukça fazla yararlanılan ve dünyada en çok tüketilen sebzeler arasında yer almaktadır. Bu önemi son yıllarda ülkemizde dâhil olmak üzere diğer ülkelerde de soğan üretiminde artışa neden olmuştur. Dünyada 2012 yılında 82.498.299 ton, 2013 yılında 85.795.190 ton soğan üretilmiştir. Çin ve Hindistan dünyada en çok soğan üretimi yapan iki ülke olarak 2012 yılında ortalama 22.294.993 ton ve 2013 yılında 18.56.000 ton soğanı piyasaya sürmüştür. Bu iki ülkeyi Amerika Birleşik Devletleri ve İran İslam Cumhuriyeti takip etmekte ve Türkiye bu ülkelerden sonra dünya çapında en çok soğan üretimi yapan ülkeler arasında yer almaktadır.
Ülkemizin her bölgesinde soğan yetiştiriciliği için uygun şartlar bulunmasına rağmen en çok İç Anadolu, Doğu Karadeniz, Orta Karadeniz ve Marmara'da üretilmektedir. En fazla soğan üretimi yapan illerimiz ise Amasya'nın Suluova ilçesi ve Ankara'nın Polatlı ilçesidir. Bunlara ek olarak Hatay’ın Reyhanlı ilçesinde de soğan üretimi için ekim alanları artış göstermektedir. Eskişehir, Adana, Tokat, Bursa, Çorum, Tekirdağ, Aksaray, Balıkesir ve Konya önemli oranda soğan yetiştiriciliği yapan illerimizdir (TÜİK, 2018).
Soğan üretiminde verim kaybına neden olan birçok hastalık ve zararlı bulunmaktadır. Verim kaybına yol açan soğan hastalık ve zararlılarını; beyaz çürüklük hastalığı (Sclerotium cepivorum), septoria leke hastalığı (Septoria apiicola, Septoria licopersici), Kurşuni küf hastalığı (Botrytis cinerea), soğan mildiyösü hastalığı (Peronospora destructor), Soğan sürmesi hastalığı (Urocystis cepula), soğan psillidi (Bactericera tremblay), soğan sineği (Delisi antiqua), sebzelerde thripsler (Thrips tabaci ve Frankliniella occidentalis), pırasa güvesi (Aceolepiopsis assectella), telkurdu (Agriotes spp.), yaprak galeri sinekleri (Liriomyza trifolii, L. bryoniae, L.huidobrensis, Phytomyza horticola) ve son olarak soğan-sak nematodu (Dityenchus dipsaci) olarak sıralamak mümkündür (Anonim, 2013).
2
Nematoda şubesinde yer alan Ditylenchus Filipjev, 1936 cinsi birçoğu fungivor olmasına rağmen bitkilerde önemli derecede zarar veren bitki paraziti türleri de içerir. En önemli bitki paraziti türlerinden biri Ditylenchus dipsaci (Kühn, 1857) Filipjev, 1936’ dir. Soğan yetiştiriciliğinde % 60-80 (Nickle, 1991), % 65 (Mennan ve Ecevit, 2002) ve son yapılan çalışma ile % 41,5’ e varan (Yavuzaslanoğlu ve ark., 2015) verim kaybına neden olan Ditylenchus dipsaci mikroskobik, iplik formunda ve enine çizgili bir vücuda sahiptir.
Bu tez çalışmasında Ditylenchus dipsaci soğan ırkının daha önce literatürde bildirilmiş ve yurdumuzda yetiştirilen bazı bitki türlerine karşı konukçuluk reaksiyonları denenmiştir. Belirlenen bitkiler soğan, sarımsak, pırasa, domates, fasulye, bezelye, nohut, biber, patlıcan, marul, ıspanak, kabak, hıyar, kavun, çilek, patates, tütün, yonca, yulaf, buğday, mısır, sümbül, nergis, çavdar, havuç, karalahana, lale ve pancar olarak seçilmiştir. Soğan ve sarımsak ekim alanlarındaki bitki ve toprak örneklerinden ayrıştşrlan 4 farklı D. dipsaci popülasyonu seçilen bitkilere bulaştırılarak bitkilerde zarar belirtisi oluşturmasına ve bitkide üreme gösterip göstermediğine bakılarak üreme oranları hesaplanmıştır. Üreme oranlarına göre bitkiler konukçu değil, orta konukçu ve mükemmel konukçu olarak belirlenmiştir.
3
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI
Soğan önceleri Liliaceae ve Amaryllidaceae familyalarında yer alırken son yapılan çalışmalarda Alliaceae familyasına dahil edilmiştir (Brewster,1994; Schwartz ve ark., 1996; Vural ve ark., 2000).
Dünyada ve ülkemizde en çok üretilen sebzeler arasında domates ve patates üretiminden sonra üçüncü sırada yer almaktadır (Anonim, 2011). 1990’ lı yıllarda 35-40 milyon ton olan kuru soğan üretimi 2016 yılına gelindiğinde 93 milyonu geçmiştir (FAO, 2018, Şekil 2-1).
Şekil 2-1 Dünya’ da 1994-2016 yılları arasında toplam kuru soğan üretim miktarları (FAO, 2018). Çin ve Hindistan dünyada en çok soğan üretimi yapan iki ülke olarak 2012 yılında ortalama 22.294.993 ton ve 2013 yılında 18.560.000 ton soğanı piyasaya sürmüştür. 1994 – 2016 yılları arasındaki verilere göre soğan üretiminde ilk sırayı Çin almakta bu ülkeyi Hindistan ve ABD takip etmekte Türkiye ise bu ülkelerden sonra 4.sırada yer almaktadır (FAO, 2018, Şekil 2-2). FAO verilerine göre 2016 yılında Dünya’da 4.955.432 ha da 93.168.548 ton soğan üretimi olmuştur (FAO, 2018). İki bin on yedi yılında Türkiye’ de 2.131.513 ton kuru soğan üretimi gerçekleştirilmiştir (TUİK, 2017).
0 10.000 20.000 30.000 40.000 50.000 60.000 70.000 80.000 90.000 100.000 1994 2000 2005 2010 2015 2016 B in to n
4
Şekil 2-2 Dünya’ da 2016 yılında en fazla kuru soğan üretiminin gerçekleştirildiği ülkelerde üretim miktarları (FAO, 2018).
İrlanda 656.250 hg/ha ile soğan üretiminde en fazla verim alan ülke olmuş bu ülkeyi 608,095 hg/ha ile Kore Cumhuriyeti, 545.450 hg/ ha ile Amerika Birleşik Devletleri, 532.326 hg/ ha ile Avustralya ve 524.974 hg/ ha ile İspanya takip etmiştir. Türkiye'de ise verim 2013 yılında 298.583 hg/ ha ile üretime göre verimin düşük olduğu görülmektedir (FAO, 2018).
Soğan gündüzleri sıcak ve kurak, geceleri ise serin karasal iklimi sevmesine rağmen serin iklimlerde üretiminde verimin yüksek olduğu bir sebzedir (Beşirli, 2002; Anonim, 2011).
Soğan yetiştiriciliğinde vazgeçilmez unsurlar arasında sıcaklık ve gün uzunluğu gelmektedir. Kök ve yaprakların gelişimi sırasında serin bir iklim ve ortalama 12-13°C sıcaklık ister. Baş bağlamaya başladıktan sonra 18-20°C ve oluşan başların olgunlaşması için istediği sıcaklık 23-27°C ' ye kadar yükselir. Soğan başlarının oluşumu ve gelişimi sırasında ihtiyaç duyduğu gün uzunluğu gelişim evrelerine göre 8 ila 15 saat arasında değişmektedir (Anonim, 2011).
0 2.000 4.000 6.000 8.000 10.000 12.000 14.000 16.000 18.000 20.000
Çin Hindistan Amerika Birleşik Devletleri
Türkiye İran Pakistan Rusya Mısır Sudan Brezilya
B
in
to
5
Toprak isteği besin maddesi yönünden zengin, hafif bünyeli topraklardır (Vural ve ark., 2000; Beşirli, 2002; Anonim, 2013). Kumlu-tınlı topraklarla birlikte humusça zengin, killi-kumlu topraklarda da iyi ürün alınmaktadır. Ancak soğan yüksek asitliğe karşı hassas olduğu için üretim alanındaki asitlik pH' sının 6-6,5 olması gerekmektedir (Anonim, 2013).
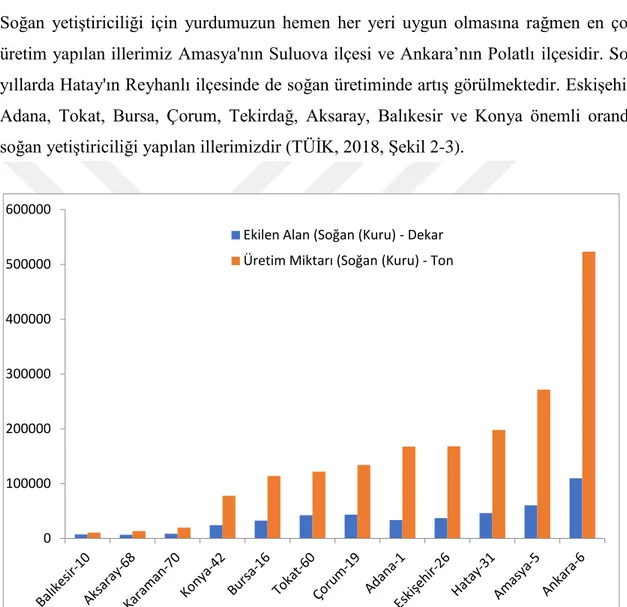
Soğan yetiştiriciliği için yurdumuzun hemen her yeri uygun olmasına rağmen en çok üretim yapılan illerimiz Amasya'nın Suluova ilçesi ve Ankara’nın Polatlı ilçesidir. Son yıllarda Hatay'ın Reyhanlı ilçesinde de soğan üretiminde artış görülmektedir. Eskişehir, Adana, Tokat, Bursa, Çorum, Tekirdağ, Aksaray, Balıkesir ve Konya önemli oranda soğan yetiştiriciliği yapılan illerimizdir (TÜİK, 2018, Şekil 2-3).
Şekil 2-3 Türkiye’ de 2016 yılında önemli oranda kuru soğan üretimi yapılan bazı illerimiz (TÜİK, 2018). Soğan yetiştiriciliğinde azalan verimin nedenleri arasında birçok hastalık ve zararlılar bulunmaktadır. Soğan zararlıları arasında yer alan ve soğan sak nematodu olarak da bilinen Ditylenchus dipsaci dünya genelinde yayılış gösteren, farklı konukçularda bulunabilen, çok fazla ırka sahip, olumsuz koşullara karşı oldukça dayanıklı bir türdür.
0 100000 200000 300000 400000 500000 600000
Ekilen Alan (Soğan (Kuru) - Dekar Üretim Miktarı (Soğan (Kuru) - Ton
6
Bu zararlı ya ait ilk kayıt Schwartz tarafından 1855 yılında çavdar, yulaf ve üçgülde olmakla birlikte müşahede etmemiştir. Kühn (1857)' de ilk olarak D. dipsaci' yi deve dikeninde tanımlamıştır (Ecevit ve Akyazı, 2010).
Soğan sak nematodu soğanların yapraklarında kıvrılma ve biçimsizleşmelere, merdivenvâri bir yapının oluşmasına, köklerde saçaklanmaya ve bodurlaşmaya, soğan yumrularında çürüme ve gelişim bozukluğuna neden olur. Soğan yumrusunun dış pulcukları anormal gelişir, çatlar ve yumru pazar değerini tamamen yitirebilir (Decker, 1981; Thorne, 1961). Soğanlarda 400 cm3 toprakta 10 larva bulunmasının ekonomik zarar eşiği olduğu saptanmıştır (Seinhorst, 1956).
Genel olarak soğan sak nematodu; iplik formunda olup vücut enine çizgilidir. Çizgi genişliği 1 mikrondur. Lateral saha 4 çizgilidir. Deiridler genellikle boynun bazal tarafına yakındır. Scletorize olmuş bir baş çatısı vardır. Stilet az gelişmiştir. Kuyruk küçük ve koniktir. Bağırsak çok küçük valf aparatı ile özofagus lümenine bağlıdır. Ovaryum uzamıştır, bazen median özofagus bulbuna kadar uzanır. Testis uzamıştır, çoğalmanın olduğu kısa bir mesafe hariç spermatocytler tek sıra halinde dizilmiştir (Şekil 2-4). Bütün gelişme dönemleri büyüme sonuna kadar konukçuda bulunur. Generasyon sayısı konukçu dokusunun etli ve besleyici olmasına, ışığa, rutubet ve zirai uygulamalara göre değişir. Normal koşullarda 45-73 gün yaşarlar. Hayat devrini 15 derecede 20 günde tamamlar. Dişiler 200 ila 500 yumurta bırakır. Yumurtalar 70-100 mikron uzunluğunda ve 30- 40 mikron genişliğindedir. Uygun şartlarda yumurta içinde birinci dönem larva ve çıkmaya hazır larva dönemlerinin hepsi görülebilir. Yumurtadan çıkan 2. dönem genç larva 0,3 mm uzunluğundadır. İkinci ve 3. dönem larva dönemlerini çabuk tamamlarlar. Genital premordium vücudun ortasında belirgin hale gelmiş olur. Olgunluk öncesi larva dönemi olan bu form aynı zamanda infektif larva dönemidir. Uygun şartlar oluşana kadar dormant durumda kalabilir. Yumrulu bitkilerde pamuklu yapılar oluştururlar ve bu yumrular toprağa dikildiği zaman 4.dönem infektif larvalar ortaya çıkar (Ecevit ve Akyazı, 2010).
7
Şekil 2-4 Ditylenchus dipsaci’ nin mikroskobik görünümünün şematik çizimi
İnfekteli bitkilerin büyümeleri sırasında anormal bir soğan yapısı oluştuğu görülür. Bitkilerin toprak üstü kısımlarında ki belirtileri açıkça görülmektedir. Yaprakların uç kısımlarında kırılmalar oluşur. Kısa ve kalın kalan yapraklar kahverengi veya sarımsı bir renk alır. Mevsimin ilerlemesiyle kök boğazı kısmında kalınlaşma ve yumuşama meydana gelir. Özellikle soğan saplarını saran zarda sümüksü bir yapı oluşur. Soğan yumruları kesilince yumuşak, ağırlığı beklenilen ve olması gerekenden daha az, kokuşmuş ve çatlamış (Şekil 2-5) olduğu görülür (Ecevit ve Akyazı, 2010).
8
Şekil 2-5 Soğan sak nematodunun soğan yumrusu üzerinde zarar belirtileri
Soğan sak nematodu özellikle ılıman bölgelerde zarara neden olmaktadır. Serin ve rutubetli ortamlar bu nematodun zararı için çok uygundur (Anonim, 2011).
Soğan yaprakları şişmiş, eğilmiş, bükülmüş bir görünüme sahiptir. Birçok bitki ölür ve bulaşık soğanlar hasattan sonra çürürler. Nergis yaprakları kıvrılmış, bükülmüş ve üzerinde siğil olarak tabir edilen karakteristik açık renkli şişkinliklere sahiptir. Çok bulaşık soğanlar enine kesildiğinde kahverengi halkalar açıkça görülür. Ülkemizde soğan ve soğanlı süs bitkilerinde % 5-100 oranında zarar meydana getirebilmektedir (Anonim, 2011).
Patateste de zarara neden olmaktadır, patates çürüklük nematodu olan Ditylenchus destructor 'un zararına benzer belirtiler meydana getirir. Ancak bazen tüm yumruyu kaplayacak kadar fazla ve çürüklük nematodun daha derin lezyonlar oluşturur. Genellikle yumru üzerinde çatlak görülmez. Soğan sak nematodu patates bitkisinin toprak üstü aksamında zararlıdır. Yumruda herhangi bir belirti oluşturmaksızın bitkide tipik bodurluk, kalınlaşma ve çarpıklıklar meydana getirebilir. Yapraklarda lekeler oluşturur. Patatesteki zararı Phoma solonicola adlı fungusun bulunmasıyla artış gösterir (Anonim, 2011).
Soğan sak nematodunun tütün bitkisindeki zararı gövdenin alt tarafından girip gövde de kırılma bodurlaşma ve deformasyonlar oluşturması şeklinde görülür. Marul tarlaları içinde öbek öbek çürüme lerle birlikte bitki gövdesinde bodurluk ve kıvrıklık görülür.
9
Nemli koşullarda zararın arttığı ve bütün bitkinin kuruduğu bilinir. Fasulyede şişkinliklere, gövde deformasyonlarına neden olur. Dokuda lezyonlar oluşturur bu lezyonlar kırmızı-kahverengi iken sonraları siyaha döner. Yeni oluşan dallar koyu kahverengi bir görünümdedir. Ağır enfeksiyonlarda yaprak ve yaprak sapında çürümeler görülür ve gövde kısa kalır. Bu durum yan gövde oluşumunu uyarır. Fasulye tohumları daha koyu, küçük boyutlu ve çürümüştür. Fasulyedeki zararlar genelde dev ırklar tarafından yapılır (Sikora ve Greco, 1990).
Mennan (2001), soğan ve sarımsak bitkilerinde yaprak kıvrılmaları ve renk açılmaları olduğunu, fasulye ve domates bitkilerinde belirgin olarak gelişim geriliği görüldüğünü belirtmiştir.
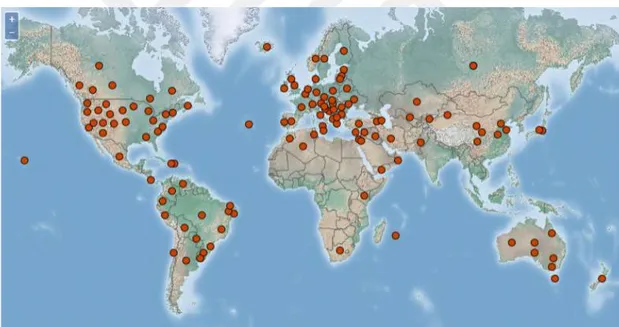
Zararlının dünya üzerinde yayılış gösteren kozmopolit bir tür olduğunu farklı araştırmacılar tarafından sunulan bilgiler göstermektedir (Anonim, 2018; Şekil 2-6).
Şekil 2-6 Ditylenchus dipsaci’ nin dünya haritası üzerinde bulaşık olduğu yerlerin gösterimi
Rusya’nın Kharkov bölgesinde yoğun olarak çilek, soğan ve salatalıklarda bulunduğu belirtilmektedir (Zinovev ve Barabashova,1980).
10
Çoğunlukla soğan ve sarımsak alanlarında varlığı bildirilen araştırmalar arasında Kazakistan’ın soğan ve sarımsak üretimi yapılan alanların neredeyse tamamının D.dipsaci ile bulaşık olduğunu bildirmektedir (German ve Sagitov, 1983).
Rusya’nın Chernozom bölgesinde yine soğan ve sarımsak ekim alanlarında nematodun varlığı bildirilmiştir (Shavrov, 1983).
Kuroki (1987), Japonya’da, Wang (1991), Çin'de soğanlarda, Silva ve Carneiro (1992), Brezilya’da sarımsak ekim alanlarında bu nematoda rastladıklarını bildirmişlerdir. D'errico ve ark. (1991), İtalya’da sogan, maydanoz ve kerevizde bu nematoda rastladığını bildirmişlerdir.
Ditylenchus dipsaci 500 bitki türünde 30’dan fazla ırka sahiptir (Saturhan ve Brzeski, 1991). Bu nedenle D. dipsaci tür kompleksi olarak adlandırılmaktadır. Son olarak gerçekleştirilen taksonomik çalışmalarda D. dipsaci türü iki gruba ayrılmıştır. Birincisi; D.dipsaci sensu stricto veya normal boyutlu tür olarak adlandırılan diploid özellikte bireyleri içeren gruptur. Diğer grup poliploid özellikte bireyleri içeren 6 alt gruba ayrılmıştır. Vicia faba bitkisinden elde edilen Ditylenchus sp. B, Cirsium setosum bitkisinden elde edilen Ditylenchus sp. C , Pilosella cinsi bitkilerle ilişkili olan Ditylenchus sp. D, Crepis praemorsa bitkisinden elde edilen Ditylenchus sp. E, Pilosella ve Leontodon cinsi bitkilerle ilişkili olan Ditylenchus sp. F ve Plantago maritima bitkisinden elde edilen Ditylenchus sp. G gruplarıdır (Subbotin ve ark.,2005).
Bakla bitkisinden elde edilen Ditylenchus sp. B grubundan sonraki çalışmalarla Ditylenchus gigas (Vovlas ve ark., 2011) ve Ditylenchus sp. C grubu ise Ditylenchus weischeri (Chizhov ve ark., 2010) türü olarak ayrılmıştır.
Yurdumuzda bu nematod ile ilgili ilk bildiri Yüksel (1958) tarafından verilmiştir. Yüksel (1958) Sivas (Merkez), Aksaray, Adana (Merkez), Ankara (Ayaş) ve Nevşehir (Ürgüp)' de rastlanan ırkın soğan ırkı olduğunu belirtmiştir.
Kastamonu Taşköprü ilçesinde kenevir ekim alanlarında (Tunçdemir, 1983), Karadeniz bölgesinde çilek ekim alanlarında (Enneli ve Öztürk, 1989) D. dipsaci varlığı bildirilmiştir.
11
Konya Merkez ve Çumra ilçesi, Karaman Merkez ve Ermenek ilçesi, Nevşehir Merkez, Derinkuyu, Gülşehir ve Ürgüp ilçelerinden alınan 27 adet örnekte ve tüm örneklerin içinde % 23,7 oranında D.dipsaci olduğu saptanmıştır (Öztürk ve Ökten, 1996).
Ditylenchus dipsaci sensu stricto grubunda yer alan bireyler filogenetik olarak birbirlerine çok yakın gruplar olarak yer almaktadırlar ve alt tür ayrımına gidilememiştir (Subbotin ve ark., 2005). Bu nematodların sınıflandırılması bitkilerin konukçuluk durumuna göre ırk düzeyinde yapılmaktadır. Bu grup içerisinde ekonomik olarak önemli bitki türlerinde de üreyebilen 30’dan fazla ırk olduğu ortaya konmuştur (Sturhan ve Brzeski, 1991).
Kotthoff (1937), İtalya’da kenevir, havuç ve hıyar ekim alanlarında yoğun olarak bulunan D.dipsaci' nin çavdar ırkı olduğunu saptamıştır.
Caubel (1968), Fransa’da farklı familyalardan 22 bitkide hangi ırkın bulunduğunu tespit etmiştir.
Janssen (1994) tarafından D. dipsaci sensu stricto grubu içerisinde bulunan nematodların, elde edildikleri bitkiye göre 8 ırkı tanımlanmış ve bu ırklara 17 bitki türünün (adi yonca, kızıl yonca, beyaz yonca, lale, sümbül, nergis, soğan, yulaf, çavdar, şeker pancarı, patates, mısır, bezelye, fasulye, havuç, çilek ve tarak otu) konukçuluk durumlarına dair raporlar derlenmiştir. Janssen (1994)'e göre belirlenen ırklar; adi yonca (Medicago sativa, Fabaceae), kızıl yonca (Trifolium pratense, Fabaceae), yulaf (Avena sativa, Poaceae), pancar (Beta vulgaris, Amaranthaceae), nergis(Narcissus ssp., Amaryllidaceae), lale (Tulipa ssp., Liliaceae) ve soğan (Allium cepa, Alliaceae)' dır. Irkların konukçu spektrumları çok geniştir ve bir bitki türü birden fazla ırk için konukçu olabilmektedirler. Ditylenchus dipsaci eşeyli üreyen bir nematod olduğu için ırklar arası üremelerde söz konusu olabilmektedir (Wright ve Perry, 2006).
Farklı araştırmacılar tarafından elde edilen D.dipsaci ırklarının konukçuluk durumlarında çok değişken sonuçlar bulunmaktadır. Bu durumun nedeni farklı araştırıcılar tarafından farklı bitki türlerinin kullanılmış olmasına bağlı olarak görülebilecek dayanıklı reaksiyonlara, karışık nematod popülasyon ve ırklarının
12
kullanımına, nematodların patojenitesi üzerine çevre koşullarının etkisine, nematod inokulasyonunun başarısız olması gibi durumlara bağlanabilir.
Seinhorst (1957) konukçu denemesi kurarak zararlının farklı konukçularda beslenen ırklarını ortaya koymuş 9 değişik bitki çeşidi kullanarak D. dipsaci’ yi 11 farklı ırka ayırmıştır. Buna göre soğan ırkının konukçuları soğan, sarımsak ve bezelye olarak bildirilmiştir.
Southey (1957), lale, sümbül ve nergis ırklarının 7 değişik bitkideki reaksiyonlarını karşılaştırmıştır. En geniş konukçu dizisine sahip olan ırkın lale ırkı olduğunu, sümbül ırkının denemede kullanılan bitkilerden sadece sümbülde ürediğini ve yulaf bitkisinin her üç ırk içinde konukçu olmadığını saptamıştır.
Thorne (1961)'ye göre soğan ırkının konukçuları çeltik, sümbül, nergis, deve dikeni ve maydonuzdur.
Shubina (1992), soğan ırkının mısır bitkisinde beslenemediğini ancak çeltik ve bezelye üzerinde ise beslenip üreyebildiğini belirtir.
Greco ve Vito (1994)' e göre Leguminose familyası içinde bakla, bezelye ve mercimek D.dipsaci’ den çok fazla etkilenmektedir.
Brezilya’da sarımsaktan sonra dikilen soğanlarda D. dipsaci zararının çok yüksek olduğu ve ekim nöbetinde mısır, soya fasulyesi, buğday ve fasulye kullanılabileceği belirtilmiştir (Becker, 1993).
Sarımsak izolatlarının konukçuluk durumlarını belirlemeye yönelik gerçekleştirilen bir çalışmada nematodların soğan ve sarımsakta hayat devrini tamamladığı, yabani hindibada (Cichhorium intybus) bitkisinde yalnızca başlangıçta verilen erginleri hayatta kaldığı, pırasa ve ıspanakta ise hiç nematodun yaşamadığı tespit edilmiştir (Douda, 2005).
Yurdumuzda Amasya Suluova ilçesinde soğandan elde edilen D.dipsaci izolatlarının bölgede çiftçiler tarafından en fazla yetiştirilen bitki türlerinde konukçuluk durumu Mennan (2001) tarafından araştırılmıştır. Gerçekleştirilen çalışmada bulaştırma yapılan bitkilerden, soğan, sarımsak, domates ve fasulyede nematodun zarar belirtisi görülmüş,
13
kabak, karalahana, ıspanak, biber, hıyar ve buğday bitkilerinde zarar belirtisi görülmemiştir.
Soğan ırkı konukçuları arasında çavdar, sümbül, nergis, deve dikeni ve yabani havucun olduğu, sarımsak popülasyonlarının arazi şartlarında yemlik otu ve maydanozda, serada ise kerevizde çok zararlı olduğu bildirilmektedir. Ayrıca yonca ve kırmızı üçgülde de zarar yaptığı ve çileğin en önemli konukçusu olduğu belirtilmektedir (Ecevit ve Akyazı, 2010).
Soğan ırkı için denenen bitkilerden sadece ana konukçu soğan, bezelye ve fasulyenin iyi konukçu olduğu; adi yonca ve lalenin ise konukçu olmadığı konusunda araştırmalarda mutabakat vardır. Ancak havuç, çilek, tarak otu, kızıl yonca, beyaz yonca, sümbül, nergis, yulaf, çavdar, şeker pancarı, patates ve mısıra ait olarak hem iyi konukçu hem zayıf konukçu hem de konukçu olmadığına dair kayıtlar vardır (Janssen, 1994).
Bu bilgiler D.dipsaci' nin konukçu spektrumunun çok geniş ve önemli oranlarda zarara neden olarak verim kalite ve miktarında düşüşe neden olduğunu açıkça göstermektedir. Soğan üretiminde verimi arttırmak için hastalık ve zararlılara karşı mücadelede etkili yöntemlerin kullanılması gerekmektedir.
Toprakta enfeksiyon olduğu zaman fümigasyon ile mücadele edilebileceği önerilmekle birlikte bu yöntemde kullanılan fumigantların soğanda çok toksik olduğu belirtilmektedir (Ecevit ve Akyazı, 2010). EPPO A2 karantina listesinde (EPPO, 2018) yer alan D. dipsaci' nin mücadelesinde başarılı olmak için, bulaşık materyallerin temiz yerlere taşınmaması büyük önem arz etmektedir.
Temiz toprağa temiz tohum kullanılmalıdır. Sel ve yağmur sularının önüne geçme çareleri araştırılmalı, soğan ve soğanlı bitki köklerinin topraklardan arındırılması akarsularda yapılmamalıdır. Bulaşık yerlerde kullanılan toprak işleme aletleri temizlenmeden kullanılmamalıdır. Eğer varsa dayanıklı çeşitlerin kullanılması önerilebilecek önlemler arasında yer almaktadır (Anonim, 2013).
Mücadele yöntemlerinin hem büyük tarla koşullarında kolay uygulanabilmesi hem de mücadele sırasında üretimin de devam ettirilebilmesi ekonomik olarak büyük önem taşımaktadır. Bunun için en uygun kontrol yöntemi olarak rotasyon uygulamaları
14
önerilmektedir. Rotasyonda kullanılacak olan bitkiler soğan sak nematoduna karşı hassas olmamalı, nematodun yayılmasına fırsat vermeyen uygun sulama teknikleri ile sulama yapılmalıdır. Rotasyon toprak tipine ve nematodun yaygınlığına göre 2-4 yıl arasında uygulanmalıdır (Anonim, 2013).
Bu nedenle konukçu olmayan bitkilerle rotasyon üreticilere önerilebilecek pratik ve ekonomik bir yöntem olması nedeniyle büyük önem taşımaktadır.
Rotasyona sokulacak olan bitkiler D. dipsaci için konukçu olmamalı, nematod popülasyonunu azaltmaya yardımcı olmalı aynı zamanda bölge koşullarında yetiştirilebilen bir çeşit olmalıdır.
Bu nedenle rotasyon için uygun olan bitkilerin bilinmesi gerekmektedir. Bu bitkilerin belirlenebilmesi için son derece önemli olan konukçu spektrumunun belirlenmesi için uygulanan bu tez çalışması üreticilere rotasyonun pratikte uygulanabilmesi için temel çalışma niteliği taşımaktadır.
15
3. MATERYAL VE METOT
3. 1. Bitki Türleri
Denemede kullanılan bitkiler daha önceki çalışmalarda denenmiş (Janssen, 1994; Mennan, 2001; Douda, 2005), Türkiye iklim ve toprak özelliklerinde yetiştirilen ve soğan bitkisi ile rotasyona sokulabilecek bitkiler olarak seçilmiştir. Bu bitkiler domates, biber, patlıcan, soğan, sarımsak, pırasa, patates, marul, pancar, havuç, kabak, hıyar, kavun, fasulye, nohut, bezelye, lale, sümbül, nergis, çilek, karalahana, ıspanak, çavdar, yulaf, mısır, buğday, yonca, tütün ve tarak otu olarak seçilmiş ancak tarak otu çimlendirilemediği için değerlendirmelere dahil edilememiştir. Bu bitkilerin piyasada bulunan standart çeşitleri temin edilmiştir (Çizelge 3-1).
16 Bitki Sıra No Bitki Türü
Bitki Çeşidi Elde Edildiği Ticari Firma, İli
1 Bezelye Utrillo Arzuman Tohum, Konya 2 Biber Çetinel150 Arzuman Tohum, Konya
3 Buğday Çeşit1252 Karaman
4 Çavdar Yerel çeşit Karaman
5 Çilek Fide Karaman
6 Domates Kokteyl Ekoherb Asgen Tarım, İstanbul
7 Fasulye Dermason Karaman
8 Havuç Nantes Paşa Tohumculuk, Balıkesir 9 Hıyar Beith Alpha Arzuman Tohum, Konya 10 Ispanak Matador Arzuman Tohum, Konya
11 Kabak Pelin Arzuman Tohum, Konya
12 Karalahana Morris İntfa Tohum, Konya
13 Kavun Ananas Arzuman Tohum, Konya
14 Lale Asya lale Asya lale, Konya
15 Marul Yedikule5701 Arzuman Tohum, Konya 16 Mısır Dane mısır Dekalb, Konya
17 Nergis Asya lale Asya lale, Konya
18 Nohut Sarı98 Karaman
19 Pancar Geleneksel Arzuman Tohum, Konya 20 Patates Yerel çeşit Karaman
21 Patlıcan Balıkesir76 Ekoherb Asgen Tarım, İstanbul 22 Pırasa İnegöl İntfa Tohum, Konya
23 Sarımsak Yerel çeşit Karaman
24 Soğan Banko İntfa Tohum, Konya
25 Sümbül Asya lale Asya lale, Konya
26 Tütün Basma Ege Tarımsal Araştırma Enstitüsü Müdürlüğü, İzmir
27 Yonca Bilensoy80 Beyza Tarım Ürünleri, Konya 28 Yulaf Yerel çeşit Karaman
Çizelge 3- 1 Nematoda karşı konukçuluk durumları belirlenen bitki türleri, çeşit ve elde edildiği ticari firma bilgileri.
3. 2. Denemede Kullanılan Nematodların Elde Edilmesi 3. 2. 1. Bitki ve Toprak Örneklerinin Toplanması
Konukçu testleme çalışması için kullanılacak olan nematodlar, D. dipsaci ile bulaşık olduğu belirlenen ve soğan ekimi yapılan tarlalardan elde edilen bitki ve toprak örneklerinden ayrılmıştır. Deneme için nematodların toplanması amacıyla toprak örnekleri, her bir tarladan 3-4 hat şeklinde ve zig zag çizilerek 10-15 noktadan toprak
17
yüzeyinden 20 cm derinlikten 2 cm çapında toprak sondası ile alınmış ve birleştirilerek yaklaşık 2 kg' lık paçal örnek oluşturulmuştur. Aynı noktalardan alınan soğan bitkileri de ayrı ayrı poşetlere konulmuş ve gerekli etiketleme yapılmıştır. Konukçu testleme çalışmasında 4 lokasyondan elde edilen nematod populasyonları kullanılmıştır. Nematodların elde edildiği lokasyon bilgileri Çizelge 3- 2’ de sunulmuştur.
Kültür No
Coğrafi
Bölge İl İlçe Enlem Boylam
İzolasyon Materyali
1
Orta
Anadolu Karaman Merkez 37,11017 33,11239 Soğan 2
Orta
Anadolu Karaman Merkez 37,10351 33,117 Sarımsak 3
Orta
Anadolu Karaman Merkez 37,10127 33,11345 Soğan 4 Karadeniz Amasya Merzifon 40,76390 35,48726 Soğan Çizelge 3-2. Nematod kültürlerinin oluşturulduğu coğrafi bölge, il, ilçe, GPS lokasyonu ve izolasyon
materyali bilgisi
3. 2. 2. Bitki ve Toprak Örneklerinden Nematodların Ayrılması
Toplanan örneklerden Baermann Huni yönteminden modifiye edilmiş petri kabı yöntemi kullanılarak nematodlar ayrılmıştır (Whitehead ve Hemming, 1965; Hooper, 1986a). Bu yöntemde geniş petrilerin üzerine yerleştirilen eleklere bitkiler 3-5 cm olacak şekilde doğranarak ve topraklar da elek üzerine bir peçete yerleştirildikten sonra 100 g konulmuş ve petri kaplarının hacmine göre yeterince çeşme suyu dökülmüştür. Bitki örnekleri bir gece ve toprak örnekleri de iki gece olacak şekilde petrilerde bekletilmiş ve namatodların suya geçişi sağlanmıştır. Bekletilme sürelerinin sonunda petrilerdeki sular 100 ml'lik mezürlere boşaltılmıştır. Mezürlere içinde en az iki saat bekletilerek nematodların dip kısma çöküşü sağlanmıştır. Daha sonra mezürün üst kısmından sifon yapılmış ve su miktarı 10 ml'ye kadar azaltılmıştır. Nematodların bulunduğu 10 ml'lik sular 15 ml'lik santrifüj tüplerine aktarılmış ve yine iki saat bekletilerek nematodlar dip kısımda toplanmış ve 1 ml olacak şekilde üst kısmından suları azaltılmıştır (Şekil 3-1). Tüp içinde kalan 1 ml su mikropipet yardımıyla iyice karıştırılarak homojen bir dağılım sağlanarak 50 mikrolitre örnek alınarak nematod sayımı ve cins düzeyinde ayrımı yapılmıştır.
18 Şekil 3-1 Nematodların toprak örneklerinden ayrılması
3. 2. 3. Nematodların Tür Teşhisi
Kültürlerden ayrılan nematodların morfolojik, morfometrik ve moleküler olarak tür teşhisleri gerçekleştirilmiştir.
3. 2. 3. 1. Nematodların Morfolojik Tür Teşhisi
Nematodların morfolojik ve morfometrik tür teşhisleri için, kültürlerden elde edilen nematod solusyonlarında bulunan nematodlar Hooper (1986b)’ a göre sabit preparat haline getirilmiştir. Bu amaçla, 1 ml su içerisindeki nematodlar 65 oC’ deki su banyosu içinde 2 dakika bekletilerek öldürülmüş ve 1 ml TAF solüsyonu (7 ml % 40’ lık formaldehid + 2 ml trietanolamin + 91 ml saf su) eklenip 2 gün bekletilerek fikse edilmiştir. Fixe olmuş nematodlar 5 cm çapında plastik petrilerde havada kurutulmuştur. Kurumuş nematodların üzerine sırasıyla 20 kısım % 95’ lik etanol, 1 kısım gliserin ve 79 kısım saf su içeren Seinhorst solüsyonu-I ve 95 kısım % 95’ lik etanol ve 5 kısım gliserin içeren Seinhorst-II eklenerek tekrar kurutulmuştur. En son aşamada kuru nematod örnekleri üzerine saf gliserin içine alınarak lam üzerinde sabitlenmiştir.
19
Soğan sak nematodunnun morfolojik teşhisinde nematodun stylet ve kuyruk yapısındaki morfolojik özellikler ile ovaryum yapısı, lateral alandaki deri katlantılarının sayısı göz önünde bulundurulmuştur (Andrassy, 2007). Elde edilen dişi bireylerin boy (L), stylet, özefagus, kuyruk, vulva, anüs, post uterine sak uzunluğu ve vücudun en geniş yerindeki genişlik değerleri ölçülmüştür. Ölçüm değerlerinden a (vücut uzunluğu/ maksimum vücut genişliği), b (vücut uzunluğu/ özefagus uzunluğu), c (vücut uzunluğu/ kuyruk uzunluğu), c’ (kuyruk uzunluğu/ anüs veya kloaktaki kuyruk çapı), V (başın son kısmı ile vulva arasındaki mesafe/ vücut uzunluğu) ve V’ (başın sonundan vulvaya olan uzaklık/ başın sonundan anüse olan uzaklık X 100) oranları hesaplanmıştır (Sturhan ve Brzeski, 1991; Brzeski, 1991; Siddiqi, 2000; Mollow vd., 2012).
3. 2. 3. 2. Nematodların Moleküler Tür Teşhisi
Kültürlerdeki nematodların moleküler tür teşhisleri Karamanoğlu Mehmetbey Üniversitesi Mühendislik Fakültesi Biyomühendislik Bölümü Araştırma Laboratuvarında Doç. Dr. Özlem ATEŞ SÖNMEZOĞLU tarafından gerçekleştirilmiştir.
Moleküler tür teşhisi için, bitki ve toprak örneklerinden ayrılan nematod süspansiyonundan Ditylenchus spp. olarak mikroskop altında ayrılan nematodlar moleküler teşhis çalışmaları için PZR tüpleri içinde toplanmıştır. Elde edilen nematodlar DNA izolasyonu ve türe özgü primerler ile PZR işlemine tabi tutulmuştur.
3. 2. 3. 2. 1. DNA İzolasyonu
Her bir nematod popülasyonundan elde edilen nematod örneklerinden DNA izolasyonu, Holterman vd. (2006) tarafından belirtilen prosedüre göre gerçekleştirilmiştir. İzolasyonda kullanılan solüsyonların içeriği aşağıda verilmiştir.
Lizis Tampon Eksi (WLB-): 10-15 ml steril bir plastik tüp içerisine 2 ml 1 M NaCl + 2 ml 1 M Tris-HCl (pH 8) + 5,5 ml steril su eklenerek vortekslenir. 4 °C’ de 1 ay muhafaza edilebilir. Lizis Tamponu Artı (WLB +): 1,5-2 ml eppendorf tüpü içerisine, 950 μl WLB- + 10 μl beta-mercaptoethanol + 40 μl 20 mg / ml Proteinaz K ekleyip vortekslenir ve -20 ºC’ de 1 ay muhafaza edilebilir. DNA İzolasyonu için PZR tüplerinde bulunan nematod örneklerinin üzerlerine; 25 μl steril su ve 25 μl WLB+
20
eklenerek, 65 °C'de 1,5 saat, ardından 99 °C'de 5 dakika inkübasyona bırakılır. Süre tamamlandığında DNA izolasyonu gerçekleştirilmiş olmaktadır. DNA izolasyonu yapılan örnekler +4° C’de muhafaza edilmektedir.
3. 2. 3. 2. 2. PZR Reaksiyonu
Ekstrakte edilen DNA’ lar Polimeraz Zincir Reaksiyonu (PZR) ile çoğaltılıp elde edilen PZR ürünleri agaroz jelde koşulmuş ve görüntülenmiştir. Moleküler taramalarda 7 adet primere (PF1-PR1, PF2-PR2, DdPS1-rDNA2, DitNF1-rDNA2, H05-H06, 18S-26S ve DipU-F-DipU-R) ait bilgiler Çizelge 3-3’ de verilmiştir.
Çizelge 3-3. Çalışmada kullanılan SCAR, SSR ve RFLP markörlerine ait primer dizisi, D. dipsaci için beklenen bant büyüklüğü, hedef bölge ve yayınlandığı kaynak makale bilgileri.
Bu primerlere ait kaynak makalelerde belirtilen PZR koşulları ve miktarları optimize edilerek moleküler çalışmalar gerçekleştirilmiştir (Çizelge 3-4).
Primer Adı
Primer Dizisi
(5’--- 3’) Beklenen Bant D. dipsaci için Büyüklüğü (bç)
Hedef Bölge Kaynak Makale PF1 PR1 5′-AACGGCTCTGTTGGCTTCTAT-3 327 bç ITS bölgelerini çevreleyen Marek ve ark., 2005 5′-ATTTACGACCCTGAGCCAGAT-3′ PF2 PR2 5′-TCGCGAGAATCAATGAGTACC-3′ 396 bç ITS bölgelerini çevreleyen Marek ve ark., 2005 5′-AATAGCCAGTCGATTCCGTCT-3′ DdpS1 rDNA2 5′-TGGCTGCGTTGAAGAGAACT-3′ 517 bç 5.8S rDNA Vrain ve ark., 1992 5′-TTTCACTCGCCGTTACTAAGG-3′ 18S 26S 5’-TTGATTAGGTCCCTGCCCTTT-3’ 967 bç ITS1-5.8S-ITS2 Vrain ve ark., 1992 5’-TTTCACTCGCCGTTACTAAGG-3’ DitNF1 rDNA2 5′-TTATGACAAATTCATGGCGG-3′ 263 bç 18S ve ITS1 Vrain ve ark., 1992 5′-TTTCACTCGCCGTTCTAAGG-3′ H05 H06 5′- TCAAGGTAATCTTTTTCCCCACT-3′ 242 bç 5.8S Esquibet ve ark., 2003 5′-CAACTGCTAATGCGTGCTCT-3′ DipU-F DipU-R 5’-CCCATTTTTGAACTTTTTTACAAG-3’
333 bç ITS bölgelerini çevreleyen
Vovlas ve ark., 2011 5’-CTAGATTAGCAAAGACGTATATC
21
Primer Adı PZR Isı Döngüsü PZR Mix (1x)
PF1 PR1 94°C 3 dk 94 °C 2 dk 62 °C 30 sn 72 °C 2 dk 72 °C 10 dk 30 döngü 7,5 μL Dream Tag 0,5 μL Primer F-R 13,5 μL ddH2O 3 μL DNA PF2 PR2 94 °C 3 dk 94 °C 2 dk 63 °C 30 sn 72 °C 2 dk 72 °C 10 dk 30 döngü
2,5 μL 10X Tag Buffer with KCL 2 μL MgCl2 2 μL dNTP 0,25 μL Primer F-R 0,3 μL Tag 14,7 μL ddH2O 3 μL DNA DdpS1 rDNA2 94 °C 1 dk 94 °C 30 dk 60 °C 30 sn 72 °C 45 sn 72 °C 10 dk 40 döngü
2 μL 10X Tag Buffer with KCL 1,2 μL MgCl2 1,6 μL dNTP 1,5 μL Primer F 0,2 μL Tag 10 μL ddH2O 3 μL DNA 18S 26S 94 °C 2 dk 94 °C 30 dk 60 °C 20 sn 72 °C 1 dk 72 °C 7 dk 30 döngü
2,2 μL 10X Tag Buffer with KCL 2,2 μL MgCl2 1,76 μL dNTP 0,22 μL Primer F-R 0,44 μL Tag 14,96 μL ddH2O 3 μL DNA DitNF1 rDNA2 94 °C 4 dk 94 °C 15 sn 57 °C 30 sn 72 °C 30 sn 72 °C 10 dk 35 döngü
2,5 μL 10X Tag Buffer with KCL 1,5 μL MgCl2 2 μL dNTP 0,15 μL Primer F-R 0,4 μL Tag 15,3 μL ddH2O 3 μL DNA H05 H06 94 °C 3 dk 94 °C 1 dk 57 °C 1 dk 72 °C 1 dk 72 °C 10 dk 30 döngü
2 μL 10X Tag Buffer with KCL 1,2 μL MgCl2 0,8 μL dNTP 1,5 μL Primer F-R 0,2 μL Tag 9,8 μL ddH2O 3 μL DNA DipU-F DipU-R 95 °C 11 dk 95 °C 45 sn 55 °C 30 sn 72 °C 1 dk 72 °C 5 dk 45 döngü
2,2 μL 10X Tag Buffer with KCL 2,2 μL MgCl2 1,76 μL dNTP 0,22 μL Primer F-R 0,44 μL Tag 14,96 μL ddH2O 3 μL DNA
22
3. 2. 4. Havuç Kültürü Oluşturulması
Kültürlerde kullanılacak havuçlar çeşme suyu altında yıkanarak üzerlerindeki topraktan temizlenmiş ve soyularak %97’lik etil alkolde 10-15 dk bekletilmiş ve yüzey sterilizasyonu için bek alevinde yakılmıştır. Yine alkolle steril edilen metal soyacak ile yakılan dış kaynaklardan soyulmuş ve yine steril bıçak ile 1 cm kalınlığında dilimlenerek steril petrilerin içine hızlı bir şekilde aktarılmıştır (Şekil 3-2).
Bu ayırımdan Ditylenchus spp. ler bir dişi ve bir erkek birey olacak şekilde ayrılarak 1 cm kalınlığındaki havuç diskleri üzerine alınmış ve saf kültür oluşması sağlanmıştır. 2-4 ay süreyle kontrol edilerek kültür devam ettirilmiştir.
Şekil 3-2 Havuç kültürlerinin hazırlanması ve alt kültür yapım aşamalarının gösterimi
Alt kültür oluşturulacak havuç diski çeşme suyu ile yıkatılarak 15 ml'lik santrifüj tüplerine alınmış ve nematod popülasyonunun dibe çökmesi beklenmiştir. Yine üst kısmından suyu azaltılarak popülasyon yoğunluğu arttırılmış ve 50 mikrolitrelik bir örnek mikroskop altında hareketli ve canlı olup olmadıklarına bakılarak yeni hazırlanan havuç diskleri üzerine bir damla (50 mikrolitre) damlatılarak yaklaşık bir cm’lik parafilm ile petri kabının etrafı sarılmıştır. Petriler üzerine gerekli etiketlemeler yapılmış ve nematod gelişimi için uygun olan 15 °C sıcaklığa (Yüksel, 1960) ayarlı etüve kaldırılmıştır. Bu işlemler deneme boyunca tekrar tekrar yapılarak canlı nematodların devamlılığı sağlanmış ve deneme için gereken populasyonlar bu kültürlerden karşılanmıştır.
3.3. Nematod İnokulümünün Hazırlanması
İnokulasyon için nematod populasyonları ayrı ayrı steril çeşme suyu ile yıkanmıştır ve nematodların dibe çökmesi için 1-2 saat beklenmiştir. İnokule edilecek nematodlar 15
23
ml’lik santrifüj tüplerinde %1’ lik CMC solusyonu içinde her saksı için 10 µl olacak ve yaklaşık 200 hareketli nematod içerecek şekilde hazırlanmıştır (Şekil 3-3).
Şekil 3-3 Bitkilere inokulasyon için nematodların havuç kültürlerinden ayrılması ve nematd süspansiyonunun hazırlanması
3. 4. Konukçu Testleme Denemesi
Konukçu denemeleri büyütme dolabında 15 °C sıcaklıkta ve %70 nem koşullarında gerçekleştirilmiştir. Büyütme dolabı sıcaklığı nematod gelişimi için en uygun seviyelerde tutulmuş ve bitki gelişimini etkilemeyecek şekilde ayarlanmıştır. Gece ve gündüz etkileri göz önünde bulundurularak 16 saat aydınlık ve 8 saat karanlık olacak şekilde büyütme dolabı ışık süreleri ayarlanmış ve en az 2 günde bir sulanarak nematodlar için nemli bir ortam oluşturulmaya çalışılmıştır.
Her bitkiden, 4 farklı lokasyondan elde edilen nematod populasyonları ve nematod içermeyen gruplar olmak üzere 5 gruba 4 tekerrürlü olarak toplamda 20 saksıya ekim yapılmıştır (Çizelge 3-5). 1. Nematod popülasyonu 2. Nematod popülasyonu 3. Nematod popülasyonu 4. Nematod popülasyonu Negatif kontrol (nematod yok)
1. tekerrür 1. tekerrür 1. tekerrür 1. tekerrür 1. tekerrür 2. tekerrür 2. tekerrür 2. tekerrür 2. tekerrür 2. tekerrür 3. tekerrür 3. tekerrür 3. tekerrür 3. tekerrür 3. tekerrür 4. tekerrür 4. tekerrür 4. tekerrür 4. tekerrür 4. tekerrür Çizelge 3-5 Konukçu testleme deneme planının bir bitki türü için şematik gösterimi
24
Saksılar 7×7×8 cm boyutlarında olup ekim yapılan toprak karışımı %70 steril kum ve %30 steril tarla toprağı şeklindedir (Şekil 3-4).
Şekil 3-4 Tohum ekimi için deneme toprağının hazırlanması ve bitkilerin büyütme dolabına yerleştirilmesi
Tohumlar ekimden bir gün önce ıslatılmış ve dormansileri kırılarak çimlenmelerinin daha hızlı olması sağlanmıştır. Saksılar bitki numarası ve saksı numarası olarak iki ayrı şekilde etiketlenmiştir. Saksılar üst tarafta biraz boşluk bırakılarak doldurulmuş biraz nemlendirilerek tohumlar saksılara etkilemiştir. Üzerlerine bir miktar daha toprak konularak tekrar sulanmıştır (Şekil 3-5).
Şekil 3-5 Bitki tohumlarının ön çimlendirilmesi ve saksılara ekimi
Bitkilerin çimlenme durumuna göre 1-2 hafta sonra çimlenme görülmeyen saksılara tekrar tohum ekilmiştir. Bitkiler en az iki günde bir olarak sulanmıştır.
Bitki türünün gelişimine göre 4-5 hafta sonra nematodlar bitkilere bulaştırılmıştır. Bitkilerin gelişim ve yaprak oluşturma şekillerine göre taze ve genç yaprakların bitki gövdesi ile bağlandığı yere mikropipet ile 10 µl inokulasyon yapılmıştır (Şekil 3-6).
25 Şekil 3-6 Nematodların bitkilere bulaştırılması
En az iki günde bir sulanarak nematodların bitki içine girinceye kadarki süreçte nemli bir ortam oluşturulması sağlanmıştır. Nematod inokulasyonundan sonra bitkiler her hafta fotoğraflanarak nematodların zarar belirtisi gözlemlenmiştir.
3. 5. Konukçu Testleme Denemesinin Değerlendirilmesi
Bitkilerin çürüme ve sararma durumları dikkate alınarak nematod inokulasyonundan 5-6 hafta sonra bitkiler hasat edilmiştir. Hasat sırasında nematod zararının belirtileri arasında yer alan bitki boyunda kısalma, bitki kök ve gövdesinde yumuşama, sararma, buruşukluk ve çürüme olup olmadığı kayıt altına alınmıştır. Nematod varlığının bitki ağırlığına etkisi de dikkate alınmış ve bitki ağırlığı da ölçüm kriterlerine dahil edilmiştir (Şekil 3-7). Hasat edilen her bitki çeşidi bir nematodlu ve bir nematodsuz örneği yan yana konularak fotoğraflanmıştır Nematodu bitki içine girip girmediğini ve varsa nematod sayımını yapabilmek için Bearhnman Huni yönteminden modifiye edilmiş petri kabı yöntemi kullanılarak nematod inokulasyonu yapılan bütün bitkiler ve bitki toprakları incelemeye alınmıştır. Bitki gelişimi olmayan saksılar değerlendirmeye alınamamıştır.
26
Nematodları ayrılmak için bitkiler küçük parçalar halinde doğranarak üzerlerine su eklenmiş ve geniş petri kaplarında elekler içinde bir gece boyunca bekletilmiştir. Bitki toprakları elekler üzerine yerleştirilen peçetelerin üstüne konulmuş, üzerine yeteri miktarda su eklenmiş ve iki gece boyunca bekletilmiştir (Şekil 3-8). Bekletilme sürelerinin sonunda petrilerdeki sular 100 ml’lik mezürlere boşaltılmıştır ve iki saat bekletilerek nematodların yer çekimi etkisiyle dibe çökmesi sağlanmıştır. İki saat sonra mezürlerin üst kısmından sifon yapılmış ve su miktarı 10 ml’ye kadar azaltılmıştır. Mezürlerin dibinde kalan sular 15 ml’lik santrifüj tüplerine aktarılmış ve yine yaklaşık 2 saat bekletilmiştir. Pipet yardımıyla sular azaltılmış ve 1 ml'lik örnekler oluşturulmuştur. Daha sonra sayım için her tüp iyice karıştırılarak homojen bir dağılım sağlanmış ve lam üzerine 50 mikrolitre damlatılarak sayım yapılmıştır. Elde edilen nematod sayısı 20 ile çarparak tüm örnekteki nematod sayısı belirlenmiştir.
Şekil 3-8 Bitki ve toprak örneklerinden nematodların ayrılması
Bitki türlerinin D. dipsaci’ ye karşı konukçuluk özelliklerinin belirlenmesinde; bitkilerde D. dipsaci zararı belirtilerinin varlığı ve nematodun üreme oranı verileri kullanılarak bitki türlerinin konukçuluk durumları tespit edilmiştir. Üreme oranı; hasatta saksı başına elde edilen nematod sayısı, başlangıç nematod inokulüm yoğunluğu olan 200’ e bölünerek elde edilmiştir. Nematodların bitki içine girip üreyebildiği bitkiler (üreme oranı 1 den büyük) mükemmel konukçu, girip üremeyenler (üreme oranı 1 ve altında) orta derecede konukçu ve hiç giremeyenler (hiç nematod yok) konukçu olmayan olarak sınıflandırılmıştır (Mennan, 2001; Douda, 2005).
27
3. 6. Verilerin İstatistikî Analizi
Bitki türlerinde nematod uygulamalarının etkilerinin karşılaştırılmasında ANOVA ve TUKEY HSD testi kullanılmıştır. İstatistiksel olarak önemli bulunan kriterlerin nematod uygulamasına bağlılığının tespit edilmesinde multifaktoriyel korelasyon analizi uygulanmıştır. Analizlerin gerçekleştirilmesinde JMP5.01.a istatistiksel analiz programı (JMP, 2018) kullanılmıştır.
28
4. BULGULAR VE TARTIŞMA
4. 1. Havuç Kültüründe Çoğaltılan Nematodların Tür Teşhisi 4. 1. 1. Morfolojik Tür Teşhisi
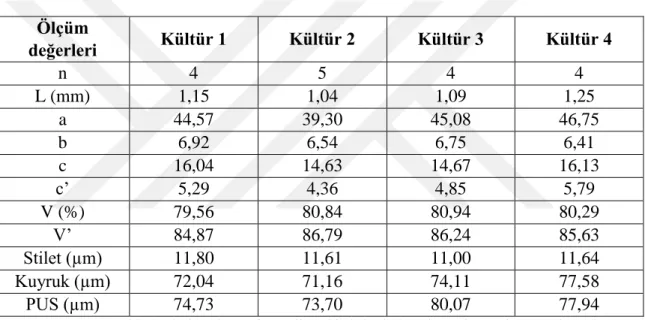
Kültüre alınan nematod populasyonlarının türleri morfolojik olarak Ditylenchus dipsaci olarak teşhis edilmiştir. Nematodlardan yapılan ölçüm ve hesaplamalar çizelge 4-1’ de sunulmuştur. Elde edilen ölçüm değerlerinin referans değerler (Öztürk, 1990; Sturhan ve Brzeski, 1991; Kepenekçi, 1999; Mennan, 2001; Chizov vd, 2010; Tenuta vd., 2014) ile uygunluk içerisinde olduğu görülmüştür.
Ölçüm değerleri Kültür 1 Kültür 2 Kültür 3 Kültür 4 n 4 5 4 4 L (mm) 1,15 1,04 1,09 1,25 a 44,57 39,30 45,08 46,75 b 6,92 6,54 6,75 6,41 c 16,04 14,63 14,67 16,13 c’ 5,29 4,36 4,85 5,79 V (%) 79,56 80,84 80,94 80,29 V’ 84,87 86,79 86,24 85,63 Stilet (µm) 11,80 11,61 11,00 11,64 Kuyruk (µm) 72,04 71,16 74,11 77,58 PUS (µm) 74,73 73,70 80,07 77,94
Çizelge 4-1 Nematod kültürlerine ait morfometrik teşhis kriterlerine ait ortalama ölçüm ve hesaplamalar [n: incelenen örnek sayısı, L: boy, a: vücut uzunluğu/ maksimum vücut genişliği, b: vücut uzunluğu/ özefagus uzunluğu, c: vücut uzunluğu/ kuyruk uzunluğu, c’: kuyruk uzunluğu/ anüs veya kloaktaki kuyruk çapı, V: başın son kısmı ile vulva arasındaki mesafe/ vücut uzunluğu ve V’: başın sonundan vulvaya olan uzaklık/ başın sonundan anüse olan uzaklık X 100 (Brzeski, 1991; Sturhan ve Brzeski, 1991; Siddiqi, 2000; Mollow vd., 2012)].
4. 1. 2. Moleküler Tür Teşhisi
Kültürlerden elde edilen nematodlardan DNA analizi yapılarak, 7 farklı primer ile moleküler tür teşhisleri gerçekleştirilmiştir.
Birinci primer seti PF1-PR1 ile yapılan PZR taraması ile 4 adet kültürden elde edilen nematod örneklerinin % 1’lik agaroz jellerde görüntülenmesi sonucunda pozitif kontrol baz alınarak 327 bç’lik beklenen büyüklükte bant verdikleri ve Ditylenchus dipsaci oldukları tespit edilmiştir (Şekil 4-1).
29
Şekil 4-1 PF1-PR1 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür).
İkinci primer seti PF2-PR2 ile yapılan PZR taraması ile 4 adet kültürden elde edilen nematod örneklerinin % 1’lik agaroz jellerde görüntülenmesi sonucunda pozitif kontrol baz alınarak 396 bç’lik beklenen büyüklükte bant verdikleri ve Ditylenchus dipsaci oldukları tespit edilmiştir (Şekil 4-2).
Şekil 4-2 PF2-PR2 primeri ile 4 adet nematod kültürü örneklerinin moleküler taramasına ait agaroz jel görüntüsü (L: 100 bç Ladder, PK: Pozitif Kontrol, NK: Negatif Kontrol, 01: 1. Kültür, 02: 2. Kültür, 03: 3. Kültür, 04: 4. Kültür).
DdpS1-rDNA2 primeri ile yapılan PZR taraması ile 4 adet kültürden elde edilen nematod örneklerinin % 1’lik agaroz jellerde görüntülenmesi sonucunda pozitif kontrol