T.C.
Ege Üniversitesi Tıp Fakültesi Nükleer Tıp Anabilim Dalı Prof. Dr. Zeynep BURAK
BAġ-BOYUN MALĠGNĠTELERĠNDE EVRELEMEYE
F-18 FDG PET/BT’nin RETROSPEKTĠF KATKISI
Uzmanlık Tezi
Dr. YeĢim CEYLAN
Tez DanıĢmanı
Doç. Dr. Özgür ÖMÜR
i ĠÇĠNDEKĠLER TABLO LİSTESİ ... iv ŞEKİL LİSTESİ ... v GRAFİK LİSTESİ ... v KISALTMALAR ... vi 1.ÖZET... vii 1.SUMMARY ... viii 2.GİRİŞ ... 1 3.GENEL BİLGİLER ... 2 3.1 Baş-Boyun Kanserleri ... 2 3.1.1 Nazofarinks Kanserleri... 3 3.1.1.1. Nazofarinks Anatomisi ... 3 3.1.1.2. Epidemiyoloji ve Etiyoloji ... 4 3.1.1.3. Patolojik Sınıflama ... 4 3.1.1.4. Lenfatik Yayılım ... 5 3.1.1.5. Evreleme ... 5
3.1.2 Oral Kavite Kanserleri ... 6
3.1.2.1. Oral Kavite Anatomisi ... 6
3.1.2.2. Epidemiyoloji ve Etiyoloji ... 8 3.1.2.3. Patolojik Sınıflama ... 9 3.1.2 4. Lenfatik Yayılım ... 9 3.1.2.5. Evreleme ... 10 3.1.3.Orofarinks Kanserleri ... 11 3.1.3.1. Orofarinks Anatomisi ... 11 3.1.3.2. Etiyoloji ve Epidemiyoloji ... 12 3.1.3.3. Patolojik Sınıflama ... 12 3.1.3.4. Lenfatik Yayılım ... 12 3.1.3.5. Evreleme ... 12 3.1.4. Hipofarinks Kanserleri ... 13 3.1.4.1. Hipofarinks Anatomisi ... 13 3.1.4.2. Epidemiyoloji ve Etiyoloji ... 14
ii 3.1.4.3. Patolojik Sınıflama ... 14 3.1.4.4. Lenfatik Yayılım ... 14 3.1.4.5. Evreleme ... 15 3.1.5. Larinks Kanserleri ... 15 3.1.5.1. Larinks Anatomisi ... 15 3.1.5.2. Epidemiyoloji ve Etiyoloji ... 16 3.1.5.3. Patolojik Sınıflama ... 17 3.1.5.4. Lenfatik Yayılım ... 17 3.1.5.5. Evreleme ... 17 3.1.6. Tükrük Bezi Maligniteleri ... 19
3.1.7. Paranazal Sinüs Maligniteleri ... 19
3.2 Klinik ... 20
3.2.1. Nazofarinks Kanserleri... 20
3.2.2. Oral Kavite Kanserleri ... 20
3.2.3. Orofarinks Kanserleri ... 20
3.2.4. Hipofarinks Kanserleri ... 21
3.2.5. Larinks Kanserleri ... 21
3.3 Tanı ... 22
3.3.1. Nazofarinks Kanserleri... 22
3.3.2. Oral Kavite Kanserleri ... 22
3.3.3. Orofarinks Kanserleri ... 22
3.3.4. Hipofarinks Kanserleri ... 22
3.3.5. Larinks Kanserleri ... 23
3.4 Tedavi ... 23
3.5 Tedavi Öncesi Evreleme ... 25
3.5.1. Servikal Lenf Nodu Haritalaması... 25
3.5.2. Bilgisayarlı Tomografi ... 26
3.5.3. Magnetik Rezonans Görüntüleme ... 27
3.5.4. Pozitron Emisyon Tomografisi ... 28
iii
3.5.4.2. Temel Görüntüleme Prensipleri ... 29
3.5.4.3. Dedektör ve Kristal Yapıları ... 30
3.5.4.4. Atenüasyon Düzeltmesi ... 30
3.5.4.5. PET Görüntüleme Ajanları ve Kullanım Alanları ... 31
3.5.4.6. FDG‘nin Normal Vücut Biyodağılımı ... 31
3.5.4.7. Standart Uptake Değeri (SUV) ... 32
4.MATERYAL ve METOD... 34
4.1. Hasta Grubu ... 34
4.2. Hasta Hazırlığı ve PET/BT Görüntüleme ... 34
4.3. Değerlendirme ... 35
4.4. Veri Analizi ve İstatistik ... 35
5. BULGULAR ... 36
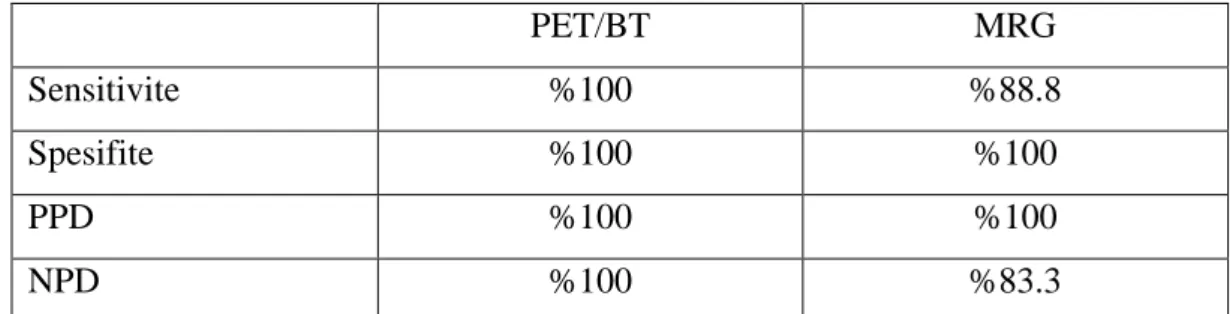
5.1. F-18 FDG PET/BT ve MRG Bulgularının Karşılaştırılmalı Değerlendirilmesi .. 40
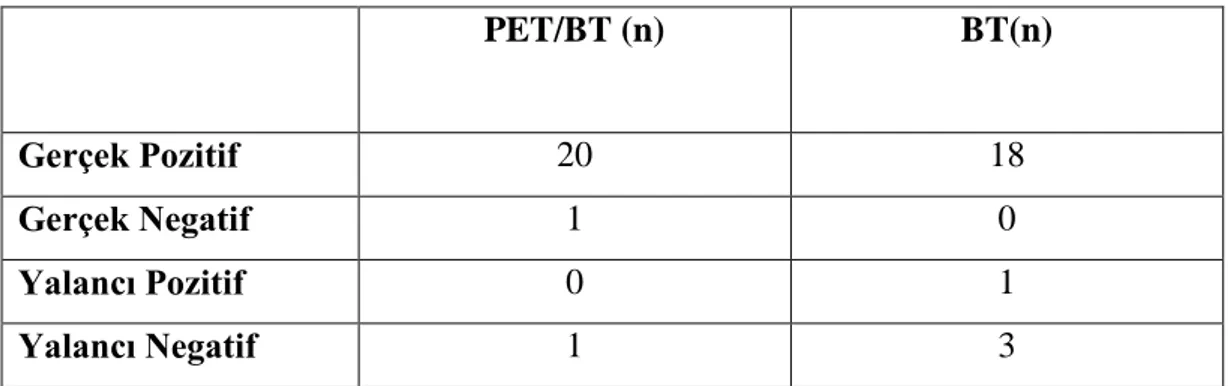
5.2. F-18 FDG PET/BT ve BT Bulgularının Karşılaştırılmalı Değerlendirilmesi ... 43
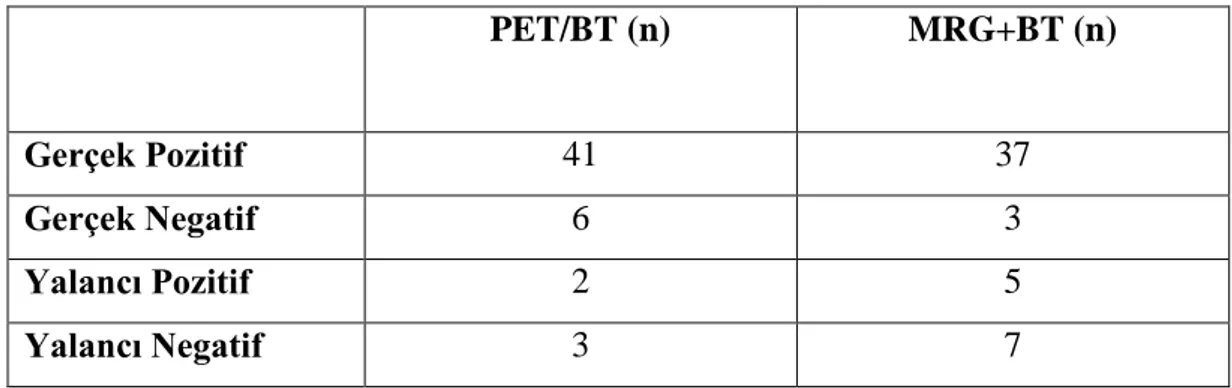
5.3. F-18 FDG PET/BT ve Konvansiyonel Görüntüleme Bulgularının Karşılaştırmalı Değerlendirilnesi ... 45
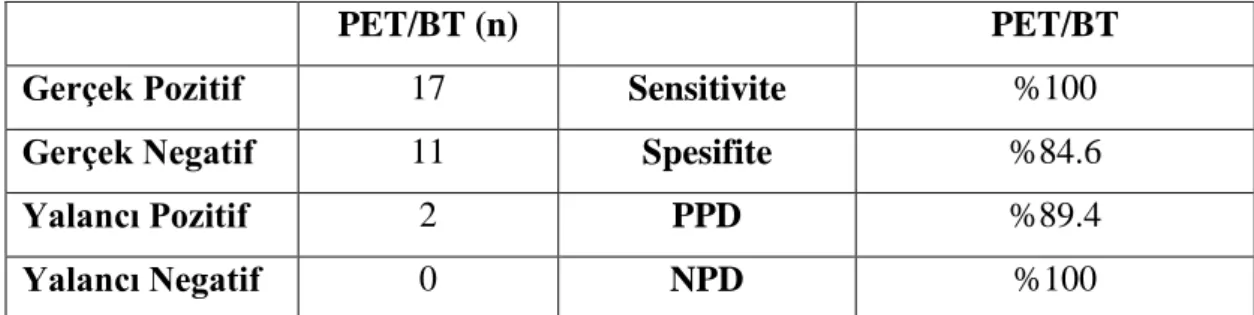
5.4. Tüm Olgu Grubunda F-18 FDG PET/BT Bulgularının Değerlendirilmesi ... 47
5.5. Tüm Olgu Grubunda F-18 FDG PET/BT‘nin Evreleme ve Yeniden Evrelemeye Katkısı ... 48
6. OLGU ÖRNEKLERİ ... 51
7. TARTIŞMA ... 56
iv TABLO LĠSTESĠ
Tablo Sayfa 1. En sık kullanılan pozitron salıcı radyonüklidler………...31 2. Primer lezyon alanı ya da bölgesel lenf nodlarında artmış FDG tutulumu izlenen ve patolojik sonucu bulunan olgularda SUVmax ile histopatolojik sonuç ilişkisi ... 39 3. Uzak metastaz saptanan olgularda PET/BT‘de metastatik lezyonların lokalizasyonu ile MRG ve BT bulguları ... 40 4. PET/BT ve MRG‘nin primer tümöral lezyon değerlendirmede gerçek-yalancı
pozitif/negatif değerleri ... 41 5. PET/BT ve MRG‘nin primer tümöral lezyon değerlendirmede sensitivite, spesifite, PPD ve NPD sonuçları……….41 6. Histopatolojik kanıtı bulunan olgularda PET/BT ve MRG‘nin metastatik lenf nodu değerlendirmede gerçek-yalancı pozitif/negatif değerleri ... 42 7. Histopatolojik kanıtı bulunan olgularda PET/BT ve MRG‘nin metastatik lenf nodu değerlendirmede sensitivite, spesifite, PPD ve NPD sonuçları………42 8. PET/BT ve BT‘nin primer tümöral lezyon değerlendirmede gerçek-yalancı
pozitif/negatif değerleri ... 43 9. PET/BT ve BT‘nin primer tümöral lezyon değerlendirmede sensitivite, spesifite, PPD ve NPD sonuçları………..44 10. Patolojik incelemesi bulunan olgularda PET/BT ve BT‘nin metastatik lenf nodu değerlendirmede olgu bazında gerçek-yalancı pozitif/negatif sonuçları ... 44 11. Patolojik incelemesi bulunan olgularda PET/BT ve BT‘nin metastatik lenf nodu değerlendirmede sensitivite, spesifite, PPD ve NPD sonuçları………45 12. PET/BT ve MRG/BT‘nin primer odak değerlendirmede gerçek-yalancı
pozitif/negatif değerleri ... 45 13. PET/BT ve MRG/BT‘nin primer odak değerlendirmede sensitivite, spesifite, PPD ve NPD sonuçları………..46 14. PET/BT ve MRG/BT‘nin metastatik lenf nodu değerlendirmede gerçek-yalancı pozitif/negatif değerleri ... 46
v 15. PET/BT ve MRG/BT‘nin metastatik lenf nodu değerlendirmede sensitivite, spesifite,
PPD ve NPD sonuçları……….46
16. PET/BT‘nin primer lezyon değerlendirmede tüm olgu grubunda gerçek-yalancı pozitif/negatif değerleri ve sensitivite/spesifite/PPD/NPD sonuçları ... 47
17. PET/BT‘nin metastatik lenf nodu değerlendirmede tüm olgu grubunda gerçek yalancı pozitif/negatif değerleri ve sensitivite/spesifite/PPD/NPD sonuçları ... 47
18. Evreleme endikasyonuyla F-18 FDG PET/BT görüntülemesi bulunan ve PET/BT sonucunun TNM evresinde değişikliğe neden olduğu olgular ... 48
19. Yeniden evreleme endikasyonuyla başvuran olgularda PET/BT ve konvansiyonel görüntüleme yöntemleri sonuçlarının karşılaştırılması ... 49
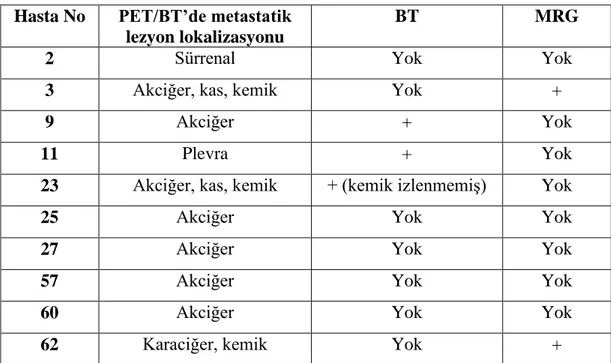
20. Yanlış negatif ve pozitif bulgular saptanan olgulara ait BT/MRG/PET-BT bulguları ... 50
ġEKĠL LĠSTESĠ ġekil Sayfa 1. Nazofarinks Anatomik Yapı ... 4
2. Oral Kavite Anatomisi ... 8
3. Orofarinks Anatomisi ... 11
4. Hipofarinks Anatomisi ... 14
5. Larinks Anatomisi ... 16
6. Servikal Lenf Nodu Bölgeleri ... 26
7. Siemens Biograph 16 TruePoint PET/BT ... 28
GRAFĠK LĠSTESĠ Grafik Sayfa 1. Olguların refere edildikleri kliniklere göre dağılımı ... 36
2. Olgu grubunun primer tümör lokalizasyonuna göre yüzdelik dağılımı ... 37
vi KISALTMALAR
BT: Bilgisayarlı Tomografi
MRG: Manyetik Resonans Görüntüleme USG: Ultrasonografi
F-18: Flor 18
FDG: Florodeoksiglikoz
PET: Pozitron Emisyon Tomografi
PET/BT: Pozitron Emisyon Tomografisi/Bilgisayarlı Tomografi UICC: International Union Against Cancer
AJCC: American Joint Committee on Cancer HPV: Human Papilloma Virus
RT: Radyoterapi KT: Kemoterapi
SCC: Skuamöz Hücreli Karsinom SUV: Standardize Uptake Value ROI: Region of Interest
keV: Kilo elektron volt mCi: Milicurie
mA: Miliamper
MIP: Maksimum Intensity Projection PPD: Pozitif Prediktif Değer
vii 1.ÖZET
GiriĢ: Baş-boyun kanserlerinin büyük bölümü mukozadan köken almakta ve en sık skuamöz hücreli karsinom histolojik tipi görülmektedir. Baş-boyun kanserleri tüm kanser olgularının %6‘sını oluşturmakta ve kansere bağlı ölümlerde 8. sırada yer almaktadır. Doğru evreleme, baş boyun yapılarının fonksiyonel ve kozmetik özelliklerinin korunması ile uygun tedavi modalitesinin seçilmesinde ve izlem protokollerinin belirlenmesinde önemli rol oynamaktadır. Evrelemede konvansiyonel görüntüleme yöntemlerinin yanısıra PET/BT hibrid görüntüleme yöntemi önemli katkı sağlamaktadır.
Materyal ve Metod: Ege Üniversitesi Tıp Fakültesi Nükleer Tıp Anabilim Dalı‘na 2 Ocak 2012–1 Kasım 2013 tarihleri arasında, F-18 FDG PET/BT görüntüleme amacıyla refere edilen 138 baş-boyun kanserli olguya ait klinik kayıtları incelendi. Evreleme ve yeniden evreleme endikasyonuyla F-18 FDG PET/BT görüntülemesi gerçekleştirilerek klinik izlem verilerine ulaşılabilen 65 olgu çalışma grubuna alındı. Olgu grubunu oluşturan 65 baş–boyun kanserli hastanın F-18 PET/BT ve konvansiyonel görüntüleme bulguları retrospektif olarak incelendi.
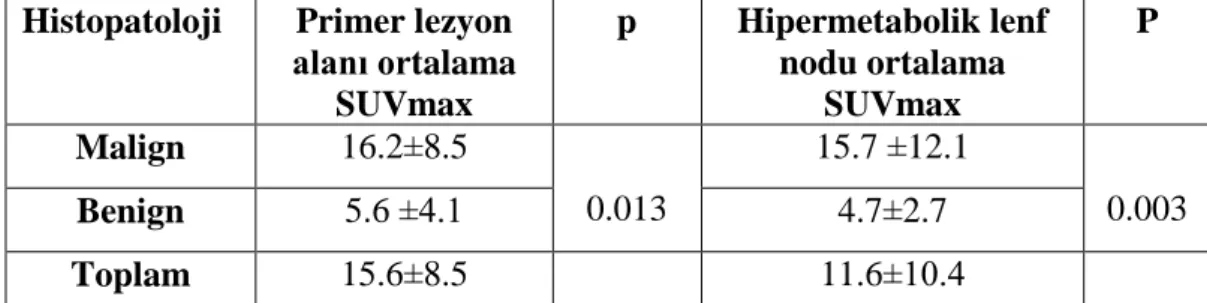
Bulgular: Altmışbeş baş-boyun kanseri tanılı olgunun 49‘u (%75.3) erkek, 16‘sı (%24.7) kadındı. Ortalama yaş 68±7,07 idi (yaş aralığı: 18 – 89). Otuzyedi olguda evreleme ve 28 olguda yeniden evreleme endikasyonuyla PET/BT görüntüleme gerçekleştirildi. FDG PET/BT‘de görüntülenen metastatik lenf nodları ve primer lezyonların SUVmax‘ları sırasıyla 15.7±12.1 ve 16.2±8.5 olarak hesaplandı. PET/BT ile 9 olguda uzak metastatik odak saptandı. Histopatolojik inceleme sonrasında patolojik ve benign olarak rapor edilen tümöral lezyonlar (p=0.013) ve lenf nodlarının (p= 0.003) SUVmax değerleri arasındaki farklılık istatistiksel olarak anlamlı bulundu.
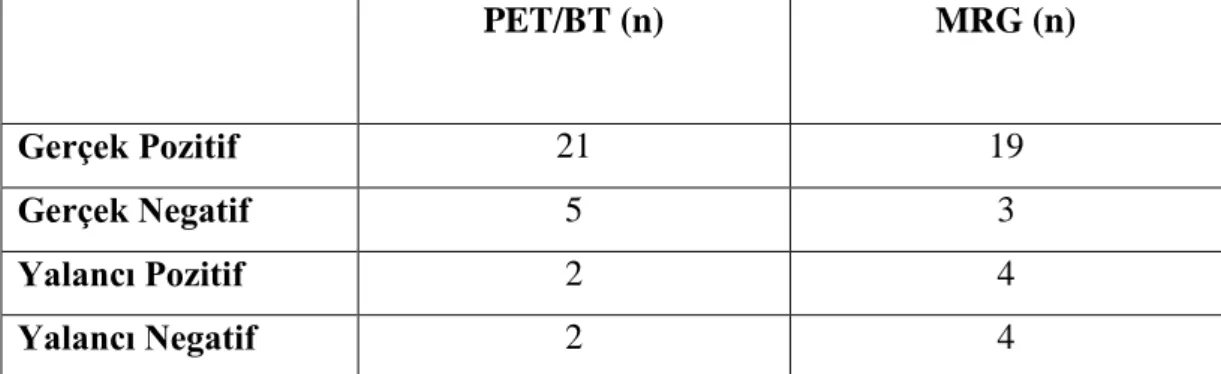
Primer lezyon değerlendirmede PET/BT ve konvansiyonel yöntemler için sensitivite sırasıyla %93.1 ve %82; spesifite, PPD ve NPD ise PET/BT ve BT+MRG için %75, %95.3, %66.6 ; %42.8, %88, %30 olarak bulundu. Metastatik lenf nodu saptamada PET/BT ve morfolojik görüntüleme yöntemleri toplamının (BT+MRG) sensitivitesi; PET/BT için %100, konvansiyonel yöntemler için %73.3; PPD ile spesifite
viii PET/BT ve BT+MRG için %100; NPD PET/BT için %100, BT+MRG için %69.2 olarak hesaplandı. Tüm olgu grubu değerlendirildiğinde metastatik lenf nodu saptamada PET/BT‘nin spesifitesi %84.6, PPD %89.4, sensitivite ve NPD %100 olarak hesaplanmıştır. PET/BT bulguları 5 olguda TNM evrelemede değişikliğe neden oldu.
Sonuç: Bu çalışmanın sonucunda baş-boyun kanserlerinde evreleme ve yeniden evrelemeye PET/BT‘nin anlamlı düzeylerde olmasa da olgu bazında katkı sağladığı, TNM sınıflamasında özellikle lokal ileri evre olgularda değişikliğe neden olarak tedavi planlamada önemli rolü olduğu sonucuna varılmıştır. PET/BT‘nin tedaviye yanıt değerlendirmede ve tedavi (RT) planlamadaki katkıları da dikkate alınarak baş-boyun tümörlerinin evrelemesinde rutin uygulanan bir tetkik olması gerektiği düşünülmektedir
1. SUMMARY
Introduction: Majority of head and neck cancers are originated from mucosal cells and squamous cell carcinoma is the most common histologic type. Head and neck cancers account for 6% of all cancer cases and cancer deaths in the ranks of the 8th. Because of functional and cosmetic properties of the head and neck structures correct staging and selection of appropriate treatment modalities have an important role in the diagnosis. Besides the conventional methods, hybrid imaging modality PET/CT has made an important contribution in staging of head and neck cancers in recent years.
Materials and Methods: Data of 138 patients with head and neck cancers, who admitted to Ege University Department of Nuclear Medicine for 18F FDG PET-CT imaging between January 2012 and November 2013, were retrospectively evaluated. Sixty five of 138 patients who has clinical indications of staging and restaging and whose follow-up data could be retrieved were enrolled in the study group.
Results: There were 49 (75.3%) male and 16 (24.7%) female patients with a mean age of 68±7.07 (between 18 and 89 ages). PET-CT imaging was performed for staging in 37 and for restaging purposes in 28 patients. The SUV max value of metastatic lymph nodes and the primary foci were 16.2 ± 8.5 and 15.7 ± 12.1. PET-CT detected unknown
ix distant metastases in 9 patients. There was a statistically significant difference between SUV max values of histopathologically proven benign lesions (p=0.013) and (p=0.003) metastatic lymph nodes.
The sensitivity, specificity, PPD and NPD of PET-CT and conventional imaging modalities (CT +MR) in the evaluation of the primary foci were 93.1% and 82%, 75% and 95.3%, 66.6% and 42.8%, 88% and 30%, respectively. The sensitivity, specificity, PPD and NPD of PET-CT and CT+MRI in the diagnoses of metastatic lymph nodes were 100% and 73.3%, 100% and 100%, 100% and 100%, 100% and 69.2, respectively in the group of patients was evaluated with PET/CT and CT or MRI. In entire study group; specificity, PPV, sensitivity and NPV of PET/CT were 84.6%, 89.4%, 100% and 100%, respectively, in determining of metastatic lymph nodes. PET-CT imaging led to upstaging in 5 patients.
Conclusion: Our results showed that PET-CT had an important role in staging and restaging of head and neck cancers with a special contribution in the therapy planning of locally advanced cases. As radiotherapy remains the only therapeutic option in most of those patients, defining the tumoral infiltration borders and treatment field with PET-CT has a major impact in the therapy response. We conclude that PET-CT should be a routine imaging modality in the staging of head and neck cancers.
1
2. GĠRĠġ
Baş-boyun kanserleri paranazal sinüsler, nazal ve oral kavite, farinks ve larinksten köken alan maligniteleri içermektedir. Baş-boyun kanserlerinin büyük bölümü mukozadan köken almakta ve en sık yassı hücreli karsinom (skuamöz hücreli karsinom, SCC) histolojik tipi görülmektedir. Baş-boyun kanserleri tüm kanser olgularının %6‘sını oluşturmakta ve kansere bağlı ölümlerde de 8. sırada yer almaktadır (1).
Olguların önemli bir bölümü ileri evre hastalık aşamasında saptanmakta ve genellikle tanı anında bölgesel lenf nodu metastazları bulunmaktadır. Tanı anında uzak metastaz sıklığı %10 düzeyinde olup, olguların %7‘sinde ikinci primer maligniteye rastlanmaktadır (2, 3).
Tanı, evreleme ve izlemde ayrıntılı fizik muayeneyle birlikte endoskopik değerlendirme, ultrasonografi (USG), Bilgisayarlı Tomografi (BT) ve Manyetik Rezonans görüntüleme (MRG) gibi radyolojik yöntemler kullanılmaktadır. Radyolojik incelemelerin değerlendirilmesinde morfolojik kriterler esas alınır. Lenf nodunun boyutu, lezyonun kontrastlanması gibi morfolojik ölçütler bazı durumlarda patolojiyi saptamada doğru sonuç veremeyebilirler (4). Radyoterapi (RT) ve operasyon sonrası değişen anatomik yapılar görüntüleme yöntemleriyle nüks ve rezidüel lezyon saptamasını oldukça güçleştirmektedir.
18-floro–2-deoksi-d-glikoz (F-18 FDG) Pozitron Emisyon Tomografisi (PET), tümör metabolizmasınının değerlendirilmesini sağlayan fonksiyonel görüntüleme yöntemidir. Tüm vücut görüntüleme imkanı sağladığından uzak metastazlar ve beklenmeyen lokalizasyonlardaki lenf nodu metastazları dahil olmak üzere lokal ve uzak organ değerlendirmesi eş zamanlı yapılabilir (5). Doğru evreleme, tedavi planlama, prognozun belirlenmesi, tedavi yanıtının değerlendirilmesi ve izlemde rekürren hastalığın erken saptanması PET ile mümkün olabilmektedir. Anatomik bilgi açısından yetersiz olan PET görüntülerinin PET/BT sistemlerinde 3 boyutlu, uzaysal rezolüsyonu yüksek BT kesitleriyle füzyonu anatomik ve fonksiyonel değerlendirmenin bir arada yapılabilmesini sağlamakta, böylece tetkikin duyarlılığı ve özgüllüğü diğer morfolojik görüntüleme yöntemlerinin üzerine çıkmaktadır (6).
2 Bu çalışmada, baş-boyun kanseri olan olgularda evreleme ve yeniden evreleme endikasyonlarında F-18 FDG PET/BT görüntüleme yönteminin klinik değerlendirme ve tedavi planlamadaki katkısını araştırmak amaçlanmıştır.
3. GENEL BĠLGĠLER
3.1. BaĢ Boyun KanserleriBaş-boyun kanserleri en sık 5-7. dekatlarda görülmekte ve erkeklerde kadınlardan 3-5 kat daha yüksek sıklıktadır. %95‘i skuamöz hücreli karsinom histolojik tipindedir (7). Etiyolojisinde alkol, sigara, bazı viral etkenler, radyasyon, kronik irritasyonlar, baskılanmış immün sistem ve genetik faktörler önemli rol oynamaktadır. Klinik olarak en belirgin bulgu primer tümör ya da metastatik lenf nodlarına ait kitle lezyonlarıdır. Ağrı, konuşma-yutkunma bozukluğu, kanama ve nefes darlığı gibi yakınmalar da görülebilir.
Baş boyun kanserleri lokalizasyonlarına göre aşağıdaki biçimde gruplanmaktadır:
• Oral kavite
• Nazofarinks, orofarinks ve hipofarinks • Nazal kavite ve paranazal sinüsler • Larinks
• Servikal özefagus
• Tükürük bezleri (Parotis, submandibuler, sublingual, minör tükrük bezleri) • Tiroid
• Temporal kemik ve kulak • Baş-boyun cildi
3 3.1.1. Nazofarinks Kanserleri
3.1.1.1. Nazofarinks Anatomisi
Kafa tabanı ile yumuşak damağın üst yüzü (C1. vertebra seviyesi) arasında kalan alandır. Nazofarinks ön duvarı burun boşlukları ve koana tarafından, arka duvarı ise C1-C2. vertebralar tarafından oluşturulmaktadır. Yan duvarlar süperior konstrüktör kas tarafından oluşturulur ve östaki ağızları ile Rosen Müller fossa bu bölgede yer alır (8). Alt duvar, yumuşak damağın üst yüzü tarafından oluşturulur ve bu noktanın aşağı bölümü orofarinkstir. Sfenoid kemik, oksipital kemiğin tabanı ve atlas kemiğinin ön yayı nazofarinksin çatısını oluşturmaktadır. Kafatası tabanında yer alan bazı foramina ve fissürler nazofarengeal kanserlerin intrakranial ilerlemesi, ayrıca bazı kranial sinirlerin tutulmasında önemli rol oynamaktadır. Foramen lacerum ve foramen ovale III-VI kranial sinirler ile yakın anatomik ilişkide olduklarından en önemlileridir. Nazofarinks lenfatik ağ bakımından çok zengindir. Çift taraflı lenfatik drenaja sahip olması nedeniyle nazofarinks kanser olgularında bilateral ya da kontralateral lenfatik metastazlara sıkça rastlanmaktadır. Lenf kanalları üç temel yolla bölgesel lenf bezlerine dökülür; birinci yol parafaringeal lenf bezlerine drene olmaktadır. Üst-lateral yerleşimli olanlara Rouvier lenf bezleri denir. Tümörün yayılımı açısından çok önemlidir (%80 olguda tutulur). İkinci olarak jugulodigastrik (subdigastrik) lenf bezlerine drene olmaktadır. Son yol da direkt olarak posterior servikal üçgendeki spinal lenf nodlarına drene olmaktadır (2, 3) .
4
ġekil 1: Nazofarinks Anatomik Yapı
3.1.1.2. Epidemiyoloji ve Etiyoloji
Nazofarinks kanserleri seyrek görülen tümörlerdir, fakat bazı bölgelerde insidansı yüksek olarak izlenmektedir (9, 10, 11). Nazofarinks kanseri görülme sıklığı 20‘li yaşlardan sonra iki pikle artmaktadır. Birinci pik 15-25 yaşları arasında EBV nedeniyle, ikinci pik ise 50-59 yaşlarında görülmektedir. Erkek/kadın hasta oranı 2.2/l'dir (12). Etiyolojide çevresel, viral ve genetik faktörler rol oynamaktadır. Genetik değişiklikler tümör supressör genlerin inaktivasyonu veya protoonkogenlerin aktivasyonu şeklindedir. DNA onarımı, apoptozis ve telomeraz aktivitesi ile ilgili genlerin de karsinogenezde hedef değişiklikler arasında olabileceği belirtilmektedir (13, 14).
3.1.1.3. Patolojik Sınıflama
Nazofarinks malignitelerinin yaklaşık %90'nını epidermoid veya indiferansiye karsinomlar oluşturmaktadır. Kalan %10 ise lenfomalar, plazmositom, melanom, rhabdomyosarkomu içermektedir (15, 16). İndiferansiye karsinomların nazofarinks kanserleri arasında önemli bir yeri vardır ve çocukluk çağı tümörlerinin çoğunu oluşturarak EBV ile ilişki göstermektedirler. Uzak metastaz oranları daha yüksek olmasına rağmen daha radyosensitiftir ve 5 yıllık sağ kalım oranları daha iyidir (17).
5 Skuamöz hücreli karsinomlar göreceli radyorezistandır ve nüks oranları yüksektir. Kür oranlarının diğer tiplere oranla daha düşük olduğu belirtilmektedir.
3.1.1.4. Lenfatik Yayılım
Nazofarinks karsinomlarında başvuru anında %60-85 oranında lenfatik tutulum mevcuttur (18). Bilateral lenf nodu metastazı sıklığı %50‘nin üzerindedir. Lateral ve posterior retrofaringeal lenfatik yayılım erken dönemde var olup, BT veya MRG ile saptanabilir. Jugulodigastrik ve superior posterior ganglionlar en sık, takiben orta juguler, posterior servikal, alt juguler ve supraklavikuler lenf nodu tutulumları izlenmektedir (19).
3.1.1.5. Evreleme
Avrupa ve Amerika da International Union Against Cancer (UICC) / American Joint Committee on Cancer (AJCC) evreleme sistemi yaygın olarak kullanılmaktadır (20).
T1: Tümör nazofarinks, orofarinks ve/ veya oral kavite içinde, parafaringeal tutulum yok
T2: Tümör nazofarinks, orofarinks ve/ veya oral kavite içinde, parafaringeal tutulum var
T3: Tümör kemik yapılara ve/ veya paranazal sinüslere uzanmış T4: Tümör intrakranial yayılımı var ve/ veya kranial sinir,
infratemporal fossa, hipofarinks, orbita tutulumu, mastikatör boşluk yayılımı mevut.
N1: Supraklaviküler fossa üzerinde yer alan tek taraflı servikal, unilateral/bilateral retrofaringeal 6 cm‘den küçük lenf nodları
N2: Supraklaviküler fossa üzerinde kalan 6 cm‘den küçük bilateral servikal lenf nodları
N3a: 6 cm'den büyük lenf nodu tutulumu
N3b: Supraklavikular fossada lenf nodu tutulumu M0: Uzak organ metastazı yok
6 EVRELEME Evre I: T1N0 Evre II: T1N1 T2N0, N1 Evre III: T1,T2 N2 T3N0,1,2 Evre IVA: T4N0,1,2 Evre IVB: T1,2,3,4 N3 Evre IVC: T1,2,3,4 N1,2,3 M1
3.1.2. Oral Kavite Kanserleri
3.1.2.1. Oral Kavite Anatomisi
Oral kavite; önde vermillion hattından (alt ve üst dudakların mukoza ve cilt birleşim hattından) arkada isthmus faucium‘a kadar uzanan, alttan ağız tabanı, üstte sert damak ve yanlarda yanak mukozası ile sınırlı bir anatomik boşluktur (21). Yanda ön tonsil plikaları, üstte tonsil üst kutupları seviyesinden geçen hayali çizgi ve altta sulcus terminalis‘in oluşturduğu isthmus faucium, arkada oral kaviteyi orofarinksten ayırmaktadır (22). Ağız kapalı iken üst ve alt diş arkusları oral kaviteyi 2 bölüme ayırır; ön bölüme vestibulum oris (oral kavite girişi), arka bölüme cavum oris propria (esas ağız boşluğu) denmektedir (21). Ağız kapalı iken, bu 2 boşluğu birbirine bağlayan bölge, mandibula ramusu ile son molar diş arasında kalan retromolar trigon‘dur.
7 Oral kavitede bulunan yapılar:
Alt ve üst dudak mukozası Yanak mukozası
Dişetleri ve dişler (üst ve alt diş arkusları) Sert damak
Yumuşak damağın bir kısmı Dil korpusu
Ağız tabanı
Retromolar trigon‘dur.
DUDAKLAR: Vermilyon sınırı bileşkesinde deriden başlayarak, oral vestibülün ön yüzünü oluşturmaktadır; alt ve üst olarak ayrılmıştır. İçeride mukoza, dışarıda cilt ile kaplı orbikularis kası tarafından oluşturulur. Alt ve üst dudağın 1/3 dış bölümünün lenfatik direnajı aynı taraftaki submandibuler bölgeye, alt dudağın orta kısmı submental bölgeye drene olmaktadır (22). Üst dudağın ortası ise parotis içi ve preauriküler lenf nodlarına drene olur.
DĠL: Çok katlı yassı epitelle döşeli bir kas ve yumuşak dokudan oluşmaktadır. Corpus linguae ve radix linguae olmak üzere 2 ana bölüme ayrılır. Dil gövdesi ön 2/3 kısmı oluşturmaktadır, hareketli ve kaslardan oluşmuştur. Dil kökü ise arka 1/3 kısmı oluşturur ve hareketsizdir (21). Daha çok lenfoid dokudan oluşmaktadır.
Dil gövdesi oral kavitede, dil kökü ise orofarinkste yer alır. Dilin ekstrensek kasları; genioglossus, hyoglossus, styloglossus ve intrensek kasları ise; lingual, vertikal ve transvers kaslardır. Dilin ucunun lenfatik direnajı submental lenf nodlarına olurken, lateral kenarları submandibuler ve jugulodigastrik lenf nodlarına, medial yüzü ise juguloomohyoid lenf noduna direne olur (19).
8 AĞIZ TABANI: Mandibula ile hiyoid kemik arasında uzanan milohiyoid kas tarafından oluşturulmaktadır (21). Ayrıca genioglossus ve geniohiyoideus kasları da burayı desteklemektedir. Ağız tabanında oluşan enfeksiyonlar ve malign neoplastik patolojiler sert bir destek olmadığından kolaylıkla lokal yayılım gösterebilirler.
SERT DAMAK: Oral ve nazal kaviteyi ayıran yapıdır. Sert damağın 2/3 ön kısmını her iki maksiller kemiğin palatinal çıkıntısı, 1/3 arka kısmını ise palatinal kemiğin horizontal çıkıntısı yapmaktadır (21). Sert damak mukozasının altında çok miktarda minör tükrük bezi bulunur. Damağın lenfatik direnajı submandibuler lenf nodlarına olmaktadır.
ġekil 2: Oral Kavite Anatomisi
3.1.2.2. Epidemiyoloji ve Etyoloji
Oral kavite kanserleri baş boyun kanserleri arasında larinks kanserlerinin ardından ikinci sırada yer alır (22, 23). Oral kavite kanserleri genellikle orta yaş ve üzerindeki insanlarda görülen, kötü ağız hijyeni, sigara ve alkol tüketimi ile ilişkili bir hastalıktır. Dil, ağız tabanı, yanak, sert damak, retromolar üçgen, gingiva tümörleri anatomik yerleşimleri ile değişik histolojik ve davranış özellikleri nedeniyle alt bölgelere ayrılarak ayrı ayrı değerlendirilmektedir (24, 25, 26). Alkol ve sigara kullanımı riski tek başına artırırken (27); HPV 16 seropozitifliği 2-3 kat (28, 29, 30), oral HPV enfeksiyonu 6 kat arttırmaktadır (31, 32). Vitamin C, vitamin
9 E gibi antioksidan alımının ise riski düşürdüğübelirtirmektedir (33, 34). Düşük ağız hijyeni (diş çürüğü, tartar, mukozal irritasyon) de yaş, cinsiyet, diyet, alkol, sigara kullanımı gibi faktörlerden sonra 2-4 kat artmış riske neden olabilir (35, 36).
3.1.2.3. Patolojik Sınıflama
Oral kavite mukozası non-keratinize çok katlı yassı epiteldir. Skuamöz hücreli karsinom tüm oral kavite karsinomlarının %90‘dan fazlasını oluşturmaktadır (8, 37, 38). Skuamöz hücreli karsinom dışında kalan %10‘luk bölüm de ise minör tükrük bezi kaynaklı tümörler, melanom, lenfoma ve sarkomlar gözlenmektedir (39).En sık rastlanan kanser dudak kanseri (%39) olup, bunu sırasıyla dil, ağız tabanı, bukkal ve gingiva-retromolar kanserleri izlemektedir (40).
3.1.2.4. Lenfatik Yayılım
Oral kavite kanserlerinde en önemli prognostik faktör lenfatik metastazın varlığıdır. Oral kavite kanserilerinde başvuru anında hastaların %30‘unda lenf nodu metastazı vardır (dudak ve sert damak kanserleri hariç) (29). Primer tümörün yerleşim yeri ve büyüklüğüne göre lenf nodu metastazı sıklığı değişiklik göstermektedir. Dil 2/3 ön kısmı lenfatiklerden çok zengindir ve bu bölge tümörlerinde lenf nodu metastaz riski diğer oral kavite kanserlerine göre daha fazladır. Oran %30 olarak belirtilmektedir (29, 31). Dil metastazları en fazla submandibuler bölge ile üst ve orta juguler zincire olmaktadır (Seviye1–2–3). Orta hatta mevcut tümörlerde karşı tarafa metastaz görülebildiği için bu lezyonlarda bilateral boyun disseksiyonu endikasyonu vardır (32, 33). Ağız tabanı lezyonları submandibuler, subdigastrik ve daha az oranda submental lenf nodlarına metastaz yapmaktadır (Seviye 1–2–3) (32). Ağız tabanının bilateral lenf direnajı mevcut olduğundan anterior tümörlerde yine bilateral yayılım söz konusudur. Yanak mukozası kanserlerinde periparotid, submental ve submandibuler lenf nodları en sık tutulan lenf nodlarıdır. Retromolar üçgendeki malign tümörler temel olarak üst derin juguler lenfatiklere yayılmakla beraber, submandibuler bölge ve orta juguler zincirde de metastaz yapmaktadırlar (32, 33). Gingiva malign tümörleri submental ve submandibuler lenfatiklere yayılabildiği gibi, özellikle alt gingivada medial lezyonlar (lingual kısım) üst derin juguler zincire ve retrofarengeal lenfatik sisteme de direne olur (33). Sert damak kanserleri diğer oral kavite tümörlerine göre daha az lenfatik yayılım göstermektedir. Boyunda %10 ile %25 oranlarında metastaz yaparlar,
10 sıklıkla retrofarengeal ve juguler sisteme direne olurlar. Klinik N0 olgularda boyun disseksiyonu endikasyonu yoktur. Uzak metastaz oranları oral kavite kanserlerinde düşüktür. Ancak ileri evre olgularda (N2-N3) ve lokal ya da bölgesel rekürrens olduğunda uzak metastaz oranı yükselmektedir. En sık akciğer metastazı, daha az oranda karaciğer ve kemik metastazı görülmektedir (32).
3.1.2.5. Evreleme
Oral kavite kanserlerinde, AJCC TNM evreleme sistemi kullanılmaktadır.
T1: 2 cm yada daha küçük boyutta tümör T2: 2 ile 4 cm arasındaki boyutta tümör T3: 4 cm‘den büyük boyutta tümör
T4:(dudak): tümör kortikal kemiği, inferior alveolar siniri, ağız tabanını veya yanak-burun gibi yüz derisini invaze etmiş
T4a: (oral kavite): tümör komşu dokuları invaze etmiş (kortikal kemik, derin dil kasları, maksiller sinus, yüz derisi)
T4b: (oral kavite): tümör maksikatör boşluğu, pterygoid plate‘leri veya kafa tabanını invaze etmiş ve/veya internal karotid arteri sarmış
N0: Bölgesel lenf nodu metastazı yok
N1: İpsilateral, tek, 3 cm veya daha küçük boyutlu lenf nodu N2a: İpsilateral, tek, 3 cm‘den büyük 6 cm‘den küçük lenf nodu N2b: İpsilateral, 6 cm‘den büyük olmayan lenf nodları
N2c: Bilateral veya kontralateral 6 cmden büyük olmayan lenf nodları N3 : 6 cm'den büyük lenf nodu tutulumu
M0: Uzak organ metastazı yok M1: Uzak organ metastazı var
11 EVRELEME
Evre I : T1N0 Evre II: T2N0
Evre III : T1,2,3 N1 T3N0
Evre IVA: T1,2,3 N2 T4a N0,1,3 Evre IVB: T1,2,3 N3, T4b N0,1,2,3 Evre IVC: T1,2,3,4 N1,2,3 M1
3.1.3. Orofarinks Kanserleri
3.1.3.1. Orofarinks Anatomisi
Farinksin orta kısmını oluşturur ve sert damaktan hyoid kemik seviyesine kadar uzanmaktadır. Anteriorda oral kavite yer alır ve orofarinks ön sınırını sirkumvallat papilla, anterior tonsil plikaları ve sert-yumuşak damak bileşkesi oluşturur (15). Orofarinks dil kökünü, anterior ve posterior tonsiller plikaları, palatin ve lingual tonsilleri, yumuşak damak ve lateral farengeal duvarları içermektedir.
12 3.1.3.2. Etyoloji ve Epidemiyoloji
Alkol ve tütün kullanımı risk faktörlerinin başında yer almaktadır. HPV tip 16 enfeksiyonu ve meyve-sebzeden fakir diyet diğer baş boyun malignitelerinde olduğu gibi risk faktörleri arasındadır (25).
3.1.3.3. Patolojik Sınıflama
En sık skuamöz hücreli karsinom görülmektedir (11). Minör tükrük bezi tümörleri, lenfomalar ve lenfoepitelyomalar (tonsiller fossa) takip eden malignitelerdir.
3.1.3.4. Lenfatik Yayılım
Dil kökünün derin lenfatik direnajı bilateraldir, seviye 1, 2 ve 3. lenf nodlarına yayılım görülebilir (1,26). Palatin tonsiller öncelikle ipsilateral seviye 2 ve retrofarengeal lenf nodlarına direne olduklarından öncelikle beklenen tutulum bölgeleri ipsilateraldir. Bilateral lenf nodu tutulumu görülmez (1,26). Yumuşak damak lezyonları seviye 1, 2 ve lateral retrofarengeal lenf nodlarına bilateral olarak yayılabilirler.
3.1.3.5. Evreleme
Orofarinks kanserlerinde, AJCC TNM evreleme sistemi kullanılmaktadır. T1: Tümörün en büyük çapı 2 cm veya daha küçük
T2: Tümörün en büyük çapı 2 cm‘den büyük, 4 cm‘den küçük T3: Tümörün en büyük çapı 4 cm‘ den büyük
T4a: Tümör larinksi, derin dil kaslarını, medial pterygoidi, sert damağı veya mandibulayı invaze etmiş
T4b: Tümör lateral pterygoid kası, lateral nazofarinksi veya kafa tabanını tutmuş veya karotid arteri sarmış
N0: Bölgesel lenf nodu metastazı yok
N1: İpsilateral, tek, 3 cm veya daha küçük boyutlu lenf nodu N2a: İpsilateral, tek, 3 cm‘den büyük 6 cm‘den küçük lenf nodu N2b: İpsilateral, 6 cm‘den büyük olmayan lenf nodları
N2c: Bilateral veya kontralateral 6 cm den büyük olmayan lenf nodları N3: 6 cm'den büyük lenf nodu tutulumu
M0 :Uzak organ metastazı yok M1 :Uzak organ metastazı var
13 EVRELEME
Evre I: T1N0 Evre II: T2N0
Evre III: T1,2,3 N1 T3N0
Evre IVA: T1,2,3 N2 T4a N0,1,3 Evre IVB: T1,2,3 N3, T4b N0,1,2,3 Evre IVC: T1,2,3,4 N1,2,3 M1
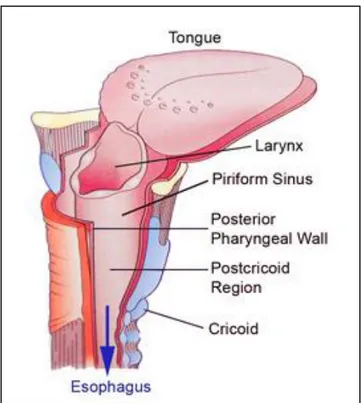
3.1.4. Hipofarinks Kanserleri
3.1.4.1. Hipofarinks Anatomisi
Hipofarinks; hyoid kemik seviyesinden krikoid kıkırdağın alt sınırına kadar uzanmaktadır. Üstte orofarinks, altta özafagus ile devamlılık gösterir (8). Hipofarinks lateralde piriform sinüsler, posteriorda faringeal duvar, anteriorda postkrikoid bölge olmak üzere üç bölüme ayrılmaktadır. Piriform sinüs süperiorda faringoepiglotik kıvrımdan inferiorda gerçek vokal kord seviyesine kadar uzanmaktadır. Tiroid kıkırdak ve tirohiyoid membran lateral sınırını, medial sınırını larinks oluşturmaktadır. Postkrikoid bölge aritenoidlerin posterior yüzünden krikoid kıkırdağın inferior kenarına doğru tümseklik yapmakta ve hipofarinksin anterior sınırını oluşturmaktadır. Hipofarinks jugulodigastrik lenf nodlarına direne olarak zengin bir lenfatik ağa sahiptir (15). En yaygın olarak subdigastrik lenf nodları tutulmaktadır. Ayrıca tümör posterior faringeal duvarı tuttuysa retrofaringeal nodlara direne olabilir ve en üst seviyedeki rouvier‘in retrofaringeal lenf nodlarını içerebilir.
14
ġekil 4: Hipofarinks Anatomisi
3.1.4.2. Epidemiyoloji ve Etyoloji
Diğer baş-boyun karsinomlarında olduğu gibi sigara ve alkol kullanımı, nutrisyonel eksiklikler hipofarinks kanserlerine neden olmaktadır (41). Postkrikoidal özafagus weblerine eşlik eden Plummer-Vinson (Paterson-Kelly) Sendromu da nedenler arasındadır.
3.1.4.3. Patolojik Sınıflama
Hemen hemen tüm hipofarinks malign tümörleri skuamöz hücreli karsinom‘dur (42). Sıklıkla kötü differansiye tipi görülmektedir.
3.1.4.4. Lenfatik Yayılım
Primeri hipofarinkste olan malignitelerde lenf nodu metastazı oldukça sıktır ve bunlar içinde ise en fazla priform sinus kanserlerinde nod metastazı görülmektedir. Postkrikoid bölge tümörleri boyun lateraline olduğu kadar (sıklıkla bilateral), mediastinal ve paratrakeal lenf nodlarına da metastaz yapmaktadır. Arka faringeal
15 duvar yerleşimli tümörler boyunda I, II ve III numaralı lenf nodu bölgelerine ve retrofaringeal lenf nodlarına direne olurlar (42).
3.1.4.5. Evreleme
Hipofarinks kanserlerinde, AJCC TNM evreleme sistemi kullanılmaktadır.
T1: Tümör hipofarinksin bir alt bölümünde ve en büyük çapı 2 cm veya daha küçük T2: Tümör hipofarinksin birden çok alt bölümünü veya komşu bölümleri tutmuş, en büyük çapı 2 cm‘den büyük, 4 cm‘den küçük, hemilarinks fiksasyonu yok
T3: Tümörün en büyük çapı 4 cm‘den büyük veya hemilarinks fiksasyonu var T4a: Tümör tiroid/krikoid kartilajı, hyoid kemiği, tiroid bezi, özefagusu veya prelarengeal strep kaslar ve subkutanoz yağlı dokuyu invaze etmiş
T4b: Tümör prevertebral boşluğu tutmuş, karotid arteri sarmış, mediastinal yapılara invaze olmuş
N0: Bölgesel lenf nodu metastazı yok
N1: İpsilateral, tek, 3 cm veya daha küçük boyutlu lenf nodu N2a: İpsilateral, tek, 3 cm‘den büyük 6 cm‘den küçük lenf nodu N2b: İpsilateral, 6 cm‘den büyük olmayan lenf nodları
N2c: Bilateral veya kontralateral 6 cmden büyük olmayan lenf nodları N3: 6 cm'den büyük lenf nodu tutulumu
M0: Uzak organ metastazı yok M1: Uzak organ metastazı var EVRELEME
Evre I : T1N0 Evre II: T2N0
Evre III: T1,2,3 N1 T3N0
Evre IVA: T1,2,3 N2 T4a N0,1,3 Evre IVB: T1,2,3 N3, T4b N0,1,2,3 Evre IVC: T1,2,3,4 N1,2,3 M1
3.1.5. Larinks Kanserleri
3.1.5.1. Larinks Anatomisi
Larinks tiroid kıkırdak üst kenarından krikoid kıkırdak alt kenarına kadar uzanmaktadır. Hyoid kemik ile trakea arasında yerleşmiştir. Supraglottik, glottik ve subglottik bölgelere ayrılır. Supraglottik larinks yalancı vokal kordlar, epiglot, ventriküller, ariepiglottik katlantılar ve aritenoid kıkırdaklardan oluşmaktadır (8). Glottis, gerçek vokal kordlar, anterior ve posterior komissürler tarafından oluşturulmaktadır. Subglottik bölge ise glottisin alt sınırından krikoid kartilajın alt ucuna kadar uzanmaktadır. Hyoid kemik, tiroid kıkırdak ve krikoid kıkırdak larinksin
16 dış duvarını oluşturur (15). Daha hareketli olan iç çatı ise epiglot, aritenoid, kornikulat ve kuneiform kıkırdaklar tarafından oluşturulmaktadır.
ġekil 5: Larinks Anatomisi
3.1.5.2. Epidemiyoloji ve Etyoloji
Larinks kanserleri tüm kanserlerin %2-5‘i, baş-boyun kanserlerinin %45'ini oluşturur. En sık 45-75 yaşları arasında görülür (43, 44, 45). Erkek:Kadın oranı 5:1‘dir. İkincil malignitelerle en fazla birliktelik gösteren tümör larinks kanseridir (46). Larinks skuamöz hücreli karsinomunda tütün etiyopatogenezde en başta suçlanan ajan konumundadır (47). A vitamininin ve provitamini olan retinoidlerin skuamöz hücreli karsinom riskini azalttığı bilinmektedir (48, 49). Larinks karsinomlarında %40‘lara ulaşan HPV DNA‘ları gösterilmiştir (50, 51). Laringeal papillomlu hastaların 10 yıllık takiplerinde %21 oranında larinkste ya da aerodigestif traktusun diğer bölümlerinde skuamöz hücreli karsinom geliştiği bildirilmiştir (52, 53).
17 3.1.5.3. Patolojik Sınıflama
Larinks‘in malignitelerinin çoğunluğunu epitelyal kökenli olan skuamöz hücreli kanserler oluşturmaktadır (%95-98). Bunun dışındaki maligniteler (verriköz, bazosellüler, fusiform hücreli karsinomlar, adenokarsinom, adenokistik karsinom ve mezanşimal kaynaklı malignitelerin) görülme insidansları oldukça azdır (54).
3.1.5.4. Lenfatik Yayılım
Supraglottik bölge zengin lenfatik direnaja sahip olduğundan en fazla nodal metastaz oranına sahiptir (42). Supraglottik tümörlerde okkult lenfatik metastaz insidansı %12-40‘dır. Risk T evresi arttıkça artar. Başlıca subdigastrik lenf nodlarına, daha az oranda da orta juguler zincir lenf nodlarına direne olur. En sık seviye 2, 3, 4 lenf nodlarına metastaz gerçekleşir. Gerçek vokal kordların lenfatikleri yoktur. Bu nedenle glottik kanserlerin lenfatik yayılımı ancak tümörün subglottik veya supraglottik bölgelere ulaşması sonucu olur. Glottik tümörde okkult metastaz insidansı %18‘dir (42). Seviye 2, 3, 6‘ya metastaz gerçekleşebilir. Bilateral ve kontralateral yayılım nadirdir (42). Subglottik bölge metastazları sıklıkla paratrakeal lenf nodlarına (seviye 6) olmaktadır (55). Bu bölge tümörlerinde servikal lenf nodu metastazı insidansı %4-%27 arasındadır.
3.1.5.5. Evreleme
Larinks kanserlerinde, AJCC TNM evreleme sistemi kullanılmaktadır.
EVRELEME Evre I : T1N0 Evre II : T2N0
Evre III: T1,2,3 N1 T3N0
Evre IVA: T1,2,3 N2 T4a N0,1,3 Evre IVB: T1,2,3 N3, T4b N0,1,2,3 Evre IVC: T1,2,3,4 N1,2,3 M1
18 T evrelemesi
Supraglottik Larinks Ca
T1: Tümör bir anatomik alt bölgede sınırlı, kord hareketleri normal
T2: Tümör, supraglottise ait veya glottise ait veya dışarıda (dil kökü mukozası, vallekula, piriform sinus medial duvarı) komşu birden fazla alt bölgenin mukozasını invaze etmiş, larinks fiksasyonu yok
T3: Tümör kord fiksasyonu yaparak larinks icinde ve/veya şu bölgeleri invaze etmiş: postkrikoid bölge, preepiglottik bölge, paraglottik boşluk, ve/veya minor tiroid kartilaj erozyonu (ic korteks)
T4a: Tümör tiroid kartilajı invaze etmiş ve/veya larink dışı tutulum yapmış (trakea, boyun derin dokuları, tiroid, özefagus)
T4b: Tümör prevertebral boşluğu tutmuş, karotid arteri sarmış, mediastinal yapılara invaze olmuş
Glottik Larinks Ca
T1: Tümör normal hareketli kord(lar)ı tutmuş, anterior ve posterior komissür tutulmuş olabilir
T1a: Tümör tek korda T1b: Tümör her iki korda
T2: Tümör supraglottis ve/veya subglottise uzanmış ve/veya kord hareketleri azalmış T3: Tümör kord fiksasyonu ile birlikte larinks içinde sınırlı ve/veya paraglottik boşluğu tutmuş, ve/veya minör tiroid kartilaj erozyonu (iç korteks)
T4a:Tümör tiroid kartilajı invaze etmiş ve/veya larinks dışı tutulum yapmış (trakea, boyun derin dokuları, tiroid, özefagus)
T4b: Tümör prevertebral boşluğu tutmuş, karotid arteri sarmış, mediastinal yapılara invaze olmuş
Subglottik Larinks Ca T1 : Tümör subglottiste sınırlı
T2 : Tümör vokal kord(lar)a uzanmış, kord hareketleri normal veya azalmış T3 : Tümör kord fiksasyonu ile birlikte larinks icinde sınırlı
T4a: Tümör krikoid veya tiroid kartilajı invaze etmiş ve/veya larinks dışı tutulum yapmış (trakea, boyun derin dokuları, tiroid, özefagus)
T4b: Tümör prevertebral boşluğu tutmuş, karotid arteri sarmış, mediastinal yapılara invaze olmuş
N evrelemesi
N0 : Bölgesel lenf nodu metastazı yok
N1 : İpsilateral, tek, 3 cm veya daha küçük boyutlu lenf nodu N2a : İpsilateral, tek, 3 cm‘den büyük 6 cm‘den küçük lenf nodu N2b : İpsilateral, 6 cm‘den büyük olmayan lenf nodları
N2c : Bilateral veya kontralateral 6 cm den büyük olmayan lenf nodları N3 : 6 cm'den büyük lenf nodu tutulumu
M evrelemesi
M0 :Uzak organ metastazı yok M1 :Uzak organ metastazı var
19 3.1.6. Tükrük Bezi Maligniteleri
Tükrük bezi maligniteleri nadir rastlanılan bir gruptur. Tüm baş-boyun kanserlerinin %3‘nü oluşturur. Sıklığı 65-74 yaşda pik yapmaktadır. Tükrük bezi malignitelerinin %5‘inden daha azı çocukluk yaş grubunda görülmektedir. Ancak çocukluk grubunda görülen tümörler daha agresiftir (42). En sık parotis bezinde (%75), en az sublingual bezde izlenmektedir. Malign tükrük bezi tümörlerinde en sık histopatolojik tip mukoepidermoid karsinom, ikinci sıklıkla adenoid kistik karsinomdur. Bu iki grubu adenokarsinom takip etmektedir. Malign Tükrük Bezi tümörlerinde 10 yıllık sağkalım %47 ile %74 arasında değişmektedir. Tümörün T evresi ve extraglanduler içerik arttıkça metastaz varlığı ve kötü prognoz sıklığı artmaktadır (42). Tedavi rezektabl tümörlerde öncelikle cerrahidir. Histolojik alt tipe ve evreye bakılmaksızın tükrük bezi malignitelerinde N0 olgularda boyun diseksiyonu ile ilgili net bir karar yoktur. Palpabl lenf nodu varlığında ya da radyolojik olarak görüntülenmiş büyümüş lenf nodu varlığında eksizyona ipsilateral boyun diseksiyonu eklenmektedir. İleri evre, pozitif cerrahi sınır, SCC, indifferansiye karsinom, yüksek dereceli, mukoepidermoid karsinom gibi histolojik alt tiplerde, perinöral ve kemik invazyonu varlığında RT uygulanmaktadır.
3.1.7. Paranazal Sinüs Maligniteleri
Paranazal Sinüs Maligniteleri nonpalpabl oldukları için genellikle büyük boyutlara ulaştıklarında ve ileri evrede tanı alırlar. Nadir rastlanan malignitelerdendir. Tüm maligniteler arasında insidansı <% 1‘dir (42). En sık görülen histolojik tip SCC‘dir. Rezeke edilebiliyorsa cerrahi ve buna ek olarak cerrahi sınır negatif olan olgular dahil RT uygulanmaktadır. Sfenoid sinüs karsinomları genellikle geç saptanmaktadır ve tedavisi RT olup, nazofarinks karsinomları gibi izlenmektedir. Maksiller sinus karsinomlarında esas tedavi cerrahidir ancak sfenoid sinus, nazofarinks veya kafa tabanı tutulmuş ise sadece RT uygulanmaktadır (42). Maksiller sinus karsinomları genellikle teşhis edildiklerinde %75-80 sinus dışına taşmışlardır.
20 3.2. Klinik
3.2.1. Nazofarinks Kanseri
Nazofarinks kanserlerinin çoğu Rosenmüller fossadan köken almaktadır. Semptom ve bulgularının başında servikal lenfatik metastazlara bağrı ağrısız lenfadenomegaliler bulunmaktadır (56). Tüm boyun lenf guruplarına metastaz yapabileceği gibi, özellikle seviye II ve seviye V‘e metastaz sıktır. Bu nedenle boyun arka üçgeninde kitle saptanan bir hastada primer tümör lokalizasyonu açısından nazofarinks düşünülmelidir. Servikal nodların klinik tutulumu %60-87 oranda olup, %50'ye yakın hastada bilateraldir(57). Tümörün basısı ve invazyonuna bağlıçeşitli kraniyal sinir tutulumları görülebilir. Foramen ovale‘ye doğru tümörün superiora yayılımı trigeminal sinir tutulumuna neden olarak fasiyal ağrı ve yüz duyusunda değişikliğe neden olabilir. Myozis, ptozis ve enoftalmus ile karakterize Horner Sendromu karotid kılıf içindeki sempatik trunkusun tutulumu ile ortaya çıkabilir.
3.2.2. Oral Kavite Kanseri
Oral kavite kanserleri larinks kanserinden sonra baş-boyun bölgesinde en sık rastlanan kanserlerdir. Dil, ağız tabanı, yanak, sert damak retromolar üçgen ve gingiva tümorleri anatomik yerleşimleri, değişik histolojik ve davranış özellikleri nedeniyle alt bölgelere ayrılarak ayrı ayrı değerlendirilmektedir (58,59). Lokalizasyonları nedeniyle kolay saptanabilen kenserler olup başlıca semptomları; iyileşmeyen yara, kanama, ağrı, ağız kokusu, konuşma bozukluğu, yutmada güçlük, trismus, kulak ağrısıdır (60).
3.2.3. Orofarinks Kanseri
Orofarinks kanserlerinde genel başvuru yakınması sıklıkla tek taraflı, progressif otalji ve disfaji ile birlikte olan boğazda rahatsızlık öyküsüdür (61). Birçok hastada boğazın gerisinde şişlik hissi vardır. İlk başvuruda lenf nodu metastazı sıklıkla görülmektedir. Boyunda kitle bazen başvuru yakınması olabilir. Özellikle dil kökünde lokalize tümörlerde bilateral servikal lenf nodu metastazı riski yüksektir.
21 3.2.4. Hipofarinks Kanseri
Hipofarinks kanserleri sık olmamaları, tanı anında hastalığın genellikle ileri evrelere ulaşmış olması ve uygulanan cerrahi sonrası ortaya çıkan defektin kapatılmasındaki güçlükler nedeniyle önem kazanmaktadır (62, 63, 64). Disfaji genellikle en belirgin başvuru yakınmasıdır ve hemen daima kilo kaybı eşlik eder. Yansıyan otalji de sıklıkla mevcuttur (64). Servikal lenf nodu metastazına bağlı kitle bazen tek başvuru yakınması olabilir. Uzak metastaz riski %10 kadar olup öncelikle akciğer, kemik ve karaciğere metastaz olmaktadır.
3.2.5. Larinks Kanseri
Baş-boyun kanserleri arasında %45 oranla en sık görülen kanserdir. Larinks kanserleri lokalizasyonlarına göre supraglottik, glottik, subglottik ve transglottik olarak 4 grupta incelenir. Glottik kanserler %56-60, supraglottik kanserler %41-45 ve subglottik kanserler %1-2 oranında görülmektedir. Supraglottik kanserler; epiglotun serbest kenarından ventriküle kadar olan alana lokalize tümörlerdir. Supraglottik bölgenin lenfatikten zengin olması nedeniyle lenfatik yayılım sıklığı yüksektir (24). Glottik kanserler; genellikle vokal kordu ve ön komisürü tutarlar. İyi diferansiye tümör olmaları, lenfatiklerin yok denecek kadar az olması, tiroid kıkırdağın iyi bir bariyer oluşturması, yayılımın yavaş olmasını sağlayan en önemli faktörlerdir (65). Subglottik kanserler; ön komisürde vokal kordların serbest kenarının 2-4 mm ve vokal çıkıntıların ucundan 5-7 mm kadar aşağısından başlayarak krikoid kıkırdak alt kenarına uzanmaktadırlar. Transglottik kanserler; bir larengeal bölgeden glottisi geçerek diğer bölgeye atlayan tümörlere denir. Erken dönemde paraglottik alana yayıldıklarından prognozları kötüdür (65). Ses kısıklığı larinks kanserinin en çok görülen belirtisidir. Özellikle glottik lezyonların ilk belirtisidir. Larinks veya hyoid altı bölgede boyunda görülen şişlik larinks içindeki tümörün tiroid kıkırdak veya tirohiyoid membran bariyerini aşıp cilt altına yayıldığında görülmektedir.
22 3.3. Tanı
3.3.1. Nazofarinks Kanseri
Anamnez ve fizik muayeneyenin ardından indirekt posterior rinoskopiyle tümör görsel olarak değerlendirilir. Orofarinks ve hipofarinks muayenesinin yanısıra, tüm kranial sinirlerin test edilmesi ve timpanik membrann incelenmesi gerekmektedir (66). BT ve MRG ile tümörün karakterizasyonu ve lokal yayılım gibi koşullar belirlenmelidir.
3.3.2. Oral Kavite Kanseri
Oral kavite kanserlerinde sık gözlenen multifokal hastalığın belirlenebilmesi için mutlaka bimanuel muayene yapılmalı, dil, ağız tabanı, damak gibi bölgeler palpe edilerek gözden geçirilmelidir (21). Primer lezyondan yapılacak biyopsi genellikle insizyonel ya da ve punch biyopsi tarzındadır.
3.3.3. Orofarinks Kanseri
Orofarinksin tam görülebilmesi için ayna ile indirekt muayene gereksinimi vardır (dilkökü, vallekula için). Tümörler sıklıkla lokal invazyon yapma eğiliminde olup gerçek boyutları, kemik ve çevre yumuşak doku tutulumu palpasyon ve ileri görüntüleme yöntemleri (MR, BT) ile saptanabilir. Uzak metastaz riski oral kavite tümörlerine oranla biraz daha fazla olduğundan sistemik değerlendirme mutlaka yapılmalıdır (42). Üst solunum ve sindirim sisteminde ikinci bir malignite olasılığı da akılda tutulmalıdır. Ülserovejetan kitlelerde kesin tanı için punch biyopsisi, diffüz büyümelerde tonsillektomi yapılmaktadır.
3.3.4. Hipofarinks Kanseri
Hipofarinks kanserlerinde; tümör priform sinüs girişinde veya arka duvarda lokalize ise ayna muayenesi ile tümör görülebilir. Kord vokal paralizisi olup olmadığı muayene, fleksibl veya rijit endoskopi ile değerlendirilmelidir. Baryumlu pasaj grafisi mukozada dolma defekti olduğunu göstermektedir. Priform sinus konvansiyonel görüntülemelerde sıklıkla kollapsa uğradığından, endoskopiyle apeksi görüntülemenin zor olması nedeniyle değerlendirmede baryumlu grafiler kullanılabilir (67). Direkt akciğer grafisi, akciğer metastazını, 2. primer tümör
23 varlığını ve metastaza bağlı paratrakeal ve mediastinum tutulumunu gösterebilir. Tanı mutlaka biyopsi ile konmalıdır.
3.3.5. Larinks Kanseri
Tanı amacıyla öncelikle larinks kanseri ile uyumlu klinik semptomları olan hastalardan iyi bir anamnez alınmalı ve fizik muayene yapılmalıdır. Hastanın ses kalitesi ve sesindeki değişim değerlendirilmelidir. Larengeal krepitasyonun kaybolması, krikoid kıkırdağa yakın bir tümörü ya da retrofaringeal lenf nodlarının metastatik tutulumu düşündürmektedir (68). Tanının ilk basamağı indirekt laringoskopidir. Tümörün yer ve yayılımı, vokal kordların mobilitesi iyice gözden geçirilmelidir. Mikrolaringoskopi ile tümörün yeri ve yaygınlığı, ventrikül ve sinüs piriformis gibi gizli köşelerin durumu, tümörün yüzeysel karakterleri (nodüler, ekzofitik, granülomatöz, ülsere vb. gibi) değerlendirilebilir (69). Histopatolojik tanı için de biopsi alınmalıdır. Uzak metastazların tespiti için gerekli olgularda tüm batın ultrasonografisi, kemik sintigrafisi ve toraks BT görüntüleme yapılabilir.
3.4. Tedavi
Baş-boyun kanserlerinde lokal ve bölgesel yayılım önemli yer tutmaktadır. Tedavide öncelikle primer tümör ve varsa bölgesel yayılım kontrol altına alınmalıdır. Tedavi amaçlı agresif cerrahi girişimler yapıldığında fonksiyonel ve kozmetik kayıplar artmaktadır. Baş-boyun kanserlerinde hastanın iyi değerlendirilip en az zararla, en uygun tedavinin uygulanması zorunluluğu vardır.
Nazofarinks kanserleri; anatomik yeri, kafa tabanıyla olan sınırları, erken bilateral ve cerrahi olarak ulaşımı güç retrofarengeal nod tutulum özellikleri ile primer tümör ve boyun bölgesine yüksek doz RT uygulanması esas tedavi şeklidir. Cerrahi, RT‘den sonra rezidüel hastalık varlığında veya klinik tam yanıttan sonra rekürrens gelişen olgularda radikal boyun diseksiyonu veya ganglion ekstirpasyonu biçiminde yapılabilir (70, 71). Radyosensitif tümörler olduğundan erken evre hastalıkta tek başına RT ile yüksek sağkalım oranlarına ulaşılmaktadır (72,73). İleri evrede sağkalım oranı kötüdür. Erken evre hastalıkta (T1 –T2) eksternal RT iyi lokal kontrol oranı sağlamaktadır. T3 ve T4 tümörlerde bu oranlar belirgin olarak daha düşüktür (74, 75).RT ve KT kombinasyonunun ek terapotik etkisi ile beş yıllık sağ kalımlar artmaktadır.
24 Oral kavite ve dil kanserlerinde; erken evrede (evre 1-2) RT veya cerrahi ile kür şansı yüksektir (1-3). Cerrahi sınır pozitifliği ve tümör derinliğinin 5 mm‘den daha fazla olması kombine tedaviyi ön plana çıkarmaktadır (4-5). İleri evre tümörlerde ise bölgesel lenf nodu ve/veya uzak metastastaz yoksa ya da metastatik lenf nodları 2 cm‘den küçükse sadece RT veya cerrahi tedavi, evre 3-4 olguların çoğunda ise lokal rekürrens ve uzak metastaz riski yüksek olduğundan kombine tedaviler uygulanmaktadır (2).
Orofarengeal kanserler; genellikle kötü diferansiye, çevresi infiltrasyonla sarılı ülserli tümörlerdir. Lateral ve posterior duvardan kaynaklanırlar ve erken dönemde bölgesel lenf nodlarına metastaz yaparlar. Lokal olarak hipofarinks ya da nazofarinkse yayılırlar. Lateral duvardan köken alanlar epiglot ve fossa priformisi tutarlar ve boyun orta düzey lenf nodlarına metastaz yaparlar. Derin prevertebral fasya nadiren tutulmaktadır ve tümör bu bölgeyi geç dönemde infiltre etmektedir. Tümör 9. kranial siniri tutabilir ve böylece kafa kaidesine yayılabilir. İnfiltratif lezyonlarda RT daha etkindir. Posterior duvar tümörlerinde uzak metastaz olasılığı daha fazladır. Orofarengeal tümörlerin çoğu RT ve cerrahi kombinasyonuyla tedavi edilmektedir (31, 33).
Hipofarinks kanserlerinde; T1 veya T2 tümörlerin bazılarında ve düşük volümlü ekzofitik piriform sinüs tümörlerinde sadece RT yeterli olabilir (76). Evre 1 karsinomlarda genellikle larengofarenkjektomi ve boyun diseksiyonunu takiben RT uygulanır. Evre 2‘de cerrahi ve takiben RT ya da neoadjuvan KT sonrası cerrahi ya da RT uygulanabilir. Evre 3 ve rezektabl evre 4 hipofarinks karsinomlarında cerrahi ve takiben RT, neoadjuvan KT sonrasında cerrahi yada KT diğer bir seçenek olarak cerrahiyi takiben adjuvan RT ve KT uygulanabilir. Anrezektabl evre 3 ve evre 4 olgularda RT ve KT protokolleri uygulanır (76).
Larinks kanserinde; cerrahi ve RT iki ana tedavi yöntemidir (76). Tümörün yayılımı, yeri, evresi, lenf nodu metastazlarının varlığı, hangi tedavi yöntemi ile en çok kür şansının tanınabileceği, larinks işlevlerinin ne kadar korunabileceği önemlidir. N+ olgularda teropatik, N0 olgularda profilaktik amaçlı boyun disseksiyonu uygulanır. Erken evre supraglottik ve glottik kanserlerde konservatif parsiyel larenjektomi ile RT‘nin eşit sağkalım sağladığı yönünde birçok çalışma vardır. Rezektabl lokal ileri evre tümörlerde klasik yaklaşım postoperatif RT iken
25 son yıllarda organ koruyucu KRT protokolleri de artan sıklıkta kullanılmaya başlanmıştır. Subglottik kanserlerde ise genel olarak kombine (cerrahi +RT) tedavi önerilmektedir (77). Organ koruyucu protokoller ile gündeme gelen neoadjuvan KT ile primer tümörün önemli oranlarda küçüldüğü tespit edilmekle beraber, bu uygulamanın sağ kalıma ek bir katkısı henüz gösterilememiştir (77, 78).
3.5. Tedavi Öncesi Evreleme
Baş-boyun kanserlerinde uygun tedavi modalitesi seçimi öncesi tümör boyutu, lenf nodu metastazı varlığı, komşu doku invazyonu, tümör derinliği ve uzak metastaz varlığını belirlemek için çeşitli görüntüleme yöntemleri kullanılmaktadır (78).
3.5.1. Servikal Lenf Nodu Haritalaması
Baş-boyun kanserlerinde tanı ve izlemde standardizasyon için ‗Committee for Head and Neck Surgery and Oncology, American Academy of Otolaryngology-Head and Neck Surgery‘ grubu 1991 yılında yayımladığı ve 2008‘de güncellenen klasifikasyon kullanılmaktadır (9) (şekil 5).
Seviye I: Submental lenfatikler (I A), Submandibuler lenfatikler (I B)
Seviye II: Üst juguler lenf nodları Seviye III: Orta juguler lenf nodları Seviye IV: Alt juguler lenf nodları
Seviye V: Posterior boyun üçgeninde bulunan lenf nodları Seviye VI: Boynun anterior kompartmanındaki lenf nodları (prelarengeal, pretrakeal, paratrakeal lenf nodları)
26
ġekil 6: Servikal Lenf Nodu Bölgeleri
3.5.2. Bilgisayarlı Tomografi (BT)
BT ile yapı ve oluşumların geometrik yapıları ve dansite farklılıkları belirlenerek hastalıklar tanımlanmaya çalışılmaktadır. BT‘de bilgisayar yardımı ile kesitsel görüntü elde edilmektedir. X ışınları hasta vücudundan geçtikten sonra dedektör zincirine ulaşır. Dedektörlerde hasta vücudundaki emilim sonucu X ışınında ortaya çıkan zayıflama miktarı hesaplanarak görüntü oluşturulmaktadır (79). BT‘nin anatomik yapıların ayrıntılı değerlendirilmesi, organlar arasındaki ilişkilerin gösterilmesi ve iki taraflı karşılaştırmanın kolaylıkla yapılabilmesi gibi avantajları vardır. Spiral BT ile elde edilen reformat görüntüler anatomik yapıların multiplanar değerlendirilmesine olanak sağlamaktadır. Özellikle lokal ya da metastatik kemik tutuluşu ile akciğer metastazlarının değerlendirilmesinde BT‘nin vazgeçilmez rolü vardır. Ancak tümörün yarattığı doku kalınlaşması ve doku yıkımının ödemden ayrımında, kıkırdak invazyonlarının saptanmasında sıklıkla yetersiz kalmaktadır (80).
27 3.5.3. Magnetik Rezonans Görüntüleme (MRG)
Dinamik kontrastlı MRG verilerin farmokinetik iki kompartman modeli kullanılarak işlemlenmesi sonucu hem yapısal hem de fonksiyonel bilgilerin elde edilmesine imkan vermektedir (81,82). Dinamik MRG‘de malign lezyonların hızlı ve daha yoğun kontrastlanma gösterdikleri tespit edilmiştir (83). MRG artmış yumuşak doku kontrastı ile anatomik detayları oldukça iyi ortaya koyar ve diğer görüntüleme yöntemlerine oranla çok daha fazla anatomik yapının değerlendirilmesini sağlar. MRG kemik iligi tutulumunu göstermede BT‘den daha üstündür (84).
MRG‘de hasta vücudunu içine alacak bir gantri içerisinde çok güçlü bir manyetik alan oluşturulur. Görüntüleme temeli bu güçlü manyetik alan içerisinde organizmada gerçekleşen anatomik-moleküler etkileşimlere dayanmaktadır. Burada elde edilen veriler daha sonra bilgisayarlarda değerlendirilir ve görüntüleme ünitesine aktarılır. Baş boyun kanserlerinde primer tümörün lokal değerlendirmesinde MRG önemli yer tutmaktadır.
Morfolojik görüntüleme yöntemleri lezyonların kontrast tutma paterni, çevre doku ile ilişkileri ile lenf nodlarının büyüklüğü kriterlerine dayanır. Küçük veya submukozal yerleşimli tümörler anatomik görüntüleme yöntemleriyle komşu dokulardan ayrılamayabilir (82). Lenf nodlarının boyutunun değerlendirilmesinde ölçümün hangi eksende yapılacağı, boyut olarak hangi eşik değerinin metastaz için anlamlı kabul edileceği konusunda kesin görüş birliği bulunmamakla birlikte kısa aksı 10 mm üzerindeki lenf nodları patolojik kabul edilmektedir (84). Lenf nodlarında santral nekroz varlığı, erken kontrast tutulumu, ekstrakapsüler yayılımı işaret eden düzensiz sınır ve yuvarlak şekil metastazı düşündürürken, santral hilusu seçilebilen küçük boyutlu ovoid lenf nodları sıklıkla benign kabul edilmektedir. Ancak bu kriterlerden hiçbirisi tek başına metastaz için yeterli özgüllükte değildir. Bu nedenle nodal metastazların ve primer tümör odaklarının değerlendirilmesinde, anatomik bilgiye ek olarak metabolik bilgi de sunabilen PET/BT gibi hibrid sistemlere ihtiyaç duyulmaktadır.
28 3.5.4. Pozitron Emisyon Tomografisi (PET)
ġekil 7: Siemens Biograph 16 TruePoint PET/BT
PET, dokuların perfüzyonunu, metabolik aktivitesini ve viabilitesini yansıtan tomografik görüntüler ve kantitatif parametrelerin kullanıldığı non-invaziv bir görüntüleme yöntemidir (85). PET diğer nükleer tıp yöntemlerinde olduğu gibi emisyon tekniğine dayalı olup anatomik bilgiden çok fonksiyonel-metabolik aktivite hakkında bilgi sağlamaktadır. Vücuda verilen pozitron yayıcı radyofarmasötiklerden yayılan ışınların vücut içerisindeki dağılımları belirlenir ve üç farklı uzaysal düzlemde görüntüleme elde edilir. PET vücutta radyonüklid ile işaretli radyofarmasötik molekülünden pozitron emisyonu sonrasında oluşan iki annihilasyon fotonunu algılamaktadır. Her iki annihilasyon fotonunun koinsidans dedeksiyonu tek foton görüntülemeyle karşılaştırıldığında artmış duyarlılık kazandırmakta ve transmisyon tarama ya da bilgisayarlı tomografik bilgiden daha iyi kolimasyon ve doğru atenüasyon düzeltmesi sağlamaktadır (86). Bu da PET görüntülerinden elde edilen kalitatif bilginin yanında doğru kantitatif bilginin ortaya çıkarılmasına izin vermektedir.
29 PET sistemlerinde, organizmanın temel yapıtaşlarında bulunan Karbon (C), Flor (F), Ozon (O) ve Azot (N) elementlerinin pozitron yayan izotopları ile yer değiştirerek elde edilen kısa yarı ömürlü radyofarmasötikler kullanılmaktadır. Pozitron yayıcılar (C-11, N-13, O-15, F-18, vb) rölatif kısa ömürlüdür, bu da hastaya verilen radyasyon dozunu düşük tutarken görüntüleme fotonlarının optimal kullanımına yardımcı olmaktadır. En sık Flor-18 (F-18) ile işaretli 2-deoksi-D-Glukoz kullanılmaktadır. FDG bir glukoz analoğudur. Neoplastik ve inflamatuvar hücrelerde artmış glikolitik metabolizmanın ve artmış glukoz kullanımının olması nedeni ile bu tip hücrelerde artmış FDG tutulumu söz konusudur (86). F-18 FDG PET tek çekimde tüm vücudun değerlendirilmesini sağlamaktadır (86).
3.5.4.1. Temel Fiziksel Prensipler
Pozitron (ß+) elektron ile aynı kütlede ve pozitif yüklü, partiküler bir radyasyondur. Pozitron yayan radyoaktif maddeler, kararlı izotopların siklotron adı verilen parçacık hızlandırıcılarında yüklü partiküller (proton, helyum çekirdeği gibi) ile bombardımanı sonucunda elde edilmektedirler. Siklotronda, yüklü partiküller değişken elektromanyetik alanlar yardımıyla dairesel bir eksen üzerinde hızlandırılır ve hedefe yerleştirilmiş kararlı izotoplara doğru yönlendirilir. Böylece hedefte bulunan kararlı izotoplar çekirdeklerinde artan proton sayısı nedeniyle kararsız hale geçerler ve tekrar kararlı hale dönmek üzere pozitron yaymaya başlarlar. Atom çekirdeğinin indirgenmesi sürecinde salınan pozitron, bulunduğu ortam içerisinde yaklaşık 1-3 mm kadar (F-18 FDG 2 mm) ilerleyerek ortamda mevcut serbest bir elektron ile birleşir (87). Bu birleşme sonrasında her iki partikül de enerjiye dönüşür ve ortaya birbiri ile 180º açı yapan, 511 keV enerjiye sahip iki gama fotonu çıkar. Bu olaya ―Annihilasyon‖ adı verilmektedir.
Pozitron yayıldıktan sonra annihilasyon oluşuncaya kadar geçen sürede kat ettiği mesafe PET tarayıcının çözünürlüğünü belirleyen önemli bir faktördür. Bu mesafenin artması çözünürlüğü olumsuz yönde etkilediği gibi kantitasyon hatalarına da neden olmaktadır (87, 88).
3.5.4.2. Temel Görüntüleme Prensipleri
Hastaya uygulanarak vücutta biyodağılımını tamamlayan görüntüleme ajanından kaynaklanan, aralarında 180º açı bulunan 511 keV‘lik gama fotonu çiftlerini tespit etmek üzere farklı sayı ve konfigürasyonlarda detektör halkaları mevcuttur. Birbiri ile 180º açı yapacak şekilde yer alan detektör çiftleri, belirlenen
30 zaman limiti içerisinde tespit edilecek her bir gama foton çiftini sistem bilgisayarında x, y ve z eksen koordinatları ile birlikte tek bir nokta olarak kaydetmektedirler (88). Bu zaman limiti dışında detektörlere ulaşan fotonlar ise sayıma dahil edilmezler. Bu noktalar radyoaktivitenin yoğun olduğu bölgelerden daha çok, az olduğu bölgelerden ise daha az sayıda kaydedilmektedirler. Bu ham veriler sistem bilgisayarı tarafından işlenerek tomografik PET görüntüleri oluşturulmaktadır (78).
3.5.4.3. Detektör ve Kristal Yapıları
Detektörlerde sintilasyon teknolojisi kullanılmaktadır. Farklı kimyasal yapılardaki [NaI(Tl),BGO, LSO gibi] sintilasyon kristallerinin özelliği radyasyon ile etkileştikleri zaman bir ışıltı oluşturmalarıdır. Bu ışıltı, sintilasyon kristalinin arkasında bulunan ve pozisyon belirleme özelliği olan foton çoğaltıcı tüpler (photo-multiplier tube) tarafından algılanır ve amplifiye edilerek sistem bilgisayarına gönderilir. İdeal bir PET detektörünün gelen gama fotonunu tam olarak durdurabilmesi, kısa süreli ve yüksek şiddette bir ışık parıltısı oluşturması arzu edilmektedir. Dedike PET tarama sistemlerinde tam bir halka boyunca binlerce detektör bulunmaktadır. Detektörlerin küçük ve çok sayıda olması sistemin uzaysal rezolüsyonuna olumlu yönde katkıda bulunmaktadır. PET tarayıcılarında farklı sintilasyon kristalleri kullanılabildiği gibi farklı mekanik ve konfigürasyonlar da mevcuttur (89, 90).
Günümüzde PET tarayıcısı ile birlikte aynı sistem içerisinde BT veya MRG içeren sistemler mevcut olup ―Hibrid Sistemler‖ olarak adlandırılmaktadır. Bu tür cihazlar sayesinde aynı seansta hem yapısal hem de fonksiyonel görüntüler elde edilebilmektedir (91).
3.5.4.4. Atenüasyon Düzeltmesi
Görüntüleme ajanının enjekte edilmesi sonrasında vücut içerisindeki organlardan kaynaklanan gama fotonları (emisyon görüntüleme) detektörlere ulaşmak üzere yolları üzerindeki değişik yoğunluktaki dokulardan geçerler ve bu sırada belli oranlarda absorbe edilirler. Absorbsiyon miktarı fotonun kat ettiği mesafe ve içerisinden geçtiği dokunun yoğunluğu ile doğru orantılıdır. Örneğin gama fotonları kemik dokudan geçerken, akciğer dokusundakinden daha çok soğurulmaktadır. PET görüntülemede kullanılan gama fotonlarının enerjilerinin yüksek olması (511 keV) soğurulmanın belli bir oranda sınırlı kalmasını sağlasa da