- 0 - T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
MEME KANSERLİ OLGULARDA HER2/neu POZİTİFLİĞİNİN ve TRASTUZUMAB KULLANIMININ BEYİN METASTAZI GELİŞİMİNE ETKİLERİ
İÇ HASTALIKLARI UZMANLIK TEZİ Dr.Hamza ERTUĞRUL
Tez Danışmanı
Prof.Dr.Abdurrahman IŞIKDOĞAN
DİYARBAKIR 2011
- 1 - İÇİNDEKİLER TEŞEKKÜR……….2 KISALTMALAR VE SİMGELER……….3 TABLOLAR DİZİNİ………....4 ŞEKİLLER DİZİNİ………..4 GİRİŞ VE AMAÇ……….5 ÖZET……….7 ABSTRACT……….9 GENEL BİLGİLER………....11 GEREÇ VE YÖNTEM…….………..34 BULGULAR………....36 TARTIŞMA………..54 SONUÇLAR……….59 KAYNAKLAR………60
- 2 - TEŞEKKÜR
Ġç hastalıkları uzmanlık eğitim sürecinde her türlü fedakarlık ve emeği bize sunan saygıdeğer hocalarım, Prof . Dr. Ekrem MÜFTÜOĞLU na , iç hastalıkları A.B.D baĢkanımız Prof . Dr. Emin YILMAZ ‟ a ,Prof .Dr. Vedat GÖRAL ‟a , Prof . Dr. Orhan AYYILDIZ‟ a , Prof .Dr. Kendal YALÇIN ‟a ,Prof Dr Alpaslan Kemal TUZCU‟ a, Doc. Dr Muhsin KAYA‟ ya, Doc. Dr. Ali Kemal KADĠROĞLU‟ na Yrd.Doc.Dr.Hasan KAYBAġI‟na ,Yrd Doc Dr Ali ĠNAL‟a,Yrd.Doc.Dr Mehmet KÜÇÜKÖNER e ve tüm çalıĢma arkadaĢlarıma teĢekkür eder ,saygılarımı sunarım.
Tezimin her aĢamasında büyük emeği olan ve ihtisas süresince desteklerini sunan değerli hocam Prof.Dr . Abdurahman IġIKDOGAN‟a teĢekkür eder ,saygılarımı sunarım.
Tezimin hazırlama aĢamasında katkıları olan Yrd. Doc. Dr. Muhammed Ali KAPLAN‟ a teĢekkür eder, saygılarımı sunarım.
Tezim ile ilgili verilerin patolojik incelemesinde büyük emek ve katkı sağlayan Yrd.Doc.Dr. Uğur FIRAT a teĢekkür eder,saygılarımı sunarım.
Rotasyon eğitimim sırasında bilgilerini benimle paylaĢan Kardiyoloji A.B.D., Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D , Göğüs Hastalıkları ve Tüberküloz A.B.D., Biyokimya A.B.D., ve Radyoloji A.B.D., baĢkanları ve öğretim üyelerine teĢekkürlerimi sunarım.
Hayatımın her döneminde bana destek olan, kendi hayatları pahasına beni yetiĢtirip maddi manevi sıkıntılarımda yanımda olan annem, babam ve diğer aile bireylerine teĢekkür ederim.
Her zaman her konuda bana desteğini sunan hayat arkadaĢım Remziye ERTUĞRUL‟ a teĢekkür ederim.
Ayrıca hastalarımıza ve onların tanı ve tedavisinde emeği gecen herkese teĢekkür ederim. Dr. Hamza ERTUĞRUL
- 3 - KISALTMALAR VE SİMGELER
Aİ: Aramotaz Ġnhibitörü
ASCO: Amerikan kanser cemiyeti BT(CT) : Bilgisayarlı Tomografi DCIS : Duktal Karsinoma in Situ DNA : Deoksiribonükleik Asit
EGFR : Epidermal Büyüme Faktör Reseptörü ER : Östrojen Reseptörü
FİSH: flöresan in situ hibridizasyon FDA:Amerikan federal ilaç ajansı
HER-2 : Human Epidermal Büyüme Faktör Reseptör 2 İHK(İHC): immünhistokimya yöntemi
IDC : Ġnfiltratif Duktal Karsinom LCIS : Lobuler Karsinoma in Situ. KT : Kemoterapi
MMK : Metastatik Meme Kanseri
MRG : Manyetik Rezonans Görüntüleme PR : Progesteron Reseptörü
PTHrp : Paratiroid Hormon Salgılatıcı Peptid RT : Radyoterapi
TNM : Tümör Nod Metastaz TBI : Tüm Beyin IĢınlaması WHO : World Health Organisation
- 4 - TABLOLAR DİZİNİ
TABLO A.1 MEME TÜMÖRLERĠNĠN SINIFLAMASI…………...………..…12
TABLO A.2 MEME KANSERĠ GELĠġĠMĠNĠN RĠSK FAKTÖRLERĠ………...14
TABLO A.3 MEME KANSERĠNDE TNM SINIFLAMASI……….……16
TABLO A.4 MEME KANSERĠNĠN TNM EVRELEMESĠ………...…17
TABLO A.5 MEME KANSERĠNDE PROGNOSTĠK PREDĠKTĠF FAKTÖRLER……...19
TABLO B.1 TÜM HER-2 POSĠTĠVE HASTALARIN GENEL ÖZELĠKLERĠ……….45
TABLO B.2 TÜM HER-2 POSĠTĠVE HASTALARIN MULTĠVARYANT ANALĠZ.…....46
TABLO B.3 HER-2 POZĠTĠF METASTATĠK HASTALARIN GENEL ÖZELĠKLERĠ…..49
TABLO B.4 METASTATĠK HASTALARIN MULTĠVARYANT ANALĠZĠ ……...50
TABLO B.5 BEYĠN METASTAZLI HASTALARIN GENEL ÖZELĠKLERĠ ………..52
ġEKĠLLER DĠZĠNĠ ġEKĠL B.1 ÇALIġMA HASTALARI SEÇĠM YÖNTEMĠ………...37
ġEKĠL B.2 ÇALIġMA HASTALARININ GRUPLANMASI ……….……...38
ġEKĠL B.3 MEME KANSERLĠ HASTALARIN BEYĠN METASTAZ DAĞILIMI……….39
ġEKĠL B.4 HER-2 POZĠTĠF HASTALARDA BEYĠN METASTAZ DAĞILIMI……….…39
ġEKĠL B.5 METASTATĠK HASTALARIN BEYĠN METASTAZ DAĞILIMI ….…….…..40
ġEKĠL B.6 ÇALIġMA HASTALARI BEYĠN METASTAZ SIKLIKLARI………...41
ġEKĠL B.7 HASTALARIN BEYĠN METASTAZI DAĞILIMI ………...……..42
- 5 - GİRİŞ VE AMAÇ
Meme kanseri kadınlarda en sık görülen kanser türüdür. Kadınlarda kansere bağlı ölümlerde ise akciğer kanserinden sonra ikinci kanser türüdür. Tüm kadınların sekizde biri hayatlarının bir döneminde meme kanserine yakalanmariski taĢır.Meme kanserli hastalarda metastazlar morbidite ve mortalitenin baĢlıca nedenidir.(1,2,3) Beyin metastazınında ikinci en sık sebebidir ve en sık leptomeninjeal tutulum gözlenen tümör türüdür.( 2,4)
Sistemik bir hastalık olan meme kanserinin tedavisindeki geliĢmeler sayesinde, hastaların sağkalım süreleri uzamıĢ; bu da meme kanseri hastalarında beyin metastazı görülme sıklığında artıĢa neden olmuĢtur. Genel olarak meme kanserinde beyin metastazı geliĢimi yaĢ, tümör boyutu, grade, nodal status, hormon reseptör durumu,HER-2 reseptör durumu gibi prognostik faktörlerle iliĢkilidir. Beyin metastazlarının tanısı; baĢ ağrısı ve mental değiĢiklikler gibi hasta semptomlarına ve bilgisayarlı tomografi (BT) ve manyetik rezonans görüntüleme (MRG) gibi görüntüleme yöntemlerine dayanır. Beyin metastazlarında, tedavi seçenekleri hastanın prognostik faktörlerine ve beyin metastaz sayı ve boyutuna göre; cerrahi ve radyoterapi olup etkinliği kesin olmamakla birlikte kemoterapide sayılabilir.(5,6,7,8)
HER-2 ya da c-erb-B2 „human epidermal growth faktör 2‟/neu adıyla bilinen glikoproteindir. HER-2 neu geni büyüme faktör reseptör tirozin kinaz ailesinden 185- kD ağırlığındaki transmembran proteini kodlar.Bu maddenin ekspresyonu kanser dokusunda artmıĢtır. HER-2 proteini immünhistokimyasal olarak değerlendirilebilmektedir. HER-2, epidermal büyüme faktör reseptörüne benzer yapıda olup meme kanserlerinin yaklaĢık olarak %25-30‟unda aĢırı ekspresse edilmektedir(10). HER-2 aĢırı ekspresyonunun, erken evre meme kanserli hastalarda kötü prognozla iliĢkisi gösterilmiĢtir (10). Trastuzumab, HER-2 reseptörüne karĢı geliĢtirilmiĢ monoklonal antikordur. Dirençli ileri evre meme kanserli hastalarda tek baĢına trastuzumab ile %11-15 civarında yanıt elde edilmiĢtir(10,11). Taksan grubu baĢta olmak üzere diğer kemoterapötik ilaçlarla kombine edildiğinde yanıt oranları artmıĢtır. (10). Dolaysıyla , kemoterapi ile kombine kullanımı ile sağkalım sonuçları tek baĢına kemoterapiden daha üstün bulunmuĢtur(10,11).
Metastatik meme kanserli hastaların yaklaĢık olarak %6-16‟sında semptomatik beyin metastazı geliĢmektedir (10,13,14). HER-2 aĢırı expresyonu olan ve trastuzumab tedavisi alan meme kanserli hastalarda beyin metastazı görülme sıklığında artıĢ olduğunu bildiren çalıĢmalar giderek artmaktadır (11,12,13). Beyin metastazı görülme sıklığındaki artıĢ nedenleri arasında
- 6 -
trastuzumab ile iyi bir sistemik kontrol elde edilmesi buna bağlı sağkalımın uzaması ve klinik seyrin değiĢmesi, trastuzumabın kan-beyin bariyerini iyi geçememesi ve aĢırı HER-2 ekspresyonu gösteren tümörlerin daha agresif biyolojik davranıĢa sahip olması gibi görüĢler ileri sürülmektedir (12,13,14). ÇalıĢmalarda trastuzumab kullanan hastalarda beyin metastazı riskinin artığına dair görüĢ birliği bulunmamaktadır.
Bu çalıĢmamızdaki amacımız: Metastatik meme kanseri tanısı alıp HER-2 aĢırı expresyonu olan olgularda trastuzumab kullanımının beyin metastaz riskini artırıp artırmadığını araĢtırmaktır. Elde edilecek olan sonuçlar doğrultusunda trastuzumab ile sagkalımı uzayan olgularda proflaktik beyin ıĢınlamasının önerilip önerilemeyeceğini ortaya koymaktır. Bu amaçla Dicle Üniversitesi Tıp Fakültesinde Onkoloji Bilim Dalında 2001- 2011 yılları arasında düzenli takip edilen meme kanserli hastalarının dosyalarının retrospektif incelenmesi ve hastaların HER-2 pozitifliği ve trastuzumab kullanımı ile beyin metastazı arasındaki iliĢkinin analiz edilmesi planlanmıĢtır.
- 7 - ÖZET
Amaç:Meme kanseri kadınlarda en sık rastlanan kanserdir.Tanımlanan birçok prognostik ve prediktif faktör bulunmaktadır.HER-2 onkogeni olguların yaklaĢık %25 inde saptanır.Tek baĢına kötü prognostik bir faktördür. Ancak son yıllarda HER-2 ye karĢı geliĢtirilen monoklonal antkikor olan Trastuzumab kullanımı ile hem erken hem de metastatik olgularda olumlu sonuçlar elde edilmiĢtir. Trastuzumab kullanan metastatik meme kanserli olgularla beyin metastazının sıklığı ile ilgili çeliĢkili bilgiler mevcuttur. Bu çalıĢmamızdaki amacımız HER-2 pozitif metastatik meme kanserli hastalarda trastuzumab kullanan ve kullanmayan hastalarda beyin metastazı riskini karĢılaĢtırmaktır.
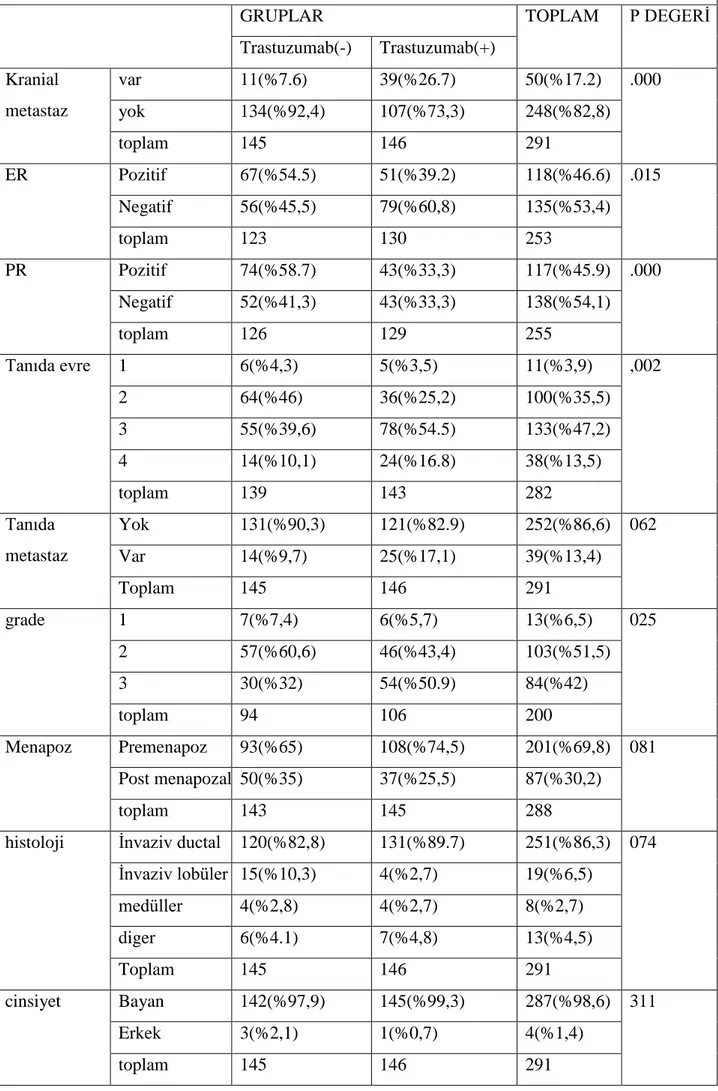
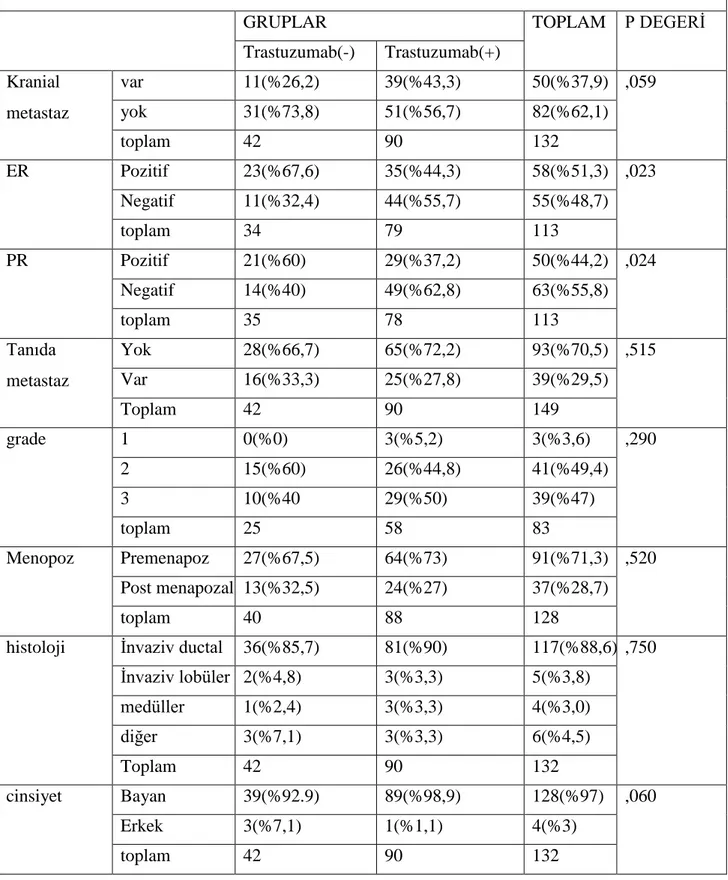
Materyal –method: Dicle Üniversitesi Tıp Fakültesi Tıbbi Onkoloji Bilim Dalında takip edilen 1248 meme kanserli hastanın dosyaları retrospektif olarak incelendi. Bunların arasından 295 hasta HER-2 pozitifti (immünhistokimyasal olarak +3 veya FĠSH pozitif) . 4 hastada baĢlangıçta beyin metastazı olduğu için çalıĢma dıĢında bırakıldı. HER-2 pozitif 291 hastada beyin metastazını etkileyen faktörler açısından incelendi. HER-2 pozitif 291 hastadan 132 si metastatik evredeydi.Metastatik meme kanserli 132 hastadan 42 si trastuzumab kullanmamıĢtı 90 nı ise trastuzumab kullanmıĢ hastalardı.Trastuzumab kullanan ve kullanmayan hastalarda beyin metastazı geliĢme oranları ve bunu etkileyen ER,PR, tanıdaki evre , tanıda metastaz ,grade , menopoz durumu,histolojik tip ,cinsiyet gibi parametrelerle iliĢkisine bakıldı.istatistiksel analizler için SPSS 16.0 programı kullanıldı.P≤0,05 değerleri anlamlı olarak kabul edildi.
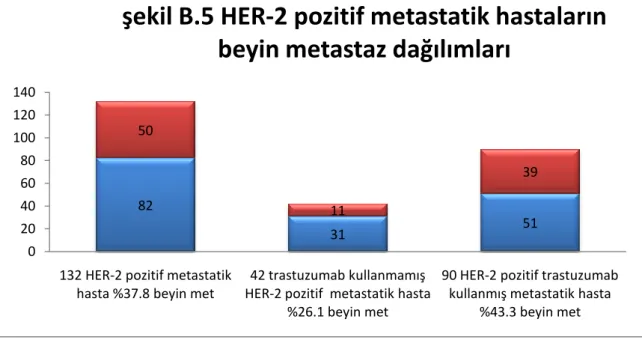
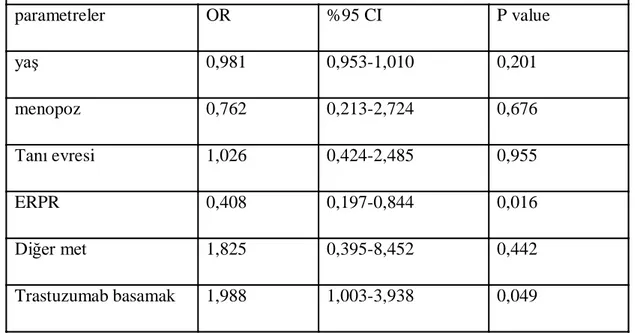
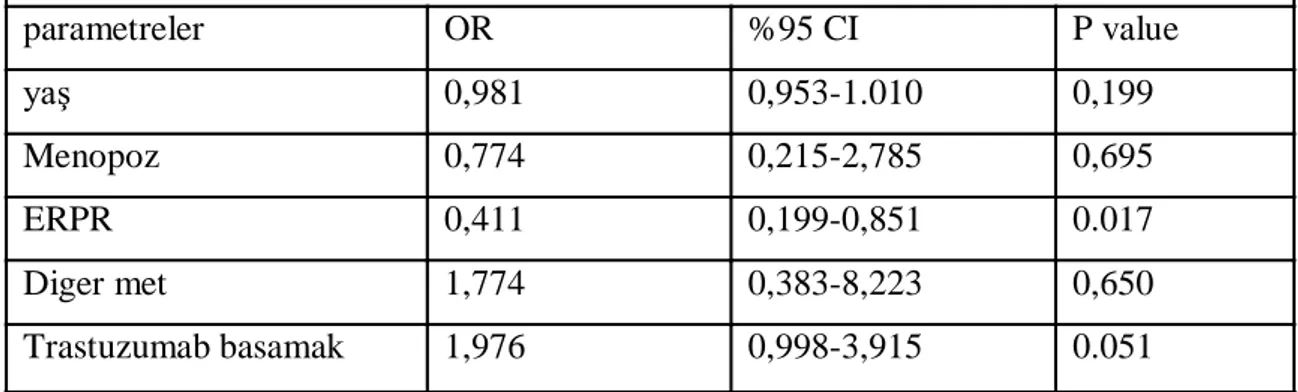
Bulgular: Tüm meme kanserli hastalarda ( 1248 hasta )beyin metastaz oranı %8,4 olarak bulundu ; HER-2 negatif hastalarda oran %5,8 iken, HER-2 pozitif olan hastalarda bu oran %17,2 olarak bulundu. HER-2 pozitif tüm hastalar(291 hasta) değerlendiğinde trastuzumab kullanmamıĢ 145 hastada beyin metastazı oranı %7,5 iken, trastuzumab kullanmıĢ 146 hastada bu oran %26,7 olarak bulundu.(p:0,000)291 HER-2 pozitif meme kanserli hastanın 132 si metastatik hastaydı. HER-2 pozitif metastatik 132 hastada ise beyin metastaz oranı %37,8 olarak bulundu , trastuzumab kullanmamıĢ hastalarda bu oran %26,1 iken ,trastuzumab kullanmıĢ hastalarda ise %43,3 olarak bulundu.(p:0,059). Multivariant analizde trastuzumab iki basamak üzeri kullanılması beyin metastaz sıklığını artırıyordu. (p= 0,051 ;OR= 1,976; %95 CI= 0,998-3,915). ER veya PR den birinin pozitif olması beyin metastazı açısından koruyucu etki gösteriyordu.( P=
-
0.017; OR= 0,411; %95CI= 0,199-0,851). Diğer parametreler açısından multivariant analizde iki grup arasında anlamlı fark yoktu.- 8 -
Sonuçlar:.HER-2 pozitif hastalarda beyin metastazı oranını yüksek HER-2 pozitif trastuzumab tedavisi alan hastalarda bu oranın daha da artığını tespit ettik.Bu yüksekliğin nedeni trastuzumab kullanan hastalarda sagkalımın uzaması ,sistemik hastalığın daha iyi kontrol edilmesi ve trastuzumabın kan beyin bariyerini geçmemesine bağlı beyin metastazı geliĢimini önlemede yetersiz kalması gibi nedenler olabilir.HER-2 pozitif trastuzumab tedavisi alan hastalarda beyin metastaz oranının yüksekliği nedeniyle bu hasta grubunda proflaktik tüm beyin ıĢınlaması gündeme getirilebilir. ER veya PR reseptörlerinden birinin pozitif olmasının beyin metastaz sıklığını azatlığını tespit ettik. Diğer faktörlerin istatistiksel olarak anlamlı Ģekilde prognozu etkilemediği gözlendi.
- 9 - ABSTRACT
Aim : Breast cancer is the most common cancer in women. There are many prognostic and predictive factors. HER-2 onacogene is established approximately 25% of cases. It is an independent negative prognostic factor. But in recent years with the use of trastuzumab, monoclonal antibody developed against HER-2 it has been successful in the treatment of
metastatic patients with both early and metastatic breast cancer. There is conflicting information regarding Trastuzumab positive results and the the prevalence of in cases of brain metastasis. The aim of our study is to compare the risk of brain metastasis in patients HER-2 positive metastatic breast cancer using trastuzumab and in patients who do not use.
Materials and methods: 1248 breast cancer patients were followed up retrospectively in Dicle University Faculty of Medicine Department of Medical Oncology. Among these 295 patients were HER-2 positive (+3 by immunohistochemistry or Fish-positive). 4 patients initially excluded from the study because of earlier brain metastases. 291 patients HER-2 positive were followed up in terms of factors affecting brain metastas. 132 out of 291 patients HER-2 positive were in metastatic phase. 42 patients out of 132 metastases breast cancer were those not using
trastuzumab, 90 patients, however, were the ones using trastuzumab. In patients it was assessed with parameters such as using trastuzumab or do not use, growth rates of brain metastases and influencing the ER, PR, diagnosis stage, the diagnosis of metastasis, grade, menopausal status, histological type, gender. Statistical analyses were made by using the SPSS 16.0 program. P ≤ 0.05 values was considered significant.
Findings: All breast cancer patients (1248 patients) were found to be 8.4% of brain metastases; while rate of HER-2 negative patients was 5.8%, it was 17.2% in patients with HER-2 positive. In all patients HER-2 positive (291 patients), the rate of brain metastasis was 7.5% in 145 patients not using trastuzumab, and the rate was 26.7% of 146 patients using trastuzumab (p: 0.000). 132 out of 291 HER-2 positive breast cancer patients were metastatic. 132 HER-2 positive metastatic patients the rate of brain metastases was 37.8%. The rate was 26.1% in patients not using
trastuzumab, and the rate was 43.3% in patients using trastuzumab (p: 0.059). In Multivariant analysis use of trastuzumab above two step was increasing the frequency of the of brain
metastasis. (p = 0.051, OR = 1.976, 95% CI = 0.998 to 3.915). Being ER or PR positive showed a protective effect in terms of brain metastases. (P = - 0,017, OR = 0.411; 95% CI = 0.199 to 0.851).
- 10 -
Other parameters were not significantly different between the two groups in terms of multivariant analysis.
Results: We established that in HER-2 positive patients, the rate of brain metastasis with HER-2 positive trastuzumab therapy patients was high. The reasons may be the prolonged survival in patients with trastuzumab, better control of systemic disease, and insufficiency in preventing the devolopment of brain metastasis because trastuzumab does not exceed blood brain barrier. Patients receiving HER-2 positive trastuzumab due to high rate of brain metastases, in this patient group prophylactic whole brain radiation can be on the agenda. We have determined that being one of the ER or PR receptors positive decrease the frequency of brain metastases. It has been observed that other factors statistically do not affect the prognosis significantly.
- 11 - GENEL BİLGİLER
2.1 Meme Kanseri
Meme kanseri memedeki duktus ya da lobüllerde sıralanan epitelyal hücrelerden köken alan malign bir proliferasyondur.Meme kanseri insidansı yavaĢça artmaya devam etse de, mortalite hızı son yirmi yılda düĢme eğilimi göstermektedir (16). Bu düĢüĢ, büyük ihtimalle mamografik taramaların artması, daha iyi cerrahi ve radyoterapi, daha iyi sistemik adjuvan kemoterapi gibi birçok faktörün etkisi sonucunda ortaya çıkmaktadır. Meme kanseri patolojik özelliklerine göre sınıflandırıldığında, %85 duktal karsinoma, %5-10 lobular karsinoma, %5-7 meduller karsinoma, %3 musinoz veya kolloid karsinoma, %2 tubuler karsinoma olacak Ģekilde ayrılmaktadır. ilk baĢvuru anında hastaların %3-6‟sı zaten metastatik hastalığa sahiptir ve geri kalan hastaların %50-70‟i hastalığın seyri boyunca sistemik relaps göstereceklerdir.Relapsların %75‟i ilk 5 yıl içinde olsa da, 30 yılla kadar relapslar görülebilir (16). Meme kanseri en sık kemik, karaciğer ve akciğerlere metastaz yapmaktadır. (17). Metastatik meme kanseri olan kadınlarda kur sansı çok sık olmamakla beraber, 5 yıldan fazla süreyi kapsayan progresyonsuz uzamıĢ sağkalım dönemleri ancak hastaların %2 sinden azında görülmektedir (18). Meme kanseri akciğer kanserinden sonra ikinci en sık beyin metastazı yapan kanser türüdür. Bununla beraber leptomeninjial metastaz yapan en sık solid tümördür (19,20). Metastatik meme kanseri olan hastalarda, semptomatik beyin metastazı insidansı %10-15 arasında değiĢmekteyse de, otopsi serileri gerçek insidansın bu rakamın iki katı kadar olduğunu göstermektedir (21).
2.2 Epidemiyoloji
Meme kanseri dünyada kadınlarda en sık görülen kanser türüdür. Kansere bağlı ölümlerde akciğer kanserinden sonra ikinci sırada yer almaktadır. En sık 55-64 yaĢlar arasında görülür. Ortanca görülme yaĢı 61 dir (22). Tüm kadınların %12,5 „unda meme kanseri geliĢmektedir. BaĢka bir deyiĢle her sekiz kadından birisi ömrü boyunca meme kanseri tanısı almaktadır. Tahminlere göre dünyada yılda 1 milyon yeni meme kanseri tanısı konmaktadır. Batı ülkelerinde insidans daha fazlayken geliĢmekte olan ülkelerde daha azdır. Bu durum sosyodemografik ve beslenme farklılıklarıyla açıklanmaya çalıĢılmaktadır. Tarama yöntemlerinin geliĢmesi, kullanımının artmasıyla ve tedavi yöntemlerinin geliĢmesiyle meme kanseri mortalitesinde son yıllarda azalma gözlenmektedir.(23,24)
- 12 - 2.3 Meme Tümörlerinin Sınıflaması
Çok çeĢitli olan meme tümörlerinin sınıflamalarından Dünya Sağlık Örgütü (WHO)' nun önerdiği sınıflama aĢağıda verilmiĢtir.(25,26)
Tablo A.1
A- Epitelyal Tümörler
1- Ġnvaziv Duktal Karsinom 13 - Sekretuar Karsinom 2- Ġnvaziv Lobuler Karsinom 14- Onkositik Karsinom
3- Tubuler Karsinom 15- Adenoid Kistik Karsinom
4- Ġnvaziv Kribriform Karsinom 16- Asinik Hücreli Karsinom
5- Medüller Karsinom 17- Glikojenden zengin berrak hücreli Karsinom
6- Müsinöz Karsinom 18- Sebase Karsinom
7- Nöroendokrin Tümörler 19- Ġnflamatuar Karsinom 8- Ġnvaziv Papiller Karsinom 20- Lobüler Neoplazi
9- Ġnvaziv Mikropapiller Karsinom 21- Ġntraduktal Proliferatif Lezyonlar
10- Apokrin Karsinom 22- Mikroinvaziv Karsinoma
11- Metaplastik Karsinom 23- Ġntraduktal Papiller Neoplaziler 12- Lipid-rich Karsinom 24- Beningn epitelyal proliferasyonlar
Ġnfiltratif Duktal Karsinom:
Ġnfiltratif duktal karsinom (IDK) meme kanserlerinin en büyük sınıfını oluĢturur.IDK bütün infiltratif meme kanserlerinin % 47-75' ini oluĢturur. IDK diğer infiltratif karsinomlara göre daha kötü bir prognoza sahiptir (25,26)
İnfiltratif Lobuler Karsinom :
Tüm invaziv meme karsinomlarının % 0,7-15' ini oluĢtururlar. Görülme yaĢı ortalama olarak 45-57 yaĢlar arasıdır. ILK‟ lerin vakaların % 14-31'inde multisentrik, % 4-28' inde ise bilateral olduğu bildirilmiĢtir.(25,26).
Tübüler Karsinom :
Tüm meme kanserlerinin % 0,4-8 'ini oluĢturur. Sıklıkla 23-87 yaĢlar arasında görülür. Ortalama yaĢ 50'dir. Bu tümörler % 28 multisentrik, % 12-38 oranında da bilateral olarak karĢımıza çıkmaktadır.(25,26)
- 13 - Müsinöz Karsinom :
Kolloid karsinom olarak da bilinen bu tümörler, tüm meme karsinomlarının %2-3' ünü oluĢtururlar. Daha çok 60 yaĢ üzeri kadınlarda görülür.(25,26)
Medüller Karsinom :
Tüm meme karsinomlarının % 5-7‟ sini oluĢturur. Sıklıkla 50 yaĢ civarı kadınlarda görülür.(25,26) 2.4 Meme Kanserinde Etiyoloji
Meme kanserinin etiyolojisi multifaktöriyeldir ve genetik, diyet, üreme faktörleri, hormonal dengesizlik gibi pek çok faktöre bağlıdır.YaĢ en önemli risk faktörlerindendir.YaĢ ilerledikçe meme kanseri insidansı artmaktadır. 40 yaĢın altında meme kanseri görülme sıklığı 1/235 oranında iken, 40-59 yaĢ arası 1/25 oranında, 60-79 yas arasında 1/15 oranındadır. (16). Sosyoekonomik Ģartları iyi olan toplumların kadınlarında meme kanseri görülme sıklığı artmaktadır. Etnik olarak farklı toplulukları barındıran aynı popülasyonda da görülme insidansı farklılıklar gösterir (16). Diğer kanserlere göre çok daha fazla ailesel kümelenme gösterir. Olguların %20‟sinde aile öyküsü mevcuttur. Meme kanserli kadınların %5-10‟unda ise otozomal dominant kalıtım paterni saptanmıĢtır (27). Bu hastaların çoğunda BRCA-1 veya BRCA-2 mutasyonu saptanmıĢtır. Herediter meme kanserli kadınların yaklaĢık yarısında BRCA-1 geninde (kromozom 17q21.3‟de lokalize) mutasyon görülür ve ayrıca 1/3‟unde BRCA-2‟de mutasyonlar (kromozom 13q12- 13‟te) söz konusudur. Bunlar büyük kompleks yapıya sahip tümör süpressor geni özelliğinde genlerdir ve bu genlerin karsinogenezisteki rolü ve meme kanserine iliĢkin rolatif spesifitesi hala tam olarak açıklığa kavuĢmuĢ olmamakla birlikte, bu genlerin ikisinindi DNA tamirinde kritik bir rol oynadığ ı düĢünülmektedir.(28,29).
Bir diğer risk faktörü de memedeki benign ve malign öncül lezyonların varlığıdır. Atipik benign proliferatif lezyonların malignleĢme potansiyeli, atipisiz ve proliferatif olmayan lara göre artmıĢtır. Ayrıca lobüler karsinoma insitu ve atipik lobuler hiperplazi yıllık %1 oranında invaziv karsinom geliĢtirme potansiyeli taĢır (30). Meme kanserinde beyin metastazı ile ilgili etiyolojisi bölüm 9.2.2.anlatılmıĢtır.
- 14 -
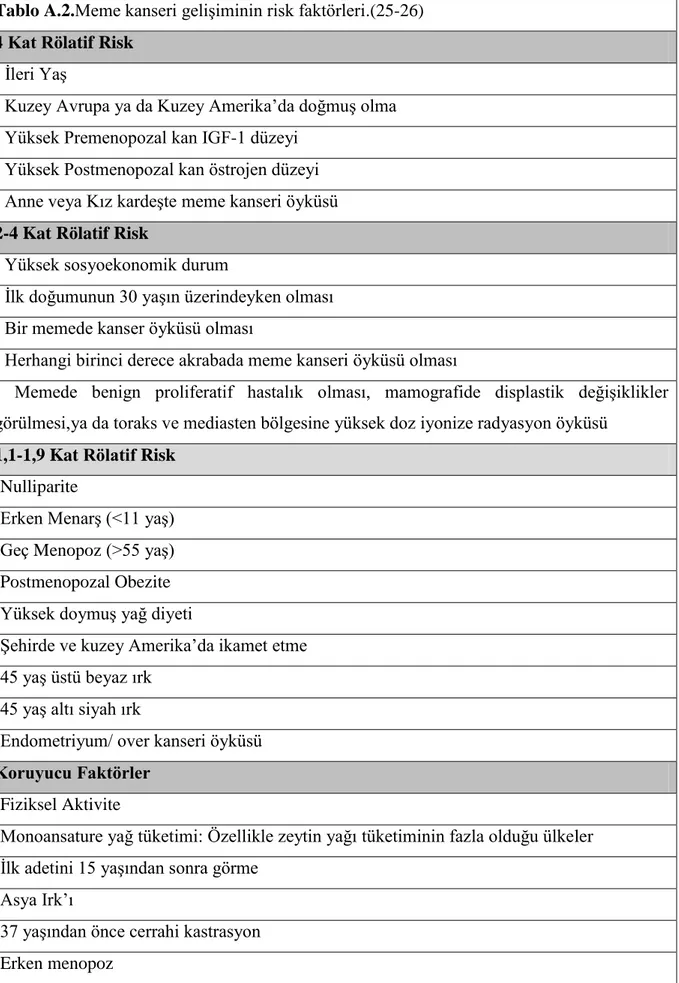
Tablo A.2.Meme kanseri geliĢiminin risk faktörleri.(25-26) 4 Kat Rölatif Risk
- Ġleri YaĢ
- Kuzey Avrupa ya da Kuzey Amerika‟da doğmuĢ olma - Yüksek Premenopozal kan IGF-1 düzeyi
- Yüksek Postmenopozal kan östrojen düzeyi - Anne veya Kız kardeĢte meme kanseri öyküsü 2-4 Kat Rölatif Risk
- Yüksek sosyoekonomik durum
- Ġlk doğumunun 30 yaĢın üzerindeyken olması - Bir memede kanser öyküsü olması
- Herhangi birinci derece akrabada meme kanseri öyküsü olması
- Memede benign proliferatif hastalık olması, mamografide displastik değiĢiklikler görülmesi,ya da toraks ve mediasten bölgesine yüksek doz iyonize radyasyon öyküsü
1,1-1,9 Kat Rölatif Risk -Nulliparite
-Erken MenarĢ (<11 yaĢ) -Geç Menopoz (>55 yaĢ) -Postmenopozal Obezite -Yüksek doymuĢ yağ diyeti
-ġehirde ve kuzey Amerika‟da ikamet etme -45 yaĢ üstü beyaz ırk
-45 yaĢ altı siyah ırk
-Endometriyum/ over kanseri öyküsü Koruyucu Faktörler
-Fiziksel Aktivite
-Monoansature yağ tüketimi: Özellikle zeytin yağı tüketiminin fazla olduğu ülkeler -Ġlk adetini 15 yaĢından sonra görme
-Asya Irk‟ı
-37 yaĢından önce cerrahi kastrasyon -Erken menopoz
2.5 Belirti ve Bulgular
Literatürde meme kanserinin belirtileri ile ilgili bilgiler incelendiğinde, memede bir kitlenin varlığının, memenin portakal kabuğu Ģeklinde bir görüntü almasının, meme derisinde ülser,
- 15 -
kızarıklık ve ödem meydana gelmesinin, doğumsal nedenlere bağlı olmaksızın meme basının içe çekilmesinin, meme basından kanlı ya da kansız akıntı gelmesinin, memede ağrı olmasının, lenf bezlerinde ĢiĢlik olmasının ve kolda ĢiĢlik ve ödem oluĢmasının önemli olduğu görülmektedir (31,32).
Meme baĢından spontan gelen kanlı ya da seröz akıntı genelde meme kanseriyle iliĢkilidir. Süt rengi akıntı ise genelde benign sebeplere bağlıdır. Memede ağrı meme kanseri olan hastaların %10‟unda görülmektedir. Premenopozal kadınlarda memede ağrı sık görülen premenstrual bir bulgudur. Eğer ağrı bir yere lokalize olup adet dönemi boyunca devam ediyorsa altta yatan hastalıktan Ģüphelenilmelidir. Hastaların çok az bir kısmı görüntüleme yöntemleriyle memede kitle olmadan aksillada kitle ile baĢvurmaktadır(3,28).
Meme kanseri yayılımını kan ve lenf yolu ile yapar. En sık metastaz yaptığı organlar; kemik (%71), akciğer (%69), karaciğer (%65), plevra (%51), adrenal bezler (%49), deri (%30), beyin (%20) dir (31-32). Metastatik tümörlerde yayıldığı organa özel belirtiler de klinik tabloya eklenir. Meme kanserinde kranial metastaz ait bulgular 9.2.3. de anlatılmıĢtır.
2.6. Meme Kanserinde Tanı ve Evrelendirme(26)
Meme kanserinde tanı anemnez, fizik muayene, mamografi ve biyopsi yardımıyla konur. Anamnez: YaĢ, ailenin sağlık öyküsü, menarj yaĢı ve düzeni, menopoz yaĢı, doğum yaĢı, meme ile ilgili geçirdiği hastalıklar v.b. anemnezde alınır. Fizik muayene: inspeksiyon: Memelerin büyüklüğü, simetrisi, üzerinin ve kenarlarının görünümü, deride renk d eğiĢikliği, retraksiyon, ödem, ülserasyon ve meme baslarına bakılır. Palpasyon:Hasta önce oturur sonra yatar duruma getirilerek muayene yapılır. Aksiller ve subraklavikular lenf nodlar muayene edilir. Mamografi: Herhangi bir kontrast madde kullanılmadan, memeye uygulanan röntgen tekniğidir. Mamografi; varlığından klinik olarak Ģüphe edilen, fakat küçüklüğü nedeni ile palpe edilemeyen kitleleri ortaya koyar, biyopsi alanını belirler, aksiller bölgeye metastaz yapmıĢ ancak memedeki yeri ortaya konulamayan primer lezyonu bulmaya yarar, kanser tarama amacıyla yapıldığında asemptomatik devrede bir çok kanserli hastayı saptar.
Sitoloji: Meme basından gelen akıntıdan habis hücre aranmasıdır. Ultrasonografi: Memenin kistik lezyonlarının ortaya konmasına yardımcıdır. Biyopsi: meme hastalıklarında kesin teĢhis biyopsi ile konur. Biyopsi; memede her palpe edilen kitlede, meme baĢından devamlı akıntı varlığında (gebelik ve laktasyon dıĢında) yapılmalıdır. Meme kanserinin evrelendirilmesi hastalığın anatomik yaygınlığını değerlendirmek ve tedavinin tipini belirlemek için gereklidir. Evrelemede tümörün boyutu (T), lenf nodu metastazının olup
- 16 -
olmaması (N) ve uzak metastazın olup olmamasını (M) esas alan TNM evreleme sistemi kullanılmaktadır.(26).Bkz tablo A.3 ve tablo A.4
TABLO A.3 Meme Karsinomunda TNM Sınıflaması T- Primer tümör
Tx Saptanamayan tümör.
T0 Primer tümöre ait bulgu yok. Tis Karsinoma in situ.
Tis (DCIS) Duktal karsinoma in situ. Tis(LCIS) Lobuler karsinoma in situ.
Tis (Paget) Tümör olmaksızın meme basının Paget hastalığı. T1 Tümör en büyük boyutunda 2cm veya daha az.
T3 Tümör en büyük boyutunda 5cm‟den büyük.
T4 Tümörün boyutuna bakmaksızın göğüs duvarına veya deriye direkt yayılı mın bulunması. N- Bölgesel Lenf Nodları
Nx Bölgesel lenf nodları elde edilemiyor (örn: daha önce çıkartılmıĢ). N0 Bölgesel lenf nodu metastazı yok.
N1 Aynı taraf fikse olmayan lenf nodları metastazı.
N2 Aynı tarafın fikse lenf nodlarında metastaz veya aksiler lenf nodlarının metaztazı olmadığı durumlarda aynı taraf internal mamaryal lenf nodlarında klinik olarak belirgin metastaz.
N3 Aksiller lenf nodu tutulumu olsun ya da olmasın ipsilateral infraklavikular lenf nod(ları) metastazı veya klinik olarak belirgin ipsilateral internal mammaryal lenf nod(ları) metastazı ile birlikte klinik olarak belirgin aksiller lenf nodu metastazı; veya aksiller yada internal mamaryal lenf nodu metastazı olsun yada olmasın ipsilateral supraklavikular lenf nod(ları) metastazı
N3a ipsilateral infraklavikular lenf nod(lar)ında metastaz
N3b ipsilateral internal mammaryal lenf nod(lar)ında ve aksiller lenf nod(ları)nda metastaz N3c ipsilateral supraklaviküler lenf nod(ları)nda metastaz
M- Uzak Metastaz
Mx Uzak metastaz değerlendirilemiyor. M0 Uzak metastaz yok.
- 17 - TABLO A.4
MEME KANSERiNDE TNM SINIFLAMASINA GÖRE EVRELERiN GRUPLANDIRILMASI Evre 0 Tis N0 M0 Evre I T1 N0 M0 Evre IIA T0 N1 M0 T1 N1 M0 T2 N0 M0 Evre IIB T2 N1 M0 T3 N0 M0 Evre IIIA T0 N2 M0 T1 N2 M0 T2 N2 M0 T3 N1,2 M0 Evre IIIB T4 N0,1,2 M0
Evre IIIC Herhangi T N3 M0
Evre IV Herhangi T Herhangi N M1
2.7. Meme Kanserinde Prognostik ve Prediktif Faktörler
Prognostik faktörler meme kanseri tanısında tespit edilen parametreler olup hastanın ve hastalığın geleceği ile ilgili bilgiler verir. Örneğin; toplam sağkalım, hastalıksız sağkalım, ve lokal kontrol gibi. Prediktif faktörler ise tümörün tedavisinde yanıtı ya da yanıtsızlığı belirleyen faktörlerdir (33).
2.7.1 erken evre meme kanserinde prognostik ve prediktif faktörler
Meme kanserinde bilinen en önemli prognostik parametre aksiller lenf nodunun tümörlü olup olmadığıdır. Lenf nodu pozitifliği sistemik tümör metastazı ve dolayısı ile prognoz hakkında bilgi verir. Lenfovasküler tutulum ve artmıĢ nekroz diğer kötü prognostik parametrelerdendir. Histolojik grade de önemli bir prognostik parametredir. Grade 3 en kötü
- 18 -
prognozu taĢır. YaĢ ise bağımsız prognostik parametredir. Genç hastalar yaĢlılara göre kötü prognoza sahiptirler. En kötü prognoz 30 yaĢ altı hastalarda gözlenmektedir. 45-50 yaĢa göre risk 30 yaĢ altında iki kat artmıĢtır (33). Steroid hormon reseptörü varlığı ER, PR, prognostik özellik taĢımakla birlikte bu etkisi 3 yıldan sonra azalır. Endokrin tedavi için prediktif belirleyici olarak adjuvan ve metastatik meme kanserinde önemli bir yer tutar (33,34).
HER-2 (Epidermal Growth Factör Receptör-2, c-erb-B2) büyüme faktörü olup meme kanseri için prognostik ve prediktif özelliği vardır. Meme kanserli hastaların yaklaĢık %20-25‟inde pozitiftir. HER-2 pozitif meme kanserli hastaların daha kötü seyrettiği, az diferansiye, ER/PR negatif tümörler olduğu bilinmektedir. Ayrıca antrasiklin dıĢı kemoterapi ajanlarına ve tamoksifene dirençten de sorumludur. HER-2 pozitif hastaların antrasiklinlere, spesifik hedefleyici tedavi olan Transtuzumab‟a (Anti-HER2) ve aromataz inhibitörlerine yanıtı daha iyidir (Tablo 2.3) (33,34).
Yüksek proliferasyonlu tümörler kötü prognostik özellik taĢırlar. DNA ploidi analizi, S faz fraksiyon analizi, timidin labeling index, Ki-67 ve mitotik indeks, tümör proliferasyon kapasitesini ölçen metotlardır. Yapılan çalıĢmalarda proliferasyon belirleyicilerin, kötü tümör diferansiyasyonu, ER, PR negatifliği ve kötü sağkalım la iliĢkili olduğu bildirilmektedir. Yüksek proliferasyon kapasiteli tümörler kemoterapiye iyi cevap verir ve bu açıdan prediktif özellik taĢır. Rutin pratikte proliferasyon belirleyicilerinin standardizasyonunda sorun olması nedeni ile tayini önerilmemektedir (33,34).
2.7.2 metastatik meme kanserli hastalarda prognostik faktörler
Metastatik meme kanseri (MMK) tanısı konduktan sonra ortalama sağkalım 18-24 ay arasında değiĢmektedir. Daha önceden MMK tedavisinde temel amaç palyasyon sağlanması iken günümüzde hayatın uzatılması hedeflenmiĢtir. Özellikle trastuzumab, aromataz inhibitörleri ve kapesitabin gibi yeni sistemik ajanların kullanıma girmesi ile bu hedef bir ölçüde gerçekleĢtirilmiĢtir. Meme kanseri metastatik hale geldikten sonra farklı klinik seyir izlemektedir. Bazı hastalar metastaz sonrasında kısa sürede kaybedilirken bazı hastalar uzun yıllar yaĢamaktadır. Erken evre meme kanserli hastalar için hastalıksız ve genel sağkalımı belirleyen prognostik faktörlerle ilgili çok sayıda çalıĢma yapılmıĢtır. Buna karĢılık MMK'nin prognostik faktörleriyle ilgili az sayıda çalıĢma bulunmaktadır. Metastatik meme kanseri ile ilgili yapılan çalıĢmalarda; hormon reseptörü (HR), HER-2, S-fazı fraksiyonu, Bcl-2 ekspresyonugibi primer meme kanserinin biyolojik faktörleri ile hastalıksız sağkalım aralığı, tutulum bölgesi ve performans durumu gibi klinik faktörlerin sağkalımı etkilediği kanıtlanmıĢtır.(33,34,163)
- 19 -
Tablo A.5. Meme Kanserinde Prognostik ve prediktif parametreler Metastaz Potansiyeli Prediktif Parametreleri
TNM evresi
Aksiller lenf nodu durumu Histolojik alt tipler
Anjiyogenez belirleyicileri
Hücre proliferasyon belirleyicileri
Onkogen ve büyüme faktörü gen ekspresyonları Proteaz ekspresyonu
Organ spesifik Metastaz Prediktif Parametreleri PTHrP ekspresyonu
Vimentin ekspresyonu Kemik iliği mikrometastazı L-myc polimorfizmi
Tümör Büyüme Hızı Prediktif Parametreleri Tümör diferansiyasyonu (Grade)
Östrojen ve Progesteron reseptörleri HER2/neu, EGFR, mutant p53, Cyclin-D
Proliferasyon belirleyicileri (mitotik indeks, timidin, labeling indeks, S -faz fraksiyonu, Ki-67, PCNA)
Sistemik Tedavi Etkinliği için Prediktif Parametreler ER ve PR pozitifliği
HER-2 pozitifliği p53 mutasyonu BCL-2 ekspresyonu
pgp ekspresyonu (P Glikoprotein)
Meme kanserinde kranial metastaz ilgili prognostik faktörler ve HER2 /neu bölüm 9.2.4 de anlatılmıĢtır.
- 20 - 2.8 MEME KANSERİ TEDAVİSİ
2.8.1. Meme kanserinde cerrahi
Meme kanseri halen dünyadaki en yaygın kanserlerden biridir ve cerrahi tedavi tedavinin temel taĢını oluĢturmaktadır.(35) Son 20 yılda erken evre meme kanserinin tedavisinde oldukça büyük değiĢiklikler olmuĢtur. Modifiye radikal mastektominin yerini meme koruyucu cerrahi almıĢtır. Yirmi yıldan fazla takip süresi olan çalıĢmalar sonucunda meme koruyucu cerrahinin mastektomiye eĢdeğer sağkalım sağladığı gösterilmiĢtir.(36) Ayrıca sentinel lenf düğümü biyopsisinin kullanımı ile birlikte aksiller kürataj sayısındaki azalma cerrahinin morbiditesinde azalmayla sonuçlanmıĢtır.(37)
2.8.2. Meme kanserinde sistemik tedavi
Erken ve ilerlemiĢ meme kanserlerinde sağkalım, primer ve adjuvan sistemik tedavilerdeki ilerlemeler nedeniyle artmıĢtır. Son dekatta bile, metastatik meme kanserli kadınların ortanca sağkalımı 1991-1992 arasında 436 gün iken, 1999-2001 arasında 661 güne çıkmıĢtır (38). 5 yıllık sağkalım oranı, lokalize meme kanseri için %90 üzerinde iken, metastatik hastalığı olan kadınlarda bu oran sadece %27‟dir (39). Metastatik hastalarda tedavi hastanın risk durumuna göre bireyselleĢtirilmelidir. Kemiğe veya yumuĢak dokuya sınırlı metastazı olan, uzun süre hastalıksız izlenen, yavaĢ progressif hastalığa sahip olan düĢük riskli hastalar, tümör östrojen reseptörü ve/veya progesteron reseptörü pozitif ise endokrin tedavi ile tedavi edilebilir. Hızlı progresif büyüme gösteren tümörü olan, semptomatik viseral metastazı, vital organ disfonksiyonu, yaygın hastalığı olan yüksek riskli hastalarda ve hormon reseptör durumu negatif olanlarda ise öncelikle tedaviye kemoterapi ile baĢlanması daha uygundur.(38,39)
2.8.2.1. Endokrin tedavi
Hem normal meme dokusu, hem de meme kanserlerinin çoğu, büyüme ve yaĢamın devamı için östrojene bağımlıdır. Bu nedenle endokrin tedavi hormon duyarlı meme kanserlerinde sistemik ve hedefe yönelik tedavinin temel taĢı olmuĢtur. Tarihi öneme sahip olan hormonal sisteme müdahaleye yönelik ooferektomi, adrenalektomi gibi cerrahi yaklaĢımlar yerini artık tıbbi endokrin tedavi seçeneklerine bırakmıĢtır. Tümör östrojen reseptörü veya progesteron reseptör pozitifliğinin buna bağlı olarak da hastanın endokrin tedaviye uygunluğunun araĢtırılması için immunohistokimyasal analizler yapılmaktadır. Her iki hormon reseptörü pozitif olanların %70 i hormonal tedaviye yanıt verirken, ER(+)/PR(-) ve/veya ER(-) /PR(+)olanlarda yanıt oranı %40 dan az, ER(-)/PR(-) olanlarda ise %10‟un altındadır
- 21 -
(40,41). ilk yanıtın süresi kemoterapide olduğu gibi 9-12 ayı bulmaktadır. Endokrin tedavi daha az bir toksisite oranıyla daha iyi bir yaĢam kalitesi seçeneği sunarken uygun risk yarar oranını sağlamaktadır. ilk endokrin tedavi ile yanıt alınan veya uzun süre stabil hastalar, ardıĢık hormon tedavilerinden yine fayda görürler (42).
2.8.2.2. Kemoterapatik ajanlar
Kemoterapi hormon reseptör negatif meme kanserinde, hormon tedavisinin efektifliği sona ermiĢ ise, hızlı ilerleyen yaygın hastalıkta, visseral metastaz ve tümör ile ilgili semptomları olan hastalarda tercih edilir. Meme kanseri kemosensitif bir tümördür, ve birçok aktif ilaç gerek tek gerekse multiajan rejimlerin bir parçası olarak kullanılmaktadır. Hastalar uygun tedaviye karar verilmesi için HER-2 düzeyine göre değerlendirilmelidir. Kemoterapiye yanıtı ölçen standart bir test yoktur. Daha iyi performans durumu olan hastalar, daha düĢük tümör yükü, visseral organların daha az tutulumu olan, daha az yoğun önceki tedavi, ve adjuvan tedaviyi takiben daha uzun hastalıksız dönem geçiren hastalar kemoterapiye daha iyi yanıt vermektedir (43,44).
Her ne kadar, MMK hastalarında antrasiklinler ve taksanların en fazla tek ajan aktivitesi olsa da, günümüzde oluĢturulan kılavuzlarda ilk kemoterapi seçeneği olarak hiç bir ilaç optimal tek ilaç olarak tanımlanmamıĢtır.
Tedavi kararı hastanın uyumluluğu, klinik bulguları, performans durumu, ve daha önce kemoterapi maruziyeti hikayesine göre verilir. Benzer olarak, tedaviye baĢlamada tek ajan ile kombinasyon tedavisi seçimi tartıĢmalıdır. ArtmıĢ toksisite oranına rağmen, yapılan birçok randomize çalıĢmada kombinasyon tedavilerinde tek ajan tedavisine oranla ciddi sağkalım yararı sağlanmıĢtır (45,46).
2.8.2.3. anti HER-2/neu tedavi seçenekleri Bölüm 2.9.5.9 da ayrıntılı olarak anlatılmıĢtır.
2.9.MEME KANSERİNDE BEYİN METASTAZI
2.9.1 EPİDEMİYOLOJİMeme kanseri akciğer kanserinden sonra ikinci en sık beyin metastazı yapan kanser türüdür. Ayrıca leptomeninjial metastazın en sık gözlemlendiği tümördür.(19-20). Metastatik meme kanseri olan hastalarda, semptomatik beyin metastazı sıklığı %10-20 arasında değiĢmekteyse de, otopsi serileri gerçek sıklığı bu rakamın iki katı kadar olduğunu göstermektedir (21). Meme kanseri yayılımını kan ve lenf yolu ile yapar. En sık metastaz yaptığı organlar; kemik (%71), akciğer (%69), karaciğer (%65), plevra (%51), adrenal bezler (%49), deri (%30), beyin (%20) dir.(47)
- 22 - 2.9.2 ETYOLOJİ
Meme kanserli hastalarda beyin metastazı olguları değerlendirildiğinde, genç yaĢ bağımsız bir risk faktörü olarak saptanmıĢtır. Beyin metastazı olan meme kanseri hastalarının ortanca yaĢı, beyin metastazı olmayan meme kanseri olgularının ortalama yasından 5 yaĢ daha gençtir. Tutulan lenf nodu durumu (>3 nod), tümör grade (grade 3), patolojik tümör boyutu (>2 cm.) gibi diğer tümör özellikleri de beyin metastazı için bildirilen diğer risk faktörleridir (48,49,50,51).Hormon reseptörü durumu, özellikle östrojen reseptörü negatifliği de beyin metastazı insidansını etkilemektedir. Yapılan retrospektif çalıĢmalarda östrojen reseptörü negatif hastalar ile östrojen reseptörü pozitif olanlar karsılaĢtırıldığında, beyin metastazı insidansı östrojen reseptörü pozitif olanlara oranla en az iki kat çıkmıĢtır (48,49,50,52,53).Ek olarak, epidermal büyüme faktörü reseptörü,c-eErb-B2 (ayrıca HER-2/neu olarak da adlandırılmaktadır) de meme kanserinde beyin metastazı için ayrı ve bağımsız bir risk faktörüdür (48,49,51,53,54).Daha az çalıĢılmıĢ olmakla birlikte; p53 pozitifliği, daha az bcl-2 ekspresyonu, artmıĢ EGFR ekspresyonu ve düĢük CK5/6/19 ekspresyonu meme kanserinin beyin metastazı ile ilgili olduğu bildirilen diğer faktörlerdir (50,51,53,54).
2.9.3 BELİRTİ VE BULGULAR
Meme kanserinde beyin metastazını klinik olarak düĢündüren tablo yavaĢ progresif nörolojik defisittir. Örneğin, sağ serebral motor kortekse yakın bölgede metastazı olan bir hastada, sol kolda veya bacakta güçsüzlük izlenecektir. YavaĢ ortaya çıkan belirtilerden baĢka, bazı hastalar tümör içine kanama nedeniyle inme benzeri tablo veya geçici iskemik atak ile baĢvurabilirler (47). Ayrıca nöbetler beyin metastazlarının bir iĢareti olabilirler ve hastaların %15-25‟inde baĢlangıç semptomu olarak ortaya çıkarlar. Hastaların benzer bir yüzdesi ise, hastalığın seyri sırasında nöbet geçirirler (55).Beyin metastazlarının %40-50 si baĢ ağrısı ile baĢvuracağından, kanser tanısı olan hastalarda yeni ortaya çıkan baĢ ağrısına dikkat edilmesi gerekmektedir (56). AltmıĢ sekiz hastayı kapsayan bir çalıĢmada bulantı varlığı, gerilim tipi olamayan baĢ ağrısı, ve kısa süreli baĢ ağrısı (<10 hafta) beyin metastazı açısından anlamlı prediktörler olarak saptanmıĢtır(57). Fakat bu prediktörlerin özgüllüğü düĢük olduğundan, yeni ortaya çıkan baĢ ağrısı veya nörolojik belirtisi olan hastalarda beyin görüntülemesi gerekli görülmektedir. BiliĢsel fonksiyonlarda bozulma, beyin metastazlı hastalarda varlığı fark edilenden çok daha fazla olan, ve yaĢam kalitesini önemli ölçüde düĢüren bir klinik durumdur. Yapılan çalıĢmalarda genel durumları ve performans skorları iyi olsa da, beyin metastazlı hastaların anlamlı bir kısmında hafızada ve diğer biliĢsel fonksiyonlarda bozulma, ve ince motor hareketlerde azalma olduğu gösterilmiĢtir (58,59,60). Hızlı ve progresif bir demans bazen yaygın beyin metastazının iĢareti olabilir (61).
- 23 -
2.9.4 PROGONOSTİK VE PREDİKTİF FAKTÖRLER
Birçok vakada, beyin metastazı metastatik meme kanserinin geç dönemlerinde ortaya çıkar. Beyin metastazı saptandığında genellikle zaten akciğer, karaciğer, veya kemik metastazı mevcuttur. Beyin metastazının saptanmasından itibaren ortalama sağkalım 2-16 ay arasında değiĢmektedir. Bu olguların sadece %20‟sinde ortalama 1 yıllık sağkalım beklenir (62,63).Radyasyon Terapi Onkoloji Grup tarafından birçok değiĢik çeĢitte solid tümöre sahip 1200 hastayı kapsayan çalıĢmaya dayanılarak beyin metastazları için bir prognostik indeks yapılmıĢtır. 65 yaĢından küçük olup, ekstrakraniyal metastazları olmaksızın kontrol altında primer tümörü bulunan, ve performans durumu iyi olan (Karnofsky performans skoru 70‟in üzerinde) hastalarda daha uzun, 7.1 aylık bir ortanca sağkalım saptamıĢtır.Fakat daha yaĢlı olup, genel performans durumu daha kötü olan hastalarda ortanca sağkalım sadece 2-3 aydır (64).Diğer daha iyi prognostik faktörler, soliter beyin metastazı varlığı ve daha uzun bir hastalıksız sağkalım öyküsüdür(64,65). Sistemik tedavilerin geliĢmesiyle beraber,ekstrakranyal hastalığın kontrolü beyin metastazlı meme kanseri hastaları için iyi bir prediktif değer olmayabilir. Çünkü sistemik hastalığın kontrolü ile beraber, beyin metastazı insidansı artmakta, bu da progresif beyin hastalığı nedeniyle ölen meme kanseri hastası sayısını artırmaktadır (66).
HER-2/neu (c ERB B2)
1980 li yıllarda Dr. Slamon tarafından keĢfedilmiĢtir. HER-2/neu protoonkogen‟i 17q21 kromozomunda lokalize olup intrinsik tirozin kinaz aktivitesine sahiptir. Epidermal Growth Factor (EGF) ailesinden bir glikoproteini (p185) kodlamaktadır. Bu protein immunohistokimyasal olarak meme dokusunda saptanabilmektedir. (10,11). HER-2 aĢırı ekspresyonu invaziv duktal karsinomlu hastalarda %25 -35 olarak izlenmektedir (10,11). HER-2 geni, meme kanserinde negatif bağımsız prognostik faktör olarak kabul edilmektedir (67-75). HER-2 aynı zamanda prediktif bir belirleyicidir . HER-2 amplifikasyonu ya da fazla ekspresyonu olan tümörler daha agresif seyir gösterip artmıĢ nüks ve ölüm oranları ile iliĢkilidirler. Bu proteinin aĢırı ekspresyonu ile bazı sistemik tedavilere direnç arasında iliĢki belirlenmiĢtir. 1990 lı yıllarda ise bu moleküle karĢı trastuzumab adı verilen bir monoklonal antikor geliĢtirilmiĢtir.(67,68,75) ASCO (American Society of Clinical Oncology) tümör marker paneli , trastuzumab için prediktif faktör olarak kullanılmak üzere, HER-2‟ nin, tüm primer meme karsinomlarında tanı ve rekürrens anında incelenmesini önermektedir (67,68,75). Bu tümörler antrasikline daha iyi cevap vermektedir. 2.9.5.9 de ayrıntılı olarak anlatılmıĢtır.
- 24 - 2.9.5 Meme kanserinde beyin metastazının tedavisi 2.9.5.1 Semptomatik tedavi
Herhangi bir kanser çeĢidine bağlı beyin metastazı olan hastalarda deksametazon ile tedavide hızlı klinik düzelme gözlemlenmektedir. Günde 4 mg. kadar düĢük bir deksametazon dozu intrakraniyal basınçta artıĢ olmayan veya bilinç bulanıklığı olmayan hastalarda yüksek dozlara göre daha az yan etki ile efektif bir semptomatik tedavi sağlamaktadır (77). Yüksek doz deksametazon tedavisi artmıĢ intrakranyal basınçta ve beyin sapına yakın metastazlarda kullanılabilir, ve i.v. 10 mg. bolusu takiben 16 mg/gün oral doz cerrahi veya anti-tümör tedaviden sonra tedricen azaltılacak Ģekilde önerilmektedir. Karbamezapin, fenitoin, veya valproik asit gibi anti-epileptik ilaçlarla nöbetlerin primer profilaksisi efektif olmadığından genellikle önerilmemektedir (55,78). Eğer hasta bir veya daha çok nöbet geçirdiyse, hastaya anti-epileptik ilaç baĢlanmalıdır. Etkinliği ve iyi tolere edilebilmesi nedeniyle sıklıkla valporik asit tercih edilse de, valproik asit hepatik sitokrom p–450 sistemini inhibe eden bir ilaçtır. Sonuçta valproik asit kemoterapotik ilaçların konsantrasyonunu ve potansiyel toksisitesini artırabilir. Bu nedenle 9-aminokamptotesin, sisplatin, lamotrijin ve bazı antidepresanlarla beraber kullanımına dikkat edilmelidir (79). Levetirasetam nöbet kontrolü etkinliği ve iyi olan, iyi tolere edilen, ve eĢ zamanlı verilen kemoterapilerle etkileĢimi olmayan bir ajan olduğundan kemoterapi aldığı sırada nöbet geçiren hastalar için iyi bir seçenektir (80).
2.9.5.2. Tüm Beyin IŞINLANMASI (TBI)
Beyin metastazı olan hastalarda TBI 1950 lerden beri uygulanmaktadır. TBI multipl beyin metastazlarında, nörolojik semptomların kontrol altına alınması ve progresyonun önlenmesinde standart tedavi yaklaĢımıdır. TBI kortikosteroid bağımlılığını düzeltir, ve sadece kortikosteroid tedavisiyle 10 hafta olan ortanca sağkalımı 14 haftaya kadar uzatır (81). Radyoterapi için sık kullanılan bir Ģema günlük 3Gy lik bölümler halinde toplam 10 günlük tedavidir (10 x 3Gy.) Beyin metastazlarının yaklaĢık %80‟i serebral kortekste, %15‟i serebellumda ve %5‟i ise beyin sapında lokalizedir (82,83). Genel olarak kabul edilen fraksiyon Ģeması 30Gy/10 fraksiyon Ģeklindedir. 50Gy/20 fraksiyon veya akselere hiperfraksiyone Ģemaların bir üstünlüğü gösterilememiĢtir (84,85). Daha kısa TBI‟sı (12 Gy/2 fraksiyon)ile konvansiyonel RT Ģemasının (30 Gy/10 fraksiyon) karĢılaĢtırıldığı randomize çalıĢmada mediyan sağkalımlar benzer bulunmuĢtur (86). Ancak bu tür çalıĢmalarda yaĢam kalite analizi de göz önünde bulundurulmalıdır. Hastaların nörokognitif becerilerinin de değerlendirildiği prospektif çalıĢmalara ihtiyaç vardır. TBI‟da amaç tüm radyoterapi planlamalarında olduğu gibi, hedef volüme istenen dozun homojen ve tam olarak
- 25 -
verilmesini ve çevre normal dokuların maksimum korunmasını sağlayacak bir planlamanın yapılması ve geliĢtirilmesi olmalıdır. Lens radyasyona çok duyarlı bir doku olduğundan radyoterapi sırasında korunması gereklidir. Kranial radyoterapi sırasında lensin dozu pek çok faktöre bağlıdır. Hastaya bağlı faktörler, yaĢ ve lens ile lateral kemik kantus arasındaki uzaklıktır ve tedaviye bağlı faktörler ise radyasyon kalitesi, total doz, hasta set-up hataları, doz hızı ve radyoterapi tekniğidir.(87) Tek fraksiyonluk uygulamalarda minimum kataraktojenik doz 2 Gy, fraksiyone radyoterapi uygulamalarında ise doz sınırı eriĢkinlerde yaklaĢık 4-8 Gy olarak kabul edilmektedir, çocuklarda ise bu doz daha düĢüktür ve özellikle profilaktik kranial ıĢınlama yapılan hastalarda önemlidir.(87)EriĢkin lensi, fraksiyone uygulanan radyoterapide total 5 Gy‟lik dozu tolere edebilmektedir; %50 olasılıkla görmede klinik sorun yaratacak doz ise yaklaĢık olarak 15 Gy‟dir. TBI‟da genellikle konvansiyonel radyoterapi yöntemleri tercih edilmektedir. KarĢılıklı paralel lateral alanlar en sık kullanılan tedavi alanlarıdır. Klinik yoğunluk, kiĢiye özgü blok hazırlamada güçlükler gibi nedenlerle lens koruması ise her zaman uygulanamamaktadır. Son yıllarda kullanımı artan üç boyutlu konformal tedavi yöntemleri konvansiyonel iki boyutlu tedavilerle karĢılaĢtırıldığında hedef volümün kapsanması ve lensin korunması konformal planlamalarda daha iyi olmaktadır.(87) Gripp ve arkadaĢları TBI‟sınde bilgisayarlı tomografi ile yapılan simülasyonun rolünü araĢtırmıĢlardır.(87,88) Bilgisayarlı tomografi ile yapılan simülasyon sonrası üç boyutlu konformal planlama ve konvansiyonel iki boyutlu planlama yöntemleri karĢılaĢtırılmıĢ ve konvansiyonel yöntemlerde frontobazal bölgenin istatistiksel olarak anlamlı derecede eksik doz aldığı görülmüĢtür. Weiss ve arkadaĢlarının çalıĢmasında ise standart “helmet” tekniğiyle lens koruması uygulandığında frontobazal bölgede dozun düĢtüğü gösterilmiĢtir.(87,89)
2.9.5.3. Cerrahi
Beyine yayılan metastatik hastalıkta cerrahi uzun yıllar boyunca uygunsuz veya etkisiz olarak düĢünülmüĢtür. Fakat 1990‟lı yılların baĢında yapılan 65 yaĢından küçük, sınırlanmıĢ ekstrakranyal hastalığı olan, fonksiyonel olarak bağımsız hastaları kapsayan iki çalıĢmada tek beyin metastazı olan hastaların cerrahiden yarar gördüğü, sadece TBI ile sağkalım yaklaĢık 3 ay artmıĢken, TBI cerrahi ile kombine edildiğinde bu uzamanın 9 ayı bulduğu bildirilmiĢtir (90,91). Yapılan baĢka bir çalıĢmada cerrahi yararsız bulunmuĢtur, düĢük performans skoru ve aktif ekstrakraniyal hastalığı olan hastaların çalıĢmaya dahil edilmesi, muhtemelen bu çalıĢmada cerrahinin yararsız bulunmasını açıklayabilir (92).Tek beyin metastazının baĢarılı bir rezeksiyonu sonrası TBI verilmesi, ya da MR takibi sonunda tümör saptanır ise kurtarma TBI verilmesi konusu tartıĢmalıdır. Yapılan çalıĢmalarda radiyoterapi
- 26 -
grubunda, MR ile takip grubuna göre gerek cerrahi rezeksiyon alanında gerek ise beyindeki diğer bölgelerde daha az rekurens saptanmıĢtır. Ayrıca nörolojik sebeplerden kaynaklanan ölüm oranı postoperatif TBI‟nı takiben daha az saptanmıĢtır. Bu bilgiler cerrahinin rezeksiyon alanındaki tümör aktivitesini tamamen bitiremediğini düĢündürse de, sonuçta hastada tümör rekürensi geliĢsin veya geliĢmesin, her iki grup arasında toplam sağkalım veya hastaların fonksiyonel olarak bağımsız olduğu süre bakımından farklılık saptanmamıĢtır (93).
2.9.5.4. Radyocerrahi
Günümüzde radyocerrahi ile küçük spesifik alanlara yüksek doz radyasyon verilmesi (steriotaktik radyoterapi) beyin metastazları için tedavi seçeneklerini geniĢletmiĢ, ve hızlı bir Ģekilde bu tedavinin önemli bir parçası olmuĢtur (94) . Beyin metastazları sıklıkla küresel olan Ģekilleri ve küçük boyutları ile (<4cm), radyocerrahi için ideal hedefler oluĢturmaktadırlar. Yakın zamanda yapılan bir randomize çalıĢmada, TBI sonrası radyocerrahi veya gözlem yöntemleri karsılaĢtırılmıĢ, tek beyin metastazı olan olgularda radyocerrahinin sağkalımı artırdığı saptanmıĢtır (95).
2.9.5.5. Kemoterapi
Meme kanserinin beyin metastazının tedavisinde kemoterapinin etkisi geniĢ bir Ģekilde açıklanamamıĢtır. TBI veya cerrahinin aksine, kemoterapi Ģuan beyin metastazlı meme kanseri hastalarında standart tedavi değildir, ve kemoterapinin verilip verilmeyeceği, verilecekse zamanlaması açıklığa kavuĢmamıĢtır.
Prensip olarak, beyin metastazlı meme kanseri hastalarında, kemoterapi hastalığın birkaç evresinde verilebilir:
1) Kemoterapi almamıĢ hastalarda yeni ortaya çıkan beyin metastazlarında tek baĢına veya radyoterapiyle beraber verilebilir.
2) Daha önce sistemik hastalık için kemoterapi almıĢ hastalarda beyin metastazı oluĢursa kurtarma kemoterapisi tek basına veya radyoterapiyle beraber verilebilir
3) Daha önce radyoterapi almıĢ olan hastalarda kemoterapi tek baĢına rekürren beyin metastazlarının tedavisi için verilebilir.
Siklofosfamid ve Sisplatin
Sistemik kemoterapi ile tedavi edilen 100 meme kanseri beyin metastazı hastasını kapsayan bir retrospektif çalıĢma 1980 li yılların ortalarında yayınlanmıĢtır (96). 50 hasta beyin metastazı ve ekstrakraniyal hastalık için benzer objektif yanıt vermiĢtir. %10 tam yanıt, %40 parsiyel yanıt, %9 stabil hastalık ve %41 yanıtsızlık izlenmiĢtir. Elli altı meme kanseri hastasını kapsayan baĢka bir prospektif çalıĢmada, verilen sisplatin ve etoposid
- 27 -
kombinasyonu sonucunda 7 hastada (%13) tam yanıt, 14 hastada (%25) parsiyel yanıt alındığı ve ortanca sağkalımın 31 hafta olduğu saptanmıĢtır (97). Bu 1980‟li ve 1990‟lı yıllarda yapılan randomize olmayan çalıĢmalar göz önüne alındığında, radyoterapi öncesinde meme kanseri beyin metastazı hastalarına kemoterapi verildiğinde vücudun baĢka kısımlarındaki metastazlarda olduğu gibi önemli yanıt alınabilmektedir. Bu da beyin metastazlarında kemoterapotik ajan seçiminin önemli olduğunu ve en etkili seçeneğin saptanmasının araĢtırılmaya değer bir alan olduğu gerçeğini ortaya çıkarmıĢtır.
2.9.5.6 Temozolomid
Temozolomid meme kanseri beyin metastazı hastalarının tedavisinde tek baĢına ya da TBI veya diğer ajanlarla kombine halde kullanılan, yeni çıkan ve değerlendirilmekte olan bir ilaçtır. Mitozolomidin 3-metil türevidir, ve anti-tümör aktivitesi nükleofilik bölgelerde DNA nın metilasyonuna bağlıdır (98). Guaninin metilasyonu sonucunda O6- metilguanin oluĢur, bu da DNA replikasyonu sırasında sitozin yerine sürekli timin katılımına sebep olur. Bu sürekli yanlıĢ katılım sonucunda da apoptosis tetiklenmiĢ olur. Oral temozolomidin %100 biyoyararlanımı ve mükemmel kan-beyin bariyeri geçirgenliği vardır ve beyin omurilik sıvısı (BOS) konsantrasyonu plazma konsantrasyonunun %20‟si civarındadır (99). Miyelosupresyon temozolomidin 5 günlük kürlerinde görülen doz kısıtlayan toksisitedir, ve hastaların %6-10‟unda ortaya çıkmaktadır (98). Temozolomid monoterapisi (150 mg/m2/gün, 5 gün her 2 veya 4 haftada bir) uygulanan, daha önce TBI veya kemoterapi almıĢ toplam 29 meme kanseri beyin metastazı hastası içeren 3 çalıĢmada da objektif yanıt alınamamıĢtır (100-102). Temozolomid monoterapisi beĢinde beyin metastazı olan 18 MMK hastasında da objektif yanıt ortaya çıkaramamıĢtır (103). Temozolomid ve TBI kombinasyonu araĢtırılmıĢ ve randomize bir faz 2 çalıĢmada yalnız TBI ye göre daha uzun bir progresyonsuz sağkalım (%72 %54), ve bir baĢka çalıĢmada yine yalnız TBI ye göre daha iyi yanıt oranı saptanmıĢtır (%96 %67) (104,105). Bahsi geçen her iki çalıĢmada da meme kanserli hasta yüzdesi düĢük olduğundan (%10-15) temozolomidin meme kanserli hastalarda TBI etkisini artırıp artırmadığı konusu tam olarak aydınlatılamamıĢtır. Yapılan baĢka bir faz 2 çalıĢmada daha önce kemoterapi veya TBI alan 15 meme kanserli beyin metastazı hastasının 6‟sında sisplatin ve temozolomid kombinasyonuyla kısmi yanıt alınmıĢtır (106). Fakat gözlenen etki, zaten meme kanseri beyin metastazı hastalarına etkili olan sisplatine de bağlı olabileceğinden, bu etkinin ne kadarının temozolomide bağlı olduğu belirlenememiĢtir. Temozolomid ile vinorelbin ve pegile lipozomal doksorubisin kombinasyonları faz 1 çalıĢmalarda araĢtırılmıĢ, ve iyi tolere edildiği saptanmıĢtır (107,108), ileri çalıĢmalar beklenmektedir.
- 28 -
2.9.5.7. Hormon reseptörü pozitif metastazlarda hormon tedavisi
Her ne kadar östrojen reseptörü ya da progesteron reseptörü pozitif olan meme kanseri hastalarında reseptörleri negatif olanlara göre daha az sıklıkta beyin metastazı görülse de (109), yayınlanan vaka sunumlarında hormonal tedaviye yanıt veren beyin metastazları bildirilmiĢtir. Bu vaka sunumları incelendiğinde görülmüĢtür ki; sentetik progesteron analoğu megestrol ya da östrojen antagonisti tamoksifen kullanan meme kanseri olan 3 hastada beyin metastazlarının remisyonuna yol açmıĢtır (110-112).
2.9.5.8. Taksanlar
Taksanlar, dokitaksel ve paklitaksel, metastatik meme kanserinin tedavisinde temel taĢlardan birisidir. Etkilerini hücre iskeletindeki tubuline bağlanıp normal mitotik iğ ipliklerinin geliĢimini engelleyerek, dolayısıyla da hücre bölünmesini önleyerek gösterirler (113). Bu ajanları kullanan hastaların toplam sağkalımı önceki standart tedavi olan doksorubisine benzerdir, fakat taksanların toksisite profili çok daha iyidir (45,114). Bu ajanların MMK tedavisinde günümüzde sık kullanılan dozları paklitaksel için 3 haftada bir 175 mg/m2, ve dositaksel için 3 haftada bir 60-100 mg/m2„dir. Taksanlar proteine yüksek oranda bağlanırlar, ve endotelin lümene bakan kenarında bulunan multi-drug resistans proteinleri için substrattırlar (115). Bu taĢıyıcı proteinlere bağlanmaları da taksanların beyine olan kısıtlı etkisinin nedenlerinden biridir (115). Taksanlar anlamlı sistemik yanıtlara rağmen meme kanseri hastalarında beyin metastazı progresyonunu engellememektedir, ayrıca literaturdeki meme kanserinin beyin metastazı oranı göz önüne alındığında, taksanlarla tedavi edilen meme kanseri hastalarındaki beyin metastazı oranı daha yüksek bulunmuĢtur. Bu da taksanların kan-beyin bariyerini yeteri kadar geçemeyerek, tedavinin baĢlangıç aĢamasında santral sinir sisteminde muhtemelen in-situ olarak bekleyen tümör hücrelerinin büyümesini engellemede yetersiz kaldığı savını desteklemektedir. Bu nedenle taksanlarla tedavi edilen hastalarda nörolojik semptomların geliĢimi acısından dikkatli olunması önerilmektedir.
2.9.5.9. ANTİ HER2/neu tedavi stratejileri
Bir tirozin kinaz reseptörü olan HER2/neu proto-onkogeninin fazla ekspresyonu (over-expression) invaziv meme kanserli hastaların %30‟unda saptanmıĢtır, ve bu hastalarda daha agresif bir seyir ve daha kısa sağkalım saptanmıĢtır (116,117). Bu hastalar trastuzumab veya lapatinib gibi HER2 yi hedefleyen ilaç tedavilerindendir.
- 29 - HER2/neu (cERB B2)
1980 li yıllarda Dr. Slamon tarafından keĢfedilmiĢtir. HER-2/neu protoonkogen‟i 17q21 kromozomunda lokalize olup intrinsik tirozin kinaz aktivitesine sahiptir. Epidermal Growth Factor (EGF) ailesinden bir glikoproteini (p185) kodlamaktadır. Bu protein immunohistokimyasal olarak meme dokusunda saptanabilmektedir. P185' inintrasellüler komponenti tirozin kinaz aktivitesi göstermektedir. Ekstrasellüler komponenti ise yapı olarak growth faktör reseptörlerine benzemektedir (10,11,75). HER-2 aĢırı ekspresyonu invaziv duktal karsinomlu hastalarda %25 -35 olarak izlenmektedir (10,11,75). HER-2 geninin meme kanserindeki rolü, EGF (Epidermal Growth Factor)'nin meme epiteli geliĢiminde önemli rol oynaması, HER-2 proteinine (p185), 1255 aminoasitlik, karĢı geliĢtirilen antikorların sıçan tümörlerinde malign hücre fenotipini normale dönüĢtürmesi, HER-2 geninin embriyonik geliĢme boyunca değiĢik roller üstlenmesi ve baĢta meme kanseri olmak üzere bir çok değiĢik tümör tipinde (over, mide, böbrek, kolon v.b) HER-2 geninde amplifikasyon gösterilmesi nedeniyle yoğun olarak araĢtırılmıĢtır (10,11,67-75). HER-2 aĢırı ekspresyonunun,lokal nüks, metastazsız sağ kalım, mitotik indeks ve aksiller lenf nodu tutulumu ile iliĢkisi olduğunu gösteren çalıĢmalar mevcuttur. Ancak meme kanserinde diğer prognostik faktörlerle HER-2 ekspresyonu arasında iliĢki gösterilememiĢtir. Bu nedenle HER-2 geni, meme kanserinde negatif bağımsız prognostik faktör olarak kabul edilmektedir (67-75). HER-2 aynı zamanda prediktif bir belirleyicidir . HER-2 amplifikasyonu ya da fazla ekspresyonu olan tümörler daha agresif seyir gösterip artmıĢ nüks ve ölüm oranları ile iliĢkilidirler. Bu proteinin aĢırı ekspresyonu ile bazı sistemik tedavilere direnç arasında iliĢki belirlenmiĢtir. 1990 li yıllarda ise bu moleküle karĢı trastuzumab adı verilen bir monoklonal antikor geliĢtirilmiĢtir.(67,68) ASCO (American Society of Clinical Oncology) tümör marker paneli , trastuzumab için prediktif faktör olarak kullanılmak üzere, HER-2‟ nin, tüm primer meme karsinomlarında tanı ve rekürrens anında incelenmesini önermektedir (10,11,76). Bu tümörler antrasikline daha iyi cevap vermektedir.
Trastuzumab
HER-2 (+) MMK tedavisi için ilk FDA onayı almıĢ ilaç olan Trastuzumab, HER-2/neu proteinine karĢı geliĢtirilen bir murin-insan monoclonal antikordur. 25 eylül 1998 de FDA tarafından metastatik meme kanserli hastalarda kullanımı onaylanmıĢtır.2005 yılında adjuvan olarak kullanılmaya baĢlanmıĢtır. Dört büyük çalıĢma (The National SurgicalAdjuvant Breast and Bowel Project – NSABP B-31/The North Central Cancer Treatment Group –NCCTG–N9831), (Herceptin® Adjuvant Trial–HERA), (The Breast Cancer International ResearchGroup – BCIRG 006) ve (Fin Her Study) ile trastuzumabın adjuvan kullanımının nükslerde %50 ya varan azalttığı ve yaĢam süresinde uzama sağladığı
- 30 -
kanıtlanmıĢtır. Bu çalıĢmalarda trastuzumab kullanım süresi ve kemoterapiyle mi yoksa sonra mı verilmesi gerektiği konuları tam olarak aydınlatılamamıĢtır.(118)
Trastuzumab HER2/neu reseptörüne bağlanarak tümör hücrelerinin büyümesini engeller (119). Trastuzumab anti-tümör etkisini HER-2/neu reseptörünün hücre içine alınıp yıkılmasıyla, hücre döngüsünün G1 fazında tutulmasını sağlayıp proliferasyonu azaltarak, apoptozisi artırarak, ve vasküler endotelyal büyüme faktörünün ekspresyonunu azaltıp anjiogenezi baskılayarak yapar (120). Kemoterapiden farklı olarak trastuzumabın kendine özgü toksisitesi mevcut olup, konjestif kalp yetmezliği Ģeklinde izlenen kardiyotoksisite en önemli toksitesidir. Tek ajan olarak kullanıldığında kardiyotoksite insidansı %1.4 dolayında iken (118,121,122), özellikle antrasiklinlerle birlikte kullanıldığında bu oran anlamlı oranda artmaktadır (123, 125). Bu nedenle trastuzumab sıklıkla kardiyotoksite insidansının fazla artmadığı taksanlarla birlikte kombine olarak kullanılmaktadır(123,124). Trastuzumab ile iliĢkili kardiyotoksitenin uzun dönem sonuçları tam olarak bilinmemekle birlikte ilacın kesilmesinden sonra giderek düzeldiği belirtilmektedir (126).
Trastuzumabın tedaviye giriĢi HER-2 (+) meme kanseri hastalarının doğal seyrini değiĢtirmiĢtir. MMK hastalarda yapılan bir retrospektif analizde, HER-2 (+) olup trastuzumab tedavisi alan hastaların prognozu HER-2 (-) olanlardan daha iyi saptanmıĢtır (127,128). Trastuzumab, tek baĢına veya taksanlar (129,130), kapesitabin (131), vinorelbin(132), platinyum bileĢikleri (133) ile kullanıldığında iyi yanıtlar alınmıĢtır.(134).Dirençli ileri evre meme kanserli hastalarda yapılan çalıĢmalarda tek baĢına trastuzumab‟ın %11-15 civarında yanıt oranlarına sahip olduğu gösterilmiĢtir(135,128). Ayrıca, kemoterapi ile beraber kullanılmasıyla elde edilen sağkalım sonuçlarının tek baĢına kemoterapi alan hastalardan daha iyi olduğu gösterilmiĢtir (134). MMK hastalarında yapılan bir trastuzumab monoterapisi çalıĢmasında (4 mg/kg yükleme dozu, sonra 2 mg/kg haftalık idame) objektif yanıt oranı %15, tam veya kısmi yanıt olanlarda ortanca yanıt süresi 9 .1 ay olarak saptanmıĢtır. Dört yüz altmıĢ dokuz hastayı kapsayan geniĢ bir randomize çalıĢmadan elde edilen bilgilere göre, paklitakselli veya doksorubisin siklofosfamid kombinasyonlu standart kemoterapi alan hastaların tedavisine trastuzumab eklendiğinde progresyonsuz geçen sürede uzama (7.4, 4.6 ay) ve daha uzun sağkalım saptanmıĢtır (25.1 ,20.3 ay) (134). Trastuzumabın yüksek molekül ağırlığı (14 kDa) kan beyin bariyerini geçmesine izin vermez. Meme kanseri beyin metastazı hastalarının beyin omurilik sıvısındaki trastuzumab konsantrasyonu plazmadakinden 300 kat daha düĢük bulunmuĢtur (136). Trastuzumab dünyanın her yerinde meme kanseri için standart tedavidir (137).Trastuzumab tedavisi hakkındaki birçok olumlu bulguyu gölgeleyen veri ise, trastuzumab la tedavi edilen
- 31 -
hastalarda göreli olarak yüksek oranda beyin metastazı görülme sıklığıdır. Yapılan bazı çalıĢmalarda bu oran %50‟ye yakın bulunmuĢtur (8). Bu gözlemler trastuzumab içeren kemoterapilerin beyin metastazı riskini artırdığı düĢünülmektedir. (138). Beyin metastazının geliĢmesinde muhtemel bir olumsuz etkiye rağmen trastuzumab beyin metastazı olan hastalarda dahi yararlı etkiye sahiptir. Ġki veya üç beyin metastazı olan hastaları kapsayan bir çalıĢmada ortanca sağkalımın trastuzumab öncesinde 9.4 ay iken trastuzumab sonrasında 22.4 aya çıktığı bildirilmiĢtir (138). Trastuzumaba bağlı artmıĢ sağkalım asıl olarak sistemik yanıta bağlıdır; yine aynı çalıĢmada, her iki grupta da benzer oranda beyin metastazı geliĢen hasta olmasına rağmen (%25-30), kontrol grubunda %90 kemik metastazı geliĢirken bu oran trastuzumab alanlarda %15‟tir (138). Büyük ihtimalle trastuzumab kullanımına rağmen beyin metastazlarının geliĢimi, bu ilacın kan beyin bariyerini geçememesine bağlıdır. Bundan dolayı, trastuzumab baĢlandıktan sonra görülen beyin metastazları tedavi de bir baĢarısızlık olarak görülmemelidir, ve vücuttaki baĢka bir bölgedeki tümör için verilen trastuzumaba olumlu yanıt veren hastalarda, SSS hastalığı için ayrı tedavi verilmelidir. Bu tedavi tek lezyonu olanlar için cerrahi, iki veya dört lezyonu olanlar için radyocerrahi, veya dörtten fazla veya büyük lezyonu olanlar için TBI dır. Bu ilaçlar sıklıkla intrakranyel hastalığı kontrol altına alırken, kan beyin bariyerini de bozdukları için teorik olarak trastuzumabın penetrasyonuna izin vermektedirler (139). Ayrıca beyin metastazı geliĢtirmiĢ meme kanseri hastalarında hiperosmolar ajanlarla kan-beyin bariyerinin ozmotik yıkımı, ve profilaktik kraniyal radyoterapi trastuzumab tedavisi ile kombine olarak önerilmektedir (140). HER-2/neu nun antikor aracılı inhibisyonundan ayrı olarak, HER-2/neu inhibisyonunun farklı yolları geliĢtirilmiĢtir. Bunun bir örneği HER-2/neu yu hedef alan oral tirozin kinaz inhibitörü lapatinib dir (141). Bu ilaç refrakter MMK hastalarında etkili bir ilaçtır, ve beyin metastazları için de yararlı bir potansiyel etkisi vardır. Trastuzumabın aksine hastaların %11‟inde grad 3 toksisite bildirilmiĢtir (142) lapatinibde çok düĢük oranda kardiyotoksisite saptanmıstır (143).Kombinasyon tedavilerinde ve adjuvan çalıĢmalarda, lapatinibin faz III çalıĢmalarının sonuçları beklenmektedir (144). Kemoterapotik ajanların verilmesi için birçok yeni teknik üzerinde çalıĢılmaktadır. Örneğin cerrahi sırasında rezeksiyon alanına BCNU (karmustin) yerleĢtirilmesi fikri incelenmektedir. Bu tekniğin primer beyin tümörlerinde baĢarılı olduğu gösterilmiĢtir, ve simdi metastatik kanserlerde kullanımı için araĢtırmalar yapılmaktadır (145,146). Diğer yeni geliĢtirilen teknik ise direk intraserebral mikroinfüzyondur (convection-enhanced delivery). Bu yaklaĢım hayvanlarda test edilmiĢ ve baĢarılı bulunmuĢtur (147). insanlar üzerinde ise henüz çalıĢmalar