T.C.
Dicle Üniversitesi Tıp Fakültesi
Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı
Lokalize Kutanöz Leishmaniasis’ten
Korunma ve Duyarlılıkta HLA Class II Allellerinin
Rolü
UZMANLIK TEZİ
Hazırlayan: Dr. Heval BİLEK
Danışman: Prof. Dr. Selahattin ATMACA
İ
ÇİNDEKİLER
ŞEKİL LİSTESİ TABLO LİSTESİ 1. GİRİŞ 6 2. GENEL BİLGİLER 8 2.1. Hastalığın Önemi 8 2.2. Tarihçe 9 2.3. Epidemiyolojisi 11 2.4. Taksonomi 14 2.5. Yaşam Döngüsü 16 2.6. Klinik 20 2.6.1. Kutanöz Leishmaniasis 22 2.6.2. Mukokutanöz Leishmaniasis 23 2.6.3. Visseral Leishmaniasis 24 2.7. İmmünoparazitoloji 25 2.8. MHC ve Hastalıklarla İlişkisi 272.8.1. İnsan Lökosit Antijenleri 27
2.8.2. HLA Antijenlerinin Sınıflandırılması 29
2.8.3. HLA Antijenlerinin Yapısı 30
2.8.4. HLA Antijenlerinin Fonksiyonları 32
2.8.4.1. Class I Antijenlerin Fonksiyonları 32
2.8.4.2. Class II Antijenlerin Fonksiyonları 33
2.8.4.3. Class III Antijenlerin Fonksiyonları 34
2.9. HLA ve Hastalıklarla İlişkisi 34
2.10. Doku Tiplendirimi 36
2.10.1. Moleküler Tiplendirme Yöntemleri 37
3. MATERYAL VE METOD 38 4. BULGULAR 40 5. TARTIŞMA 42 6. SONUÇ 48 ÖZET İNGİLİZCE ÖZET KAYNAKLAR
Ş
EKİL LİSTESİ
Şekil 1: Wright ‘tın yayındaki orijinal fotoğraflar sayfa 11 Şekil 2: Dünya’da leishmaniasis’in endemik olduğu bölgeler sayfa 12
Şekil 3: Güney Avrupa’da Leishmaniasis’in dağılımı sayfa 12 Şekil 4: Leishmanianın vektör ve memeli konaktaki yaşam döngüsü sayfa 17
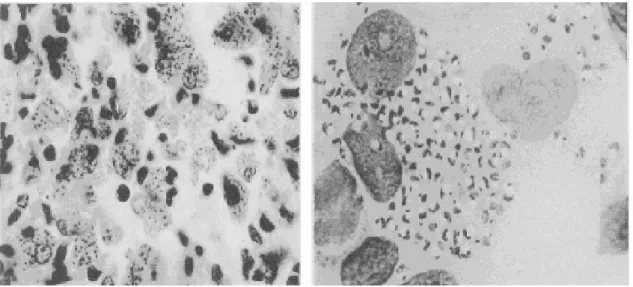
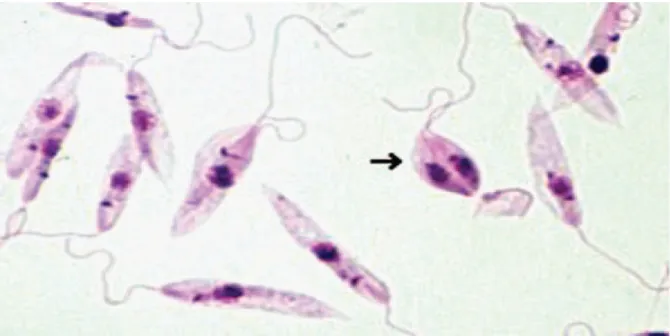
Şekil 5: L. tropica promastigotları sayfa 19
Şekil 6: Makrofajlar içindeki L. donovani amastigostları sayfa 19 Şekil 7: Leishmaniasisin farklı klinik şekilleri sayfa 21 Şekil 8: Th hücrelerinin immün etkilerinin şematik gösterimi sayfa 27
Şekil 9: HLA bölgesinin gen haritası sayfa 30
Şekil 10: HLA Class I ve Class II Molekülleri sayfa 31 Şekil 11: Antijen sunumu ve MHC etkileşimleri sayfa 32
TABLO LİSTESİ
Tablo 1: 1994–2000 yılları arasında kutanöz leishmaniasis dağılımı sayfa 13 Tablo 2: Diyarbakır’daki kutanöz leishmaniasis olgularının dağılımı sayfa 14 Tablo 3: Leishmania cinsinin taksonomisi sayfa 15 Tablo 4: Leishmania türlerinin coğrafik dağılımları sayfa 16 Tablo 5: Leishmaniasis’in, kliniğe ve etkenlere göre sınıflandırılması sayfa 22 Tablo 6: HLA DRB1 allel sıklığının dağılımı sayfa 40 Tablo 7: HLA DPB1 allel sıklığının dağılımı sayfa 41 Tablo 8: HLA DQB1 allel sıklığının dağılımı sayfa 41 Tablo 9: Parazitik infeksiyonlarla ilgili olduğu tespit edilmiş genler sayfa 44
TEŞEKKÜR
Uzmanlık eğitimim süresince sevgi ve saygının hâkim olduğu bir çalışma ortamı sağladığı için Tıbbi Mikrobiyoloji Anabilim Dalı Başkanı Sayın Prof. Dr. Eralp ARIKAN başta olmak üzere,
Uzmanlık tezi olarak çalışmamın hazırlık ve uygulama aşamasındaki yardımlarından dolayıSayın Prof. Dr. Selahattin ATMACA’ya,
Eğitim ve öğretimime katkılarından dolayı Anabilim Dalı’ndaki değerli hocalarıma teşekkürlerimi sunarım.
Ayrıca, moleküler izolasyon yöntemlerindeki katkılarından Tıbbi Biyokimya Anabilim Dalı’ndan Prof. Dr. Sabri BATUN’a ve Hematoloji laboratuvarı çalışanlarına,
Anabilim Dalı’nda çalışma şansı bulduğum değerli doktor, teknisyen ve personel arkadaşlarıma teşekkür ederim.
Dr. Heval BİLEK Diyarbakır 2009
1. GİRİŞ
Leishmaniasis, Leishmania cinsi protozoonların 20’den fazla türünün neden olduğu, vektör aracılığıyla bulaşan hastalığın genel adıdır. Hastalık, lokalize cilt ülserinden, ölümcül sistemik hastalık tablosuna varıncaya kadar farklı klinik şekillerde karşımıza çıkabilir (1).
Dünyada 88 ülkede yaşayan 12 milyondan fazla insanın Leishmania parazitleri ile infekte olduğu bilinmektedir. Ancak gerçek sayının bunun çok üzerinde olduğu tahmin edilmektedir. Her yıl 1,5 milyonu kutanöz ve 500 bini visseral leishmaniasis olmak üzere yaklaşık 2 milyon yeni vakanın meydana geldiği bildirilmektedir. Hastalık bildiriminin sadece 32 ülkede zorunlu olduğu düşünülünce, önemli sayıda vakanın hiçbir zaman kayıt altına alınmadığı da bir başka gerçek olarak karşımıza çıkmaktadır (2).
Türkiye’de, 1950’li yıllardan önce hastalığın en fazla Güneydoğu Anadolu bölgesinde olmak üzere, endemik olarak görüldüğü, bu tarihten sonra sıtma kontrolünde kullanılan DDT (dikloro difenol trikloroethan) nedeniyle sıklığının azaldığı, ancak 1960’dan sonra sıtma kontrol çalışmasındaki yetersizlik sonucu tekrar olgu sayısının arttığı bildirilmektedir (3).
Diyarbakır’da son beş yılda sürekli olarak kutanöz leishmaniasis vakalarının saptanması ve vaka sıklığının Türkiye ortalamasından yüksek olması, kutanöz leishmaniasis’in ilimiz için önemli bir halk sağlığı problemi olduğunu ortaya koymaktadır. Ayrıca, GAP (Güneydoğu Anadolu Projesi) ile artan tarımsal sulama ile kutanöz leishmaniasis’in artış gösterebileceği de bildirilmektedir (4).
Hastalığın görülme sıklığı ve bu sıklık artışı eğiliminin devam edeceği beklentisi, kutanöz leishmaniasis’i çalışmamızın konusu yapma kararımızda belirleyici etken olmuştur. Ayrıca hastanemize başvuran bireylerin genellikle aynı veya yakın bölgelerde ikamet ediyor olmaları, benzer çevresel koşullarda yaşayan sağlıklı bireylerin, hastalıktan neden etkilenmedikleri sorusunu da akla getirmiştir. Hastalığın endemik olduğu bölgelerde yürütülen ve tümü de yurtdışı kaynaklı olan çalışmalar, konak genetik faktörlerinin hastalığın ortaya çıkmasında etkili olduğu yönünde bulgular rapor etmişlerdir. Biz de, çalışma kapsamında uygun hasta ve sağlıklı kontrol grupları oluşturarak, hastalıktan korunma ve duyarlılıkta rol oynaması muhtemel HLA Class II allellerini tespit etmeyi amaçladık.
Dicle Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı’nda, bilimsel araştırma projesi kapsamında yürütülen tez çalışmasının, ileride geliştirilmesi muhtemel ilaç ve aşıların elde edilmesine katkı sunacağını umut etmekteyiz.
2. GENEL BİLGİLER
2.1. HASTALIĞIN ÖNEMİ
Leishmaniasis, Leishmania cinsi protozoonların neden olduğu, deride veya mukozalarda şekil bozuklukları yapan, lokalize kutanöz formlarından, ölümcül olabilen generalize visseral formlarına kadar değişen ve farklı klinik belirtilerle ortaya çıkan hastalıkların genel adlandırılmasıdır (5).
Dünya Sağlık Örgütü (WHO) tarafından, önemi ihmal edilen tropikal hastalıklar (Neglected Tropical Diseases=NTD) kapsamında olan leishmaniasis, öncelikle tropikal ve subtropikal bölgelerde yaşayan yoksul nüfusu etkilemektedir. Aynı bölgelerde yaşayan çocuklar diğer tüm tropikal hastalıklarda olduğu gibi hastalığın etkisine en açık ve savunmasız olan gruptur (6).
Temel olarak iki ana klinik formda karşımıza çıkan leishmaniasis’in daha yaygın olan kutanöz formunda deri ülserleri gelişmekte, lezyonlar kalıcı bir skar ile iyileşebilmektedir. İç organlara yerleşen formunda ise ciddi klinik semptomlar ortaya çıkmakta ve tedavi edilmediği takdirde ölümle sonuçlanabilmektedir (3).
Kutanöz leishmaniasis’in öldürücü bir hastalık olmamasından ötürü, birincil halk sağlığı problemi olarak önemi ihmal edilmiştir. Ancak aşağıdaki bilgilerin bir kez daha hatırlanmasında yarar vardır;
—Her 20 saniyede bir kişi kutanöz leishmaniasis etkenleriyle infekte olmaktadır,
—Dünyada 82 ülkede endemik olarak bulunan hastalıktan, milyonlarca kişi acı çekmektedir,
—Sosyoekonomik, politik (savaş ve göçler) ve çevresel faktörler yeni vakaların artmasına yol açan etkenler olarak bulunmaktadır,
—Ciltteki kalıcı şekil bozukluklarından kaynaklanan sosyal ve psikolojik rahatsızlıklar, hastalığın sebep olduğu ciddi sonuçlardır (7).
2.2. TARİHÇE
Kutanöz leishmaniasis’e özgü lezyonlara ait bilinen en eski betimlemeler M.Ö. 7. yüzyılda, Kral Asurbanipal’e ait kütüphanenin tabletlerinde tarif edilmiştir. 10. yüzyılda, aralarında İbn’i Sina’nın da bulunduğu Arap hekimler tarafından hastalığın lezyonlarına özgü detaylı betimlemeler yapılmıştır. Sonraki dönemlerde de Orta Doğu’da hastalığın görüldüğü bölgelerin adlarıyla isimlendirilmiş ve halen bilinen isimlerle (Delhi çıbanı, Şark çıbanı, Halep çıbanı, Bağdat çıbanı vb.) adlandırmalar devam etmektedir (8).
Güney Amerika’da yer alan And Dağları bölgesinden dönen mevsimlik İspanyol işçilerinde görülen ve “Valley sickness” veya “Andean sickness” olarak isimlendirilen hastalığa XV. ve XVI. yüzyıllardan kalma Inka yazıtlarında da değinilmiştir. İyileşmeyen burun ve ağız lezyonlarıyla cüzzama çok benzemesinden dolayı hastalığa “beyaz cüzzam” adı da verilmiştir (9).
Leishmania parazitlerinin etken olduğu, visseral leishmanaisis’le ilgili olarak, 1882 yılında Clarke, Hindistanlı hekimler tarafından, Sanskritçe “kala azar” adı verilen ve anlamı kara ateş “black fever” olan hastalığın Hindistan’da bazı yerlerde çok sayıda ölümlere sebep olduğunu bildirmiştir. Bu çok eski tarihlere dayanan ve nedeni bilinemeyen hastalık ilk kez 1900 yılında Leishman’ın ölen bir askerin dalağından yaptığı yayma preparasyonda ufak oval cisimler görmesiyle ortaya konulabilmiştir. Aynı yıl Donovan, kala-azar vakalarında dalaktan hazırladığı yayma preparasyonlarda aynı etkeni görmüş ve bunların Trypanosoma olmadığını vurgulamıştır. 1903 yılında Major Ross bu parazitler için, Leishmania cinsini ortaya koymuş ve kala-azar etkenine Leishmania donovani ismini vermiştir (9).
Eski dünyadaki kutanöz leishmaniasis’ten sorumlu parazit etkenlerinin keşfi ile ilgili konu tartışmalı ise de, bu etkeni ilk keşfeden bilim adamının 1903 yılında Amerika’lı James Homer Wright olduğu kabul edilmektedir. Wright’tan önce 1885 yılında David Cunningham, 1898 yılında Rus askeri cerrah P. F. Borovsky tarfından da etkenlerin gözlemlendiğine dair bilgiler mevcuttur (8, 10).
Şekil 1: James Homer Wright ‘tın 1903 yılında yaptığı yayındaki orijinal fotoğraflar. (J Med Res. 1903)
2.3. EPİDEMİYOLOJİSİ
Antarktika dışında bütün kıtalarda yayılım gösteren leishmaniasis, vektör aracılığıyla bulaştırılan zoonotik/antroponotik karekterli bir protozoon paraziter infeksiyon hastalığıdır (1, 3).
Dünya Sağlık Örgütü kayıtlarına göre; leishmaniasis’ten 12 milyon insanın etkilendiği, 350 milyon insanın risk altında olduğu ve yılda 1,5 milyon yeni kutanöz leishmaniasis olgusunun kayıtlara geçtiği bildirilmektedir (11).
Leishmaniasis; Avrupa, Kuzey Afrika, Orta-Doğu, Orta ve Güney Amerika ile Hindistan’ın bulunduğu bölgelerde, 60’tan fazla ülkede endemik olarak bulunmaktadır. Tüm leishmaniasis infeksiyonlarının yaklaşık %90’ı lokalize kutanöz formdadır. Kutanöz leishmaniasis olgularının %90’ından fazlası Afganistan, Pakistan, Suriye, Suudi Arabistan, Cezayir, İran, Brezilya ve Peru’da meydana gelmektedir (12,13).
Şekil 2: Dünya’da kutanöz, mukokutanöz ve visseral leishmaniasis’in endemik olduğu bölgeler (Clın Mıcrobıol Rev 2001,229–243).
Son 10 yılda hastalığın endemik olduğu bölgelerde vaka sayısı belirgin olarak artmıştır. Buna ek olarak HIV infeksiyonuyla beraber görülen koinfeksiyonlar nedeniyle Güney Avrupa gibi daha önce hastalığın endemik olmadığı bölgelerde de hastalık görülmeye başlanmıştır (14).
Şekil 3: Güney Avrupa’da Leishmaniasis’in dağılımı (www.cdc.gov/eid . Vol. 14, 2008 )
Ülkemizde 1833 yılından beri varlığı bilinen, 1950’li yıllarda Güneydoğu Anadolu Bölgesinde çok görüldüğü bildirilen kutanöz leishmaniasis, sıtma ile savaş ve tarımsal ilaçlamanın vektör tatarcıkları da etkilemesi sonucu azalmış, ancak son yıllarda sıklığı artmaya başlamıştır. Daha önceleri son derece nadir olguların bildirildiği Ege, Marmara, Orta Anadolu, Batı Karadeniz gibi bölgelerimiz de düzenli sıklıkta olguların görüldüğü yerler haline gelmiştir.(3)
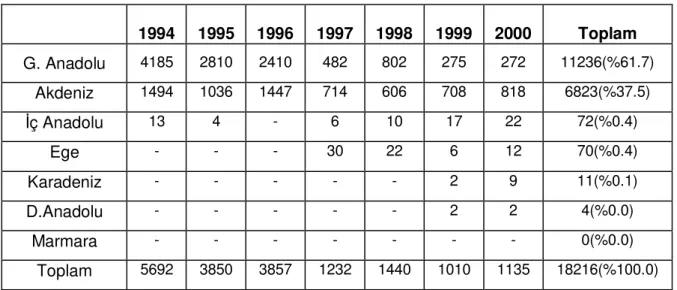
Tablo 1: Sağlık Bakanlığı verilerine göre 1994–2000 yılları arasında kutanöz leishmaniasis vakaların bölgelere göre dağılımı
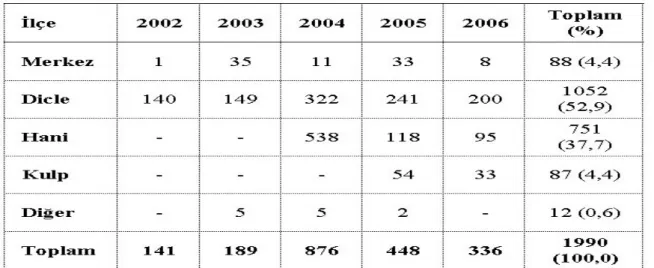
Diyarbakır İl Sağlık Müdürlüğü ile Üniversitemiz Halk Sağlığı Anabilim Dalınca yürütülen ve 2002–2006 yılları arasında Diyarbakır’da bildirilen kutanöz leishmaniasis olguların epidemiyolojik özelliklerinin değerlendirildiği bir çalışmada, beş yıl içinde 1990 vakanın bildirilmiş olduğu ve bildirimlerin %52,9’unun Dicle, %37,7’sinin Hani ilçelerinden yapıldığı tespit edilmiştir.(4)
1994 1995 1996 1997 1998 1999 2000 Toplam G. Anadolu 4185 2810 2410 482 802 275 272 11236(%61.7) Akdeniz 1494 1036 1447 714 606 708 818 6823(%37.5) İç Anadolu 13 4 - 6 10 17 22 72(%0.4) Ege - - - 30 22 6 12 70(%0.4) Karadeniz - - - 2 9 11(%0.1) D.Anadolu - - - 2 2 4(%0.0) Marmara - - - 0(%0.0) Toplam 5692 3850 3857 1232 1440 1010 1135 18216(%100.0)
Tablo 2: Diyarbakır’da görülen kutanöz leishmaniasis olgularının ilçelere ve yıllara göre dağılımı (Sucaklı MB. ve Saka G. Türkiye Parazitol Derg, 2007)
2.4. TAKSONOMİ
Leishmanialar, Trypanosomatidae ailesinin Kinetoplastida dizisinde yer alan protozoonlardır. Lainson ve Shaw, leishmaniaları vektör sinekteki gelişimlerine göre Viannia ve Leishmania olarak iki alt sınıfa ayırmıştır. Viannia alt genusu L. braziliensis’i kapsar ve vektörün orta ve ön barsağına göç etmeden önce arka barsakta gelişen türlerle ilişkilidir (15)
Bu cinsin sınıflandırılmasında, neden oldukları hastalıklar, coğrafik dağılım, epidemiyolojik, serolojik, biyokimyasal, immünolojik ve biyolojik özelliklerinden yararlanılmaktadır. Son yıllarda izoenzim, monoklonal antikorlar ya da parazitin DNA yapısının araştırılmasına da başlanmıştır (16).
Moleküler yöntemlerin kullanılmasıyla birlikte elde edilen veriler ışığında Dünya Sağlık Örgütü (WHO) bir taksonomi şeması yayınlamıştır. Etkenin tespit edilmesi, izolasyonu ve genetik identifikasyonu için kullanılan yeni yöntemler sayesinde tanımlanmış türlerin sayısı da artış göstermiştir. Bugün için bilinen 30 türün, 21 tanesi insanlar için patojendir (17).
Tablo 3: Leishmania cinsinin taksonomisi (Advances İn Parasıtology Vol 64, 2007)
Leishmaniasis, ekoepidemiyolojik açıdan sadece insandan insana bulaşımı niteleyen ‘’Antroponotik Kutanöz Leishmaniasis”, hayvandan insana bulaşımı niteleyen “Zoonotik Kutanöz Leishmaniasis”, olarak da ayrılabilmektedir.(18)
Eski Dünya kutanöz leishmaniasis’inde, zoonoz olan şekle yarı kurak bölgelerde rastlanır, rezervuarı et yiyen gündüzcü ve koloni halinde bulunan kemirgenlerdir. Etken Leishmania(L) major, vektör Phlebotomus(P) papatasii gibi tatarcıklardır. Eski Dünya deri leishmaniasis’inin antroponoz olan şeklinde rezervuar insandır. Etken L. tropica, vektör P. sergenti adı verilen tatarcıklardır. Yeni Dünya deri ve mukozal leishmaniasis’i genellikle zoonotiktir. Etken L. braziliensis ve L. mexicana alt türleri ve vektör orman tatarcıklarıdır. Bazı leishmanisis formlarında ise hyrax ve rhombomis denilen tarla farelerine benzer kemirgenler kaynak olarak rol oynarlar (15).
Tablo 4: Leishmania türlerinin coğrafik dağılımları ve klinik görünümleri (Slappendel ve Ferrer, 1990)
2.5. YAŞAM DÖNGÜSÜ
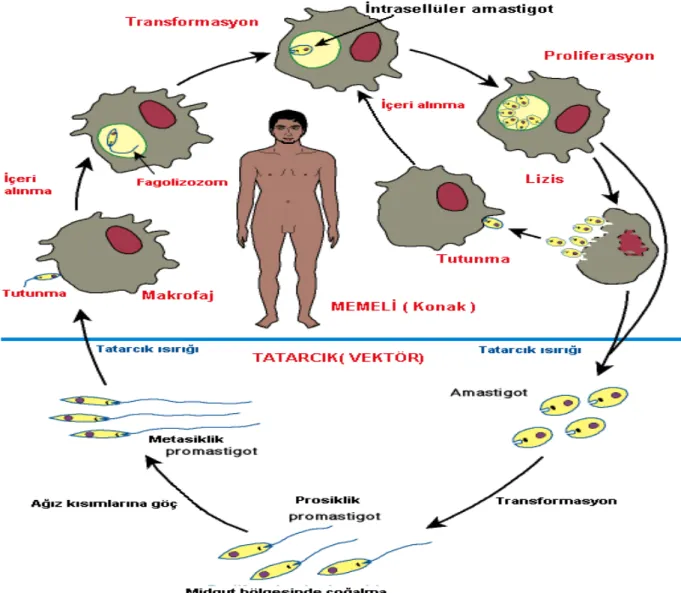
Leishmania parazitleri, karmaşık yaşam döngüleri boyunca, değişik ekstra ve intrasellüler ortamlara maruz kalırlar. Bu organizmalar iki temel yaşam döngüsü evresine sahip digenetik parazitlerdir; bu evrelerden ilki omurgasız bir konaktaki (Phlebotom-tatarcık) ekstrasellüler evre, diğeri de omurgalı konaktaki intrasellüler evredir. Parazit omurgasız konakta promastigot (leptomonas), omurgalı konakta ise amastigot formunda canlılığını sürdürmeye çalışır (17).
Şekil 4: Leishmanianın vektör ve memeli konaktaki yaşam döngüsü (Handman E,Clinical Microbiology Reviews, 2001, 229–243)
Leishmaniaların vektörleri, parazitin türüne ve bölgesine göre değişmek üzere Eski Dünya’da belirli Phlebotomus türleri, Yeni Dünya’da belirli Lutzomyia türleridir (10,15). Hastalığın vektörü olan Phlebotom’lar halk arasında tatarcık, yakarca, üvez vs. olarak bilinirler. Yurdumuzda tatarcıklar, Phlebotomus ve Sergentomyia cinslerinde bulunmaktadır (15). Çoğunlukla dişiler yumurtalarının gelişmesi için kan emmeye ihtiyaç duyarlar. Sıcak ve nemli iklim koşullarında üreyip çoğalabilirler.
Gündüzleri karanlık ve rüzgârsız yerlerde, mesela kilerlerde, duvar yarıklarında, kuytu gölgeliklerde, kulübelerde ve ahırlarda saklanan bu sinekler aktivasyonlarını özellikle sıcak ve durgun yaz gecelerinde gösterirler. Akşamları alaca karanlıkta saklandıkları yerlerden çıkarak beslenmek için kan emecek hayvan ve insan ararlar. Bu kan emme işlemi sırasında farinkslerindeki leishmaniaları insan veya hayvanların derileri içerisine inoküle ederek hastalığı bulaştırırlar. Dişi tatarcıklar insandan başka köpekler, kemirgenler gibi memelilerden, hatta bazen kuşlardan ve sürüngenlerden kan emerler (15).
Leishmania türlerinin vektörü olan Phlebotomus veya Lutzomyia cinsi tatarcıklar, leishmaniasis’li bir omurgalı konaktan kan emerken makrofajlar içinde bulunan parazitin amastigot şeklini almaktadır. Emilen kan, orta midede “peritrofik membran’’ adı verilen bir membran ile sarılmakta ve sineğin sindirim enzimleri ile bu membran içine salgılanmaktadır. Leishmaniaların bir kısmı makrofajların lizis olması esnasında sindirilirken kalanların vücudu uzamakta ve kamçı gelişerek infektif olmayan promastigot şekline dönüşüp bölünerek çoğalmaya başlamaktadır. İnfektif promastigotları barındıran vektör tatarcık, kan emmek için bir omurgalı konağı soktuğu zaman, deriden vücuda giren promastigotlar, uygun hücreler tarafından fagosite edilmektedir. Fagosite edilen promastigotlar kamçısını kaybederek amastigot şekline dönüşmektedirler. Enfekte hücre parazitin sayıca çoğalması sonucu parçalanmakta ve amastigotlar dağılmaktadırlar. Daha sonra bu amastigotlar tekrar diğer makrofajları enfekte edebilmektedirler (18).
Şekil 5: L. tropica promastigotları (Advances İn Parasitology Vol 64, 2007)
Şekil 6: Makrofajlar içindeki L. donovani amastigostları (Advances İn Parasitology Vol 64, 2007)
Leishmanianın omurgalı vücudunda bulunan amastigot yani kamçısız şekli genellikle monositler, polimorf çekirdekli lökositler ve endotel hücreler içinde, bazen kümeler halinde bulunur; bu hücrelerin parçalanmasından dolayı bu hücrelerin
dışında tek tek görülebilirler. Amastigot formundaki bir leishmanianın sitoplazmasında arka uca yakın büyük bir nükleus ve nükleusa bitişik kinetoplast bulunmaktadır. Sitoplazmada ayrıca vakuoller, nokta şeklinde bir bleforablast (kamçı kökü) ve bleforablasttan çıkıp ön kısımda sonlanan bir aksonem (kamçının sitoplâzmada kalan kısmı ) bulunmakta, ancak kamçı hücre dışına serbest olarak çıkamamaktadır. Bütün leishmania türlerinde sitoplazmada tek bir mitokondrium yer almakta, golgi aygıtı ve lizozomlar çeşitli enzim aktiviteleri ile parazitin beslenmesine yardımcı olmaktadırlar (18,19).
2.6. KLİNİK
Leishmaniasis’li bir hasta genel olarak 3 farklı klinik sendromdan biri ile karşımıza çıkabilir.
Kutanöz leishmaniasis; vektör sineğin ısırdığı yerde ülserleşen deri lezyonunun, kendiliğinden skar bırakarak iyileşmesi şeklindedir. Kutanöz leishmaniasis’in daha az görülen bir şekli olan diffüz kutanöz leishmanaisis’te deri lezyonlarının yaygın bir hal alması söz konusudur.
Mukozal leishmaniasis; kutanöz leishmaniasis’in nadir bir sonucu olan bu klinik tabloda, ilk deri ülserinin iyileşmesinden yıllar sonra belirtiler ortaya çıkabilir. Birincil lezyonun metastatik bir komplikasyonu kabul edilen bu durum burun mukokutanöz bileşkesinde şekil bozukluğu ve ilerleyici ülserasyona neden olur.
Visseral leishmaniasis; ateş, kilo kaybı, hepatosplenomegali ve anemi kliniğiyle belirti verir. Tedavi edilmeye çalışılan olgularda bile ölümle sonuçlanabilir (20).
Şekil 7: Leishmaniasisin farklı klinik şekilleri a) kutanöz b) mukokutanöz c)diffüz kutanöz d) visseral leishmaniasis (http://www.who.int/leishmaniasis/en/)
Leishmania türü parazitler farklı dokulara tropizm (visserotropizm, dermotropizm ve mukokutanöztropizm) sergilerler, bunun doğal sonucu olarak infeksiyon oluşturan etkene bağlı olarak farklı klinik sonuçlar ortaya çıkar (17).
Tablo 5: Leishmaniasis’in, kliniğe ve etkenlere göre sınıflandırılması (Ersöz Ş,2006).
Lieshmaniasis’te, hastalık tipinin tayininde, parazitin türünün belirleyici olduğuna dair genel bir kabul olmasına rağmen, bu düşünce tek başına olayı açıklamaya yetmemektedir. Konağın genetik özellikleri ve immün yeterliliği, en az parazit türü kadar önemlidir. Kendiliğinden iyileşen cilt ülserleri L. major, L. tropica, L. aethiopica gibi türlerde görülürken normalde dermatotropik olan bu türlerin bölgedeki lenf nodlarına göç etmesi hatta organlara yayılması söz konusu olabilir (13,17).
2.6.1 Kutanöz Leishmaniasis
Kutanöz leishmaniasis, (KL, Şark çıbanı, Antep Çıbanı, Halep çıbanı, Delhi çıbanı, Yıl çıbanı, Güzellik çıbanı) genellikle deriyi ve bazen de deri ve mukozaları tutan ve skar bırakarak iyileşen lezyonlar ile karakterize bir deri hastalığıdır. Bu lezyonlar tedavi ile veya kendiliğinden düzeldikten sonra kişiyi ömür boyu yeni infeksiyonlardan koruyan kalıcı bir bağışıklık bırakmaktadır (3).
Leishmania tropica, Leishmania major, Leishmania aethiopica ve L. İnfantum Eski Dünya kutanöz leishmaniasis’ine yol açarken, L. brasiliensis, L. panamensis, L. peruviana Yeni Dünya leishmaniasis’ine neden olmaktadırlar. Ayrıca L. braziliensis mukozaları da tutabilmekte ve mukokutanöz leishmaniasis’e neden olmaktadır (3).
Kutanöz leishmaniasis, dişi tatarcığın kan emdiği yerde küçük, sert ve kaşıntılı bir papül şeklinde başlar, zamanla çevresi kızarır, 3–4 ay içinde etrafı sert ve kabarık üzeri kabuklu, hafif sızıntılı bir yara şekline dönüşür. Yaranın üzerindeki kabuk kanatılmadan kaldırılırsa alt yüzeyinde sivri bir takım çıkıntılar olduğu görülür ki buna “Hulusi Behçet’in çivi belirtisi” denir. Yavaş büyüyen ve 2–3 cm çapına gelen yaraya, bakteri infeksiyonu eklenirse ateş, titreme gibi belirtiler görülür. Bu tip yarada, komplikasyonlar olmazsa ağrı yoktur ve zaman içinde pigmentsiz bir skar bırakarak iyileşirse de izin etrafında büzülmeler ve yaranın yerine göre bazı şekil bozuklukları gözlenebilir (18).
2.6.2. Mukokutanöz Leishmaniasis
Mukokutanöz leishmaniasis etkenleri L. braziliensis başta olmak üzere, L. braziliensis kompleksine ait türlerdir. Mukokütanöz leishmaniasis, “Espundia” adıyla da anılır. Bu sözcük Portekizce’de “sünger” anlamına gelmektedir. Neredeyse tamamen Orta ve Güney Amerika’da görülür. Kronik ve ciddi komplikasyonlara neden olabilen bir durumdur. Burun ve farinks ve hatta larinks mukozasında, kıkırdak ve kemiklerinde ciddi bir yıkım ile seyreder. Bunun sonucunda yüzün yapısı ileri derecede bozulur (21).
2.6.3. Visseral Leishmaniasis
Visseral leishmaniasis etkenleri L. donovani kompleksine ait türlerdir. Bunlar L. donovani (Hindistan, Doğu Afrika), L. infantum (Akdeniz Havzası, Orta Doğu ve Orta Asya), L. chagasi (Latin Amerika) ve L. archibaldi (Doğu Afrika)’dir. Özellikle Akdeniz havzasında hastalığın hedefi daha ziyade küçük çocuklar ile immün sistemi baskılanmış kişilerdir (21).
Bu türler insan ve köpeklerde Kala-Azar Hastalığı’nı meydana getirir. Visseral leishmaniasis’e, deri üzerinde siyah renkli alanlara yol açması nedeniyle, kara hastalık anlamında “Kala Azar” adı verilmiştir. Daha çok sıcak ülkelerde yaygındır. Asıl konakları insan ve köpekler olduğu halde, kedi, at, tilki, maymun gibi hayvanlarda da görülür. Epidemiyolojisinde yabani karnivorlar önem taşır.
Etkenler bütün vücutta bulunur. Özellikle, karaciğer, dalak, kemik iliği, böbrek, mesenterial lenf yumruları ile derinin kan ve lenf damarlarına yerleşir. Endotel hücreleri, monositler, polimorf çekirdekli lökositler dâhil retiküloendotelial sistem hücreleri, en çok bulunduğu hücrelerdir.
Birkaç aylık kuluçka döneminden sonra, tatarcığın soktuğu yerde gittikçe büyüyen bir papül şekillenir. Bir süre sonra bu papül kaybolur. Hastalarda düzensiz bir ateş vardır. Ateş akşamları yükselir, sabahları ise düşer ve bu durum aylarca sürer. Anemi, zaafiyet, hepatosplenomegali şekillenir. Dalak o kadar büyür ki, vücudun sağ tarafına geçer. Hastaların dışkı ve idrarları ile burun ve ağız salgılarında etkenlere rastlanabilir. Bu salgılarla da bulaşma olabileceği belirtilmekle birlikte, esas bulaşma tatarcıklarla olmaktadır (22).
2.7. İMMÜNOPARAZİTOLOJİ
Parazite ait faktörler ve konağın savunma mekanizmaları patogenezi direkt olarak şekillendirmektedir. Başlangıçta makrofaj içerisine giren promastigot, amastigot formuna dönüştükten sonra hızlı bir çoğalma sürecine girmektedir. Aynı anda ise konağın doğuştan edinilmiş yanıtı ve antijene spesifik immün cevapları (hücresel, geç tip hipersensitivite) devreye girerek asemptomatik veya kendiliğinden iyileşen ya da iyileşmeyen bir infeksiyon oluşturmak üzere farklı görüntülerde klinik tabloları meydana getirmektedirler (23).
Makrofajlar, leishmania parazitleriyle ilk karşılaşan ve parazitlerce ilk infekte edilen konak hücreleridir. Konağın immün savunma sisteminde anahtar konumda hücrelerdir. Bu hücreler, T hücre reseptörlerine, esas doku uyum bölgesi (Majör Histocompatibility Complex: MHC) molekülleri vasıtasıyla, parazit antijenlerini sunarlar. Bu basamak oldukça önemlidir çünkü salgılanan sitokinler ve sunulan leishmania peptidleri bağlamında immün yanıtın şeklini etkileyebilir ler (17).
Leishmania infeksiyonuna immun yanıt esas olarak hücre aracılıdır. Anti-leishmanial IgG’nin kronik ve iyileşmeyen hastalarda yüksek oluşu da göz önüne alınarak humoral bağışıklığın koruyuculukta işlev görmediği anlaşılmaktadır (23).
İnfeksiyonun sonucu ortaya çıkacak klinik, konak immün sisteminin öncelikle T helper (Th)1 veya Th2 yanıt vermesine bağlıdır. Hayvan deneylerinden elde sonuçlara göre; parazitin epitopları, bazı hayvanlarda Th1 yanıtı indükleyip iyileşmeyi sağlarken, aynı epitoplar başka hayvanlarda Th2 yanıtına neden olup, hastalığın
ilerlemesine neden olurlar. Diğer bazı hayvan deneyleri, Th1 hücreleri ve natural killer hücreleri tarafından üretilen interferon γ (IFN γ) direnç oluşumuna aracılık ettiğini, Th2 hücrelerince üretilen IL4’ün ise infeksiyona duyarlılığa neden olduğunu göstermiştir.
Th1 yanıtında, promastigotlar, retiküloendotelial hücrelerince tutulurlar ve CD4(+) Th hücrelerince üretilen IL2, IL3 ve interferon γ makrofajları aktive eder. Aktive edilmiş makrofajlarca fagosite edilen promastigotlar vakuoller içine alınır ve daha sonra bu vakuoller lizozomlarla kaynaşır.
Türkiye’de yapılan bir grup çalışmada akut infeksiyonlu, L. tropica ile infekte olan kutanöz leishmaniasis’li hastalarda, Th2 cevabı daha baskın iken, iyileşmiş olgularda Th1 cevabının daha öne çıktığı gösterilmiştir (23).
Dendritik hücreler de, konak hücresel immun sistemin önemli bir parçasıdır. Derideki dendritik hücrelere Langerhans hücreleri adı verilir ve yüzeylerinde MHC Class I ve Clas II molekülü eksprese ederler. Fagosite ettikleri patojen antijenlerini, dermal lenfatikler yoluyla bölgesel lenf nodlarının T hücre zonlarına geçerek, T hücrelerine sunarlar. Kutanöz leishmanaisis’te konağın derisinde bulunan dentritik hücreler, leishmania parazitlerini fagosite ederek doğuştan sahip olunan immünite ile kazanılmış immünite arasında köprü görevini gerçekleştirirler (23).
Şekil 8: Th hücrelerinin immün etkilerinin şematik gösterimi (Handman E, Clinical Microbiology Reviews, 2001, 229–243)
2.8. MHC ve HASTALIKLARLA İLİŞKİSİ
2.8.1. İnsan Lökosit Antijenleri:
Yaklaşık 100 yıl kadar önce araştırmacılar, farelerde spontane gelişen tümörlerin yine aynı farede kendiliğinden kaybolabildiğini fark edince, bu tümörleri hasta fareden alıp sağlıklı fareye aktarma girişiminde bulundular. Amaçları tümörleri uzun süre yaşatarak araştırmalarını ilerletebilmekti. Ancak tümör transplantasyonu, farelerin çoğunda başarısızlıkla sonuçlandı. Akraba fareler arasında transplantasyonun başarılı olduğunun fark edilmesi, bugünkü bilgilerimizin temelini oluşturmaktadır (24).
1944 yılında araştırmacılar, tavşanlar üzerinde yaptıkları deneylerde, organ nakillerinde görülen reaksiyonların immünolojik bir temele dayalı olduğunu göstermişlerdir. Takip eden çalışmalarda, ilk kez insan lökositlerinde doku uygunluk antijenlerini göstermeyi başarmışlardır. Bazı araştırıcılar da kan transfüzyonu yapılmış kişilerin serumlarında lökositlere karşı gelişmiş antikorların bulunduğunu kanıtlamışlar, yapılan gözlemlerle kendilerine karşı antikor gelişen antijenlerin sadece lökositlerde değil, doku hücrelerinde de bulunduğunu göstermişlerdir. Bu antijenler “Doku Uygunluk Antijenleri” veya “Transplantasyon Antijenleri” olarak isimlendirilmiştir. 1967’de bu antijenlerin isimlendirilmesinde görüş birliğine varılarak ilk kez lökositlerde gösterilmiş olmalarından dolayı “İnsan Lökosit Antijenleri” anlamına gelen “Human Leukocyte Antigens: HLA” kısaltması kullanılmaya başlanmıştır (25).
HLA antijenlerinin sentezi genetik kontrol altında olup, antijen moleküllerinin sentezinden sorumlu bu bölge, insanda 6. kromozomun kısa kolu üzerindeki gen bölgesine lokalizedir. İnsanlarda, doku uygunluğunda en güçlü etkiye sahip olan bölge, MHC olarak adlandırılmıştır (26).
MHC bölgesindeki, polimorfik gen kümelenmesi, üç ana bölgeye ayrılmıştır. Class I ve Class II gen bölgeleri, antijen işleme ve sunma yolaklarında önemli olan HLA moleküllerinin kodlanmasında görevlidirler. Class III bölgesi, aralarında sitokinler, kompleman kompanentleri ve ısı-şok proteinlerinin bulunduğu bir grup geni kodlar (27).
2.8.2. HLA Antijenlerinin Sınıflandırılması:
HLA antijenleri yapısal ve fonksiyonel özelliklerine göre 3 farklı sınıfta gruplandırılır:
a) Class I Antijenler: Bu grupta HLA-A, -B, -C antijenleri yer alır. b) Class II Antijenler: Bu grupta HLA-DR, -DQ, -DP antijenleri yer alır.
c) Class III Antijenler: Bu grupta properdin faktör B (BF), C2, C4A, C4B bulunur. Steroid 21 hidroksilaz A ve B de bu grupta yer alır.
Class I HLA hemen hemen bütün çekirdekli hücrelerin yüzeylerinde bulunur. Buna karşın;
Class II HLA; monositler, makrofajlar, dentritik hücreler, B hücreleri ve uyarılmış T hücreleri gibi bazı hücrelerin yüzeylerinde bulunur. İnaktif devredeki T hücreler ise Class II HLA taşımazlar.
T hücreleri; Class I HLA ya da Class II HLA moleküllerini tanımalarına göre 2’ye ayrılır. Yüzeylerinde CD8 reseptörü taşıyanlar Class I HLA antijenlerini; yüzeylerinde CD4 reseptörünü taşıyanlar Class II HLA antijenlerini tanırlar (28).
Şekil 9: HLA bölgesinin gen haritası (www-ermm.cbcu.cam.ac.uk)
2.8.3. HLA Antijenlerinin Yapısı:
Class I antijenleri glikoprotein yapısındadır. Class I HLA molekülleri tüm çekirdekli somatik hücrelerde bulunur ve birbirine nonkovalen bağlarla bağlanmış farklı yapıdaki iki zincirden oluşurlar. Ağır zincir 45 KDa, küçük polipeptid zincir ise 12,5 KDa ağırlıkta olup β2 mikroglobulin adını alır. Plazma membranına gömülü olarak bulunan α1, α2, α3 olarak tanımlanan ekstrasellüler 3 domaini vardır. Class I moleküllerinin hücre yüzeyine yerleşebilmeleri için β2 mikroglobuline gereksinimleri vardır.
Class II HLA molekülleri, Class I antijenlerine kıyasla daha az sayıda hücrede (monositler, makrofajlar, dentritik hücreler, langerhans hücreleri, B lenfositler ve T lenfositler) bulunurlar. Bu gruptaki antijenlerin yapısı daha simetrik olup, birbirine nonkovalen bağlarla bağlanmış 2 α ve 2β polipeptid zincirinden oluşurlar. α zinciri yaklaşık 34KDa, β zinciri ise 29 KDa ağırlığında bir glikoproteindir (29).
Şekil 10: HLA Class I ve Class II Molekülleri (Klein, J., Sato, A., HLA System First of Two Parts. N. Eng. J. Med. 343, 702–709, 2000)
Class III antijenler kompleman sisteminin bileşenleri olup genetik olarak HLA kompleksi içindeki genler tarafından kodlanmaktadır. Bu grupta yer alan antijenler; properdin faktör B (BF), C2, C4A ve C4B antijenleridir. Steroid 21 hidroksilaz A ve B de bu grupta yer alır (30).
2.8.4. HLA ANTİJENLERİNİN FONKSİYONLARI
2.8.4.1. Class I Antijenlerinin Fonksiyonları:
Class I antijenler, T lenfositleri tarafından tanınan hedef antijenlerdir. Bir antijenin CD8 sitotoksik T lenfosit (killer) tarafından tanınması için; antijenin Class I antijeni ile kombine olması gerekir. Bu fenomen HLA restriksiyonu (kısıtlaması) olarak adlandırılır.
Örneğin; bir virüs bir hücreyi infekte ettiğinde, viral antijenleri peptid fragmanlarına ayrılır, daha sonra Class I moleküllerince bağlanır ve CD8 sitotoksik T hücrelerine sunulur. T lenfositin antijen reseptörü viral peptidi ancak belirli bir Class I HLA molekülü varlığında tanıyabilir. Tanıma gerçekleştikten sonra T lenfositleri viral antijeni taşıyan hedef hücreyi öldürür.
2.8.4.2. Class II Antijenlerinin Fonksiyonları:
a) Class II moleküllerinin fonksiyonu antijenik peptid fragmanlarını CD4 T lenfositlerine (yardımcı) sunmaktır. CD4 T lenfositleri de peptid fragmanlarını sadece Class II molekülleri ile tanır.
b) Class II antijenleri pek çok antijene karşı yüksek ya da düşük immün yanıt fenotipini belirler. Kişiler arasındaki immün yanıt farklılıkları, değişik Class II moleküllerinin antijenlere karşı farklı affiniteye sahip olması veya T hücre reseptörünün (TCR) bunu tanımasındaki değişkenlikle açıklanabilir. Eğer bir kişinin HLA antijenleri belirli bir peptidle birleşmiyorsa o kişi o peptide immün yanıt veremez.
c) Class II antijenlerinin Graft Versus Host reaksiyonlarından sorumlu olduğuna inanılmaktadır.
d) Class II antijenlerin bazı antijenlere reseptör görevi yaptığı ve transmembran sinyal oluşturduğu üzerinde de durulmaktadır. Gamma interferon; makrofajlarda, bazı epitelyum hücrelerinde ve parankim (pankreas, tiroid) hücrelerinde DR ve DP antijenlerini arttırırken, prostoglandin E2, glukokortikoidler ve siklosporin-A ise ekspresyonu azaltan ajanlardır.
2.8.4.3. Class III Antijenlerinin Fonksiyonları:
Bu antijenler, görevleri; inflamasyon oluşumu, yabancı materyalin fagositoz için opsonize edilmesi, çeşitli hücre ve mikroorganizmalara karsı antikorla ilişkili sitotoksisitenin düzenlenmesi olan kan proteinleri ile ilgili bir kompleksin üyeleridir. C2, C4, BF genleri kompleman komponenti C3 proteinini aktive ederler. TNF (Tümör nekrotizan faktör) ateş yükselmesi, tümörlerin inhibisyonu, kompleman genlerinin transkripsiyonun uyarılması ve nötrofilik granülositlerin aktivasyonu ile görevlidir. 21-hidroksilaz ise kortizol biyosentezi ve TNF sentezi ile ilgilidir(29).
2.9. HLA VE HASTALIKLARLA İLİŞKİSİ
1973’de belli bir doku tipine sahip insanların bazı hastalıklara daha yatkın olduğu saptanmıştır. Son 10 yıl içerisinde MHC molekülleri kristalize edilmiş, rekombinant DNA yöntemleri kullanılarak MHC kompleksi genlerinin baz dizilimi ve bu genlerin sentezini sağladığı MHC antijenlerinin aminoasit dizileri ortaya konabilmiştir. Çeşitli çalışmalar neticesinde çok sayıda ve farklı MHC antijenleri saptanmış, yapıları ve özellikleri belirlenmiştir (31).
HLA ile hastalıklar arasındaki ilişki henüz tam olarak açıklanabilmiş değildir. Bu ilişkiyi açıklamaya yönelik olası teoriler bulunmaktadır. Bu teoriler;
1. HLA molekülleri T-lenfositlerinin antijeni tanımasına aracılık eden moleküllerdir. HLA’nın yapısındaki polimorfizmler antijene verilen cevabı etkileyebilmektedir. Örneğin; HLADRB1* 1302 allelinin ağır malarya riskini azalttığı saptanmıştır. Bunun sebebinin ise HLADRB1* 1302 allelinin beta zincirindeki tek bir aminoasit değişiminden kaynaklandığı ortaya konmuştur.
2. MHC Class II moleküllerinin anormal ekspresyonu, normalde Class II antijenlerini göstermeyen hücrelerde Class II antijenlerinin eksprese edilmesi, bazı hastalıklara neden olabilmektedir. Normalde hücre yüzeyinde bulunan moleküller devamlı değişmektedir. Eğer normalden farklı olarak bir hücre yüzeyinde Class II molekülleri belirirse, antijen sunan hücre görevini görerek immün sistemi uyarır.
3. MHC’nin embriyonik gelişimde çeşitli formlardaki omurga anomalileri, HLA lokusundaki değişimleri bağlı gibi görünmektedir. Bazı fetal antijenler yaşamın erken dönemlerinde bulunurlar ve HLA antijenlerinin oluşumu sırasında kaybolurlar. Genetik yapı, kromozomun bu bölgesinde pek çok gelişim bozukluğunun haritalanmış olmasıyla tanınmaktadır. Bundan dolayı MHC’nin, embriyolojik gelişimde gerekli olan hücreler arası proteinleri kodlayan bir sistemin aktivasyonunda görevli olabileceği düşünülmektedir.
4. HLA antijenik peptidler için seçici özellik göstermektedir. Sadece belirli HLA molekülleri vücuttaki antijenik peptidleri T-lenfositlere sunabilmekte ve belirli HLA moleküllerinin antijen bağlanma yeri, hastalığın oluşmasında sorumlu antijenik peptid fragmentlerini kabul etmektedir. Örneğin; HLA-B27 molekülü bazı peptidleri almada özel bir konumda olabilir. Bu nedenle ancak bu grubu taşıyan şahıslar ankiloza spondilite yakalanabilirler.
5. HLA moleküllerinin reseptör gibi davranma olasılığı vardır. Bu da herhangi bir etiyolojik etkenle karşılaştığında, eğer o etkenin reseptörü ise etkene bağlanarak hastalığa sebep olabileceği ihtimalini doğururlar.
6. HLA moleküllerinin antijenik yapısı virüs veya diğer patojenlere benzerlik gösterebilir. Bu benzerlik nedeniyle immün yanıt körelebilir veya tam tersine patojenik ajana benzerlik gösteren HLA moleküllerine karşı çapraz bir reaksiyon ortaya çıkabilir (32).
2.10. DOKU TİPLENDİRİMİ
Doku grubu tiplemesi testleri çeşitli yöntemlerle yapılabilir. Bunlar;
i- Serolojik testler: mikrolenfosite toksisite testi, isoelektrik focussing, biyokimyasal testler, iki boyutlu jel elektroforezi
ii- Hücresel testler: karışık lenfosit kültürü
iii- Genomik testler: RFLP ve PCR’a dayalı testler SSO, SSP, PCR-SSCP, PCR-RFLP ve PCR-STP (31).
2.10.1. Moleküler Tiplendirme Yöntemleri:
Son yıllarda tüm alanlarda olduğu gibi HLA konusunda da moleküler yöntemler hızla gelişme göstermiştir. Ayrıca DNA boyutunda bu kadar polimorfizmin olduğu bir gen için ideal olan da budur.
SSO(P) (Sequence Specific Oligonucleotide probing) ya da SSP (Sequence Specific Priming) gibi seçici PCR amplifikasyonu, DNA hibridizasyonuna bağlı diagnostik yöntemlerde düşük yada orta düzeydeki tiplendirme için yeterlidir. Buna rağmen, bu yöntemler HLA genleri gibi yüksek polimorfik genlerdeki yüksek çözünürlük tiplendirimi için çok uygun değildir. Bu yüksek çözünürlükteki tiplendirme kemik iliği ya da hücre transplantasyonu öncesinde zorunludur. Bu tedaviler için başvuru sayılari arttıkça, tedaviler önem kazanmaktadir. Bu nedenle yüksek çözünürlükteki doku tiplendirimine gereksinim de dramatik olarak artmaktadir.
SBT yöntemi, yukarıda belirtilen yöntemlerdeki eksikliklerin üstesinden tam nükleotid sekansını ortaya çıkararak gelir. Elde edilmiş sekanslar, tanımlanmış ve kanıtlanmış tüm allel sekanslarını içeren düzenli güncellenmiş veri tabanıyla (örn. IMGT/HLA) otomatik olarak bağıntılanmıştır. Buna ek olarak yeni alleller eş zamanlı olarak tanımlanabilir ve veri tabanına eklenir. Tüm bu nedenlerden dolayı SBT, HLA tiplendiriminde en duyarlı yöntem olarak nitelendirilebilir (26,31).
3. MATERYAL VE METOD
Çalışmamıza, hasta grubunu oluşturmak üzere, poliklinik muayenelerinde kutanöz leishmaniasis öntanısı almış ve Merkez Mikrobiyoloji Laboratuvarında direkt mikroskobik değerlendirme sonucunda tanıları kesinleşmiş 25 birey dâhil edildi. Hasta grubunu oluşturan bireyler, farklı yaş grubunda ve cinsiyette olup, aralarında akrabalık bağı yoktu. Hasta grubunu oluşturan bireylerin tamamı, hastalığın endemik olarak görüldüğü Diyarbakır ili Dicle ve Hani ilçelerinde ve bu ilçelere bağlı köylerde ikamet eden bireyler arasından seçildi. Kontrol grubunu oluşturmak amacıyla, yine aynı bölgelerde ikamet eden, hastalık öyküsü bulunmayan ve klinik muayenelerinde, hastalığın belirtilerine ait fiziki bulgu tespit edilmeyen, farklı yaş ve cinsiyette, aralarında akrabalık bağı bulunmayan 15 sağlıklı birey dâhil edildi.
Direkt mikroskobik inceleme için örnek alımı: • Lezyon ve kenarı, % 70’lik alkol ile iyice temizlendi,
• Lezyon kenarından, bistüri ile yaklaşık 2–3 mm derinliğinde bir insizyon yapıldı, • İnsizyon aralığından pastör pipeti kullanılarak, kazıma işlemi yapıldı ve mümkün olduğunca kansız seröz bir materyal elde edilmeye çalışıldı
• Elde edilen bu materyal lam üzerine yayıldı, tespit edilen materyal Giemsa ile boyandı ve mikroskobik inceleme 100’lük immersiyon objektifi ile yapıldı.
• Hücre içerisinde veya dışarısında parazitin amastigot şekillerinin görülmesi ile parazitolojik tanı kondu.
Direkt mikroskobik inceleme sonrası, parazitolojik tanısı konulan hastalarda ve kontrol grubundaki sağlıklı bireylerde, doku tiplendirilmesi, yüksek çözünürlükte tiplendirmeye olanak sağlayan Sekans Tabanli Tiplendirme (Sequence Based typing=SBT) yöntemi kullanılarak yapıldı.
Kullandığımız yöntemde, amplifikasyon primer mixi , DNA ve QIAGEN LongRange PCR Kiti Thermal cycler da kullanilarak HLA lokusuna spesifik amplifikasyon yapıldı. Sekanslama öncesi PCR ürünleri QIAquick PCR Saflaştırma Kiti kullanarak ilgili olmayan primer ve nükleotidleri uzaklaştırmak için temizlendi. Sekanslama BigDye Terminator sekanslama kimyası kullanarak yapıldı. Son reaksiyonlar DyeEx Kitleri kullanarak ilgili olmayan sekanslanmış primerleri ve artık nükleotidleri uzaklaştırarak saflaştırıldı. Denatüre olmuş örnekler otomatik sekanslama cihazına yüklendi. Uygun program kullanarak verilerin analizi yapıldı.
Allel sıklıkları direkt sayımla hesaplandı. Hasta ve kontrol grubuna ait allellerin sıklıkları karşılaştırıldı. İstatistik analizi amacıyla; iki grupta gözlenen oranları test eden, "Yates düzeltmesi uygulanmış Khi kare" testi kullanıldı. İstatistik önemlilik için ρ‹0.05 dikkate alındı. Karşılaştırmalarda hipotez çift yönlüydü. İstatistik tez değerlendirmesi, SPSS 15,0 paket programı (SPSS Inc. Chicago, IL ) ile yapıldı.
Tablo 6’da, HLA DRB1 allellerinin 25 hasta ve 15 kontrol vakası arasındaki dağılımı gösterilmiştir. DRB1*0405 alleli sağlıklı kontrol vakalarında, hasta grupla karşılaştırıldığında anlamlı bir yükseklik göstermiştir.
Tablo 7’de, HLA DPB1 allellerinin 25 hasta ve 15 kontrol vakası arasındaki dağılımı gösterilmiştir. Bu grupta allel sıklığı hasta ve kontrol grubu karşılaştırıldığında anlamlı bir dağılım göstermemiştir.
Tablo 8’de, HLA DQB1 allellerinin 25 hasta ve 15 kontrol vakası arasındaki dağılımı gösterilmiştir. Bu grupta da allel sıklığı hasta ve kontrol grubu karşılaştırıldığında anlamlı bir dağılım göstermemiştir.
5. TARTIŞMA
Parazitik infeksiyon hastalıklarına duyarlılık ve dirençte rol oynayan karmaşık genetik kaynakların açığa çıkarılması oldukça önemlidir. Muhtemeldir ki; duyarlılık ve dirençte, birçok farklı konak geni dışında, parazite ait genetik yapı ve çevresel faktörler de önemli rol oynar. Parazitik infeksiyonlarla ilişkili olarak, ailesel ve toplumsal kaynaklı birçok çalışmanın yanında bazı hayvan modelli çalışmalar da yapılmış ve tüm bu çalışmaların sonucunda, korunma ve duyarlılıkta genetiğin rolü ile ilgili önemli veriler elde edilmiştir (33).
Konağın genetik özelliklerinin, leishmaniasis’in patogenezindeki katkısının anlaşılmasında, özellikle farelerin kullanıldığı hayvan deneylerinin büyük katkısı
olmuştur. Aynısı değilse bile, insanlardaki leishmaniasis’te gözlenen hastalık belirtilerinin benzerleri, L. major ile infekte edilmiş farelerde, laboratuvar şartlarında gözlemlenebilmiştir. BALB/c türü fareler yüksek derecede duyarlı oldukları etkenle infekte edildiklerinde, yaygın deri ülserlerinin gelişmesi sonucu ölmekte, C5BL/6 ve CBA/N türlerinde ise, 10 -12 haftada iyileşme gösteren küçük deri lezyonları oluşmakta ve infeksiyona kalıcı bağışıklık geliştirmektedirler (34).
Farelerde, infeksiyonun sonucunda ortaya çıkan belirtileri tayin eden temel unsurun, Th1 veya Th2 yanıtlarından hangisinin daha baskın olduğuna bağlı olduğu gözlemlenmiştir. Th1 ve Th2 hücreleri arasındaki ayırım, salgıladıkları sitokinlerle ilgilidir. Th1 hücreleri, gamma interferon(IFNγ) ve interlökin–2 (IL–2) salgılarken, Th2 hücreleri ise IL–4, IL–5 ve IL–10 salgılarlar. Koruyucu bağışıklık, Th1 hücrelerinin salgıladıkları sitokinler sonucu, makrofajları aktive ederek, özellikle nitrikoksit aracılı mekanizmayla intrasellüler patojenlerin öldürülmesi neticesinde sağlanır (35).
İyileşmenin T-hücre bağışıklığının uyarılmasıyla sağlandığı bir hastalıkta, MHC’nin duyarlılıkta rol aldığını düşünmek şaşırtıcı olmasa gerekir. Farelerde, farklı MHC haplotiplerinin, visseral leishmaniasis’e farklı derecelerde duyarlılıkla ilişkili olduğu gösterilmiştir. İnsanlarda kutanöz leishmaniasis’te MHC’nin rolünü gösteren çalışmalar yapılmış ve farelerdeki genetik bağlantı çalışmalarıyla desteklenmiştir (13). Bu veriler aralarında lepra, schistosomiasis, malarya, hepatit B infeksiyonu ve HIV infeksiyonundan AIDS’e ilerleyişin olduğu bir dizi infeksiyöz hastalıkta, MHC’nin rolünü destekleyen kanıtlardır (36).
Tablo 9: Parazitik infeksiyonlarla ilgili olduğu tespit edilmiş genler (S. Campino. Seminars in Immunology, 2006).
Farklı leishmania türlerinin farklı klinik tabloların ortaya çıkmasına neden olduğu bilinse de, aynı parazit tarafından infekte edilmiş değişik bireylerde semptomlar ve tedaviye yanıt aynı şekilde görülmeyebilir. İnfeksiyonla ilgili genetik çalışmaların amacı, klinik ve tedavideki bu çeşitliliğin temelini anlamak ve çeşitlilikten sorumlu olabilecek gen veya genleri tespit etmektir(33).
Leishmania parazitlerince infekte edilmiş bireylerde hastalığın klinik olarak ortaya çıkmasında etkisi olabilecek Class I ve Class II antijenlerinin serolojik yöntemler kullanılarak incelendiği bazı çalışmalarda önemli sonuçlar elde edilmiştir.
Parazitik hastalık
Gen/loküs Görevi Parazitik infeksiyon hastalığına
yanıtla ilişkisi
Malarya HLA (class I ve II) Antijen sunma HLA-B53 ve HLA-DRB1 bağımsız olarak
ciddi malaryaya karşı korunmayla ilişkilidir
Lenfatik filariasis HLA-B HLA-DQ5 HLA-DR3
Antijen sunma Antijen sunma Antijen sunma
HLA-B15 elefantiasis ile ilişkilidir DQ5 elefantiasis gelişimi ile ilgili
DR3 ve 2B3 antijenleri elefantiasisli hastalarda azalmıştır
Onkoserkiasis HLA-DQ Antijen sunma DQA1*0501-DQB*0301 bağışık
bireylerde hastalardan daha sık bulunur
Barbier ve ark. tarafından Yeni Gine’de yapılan ve kutanöz leishmaniasis’te HLA-A, B, C, antijenlerinin incelendiği çalışmada, hasta bireylerde HLA-Cw7 antijeninde anlamlı bir eksiklik tespit edilmiştir (37).
Petzl-Erler ve ark. tarafından Brezilya’da yapılan bir çalışmada, mukokutanöz leishmaniasis tanısı almış 43 hasta ve 111 sağlıklı bireyin, HLA-A, -B, -C, -DR ve DQ loküslerindeki antijen özgüllükleri belirlenmiş ve hasta ile kontrol grubundaki bireylerdeki sıklıkları karşılaştırılmıştır. Hasta bireylerde HLA-DR2 sıklıklığında anlamlı bir düşüklük ile birlikte HLA-DQw3 sıklığında anlamlı bir yükseklik tespit edilmiştir. Bu sonuç; HLA Class II moleküllerinin, bireylerin mukokutanöz leishmaniasis’e duyarlılığında ve metastatik, mukozal hastalığın patogenezinde etkili olduğu şeklinde yorumlanmıştır (38).
Faghiri Z. Ve ark. tarafından İran’da yapılan bir çalışmada, HLA Class I antijenleriyle Kala-azar ilişkisi araştırılmıştır. 52 hasta ile 222 sağlıklı bireyin HLA Class I antijen sıklığının karşılaştırıldığı çalışmada, HLA-A26 antijeni ile hastalığın ortaya çıkması arasında anlamlı bir ilişki tespit edilmiştir (39).
el-Mogy MH ve ark. tarafından, Mısır’da yapılan bir çalışmada, kutanöz leishmaniasis’li 27 hastanın HLA sıklığı incelenmiştir. HLA-A11, -B5 ve -B7 antijenleri ile diffüz kutanöz leishmaniasis arasındaki ilişki anlamlı bulumuş ve immün yanıttan sorumlu genlerin, kutanöz leishmaniasis’ten sorumlu patojenik mekanizmaları anlamada değerli olduğu sonucuna varılmıştır (40).
Lara ML ve ark tarafından, Venezuella’da lokalize kutanöz leishmaniasis için endemik olarak kabul edilen bir bölgede, bireylerinin en az birinde hastalık tespit edilen 24 aile HLA-ABC, DR, DQ antijenleri açısından incelenmiştir. Yapılan genetik tiplendirmelerin sonucunda, HLA-DQw3’ün, popülasyon düzeyinde lokalize kutanöz leishmaniasis’e en belirgin etkiyi yapan genetik risk faktörü olduğu tespit edilmiştir (41).
Olivo-Diaz ve ark. tarafından 2003 yılında Meksika’da yapılan bir çalışmada lokalize kutanöz leishmaniasis’ten korunma ve duyarlılıkta HLA Class II allellerinin rolü incelenmiştir. Bu amaçla hastalığın endemik olarak görüldüğü bir bölgede yaşayan 65 hasta bireyin ve 100 sağlıklı kontrol vakasının HLA Class II bölgesine bulunan DRB1, DQA1, DQB1, DPA1 ve DPB1 allelleri PCR-SSO ve PCR-SSP yöntemleri kullanılarak tiplendirilmiştir. Hasta ve kontrol grubunda bulunan bireylerin allel sıklıklarının istatistikî olarak karşılaştırıldığı çalışmada DRB1*0407, DPA1*0401 ve DPB1*0101 allellerinin duyarlılıkla, DPB1*401’in ise korunmayla ilişkili olduğu tespit edilmiştir. Sonuçlar Class II genlerinin lokalize kutanöz leishmaniasis’in ortaya çıkmasında etkili olduğu şeklinde yorumlanmıştır (42).
Bizim çalışmamızda, DRB1*0405 alleli sağlıklı kontrol vakalarında, hasta grupla karşılaştırıldığında anlamlı bir yükseklik göstermiştir. Bu durum tespit edilen allelin hastalığa karşı korunmada etkili olabileceği şeklinde yorumlanmıştır. Ancak farklı toplumlarda yapılan çalışmalarda farklı sonuçların elde edildiği göz önüne alındığında, HLA polimorfizminde etnik kökenin, hastalıktan sorumlu parazit türünün ayrıca kullanılan yöntemlerin, karşılaştırılan grup sayısının, yaşın, cinsiyetin, coğrafi faktörlerin, kalıtsal özelliklerin de sonuçlara etki etmesi beklenen bir durumdur.
2007 yılında, Bahadır ve Sucaklı’nın ve Diyarbakır’da şark çıbanının epidemiyolojisinin araştırıldığı çalışmada, 2002–2006 yılları arasında bildirimi yapılan kutanöz leishmaniasis olguların %90,6’sı ( Dicle %52,8, Hani %37,7), bizim de hasta ve kontrol grubumuzun ikamet etmekte oldukları bölgeyi kapsayan alandan tespit edilmiştir (4). Çalışmamızda hasta ve kontrol grubunu oluşturan bireylerin hastalığın yüksek endemisite gösterdiği bu bölgelerden seçilmelerindeki amaç; hastalığa karşı korunmada ve duyarlılıkta, çevresel etkenlere bağlı olarak sonuçlara etki edebilecek faktörleri en aza indirmektir.
Çalışmamızda; hasta ve kontrol grubunu oluşturan bireylerin yaş ve cinsiyet grupları değerlendirilmeye alınmamıştır. 2004 yılında Ertem ve ark. kutanöz leishmaniasis’in Diyarbakır bölgesinde endemik olarak görüldüğü köylerde yaptıkları çalışmada, hasta bireylerin yaş ve cinsiyet grupları arasında anlamlı bir fark olmadığı tespit edilmiştir (43). Bu tespit, elde ettiğimiz sonuçların güvenilirliğini destekler niteliktedir.
6. SONUÇ
Leishmaniasis, temelde dünya nüfusunun en yoksul kesimlerinin etkilendiği bir hastalıktır. Hastalığın endemik olarak görüldüğü 88 ülkede, her yıl bildirilen 1,5–2 milyon yeni vakanın, %80’inin günlük 2 $’ın altında bir gelirlerinin olduğu tahmin edilmektedir (44).
Hastalıkların genetik ve biyolojik temellerini anlamak, tedavi edici ilaçların geliştirilmesini birkaç yönden etkiler. Konak duyarlılığına etki eden her bir genin tanımlanması, tedavi edici yöntemlerde en önemli hedeftir. Bu tür genlerce kodlanan proteinler, Hepatit C’de alfa interferon veya kanser kemoterapisinde kullanılan granülosit koloni-stimüle edici faktör gibi, direkt olarak kullanılabilir. Alternatif bir yöntem olarak, istenilen etkiyi elde edebilmek amacıyla, ileride genin aktivasyonunu artırmak ve ya engellemek gibi yollar mümkün olabilecektir.
HLA molekülleri sadece hastalığa yatkınlığı gösteren bir özellik olup; genellikle hastalığın ortaya çıkmasına çok sayıda faktörün beraberce bulunması sebep olmaktadır. Bu faktörler, HLA molekülleri ile birlikte kalıtılan genler (ör TNF), farklı kromozomlarda yerleşen farklı genlerle ilişkili olabilir. Sunulacak peptidleri ve dolayısıyla oluşacak immun yanıtın özelliklerini HLA molekülleri kadar antijenlerin işlenmesi sırasında oluşan peptidlerin yapısı da belirlemektedir (26).
Genetik olarak hastalığa duyarlı bireylerin tespit edilebilmesi; hastalığın endemik olduğu bölgelerde seçici bir aşılama programına imkân sağlayabilir. Bu durum hem ekonomik maliyeti hem de yan etki sıklığını önemli ölçüde azaltır. Ayrıca hastalığın endemik olduğu bölgeye seyahat veya çalışma amaçlı gidecek olan insanlar, hastalığa olan duyarlılıkları konusunda bilgi sahibi olabilirlerse gerekli tedbirlerini önceden alma imkânları olacaktır (20).
ÖZET
Leishmaniasis, Leishmania cinsi protozoonların neden olduğu, deride veya mukozalarda şekil bozuklukları yapan, lokalize kutanöz formlarından, ölüme neden olabilen generalize visseral formlarına kadar değişen ve farklı klinik belirtilerle ortaya çıkan hastalıkların genel adlandırılmasıdır. Dünyada 88 ülkede yaşayan 12 milyondan fazla insanın leishmania parazitleri ile infekte olduğu bilinmektedir. Ancak gerçek sayının bunun çok üzerinde olduğu tahmin edilmektedir. Her yıl 1,5 milyonu kutanöz ve 500 bini visseral leishmaniasis olmak üzere yaklaşık 2 milyon yeni vakanın meydan geldiği bildirilmektedir.
Çalışmamızda hastalıktan korunma ve duyarlılıkta rol oynaması muhtemel HLA Class II allellerini tespit etmeyi amaçladık. Bu amaçla lokalize kutanöz leishmaniasis tanısı almış 25 hasta ve 15 sağlıklı kontrol vakası çalışmaya alındı.
Bizim çalışmamızda, DRB1*0405 allelli sağlıklı kontrol vakalarında, hasta grupla karşılaştırıldığında anlamlı bir yükseklik göstermiştir. Bu durum tespit edilen allellin hastalığa karşı korunmada etkili olabileceği şeklinde yorumlanmıştır. Ancak farklı toplumlarda yapılan çalışmalarda farklı sonuçların elde edildiği göz önüne alındığında, HLA polimorfizminde etnik kökenin, hastalıktan sorumlu parazit türünün ayrıca kullanılan yöntemlerin, karşılaştırılan grup sayısının, yaşın, cinsiyetin, coğrafi faktörlerin, kalıtsal özelliklerin de sonuçlara etki etmesi beklenen bir durumdur.
Anahtar Kelimeler: Kutanöz Leishmaniasis,HLA (Histokompatibilite antijenleri) klas II, Duyarlılık, Korunma
SUMMARY
Leishmaniasis comprises a complex of vector-borne diseases, caused by more than 20 species of the protozoan genus Leishmania, and ranging from localized skin ulcers to lethal systemic disease. More than 12 million people in 88 countries are known to be infected with leishmaniasis, but the true burden remains largely hidden. Two million new cases 1,5 million of cutaneous leishmaniasis, 500 000 of the visceral form of the disease occur annually.
The purpose of this study was to assess the contribution of HLA Class II alleles in the protection and/or the susceptibility to localized cutaneous leishmaniasis. Twenty-five patients with localized cutaneous leishmaniasis were recruited and 15 healthy controls were included for comparison.
In this study, we detected that HLA DRB1*0405 allel, had significantly high frequency among control group in contrast to patients. This result was interpreted that the detected allel may be associated to protection. But considering different study results obtained from distinct populations, it is anticipated that several factors such as ethnic population, parasitic species, working method, age, sex, geographical and genetic factors may also affect the results.
Key words: Cutaneous Leishmaniasis, HLA (Histocompatibility antigens) class II Sensitivity, Protection
KAYNAKLAR
1. Bern C, Maguire JH, Alvar J. Complexities of Assessing the Disease Burden Attributable to Leishmaniasis. PLoS Negl Trop Dis, 2008; 2: 313.
2. TDR 2005. Leishmaniasis. Seventeenth Programme Report Progress, 2003– 2004; 19–23.
3. Özcel MA. Tıbbi Parazit Hastalıkları. 1.baskı, Türkiye Parazitoloji Derneği Yayını, 2007; 197–232.
4. Sucaklı MB, Saka G. Diyarbakır’da Şark Çıbanı Epidemiyolojisi. Türkiye Parazitol Derg, 2007; 3: 165–169.
5. Hepburn NC. Cutaneous Leishmaniasis: An Overview. J Postgrad Med, 2003; 49: 50–54.
6. World Health Organization.10 Facts on Neglected Tropical Diseases. Erişim:www.who.int/features/factfiles/neglected_tropical_diseases/ntd_facts/e n/ index1.html
7. World Health Organization. Control of Neglected Tropical Diseases. NTD. Erişim: www.who.int/neglected_diseases/en/
8. Cox FEG. History of Human Parasitology. Clın Mıcrobıol Rev, 2002; 15: 595–612.
9. Atasoy A. Ege Bölgesinde Köpeklerde Visseral Leishmaniasis’in Seroprevelansı. 2005, Yüksek Lisans Tezi.
10. Neto JPN, Basso G, Cipoli A, El Kadre L. American Cutaneous Leishmaniasis In The State Of São Paulo, Brazil. Ann Agric Environ Med, 1998; 5: 1–5.
11. Kumar R, Bumb RA, Ansari NA, Mehta RD, Salotra P. Cutaneous Leishmaniasis Caused By Leishmania tropica In Bikaner. Am J Trop Med Hyg, 2007; 5: 896–901.
12. World Health Organization.Essential Leishmaniasis Maps 2006. Erişim: http://www.who.int/leishmaniasis/leishmaniasis_maps/en/ index2.html
13. Handman E. Leishmaniasis: Current Status of Vaccine Development. Clın Mıcrobıol Rev, 2001; 14: 229–243.
14. von Stebut E. Cutaneous Leishmania Infection: Progress In Pathogenesis Research And Experimental Therapy. Experimental Dermatology, 2007; 16: 340–346.
15. Varışlı AN. Kutanöz Leshmanaisis’li Hastaların Tanı Ve Takibinde Real Time PCR Kullanımı. 2005, Yüksek Lisans Tezi.
16. Ustaçelebi Ş. Temel ve Klinik Mikrobiyoloji. 1. Baskı, Güneş Kitabevi, 1999:1198–99.
17. Banuls AL, Hide M, Prugnolle F. Leishmania and the Leishmaniases: A Parasite Genetic Update and Advances in Taxonomy, Epidemiology and Pathogenicity in Humans. Advances In Parasıtology, 2007; 7: 7–8.
18. Eroğlu F. Kutanöz Leyişmanyozlu Hastalarda Etken Türlerin PCR-RFLP Yöntemi İle Tanımlanması. 2008, Yüksek Lisans Tezi.
19. Erhan H. Mersin İli Mut İlçesi’ndeki Değişik Yaş Gruplarında Leishmania Antikor Düzeyleri. 2006, Yüksek Lisans Tezi.
20. Roberts LJ, Handman E, Foote SJ. Science, Medicine, And The Future Leishmaniasis. BMJ, 2000; 321: 801–804.
21. Güneş K. Klinik Örneklerde PZR – RFLP (Polimeraz Zincir Reaksiyonu – Restriksiyon Bölümünün Uzunluk Değişkenliği) Yöntemi Kullanılarak Leishmania Parazitlerinin Tür Tayini. 2006, Doktora Tezi.
22. Yukarı BA. Genel Protozooloji. Leishmaniasis. Erişim: www.veterinerhekimiz.com/forum/thread–19335.html.
23. Özcel MA, İnci A, Turgay N, Köroğlu E. Tıbbi ve Veteriner İmmünoparazitoloji. 1.Baskı, İzmir. Türkiye Parazitoloji Derneği Yayınları, 2007:155–164.
24. Beksaç M. HLA ve Doku tiplendirmesi. THD Kan ve Kemik İliği Transplantasyonu Kurs Kitabı, 2004: 42–49.
25. Schwartz BD. The human major histocompatibility HLA complex. In: Stites DP, Stobo JD, Wells JV, eds. Basic and Clinical Immunology. 6.baskı. California: Appleton and Lange; 1987: 50–64.
26. Davla K. Her Yerde Karşımda; Nedir Bu HLA Tiplendirimi? XXXI. Ulusal Hematoloji Kongresi IV. Hematoloji İlk Basamak Kursu. 42–52.
27. Bellamy R. Susceptibility to Infectious Diseases: The Importance of Host Genetics. Cambridge University Press; 2003; 1: 77–79.
28. Temiz N. Akdeniz Bölgesinde HLA (Human Leucocyte Antigens) Tipleri Ve Sıklığının Saptanması. 2005, Yüksek Lisans Tezi.
29. Özcan R. Koroziv Madde İçimine Bağlı Özofagus Darlığı Gelişimi Ve HLA İle İlişkisinin İncelenmesi. 2007, Uzmanlık Tezi.
30. Yeşilli O. 1993. Pemfigus Vulgarisde Human Lökosit Antijenleri. 1993, Uzmanlık Tezi.
31. Uçar F, Ovalı E, Değer O, Önder E, Kartı SS. MHC Gen Kompleksi Ve HLA Doku Tiplemesi Testlerinin Önemi. İbni Sina Tıp Dergisi, 2001; 6: 117–123. 32. Sabuncuoğlu Y. Vitiligolu Olgularda MHC Gen Polimorfizmleri. 2006,
Yüksek Lisans Tezi.
33. Campino S, Kwiatkowski D, Dessein A. Mendelian And Complex Genetics Of Susceptibility And Resistance To Parasitic Infections. Seminars in Immunology, 2006: 18; 411–422.
34. Preston PM, Dumonde DC. Experimental cutaneous leishmaniasis.V. Protective immunity in subclinical and selfhealing infection in the mouse. Clin Exp Immunol, 1976; 23: 126–138.
35. Liew FY, Li Y, Millott S. Tumor Necrosis Factor-α Synergizes With IFN-γ Mediating Killing Of Leishmania major Through The Induction Of Nitric Oxide. J Immunol, 1990; 145: 4306–4310.
36. Mann DL, Garner RP, Dayhoff DE, Cao K, Fernandez-Vina MA, Davis C, Aronson N, Ruiz N, Birx DL, Michael NL. Major Histocompatibility Complex Genotype is Associated With Disease Progression And Virus Load Levels in A Cohort Of Human İmmunodeficiency Virus Type 1-İnfected Caucasians And African Americans. J Infect Dis, 1998; 178:1799– 1802.
37. Barbier D, Demenais F, Lefait JF, David B, Blanc M, Hors J, Feingold N. Susceptibility To Human Cutaneous Leishmaniasis And HLA, Gm, Km Markers. Tissue Antigens, 1987: 2; 63–67.
38. Petzl-Erler ML, Belich MP, Quiroz-Telles F: Association Of Mucosal Leishmaniasis With HLA. Hum Immunol, 1991; 32: 254–260.
39. Faghiri Z, Tabei SZ, Taheri F. Study of the association of HLA class I antigens with kala-azar. Hum Hered, 1995; 45: 258–261.
40. el-Mogy MH, Abdel-Hamid IA, Abdel-Razic MM, Rizk RA, Romia SA.
Histocompatibility Antigens İn Egyptians With Cutaneous Leishmaniasis: A Preliminary Study. J Dermatol Sci, 1993: 5; 89–91.
41. Lara ML, Layrisse Z, Scorza JV, Garcia E, Stoikow Z, Granados J, Bias W. Immunogenetics Of Human American Cutaneous Leishmaniasis. Study Of HLA Haplotypes İn 24 Families From Venezuela. Hum Immunol, 1991: 30; 129–135.
42. Olivo-Díaz A, Debaz H, Alaez C, Islas VJ, Pérez-Pérez H, Hobart O, Gorodezky C. Role Of HLA Class II Alleles İn Susceptibility To And Protection From Localized Cutaneous Leishmaniasis. Hum Immunol, 2004; 65: 255–261. 43. Ertem M, Aytekin S, Acemoğlu H, Akpolat N, Aytekin N. Diyarbakır Dicle
İlçesi Dedeköy ve Durabeyli’de Kutanöz Leishmaniasis Olgularının İncelenmesi.Türkiye Parazitoloji Dergisi, 2004; 2: 65–68
44. Davies CR, Kaye P, Croft SL, Sundar S. Leishmaniasis: New Approaches To Disease Control. BMJ, 2003; 326: 377–381.